Léčba žaludku a střev: Nexium 20mg, 40mg Esomeprazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Nexium a jak se používá?
Nexium je lék na předpis používaný k léčbě příznaků gastroezofageální refluxní choroby (GERD) a dalších stavů, kde je nadměrná žaludeční kyselina, jako je Zollinger-Ellisonův syndrom. Nexium lze užívat samostatně nebo s jinými léky.
Nexium 20 mg je inhibitor protonové pumpy.
Není známo, zda je přípravek Nexium 20 mg bezpečný a účinný u dětí mladších 1 měsíce pro intravenózní léčbu a 1 rok pro perorální léčbu.
Jaké jsou vedlejší účinky přípravku Nexium 40 mg?
Nexium může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- průjem, který je vodnatý nebo krvavý,
- záchvat (křeče),
- malé nebo žádné močení,
- krev v moči,
- otok,
- rychlý nárůst hmotnosti,
- závrať,
- rychlý nebo nepravidelný srdeční tep,
- třes nebo trhavé pohyby svalů,
- pocit nervozity,
- svalové křeče,
- svalové křeče v rukou a nohou,
- kašel nebo pocit dušení,
- bolesti kloubů a
- kožní vyrážka na tvářích nebo pažích, která se zhoršuje na slunci
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Nexium 40 mg patří:
- bolest hlavy,
- ospalost,
- mírný průjem,
- nevolnost,
- bolest břicha,
- plyn,
- zácpa a
- suchá ústa
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Nexium. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
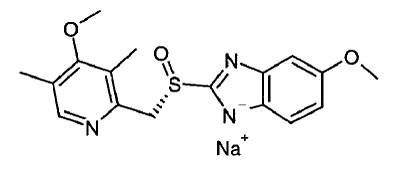
Aktivní složkou přípravku NEXIUM® IV (esomeprazol sodný) pro injekci je (S)-5-methoxy-2[[(4-methoxy-3,5-dimethyl-2-pyridinyl)-methyl]sulfinyl]-1 H-benzimidazol sodík, inhibitor protonové pumpy, který inhibuje sekreci žaludeční kyseliny. Esomeprazol je S-izomer omeprazolu, který je směsí S- a R-izomerů. Jeho empirický vzorec je C17H18N3O3SNa s molekulovou hmotností 367,4 g/mol (sodná sůl) a 345,4 g/mol (mateřská sloučenina).
Esomeprazol sodný je velmi rozpustný ve vodě a volně rozpustný v ethanolu (95%). Strukturní vzorec je:
NEXIUM 20 mg IV for Injection se dodává jako sterilní, lyofilizovaný, bílý až téměř bílý, porézní koláč nebo prášek v 5ml lahvičce, určený pro intravenózní podání po rekonstituci 0,9% injekcí chloridu sodného, USP; Lactated Ringer's Injection, USP nebo 5% dextrose Injection, USP. NEXIUM IV pro injekci obsahuje esomeprazol sodný 21,3 mg nebo 42,5 mg ekvivalent esomeprazolu 20 mg nebo 40 mg, edetát disodný 1,5 mg a hydroxid sodný qs pro úpravu pH. pH rekonstituovaného roztoku NEXIUM IV pro injekci závisí na rekonstitučním objemu a je v rozmezí pH 9 až 11. Stabilita esomeprazolu sodného ve vodném roztoku je silně závislá na pH. Rychlost degradace se zvyšuje s klesajícím pH.
INDIKACE
Léčba gastroezofageální refluxní choroby (GERD) s erozivní ezofagitidou (EE)
NEXIUM IV je indikováno ke krátkodobé léčbě GERD s EE u dospělých a dětských pacientů ve věku od 1 měsíce do 17 let, včetně alternativy k perorální léčbě, když perorální podání NEXIUM 40 mg není možné nebo vhodné.
Snížení rizika opětovného krvácení žaludečních nebo duodenálních vředů po terapeutické endoskopii u dospělých
NEXIUM 40 mg IV je indikován ke snížení rizika opětovného krvácení žaludečních nebo dvanáctníkových vředů po terapeutické endoskopii u akutních krvácejících žaludečních nebo duodenálních vředů u dospělých.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování pro GERD s EE
Dospělí pacienti
Doporučená dávka pro dospělé je buď 20 mg nebo 40 mg NEXIUM 40 mg IV podávaná jednou denně intravenózní injekcí (po dobu alespoň 3 minut) nebo intravenózní infuzí (10 minut až 30 minut) po dobu až 10 dnů [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pediatričtí pacienti
Doporučené dávkování pro pediatrické pacienty je založeno na věku a tělesné hmotnosti, jak je uvedeno v tabulce 1 níže. Podávejte jako intravenózní infuzi po dobu 10 až 30 minut jednou denně po dobu až 10 dnů [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Dokončení Léčba
- Bezpečnost a účinnost přípravku NEXIUM 20 mg IV po dobu delší než 10 dnů nebyla prokázána.
- Jakmile je perorální léčba možná nebo vhodná, přerušte intravenózní léčbu přípravkem NEXIUM 40 mg IV a pokračujte v léčbě perorálním přípravkem NEXIUM 20 mg.
Dávkování pro snížení rizika opětovného krvácení žaludečních nebo duodenálních vředů po terapeutické endoskopii u dospělých
Doporučená dávka pro dospělé je 80 mg NEXIUM IV podávaná jako intravenózní infuze po dobu 30 minut následovaná kontinuální infuzí 8 mg/hod po celkovou dobu léčby 72 hodin (tj. zahrnuje úvodní 30minutovou nasycovací dávku plus 71,5 hodiny nepřetržité infuze) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Intravenózní terapie je zaměřena pouze na akutní počáteční léčbu krvácejících žaludečních nebo dvanáctníkových vředů a nepředstavuje úplnou léčbu. Po intravenózní terapii podávejte perorální acidorezistentní léčbu pro úplný průběh léčby.
Úprava dávkování pro jaterní poškození
GERD s EE
pacientů s těžkou poruchou funkce jater (Child-Pugh třída C) je maximální dávka 20 mg jednou denně (viz Použití u konkrétních populací ].
Snížení rizika opětovného krvácení žaludečních nebo duodenálních vředů po terapeutické endoskopii u dospělých
U pacientů s mírnou až středně těžkou poruchou funkce jater (Child-Pugh třídy A a B, v tomto pořadí) se podává 80 mg ve formě intravenózní infuze po dobu 30 minut, po které následuje kontinuální infuze 6 mg/hodinu po dobu 71,5 hodiny.
U pacientů s těžkou poruchou funkce jater (Child-Pugh třída C) se podává 80 mg jako intravenózní infuze po dobu 30 minut, po které následuje kontinuální infuze 4 mg/hod po dobu 71,5 hodiny [viz Použití u konkrétních populací ].
Pokyny pro přípravu a podávání pro GERD s EE
Nepodávejte NEXIUM 40 mg IV současně s jinými léky stejným intravenózním místem a/nebo hadičkou.
Během léčby přípravkem NEXIUM 20 mg IV lze užívat perorální antacida
Intravenózní injekce po dobu nejméně 3 minut u dospělých pacientů
Intravenózní infuze po dobu 10 minut až 30 minut u dospělých a dětských pacientů
Úložný prostor
Konečný (naředěný) roztok NEXIUM IV skladujte při pokojové teplotě do 30 °C (86 °F) a podávejte v určeném časovém období, jak je uvedeno v tabulce 2 níže.
Pokyny pro přípravu a podávání pro snížení rizika opětovného krvácení žaludečních nebo duodenálních vředů u dospělých
Nepodávejte NEXIUM 40 mg IV současně s jinými léky stejným intravenózním místem a/nebo hadičkou.
Během léčby přípravkem NEXIUM IV lze užívat perorální antacida
Nasycovací dávka (80 mg)
Kontinuální infuze
Úložný prostor
- Konečný (naředěný) roztok NEXIUM IV skladujte při pokojové teplotě do 30 °C (86 °F) a podávejte do 12 hodin.
JAK DODÁVÁNO
Dávkové formy A Síly
Pro injekci: 40 mg esomeprazolu jako bílý až téměř bílý lyofilizovaný prášek v jednodávkové lahvičce pro rekonstituci.
Skladování A Manipulace
NEXIUM 20 mg IV se dodává v jednodávkové injekční lahvičce jako bílý až téměř bílý lyofilizovaný prášek pro rekonstituci obsahující 40 mg esomeprazolu.
NEXIUM 40 mg IV . je k dispozici následovně:
Úložný prostor
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15° až 30°C (59° až 86°F). [Vidět USP řízená pokojová teplota .] Chraňte před světlem. Uchovávejte v kartonu až do doby použití.
Po rekonstituci a podání zlikvidujte veškerou nepoužitou část roztoku esomeprazolu [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Vyrobeno pro: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revize: březen 2022
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Akutní tubulointersticiální nefritida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní nežádoucí účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kožní a systémový lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypomagnezémie a metabolismus minerálů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Polypy fundických žláz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Symptomatická GERD a EE
Dospělí
Bezpečnost přípravku NEXIUM IV je založena na výsledcích klinických studií provedených na čtyřech různých populacích včetně zdravých subjektů (n=204) a pacientů s krvácejícími žaludečními nebo dvanáctníkovými vředy (n=375). Níže popsaná data odrážejí expozici NEXIUM 20 mg IV u 359 pacientů v aktivně kontrolovaných studiích: symptomatická GERD s nebo bez anamnézy EE (n=199) a pacienti s EE (n=160). Obyvatelstvo bylo ve věku 18 až 77 let; 45 % muži, 52 % kavkazští, 17 % černoši, 3 % Asiaté a 28 % jiná rasa. Většina pacientů dostávala dávky 20 nebo 40 mg buď ve formě infuze nebo injekce. Nežádoucí účinky vyskytující se alespoň u 1 % pacientů jsou uvedeny níže v tabulce 3:
Bylo zjištěno, že intravenózní léčba přípravkem NEXIUM 20 mg IV 20 a 40 mg podávaným jako injekce nebo jako infuze má bezpečnostní profil podobný jako u perorálního esomeprazolu.
Pediatrie
Byla provedena randomizovaná, otevřená, mezinárodní studie k hodnocení farmakokinetiky opakovaných intravenózních dávek přípravku NEXIUM IV jednou denně u pediatrických pacientů ve věku 1 měsíc až 17 let včetně [viz KLINICKÁ FARMAKOLOGIE ]. Výsledky bezpečnosti jsou v souladu se známým bezpečnostním profilem esomeprazolu a nebyly identifikovány žádné neočekávané bezpečnostní signály.
Snížení rizika opětovného krvácení žaludečních nebo duodenálních vředů u dospělých
Údaje popsané v tabulce 4 níže odrážejí expozici NEXIUM 20 mg IV u 375 pacientů, u kterých se v placebem kontrolované studii projevilo endoskopicky potvrzené krvácení ze žaludečního nebo duodenálního vředu. Obyvatelstvo bylo ve věku 18 až 98 let; 68 % muži, 87 % kavkazští, 1 % černoši, 7 % Asiaté a 4 % jiná rasa. Po endoskopické hemostáze pacienti dostávali buď placebo nebo 80 mg NEXIUM IV jako intravenózní infuzi po dobu 30 minut, po které následovala kontinuální infuze 8 mg/hodinu po celkovou dobu léčby 72 hodin. Po počátečním 72hodinovém období všichni pacienti dostávali perorální PPI po dobu 27 dnů.
S výjimkou reakcí v místě vpichu popsaných výše bylo zjištěno, že intravenózní léčba přípravkem NEXIUM 20 mg IV podávaným jako injekce nebo infuze má bezpečnostní profil podobný jako u perorálního esomeprazolu.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během užívání esomeprazolu po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému: agranulocytóza, pancytopenie;
Oční poruchy: rozmazané vidění;
Gastrointestinální poruchy: pankreatitida; stomatitida; mikroskopická kolitida; polypy fundických žláz;
Poruchy jater a žlučových cest: jaterní selhání, hepatitida se žloutenkou nebo bez ní;
Poruchy imunitního systému: anafylaktická reakce/šok; systémový lupus erythematodes;
Infekce a nákazy: GI kandidóza;
Poruchy metabolismu a výživy: hypomagnezémie (může vést k hypokalcémii a/nebo hypokalémii) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], hyponatrémie;
Poruchy svalové a kosterní soustavy a pojivové tkáně: svalová slabost, myalgie, zlomeniny kostí;
Poruchy nervového systému: jaterní encefalopatie, poruchy chuti;
Psychiatrické poruchy: agrese, agitovanost, deprese, halucinace;
Poruchy ledvin a močových cest: intersticiální nefritida;
Poruchy reprodukčního systému a prsu: gynekomastie;
Respirační, hrudní a mediastinální poruchy: bronchospasmus;
Poruchy kůže a podkožní tkáně: alopecie, erythema multiforme, hyperhidróza, fotosenzitivita, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza (TEN, některé fatální), léková reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizovaná exantematózní pustulóza (AGEP), kožní lupus erythematodes.
Nežádoucí účinky spojené s omeprazolem lze očekávat také u přípravku NEXIUM IV Kompletní informace o bezpečnosti naleznete v úplné informaci o předepisování perorálního omeprazolu.
DROGOVÉ INTERAKCE
Tabulky 5 a 6 zahrnují léky s klinicky významnými lékovými interakcemi a interakcí s diagnostikou při současném podávání s esomeprazolem a pokyny pro jejich prevenci nebo léčbu.
Chcete-li získat další informace o interakcích s PPI, podívejte se na označení současně užívaných léků.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Přítomnost Malignity žaludku
U dospělých nevylučuje symptomatická odpověď na léčbu přípravkem NEXIUM IV přítomnost žaludeční malignity. Zvažte další sledování a diagnostické testování u dospělých pacientů, kteří mají suboptimální odpověď nebo časný symptomatický relaps po dokončení léčby PPI. U starších pacientů zvažte i endoskopii.
Akutní tubulointersticiální nefritida
Akutní tubulointersticiální nefritida (TIN) byla pozorována u pacientů užívajících PPI a může se objevit kdykoli během léčby PPI. Pacienti mohou mít různé známky a příznaky od symptomatických reakcí přecitlivělosti až po nespecifické příznaky snížené funkce ledvin (např. malátnost, nauzea, anorexie). V hlášených sériích případů byli někteří pacienti diagnostikováni biopsií a bez extrarenálních projevů (např. horečka, vyrážka nebo artralgie). Přerušte podávání NEXIUM 20 mg IV a vyhodnoťte pacienty s podezřením na akutní TIN [viz KONTRAINDIKACE ].
Průjem spojený s Clostridium Difficile
Publikované observační studie naznačují, že léčba PPI, jako je NEXIUM 20 mg IV, může být spojena se zvýšeným rizikem průjmu souvisejícího s Clostridium difficile, zejména u hospitalizovaných pacientů. Tuto diagnózu je třeba zvážit u průjmu, který se nezlepšuje [viz NEŽÁDOUCÍ REAKCE ].
Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu.
Zlomenina kosti
Několik publikovaných observačních studií naznačuje, že léčba inhibitorem protonové pumpy (PPI) může být spojena se zvýšeným rizikem zlomenin kyčle, zápěstí nebo páteře souvisejících s osteoporózou. Riziko zlomenin se zvýšilo u pacientů, kteří dostávali vysoké dávky, definované jako opakované denní dávky, a dlouhodobou terapii PPI (rok nebo déle). Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu. Pacienti s rizikem zlomenin souvisejících s osteoporózou by měli být léčeni podle zavedených pokynů pro léčbu [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE ].
Závažné kožní nežádoucí reakce
V souvislosti s užíváním PPI byly hlášeny závažné kožní nežádoucí reakce, včetně Stevens-Johnsonova syndromu (SJS) a toxické epidermální nekrolýzy (TEN), lékové reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizované exantematózní pustulózy (AGEP). [vidět NEŽÁDOUCÍ REAKCE ]. Při prvních známkách nebo příznacích závažných kožních nežádoucích reakcí nebo jiných příznaků hypersenzitivity přerušte podávání NEXIUM IV a zvažte další vyšetření.
Kožní a systémový lupus erythematodes
U pacientů užívajících PPI, včetně esomeprazolu, byly hlášeny kožní lupus erythematodes (CLE) a systémový lupus erythematodes (SLE). Tyto příhody se objevily jak jako nový nástup, tak jako exacerbace stávajícího autoimunitního onemocnění. Většina případů lupus erythematodes vyvolaných PPI byla CLE.
Nejběžnější formou CLE hlášenou u pacientů léčených PPI byl subakutní CLE (SCLE) a vyskytoval se během týdnů až let po kontinuální medikamentózní terapii u pacientů od kojenců až po seniory. Obecně byly histologické nálezy pozorovány bez orgánového postižení.
Systémový lupus erythematodes (SLE) je u pacientů užívajících PPI méně často hlášen než CLE. SLE spojený s PPI je obvykle mírnější než SLE neindukovaný léky. Nástup SLE se typicky objevil během dnů až let po zahájení léčby primárně u pacientů od mladých dospělých po starší osoby. U většiny pacientů se objevila vyrážka; byly však také hlášeny artralgie a cytopenie.
Vyhněte se podávání PPI déle, než je lékařsky indikováno. Pokud jsou u pacientů užívajících NEXIUM 20 mg IV zaznamenány známky nebo příznaky odpovídající CLE nebo SLE, přerušte podávání léku a odešlete pacienta k příslušnému specialistovi k vyšetření. Většina pacientů se zlepší po vysazení samotného PPI za 4 až 12 týdnů. Sérologické vyšetření (např. ANA) může být pozitivní a vyřešení zvýšených sérologických testů může trvat déle než klinické projevy.
Interakce s klopidogrelem
Vyhněte se současnému užívání přípravku NEXIUM IV s klopidogrelem. Clopidogrel je proléčivo. Inhibice agregace krevních destiček klopidogrelem je zcela způsobena aktivním metabolitem. Metabolismus klopidogrelu na jeho aktivní metabolit může být narušen současným užíváním léků, jako je esomeprazol, které inhibují aktivitu CYP2C19. Současné užívání klopidogrelu se 40 mg esomeprazolu snižuje farmakologickou aktivitu klopidogrelu. Při použití NEXIUM IV zvažte alternativní protidestičkovou léčbu [viz DROGOVÉ INTERAKCE ].
Hypomagnezémie a metabolismus minerálů
Hypomagnezémie, symptomatická a asymptomatická, byla vzácně hlášena u pacientů léčených PPI po dobu alespoň tří měsíců, ve většině případů po roce léčby. Mezi závažné nežádoucí účinky patří tetanie, arytmie a záchvaty. Hypomagnezémie může vést k hypokalcemii a/nebo hypokalémii a může u rizikových pacientů zhoršit základní hypokalcemii. U většiny pacientů vyžadovala léčba hypomagnezémie náhradu hořčíku a vysazení PPI.
U pacientů, u kterých se očekává delší léčba nebo kteří užívají PPI s léky, jako je digoxin nebo léky, které mohou způsobit hypomagnezémii (např. diuretika), mohou zdravotníci zvážit sledování hladin hořčíku před zahájením léčby PPI a pravidelně [viz NEŽÁDOUCÍ REAKCE ].
Zvažte sledování hladin hořčíku a vápníku před zahájením léčby přípravkem NEXIUM IV a pravidelně během léčby u pacientů s již existujícím rizikem hypokalcémie (např. hypoparatyreóza). Podle potřeby doplňte hořčík a/nebo vápník. Pokud je hypokalcémie refrakterní na léčbu, zvažte přerušení léčby PPI.
Interakce s třezalkou tečkovanou nebo rifampinem
Léky, které indukují CYP2C19 nebo CYP3A4 (jako je třezalka tečkovaná nebo rifampin), mohou podstatně snížit koncentrace esomeprazolu [viz DROGOVÉ INTERAKCE ]. Vyhněte se současnému užívání NEXIUM 40 mg IV s třezalkou tečkovanou nebo rifampinem.
Interakce s diagnostickými vyšetřeními pro neuroendokrinní nádory
Hladiny sérového chromograninu A (CgA) se zvyšují sekundárně po lékem vyvolaném poklesu kyselosti žaludku. Zvýšená hladina CgA může způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů. Poskytovatelé zdravotní péče by měli dočasně přerušit léčbu esomeprazolem alespoň 14 dní před stanovením hladin CgA a zvážit opakování testu, pokud jsou počáteční hladiny CgA vysoké. Pokud se provádějí sériové testy (např. pro monitorování), měla by být pro testování použita stejná komerční laboratoř, protože referenční rozsahy mezi testy se mohou lišit [viz DROGOVÉ INTERAKCE ].
Interakce s methotrexátem
Literatura naznačuje, že současné užívání PPI s methotrexátem (primárně ve vysokých dávkách; viz informace o předepisování methotrexátu) může zvýšit a prodloužit sérové hladiny methotrexátu a/nebo jeho metabolitu, což může vést k toxicitě methotrexátu. Při podávání vysokých dávek metotrexátu lze u některých pacientů zvážit dočasné vysazení PPI [viz DROGOVÉ INTERAKCE ].
Polypy fundických žláz
Užívání PPI je spojeno se zvýšeným rizikem polypů fundických žláz, které se zvyšuje s dlouhodobým užíváním, zejména po jednom roce. Většina uživatelů PPI, u kterých se vyvinuly polypy fundické žlázy, byla asymptomatická a polypy fundické žlázy byly identifikovány náhodně při endoskopii. Použijte nejkratší dobu trvání léčby PPI vhodnou pro léčený stav.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogenní potenciál esomeprazolu byl hodnocen pomocí studií omeprazolu. Ve dvou 24měsíčních studiích karcinogenity po perorálním podání na potkanech byl omeprazol v denních dávkách 1,7, 3,4, 13,8, 44,0 a 140,8 mg/kg/den (přibližně 0,4 až 34násobek lidské dávky 40 mg/den vyjádřené na povrchu těla plošný základ) produkoval žaludeční ECL buněčné karcinoidy způsobem závislým na dávce u samců i samic potkanů; výskyt tohoto účinku byl výrazně vyšší u samic potkanů, které měly vyšší hladiny omeprazolu v krvi. Karcinoidy žaludku se u neléčených potkanů vyskytují jen zřídka. Kromě toho byla u všech léčených skupin obou pohlaví přítomna hyperplazie buněk ECL. V jedné z těchto studií byly samice potkanů léčeny 13,8 mg omeprazolu/kg/den (přibližně 3,4násobek lidské dávky 40 mg/den na základě tělesného povrchu) po dobu 1 roku, poté byly sledovány další rok bez léku . U těchto potkanů nebyly pozorovány žádné karcinoidy. Zvýšený výskyt hyperplazie buněk ECL související s léčbou byl pozorován na konci 1 roku (94 % léčených vs 10 % kontrol). Do druhého roku byl rozdíl mezi léčenými a kontrolními potkany mnohem menší (46 % vs. 26 %), ale stále vykazoval větší hyperplazii v léčené skupině. Adenokarcinom žaludku byl pozorován u jednoho potkana (2 %). Žádný podobný nádor nebyl pozorován u samců nebo samic potkanů léčených po dobu 2 let. U tohoto kmene potkanů nebyl historicky zaznamenán žádný podobný nádor, ale nález zahrnující pouze jeden nádor je obtížné interpretovat. 78týdenní studie karcinogenity omeprazolu na myších neprokázala zvýšený výskyt nádorů, ale studie nebyla přesvědčivá.
Esomeprazol byl negativní v testu Amesovy mutace, v testu in vivo na chromozomové aberace buněk kostní dřeně potkana a in vivo testu na mikronukleus myší. Esomeprazol byl však pozitivní v in vitro testu na chromozomové aberace lidských lymfocytů. Omeprazol byl pozitivní v in vitro testu chromozomových aberací lidských lymfocytů, in vivo testu chromozomových aberací buněk kostní dřeně myší a in vivo testu mikrojader myší.
Potenciální účinky esomeprazolu na fertilitu a reprodukční schopnost byly hodnoceny pomocí studií omeprazolu. Bylo zjištěno, že omeprazol v perorálních dávkách až 138 mg/kg/den u potkanů (přibližně 34násobek lidské dávky 40 mg/den na základě tělesného povrchu) nemá žádný vliv na reprodukční schopnost rodičovských zvířat.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Neexistují žádné adekvátní a dobře kontrolované studie s esomeprazolem u těhotných žen. Esomeprazol je s-izomer omeprazolu. Dostupné epidemiologické údaje neprokázaly zvýšené riziko závažných vrozených malformací nebo jiných nepříznivých následků těhotenství při užívání omeprazolu v prvním trimestru. Reprodukční studie na potkanech a králících vedly k embryonální letalitě závislé na dávce při dávkách omeprazolu, které byly přibližně 3,4 až 34násobkem perorální dávky 40 mg pro člověka (na základě plochy povrchu těla pro osobu o hmotnosti 60 kg).
Teratogenita nebyla pozorována v reprodukčních studiích na zvířatech s perorálním podáváním hořečnatého esomeprazolu u potkanů a králíků v dávkách přibližně 68krát a 42krát, v uvedeném pořadí, než je perorální dávka pro člověka 40 mg (na základě plochy povrchu těla pro osobu o hmotnosti 60 kg). . Změny v morfologii kostí byly pozorovány u potomků potkanů, kterým byly po většinu březosti a laktace podávány dávky rovné nebo vyšší než přibližně 34násobek perorální dávky 40 mg pro člověka. Když bylo podávání matce omezeno pouze na březost, nebyly žádné účinky na morfologii kostní fýzy u potomků v jakémkoli věku (viz Data ).
Odhadovaná základní rizika závažných vrozených vad a potratu pro indikovanou populaci nejsou známa. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Data
Lidská data
Esomeprazol je S-izomer omeprazolu. Čtyři epidemiologické studie porovnávaly četnost vrozených abnormalit mezi kojenci narozenými ženám, které užívaly omeprazol během těhotenství, s četností abnormalit u kojenců žen vystavených antagonistům H2-receptorů nebo jiným kontrolám.
Populační retrospektivní kohortová epidemiologická studie ze Švédského lékařského registru narození, pokrývající přibližně 99 % těhotenství v letech 1995 až 99, uváděla 955 kojenců (824 exponovaných během prvního trimestru, z toho 39 exponovaných po prvním trimestru a 131 exponovaných po v prvním trimestru), jejichž matky užívaly omeprazol během těhotenství. Počet kojenců vystavených in utero omeprazolu s jakoukoli malformací, nízkou porodní hmotností, nízkým Apgar skóre nebo hospitalizací byl podobný počtu pozorovanému v této populaci. Počet dětí narozených s defekty komorového septa a počet mrtvě narozených dětí byl mírně vyšší u kojenců vystavených působení omeprazolu než očekávaný počet v této populaci.

Populační retrospektivní kohortová studie zahrnující všechny živě narozené děti v Dánsku od roku 1996 do roku 2009 uvádí 1 800 živě narozených dětí, jejichž matky užívaly omeprazol během prvního trimestru těhotenství, a 837 317 živě narozených dětí, jejichž matky neužívaly žádný inhibitor protonové pumpy. Celková míra vrozených vad u kojenců narozených matkám s expozicí omeprazolu v prvním trimestru byla 2,9 % a 2,6 % u kojenců narozených matkám, které nebyly vystaveny žádnému inhibitoru protonové pumpy během prvního trimestru.
Retrospektivní kohortová studie referovala o 689 těhotných ženách vystavených buď H2-blokátorům nebo omeprazolu v prvním trimestru (134 vystavených omeprazolu) a 1 572 těhotných ženách neexponovaných žádnému z nich během prvního trimestru. Celková míra malformací u potomků narozených matkám s expozicí omeprazolu, H2-blokátoru v prvním trimestru nebo neexponovaných, byla 3,6 %, 5,5 % a 4,1 %.
Malá prospektivní observační kohortová studie sledovala 113 žen vystavených omeprazolu během těhotenství (89 % s expozicemi v prvním trimestru). Hlášená četnost velkých vrozených malformací byla 4 % ve skupině s omeprazolem, 2 % u kontrol vystavených neteratogenům a 2,8 % u kontrol s párem onemocnění. Míra spontánních a elektivních potratů, předčasných porodů, gestační věk při porodu a průměrná porodní hmotnost byla mezi skupinami podobná.
Několik studií neukázalo žádné zjevné nepříznivé krátkodobé účinky na kojence, když byla jednorázová perorální nebo intravenózní dávka omeprazolu podána více než 200 těhotným ženám jako premedikace k císařskému řezu v celkové anestezii.
Údaje o zvířatech
omeprazol
Reprodukční studie provedené s omeprazolem u potkanů v perorálních dávkách až 138 mg/kg/den (asi 34násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu) au králíků v dávkách až 69,1 mg/kg/den ( přibližně 34násobek perorální dávky pro člověka 40 mg na bázi tělesného povrchu) během organogeneze neodhalil žádný důkaz teratogenního potenciálu omeprazolu. U králíků vyvolal omeprazol v rozmezí dávek 6,9 až 69,1 mg/kg/den (přibližně 3,4 až 34násobek perorální dávky 40 mg pro člověka na základě tělesného povrchu) podávaný během organogeneze zvýšení embryonální letality související s dávkou, fetální resorpce a narušení těhotenství. U potkanů byla pozorována na dávce závislá embryonální/fetální toxicita a postnatální vývojová toxicita u potomků po rodičích léčených omeprazolem v dávce 13,8 až 138,0 mg/kg/den (asi 3,4 až 34násobek perorální dávky 40 mg pro člověka na povrch těla plošný základ), podávaný před pářením během období laktace.
esomeprazol
reprodukčních studiích s esomeprazolem magnesium u potkanů v perorálních dávkách až 280 mg/kg/den (asi 68násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu) nebo u králíků nebyly pozorovány žádné účinky na embryo-fetální vývoj. perorální dávky až do 86 mg/kg/den (asi 41násobek lidské dávky na základě tělesného povrchu) podávané během organogeneze.
Studie prenatální a postnatální vývojové toxicity u potkanů s dalšími cílovými body pro hodnocení vývoje kostí byla provedena s esomeprazolem magnesium v perorálních dávkách 14 až 280 mg/kg/den (asi 3,4 až 68násobek perorální dávky 40 mg pro člověka na tělo základ plochy). Neonatální/časně postnatální (od narození do odstavení) přežití bylo sníženo při dávkách rovných nebo vyšších než 138 mg/kg/den (asi 34násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu). Tělesná hmotnost a přírůstek tělesné hmotnosti byly sníženy a neurobehaviorální nebo obecné vývojové zpoždění v časovém rámci bezprostředně po odstavení bylo evidentní při dávkách rovných nebo vyšších než 69 mg/kg/den (přibližně 17násobek perorální dávky 40 mg pro člověka na tělo základ plochy). Kromě toho byla při dávkách rovných nebo vyšších než 14 mg/kg/den (asi 3,4krát vyšší než u lidí po perorálním podání) zaznamenána snížená délka stehenní kosti, šířka a tloušťka kortikální kosti, snížená tloušťka tibiální růstové ploténky a minimální až mírná hypocelularita kostní dřeně. dávka 40 mg na základě tělesného povrchu). Fyzální dysplazie stehenní kosti byla pozorována u potomků potkanů léčených perorálními dávkami hořečnatého esomeprazolu v dávkách rovných nebo vyšších než 138 mg/kg/den (asi 34násobek perorální dávky pro člověka 40 mg na základě plochy povrchu těla).
Účinky na kost matek byly pozorovány u březích a kojících potkanů ve studii pre- a postnatální toxicity, kdy byl esomeprazol magnesium podáván v perorálních dávkách 14 až 280 mg/kg/den (asi 3,4 až 68násobek perorální dávky 40 mg u člověka základ plochy povrchu těla). Když byly potkanům podávány dávky od 7. gestačního dne do odstavení 21. postnatálního dne, bylo pozorováno statisticky významné snížení hmotnosti stehenní kosti matky až o 14 % (ve srovnání s léčbou placebem) při dávkách rovných nebo vyšších než 138 mg/kg/den (přibližně 34násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu).
Studie prenatálního a postnatálního vývoje u potkanů s esomeprazolem stronciem (za použití ekvimolárních dávek ve srovnání se studií esomeprazol magnesium) přinesla podobné výsledky u samic a mláďat, jak je popsáno výše.
Následná studie vývojové toxicity u potkanů s dalšími časovými body k vyhodnocení vývoje kostí mláďat od 2. postnatálního dne do dospělosti byla provedena s esomeprazolem magnesium v perorálních dávkách 280 mg/kg/den (asi 68násobek perorální dávky 40 mg pro člověka na základě tělesného povrchu), kdy esomeprazol byl podáván buď od 7. dne gestace nebo od 16. dne gestace až do porodu. Když bylo podávání matce omezeno pouze na gestaci, neprojevily se žádné účinky na morfologii kostní fýzy u potomků v jakémkoli věku.
Laktace
Shrnutí rizik
Esomeprazol je S-izomer omeprazolu a omezené údaje naznačují, že omeprazol může být přítomen v lidském mléce. Neexistují žádné klinické údaje o účincích esomeprazolu na kojené dítě nebo na produkci mléka. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky NEXIUM 20 mg a veškerými potenciálními nepříznivými účinky NEXIUM nebo základního stavu matky na kojené dítě.
Pediatrické použití
Bezpečnost a účinnost NEXIUM 20 mg IV byla stanovena u pediatrických pacientů ve věku od 1 měsíce do 17 let pro krátkodobou léčbu GERD pomocí EE, jako alternativu k perorální léčbě, když perorální podávání NEXIUM 40 mg není možné nebo vhodné.
Použití přípravku NEXIUM 40 mg IV v této věkové skupině je založeno na extrapolaci účinnosti u dospělých na děti a na výběru dávky založené na přizpůsobení expozice pediatrickým pacientům dospělým podpořeným následujícími důkazy: a) výsledky pozorované z farmakokinetické (PK) studie na NEXIUM 20 mg IV pro injekci u pediatrických pacientů, b) předpovědi z populačního PK modelu porovnávajícího IV PK data mezi dospělými a dětskými pacienty a c) vztah mezi expozicí a farmakodynamickými výsledky získanými z dospělých IV a pediatrických perorálních dat a d) PK výsledky z adekvátní a dobře kontrolované studie, které podpořily schválení NEXIUM 40 mg IV u dospělých [viz NEŽÁDOUCÍ REAKCE , KLINICKÁ FARMAKOLOGIE , Klinické studie ].
Bezpečnost a účinnost přípravku NEXIUM IV nebyla stanovena u pacientů mladších 1 měsíce pro léčbu GERD s EE nebo pro snížení rizika opětovného krvácení žaludečního nebo duodenálního vředu po terapeutické endoskopii.
Údaje o mladých zvířatech
Ve studii toxicity na juvenilních potkanech byl esomeprazol podáván se solemi hořčíku i stroncia v perorálních dávkách přibližně 34 až 68násobku denní dávky pro člověka 40 mg podle plochy povrchu těla. Zvýšení úmrtí bylo pozorováno při vysoké dávce a při všech dávkách esomeprazolu došlo ke snížení tělesné hmotnosti, zvýšení tělesné hmotnosti, hmotnosti stehenní kosti a délky stehenní kosti a ke snížení celkového růstu [viz Neklinická toxikologie ].
Geriatrické použití
klinické studii pacientů s krvácejícími žaludečními nebo duodenálními vředy bylo 52 % z 375 pacientů randomizovaných do NEXIUM IV ve věku 65 let a více. Nebyly pozorovány žádné celkové rozdíly v bezpečnosti a účinnosti mezi staršími a mladšími jedinci a další hlášené klinické zkušenosti s NEXIUM 40 mg IV a perorálním esomeprazolem neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, ale větší citlivost některých starších jedinců nelze vyloučeno.
Poškození jater
GERD s EE
Expozice esomeprazolu byla podstatně zvýšena u pacientů s těžkou poruchou funkce jater (Child-Pugh třída C), ale ne u pacientů s mírnou až středně těžkou poruchou funkce jater (Child-Pugh třídy A a B), ve srovnání s pacienty s normální funkcí jater (viz KLINICKÁ FARMAKOLOGIE ].
U dospělých pacientů není u mírné až středně těžké poruchy funkce jater nutná úprava dávkování. U pacientů s těžkou poruchou funkce jater je maximální doporučená dávka 20 mg jednou denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Snížení rizika opětovného krvácení žaludečních nebo duodenálních vředů po terapeutické endoskopii
Nejsou k dispozici žádné farmakokinetické údaje pro NEXIUM 20 mg IV podávané jako kontinuální intravenózní podávání pacientům s poruchou funkce jater. Expozice intravenóznímu omeprazolu, jehož je esomeprazol enantiomer, se zvýšila u pacientů se všemi stupni poškození jater ve srovnání s jedinci s normální funkcí jater (viz KLINICKÁ FARMAKOLOGIE ].
U dospělých pacientů není u pacientů s jakýmkoli stupněm poruchy funkce jater nutná žádná úprava počáteční nasycovací dávky NEXIUM IV 80 mg. Snižte rychlost kontinuální infuze na 6 mg/hod u pacientů s mírnou až středně těžkou poruchou funkce jater (Child-Pugh třídy A a B) a na 4 mg/hod pro pacienty s těžkou poruchou funkce jater (Child-Pugh třída C) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
PŘEDÁVKOVAT
Příznaky popsané v souvislosti se záměrným předávkováním NEXIUM 40 mg (omezené zkušenosti s dávkami přesahujícími 240 mg/den) jsou přechodné. Relevantní mohou být také zprávy o předávkování omeprazolem u lidí. Dávky se pohybovaly až do 2 400 mg (120násobek obvyklé doporučené klinické dávky). Projevy byly různé, ale zahrnovaly zmatenost, ospalost, rozmazané vidění, tachykardii, nevolnost, pocení, návaly horka, bolest hlavy, sucho v ústech a další nežádoucí reakce podobné těm, které byly pozorovány při doporučených dávkách. Úplné informace o bezpečnosti naleznete v úplné informaci o předepisování perorálního omeprazolu. Pro esomeprazol není známo žádné specifické antidotum. Protože se esomeprazol ve velké míře váže na proteiny, neočekává se, že bude odstraněn dialýzou. V případě předávkování by měla být léčba symptomatická a podpůrná.
Pokud dojde k nadměrné expozici, zavolejte do Poison Control Center na čísle 1-800-222-1222, kde získáte aktuální informace o léčbě otravy nebo předávkování.
KONTRAINDIKACE
- NEXIUM 20 mg IV je kontraindikován u pacientů se známou přecitlivělostí na substituované benzimidazoly nebo na kteroukoli složku přípravku. Hypersenzitivní reakce mohou zahrnovat anafylaxi, anafylaktický šok, angioedém, bronchospasmus, akutní tubulointersticiální nefritidu a kopřivku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
- Inhibitory protonové pumpy (PPI), včetně NEXIUM 20 mg IV, jsou kontraindikovány u pacientů užívajících přípravky obsahující rilpivirin (viz DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Esomeprazol patří do třídy antisekrečních sloučenin, substituovaných benzimidazolů, které potlačují sekreci žaludeční kyseliny specifickou inhibicí enzymového systému H+/K+ ATPázy na sekrečním povrchu parietálních buněk žaludku. Esomeprazol je protonován a konvertován v kyselém kompartmentu parietální buňky za vzniku aktivního inhibitoru, achirálního sulfenamidu. Protože tento enzymový systém je považován za kyselou (protonovou) pumpu v žaludeční sliznici, esomeprazol byl charakterizován jako inhibitor pumpy žaludeční kyseliny, protože blokuje poslední krok produkce kyseliny. Tento účinek je závislý na dávce a vede k inhibici jak bazální, tak stimulované sekrece kyseliny bez ohledu na stimul.
Farmakodynamika
Antisekreční činnost
Účinek esomeprazolu na 24hodinové intragastrické pH u zdravých subjektů byl hodnocen ve dvou studiích s 20 mg a 40 mg NEXIUM 20 mg IV intravenózně jednou denně po dobu 30 minut po dobu 5 dnů, jak je uvedeno v tabulce 7.
Účinky esomeprazolu na 24hodinové intragastrické pH po podání intravenózní infuze 80 mg NEXIUM.IV po dobu 30 minut následované kontinuální infuzí 8 mg/hod po dobu 23,5 hodiny byly hodnoceny ve dvou studiích.
U zdravých kavkazských subjektů negativních na H. pylori (n=24), % času za 24 hodin (95% CI), kdy bylo intragastrické pH > 6 a > 7, bylo 52,3 % (40,3, 64,4) a 4,8 % (1,8, 7.8), resp.
U H. pylori-pozitivních (n=8) a H. pylori-negativních (n=11) zdravých čínských subjektů bylo % času za 24 hodin (95% CI), kdy intragastrické pH bylo > 6 a > 7 53 % ( 45,6, 60,3) a 15,1 % (9,5, 20,7). Procento času s intragastrickým pH > 6 [59 % vs. 47 %] as pH > 7 [17 % vs. 11 %] mělo tendenci být větší u H. pylori pozitivních subjektů ve srovnání s H. pylori-negativními subjekty.
Sérum Gastrin Effects
Účinek esomeprazolu na sérové koncentrace gastrinu byl hodnocen u přibližně 2 700 pacientů v klinických studiích s perorálním esomeprazolem po dobu až 8 týdnů au více než 1 300 pacientů léčených po dobu až 12 měsíců. Průměrná hladina gastrinu nalačno se zvyšovala v závislosti na dávce. Zvýšení sérových koncentrací gastrinu dosáhlo plató během dvou až tří měsíců léčby a vrátilo se na výchozí hodnoty do čtyř týdnů po přerušení léčby.
Zvýšený gastrin způsobuje hyperplazii buněk podobnou enterochromafinu a zvýšené hladiny sérového chromograninu A (CgA). Zvýšené hladiny CgA mohou způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Enterochromaffin-like (ECL) Cell Effects
Nejsou k dispozici žádné údaje o účincích intravenózního esomeprazolu na buňky ECL.
Vzorky biopsie lidského žaludku byly získány od více než 3 000 pacientů (dětí i dospělých) léčených perorálně omeprazolem v dlouhodobých klinických studiích. Výskyt hyperplazie buněk ECL se v těchto studiích s časem zvyšoval; u těchto pacientů však nebyl nalezen žádný případ karcinoidů, dysplazie nebo neoplazie buněk ECL [viz Neklinická toxikologie ].
U více než 1 000 pacientů léčených perorálním esomeprazolem (10 mg, 20 mg nebo 40 mg/den) po dobu až 12 měsíců se prevalence hyperplazie ECL buněk zvyšovala s časem a dávkou. U žádného pacienta se nevyvinuly ECL buněčné karcinoidy, dysplazie nebo neoplazie v žaludeční sliznici.
Endokrinní účinky
Esomeprazol neměl žádný účinek na funkci štítné žlázy, když byl podáván v perorálních dávkách 20 mg nebo 40 mg po dobu 4 týdnů. Další účinky esomeprazolu na endokrinní systém byly hodnoceny ve studiích s omeprazolem. Perorální dávky omeprazolu 30 mg nebo 40 mg denně po dobu 2 až 4 týdnů neměly žádný vliv na metabolismus sacharidů, cirkulující hladiny parathormonu, kortizolu, estradiolu, testosteronu, prolaktinu, cholecystokininu nebo sekretinu.
Farmakokinetika
Vstřebávání
Farmakokinetika esomeprazolu u zdravých subjektů po podání NEXIUM IV 20 mg a 40 mg jednou denně ve formě intravenózní infuze po dobu 30 minut po dobu 5 dnů je uvedena v tabulce 8.
Po intravenózním podání NEXIUM 40 mg IV 24 zdravým subjektům jako nasycovací dávka 80 mg po dobu 30 minut s následnou kontinuální infuzí 8 mg/h po dobu 23,5 hodiny (celkem 24 hodin) byly farmakokinetické parametry esomeprazolu [geometrická střední hodnota (95% CI)] byly následující: AUCt 111,1 mikromol*h/l (100,5, 122,7 mikromol*h/l), Cmax 15,0 mikromol/l (13,5, 16,6 mikromol/l) a plazmatická koncentrace v ustáleném stavu (Css) 3,9 mikromol/l (3,5, 4,5 mikromol/l). V jiné studii se zdravými bělošskými subjekty byl podáván stejný léčebný režim.
Esomeprazol je časově závislý inhibitor CYP2C19, jehož výsledkem je autoinhibice a nelineární farmakokinetika. Po opakovaných perorálních dávkách esomeprazolu se systémová expozice zvyšuje více než úměrně dávce. Ve srovnání s první dávkou se systémová expozice (Cmax a AUC0-24h) v ustáleném stavu po dávkování jednou denně zvýšila o 43 %, respektive o 90 %, ve srovnání s první dávkou pro dávku 20 mg a zvýšila se o 95 %. a 159 %, v tomto pořadí, pro dávku 40 mg.
Rozdělení
Esomeprazol se z 97 % váže na plazmatické proteiny. Vazba na plazmatické proteiny je konstantní v rozmezí koncentrací 2 až 20 mikromol/l. Zdánlivý distribuční objem v ustáleném stavu u zdravých jedinců je přibližně 16 l.
Odstranění
Metabolismus
Esomeprazol je rozsáhle metabolizován v játrech enzymovým systémem cytochromu P450 (CYP). Metabolity esomeprazolu postrádají antisekreční aktivitu. Hlavní část metabolismu esomeprazolu je závislá na izoenzymu CYP2C19, který tvoří hydroxy a desmethyl metabolity. Zbývající množství závisí na CYP3A4, který tvoří sulfonový metabolit.
Vylučování
Esomeprazol je vylučován jako metabolity primárně močí, ale také stolicí. Méně než 1 % původního léčiva se vylučuje močí. Esomeprazol je zcela eliminován z plazmy a při podávání jednou denně nedochází k jeho akumulaci. Plazmatický eliminační poločas esomeprazolu po intravenózním podání NEXIUM IV je přibližně 1,1 až 1,4 hodiny a se zvyšujícími se dávkami se prodlužuje.
Plazmatická clearance (CL) je přibližně 5,9 až 7,2 l/h během podávání NEXIUM 40 mg IV jako intravenózní infuze 80 mg po dobu 30 minut, po níž následuje kontinuální infuze 8 mg/hod po dobu 23,5 hodin.
Specifické populace
Geriatričtí pacienti
Hodnoty AUC a Cmax esomeprazolu byly mírně vyšší (25 %, resp. 18 %) u starších osob ve srovnání s mladšími jedinci v rovnovážném stavu. Toto zvýšení expozice se nepovažuje za klinicky významné.
Pediatričtí pacienti
Farmakokinetika esomeprazolu byla hodnocena u 50 pediatrických pacientů ve věku do 17 let včetně (z toho 44 pediatrických pacientů bylo ve věku 1 měsíc až 17 let) v randomizované, otevřené, mezinárodní studii s opakovanými dávkami 20 mg NEXIUM 40 mg IV podávaných jednou denně 3minutovou intravenózní injekcí. Hodnoty AUC esomeprazolu v plazmě byly o 183 % a 60 % vyšší u pediatrických pacientů ve věku 6 až 11 let a 12 až 17 let ve srovnání s dospělými.
Následné farmakokinetické analýzy předpověděly, že následující dávkovací režimy dosáhnou srovnatelné plazmatické expozice v ustáleném stavu (AUC0-24) s těmi, které byly pozorovány u dospělých pacientů, kterým bylo podáváno 20 mg NEXIUM IV jednou denně: 0,5 mg/kg jednou denně pro pediatrické pacienty 1 měsíc až 11 měsíců věku, 10 mg jednou denně pro pediatrické pacienty ve věku 1 rok až 17 let s tělesnou hmotností nižší než 55 kg a 20 mg jednou denně pro pediatrické pacienty ve věku od 1 roku do 17 let s tělesnou hmotností 55 kg a vyšší. Předpokládalo se, že prodloužení doby trvání infuze ze 3 minut na 10 minut nebo 30 minut povede ke vzniku hodnot Cmax v ustáleném stavu, které byly srovnatelné s hodnotami pozorovanými u dospělých pacientů při dávkách 40 mg a 20 mg NEXIUM IV, v tomto pořadí [viz Použití u konkrétních populací ].
Mužské A ženské pacienty
Hodnoty AUC a Cmax esomeprazolu byly mírně vyšší (13 %) u žen než u mužů v rovnovážném stavu při perorálním podávání. Podobné rozdíly byly pozorovány u intravenózního podání esomeprazolu. Toto zvýšení expozice se nepovažuje za klinicky významné.
Pacienti s poruchou ledvin
Neočekává se, že by farmakokinetika esomeprazolu u pacientů s poruchou funkce ledvin byla ve srovnání se zdravými jedinci změněna, protože méně než 1 % esomeprazolu se vylučuje v nezměněné podobě močí.
Pacienti s poruchou funkce jater
Farmakokinetika esomeprazolu v rovnovážném stavu získaná po podání 40 mg perorálně jednou denně 4 pacientům, z nichž každý měl mírnou (Child-Pugh třída A), středně těžkou (Child-Pugh třída B) a těžkou (Child-Pugh třída C) jaterní poškození, byla ve srovnání s hodnotami získanými u 36 mužů a žen s GERD s normální funkcí jater. U pacientů s mírnou a středně těžkou poruchou funkce jater byly hodnoty AUC v rozmezí, které lze očekávat u pacientů s normální funkcí jater. U pacientů s těžkou poruchou funkce jater byly AUC 2 až 3krát vyšší než u pacientů s normální funkcí jater. [vidět Použití u konkrétních populací ].
Nejsou k dispozici žádné farmakokinetické údaje pro esomeprazol podávaný kontinuálně intravenózně u pacientů s poruchou funkce jater. Farmakokinetika intravenózního omeprazolu 80 mg podávaného v infuzi po dobu 30 minut, následně 8 mg/hod po dobu 47,5 hodin u pacientů s mírnou (Child-Pugh třída A; n=5), středně těžkou (Child-Pugh třída B; n=4) a těžké (Child-Pugh třída C; n=3) poškození jater bylo porovnáno s poškozením získaným u 24 zdravých subjektů mužského a ženského pohlaví. U pacientů s mírnou a středně těžkou poruchou funkce jater byla clearance omeprazolu a ustálená plazmatická koncentrace přibližně o 35 % nižší a o 50 % vyšší než u zdravých subjektů. U pacientů s těžkou poruchou funkce jater byla clearance omeprazolu 50 % clearance u zdravých subjektů a plazmatická koncentrace v ustáleném stavu byla dvojnásobná než u zdravých subjektů (viz Použití u konkrétních populací ].
Studie lékových interakcí
Účinek esomeprazolu/omeprazolu na jiná léčiva
Studie in vitro a in vivo ukázaly, že esomeprazol pravděpodobně neinhibuje CYP 1A2, 2A6, 2C9, 2D6, 2E1 a 3A4.
Antiretrovirotika
U některých antiretrovirových léků, jako je rilpivirin, atazanavir a nelfinavir, byly hlášeny snížené sérové koncentrace při podávání spolu s omeprazolem (viz DROGOVÉ INTERAKCE ].
rilpivirin
Po opakovaných dávkách rilpivirinu (150 mg, denně) a omeprazolu (20 mg, denně) se AUC snížila o 40 %, Cmax o 40 % a Cmin o 33 % pro rilpivirin (viz KONTRAINDIKACE ].
Nelfinavir
Po opakovaných dávkách nelfinaviru (1250 mg, dvakrát denně) a omeprazolu (40 mg denně) se AUC snížila o 36 % a 92 %, Cmax o 37 % a 89 % a Cmin o 39 % a 75 % pro nelfinavir a M8 .
atazanavir
Po opakovaných dávkách atazanaviru (400 mg, denně) a omeprazolu (40 mg, denně, 2 hodiny před atazanavirem) se AUC snížila o 94 %, Cmax o 96 % a Cmin o 95 %.
saquinavir
Po opakovaném podávání sachinaviru/ritonaviru (1000/100 mg) dvakrát denně po dobu 15 dnů s omeprazolem 40 mg denně souběžně podávaných 11. až 15. den. AUC se zvýšila o 82 %, Cmax o 75 % a Cmin o 106 %. Mechanismus této interakce není zcela objasněn.
clopidogrel
Ve zkřížené studii byl zdravým subjektům podáván klopidogrel (300 mg nasycovací dávka následovaná 75 mg denně jako udržovací dávka po dobu 28 dnů) samotný a s esomeprazolem (40 mg perorálně jednou denně ve stejnou dobu jako klopidogrel) po dobu 29 dnů. Expozice aktivnímu metabolitu klopidogrelu se během tohoto časového období snížila o 35 % až 40 %, když byly klopidogrel a esomeprazol podávány společně. Farmakodynamické parametry byly také měřeny a prokázaly, že změna inhibice agregace krevních destiček souvisí se změnou expozice aktivnímu metabolitu klopidogrelu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Mykofenolát mofetil
Podávání omeprazolu 20 mg dvakrát denně po dobu 4 dnů a jednorázová dávka 1000 mg MMF přibližně jednu hodinu po poslední dávce omeprazolu 12 zdravým subjektům ve zkřížené studii vedlo ke snížení Cmax o 52 % a snížení o 23 %. v AUC MPA [viz DROGOVÉ INTERAKCE ].
Cilostazol
Omeprazol působí jako inhibitor CYP2C19. Omeprazol podávaný v dávkách 40 mg denně po dobu jednoho týdne 20 zdravým subjektům ve zkřížené studii zvýšil Cmax cilostazolu o 18 % a AUC o 26 %. Cmax a AUC jednoho z aktivních metabolitů, 3,4-dihydro-cilostazolu, který má 4-7krát vyšší aktivitu než cilostazol, byly zvýšeny o 29 % a 69 %. Očekává se, že současné podávání cilostazolu s omeprazolem zvýší koncentrace cilostazolu a výše uvedeného aktivního metabolitu [viz DROGOVÉ INTERAKCE ].
Diazepam
Současné podávání esomeprazolu 30 mg a diazepamu, substrátu CYP2C19, vedlo ke snížení clearance diazepamu o 45 %. Zvýšené plazmatické hladiny diazepamu byly pozorovány 12 hodin po podání dávky a dále. V té době však byly plazmatické hladiny diazepamu pod terapeutickým intervalem, a proto je nepravděpodobné, že by tato interakce měla klinický význam.
Digoxin
Současné podávání omeprazolu 20 mg jednou denně a digoxinu u zdravých subjektů zvýšilo biologickou dostupnost digoxinu o 10 % (30 % u dvou subjektů) [viz DROGOVÉ INTERAKCE ].
Jiné drogy
Současné podávání esomeprazolu a žádného naproxenu (neselektivní NSAID) neidentifikovalo žádné klinicky významné změny ve farmakokinetických profilech těchto NSAID.
Účinek jiných léků na Esomeprazol/Omeprazol
Třezalka tečkovaná
Ve zkřížené studii na 12 zdravých mužských subjektech třezalka tečkovaná (300 mg třikrát denně po dobu 14 dnů) významně snížila systémovou expozici omeprazolu u pomalých metabolizátorů CYP2C19 (Cmax a AUC se snížily o 37,5 % a 37,9 %, respektive) a extenzivní metabolizátoři (Cmax a AUC se snížily o 49,6 % a 43,9 %, v tomto pořadí) [viz DROGOVÉ INTERAKCE ].
vorikonazol
Současné podávání omeprazolu a vorikonazolu (kombinovaný inhibitor CYP2C19 a CYP3A4) vedlo k více než zdvojnásobení expozice omeprazolu. Když byl vorikonazol (400 mg každých 12 hodin po dobu jednoho dne a následně 200 mg jednou denně po dobu 6 dnů) podáván s omeprazolem (40 mg jednou denně po dobu 7 dnů) zdravým subjektům, Cmax a AUC0-24 omeprazolu v ustáleném stavu významně zvýšené: v průměru 2krát (90% CI: 1,8, 2,6) a 4krát (90% CI: 3,3, 4,4), v tomto pořadí, ve srovnání s tím, kdy byl omeprazol podáván bez vorikonazolu [viz DROGOVÉ INTERAKCE ].
Jiné drogy
Nezdálo se, že by současné podávání esomeprazolu s perorálními kontraceptivy, diazepamem, fenytoinem, chinidinem, naproxenem (neselektivní NSAID) změnilo farmakokinetický profil esomeprazolu.
Mikrobiologie
Účinky na mikrobiální ekologii gastrointestinálního traktu
Snížená žaludeční acidita způsobená jakýmikoli prostředky, včetně inhibitorů protonové pumpy, zvyšuje počet bakterií v žaludku normálně přítomných v gastrointestinálním traktu. Léčba inhibitory protonové pumpy může vést k mírně zvýšenému riziku gastrointestinálních infekcí, jako jsou Salmonella a Campylobacter a u hospitalizovaných pacientů možná také Clostridium difficile.
Farmakogenomika
CYP2C19, polymorfní enzym, se účastní metabolismu esomeprazolu. Alela CYP2C19*1 je plně funkční, zatímco alely CYP2C19*2 a *3 jsou nefunkční. Existují další alely spojené s žádnou nebo sníženou enzymatickou funkcí. Pacienti nesoucí dvě plně funkční alely jsou rychlí metabolizátoři a pacienti nesoucí dvě alely se ztrátou funkce jsou pomalí metabolizátoři. Systémová expozice esomeprazolu se liší podle stavu metabolismu pacienta: pomalí metabolizátoři > střední metabolizátoři > rychlí metabolizátoři. Přibližně 3 % bělochů a 15 až 20 % Asiatů jsou pomalí metabolizátoři CYP2C19.
Systémové expozice esomeprazolu byly mírně vyšší (přibližně o 17 %) u středních metabolizátorů CYP2C19 (IM; n=6) ve srovnání s extenzivními metabolizátory (EM; n=17) CYP2C19. Podobné farmakokinetické rozdíly byly zaznamenány napříč těmito genotypy ve studii zdravých čínských subjektů, která zahrnovala 7 EM a 11 IM. Z těchto studií existují velmi omezené farmakokinetické informace pro slabé metabolizátory (PM).
V ustáleném stavu po podávání přípravku NEXIUM 40 mg IV 40 mg jednou denně je poměr AUC u špatných metabolizátorů k AUC ve zbytku populace (EM) přibližně 1,5. Tato změna expozice není považována za klinicky významnou.
Toxikologie zvířat a/nebo farmakologie
Reprodukční studie
Reprodukční studie byly provedeny na potkanech při perorálních dávkách až 280 mg/kg/den (asi 68násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu) a na králících při perorálních dávkách až 86 mg/kg/den (asi 42násobek perorální dávky pro člověka 40 mg na základě plochy povrchu těla) a neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku esomeprazolu [viz Použití u konkrétních populací ].
Studie mladých zvířat
28denní studie toxicity se 14denní fází zotavení byla provedena na mláďatech potkanů s esomeprazolem magnesium v dávkách 70 až 280 mg/kg/den (asi 17 až 68násobek denní perorální dávky 40 mg pro člověka na povrch těla plošný základ). Zvýšení počtu úmrtí při vysoké dávce 280 mg/kg/den bylo pozorováno, když byl juvenilním potkanům podáván esomeprazol magnesium od 7. postnatálního dne do 35. postnatálního dne. Navíc dávky rovné nebo vyšší než 140 mg/kg/den den (přibližně 34krát denní perorální dávka 40 mg pro člověka na základě tělesného povrchu), způsobilo snížení tělesné hmotnosti (přibližně 14 %) a nárůst tělesné hmotnosti související s léčbou, snížení hmotnosti a délky stehenní kosti a celkové ovlivnění růst. Výše popsaná srovnatelná zjištění byla také pozorována v této studii s jinou solí esomeprazolu, esomeprazol-stronciem, v ekvimolárních dávkách esomeprazolu.
Klinické studie
Potlačení kyseliny u GERD
Byly provedeny čtyři multicentrické, otevřené, dvoudobé zkřížené studie s cílem porovnat farmakodynamické účinky esomeprazolu po intravenózním nebo perorálním podání na supresi kyseliny u 206 pacientů se symptomy GERD s erozivní ezofagitidou nebo bez ní. Pacienti byli randomizováni tak, aby dostávali buď 20 nebo 40 mg NEXIUM 40 mg IV nebo perorální esomeprazol jednou denně po dobu 10 dnů (období 1), a poté byli převedeni v období 2 na jinou formu po dobu 10 dnů, odpovídající jejich příslušné dávce z období 1. NEXIUM 40 mg IV 20 mg a 40 mg byl podáván jako 3minutová injekce ve dvou studiích a jako 15minutová infuze v dalších dvou studiích.
Populace pacientů se pohybovala od 18 do 72 let; 54 % byly ženy; 53 % bělochů, 24 % černochů, 5 % Asiatů a 17 % jiné rasy. Bazální výdej kyseliny (BAO) a maximální výdej kyseliny (MAO) byly stanoveny 22 až 24 hodin po dávce v období 1, den 11; v období 2, den 3; a v období 2, den 11. BAO a MAO byly odhadnuty z 1-hodinového kontinuálního sběru žaludečního obsahu před a po (respektive) subkutánní injekci 6,0 mcg/kg pentagastrinu.
V těchto studiích byly po 10 dnech podávání jednou denně NEXIUM IV 20 mg a 40 mg podobné odpovídající perorální dávce esomeprazolu ve schopnosti potlačit BAO a MAO u těchto pacientů s GERD (viz tabulka 9 níže).
Při přechodu mezi intravenózními a perorálními dávkovými formami nedošlo k žádným velkým změnám v potlačení kyseliny.
Krvácející žaludeční nebo duodenální vředy
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie byla provedena u 764 pacientů s endoskopicky potvrzeným krvácením ze žaludečního nebo duodenálního vředu. Obyvatelstvo bylo ve věku 18 až 98 let; 68 % byli muži, 87 % kavkazští, 1 % černoši, 7 % Asiaté a 4 % jiná rasa. Po endoskopické hemostáze byli pacienti randomizováni buď k placebu, nebo k NEXIUM IV 80 mg ve formě intravenózní infuze po dobu 30 minut, po které následovala kontinuální infuze 8 mg/hodinu po dobu celkem 72 hodin. Po počátečním 72hodinovém období všichni pacienti dostávali perorální PPI po dobu 27 dnů. Výskyt opětovného krvácení do 3 dnů od randomizace byl 5,9 % ve skupině léčené NEXIUM 20 mg IV ve srovnání s 10,3 % ve skupině s placebem (rozdíl v léčbě -4,4 %; 95% interval spolehlivosti: -8,3 %, -0,6 %; p=0,03 ). Tento rozdíl v léčbě byl podobný rozdílu pozorovanému v den 7 a den 30, během kterých všichni pacienti dostávali perorální PPI.
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná jednocentrická studie provedená v Hongkongu také prokázala snížení rizika opětovného krvácení do 72 hodin ve srovnání s placebem u pacientů s krvácejícími žaludečními nebo dvanácterníkovými vředy, kteří dostávali racemický omeprazol, z nichž 50 % je S-enantiomer esomeprazol.
INFORMACE PRO PACIENTA
Nežádoucí účinky
Poraďte pacientům, aby hlásili svému poskytovateli zdravotní péče, pokud zaznamenají jakékoli známky nebo příznaky odpovídající:
- Hypersenzitivní reakce [viz KONTRAINDIKACE ]
- Akutní tubulointersticiální nefritida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní nežádoucí účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Kožní a systémový lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypomagnezémie a metabolismus minerálů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Lékové interakce
Doporučte pacientům, aby před zahájením léčby nahlásili svému poskytovateli zdravotní péče některý z následujících případů:
- Produkty obsahující rilpivirin [viz KONTRAINDIKACE ]
- Clopidogrel [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Třezalka tečkovaná nebo rifampin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vysoké dávky methotrexátu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Správa
- Informujte pacienty, že při užívání přípravku NEXIUM 40 mg IV lze užívat antacida
