Anafranil 10mg, 25mg, 50mg Clomipramine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Anafranil 10 mg a jak se používá?
Anafranil 50 mg je lék na předpis používaný k léčbě příznaků obsedantně-kompulzivní poruchy. Anafranil 50 mg lze užívat samostatně nebo s jinými léky.
Anafranil patří do třídy léků nazývaných antidepresiva, TCA.
Není známo, zda je přípravek Anafranil 50 mg bezpečný a účinný u dětí mladších 10 let.
Jaké jsou možné vedlejší účinky přípravku Anafranil 25 mg?
Anafranil 50 mg může způsobit závažné nežádoucí účinky, včetně:
- vyrážka,
- horečka,
- oteklé žlázy,
- příznaky podobné chřipce,
- Bolest svalů,
- těžká slabost,
- neobvyklé modřiny,
- zežloutnutí kůže a očí (žloutenka),
- změny chování,
- úzkost,
- panický záchvat,
- problémové spaní,
- impulzivní chování,
- podrážděnost,
- míchání,
- nepřátelství,
- agresivita,
- hyperaktivní (duševně nebo fyzicky),
- Deprese,
- sebevražedné myšlenky,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halo kolem světel,
- rychlý srdeční tep,
- třes nebo třes,
- zmatek,
- extrémní strach,
- bolestivé nebo obtížné močení,
- záchvat,
- horečka,
- halucinace,
- pocení,
- chvění,
- rychlý srdeční tep,
- svalová ztuhlost,
- cukání,
- ztráta koordinace,
- nevolnost,
- zvracení a
- průjem
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky Anafranilu patří:
- suchá ústa,
- nevolnost,
- žaludeční nevolnost,
- ztráta chuti k jídlu,
- zácpa,
- pocit úzkosti,
- závrať,
- ospalost,
- unavený,
- problémy se spánkem,
- změny chuti k jídlu nebo hmotnosti,
- problémy s pamětí,
- potíže se soustředěním,
- zvýšené pocení,
- necitlivost nebo mravenčení,
- změny vidění,
- snížená chuť na sex,
- impotence a
- potíže s orgasmem
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Anafranilu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
Sebevražednost a antidepresiva
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití klomipramin hydrochloridu nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. Klomipramin hydrochlorid není schválen pro použití u pediatrických pacientů s výjimkou pacientů s obsedantně kompulzivní poruchou (OCD) (viz VAROVÁNÍ , Klinické zhoršení a riziko sebevraždy ; INFORMACE PRO PACIENTA ; a OPATŘENÍ , Pediatrické použití ).
POPIS
Anafranil™ (klomipramin hydrochlorid) Kapsle USP je antiobsedantní lék, který patří do třídy (dibenzazepin) farmakologických látek známých jako tricyklická antidepresiva. Anafranil je dostupný jako tobolky po 25, 50 a 75 mg pro perorální podání.
Klomipramin hydrochlorid USP je 3-chlor-5-[3-(dimethylamino)propyl]-10,11-dihydro5H-dibenz[b,f]azepin monohydrochlorid a jeho strukturní vzorec je:
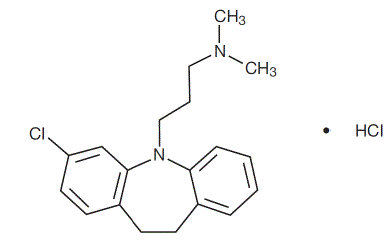
C19H23CIN2 • HC1 MW = 351,31
Klomipramin hydrochlorid USP je bílý až téměř bílý krystalický prášek. Je snadno rozpustný ve vodě, v methanolu a methylenchloridu a nerozpustný v ethyletheru a hexanu.
Neaktivní ingredience. D&C Red č. 33 (pouze 25 mg kapsle), D&C Yellow č. 10, FD&C Blue č. 1 (pouze kapsle 50 mg), FD&C Yellow č. 6, želatina, stearát hořečnatý, methylparaben, propylparaben, škrob (kukuřičný), a oxid titaničitý.
INDIKACE
Anafranil™ (klomipramin hydrochlorid) Kapsle USP jsou indikovány k léčbě obsesí a kompulzí u pacientů s obsedantně-kompulzivní poruchou (OCD). Obsese nebo kompulze musí způsobovat značné utrpení, být časově náročné nebo významně narušovat sociální nebo pracovní fungování, aby splnily diagnózu OCD podle DSM-III-R (cca 1989).
Obsese jsou opakující se, přetrvávající nápady, myšlenky, obrazy nebo impulsy, které jsou ego-dystonické. Nutkání jsou opakující se, účelové a záměrné chování prováděné v reakci na posedlost nebo stereotypním způsobem a osoba je rozpoznává jako nadměrné nebo nerozumné.
Účinnost přípravku Anafranil 25 mg při léčbě OCD byla prokázána v multicentrických, placebem kontrolovaných studiích s paralelními skupinami, včetně dvou 10týdenních studií u dospělých a jedné 8týdenní studie u dětí a dospívajících ve věku 10 až 17 let. Pacienti ve všech studiích měli středně těžkou až těžkou OCD (DSM-III), s průměrným výchozím hodnocením na Yale-Brown Obsessive Compulsive Scale (YBOCS) v rozmezí od 26 do 28 a průměrným výchozím hodnocením 10 na NIMH Clinical Global Obsessive Kompulzivní stupnice (NIMH-OC). U pacientů užívajících CMI došlo k průměrnému snížení hodnoty YBOCS přibližně o 10, což představuje průměrné zlepšení na této škále o 35 % až 42 % u dospělých a 37 % u dětí a dospívajících. U pacientů léčených CMI došlo ke snížení NIMH-OC o 3,5 jednotky. Pacienti na placebu nevykazovali žádnou významnou klinickou odpověď na žádné škále. Maximální dávka byla 250 mg/den pro většinu dospělých a 3 mg/kg/den (až 200 mg) pro všechny děti a dospívající.
Účinnost přípravku Anafranil 25 mg při dlouhodobém užívání (tj. po dobu delší než 10 týdnů) nebyla systematicky hodnocena v placebem kontrolovaných studiích. Lékař, který se rozhodne užívat Anafranil 10 mg po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
DÁVKOVÁNÍ A PODÁVÁNÍ
Léčebné režimy popsané níže jsou založeny na režimech použitých v kontrolovaných klinických studiích s Anafranilem 50 mg u 520 dospělých a 91 dětí a dospívajících s OCD. Během počáteční titrace by měl být Anafranil podáván v rozdělených dávkách s jídlem, aby se snížily gastrointestinální nežádoucí účinky. Cílem této počáteční titrační fáze je minimalizovat vedlejší účinky umožněním rozvoje tolerance k vedlejším účinkům nebo poskytnutím času pacientovi na adaptaci, pokud se tolerance nevyvine.
Protože jak CMI, tak jeho aktivní metabolit, DMI, mají dlouhé eliminační poločasy, předepisující lékař by měl vzít v úvahu skutečnost, že rovnovážného stavu plazmatických hladin nemusí být dosaženo dříve než 2 až 3 týdny po změně dávkování (viz KLINICKÁ FARMAKOLOGIE ). Proto může být vhodné po úvodní titraci mezi dalšími úpravami dávkování počkat 2 až 3 týdny.
Počáteční léčba/úprava dávky (dospělí)
Léčba přípravkem Anafranil 25 mg by měla být zahájena dávkou 25 mg denně a postupně zvyšována podle tolerance až na přibližně 100 mg během prvních 2 týdnů. Během počáteční titrace by měl být Anafranil 50 mg podáván v rozdělených dávkách s jídlem, aby se snížily gastrointestinální nežádoucí účinky. Poté může být dávka postupně zvyšována v průběhu dalších několika týdnů až na maximální dávku 250 mg denně. Po titraci může být celková denní dávka podána jednou denně před spaním, aby se minimalizovala denní sedace.
Počáteční léčba/úprava dávky (děti a dospívající)
Stejně jako u dospělých je počáteční dávka 25 mg denně a měla by být postupně zvyšována (také podávána v rozdělených dávkách s jídlem, aby se snížily gastrointestinální nežádoucí účinky) během prvních 2 týdnů, jak je tolerováno, až na denní maximum 3 mg/kg resp. 100 mg, podle toho, která hodnota je menší. Poté může být dávka postupně zvyšována v průběhu dalších několika týdnů až na denní maximum 3 mg/kg nebo 200 mg, podle toho, která dávka je nižší (viz OPATŘENÍ , Pediatrické použití ). Stejně jako u dospělých lze po titraci podat celkovou denní dávku jednou denně před spaním, aby se minimalizovala denní sedace.
Udržovací/pokračovací léčba (dospělí, děti a dospívající)
když neexistují žádné systematické studie, které by odpověděly na otázku, jak dlouho pokračovat v užívání Anafranilu 10 mg, OCD je chronický stav a je rozumné zvážit pokračování u pacienta, který odpovídá. Ačkoli účinnost Anafranilu 50 mg po 10 týdnech nebyla zdokumentována v kontrolovaných studiích, pacienti pokračovali v léčbě za dvojitě zaslepených podmínek po dobu až 1 roku bez ztráty přínosu. Je však třeba upravit dávkování, aby byl pacient udržován na nejnižší účinné dávce, a pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba léčby. Během udržovací léčby může být celková denní dávka podána jednou denně před spaním.
Přechod pacienta na nebo z inhibitoru monoaminooxidázy (MAOI) určeného k léčbě psychiatrických poruch
Mezi vysazením IMAO určeného k léčbě psychiatrických poruch a zahájením léčby Anafranilem by mělo uplynout alespoň 14 dní. Naopak, po vysazení Anafranilu by mělo uplynout alespoň 14 dní před zahájením IMAO určeného k léčbě psychiatrických poruch (viz KONTRAINDIKACE ).
Použití Anafranilu 25 mg s jinými IMAO, jako je linezolid nebo methylenová modř
Nezahajujte léčbu přípravkem Anafranil 50 mg u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, protože existuje zvýšené riziko serotoninového syndromu. U pacienta, který vyžaduje naléhavější léčbu psychiatrického stavu, je třeba zvážit další intervence, včetně hospitalizace (viz KONTRAINDIKACE ).
některých případech může pacient, který již dostává Anafranil 25 mg, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou dostupné přijatelné alternativy k léčbě linezolidem nebo intravenózní metylenovou modří a potenciální přínosy linezolidu nebo intravenózní léčby methylenovou modří u konkrétního pacienta převažují nad riziky serotoninového syndromu, měl by být Anafranil okamžitě vysazen a linezolid nebo intravenózní léčba methylenovou modří lze podávat. Pacient by měl být sledován na příznaky serotoninového syndromu po dobu dvou týdnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Léčba Anafranilem může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři (viz VAROVÁNÍ ).
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg u přípravku Anafranil 50 mg není jasné. Lékař by si však měl být vědom možnosti vzniku symptomů serotoninového syndromu při takovém použití (viz VAROVÁNÍ ).
JAK DODÁVÁNO
Anafranil™ (klomipramin hydrochlorid) kapsle USP
Tobolky 25 mg – tělo ze slonoviny s černým potiskem „M“ a melounově žlutý uzávěr s černým potiskem „ANAFRANIL 25 mg“
Láhve po 30…………………………………………………… … NDC 0406-9906-03
Tobolky 50 mg – tělo ze slonoviny s černým potiskem „M“ a akvamarínově modrý uzávěr s černým potiskem „ANAFRANIL 50 mg“
Láhve po 30…………………………………………………… ..…NDC 0406-9907-03
Tobolky 75 mg – tělo ze slonoviny s černým potiskem „M“ a žlutý uzávěr s černým potiskem „ANAFRANIL 75 mg“
Láhve po 30……………………………………………………… ..…NDC 0406-9908-03
Úložný prostor
Uchovávejte při teplotě 20 ° až 25 ° C (68 ° až 77 ° F) [viz USP řízená pokojová teplota ].
Podávejte v dobře uzavřených nádobách s dětským bezpečnostním uzávěrem. Chraňte před vlhkostí.
Toxikologie zvířat
Anafranilu byla pozorována fosfolipidóza a změny varlat, běžně spojené s tricyklickými sloučeninami. V chronických studiích na potkanech se změny související s Anafranilem 50 mg skládaly ze systémové fosfolipidózy, změn ve varlatech (atrofie, mineralizace) a sekundárních změn v jiných tkáních. Kromě toho byla srdeční trombóza a dermatitida/keratitida pozorována u potkanů léčených po dobu 2 let v dávkách, které byly 24krát a 10krát vyšší než maximální doporučená denní dávka pro člověka (MRHD), v daném pořadí, na základě mg/kg, a 4krát a 1,5krát převyšovaly MRHD , respektive na základě mg/m².
Mallinckrodt, značka „M“, logo Mallinckrodt Pharmaceuticals, M Â a další značky jsou ochranné známky společnosti Mallinckrodt.
Výrobce: Patheon Inc., Whitby, Ontario, Kanada, L1N 5Z5 pro SpecGx LLC, Webster Groves, MO 63119 USA. Revize: březen 2019
VEDLEJŠÍ EFEKTY
Běžně pozorované
Nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním Anafranilu 10 mg, které nebyly pozorovány s ekvivalentní incidencí u pacientů léčených placebem, byly gastrointestinální potíže, včetně sucha v ústech, zácpy, nauzey, dyspepsie a anorexie; potíže nervového systému, včetně somnolence, třesu, závratí, nervozity a myoklonu; urogenitální potíže, včetně změněného libida, selhání ejakulace, impotence a poruchy močení; a další různé potíže, včetně únavy, pocení, zvýšené chuti k jídlu, přibírání na váze a zrakových změn.
Vede k přerušení léčby
Přibližně 20 % z 3 616 pacientů, kteří dostávali Anafranil v předmarketingových klinických studiích v USA, přerušilo léčbu kvůli nežádoucí příhodě. Přibližně polovina pacientů, kteří přerušili léčbu (9 % z celkového počtu), měla mnohočetné potíže, z nichž žádný nemohl být klasifikován jako primární. Tam, kde bylo možné identifikovat primární důvod přerušení, většina pacientů přerušila léčbu kvůli potížím s nervovým systémem (5,4 %), především ospalosti. Druhým nejčastějším důvodem vysazení byly potíže trávicího systému (1,3 %), především zvracení a nauzea.
Mezi nežádoucími účinky a zvýšenými plazmatickými koncentracemi léku nebyl žádný zjevný vztah.
Výskyt v kontrolovaných klinických studiích
Následující tabulka uvádí nežádoucí příhody, které se vyskytly s incidencí 1 % nebo vyšší u pacientů s OCD, kteří dostávali Anafranil 10 mg v placebem kontrolovaných klinických studiích u dospělých nebo dětí. Frekvence byly získány ze souhrnných údajů z klinických studií zahrnujících buď dospělé užívající Anafranil (N=322) nebo placebo (N=319) nebo děti léčené Anafranilem (N=46) nebo placebem (N=44). Předepisující lékař by si měl být vědom toho, že tato čísla nelze použít k predikci výskytu nežádoucích účinků v průběhu obvyklé lékařské praxe, ve které se charakteristiky pacienta a další faktory liší od těch, které převládaly v klinických studiích. Podobně nelze uvedené frekvence porovnávat s údaji získanými z jiných klinických studií zahrnujících různé způsoby léčby, použití a zkoušející. Uvedené údaje však poskytují lékaři základ pro odhad relativního podílu léčivých a nelékových faktorů na výskytu nežádoucích účinků ve studované populaci.
Výskyt nežádoucích účinků léčby – naléhavých nežádoucích účinků v klinických studiích kontrolovaných placebem (procento pacientů hlásících událost)
Další události pozorované během předmarketingového hodnocení Anafranilu
Během klinických testů v USA byly vícenásobné dávky Anafranilu 50 mg podány přibližně 3600 subjektům. Nežádoucí události spojené s touto expozicí byly zaznamenány klinickými výzkumníky s použitím terminologie podle vlastního výběru. V důsledku toho není možné poskytnout smysluplný odhad podílu jedinců, u kterých se vyskytly nežádoucí příhody, aniž by se nejprve seskupily podobné typy nežádoucích příhod do menšího počtu standardizovaných kategorií příhod.
tabulkách, které následují, byl ke klasifikaci hlášených nežádoucích účinků použit upravený terminologický slovník Světové zdravotnické organizace. Uvedené frekvence proto představují podíl z 3525 jedinců vystavených Anafranilu, kteří zažili událost typu citovaného alespoň jednou při užívání Anafranilu. Zahrnuty jsou všechny události kromě těch, které již byly uvedeny v předchozí tabulce, těch, které byly hlášeny tak obecnými termíny, že jsou neinformativní, a těch, ve kterých byla souvislost s drogou vzdálená. Je důležité zdůraznit, že ačkoli k hlášeným příhodám došlo během léčby Anafranilem, nebyly nutně způsobeny jí.
Příhody jsou dále kategorizovány podle tělesného systému a uvedeny v pořadí klesající frekvence podle následujících definic: časté nežádoucí příhody jsou ty, které se vyskytují jednou nebo vícekrát u alespoň 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; vzácné příhody jsou ty, které se vyskytují u méně než 1/1000 pacientů.
Tělo jako celek - Méně časté - celkový otok, zvýšená náchylnost k infekci, malátnost. Vzácné - závislý edém, abstinenční syndrom.
Kardiovaskulární systém - Méně časté - abnormální EKG, arytmie, bradykardie, srdeční zástava, extrasystoly, bledost. Vzácné - aneuryzma, flutter síní, blokáda raménka, srdeční selhání, mozkové krvácení, srdeční blokáda, infarkt myokardu, ischemie myokardu, periferní ischemie, tromboflebitida, vazospasmus, ventrikulární tachykardie.
Zažívací ústrojí - Méně časté - abnormální funkce jater, krev ve stolici, kolitida, duodenitida, žaludeční vřed, gastritida, gastroezofageální reflux, gingivitida, glositida, hemoroidy, hepatitida, zvýšená tvorba slin, syndrom dráždivého tračníku, peptický vřed, krvácení z konečníku, ulcerace jazyka, zubní kaz. Vzácné - cheilitida, chronická enteritida, změněná barva stolice, dilatace žaludku, krvácení z dásní, škytavka, střevní obstrukce, orální/faryngeální edém, paralytický ileus, zvětšení slinných žláz.
Endokrinní systém - Méně časté - hypotyreóza. Vzácné - struma, gynekomastie, hypertyreóza.
Hemický a lymfatický systém - Méně časté - lymfadenopatie. Vzácné - leukemoidní reakce, lymfomu podobná porucha, deprese dřeně.
Poruchy metabolismu a výživy - Méně časté - dehydratace, diabetes mellitus, dna, hypercholesterolémie, hyperglykémie, hyperurikémie, hypokalémie. Vzácné - intolerance tuků, glykosurie.
Muskuloskeletální systém - Méně časté - artróza. Vzácné - dystonie, exostóza, vyrážka lupus erythematodes, modřiny, myopatie, myositida, polyarteritis nodosa, torticollis.
Nervový systém - Časté - abnormální myšlení, vertigo. Méně časté - abnormální koordinace, abnormální EEG, abnormální chůze, apatie, ataxie, kóma, křeče, delirium, bludy, dyskineze, dysfonie, encefalopatie, euforie, extrapyramidová porucha, halucinace, nepřátelství, hyperkineze, hypnagogická reakce, halucinace hypokineze, nohy, hypokineze , neuralgie, paranoia, fobická porucha, psychóza, smyslová porucha, somnambulismus, stimulace, sebevražedné myšlenky, pokus o sebevraždu, skřípání zubů. Vzácné - anticholinergní syndrom, afázie, apraxie, katalepsie, cholinergní syndrom, choreoatetóza, generalizovaný spasmus, hemiparéza, hyperestézie, hyperreflexie, hypoestézie, iluze, zhoršená kontrola impulsů, nerozhodnost, mutismus, neuropatie, okunickomotorický stag, okunickomotorický stagmus, nervový stag , strnulost, sebevražda.
Dýchací systém - Méně časté - bronchitida, hyperventilace, zvýšené sputum, pneumonie. Vzácné - cyanóza, hemoptýza, hypoventilace, laryngismus.
Kůže a přílohy - Méně časté - alopecie, celulitida, cysta, ekzém, erytematózní vyrážka, genitální pruritus, makulopapulózní vyrážka, fotosenzitivní reakce, psoriáza, pustulózní vyrážka, změna barvy kůže. Vzácné - chloasma, folikulitida, hypertrichóza, piloerekce, seborea, kožní hypertrofie, kožní ulcerace.
Speciální smysly - Méně časté - abnormální akomodace, hluchota, diplopie, bolest ucha, bolest očí, pocit cizího tělesa, hyperakuzie, parosmie, fotofobie, skleritida, ztráta chuti. Vzácné - blefaritida, chromatopsie, spojivkové krvácení, exoftalmus, glaukom, keratitida, porucha labyrintu, šeroslepost, porucha sítnice, strabismus, porucha zorného pole.
Urogenitální systém - Méně časté - endometrióza, epididymitida, hematurie, nykturie, oligurie, ovariální cysty, perineální bolest, polyurie, prostatická porucha, ledvinový kámen, ledvinová bolest, porucha močové trubice, močová inkontinence, děložní krvácení, vaginální krvácení. Vzácné - albuminurie, anorgasmie, překrvení prsu, fibroadenóza prsu, cervikální dysplazie, hyperplazie endometria, předčasná ejakulace, pyelonefritida, pyurie, cysta ledvin, zánět dělohy, vulvální porucha.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly hlášeny během užívání Anafranilu po schválení. Protože tato reakce je hlášena dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout frekvenci.
Oční poruchy - Glaukom s uzavřeným úhlem.
Poruchy imunitního systému - Léková vyrážka s eozinofilií a systémovými příznaky (DRESS).
Poruchy metabolismu a výživy - Hyponatrémie.
Endokrinní poruchy - Syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH).
DROGOVÉ INTERAKCE
Rizika užívání Anafranilu v kombinaci s jinými léky nebyla systematicky hodnocena. Vzhledem k primárním účinkům Anafranilu na CNS se doporučuje opatrnost při jeho současném užívání s jinými léky působícími na CNS (viz TRPĚLIVÍ INFORMACE ). Anafranil by se neměl užívat s inhibitory MAO (viz KONTRAINDIKACE ).
Při podávání Anafranilu s anticholinergními nebo sympatomimetiky je nutný pečlivý dohled a pečlivá úprava dávkování.
Bylo popsáno, že několik tricyklických antidepresiv blokuje farmakologické účinky guanethidinu, klonidinu nebo podobných látek a takový účinek lze předpokládat u CMI kvůli jeho strukturální podobnosti s jinými tricyklickými antidepresivy.
Plazmatická koncentrace CMI byla hlášena jako zvýšená při současném podávání haloperidolu; bylo hlášeno, že plazmatické hladiny několika blízce příbuzných tricyklických antidepresiv se zvýšily při současném podávání methylfenidátu nebo inhibitorů jaterních enzymů (např. cimetidin, fluoxetin) a snížily při současném podávání induktorů jaterních enzymů (např. barbituráty, fenytoin) a takový efekt lze předpokládat i u CMI. Bylo hlášeno, že podávání CMI zvyšuje plazmatické hladiny fenobarbitalu, pokud je podáván současně (viz KLINICKÁ FARMAKOLOGIE , Interakce ).
Léky metabolizované P450 2D6
Biochemická aktivita izozymu cytochromu P450 2D6 (debrisochin hydroxyláza) metabolizujícího léčivo je u podskupiny kavkazské populace snížena (asi 7 až 10 % bělochů jsou tzv. „špatní metabolizátoři“); spolehlivé odhady prevalence snížené aktivity isozymu P450 2D6 mezi asijskými, africkými a dalšími populacemi zatím nejsou k dispozici. Špatní metabolizátoři mají při podávání obvyklých dávek vyšší plazmatické koncentrace tricyklických antidepresiv (TCA), než se očekávalo. V závislosti na frakci léčiva metabolizovaného P450 2D6 může být zvýšení plazmatické koncentrace malé nebo poměrně velké (8násobné zvýšení plazmatické AUC TCA). Některá léčiva navíc inhibují aktivitu tohoto isozymu a dělají normální metabolizátory podobné pomalým metabolizátorům. Jednotlivec, který je stabilní na dané dávce TCA, se může stát náhle toxickým, když je mu současně podáván jeden z těchto inhibičních léků. Mezi léky, které inhibují cytochrom P450 2D6, patří některé, které nejsou metabolizovány enzymem (chinidin; cimetidin) a mnohé, které jsou substráty pro P450 2D6 (mnoho dalších antidepresiv, fenothiaziny a antiarytmika typu 1C propafenon a flekainid). Zatímco všechny selektivní inhibitory zpětného vychytávání serotoninu (SSRI), např. fluoxetin, sertralin, paroxetin a fluvoxamin, inhibují P450 2D6, mohou se lišit v rozsahu inhibice. Bylo také prokázáno, že fluvoxamin inhibuje P450 1A2, izoformu, která se také účastní metabolismu TCA. Rozsah, v jakém mohou interakce SSRI-TCA představovat klinické problémy, bude záviset na stupni inhibice a farmakokinetice příslušného SSRI. Přesto je třeba opatrnosti při současném podávání TCA s kterýmkoli ze SSRI a také při přechodu z jedné třídy na druhou. Obzvláště důležité je, že před zahájením léčby TCA u pacienta, kterému je fluoxetin vysazen, musí uplynout dostatečná doba vzhledem k dlouhému poločasu mateřského a aktivního metabolitu (může být zapotřebí alespoň 5 týdnů). Současné užívání látek ze skupiny tricyklických antidepresiv (která zahrnuje Anafranil) s léky, které mohou inhibovat cytochrom P450 2D6, může vyžadovat nižší dávky, než jsou obvykle předepisovány buď pro tricyklická antidepresiva, nebo pro jiný lék. Kromě toho, kdykoli je některý z těchto léků vysazen z kombinované léčby, může být vyžadována zvýšená dávka tricyklického antidepresiva. Je žádoucí monitorovat plazmatické hladiny TCA vždy, když bude přípravek ze třídy tricyklických antidepresiv včetně Anafranilu podáván současně s jiným lékem, o kterém je známo, že je inhibitorem P450 2D6 (a/nebo P450 1A2).
Vzhledem k tomu, že Anafranil se silně váže na sérové bílkoviny, může podávání Anafranilu pacientům užívajícím jiné léky, které se vysoce váží na bílkoviny (např. warfarin, digoxin), způsobit zvýšení plazmatických koncentrací těchto léků, což může mít za následek nežádoucí účinky. Naopak nežádoucí účinky mohou vyplývat z vytěsnění Anafranilu vázaného na proteiny jinými vysoce vázanými léky (viz KLINICKÁ FARMAKOLOGIE , Rozdělení ).
Inhibitory monoaminooxidázy (MAOI)
(Vidět KONTRAINDIKACE , VAROVÁNÍ , a DÁVKOVÁNÍ A PODÁVÁNÍ .)
Serotonergní léky
(Vidět KONTRAINDIKACE , VAROVÁNÍ , a DÁVKOVÁNÍ A PODÁVÁNÍ .)
Zneužívání drog a závislost
Anafranil nebyl systematicky studován na zvířatech ani na lidech z hlediska jeho potenciálu pro zneužívání, toleranci nebo fyzickou závislost. I když byly v souvislosti s vysazením Anafranilu 50 mg popsány různé abstinenční příznaky (viz OPATŘENÍ , Abstinenční příznaky ), neexistují žádné důkazy pro vyhledávání drog, kromě jediné zprávy o potenciálním zneužívání Anafranilu pacientem s anamnézou závislosti na kodeinu, benzodiazepinech a více psychoaktivních drogách. Pacient dostával Anafranil kvůli depresi a záchvatům paniky a zdálo se, že se po propuštění z nemocnice stal závislým.
Navzdory nedostatku důkazů, které by naznačovaly odpovědnost Anafranilu za zneužívání v zahraničním marketingu, není možné předvídat rozsah, v jakém by mohl být Anafranil zneužit nebo zneužíván, jakmile bude uveden na trh v USA. Lékaři by proto měli pacienty pečlivě vyhodnotit z hlediska anamnézy zneužívání drog. takové pacienty pečlivě sledovat.
VAROVÁNÍ
Klinické zhoršení a riziko sebevraždy
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a další) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (ve věku 18 až 24 let) s těžkou depresivní poruchou. poruchy (MDD) a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl s placebem v počtu případů suicidality na 1000 léčených pacientů) jsou uvedeny v tabulce 1.
žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými se vyskytly sebevraždy, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky popsané výše. , jakož i vznik suicidality, a takové příznaky neprodleně hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro klomipramin hydrochlorid by měly být napsány na nejmenší množství tobolek v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.

Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese. Je třeba poznamenat, že klomipramin hydrochlorid není schválen pro použití při léčbě bipolární deprese.
serotoninový syndrom
Vývoj potenciálně život ohrožujícího serotoninového syndromu byl hlášen u SNRI a SSRI, včetně Anafranilu 50 mg, samotných, ale zejména při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu a třezalka tečkovaná) a s léky, které zhoršují metabolismus serotoninu (zejména IMAO, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid a intravenózní methylenová modř).
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární změny (např. třes, rigiditu, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu.
Současné užívání Anafranilu 10 mg s IMAO určenými k léčbě psychiatrických poruch je kontraindikováno. Léčba přípravkem Anafranil 50 mg by také neměla být zahájena u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř. Všechny zprávy s methylenovou modří, které poskytly informace o cestě podání, zahrnovaly intravenózní podání v rozmezí dávek 1 mg/kg až 8 mg/kg. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Mohou nastat okolnosti, kdy je u pacienta užívajícího Anafranil nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř. Před zahájením léčby IMAO je třeba vysadit Anafranil (viz KONTRAINDIKACE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pokud je současné užívání Anafranilu 10 mg s jinými serotonergními léky, včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu a třezalky tečkované, klinicky oprávněné, pacienti by měli být upozorněni na možné zvýšené riziko serotoninový syndrom, zejména při zahájení léčby a při zvyšování dávky.
Dojde-li k výše uvedeným příhodám, léčba přípravkem Anafranil 10 mg a jakýmikoli souběžně podávanými serotonergními látkami by měla být okamžitě přerušena a měla by být zahájena podpůrná symptomatická léčba.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně Anafranilu, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii.
Záchvaty
Během hodnocení před uvedením na trh byl záchvat identifikován jako nejvýznamnější riziko užívání Anafranilu.
Pozorovaná kumulativní incidence záchvatů u pacientů vystavených Anafranilu 25 mg v dávkách až 300 mg/den byla 0,64 % po 90 dnech, 1,12 % po 180 dnech a 1,45 % po 365 dnech. Kumulativní míry korigují hrubou míru 0,7 % (25 z 3519 pacientů) pro proměnnou dobu expozice v klinických studiích.
Ačkoli se zdá, že dávka je prediktorem záchvatu, dochází k záměně mezi dávkou a délkou expozice, což ztěžuje nezávislé posouzení účinku obou faktorů samostatně. Schopnost předpovídat výskyt záchvatů u subjektů vystavených dávkám CMI vyšším než 250 mg je omezená, vzhledem k tomu, že plazmatická koncentrace CMI může být závislá na dávce a může se lišit mezi subjekty, kterým byla podávána stejná dávka. Přesto se předepisujícím lékařům doporučuje omezit denní dávku na maximálně 250 mg u dospělých a 3 mg/kg (nebo 200 mg) u dětí a dospívajících (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Opatrnosti je třeba při podávání Anafranilu 50 mg pacientům s anamnézou záchvatů nebo jiných predisponujících faktorů, např. poškození mozku různé etiologie, alkoholismus a současné užívání s jinými léky, které snižují práh záchvatů.
Vzácné zprávy o úmrtích v souvislosti se záchvaty byly hlášeny zahraničním postmarketingovým sledováním, ale ne v klinických studiích v USA. V některých z těchto případů byl Anafranil podáván s jinými epileptogenními látkami; v jiných případech měli dotčení pacienti pravděpodobně predisponující zdravotní stav. Příčinná souvislost mezi léčbou Anafranilem 25 mg a těmito úmrtími tedy nebyla stanovena.
Lékaři by měli s pacienty prodiskutovat riziko užívání Anafranilu při činnostech, při nichž by náhlá ztráta vědomí mohla vést k vážnému zranění pacienta nebo jiných osob, např. obsluha složitých strojů, řízení, plavání, horolezectví.
ŠATY
Při užívání klomipraminu byly hlášeny vzácné případy lékové vyrážky s eozinofilií a systémovými příznaky (DRESS). V případě závažných akutních reakcí, jako je DRESS, okamžitě přerušte léčbu klomipraminem a zahajte vhodnou léčbu.
OPATŘENÍ
Všeobecné
Sebevražda
Vzhledem k tomu, že deprese je běžně přidruženým rysem OCD, je třeba zvážit riziko sebevraždy. Předpisy pro Anafranil by měly být napsány na nejmenší množství tobolek v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Kardiovaskulární účinky
Mírné ortostatické snížení krevního tlaku a mírná tachykardie byly pozorovány přibližně u 20 % pacientů užívajících Anafranil 10 mg v klinických studiích; ale pacienti byli často asymptomatičtí. Mezi přibližně 1400 pacienty léčenými CMI před uvedením na trh, kteří měli EKG, se u 1,5 % objevily abnormality během léčby ve srovnání s 3,1 % pacientů užívajících aktivní kontrolní léky a 0,7 % pacientů užívajících placebo. Nejčastějšími změnami na EKG byly PVC, změny ST-T vlny a abnormality intraventrikulárního vedení. Tyto změny byly zřídka spojeny s významnými klinickými příznaky. Přesto je při léčbě pacientů se známým kardiovaskulárním onemocněním nutná opatrnost a doporučuje se postupná titrace dávky.
Psychóza, zmatenost a jiné neuropsychiatrické jevy
pacientů léčených Anafranilem 10 mg byly hlášeny různé neuropsychiatrické příznaky a symptomy včetně bludů, halucinací, psychotických epizod, zmatenosti a paranoie. Vzhledem k nekontrolované povaze mnoha studií není možné poskytnout přesný odhad rozsahu rizika spojeného s léčbou Anafranilem. Stejně jako u tricyklických antidepresiv, se kterými je úzce příbuzný, může Anafranil 25 mg vyvolat akutní psychotickou epizodu u pacientů s nerozpoznanou schizofrenií.
Mánie/hypománie
Během premarketingového testování Anafranilu 10 mg u pacientů s afektivní poruchou se u několika pacientů objevila hypománie nebo mánie. Aktivace mánie nebo hypománie byla také hlášena u malé části pacientů s afektivní poruchou léčených tricyklickými antidepresivy na trhu, která jsou blízce příbuzná s Anafranilem.
Jaterní změny
Během premarketingového testování byl Anafranil příležitostně spojován se zvýšením SGOT a SGPT (sdružená incidence přibližně 1 %, resp. 3 %) s potenciální klinickou důležitostí (tj. hodnotami vyššími než trojnásobek horní hranice normy). Ve velké většině případů tato zvýšení enzymů nebyla spojena s jinými klinickými nálezy naznačujícími poškození jater; navíc žádný neměl žloutenku. Ze zahraničních postmarketingových zkušeností byly zaznamenány vzácné zprávy o závažnějším poškození jater, některé fatální. Při léčbě pacientů se známým onemocněním jater je nutná opatrnost a u těchto pacientů se doporučuje pravidelné monitorování hladin jaterních enzymů.
Hematologické změny
Ačkoli nebyly v předmarketingových zkušenostech s Anafranilem 25 mg pozorovány žádné případy závažné hematologické toxicity, po uvedení přípravku na trh byly v souvislosti s užíváním Anafranilu 50 mg hlášeny leukopenie, agranulocytóza, trombocytopenie, anémie a pancytopenie. Stejně jako v případě tricyklických antidepresiv, se kterými je Anafranil 25 mg úzce příbuzný, je třeba u pacientů, u kterých se během léčby Anafranilem objeví horečka a bolest v krku, zjistit leukocyty a diferenciální krevní obraz.
Centrální nervový systém
Nedomácími systémy postmarketingového sledování bylo zaznamenáno více než 30 případů hypertermie. Většina případů se vyskytla, když byl Anafranil použit v kombinaci s jinými léky. Při současném užívání Anafranilu 25 mg a neuroleptika byly tyto případy někdy považovány za příklady neuroleptického maligního syndromu.
Sexuální dysfunkce
Míra sexuální dysfunkce u pacientů mužského pohlaví s OCD, kteří byli léčeni Anafranilem před uvedením na trh, byla výrazně zvýšena ve srovnání s kontrolami s placebem (tj. u 42 % došlo k selhání ejakulace a 20 % k impotenci ve srovnání s 2,0 % a 2,6 %, v uvedeném pořadí, ve skupině s placebem). Přibližně 85 % mužů se sexuální dysfunkcí se rozhodlo v léčbě pokračovat.
Hyponatrémie
důsledku léčby klomipraminem se objevila hyponatrémie. V mnoha případech se zdá, že hyponatrémie je výsledkem syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH). Starší pacienti mohou být vystaveni většímu riziku rozvoje hyponatremie při užívání serotonergních antidepresiv. Také pacienti užívající diuretika nebo jinak objemově vyčerpaní mohou být více ohroženi. U pacientů se symptomatickou hyponatrémií je třeba vysadit Anafranil a zahájit odpovídající lékařskou intervenci. Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, což může vést k pádům. Závažnější a/nebo akutní případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt.
Změny hmotnosti
kontrolovaných studiích OCD byl přírůstek hmotnosti hlášen u 18 % pacientů užívajících Anafranil ve srovnání s 1 % pacientů užívajících placebo. V těchto studiích mělo 28 % pacientů užívajících Anafranil 25 mg hmotnostní přírůstek nejméně o 7 % původní tělesné hmotnosti ve srovnání se 4 % pacientů užívajících placebo. U několika pacientů došlo k nárůstu hmotnosti o více než 25 % původní tělesné hmotnosti. Naopak u 5 % pacientů užívajících Anafranil a 1 % užívajících placebo došlo ke ztrátě hmotnosti alespoň o 7 % původní tělesné hmotnosti.
Elektrokonvulzivní terapie
Stejně jako u blízce příbuzných tricyklických antidepresiv může současné podávání Anafranilu s elektrokonvulzivní léčbou zvýšit rizika; taková léčba by měla být omezena na pacienty, pro které je nezbytná, protože klinické zkušenosti jsou omezené.
Chirurgická operace
Před plánovaným chirurgickým výkonem s celkovými anestetiky by měla být léčba Anafranilem 50 mg přerušena tak dlouho, jak je to klinicky proveditelné, a měl by být informován anesteziolog.
Použití při souběžném onemocnění
Pacienti s významně narušenou funkcí ledvin.
Abstinenční příznaky
souvislosti s náhlým vysazením Anafranilu 50 mg byly hlášeny různé abstinenční příznaky, včetně závratí, nevolnosti, zvracení, bolesti hlavy, malátnosti, poruch spánku, hypertermie a podrážděnosti. U takových pacientů může navíc dojít ke zhoršení psychiatrického stavu. Přestože abstinenční účinky přípravku Anafranil 10 mg nebyly systematicky hodnoceny v kontrolovaných studiích, jsou dobře známy s blízce příbuznými tricyklickými antidepresivy a doporučuje se, aby se dávkování snižovalo postupně a pacient byl během vysazování pečlivě sledován (viz Zneužívání drog a závislost ).
Informace pro pacienty
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o přínosech a rizicích spojených s léčbou klomipramin-hydrochloridem a měli by jim poradit o jeho vhodném použití. Pro klomipramin hydrochlorid je k dispozici průvodce léky pro pacienty o „antidepresivech, depresi a jiných vážných duševních onemocněních a sebevražedných myšlenkách nebo akcích“. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Příručku o medikaci, a měl by jim pomoci porozumět jejímu obsahu. Pacienti by měli mít příležitost prodiskutovat obsah Příručky pro léky a získat odpovědi na případné otázky. Úplný text Příručky k medikaci je přetištěn na konci tohoto dokumentu.
Pacienti by měli být informováni o následujících problémech a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání klomipramin-hydrochloridu.
Klinické zhoršení a riziko sebevraždy
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Rodiny a pečovatelé pacientů by měli být poučeni, aby každý den hledali výskyt těchto příznaků, protože změny mohou být náhlé. Takové příznaky by měly být hlášeny pacientovu předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, začínají náhle nebo nejsou součástí pacientových příznaků. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě.
Lékařům se doporučuje, aby s pacienty, kterým předepisují Anafranil, probrali následující problémy:
- Riziko záchvatu (viz VAROVÁNÍ );
- Relativně vysoký výskyt sexuální dysfunkce u mužů (viz Sexuální dysfunkce );
- Vzhledem k tomu, že Anafranil 50 mg může narušit duševní a/nebo fyzické schopnosti potřebné pro provádění složitých úkolů a protože Anafranil 25 mg je spojen s rizikem záchvatů, pacienti by měli být varováni před prováděním složitých a nebezpečných úkolů (viz VAROVÁNÍ );
- Pacienti by měli být upozorněni na současné užívání alkoholu, barbiturátů nebo jiných látek tlumících CNS, protože Anafranil 50 mg může přehnat jejich odpověď na tyto léky;
- Pacientky by měly informovat svého lékaře, pokud během léčby otěhotní nebo plánují otěhotnět;
- Pacientky by měly informovat svého lékaře, pokud kojí.
Pacienti by měli být upozorněni, že užívání Anafranilu může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a pokud jsou citliví, podstoupí profylaktický postup (např. iridektomie).
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve dvou dvouletých biologických testech na potkanech při dávkách až 100 mg/kg, což je 24 a 4násobek maximální doporučené denní dávky u člověka (MRHD) na základě mg/kg a mg/m², nebyly nalezeny žádné důkazy o karcinogenitě. nebo ve dvouletém biologickém testu na myších v dávkách až 80 mg/kg, což je 20 a 1,5násobek MRHD na základě mg/kg a mg/m².
reprodukčních studiích nebyly zjištěny žádné účinky na fertilitu u potkanů, kterým byla podávána dávka až 24 mg/kg, což je 6násobek a přibližně rovno MRHD na základě mg/kg a mg/m².
Kategorie těhotenství C
Žádné teratogenní účinky nebyly pozorovány ve studiích prováděných na potkanech a myších v dávkách až 100 mg/kg, což je 24násobek maximální doporučené denní dávky pro člověka (MRHD) na základě mg/kg a 4násobek (krysy) a 2násobek ( myši) MRHD na základě mg/m². Mírné nespecifické embryo/fetotoxické účinky byly pozorovány u potomků léčených potkanů, kterým bylo podáváno 50 a 100 mg/kg a léčených myší, kterým bylo podáváno 100 mg/kg.
Neexistují žádné adekvátní nebo dobře kontrolované studie u těhotných žen. Příznaky z vysazení, včetně nervozity, třesu a záchvatů, byly hlášeny u novorozenců, jejichž matky užívaly Anafranil 50 mg až do porodu. Anafranil 10 mg by měl být užíván během těhotenství pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Anafranil byl nalezen v lidském mléce. Vzhledem k potenciálním nežádoucím účinkům by se mělo rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u jiné pediatrické populace než u pediatrických pacientů s OCD nebyla stanovena (viz BOX VAROVÁNÍ a VAROVÁNÍ , Klinické zhoršení a riziko sebevraždy ). Každý, kdo zvažuje použití Anafranilu u dětí nebo dospívajících, musí vyvážit potenciální rizika s klinickou potřebou.
V kontrolované klinické studii u dětí a dospívajících (ve věku 10 až 17 let) dostávalo 46 ambulantních pacientů Anafranil 50 mg po dobu až 8 týdnů. Kromě toho 150 dospívajících pacientů dostávalo Anafranil 10 mg v otevřených protokolech po dobu několika měsíců až několika let. Ze 196 zkoumaných adolescentů bylo 50 ve věku 13 let nebo méně a 146 bylo ve věku 14 až 17 let. Profil nežádoucích účinků v této věkové skupině (viz NEŽÁDOUCÍ REAKCE ) je podobný jako u dospělých.
Rizika, pokud nějaká existují, která mohou být spojena s prodlouženým užíváním Anafranilu u dětí a dospívajících s OCD, nebyla systematicky hodnocena. Důkazy podporující závěr, že Anafranil 50 mg je bezpečný pro použití u dětí a dospívajících, jsou odvozeny z relativně krátkodobých klinických studií a z extrapolace zkušeností získaných u dospělých pacientů. Zejména neexistují žádné studie, které by přímo vyhodnocovaly účinky dlouhodobého užívání Anafranilu 25 mg na růst, vývoj a dospívání dětí a dospívajících. Ačkoli neexistují žádné důkazy, které by naznačovaly, že Anafranil 10 mg nepříznivě ovlivňuje růst, vývoj nebo dozrávání, absence takových zjištění není dostatečná k vyloučení možnosti takových účinků při chronickém užívání.
Bezpečnost a účinnost u pediatrických pacientů mladších 10 let nebyla stanovena. Proto nelze učinit konkrétní doporučení pro použití Anafranilu u pediatrických pacientů mladších 10 let.
Geriatrické použití
Klinické studie s Anafranilem 50 mg nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně od mladších subjektů; 152 pacientů ve věku alespoň 60 let, kteří se účastnili různých klinických studií v USA, dostávalo Anafranil po dobu několika měsíců až několika let. U této populace nebyly zjištěny žádné neobvyklé nežádoucí účinky související s věkem. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Anafranil byl spojován s případy klinicky významné hyponatremie. Starší pacienti mohou být vystaveni většímu riziku této nežádoucí reakce (viz OPATŘENÍ , Hyponatrémie ).
PŘEDÁVKOVAT
důsledku předávkování touto třídou léků může dojít k úmrtí. Při úmyslném předávkování tricyklickými látkami je běžné požití více drog (včetně alkoholu). Vzhledem k tomu, že řízení je složité a mění se, doporučuje se, aby lékař kontaktoval toxikologické centrum pro aktuální informace o léčbě. Příznaky a příznaky toxicity se po předávkování tricyklickými látkami rychle rozvíjejí. Proto je nutné co nejrychlejší sledování v nemocnici.
Lidská zkušenost
klinických studiích v USA došlo ke 2 úmrtím ve 12 hlášených případech akutního předávkování Anafranilem buď samotným nebo v kombinaci s jinými léky. Jedno úmrtí zahrnovalo pacienta podezřelého z požití dávky 7000 mg. Druhé úmrtí se týkalo pacienta podezřelého z požití dávky 5750 mg. 10 nefatálních případů zahrnovalo dávky až 5000 mg doprovázené plazmatickými hladinami až 1010 ng/ml. Všech 10 pacientů se zcela uzdravilo. Mezi zprávami o předávkování Anafranilem z jiných zemí byla nejnižší dávka spojená s úmrtím 750 mg. Na základě postmarketingových zpráv ve Spojeném království se letalita CMI při předávkování považuje za podobnou jako u blízce příbuzných tricyklických sloučenin uváděných na trh jako antidepresiva.
Projevy
Příznaky a symptomy se liší v závažnosti v závislosti na faktorech, jako je množství absorbovaného léku, věk pacienta a doba, která uplynula od požití léku. Mezi kritické projevy předávkování patří srdeční dysrytmie, těžká hypotenze, křeče a deprese CNS včetně kómatu. Změny na elektrokardiogramu, zejména v ose nebo šířce QRS, jsou klinicky významnými indikátory tricyklické toxicity. Jiné CNS projevy mohou zahrnovat ospalost, strnulost, ataxii, neklid, agitovanost, delirium, silné pocení, hyperaktivní reflexy, svalovou rigiditu a atetoidní a choreiformní pohyby. Srdeční abnormality mohou zahrnovat tachykardii, známky městnavého srdečního selhání a ve velmi vzácných případech srdeční zástavu. Může být také přítomna respirační deprese, cyanóza, šok, zvracení, hyperpyrexie, mydriáza a oligurie nebo anurie.
Řízení
Získejte EKG a okamžitě zahajte monitorování srdce. Chraňte pacientovy dýchací cesty, zaveďte intravenózní hadičku a zahajte dekontaminaci žaludku. Je nutné minimálně 6 hodin pozorování s monitorováním srdce a sledováním známek CNS nebo respirační deprese, hypotenze, srdečních dysrytmií a/nebo převodních bloků a záchvatů.
Pokud se kdykoli během tohoto období objeví známky toxicity, je nutné dlouhodobé sledování. Existují kazuistiky pacientů, kteří podlehli fatálním dysrytmiím pozdě po předávkování; tito pacienti měli před smrtí klinické známky významné otravy a většina z nich byla dekontaminována gastrointestinálním traktem. Sledování plazmatických hladin léčiva by nemělo vést k léčbě pacienta.
Gastrointestinální dekontaminace
Všichni pacienti s podezřením na předávkování tricyklickými látkami by měli dostat gastrointestinální dekontaminaci. To by mělo zahrnovat výplach žaludku ve velkém objemu následovaný aktivním uhlím. Pokud je vědomí narušeno, je třeba před výplachem zajistit dýchací cesty. Emese je kontraindikována.
Kardiovaskulární
Maximální trvání QRS z končetiny ≥ 0,10 sekundy může být nejlepším ukazatelem závažnosti předávkování. K udržení pH séra v rozmezí 7,45 až 7,55 by měl být použit intravenózní hydrogenuhličitan sodný. Pokud je reakce na pH nedostatečná, lze také použít hyperventilaci. Současné užívání hyperventilace a hydrogenuhličitanu sodného by mělo být prováděno s extrémní opatrností, s častým monitorováním pH. pH >7,60 nebo pCO2
Ve vzácných případech může být hemoperfuze prospěšná při akutní refrakterní kardiovaskulární nestabilitě u pacientů s akutní toxicitou. Nicméně hemodialýza, peritoneální dialýza, výměnné transfuze a nucená diuréza byly obecně hlášeny jako neúčinné při tricyklické otravě.
CNS
U pacientů s útlumem CNS se doporučuje časná intubace kvůli možnosti náhlého zhoršení. Záchvaty by měly být kontrolovány benzodiazepiny, nebo pokud jsou neúčinné, jinými antikonvulzivními látkami (např. fenobarbitalem, fenytoinem). Fysostigmin se nedoporučuje kromě léčby život ohrožujících příznaků, které nereagují na jiné terapie, a to pouze po konzultaci s toxikologickým centrem.
Psychiatrické sledování
Vzhledem k tomu, že předávkování je často záměrné, mohou se pacienti během fáze zotavení pokusit o sebevraždu jinými způsoby. Vhodné může být doporučení psychiatra.
Pediatrický management
Principy léčby předávkování dětmi a dospělými jsou podobné. Důrazně se doporučuje, aby lékař kontaktoval místní toxikologické centrum pro konkrétní pediatrickou léčbu.
KONTRAINDIKACE
Anafranil je kontraindikován u pacientů s anamnézou přecitlivělosti na Anafranil 25 mg nebo jiná tricyklická antidepresiva.
Inhibitory monoaminooxidázy (MAOI)
Užívání IMAO určených k léčbě psychiatrických poruch Anafranilem nebo do 14 dnů po ukončení léčby Anafranilem je kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu. Užívání Anafranilu 10 mg do 14 dnů po ukončení užívání IMAO určeného k léčbě psychiatrických poruch je také kontraindikováno (viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Zahájení léčby přípravkem Anafranil u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, je také kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu (viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Infarkt myokardu
Anafranil je kontraindikován v období akutní rekonvalescence po infarktu myokardu.
KLINICKÁ FARMAKOLOGIE
Farmakodynamika
Předpokládá se, že klomipramin (CMI) ovlivňuje obsedantní a kompulzivní chování prostřednictvím svých účinků na serotonergní neuronální přenos. Skutečný neurochemický mechanismus není znám, ale schopnost CMI inhibovat zpětné vychytávání serotoninu (5-HT) se považuje za důležitou.
Farmakokinetika
Absorpce/biologická dostupnost
CMI z Anafranil 25mg tobolek je stejně biologicky dostupný jako CMI z roztoku. Biologická dostupnost CMI z kapslí není významně ovlivněna potravou.
Ve studii proporcionality dávky zahrnující vícenásobné dávky CMI nebyly plazmatické koncentrace v ustáleném stavu (Css) a křivky plochy pod plazmatickou koncentrací v čase (AUC) CMI a hlavního aktivního metabolitu CMI, desmethylklomipraminu (DMI), úměrné dávce v hodnocených rozmezích, tj. mezi 25 až 100 mg/den a mezi 25 až 150 mg/den, ačkoli Css a AUC jsou přibližně lineárně závislé na dávce mezi 100 až 150 mg/den. Vztah mezi dávkou a koncentracemi CMI/DMI při vyšších denních dávkách nebyl systematicky hodnocen, ale pokud existuje signifikantní závislost na dávce při dávkách nad 150 mg/den, existuje potenciál pro dramaticky vyšší Css a AUC i u pacientů užívajících doporučený rozsah. To může pro některé pacienty představovat potenciální riziko (viz VAROVÁNÍ a DROGOVÉ INTERAKCE ).
Po jednorázové perorální dávce 50 mg se maximální plazmatické koncentrace CMI objeví během 2 až 6 hodin (průměrně 4,7 hodiny) a pohybují se v rozmezí od 56 ng/ml do 154 ng/ml (průměrně 92 ng/ml). Po opakovaných denních dávkách 150 mg Anafranilu 25 mg se maximální plazmatické koncentrace v ustáleném stavu pohybují od 94 ng/ml do 339 ng/ml (průměr, 218 ng/ml) pro CMI a od 134 ng/ml do 532 ng/ml ( průměr, 274 ng/ml) pro DMI. Další informace ze studie zvyšující se dávky až do 250 mg naznačují, že DMI může vykazovat nelineární farmakokinetiku v obvyklém dávkovacím rozmezí. Při dávce Anafranil 200 mg měly subjekty, kterým byl odebrán jeden vzorek krve přibližně za 9 až 22 hodin (medián 16 hodin), po dávce plazmatické koncentrace až 605 ng/ml pro CMI, 781 ng/ml pro DMI a 1386 ng/ml pro oba.
Rozdělení
CMI se distribuuje do mozkomíšního moku (CSF) a mozku a do mateřského mléka. DMI se také distribuuje do CSF s průměrným poměrem CSF/plazma 2,6. Vazba CMI na proteiny je přibližně 97 %, hlavně na albumin, a je nezávislá na koncentraci CMI. Interakce mezi CMI a jinými léky vysoce vázanými na proteiny nebyla plně vyhodnocena, ale může být důležitá (viz DROGOVÉ INTERAKCE ).
Metabolismus
CMI je extenzivně biotransformován na DMI a další metabolity a jejich glukuronidové konjugáty. DMI je farmakologicky aktivní, ale jeho účinky na chování OCD nejsou známy. Tyto metabolity jsou po eliminaci žlučí vylučovány močí a stolicí. Po dávce 25 mg radioaktivně značeného CMI u dvou subjektů bylo 60 % a 51 % dávky nalezeno v moči a 32 % a 24 % ve stolici. Ve stejné studii bylo kombinované obnovení CMI a DMI močí pouze asi 0,8 % až 1,3 % podané dávky. CMI neindukuje enzymy metabolizující léky, jak bylo měřeno poločasem antipyrinu.
Odstranění
Důkazy, že Css a AUC pro CMI a DMI se mohou neúměrně zvyšovat se zvyšujícími se perorálními dávkami, naznačují, že metabolismus CMI a DMI může být kapacitně omezen. Tuto skutečnost je třeba vzít v úvahu při hodnocení odhadů farmakokinetických parametrů uvedených níže, protože ty byly získány u jedinců vystavených dávkám 150 mg. Pokud je farmakokinetika CMI a DMI nelineární při dávkách nad 150 mg, jejich eliminační poločasy se mohou značně prodloužit při dávkách blízkých horní hranici doporučeného dávkovacího rozmezí (tj. 200 mg/den až 250 mg/den). V důsledku toho se CMI a DMI mohou akumulovat a tato akumulace může zvýšit výskyt jakýchkoli nežádoucích účinků závislých na dávce nebo plazmatické koncentraci, zejména záchvatů (viz VAROVÁNÍ ).
Po dávce 150 mg se poločas CMI pohybuje od 19 hodin do 37 hodin (průměr 32 hodin) a poločas DMI se pohybuje od 54 hodin do 77 hodin (průměrně 69 hodin). Ustálené hladiny po opakovaných dávkách jsou u CMI typicky dosaženy během 7 až 14 dnů. Plazmatické koncentrace metabolitu převyšují původní léčivo při opakovaném podávání. Po opakovaném dávkování 150 mg/den je akumulační faktor pro CMI přibližně 2,5 a pro DMI je 4,6. Důležité je, že dosažení tohoto rozsahu akumulace při konstantním dávkování může trvat dva týdny nebo déle kvůli relativně dlouhým poločasům eliminace CMI a DMI (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Účinky poškození jater a ledvin na vylučování Anafranilu nebyly stanoveny.
Interakce
Současné podávání haloperidolu s CMI zvyšuje plazmatické koncentrace CMI. Současné podávání CMI s fenobarbitalem zvyšuje plazmatické koncentrace fenobarbitalu (viz DROGOVÉ INTERAKCE ). Mladší subjekty (18 až 40 let) lépe tolerovaly CMI a měly významně nižší plazmatické koncentrace v ustáleném stavu ve srovnání se subjekty staršími 65 let. Děti do 15 let měly významně nižší poměr plazmatická koncentrace/dávka ve srovnání s dospělými. Plazmatické koncentrace CMI byly významně nižší u kuřáků než u nekuřáků.
INFORMACE PRO PACIENTA
Anafranil™ (klomipramin hydrochlorid) Kapsle USP
Antidepresiva, deprese a další vážné duševní nemoci a sebevražedné myšlenky nebo činy
Přečtěte si Příručku o medikaci, která je dodávána s vámi nebo s antidepresivy vašeho člena rodiny. Tato příručka o medikaci je pouze o riziku sebevražedných myšlenek a činů s antidepresivy. Promluvte si se svým poskytovatelem zdravotní péče nebo s poskytovatelem zdravotní péče o:
- všechna rizika a přínosy léčby antidepresivy
- všechny možnosti léčby deprese nebo jiné vážné duševní choroby
Jaké jsou nejdůležitější informace, které bych měl vědět o antidepresivech, depresi a jiných vážných duševních chorobách a sebevražedných myšlenkách nebo činech?
1. Antidepresiva mohou u některých dětí, dospívajících a mladých dospělých během prvních měsíců léčby zvýšit sebevražedné myšlenky nebo činy.
2. Deprese a jiná závažná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek a činů. Někteří lidé mohou mít zvláště vysoké riziko sebevražedných myšlenek nebo činů. Patří mezi ně lidé, kteří mají (nebo mají v rodinné anamnéze) bipolární nemoc (nazývanou také maniodepresivní nemoc) nebo sebevražedné myšlenky nebo činy.
3. Jak mohu sledovat a snažit se předcházet sebevražedným myšlenkám a činům u sebe nebo člena rodiny?
- Věnujte zvýšenou pozornost všem změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Dodržujte všechny následné návštěvy u poskytovatele zdravotní péče podle plánu. Zavolejte poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte poskytovatele zdravotní péče, pokud máte vy nebo váš rodinný příslušník některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- myšlenky na sebevraždu nebo smrt
- pokusy o sebevraždu
- nová nebo horší deprese
- nová nebo horší úzkost
- pocit velkého rozrušení nebo neklidu
- panický záchvat
- potíže se spánkem (nespavost)
- nová nebo horší podrážděnost
- chovat se agresivně, být naštvaný nebo násilný
- působící na nebezpečné impulsy
- extrémní nárůst aktivity a mluvení (mánie)
- jiné neobvyklé změny v chování nebo náladě
Nízká hladina soli (sodíku) v krvi. Starší lidé mohou být tímto více ohroženi. Příznaky mohou zahrnovat:
- bolest hlavy
- slabost nebo pocit nejistoty
- zmatenost, problémy se soustředěním nebo myšlením nebo problémy s pamětí
Vizuální problémy
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
Kdo by neměl užívat Anafranil?
Neužívejte Anafranil, pokud:
- užívat inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu.
- Neužívejte IMAO do 2 týdnů po ukončení léčby Anafranilem 25 mg, pokud to nenařídí váš lékař.
- Nezačínejte s přípravkem Anafranil, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš lékař.
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili s poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité probrat všechna rizika léčby deprese a také rizika její neléčení. Pacienti a jejich rodiny nebo jiní pečovatelé by měli s poskytovatelem zdravotní péče diskutovat o všech možnostech léčby, nejen o užívání antidepresiv.
- Antidepresiva mají další vedlejší účinky. Promluvte si s poskytovatelem zdravotní péče o vedlejších účincích léku předepsaného vám nebo vašemu rodinnému příslušníkovi.
- Antidepresiva mohou interagovat s jinými léky. Znát všechny léky, které užíváte vy nebo váš rodinný příslušník. Uchovávejte seznam všech léků, abyste je mohli ukázat poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
- Ne všechna antidepresiva předepisovaná dětem jsou schválena FDA pro použití u dětí. Pro více informací se poraďte s poskytovatelem zdravotní péče vašeho dítěte.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
