Buspar 5mg, 10mg Buspirone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Buspar a jak se používá?
Buspar 5 mg je lék na předpis používaný k léčbě příznaků úzkostných poruch. Buspar 5 mg lze užívat samostatně nebo s jinými léky.
Buspar patří do třídy léků nazývaných léky proti úzkosti, anxiolytika, nebenzodiazepiny.
Jaké jsou možné vedlejší účinky přípravku Buspar?
Jaké jsou možné vedlejší účinky přípravku Buspar 5 mg?
Buspar může způsobit závažné nežádoucí účinky včetně:
- bolest na hrudi,
- dušnost a
- točení hlavy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Buspar patří:
- bolest hlavy,
- závrať,
- ospalost,
- problémy se spánkem (nespavost),
- nevolnost,
- podrážděný žaludek a
- pocit nervozity nebo vzrušení
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Buspar. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Tablety buspiron hydrochloridu, USP, jsou látky proti úzkosti, které nejsou chemicky ani farmakologicky příbuzné s benzodiazepiny, barbituráty nebo jinými sedativními/anxiolytickými léky.
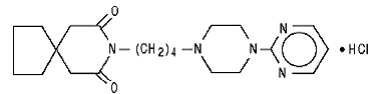
Buspiron hydrochlorid, USP je bílý krystalický prášek. Je velmi dobře rozpustný ve vodě; snadno rozpustný v methanolu a v methylenchloridu; těžce rozpustný v ethanolu a acetonitrilu; velmi těžce rozpustný v ethylacetátu a prakticky nerozpustný v hexanech. Jeho molekulová hmotnost je 422. Chemicky je buspiron hydrochlorid 8-[4-[4-(2-pyrimidinyl)-1-piperazinyl]butyl]-8-azaspiro[4.5]dekan-7,9-dion monohydrochlorid. Molekulární vzorec C21H31N5O2•HCl je reprezentován následujícím strukturním vzorcem:
Každá tableta buspiron hydrochloridu určená k perorálnímu podání obsahuje 5 mg nebo 10 mg nebo 15 mg nebo 30 mg buspiron hydrochloridu (odpovídá 4,6 mg, 9,1 mg, 13,7 mg a 27,4 mg volné báze buspironu). Kromě toho každá tableta obsahuje následující neaktivní složky: koloidní oxid křemičitý, monohydrát laktózy, magnesium-stearát, mikrokrystalickou celulózu a sodnou sůl glykolátu škrobu. 5 mg a 10 mg tablety jsou opatřeny rýhou, takže je lze rozpůlit. 5 mg tableta tedy může také poskytnout 2,5 mg dávku a 10 mg tableta může poskytnout 5 mg dávku. 15mg a 30mg tablety jsou opatřeny rýhou, takže je lze rozpůlit nebo rozdělit na tři části. Jedna 15mg tableta tedy může poskytnout následující dávky: 15 mg (celá tableta), 10 mg (dvě třetiny tablety), 7,5 mg (jedna polovina tablety) nebo 5 mg (jedna třetina tablety) . Jedna 30mg tableta může poskytnout následující dávky: 30 mg (celá tableta), 20 mg (dvě třetiny tablety), 15 mg (jedna polovina tablety) nebo 10 mg (jedna třetina tablety).
INDIKACE
Tablety buspiron hydrochloridu jsou indikovány k léčbě úzkostných poruch nebo ke krátkodobé úlevě od příznaků úzkosti. Úzkost nebo napětí spojené se stresem každodenního života obvykle nevyžadují léčbu anxiolytikem.
Účinnost tablet buspiron hydrochloridu byla prokázána v kontrolovaných klinických studiích u ambulantních pacientů, jejichž diagnóza zhruba odpovídá generalizované úzkostné poruše (GAD). Mnoho pacientů zařazených do těchto studií mělo také koexistující příznaky deprese a tablety buspiron hydrochloridu zmírnily úzkost v přítomnosti těchto koexistujících příznaků deprese. Pacienti hodnocení v těchto studiích měli příznaky po dobu 1 měsíce až více než 1 rok před studií, s průměrnou dobou trvání příznaků 6 měsíců. Generalizovaná úzkostná porucha (300.02) je popsána v Diagnostickém a statistickém manuálu Americké psychiatrické asociace, III1 takto:
Generalizovaná, přetrvávající úzkost (s nepřetržitým trváním alespoň 1 měsíc), projevující se příznaky ze tří ze čtyř následujících kategorií:
Napětí motoru
Roztřesenost, nervozita, podrážděnost, chvění, napětí, bolesti svalů, únava, neschopnost se uvolnit, cukání víček, svraštělé obočí, namožený obličej, vrtění, neklid, snadné polekání.
Autonomní hyperaktivita
Pocení, bušení nebo bušení srdce, nachlazení, vlhké ruce, sucho v ústech, závratě, točení hlavy, parestézie (brnění rukou nebo nohou), žaludeční nevolnost, návaly horka nebo nachlazení, časté močení, průjem, nepříjemné pocity v žaludeční jamce, boule v krku, návaly horka, bledost, vysoký klidový puls a frekvence dýchání.
Obávané očekávání
Úzkost, obavy, strach, přemítání a očekávání neštěstí sobě nebo druhým.
Bdělost a skenování
Hyperpozornost vedoucí k roztěkanosti, potížím se soustředěním, nespavosti, pocitu „na hraně“, podrážděnosti, netrpělivosti.
Výše uvedené příznaky by nebyly způsobeny jinou duševní poruchou, jako je depresivní porucha nebo schizofrenie. Mírné depresivní příznaky jsou však u GAD běžné.
Účinnost tablet buspiron hydrochloridu při dlouhodobém užívání, to znamená déle než 3 až 4 týdny, nebyla v kontrolovaných studiích prokázána. Není k dispozici žádný soubor důkazů, které by systematicky řešily vhodné trvání léčby GAD. Ve studii dlouhodobého užívání však bylo 264 pacientů léčeno tabletami buspiron hydrochloridu po dobu 1 roku bez nepříznivého účinku. Proto by měl lékař, který se rozhodne používat tablety buspiron hydrochloridu po delší dobu, pravidelně přehodnocovat užitečnost léku pro jednotlivého pacienta.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená počáteční dávka je 15 mg denně (7,5 mg dvakrát denně). Pro dosažení optimální terapeutické odpovědi lze v intervalech 2 až 3 dnů dávku podle potřeby zvyšovat o 5 mg denně. Maximální denní dávka by neměla překročit 60 mg denně. V klinických studiích umožňujících titraci dávky se běžně používaly rozdělené dávky 20 mg až 30 mg denně.
Biologická dostupnost buspironu je zvýšena při podávání s jídlem ve srovnání se stavem nalačno (viz KLINICKÁ FARMAKOLOGIE ). V důsledku toho by pacienti měli užívat buspiron konzistentním způsobem s ohledem na načasování dávkování; buď vždy s jídlem nebo vždy bez jídla.
Pokud má být buspiron podáván se silným inhibitorem CYP3A4, doporučení pro dávkování popsaná v DROGOVÉ INTERAKCE oddíl by měl být dodržován.
JAK DODÁVÁNO
Buspirone Hydrochloride Tablets USP, 5 mg jsou bílé až téměř bílé tablety ve tvaru tobolky s plochým povrchem se zkosenými hranami s vyraženým půlením na jedné straně; na jedné straně půli je vyraženo „ZE“ a na druhé straně je vyraženo „36“ a druhá strana je hladká
Údaje o výrobci: N/A. Revize: květen 2016
VEDLEJŠÍ EFEKTY
Nebyly poskytnuty žádné informace.
DROGOVÉ INTERAKCE
Psychotropní agenti
Inhibitory MAO
Doporučuje se, aby tablety buspiron hydrochloridu nebyly užívány současně s inhibitory MAO (viz VAROVÁNÍ ).
amitriptylin
Po přidání buspironu k dávkovacímu režimu amitriptylinu nebyly pozorovány žádné statisticky významné rozdíly ve farmakokinetických parametrech v ustáleném stavu (Cmax, AUC a Cmin) amitriptylinu nebo jeho metabolitu nortriptylinu.
Diazepam
Po přidání buspironu k dávkovacímu režimu diazepamu nebyly pozorovány žádné statisticky významné rozdíly ve farmakokinetických parametrech v ustáleném stavu (Cmax, AUC a Cmin) pro diazepam, ale zvýšení asi o 15 % bylo pozorováno u nordiazepamu a menší nežádoucí klinické účinky (závratě, bolesti hlavy a nevolnost).
haloperidol
Ve studii na normálních dobrovolnících vedlo současné podávání buspironu a haloperidolu ke zvýšení sérových koncentrací haloperidolu. Klinický význam tohoto nálezu není jasný.
Nefazodon
[vidět Inhibitory a induktory cytochromu P450 3A4 (CYP3A4) ].
Trazodon
Existuje jedna zpráva naznačující, že současné užívání přípravku Desyrel®# (trazodon hydrochlorid) a buspironu mohlo u několika pacientů způsobit 3 až 6násobné zvýšení SGPT (ALT). V podobné studii, která se pokoušela toto zjištění replikovat, nebyl identifikován žádný interaktivní účinek na jaterní transaminázy.
triazolam/flurazepam
Nezdálo se, že by současné podávání buspironu s triazolamem nebo flurazepamem prodloužilo nebo zesílilo sedativní účinky obou benzodiazepinů.
Ostatní psychotropní látky
Protože účinky současného podávání buspironu s většinou ostatních psychofarmak nebyly studovány, je třeba k současnému užívání buspironu s jinými léky působícími na CNS přistupovat opatrně.
Inhibitory a induktory cytochromu P450 3A4 (CYP3A4)
In vitro bylo prokázáno, že buspiron je metabolizován CYP3A4. Toto zjištění je v souladu s interakcemi in vivo pozorovanými mezi buspironem a následujícími:
Diltiazem a verapamil
Ve studii s devíti zdravými dobrovolníky zvýšilo současné podávání buspironu (10 mg v jedné dávce) s verapamilem (80 mg třikrát denně) nebo diltiazemem (60 mg třikrát denně) plazmatické koncentrace buspironu (verapamil zvýšil AUC a Cmax buspironu 3,4krát, zatímco diltiazem zvýšené AUC a Cmax 5,5krát a 4krát, v tomto pořadí.) Nežádoucí účinky přisuzované buspironu mohou být pravděpodobnější při současném podávání buď diltiazemu nebo verapamilu. Následná úprava dávky může být nezbytná a měla by být založena na klinickém hodnocení.
Erythromycin
Ve studii na zdravých dobrovolnících zvýšilo současné podávání buspironu (10 mg v jedné dávce) s erythromycinem (1,5 g/den po dobu 4 dnů) plazmatické koncentrace buspironu (5násobné zvýšení Cmax a 6násobné zvýšení AUC). Tyto farmakokinetické interakce byly doprovázeny zvýšeným výskytem nežádoucích účinků připisovaných buspironu. Pokud mají být tyto dva léky použity v kombinaci, doporučuje se nízká dávka buspironu (např. 2,5 mg dvakrát denně). Následná úprava dávky kteréhokoli léku by měla být založena na klinickém hodnocení.
Grepový džus
Ve studii u zdravých dobrovolníků zvýšilo současné podávání buspironu (10 mg v jedné dávce) s grapefruitovým džusem (200 ml dvakrát denně třikrát denně po dobu 2 dnů) plazmatické koncentrace buspironu (4,3násobné zvýšení Cmax; 9,2násobné zvýšení AUC ). Pacienti užívající buspiron by měli být poučeni, aby se vyvarovali pití tak velkého množství grapefruitové šťávy.
itrakonazol
Ve studii na zdravých dobrovolnících zvýšilo současné podávání buspironu (10 mg v jedné dávce) s itrakonazolem (200 mg/den po dobu 4 dnů) plazmatické koncentrace buspironu (13násobné zvýšení Cmax a 19násobné zvýšení AUC). Tyto farmakokinetické interakce byly doprovázeny zvýšeným výskytem nežádoucích účinků připisovaných buspironu. Pokud mají být tyto dva léky použity v kombinaci, doporučuje se nízká dávka buspironu (např. 2,5 mg qd). Následná úprava dávky kteréhokoli léku by měla být založena na klinickém hodnocení.
Nefazodon
Ve studii farmakokinetiky v ustáleném stavu u zdravých dobrovolníků vedlo současné podávání buspironu (2,5 nebo 5 mg dvakrát denně) s nefazodonem (250 mg dvakrát denně) k výraznému zvýšení plazmatických koncentrací buspironu (až 20násobné zvýšení Cmax a až 50 -násobek AUC) a statisticky významný pokles (asi 50 %) plazmatických koncentrací metabolitu buspironu 1-PP. Při dávkách buspironu 5 mg dvakrát denně bylo pozorováno mírné zvýšení AUC u nefazodonu (23 %) a jeho metabolitů hydroxynefazodonu (HO-NEF) (17 %) a meta-chlorfenylpiperazinu (9 %). Mírné zvýšení Cmax bylo pozorováno u nefazodonu (8 %) a jeho metabolitu HO-NEF (11 %).
Subjekty, které dostávaly buspiron 5 mg dvakrát denně a nefazodon 250 mg dvakrát denně, pociťovaly závratě, astenii, závratě a ospalost, nežádoucí účinky byly také pozorovány u každého léku samostatně. Pokud mají být tyto dva léky použity v kombinaci, doporučuje se nízká dávka buspironu (např. 2,5 mg qd). Následná úprava dávky kteréhokoli léku by měla být založena na klinickém hodnocení.
rifampin
Ve studii na zdravých dobrovolnících snížilo současné podávání buspironu (30 mg v jedné dávce) s rifampinem (600 mg/den po dobu 5 dnů) plazmatické koncentrace (83,7% snížení Cmax; 89,6% snížení AUC) a farmakodynamické účinky buspiron. Pokud mají být tyto dva léky použity v kombinaci, může být nutné upravit dávkování buspironu, aby byl zachován anxiolytický účinek.
Jiné inhibitory a induktory CYP3A4
Látky, které inhibují CYP3A4, jako je ketokonazol nebo ritonavir, mohou inhibovat metabolismus buspironu a zvyšovat plazmatické koncentrace buspironu, zatímco látky, které indukují CYP3A4, jako je dexamethason nebo některá antikonvulziva (fenytoin, fenobarbital, karbamazepin), mohou zvýšit rychlost metabolismu buspironu. Pokud byla pacientovi titrována stabilní dávka buspironu, může být nezbytná úprava dávky buspironu, aby se předešlo nežádoucím účinkům přisuzovaným buspironu nebo snížené anxiolytické aktivitě. V důsledku toho se při podávání se silným inhibitorem CYP3A4 doporučuje nízká dávka buspironu užívaná opatrně. Při použití v kombinaci se silným induktorem CYP3A4 může být nutné upravit dávkování buspironu, aby byl zachován anxiolytický účinek.
Jiné drogy
Cimetidin
Bylo zjištěno, že současné podávání buspironu s cimetidinem zvyšuje Cmax (40 %) a Tmax (2krát), ale má minimální vliv na AUC buspironu.
Vazba na bílkoviny
In vitro buspiron nevytěsňuje pevně vázané léky jako fenytoin, propranolol a warfarin ze sérových proteinů. Existuje však jedna zpráva o prodlouženém protrombinovém čase, když byl buspiron přidán do režimu u pacienta léčeného warfarinem. Pacient také chronicky dostával fenytoin, fenobarbital, digoxin a Synthroid®*. In vitro může buspiron vytlačit méně pevně vázaná léčiva, jako je digoxin. Klinický význam této vlastnosti není znám.
Terapeutické hladiny aspirinu, desipraminu, diazepamu, flurazepamu, ibuprofenu, propranololu, thioridazinu a tolbutamidu měly pouze omezený vliv na rozsah vazby buspironu na plazmatické proteiny (viz KLINICKÁ FARMAKOLOGIE ).
Interakce drog/laboratorních testů
Buspiron hydrochlorid může interferovat se stanovením metanefrinu/katecholaminu v moči. Během rutinního testování na feochromocytom byl omylem přečten jako metanefrin, což vedlo k falešně pozitivnímu laboratornímu výsledku. Buspiron-hydrochlorid by proto měl být vysazen alespoň 48 hodin před odběrem moči na katecholaminy.
Zneužívání drog a závislost
Třída kontrolovaných látek
Buspiron hydrochlorid není kontrolovaná látka.
Fyzická a psychická závislost
Ve studiích na lidech a zvířatech buspiron neprokázal žádný potenciál pro zneužívání nebo zneužívání a neexistuje žádný důkaz, že by způsoboval toleranci nebo fyzickou nebo psychickou závislost. Lidští dobrovolníci s anamnézou užívání rekreačních drog nebo alkoholu byli studováni ve dvou dvojitě zaslepených klinických studiích. Žádný ze subjektů nebyl schopen rozlišit mezi tabletami buspiron hydrochloridu a placebem. Naproti tomu subjekty vykazovaly statisticky významnou preferenci metakvalonu a diazepamu. Studie na opicích, myších a krysách ukázaly, že buspiron postrádá potenciál ke zneužití. Po chronickém podávání u potkanů nevedlo náhlé vysazení buspironu ke ztrátě tělesné hmotnosti běžně pozorované u látek, které způsobují fyzickou závislost.
Ačkoli neexistují žádné přímé důkazy, že tablety buspiron hydrochloridu způsobují fyzickou závislost nebo chování při vyhledávání drog, je obtížné z experimentů předvídat, do jaké míry bude léčivo působící na CNS zneužito, odkloněno a/nebo zneužito, jakmile bude uvedeno na trh. V důsledku toho by měli lékaři pečlivě vyhodnotit pacienty, zda v anamnéze nezoužili drogy, a pozorně tyto pacienty sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání tablet buspiron hydrochloridu (např. rozvoj tolerance, zvyšování dávky, chování při vyhledávání drog).
Třída kontrolovaných látek
Buspiron hydrochlorid není kontrolovaná látka.
Fyzická a psychická závislost
Ve studiích na lidech a zvířatech buspiron neprokázal žádný potenciál pro zneužívání nebo zneužívání a neexistuje žádný důkaz, že by způsoboval toleranci nebo fyzickou nebo psychickou závislost. Lidští dobrovolníci s anamnézou užívání rekreačních drog nebo alkoholu byli studováni ve dvou dvojitě zaslepených klinických studiích. Žádný ze subjektů nebyl schopen rozlišit mezi tabletami buspiron hydrochloridu a placebem. Naproti tomu subjekty vykazovaly statisticky významnou preferenci metakvalonu a diazepamu. Studie na opicích, myších a krysách ukázaly, že buspiron postrádá potenciál ke zneužití. Po chronickém podávání u potkanů nevedlo náhlé vysazení buspironu ke ztrátě tělesné hmotnosti běžně pozorované u látek, které způsobují fyzickou závislost.
Ačkoli neexistují žádné přímé důkazy, že tablety buspiron hydrochloridu způsobují fyzickou závislost nebo chování při vyhledávání drog, je obtížné z experimentů předvídat, do jaké míry bude léčivo působící na CNS zneužito, odkloněno a/nebo zneužito, jakmile bude uvedeno na trh. V důsledku toho by měli lékaři pečlivě vyhodnotit pacienty, zda v anamnéze nezoužili drogy, a pozorně tyto pacienty sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání tablet buspiron hydrochloridu (např. rozvoj tolerance, zvyšování dávky, chování při vyhledávání drog).
VAROVÁNÍ
Podávání tablet buspiron hydrochloridu pacientovi užívajícímu inhibitor monoaminooxidázy (MAOI) může představovat riziko. Byly hlášeny případy zvýšeného krevního tlaku, když byly tablety buspiron-hydrochloridu přidány k režimu zahrnujícímu IMAO. Proto se doporučuje, aby tablety buspiron-hydrochloridu nebyly užívány současně s IMAO.
Vzhledem k tomu, že tablety buspiron hydrochloridu nemají žádnou prokázanou antipsychotickou aktivitu, neměl by být používán místo vhodné antipsychotické léčby.
OPATŘENÍ
Všeobecné
Zásah do kognitivního a motorického výkonu
Studie naznačují, že tablety buspiron hydrochloridu jsou méně sedativní než jiná anxiolytika a že nezpůsobují významné funkční poškození. Jeho účinky na CNS u žádného jednotlivého pacienta však nemusí být předvídatelné. Pacienti by proto měli být varováni před řízením automobilu nebo používáním složitých strojů, dokud si nejsou přiměřeně jisti, že je léčba buspironem nepříznivě neovlivňuje.
Zatímco formální studie interakce buspiron-hydrochloridu s alkoholem naznačují, že buspiron nezvyšuje alkoholem indukované poruchy motorické a duševní výkonnosti, je rozumné vyhnout se současnému užívání alkoholu a buspironu.
Potenciál pro abstinenční reakce u pacientů závislých na sedativních/hypnotických/anxiolytických lécích
Vzhledem k tomu, že tablety buspiron hydrochloridu nevykazují zkříženou toleranci s benzodiazepiny a jinými běžnými sedativy/hypnotiky, neblokují abstinenční syndrom často pozorovaný při ukončení léčby těmito léky. Před zahájením léčby tabletami buspiron-hydrochloridu je proto vhodné postupně vyřazovat pacienty, zejména pacienty, kteří chronicky užívají léky tlumící CNS, z předchozí léčby. Rebound fenomén nebo abstinenční příznaky se mohou objevit v různých časových obdobích, částečně v závislosti na typu léku a jeho efektivním poločasu eliminace.
Syndrom z vysazení sedativních/hypnotických/anxiolytických léků se může objevit jako jakákoliv kombinace podrážděnosti, úzkosti, neklidu, nespavosti, třesu, křečí v břiše, svalových křečí, zvracení, pocení, příznaků podobných chřipce bez horečky a příležitostně i jako záchvaty .
Možné obavy související s vazbou Buspironu na dopaminové receptory
Protože se buspiron může vázat na centrální dopaminové receptory, byla vznesena otázka o jeho potenciálu způsobit akutní a chronické změny v neurologické funkci zprostředkované dopaminem (např. dystonie, pseudoparkinsonismus, akatizie a tardivní dyskineze). Klinické zkušenosti v kontrolovaných studiích nedokázaly identifikovat žádnou významnou aktivitu podobnou neuroleptiku; nicméně u malé části pacientů léčených buspironem byl hlášen syndrom neklidu, který se objevil krátce po zahájení léčby. Syndrom lze vysvětlit několika způsoby. Například buspiron může zvýšit centrální noradrenergní aktivitu; alternativně může být účinek přisuzován dopaminergním účinkům (tj. představuje akatizii). Vidět NEŽÁDOUCÍ REAKCE : Postmarketingové zkušenosti .
Informace pro pacienty
K zajištění bezpečného a účinného užívání tablet buspiron hydrochloridu by měly být pacientům poskytnuty následující informace a pokyny:
Informujte svého lékaře o všech lécích, na předpis nebo bez předpisu, alkoholu nebo lécích, které nyní užíváte nebo plánujete užívat během léčby tabletami buspiron hydrochloridu.
Informujte svého lékaře, pokud jste těhotná nebo plánujete otěhotnět, nebo pokud otěhotníte během užívání tablet buspiron-hydrochloridu.
Informujte svého lékaře, pokud kojíte dítě.
Dokud nezjistíte, jak na vás tento lék působí, neřiďte auto ani neobsluhujte potenciálně nebezpečné stroje.
Měli byste užívat buspiron-hydrochlorid důsledně, buď vždy s jídlem nebo vždy bez jídla.
Během léčby tabletami buspiron-hydrochloridu se vyhněte pití velkého množství grapefruitové šťávy.
Laboratorní testy
Nedoporučují se žádné specifické laboratorní testy.
Karcinogeneze, mutageneze, zhoršení plodnosti
Během 24měsíční studie při přibližně 133násobku maximální doporučené perorální dávky pro člověka nebyly u potkanů pozorovány žádné známky karcinogenního potenciálu; nebo u myší během 18měsíční studie při přibližně 167násobku maximální doporučené perorální dávky pro člověka.
S metabolickou aktivací nebo bez ní buspiron neindukoval bodové mutace v pěti kmenech Salmonella typhimurium (Amesův test) nebo buněčných kulturách myšího lymfomu L5178YTK+, ani nebylo pozorováno poškození DNA u buspironu v lidských buňkách Wi-38. Chromozomální aberace nebo abnormality se nevyskytly v buňkách kostní dřeně myší, kterým byla podávána jedna nebo pět denních dávek buspironu.
Těhotenství
Teratogenní účinky
Těhotenství kategorie B
reprodukčních studiích provedených na potkanech a králících při dávkách buspironu přibližně 30násobku maximální doporučené dávky pro člověka nebylo pozorováno žádné poškození plodnosti nebo poškození plodu. U lidí však adekvátní a dobře kontrolované studie během těhotenství nebyly provedeny. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Práce a dodání
Vliv buspiron hydrochloridu na porod u žen není znám. V reprodukčních studiích na potkanech nebyly zaznamenány žádné nežádoucí účinky.
Kojící matky
Rozsah vylučování buspironu nebo jeho metabolitů do mateřského mléka není znám. U potkanů se však buspiron a jeho metabolity vylučují do mléka. Je-li to klinicky možné, je třeba se vyhnout podávání tablet buspiron hydrochloridu kojícím ženám.
Pediatrické použití
Bezpečnost a účinnost buspironu byla hodnocena ve dvou placebem kontrolovaných 6týdenních studiích zahrnujících celkem 559 pediatrických pacientů (ve věku od 6 do 17 let) s GAD. Studované dávky byly 7,5 mg až 30 mg dvakrát denně (15 až 60 mg/den). Nebyly žádné významné rozdíly mezi buspironem a placebem, pokud jde o příznaky GAD po dávkách doporučených pro léčbu GAD u dospělých. Farmakokinetické studie ukázaly, že při stejných dávkách je plazmatická expozice buspironu a jeho aktivnímu metabolitu 1-PP u pediatrických pacientů stejná nebo vyšší než u dospělých. V těchto studiích nebyly s buspironem spojeny žádné neočekávané bezpečnostní nálezy. U této populace nejsou k dispozici žádné dlouhodobé údaje o bezpečnosti nebo účinnosti.
Geriatrické použití
jedné studii 6632 pacientů, kteří dostávali buspiron k léčbě úzkosti, bylo 605 pacientů ve věku ≥ 65 let a 41 bylo ve věku ≥ 75 let; profily bezpečnosti a účinnosti u těchto 605 starších pacientů (průměrný věk = 70,8 let) byly podobné jako u mladší populace (průměrný věk = 43,3 let). Přehled spontánně hlášených nežádoucích klinických příhod nezjistil rozdíly mezi staršími a mladšími pacienty, nelze však vyloučit vyšší citlivost některých starších pacientů.
Věk neměl žádný vliv na farmakokinetiku buspironu (viz KLINICKÁ FARMAKOLOGIE , Zvláštní populace ).
Použití u pacientů s poruchou funkce jater nebo ledvin
Buspiron je metabolizován játry a vylučován ledvinami. Farmakokinetická studie u pacientů s poruchou funkce jater nebo ledvin prokázala zvýšené plazmatické hladiny a prodloužený poločas buspironu. Proto nelze podávání tablet buspiron-hydrochloridu pacientům s těžkou poruchou funkce jater nebo ledvin doporučit (viz KLINICKÁ FARMAKOLOGIE ).
PŘEDÁVKOVAT
Nebyly poskytnuty žádné informace.
KONTRAINDIKACE
Tablety buspiron hydrochloridu jsou kontraindikovány u pacientů přecitlivělých na buspiron hydrochlorid.
KLINICKÁ FARMAKOLOGIE
Mechanismus účinku buspironu není znám. Buspiron se liší od typických benzodiazepinových anxiolytik tím, že nevykazuje antikonvulzivní nebo svalově relaxační účinky. Postrádá také výrazný sedativní účinek, který je spojen s typičtějšími anxiolytiky. Předklinické studie in vitro ukázaly, že buspiron má vysokou afinitu k serotoninovým (5-HT1A) receptorům. Buspiron nemá žádnou významnou afinitu k benzodiazepinovým receptorům a neovlivňuje vazbu GABA in vitro ani in vivo při testování na preklinických modelech.
Buspiron má střední afinitu k mozkovým D2-dopaminovým receptorům. Některé studie naznačují, že buspiron může mít nepřímé účinky na jiné neurotransmiterové systémy.
Buspiron hydrochlorid se u člověka rychle vstřebává a podléhá rozsáhlému metabolismu při prvním průchodu játry. V radioaktivně značené studii představoval nezměněný buspiron v plazmě pouze asi 1 % radioaktivity v plazmě. Po perorálním podání jsou plazmatické koncentrace nezměněného buspironu velmi nízké a proměnlivé mezi subjekty. Maximální plazmatické hladiny 1 ng/ml až 6 ng/ml byly pozorovány 40 až 90 minut po jednorázové perorální dávce 20 mg. Biologická dostupnost jednorázové dávky nezměněného buspironu, když je užíván jako tableta, je v průměru asi 90 % ekvivalentní dávky roztoku, ale existuje velká variabilita.
Účinky potravy na biologickou dostupnost tablet buspiron hydrochloridu byly studovány u osmi subjektů. Byla jim podávána dávka 20 mg s jídlem a bez jídla; plocha pod křivkou plazmatické koncentrace-čas (AUC) a maximální plazmatická koncentrace (Cmax) nezměněného buspironu se zvýšila o 84 %, resp. 116 %, ale celkové množství buspironového imunoreaktivního materiálu se nezměnilo. To naznačuje, že jídlo může snížit rozsah presystémové clearance buspironu (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Studie s více dávkami provedená u 15 subjektů naznačuje, že buspiron má nelineární farmakokinetiku. Zvyšování dávek a opakované podávání tedy může vést k poněkud vyšším hladinám nezměněného buspironu v krvi, než by bylo možné předpovědět z výsledků studií s jednorázovou dávkou.
Studie vazby na proteiny in vitro ukázala, že přibližně 86 % buspironu se váže na plazmatické proteiny. Bylo také pozorováno, že aspirin zvýšil plazmatické hladiny volného buspironu o 23 %, zatímco flurazepam snížil plazmatické hladiny volného buspironu o 20 %. Není však známo, zda tyto léky vyvolávají podobné účinky na plazmatické hladiny volného buspironu in vivo, nebo zda takové změny, pokud k nim dojde, způsobují klinicky významné rozdíly ve výsledcích léčby. Studie in vitro ukázala, že buspiron nevytěsňuje léky vysoce vázané na proteiny, jako je fenytoin, warfarin a propranolol, z plazmatických proteinů a že buspiron může vytlačovat digoxin.
Buspiron je metabolizován primárně oxidací, o které bylo in vitro prokázáno, že je zprostředkována cytochromem P450 3A4 (CYP3A4) (viz DROGOVÉ INTERAKCE ). Je produkováno několik hydroxylovaných derivátů a farmakologicky aktivní metabolit, 1-pyrimidinylpiperazin (1-PP). Ve zvířecích modelech predikujících anxiolytický potenciál má 1-PP přibližně jednu čtvrtinu aktivity buspironu, ale je přítomen až v 20krát větším množství. To však pravděpodobně není důležité u lidí: krevní vzorky od lidí chronicky vystavených buspiron hydrochloridu nevykazují vysoké hladiny 1-PP; průměrné hodnoty jsou přibližně 3 ng/ml a nejvyšší hladina v lidské krvi zaznamenaná u 108 chronicky léčených pacientů byla 17 ng/ml, což je méně než 1/200 hladin 1-PP zjištěných u zvířat, kterým byly podávány velké dávky buspironu bez známek toxicity.
Ve studii s jednorázovou dávkou buspironu značeného 14C bylo 29 % až 63 % dávky vyloučeno močí během 24 hodin, především ve formě metabolitů; fekální vylučování představovalo 18 % až 38 % dávky. Průměrný poločas eliminace nezměněného buspironu po jednotlivých dávkách 10 mg až 40 mg je přibližně 2 až 3 hodiny.
Zvláštní populace
Vliv na věk a pohlaví
Po jedné nebo více dávkách u dospělých nebyly pozorovány žádné významné rozdíly ve farmakokinetice buspironu (AUC a Cmax) mezi staršími a mladšími subjekty nebo mezi muži a ženami.
Poškození jater
Po podání více dávek buspironu pacientům s poruchou funkce jater se AUC buspironu v rovnovážném stavu zvýšila 13krát ve srovnání se zdravými jedinci (viz OPATŘENÍ ).
Renální poškození
Po podání více dávek buspironu pacientům s poruchou funkce ledvin (Clcr = 10 až 70 ml/min/1,73 m2) se AUC buspironu v ustáleném stavu zvýšila 4krát ve srovnání se zdravými (Clcr ≥ 80 ml/min/1,73 m2) jedinci (vidět OPATŘENÍ ).
Závodní efekty
Účinky rasy na farmakokinetiku buspironu nebyly studovány.
INFORMACE PRO PACIENTA
Buspiron hydrochlorid Tablety, USP Pro tablety 15 mg a 30 mg
JAK POUŽÍVAT
Reakce na buspiron se u jednotlivců liší. Váš lékař může považovat za nutné upravit dávkování, abyste dosáhli správné odpovědi.
Každá tableta je opatřena rýhou a lze ji přesně rozlomit.
Chcete-li tabletu rozlomit přesně a snadno, držte tabletu mezi palci a ukazováčky v blízkosti příslušné rýhy na tabletě (drážky). Poté s půlicí rýhou směrem k vám zatlačte a odlomte segmenty tablety od sebe (nesprávně se zlomící segmenty by se neměly používat).
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800- FDA-1088.
