Clozaril 25mg, 50mg, 100mg Clozapine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je přípravek Clozaril a jak se používá?
Clozaril 100 mg je lék na předpis používaný k léčbě příznaků schizofrenie. Clozaril 50 mg lze užívat samostatně nebo s jinými léky.
Clozaril 100 mg patří do třídy léků nazývaných antipsychotika 2. generace.
Není známo, zda je přípravek Clozaril 25 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Clozaril?
Clozaril může způsobit závažné nežádoucí účinky včetně:
- slabost,
- horečka,
- oteklé dásně,
- bolest krku,
- bolestivé vředy v ústech,
- bolest při polykání,
- kožní vředy,
- příznaky nachlazení nebo chřipky,
- kašel,
- potíže s dýcháním,
- nekontrolovatelné pohyby svalů rtů, jazyka, očí, obličeje, paží nebo nohou,
- bolest hlavy s bolestí na hrudi a těžkými závratěmi,
- bušení srdce,
- chvění v tvé hrudi,
- točení hlavy,
- náhlý kašel,
- zrychlené dýchání,
- vykašlávání krve,
- pocit sevření v krku nebo čelisti,
- záškuby nebo nekontrolovatelné pohyby svalů,
- záchvat (ztmavnutí nebo křeče),
- malé nebo žádné močení,
- otoky nohou nebo kotníků,
- únava,
- dušnost,
- nevolnost,
- bolest v horní části žaludku,
- ztráta chuti k jídlu,
- neobvyklé krvácení,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- velmi ztuhlé (tuhé) svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- třes,
- zvýšená žízeň,
- zvýšené močení,
- hlad,
- suchá ústa,
- ovocný zápach dechu,
- ospalost,
- suchá kůže,
- rozmazané vidění,
- ztráta váhy,
- snadná tvorba modřin nebo krvácení,
- silné brnění nebo necitlivost,
- svalová slabost,
- bolest v horní části žaludku,
- bolest na hrudi,
- nový nebo zhoršující se kašel a
- potíže s dýcháním
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Clozaril patří:
- přibývání na váze,
- třes,
- závrať,
- pocit točení,
- bolest hlavy,
- ospalost,
- nevolnost,
- zácpa,
- suchá ústa,
- zvýšené slinění,
- rozmazané vidění,
- rychlý srdeční tep a
- zvýšené pocení
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Clozaril. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
TĚŽKÁ NEUTROPENIE; ORTOSTATICKÁ HYPOTENZE, BRADYKARDIE A SYNKOPA; ZÁCHVAT; MYOKARDITIDA A KARDIOMYOPATIE; ZVÝŠENÁ ÚMRTNOST U STARŠÍCH PACIENTŮ S PSYCHÓZOU SOUVISEJÍCÍ S DEMENCÍ
Těžká neutropenie
Léčba přípravkem CLOZARIL způsobila těžkou neutropenii definovanou jako absolutní počet neutrofilů (ANC) nižší než 500/μl. Těžká neutropenie může vést k vážné infekci a smrti. Před zahájením léčby přípravkem CLOZARIL musí být výchozí hodnota ANC u běžné populace alespoň 1500/μl; a musí být alespoň 1000/μl u pacientů s dokumentovanou benigní etnickou neutropenií (BEN). Během léčby musí být pacienti pravidelně monitorováni ANC. Informujte pacienty, aby okamžitě hlásili příznaky odpovídající těžké neutropenii nebo infekci (např. horečka, slabost, letargie nebo bolest v krku) (viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Kvůli riziku těžké neutropenie je CLOZARIL dostupný pouze prostřednictvím omezeného programu v rámci strategie zmírňování rizik (REMS) nazývané Clozapin REMS Program. [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ].
Ortostatická hypotenze, bradykardie, synkopa
Při léčbě přípravkem CLOZARIL se vyskytla ortostatická hypotenze, bradykardie, synkopa a srdeční zástava. Riziko je nejvyšší během období počáteční titrace, zejména při rychlém zvyšování dávky. Tyto reakce se mohou objevit při první dávce, s dávkami tak nízkými, jako je 12,5 mg denně. Zahajte léčbu dávkou 12,5 mg jednou nebo dvakrát denně; pomalu titrujte; a použijte rozdělené dávky. Používejte přípravek CLOZARIL opatrně u pacientů s kardiovaskulárním nebo cerebrovaskulárním onemocněním nebo stavy predisponujícími k hypotenzi (např. dehydratace, užívání antihypertenzních léků) (viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Záchvaty
Při léčbě přípravkem CLOZARIL 25 mg se vyskytly záchvaty. Riziko je závislé na dávce. Zahajte léčbu dávkou 12,5 mg, postupně titrujte a použijte rozdělené dávkování. Buďte opatrní při podávání přípravku CLOZARIL 50 mg pacientům s anamnézou záchvatů nebo jiných predisponujících rizikových faktorů pro záchvat (patologie CNS, léky snižující práh záchvatů, abúzus alkoholu). Varujte pacienty před zapojením se do jakékoli činnosti, kde by náhlá ztráta vědomí mohla způsobit vážné riziko pro sebe nebo pro ostatní (viz DÁVKOVÁNÍ A PODÁVÁNÍ, VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Myokarditida a kardiomyopatie
Při léčbě přípravkem CLOZARIL se vyskytla fatální myokarditida a kardiomyopatie. Při podezření na tyto reakce přerušte léčbu přípravkem CLOZARIL 25 mg a nechte si vyšetřit srdce. Obecně by pacientům s myokarditidou nebo kardiomyopatií související s klozarilem neměl být přípravek CLOZARIL znovu podáván. Zvažte možnost myokarditidy nebo kardiomyopatie, pokud se objeví bolest na hrudi, tachykardie, palpitace, dušnost, horečka, příznaky podobné chřipce, hypotenze nebo změny EKG (viz VAROVÁNÍ A OPATŘENÍ ).
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí
U starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. CLOZARIL není schválen pro použití u pacientů s psychózou související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
POPIS
CLOZARIL® (klozapin), atypické antipsychotikum, je tricyklický dibenzodiazepinový derivát, 8-chlor-11-(4-methyl-1-piperazinyl)-5H-dibenzo[b,e][1,4]diazepin. Strukturní vzorec je
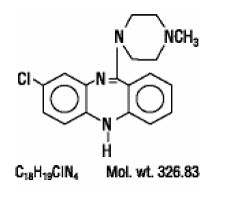
CLOZARIL je dostupný ve světle žlutých tabletách po 25 mg a 100 mg pro perorální podání.
Aktivní složka: clozapin
Neaktivními složkami jsou koloidní oxid křemičitý, laktóza, stearát hořečnatý, povidon, škrob (kukuřice) a mastek.
INDIKACE
Schizofrenie odolná vůči léčbě
CLOZARIL 50 mg je indikován k léčbě těžce nemocných pacientů se schizofrenií, kteří nereagují adekvátně na standardní antipsychotickou léčbu. Vzhledem k rizikům těžké neutropenie a záchvatů spojených s jeho užíváním by měl být přípravek CLOZARIL používán pouze u pacientů, u kterých selhala adekvátní odpověď na standardní antipsychotiku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Účinnost přípravku CLOZARIL u schizofrenie rezistentní na léčbu byla prokázána v 6týdenní, randomizované, dvojitě zaslepené, aktivně kontrolované studii srovnávající přípravek CLOZARIL a chlorpromazin u pacientů, u kterých selhala jiná antipsychotika (viz Klinické studie ].
Snížení rizika opakovaného sebevražedného chování u schizofrenie nebo schizoafektivní poruchy
CLOZARIL je indikován ke snížení rizika opakovaného sebevražedného chování u pacientů se schizofrenií nebo schizoafektivní poruchou, u kterých je na základě anamnézy a nedávného klinického stavu posouzeno, že mají chronické riziko opětovného sebevražedného chování. Sebevražedným chováním se rozumí jednání pacienta, které ho vystavuje riziku smrti.
Účinnost přípravku CLOZARIL při snižování rizika opakovaného sebevražedného chování byla prokázána během dvouletého léčebného období ve studii InterSePT™ [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Požadované laboratorní testování před zahájením a během terapie
Před zahájením léčby přípravkem CLOZARIL je nutné získat základní ANC. Výchozí hodnota ANC musí být alespoň 1500/μl pro běžnou populaci a alespoň 1000/μl pro pacienty s dokumentovanou benigní etnickou neutropenií (BEN). Aby léčba pokračovala, musí být ANC pravidelně monitorován [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Informace o dávkování
Počáteční dávka je 12,5 mg jednou denně nebo dvakrát denně. Celková denní dávka může být zvyšována o 25 mg až 50 mg denně, pokud je dobře tolerována, k dosažení cílové dávky 300 mg až 450 mg denně (podávané v rozdělených dávkách) do konce 2 týdnů. Následně lze dávku zvyšovat jednou týdně nebo dvakrát týdně v přírůstcích až do 100 mg. Maximální dávka je 900 mg denně. Aby se minimalizovalo riziko ortostatické hypotenze, bradykardie a synkopy, je nutné použít tuto nízkou počáteční dávku, postupné titrační schéma a rozdělené dávky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
CLOZARIL lze užívat s jídlem nebo bez jídla [viz Farmakokinetika ].
Udržovací léčba
Obecně by pacienti reagující na CLOZARIL měli pokračovat v udržovací léčbě na jejich účinné dávce i po akutní epizodě.
Přerušení léčby
Způsob ukončení léčby se bude lišit v závislosti na posledním ANC pacienta:
- Viz tabulky 2 nebo 3 pro vhodné monitorování ANC na základě úrovně neutropenie, pokud je nutné náhlé přerušení léčby z důvodu středně těžké až těžké neutropenie.
- Dávku snižujte postupně po dobu 1 až 2 týdnů, pokud je plánováno ukončení léčby přípravkem CLOZARIL 50 mg a nejsou žádné známky středně těžké až těžké neutropenie.
- Při náhlém vysazení klozapinu z důvodu, který nesouvisí s neutropenií, se u pacientů v běžné populaci doporučuje pokračovat ve stávajícím monitorování ANC, dokud jejich ANC není ≥1500/μl, au pacientů s BEN, dokud jejich ANC není ≥1000/μl nebo nad výchozí hodnotou.
- Další monitorování ANC je vyžadováno u každého pacienta hlásícího nástup horečky (teplota 38,5 °C nebo 101,3 °F nebo vyšší) během 2 týdnů po přerušení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Pečlivě sledujte všechny pacienty, zda se neopakují psychotické symptomy a symptomy související s cholinergním odrazem, jako je silné pocení, bolest hlavy, nevolnost, zvracení a průjem.
Opětovné zahájení léčby
Při opětovném zahájení léčby přípravkem CLOZARIL u pacientů, kteří přerušili léčbu přípravkem CLOZARIL (tj. 2 dny nebo více od poslední dávky), začněte znovu s dávkou 12,5 mg jednou denně nebo dvakrát denně. To je nezbytné pro minimalizaci rizika hypotenze, bradykardie a synkopy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pokud je tato dávka dobře tolerována, může být dávka zvýšena na předchozí terapeutickou dávku rychleji, než je doporučeno pro počáteční léčbu.
Úpravy dávkování při současném užívání CYP1A2, CYP2D6, CYP3A4 inhibitorů nebo CYP1A2, CYP3A4 induktorů
Úprava dávky může být nezbytná u pacientů, kteří současně užívají: silné inhibitory CYP1A2 (např. fluvoxamin, ciprofloxacin nebo enoxacin); středně silné nebo slabé inhibitory CYP1A2 (např. perorální antikoncepce nebo kofein); inhibitory CYP2D6 nebo CYP3A4 (např. cimetidin, escitalopram, erythromycin, paroxetin, bupropion, fluoxetin, chinidin, duloxetin, terbinafin nebo sertralin); induktory CYP3A4 (např. fenytoin, karbamazepin, třezalka tečkovaná a rifampin); nebo induktory CYP1A2 (např. kouření tabáku) (tabulka 1) [viz DROGOVÉ INTERAKCE ].
Renální nebo jaterní poškození nebo CYP2D6 špatné metabolizátory
Může být nutné snížit dávku přípravku CLOZARIL 50 mg u pacientů s významným poškozením ledvin nebo jater nebo u pomalých metabolizátorů CYP2D6 (viz Použití u konkrétních populací ].
JAK DODÁVÁNO
Dávkové formy A Síly
CLOZARIL (klozapin) je dostupný jako 25 mg, 50 mg a 100 mg kulaté, světle žluté, nepotahované tablety s rýhou na jedné straně. Clozaril (klozapin) 200 mg tablety jsou světle žluté nepotahované tablety ve tvaru tobolky s rýhou na jedné straně.
Tablety CLOZARIL® (klozapin).
25 mg
Kulatá, světle žlutá, nepotahovaná tableta. Vyraženo „CLOZARIL“ jednou na okraji jedné strany. Vyraženo s usnadněným skóre a „25“ jednou na druhé straně. Láhev 100 ........... NDC 69809-0126-05
50 mg
Kulatá, světle žlutá, nepotahovaná tableta. Vyraženo „CLOZARIL“ jednou na okraji jedné strany. Vyraženo „50“, usnadněné skóre a „mg“ na druhé straně. Láhev 100 ........... NDC 69809-0130-05
100 mg
Kulatá, světle žlutá, nepotahovaná tableta. Vyraženo „CLOZARIL“ jednou na okraji jedné strany. Vyraženo s usnadněným skóre a „100“ jednou na druhé straně. Láhev 100 ........... NDC 69809-0127-05
200 mg
Světle žlutá nepotahovaná tableta ve tvaru tobolky. Na jedné straně jednou vyraženo „CLOZARIL“. Vyraženo „200“, usnadněné skóre a „mg“ na druhé straně. Láhev 100 ........... NDC 69809-0135-05
Skladování A Manipulace
Skladovací teplota by neměla překročit 30°C (86°F).
Uchovávejte mimo dosah dětí.
Distribuce: HLS Therapeutics (USA), Inc., Rosemont, PA 19010, (844) 457-8721. Revize: únor 2021
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Těžká neutropenie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Ortostatická hypotenze, bradykardie a synkopa [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Falls [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Myokarditida, kardiomyopatie a inkompetence mitrální chlopně [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšená úmrtnost u starších pacientů s psychózou související s demencí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Gastrointestinální hypomotilita se závažnými komplikacemi [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Eozinofilie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT intervalu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Metabolické změny (hyperglykémie a diabetes mellitus, dyslipidémie a přírůstek hmotnosti) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Neuroleptický maligní syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Horečka [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Plicní embolie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Anticholinergní toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zásah do kognitivního a motorického výkonu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Tardivní dyskineze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Cerebrovaskulární nežádoucí účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Recidiva psychózy a cholinergní rebound fenomén po náhlém vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Nejčastěji hlášenými nežádoucími účinky (≥5 %) v klinických studiích s přípravkem CLOZARIL byly: reakce CNS, včetně sedace, závratě/vertigo, bolesti hlavy a třesu; kardiovaskulární reakce, včetně tachykardie, hypotenze a synkopy; reakce autonomního nervového systému, včetně hypersalivace, pocení, sucha v ústech a poruch vidění; gastrointestinální reakce, včetně zácpy a nevolnosti; a horečka. Tabulka 9 shrnuje nejčastěji hlášené nežádoucí účinky (≥5 %) u pacientů léčených přípravkem CLOZARIL (ve srovnání s pacienty léčenými chlorpromazinem) v klíčové, 6týdenní, kontrolované studii u schizofrenie rezistentní na léčbu.
Tabulka 10 shrnuje nežádoucí účinky hlášené u pacientů léčených přípravkem CLOZARIL s frekvencí 2 % nebo vyšší ve všech studiích s přípravkem CLOZARIL (s výjimkou 2leté studie InterSePT™). Tyto sazby nejsou upraveny podle délky expozice.
Tabulka 11 shrnuje nejčastěji hlášené nežádoucí účinky (>10 % ve skupině užívající přípravek CLOZARIL nebo olanzapin) ve studii InterSePT™. Jednalo se o adekvátní a dobře kontrolovanou dvouletou studii hodnotící účinnost přípravku CLOZARIL ve srovnání s olanzapinem při snižování rizika sebevražedného chování u pacientů se schizofrenií nebo schizoafektivní poruchou. Sazby nejsou upravovány podle délky expozice.
Dystonie
Třídní efekt
Příznaky dystonie, prodloužené abnormální kontrakce svalových skupin, se mohou objevit u vnímavých jedinců během prvních několika dnů léčby. Dystonické příznaky zahrnují: křeče šíjových svalů, někdy progredující do sevření hrdla, potíže s polykáním, potíže s dýcháním a/nebo vyčnívání jazyka. I když se tyto příznaky mohou objevit při nízkých dávkách, vyskytují se častěji as větší závažností při vysoké účinnosti a při vyšších dávkách antipsychotik první generace. Zvýšené riziko akutní dystonie je pozorováno u mužů a mladších věkových skupin.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během užívání klozapinu po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Centrální nervový systém
Delirium, abnormální EEG, myoklonus, parestézie, možná kataplexie, status epilepticus, obsedantně kompulzivní symptomy, syndrom neklidných nohou a nežádoucí reakce na cholinergní reakci po ukončení léčby.
Kardiovaskulární systém
Fibrilace síní nebo komor, ventrikulární tachykardie, palpitace, prodloužení QT intervalu, Torsades de Pointes, inkompetence mitrální chlopně spojená s kardiomyopatií související s klozapinem, infarkt myokardu, zástava srdce, myokarditida a periorbitální edém.
Endokrinní systém
Pseudofeochromocytom
Gastrointestinální systém
Akutní pankreatitida, dysfagie, otok slinných žláz, kolitida, megakolon, střevní ischemie nebo infarkt.
Hepatobiliární systém
Cholestáza, hepatitida, žloutenka, hepatotoxicita, jaterní steatóza, jaterní nekróza, jaterní fibróza, jaterní cirhóza, poškození jater (jaterní, cholestatické a smíšené) a selhání jater.
Poruchy imunitního systému
Angioedém, leukocytoklastická vaskulitida.
Urogenitální systém
Akutní intersticiální nefritida, noční enuréza, priapismus, selhání ledvin a retrográdní ejakulace.
Poruchy kůže a podkožní tkáně
Hypersenzitivní reakce: fotosenzitivita, vaskulitida, erythema multiforme, porucha pigmentace kůže a Stevens-Johnsonův syndrom.
Muskuloskeletální Systém A Poruchy pojivové Tkáně
Myastenický syndrom, rhabdomyolýza a systémový lupus erythematodes.
Dýchací systém
Aspirace, pleurální výpotek, pneumonie, infekce dolních cest dýchacích, spánková apnoe.
Hemický A Lymfatický Systém
Mírná, střední nebo těžká leukopenie, agranulocytóza, granulocytopenie, snížení WBC, hluboká žilní trombóza, zvýšený hemoglobin/hematokrit, zvýšená rychlost sedimentace erytrocytů (ESR), sepse, trombocytóza a trombocytopenie.
Poruchy zraku
Glaukom s úzkým úhlem.
Smíšený
Zvýšení kreatinfosfokinázy, hyperurikémie, hyponatrémie, polyserozitida a ztráta hmotnosti.
DROGOVÉ INTERAKCE
Potenciál jiných léků ovlivnit CLOZARIL
Klozapin je substrátem mnoha izoenzymů cytochromu P450, zejména CYP1A2, CYP3A4 a CYP2D6. Buďte opatrní při podávání přípravku CLOZARIL 100 mg současně s léky, které jsou induktory nebo inhibitory těchto enzymů.
Inhibitory CYP1A2
Současné užívání přípravku CLOZARIL a inhibitorů CYP1A2 může zvýšit plazmatické hladiny klozapinu, což může mít za následek nežádoucí účinky. Pokud je CLOZARIL podáván společně se silnými inhibitory CYP1A2 (např. fluvoxamin, ciprofloxacin nebo enoxacin), snižte dávku přípravku CLOZARIL na jednu třetinu původní dávky. Dávka přípravku CLOZARIL by měla být zvýšena na původní dávku, když je přerušeno současné podávání silných inhibitorů CYP1A2 (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Mezi středně silné nebo slabé inhibitory CYP1A2 patří perorální antikoncepce a kofein. Při současném podávání přípravku CLOZARIL s těmito inhibitory pacienty pečlivě sledujte. V případě potřeby zvažte snížení dávky přípravku CLOZARIL 25 mg [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Inhibitory CYP2D6 a CYP3A4
Současná léčba přípravkem CLOZARIL a inhibitory CYP2D6 nebo CYP3A4 (např. cimetidin, escitalopram, erythromycin, paroxetin, bupropion, fluoxetin, chinidin, duloxetin, terbinafin nebo sertralin) může zvýšit hladiny klozapinu a vést k nežádoucím účinkům (viz KLINICKÁ FARMAKOLOGIE ]. Při používání takových inhibitorů buďte opatrní a pečlivě sledujte pacienty. Zvažte snížení dávky přípravku CLOZARIL 100 mg [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Induktory CYP1A2 a CYP3A4
Souběžná léčba léky, které indukují CYP1A2 nebo CYP3A4, může snížit plazmatickou koncentraci klozapinu, což má za následek sníženou účinnost přípravku CLOZARIL. Tabákový kouř je středně silným induktorem CYP1A2. Mezi silné induktory CYP3A4 patří karbamazepin, fenytoin, třezalka tečkovaná a rifampin. Může být nutné zvýšit dávku přípravku CLOZARIL 50 mg, pokud se užívá současně s induktory těchto enzymů. Současné užívání přípravku CLOZARIL a silných induktorů CYP3A4 se však nedoporučuje (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Zvažte snížení dávky přípravku CLOZARIL 50 mg při vysazování souběžně podávaných induktorů enzymů; protože vysazení induktorů může mít za následek zvýšení plazmatických hladin klozapinu a zvýšené riziko nežádoucích reakcí [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Anticholinergní léky
Současná léčba klozapinem a jinými léky s anticholinergní aktivitou (např. benztropin, cyklobenzaprin, difenhydramin) může zvýšit riziko anticholinergní toxicity a závažných gastrointestinálních nežádoucích reakcí souvisejících s hypomotilitou. Vyhněte se současnému užívání přípravku CLOZARIL s anticholinergními léky, pokud je to možné (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léky, které způsobují prodloužení QT intervalu
Buďte opatrní při současném podávání léků, které prodlužují QT interval nebo inhibují metabolismus klozapinu. Mezi léky, které způsobují prodloužení QT intervalu, patří: specifická antipsychotika (např. ziprasidon, iloperidon, chlorpromazin, thioridazin, mesoridazin, droperidol a pimozid), specifická antibiotika (např. erythromycin, gatifloxacin, moxifloxacin, sparfloxacin, antiarytmika 1. třídy A prokainamid) nebo antiarytmika třídy III (např. amiodaron, sotalol) a další (např. pentamidin, levomethadylacetát, metadon, halofantrin, meflochin, dolasetron mesylát, probukol nebo takrolimus) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Potenciál pro CLOZARIL ovlivnit jiné léky
Současné užívání přípravku CLOZARIL 25 mg s jinými léky metabolizovanými CYP2D6 může zvýšit hladiny těchto substrátů CYP2D6. Buďte opatrní při současném podávání přípravku CLOZARIL 50 mg s jinými léky, které jsou metabolizovány CYP2D6. Může být nutné použít nižší dávky takových léků, než jsou obvykle předepsány. Mezi taková léčiva patří specifická antidepresiva, fenothiaziny, karbamazepin a antiarytmika typu 1C (např. propafenon, flekainid a enkainid).
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Těžká neutropenie
Pozadí
CLOZARIL může způsobit neutropenii (nízký absolutní počet neutrofilů (ANC)), definovanou jako snížení krevních neutrofilů pod normální hladiny před léčbou. ANC je obvykle k dispozici jako složka kompletního krevního obrazu (CBC), včetně diferenciálu, a je pro neutropenii vyvolanou léky relevantnější než počet bílých krvinek (WBC). ANC lze také vypočítat pomocí následujícího vzorce: ANC se rovná celkovému počtu bílých krvinek vynásobenému celkovým procentem neutrofilů získaných z diferenciálu (neutrofilní „segmenty“ plus neutrofilní „pásy“). Ostatní granulocyty (bazofily a eozinofily) se na neutropenii podílejí minimálně a jejich měření není nutné [viz. NEŽÁDOUCÍ REAKCE ]. Neutropenie může být mírná, středně závažná nebo závažná (viz tabulky 2 a 3). Pro zlepšení a standardizaci porozumění nahrazuje výraz „těžká neutropenie“ předchozí termíny těžká leukopenie, těžká granulocytopenie nebo agranulocytóza.
Těžká neutropenie, ANC nižší než (
Níže jsou uvedeny dva samostatné algoritmy léčby, první pro pacienty v běžné populaci a druhý pro pacienty, u kterých byla zjištěna výchozí neutropenie.
Léčba a monitorování přípravkem CLOZARIL u běžné populace pacientů (viz tabulka 2)
Před zahájením léčby přípravkem CLOZARIL 25 mg získejte CBC, včetně hodnoty ANC, abyste zajistili přítomnost normálního výchozího počtu neutrofilů (rovný nebo vyšší než 1500/μl) a umožnili pozdější srovnání. Pacienti v obecné populaci s ANC rovným nebo vyšším než (≥) 1500/μl jsou považováni za v normálním rozmezí (tabulka 2) a jsou způsobilí k zahájení léčby. Během prvních 6 měsíců léčby je u všech pacientů vyžadováno týdenní monitorování ANC. Pokud ANC pacienta zůstane rovný nebo vyšší než 1500/μl po dobu prvních 6 měsíců léčby, může být frekvence monitorování snížena na každé 2 týdny po dobu následujících 6 měsíců. Pokud ANC zůstane rovný nebo vyšší než 1500/μl po dobu druhých 6 měsíců nepřetržité léčby, může být frekvence monitorování ANC poté snížena na jednou za 4 týdny.
Léčba a monitorování přípravkem CLOZARIL u pacientů s benigní etnickou neutropenií (viz tabulka 3)
Benigní etnická neutropenie (BEN) je stav pozorovaný u určitých etnických skupin, jejichž průměrné hodnoty ANC jsou nižší než „standardní“ laboratorní rozmezí pro neutrofily. Nejčastěji je pozorován u jedinců afrického původu (přibližná prevalence 25-50 %), některých blízkovýchodních etnických skupin a u jiných nebělošských etnických skupin s tmavší pletí. BEN je častější u mužů. Pacienti s BEN mají normální počet hematopoetických kmenových buněk a myeloidní zrání, jsou zdraví a netrpí opakovanými nebo závažnými infekcemi. Není u nich zvýšené riziko rozvoje neutropenie vyvolané přípravkem CLOZARIL. K určení, zda je výchozí neutropenie způsobena BEN, může být zapotřebí další vyšetření. Zvažte hematologickou konzultaci před zahájením nebo během léčby přípravkem CLOZARIL 50 mg podle potřeby.
Pacienti s BEN vyžadují jiný algoritmus ANC pro léčbu přípravkem CLOZARIL kvůli jejich nižším výchozím hladinám ANC. Tabulka 3 uvádí pokyny pro řízení léčby přípravkem CLOZARIL 100 mg a monitorování ANC u pacientů s BEN.
Obecné pokyny pro léčbu všech pacientů s horečkou nebo neutropenií
- Horečka: Přerušte CLOZARIL jako preventivní opatření u každého pacienta, u kterého se rozvine horečka, definovaná jako teplota 38,5 °C [101,3 °F] nebo vyšší, a získejte hladinu ANC. Horečka je často prvním příznakem neutropenické infekce.
- ANC menší než 1 000/μl: Pokud se u kteréhokoli pacienta s ANC menším než 1 000/μl objeví horečka, zahajte vhodné vyšetření a léčbu infekce a podívejte se na Tabulky 2 nebo 3 pro léčbu.
- Zvažte hematologickou konzultaci.
- Viz Neuroleptický maligní syndrom [NMS] a Horečka níže VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Pokyny pro pacienty, pod INFORMACE PRO PACIENTA .
Opakovaná expozice po ANC nižším než 500/μl (těžká neutropenie)
některých pacientů, kteří prodělali těžkou neutropenii související s přípravkem CLOZARIL, může být riziko vážného psychiatrického onemocnění při přerušení léčby přípravkem CLOZARIL vyšší než riziko opětovného zahájení léčby (např. pacienti se závažným schizofrenním onemocněním, kteří nemají jiné možnosti léčby než přípravek CLOZARIL). Při rozhodování o opětovném přijetí pacienta může být užitečná hematologická konzultace. Obecně však pacientům, u kterých se rozvine závažná neutropenie, znovu nepodávejte přípravek CLOZARIL nebo klozapinový přípravek.
Pokud bude pacient znovu vyvolán, lékař by měl zvážit prahové hodnoty uvedené v tabulkách 2 a 3, pacientovu lékařskou a psychiatrickou anamnézu, diskusi s pacientem a jeho pečovatelem o výhodách a rizicích opětovného podání přípravku CLOZARIL 50 mg a závažnost a charakteristiky neutropenické epizody.
Užívání přípravku CLOZARIL s jinými léky spojenými s neutropenií
Není jasné, zda současné užívání jiných léků, o nichž je známo, že způsobují neutropenii, zvyšuje riziko nebo závažnost neutropenie vyvolané přípravkem CLOZARIL. Neexistuje žádné silné vědecké zdůvodnění, proč se vyhnout léčbě přípravkem CLOZARIL u pacientů současně léčených těmito léky. Pokud se přípravek CLOZARIL 100 mg užívá současně s látkou, o které je známo, že způsobuje neutropenii (např. některá chemoterapeutika), zvažte pozornější sledování pacientů, než jsou pokyny pro léčbu uvedené v tabulkách 2 a 3. U pacientů, kteří dostávají souběžnou chemoterapii, se poraďte s ošetřujícím onkologem.
Program Clozapin REMS
CLOZARIL je k dispozici pouze prostřednictvím omezeného programu v rámci REMS nazývaného Clozapine REMS Program kvůli riziku těžké neutropenie.
Mezi významné požadavky programu Clozapine REMS patří:
- Zdravotničtí pracovníci, kteří předepisují CLOZARIL 25 mg, musí být certifikováni v programu registrací a absolvováním školení
- Pacienti, kteří dostávají CLOZARIL 100 mg, musí být zařazeni do programu a musí splňovat požadavky na testování a monitorování ANC.
- Lékárny vydávající CLOZARIL 50 mg musí být certifikovány programem registrací a absolvováním školení a musí vydávat pouze pacientům, kteří jsou způsobilí dostávat CLOZARIL
Další informace jsou k dispozici na www.clozapinerems.com nebo 1-844-267-8678.
Ortostatická hypotenze, bradykardie a synkopa
Při léčbě klozapinem se objevila hypotenze, bradykardie, synkopa a srdeční zástava. Riziko je nejvyšší během období počáteční titrace, zejména při rychlém zvyšování dávky. Tyto reakce se mohou objevit při první dávce, již při dávkách 12,5 mg. Tyto reakce mohou být fatální. Syndrom je konzistentní s nervově zprostředkovanou reflexní bradykardií (NMRB).
Léčba musí začít maximální dávkou 12,5 mg jednou denně nebo dvakrát denně. Celková denní dávka může být zvýšena o 25 mg až 50 mg denně, pokud je dobře tolerována, na cílovou dávku 300 mg až 450 mg denně (podávanou v rozdělených dávkách) do konce 2 týdnů. Následně může být dávka zvyšována týdně nebo dvakrát týdně v přírůstcích až do 100 mg. Maximální dávka je 900 mg denně. Použijte opatrnou titraci a rozdělené dávkování, abyste minimalizovali riziko závažných kardiovaskulárních reakcí [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Pokud dojde k hypotenzi, zvažte snížení dávky. Při opětovném zahájení léčby u pacientů, kteří měli byť jen krátký interval bez užívání přípravku CLOZARIL (tj. 2 dny nebo více od poslední dávky), znovu zahajte léčbu dávkou 12,5 mg jednou denně nebo dvakrát denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Používejte přípravek CLOZARIL opatrně u pacientů s kardiovaskulárním onemocněním (infarkt myokardu nebo ischemie v anamnéze, srdeční selhání nebo poruchy vedení vzruchu), cerebrovaskulárním onemocněním a stavy, které by mohly pacienty predisponovat k hypotenzi (např. současné užívání antihypertenziv, dehydratace a hypovolémie).
Falls
CLOZARIL 25 mg může způsobit somnolenci, posturální hypotenzi, motorickou a senzorickou nestabilitu, což může vést k pádům a následně ke zlomeninám nebo jiným zraněním. U pacientů s nemocemi, stavy nebo léky, které by mohly tyto účinky zhoršit, dokončete posouzení rizika pádu při zahájení antipsychotické léčby a opakovaně u pacientů na dlouhodobé antipsychotické léčbě.
Záchvaty
Odhaduje se, že záchvaty se vyskytují v souvislosti s užíváním klozapinu s kumulativní incidencí za jeden rok přibližně 5 %, na základě výskytu jednoho nebo více záchvatů u 61 z 1743 pacientů vystavených klozapinu během jeho klinického testování před uvedením na trh na domácím trhu (tj. , hrubá sazba 3,5 %). Riziko záchvatu závisí na dávce. Zahajte léčbu nízkou dávkou (12,5 mg), pomalu titrujte a použijte rozdělené dávkování.
Buďte opatrní při podávání přípravku CLOZARIL 50 mg pacientům s anamnézou záchvatů nebo jiných predisponujících rizikových faktorů pro záchvat (např. poranění hlavy nebo jiná patologie CNS, užívání léků snižujících práh záchvatů nebo abúzus alkoholu). Vzhledem k značnému riziku záchvatu spojenému s užíváním přípravku CLOZARIL varujte pacienty, aby se nezapojovali do jakékoli činnosti, kde by náhlá ztráta vědomí mohla způsobit vážné riziko pro ně nebo pro ostatní (např. řízení automobilu, obsluha složitých strojů, plavání, lezení).
Myokarditida, kardiomyopatie a nekompetence mitrální chlopně
Při užívání přípravku CLOZARIL se objevila myokarditida a kardiomyopatie. Tyto reakce mohou být fatální. Při podezření na myokarditidu nebo kardiomyopatii přerušte léčbu přípravkem CLOZARIL 25 mg a nechte si vyšetřit srdce. Obecně platí, že pacientům s anamnézou myokarditidy nebo kardiomyopatie související s klozapinem by neměl být přípravek CLOZARIL znovu podáván. Pokud se však usoudí, že přínos léčby přípravkem CLOZARIL 25 mg převáží potenciální rizika rekurentní myokarditidy nebo kardiomyopatie, může lékař po konzultaci s kardiologem, po kompletním kardiologickém vyšetření a za pečlivého sledování zvážit opětovné nasazení přípravku CLOZARIL.
Zvažte možnost myokarditidy nebo kardiomyopatie u pacientů užívajících přípravek CLOZARIL, kteří mají bolest na hrudi, dušnost, přetrvávající klidovou tachykardii, bušení srdce, horečku, příznaky podobné chřipce, hypotenzi, jiné známky nebo příznaky srdečního selhání nebo elektrokardiografické nálezy (nízké napětí, abnormality ST-T, arytmie, odchylka pravé osy a špatná progrese R vlny). Myokarditida se nejčastěji projevuje během prvních 2 měsíců léčby klozapinem. Příznaky kardiomyopatie se obecně objevují později než myokarditida spojená s klozapinem a obvykle po 8 týdnech léčby. Myokarditida a kardiomyopatie se však mohou objevit kdykoli během léčby přípravkem CLOZARIL. Je běžné, že nespecifické příznaky podobné chřipce, jako je malátnost, myalgie, pleurická bolest na hrudi a nízké horečky, předcházejí zjevnějším známkám srdečního selhání. Mezi typické laboratorní nálezy patří zvýšený troponin I nebo T, zvýšená kreatininkináza-MB, periferní eozinofilie a zvýšený C-reaktivní protein (CRP). Rentgenogram hrudníku může prokázat zvětšení siluety srdce a zobrazení srdce (echokardiogram, radionukleotidové studie nebo srdeční katetrizace) může odhalit známky dysfunkce levé komory. U pacientů, u kterých byla během užívání přípravku CLOZARIL 50 mg diagnostikována kardiomyopatie, byla hlášena nekompetence mitrální chlopně. Tyto případy hlásily buď mírnou nebo střední mitrální regurgitaci na dvourozměrné echokardiografii. U pacientů s podezřením na kardiomyopatii zvažte 2D-echo dopplerovské vyšetření k identifikaci inkompetence mitrální chlopně.
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí
starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. Analýzy 17 placebem kontrolovaných studií (modální trvání 10 týdnů), převážně u pacientů užívajících atypická antipsychotika, odhalily riziko úmrtí u pacientů léčených drogami 1,6 až 1,7krát vyšší než riziko úmrtí u pacientů léčených placebem. V průběhu typické 10týdenní kontrolované studie byla míra úmrtí u pacientů léčených léky asi 4,5 % ve srovnání s mírou asi 2,6 % ve skupině s placebem. Ačkoli byly příčiny úmrtí různé, většina úmrtí se zdála být kardiovaskulárního (např. srdeční selhání, náhlá smrt) nebo infekční (např. zápal plic). Observační studie naznačují, že podobně jako u atypických antipsychotik může léčba konvenčními antipsychotiky u této populace zvýšit mortalitu. Není jasné, do jaké míry lze zjištění zvýšené úmrtnosti v observačních studiích přičíst antipsychotickému léku na rozdíl od některých charakteristik pacientů. CLOZARIL není schválen pro léčbu pacientů s psychózou související s demencí [viz VAROVÁNÍ V KRABICE ].
Gastrointestinální hypomotilita se závažnými komplikacemi
Při užívání přípravku CLOZARIL se objevily závažné gastrointestinální nežádoucí účinky, především kvůli jeho silným anticholinergním účinkům a následné gastrointestinální hypomotilitě. V postmarketingových zkušenostech se hlášené účinky pohybují od zácpy po paralytický ileus. Zvýšená frekvence zácpy a opožděná diagnostika a léčba zvyšovaly riziko závažných komplikací gastrointestinální hypomotility, vedoucích ke střevní obstrukci, fekální impakci, megakolonu a střevní ischemii nebo infarktu (viz NEŽÁDOUCÍ REAKCE ]. Tyto reakce vedly k hospitalizaci, operaci a smrti. Riziko závažných nežádoucích reakcí se dále zvyšuje s anticholinergními léky (a jinými léky snižujícími gastrointestinální peristaltiku); proto je třeba se současnému užívání pokud možno vyhnout [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Před zahájením léčby přípravkem CLOZARIL 50 mg proveďte screening na zácpu a podle potřeby ošetřete. Subjektivní příznaky zácpy nemusí přesně odrážet stupeň gastrointestinální hypomotility u pacientů léčených přípravkem CLOZARIL. Proto často přehodnocujte funkci střev a pečlivě sledujte jakékoli změny ve frekvenci nebo charakteru pohybů střev, stejně jako známky a příznaky komplikací hypomotility (např. nauzea, zvracení, abdominální distenze, bolest břicha). Pokud je zjištěna zácpa nebo gastrointestinální hypomotilita, pozorně sledujte a podle potřeby okamžitě ošetřete vhodnými laxativy, abyste předešli závažným komplikacím. U vysoce rizikových pacientů zvažte profylaktická laxativa.
Eozinofilie
Při léčbě přípravkem CLOZARIL 100 mg se objevila eozinofilie, definovaná jako počet eozinofilů v krvi vyšší než 700/μl. V klinických studiích se přibližně u 1 % pacientů rozvinula eozinofilie. Eozinofilie související s klozapinem se obvykle vyskytuje během prvního měsíce léčby. U některých pacientů byla spojena s myokarditidou, pankreatitidou, hepatitidou, kolitidou a nefritidou. Takové postižení orgánů by mohlo být v souladu s lékovou reakcí s eozinofilií a syndromem systémových příznaků (DRESS), také známým jako syndrom přecitlivělosti vyvolaný léky (DIHS). Pokud se během léčby přípravkem CLOZARIL rozvine eozinofilie, okamžitě vyhodnoťte známky a příznaky systémových reakcí, jako je vyrážka nebo jiné alergické příznaky, myokarditida nebo jiné orgánově specifické onemocnění spojené s eozinofilií. Pokud je podezření na systémové onemocnění související s přípravkem CLOZARIL, okamžitě vysaďte přípravek CLOZARIL 50 mg.
Pokud je identifikována příčina eozinofilie nesouvisející s přípravkem CLOZARIL 50 mg (např. astma, alergie, kolagenové vaskulární onemocnění, parazitární infekce a specifické novotvary), léčte základní příčinu a pokračujte v užívání přípravku CLOZARIL.
Eozinofilie související s klozapinem se také objevila bez postižení orgánů a může se vyřešit bez zásahu. Existují zprávy o úspěšném opětovném zahájení léčby po vysazení klozapinu bez recidivy eozinofilie. Při absenci postižení orgánů pokračujte v podávání CLOZARIL za pečlivého sledování. Pokud se celkový počet eozinofilů i nadále zvyšuje během několika týdnů bez přítomnosti systémového onemocnění, rozhodnutí o přerušení léčby přípravkem CLOZARIL 25 mg a opětovném nasazení po poklesu počtu eozinofilů by mělo být založeno na celkovém klinickém posouzení po konzultaci s internistou nebo hematologem.
Prodloužení QT intervalu
Při léčbě přípravkem CLOZARIL 100 mg došlo k prodloužení QT intervalu, Torsade de Pointes a dalším život ohrožujícím ventrikulárním arytmiím, srdeční zástavě a náhlé smrti. Při předepisování přípravku CLOZARIL zvažte přítomnost dalších rizikových faktorů pro prodloužení QT intervalu a závažné kardiovaskulární reakce. Mezi stavy, které zvyšují tato rizika, patří: anamnéza prodloužení QT intervalu, syndrom dlouhého QT intervalu, rodinná anamnéza syndromu dlouhého QT intervalu nebo náhlé srdeční smrti, významná srdeční arytmie, nedávný infarkt myokardu, nekompenzované srdeční selhání, léčba jinými léky, které způsobují prodloužení QT intervalu, léčba léky, které inhibují metabolismus klozapinu, a elektrolytové abnormality.
Před zahájením léčby přípravkem CLOZARIL 25 mg proveďte pečlivé fyzikální vyšetření, anamnézu a anamnézu souběžných léků. Zvažte získání základního EKG a panelu chemie séra. Opravte abnormality elektrolytů. Přerušte léčbu přípravkem CLOZARIL 25 mg, pokud interval QTc překročí 500 ms. Pokud se u pacientů objeví příznaky odpovídající Torsades de Pointes nebo jiné arytmie (např. synkopa, presynkopa, závratě nebo palpitace), nechte si vyšetřit srdce a přerušte léčbu přípravkem CLOZARIL.
Buďte opatrní při současném podávání léků, které prodlužují QT interval nebo inhibují metabolismus přípravku CLOZARIL. Mezi léky, které způsobují prodloužení QT intervalu, patří: specifická antipsychotika (např. ziprasidon, iloperidon, chlorpromazin, thioridazin, mesoridazin, droperidol, pimozid), specifická antibiotika (např. erythromycin, gatifloxacin, moxifloxacin, sparfloxacin, antiarytmika třídy 1A, antiarytmika 1A prokainamid) nebo antiarytmika třídy III (např. amiodaron, sotalol) a další (např. pentamidin, levomethadylacetát, metadon, halofantrin, meflochin, dolasetron mesylát, probukol nebo takrolimus). Klozapin je primárně metabolizován izoenzymy CYP 1A2, 2D6 a 3A4. Současná léčba inhibitory těchto enzymů může zvýšit koncentraci přípravku CLOZARIL (viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Hypokalémie a hypomagnezémie zvyšují riziko prodloužení QT intervalu. Hypokalémie může být důsledkem diuretické terapie, průjmu a dalších příčin. Buďte opatrní při léčbě pacientů s rizikem významné poruchy elektrolytů, zejména hypokalémie. Získejte základní měření sérových hladin draslíku a hořčíku a pravidelně sledujte elektrolyty. Před zahájením léčby přípravkem CLOZARIL upravte abnormality elektrolytů.
Metabolické změny
Atypická antipsychotika, včetně přípravku CLOZARIL 50 mg, byla spojována s metabolickými změnami, které mohou zvýšit kardiovaskulární a cerebrovaskulární riziko. Tyto metabolické změny zahrnují hyperglykémii, dyslipidémii a nárůst tělesné hmotnosti. Zatímco atypická antipsychotika mohou vyvolat určité metabolické změny, každý lék ve třídě má svůj vlastní specifický rizikový profil.
Hyperglykémie A Diabetes Mellitus
Hyperglykémie, v některých případech extrémní a spojená s ketoacidózou nebo hyperosmolárním kómatem nebo smrtí, byla hlášena u pacientů léčených atypickými antipsychotiky včetně přípravku CLOZARIL. Posouzení vztahu mezi atypickým užíváním antipsychotik a glukózovými abnormalitami je komplikováno možností zvýšeného základního rizika diabetes mellitus u pacientů se schizofrenií a zvyšujícím se výskytem diabetes mellitus v běžné populaci. Vzhledem k těmto matoucím faktorům není vztah mezi atypickým užíváním antipsychotik a nežádoucími účinky souvisejícími s hyperglykémií zcela objasněn. Epidemiologické studie však naznačují zvýšené riziko nežádoucích účinků souvisejících s léčbou a hyperglykémie u pacientů léčených atypickými antipsychotiky. Přesné odhady rizik nežádoucích reakcí souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky nejsou k dispozici.
Pacienti s prokázanou diagnózou diabetes mellitus, u kterých je zahájena léčba přípravkem CLOZARIL 100 mg, by měli být pravidelně sledováni, zda nedochází ke zhoršení glukózové kontroly. Pacienti s rizikovými faktory pro diabetes mellitus (např. obezita, rodinná anamnéza diabetu), kteří zahajují léčbu atypickými antipsychotiky, by měli podstoupit vyšetření glykémie nalačno na začátku léčby a pravidelně během léčby. U každého pacienta léčeného atypickými antipsychotiky je třeba sledovat příznaky hyperglykémie včetně polydipsie, polyurie, polyfagie a slabosti. Pacienti, u kterých se během léčby atypickými antipsychotiky objeví příznaky hyperglykémie, by měli podstoupit vyšetření glykémie nalačno. V některých případech hyperglykémie ustoupila po vysazení atypického antipsychotika; někteří pacienti však vyžadovali pokračování v antidiabetické léčbě i přes vysazení podezřelého léku.
analýze souhrnných dat 8 studií u dospělých pacientů se schizofrenií byly průměrné změny v koncentraci glukózy nalačno ve skupině užívající CLOZARIL 50 mg a chlorpromazinu +11 mg/dl a +4 mg/dl. Vyšší podíl ve skupině užívající CLOZARIL prokázal kategorický nárůst koncentrací glukózy nalačno oproti výchozí hodnotě ve srovnání se skupinou s chlorpromazinem (tabulka 4). Dávky přípravku CLOZARIL 25 mg byly 100 – 900 mg denně (průměrná modální dávka: 512 mg denně). Maximální dávka chlorpromazinu byla 1800 mg denně (průměrná modální dávka: 1029 mg denně). Medián trvání expozice byl 42 dní pro CLOZARIL a chlorpromazin.
Dyslipidémie
U pacientů léčených atypickými antipsychotiky, včetně přípravku CLOZARIL, se vyskytly nežádoucí změny lipidů. U pacientů užívajících přípravek CLOZARIL se doporučuje klinické monitorování, včetně výchozího a pravidelného následného hodnocení lipidů.
analýze souhrnných údajů z 10 studií u dospělých pacientů se schizofrenií byla léčba přípravkem CLOZARIL spojena se zvýšením celkového cholesterolu v séru. Nebyla shromážděna žádná data o LDL a HDL cholesterolu. Průměrné zvýšení celkového cholesterolu bylo 13 mg/dl ve skupině léčené přípravkem CLOZARIL 25 mg a 15 mg/dl ve skupině s chlorpromazinem. V analýze souhrnných údajů ze 2 studií u dospělých pacientů se schizofrenií byla léčba přípravkem CLOZARIL 50 mg spojena se zvýšením sérových triglyceridů nalačno. Průměrné zvýšení triglyceridů nalačno bylo 71 mg/dl (54 %) ve skupině CLOZARIL 100 mg a 39 mg/dl (35 %) ve skupině chlorpromazinu (tabulka 5). Kromě toho byla léčba přípravkem CLOZARIL spojena s kategorickým zvýšením celkového cholesterolu a triglyceridů v séru, jak ukazuje tabulka 6. Podíl pacientů s kategorickým zvýšením celkového cholesterolu nebo triglyceridů nalačno se zvyšoval s délkou expozice. Medián trvání expozice přípravku CLOZARIL 50 mg a chlorpromazinu byl 45 dní, respektive 38 dní. Rozsah dávek přípravku CLOZARIL byl 100 mg až 900 mg denně; maximální dávka chlorpromazinu byla 1800 mg denně.
Přibývání na váze
Při užívání antipsychotik, včetně přípravku CLOZARIL, došlo k nárůstu tělesné hmotnosti. Během léčby přípravkem CLOZARIL sledujte hmotnost. Tabulka 7 shrnuje údaje o přírůstku hmotnosti podle doby trvání expozice shromážděné z 11 studií s přípravkem CLOZARIL a aktivními komparátory. Medián trvání expozice byl 609, 728 a 42 dní ve skupině s přípravkem CLOZARIL 25 mg, olanzapinem a chlorpromazinem, v daném pořadí.
Tabulka 8 shrnuje souhrnná data z 11 studií u dospělých pacientů se schizofrenií, které prokázaly nárůst tělesné hmotnosti ≥ 7 % tělesné hmotnosti ve srovnání s výchozí hodnotou. Medián trvání expozice byl 609, 728 a 42 dní ve skupině s přípravkem CLOZARIL, olanzapinem a chlorpromazinem.
Neuroleptický maligní syndrom
Antipsychotika včetně přípravku CLOZARIL 50 mg mohou způsobit potenciálně fatální komplex symptomů označovaný jako neuroleptický maligní syndrom (NMS). Mezi klinické projevy NMS patří hyperpyrexie, svalová rigidita, změněný duševní stav a autonomní nestabilita (nepravidelný puls nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie). Přidružené nálezy mohou zahrnovat zvýšenou kreatinfosfokinázu (CPK), myoglobinurii, rhabdomyolýzu a akutní renální selhání.
Diagnostické hodnocení pacientů s tímto syndromem je složité. Je důležité vzít v úvahu přítomnost dalších závažných zdravotních stavů (např. těžká neutropenie, infekce, úpal, primární patologie CNS, centrální anticholinergní toxicita, extrapyramidové symptomy a horečka po drogách).
Léčba NMS by měla zahrnovat (1) okamžité vysazení antipsychotických léků a jiných léků, které nejsou nezbytné pro souběžnou léčbu, (2) intenzivní symptomatickou léčbu a lékařské sledování a (3) léčbu komorbidních onemocnění. Neexistuje obecná shoda ohledně specifické farmakologické léčby NMS.
Vyžaduje-li pacient po zotavení z NMS léčbu antipsychotickými léky, je třeba pečlivě zvážit případné znovuzavedení lékové terapie. NMS se může opakovat. Při opětovném zahájení léčby antipsychotiky pečlivě sledujte.
NMS se vyskytla při monoterapii přípravkem CLOZARIL a souběžně s léky působícími na CNS, včetně lithia.
Hepatotoxicita
V postmarketingových studiích u pacientů léčených klozapinem byla hlášena těžká, život ohrožující a v některých případech fatální hepatotoxicita včetně jaterního selhání, jaterní nekrózy a hepatitidy (viz NEŽÁDOUCÍ REAKCE ]. Sledujte výskyt známek a příznaků hepatotoxicity, jako je únava, malátnost, anorexie, nauzea, žloutenka, bilirubinémie, koagulopatie a jaterní encefalopatie. Proveďte sérové testy na poškození jater a zvažte trvalé ukončení léčby, pokud je hepatitida nebo zvýšení transamináz v kombinaci s dalšími systémovými příznaky způsobeno klozapinem.
Horečka
Během léčby klozapinem se u pacientů vyskytla přechodná horečka související s klozapinem. Vrchol výskytu je během prvních 3 týdnů léčby. I když je tato horečka obecně benigní a sama odezní, může si vyžádat přerušení léčby. Horečka může být spojena se zvýšením nebo snížením počtu bílých krvinek. Pečlivě vyhodnoťte pacienty s horečkou, abyste vyloučili závažnou neutropenii nebo infekci. Zvažte možnost NMS [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Plicní embolie
pacientů léčených přípravkem CLOZARIL se vyskytla plicní embolie a hluboká žilní trombóza. Zvažte možnost plicní embolie u pacientů s hlubokou žilní trombózou, akutní dušností, bolestí na hrudi nebo s jinými respiračními příznaky a symptomy. Zda lze plicní embolii a hlubokou žilní trombózu připsat klozapinu nebo některým charakteristikám pacientů, není jasné.
Anticholinergní toxicita
CLOZARIL 50 mg má silné anticholinergní účinky. Léčba přípravkem CLOZARIL může vést k CNS a periferní anticholinergní toxicitě, zejména při vyšších dávkách nebo v situacích předávkování (viz PŘEDÁVKOVÁNÍ ]. Používejte opatrně u pacientů se současnou diagnózou nebo předchozí anamnézou zácpy, retence moči, klinicky významné hypertrofie prostaty nebo jiných stavů, u kterých mohou anticholinergní účinky vést k významným nežádoucím reakcím. Pokud je to možné, vyhněte se současnému užívání s jinými anticholinergními léky, protože se zvyšuje riziko anticholinergní toxicity nebo závažných gastrointestinálních nežádoucích účinků (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Zásah do kognitivního a motorického výkonu
CLOZARIL může způsobit sedaci a zhoršení kognitivní a motorické výkonnosti. Varujte pacienty před obsluhou nebezpečných strojů, včetně automobilů, dokud si nebudou přiměřeně jisti, že na ně CLOZARIL nepříznivě nepůsobí. Tyto reakce mohou souviset s dávkou. Pokud se vyskytnou, zvažte snížení dávky.
Tardivní dyskineze
Tardivní dyskineze (TD) se objevila u pacientů léčených antipsychotiky, včetně přípravku CLOZARIL. Syndrom se skládá z potenciálně ireverzibilních, mimovolních, dyskinetických pohybů. Předpokládá se, že riziko TD a pravděpodobnost, že se stane nevratným, se zvyšuje s delší dobou léčby a vyššími celkovými kumulativními dávkami. Syndrom se však může vyvinout po relativně krátkých obdobích léčby nízkými dávkami. Předepisujte CLOZARIL způsobem, který s největší pravděpodobností minimalizuje riziko rozvoje TD. Použijte nejnižší účinnou dávku a nejkratší dobu nutnou ke kontrole příznaků. Pravidelně vyhodnocujte potřebu pokračování v léčbě. Zvažte přerušení léčby, pokud se objeví TD. Někteří pacienti však mohou vyžadovat léčbu přípravkem CLOZARIL 100 mg i přes přítomnost syndromu.
Není známa žádná léčba TD. Pokud se však léčba přeruší, syndrom může částečně nebo úplně ustoupit. Antipsychotická léčba sama o sobě může potlačit (nebo částečně potlačit) příznaky a symptomy a má potenciál maskovat základní proces. Vliv potlačení symptomů na dlouhodobý průběh TD není znám.
Cerebrovaskulární nežádoucí účinky
V kontrolovaných studiích měli starší pacienti s psychózou související s demencí léčení některými atypickými antipsychotiky zvýšené riziko (ve srovnání s placebem) cerebrovaskulárních nežádoucích účinků (např. mrtvice, tranzitorní ischemické ataky), včetně úmrtí. Mechanismus tohoto zvýšeného rizika není znám. U přípravku CLOZARIL nebo jiných antipsychotik nebo jiných populací pacientů nelze vyloučit zvýšené riziko. CLOZARIL 50 mg by měl být používán s opatrností u pacientů s rizikovými faktory pro cerebrovaskulární nežádoucí účinky.
Recidiva psychózy a cholinergní návrat po náhlém vysazení přípravku CLOZARIL
Pokud je nutné náhlé vysazení přípravku CLOZARIL (například kvůli těžké neutropenii nebo jinému zdravotnímu stavu) (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], pečlivě sledujte, zda se znovu neobjeví psychotické symptomy a nežádoucí reakce související s cholinergním rebound fenoménem, jako je silné pocení, bolest hlavy, nauzea, zvracení a průjem.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
V dlouhodobých studiích na myších a potkanech při dávkách až 0,3násobku a 0,4násobku maximální doporučené dávky pro člověka (MRHD) 900 mg/den na základě tělesného povrchu v mg/m² nebyl prokázán žádný karcinogenní potenciál.
Mutageneze
Klozapin nebyl genotoxický, když byl testován v následujících testech genových mutací a chromozomálních aberací: bakteriální Amesův test, in vitro savčí V79 v buňkách čínského křečka, in vitro neplánovaná syntéza DNA v potkaních hepatocytech nebo in vivo mikronukleární test u myší.
Zhoršení Plodnosti
Klozapin neměl žádný účinek na žádné parametry fertility, březosti, hmotnosti plodu nebo postnatálního vývoje, když byl podáván perorálně samcům potkanů 70 dní před pářením a samicím potkanů po dobu 14 dní před pářením v dávkách až 0,4násobku MRHD 900 mg/den na na bázi mg/m² tělesného povrchu.
Použití u konkrétních populací
Těhotenství
Těhotenství kategorie B
Shrnutí rizik
Neexistují žádné adekvátní nebo dobře kontrolované studie klozapinu u těhotných žen.
Reprodukční studie byly provedeny na potkanech a králících v dávkách až 0,4 a 0,9 násobku maximální doporučené dávky pro člověka (MRHD) 900 mg/den na základě mg/m² tělesného povrchu. Studie neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku klozapinu. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, měl by být přípravek CLOZARIL během těhotenství podáván pouze v případě, že je to jednoznačně nutné.
Klinické úvahy
Zvažte riziko exacerbace psychózy při přerušení nebo změně léčby antipsychotiky během těhotenství a po porodu. Zvažte časný screening gestačního diabetu u pacientek léčených antipsychotiky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Novorozenci vystavení antipsychotikům během třetího trimestru těhotenství jsou vystaveni riziku extrapyramidových a/nebo abstinenčních příznaků po porodu. Sledujte novorozence na příznaky agitovanosti, hypertonie, hypotonie, třesu, ospalosti, respiračních potíží a potíží s krmením. Závažnost komplikací se může lišit od příznaků, které se sami omezí, až po některé novorozence vyžadující podporu na jednotce intenzivní péče a prodlouženou hospitalizaci.
Údaje o zvířatech
Ve studiích embryofetálního vývoje neměl klozapin žádné účinky na mateřské parametry, velikost vrhu nebo parametry plodu, když byl perorálně podáván březím potkanům a králíkům během období organogeneze v dávkách až 0,4 a 0,9násobku MRHD 900 mg/den na bázi mg/m² tělesného povrchu.
V peri/postnatálních vývojových studiích byl březím samicím potkanů podáván klozapin během poslední třetiny březosti a až do 21. dne po porodu. Pozorování byla provedena na plodech při narození a během postnatálního období; potomkům bylo umožněno dosáhnout pohlavní dospělosti a spářilo se. Klozapin způsobil snížení tělesné hmotnosti matky, ale neměl žádný vliv na velikost vrhu nebo tělesnou hmotnost generací F1 nebo F2 v dávkách až 0,4násobku MRHD 900 mg/den na základě tělesného povrchu v mg/m².
Kojící matky
CLOZARIL 50 mg je přítomen v mateřském mléce. Vzhledem k potenciálu závažných nežádoucích účinků přípravku CLOZARIL u kojených dětí je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
V klinických studiích s použitím přípravku CLOZARIL 50 mg nebyl dostatečný počet geriatrických pacientů, aby bylo možné určit, zda se pacienti starší 65 let liší od mladších subjektů v odpovědi na přípravek CLOZARIL.
Při léčbě přípravkem CLOZARIL 50 mg se může objevit ortostatická hypotenze a tachykardie (viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. K těmto účinkům mohou být náchylnější starší pacienti, zejména pacienti s narušeným kardiovaskulárním fungováním.
Starší pacienti mohou být zvláště citliví na anticholinergní účinky přípravku CLOZARIL, jako je retence moči a zácpa (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pečlivě vybírejte dávky přípravku CLOZARIL 50 mg u starších pacientů s ohledem na jejich vyšší frekvenci snížené funkce jater, ledvin nebo srdce, jakož i na další doprovodná onemocnění a další lékovou terapii. Klinické zkušenosti naznačují, že prevalence tardivní dyskineze se zdá být nejvyšší u starších osob; zejména starší ženy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pacienti s poruchou ledvin nebo jater
U pacientů s významnou poruchou funkce ledvin nebo jater může být nutné snížit dávku. Koncentrace klozapinu mohou být u těchto pacientů zvýšeny, protože klozapin je téměř úplně metabolizován a poté vylučován [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Špatní metabolizátoři CYP2D6
U pacientů, kteří jsou pomalými metabolizátory CYP2D6, může být nutné snížení dávky. Koncentrace klozapinu mohou být u těchto pacientů zvýšeny, protože klozapin je téměř úplně metabolizován a poté vylučován [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Pacienti v hospici
pacientů v hospici (tj. nevyléčitelně nemocných pacientů s předpokládanou délkou života šest měsíců nebo méně) může předepisující lékař po diskusi s pacientem a jeho pečovatelem snížit frekvenci monitorování ANC na jednou za 6 měsíců. Individuální rozhodnutí o léčbě by měla zvážit důležitost monitorování ANC v kontextu potřeby kontroly psychiatrických symptomů a terminálního onemocnění pacienta.
PŘEDÁVKOVAT
Zkušenosti s předávkováním
Nejčastěji hlášené známky a příznaky spojené s předávkováním klozapinem jsou: sedace, delirium, kóma, tachykardie, hypotenze, respirační deprese nebo selhání; a hypersalivace. Existují zprávy o aspirační pneumonii, srdečních arytmiích a záchvatech. Bylo hlášeno smrtelné předávkování klozapinem, obvykle v dávkách nad 2500 mg. Byly také hlášeny případy, kdy se pacienti zotavili z předávkování nad 4 g.
Řízení Předávkování
Neexistuje žádné dostupné specifické antidotum na předávkování přípravkem CLOZARIL. Vytvořte a udržujte dýchací cesty; zajistit dostatečné okysličení a ventilaci. Sledujte srdeční stav a životní funkce. Použijte obecná symptomatická a podpůrná opatření. Zvažte možnost zapojení více drog.
Kontaktujte Certified Poison Control Center pro nejaktuálnější informace o řešení předávkování (1-800Â222-1222).
KONTRAINDIKACE
CLOZARIL je kontraindikován u pacientů s anamnézou závažné přecitlivělosti na klozapin (např. fotosenzitivita, vaskulitida, erythema multiforme nebo Stevens-Johnsonův syndrom) nebo na kteroukoli jinou složku CLOZARIL (viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku klozapinu není znám. Bylo však navrženo, že terapeutická účinnost klozapinu u schizofrenie je zprostředkována antagonismem receptorů dopaminu typu 2 (D2) a serotoninu typu 2A (5ÂHT2A). CLOZARIL také působí jako antagonista adrenergních, cholinergních, histaminergních a dalších dopaminergních a serotonergních receptorů.
Farmakodynamika
Klozapin prokázal vazebnou afinitu k následujícím receptorům: histamin H1 (Ki 1,1 nM), adrenergní α1A (Ki 1,6 nM), serotonin 5-HT6 (Ki 4 nM), serotonin 5-HT2A (Ki 5,4 nM), muskarinový 6 M1. nM), serotonin 5-HT7 (Ki 6,3 nM), serotonin 5-HT2C (Ki 9,4 nM), dopamin D4 (Ki 24 nM), adrenergní a2A (Ki 90 nM), serotonin 5-HT3 (Ki 95 nM), 5-HT1A (Ki 120 nM), dopamin D2 (Ki 160 nM), dopamin Dl (Ki 270 nM), dopamin D5 (Ki 454 nM) a dopamin D3 (Ki 555 nM).
Klozapin způsobuje malé nebo žádné zvýšení prolaktinu.
Klinické studie elektroencefalogramu (EEG) prokázaly, že klozapin zvyšuje aktivitu delta a theta a zpomaluje dominantní alfa frekvence. Dojde k rozšířené synchronizaci. Může se také vyvinout aktivita ostrých vln a komplexy hrotů a vln. Pacienti hlásili zesílení snové aktivity během terapie klozapinem. Bylo zjištěno, že REM spánek se zvýšil na 85 % celkové doby spánku. U těchto pacientů došlo k nástupu REM spánku téměř okamžitě po usnutí.
Farmakokinetika
Vstřebávání
lidí jsou tablety CLOZARIL (25 mg a 100 mg) stejně biologicky dostupné ve srovnání s roztokem CLOZARIL. Po perorálním podání přípravku CLOZARIL 100 mg dvakrát denně byla průměrná vrcholová plazmatická koncentrace v ustáleném stavu 319 ng/ml (rozmezí: 102 až 771 ng/ml), k níž došlo v průměru za 2,5 hodiny (rozmezí: 1 až 6 hodin) po dávkování. Průměrná minimální koncentrace v ustáleném stavu byla 122 ng/ml (rozmezí: 41 až 343 ng/ml) po dávkování 100 mg dvakrát denně. Nezdá se, že by jídlo ovlivnilo systémovou biologickou dostupnost přípravku CLOZARIL. Přípravek CLOZARIL 50 mg lze tedy podávat s jídlem nebo bez jídla.
Rozdělení
Klozapin se přibližně z 97 % váže na sérové proteiny. Interakce mezi klozapinem a jinými léky vysoce vázanými na proteiny nebyla plně hodnocena, ale může být důležitá [viz DROGOVÉ INTERAKCE ].
Metabolismus A Vylučování
Klozapin je před vylučováním téměř úplně metabolizován a v moči a stolici jsou detekována pouze stopová množství nezměněného léku. Klozapin je substrátem mnoha izoenzymů cytochromu P450, zejména CYP1A2, CYP2D6 a CYP3A4. Přibližně 50 % podané dávky se vyloučí močí a 30 % stolicí. Demethylované, hydroxylované a N-oxidové deriváty jsou složkami jak v moči, tak ve stolici. Farmakologické testování ukázalo, že desmethylový metabolit (norklozapin) má pouze omezenou aktivitu, zatímco hydroxylované a N-oxidové deriváty byly neaktivní. Průměrný poločas eliminace klozapinu po jednorázové dávce 75 mg byl 8 hodin (rozmezí: 4 až 12 hodin), ve srovnání s průměrným poločasem eliminace 12 hodin (rozmezí: 4 až 66 hodin) po dosažení rovnovážného stavu s dávkováním 100 mg dvakrát denně.
Srovnání jednorázového a vícedávkového podání klozapinu prokázalo, že poločas eliminace se významně zvýšil po opakovaném podání ve srovnání s poločasem po podání jednorázové dávky, což naznačuje možnost farmakokinetiky závislé na koncentraci. V ustáleném stavu však byly po podávání 37,5, 75 a 150 mg dvakrát denně pozorovány změny přibližně úměrné dávce, pokud jde o AUC (plochu pod křivkou), maximální a minimální plazmatické koncentrace klozapinu.
Studie lékových interakcí
Fluvoxamin
Farmakokinetická studie byla provedena u 16 schizofrenních pacientů, kteří dostávali klozapin za podmínek ustáleného stavu. Po společném podávání fluvoxaminu po dobu 14 dnů byly průměrné minimální koncentrace klozapinu a jeho metabolitů, N-desmethylklozapinu a klozapin N-oxidu, zvýšeny asi trojnásobně ve srovnání s výchozími koncentracemi v ustáleném stavu.
Paroxetin, fluoxetin a sertralin
Ve studii u pacientů se schizofrenií (n=14), kteří dostávali klozapin za podmínek ustáleného stavu, vyvolalo současné podávání paroxetinu pouze malé změny v hladinách klozapinu a jeho metabolitů. Jiné publikované zprávy však popisují mírné zvýšení (méně než dvojnásobné) koncentrace klozapinu a jeho metabolitů, když byl klozapin užíván s paroxetinem, fluoxetinem a sertralinem.
Specifické populační studie
Renální nebo jaterní poškození
Nebyly provedeny žádné specifické farmakokinetické studie, které by zkoumaly účinky poškození ledvin nebo jater na farmakokinetiku klozapinu. Vyšší plazmatické koncentrace klozapinu jsou pravděpodobné u pacientů s významným poškozením ledvin nebo jater při podávání obvyklých dávek.
Špatní metabolizátoři CYP2D6
Podskupina (3 % – 10 %) populace má sníženou aktivitu CYP2D6 (slabí metabolizátoři CYP2D6). U těchto jedinců se mohou při podávání obvyklých dávek vyvinout vyšší plazmatické koncentrace klozapinu, než se očekávalo.
Klinické studie
Schizofrenie odolná vůči léčbě
Účinnost přípravku CLOZARIL 100 mg u schizofrenie rezistentní na léčbu byla stanovena v multicentrické, randomizované, dvojitě zaslepené, aktivně kontrolované (chlorpromazinem) studii u pacientů s DSM-III diagnózou schizofrenie, kteří neměli adekvátní odpověď na alespoň 3 různá antipsychotika ( z alespoň 2 různých chemických tříd) během předchozích 5 let. Antipsychotické testy musely být posouzeny jako adekvátní; dávky antipsychotik musí být ekvivalentní nebo vyšší než 1000 mg chlorpromazinu denně po dobu alespoň 6 týdnů, každá bez významného snížení symptomů. Během předchozích 5 let nesmělo existovat žádné období dobrého fungování. Pacienti museli mít výchozí skóre alespoň 45 na Brief Psychiatric Rating Scale (BPRS) hodnocené zkoušejícím. Na BPRS s 18 položkami 1 znamená nepřítomnost příznaků a 7 znamená závažné příznaky; maximální potenciální celkové skóre BPRS je 126. Na začátku bylo průměrné skóre BPRS 61. Kromě toho pacienti museli mít skóre alespoň 4 u alespoň dvou z následujících čtyř jednotlivých položek BPRS: koncepční dezorganizace, podezřívavost, halucinace chování a neobvyklý myšlenkový obsah. Pacienti museli mít skóre klinického globálního dojmu – stupnice závažnosti alespoň 4 (středně nemocní).
prospektivní úvodní fázi studie všichni pacienti (N=305) zpočátku dostávali jednoduše zaslepenou léčbu haloperidolem (průměrná dávka byla 61 mg denně) po dobu 6 týdnů. Více než 80 % pacientů dokončilo 6týdenní studii. Pacienti s nedostatečnou odpovědí na haloperidol (n=268) byli randomizováni k dvojitě zaslepené léčbě přípravkem CLOZARIL (N=126) nebo chlorpromazinem (N=142). Maximální denní dávka přípravku CLOZARIL byla 900 mg; průměrná denní dávka byla >600 mg. Maximální denní dávka chlorpromazinu byla 1800 mg; průměrná denní dávka byla >1200 mg.
Primárním cílovým parametrem byla odpověď na léčbu, předem definovaná jako snížení skóre BPRS alespoň o 20 % a buď (1) skóre CGI-S
Opakované sebevražedné chování u schizofrenie nebo schizoafektivní poruchy
Účinnost přípravku CLOZARIL při snižování rizika opakovaného sebevražedného chování byla hodnocena v mezinárodní studii prevence sebevražd (InterSePT™, ochranná známka společnosti Novartis Pharmaceuticals Corporation). Jednalo se o prospektivní, randomizované, otevřené, aktivně kontrolované, multicentrické, mezinárodní, paralelní skupinové srovnání přípravku CLOZARIL versus olanzapin (*Zyprexa®, registrovaná ochranná známka společnosti Eli Lilly and Company) u 956 pacientů se schizofrenií nebo schizoafektivní poruchou ( DSM-IV), kteří byli posouzeni jako ohrožení opakovaným sebevražedným chováním. Pouze asi jedna čtvrtina těchto pacientů (27 %) byla považována za rezistentní vůči standardní léčbě antipsychotiky. Aby se pacienti mohli zúčastnit studie, musí splňovat 1 z následujících kritérií:
- Během tří let před výchozím hodnocením se pokusili o sebevraždu.
- Byli hospitalizováni, aby se zabránilo pokusu o sebevraždu během tří let před jejich základním hodnocením.
- Během jednoho týdne před výchozím hodnocením prokázali středně těžké až těžké sebevražedné myšlenky s depresivní složkou.
- Prokázali středně těžké až těžké sebevražedné myšlenky doprovázené příkazovými halucinacemi k sebepoškozování během jednoho týdne před jejich základním hodnocením.
Dávkovací režimy pro každou léčebnou skupinu byly stanoveny jednotlivými zkoušejícími a byly individualizovány podle pacienta. Dávkování bylo flexibilní, s rozsahem dávek 200 – 900 mg/den pro CLOZARIL a 5 – 20 mg/den pro olanzapin. U 956 pacientů, kteří v této studii dostávali CLOZARIL nebo olanzapin, došlo k rozsáhlému užívání souběžných psychofarmak: 84 % s antipsychotiky, 65 % s anxiolytiky, 53 % s antidepresivy a 28 % se stabilizátory nálady. Mezi pacienty ve skupině s olanzapinem bylo signifikantně vyšší užívání souběžných psychotropních léků.
Primárním měřítkem účinnosti byl čas do (1) významného pokusu o sebevraždu, včetně dokončené sebevraždy; (2) hospitalizace z důvodu bezprostředního rizika sebevraždy, včetně zvýšené úrovně dohledu nad sebevraždou u pacientů, kteří již byli hospitalizováni; nebo (3) zhoršení závažnosti sebevražednosti, jak je prokázáno „velkým zhoršením“ nebo „velmi výrazně zhoršením“ od výchozí hodnoty v klinickém globálním dojmu závažnosti suicidality, jak je hodnoceno stupnicí zaslepeného psychiatra (CGI-SS-BP). Rozhodnutí, zda hlášená událost splnila kritérium 1 nebo 2 výše, provedla Rada pro monitorování sebevražd (SMB), skupina odborníků zaslepených k údajům o pacientech.
Do studie bylo randomizováno celkem 980 pacientů a 956 dostávalo studijní medikaci. U 62 procent pacientů byla diagnostikována schizofrenie a u zbytku (38 %) byla diagnostikována schizoafektivní porucha. Pouze asi jedna čtvrtina celkové populace pacientů (27 %) byla na počátku označena jako „rezistentní na léčbu“. Ve studii bylo více mužů než žen (61 % všech pacientů byli muži). Průměrný věk pacientů vstupujících do studie byl 37 let (rozmezí 18 – 69). Většina pacientů byli běloši (71 %), 15 % byli černoši, 1 % byli Asiaté a 13 % bylo klasifikováno jako „jiné“ rasy.
Pacienti léčení přípravkem CLOZARIL 100 mg měli ve srovnání s olanzapinem statisticky významně delší zpoždění v době do recidivy sebevražedného chování. Tento výsledek by měl být interpretován pouze jako důkaz účinnosti přípravku CLOZARIL v oddálení doby do opakujícího se sebevražedného chování, a nikoli jako důkaz vyšší účinnosti přípravku CLOZARIL 50 mg oproti olanzapinu.
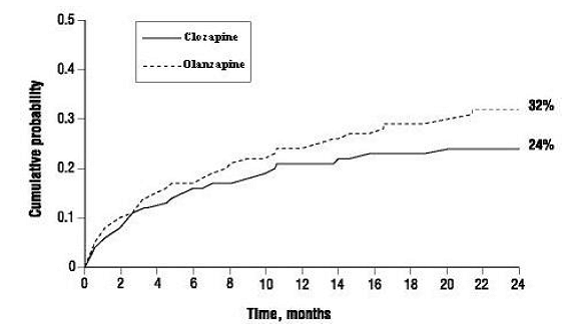
Pravděpodobnost prožití (1) významného pokusu o sebevraždu, včetně dokončené sebevraždy, nebo (2) hospitalizace z důvodu bezprostředního rizika sebevraždy, včetně zvýšené úrovně dohledu nad sebevraždou u pacientů již hospitalizovaných, byla nižší u pacientů s přípravkem CLOZARIL než u pacientů s olanzapinem v 104. týden: CLOZARIL 24 % versus olanzapin 32 %; 95% CI rozdílu: 2%, 14% (obrázek 1).
Obrázek 1: Kumulativní pravděpodobnost významného pokusu o sebevraždu nebo hospitalizace k prevenci sebevraždy u pacientů se schizofrenií nebo schizoafektivní poruchou s vysokým rizikem sebevraždy
INFORMACE PRO PACIENTA
Diskutujte s pacienty a pečovateli o následujících problémech:
- Těžká neutropenie:
- Poučte pacienty (a pečovatele), kteří začínají léčbu přípravkem CLOZARIL, o riziku rozvoje těžké neutropenie a infekce.
- Poučte pacienty, aby okamžitě hlásili svému lékaři jakýkoli příznak nebo známku infekce (např. onemocnění podobné chřipce; horečka; letargie; celková slabost nebo malátnost; ulcerace sliznice; kožní, faryngeální, vaginální, močové nebo plicní infekce; nebo extrémní slabost nebo letargie), ke kterým dojde kdykoli během léčby přípravkem CLOZARIL 100 mg, aby se napomohlo vyhodnocení neutropenie a aby byla zahájena rychlá a vhodná léčba. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Informujte pacienty a pečovatele CLOZARIL 25 mg je dostupný pouze prostřednictvím omezeného programu zvaného Clozapin REMS Program, který je navržen tak, aby zajistil požadované monitorování krve, aby se snížilo riziko rozvoje těžké neutropenie. Informujte pacienty a pečovatele o důležitosti vyšetření krve následovně:
- Prvních 6 měsíců jsou vyžadovány týdenní krevní testy.
- ANC je vyžadováno každé 2 týdny po dobu následujících 6 měsíců, pokud je přijatelný ANC udržován během prvních 6 měsíců nepřetržité léčby,
- Poté je ANC vyžadováno jednou za 4 týdny, pokud je přijatelný ANC udržován během druhých 6 měsíců nepřetržité léčby.
- CLOZARIL 50 mg je dostupný pouze v certifikovaných lékárnách účastnících se programu. Poskytněte pacientům (a pečovatelům) informace o webových stránkách a telefonní číslo, jak produkt získat (www.clozapinerems.com nebo 1-844-267-8678) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Ortostatická hypotenze, bradykardie a synkopa: Informujte pacienty a pečovatele o riziku ortostatické hypotenze a synkopy, zejména během období počáteční titrace dávky. Poučte je, aby přísně dodržovali pokyny lékaře pro dávkování a podávání. Poraďte pacientům, aby se okamžitě obrátili na svého lékaře, pokud se cítí na omdlení, ztratí vědomí nebo mají známky nebo příznaky naznačující bradykardii nebo arytmii (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Záchvaty: Informujte pacienty a pečovatele o významném riziku záchvatů během léčby přípravkem CLOZARIL 100 mg. Upozorněte je na řízení a jakoukoli jinou potenciálně nebezpečnou činnost při užívání přípravku CLOZARIL [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Gastrointestinální hypomotilita se závažnými komplikacemi: Poučte pacienty a pečovatele o rizicích, prevenci a léčbě zácpy vyvolané klozapinem, včetně léků, kterým je třeba se vyhnout, pokud je to možné (např. léky s anticholinergní aktivitou). Podporujte vhodnou hydrataci, fyzickou aktivitu a příjem vlákniny a zdůrazněte, že včasná pozornost a léčba rozvoje zácpy nebo jiných gastrointestinálních příznaků je zásadní pro prevenci závažných komplikací. Poraďte pacientům a pečovatelům, aby kontaktovali svého poskytovatele zdravotní péče, pokud pociťují příznaky zácpy (např. potíže s vyprazdňováním, neúplné vyprazdňování, snížená frekvence vyprazdňování) nebo jiné příznaky spojené s hypomotilitou gastrointestinálního traktu (např. nevolnost, abdominální distenze nebo bolest). zvracení) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- Prodloužení QT intervalu: Doporučte pacientům, aby se okamžitě obrátili na svého lékaře, pokud se cítí na omdlení, ztrácejí vědomí nebo mají známky či příznaky naznačující arytmii. Poučte pacienty, aby neužívali CLOZARIL s jinými léky, které způsobují prodloužení QT intervalu. Poučte pacienty, aby informovali své lékaře, že užívají CLOZARIL 25 mg před jakýmkoli novým lékem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- Metabolické změny (hyperglykémie a diabetes mellitus, dyslipidémie, přírůstek hmotnosti): Poučte pacienty a pečovatele o riziku metabolických změn a nutnosti specifického sledování. Rizika zahrnují hyperglykémii a diabetes mellitus, dyslipidémii, nárůst hmotnosti a kardiovaskulární reakce. Poučte pacienty a pečovatele o symptomech hyperglykémie (vysoká hladina cukru v krvi) a diabetes mellitus (např. polydipsie, polyurie, polyfagie a slabost). Sledujte všechny pacienty s ohledem na tyto příznaky. U pacientů s diagnózou diabetu nebo s rizikovými faktory pro diabetes (obezita, rodinná anamnéza diabetu) by měla být před zahájením léčby a pravidelně během léčby monitorována hladina glukózy v krvi nalačno. Pacienti, u kterých se rozvinou příznaky hyperglykémie, by měli mít vyšetření glukózy nalačno. Doporučuje se klinické sledování hmotnosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Interference s kognitivní a motorickou výkonností: Vzhledem k tomu, že přípravek CLOZARIL může mít potenciál narušit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že je léčba přípravkem CLOZARIL neovlivňuje nepříznivě [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Vynechané dávky a opětovné zahájení léčby: Informujte pacienty a ošetřovatele, že pokud pacient vynechá užívání přípravku CLOZARIL 50 mg po dobu delší než 2 dny, neměl by znovu užívat léčbu ve stejné dávce, ale měl by kontaktovat svého lékaře pro pokyny k dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Těhotenství: Pacientky a ošetřovatelé by měli informovat lékaře, pokud pacientka otěhotní nebo zamýšlí otěhotnět během léčby [viz Použití u konkrétních populací ].
- Ošetřovatelství: Informujte pacienty a pečovatele, že pacient by neměl kojit dítě, pokud užívá CLOZARIL [viz Použití u konkrétních populací ].
- Souběžná medikace: Doporučte pacientům, aby informovali svého poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky; existuje potenciál pro významné lékové interakce [viz DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE ].
