Léčba psychických poruch: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Strattera 40 mg a jak se používá?
Strattera je lék na předpis používaný k léčbě příznaků poruchy pozornosti/hyperaktivity (ADHD). Strattera 18 mg lze užívat samostatně nebo s jinými léky.
Strattera 10 mg je selektivní inhibitor zpětného vychytávání norepinefrinu.
Není známo, zda je přípravek Strattera bezpečný a účinný u dětí mladších 2 let.
Jaké jsou možné vedlejší účinky přípravku Strattera?
Strattera 25 mg může způsobit závažné nežádoucí účinky, včetně:
- bolest na hrudi,
- potíže s dýcháním,
- točení hlavy,
- halucinace,
- nové problémy s chováním,
- agrese,
- nepřátelství,
- paranoia,
- bolest břicha,
- svědění,
- příznaky podobné chřipce,
- tmavá moč,
- žloutenka (zežloutnutí kůže nebo očí),
- bolestivé nebo obtížné močení a
- erekce, která je bolestivá nebo trvá déle než 4 hodiny
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Strattera 40 mg patří:
- nevolnost,
- zvracení,
- žaludeční nevolnost,
- zácpa,
- suchá ústa,
- ztráta chuti k jídlu,
- změny nálady,
- cítit se unaveně,
- závrať,
- problémy s močením a
- impotence, potíže s erekcí,
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Strattera. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
SEBEvražedné myšlenky u dětí a dospívajících
STRATTERA (atomoxetin) zvyšoval riziko sebevražedných myšlenek v krátkodobých studiích u dětí nebo dospívajících s poruchou pozornosti/hyperaktivitou (ADHD). Každý, kdo zvažuje použití přípravku STRATTERA 18 mg u dětí nebo dospívajících, musí toto riziko vyvážit klinickou potřebou. Komorbidity vyskytující se s ADHD mohou být spojeny se zvýšením rizika sebevražedných myšlenek a/nebo chování. Pacienti, u kterých je léčba zahájena, by měli být pečlivě sledováni z hlediska sebevražednosti (sebevražedné myšlení a chování), klinického zhoršení nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. STRATTERA 10 mg je schválen pro léčbu ADHD u pediatrických a dospělých pacientů. STRATTERA 40 mg není schválen pro depresivní poruchu. Souhrnné analýzy krátkodobých (6 až 18 týdnů) placebem kontrolovaných studií přípravku STRATTERA 10 mg u dětí a dospívajících (celkem 12 studií zahrnujících více než 2200 pacientů, včetně 11 studií s ADHD a 1 studie s enurézou) odhalily vyšší riziko sebevražedných myšlenek časně během léčby u pacientů užívajících přípravek STRATTERA ve srovnání s placebem. Průměrné riziko sebevražedných myšlenek u pacientů užívajících přípravek STRATTERA 25 mg bylo 0,4 % (5/1357 pacientů) ve srovnání s žádným u pacientů užívajících placebo (851 pacientů). V těchto studiích nedošlo k žádné sebevraždě [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
POPIS
STRATTERA® (atomoxetin) je selektivní inhibitor zpětného vychytávání norepinefrinu. Atomoxetin HCl je R(-) izomer, jak je určeno rentgenovou difrakcí. Chemické označení je (-)-N-methyl-3-fenyl-3-(o-tolyloxy)-propylamin hydrochlorid. Molekulární vzorec je C17H21NO•HCl, což odpovídá molekulové hmotnosti 291,82. Chemická struktura je:
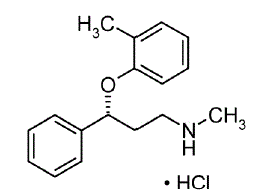
Atomoxetin HCl je bílá až prakticky bílá pevná látka, která má rozpustnost 27,8 mg/ml ve vodě.
Tobolky STRATTERA jsou určeny pouze k perorálnímu podání.
Každá tobolka obsahuje atomoxetin HCl ekvivalentní 10, 18, 25, 40, 60, 80 nebo 100 mg atomoxetinu. Kapsle také obsahují předželatinovaný škrob a dimethikon. Obal kapsle obsahuje želatinu, laurylsulfát sodný a další neaktivní složky. Obaly kapslí také obsahují jednu nebo více z následujících látek:
FD&C Blue č. 2, syntetický žlutý oxid železitý, oxid titaničitý, červený oxid železitý. Tobolky jsou potištěny jedlým černým inkoustem.
INDIKACE
Porucha pozornosti/hyperaktivita (ADHD)
STRATTERA 25 mg je indikován k léčbě poruchy pozornosti/hyperaktivity (ADHD).
Účinnost přípravku STRATTERA Capsules byla stanovena v sedmi klinických studiích u ambulantních pacientů s ADHD: čtyři 6 až 9týdenní studie u pediatrických pacientů (ve věku 6 až 18 let), dvě 10týdenní studie u dospělých a jedna udržovací studie u pediatrů (věk 6 let až 15) [viz Klinické studie ].
Diagnostické aspekty
Diagnóza ADHD (DSM-IV) znamená přítomnost hyperaktivně-impulzivních nebo nepozorných symptomů, které způsobují poškození a které byly přítomny před dosažením věku 7 let. Příznaky musí být trvalé, musí být závažnější, než je typicky pozorováno u jedinců na srovnatelné úrovni vývoje, musí způsobovat klinicky významné poškození, např. v sociálním, akademickém nebo pracovním fungování, a musí se vyskytovat ve 2 nebo více prostředích, např. ve škole (nebo v práci) a doma. Příznaky nesmí být lépe vysvětleny jinou duševní poruchou.
Specifická etiologie ADHD není známa a neexistuje jediný diagnostický test. Adekvátní diagnóza vyžaduje využití nejen lékařských, ale i speciálních psychologických, výchovných a sociálních zdrojů. Učení může a nemusí být narušeno. Diagnóza musí být založena na kompletní anamnéze a vyhodnocení pacienta, nikoli pouze na přítomnosti požadovaného počtu charakteristik DSM-IV.
nepozorného typu musí alespoň 6 z následujících příznaků přetrvávat po dobu alespoň 6 měsíců: nedostatek pozornosti k detailům/chyby z nedbalosti, nedostatek trvalé pozornosti, špatný posluchač, neschopnost plnit úkoly, špatná organizace, vyhýbání se úkolům vyžadující trvalé duševní úsilí, ztrácí věci, snadno se rozptyluje, zapomíná. U hyperaktivního-impulzivního typu musí alespoň 6 z následujících příznaků přetrvávat po dobu alespoň 6 měsíců: vrtění se/kroucení, opouštění sedadla, nevhodné běhání/lezení, potíže s tichými aktivitami, „na cestách“, nadměrné mluvení, mlžení odpovědi, nedočkavost zase, dotěrný. Pro diagnózu kombinovaného typu musí být splněna jak nepozorná, tak hyperaktivně-impulzivní kritéria.
Potřeba komplexního léčebného programu
STRATTERA 18 mg je indikována jako nedílná součást celkového léčebného programu pro ADHD, který může zahrnovat další opatření (psychologická, výchovná, sociální) pro pacienty s tímto syndromem. Medikamentózní léčba nemusí být indikována u všech pacientů s tímto syndromem. Léčba drogami není určena pro použití u pacienta, který vykazuje symptomy sekundární k faktorům prostředí a/nebo jiným primárním psychiatrickým poruchám, včetně psychózy. U dětí a dospívajících s touto diagnózou je nezbytné vhodné umístění do vzdělání a často je užitečná psychosociální intervence. Pokud samotná nápravná opatření nepostačují, bude rozhodnutí předepsat medikamentózní léčbu záviset na posouzení chronicity a závažnosti symptomů pacienta lékařem.
DÁVKOVÁNÍ A PODÁVÁNÍ
Akutní léčba
Dávkování u dětí a dospívajících do 70 kg tělesné hmotnosti
STRATTERA 40 mg by měla být zahájena celkovou denní dávkou přibližně 0,5 mg/kg a po minimálně 3 dnech by měla být zvýšena na cílovou celkovou denní dávku přibližně 1,2 mg/kg podávanou buď jako jedna denní dávka ráno, nebo jako rovnoměrně rozdělená dávky ráno a pozdě odpoledne/podvečer. Pro dávky vyšší než 1,2 mg/kg/den nebyl prokázán žádný další přínos [viz Klinické studie ].
Celková denní dávka u dětí a dospívajících by neměla překročit 1,4 mg/kg nebo 100 mg, podle toho, která dávka je nižší.
Dávkování u dětí a dospívajících nad 70 kg tělesné hmotnosti a dospělých
STRATTERA 18 mg by měla být zahájena celkovou denní dávkou 40 mg a po minimálně 3 dnech by měla být zvýšena na cílovou celkovou denní dávku přibližně 80 mg podávanou buď jako jedna denní dávka ráno, nebo jako rovnoměrně rozdělené dávky ráno a pozdě odpoledne/podvečer. Po dalších 2 až 4 týdnech může být dávka zvýšena na maximálně 100 mg u pacientů, kteří nedosáhli optimální odpovědi. Neexistují žádné údaje, které by podporovaly zvýšenou účinnost při vyšších dávkách [viz Klinické studie ].
Maximální doporučená celková denní dávka u dětí a dospívajících nad 70 kg a dospělých je 100 mg.
Údržba/rozšířená léčba
Všeobecně se souhlasí s tím, že farmakologická léčba ADHD může být potřebná po delší dobu. Přínos udržení pediatrických pacientů (ve věku 6-15 let) s ADHD na STRATTERA 18 mg po dosažení odpovědi v rozmezí dávek 1,2 až 1,8 mg/kg/den byl prokázán v kontrolované studii. Pacienti přiřazení ke STRATTERA v udržovací fázi obecně pokračovali ve stejné dávce, která byla použita k dosažení odpovědi v otevřené fázi. Lékař, který se rozhodne používat STRATTERA po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta (viz Klinické studie ].
Obecné informace o dávkování
STRATTERA lze užívat s jídlem nebo bez jídla.
STRATTERA 40 mg lze vysadit, aniž by došlo k postupnému snižování.
Tobolky STRATTERA nejsou určeny k otevírání, měly by se užívat celé [viz INFORMACE PRO PACIENTA ].
Bezpečnost jednotlivých dávek nad 120 mg a celkových denních dávek nad 150 mg nebyla systematicky hodnocena.
Dávkování u specifických populací
Úprava dávkování pro pacienty s poškozením jater
U pacientů s ADHD, kteří mají jaterní insuficienci (HI), se doporučuje úprava dávkování následovně: U pacientů se středně těžkou HI (Child-Pugh třída B) by počáteční a cílové dávky měly být sníženy na 50 % normální dávky (u pacientů bez AHOJ). U pacientů s těžkou HI (Child-Pugh třída C) by počáteční dávka a cílové dávky měly být sníženy na 25 % normální hodnoty (viz Použití u konkrétních populací ].
Úprava dávkování pro použití se silným inhibitorem CYP2D6 nebo u pacientů, o kterých je známo, že jsou CYP2D6 PM
U dětí a dospívajících s tělesnou hmotností do 70 kg, kterým jsou podávány silné inhibitory CYP2D6, např. paroxetin, fluoxetin a chinidin, nebo u pacientů, o kterých je známo, že jsou CYP2D6 PM, by měla být léčba přípravkem STRATTERA zahájena dávkou 0,5 mg/kg/den a zvýšena pouze na obvyklá cílová dávka 1,2 mg/kg/den, pokud se příznaky nezlepší po 4 týdnech a počáteční dávka je dobře tolerována.
dětí a dospívajících s tělesnou hmotností nad 70 kg a u dospělých, kterým byly podávány silné inhibitory CYP2D6, např. paroxetin, fluoxetin a chinidin, by měla být léčba přípravkem STRATTERA zahájena dávkou 40 mg/den a pouze v případě, že příznaky selžou, je třeba ji zvýšit na obvyklou cílovou dávku 80 mg/den. ke zlepšení po 4 týdnech a úvodní dávka je dobře snášena.
JAK DODÁVÁNO
Dávkové formy A Síly
Jedna tobolka obsahuje atomoxetin HCl ekvivalentní 10 mg (neprůhledná bílá, neprůhledná bílá), 18 mg (zlatá, neprůhledná bílá), 25 mg (neprůhledná modrá, neprůhledná bílá), 40 mg (neprůhledná modrá, neprůhledná modrá), 60 mg (neprůhledná modrá, zlatá), 80 mg (neprůhledná hnědá, neprůhledná bílá) nebo 100 mg (neprůhledná hnědá, neprůhledná hnědá) atomoxetinu.
Skladování A Manipulace
Skladujte při teplotě 25 °C (77 °F); povolené výchylky do 15° až 30°C (59° až 86°F) [viz USP Controlled Room Temperature].
Prodává: Lilly USA, LLC Indianapolis, IN 46285, USA. Revize: květen 2017.
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
STRATTERA 10 mg byl v klinických studiích podán 5382 dětem nebo dospívajícím pacientům s ADHD a 1007 dospělým s ADHD. Během klinických studií ADHD bylo 1625 dětí a dospívajících pacientů léčeno déle než 1 rok a 2529 dětí a dospívajících pacientů bylo léčeno déle než 6 měsíců.
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Klinické zkoušky pro děti a dospívající
Důvody pro přerušení léčby kvůli nežádoucím reakcím v klinických studiích u dětí a dospívajících
akutních placebem kontrolovaných studiích u dětí a dospívajících přerušilo léčbu z důvodu nežádoucích účinků 3,0 % (48/1613) subjektů s atomoxetinem a 1,4 % (13/945) subjektů s placebem. Ve všech studiích (včetně otevřených a dlouhodobých studií) 6,3 % pacientů s rychlým metabolizátorem (EM) a 11,2 % pacientů s pomalým metabolizátorem (PM) ukončilo léčbu kvůli nežádoucí reakci. U pacientů léčených přípravkem STRATTERA podrážděnost (0,3 %, N=5); somnolence (0,3 %, N=5); agrese (0,2 %, N=4); nauzea (0,2 %, N=4); zvracení (0,2 %, N=4); bolest břicha (0,2 %, N=4); zácpa (0,1 %, N=2); únava (0,1 %, N=2); abnormální pocit (0,1 %, N=2); a bolest hlavy (0,1 %, N=2) byly důvodem pro přerušení léčby u více než 1 pacienta.
Záchvaty
Přípravek STRATTERA nebyl systematicky hodnocen u pediatrických pacientů se záchvatovými poruchami, protože tito pacienti byli vyloučeni z klinických studií během testování přípravku před uvedením na trh. V programu klinického vývoje byly záchvaty hlášeny u 0,2 % (12/5073) dětí, jejichž průměrný věk byl 10 let (rozmezí 6 až 16 let). V těchto klinických studiích bylo riziko záchvatů u pomalých metabolizátorů 0,3 % (1/293) ve srovnání s 0,2 % (11/4741) u rychlých metabolizátorů.
Běžně pozorované nežádoucí reakce u akutních dětí a dospívajících, placebem kontrolované studie
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku STRATTERA (incidence 2 % nebo vyšší) a nepozorované při ekvivalentní incidenci u pacientů léčených placebem (incidence STRATTERA o 40 mg vyšší než u placeba) jsou uvedeny v tabulce 2. Výsledky byly podobné v BID a QD studie s výjimkou, jak je uvedeno v tabulce 3, která ukazuje výsledky BID i QD pro vybrané nežádoucí účinky na základě statisticky významných Breslow-Day testů. Nejčastěji pozorované nežádoucí účinky u pacientů léčených přípravkem STRATTERA (výskyt 5 % nebo vyšší a alespoň dvojnásobný výskyt u pacientů s placebem, při dávkování BID nebo QD) byly: nauzea, zvracení, únava, snížená chuť k jídlu, bolest břicha a somnolence (viz tabulky 2 a 3).
Další údaje z klinických studií ADHD (kontrolovaných a nekontrolovaných) ukázaly, že přibližně 5 až 10 % dětských pacientů zaznamenalo potenciálně klinicky významné změny srdeční frekvence (≥ 20 tepů za minutu) nebo krevního tlaku (≥ 15 až 20 mm Hg) [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Následující nežádoucí účinky se vyskytly u nejméně 2 % dětských a dospívajících pacientů s CYP2D6 PM a byly statisticky významně častější u pacientů s PM ve srovnání s pacienty s CYP2D6 EM: nespavost (11 % PM, 6 % EM); hmotnost snížena (7 % PM, 4 % EM); zácpa (7 % PM, 4 % EM); deprese1 (7 % PM, 4 % EM); třes (5 % PM, 1 % EM); exkoriace (4 % PM, 2 % EM); střední nespavost (3 % PM, 1 % EM); konjunktivitida (3 % PM, 1 % EM); synkopa (3 % PM, 1 % EM); časné ranní probuzení (2 % PM, 1 % EM); mydriáza (2 % PM, 1 % EM); sedace (4 % PM, 2 % EM).
1Deprese zahrnuje následující pojmy: deprese, velká deprese, depresivní symptomy, depresivní nálada, dysforie.
Klinické zkoušky pro dospělé
Důvody pro přerušení léčby kvůli nežádoucím reakcím v akutních studiích kontrolovaných placebem u dospělých
akutních placebem kontrolovaných studiích u dospělých přerušilo léčbu z důvodu nežádoucích účinků 11,3 % (61/541) subjektů s atomoxetinem a 3,0 % (12/405) subjektů s placebem. Mezi pacienty léčenými přípravkem STRATTERA nespavost (0,9 %, N=5); nauzea (0,9 %, N=5); bolest na hrudi (0,6 %, N=3); únava (0,6 %, N=3); úzkost (0,4 %, N=2); erektilní dysfunkce (0,4 %, N=2); změny nálady (0,4 %, N=2); nervozita (0,4 %, N=2); palpitace (0,4 %, N=2); a retence moči (0,4 %, N=2) byly důvodem pro přerušení léčby u více než 1 pacienta.
Záchvaty
Přípravek STRATTERA nebyl systematicky hodnocen u dospělých pacientů se záchvatovým onemocněním, protože tito pacienti byli vyloučeni z klinických studií během testování přípravku před uvedením na trh. V programu klinického vývoje byly záchvaty hlášeny u 0,1 % (1/748) dospělých pacientů. V těchto klinických studiích žádní pomalí metabolizátoři (0/43) neuváděli záchvaty ve srovnání s 0,1 % (1/705) u extenzivních metabolizátorů.
Běžně pozorované nežádoucí reakce v akutních studiích kontrolovaných placebem u dospělých
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku STRATTERA (incidence 2 % nebo vyšší) a nepozorované s ekvivalentní incidencí u pacientů léčených placebem (incidence STRATTERA o 25 mg vyšší než u placeba) jsou uvedeny v tabulce 4. Nejčastěji pozorované nežádoucí účinky u pacientů léčených přípravkem STRATTERA (výskyt 5 % nebo vyšší a alespoň dvojnásobný výskyt u pacientů s placebem) byly: zácpa, sucho v ústech, nauzea, snížená chuť k jídlu, závratě, erektilní dysfunkce a váhavost moči (viz tabulka 4). Další údaje z klinických studií ADHD (kontrolovaných a nekontrolovaných) ukázaly, že přibližně 5 až 10 % dospělých pacientů zaznamenalo potenciálně klinicky významné změny srdeční frekvence (≥ 20 tepů za minutu) nebo krevního tlaku (≥ 15 až 20 mm Hg) [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Následující nežádoucí příhody se vyskytly u nejméně 2 % dospělých pacientů s pomalým metabolizmem (PM) CYP2D6 a byly statisticky významně častější u pacientů s PM ve srovnání s pacienty s rychlým metabolizátorem (EM) CYP2D6: rozmazané vidění (4 % PM, 1 % EM ); sucho v ústech (35 % PM, 17 % EM); zácpa (11 % PM, 7 % EM); pocit nervozity (5 % PM, 2 % EM); snížená chuť k jídlu (23 % PM, 15 % EM); třes (5 % PM, 1 % EM); nespavost (19 % PM, 11 % EM); poruchy spánku (7 % PM, 3 % EM); střední nespavost (5 % PM, 3 % EM); terminální insomnie (3 % PM, 1 % EM); retence moči (6 % PM, 1 % EM); erektilní dysfunkce (21 % PM, 9 % EM); porucha ejakulace (6 % PM, 2 % EM); hyperhidróza (15 % PM, 7 % EM); periferní chlad (3 % PM, 1 % EM).
Mužské a ženské sexuální dysfunkce
Zdá se, že atomoxetin u některých pacientů narušuje sexuální funkce. Změny v sexuální touze, sexuální výkonnosti a sexuální spokojenosti nejsou ve většině klinických studií dobře hodnoceny, protože vyžadují zvláštní pozornost a protože se pacienti a lékaři mohou zdráhat o nich diskutovat. V souladu s tím odhady výskytu nežádoucích sexuálních zkušeností a výkonu uvedené v označení produktů pravděpodobně podhodnocují skutečný výskyt. Tabulka 4 výše ukazuje výskyt sexuálních nežádoucích účinků hlášených nejméně 2 % dospělých pacientů užívajících přípravek STRATTERA v placebem kontrolovaných studiích.
Neexistují žádné adekvátní a dobře kontrolované studie zkoumající sexuální dysfunkci při léčbě přípravkem STRATTERA 40 mg. I když je obtížné znát přesné riziko sexuální dysfunkce spojené s užíváním přípravku STRATTERA 40 mg, lékaři by se měli běžně dotazovat na takové možné nežádoucí účinky.
Postmarketingové spontánní zprávy
Následující nežádoucí účinky byly zjištěny během postregistračního používání přípravku STRATTERA. Pokud není uvedeno jinak, vyskytly se tyto nežádoucí účinky u dospělých a dětí a dospívajících. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Kardiovaskulární systém - Prodloužení QT intervalu, synkopa.
Účinky na periferní cévy - Raynaudův fenomén.
Celkové poruchy a reakce v místě aplikace - Letargie.
Muskuloskeletální systém - Rabdomyolýza.
Poruchy nervového systému - hypoestézie; parestézie u dětí a dospívajících; smyslové poruchy; tiky.
Psychiatrické poruchy - Deprese a depresivní nálada; úzkost, změny libida.
Záchvaty V postmarketingovém období byly hlášeny záchvaty. Postmarketingové případy záchvatů zahrnují pacienty s preexistujícími záchvatovými poruchami a pacienty s identifikovanými rizikovými faktory pro záchvaty, stejně jako pacienty, kteří nemají v anamnéze ani identifikované rizikové faktory záchvatů. Přesný vztah mezi přípravkem STRATTERA 40 mg a záchvaty je obtížné vyhodnotit kvůli nejistotě ohledně základního rizika záchvatů u pacientů s ADHD.
Poruchy kůže a podkoží - Alopecie, hyperhidróza.
Urogenitální systém - Pánevní bolest u mužů; váhání moči u dětí a dospívajících; retence moči u dětí a dospívajících.
DROGOVÉ INTERAKCE
Inhibitory monoaminoxidázy
jiných léků, které ovlivňují koncentrace monoaminů v mozku, byly hlášeny závažné, někdy fatální reakce (včetně hypertermie, rigidity, myoklonu, autonomní nestability s možnými rychlými fluktuacemi vitálních funkcí a změn duševního stavu, které zahrnují extrémní neklid přecházející do deliria a kómatu ) při užívání v kombinaci s IMAO. Některé případy vykazovaly rysy připomínající neuroleptický maligní syndrom. Takové reakce se mohou objevit, když jsou tyto léky podávány současně nebo v těsné blízkosti [viz KONTRAINDIKACE ].
Účinek inhibitorů CYP2D6 na atomoxetin
U extenzivních metabolizátorů (EM) zvyšují inhibitory CYP2D6 (např. paroxetin, fluoxetin a chinidin) plazmatické koncentrace atomoxetinu v ustáleném stavu na expozice podobnou expozicím pozorovaným u pomalých metabolizátorů (PM). U jedinců s EM léčených paroxetinem nebo fluoxetinem je AUC atomoxetinu přibližně 6 až 8krát vyšší a Css, max je přibližně 3 až 4krát větší než samotný atomoxetin.
Studie in vitro naznačují, že současné podávání inhibitorů cytochromu P450 s PM nezvýší plazmatické koncentrace atomoxetinu.
Antihypertenziva a presorické látky
Vzhledem k možným účinkům na krevní tlak by měl být STRATTERA používán opatrně s antihypertenzivy a presorickými látkami (např. dopaminem, dobutaminem) nebo jinými léky, které zvyšují krevní tlak.
albuterol
STRATTERA by měl být podáván s opatrností pacientům léčeným systémově (perorálně nebo intravenózně) albuterolem (nebo jinými beta2 agonisty), protože účinek albuterolu na kardiovaskulární systém může být zesílen, což vede ke zvýšení srdeční frekvence a krevního tlaku. Albuterol (600 mcg iv během 2 hodin) vyvolal zvýšení srdeční frekvence a krevního tlaku. Tyto účinky byly zesíleny atomoxetinem (60 mg dvakrát denně po dobu 5 dnů) a byly nejvýraznější po počátečním společném podání albuterolu a atomoxetinu. Tyto účinky na srdeční frekvenci a krevní tlak však nebyly pozorovány v jiné studii po současném podávání inhalační dávky albuterolu (200-800 mcg) a atomoxetinu (80 mg QD po dobu 5 dnů) u 21 zdravých asijských subjektů, kteří byli vyloučeni pro chudé stav metabolizátoru.
Vliv Atomoxetinu Na Enzymy P450
Atomoxetin nezpůsobil klinicky významnou inhibici nebo indukci enzymů cytochromu P450, včetně CYP1A2, CYP3A, CYP2D6 a CYP2C9.
Substrát CYP3A (např. Midazolam)
Současné podávání přípravku STRATTERA (60 mg dvakrát denně po dobu 12 dnů) s midazolamem, modelovou sloučeninou pro léčiva metabolizovaná CYP3A4 (jednorázová dávka 5 mg), vedlo k 15% zvýšení AUC midazolamu. U léků metabolizovaných CYP3A se nedoporučuje žádná úprava dávky.
Substrát CYP2D6 (např. desipramin)
Současné podávání přípravku STRATTERA (40 nebo 60 mg dvakrát denně po dobu 13 dnů) s desipraminem, modelovou sloučeninou pro léky metabolizované CYP2D6 (jednorázová dávka 50 mg), nezměnilo farmakokinetiku desipraminu. U léků metabolizovaných CYP2D6 se nedoporučuje žádná úprava dávky.
Alkohol
Konzumace etanolu se STRATTERA 18mg nezměnila omamné účinky etanolu.
methylfenidát
Současné podávání methylfenidátu s přípravkem STRATTERA 18 mg nezvýšilo kardiovaskulární účinky nad rámec těch, které byly pozorovány u samotného methylfenidátu.
Léky vysoce vázané na plazmatické bílkoviny
In vitro studie vytěsňování léčiva byly provedeny s atomoxetinem a jinými vysoce vázanými léčivy v terapeutických koncentracích. Atomoxetin neovlivnil vazbu warfarinu, kyseliny acetylsalicylové, fenytoinu nebo diazepamu na lidský albumin. Podobně tyto sloučeniny neovlivnily vazbu atomoxetinu na lidský albumin.
Léky, které ovlivňují pH žaludku
Léky, které zvyšují pH žaludku (hydroxid hořečnatý/hydroxid hlinitý, omeprazol), neměly žádný vliv na biologickou dostupnost přípravku STRATTERA.
Zneužívání drog a závislost
Kontrolovaná látka
STRATTERA není kontrolovaná látka.
Zneužívání
V randomizované, dvojitě zaslepené, placebem kontrolované studii s potenciálem zneužívání u dospělých porovnávající účinky přípravku STRATTERA a placeba, nebyl přípravek STRATTERA spojen s typem odpovědi, který by naznačoval stimulační nebo euforizující vlastnosti.
Závislost
Údaje z klinických studií u více než 2 000 dětí, dospívajících a dospělých s ADHD a více než 1 200 dospělých s depresí ukázaly pouze ojedinělé případy zneužití léku nebo nevhodného samoaplikace spojené s přípravkem STRATTERA. Neexistoval žádný důkaz o návratu symptomů nebo nežádoucích reakcí naznačujících syndrom z vysazení léku nebo abstinenční syndrom.
Zkušenosti se zvířaty
Studie drogové diskriminace u potkanů a opic ukázaly nekonzistentní generalizaci stimulů mezi atomoxetinem a kokainem.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Sebevražedné myšlenky
STRATTERA zvyšoval riziko sebevražedných myšlenek v krátkodobých studiích u dětí a dospívajících s poruchou pozornosti/hyperaktivitou (ADHD). Souhrnné analýzy krátkodobých (6 až 18 týdnů) placebem kontrolovaných studií přípravku STRATTERA u dětí a dospívajících odhalily vyšší riziko sebevražedných myšlenek na začátku léčby u pacientů užívajících přípravek STRATTERA. Bylo provedeno celkem 12 studií (11 u ADHD a 1 u enurézy) zahrnujících více než 2200 pacientů (včetně 1357 pacientů užívajících přípravek STRATTERA a 851 pacientů užívajících placebo). Průměrné riziko sebevražedných myšlenek u pacientů užívajících přípravek STRATTERA bylo 0,4 % (5/1357 pacientů) ve srovnání s žádným u pacientů užívajících placebo. Mezi těmito přibližně 2 200 pacienty byl 1 pokus o sebevraždu, k němuž došlo u pacienta léčeného přípravkem STRATTERA. V těchto studiích nedošlo k žádné sebevraždě. Všechny reakce se objevily u dětí ve věku 12 let nebo mladších. Všechny reakce se objevily během prvního měsíce léčby. Není známo, zda se riziko sebevražedných myšlenek u pediatrických pacientů rozšiřuje na dlouhodobé užívání. Podobná analýza u dospělých pacientů léčených přípravkem STRATTERA pro ADHD nebo velkou depresivní poruchu (MDD) neodhalila zvýšené riziko sebevražedných myšlenek nebo chování v souvislosti s užíváním přípravku STRATTERA.
Všichni dětští pacienti léčení přípravkem STRATTERA by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, sebevražednosti a neobvyklých změn v chování, zejména během několika prvních měsíců léčebné kúry nebo v době změn dávky, ať už zvýšení nebo snížení .
přípravku STRATTERA byly hlášeny následující příznaky: úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie. Ačkoli příčinná souvislost mezi vznikem takových symptomů a vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevražednosti. Pacienti léčení přípravkem STRATTERA 40 mg by proto měli být sledováni, zda se u nich tyto příznaky neobjeví.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, kteří prožívají náhlou sebevraždu nebo symptomy, které by mohly být prekurzory vznikající sebevraždy, zejména pokud jsou tyto příznaky závažné nebo náhlé nebo nebyly součástí symptomy pacienta.
Rodiny a ošetřovatelé dětských pacientů léčených přípravkem STRATTERA 10 mg by měli být upozorněni na nutnost sledovat pacienty kvůli výskytu agitovanosti, podrážděnosti, neobvyklých změn chování a dalších příznaků popsaných výše, stejně jako výskytu sebevražednosti a takové příznaky okamžitě nahlaste poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů.
Těžké poranění jater
Postmarketingové zprávy naznačují, že STRATTERA může způsobit vážné poškození jater. Přestože v klinických studiích s přibližně 6000 pacienty nebyly zjištěny žádné známky poškození jater, vyskytly se vzácné případy klinicky významného poškození jater, které byly po uvedení přípravku na trh považovány za pravděpodobně nebo možná související s užíváním přípravku STRATTERA 40 mg. Byly také hlášeny vzácné případy selhání jater, včetně případu, který vedl k transplantaci jater. Vzhledem k pravděpodobnému nedostatečnému hlášení není možné poskytnout přesný odhad skutečného výskytu těchto reakcí. Hlášené případy poškození jater se ve většině případů vyskytly během 120 dnů od zahájení léčby atomoxetinem a u některých pacientů se objevily výrazně zvýšené jaterní enzymy [>20 x horní hranice normy (ULN)] a žloutenka s významně zvýšenými hladinami bilirubinu (>2 X ULN), po kterém následuje zotavení po vysazení atomoxetinu. U jednoho pacienta se poškození jater, projevující se zvýšenými jaterními enzymy až na 40x ULN a žloutenkou s bilirubinem až 12x ULN, vrátilo po opětovném podání a po vysazení léku následovalo zotavení, což poskytuje důkaz, že poškození jater pravděpodobně způsobil přípravek STRATTERA. Takové reakce se mohou objevit několik měsíců po zahájení léčby, ale laboratorní abnormality se mohou zhoršovat ještě několik týdnů po vysazení léku. Výše popsaný pacient se zotavil z poškození jater a nevyžadoval transplantaci jater.
Léčba přípravkem STRATTERA by měla být přerušena u pacientů se žloutenkou nebo laboratorním průkazem poškození jater a neměla by být znovu zahájena. Laboratorní vyšetření ke stanovení hladin jaterních enzymů by mělo být provedeno při prvním příznaku nebo známce jaterní dysfunkce (např. svědění, tmavá moč, žloutenka, citlivost pravého horního kvadrantu nebo nevysvětlitelné příznaky podobné chřipce) [viz Laboratorní testy , INFORMACE PRO PACIENTA ].
Závažné kardiovaskulární příhody
Náhlá smrt a již existující strukturální srdeční abnormality nebo jiné vážné srdeční problémy
Děti a dospívající
Náhlá smrt byla hlášena v souvislosti s léčbou atomoxetinem v obvyklých dávkách u dětí a dospívajících se strukturálními srdečními abnormalitami nebo jinými závažnými srdečními problémy. Ačkoli některé závažné srdeční problémy samotné s sebou nesou zvýšené riziko náhlé smrti, atomoxetin by obecně neměl být používán u dětí nebo dospívajících se známými závažnými strukturálními srdečními abnormalitami, kardiomyopatií, závažnými abnormalitami srdečního rytmu nebo jinými závažnými srdečními problémy, které je mohou vystavit zvýšené zranitelnosti. k noradrenergním účinkům atomoxetinu.
Dospělí
dospělých užívajících atomoxetin v obvyklých dávkách pro ADHD byla hlášena náhlá úmrtí, mrtvice a infarkt myokardu. Ačkoli role atomoxetinu v těchto případech u dospělých také není známa, dospělí mají větší pravděpodobnost než děti, že budou mít vážné strukturální srdeční abnormality, kardiomyopatii, vážné abnormality srdečního rytmu, onemocnění koronárních tepen nebo jiné závažné srdeční problémy. Je třeba zvážit neléčení dospělých s klinicky významnými srdečními abnormalitami.
Hodnocení kardiovaskulárního stavu u pacientů léčených atomoxetinem
Děti, dospívající nebo dospělí, u kterých se zvažuje léčba atomoxetinem, by měli mít pečlivou anamnézu (včetně posouzení rodinné anamnézy náhlé smrti nebo ventrikulární arytmie) a fyzické vyšetření k posouzení přítomnosti srdečního onemocnění a měli by podstoupit další srdeční hodnocení, pokud nálezy naznačují takové onemocnění (např. elektrokardiogram a echokardiogram). Pacienti, u kterých se během léčby atomoxetinem rozvinou symptomy, jako je námahová bolest na hrudi, nevysvětlitelná synkopa nebo jiné symptomy naznačující srdeční onemocnění, by měli podstoupit okamžité kardiologické vyšetření.
Účinky Na Krevní Tlak A Srdeční Frekvenci
STRATTERA by měl být používán s opatrností u pacientů, jejichž základní zdravotní stav by se mohl zhoršit zvýšením krevního tlaku nebo srdeční frekvence, jako jsou někteří pacienti s hypertenzí, tachykardií nebo kardiovaskulárním nebo cerebrovaskulárním onemocněním. Neměl by se používat u pacientů se závažnými srdečními nebo cévními poruchami, u nichž lze očekávat zhoršení stavu, pokud by u nich došlo ke klinicky významnému zvýšení krevního tlaku nebo srdeční frekvence (viz KONTRAINDIKACE ]. Puls a krevní tlak by měly být měřeny na začátku léčby, po zvýšení dávky přípravku STRATTERA a pravidelně během léčby, aby se zjistilo možné klinicky významné zvýšení.
Následující tabulka poskytuje údaje z krátkodobých, placebem kontrolovaných klinických studií pro podíl pacientů se zvýšením: diastolického krevního tlaku ≥15 mm Hg; systolický krevní tlak ≥20 mm Hg; srdeční frekvence vyšší nebo rovna 20 tepů/min, u pediatrické i dospělé populace (viz tabulka 1).
placebem kontrolovaných registračních studiích zahrnujících pediatrické pacienty byla tachykardie identifikována jako nežádoucí účinek u 0,3 % (5/1597) těchto pacientů s přípravkem STRATTERA 10 mg ve srovnání s 0 % (0/934) pacientů s placebem. Průměrné zvýšení srdeční frekvence u pacientů s rychlým metabolizátorem (EM) bylo 5,0 tepů/minutu a u pacientů s pomalým metabolizátorem (PM) 9,4 tepů/minutu.
V klinických studiích u dospělých, kde byl k dispozici stav EM/PM, bylo průměrné zvýšení srdeční frekvence u pacientů s PM významně vyšší než u pacientů s EM (11 tepů/minutu oproti 7,5 tepů/minutu). Účinky srdeční frekvence mohou být klinicky důležité u některých pacientů s PM.
V placebem kontrolovaných registračních studiích zahrnujících dospělé pacienty byla tachykardie identifikována jako nežádoucí příhoda u 1,5 % (8/540) pacientů s přípravkem STRATTERA 25 mg ve srovnání s 0,5 % (2/402) pacientů s placebem.
klinických studiích u dospělých, kde byl k dispozici stav EM/PM, byla průměrná změna diastolického krevního tlaku od výchozí hodnoty u pacientů s PM vyšší než u pacientů s EM (4,21 oproti 2,13 mm Hg), stejně jako průměrná změna od výchozí hodnoty v systolickém krevním tlaku (PM : 2,75 versus EM: 2,40 mm Hg). Účinky na krevní tlak by mohly být klinicky důležité u některých pacientů s PM.
pacientů užívajících přípravek STRATTERA byla hlášena ortostatická hypotenze a synkopa. V registračních studiích dětí a dospívajících se u 0,2 % (12/5596) pacientů léčených přípravkem STRATTERA vyskytla ortostatická hypotenze au 0,8 % (46/5596) se vyskytla synkopa. V krátkodobých registračních studiích dětí a dospívajících se u 1,8 % (6/340) pacientů léčených přípravkem STRATTERA vyskytla ortostatická hypotenze ve srovnání s 0,5 % (1/207) pacientů léčených placebem. Během krátkodobých placebem kontrolovaných registračních studií ADHD u dětí a dospívajících nebyla hlášena synkopa. STRATTERA 10 mg by měl být používán s opatrností při jakémkoli stavu, který může pacienty predisponovat k hypotenzi, nebo stavů spojených s náhlou srdeční frekvencí nebo změnami krevního tlaku.
Vznik nových psychotických nebo manických příznaků
Při léčbě vznikající psychotické nebo manické symptomy, např. halucinace, bludné myšlení nebo mánie u dětí a dospívajících bez předchozí psychotické nemoci nebo mánie, mohou být způsobeny atomoxetinem v obvyklých dávkách. Pokud se takové příznaky objeví, je třeba zvážit možnou kauzální roli atomoxetinu a zvážit přerušení léčby. V souhrnné analýze několika krátkodobých, placebem kontrolovaných studií se tyto příznaky objevily u přibližně 0,2 % (4 pacienti s reakcemi z 1939 vystavení atomoxetinu po několik týdnů v obvyklých dávkách) pacientů léčených atomoxetinem ve srovnání s 0 z 1056 pacientů léčených placebem.
Screening pacientů na bipolární poruchu
Obecně je třeba věnovat zvláštní pozornost léčbě ADHD u pacientů s komorbidní bipolární poruchou z důvodu obav z možného vyvolání smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby přípravkem STRATTERA 40 mg by však pacienti s komorbidními depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda u nich existuje riziko bipolární poruchy; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese.
Agresivní chování nebo nepřátelství
Pacienti zahajující léčbu ADHD by měli být sledováni z hlediska výskytu nebo zhoršení agresivního chování nebo nepřátelství. Agresivní chování nebo nepřátelství je často pozorováno u dětí a dospívajících s ADHD. V pediatrických krátkodobých kontrolovaných klinických studiích 21/1308 (1,6 %) pacientů s atomoxetinem oproti 9/806 (1,1 %) pacientů léčených placebem spontánně hlásilo nežádoucí příhody související s hostilitou související s léčbou (celkový poměr rizika 1,33 [95 % CI 0,67-2,64 – není statisticky významné]). V placebem kontrolovaných klinických studiích dospělých 6/1697 (0,35%) pacientů s atomoxetinem oproti 4/1560 (0,26%) pacientů léčených placebem spontánně hlásilo nežádoucí příhody související s hostilitou související s léčbou (celkový poměr rizika 1,38 [95% CI 0,39-4,88 – není statisticky významné]). Ačkoli to není nezvratný důkaz, že přípravek STRATTERA 10 mg způsobuje agresivní chování nebo nepřátelství, bylo toto chování v klinických studiích častěji pozorováno u dětí, dospívajících a dospělých léčených přípravkem STRATTERA ve srovnání s placebem.
Alergické příhody
Přestože jsou méně časté, u pacientů užívajících přípravek STRATTERA byly hlášeny alergické reakce, včetně anafylaktických reakcí, angioneurotického edému, kopřivky a vyrážky.
Účinky na odtok moči z močového měchýře
V kontrolovaných studiích ADHD u dospělých byla míra retence moči (1,7 %, 9/540) a váhání moči (5,6 %, 30/540) zvýšena u subjektů s atomoxetinem ve srovnání s pacienty s placebem (0 %, 0/402; 0,5 %, 2/402). Dva dospělí jedinci s atomoxetinem a žádný jedinci s placebem přerušili kontrolované klinické studie z důvodu retence moči. Stížnost na retenci moči nebo váhavost moči by měla být považována za potenciálně související s atomoxetinem.
Priapismus
pediatrických a dospělých pacientů léčených přípravkem STRATTERA byly hlášeny vzácné postmarketingové případy priapismu, definovaného jako bolestivá a nebolestivá erekce penisu trvající déle než 4 hodiny. Erekce ustoupily v případech, kdy byly k dispozici další informace, některé po vysazení přípravku STRATTERA. V případě podezření na priapismus je nutná okamžitá lékařská pomoc.
Účinky Na Růst
Údaje o dlouhodobých účincích přípravku STRATTERA 25 mg na růst pocházejí z otevřených studií a změny hmotnosti a výšky jsou porovnávány s údaji o normativní populaci. Obecně platí, že přírůstek hmotnosti a výšky u pediatrických pacientů léčených přípravkem STRATTERA zaostává za předpokládanými údaji o normativní populaci po dobu přibližně prvních 9-12 měsíců léčby. Následně se nárůst hmotnosti obnoví a přibližně po 3 letech léčby pacienti léčení přípravkem STRATTERA přibrali v průměru 17,9 kg, což je o 0,5 kg více, než předpokládali jejich výchozí údaje. Přibližně po 12 měsících se nárůst výšky stabilizuje a po 3 letech narostli pacienti léčení přípravkem STRATTERA 40 mg v průměru o 19,4 cm, o 0,4 cm méně, než předpokládali jejich výchozí údaje (viz obrázek 1 níže).
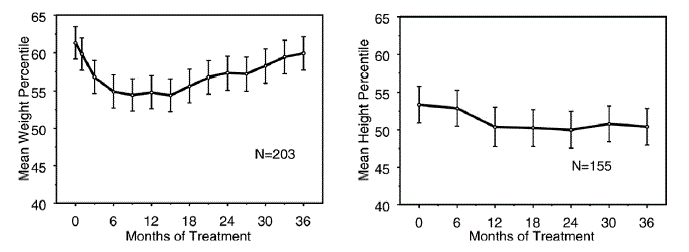
Obrázek 1: Průměrné hmotnostní a výškové percentily v průběhu času pro pacienty s tříletou léčbou STRATTERA 40 mg
Tento růstový vzorec byl obecně podobný bez ohledu na pubertální stav v době zahájení léčby. Pacienti, kteří byli na začátku léčby předpubertální (dívky ≤ 8 let, chlapci ≤ 9 let), přibrali po třech letech v průměru o 2,1 kg a o 1,2 cm méně, než se předpokládalo. Pacienti v pubertě (dívky >8 až ≤13 let, chlapci >9 až ≤14 let) nebo pozdní puberta (dívky >13 let, chlapci >14 let) měli průměrné přírůstky hmotnosti a výšky, které se blížily nebo překročila předpokládané hodnoty po třech letech léčby.
Růst probíhal podobným způsobem jak u extenzivních, tak u pomalých metabolizátorů (EM, PM). PM léčené po dobu alespoň dvou let přibraly v průměru o 2,4 kg a 1,1 cm méně, než se předpokládalo, zatímco EM přibraly v průměru o 0,2 kg a 0,4 cm méně, než se předpokládalo.

krátkodobých kontrolovaných studiích (do 9 týdnů) pacienti léčení přípravkem STRATTERA zhubli v průměru o 0,4 kg a přibrali v průměru o 0,9 cm ve srovnání s přírůstkem 1,5 kg a 1,1 cm u pacientů užívajících placebo. V kontrolované studii s fixní dávkou ztratilo 1,3 %, 7,1 %, 19,3 % a 29,1 % pacientů alespoň 3,5 % své tělesné hmotnosti ve skupinách s placebem, 0,5, 1,2 a 1,8 mg/kg/den.
Během léčby přípravkem STRATTERA je třeba sledovat růst.
Laboratorní testy
Rutinní laboratorní testy nejsou nutné.
Metabolismus CYP2D6
Slabí metabolizátoři (PM) CYP2D6 mají 10krát vyšší AUC a 5krát vyšší maximální koncentraci při dané dávce STRATTERA 25 mg ve srovnání s extenzivními metabolizátory (EM). Přibližně 7 % kavkazské populace jsou PM. K identifikaci PM CYP2D6 jsou k dispozici laboratorní testy. Hladiny PM v krvi jsou podobné těm, kterých se dosáhne užíváním silných inhibitorů CYP2D6. Vyšší hladiny PM v krvi vedou k vyšší míře některých nežádoucích účinků STRATTERA [viz NEŽÁDOUCÍ REAKCE ].
Současné užívání silných inhibitorů CYP2D6 nebo použití u pacientů, o kterých je známo, že jsou CYP2D6 PM
Atomoxetin je primárně metabolizován cestou CYP2D6 na 4-hydroxyatomoxetin. Úprava dávkování přípravku STRATTERA může být nezbytná při současném podávání se silnými inhibitory CYP2D6 (např. paroxetinem, fluoxetinem a chinidinem) nebo při podávání PM CYP2D6. [Vidět DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
Informace pro pacienty
Viz FDA-schváleno INFORMACE PRO PACIENTA .
Obecná informace
Lékaři by měli své pacienty poučit, aby si před zahájením léčby přípravkem STRATTERA přečetli Příručku k léčbě a aby si ji znovu přečetli při každém obnovení předpisu.
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o přínosech a rizicích spojených s léčbou přípravkem STRATTERA a měli by jim poradit, jak správně používat. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Příručku o medikaci, a měl by jim pomoci porozumět jejímu obsahu. Pacienti by měli mít příležitost prodiskutovat obsah Příručky pro léky a získat odpovědi na případné otázky.
Pacienti by měli být informováni o následujících problémech a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání přípravku STRATTERA.
Riziko sebevraždy
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. deprese a sebevražedné myšlenky, zvláště brzy během léčby přípravkem STRATTERA a při úpravě dávky. Rodiny a ošetřovatelé pacientů by měli být poučeni, aby každý den pozorovali výskyt těchto příznaků, protože změny mohou být náhlé. Takové příznaky by měly být hlášeny pacientovu předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, začínají náhle nebo nejsou součástí pacientových příznaků. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě.
Těžké poranění jater
Pacienti, kteří zahajují léčbu přípravkem STRATTERA, by měli být upozorněni, že se může vyvinout závažné poškození jater. Pacienti by měli být poučeni, aby okamžitě kontaktovali svého lékaře, pokud se u nich objeví svědění, tmavá moč, žloutenka, citlivost pravého horního kvadrantu nebo nevysvětlitelné „chřipkové“ příznaky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Agrese nebo nepřátelství
Pacienti by měli být poučeni, aby co nejdříve zavolali svého lékaře, pokud zaznamenají nárůst agresivity nebo nepřátelství.
Priapismus
U pediatrických a dospělých pacientů léčených přípravkem STRATTERA byly hlášeny vzácné postmarketingové případy priapismu, definovaného jako bolestivá a nebolestivá erekce penisu trvající déle než 4 hodiny. Rodiče nebo opatrovníci dětských pacientů užívajících STRATTERA 25 mg a dospělých pacientů užívajících STRATTERA by měli být poučeni, že priapismus vyžaduje okamžitou lékařskou pomoc.
Dráždí oči
STRATTERA je oční dráždidlo. Tobolky STRATTERA nejsou určeny k otevírání. V případě kontaktu obsahu tobolky s okem je třeba postižené oko okamžitě vypláchnout vodou a vyhledat lékařskou pomoc. Ruce a jakékoli potenciálně kontaminované povrchy by se měly co nejdříve umýt.
Interakce lék-lék
Pacienti by měli být poučeni, aby se poradili s lékařem, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, doplňky stravy nebo bylinné přípravky.
Těhotenství
Pacientky by měly být poučeny, aby se během užívání přípravku STRATTERA poradily s lékařem, pokud kojí, jsou těhotné nebo uvažují o těhotenství.
Jídlo
Pacienti mohou užívat přípravek STRATTERA 25 mg s jídlem nebo bez jídla.
Zmeškaná dávka
Pokud pacienti vynechají dávku, měli by být poučeni, aby ji užili co nejdříve, ale neměli by užít více, než je předepsané celkové denní množství přípravku STRATTERA během jakéhokoli 24hodinového období.
Zasahování do psychomotorického výkonu
Pacienti by měli být poučeni, aby byli opatrní při řízení auta nebo obsluze nebezpečných strojů, dokud si nebudou přiměřeně jisti, že jejich výkon není ovlivněn atomoxetinem.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Atomoxetin HCl nebyl karcinogenní u potkanů a myší, pokud byl podáván v dietě po dobu 2 let v časově vážených průměrných dávkách až do 47 a 458 mg/kg/den, v uvedeném pořadí. Nejvyšší dávka použitá u potkanů je přibližně 8násobek a 5násobek maximální dávky pro člověka u dětí a dospělých, v přepočtu na mg/m2. Plazmatické hladiny (AUC) atomoxetinu v této dávce u potkanů se odhadují na 1,8násobek (extenzivní metabolizátoři) nebo 0,2násobek (slabí metabolizátoři) než u lidí, kterým byla podávána maximální dávka pro člověka. Nejvyšší dávka použitá u myší je přibližně 39násobek a 26násobek maximální dávky pro člověka u dětí a dospělých, v přepočtu na mg/m2.
Mutageneze
Atomoxetin HCl byl negativní v řadě studií genotoxicity, které zahrnovaly test reverzních bodových mutací (Amesův test), test in vitro myšího lymfomu, test chromozomálních aberací v buňkách vaječníků čínského křečka, test neplánované syntézy DNA v potkaních hepatocytech a test in vivo mikronukleový test u myší. Došlo však k mírnému zvýšení procenta ovariálních buněk čínského křečka s diplochromozomy, což naznačuje endoreduplikaci (numerická aberace).
Metabolit N-desmethylatomoxetin HCl byl negativní v Amesově testu, testu myšího lymfomu a testu neplánované syntézy DNA.
Zhoršení Plodnosti
Atomoxetin HCl nezhoršil plodnost u potkanů, když byl podáván v potravě v dávkách až 57 mg/kg/den, což je přibližně 6násobek maximální dávky u člověka na základě mg/m2.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství C
Březí králíci byli léčeni až 100 mg/kg/den atomoxetinu sondou během období organogeneze. Při této dávce bylo v 1 ze 3 studií pozorováno snížení počtu živých plodů a zvýšení časných resorpcí. Byl pozorován mírný nárůst výskytu atypického původu karotické arterie a chybějící podklíčkové arterie. Tyto nálezy byly pozorovány při dávkách, které způsobily mírnou toxicitu pro matku. Dávka bez účinku pro tyto nálezy byla 30 mg/kg/den. Dávka 100 mg/kg je přibližně 23násobkem maximální dávky pro člověka na základě mg/m2; plazmatické hladiny (AUC) atomoxetinu v této dávce u králíků se odhadují na 3,3násobek (extenzivní metabolizátoři) nebo 0,4násobek (pomalí metabolizátoři) než u lidí, kterým je podávána maximální dávka pro člověka.
Potkani byli léčeni až přibližně 50 mg/kg/den atomoxetinu (přibližně 6násobek maximální dávky pro člověka na základě mg/m2) ve stravě od 2 týdnů (samice) nebo 10 týdnů (samci) před pářením. období organogeneze a laktace. V 1 ze 2 studií bylo pozorováno snížení hmotnosti mláďat a přežití mláďat. Snížené přežití mláďat bylo také pozorováno při 25 mg/kg (ale ne při 13 mg/kg). Ve studii, ve které byli potkani léčeni atomoxetinem ve stravě 2 týdny (samice) nebo 10 týdnů (samci) před pářením během období organogeneze, došlo ke snížení hmotnosti plodu (pouze samice) a zvýšení výskytu neúplná osifikace vertebrálního oblouku u plodů byla pozorována při dávce 40 mg/kg/den (přibližně 5násobek maximální dávky pro člověka na základě mg/m2), ale nikoli při dávce 20 mg/kg/den.
Nebyly pozorovány žádné nepříznivé účinky na plod, když byly březím krysám podávány až 150 mg/kg/den (přibližně 17násobek maximální dávky pro člověka na základě mg/m2) žaludeční sondou během období organogeneze. Nebyly provedeny žádné adekvátní a dobře kontrolované studie u těhotných žen. STRATTERA 18 mg se nemá užívat během těhotenství, pokud potenciální přínos neospravedlňuje potenciální riziko pro plod.
Práce a dodání
Porod u potkanů nebyl atomoxetinem ovlivněn. Účinek přípravku STRATTERA na porod a porod u lidí není znám.
Kojící matky
Atomoxetin a/nebo jeho metabolity byly vylučovány do mléka potkanů. Není známo, zda se atomoxetin vylučuje do lidského mléka. Pokud je přípravek STRATTERA podáván kojící ženě, je třeba postupovat opatrně.
Pediatrické použití
Každý, kdo zvažuje použití přípravku STRATTERA u dítěte nebo dospívajícího, musí vyvážit potenciální rizika s klinickou potřebou [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Farmakokinetika atomoxetinu u dětí a dospívajících je podobná jako u dospělých. Bezpečnost, účinnost a farmakokinetika přípravku STRATTERA u pediatrických pacientů mladších 6 let nebyly hodnoceny.
Studie byla provedena na mladých potkanech s cílem vyhodnotit účinky atomoxetinu na růst a neurobehaviorální a sexuální vývoj. Potkani byli léčeni 1, 10 nebo 50 mg/kg/den (přibližně 0,2, 2 a 8násobek maximální dávky pro člověka na bázi mg/m2) atomoxetinu podávaného žaludeční sondou od časného postnatálního období (den 10 let) až do dospělosti. Mírné zpoždění nástupu vaginální průchodnosti (všechny dávky) a separace předkožky (10 a 50 mg/kg), mírné snížení hmotnosti nadvarlete a počtu spermií (10 a 50 mg/kg) a mírné snížení žlutých tělísek (50 mg /kg), ale nebyly pozorovány žádné účinky na plodnost nebo reprodukční schopnost. Mírné zpoždění nástupu prořezávání řezáků bylo pozorováno při dávce 50 mg/kg. Mírné zvýšení motorické aktivity bylo pozorováno v den 15 (muži při 10 a 50 mg/kg a ženy při 50 mg/kg) a 30. den (ženy při 50 mg/kg), ale ne v 60. dni věku. Nebyly zjištěny žádné účinky na testy učení a paměti. Význam těchto zjištění pro člověka není znám.
Geriatrické použití
Bezpečnost, účinnost a farmakokinetika přípravku STRATTERA 10 mg u geriatrických pacientů nebyla hodnocena.
Jaterní nedostatečnost
Expozice atomoxetinu (AUC) je ve srovnání s normálními subjekty zvýšená u subjektů s EM se středně těžkou (Child-Pugh třída B) (2násobné zvýšení) a těžkou (Child-Pugh třída C) (4násobné zvýšení) jaterní nedostatečností. Úprava dávkování se doporučuje u pacientů se středně těžkou nebo těžkou jaterní insuficiencí [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Renální insuficience
Subjekty s EM s terminálním stádiem onemocnění ledvin měly vyšší systémovou expozici atomoxetinu než zdravé subjekty (asi 65% nárůst), ale nebyl žádný rozdíl, když byla expozice korigována na dávku mg/kg. STRATTERA 25 mg lze proto podávat pacientům s ADHD v konečném stádiu onemocnění ledvin nebo s nižším stupněm renální insuficience za použití normálního dávkovacího režimu.
Rod
Pohlaví neovlivnilo dispozice atomoxetinu.
Etnického původu
Etnický původ neovlivnil dispozice atomoxetinu (kromě toho, že PM jsou běžnější u bělochů).
Pacienti se souběžným onemocněním
Tiky u pacientů s ADHD a komorbidní Tourettovou poruchou
Atomoxetin podávaný ve flexibilním rozmezí dávek 0,5 až 1,5 mg/kg/den (průměrná dávka 1,3 mg/kg/den) a placebo byly srovnávány u 148 randomizovaných pediatrických pacientů (věk 717 let) s DSM-IV diagnózou ADHD a komorbidní tiková porucha v 18týdenní, dvojitě zaslepené, placebem kontrolované studii, ve které se většina (80 %) zapsala do této studie s Touretteovou poruchou (Touretteova porucha: 116 subjektů; chronická motorická tiková porucha: 29 subjektů). Analýza non-inferiority odhalila, že přípravek STRATTERA 10 mg nezhoršil tiky u těchto pacientů, jak bylo stanoveno pomocí Yale Global Tic Severity Scale Total Score (YGTSS). Ze 148 pacientů, kteří vstoupili do akutní fáze léčby, 103 (69,6 %) pacientů studii ukončilo. Primární důvod pro přerušení léčby jak u atomoxetinu (38 ze 76 pacientů, 50,0 %), tak u skupiny s placebem (45 ze 72 pacientů, 62,5 %) byl identifikován jako nedostatečná účinnost, přičemž většina pacientů ukončila léčbu v týdnu 12. první návštěva, kdy pacienti s CGI-S≥4 mohli také splňovat kritéria pro „neodpovídajícího klinického stavu“ (CGI-S zůstal stejný nebo se zvýšil oproti výchozí hodnotě studie) a byli způsobilí vstoupit do otevřené prodloužené studie s atomoxetinem. Po uvedení na trh byly hlášeny tiky [viz NEŽÁDOUCÍ REAKCE ].
Úzkost u pacientů s ADHD a komorbidními úzkostnými poruchami
Ve dvou postmarketingových, dvojitě zaslepených, placebem kontrolovaných studiích bylo prokázáno, že léčba pacientů s ADHD a komorbidními úzkostnými poruchami přípravkem STRATTERA 10 mg nezhoršuje jejich úzkost.
Ve 12týdenní dvojitě zaslepené, placebem kontrolované studii bylo 176 pacientů ve věku 8-17 let, kteří splňovali kritéria DSM-IV pro ADHD a alespoň jednu z úzkostných poruch separační úzkostné poruchy, generalizované úzkostné poruchy nebo sociální fobie. randomizované. Po dvoutýdenním dvojitě zaslepeném úvodním placebu byla zahájena léčba přípravkem STRATTERA 25 mg dávkou 0,8 mg/kg/den se zvýšením na cílovou dávku 1,2 mg/kg/den (střední dávka 1,30 mg/kg/den +/-0,29 mg/kg/den). Přípravek STRATTERA u těchto pacientů nezhoršil úzkost, jak bylo stanoveno pomocí Pediatric Anxiety Rating Scale (PARS). Ze 158 pacientů, kteří dokončili úvodní dvojitě zaslepenou placebovou studii, 26 (16 %) pacientů studii ukončilo.
samostatné 16týdenní, dvojitě zaslepené, placebem kontrolované studii bylo randomizováno 442 pacientů ve věku 18–65 let, kteří splnili kritéria DSM-IV pro ADHD dospělých a sociální úzkostnou poruchu (23 % z nich mělo také generalizovanou úzkostnou poruchu). Po dvoutýdenním dvojitě zaslepeném úvodu placeba byla zahájena léčba přípravkem STRATTERA 10 mg dávkou 40 mg/den do maximální dávky 100 mg/den (průměrná denní dávka 83 mg/den +/-19,5 mg/den). STRATTERA 18 mg u těchto pacientů nezhoršila úzkost, jak bylo stanoveno Liebowitzovou škálou sociální úzkosti (LSAS). Ze 413 pacientů, kteří dokončili úvodní dvojitě zaslepenou placebovou studii, 149 (36,1 %) pacientů studii ukončilo. Po uvedení na trh byly hlášeny úzkostné stavy [viz NEŽÁDOUCÍ REAKCE ].
PŘEDÁVKOVAT
Lidská zkušenost
Zkušenosti z klinických studií s předávkováním STRATTERA jsou omezené. Během postmarketingového sledování byly hlášeny smrtelné případy při smíšeném předávkování přípravkem STRATTERA 10 mg a nejméně jedním dalším lékem. Nebyly hlášeny žádné případy úmrtí při předávkování samotným přípravkem STRATTERA, včetně úmyslného předávkování v množstvích až 1400 mg. V některých případech předávkování přípravkem STRATTERA byly hlášeny záchvaty. Nejčastěji hlášenými příznaky doprovázejícími akutní a chronické předávkování přípravkem STRATTERA byly gastrointestinální příznaky, somnolence, závratě, třes a abnormální chování. Byla také hlášena hyperaktivita a neklid. Byly také pozorovány známky a příznaky odpovídající mírné až střední aktivaci sympatického nervového systému (např. tachykardie, zvýšený krevní tlak, mydriáza, sucho v ústech). Většina příhod byla mírná až středně závažná. Méně často byly hlášeny prodloužení QT intervalu a duševní změny, včetně dezorientace a halucinací (viz KLINICKÁ FARMAKOLOGIE ].
Řízení Předávkování
Poraďte se s certifikovaným Poison Control Center pro aktuální pokyny a rady. Vzhledem k tomu, že atomoxetin je silně vázán na proteiny, dialýza pravděpodobně nebude užitečná při léčbě předávkování.
KONTRAINDIKACE
Přecitlivělost
STRATTERA je kontraindikován u pacientů, o kterých je známo, že jsou přecitlivělí na atomoxetin nebo jiné složky přípravku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Inhibitory monoaminooxidázy (MAOI)
STRATTERA by se neměl užívat s IMAO nebo do 2 týdnů po vysazení IMAO. Léčba IMAO by neměla být zahájena během 2 týdnů po vysazení přípravku STRATTERA. U jiných léků, které ovlivňují koncentrace monoaminů v mozku, byly hlášeny závažné, někdy fatální reakce (včetně hypertermie, rigidity, myoklonu, autonomní nestability s možnými rychlými fluktuacemi vitálních funkcí a změn duševního stavu, které zahrnují extrémní neklid přecházející do deliria a kóma), pokud se užívá v kombinaci s IMAO. Některé případy vykazovaly rysy připomínající neuroleptický maligní syndrom. Takové reakce se mohou objevit, když jsou tyto léky podávány současně nebo v těsné blízkosti [viz DROGOVÉ INTERAKCE ].
Glaukom s úzkým úhlem
V klinických studiích bylo užívání přípravku STRATTERA spojeno se zvýšeným rizikem mydriázy, a proto se jeho použití u pacientů s glaukomem s úzkým úhlem nedoporučuje.
Feochromocytom
pacientů s feochromocytomem nebo s feochromocytomem v anamnéze, kteří dostávali přípravek STRATTERA, byly hlášeny závažné reakce, včetně zvýšeného krevního tlaku a tachyarytmie. Proto by STRATTERA 18 mg neměli užívat pacienti s feochromocytomem nebo s feochromocytomem v anamnéze.
Těžké kardiovaskulární poruchy
STRATTERA 40 mg by neměli užívat pacienti se závažnými srdečními nebo cévními poruchami, u nichž lze očekávat zhoršení stavu, pokud u nich dojde ke zvýšení krevního tlaku nebo srdeční frekvence, které by mohlo být klinicky významné (například 15 až 20 mm Hg krevního tlaku nebo 20 tepů za minutu v tepové frekvenci). [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Přesný mechanismus, kterým atomoxetin vyvolává své terapeutické účinky u poruchy pozornosti/hyperaktivity (ADHD), není znám, ale předpokládá se, že souvisí se selektivní inhibicí presynaptického transportéru norepinefrinu, jak bylo stanoveno ex vivo studiemi vychytávání a deplece neurotransmiterů .
Farmakodynamika
Analýza expozice-odezva zahrnující dávky atomoxetinu (0,5, 1,2 nebo 1,8 mg/kg/den) nebo placeba prokázala, že expozice atomoxetinu koreluje s účinností měřenou pomocí stupnice hodnocení deficitu pozornosti/hyperaktivity-IV-rodičovská verze: zkoušející podávat a skóroval. Vztah mezi expozicí a účinností byl podobný tomu, který byl pozorován mezi dávkou a účinností s mediánem expozic při dvou nejvyšších dávkách, což vedlo k téměř maximálním změnám od výchozí hodnoty (viz Klinické studie ].
Elektrofyziologie srdce
Účinek přípravku STRATTERA na prodloužení QTc intervalu byl hodnocen v randomizované, dvojitě zaslepené, pozitivní (moxifloxacin 400 mg) a placebem kontrolované zkřížené studii u zdravých mužů s pomalým metabolizmem CYP2D6. Celkem 120 zdravým subjektům byl podáván přípravek STRATTERA (20 mg a 60 mg) dvakrát denně po dobu 7 dnů. Ve studii nebyly pozorovány žádné velké změny v intervalu QTc (tj. zvýšení >60 ms od výchozí hodnoty, absolutní QTc >480 ms). Malé změny v QTc intervalu však nelze ze současné studie vyloučit, protože studie neprokázala citlivost testu. Došlo k mírnému prodloužení QTc intervalu se zvýšenou koncentrací atomoxetinu.
Farmakokinetika
Atomoxetin se po perorálním podání dobře vstřebává a je minimálně ovlivněn potravou. Je eliminován především oxidativním metabolismem prostřednictvím enzymatické dráhy cytochromu P450 2D6 (CYP2D6) a následnou glukuronidací. Atomoxetin má poločas asi 5 hodin. Zlomek populace (asi 7 % bělochů a 2 % Afroameričanů) jsou pomalí metabolizátoři (PM) léků metabolizovaných CYP2D6. Tito jedinci mají sníženou aktivitu v této dráze, což má za následek 10krát vyšší AUC, 5krát vyšší maximální plazmatické koncentrace a pomalejší eliminaci (plazmatický poločas asi 24 hodin) atomoxetinu ve srovnání s lidmi s normální aktivitou [extenzivní metabolizátoři (EM )]. Léky, které inhibují CYP2D6, jako je fluoxetin, paroxetin a chinidin, způsobují podobné zvýšení expozice.
Farmakokinetika atomoxetinu byla hodnocena u více než 400 dětí a dospívajících ve vybraných klinických studiích, především za použití populačních farmakokinetických studií. Individuální farmakokinetické údaje po jednorázové dávce a v ustáleném stavu byly získány také u dětí, dospívajících a dospělých. Když byly dávky normalizovány na mg/kg, byly u dětí, dospívajících a dospělých pozorovány podobné hodnoty poločasu, Cmax a AUC. Clearance a distribuční objem po úpravě podle tělesné hmotnosti byly také podobné.
Absorpce a distribuce
Atomoxetin se po perorálním podání rychle vstřebává, s absolutní biologickou dostupností asi 63 % u EM a 94 % u PM. Maximální plazmatické koncentrace (Cmax) je dosaženo přibližně za 1 až 2 hodiny po podání.
STRATTERA 18 mg lze podávat s jídlem nebo bez jídla. Podání přípravku STRATTERA se standardním jídlem s vysokým obsahem tuků u dospělých neovlivnilo rozsah perorální absorpce atomoxetinu (AUC), ale snížilo rychlost absorpce, což vedlo ke snížení Cmax o 37 % a zpoždění Tmax o 3 hodiny. V klinických studiích u dětí a dospívajících vedlo podávání přípravku STRATTERA s jídlem ke snížení Cmax o 9 %.
Distribuční objem v ustáleném stavu po intravenózním podání je 0,85 l/kg, což ukazuje, že atomoxetin se primárně distribuuje do celkové tělesné vody. Distribuční objem je podobný v celém rozsahu hmotnosti pacienta po normalizaci na tělesnou hmotnost.
V terapeutických koncentracích se 98 % atomoxetinu v plazmě váže na protein, především albumin.
Metabolismus A Eliminace
Atomoxetin je primárně metabolizován enzymatickou cestou CYP2D6. Lidé se sníženou aktivitou v této dráze (PM) mají vyšší plazmatické koncentrace atomoxetinu ve srovnání s lidmi s normální aktivitou (EM). U PM je AUC atomoxetinu přibližně 10krát větší a Css, max je přibližně 5krát větší než EM. K identifikaci PM CYP2D6 jsou k dispozici laboratorní testy. Současné podávání přípravku STRATTERA se silnými inhibitory CYP2D6, jako je fluoxetin, paroxetin nebo chinidin, vede k podstatnému zvýšení plazmatické expozice atomoxetinu a může být nutná úprava dávkování (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Atomoxetin neinhiboval ani neindukoval dráhu CYP2D6.
Hlavním vytvořeným oxidativním metabolitem, bez ohledu na stav CYP2D6, je 4-hydroxyatomoxetin, který je glukuronidován. 4-Hydroxyatomoxetin je jako inhibitor transportéru norepinefrinu ekvipotentní jako atomoxetin, ale v plazmě cirkuluje v mnohem nižších koncentracích (1 % koncentrace atomoxetinu v EM a 0,1 % koncentrace atomoxetinu v PM). 4-Hydroxyatomoxetin je primárně tvořen CYP2D6, ale u PM se 4-hydroxyatomoxetin tvoří pomaleji několika dalšími enzymy cytochromu P450. N-Desmethylatomoxetin je tvořen CYP2C19 a dalšími enzymy cytochromu P450, ale má podstatně menší farmakologickou aktivitu ve srovnání s atomoxetinem a cirkuluje v plazmě v nižších koncentracích (5 % koncentrace atomoxetinu u EM a 45 % koncentrace atomoxetinu u PM).
Průměrná zdánlivá plazmatická clearance atomoxetinu po perorálním podání u dospělých EM je 0,35 l/hod/kg a průměrný poločas je 5,2 hodiny. Po perorálním podání atomoxetinu PM je průměrná zdánlivá plazmatická clearance 0,03 l/hod/kg a průměrný poločas je 21,6 hodin. U PM je AUC atomoxetinu přibližně 10krát větší a Css, max je přibližně 5krát větší než EM. Eliminační poločas 4-hydroxyatomoxetinu je podobný jako u N-desmethylatomoxetinu (6 až 8 hodin) u subjektů s EM, zatímco poločas N-desmethylatomoxetinu je mnohem delší u subjektů s PM (34 až 40 hodin).
Atomoxetin se vylučuje primárně jako 4-hydroxyatomoxetin-O-glukuronid, hlavně močí (více než 80 % dávky) a v menší míře stolicí (méně než 17 % dávky). Pouze malá část dávky STRATTERA 40 mg je vylučována jako nezměněný atomoxetin (méně než 3 % dávky), což ukazuje na rozsáhlou biotransformaci.
[Vidět Použití u konkrétních populací ].
Klinické studie
Studie ADHD u dětí a dospívajících
Akutní studie
Účinnost přípravku STRATTERA 40 mg v léčbě ADHD byla stanovena ve 4 randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích u pediatrických pacientů (ve věku 6 až 18 let). Přibližně jedna třetina pacientů splnila kritéria DSM-IV pro nepozorný podtyp a dvě třetiny splnily kritéria pro nepozorný i hyperaktivní/impulzivní podtyp.
Známky a symptomy ADHD byly hodnoceny srovnáním průměrné změny od výchozí hodnoty k cílovému bodu u pacientů léčených přípravkem STRATTERA a placebem pomocí analýzy záměru léčby primárního výsledného měřítka, zkoušejícího podávala a skórovala hodnoticí stupnice ADHD-IV- Celkové skóre rodičovské verze (ADHDRS) včetně hyperaktivních/impulzivních a nepozorných subškál. Každá položka v ADHDRS mapuje přímo jedno kritérium symptomu pro ADHD v DSM-IV.
Ve studii 1, 8týdenní randomizované, dvojitě zaslepené, placebem kontrolované studii akutní léčby dětí a dospívajících ve věku 8 až 18 let (N=297), která odpovídala dávce, dostávali pacienti buď fixní dávku přípravku STRATTERA (0,5,5, 1,2 nebo 1,8 mg/kg/den) nebo placebo. STRATTERA 10 mg byl podáván jako rozdělená dávka brzy ráno a pozdě odpoledne/brzy večer. Při 2 vyšších dávkách bylo zlepšení symptomů ADHD statisticky významně lepší u pacientů léčených přípravkem STRATTERA ve srovnání s pacienty léčenými placebem, měřeno na škále ADHDRS. Dávka 1,8 mg/kg/den STRATTERA 25 mg neposkytla žádný další přínos oproti tomu, který byl pozorován u dávky 1,2 mg/kg/den. Dávka STRATTERA 0,5 mg/kg/den nebyla lepší než placebo.
Ve studii 2, 6týdenní randomizované, dvojitě zaslepené, placebem kontrolované studii akutní léčby dětí a dospívajících ve věku 6 až 16 let (N=171), pacienti dostávali buď přípravek STRATTERA 40 mg, nebo placebo. STRATTERA byl podáván v jedné dávce brzy ráno a titrován na základě hmotnosti podle klinické odpovědi až do maximální dávky 1,5 mg/kg/den. Průměrná konečná dávka přípravku STRATTERA 10 mg byla přibližně 1,3 mg/kg/den. Symptomy ADHD byly statisticky významně zlepšeny u přípravku STRATTERA ve srovnání s placebem, měřeno na škále ADHDRS. Tato studie ukazuje, že přípravek STRATTERA je účinný při podávání jednou denně ráno.
Ve 2 identických, 9týdenních, akutních, randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích u dětí ve věku 7 až 13 let (studie 3, N=147; studie 4, N=144), byly STRATTERA 40 mg a methylfenidát srovnávány s placebem . STRATTERA 18 mg byla podávána jako rozdělená dávka brzy ráno a pozdě odpoledne (po škole) a titrována na základě hmotnosti upravené podle klinické odpovědi. Maximální doporučená dávka STRATTERA byla 2,0 mg/kg/den. Průměrná konečná dávka přípravku STRATTERA 18 mg pro obě studie byla přibližně 1,6 mg/kg/den. V obou studiích se symptomy ADHD statisticky významně zlepšily více u přípravku STRATTERA 10 mg než u placeba, měřeno na stupnici ADHDRS.
Zkoumání populačních podskupin na základě pohlaví a věku (
Studie údržby
Účinnost přípravku STRATTERA 18 mg v udržovací léčbě ADHD byla stanovena v ambulantní studii u dětí a dospívajících (ve věku 6-15 let). Pacienti splňující kritéria DSM-IV pro ADHD, kteří vykazovali kontinuální odpověď po dobu přibližně 4 týdnů během úvodní 10týdenní otevřené fáze léčby přípravkem STRATTERA (1,2 až 1,8 mg/kg/den), byli randomizováni k pokračování ve své současné dávce přípravku STRATTERA (N =292) nebo na placebo (N=124) při dvojitě zaslepené léčbě pro pozorování relapsu. Odpověď během otevřené fáze byla definována jako skóre CGI-ADHD-S ≤2 a snížení celkového skóre ADHDRS-IV-Parent:Inv o alespoň 25 % oproti výchozí hodnotě. Pacienti, kteří byli přiřazeni k léčbě STRATTERA a vykazovali kontinuální odpověď po dobu přibližně 8 měsíců během první dvojitě zaslepené léčebné fáze, byli opět randomizováni k pokračování ve své současné dávce přípravku STRATTERA (N=81) nebo k placebu (N=82) ve dvojitě zaslepeném režimu léčba pro pozorování relapsu. Relaps během dvojitě zaslepené fáze byl definován jako zvýšení skóre CGI-ADHD-S alespoň o 2 od konce otevřené fáze a celkové skóre ADHDRS-IV-Parent:Inv se vrátí na ≥90 % vstupního skóre studie za 2 po sobě jdoucích návštěv. V obou dvojitě zaslepených fázích měli pacienti, kteří dostávali pokračující léčbu přípravkem STRATTERA, významně delší dobu do relapsu než pacienti, kteří dostávali placebo.
Studie ADHD u dospělých
Účinnost přípravku STRATTERA v léčbě ADHD byla stanovena ve 2 randomizovaných, dvojitě zaslepených, placebem kontrolovaných klinických studiích u dospělých pacientů ve věku 18 let a starších, kteří splnili kritéria DSM-IV pro ADHD.
Známky a symptomy ADHD byly hodnoceny pomocí vyšetřovatelem spravované Conners Adult ADHD Rating Scale Screening Version (CAARS), 30-položkové škály. Primárním měřítkem účinnosti bylo 18položkové celkové skóre symptomů ADHD (součet subškál nepozornosti a hyperaktivity/impulzivity z CAARS) hodnocené srovnáním průměrné změny od výchozí hodnoty k cílovému bodu pomocí analýzy záměrné léčby.
Ve 2 identických, 10týdenních, randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích akutní léčby (studie 5, N=280; studie 6, N=256) dostávali pacienti buď přípravek STRATTERA 25 mg, nebo placebo. STRATTERA byl podáván v rozdělených dávkách časně ráno a pozdě odpoledne/brzy večer a titrován podle klinické odpovědi v rozmezí 60 až 120 mg/den. Průměrná konečná dávka přípravku STRATTERA 40 mg pro obě studie byla přibližně 95 mg/den. V obou studiích se symptomy ADHD statisticky významně zlepšily u přípravku STRATTERA, jak bylo měřeno skóre symptomů ADHD ze škály CAARS.
Zkoumání podskupin populace na základě pohlaví a věku (
INFORMACE PRO PACIENTA
STRATTERA® (Stra-TAIR-a) (atomoxetin) tobolky
Než začnete vy nebo vaše dítě užívat přípravek STRATTERA®, přečtěte si Příručku o medikaci, která je dodávána se STRATTERA® a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tato příručka pro léky nenahrazuje rozhovor s lékařem o vaší léčbě nebo léčbě vašeho dítěte přípravkem STRATTERA.
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku STRATTERA 18 mg?
Při užívání přípravku STRATTERA byly hlášeny následující případy:
Děti a teenageři někdy uvažují o sebevraždě a mnozí hlásí, že se pokoušejí zabít. Výsledky klinických studií STRATTERA s více než 2200 dětskými nebo dospívajícími pacienty s ADHD naznačují, že některé děti a dospívající mohou mít vyšší šanci na sebevražedné myšlenky nebo činy. Přestože v těchto studiích nedošlo k žádné sebevraždě, u 4 z každých 1000 pacientů se rozvinuly sebevražedné myšlenky. Informujte lékaře svého dítěte nebo dospívajícího, pokud vaše dítě nebo dospívající (nebo má rodinnou anamnézu):
- trpí bipolární nemocí (manicko-depresivní nemoc)
- měl sebevražedné myšlenky nebo činy před zahájením léčby přípravkem STRATTERA
Šance na sebevražedné myšlenky a činy může být vyšší:
- brzy během léčby přípravkem STRATTERA 10 mg
- při úpravách dávky
Zabraňte sebevražedným myšlenkám a činům u vašeho dítěte nebo teenagera:
- věnovat zvýšenou pozornost náladám, chování, myšlenkám a pocitům vašeho dítěte nebo dospívajícího během léčby přípravkem STRATTERA 25 mg
- dodržujte všechny plánované návštěvy u lékaře vašeho dítěte nebo dospívajícího
Během léčby přípravkem STRATTERA 25 mg sledujte u svého dítěte nebo dospívajícího následující příznaky:
- úzkost
- míchání
- panický záchvat
- problémové spaní
- podrážděnost
- nepřátelství
- agresivita
- impulzivita
- neklid
- mánie
- Deprese
- sebevražedné myšlenky
Okamžitě zavolejte lékaře svého dítěte nebo teenagera, pokud mají některý z výše uvedených příznaků, zejména pokud jsou nové, náhlé nebo závažné. Možná bude nutné, aby vaše dítě nebo teenager byli pečlivě sledováni kvůli sebevražedným myšlenkám a činům nebo potřebují změnu medicíny.
STRATTERA může u některých pacientů způsobit poškození jater. Okamžitě zavolejte svého lékaře, pokud máte vy nebo vaše dítě následující příznaky jaterních problémů:
- svědění
- bolest v pravé horní části břicha
- tmavá moč
- žlutá kůže nebo oči
- nevysvětlitelné příznaky podobné chřipce
- náhlá smrt u pacientů, kteří mají srdeční problémy nebo srdeční vady
- mrtvice a srdeční infarkt u dospělých
- zvýšený krevní tlak a srdeční frekvence
Informujte svého lékaře, pokud máte vy nebo vaše dítě jakékoli srdeční problémy, srdeční vady, vysoký krevní tlak nebo se tyto problémy vyskytly v rodinné anamnéze. Váš lékař by měl před zahájením léčby přípravkem STRATTERA pečlivě zkontrolovat vás nebo vaše dítě, zda nemáte problémy se srdcem.
Váš lékař by měl během léčby přípravkem STRATTERA pravidelně kontrolovat váš krevní tlak nebo krevní tlak a srdeční frekvenci vašeho dítěte.
Okamžitě zavolejte svého lékaře, pokud máte vy nebo vaše dítě při užívání přípravku STRATTERA jakékoli známky srdečních problémů, jako je bolest na hrudi, dušnost nebo mdloby.
- nové psychotické příznaky (jako je slyšení hlasů, přesvědčení o věcech, které nejsou pravdivé, podezření) nebo nové manické příznaky
Okamžitě zavolejte lékaře svého dítěte nebo teenagera o jakýchkoli nových duševních příznacích protože může být nutné zvážit úpravu nebo ukončení léčby přípravkem STRATTERA 40 mg.
Co je STRATTERA 18 mg?
STRATTERA je selektivní inhibitor zpětného vychytávání norepinefrinu. Používá se k léčbě poruchy pozornosti a hyperaktivity (ADHD). STRATTERA může pomoci zvýšit pozornost a snížit impulzivitu a hyperaktivitu u pacientů s ADHD.
STRATTERA 10 mg by se měl používat jako součást celkového léčebného programu pro ADHD, který může zahrnovat poradenství nebo jiné terapie.
STRATTERA nebyl studován u dětí mladších 6 let.
Kdo by neměl užívat přípravek STRATTERA?
STRATTERA byste neměli užívat, pokud Vy nebo Vaše dítě:
- užíváte nebo jste v posledních 14 dnech užívali antidepresivní lék nazývaný inhibitor monoaminooxidázy nebo MAOI. Některé názvy léků s MAOI jsou Nardil® (fenelzin sulfát), Parnate® (tranylcypromin sulfát) a Emsam® (selegilinový transdermální systém).
- máte oční problém nazývaný glaukom s úzkým úhlem
- jsou alergičtí na cokoli ve STRATTERA. Úplný seznam složek najdete na konci této Příručky pro léky.
- máte nebo jste měli vzácný nádor nazývaný feochromocytom.
STRATTERA nemusí být pro vás nebo vaše dítě to pravé. Před zahájením léčby přípravkem STRATTERA informujte svého lékaře nebo lékaře svého dítěte o všech zdravotních stavech (nebo rodinné anamnéze), včetně:
- máte nebo jste měli sebevražedné myšlenky nebo činy
- srdeční problémy, srdeční vady, nepravidelný srdeční tep, vysoký krevní tlak nebo nízký krevní tlak
- duševní problémy, psychóza, mánie, bipolární onemocnění nebo deprese
- problémy s játry Informujte svého lékaře, pokud jste Vy nebo Vaše dítě těhotná, plánujete otěhotnět nebo kojíte.
Lze STRATTERA užívat s jinými léky?
Informujte svého lékaře o všech lécích, které vy nebo vaše dítě užíváte, včetně léků na předpis a bez předpisu, vitamínů a bylinných doplňků. STRATTERA a některé léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky. Váš lékař rozhodne, zda lze přípravek STRATTERA užívat s jinými léky.
Zvláště informujte svého lékaře, pokud Vy nebo Vaše dítě užíváte:
- léky na astma
- léky proti depresi včetně IMAO
- léky na krevní tlak
- léky proti nachlazení nebo alergii, které obsahují dekongestanty
Znát léky, které vy nebo vaše dítě užíváte. Mějte u sebe seznam svých léků, abyste je mohli ukázat svému lékaři a lékárníkovi.
Nezačínejte během užívání přípravku STRATTERA žádný nový lék, aniž byste se nejprve poradil(a) se svým lékařem.
Jak se má STRATTERA užívat?
- Užívejte STRATTERA 40 mg přesně podle předpisu. STRATTERA 18 mg se dodává v tobolkách s různou dávkou síly. Váš lékař může upravit dávku, dokud nebude vhodná pro vás nebo vaše dítě.
- Tobolky nežvýkejte, nedrťte ani neotevírejte. Tobolky STRATTERA spolkněte celé a zapijte vodou nebo jinou tekutinou. Informujte svého lékaře, pokud Vy nebo Vaše dítě nemůžete spolknout STRATTERA 10 mg vcelku. Může být nutné předepsat jiný lék.
- Nedotýkejte se rozbité tobolky STRATTERA 18 mg. Umyjte si ruce a povrchy, které se dotkly otevřené tobolky STRATTERA 10 mg. Pokud se vám některý prášek dostane do očí nebo očí vašeho dítěte, ihned je vypláchněte vodou a zavolejte svého lékaře.
- STRATTERA lze užívat s jídlem nebo bez jídla.
- STRATTERA 10 mg se obvykle užívá jednou nebo dvakrát denně. Užívejte STRATTERA 25 mg každý den ve stejnou dobu, abyste si to zapamatovali. Pokud vynecháte dávku přípravku STRATTERA, vezměte si ji, jakmile si ten den vzpomenete. Pokud vynecháte jeden den STRATTERA 10 mg, nezdvojnásobujte svou dávku následující den. Vynechejte den, který jste vynechali.
- Čas od času může Váš lékař léčbu přípravkem STRATTERA 25 mg na chvíli přerušit, aby zkontroloval příznaky ADHD.
- Váš lékař může během užívání přípravku STRATTERA pravidelně kontrolovat krev, srdce a krevní tlak. Během užívání přípravku STRATTERA by dětem měla být často kontrolována jejich výška a hmotnost. Léčba přípravkem STRATTERA může být ukončena, pokud je během těchto kontrol zjištěn problém.
- Pokud vy nebo vaše dítě užijete příliš mnoho přípravku STRATTERA nebo se předávkujete, okamžitě zavolejte svého lékaře nebo toxikologické centrum nebo vyhledejte pohotovostní léčbu.
Jaké jsou možné vedlejší účinky přípravku STRATTERA?
Vidět Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku STRATTERA 10 mg? informace o hlášených sebevražedných myšlenkách a činech, jiných duševních problémech, vážném poškození jater a srdečních problémech.
Mezi další závažné nežádoucí účinky patří:
- závažné alergické reakce (zavolejte svého lékaře, pokud máte potíže s dýcháním, vidíte otoky nebo kopřivku nebo máte jiné alergické reakce)
- zpomalení růstu (výšky a hmotnosti) u dětí
- problémy s močením včetně
- potíže se spuštěním nebo udržením proudu moči
- nemůže úplně vyprázdnit močový měchýř
Časté nežádoucí účinky u dětí a dospívajících zahrnují:
- žaludeční nevolnost
- snížená chuť k jídlu
- nevolnost nebo zvracení
- závrať
- únava
- změny nálady
Mezi časté nežádoucí účinky u dospělých patří:
- zácpa
- suchá ústa
- nevolnost
- snížená chuť k jídlu
- závrať
- sexuální vedlejší účinky
- problémy s močením
Další informace pro děti, mládež a dospělé:
- Erekce, které nezmizí (priapismus), se během léčby přípravkem STRATTERA vyskytly vzácně. Pokud máte erekci, která trvá déle než 4 hodiny, okamžitě vyhledejte lékařskou pomoc. Vzhledem k možnosti trvalého poškození, včetně možné neschopnosti dosáhnout erekce, by měl být priapismus okamžitě vyhodnocen lékařem.
- STRATTERA 10 mg může ovlivnit vaši schopnost nebo schopnost vašeho dítěte řídit nebo obsluhovat těžké stroje. Buďte opatrní, dokud nezjistíte, jak STRATTERA 25 mg ovlivňuje vás nebo vaše dítě.
- Poraďte se se svým lékařem, pokud máte vy nebo vaše dítě nežádoucí účinky, které jsou obtěžující nebo nepřecházejí.
Toto není úplný seznam možných vedlejších účinků. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám STRATTERA uchovávat?
- Skladujte STRATTERA na bezpečném místě při pokojové teplotě, 59 až 86 °F (15 až 30 °C).
- Uchovávejte STRATTERA 40 mg a všechny léky mimo dosah dětí.
Obecné informace o STRATTERA
Léky jsou někdy předepisovány pro jiné účely, než jsou ty, které jsou uvedeny v Průvodci léčivy. Nepoužívejte STRATTERA 25 mg pro stav, pro který nebyl předepsán. Nedávejte STRATTERA jiným lidem, i když mají stejný stav. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o přípravku STRATTERA. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku STRATTERA, který byl napsán pro zdravotnické pracovníky. Pro více informací o STRATTERA volejte 1-800-Lilly-Rx (1-800-545-5979) nebo navštivte www.strattera.com.
Jaké jsou složky přípravku STRATTERA 40 mg?
Aktivní složka: atomoxetin hydrochlorid.
Neaktivní složky: předželatinovaný škrob, dimethikon, želatina, laurylsulfát sodný, FD&CBlue č. 2, syntetický žlutý oxid železitý, oxid titaničitý, červený oxid železitý a jedlý černý inkoust.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
