Copegus 100mg Ribavirin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Copegus 100 mg a jak se používá?
Copegus 100 mg je lék na předpis používaný k léčbě příznaků chronické hepatitidy C. Copegus 100 mg lze užívat samostatně nebo s jinými léky.
Copegus patří do třídy léků nazývaných agenti hepatitidy B/hepatitidy C; Agenti RSV.
Jaké jsou možné vedlejší účinky přípravku Copegus?
Copegus může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- problémy se zrakem,
- silná bolest v horní části žaludku šířící se do zad,
- nevolnost,
- zvracení,
- průjem,
- nový nebo zhoršující se kašel,
- horečka,
- bodavá bolest na hrudi,
- sípání,
- dušnost,
- těžká deprese,
- myšlenky na sebepoškozování nebo ubližování někomu jinému,
- bledá nebo zažloutlá kůže,
- tmavě zbarvená moč,
- zmatek,
- slabost,
- zimnice,
- příznaky podobné chřipce,
- oteklé dásně,
- vředy v ústech,
- kožní vředy,
- snadná tvorba modřin,
- neobvyklé krvácení a
- točení hlavy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Copegus patří:
- nevolnost,
- zvracení,
- ztráta chuti k jídlu,
- horečka,
- zimnice nebo třes,
- nízký počet krvinek,
- anémie,
- slabost,
- únava,
- bolest hlavy,
- bolest svalů,
- změny nálady,
- úzkost a
- podrážděnost
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Copegus. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
RIZIKO VÁŽNÝCH PORUCH A ÚČINKŮ SPOJENÝCH S RIBAVIRINEM
Monoterapie COPEGUS (ribavirin) není účinná pro léčbu chronické infekce virem hepatitidy C a neměla by být pro tuto indikaci používána samostatně.
Primární klinickou toxicitou ribavirinu je hemolytická anémie. Anémie spojená s léčbou ribavirinem může vést ke zhoršení srdečního onemocnění a vést k fatálním a nefatálním infarktům myokardu. Pacienti s anamnézou významného nebo nestabilního srdečního onemocnění by neměli být léčeni přípravkem COPEGUS (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ, NEŽÁDOUCÍ ÚČINKY A DÁVKOVÁNÍ A PODÁVÁNÍ ).
všech druhů zvířat vystavených ribavirinu byly prokázány významné teratogenní a/nebo embryocidní účinky. Kromě toho má ribavirin vícedávkový poločas 12 dnů a může přetrvávat v neplazmatických kompartmentech po dobu až 6 měsíců. Proto je ribavirin, včetně přípravku COPEGUS 100 mg, kontraindikován u těhotných žen a u mužských partnerů těhotných žen. Je třeba dbát mimořádné opatrnosti, aby nedošlo k otěhotnění během léčby a 6 měsíců po jejím ukončení jak u pacientek, tak u partnerek mužů, kteří užívají ribavirin. Během léčby a během 6měsíčního období sledování po léčbě musí být používány alespoň dvě spolehlivé formy účinné antikoncepce (viz KONTRAINDIKACE, VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a použití u specifických populací ).
POPIS
COPEGUS 100 mg, ribavirin, je nukleosidový analog s antivirovou aktivitou. Chemický název ribavirinu je 1-β-Dribofuranosyl-1H-1,2,4-triazol-3-karboxamid a má následující strukturní vzorec:
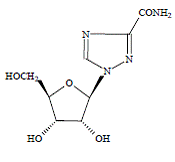
Empirický vzorec ribavirinu je C8H12N4O5 a molekulová hmotnost je 244,2. Ribavirin je bílý až téměř bílý prášek. Je volně rozpustný ve vodě a mírně rozpustný v bezvodém alkoholu.
COPEGUS (ribavirin) je dostupný ve formě světle růžové až růžové, ploché, oválné, potahované tablety pro perorální podání. Každá tableta obsahuje 200 mg ribavirinu a následující neaktivní složky: předbobtnalý škrob, mikrokrystalická celulóza, sodná sůl glykolátu škrobu, kukuřičný škrob a stearát hořečnatý. Potah tablety obsahuje Chromatone-P nebo Opadry Pink (vyrobené za použití hydroxypropylmethylcelulózy, mastku, oxidu titaničitého, syntetického žlutého oxidu železitého a syntetického červeného oxidu železitého), ethylcelulózy (ECD-30) a triacetinu.
INDIKACE
COPEGUS 100 mg v kombinaci s PEGASYS (peginterferon alfa-2a) je indikován k léčbě pacientů ve věku 5 let a starších s chronickou infekcí virem hepatitidy C (CHC), kteří mají kompenzované onemocnění jater a nebyli dříve léčeni interferonem alfa.
Při zahájení kombinované léčby přípravkem COPEGUS 100 mg s PEGASYSem je třeba vzít v úvahu následující body:
- Tato indikace je založena na klinických studiích kombinované terapie u pacientů s CHC a kompenzovaným onemocněním jater, z nichž někteří měli histologicky průkaz cirhózy (Child-Pugh třída A), a u dospělých pacientů s klinicky stabilním onemocněním HIV a počtem CD4 vyšším než 100 buněk/mm³.
- Tato indikace je založena na dosažení nedetekovatelné HCV RNA po léčbě po dobu 24 nebo 48 týdnů na základě genotypu HCV a udržení trvalé virologické odpovědi (SVR) 24 týdnů po poslední dávce.
- Údaje o bezpečnosti a účinnosti nejsou k dispozici pro léčbu delší než 48 týdnů.
- Bezpečnost a účinnost léčby přípravkem COPEGUS 100 mg a PEGASYSem nebyla stanovena u příjemců transplantovaných jater nebo jiných orgánů, pacientů s dekompenzovaným onemocněním jater nebo u pacientů, kteří dříve nereagovali na léčbu interferonem.
- Bezpečnost a účinnost léčby přípravkem COPEGUS pro léčbu adenovirových, RSV, parainfluenzy nebo chřipkových infekcí nebyla stanovena. COPEGUS by se v těchto indikacích neměl používat. Ribavirin pro inhalaci má samostatnou příbalovou informaci, kterou je třeba konzultovat, pokud se zvažuje inhalační léčba ribavirinem.
DÁVKOVÁNÍ A PODÁVÁNÍ
COPEGUS 100 mg se má užívat s jídlem. COPEGUS by měl být podáván v kombinaci s PEGASYS; je důležité si uvědomit, že COPEGUS 100 mg by nikdy neměl být podáván jako monoterapie. Vidět Příbalový leták PEGASYS pro všechny pokyny týkající se dávkování a podávání PEGASYS.
Chronická monoinfekce hepatitidy C
Dospělí pacienti
Doporučená dávka přípravku COPEGUS 100 mg tablety je uvedena v tabulce 1. Doporučená délka léčby u pacientů, kteří dříve neléčili ribavirin a interferon, je 24 až 48 týdnů.
Denní dávka přípravku COPEGUS 100 mg je 800 mg až 1200 mg podávaná perorálně ve dvou dílčích dávkách. Dávka by měla být individuální pro pacienta v závislosti na výchozích charakteristikách onemocnění (např. genotyp), odpovědi na terapii a snášenlivosti režimu (viz ).
Pediatričtí pacienti
PEGASYS se podává jako 180 mcg/1,73 m² x BSA jednou týdně subkutánně, do maximální dávky 180 mcg, a měl by být podáván v kombinaci s ribavirinem. Doporučená délka léčby u pacientů s genotypem 2 nebo 3 je 24 týdnů au ostatních genotypů 48 týdnů.
COPEGUS by měl být podáván v kombinaci s PEGASYSem. COPEGUS 100 mg je dostupný pouze jako 200 mg tableta, a proto by měl poskytovatel zdravotní péče určit, zda tuto tabletu může dětský pacient spolknout. Doporučené dávky pro COPEGUS jsou uvedeny v tabulce 2. Pacienti, kteří zahájí léčbu před svými 18. narozeninami, by měli po dokončení terapie pokračovat v pediatrickém dávkování.
Chronická hepatitida C s HIV koinfekcí
Dospělí pacienti
Doporučená dávka pro léčbu chronické hepatitidy C u pacientů koinfikovaných HIV je PEGASYS 180 mcg subkutánně jednou týdně a COPEGUS 800 mg perorálně denně po celkovou dobu 48 týdnů, bez ohledu na genotyp HCV.
Modifikace dávky
Dospělí a dětští pacienti
Pokud se během kombinované léčby přípravkem COPEGUS/PEGASYS vyvinou závažné nežádoucí účinky nebo laboratorní abnormality, je třeba dávku upravit nebo přerušit, pokud je to vhodné, dokud nežádoucí účinky nezmizí nebo se jejich závažnost nesníží. Pokud intolerance přetrvává i po úpravě dávky, je třeba léčbu přípravkem COPEGUS/PEGASYS přerušit. Tabulka 3 uvádí pokyny pro úpravy dávky a vysazení na základě koncentrace hemoglobinu pacienta a stavu srdce.
COPEGUS 100 mg by měl být podáván s opatrností pacientům s již existujícím srdečním onemocněním. Pacienti by měli být vyšetřeni před zahájením léčby a během léčby by měli být náležitě sledováni. Pokud dojde ke zhoršení kardiovaskulárního stavu, léčba by měla být ukončena [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pokyny pro úpravy dávky přípravku COPEGUS 100 mg uvedené v této tabulce platí také pro laboratorní abnormality nebo nežádoucí účinky jiné než pokles hodnot hemoglobinu.
Dospělí pacienti
Jakmile byla dávka COPEGUS 100 mg vysazena z důvodu laboratorní abnormality nebo klinické nežádoucí reakce, lze se pokusit znovu zahájit podávání COPEGUS 100 mg na 600 mg denně a dále zvýšit dávku na 800 mg denně. Nedoporučuje se však zvyšovat COPEGUS na původní přidělenou dávku (1000 mg až 1200 mg).
Pediatričtí pacienti
Po vyřešení laboratorní abnormality nebo klinické nežádoucí reakce je možné zkusit zvýšit dávku COPEGUS 100 mg na původní dávku v závislosti na úsudku lékaře. Pokud byl COPEGUS vysazen z důvodu laboratorní abnormality nebo klinické nežádoucí reakce, lze se pokusit znovu zahájit léčbu přípravkem COPEGUS 100 mg v poloviční plné dávce.
Renální poškození
Celková denní dávka přípravku COPEGUS by měla být snížena u pacientů s clearance kreatininu nižší nebo rovnou 50 ml/min; a týdenní dávka PEGASYS by měla být snížena pro clearance kreatininu nižší než 30 ml/min, jak je uvedeno v tabulce 4 [viz Použití u konkrétních populací , Farmakokinetika , a Příbalový leták PEGASYS ].
pacientů s poruchou funkce ledvin by dávka přípravku COPEGUS 100 mg neměla být dále upravována. Pokud se vyvinou závažné nežádoucí účinky nebo laboratorní abnormality, je třeba léčbu přípravkem COPEGUS přerušit, pokud je to vhodné, dokud nežádoucí účinky nezmizí nebo se jejich závažnost nesníží. Pokud intolerance přetrvává i po opětovném zahájení léčby přípravkem COPEGUS 100 mg, léčba přípravkem COPEGUS/PEGASYS by měla být přerušena.
Nejsou k dispozici žádné údaje pro pediatrické subjekty s poruchou funkce ledvin.
Přerušení dávkování
Přerušení léčby PEGASYS/COPEGUS 100 mg by mělo být zváženo, pokud se u pacienta nepodařilo prokázat snížení HCV RNA alespoň o 2 log10 oproti výchozí hodnotě do 12 týdnů léčby nebo pokud po 24 týdnech léčby nebyly zjištěny hladiny HCV RNA.
Léčba přípravkem PEGASYS/COPEGUS 100 mg by měla být přerušena u pacientů, u kterých se během léčby rozvine jaterní dekompenzace (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
JAK DODÁVÁNO
Dávkové formy A Síly
COPEGUS (ribavirin) je dostupný ve formě světle růžové až růžové, ploché, oválné, potahované tablety pro perorální podání. Jedna tableta obsahuje 200 mg ribavirinu.
COPEGUS® (ribavirin) je dostupný ve formě tablet pro perorální podání. Jedna tableta obsahuje 200 mg ribavirinu a je světle růžové až růžové, ploché, oválného tvaru, potažené filmem, s vyraženým RIB 200 na jedné straně a ROCHE na druhé straně. Jsou baleny jako lahvička po 168 tabletách ( NDC 0004-0086-94).
Skladování A Manipulace
Uchovávejte lahvičku COPEGUS®Tablets při teplotě 25 °C (77 °F); výlety jsou povoleny mezi 15°C a 30°C (59°F a 86°F) [viz USP řízená pokojová teplota ]. Uchovávejte lahvičku těsně uzavřenou.
Výrobce: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Člen Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990. Revize: srpen 2015
VEDLEJŠÍ EFEKTY
PEGASYS v kombinaci s COPEGUS způsobuje širokou škálu závažných nežádoucích reakcí [viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Mezi nejčastější závažné nebo život ohrožující nežádoucí reakce vyvolané nebo zhoršené přípravkem COPEGUS/PEGASYS patří deprese, sebevražda, relaps zneužívání drog/předávkování a bakteriální infekce, z nichž každý se vyskytuje s frekvencí nižší než 1 %. K jaterní dekompenzaci došlo u 2 % (10/574) pacientů s CHC/HIV [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Dospělí pacienti
V klíčových registračních studiích NV15801 a NV15942 dostávalo 886 pacientů COPEGUS po dobu 48 týdnů v dávkách 1000/1200 mg na základě tělesné hmotnosti. V těchto studiích se jeden nebo více závažných nežádoucích účinků objevilo u 10 % subjektů s monoinfikovanou CHC a u 19 % subjektů s CHC/HIV, kterým byl podáván PEGASYS samotný nebo v kombinaci s přípravkem COPEGUS. Nejčastějším závažným nežádoucím účinkem (3 % u CHC a 5 % u CHC/HIV) byla bakteriální infekce (např. sepse, osteomyelitida, endokarditida, pyelonefritida, pneumonie).
Další závažné nežádoucí účinky se vyskytly s frekvencí nižší než 1 % a zahrnovaly: sebevraždu, sebevražedné myšlenky, psychózu, agresi, úzkost, zneužívání drog a předávkování drogami, anginu pectoris, jaterní dysfunkci, ztučnění jater, cholangitidu, arytmii, diabetes mellitus, autoimunitní jevy (např. hypertyreóza, hypotyreóza, sarkoidóza, systémový lupus erythematodes, revmatoidní artritida), periferní neuropatie, aplastická anémie, peptický vřed, gastrointestinální krvácení, pankreatitida, kolitida, vřed rohovky, plicní embolie, kóma, myositida, mozková trombocytopura, trombocytopura, trombocytopura psychotické poruchy a halucinace.
Procento pacientů v klinických studiích, kteří zaznamenali jeden nebo více nežádoucích účinků, bylo 98 %. Nejčastěji hlášenými nežádoucími účinky byly psychiatrické reakce, včetně deprese, nespavosti, podrážděnosti, úzkosti a příznaků podobných chřipce, jako je únava, pyrexie, myalgie, bolest hlavy a ztuhlost. Další časté reakce byly anorexie, nauzea a zvracení, průjem, artralgie, reakce v místě vpichu, alopecie a pruritus.
ukazuje četnost nežádoucích účinků vyskytujících se u více než nebo rovné 5 % subjektů užívajících kombinovanou terapii pegylovaným interferonem a ribavirinem v klinické studii CHC, NV15801.
Deset procent pacientů monoinfikovaných CHC, kteří dostávali 48týdenní léčbu přípravkem PEGASYS v kombinaci s přípravkem COPEGUS 100 mg, přerušilo léčbu; 16 % pacientů koinfikovaných CHC/HIV léčbu ukončilo. Nejčastějšími důvody pro přerušení léčby byly psychiatrické, chřipce podobný syndrom (např. letargie, únava, bolest hlavy), dermatologické a gastrointestinální poruchy a laboratorní abnormality (trombocytopenie, neutropenie a anémie).
Celkově 39 % pacientů s CHC nebo CHC/HIV vyžadovalo úpravu terapie PEGASYS a/nebo COPEGUS. Nejčastějším důvodem pro úpravu dávky PEGASYSu u pacientů s CHC a CHC/HIV byly laboratorní abnormality; neutropenie (20 %, resp. 27 %) a trombocytopenie (4 %, resp. 6 %). Nejčastějším důvodem pro úpravu dávky přípravku COPEGUS u pacientů s CHC a CHC/HIV byla anémie (22 %, resp. 16 %).
Dávka PEGASYS byla snížena u 12 % pacientů užívajících 1000 mg až 1200 mg COPEGUS 100 mg po dobu 48 týdnů a u 7 % pacientů užívajících 800 mg COPEGUS po 24 týdnů. Dávka přípravku COPEGUS byla snížena u 21 % pacientů užívajících 1000 mg až 1200 mg COPEGUS 100 mg po dobu 48 týdnů a u 12 % pacientů užívajících 800 mg COPEGUS 100 mg po dobu 24 týdnů.
U pacientů s monoinfikovanou chronickou hepatitidou C léčených po dobu 24 týdnů přípravkem PEGASYS a 800 mg COPEGUS 100 mg byl pozorován nižší výskyt závažných nežádoucích účinků (3 % vs. 10 %), hemoglobin nižší než 10 g/dl (3 % vs. 15 %) úprava dávky PEGASYS (30 % vs. 36 %) a COPEGUS (19 % vs. 38 %) a vysazení léčby (5 % vs. 15 %) ve srovnání s pacienty léčenými po dobu 48 týdnů přípravkem PEGASYS a 1000 mg resp. 1200 mg COPEGUS. Na druhé straně se zdálo, že celkový výskyt nežádoucích účinků byl ve dvou léčebných skupinách podobný.
Pediatričtí pacienti
klinické studii se 114 pediatrickými subjekty (ve věku 5 až 17 let) léčenými samotným PEGASYSem nebo v kombinaci s přípravkem COPEGUS 100 mg byly nutné úpravy dávky přibližně u jedné třetiny subjektů, nejčastěji pro neutropenii a anémii. Obecně byl bezpečnostní profil pozorovaný u pediatrických subjektů podobný jako u dospělých. V pediatrické studii byly nejčastějšími nežádoucími účinky u subjektů léčených kombinovanou terapií PEGASYS a COPEGUS 100 mg po dobu až 48 týdnů onemocnění podobné chřipce (91 %), infekce horních cest dýchacích (60 %), bolest hlavy (64 %), gastrointestinální poruchy (56 %), kožní poruchy (47 %) a reakce v místě vpichu (45 %). Sedm subjektů užívajících kombinovanou léčbu PEGASYS a COPEGUS po dobu 48 týdnů přerušilo léčbu z bezpečnostních důvodů (deprese, abnormální psychiatrické hodnocení, přechodná slepota, retinální exsudáty, hyperglykémie, diabetes mellitus 1. typu a anémie). Závažné nežádoucí účinky byly hlášeny u 2 subjektů ve skupině kombinované terapie PEGASYS plus COPEGUS 100 mg (hyperglykémie a cholecystektomie).
pediatrických subjektů randomizovaných na kombinovanou léčbu byla incidence většiny nežádoucích účinků podobná po celou dobu léčby (až 48 týdnů plus 24 týdnů následného sledování) ve srovnání s prvními 24 týdny a zvýšila se jen mírně u bolesti hlavy, gastrointestinálních poruch , podrážděnost a vyrážka. Většina nežádoucích účinků se objevila během prvních 24 týdnů léčby.
Inhibice růstu u pediatrických subjektů
[vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pediatričtí jedinci léčení kombinovanou terapií PEGASYS plus ribavirin vykazovali zpoždění nárůstu hmotnosti a výšky až po 48 týdnech léčby ve srovnání s výchozí hodnotou. Jak hmotnost pro věk a výšku pro věkové z-skóre, tak i percentily normativní populace pro hmotnost a výšku subjektu se během léčby snížily. Na konci 2letého sledování po léčbě se většina subjektů vrátila k výchozím percentilům normativní křivky pro hmotnost (64. průměrný percentil na začátku, 60. průměrný percentil za 2 roky po léčbě) a výšku (54. průměrný percentil na začátku, 56. průměrný percentil 2 roky po léčbě). Na konci léčby zaznamenalo 43 % (23 z 53) subjektů pokles percentilu hmotnosti o více než 15 percentilů a 25 % (13 z 53) zaznamenalo pokles percentilu výšky o více než 15 percentilů na normativních růstových křivkách. Po 2 letech po léčbě bylo 16 % (6 z 38) subjektů více než 15 percentilů pod svou výchozí křivkou hmotnosti a 11 % (4 z 38) bylo více než 15 percentilů pod výchozí křivkou výšky.
38 ze 114 subjektů se zapsalo do dlouhodobé následné studie, která trvala až 6 let po léčbě. U většiny subjektů bylo obnovení růstu po léčbě 2 roky po léčbě zachováno až do 6 let po léčbě.
Časté nežádoucí účinky u CHC s koinfekcí HIV (dospělí)
Profil nežádoucích účinků u koinfikovaných pacientů léčených přípravkem PEGASYS/COPEGUS ve studii NR15961 byl obecně podobný profilu u monoinfikovaných pacientů ve studii NV15801 (tabulka 5). Častější příhody u koinfikovaných pacientů byly neutropenie (40 %), anémie (14 %), trombocytopenie (8 %), snížení hmotnosti (16 %) a změny nálady (9 %).
Abnormality laboratorních testů
Dospělí pacienti
Anémie způsobená hemolýzou je nejvýznamnější toxicitou léčby ribavirinem. Anémie (hemoglobin nižší než 10 g/dl) byla v klinických studiích pozorována u 13 % všech pacientů léčených kombinací COPEGUS a PEGASYS. Maximální pokles hemoglobinu nastal během prvních 8 týdnů od zahájení léčby ribavirinem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pediatričtí pacienti
Snížení hemoglobinu, neutrofilů a krevních destiček může vyžadovat snížení dávky nebo trvalé přerušení léčby (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Většina laboratorních abnormalit zaznamenaných během klinické studie se vrátila na výchozí hodnoty krátce po ukončení léčby.
U pacientů randomizovaných na kombinovanou léčbu se výskyt abnormalit během celé fáze léčby (až 48 týdnů plus 24týdenní sledování) ve srovnání s prvními 24 týdny mírně zvýšil u neutrofilů mezi 500 a 1 000 buňkami/mm³ a hodnoty hemoglobinu mezi 8,5 a 10 g/dl. Většina hematologických abnormalit se objevila během prvních 24 týdnů léčby.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly identifikovány a hlášeny během užívání kombinované terapie PEGASYS/COPEGUS 100 mg po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému
Čistá aplazie červených krvinek
Poruchy ucha a labyrintu
Porucha sluchu, ztráta sluchu
Oční poruchy
Serózní odchlípení sítnice
Poruchy imunity
Rejekce jaterního a renálního štěpu
Poruchy metabolismu a výživy
Dehydratace
Poruchy kůže a podkožní tkáně
Stevens-Johnsonův syndrom (SJS)
Toxická epidermální nekrolýza (TEN)
DROGOVÉ INTERAKCE
Výsledky z farmakokinetické dílčí studie neprokázaly žádnou farmakokinetickou interakci mezi PEGASYS (peginterferon alfa-2a) a ribavirinem.
Nukleosidové inhibitory reverzní transkriptázy (NRTI)
Údaje in vitro naznačují, že ribavirin snižuje fosforylaci lamivudinu, stavudinu a zidovudinu. Nebyly však pozorovány žádné farmakokinetické (např. plazmatické koncentrace nebo intracelulární koncentrace trifosforylovaného aktivního metabolitu) nebo farmakodynamické (např. ztráta virologické suprese HIV/HCV) interakce, když ribavirin a lamivudin (n=18), stavudin (n=10) nebo zidovudin (n=6) byl souběžně podáván jako součást vícelékového režimu pacientům koinfikovaným HCV/HIV.
Ve studii NR15961 u pacientů s cirhózou koinfikovaných CHC/HIV, kteří dostávali NRTI, byly pozorovány případy jaterní dekompenzace (některé fatální) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pacienti užívající PEGASYS/COPEGUS 100 mg a NRTI by měli být pečlivě sledováni z hlediska toxicity souvisejících s léčbou. Lékaři by se měli obrátit na informace o předepisování příslušných NRTI, kde jsou pokyny týkající se řízení toxicity. Kromě toho je třeba zvážit snížení dávky nebo vysazení přípravku PEGASYS, COPEGUS 100 mg nebo obou, pokud je pozorována zhoršující se toxicita, včetně jaterní dekompenzace (např. Child-Pugh větší nebo roven 6) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ].
didanosin
Současné podávání přípravku COPEGUS a didanosinu je kontraindikováno. Koncentrace didanosinu nebo jeho aktivního metabolitu (dideoxyadenosin-5'-trifosfátu) jsou při současném podávání didanosinu s ribavirinem zvýšené, což může způsobit nebo zhoršit klinickou toxicitu. V klinických studiích byly hlášeny zprávy o fatálním selhání jater, stejně jako periferní neuropatie, pankreatitida a symptomatická hyperlaktatémie/laktátová acidóza (viz KONTRAINDIKACE ].
zidovudin
Ve studii NR15961 se u pacientů, kterým byl podáván zidovudin v kombinaci s PEGASYS/COPEGUS, rozvinula těžká neutropenie (ANC méně než 500) a těžká anémie (hemoglobin méně než 8 g/dl) častěji než podobní pacienti, kteří zidovudin neužívali (neutropenie 15 % vs. 9 %) (anémie 5 % vs. 1 %). Vysazení zidovudinu by mělo být považováno za lékařsky vhodné.
Léky metabolizované cytochromem P450
Studie in vitro ukazují, že ribavirin neinhibuje CYP 2C9, CYP 2C19, CYP 2D6 nebo CYP 3A4.
azathioprin
Bylo hlášeno, že použití ribavirinu k léčbě chronické hepatitidy C u pacientů užívajících azathioprin vyvolává těžkou pancytopenii a může zvýšit riziko myelotoxicity související s azathioprinem. Inosinmonofosfátdehydrogenáza (IMDH) je nezbytná pro jednu z metabolických drah azathioprinu. Je známo, že ribavirin inhibuje IMDH, což vede k akumulaci metabolitu azathioprinu, 6-methylthioinosinmonofosfátu (6-MTITP), který je spojen s myelotoxicitou (neutropenie, trombocytopenie a anémie). Pacienti, kteří dostávají azathioprin s ribavirinem, by měli mít kompletní krevní obraz, včetně počtu krevních destiček, monitorovaný první měsíc týdně, druhý a třetí měsíc léčby dvakrát měsíčně a poté měsíčně nebo častěji, pokud jsou nutné změny dávkování nebo jiné změny léčby (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Mezi významné nežádoucí účinky spojené s kombinovanou terapií COPEGUS/PEGASYS patří závažná deprese a sebevražedné myšlenky, hemolytická anémie, suprese funkce kostní dřeně, autoimunitní a infekční poruchy, oftalmologické poruchy, cerebrovaskulární poruchy, plicní dysfunkce, kolitida, pankreatitida a diabetes.
Před zahájením kombinované léčby by měl být celý příbalový leták PEGASYS zkontrolován pro další bezpečnostní informace.
Těhotenství
COPEGUS 100 mg může způsobit vrozené vady a/nebo smrt exponovaného plodu. Ribavirin prokázal významné teratogenní a/nebo embryocidní účinky u všech druhů zvířat, u kterých byly provedeny adekvátní studie. Tyto účinky se objevily při dávkách tak nízkých, jako je jedna dvacetina doporučené lidské dávky ribavirinu.
Léčba přípravkem COPEGUS by neměla být zahájena, pokud bezprostředně před plánovaným zahájením léčby nebyl získán negativní těhotenský test. Je třeba věnovat mimořádnou pozornost tomu, aby nedošlo k otěhotnění u pacientek a partnerek mužských pacientů. Pacientky by měly být poučeny, aby během léčby a 6 měsíců po jejím ukončení užívaly alespoň dvě formy účinné antikoncepce. Těhotenský test by měl být prováděn měsíčně během léčby přípravkem COPEGUS 100 mg a po dobu 6 měsíců po ukončení léčby (viz VAROVÁNÍ V KRABICE , KONTRAINDIKACE , Použití ve specifických populacích , a INFORMACE PRO PACIENTA ].
Anémie
Primární toxicitou ribavirinu je hemolytická anémie, která byla v klinických studiích pozorována u přibližně 13 % všech subjektů léčených přípravkem COPEGUS/PEGASYS. Anémie spojená s přípravkem COPEGUS 100 mg se objeví během 1 až 2 týdnů od zahájení léčby. Protože počáteční pokles hemoglobinu může být významný, doporučuje se získat hemoglobin nebo hematokrit před léčbou a ve 2. a 4. týdnu léčby nebo častěji, pokud je to klinicky indikováno. Pacienti by pak měli být sledováni, jak je to klinicky vhodné. Opatrnost je třeba při zahájení léčby u každého pacienta s výchozím rizikem těžké anémie (např. sférocytóza, anamnéza gastrointestinálního krvácení) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
pacientů s anémií způsobenou přípravkem COPEGUS byly hlášeny fatální a nefatální infarkty myokardu. Před zahájením léčby ribavirinem by měli být pacienti vyšetřeni na základní srdeční onemocnění. Pacientům s již existujícím srdečním onemocněním by měly být před léčbou provedeny elektrokardiogramy a během léčby by měli být náležitě sledováni. Pokud dojde ke zhoršení kardiovaskulárního stavu, léčba by měla být pozastavena nebo přerušena [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Vzhledem k tomu, že srdeční onemocnění může být zhoršeno anémií vyvolanou léky, pacienti s anamnézou významného nebo nestabilního srdečního onemocnění by neměli používat COPEGUS [viz VAROVÁNÍ V KRABICE a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Jaterní selhání
Pacienti s chronickou hepatitidou C (CHC) s cirhózou mohou mít při léčbě interferony alfa, včetně PEGASYS, riziko jaterní dekompenzace a smrti. Pacienti s cirhózou CHC koinfikovaní HIV, kteří dostávají vysoce aktivní antiretrovirovou terapii (HAART) a interferon alfa-2a s ribavirinem nebo bez ribavirinu, se zdá být vystaveni zvýšenému riziku rozvoje jaterní dekompenzace ve srovnání s pacienty, kteří nedostávají HAART. Ve studii NR15961 [viz Klinické studie ze 129 pacientů s CHC/HIV cirhózou, kteří dostávali HAART, se u 14 (11 %) těchto pacientů ve všech léčebných ramenech rozvinula jaterní dekompenzace vedoucí k 6 úmrtím. Všech 14 pacientů užívalo NRTI, včetně stavudinu, didanosinu, abakaviru, zidovudinu a lamivudinu. Tento malý počet pacientů neumožňuje rozlišovat mezi konkrétními NRTI nebo souvisejícím rizikem. Během léčby je třeba pečlivě sledovat klinický stav pacientů a jaterní funkce, zda se u nich nevyskytují známky a příznaky jaterní dekompenzace. Léčba přípravkem PEGASYS/COPEGUS 100 mg by měla být okamžitě přerušena u pacientů s jaterní dekompenzací (viz KONTRAINDIKACE ].
Přecitlivělost
Během léčby interferonem alfa a ribavirinem byly pozorovány závažné akutní hypersenzitivní reakce (např. kopřivka, angioedém, bronchokonstrikce a anafylaxe). Pokud se taková reakce objeví, je třeba léčbu přípravkem PEGASYS a COPEGUS 100 mg okamžitě přerušit a zahájit vhodnou léčbu. U pacientů užívajících PEGASYS s ribavirinem i bez něj byly hlášeny závažné kožní reakce včetně vezikulobulózních erupcí, reakce ve spektru Stevens-Johnsonova syndromu (erythema multiforme major) s různým stupněm postižení kůže a sliznic a exfoliativní dermatitida (erytrodermie). Pacienti, u kterých se objeví známky nebo příznaky závažných kožních reakcí, musí léčbu přerušit (viz NEŽÁDOUCÍ REAKCE ].
Plicní poruchy
Během léčby ribavirinem a interferonem byly hlášeny dušnost, plicní infiltráty, pneumonitida, plicní hypertenze a pneumonie. Občas se vyskytly případy smrtelného zápalu plic. Kromě toho byla hlášena sarkoidóza nebo exacerbace sarkoidózy. Pokud se objeví známky plicních infiltrátů nebo poškození plicních funkcí, pacienti by měli být pečlivě sledováni a pokud je to vhodné, kombinovaná léčba COPEGUS/PEGASYS by měla být přerušena.
Útlak kostní dřeně
Pancytopenie (výrazný pokles červených krvinek, neutrofilů a krevních destiček) a suprese kostní dřeně byly v literatuře hlášeny během 3 až 7 týdnů po současném podání pegylovaného interferonu/ribavirinu a azathioprinu. U tohoto omezeného počtu pacientů (n=8) byla myelotoxicita reverzibilní během 4 až 6 týdnů po vysazení jak antivirové léčby HCV, tak souběžně podávaného azathioprinu a neopakovala se ani po opětovném zahájení samotné léčby. PEGASYS, COPEGUS 100 mg a azathioprin by měly být přerušeny pro pancytopenii a pegylovaný interferon/ribavirin by neměl být znovu zaveden se současným azathioprinem [viz DROGOVÉ INTERAKCE ].
Pankreatitida
Léčba přípravkem COPEGUS a PEGASYS by měla být pozastavena u pacientů se známkami a příznaky pankreatitidy a přerušena u pacientů s potvrzenou pankreatitidou.
Vliv na růst u dětských pacientů
Během kombinované terapie po dobu až 48 týdnů s PEGASYS plus ribavirin byla u pediatrických subjektů ve věku 5 až 17 let pozorována inhibice růstu. Bylo pozorováno snížení hmotnosti pro věkové z-skóre a výšky pro věkové z-skóre až do 48 týdnů léčby ve srovnání s výchozí hodnotou. 2 roky po léčbě bylo 16 % pediatrických subjektů více než 15 percentilů pod svou výchozí křivkou hmotnosti a 11 % bylo více než 15 percentilů pod svou výchozí křivkou výšky.
Dostupné dlouhodobější údaje o subjektech, které byly sledovány až 6 let po léčbě, jsou příliš omezené na to, aby bylo možné určit riziko snížené výšky v dospělosti u některých pacientů [viz Zkušenosti z klinických studií ].
Laboratorní testy
Před zahájením kombinované terapie PEGASYS/COPEGUS se u všech pacientů doporučují standardní hematologické a biochemické laboratorní testy. U žen ve fertilním věku musí být proveden těhotenský screening. Pacientům, kteří mají již existující srdeční abnormality, by měly být před léčbou přípravkem PEGASYS/COPEGUS provedeny elektrokardiogramy.
Po zahájení léčby by měly být po 2 týdnech a 4 týdnech provedeny hematologické testy a po 4 týdnech biochemické testy. Během léčby by měla být pravidelně prováděna další vyšetření. V klinických studiích u dospělých byl CBC (včetně hladiny hemoglobinu a počtu bílých krvinek a krevních destiček) a chemie (včetně jaterních testů a kyseliny močové) měřeny v 1., 2., 4., 6. a 8. týdnu a poté každé 4. až 6 týdnů nebo častěji, pokud byly zjištěny abnormality. V pediatrické klinické studii bylo hematologické a chemické hodnocení provedeno v 1., 3., 5. a 8. týdnu, poté každé 4 týdny. Hormon stimulující štítnou žlázu (TSH) byl měřen každých 12 týdnů. Během kombinované léčby a po dobu 6 měsíců po ukončení léčby by měl být prováděn těhotenský test každý měsíc.
Vstupní kritéria použitá pro klinické studie COPEGUS 100 mg a PEGASYS lze považovat za vodítko pro přijatelné výchozí hodnoty pro zahájení léčby:
- Počet krevních destiček vyšší nebo rovný 90 000 buněk/mm³ (u pacientů s HCV s cirhózou až 75 000 buněk/mm³ nebo 70 000 buněk/mm³ u pacientů s CHC a HIV)
- Absolutní počet neutrofilů (ANC) vyšší nebo roven 1500 buňkám/mm³
- TSH a T4 v normálních mezích nebo adekvátně kontrolovaná funkce štítné žlázy
- počet buněk CD4+ větší nebo roven 200 buňkám/mm³ nebo počet buněk CD4+ větší nebo roven 100 buňkám/mm³, ale méně než 200 buněk/mm³ a HIV-1 RNA méně než 5 000 kopií/ml u pacientů koinfikovaných HIV
- Hemoglobin vyšší nebo rovný 12 g/dl u žen a vyšší nebo rovný 13 g/dl u mužů u pacientů s monoinfekcí CHC
- Hemoglobin vyšší nebo rovný 11 g/dl u žen a vyšší nebo rovný 12 g/dl u mužů u pacientů s CHC a HIV
Informace pro pacienty
- Vidět Označení pacientů schválené FDA (Medication Guide)
Těhotenství
Pacientky musí být informovány, že ribavirin může způsobit vrozené vady a/nebo smrt exponovaného plodu. Terapii COPEGUS 100 mg nesmí užívat těhotné ženy ani muži, jejichž partnerky jsou těhotné. Je třeba dbát mimořádné opatrnosti, aby nedošlo k otěhotnění u pacientek a partnerek mužských pacientů užívajících léčbu přípravkem COPEGUS a 6 měsíců po léčbě. Pacientky by měly během léčby přípravkem COPEGUS a 6 měsíců po léčbě používat dvě spolehlivé metody antikoncepce. Léčba přípravkem COPEGUS by neměla být zahájena, dokud nebude bezprostředně před zahájením léčby získán negativní těhotenský test. Pacientky musí provádět těhotenský test měsíčně během léčby a 6 měsíců po léčbě.
Pacientky ve fertilním věku a pacienti s partnerkami ve fertilním věku musí být informováni o teratogenních/embryocidních rizicích a musí být poučeni o používání účinné antikoncepce během léčby přípravkem COPEGUS a 6 měsíců po léčbě. Pacientky by měly být poučeny, aby v případě těhotenství okamžitě informovaly poskytovatele zdravotní péče [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Anémie
Nejčastější nežádoucí příhodou spojenou s ribavirinem je anémie, která může být závažná [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ]. Pacienti by měli být upozorněni, že před zahájením léčby přípravkem COPEGUS a pravidelně poté jsou vyžadována laboratorní vyšetření [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Doporučuje se, aby pacienti byli dobře hydratováni, zejména během počátečních fází léčby.
Pacienti, u kterých se objeví závratě, zmatenost, ospalost a únava, by měli být upozorněni, aby se vyvarovali řízení motorových vozidel a obsluze strojů.
Pacientům je třeba doporučit, aby užívali COPEGUS 100 mg s jídlem.
Před zahájením léčby přípravkem COPEGUS/PEGASYS by měli být pacienti dotázáni na předchozí zneužívání drog, protože u pacientů léčených interferony byla hlášena recidiva drogové závislosti a předávkování drogami.
Pacientům je třeba doporučit, aby nepili alkohol, protože alkohol může zhoršit chronickou infekci hepatitidou C.
Pacienti by měli být informováni o tom, co mají dělat v případě, že vynechají dávku přípravku COPEGUS. Vynechané dávky je třeba užít co nejdříve během téhož dne. Pacienti by neměli zdvojnásobit další dávku. Pacientům by mělo být doporučeno, aby v případě dotazů zavolali svému poskytovateli zdravotní péče.
Pacienti by měli být informováni, že účinek léčby hepatitidy C pomocí PEGASYS/COPEGUS na přenos není znám a že je třeba přijmout vhodná opatření k zabránění přenosu viru hepatitidy C během léčby nebo v případě selhání léčby.
Pacienti by měli být informováni o možných přínosech a rizicích spojených s užíváním přípravku COPEGUS. Měly by být uvedeny pokyny pro správné použití, včetně kontroly obsahu přiloženého materiálu PRŮVODCE LÉČBAMI , což není zveřejnění všech nebo možných nepříznivých účinků.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Ve studii karcinogenity na myších p53 (+/-) až do maximální tolerované dávky 100 mg/kg/den nebyl ribavirin onkogenní. Ribavirin také nebyl onkogenní ve 2leté studii karcinogenity u potkanů v dávkách až do maximální tolerované dávky 60 mg/kg/den. Na základě tělesného povrchu jsou tyto dávky přibližně 0,5násobkem a 0,6násobkem maximální doporučené denní dávky ribavirinu u člověka.
Mutageneze
Ribavirin prokázal mutagenní aktivitu v in vitro testu myšího lymfomu. Žádná klastogenní aktivita nebyla pozorována v in vivo mikronukleárním testu myší v dávkách až 2000 mg/kg. Výsledky studií publikovaných v literatuře však ukazují klastogenní aktivitu v in vivo mikronukleárním testu myší při perorálních dávkách až 2000 mg/kg. Dominantní letální test u potkanů byl negativní, což ukazuje, že pokud se mutace vyskytly u potkanů, nebyly přenášeny prostřednictvím samčích gamet.
Zhoršení plodnosti
Ve studii fertility u potkanů ribavirin prokázal marginální snížení počtu spermií v dávce 100 mg/kg/den bez vlivu na fertilitu. Po ukončení léčby došlo k úplnému zotavení po 1 cyklu spermatogeneze. Abnormality ve spermatu byly pozorovány ve studiích na myších navržených tak, aby vyhodnotily časový průběh a reverzibilitu ribavirinem indukované testikulární degenerace při dávkách 15 až 150 mg/kg/den (přibližně 0,1 až 0,8násobek maximální doporučené denní dávky ribavirinu u člověka) podávaných po dobu 3 až 6 měsíců. Po ukončení léčby bylo v podstatě úplné zotavení z testikulární toxicity vyvolané ribavirinem patrné během 1 nebo 2 spermatogenních cyklů.
Pacientky ve fertilním věku a pacienti s partnerkami ve fertilním věku by neměli dostávat COPEGUS, pokud pacientka a její partner nepoužívají účinnou antikoncepci (dvě spolehlivé formy). Na základě vícedávkového poločasu (t½) ribavirinu 12 dnů je nutné používat účinnou antikoncepci po dobu 6 měsíců po léčbě (tj. 15 poločasů clearance ribavirinu).
Nebyly provedeny žádné reprodukční toxikologické studie s použitím PEGASYS v kombinaci s COPEGUS. Avšak peginterferon alfa-2a a ribavirin, pokud jsou podávány samostatně, mají oba nežádoucí účinky na reprodukci. Mělo by se předpokládat, že účinky vyvolané každým činidlem samotným by byly také způsobeny kombinací těchto dvou činidel.
Použití u konkrétních populací
Těhotenství
Kategorie X [vidět KONTRAINDIKACE ]. Ribavirin měl významné embryocidní a/nebo teratogenní účinky u všech druhů zvířat, u kterých byly provedeny adekvátní studie. Byly zaznamenány malformace lebky, patra, oka, čelisti, končetin, kostry a gastrointestinálního traktu. Výskyt a závažnost teratogenních účinků se zvyšovala s eskalací dávky léku. Přežívání plodů a potomků bylo sníženo [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
V konvenčních studiích embryotoxicity/teratogenity u potkanů a králíků byly pozorované hladiny dávek, při kterých nedocházelo k žádným účinkům, výrazně nižší než ty pro navrhované klinické použití (0,3 mg/kg/den u potkanů i králíků; přibližně 0,06násobek doporučené denní dávky ribavirinu u člověka) . Ve studii peri/postnatální toxicity u potkanů, kterým byla perorálně podávána dávka až 1 mg/kg/den (přibližně 0,01násobek maximální doporučené denní dávky ribavirinu pro člověka), nebyla pozorována žádná mateřská toxicita ani účinky na potomstvo.
Léčba a následná léčba: Potenciální riziko pro plod
Je známo, že ribavirin se hromadí v intracelulárních složkách, odkud je velmi pomalu odstraňován. Není známo, zda je ribavirin obsažen ve spermatu, a pokud ano, bude mít potenciální teratogenní účinek na oplodnění vajíček. Vzhledem k potenciálním lidským teratogenním účinkům ribavirinu by však pacienti mužského pohlaví měli být poučeni, aby učinili veškerá opatření, aby se vyhnuli riziku otěhotnění jejich partnerek.
COPEGUS by neměly užívat těhotné ženy nebo muži, jejichž partnerky jsou těhotné. Pacientky ve fertilním věku a pacienti muži s partnerkami ve fertilním věku by neměli dostávat COPEGUS, pokud pacientka a její partner nepoužívají účinnou antikoncepci (dvě spolehlivé formy) během léčby a 6 měsíců po léčbě [viz KONTRAINDIKACE ].
Ribavirinový registr těhotenství
Ribavirin Pregnancy Registry byl zřízen ke sledování mateřsko-fetálních výsledků těhotenství pacientek a partnerek mužských pacientů vystavených ribavirinu během léčby a po dobu 6 měsíců po ukončení léčby. Poskytovatelům zdravotní péče a pacientům se doporučuje, aby takové případy hlásili na telefonním čísle 1-800-593-2214.
Kojící matky
Není známo, zda se ribavirin vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka a aby se zabránilo jakémukoli potenciálu závažných nežádoucích účinků ribavirinu u kojených dětí, mělo by být na základě důležitosti léčby pro matku učiněno rozhodnutí, zda přerušit kojení nebo léčbu přípravkem COPEGUS 100 mg.
Pediatrické použití
Farmakokinetická hodnocení u pediatrických pacientů nebyla provedena.
Bezpečnost a účinnost přípravku COPEGUS nebyla stanovena u pacientů mladších 5 let.
Geriatrické použití
Klinické studie COPEGUS 100 mg a PEGASYS nezahrnovaly dostatečný počet subjektů ve věku 65 let nebo starších, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Specifická farmakokinetická hodnocení ribavirinu u starších pacientů nebyla provedena. Riziko toxických reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Dávka přípravku COPEGUS 100 mg by měla být snížena u pacientů s clearance kreatininu nižší nebo rovnou 50 ml/min; a dávka PEGASYS by měla být snížena u pacientů s clearance kreatininu nižší než 30 ml/min (viz DÁVKOVÁNÍ A PODÁVÁNÍ ; Použití u konkrétních populací ].
Závod
Farmakokinetická studie u 42 subjektů prokázala, že neexistuje žádný klinicky významný rozdíl ve farmakokinetice ribavirinu mezi jedinci černé pleti (n=14), hispánci (n=13) a bělochy (n=15).
Renální poškození
Před zahájením léčby přípravkem COPEGUS by měla být u všech pacientů vyhodnocena funkce ledvin odhadem pacientovy clearance kreatininu.
Klinická studie hodnotila léčbu přípravkem COPEGUS a PEGASYS u 50 subjektů s CHC se středně závažným (clearance kreatininu 30 – 50 ml/min) nebo závažným (clearance kreatininu méně než 30 ml/min) renálním poškozením nebo terminálním onemocněním ledvin (ESRD) vyžadujícím chronickou hemodialýzu (HD). U 18 jedinců s ESRD, kteří dostávali chronickou HD, byl COPEGUS podáván v dávce 200 mg denně bez zjevného rozdílu v profilu nežádoucích účinků ve srovnání s jedinci s normální funkcí ledvin. Snížení dávky a dočasné přerušení léčby přípravkem COPEGUS (kvůli nežádoucím účinkům souvisejícím s přípravkem COPEGUS, zejména anémii) bylo během léčby pozorováno až u jedné třetiny pacientů s ESRD/HD; a pouze jedna třetina těchto subjektů dostávala COPEGUS po dobu 48 týdnů. Plazmatické expozice ribavirinu byly přibližně o 20 % nižší u subjektů s ESRD na HD ve srovnání s subjekty s normální funkcí ledvin, které dostávaly standardní denní dávku 1000/1200 mg COPEGUS.
Subjekty se středně těžkou (n=17) nebo těžkou (n=14) poruchou funkce ledvin netolerovaly denní dávky 600 mg nebo 400 mg COPEGUSu v důsledku nežádoucích účinků souvisejících s COPEGUS, zejména anémie, a vykazovali 20 % až 30 % vyšší plazmatické expozice ribavirinu (i přes časté úpravy dávky) ve srovnání s jedinci s normální funkcí ledvin (clearance kreatininu vyšší než 80 ml/min), kteří dostávali standardní dávku přípravku COPEGUS. Míra přerušení léčby byla vyšší u subjektů s těžkou poruchou funkce ledvin ve srovnání s mírou pozorovanou u subjektů se středně těžkou poruchou funkce ledvin nebo normální funkcí ledvin. Farmakokinetické modelování a simulace ukazují, že dávka 200 mg denně u pacientů s těžkou poruchou funkce ledvin a dávka 200 mg denně střídající se s 400 mg následující den u pacientů se středně těžkou poruchou funkce ledvin zajistí expozici ribavirinu v plazmě podobnou jako u pacientů s normální funkcí ledvin příjem schváleného režimu COPEGUS. Tyto dávky nebyly u pacientů studovány [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Na základě farmakokinetických a bezpečnostních výsledků z této studie by pacienti s clearance kreatininu nižší nebo rovnou 50 ml/min měli dostávat sníženou dávku přípravku COPEGUS; a pacienti s clearance kreatininu nižší než 30 ml/min by měli dostávat sníženou dávku PEGASYSu. Klinický a hematologický stav pacientů s clearance kreatininu nižší nebo rovnou 50 ml/min, kterým je podáván přípravek COPEGUS 100 mg, by měl být pečlivě sledován. U pacientů s klinicky významnými laboratorními abnormalitami nebo nežádoucími reakcemi, které jsou trvale závažné nebo se zhoršují, by měla být léčba vysazena (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE , a Příbalový leták PEGASYS ].
Poškození jater
Vliv poruchy funkce jater na farmakokinetiku ribavirinu po podání přípravku COPEGUS nebyl hodnocen. Klinické studie přípravku COPEGUS 100 mg byly omezeny na pacienty s Child-Pughovou chorobou třídy A.
Rod
Nebyly pozorovány žádné klinicky významné rozdíly ve farmakokinetice ribavirinu mezi muži a ženami.
Farmakokinetika ribavirinu po korekci na hmotnost je u mužů a žen podobná.
Příjemci orgánových transplantací
Bezpečnost a účinnost léčby PEGASYS a COPEGUS 100 mg nebyla stanovena u pacientů s transplantací jater a jinými transplantacemi. Stejně jako u jiných interferonů alfa byly na PEGASYS hlášeny rejekce jaterního a renálního štěpu, samostatně nebo v kombinaci s COPEGUS (viz NEŽÁDOUCÍ REAKCE ].
PŘEDÁVKOVAT
V klinických studiích nebyly hlášeny žádné případy předávkování přípravkem COPEGUS. U osob, kterým byla podávána vyšší než doporučená dávka ribavirinu, byla pozorována hypokalcémie a hypomagnezémie. Ve většině těchto případů byl ribavirin podáván intravenózně v dávkách až do čtyřnásobku doporučené maximální perorální denní dávky av některých případech ji překračoval.
KONTRAINDIKACE
COPEGUS (ribavirin) je kontraindikován u:
- Ženy, které jsou těhotné. COPEGUS může při podání těhotné ženě způsobit poškození plodu. COPEGUS je kontraindikován u žen, které jsou nebo mohou otěhotnět. Pokud se tento lék užívá během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, měla by být informována o potenciálním riziku pro plod (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací , a INFORMACE PRO PACIENTA ].
- Muži, jejichž partnerky jsou těhotné.
- Pacienti s hemoglobinopatií (např. thalasemia major nebo srpkovitá anémie).
- V kombinaci s didanosinem. V klinických studiích byly hlášeny zprávy o fatálním selhání jater, stejně jako periferní neuropatie, pankreatitida a symptomatická hyperlaktatémie/laktátová acidóza (viz DROGOVÉ INTERAKCE ].
Kombinovaná léčba COPEGUS a PEGASYS je kontraindikována u pacientů s:
- Autoimunitní hepatitida.
- Jaterní dekompenzace (Child-Pugh skóre vyšší než 6; třída B a C) u pacientů s cirhózou CHC monoinfikovaných před léčbou (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Jaterní dekompenzace (Childovo-Pughovo skóre větší nebo rovné 6) u pacientů s cirhózou CHC koinfikovaných HIV před léčbou (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Ribavirin je antivirotikum [viz Mikrobiologie ].
Farmakokinetika
U pacientů s HCV, kteří dostávali ribavirin v kombinaci s peginterferonem alfa-2a, jsou k dispozici farmakokinetické údaje po podání více dávek ribavirinu. Po podávání 1200 mg/den s jídlem po dobu 12 týdnů průměr ± SD (n=39; tělesná hmotnost větší než 75 kg) AUC0-12h byla 25361±7110 ng·h/ml a Cmax byla 2748±818 ng/ml. Průměrná doba k dosažení Cmax byla 2 hodiny. Minimální plazmatické koncentrace ribavirinu po 12 týdnech podávání s jídlem byly 1662±545 ng/ml u pacientů infikovaných HCV, kteří dostávali 800 mg/den (n=89), a 2112±810 ng/ml u pacientů, kteří dostávali 1200 mg/den ( n=75, tělesná hmotnost větší než 75 kg).
Terminální poločas ribavirinu po podání jedné perorální dávky přípravku COPEGUS je přibližně 120 až 170 hodin. Celková zdánlivá clearance po podání jedné perorální dávky přípravku COPEGUS 100 mg je asi 26 l/h. Po opakovaném podávání (dvakrát denně) dochází k rozsáhlé akumulaci ribavirinu, takže Cmax v rovnovážném stavu byla čtyřikrát vyšší než u jedné dávky.
Vliv potravy na absorpci ribavirinu
Biologická dostupnost jednorázové perorální dávky ribavirinu byla zvýšena při současném podávání s jídlem s vysokým obsahem tuku. Absorpce byla zpomalena (Tmax byla zdvojnásobena) a AUC0-192h a Cmax se zvýšily o 42% a 66%, když byl COPEGUS užíván s jídlem s vysokým obsahem tuku ve srovnání s podmínkami nalačno (viz DÁVKOVÁNÍ A PODÁVÁNÍ a INFORMACE PRO PACIENTA ].
Eliminace a metabolismus
Podíl ledvin a jater na eliminaci ribavirinu po podání přípravku COPEGUS 100 mg není znám. Studie in vitro ukazují, že ribavirin není substrátem enzymů CYP450.
Renální poškození
Klinická studie hodnotila 50 subjektů s CHC buď se středně závažným (clearance kreatininu 30 až 50 ml/min) nebo závažným (clearance kreatininu méně než 30 ml/min) renálním poškozením nebo terminálním onemocněním ledvin (ESRD) vyžadujícím chronickou hemodialýzu (HD). Zdánlivá clearance ribavirinu byla snížena u subjektů s clearance kreatininu nižší nebo rovnou 50 ml/min, včetně subjektů s ESRD na HD, vykazující přibližně 30 % hodnoty zjištěné u subjektů s normální funkcí ledvin. Farmakokinetické modelování a simulace ukazují, že dávka 200 mg denně u pacientů s těžkou poruchou funkce ledvin a dávka 200 mg denně střídající se s 400 mg následující den u pacientů se středně těžkou poruchou funkce ledvin zajistí plazmatické expozice ribavirinu podobné těm, které byly pozorovány u pacientů s normální renální funkce při standardní denní dávce 1000/1200 mg COPEGUS. Tyto dávky nebyly u pacientů studovány.
18 pacientů s ESRD, kteří dostávali chronickou HD, byl COPEGUS podáván v dávce 200 mg denně. Plazmatické expozice ribavirinu u těchto subjektů byly přibližně o 20 % nižší ve srovnání s subjekty s normální funkcí ledvin, které dostávaly standardní denní dávku 1000/1200 mg COPEGUS (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Plazmatický ribavirin se odstraňuje hemodialýzou s extrakčním poměrem přibližně 50 %; vzhledem k velkému distribučnímu objemu ribavirinu se však neočekává změna plazmatické expozice hemodialýzou.
Mikrobiologie
Mechanismus působení
Mechanismus, kterým ribavirin přispívá k jeho antivirové účinnosti na klinice, není zcela objasněn. Ribavirin má přímou antivirovou aktivitu v tkáňové kultuře proti mnoha RNA virům. Ribavirin zvyšuje frekvenci mutací v genomech několika RNA virů a ribavirintrifosfát inhibuje HCV polymerázu v biochemické reakci.
Antivirová aktivita v buněčné kultuře
Ve stabilním systému HCV buněčné kultury modelu (HCV replikon) ribavirin inhiboval autonomní replikaci HCV RNA s hodnotou 50% účinné koncentrace (EC50) 11-21 mcM. Ve stejném modelu PEG-IFN a-2a také inhiboval replikaci HCV RNA s hodnotou EC50 0,1-3 ng/ml. Kombinace PEG-IFN a-2a a ribavirinu byla při inhibici replikace HCV RNA účinnější než každé činidlo samostatně.
Odpor
Různé genotypy HCV vykazují značnou klinickou variabilitu v jejich odpovědi na léčbu PEG-IFN-α a ribavirinem. Virové genetické determinanty spojené s variabilní odpovědí nebyly definitivně identifikovány.
Křížový odpor
Zkřížená rezistence mezi IFN α a ribavirinem nebyla pozorována.
Toxikologie zvířat
Ve studii na potkanech se dospělo k závěru, že dominantní letalita nebyla indukována ribavirinem v dávkách až 200 mg/kg po dobu 5 dnů (až 1,7násobek maximální doporučené dávky ribavirinu u člověka).
Dlouhodobé studie na myších a potkanech (18 až 24 měsíců; dávka 20 až 75, respektive 10 až 40 mg/kg/den, přibližně 0,1 až 0,4násobek maximální denní dávky ribavirinu u člověka) prokázaly vztah mezi chronická expozice ribavirinu a zvýšený výskyt vaskulárních lézí (mikroskopické krvácení) u myší. U potkanů se u kontrol vyskytla degenerace sítnice, ale výskyt byl zvýšený u potkanů léčených ribavirinem.
Klinické studie
Pacienti s chronickou hepatitidou C
Dospělí pacienti
Bezpečnost a účinnost přípravku PEGASYS v kombinaci s přípravkem COPEGUS pro léčbu infekce virem hepatitidy C byla hodnocena ve dvou randomizovaných kontrolovaných klinických studiích. Všichni pacienti byli dospělí, měli kompenzované jaterní onemocnění, detekovatelný virus hepatitidy C, jaterní biopsii diagnostikovali chronickou hepatitidu a nebyli předtím léčeni interferonem. Přibližně 20 % pacientů v obou studiích mělo kompenzovanou cirhózu (Child-Pugh třída A). Pacienti koinfikovaní HIV byli z těchto studií vyloučeni.
Ve studii NV15801 byli pacienti randomizováni tak, aby dostávali buď PEGASYS 180 mcg subkutánně jednou týdně s perorálním placebem, PEGASYS 180 mcg jednou týdně s COPEGUS 1000 mg ústy (tělesná hmotnost nižší než 75 kg) nebo 1200 mg ústy (tělesná hmotnost vyšší než nebo rovnající se 75 kg) nebo interferon alfa-2b 3 MIU subkutánně třikrát týdně plus ribavirin 1000 mg nebo 1200 mg perorálně. Všichni pacienti dostávali 48 týdnů terapie, po které následovalo 24 týdnů sledování bez léčby. Přiřazení léčby COPEGUS nebo placebem bylo zaslepeno. Setrvalá virologická odpověď byla definována jako nedetekovatelná (méně než 50 IU/ml) HCV RNA v 68. týdnu studie nebo po něm. PEGASYS v kombinaci s přípravkem COPEGUS 100 mg vedl k vyššímu SVR ve srovnání se samotným PEGASYSem nebo interferonem alfa-2b a ribavirinem (Tabulka 9) . Ve všech léčebných ramenech měli pacienti s virovým genotypem 1, bez ohledu na virovou zátěž, nižší míru odpovědi na PEGASYS v kombinaci s přípravkem COPEGUS 100 mg ve srovnání s pacienty s jinými virovými genotypy.
Rozdíl v celkové léčebné odpovědi (PEGASYS/COPEGUS – Interferon alfa-2b/ribavirin) byl 9 % (95% CI 2,3, 15,3).
Ve studii NV15942 všichni pacienti dostávali PEGASYS 180 mcg subkutánně jednou týdně a byli randomizováni k léčbě po dobu 24 nebo 48 týdnů a k dávce COPEGUS buď 800 mg, nebo 1000 mg/1200 mg (pro tělesnou hmotnost nižší než 75 kg/vyšší než nebo rovnající se 75 kg). Přiřazení do čtyř léčebných ramen bylo stratifikováno podle genotypu viru a výchozího titru viru HCV. Pacienti s genotypem 1 a vysokým titrem viru (definovaným jako více než 2 x 106 kopií HCV RNA/ml séra) byli přednostně zařazeni k léčbě po dobu 48 týdnů.
Trvalá virologická odpověď (SVR) a genotyp HCV
HCV 1 a 4 — Bez ohledu na výchozí virový titr vedla léčba po dobu 48 týdnů pomocí PEGASYS a 1000 mg nebo 1200 mg COPEGUS k vyššímu SVR (definovanému jako nedetekovatelná HCV RNA na konci 24týdenního období sledování bez léčby) ve srovnání s kratší léčbou (24 týdnů) a/nebo 800 mg COPEGUS.
HCV 2 a 3 — Bez ohledu na výchozí virový titr vedla léčba po dobu 24 týdnů pomocí PEGASYS a 800 mg COPEGUS k podobné SVR ve srovnání s delší léčbou (48 týdnů) a/nebo 1000 mg nebo 1200 mg COPEGUS (viz tabulka 10).
Počty pacientů s genotypem 5 a 6 byly příliš nízké na to, aby umožnily smysluplné hodnocení.
Pediatričtí pacienti
Dříve neléčení dětští pacienti ve věku 5 až 17 let (55 % mladších 12 let) s chronickou hepatitidou C, kompenzovaným onemocněním jater a detekovatelnou HCV RNA byli léčeni přípravkem COPEGUS 100 mg přibližně 15 mg/kg/den plus PEGASYS 180 mcg/1,73 m² x plocha tělesného povrchu jednou týdně po dobu 48 týdnů. Všechny subjekty byly sledovány po dobu 24 týdnů po léčbě. Setrvalá virologická odpověď (SVR) byla definována jako nedetekovatelná (méně než 50 IU/ml) HCV RNA v 68. týdnu studie nebo po něm. Celkem 114 subjektů bylo randomizováno k léčbě buď kombinovanou léčbou COPEGUS plus PEGASYS nebo monoterapií PEGASYS; jedinci, u kterých selhala monoterapie PEGASYS po 24 týdnech nebo později, mohli dostávat otevřený COPEGUS plus PEGASYS. Počáteční randomizovaná ramena byla vyvážená z hlediska demografických faktorů; 55 subjektů dostalo počáteční kombinovanou léčbu COPEGUS 100 mg plus PEGASYS a 59 dostalo PEGASYS plus placebo; v celkové populaci intent-to-treat bylo 45 % žen, 80 % bělochů a 81 % bylo infikováno HCV genotypu 1. Výsledky SVR jsou shrnuty v tabulce 11.
Další prediktory odpovědi na léčbu
Míra léčebné odpovědi je nižší u pacientů se špatnými prognostickými faktory, kteří jsou léčeni pegylovaným interferonem alfa. Ve studiích NV15801 a NV15942 byla míra léčebné odpovědi nižší u pacientů starších 40 let (50 % vs. 66 %), u pacientů s cirhózou (47 % vs. 59 %), u pacientů s hmotností nad 85 kg (49 % vs. 60 %) au pacientů s genotypem 1 s vysokou vs. nízkou virovou zátěží (43 % vs. 56 %). Afroameričtí pacienti měli nižší míru odpovědí ve srovnání s bělochy.
Ve studiích NV15801 a NV15942 byla absence časné virologické odpovědi do 12 týdnů (definovaná jako nedetekovatelná HCV RNA nebo o více než 2 log10 nižší než výchozí hodnota) důvodem pro přerušení léčby. Z pacientů, kteří postrádali časnou virovou odpověď do 12 týdnů a dokončili doporučenou kúru terapie navzdory protokolem definované možnosti přerušit léčbu, dosáhlo SVR 5/39 (13 %). Z pacientů, u kterých do 24 týdnů chyběla časná virová odpověď, 19 dokončilo celou léčebnou kúru a žádný nedosáhl SVR.
Pacienti koinfikovaní chronickou hepatitidou C/HIV
Ve studii NR15961 byli pacienti s CHC/HIV randomizováni k podávání buď PEGASYS 180 mcg subkutánně jednou týdně plus perorální placebo, PEGASYS 180 mcg jednou týdně plus COPEGUS 800 mg perorálně denně nebo interferon alfa-2a, 3 MIU subkutánně třikrát týdně plus COPEGUS 800 mg perorálně denně. Všichni pacienti dostávali 48 týdnů terapie a trvalá virologická odpověď (SVR) byla hodnocena po 24 týdnech sledování bez léčby. Přiřazení léčby přípravkem COPEGUS 100 mg nebo placebem bylo v léčebných ramenech PEGASYS zaslepeno. Všichni pacienti byli dospělí, měli kompenzované jaterní onemocnění, detekovatelný virus hepatitidy C, jaterní biopsii diagnostikovali chronickou hepatitidu C a dříve nebyli léčeni interferonem. Pacienti také měli počet buněk CD4+ vyšší nebo rovný 200 buňkám/mm³ nebo počet CD4+ buněk vyšší nebo rovný 100 buňkám/mm³, ale méně než 200 buněk/mm³ a HIV-1 RNA nižší než 5000 kopií/ml a stabilní stav HIV. Přibližně 15 % pacientů ve studii mělo cirhózu. Výsledky jsou uvedeny v tabulce 12.
Míra léčebné odpovědi byla nižší u pacientů s CHC/HIV se špatnými prognostickými faktory (včetně HCV genotypu 1, HCV RNA vyšší než 800 000 IU/ml a cirhózy), kteří dostávali terapii pegylovaným interferonem alfa.
Z pacientů, kteří neprokázali buď nedetekovatelnou HCV RNA, nebo alespoň 2 log10 snížení od výchozí hodnoty titru HCV RNA po 12 týdnech kombinované terapie PEGASYS a COPEGUS, dosáhla SVR 2 % (2/85).
U pacientů s CHC s koinfekcí HIV, kteří dostávali 48 týdnů samotný PEGASYS nebo v kombinaci s léčbou COPEGUS 100 mg, se průměrné a střední titry HIV RNA během léčby nebo 24 týdnů po léčbě nezvýšily nad výchozí hodnotu.
INFORMACE PRO PACIENTA
COPEGUS® (Co-PEG-UHS) (ribavirin) tablety
Před zahájením užívání přípravku COPEGUS 100 mg si pozorně přečtěte tento Průvodce léčivými přípravky a přečtěte si Průvodce léčivými přípravky pokaždé, když dostanete více přípravku COPEGUS. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
Přečtěte si také Průvodce léčivými přípravky pro PEGASYS (peginterferon alfa-2a).
Jaké jsou nejdůležitější informace, které bych měl vědět o COPEGUS?
- Ženy musí mít těhotenský test před zahájením léčby přípravkem COPEGUS, každý měsíc během léčby přípravkem COPEGUS 100 mg a každý měsíc po dobu 6 měsíců po léčbě přípravkem COPEGUS.
- Pokud vy nebo vaše sexuální partnerka otěhotníte během užívání přípravku COPEGUS 100 mg nebo do 6 měsíců po ukončení užívání přípravku COPEGUS okamžitě informujte svého poskytovatele zdravotní péče. Vy nebo váš poskytovatel zdravotní péče byste se měli obrátit na Registr těhotenství Ribavirin na telefonním čísle 1-800-593-2214. Ribavirin Pregnancy Registry shromažďuje informace o tom, co se stane matkám a jejich dětem, pokud matka během těhotenství užívá COPEGUS.
Co je COPEGUS 100 mg?
COPEGUS 100 mg je lék na předpis používaný s dalším lékem nazývaným PEGASYS (peginterferon alfa-2a) k léčbě chronické (dlouhotrvající) infekce hepatitidou C u lidí ve věku 5 let a starších, jejichž játra stále fungují normálně a kteří nebyli dříve léčeni lék nazývaný interferon alfa. Není známo, zda je COPEGUS bezpečný a zda bude fungovat u dětí mladších 5 let.
Kdo by neměl užívat COPEGUS 100 mg?
Vidět Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku COPEGUS 100 mg?
Neužívejte COPEGUS, pokud:
- mají určité typy hepatitidy způsobené tím, že váš imunitní systém napadá vaše játra (autoimunitní hepatitida)
- máte určité krevní poruchy, jako je thalasemia major nebo srpkovitá anémie (hemoglobinopatie)
- užívejte didanosin (Videx nebo Videx EC)
Pokud trpíte některým z těchto onemocnění, poraďte se se svým poskytovatelem zdravotní péče před zahájením léčby přípravkem COPEGUS 100 mg.
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku COPEGUS 100 mg?
Než začnete užívat COPEGUS, informujte svého poskytovatele zdravotní péče, pokud máte nebo jste měl(a):
- léčba hepatitidy C, která u vás nefungovala
- závažné alergické reakce na COPEGUS nebo na kteroukoli složku přípravku COPEGUS. Seznam složek naleznete na konci této Příručky pro léky.
- dýchací problémy. COPEGUS 100 mg může způsobit nebo zhoršit vaše dýchací potíže, které již máte.
- problémy se zrakem. COPEGUS může způsobit oční problémy nebo zhoršit oční problémy, které již máte. Před zahájením léčby přípravkem COPEGUS byste měli podstoupit oční vyšetření.
- některé krevní poruchy, jako je anémie
- vysoký krevní tlak, srdeční problémy nebo jste prodělali srdeční infarkt. Váš poskytovatel zdravotní péče by měl před zahájením léčby přípravkem COPEGUS otestovat vaši krev a srdce.
- problémy se štítnou žlázou
- cukrovka. Kombinovaná léčba přípravkem COPEGUS 100 mg a PEGASYS může váš diabetes zhoršit nebo bude obtížnější léčit.
- problémy s játry jiná než infekce virem hepatitidy C
- virus lidské imunodeficience (HIV) nebo jiné problémy s imunitou
- problémy s duševním zdravím, včetně deprese nebo myšlenek na sebevraždu
- problémy s ledvinami
- transplantaci orgánu
- drogová závislost nebo zneužívání
- infekce virem hepatitidy B
- jakýkoli jiný zdravotní stav
- kojím. Není známo, zda COPEGUS 100 mg přechází do vašeho mateřského mléka. Vy a váš poskytovatel zdravotní péče byste se měli rozhodnout, zda budete COPEGUS užívat nebo kojit.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Některé léky mohou způsobit závažné nežádoucí účinky, pokud jsou užívány současně s přípravkem COPEGUS. Některé léky mohou ovlivnit účinek přípravku COPEGUS 100 mg nebo může přípravek COPEGUS 100 mg ovlivnit účinek jiných léků.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte nějaké léky k léčbě HIV, včetně didanosinu (Videx nebo Videx EC), nebo pokud užíváte azathioprin (Imuran nebo Azasan).
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče nebo lékárníkovi, když dostanete nový lék.
Jak mám užívat COPEGUS 100 mg?
- Užívejte COPEGUS přesně tak, jak vám řekl váš poskytovatel zdravotní péče. Váš poskytovatel zdravotní péče vám sdělí, jaké množství COPEGUSU máte užívat a kdy jej užívat. Dětem ve věku 5 let a starším lékař předepíše dávku přípravku COPEGUS 100 mg na základě hmotnosti.
- COPEGUS užívejte s jídlem.
- Pokud vynecháte dávku přípravku COPEGUS 100 mg, vezměte si vynechanou dávku co nejdříve během téhož dne. Další dávku nezdvojnásobujte. Máte-li dotazy ohledně toho, co dělat, zavolejte svému poskytovateli zdravotní péče.
- Pokud užijete příliš mnoho přípravku COPEGUS 100 mg, okamžitě zavolejte svého poskytovatele zdravotní péče nebo místní Poison Control Center nebo jděte na pohotovost v nejbližší nemocnici.
- Váš poskytovatel zdravotní péče by měl provést krevní testy před zahájením léčby přípravkem COPEGUS, ve 2. a 4. týdnu léčby a poté podle potřeby, aby zjistil, jak dobře léčbu snášíte, a zkontroloval nežádoucí účinky. Váš poskytovatel zdravotní péče může změnit vaši dávku přípravku COPEGUS 100 mg na základě výsledků krevních testů nebo vedlejších účinků, které můžete mít.
- Pokud máte problémy se srdcem, měl by váš poskytovatel zdravotní péče zkontrolovat vaše srdce provedením elektrokardiogramu před zahájením léčby přípravkem COPEGUS a v případě potřeby během léčby.
Čemu se mám vyhnout při užívání přípravku COPEGUS?
COPEGUS 100 mg může způsobit únavu, závrať nebo zmatenost. Pokud máte některý z těchto příznaků, neměli byste řídit nebo obsluhovat stroje.
Nepijte alkohol, včetně piva, vína a likéru. To může zhoršit vaše onemocnění jater.
Jaké jsou možné vedlejší účinky přípravku COPEGUS?
COPEGUS 100 mg může způsobit závažné nežádoucí účinky, včetně:
Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku COPEGUS 100 mg?"
- Otok a podráždění slinivky břišní (pankreatitida). Můžete mít bolesti žaludku, nevolnost, zvracení nebo průjem.
- Závažné alergické reakce. Příznaky mohou zahrnovat kopřivku, sípání, potíže s dýcháním, bolest na hrudi, otok úst, jazyka nebo rtů nebo závažnou vyrážku.
- Vážné problémy s dýcháním. Obtížné dýchání může být příznakem vážné plicní infekce (pneumonie), která může vést ke smrti.
- Vážné oční problémy což může vést ke ztrátě zraku nebo slepotě.
- Problémy s játry. U některých lidí se může zhoršit funkce jater. Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte některý z těchto příznaků: nadýmání žaludku, zmatenost, hnědá moč a žluté oči.
- Těžká deprese
- Sebevražedné myšlenky a pokusy
- Vliv na růst u dětí. dětí může při léčbě přípravkem PEGASYS a COPEGUS dojít k opožděnému nárůstu hmotnosti a zvýšení výšky. K dohánění růstu dochází po ukončení léčby, ale některé děti nemusí dosáhnout výšky, kterou by měly mít před léčbou. Promluvte si se svým poskytovatelem zdravotní péče, pokud máte obavy o růst vašeho dítěte během léčby přípravkem PEGASYS a COPEGUS.
Zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc, pokud máte některý z výše uvedených příznaků. Mohou to být příznaky závažného nežádoucího účinku léčby přípravkem COPEGUS 100 mg.
Časté vedlejší účinky přípravku COPEGUS užívaného s PEGASYSem zahrnují:
- příznaky podobné chřipce – pocit únavy, bolesti hlavy, třes spolu s vysokou teplotou (horečkou) a bolesti svalů nebo kloubů
- změny nálady, pocit podrážděnosti, úzkost a potíže se spánkem
- ztráta chuti k jídlu, nevolnost, zvracení a průjem
- ztráta vlasů
- svědění
Informujte svého poskytovatele zdravotní péče o jakémkoli nežádoucím účinku, který vás obtěžuje nebo který nezmizí.
To nejsou všechny možné vedlejší účinky léčby přípravkem COPEGUS. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Nežádoucí účinky můžete také hlásit společnosti Genentech na čísle 1-888-835-2555.
Jak mám COPEGUS 100 mg uchovávat?
- Tablety COPEGUS skladujte při teplotě 15 °C až 30 °C (59 °F až 86 °F).
- Uchovávejte lahvičku těsně uzavřenou.
Uchovávejte COPEGUS 100 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku COPEGUS
Není známo, zda léčba přípravkem COPEGUS 100 mg v kombinaci s přípravkem PEGASYS zabrání infikované osobě v šíření viru hepatitidy C na jinou osobu během léčby.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte COPEGUS 100 mg při onemocnění, pro které nebyl předepsán. Nedávejte COPEGUS jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o přípravku COPEGUS. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku COPEGUS, který je určen pro zdravotnické pracovníky.
Jaké složky obsahuje COPEGUS 100 mg?
Aktivní složka: ribavirin
Neaktivní složky: Jádro tablety obsahuje předbobtnalý škrob, mikrokrystalickou celulózu, sodnou sůl glykolátu škrobu, kukuřičný škrob a stearát hořečnatý. Potah tablety obsahuje Chromatone-P nebo Opadry Pink (vyrobené za použití hydroxypropylmethylcelulózy, mastku, oxidu titaničitého, syntetického žlutého oxidu železitého a syntetického červeného oxidu železitého), ethylcelulózy (ECD-30) a triacetinu.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
