Famvir 250mg, 500mg Famciclovir Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Famvir a jak se používá?
Famvir je lék na předpis používaný k léčbě příznaků akutního herpes zoster (pásový opar), herpes labiallis a genitální herpes. Famvir 250 mg lze užívat samostatně nebo s jinými léky.
Famvir 250 mg patří do třídy léků nazývaných antivirotika, jiné.
Není známo, zda je přípravek Famvir bezpečný a účinný u dětí mladších 18 let.
Jaké jsou možné nežádoucí účinky přípravku Famvir 250 mg?
Famvir 250 mg může způsobit závažné nežádoucí účinky včetně:
- zmatek,
- malé nebo žádné močení,
- otoky nohou nebo kotníků,
- únava a
- dušnost
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Famvir 500 mg patří:
- bolest hlavy a
- nevolnost
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Famvir. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Účinnou složkou přípravku FAMVIR 500 mg tablety je famciklovir, perorálně podávané proléčivo antivirového činidla pencikloviru. Chemicky je famciclovir známý jako 2-[2-(2-amino-9H-purin-9-yl)ethyl]-1,3-propandiol diacetát. Jeho molekulový vzorec je C14H19N5O4; jeho molekulová hmotnost je 321,3. Je to syntetický derivát acyklického guaninu a má následující strukturu
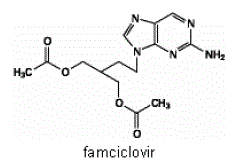
Famciclovir je bílá až světle žlutá pevná látka. Je volně rozpustný v acetonu a methanolu a těžce rozpustný v ethanolu a isopropanolu. Při 25 °C je famciclovir zpočátku volně rozpustný (>25 % w/v) ve vodě, ale rychle se vysráží jako těžko rozpustný (2 %-3 % w/v) monohydrát. Famciclovir není hygroskopický pod 85 % relativní vlhkosti. Rozdělovací koeficienty jsou: oktanol/voda (pH 4,8) P=1,09 a oktanol/fosfátový pufr (pH 7,4) P=2,08.
Tablety FAMVIR 250 mg obsahují 125 mg, 250 mg nebo 500 mg famcikloviru spolu s následujícími neaktivními složkami: hydroxypropylcelulóza, hydroxypropylmethylcelulóza, laktóza, magnesium-stearát, polyethylenglykoly, sodná sůl glykolátu škrobu a oxid titaničitý.
INDIKACE
Imunokompetentní dospělí pacienti
Herpes labialis (opary)
FAMVIR je indikován k léčbě recidivujícího herpes labialis.
Genitální opar
Opakované epizody:
FAMVIR je indikován k léčbě rekurentních epizod genitálního herpesu. Účinnost přípravku FAMVIR při zahájení více než 6 hodin po nástupu příznaků nebo lézí nebyla stanovena.
Supresivní terapie:
FAMVIR 250 mg je indikován k chronické supresivní léčbě recidivujících epizod genitálního herpesu. Účinnost a bezpečnost přípravku FAMVIR pro potlačení recidivujícího genitálního herpesu po 1 roce nebyla stanovena.
Herpes zoster (pásový opar)
FAMVIR 500 mg je indikován k léčbě pásového oparu. Účinnost přípravku FAMVIR při zahájení více než 72 hodin po nástupu vyrážky nebyla stanovena.
Dospělí pacienti infikovaní HIV
Opakující se orolabiální nebo genitální herpes
FAMVIR je indikován k léčbě rekurentních epizod orolabiálního nebo genitálního herpesu u dospělých infikovaných HIV. Účinnost přípravku FAMVIR při zahájení více než 48 hodin po nástupu příznaků nebo lézí nebyla stanovena.
Omezení používání
Účinnost a bezpečnost přípravku FAMVIR nebyla stanovena pro:
- Pacienti do 18 let
- Pacienti s první epizodou genitálního herpesu
- Pacienti s očním zoster
- Imunokompromitovaní pacienti jiní než pro léčbu rekurentního orolabiálního nebo genitálního herpesu u pacientů infikovaných HIV
- Černošští a afroameričtí pacienti s recidivujícím genitálním herpesem
DÁVKOVÁNÍ A PODÁVÁNÍ
FAMVIR 500 mg lze užívat s jídlem nebo bez jídla.
Doporučené dávkování u imunokompetentních dospělých pacientů
Herpes labialis (opary)
Doporučená dávka přípravku FAMVIR 500 mg pro léčbu recidivujícího herpes labialis je 1500 mg v jedné dávce. Léčba by měla být zahájena při prvním příznaku nebo symptomu herpes labialis (např. mravenčení, svědění, pálení, bolest nebo léze).
Genitální opar
Opakující se epizody
Doporučená dávka přípravku FAMVIR pro léčbu rekurentních epizod genitálního herpesu je 1000 mg dvakrát denně po dobu 1 dne. Terapie by měla být zahájena při prvním příznaku nebo symptomu rekurentní epizody (např. mravenčení, svědění, pálení, bolest nebo léze).
Supresivní terapie
Doporučená dávka přípravku FAMVIR 500 mg pro chronickou supresivní terapii recidivujících epizod genitálního herpesu je 250 mg dvakrát denně.
Herpes zoster (pásový opar)
Doporučená dávka přípravku FAMVIR 250 mg pro léčbu pásového oparu je 500 mg každých 8 hodin po dobu 7 dnů. Léčba by měla být zahájena, jakmile je diagnostikován pásový opar.
Doporučené dávkování u dospělých pacientů infikovaných HIV
Opakující se orolabiální nebo genitální herpes
Doporučená dávka přípravku FAMVIR pro léčbu recidivujícího orolabiálního nebo genitálního herpesu u pacientů infikovaných HIV je 500 mg dvakrát denně po dobu 7 dnů. Terapie by měla být zahájena při prvním příznaku nebo symptomu rekurentní epizody (např. mravenčení, svědění, pálení, bolest nebo léze).
Doporučené dávkování u pacientů s poruchou funkce ledvin
Doporučené dávkování pro dospělé pacienty s poruchou funkce ledvin jsou uvedeny v tabulce 1 [viz Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety FAMVIR jsou dostupné ve 3 silách:
- 125 mg: Bílé, kulaté, potažené, bikonvexní, zkosené okraje, s vyraženým „FAMVIR“ na jedné straně a „125“ na druhé straně
- 250 mg: Bílé, kulaté, potažené, bikonvexní, zkosené okraje, s vyraženým „FAMVIR“ na jedné straně a „250“ na druhé straně
- 500 mg: Bílý, oválný, potažený, bikonvexní, s vyraženým „FAMVIR“ na jedné straně a „500“ na druhé straně
Skladování A Manipulace
FAMVIR tablety se dodávají jako potahované tablety takto: 125 mg v lahvičkách po 30; 250 mg v lahvičkách po 30; 500 mg v lahvičkách po 30 a jednojednotkové balení po 50 (určeno pouze pro institucionální použití).
- FAMVIR 125 mg tableta: Bílá, kulatá potahovaná tableta, bikonvexní, se zkosenými hranami, s vyraženým „FAMVIR“ na jedné straně a „125“ na druhé straně. 125 mg 30. let NDC 0078-0366-15
- FAMVIR 250 mg tableta : Bílé, kulaté, potažené filmem, bikonvexní, zkosené hrany, s vyraženým „FAMVIR“ na jedné straně a „250“ na druhé. 250 mg 30. let NDC 0078-0367-15
- FAMVIR 500 mg tableta : Bílá, oválná, potažená filmem, bikonvexní, s vyraženým „FAMVIR“ na jedné straně a „500“ na druhé. 500 mg 30. let NDC 0078-0368-15 500 mg SUP 50's NDC 0078-0368-64
Skladujte při teplotě 25 °C (77 °F); povolené odchylky do 15-30°C (59-86°F) [viz USP Controlled Room Temperature].
Distribuce: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Revize: září 2016
VEDLEJŠÍ EFEKTY
Akutní selhání ledvin je podrobněji diskutováno v jiných částech štítku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nejčastějšími nežádoucími účinky hlášenými alespoň v 1 indikaci u >10 % dospělých pacientů léčených přípravkem FAMVIR 250 mg jsou bolest hlavy a nauzea.
Zkušenosti z klinických studií u dospělých pacientů
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Imunokompetentní pacienti
Bezpečnost přípravku FAMVIR 250 mg byla hodnocena v aktivních a placebem kontrolovaných klinických studiích zahrnujících 816 pacientů léčených přípravkem FAMVIR s pásovým oparem (FAMVIR, 250 mg třikrát denně až 750 mg třikrát denně); 163 pacientů léčených FAMVIRem s recidivujícím genitálním herpesem (FAMVIR, 1000 mg dvakrát denně); 1 197 pacientů s recidivujícím genitálním herpesem léčených FAMVIR 250 mg jako supresivní terapie (125 mg jednou denně až 250 mg třikrát denně), z nichž 570 pacientů dostávalo FAMVIR (otevřený a/nebo dvojitě zaslepený) po dobu nejméně 10 měsíců; a 447 pacientů s herpes labialis léčených FAMVIR (FAMVIR 500 mg, 1500 mg jednou denně nebo 750 mg dvakrát denně). Tabulka 2 uvádí vybrané nežádoucí účinky.
Tabulka 3 uvádí vybrané laboratorní abnormality ve studiích suprese genitálního herpesu.
Pacienti infikovaní HIV
U pacientů infikovaných HIV byly nejčastěji hlášenými nežádoucími účinky pro FAMVIR (500 mg dvakrát denně; n=150) a acyklovir (400 mg, 5x/den; n=143), v tomto pořadí, bolest hlavy (17 % vs. 15 % ), nevolnost (11 % vs. 13 %), průjem (7 % vs. 11 %), zvracení (5 % vs. 4 %), únava (4 % vs. 2 %) a bolesti břicha (3 % vs. 6 %).
Postmarketingové zkušenosti
Nežádoucí účinky uvedené níže byly hlášeny během používání přípravku FAMVIR po schválení. Protože jsou tyto příhody hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí drogám:
Poruchy krve a lymfatického systému : Trombocytopenie
Poruchy jater a žlučových cest : Abnormální jaterní testy, cholestatická žloutenka
Poruchy imunitního systému : Anafylaktický šok, anafylaktická reakce
Poruchy nervového systému : Závratě, ospalost, záchvaty
Psychiatrické poruchy zmatenost (včetně deliria, dezorientace a stavu zmatenosti vyskytující se převážně u starších osob), halucinace
Poruchy kůže a podkoží : Kopřivka, multiformní erytém, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, angioedém (např. edém obličeje, očních víček, periorbitální a faryngeální edém), hypersenzitivní vaskulitida
Srdeční poruchy : Palpitace
DROGOVÉ INTERAKCE
Potenciál pro FAMVIR 250 mg ovlivnit jiné léky
Farmakokinetika digoxinu v rovnovážném stavu se nezměnila při současném podávání více dávek famcikloviru (500 mg třikrát denně). Po jednorázové perorální dávce 500 mg famcikloviru podané současně se zidovudinem nebo emtricitabinem nebyl pozorován žádný klinicky významný účinek na farmakokinetiku zidovudinu, jeho metabolitu zidovudin glukuronidu nebo emtricitabinu.
Studie in vitro s použitím lidských jaterních mikrozomů naznačuje, že famciklovir není inhibitorem enzymů CYP3A4.
Potenciál jiných léků ovlivnit penciklovir
Nebyly pozorovány žádné klinicky významné změny farmakokinetiky pencikloviru po podání jednorázové dávky 500 mg famcikloviru po předchozí léčbě opakovanými dávkami alopurinolu, cimetidinu, theofylinu, zidovudinu, prometazinu, když byly podány krátce po podání antacid (hydroxid hořečnatý a hlinitý) nebo současně emtricitabin. Po opakovaném podávání (třikrát denně) famcikloviru (500 mg) s opakovanými dávkami digoxinu nebyl pozorován žádný klinicky významný účinek na farmakokinetiku pencikloviru.
Současné užívání s probenecidem nebo jinými léky významně eliminovanými aktivní renální tubulární sekrecí může vést ke zvýšení plazmatických koncentrací pencikloviru.
Konverze 6-deoxypencikloviru na penciklovir je katalyzována aldehydoxidázou. Mohlo by dojít k interakcím s jinými léky metabolizovanými tímto enzymem a/nebo inhibujícími tento enzym. Klinické studie interakcí famcikloviru s cimetidinem a promethazinem, in vitro inhibitory aldehydoxidázy, neprokázaly významné účinky na tvorbu pencikloviru. Raloxifen, silný inhibitor aldehydoxidázy in vitro, by mohl snížit tvorbu pencikloviru. Klinická studie lékových interakcí ke stanovení velikosti interakce mezi penciklovirem a raloxifenem však nebyla provedena.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Akutní selhání ledvin
Případy akutního selhání ledvin byly hlášeny u pacientů se základním onemocněním ledvin, kteří dostávali nepřiměřeně vysoké dávky přípravku FAMVIR vzhledem k jejich úrovni funkce ledvin. Při podávání přípravku FAMVIR pacientům s poruchou funkce ledvin se doporučuje snížení dávky [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA (Informace pro pacienta).
Neexistuje žádný důkaz, že FAMVIR ovlivní schopnost pacienta řídit nebo obsluhovat stroje. Pacienti, u kterých se při užívání přípravku FAMVIR 500 mg objeví závratě, ospalost, zmatenost nebo jiné poruchy centrálního nervového systému, by se však měli zdržet řízení a obsluhy strojů.
Vzhledem k tomu, že přípravek FAMVIR obsahuje laktózu (tablety FAMVIR 125 mg, 250 mg a 500 mg obsahují laktózu 26,9 mg, 53,7 mg a 107,4 mg, v tomto pořadí), pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, závažným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by měli být léčeni doporučuje, aby se před užitím přípravku FAMVIR poradili se svým poskytovatelem zdravotní péče.
Herpes labialis (opary)
Pacientům je třeba doporučit, aby zahájili léčbu při prvních známkách nebo příznacích recidivy oparů (např. brnění, svědění, pálení, bolesti nebo léze). Pacienti by měli být poučeni, že léčba oparů by neměla překročit 1 dávku. Pacienti by měli být informováni, že FAMVIR není lékem na opary.
Genitální opar
Pacienti by měli být informováni, že FAMVIR není lékem na genitální herpes. Neexistují žádné údaje hodnotící, zda FAMVIR zabrání přenosu infekce na jiné osoby. Vzhledem k tomu, že genitální herpes je sexuálně přenosné onemocnění, pacienti by se měli vyhnout kontaktu s lézemi nebo pohlavnímu styku, pokud jsou přítomny léze a/nebo symptomy, aby se zabránilo infekci partnerů. Genitální herpes se často přenáší bez příznaků prostřednictvím asymptomatického šíření viru. Pacienti by proto měli být poučeni, aby používali praktiky bezpečnějšího sexu.
Pokud je indikována epizodická léčba recidivujícího genitálního herpesu, je třeba pacientům doporučit, aby zahájili léčbu při prvních známkách nebo příznacích epizody.
Neexistují žádné údaje o bezpečnosti nebo účinnosti chronické supresivní terapie trvající déle než 1 rok.
Herpes zoster (pásový opar)
Neexistují žádné údaje o léčbě zahájené více než 72 hodin po propuknutí vyrážky zoster. Pacienti by měli být poučeni, aby zahájili léčbu co nejdříve po diagnóze pásového oparu.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Dvouleté dietní studie karcinogenity s famciklovirem byly provedeny na potkanech a myších. U samic potkanů, kterým byla podávána vysoká dávka 600 mg/kg/den (1,1 až 4,5násobek systémové expozice u člověka při doporučené celkové denní perorální dávce), byl pozorován zvýšený výskyt adenokarcinomu mléčné žlázy (běžný nádor u zvířat tohoto kmene). v rozmezí mezi 500 mg a 2000 mg, na základě plochy pod křivkou plazmatické koncentrace srovnání [24 hodin AUC] pro penciklovir). Nebylo hlášeno žádné zvýšení incidence nádorů u samců potkanů léčených dávkami až 240 mg/kg/den (0,7 až 2,7násobek lidské AUC) nebo u samců a samic myší při dávkách až 600 mg/kg/den (0,3 až 1,2x lidská AUC).
Mutageneze
Famciklovir a penciklovir (aktivní metabolit famcikloviru) byly testovány na genotoxický potenciál v řadě testů in vitro a in vivo. Famciclovir a penciclovir byly negativní v in vitro testech na genové mutace u bakterií (S. typhimurium a E. coli) a neplánovanou syntézu DNA v savčích buňkách HeLa 83 (v dávkách až 10 000 a 5 000 mcg/misku, v tomto pořadí). Famciclovir byl také negativní v testu L5178Y myšího lymfomu (5000 mcg/ml), in vivo mikronukleárním testu na myších (4800 mg/kg) a ve studii s dominantní letální smrtí u potkanů (5000 mg/kg). Famciclovir indukoval zvýšení polyploidie v lidských lymfocytech in vitro bez poškození chromozomů (1200 mcg/ml). Penciklovir byl pozitivní v testu myšího lymfomu L5178Y na genové mutace/chromozomální aberace, s metabolickou aktivací i bez ní (1000 mcg/ml). V lidských lymfocytech způsoboval penciklovir chromozomální aberace v nepřítomnosti metabolické aktivace (250 mcg/ml). Penciklovir způsobil zvýšený výskyt mikrojader v kostní dřeni myší in vivo, když byl podáván intravenózně v dávkách vysoce toxických pro kostní dřeň (500 mg/kg), ale ne při perorálním podání.
Zhoršení Plodnosti
Testikulární toxicita byla pozorována u potkanů, myší a psů po opakovaném podání famcikloviru nebo pencikloviru. Testikulární změny zahrnovaly atrofii semenotvorných kanálků, snížení počtu spermií a/nebo zvýšený výskyt spermií s abnormální morfologií nebo sníženou pohyblivostí. Stupeň toxicity pro samčí reprodukci souvisel s dávkou a délkou expozice. U samců potkanů byla po 10 týdnech podávání 500 mg/kg/den pozorována snížená fertilita (1,4 až 5,7násobek lidské AUC). Hladina bez pozorovatelného účinku na spermie a testikulární toxicitu u potkanů po chronickém podávání (26 týdnů) byla 50 mg/kg/den (0,15 až 0,6násobek systémové expozice u člověka na základě srovnání AUC). Testikulární toxicita byla pozorována po chronickém podávání myším (104 týdnů) a psům (26 týdnů) v dávkách 600 mg/kg/den (0,3 až 1,2násobek lidské AUC) a 150 mg/kg/den (1,3 až 5,1násobek vyšší než lidská AUC), resp.
Famciclovir neměl žádný účinek na celkovou reprodukční schopnost nebo fertilitu u samic potkanů v dávkách až 1000 mg/kg/den (2,7 až 10,8násobek lidské AUC).
Dvě placebem kontrolované studie u celkem 130 jinak zdravých mužů s normálním profilem spermií během 8týdenního výchozího období a recidivujícím genitálním herpesem, kteří dostávali perorální FAMVIR (250 mg dvakrát denně) (n=66) nebo placebo (n=64) terapie po dobu 18 týdnů neprokázala žádné významné účinky na počet spermií, motilitu nebo morfologii během léčby nebo během 8týdenního sledování.
Použití u konkrétních populací
Těhotenství
Těhotenství kategorie B
Po perorálním podání se famciklovir (proléčivo) přemění na penciklovir (aktivní léčivo). Neexistují žádné adekvátní a dobře kontrolované studie použití famcikloviru nebo pencikloviru u těhotných žen. V reprodukčních studiích na zvířatech s použitím famcikloviru a pencikloviru v dávkách vyšších, než je maximální doporučená dávka pro člověka (MRHD) a expozice u člověka, nebyly pozorovány žádné nežádoucí účinky na embryofetální vývoj. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, měl by být famciklovir během těhotenství používán pouze v případě potřeby.
reprodukčních studiích na zvířatech dostávaly březí potkaní potkani a králíci perorálně famciklovir v dávkách (až 1000 mg/kg/den), které poskytly 2,7 až 10,8násobek (potkani) a 1,4 až 5,4násobek (králíky) systémové expozice u člověka na základě AUC. Nebyly pozorovány žádné nežádoucí účinky na vývoj embrya a plodu. V jiných studiích dostávaly březí krysy a králice intravenózně famciklovir v dávkách (360 mg/kg/den) 1,5 až 6krát (potkani) a (120 mg/kg/den) 1,1 až 4,5krát (králíci) nebo penciklovir v dávkách (80 mg/kg/den) 0,3 až 1,3násobek (krysy) a (60 mg/kg/den) 0,5 až 2,1násobek (králíky) MRHD na základě srovnání plochy povrchu těla. Nebyly pozorovány žádné nežádoucí účinky na vývoj embrya a plodu.
Hlášení expozice v těhotenství
Pro sledování výsledků matek a plodů těhotných žen vystavených FAMVIR 500 mg společnost Novartis Pharmaceuticals Corporation udržuje systém hlášení těhotenství FAMVIR. Lékařům se doporučuje, aby své pacienty hlásili na telefonním čísle 1-888-NOW-NOVA (669-6682).
Kojící matky
Není známo, zda se famciklovir (proléčivo) nebo penciklovir (aktivní léčivo) vylučují do mateřského mléka. Po perorálním podání famcikloviru kojícím potkanům byl penciklovir vylučován do mateřského mléka v koncentracích vyšších, než jsou koncentrace pozorované v plazmě. Neexistují žádné údaje o bezpečnosti přípravku FAMVIR 250 mg u kojenců. FAMVIR 500 mg by neměl být podáván kojícím matkám, pokud potenciální přínosy nepřeváží potenciální rizika spojená s léčbou.
Pediatrické použití
Účinnost přípravku FAMVIR 250 mg nebyla u pediatrických pacientů stanovena. Farmakokinetický profil a bezpečnost famcikloviru (experimentální granule smíchané s OraSweet® nebo tablety) byly studovány ve 3 otevřených studiích.
Studie 1 byla farmakokinetická a bezpečnostní studie s jednorázovou dávkou u kojenců ve věku 1 měsíc až
Studie 2 byla otevřená farmakokinetická studie bezpečnosti s jednorázovou dávkou s opakovanými dávkami experimentálních granulí famcikloviru smíchaných s OraSweet u dětí ve věku 1 až
Celkem 100 pacientů bylo zařazeno do bezpečnostní části studie s vícenásobnými dávkami; 47 subjektů s aktivní nebo latentní infekcí HSV a 53 subjektů s planými neštovicemi. Pacienti s aktivní nebo latentní infekcí HSV dostávali famciklovir dvakrát denně po dobu 7 dnů. Denní dávka famcikloviru se pohybovala od 150 mg do 500 mg dvakrát denně v závislosti na tělesné hmotnosti pacienta. Pacienti s planými neštovicemi dostávali famciclovir třikrát denně po dobu 7 dnů. Denní dávka famcikloviru se pohybovala od 150 mg do 500 mg třikrát denně v závislosti na tělesné hmotnosti pacienta. Klinické nežádoucí účinky a abnormality laboratorních testů pozorované v této studii byly podobné těm, které byly pozorovány u dospělých. Dostupné údaje nejsou dostatečné pro podporu použití famcikloviru k léčbě dětí ve věku 1 až
Plané neštovice
Účinnost famcikloviru v léčbě planých neštovic nebyla stanovena ani u pediatrických, ani u dospělých pacientů. Famciclovir je schválen pro léčbu herpes zoster u dospělých pacientů. Extrapolace údajů o účinnosti od dospělých s pásovým oparem na děti s planými neštovicemi by však nebyla vhodná. Ačkoli plané neštovice a pásový opar jsou způsobeny stejným virem, onemocnění se liší.
Genitální opar
Klinické informace o genitálním herpesu u dětí jsou omezené. Údaje o účinnosti od dospělých proto nelze extrapolovat na tuto populaci. Dále famciklovir nebyl studován u dětí ve věku 1 až
Herpes Labialis
Neexistují žádné farmakokinetické a bezpečnostní údaje u dětí ve věku 1 až
Studie 3 byla otevřená jednoramenná studie k hodnocení farmakokinetiky, bezpečnosti a antivirové aktivity jedné dávky 1500 mg (tři 500mg tablety) famcikloviru u dětí ve věku 12 až
Ve studii fáze 3 u dospělých, ve které pacienti dostávali jednu dávku 1500 mg famcikloviru nebo placebo, byla střední doba do hojení u pacientů s nepotracenými lézemi 4,4 dne ve skupině s 1 500 mg famcikloviru v jedné dávce a 6,2 dne ve skupině placebo skupina. Je třeba poznamenat, že ve studii u dospělých byla léčba zahájena pacienty během 1 hodiny po nástupu příznaků [viz Klinické studie ]. Na základě výsledků účinnosti ve studii 3 se famciklovir nedoporučuje u dětí ve věku 12 až
Geriatrické použití
816 pacientů s herpes zoster v klinických studiích, kteří byli léčeni přípravkem FAMVIR, bylo 248 (30,4 %) ve věku ≥ 65 let a 103 (13 %) bylo ve věku ≥ 75 let. Nebyly pozorovány žádné celkové rozdíly ve výskytu nebo typech nežádoucích účinků mezi mladšími a staršími pacienty. Z 610 pacientů s rekurentním herpes simplex (typ 1 nebo typ 2) v klinických studiích, kteří byli léčeni přípravkem FAMVIR 500 mg, bylo 26 (4,3 %) ve věku >65 let a 7 (1,1 %) bylo ve věku >75 let. Klinické studie přípravku FAMVIR 500 mg u pacientů s recidivujícím genitálním herpesem nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně ve srovnání s mladšími subjekty.
Nedoporučuje se žádná úprava dávkování famcikloviru na základě věku, pokud není narušena funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ]. Obecně je třeba věnovat náležitou pozornost podávání a sledování přípravku FAMVIR 250 mg u starších pacientů, což odráží vyšší frekvenci snížené funkce ledvin a současné užívání jiných léků.
Pacienti s poruchou ledvin
Zdánlivá plazmatická clearance, renální clearance a konstanta rychlosti eliminace pencikloviru z plazmy klesaly lineárně se snížením renálních funkcí. Po podání jednorázové perorální dávky 500 mg famcikloviru (n=27) zdravým dobrovolníkům a dobrovolníkům s různým stupněm poškození ledvin (CLCR se pohybovalo od 6,4 do 138,8 ml/min) byly získány následující výsledky (tabulka 4):
Ve studii s opakovanými dávkami famcikloviru provedené u subjektů s různým stupněm poškození ledvin (n=18) byla farmakokinetika pencikloviru srovnatelná s farmakokinetikou po jednotlivých dávkách.
U pacientů s poruchou funkce ledvin se doporučuje úprava dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pacienti s poruchou funkce jater
Mírné nebo středně těžké poškození jater (chronická hepatitida [n=6], chronické zneužívání etanolu [n=8] nebo primární biliární cirhóza [n=1]) nemělo žádný vliv na rozsah dostupnosti (AUC) pencikloviru po jedné dávce 500 mg famcikloviru. U pacientů s poruchou funkce jater však ve srovnání s normálními dobrovolníky došlo ke snížení průměrné maximální plazmatické koncentrace (Cmax) pencikloviru o 44 % a doba dosažení maximální plazmatické koncentrace (tmax) byla prodloužena o 0,75 hodiny. U pacientů s mírnou nebo středně těžkou poruchou funkce jater se nedoporučuje žádná úprava dávkování. Farmakokinetika pencikloviru nebyla hodnocena u pacientů s těžkou poruchou funkce jater. Konverze famcikloviru na aktivní metabolit penciklovir může být u těchto pacientů narušena, což vede k nižším plazmatickým koncentracím pencikloviru, a tím pravděpodobně ke snížení účinnosti famcikloviru (viz KLINICKÁ FARMAKOLOGIE ].
Černí a afroameričtí pacienti
randomizované, dvojitě zaslepené, placebem kontrolované studii provedené u 304 imunokompetentních dospělých černochů a Afroameričanů s recidivujícím genitálním herpesem nebyl mezi pacienty užívajícími FAMVIR nebo placebo žádný rozdíl v mediánu doby do vyléčení. Obecně byl profil nežádoucích účinků podobný profilu pozorovanému v jiných klinických studiích FAMVIR u dospělých pacientů (viz NEŽÁDOUCÍ REAKCE ]. Význam těchto výsledků studie pro jiné indikace u černošských a afroamerických pacientů není znám [viz Klinické studie ].
PŘEDÁVKOVAT
Měla by být poskytnuta vhodná symptomatická a podpůrná léčba. Penciklovir se odstraňuje hemodialýzou.
KONTRAINDIKACE
FAMVIR 250 mg je kontraindikován u pacientů se známou přecitlivělostí na přípravek, jeho složky nebo Denavir® (penciklovirový krém).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Famciclovir je perorálně podávané proléčivo antivirového činidla pencikloviru [viz Mikrobiologie ].
Farmakokinetika
Famciclovir je diacetyl-6-deoxy analog účinné antivirové sloučeniny pencikloviru. Po perorálním podání famciklovir podléhá rychlému a rozsáhlému metabolismu na penciklovir a v plazmě nebo moči je detekováno jen malé množství nebo žádný famciklovir. Penciklovir se vylučuje převážně v nezměněné podobě ledvinami. U pacientů s různým stupněm poruchy funkce ledvin je proto třeba dávku přípravku FAMVIR 500 mg upravit (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Farmakokinetika u dospělých
Absorpce a biologická dostupnost:
Absolutní biologická dostupnost pencikloviru je 77 ± 8 %, jak bylo stanoveno po podání perorální dávky 500 mg famcikloviru a intravenózní dávky 400 mg pencikloviru 12 zdravým mužům.
Koncentrace pencikloviru se zvyšovaly úměrně dávce v rozmezí dávek famcikloviru od 125 mg do 1000 mg podaných v jedné dávce. Tabulka 5 ukazuje průměrné farmakokinetické parametry pencikloviru po jednorázovém podání FAMVIR zdravým mužským dobrovolníkům.
Po perorálním podání jedné dávky 500 mg famcikloviru 7 pacientům s pásovým oparem byly AUC (průměr ± SD), Cmax a tmax 12,1 ± 1,7 mcg h/ml, 4,0 ± 0,7 mcg/ml a 0,7 ± 0,2 hodiny , resp. AUC pencikloviru byla přibližně o 35 % vyšší u pacientů s herpes zoster ve srovnání se zdravými dobrovolníky. Některé z těchto rozdílů mohou být způsobeny rozdíly ve funkci ledvin mezi těmito dvěma skupinami.
Po podávání 500 mg famcikloviru třikrát denně po dobu 7 dnů nedochází k žádné akumulaci pencikloviru.
Cmax pencikloviru se snížila přibližně o 50 % a tmax se opozdil o 1,5 hodiny, když byla famciklovir ve formě tobolek podáván s jídlem (nutriční obsah byl přibližně 910 kcal a 26 % tuku). Nebyl žádný vliv na rozsah dostupnosti (AUC) pencikloviru. Při podání famcikloviru 2 hodiny po jídle došlo k 18% poklesu Cmax a zpoždění tmax o přibližně 1 hodinu ve srovnání s jeho podáním 2 hodiny před jídlem. Protože nebyl ovlivněn rozsah systémové dostupnosti pencikloviru, lze přípravek FAMVIR 250 mg užívat bez ohledu na jídlo.
Rozdělení:
Distribuční objem (Vdβ) byl 1,08±0,17 l/kg u 12 zdravých mužů po jednorázové intravenózní dávce 400 mg pencikloviru podané jako 1hodinová intravenózní infuze. Penciklovir se váže z
Metabolismus:
Po perorálním podání je famciklovir deacetylován a oxidován za vzniku pencikloviru. Mezi neaktivní metabolity patří 6-deoxypenciklovir, monoacetylovaný penciklovir a 6-deoxymonoacetylovaný penciklovir (5%, DROGOVÉ INTERAKCE ].
Odstranění:
Přibližně 94 % podané radioaktivity bylo nalezeno v moči během 24 hodin (83 % dávky bylo vyloučeno během prvních 6 hodin) po podání 5 mg/kg radioaktivně značeného pencikloviru ve formě 1hodinové infuze 3 zdravým dobrovolníkům mužského pohlaví. Penciklovir představoval 91 % radioaktivity vyloučené močí.
Po perorálním podání jedné 500mg dávky radioaktivně značeného famcikloviru 3 zdravým mužským dobrovolníkům bylo 73 % a 27 % podané radioaktivity nalezeno v moči a 27 % ve stolici během 72 hodin. Penciklovir představoval 82 % a 6-deoxypenciklovir představoval 7 % radioaktivity vyloučené močí. Přibližně 60 % podané radioaktivně značené dávky bylo zachyceno v moči během prvních 6 hodin.
Po intravenózním podání pencikloviru 48 zdravým mužským dobrovolníkům byla průměrná ± SD celková plazmatická clearance pencikloviru 36,6 ± 6,3 l/hod (0,48 ± 0,09 l/hod/kg). Renální clearance pencikloviru představovala 74,5±8,8 % celkové plazmatické clearance.
Renální clearance pencikloviru po perorálním podání jedné dávky 500 mg famcikloviru 109 zdravým mužským dobrovolníkům byla 27,7±7,6 l/hod. Aktivní tubulární sekrece přispívá k renální eliminaci pencikloviru.
Plazmatický eliminační poločas pencikloviru byl 2,0±0,3 hodiny po intravenózním podání pencikloviru 48 zdravým mužským dobrovolníkům a 2,3±0,4 hodiny po perorálním podání 500 mg famcikloviru 124 zdravým mužským dobrovolníkům. Poločas u 17 pacientů s pásovým oparem byl 2,8±1,0 hodiny a 2,7±1,0 hodiny po jednorázové a opakované dávce.
Zvláštní populace
Geriatričtí pacienti
Na základě srovnání zkřížených studií byla AUC pencikloviru o 40 % vyšší a renální clearance pencikloviru o 22 % nižší u starších subjektů (n=18, věk 65-79 let) ve srovnání s mladšími subjekty. Některé z těchto rozdílů mohou být způsobeny rozdíly ve funkci ledvin mezi těmito dvěma skupinami. Nedoporučuje se žádná úprava dávkování famcikloviru na základě věku, pokud není narušena funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ]
Pacienti s poruchou ledvin
subjektů s různým stupněm poškození ledvin se zdánlivá plazmatická clearance, renální clearance a konstanta rychlosti eliminace pencikloviru z plazmy lineárně snižovaly se snížením renálních funkcí, a to jak po jednorázovém, tak po opakovaném podání (viz Použití u konkrétních populací ]. U pacientů s poruchou funkce ledvin se doporučuje úprava dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pacienti s poruchou funkce jater
Mírné nebo středně těžké poškození jater nemělo žádný vliv na rozsah dostupnosti (AUC) pencikloviru (viz Použití u konkrétních populací ]. U pacientů s mírnou nebo středně těžkou poruchou funkce jater se nedoporučuje žádná úprava dávkování. Vliv těžkého poškození jater na farmakokinetiku pencikloviru nebyl hodnocen.
Pacienti infikovaní HIV
Po perorálním podání jednorázové dávky 500 mg famcikloviru HIV pozitivním pacientům byly farmakokinetické parametry pencikloviru srovnatelné s parametry pozorovanými u zdravých subjektů.
Rod
Farmakokinetika pencikloviru byla hodnocena u 18 zdravých mužských a 18 zdravých dobrovolníků po perorálním podání jedné dávky 500 mg famcikloviru. AUC pencikloviru byla 9,3 ± 1,9 mcg h/ml u mužů a 11,1 ± 2,1 mcg h/ml u mužů a žen. Renální clearance pencikloviru byla 28,5±8,9 l/hod a 21,8±4,3 l/hod. Tyto rozdíly byly připsány rozdílům ve funkci ledvin mezi těmito dvěma skupinami. Nedoporučuje se žádná úprava dávkování famcikloviru na základě pohlaví.
Závod
Bylo provedeno retrospektivní hodnocení za účelem srovnání farmakokinetických parametrů získaných u jedinců černé pleti a bělochů po jednorázovém a opakovaném podávání famcikloviru 500 mg jednou denně, dvakrát denně nebo třikrát denně. Údaje ze studie u zdravých dobrovolníků (jednorázová dávka), studie u subjektů s různým stupněm poškození ledvin (jednorázová a opakovaná dávka) a studie u subjektů s poškozením jater (jednorázová dávka) neukázaly žádné významné rozdíly ve farmakokinetice penciklovir mezi černochy a kavkazskými subjekty.
Mikrobiologie
Mechanismus působení
Famciclovir je proléčivo pencikloviru, které prokázalo inhibiční aktivitu proti viru herpes simplex typu 1 (HSV-1) a 2 (HSV-2) a viru varicella zoster (VZV). V buňkách infikovaných HSV-1, HSV-2 nebo VZV virová thymidinkináza fosforyluje penciklovir na monofosfátovou formu, která je naopak buněčnými kinázami přeměněna na aktivní formu penciklovirtrifosfát. Biochemické studie ukazují, že penciklovir trifosfát inhibuje HSV-2 DNA polymerázu kompetitivně s deoxyguanosintrifosfátem. V důsledku toho je selektivně inhibována syntéza DNA viru herpes a tím i replikace. Penciclovir trifosfát má intracelulární poločas 10 hodin v HSV-1-, 20 hodin v HSV-2- a 7 hodin v buňkách infikovaných VZV pěstovaných v kultuře. Klinický význam intracelulárního poločasu však není znám.
Antivirová aktivita
Ve studiích na buněčných kulturách je penciklovir inhibiční vůči následujícím herpetickým virům: HSV-1, HSV-2 a VZV. Antivirová aktivita pencikloviru proti kmenům divokého typu pěstovaných na fibroblastech lidské předkožky byla hodnocena testem redukce plaků a barvením krystalovou violetí 3 dny po infekci pro HSV a 10 dní po infekci pro VZV. Střední hodnoty EC50 pencikloviru proti laboratorním a klinickým izolátům HSV-1, HSV-2 a VZV byly 2 μM (rozsah 1,2 až 2,4 μM, n=7), 2,6 μM (rozsah 1,6 až 11 μM, n=6) a 34 uM (rozsah 6,7 až 71 uM, n=6).
Odpor
Mutace HSV a VZV rezistentní na penciklovir mohou být výsledkem mutací v genech virové thymidinkinázy (TK) a DNA polymerázy. Mutace ve virovém genu TK mohou vést k úplné ztrátě aktivity TK (TK negativní), sníženým hladinám aktivity TK (částečná TK) nebo změně schopnosti virové TK fosforylovat lék bez ekvivalentní ztráty schopnosti fosforylovat thymidin (TK změněný). Střední hodnoty EC50 pozorované v testu redukce plaku s HSV-1, HSV-2 a VZV rezistentními na penciklovir byly 69 μM (rozsah 14 až 115 μM, n=6), 46 μM (rozsah 4 až >395 μM, n= 9), respektive 92 uM (rozsah 51 až 148 uM, n=4). Možnost virové rezistence na penciklovir by měla být zvážena u pacientů, kteří nereagují na léčbu nebo se u nich během léčby objeví opakované vylučování viru.
Křížový odpor
Mezi inhibitory HSV DNA polymerázy byla pozorována zkřížená rezistence. Nejčastěji se vyskytující mutanti rezistentní na acyklovir, kteří jsou TK negativní, jsou také rezistentní na penciklovir.
Klinické studie
Herpes labialis (opary)
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie byla provedena u 701 imunokompetentních dospělých s recidivujícím herpes labialis. Pacienti si sami zahájili léčbu během 1 hodiny od prvního nástupu známek nebo příznaků rekurentní epizody herpes labialis s přípravkem FAMVIR 1500 mg v jedné dávce (n=227), přípravkem FAMVIR 750 mg dvakrát denně (n=220) nebo placebem (n= 254) na 1 den. Medián doby do zhojení u pacientů s neabortovanými lézemi (progredujícími za papulové stadium) byl 4,4 dne ve skupině FAMVIR 1500 mg s jednou dávkou (n=152) ve srovnání s 6,2 dny ve skupině s placebem (n=168). . Medián rozdílu v době do hojení mezi skupinami léčenými placebem a FAMVIR 1500 mg byl 1,3 dne (95% CI: 0,6–2,0). Mezi pacienty užívajícími FAMVIR 250 mg nebo placebo nebyly pozorovány žádné rozdíly v poměru pacientů s abortovanými lézemi (neprogredujícími do stadia papuly): 33 % pro FAMVIR 1500 mg v jedné dávce a 34 % pro placebo. Střední doba do ztráty bolesti a citlivosti byla 1,7 dne u pacientů léčených FAMVIR 1500 mg jednou dávkou vs. 2,9 dne u pacientů léčených placebem.
Genitální opar
Opakující se epizody
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie byla provedena u 329 imunokompetentních dospělých s recidivujícím genitálním herpesem. Pacienti si sami zahájili terapii během 6 hodin od prvních známek nebo příznaků rekurentní epizody genitálního herpesu buď přípravkem FAMVIR 1000 mg dvakrát denně (n=163) nebo placebem (n=166) po dobu 1 dne. Medián doby do zhojení u pacientů s neabortovanými lézemi (progredujícími za papulové stadium) byl 4,3 dne u pacientů léčených FAMVIR (n=125) ve srovnání s 6,1 dne u pacientů léčených placebem (n=145). Střední rozdíl v době do hojení mezi skupinami léčenými placebem a FAMVIRem byl 1,2 dne (95% CI: 0,5 až 2,0). Dvacet tři procent pacientů léčených přípravkem FAMVIR mělo abortované léze (žádný vývoj lézí po erytému) oproti 13 % u pacientů léčených placebem. Medián doby do ztráty všech symptomů (např. mravenčení, svědění, pálení, bolesti nebo citlivosti) byl 3,3 dne u pacientů léčených FAMVIR vs. 5,4 dne u pacientů léčených placebem.
Randomizovaná (2:1), dvojitě zaslepená, placebem kontrolovaná studie byla provedena u 304 imunokompetentních dospělých černochů a Afroameričanů s recidivujícím genitálním herpesem. Pacienti si sami zahájili léčbu během 6 hodin od prvních známek nebo příznaků rekurentní epizody genitálního herpesu buď přípravkem FAMVIR 1000 mg dvakrát denně (n=206) nebo placebem (n=98) po dobu 1 dne. Medián doby do hojení u pacientů s neabortovanými lézemi byl 5,4 dne u pacientů léčených FAMVIR (n=152) ve srovnání se 4,8 dne u pacientů léčených placebem (n=78). Střední rozdíl v době do hojení mezi skupinami léčenými placebem a FAMVIR byl -0,26 dne (95% CI: -0,98 až 0,40).
Supresivní terapie
Dvě randomizované, dvojitě zaslepené, placebem kontrolované, 12měsíční studie byly provedeny u 934 imunokompetentních dospělých s anamnézou 6 nebo více recidiv genitálního herpesu za rok. Srovnání zahrnovalo FAMVIR 125 mg třikrát denně, 250 mg dvakrát denně, 250 mg třikrát denně a placebo. Po 12 měsících 60 % až 65 % pacientů stále dostávalo FAMVIR a 25 % dostávalo placebo. Míry recidivy po 6 a 12 měsících u pacientů léčených dávkou 250 mg dvakrát denně jsou uvedeny v tabulce 6.
Pacienti léčení FAMVIR měli přibližně 1/5 mediánu počtu recidiv ve srovnání s pacienty léčenými placebem. Vyšší dávky přípravku FAMVIR 250 mg nebyly spojeny se zvýšením účinnosti.
Opakující se orolabiální nebo genitální herpes u pacientů infikovaných HIV
Randomizovaná, dvojitě zaslepená studie porovnávala famciklovir 500 mg dvakrát denně po dobu 7 dnů (n=150) s perorálním acyklovirem 400 mg 5krát denně po dobu 7 dnů (n=143) u pacientů infikovaných HIV s rekurentním orolabiálním nebo genitálním herpesem léčeným během 48 hodin od začátku léze. Přibližně 40 % pacientů mělo počet CD4+ pod 200 buněk/mm3, 54 % pacientů mělo anogenitální léze a 35 % mělo orolabiální léze. Léčba famciklovirem byla srovnatelná s perorálním acyklovirem ve snížení tvorby nových lézí a v době úplného zhojení.
Herpes zoster (pásový opar)
Dvě randomizované, dvojitě zaslepené studie, 1 placebem kontrolovaná a 1 aktivně kontrolovaná, byly provedeny u 964 imunokompetentních dospělých s nekomplikovaným pásovým oparem. Léčba byla zahájena během 72 hodin od objevení se první léze a pokračovala po dobu 7 dnů.
placebem kontrolované studii bylo 419 pacientů léčeno buď přípravkem FAMVIR 500 mg třikrát denně (n=138), přípravkem FAMVIR 750 mg třikrát denně (n=135) nebo placebem (n=146). Medián doby do úplného krustování byl 5 dnů u pacientů léčených přípravkem FAMVIR 500 mg ve srovnání se 7 dny u pacientů léčených placebem. Časy do úplného krustování, ztráty vezikul, ztráty vředů a ztráty krust byly kratší u pacientů léčených přípravkem FAMVIR 500 mg než u pacientů léčených placebem v celkové populaci studie. Účinky přípravku FAMVIR 500 mg byly větší, když byla léčba zahájena do 48 hodin od nástupu vyrážky; byla také hlubší u pacientů ve věku 50 let nebo starších. Mezi 65,2 % pacientů s alespoň 1 pozitivní virovou kulturou měli pacienti léčení FAMVIR kratší střední dobu trvání vylučování viru než pacienti léčení placebem (1 den, respektive 2 dny).
Mezi skupinami léčenými FAMVIR a placebem nebyly žádné celkové rozdíly v trvání bolesti před zhojením vyrážky. Kromě toho nebyl mezi léčebnými skupinami žádný rozdíl ve výskytu bolesti po zhojení vyrážky (postherpetická neuralgie). U 186 pacientů (44,4 % z celkové studované populace), u kterých se rozvinula postherpetická neuralgie, byla střední doba trvání postherpetické neuralgie kratší u pacientů léčených přípravkem FAMVIR 500 mg než u pacientů léčených placebem (63 dnů, resp. 119 dnů). S vyšší dávkou FAMVIR nebyla prokázána žádná další účinnost.
V aktivně kontrolované studii bylo 545 pacientů léčeno 1 ze 3 dávek FAMVIRu třikrát denně nebo acyklovirem 800 mg pětkrát denně. Časy do úplného krustování léze a časy do ztráty akutní bolesti byly srovnatelné pro všechny skupiny a nebyly žádné statisticky významné rozdíly v době do ztráty postherpetické neuralgie mezi skupinami léčenými FAMVIR a acyklovirem.
INFORMACE PRO PACIENTA
FAMVIR® (Fam'-veer) (famciclovir) Tablety
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat FAMVIR a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě.
Co je FAMVIR?
Famvir je antivirový lék na předpis používaný k:
- k léčbě vzplanutí oparů (puchýřků při horečce) u zdravých dospělých
- léčit propuknutí genitálního herpesu u zdravých dospělých
- snížit počet propuknutí genitálního herpesu u zdravých dospělých
- k léčbě vzplanutí lézí herpes simplex v nebo kolem úst, genitálií a anální oblasti u lidí infikovaných HIV
- k léčbě pásového oparu (herpes zoster) u dospělých s normálním imunitním systémem
Není známo, zda je FAMVIR 500 mg bezpečný a účinný u dětí mladších 18 let.
FAMVIR 250 mg není lék na herpes. Není známo, zda FAMVIR může zastavit šíření herpesu na ostatní. Pokud jste sexuálně aktivní, můžete herpes přenést na svého partnera, i když užíváte FAMVIR. Herpes se může přenášet, i když nemáte aktivní příznaky. Měli byste pokračovat v praktikování bezpečnějšího sexu, abyste snížili šance na šíření genitálního herpesu na ostatní. Během propuknutí genitálního oparu nebo pokud máte jakékoli příznaky genitálního oparu, nemějte sexuální kontakt se svým partnerem. Při pohlavním styku používejte kondom vyrobený z latexu nebo polyuretanu. Požádejte svého poskytovatele zdravotní péče o další informace o praktikách bezpečného sexu.
Kdo by neměl užívat FAMVIR?
Neužívejte FAMVIR 250 mg, jestliže jste alergický(á) na kteroukoli z jeho složek nebo na Denavir® (penciklovirový krém). Úplný seznam složek přípravku FAMVIR naleznete na konci této příbalové informace pro pacienty.
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku FAMVIR 500 mg?
Než začnete užívat FAMVIR 500 mg, informujte svého poskytovatele zdravotní péče, pokud:
- máte problémy s ledvinami nebo játry
- máte vzácný genetický problém s intolerancí galaktózy, závažným nedostatkem laktázy nebo neabsorbujete glukózu-galaktózu (malabsorpce)
- jste těhotná nebo těhotenství plánujete. Není známo, zda FAMVIR 250 mg poškodí vaše nenarozené dítě
- Hlášení expozice v těhotenství: Společnost Novartis Pharmaceuticals Corporation shromažďuje zprávy o těhotenství, které jsou hlášeny dobrovolně. V případě těhotenství se o nahlášení těhotenství poraďte se svým poskytovatelem zdravotní péče
- kojíte nebo plánujete kojit
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a bez předpisu, vitamínů a bylinných doplňků. Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- jakékoli další léky a přípravky, které používáte k léčbě propuknutí herpesu
- probenecid (Probalan)
Znát léky, které užíváte. Mějte jejich seznam u sebe, abyste je ukázali svému poskytovateli zdravotní péče a lékárníkovi pokaždé, když dostanete nový lék.
Jak mám užívat FAMVIR?
- Užívejte FAMVIR přesně podle předpisu
- Váš poskytovatel zdravotní péče vám řekne, kolik přípravku FAMVIR máte užívat a kdy je užívat. Vaše dávka přípravku FAMVIR 250 mg a jak často ji užíváte, se mohou lišit v závislosti na Vašem stavu
- FAMVIR lze užívat s jídlem nebo bez jídla
- Je důležité, abyste dokončil(a) všechen lék podle předpisu, i když se začnete cítit lépe
- Vaše příznaky mohou pokračovat i poté, co dokončíte celý váš FAMVIR. To neznamená, že potřebujete další léky, protože jste již dokončili celou léčbu přípravkem FAMVIR 500 mg a bude ve vašem těle nadále působit. Promluvte si se svým poskytovatelem zdravotní péče, pokud máte nějaké otázky týkající se vašeho stavu a vaší léčby
Jaké jsou možné vedlejší účinky přípravku FAMVIR 250 mg?
Mezi nejčastější nežádoucí účinky přípravku FAMVIR 500 mg patří:
- bolest hlavy
- nevolnost
Promluvte si se svým poskytovatelem zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku FAMVIR. Požádejte svého poskytovatele zdravotní péče nebo lékárníka o další informace.
Zavolejte svého poskytovatele zdravotní péče a požádejte o radu ohledně vedlejších účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA1088.
Jak mám FAMVIR 500 mg uchovávat?
- Skladujte FAMVIR při pokojové teplotě mezi 59 °F a 86 °F (15 °C až 30 °C).
Uchovávejte FAMVIR a všechny léky mimo dosah dětí.
Obecné informace o FAMVIR
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalových informacích pro pacienty. Nepoužívejte FAMVIR pro stav, pro který nebyl předepsán. Nedávejte FAMVIR 500 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták shrnuje nejdůležitější informace o FAMVIR. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Informace o přípravku FAMVIR 500 mg, který je určen pro zdravotníky, vám může poskytnout váš poskytovatel zdravotní péče nebo lékárník. Pro více informací navštivte www.FAMVIR.com nebo volejte 1-888-669-6682.
Jaké jsou složky přípravku FAMVIR?
Aktivní složka: famciklovir
Neaktivní složky: hydroxypropylcelulóza, hydroxypropylmethylcelulóza, laktóza, stearát hořečnatý, polyethylenglykoly, sodná sůl glykolátu škrobu a oxid titaničitý
