Zovirax 200mg, 400mg, 800mg Acyclovir Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Zovirax 800 mg a jak se používá?
Zovirax je lék na předpis používaný k léčbě příznaků oparu (Herpes Labialis) a genitálního herpesu. Zovirax 800 mg lze užívat samostatně nebo s jinými léky.
Zovirax 400 mg patří do třídy léků nazývaných antivirotika, topická.
Není známo, zda je přípravek Zovirax 200 mg bezpečný a účinný u dětí mladších 12 let.
Jaké jsou možné vedlejší účinky přípravku Zovirax 800 mg?
Zovirax 200 mg může způsobit závažné nežádoucí účinky, včetně:
- snadná tvorba modřin nebo krvácení,
- fialové nebo červené skvrny pod kůží,
- malé nebo žádné močení,
- bolestivé nebo obtížné močení,
- otoky nohou nebo kotníků,
- pocit únavy a
- dušnost
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Zovirax patří:
- nevolnost,
- zvracení,
- průjem,
- celkový pocit nemoci,
- bolest hlavy a
- bolest v ústech při užívání bukální tablety acyklovir
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Zovirax. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
SOUHRN INFORMACÍ O PRODUKTU
Drogová látka
Správné jméno: acyklovir
Chemický název: 9-[(2-hydroxyethoxy)methyl]guanin
Jiné jméno: acykloguanosin
Molekulární vzorec: C8H11N503
Molekulová hmotnost: 225.2 Strukturní vzorec:
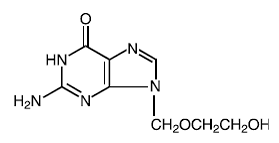
Fyzikálně-chemické vlastnosti: Acyclovir je bílý krystalický prášek s maximální rozpustností ve vodě 1,3 mg/ml při 25°C.
INDIKACE
Indikace a klinické použití
ZOVIRAX® (acyklovir) je indikován pro následující stavy:
- Léčba počátečních epizod herpes genitalis.
- Potlačení neobvykle častých recidiv herpes genitalis (6 a více epizod za rok).
- Akutní léčba pásového oparu (pásový opar) a planých neštovic (plané neštovice).
Výsledky klinických studií naznačují, že někteří pacienti s recidivujícím genitálním oparem mohou mít klinický přínos z podávání perorálního přípravku ZOVIRAX®, pokud je podán při prvních známkách blížící se epizody. Nejpravděpodobnějšími přínosy jsou pacienti, u kterých dochází k závažným, dlouhodobým recidivám; taková intermitentní terapie může být vhodnější než supresivní terapie, pokud tyto recidivy nejsou časté.
Včasná léčba akutního pásového oparu (pásový opar) u imunokompetentních jedinců perorálním přípravkem ZOVIRAX® vedla ke snížení vylučování viru; zkrácený čas do hojení; menší šíření; a zmírnění akutní bolesti.
Léčba planých neštovic u imunokompetentních pacientů perorálním přípravkem ZOVIRAX® snížila celkový počet lézí, urychlila progresi lézí do krustových a zhojených stadií a snížila počet reziduálních hypopigmentovaných lézí. Kromě toho přípravek ZOVIRAX® snížil horečku a konstituční příznaky spojené s planými neštovicemi.
Profylaktické použití acykloviru u planých neštovic nebylo stanoveno.
Geriatrie (≥ 65 let): Užívání u geriatrické populace může být spojeno s rozdíly v bezpečnosti v důsledku změn renálních funkcí souvisejících s věkem a stručnou diskuzi lze nalézt v příslušných částech (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Pediatrie ( Nejsou k dispozici žádné údaje.
DÁVKOVÁNÍ A PODÁVÁNÍ
Úvahy o dávkování
- Dávkování přípravku ZOVIRAX® (aciklovir) by mělo být sníženo u pacientů s poruchou funkce ledvin.
- Léčba by měla být zahájena co nejdříve po diagnóze planých neštovic nebo pásového oparu nebo při prvních známkách nebo příznacích propuknutí genitálního herpesu.
- Doporučená dávka a délka užívání závisí na indikaci.
Doporučená úprava dávkování a dávkování
Léčba počáteční infekce Herpes Genitalis: 200 mg (jedna 200 mg tableta nebo jedna čajová lžička suspenze [5 ml]) každé 4 hodiny, 5krát denně, celkem 1 g denně po dobu 10 dnů. Terapie by měla být zahájena co nejdříve po nástupu známek a symptomů.
Supresivní terapie pro recidivující herpes genitalis
Počáteční doporučená dávka je 200 mg (jedna 200mg tableta nebo jedna čajová lžička suspenze [5 ml]) třikrát denně. To lze zvýšit, pokud dojde k průlomu, až na dávku jedné 200mg tablety nebo jedné čajové lžičky [5 ml] suspenze pětkrát denně. V případě potřeby lze zvážit dávku 400 mg (dvě 200 mg tablety nebo dvě čajové lžičky suspenze [10 ml]) podávanou dvakrát denně. Doporučuje se pravidelné přehodnocování potřeby terapie.
Podávání přípravku ZOVIRAX® pro intermitentní léčbu je 200 mg (jedna 200mg tableta nebo jedna čajová lžička [5 ml] suspenze) každé 4 hodiny 5krát denně po dobu 5 dnů. Terapie by měla být zahájena při nejčasnějším příznaku nebo symptomu (prodromu) recidivy.
Léčba herpes zoster
800 mg perorálního přípravku ZOVIRAX®, každé 4 hodiny, 5krát denně po dobu 7 až 10 dnů. Léčba by měla být zahájena do 72 hodin od vzniku lézí. V klinických studiích došlo k největšímu přínosu, když byla léčba zahájena do 48 hodin od vzniku lézí.
Léčba planých neštovic
20 mg/kg (nepřekročit 800 mg) perorálně, 4krát denně po dobu 5 dnů. Léčba by měla být zahájena do 24 hodin od objevení se vyrážky.
Pacienti s akutním nebo chronickým poškozením ledvin
Při podávání acykloviru pacientům s poruchou funkce ledvin se doporučuje opatrnost. Je třeba udržovat dostatečnou hydrataci.
Po intravenózních infuzích acykloviru u pacientů s poruchou funkce ledvin byly dokončeny komplexní farmakokinetické studie.
Na základě těchto studií jsou v tabulce 5 doporučeny úpravy dávkování pro indikace genitálního herpesu a herpes zoster.
Hemodialýza
U pacientů, kteří vyžadují hemodialýzu, je průměrný plazmatický poločas acykloviru během hemodialýzy přibližně 5 hodin. To má za následek 60% snížení plazmatických koncentrací po šestihodinové dialýze. Proto by mělo být pacientovo dávkovací schéma upraveno tak, aby byla po každé dialýze podána další dávka.
Peritoneální dialýza
Zdá se, že po úpravě dávkovacího intervalu není nutná žádná doplňková dávka.
Zmeškaná dávka
Pokud dojde k vynechání dávky přípravku ZOVIRAX®, pacient by měl být poučen, aby si ji vzal, jakmile si vzpomene, a poté pokračoval s další dávkou ve správném časovém intervalu.
JAK DODÁVÁNO
Skladování A Stabilita
Tablety ZOVIRAX® je třeba uchovávat při kontrolované pokojové teplotě (15 až 25 °C) na suchém místě a chránit před světlem.
Suspenze ZOVIRAX® by měla být skladována při kontrolované pokojové teplotě (15 až 25 °C).
Lékové formy, Složení A Balení
Suspenze: Každá čajová lžička (5 ml) suspenze ZOVIRAX® obsahuje 200 mg acykloviru a neléčivé složky banánovou příchuť, celulózu, glycerin, methylparaben, propylparaben, sorbitol, vanilin a vodu.
Každá tableta ZOVIRAX® 200 obsahuje 200 mg acykloviru a neléčivé složky celulózu, indigotin, laktózu, magnesium-stearát, povidon a sodnou sůl glykolátu škrobu.
ZOVIRAX® Suspension je k dispozici v lahvičkách o objemu 125 ml* a 475 ml. Každá čajová lžička (5 ml) špinavě bílé suspenze s banánovou příchutí obsahuje 200 mg acykloviru.
*125ml láhev není k dispozici v Kanadě
ZOVIRAX® 200 Tablety jsou dostupné v lahvičkách po 100 tabletách. Každá modrá lisovaná tableta ve tvaru štítu se zkosenými hranami obsahuje 200 mg acykloviru a na jedné straně je potištěna „ZOVIRAX“ a na druhé straně trojúhelník.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Revize: 10. listopadu 2014
VEDLEJŠÍ EFEKTY
Přehled nežádoucích účinků léku
Nejčastější nežádoucí účinky spojené s užíváním přípravku ZOVIRAX® (aciklovir) jsou bolest hlavy a nevolnost.
Ve vzácných případech byly hlášeny také neurologické vedlejší účinky. U starších pacientů a pacientů s poruchou funkce ledvin v anamnéze je zvýšené riziko rozvoje těchto účinků. V hlášených případech byly tyto reakce po přerušení léčby obecně reverzibilní (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE , Nežádoucí účinky po uvedení na trh ).
Klinické studie Nežádoucí účinky léků
Vzhledem k tomu, že klinické studie jsou prováděny za velmi specifických podmínek, míra nežádoucích reakcí pozorovaná v klinických studiích nemusí odrážet míry pozorované v praxi a neměly by být srovnávány s mírami v klinických studiích jiného léku. Informace o nežádoucích účincích léku z klinických studií jsou užitečné pro identifikaci nežádoucích účinků souvisejících s lékem a pro přiblížení četnosti.
Léčba herpes simplex
Krátkodobé podávání (5-10 dní): Nejčastější nežádoucí účinky hlášené během klinických studií léčby genitálního herpesu perorálním přípravkem ZOVIRAX® u 298 pacientů jsou uvedeny v tabulce 1.
Potlačení herpes simplex
Dlouhodobé podávání: Nejčastější nežádoucí účinky hlášené v klinické studii prevence recidivy při nepřetržitém podávání 400 mg (dvě tobolky po 200 mg) 2krát denně jsou uvedeny v tabulce 2.
Dosavadní důkazy z klinických studií naznačují, že závažnost a frekvence nežádoucích účinků pravděpodobně nevyžadují přerušení léčby.
Herpes zoster
Nejčastější nežádoucí účinky hlášené během tří klinických studií léčby herpes zoster (pásový opar) 800 mg perorálního přípravku ZOVIRAX® 5krát denně po dobu 7 nebo 10 dnů nebo placeba jsou uvedeny v tabulce 3.
Plané neštovice
Nejčastější nežádoucí účinky hlášené během tří klinických studií léčby planých neštovic perorálním přípravkem ZOVIRAX® nebo placebem jsou uvedeny v tabulce 4.
Méně časté nežádoucí účinky z klinických studií (
Další nežádoucí účinky hlášené u méně než 1 % pacientů užívajících ZOVIRAX® v jakékoli klinické studii zahrnovaly: bolest břicha, anorexii, zácpu, závratě, otoky, únavu, plynatost, inguinální adenopatii, nespavost, bolest nohou, chuť na léky, kožní vyrážku, bolest krku, křečovité pohyby rukou a kopřivka.
Abnormální hematologické a klinické chemické nálezy
klinických studiích léčby planých neštovic a pásového oparu a léčby a potlačení genitálního herpesu přípravkem ZOVIRAX® nebyly pozorovány žádné klinicky významné změny laboratorních hodnot.
Nežádoucí účinky po uvedení na trh
Následující příhody byly hlášeny dobrovolně během post-marketingového použití přípravku ZOVIRAX® v klinické praxi. Tyto příhody byly vybrány pro zahrnutí buď kvůli jejich závažnosti, četnosti hlášení, potenciální kauzální souvislosti s přípravkem ZOVIRAX® nebo kombinaci těchto faktorů. Nežádoucí účinky po uvedení na trh jsou hlášeny spontánně z populace neznámé velikosti, takže nelze provést odhad frekvence.
Všeobecné: Horečka, bolest hlavy, bolest a periferní edém.
Nervový: Byly hlášeny závratě, parestézie, agitovanost, zmatenost, třes, ataxie, dysartrie, halucinace, psychotické symptomy, křeče, somnolence, encefalopatie a kóma. Tyto příhody jsou obecně reverzibilní a obvykle hlášené u pacientů s poruchou funkce ledvin nebo s jinými predisponujícími faktory (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ). Tyto příznaky mohou být výrazné, zejména u starších dospělých.
Zažívací: Průjem, gastrointestinální potíže a nevolnost.
Hematologické a lymfatické: Anémie, leukopenie, lymfadenopatie a trombocytopenie.
Přecitlivělost a kůže: Alopecie, multiformní erytém, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, vyrážky včetně fotosenzitivity, svědění, kopřivka, dyspnoe, angioedém a anafylaxe.
Hepatobiliární trakt a slinivka: Zprávy o reverzibilní hyperbilirubinemii a zvýšených jaterních enzymech. Hepatitida a žloutenka.
Muskuloskeletální: Myalgie.
Speciální smysly: Vizuální abnormality.
Urogenitální: Zvýšená hladina kreatininu v krvi a dusíku močoviny v krvi (BUN). Bylo hlášeno akutní selhání ledvin, bolest ledvin a hematurie. Renální bolest může být spojena se selháním ledvin (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
DROGOVÉ INTERAKCE
Lékové interakce
Nebyly zjištěny žádné klinicky významné interakce.
Acyklovir je primárně eliminován v nezměněné podobě močí prostřednictvím aktivní renální tubulární sekrece. Jakákoli léčiva podávaná současně, která soutěží s tímto mechanismem, mohou zvýšit plazmatické koncentrace acykloviru. Probenecid a cimetidin tímto mechanismem zvyšují plochu pod křivkou (AUC) acykloviru a snižují renální clearance acykloviru. Podobně bylo prokázáno zvýšení plazmatických AUC acykloviru a inaktivního metabolitu mykofenolát mofetilu, imunosupresiva používaného u pacientů po transplantaci, při současném podávání těchto léků. Vzhledem k širokému terapeutickému indexu acykloviru však není nutná žádná úprava dávkování.
Interakce drog a potravin
Nejsou známy žádné interakce s jídlem (viz Akční a klinická farmakologie , Farmakokinetika ).
Interakce léčivo-bylina
Interakce s rostlinnými produkty nebyly stanoveny.
Interakce mezi drogami a laboratorními testy
Interakce s laboratorními testy nebyly stanoveny.
VAROVÁNÍ
Kapsle, tablety a suspenze ZOVIRAX (acyclovir) jsou určeny pouze k perorálnímu požití. Při léčbě acyklovirem bylo pozorováno selhání ledvin, v některých případech vedoucí k úmrtí (viz NEŽÁDOUCÍ ÚČINKY: Pozorované během klinické praxe a PŘEDÁVKOVÁNÍ ). U imunokompromitovaných pacientů léčených acyklovirem se vyskytla trombotická trombocytopenická purpura/hemolyticko-uremický syndrom (TTP/HUS), který měl za následek smrt.
OPATŘENÍ
Při podávání přípravku ZOVIRAX (aciklovir) pacientům s poruchou funkce ledvin se doporučuje upravit dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Opatrnosti je také třeba při podávání přípravku ZOVIRAX (aciklovir) pacientům užívajícím potenciálně nefrotoxické látky, protože to může zvýšit riziko renální dysfunkce a/nebo riziko reverzibilních příznaků centrálního nervového systému, jako jsou ty, které byly hlášeny u pacientů léčených intravenózním acyklovirem . Je třeba udržovat dostatečnou hydrataci.
Herpes zoster: Neexistují žádné údaje o léčbě zahájené více než 72 hodin po propuknutí vyrážky zoster. Pacienti by měli být poučeni, aby zahájili léčbu co nejdříve po diagnóze pásového oparu.
Infekce genitálního herpesu: Pacienti by měli být informováni, že ZOVIRAX (aciklovir) není lékem na genitální herpes. Neexistují žádné údaje hodnotící, zda ZOVIRAX (aciklovir) zabrání přenosu infekce na ostatní. Vzhledem k tomu, že genitální herpes je sexuálně přenosné onemocnění, pacienti by se měli vyhnout kontaktu s lézemi nebo pohlavnímu styku, pokud jsou přítomny léze a/nebo symptomy, aby se zabránilo infekci partnerů. Genitální herpes může být také přenášen bez příznaků prostřednictvím asymptomatického šíření viru. Pokud je indikována medikamentózní léčba recidivy genitálního herpesu, je třeba pacientům doporučit, aby zahájili léčbu při prvních známkách nebo příznacích epizody.
Plané neštovice: Plané neštovice u jinak zdravých dětí jsou obvykle onemocněním mírné až střední závažnosti, které se samovolně vyléčí. Dospívající a dospělí mívají závažnější onemocnění. Léčba byla v kontrolovaných studiích zahájena do 24 hodin od typické vyrážky planých neštovic a neexistují žádné informace o účincích léčby zahájené později v průběhu onemocnění.
Karcinogeneze, mutageneze, zhoršení plodnosti
Údaje uvedené níže zahrnují odkazy na maximální plazmatické koncentrace acykloviru v ustáleném stavu pozorované u lidí léčených dávkou 800 mg podávanou perorálně 5krát denně (dávkování vhodné pro léčbu herpes zoster) nebo 200 mg podávaných perorálně 5krát denně (dávkování vhodné pro léčbu genitálního herpesu). Plazmatické koncentrace léčiva ve studiích na zvířatech jsou vyjádřeny jako násobky lidské expozice acykloviru při vyšších a nižších dávkovacích schématech (viz KLINICKÁ FARMAKOLOGIE: Farmakokinetika ).
Acyclovir byl testován v celoživotních biologických testech na krysách a myších v jednotlivých denních dávkách až 450 mg/kg podávaných žaludeční sondou. Nebyl zjištěn žádný statisticky významný rozdíl ve výskytu nádorů mezi léčenými a kontrolními zvířaty, ani acyklovir nezkrátil latenci nádorů. Maximální plazmatické koncentrace byly 3 až 6krát vyšší než u lidí v biologickém testu na myších a 1 až 2krát vyšší než u lidí v biologickém testu na potkanech.
Acyclovir byl testován v 16 in vitro a in vivo testech genetické toxicity. Acyclovir byl pozitivní v 5 testech.
Acyclovir nezhoršil plodnost nebo reprodukci u myší (450 mg/kg/den, po) nebo u potkanů (25 mg/kg/den, sc). Ve studii na myších byly plazmatické hladiny 9 až 18krát vyšší než u lidí, zatímco ve studii na potkanech byly 8 až 15krát vyšší než u lidí. Při vyšších dávkách (50 mg/kg/den, sc) u potkanů a králíků (11 až 22krát a 16 až 31krát vyšší než u člověka) se účinnost implantace, ale ne velikost vrhu, snížila. V peri- a postnatální studii u potkanů při dávce 50 mg/kg/den, sc, došlo ke statisticky významnému snížení skupinového průměrného počtu žlutých tělísek, celkových míst implantace a živých plodů.
U psů, kterým byla podávána dávka 50 mg/kg/den, IV po dobu 1 měsíce (21 až 41násobek hladiny u člověka) nebo u psů, kterým byla perorálně podávána dávka 60 mg/kg/den po dobu 1 roku (6 až 12násobek hladiny u člověka), nebyly pozorovány žádné abnormality varlat. Atrofie varlat a aspermatogeneze byly pozorovány u potkanů a psů při vyšších dávkách.
Těhotenství
Teratogenní účinky: Těhotenství kategorie B. Acyc lovir podávaný během organogeneze nebyl teratogenní u myši (450 mg/kg/den, po), králíka (50 mg/kg/den, subkutánně a iv) ani potkana (50 mg/kg/den, sc). Tyto expozice vedly k plazmatickým hladinám 9 a 18, 16 a 106 a 11 a 22krát vyšším než u člověka.
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Prospektivní epidemiologický registr užívání acykloviru během těhotenství byl založen v roce 1984 a dokončen v dubnu 1999. Bylo sledováno 749 těhotenství u žen vystavených systémovému acykloviru během prvního trimestru těhotenství, což vedlo k 756 výsledkům. Výskyt vrozených vad se blíží míře výskytu v běžné populaci. Malá velikost registru je však nedostatečná pro hodnocení rizika méně častých defektů nebo pro umožnění spolehlivých nebo definitivních závěrů ohledně bezpečnosti acykloviru u těhotných žen a jejich vyvíjejících se plodů. Acyclovir by měl být během těhotenství používán pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Koncentrace acykloviru byly dokumentovány v mateřském mléce u 2 žen po perorálním podání přípravku ZOVIRAX (aciklovir) a pohybovaly se v rozmezí od 0,6 do 4,1násobku odpovídajících plazmatických hladin. Tyto koncentrace by potenciálně vystavily kojící dítě dávce acykloviru až 0,3 mg/kg/den. ZOVIRAX (aciklovir) by měl být podáván kojící matce s opatrností a pouze pokud je to indikováno.
Pediatrické použití
Bezpečnost a účinnost perorálních forem acykloviru u pediatrických pacientů mladších 2 let nebyla stanovena.
Geriatrické použití
376 subjektů, které dostaly ZOVIRAX (acyklovir) v klinické studii léčby herpes zoster u imunokompetentních subjektů ve věku 50 let, bylo 244 ve věku 65 let a více, zatímco 111 bylo ve věku 75 a více let. Mezi geriatrickými subjekty a mladšími dospělými subjekty nebyly hlášeny žádné celkové rozdíly v účinnosti, pokud jde o dobu do zastavení tvorby nových lézí nebo dobu do hojení. Trvání bolesti po zhojení bylo delší u pacientů ve věku 65 a více let. Nevolnost, zvracení a závratě byly hlášeny častěji u starších subjektů. U starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin a vyžadují snížení dávky. U starších pacientů je také pravděpodobnější, že budou mít nežádoucí účinky na ledviny nebo CNS. Co se týče nežádoucích účinků na CNS pozorovaných během klinické praxe, u starších pacientů byly častěji hlášeny somnolence, halucinace, zmatenost a kóma (viz KLINICKÁ FARMAKOLOGIE, NEŽÁDOUCÍ ÚČINKY: Pozorované během klinické praxe, a DÁVKOVÁNÍ A PODÁVÁNÍ ).
PŘEDÁVKOVAT
Pro řešení podezření na předávkování drogami kontaktujte své regionální toxikologické středisko.
K odstranění nevstřebaného léčiva lze podat aktivní uhlí. Doporučují se obecná podpůrná opatření.
Acyclovir je v gastrointestinálním traktu absorbován pouze částečně. Pacienti požili až 20 g acykloviru při jedné příležitosti bez neočekávaných nežádoucích účinků. V klinických studiích byla nejvyšší plazmatická koncentrace pozorovaná u jednoho pacienta při těchto dávkách 10,0 μg/ml. Náhodné, opakované předávkování perorálním acyklovirem během několika dnů bylo spojeno s gastrointestinálními účinky (jako je nevolnost a zvracení) a neurologickými účinky (bolesti hlavy a zmatenost).
Intravenózní dávky podávané lidem byly až 1 200 mg/m² (28 mg/kg) 3krát denně po dobu až 2 týdnů. Maximální plazmatické koncentrace dosáhly 80 μg/ml. Předávkování intravenózním acyklovirem vedlo ke zvýšení sérového kreatininu, dusíku močoviny v krvi a následnému selhání ledvin. V souvislosti s intravenózním předávkováním byly popsány neurologické účinky včetně zmatenosti, halucinací, agitovanosti, záchvatů a kómatu.
Pacienti by měli být pečlivě sledováni kvůli známkám toxicity. Hemodialýza významně zvyšuje odstranění acykloviru z krve, a proto může být považována za možnost léčby v případě symptomatického předávkování. Pokud je překročena rozpustnost (2,5 mg/ml) v intratubulární tekutině, může dojít k vysrážení acykloviru v renálních tubulech. V případě selhání ledvin a anurie může mít pacient prospěch z hemodialýzy, dokud se funkce ledvin neobnoví (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
KONTRAINDIKACE
ZOVIRAX® (acyklovir) je kontraindikován u pacientů, u kterých se rozvine přecitlivělost nebo kteří jsou přecitlivělí na acyklovir, valaciklovir nebo jakoukoli jinou složku přípravků přípravku ZOVIRAX®. Kompletní výpis viz Dávkové formy , Složení a balení oddíl produktové monografie .
KLINICKÁ FARMAKOLOGIE
Akční a klinická farmakologie
Mechanismus působení
ZOVIRAX® (acyklovir), syntetický acyklický purinový nukleosidový analog, je substrát s vysokým stupněm specificity pro thymidinkinázu specifikovanou pro herpes simplex a varicella-zoster. Acyclovir je špatný substrát pro thymidinkinázu specifikovanou hostitelskou buňkou. Herpes simplex a varicella-zoster specifikovaná thymidinkináza transformuje acyklovir na jeho monofosfát, který je pak transformován řadou buněčných enzymů na acyklovir difosfát a acyklovir trifosfát. Acyclovir trifosfát je jak inhibitorem, tak substrátem pro DNA polymerázu specifikovanou herpesvirem. Ačkoli buněčná a-DNA polymeráza v infikovaných buňkách může být také inhibována acyklovirtrifosfátem, dochází k tomu pouze při koncentracích acyklovirtrifosfátu, které jsou vyšší než ty, které inhibují DNA polymerázu specifikovanou herpesvirem. Acyklovir se selektivně přeměňuje na svou aktivní formu v buňkách infikovaných herpesvirem, a tak je těmito buňkami přednostně přijímán. Acyclovir prokázal mnohem nižší toxický potenciál in vitro pro normální neinfikované buňky, protože: 1) méně se absorbuje; 2) méně je převedeno na aktivní formu; a 3) buněčná a-DNA polymeráza má nižší citlivost na působení aktivní formy léčiva. Kombinace specificity thymidinkinázy, inhibice DNA polymerázy a předčasného ukončení syntézy DNA vede k inhibici replikace herpes viru. Nebyl prokázán žádný účinek na latentní nereplikující se virus. Inhibice viru zkracuje dobu šíření viru, omezuje stupeň šíření a úroveň patologie, a tím usnadňuje hojení. Během suprese není žádný důkaz, že acyklovir brání neurální migraci viru. Zastavuje epizody recidivujícího herpesu v důsledku inhibice replikace viru po reaktivaci.
Farmakokinetika
Farmakokinetika acykloviru po perorálním podání byla hodnocena v 6 klinických studiích zahrnujících 110 dospělých pacientů.
Vstřebávání
jedné studii s 35 imunokompromitovanými pacienty s infekcí herpes simplex nebo varicella-zoster, kterým byly podávány kapsle ZOVIRAX® v dávkách 200 až 1 000 mg každé 4 hodiny, 6krát denně po dobu 5 dnů, byla biologická dostupnost odhadnuta na 15 až 20 %. V této studii bylo ustálených plazmatických hladin dosaženo do druhého dne podávání. Průměrné maximální a nejnižší koncentrace v ustáleném stavu po poslední dávce 200 mg byly 0,49 μg/ml (0,47 až 0,54 μg/ml) a 0,31 μg/ml (0,18 až 0,41 μg/ml) a po poslední dávce 800 mg byly 2,8 μg/ml (2,3 až 3,1 μg/ml) a 1,8 μg/ml (1,3 až 2,5 μg/ml). V jiné studii dostávalo 20 imunokompetentních pacientů s recidivujícími infekcemi genitálního herpes simplex kapsle ZOVIRAX® v dávce 800 mg každých 6 hodin, 4krát denně po dobu 5 dnů, průměrné maximální a minimální koncentrace v ustáleném stavu byly 1,4 μg/ml (0,66 až 1,8 μg/ml) a 0,55 μg/ml (0,14 až 1,1 μg/ml).
Ve zkřížené studii s více dávkami, kde 23 dobrovolníků dostávalo ZOVIRAX® jako jednu 200mg tobolku, jednu 400mg tabletu a jednu 800mg tabletu 6krát denně, se absorpce snižovala se zvyšující se dávkou a odhadovaná biologická dostupnost acykloviru byla 20, 15 a 10 %. , resp. Předpokládá se, že snížení biologické dostupnosti je funkcí dávky a nikoli dávkové formy. Bylo prokázáno, že acyklovir není úměrný dávce v rozmezí dávek 200 až 800 mg. V této studii byly maximální a nejnižší koncentrace acykloviru v ustáleném stavu 0,83 a 0,46 μg/ml, 1,21 a 0,63 μg/ml a 1,61 a 0,83 μg/ml pro dávkovací režim 200, 400 a 800 mg, v tomto pořadí.
V jiné studii u 6 dobrovolníků nebyl vliv potravy na absorpci acykloviru zřejmý.
Studie biologické dostupnosti jedné perorální dávky u 23 normálních dobrovolníků ukázala, že ZOVIRAX® Capsules 200 mg jsou bioekvivalentní 200 mg acykloviru ve vodném roztoku. V samostatné studii na 20 dobrovolnících bylo prokázáno, že suspenze ZOVIRAX® je bioekvivalentní kapslím ZOVIRAX®. V jiné studii biologické dostupnosti/bioekvivalence po jedné dávce u 24 dobrovolníků bylo prokázáno, že jedna tableta ZOVIRAX® 800 mg je bioekvivalentní čtyřem tobolkám ZOVIRAX® 200 mg.
Rozdělení
Vazba na plazmatické proteiny je relativně nízká (9 až 33 %) a lékové interakce zahrnující vytěsnění vazebného místa se nepředpokládají.
Odstranění
Po perorálním podání se průměrný plazmatický poločas acykloviru u dobrovolníků a pacientů s normální funkcí ledvin pohyboval od 2,5 do 3,3 hodin. Průměrná renální exkrece nezměněného léku představuje 14,4 % (8,6 až 19,8 %) perorálně podané dávky. Jediným metabolitem v moči (identifikovaným vysokoúčinnou kapalinovou chromatografií) je 9-[(karboxymethoxy)methyl]guanin.
Zvláštní populace a podmínky
Pediatrie
Obecně platí, že farmakokinetika acykloviru u dětí je podobná jako u dospělých. Průměrný poločas po perorálních dávkách 300 a 600 mg/m² u dětí ve věku 7 měsíců až 7 let byl 2,6 hodiny (rozmezí 1,59 až 3,74 hodiny).
Perorálně podávaný acyklovir u dětí mladších 2 let nebyl dosud plně prozkoumán.
Geriatrie
U starších pacientů celková tělesná clearance klesá se zvyšujícím se věkem, což je spojeno se snížením clearance kreatininu, i když v terminálním plazmatickém poločasu je jen malá změna. U geriatrických pacientů se sníženou funkcí ledvin může být nutné snížit dávku (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Renální insuficience
Poločas a celková tělesná clearance acykloviru závisí na funkci ledvin.
U pacientů se sníženou funkcí ledvin se doporučuje úprava dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Klinické testy
Počáteční genitální herpes
Dvojitě zaslepené, placebem kontrolované studie prokázaly, že perorálně podávaný ZOVIRAX® významně zkracuje dobu trvání akutní infekce a dobu hojení lézí. Trvání bolesti a tvorby nových lézí bylo u některých skupin pacientů sníženo.
Recidivující genitální herpes
Ve studii pacientů, kteří dostávali ZOVIRAX® 400 mg dvakrát denně po dobu 3 let, zůstalo 45, 52 a 63 % pacientů bez recidivy v prvním, druhém a třetím roce, v tomto pořadí. Sériové analýzy 3měsíční míry recidivy u pacientů ukázaly, že 71 až 87 % bylo bez recidivy v každém čtvrtletí.
Infekce herpes zoster
Ve dvojitě zaslepené, placebem kontrolované studii imunokompetentních pacientů s lokalizovanou kožní infekcí pásovým oparem ZOVIRAX® (800 mg 5krát denně po dobu 10 dnů) zkrátil dobu do vzniku strupů, zhojení a úplného zastavení bolesti a zkrátil dobu trvání virové infekce. vylučování a trvání tvorby nových lézí.
podobné dvojitě zaslepené, placebem kontrolované studii přípravek ZOVIRAX® (800 mg 5krát denně po dobu 7 dnů) zkrátil dobu do úplného strupu z léze, zhojení a zastavení bolesti a zkrátil dobu tvorby nových lézí.
Léčba byla zahájena do 72 hodin od začátku vyrážky a byla nejúčinnější, byla-li zahájena během prvních 48 hodin. Dospělí starší 50 let vykazovali větší přínos.
Plané neštovice
Byly provedeny tři randomizované, dvojitě zaslepené, placebem kontrolované studie u 993 pediatrických pacientů ve věku 2 až 18 let s planými neštovicemi. Všichni pacienti byli léčeni do 24 hodin po nástupu vyrážky. Ve dvou studiích byl ZOVIRAX® podáván v dávce 20 mg/kg čtyřikrát denně (až 3 200 mg denně) po dobu 5 dnů. Ve třetí studii byly dávky 10, 15 nebo 20 mg/kg podávány čtyřikrát denně po dobu 5 až 7 dnů. Léčba přípravkem ZOVIRAX® zkrátila dobu hojení na 50 %, snížila maximální počet lézí, snížila střední počet vezikul, snížila střední počet reziduálních lézí v den 28 a snížila podíl pacientů s horečkou, anorexií a letargií do dne 2. Léčba přípravkem ZOVIRAX® neovlivnila specifickou humorální nebo buněčnou imunitní odpověď viru varicella zoster 1 měsíc nebo 1 rok po léčbě.
Podrobná farmakologie
Vidět Akční a klinická farmakologie.
Virologie
Kvantitativní vztah mezi in vitro citlivostí viru herpes simplex (HSV) a virů varicella-zoster (VZV) na acyklovir a klinickou odpovědí na terapii nebyl u člověka stanoven a testování virové citlivosti nebylo standardizováno. Výsledky testování citlivosti, vyjádřené jako koncentrace léčiva potřebná k 50% inhibici růstu viru v buněčné kultuře (ID50), se značně liší v závislosti na konkrétním použitém testu, typu použité buňky a laboratoři provádějící test. ID50 acykloviru proti izolátům HSV-1 se může pohybovat od 0,02 μg/ml (redukce plaku ve Vero buňkách) do 5,9-13,5 μg/ml (redukce plaku v buňkách ledvin opic zelené [GMK]). ID50 proti HSV-2 se pohybuje od 0,01 do 9,9 μg/ml (snížení plaku u buněk Vero a GMK).
Pomocí metody vychytávání barviva ve Vero buňkách, která poskytuje hodnoty ID50 přibližně 5 až 10krát vyšší než testy redukce plaků, bylo vyšetřeno 1 417 izolátů HSV (553 HSV-1 a 864 HSV-2) od přibližně 500 pacientů během 5- roční období. Tyto testy zjistily, že 90 % izolátů HSV-1 bylo citlivých na ≤ 0,9 μg/ml acykloviru a 50 % všech izolátů bylo citlivých na ≤ 0,2 μg/ml acykloviru. U izolátů HSV-2 bylo 90 % citlivých na ≤ 2,2 μg/ml a 50 % všech izolátů bylo citlivých na ≤ 0,7 μg/ml acykloviru. Izoláty s výrazně sníženou citlivostí byly nalezeny u 44 pacientů. Je třeba zdůraznit, že ani pacienti, ani izoláty nebyli vybráni náhodně, a proto nepředstavují obecnou populaci. Většina méně citlivých klinických izolátů HSV byla relativně deficientní na virovou thymidinkinázu (TK). Byly také popsány kmeny se změnami virové TK nebo virové DNA polymerázy.
ID50 proti VZV se pohybuje od 0,17-1,53 μg/ml (snížení výtěžku, fibroblasty lidské předkožky) do 1,85-3,98 μg/ml (snížení ložisek, fibroblasty lidského embrya [HEF]). Reprodukce genomu EBV je potlačena o 50 % u superinfikovaných buněk Raji nebo lymfoblastoidních buněk P3HR-1 pomocí 1,5 μg/ml acykloviru. Cytomegalovirus (CMV) je relativně odolný vůči acykloviru s hodnotami ID50 v rozmezí od 2,3-17,6 μg/ml (redukce plaků, HEF buňky) do 1,82-56,8 μg/ml (DNA hybridizace, HEF buňky). Není známo, že by latentní stav genomu kteréhokoli z lidských herpesvirů byl citlivý na acyklovir.
Odpor
Dlouhodobé vystavení HSV subinhibičním koncentracím (0,1 μg/ml) acykloviru v buněčné kultuře mělo za následek vznik různých kmenů rezistentních na acyklovir. Předpokládá se, že ke vzniku rezistentních kmenů dochází „selekcí“ přirozeně se vyskytujících virů s relativně nízkou citlivostí na acyklovir. Takové kmeny byly hlášeny u izolátů před léčbou z několika klinických studií.
Byly popsány dva mechanismy rezistence zahrnující virovou thymidinkinázu (nutnou pro aktivaci acykloviru). Jsou to: (a) selekce mutantů s deficitem thymidinkinázy, které po infekci indukují malou nebo žádnou enzymatickou aktivitu, a (b) selekce mutantů s thymidinkinázou se změněnou substrátovou specifitou, která je schopna fosforylovat přirozený nukleosid thymidin, ale nikoli acyklovir. Většina méně citlivých virů vznikajících in vitro je typu s deficitem thymidinkinázy, který má sníženou infekčnost a patogenitu a menší pravděpodobnost vyvolání latence u zvířat.
Bylo však zjištěno, že infekce HSV rezistentní na acyklovir u příjemce transplantátu kostní dřeně s potlačenou imunitou na prodloužené terapii acyklovirem je způsobena klinickým izolátem, který měl normální thymidinkinázu, ale změněnou DNA polymerázu. Tento třetí mechanismus rezistence zahrnující DNA polymerázu viru herpes simplex je způsoben selekcí mutantů kódujících změněný enzym, který je odolný vůči inaktivaci acyklovir trifosfátem.
Zdá se, že VZV projevuje rezistenci vůči acykloviru prostřednictvím mechanismů podobných mechanismům pozorovaným u HSV.
Omezené klinické zkoumání však neodhalilo žádný důkaz o významné změně in vitro citlivosti VZV při léčbě acyklovirem, ačkoli rezistentní mutanty tohoto viru lze izolovat in vitro způsobem analogickým k HSV. Analýza malého počtu klinických izolátů od pacientů, kteří dostávali perorální acyklovir nebo placebo pro akutní herpes zoster, naznačuje, že in vivo vznik rezistentního VZV může nastat zřídka. Dlouhodobá léčba acyklovirem u vysoce imunokompromitovaných pacientů se syndromem získané imunodeficience a těžkým VZV může vést k objevení se rezistentního viru.
Zkřížená rezistence k jiným antivirotikům se vyskytuje in vitro u mutantů rezistentních na acyklovir. Mutanty HSV, které jsou odolné vůči acykloviru díky absenci virové thymidinkinázy, jsou zkříženě rezistentní vůči dalším činidlům, která jsou fosforylována thymidinkinázou herpesviru, jako je bromovinyldeoxyuridin, ganciklovir a 2'-fluorpyrimidinové nukleosidy, jako je 2'-fluor -5-jodarabinosyl-cytosin (FIAC).
Klinická odpověď na léčbu acyklovirem byla obvykle dobrá u pacientů s normální imunitou, u kterých byl obnoven HSV se sníženou citlivostí na acyklovir, buď před, během nebo po terapii. Některé skupiny pacientů, jako jsou těžce imunokompromitovaní (zejména příjemci transplantace kostní dřeně) a pacienti podstupující chronickou supresivní léčbu, však byly identifikovány jako nejčastěji spojené s výskytem rezistentních kmenů herpes simplex, které mohou, ale nemusí doprovázet špatnou odpověď k droze. Při léčbě takových pacientů musí být rozpoznána možnost výskytu méně citlivých virů a mělo by být podporováno monitorování citlivosti klinických izolátů od těchto pacientů.
Stručně řečeno, kvantitativní vztah mezi in vitro citlivostí HSV a VZV na acyklovir a klinickou odpovědí na terapii nebyl u člověka jasně stanoven. Pro umožnění přesnějších korelací mezi citlivostí viru in vitro a klinickou odpovědí na terapii acyklovirem jsou vyžadovány standardizované metody testování virové citlivosti.
Toxikologie
Studie akutní toxicity
Dospělé myši a krysy : Akutní toxicita orálního acykloviru byla stanovena tak, jak je uvedeno v tabulce 6.
Novorozené, nezralé a dospělé krysy
Skupinám 10 samců a 10 samic krys Charles River CD (Sprague-Dawley) byly ve věku 3, 10, 28 a 71 dnů podány jednotlivé velké dávky (5 různých úrovní dávky) roztoku (pH 11,0) acykloviru subkutánní injekcí. věku. Byly pozorovány po dobu 14 dnů po ošetření a hodnoty LD50 byly vypočteny Litchfieldovou a Wilcoxonovou metodou (viz tabulka 7 níže). Tato studie byla provedena za účelem zjištění, zda věk při expozici ovlivňuje akutní toxicitu acykloviru; nebyly žádné důkazy, že by mladé krysy byly citlivější než starší krysy na akutní toxické účinky acykloviru.
Nebyl žádný zjevný vztah mezi délkou přežití po léčbě a věkem, ve kterém byla léčba podána. Klinické příznaky u potkanů léčených ve věku 3 a 10 dnů zahrnovaly červené a fialové kožní puchýře, modré oblasti, strupy, jizvy, nekrotickou a oloupanou kůži, otevřené rány, třes těla a alopecii. Snížená aktivita, slzení, zavřená víčka, červenohnědý nebo hnědý materiál kolem očí, nosu a úst, ataxie, prostrace, třes těla, skvrny moči kolem břicha nebo genitálií, strupovité nebo nekrotické oblasti a alopecie byly pozorovány u potkanů léčených při 28 a 71 dnů věku.
Studie subchronické orální toxicity
Myši
Čtyřem skupinám, z nichž každá sestávala z 28 samců a 28 samic Charles River CD-1 (ICR) myší, byly perorálně podávány žaludeční sondou po dobu 33 dnů suspenze acykloviru. Denní dávky byly 0, 50, 150 a 450 mg/kg. Hematologická a klinicko-chemická měření byla provedena na dalších 8 samcích a 8 myších samicích na skupinu (dávkování stejným způsobem) po prvním a čtvrtém týdnu dávkování a během 3. týdne po dávce.
Plazmatické koncentrace léčiva byly měřeny ve shromážděných vzorcích od dalších 4 myších samců a 4 samic na skupinu ve dnech dávkování 1, 15 a 30.
Na základě předběžných experimentů na krysách a myších byla vybrána vysoká dávka 450 mg/kg, aby se dosáhly nejvyšší hladiny léčiva v plazmě, prakticky dosažitelné orálním podáváním u hlodavců. Průměrné plazmatické koncentrace léčiva se pohybovaly od přibližně 3,4 (při nízké dávce) do 11,0 (při vysoké dávce) μg/ml plazmy jednu hodinu po perorálním podání.
Nedošlo k žádným změnám ve zdraví, rychlosti růstu, hematologii a klinických chemických měřeních, které by bylo možné jednoznačně připsat dávkování acykloviru. Hrubá a histopatologická vyšetření 16 samců a 16 samic krys ze skupiny s vysokou dávkou a kontrolní skupiny na konci období dávky neodhalily nic pozoruhodného.
Studie chronické toxicity
Celoživotní studie orální toxicity u potkanů, kterým byl podáván acyklovir žaludeční intubací
Potkani Charles River CD (Sprague-Dawley) dostávali žaludeční sondou suspenze acykloviru. Bylo použito 50 samců a 50 samic potkanů v každé z následujících úrovní dávky: 0, 50, 150 a 450 mg/kg. Po 30 a 52 týdnech léčby bylo 10 samců a 10 samic potkanů z každé skupiny pitváno. Zbývajícím krysám byly podávány dávky každý den, dokud přirozená úmrtnost nesnížila velikost skupiny na přibližně 20 % počtu zvířat tohoto pohlaví přítomných v testovacích skupinách, když byla studie zahájena. Všechny zbývající krysy byly usmrceny a pitvány, když bylo dosaženo 20% mezní hodnoty. To bylo během 110. týdne pro krysí samce a 122. týdne pro krysí samice. Tkáně kontrolních krys a krys ve skupině s vysokou dávkou byly hodnoceny světelnou mikroskopií. Tkáně krys ve skupinách s nízkou a střední dávkou, které mají hmoty, uzliny nebo neobvyklé léze, byly také zkoumány světelnou mikroskopií. Fixované tkáně z krys, které byly nalezeny mrtvé během prvních 52 týdnů studie, byly také hodnoceny světelnou mikroskopií.
Nebyly pozorovány žádné známky toxikózy. Vzorky plazmy byly odebrány 1,5 hodiny po dávkování ve dnech 7, 90, 209, 369, 771 (pouze muži) a 852 (pouze ženy). Průměrné plazmatické hladiny zjištěné u mužů s vysokou dávkou (450 mg/kg/den) ve výše uvedených časech byly následující: 1,54, 1,63, 1,39, 1,60 a 1,70 μg/ml (6,84, 7,26, 6,17, 7,10 a 7,56 μM) . Odpovídající průměrné plazmatické hladiny u žen s vysokou dávkou za odpovídající časová období byly 1,76, 2,38, 2,12, 1,71 a 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 a 8,03 μM). Plazmatické hladiny u mužů i žen ve všech dávkových hladinách po jednom roce léčby byly obecně srovnatelné s hladinami v plazmě získanými při dřívějších odběrech vzorků. Hodnoty pro laboratorní testy včetně hematologie, klinické chemie a oftalmoskopie byly všechny v normálním rozmezí. Nebyly zjištěny žádné velké nebo mikroskopické léze vyvolané léčivem a nebyl žádný důkaz, že by acyklovir ovlivňoval přežití.
Celoživotní studie orální karcinogenity u potkanů
potkanů Charles River CD (Sprague-Dawley) (100 potkanů/pohlaví/dávková skupina), kterým byl perorálně podáván acyklovir žaludeční sondou v dávce 50, 150 a 450 mg/kg, nebyly v celoživotní studii karcinogenity pozorovány žádné známky toxikózy. Průměrné plazmatické hladiny získané u mužů s vysokou dávkou 1,5 hodiny po dávkování v různých časech odběru vzorků během studie byly následující: 1,54, 1,63, 1,39, 1,60 a 1,70 μg/ml (6,84, 7,26, 6,17, 7,10 a 7,56 μM) v 7,56 μM dnech 7, 90, 209, 369 a 771, v tomto pořadí. Odpovídající průměrné hodnoty pro ženy s vysokou dávkou byly 1,76, 2,38, 2,12, 1,71 a 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 a 8,03 μM) ve dnech 7, 90, 8369, 209, v tomto pořadí
Hodnoty pro klinické laboratorní testy včetně hematologie, klinické chemie, analýzy moči, tělesné hmotnosti, spotřeby potravy a oftalmoskopie byly všechny v normálních rozmezích. Nebyly zjištěny žádné velké nebo mikroskopické léze vyvolané léčivem a nebyl žádný důkaz, že by acyklovir ovlivňoval přežití, časové vzorce výskytu nádorů nebo počty nádorů u benigních nebo maligních novotvarů.
Většina z relativně malého počtu krys, které byly během prvních 52 týdnů této studie nalezeny mrtvé nebo umírající, utrpěla nehody při dávkování, o čemž svědčí posmrtné nálezy perforace jícnu způsobující pleurální výpotek, zápal plic nebo mediastinitidu.
Celoživotní studie orální karcinogenity u myší
celoživotní perorální studii karcinogenity nebyly u myší Charles River CD-1 (ICR) (115 myší/pohlaví/dávková skupina), kterým byl podáván acyklovir žaludeční sondou v dávce 50, 150 a 450 mg/kg/den, žádné známky toxikózy. Průměrné plazmatické hladiny získané u mužů s vysokou dávkou 1,5 hodiny po dávkování v různých časech odběru během studie byly následující: 2,83, 3,17 a 1,82 μg/ml (12,59, 14,10 a 8,10 μM) ve dnech 90, 365 a 541, v tomto pořadí. Odpovídající průměrné hodnoty pro ženy s vysokou dávkou byly 9,81, 5,85 a 4,0 μg/ml (43,60, 26,0 a 17,79 μM).
Hodnoty pro klinické laboratorní testy včetně hematologie, tělesné hmotnosti a spotřeby potravy byly všechny v normálních rozmezích. Nebyly zjištěny žádné velké nebo mikroskopické léze vyvolané léčivem. Samice myší, kterým bylo podáváno 150 a 450 mg/kg acykloviru, přežily významně déle než kontrolní samice myší; přežití léčených samců bylo srovnatelné s přežitím kontrolních samců. Vzorce výskytu nádorů a počty nádorů pro benigní nebo maligní novotvary nebyly ovlivněny léčbou acyklovirem.
Chronická 12měsíční studie orální toxicity u psů
Čistokrevným psům bígla bylo podáváno 0, 15, 45 nebo 150 mg/kg/den acykloviru každý den po dobu prvních dvou týdnů jednoleté studie. V každé testovací skupině bylo 9 psů a 9 fen. Psi dostali želatinové tobolky, které obsahovaly příslušnou dávku. Byli léčeni třikrát, takže dávky podávané v každém ze tří stejně rozložených dávkových období byly 0, 5, 15 a 50 mg/kg. Úrovně dávek 45 a 150 mg/kg vyvolaly průjem, zvracení, sníženou spotřebu potravy a ztrátu hmotnosti u samců i samic během prvních dvou týdnů studie. Z tohoto důvodu bylo během třetího týdne studie přijato rozhodnutí snížit hladiny středních a vysokých dávek na 30 a 60 mg/kg/den (10 a 20 mg/kg třikrát denně). Nízká dávka 15 mg/kg/den (5 mg/kg třikrát denně) se nezměnila. Psi, kterým byla podávána dávka 60 mg/kg/den, příležitostně zvraceli a příležitostně měli průjem, ale po dobu trvání testu se jim dařilo dobře a hodnoty tělesné hmotnosti a spotřeby potravy byly srovnatelné s kontrolními hodnotami.
Během toxikózy vyvolané vyššími dávkami acykloviru byly plazmatické hladiny léku pravděpodobně velmi vysoké (jak naznačují počáteční průměrné hodnoty 24,0 μg/ml (106,6 μM) u mužů s vysokou dávkou a 17,4 μg/ml (77,2 μM) pro samice s vysokou dávkou, když byla stanovena 1 hodinu po třetí dávce v den 1 studie). Při měření v den 15 byly plazmatické hladiny acykloviru u psů s vysokou dávkou (150 mg/kg/den) stále velmi vysoké, ale později se snížily, když byly dávky sníženy. Hodnoty plazmatických hladin po 12 měsících léčby byly obecně srovnatelné s hodnotami zaznamenanými po 1, 3 a 6 měsících léčby. Nebyly tedy žádné známky zvýšeného metabolismu acykloviru v důsledku chronické léčby.
Během 13. týdne měli někteří psi a feny ve střední i vysoké dávce následující příznaky: citlivost předních tlapek, eroze tlapek a lámání a uvolňování drápků. Regenerace ztracených nehtů začala o několik týdnů později. Nehty regenerované po 6 měsících (kdy byli 3 samci a 3 samice z každé skupiny usmrceni za účelem dočasného usmrcení) a na konci studie byly obecně dobré kvality. Nikdy nebyly žádné známky účinku na tlapky nebo nehty u psů ve skupině s nízkou dávkou (15 mg/kg/den).
Připouští se, že poškození koriálního epitelu, který produkuje nehtový keratin, může vést k zastavení produkce keratinu a produkci abnormálního keratinu. Přechodná toxikóza vyvolaná velkými dávkami (45 a 150 mg/kg/den) acykloviru podávanými během prvních dvou týdnů studie mohla ovlivnit koriální epitel. Pokud došlo k přechodnému účinku na koriální epitel (možná související s přímými účinky nebo sekundární k onemocnění vyvolanému léky během prvních dvou týdnů studie), pozdější ztráta nehtu by mohla být následkem. Nebyly pozorovány žádné rozpoznatelné účinky na jiné tkáně produkující keratin nebo obsahující keratin. Je třeba zdůraznit, že změny na nehtech se zdály souviset s přechodnou toxikózou vyvolanou dávkami 50 a 150 mg/kg/den testovanými během prvních dvou týdnů studie, a nikoli s dávkami 30 a 60 mg/kg. /den následně testované úrovně dávek.
Během této studie nebyly ve vhodných intervalech provedeny žádné významné změny hodnot sérových biochemických testů, analýz moči a elektrokardiografických testů vyvolaných léky. Hodnoty sérového albuminu a celkového proteinu byly mírně sníženy u psů léčených 30 a 60 mg/kg/den po dobu 6 a 12 měsíců. Všechny hodnoty těchto parametrů však zůstaly v mezích akceptovaných jako normální.
S výjimkou zbytkových změn ve starém keratinu na špičkách drápů nebyly v žádné z tkání zkoumaných světelným mikroskopem žádné známky účinků souvisejících s léčbou. Nedošlo ani k významným změnám hodnot orgánů vážených při pitvě. Hladiny dávek až do 60 mg/kg/den byly tedy po dobu jednoho roku dobře tolerovány. Úroveň dávky acykloviru „bez účinku dávky“ byla 15 mg/kg/den (5 mg/kg třikrát denně); jedinými nežádoucími účinky při dávkách 30 nebo 60 mg/kg/den byly změny nehtů a chodidel (30 a 60 mg/kg/den) a mírné gastrointestinální příznaky (60 mg/kg/den).
Reprodukční studie
Teratologie – Krysy
Acyclovir byl podáván březím krysím samicím ARS Sprague-Dawley subkutánní injekcí během období organogeneze (den 6 až den 15 gestace) v dávkách 0,0, 6,0, 12,5 a 25,0 mg/kg tělesné hmotnosti dvakrát denně.
Kritéria hodnocená pro účinek sloučeniny zahrnovala tělesnou hmotnost matek, přírůstky hmotnosti, vzhled a chování, míru přežití, změny očí, míru těhotenství a reprodukční údaje. Hodnotila se také životaschopnost a vývoj potomstva.
Kromě výše uvedených měření byla označená zvířata usmrcena 1 hodinu po první dávce v den 15, aby se odebraly vzorky mateřské krve, plodové vody a plodů pro měření koncentrace léčiva. Průměrné hodnoty z těchto vzorků jsou uvedeny v tabulce 8.
Hodnoty získané pro plazmu by představovaly asi 30 % počátečních hladin v plazmě, jak bylo posouzeno podle plazmatického poločasu u hlodavců.
Při srovnání hodnot tělesné hmotnosti matky, vzhledu a chování, míry přežití, míry těhotenství nebo účinnosti implantace nebyly zaznamenány žádné účinky, které by bylo možné přičíst podávání acykloviru. Kromě toho nebyly zaznamenány žádné rozdíly související se sloučeninou při hodnocení velikosti plodu, pohlaví a vývoje.
Ačkoli výskyt resorpce a životaschopnosti plodu byl ve všech skupinách v rozmezí normální variability, mírně vyšší výskyt resorpce byl zaznamenán u zvířat s vysokou dávkou usmrcených 15. a 19. den březosti; jasné trendy související s dávkou však nenastaly.
Proto nebyl acyklovir považován za teratogenní nebo embryotoxický, když byl podáván potkanům v hladinách až 50,0 mg/kg tělesné hmotnosti za den během organogeneze.
Teratologie – králíci
Teratologická studie byla provedena na novozélandských bílých králících za použití v podstatě stejného experimentálního uspořádání jako u krys, kromě toho, že dávkování bylo od 6. do 18. dne březosti. Také odběr plodů, plodové vody a vzorků mateřské krve proběhl 18. den, nikoli 15. den.
Při žádné dávce nebyly pozorovány známky mateřské toxicity, ale ve skupině s vysokou dávkou byla statisticky významně (p
Koncentrace acykloviru byly detekovány ve vzorcích plazmy a plodové vody a také v homogenátech tkání plodu. Všechny vzorky byly odebrány jednu hodinu po první dávce v den 18 gestace. Koncentrace léčiva v plodové vodě byly podstatně vyšší než v plazmě (viz tabulka 9).
Reprodukce – Plodnost
Ve dvougenerační studii fertility bylo prokázáno, že acyklovir nenarušuje plodnost nebo reprodukci ve skupinách 15 samců a 30 samic myší. Myším v této studii byl podáván acyklovir žaludeční intubací v dávkách 50, 150 a 450 mg/kg/den. Samcům byla podávána dávka 64 po sobě jdoucích dnů před pářením a samicím 21 dní před pářením.
Ve studii fertility u potkanů, kde bylo skupinám 20 samců a 20 samic potkanů podáváno 0, 12,5, 25,0 a 50,0 mg/kg/den subkutánní injekcí, se ukázalo, že acyklovir nemá vliv na páření nebo fertilitu. Samcům byla podávána dávka po dobu 60 dnů před pářením a dokud nebyl dokončen jejich plán páření. Samice krys byly podávány po dobu 14 dnů před pářením a do 7. dne březosti. Při 50 mg/kg/den sc došlo ke statisticky významnému zvýšení postimplantačních ztrát, ale k žádnému současnému snížení velikosti vrhu.
U 25 samic králíků léčených subkutánně 50 mg/kg/den acykloviru ve dnech 6. až 18. březosti došlo ke statisticky významnému snížení účinnosti implantace, ale nedošlo k současnému snížení velikosti vrhu. Ve všech drogově léčených skupinách došlo také ke zvýšení počtu plodů s nadpočetnými žebry v závislosti na dávce. Toto zvýšení nebylo závislé na dávce, když byl zkoumán výskyt nadpočetných žeber na vrh.
15 samic králíků léčených intravenózně 50 mg/kg/den acykloviru ve dnech 6. až 18. březosti nebyl žádný účinek na účinnost implantace ani na velikost vrhu.
V peri- a postnatální studii u potkanů (20 potkaních samic na skupinu) byl acyklovir podáván subkutánně v dávkách 0, 12,5, 25 a 50 mg/kg/den od 17. dne gestace do 21. dne po porodu. Při dávce 50 mg/kg/den sc došlo ke statisticky významnému snížení průměrného počtu žlutých tělísek, celkových míst implantace a živých plodů ve skupině F1 generace. Ačkoli to není statisticky významné, došlo také ke snížení průměrného počtu živých plodů a míst implantace v závislosti na dávce při 12,5 mg/kg/den a 25 mg/kg/den sc.
Ve studii zaměřené na zjištění rozmezí dávek u 5 králičích samic způsobilo intravenózní podávání acykloviru v dávce 100 mg/kg/den od 6. do 8. dne březosti, což je dávka, o které je známo, že způsobuje obstrukční nefropatii, a způsobilo významné zvýšení fetální resorpce a odpovídající snížení velikosti vrhu. Při maximální tolerované intravenózní dávce 50 mg/kg/den u králíků nebyly pozorovány žádné reprodukční účinky související s léčivem.
Ve studii subchronické toxicity, kde byly skupinám 20 samců a 20 samic potkanů podávány intraperitoneální dávky acykloviru v dávce 0, 20, 80 nebo 320 mg/kg/den po dobu jednoho měsíce a sledovány po dobu jednoho měsíce po podání dávky, se objevily varlata atrofie. Určitý histologický důkaz obnovy produkce spermií byl evidentní 30 dní po dávce, ale nebyla to doba dostatečná k prokázání plné reverzibilnosti.
Skupinám 25 samců a 25 samic potkanů byly podávány intraperitoneální dávky acykloviru v dávce 0, 5, 20 nebo 80 mg/kg/den po dobu 6 měsíců. Deset samců a 10 samic potkanů v každé skupině pokračovalo bez dávky po dobu 13 týdnů. Testikulární atrofie byla omezena na vysoké dávky potkanů, kterým byla podávána dávka 80 mg/kg/den po dobu 6 měsíců. Údaje o hmotnosti orgánu a světelná mikroskopie definovaly plnou reverzibilitu testikulární atrofie do konce období zotavení po dávce.
Ve 31denní studii na psech (16 samců a 16 samic na skupinu), kde byl acyklovir podáván intravenózně v dávkách 50, 100 a 200 mg/kg/den, byla varlata u psů při dávce 50 mg/kg normální. Dávky 100 nebo 200 mg/kg/den způsobily smrt některých psů v důsledku cytostatických účinků (kostní dřeň a gastrointestinální epitel) a aspermických varlat nebo varlat s rozptýlenými aspermickými tubuly. Nelze vyloučit, že změna varlat mohla být primární, nicméně podobné změny lze pozorovat sekundárně po těžkém stresu u umírajících psů.
Vývojové studie toxicity
Novorozené krysy - subchronická studie
Acyclovir rozpuštěný v 0,4% sterilním fyziologickém roztoku byl podáván subkutánní injekcí novorozeným krysám Charles River CD (Sprague-Dawley) po dobu 19 po sobě jdoucích dnů, počínaje 3. dnem po porodu. Testované úrovně dávek byly 0, 5, 20 a 80 mg/kg tělesné hmotnosti. V každé dávce bylo 12 vrhů (každý sestával z 5 samců a 5 novorozenců kojících přirozenou matku). Přehrady nebyly ošetřeny. Novorozenci byli z každé skupiny odebráni pro pitvu a mikroskopické hodnocení široké škály tkání, včetně očí a více částí mozku, poté, co byli léčeni po dobu 5, 12 nebo 19 dnů a po 3týdenním období bez podávání léku ( v té době jim bylo 45 dní). Hematologické (hemoglobin, objem buněk, RBC, WBC a diferenciální počty buněk) a klinické chemické testy (BUN) byly provedeny po 16 dnech léčby a opakovány 18 dnů po podání poslední (19.) dávky.
Krev byla odebrána některým novorozencům 30 minut po léčbě v den 1, v den 9 a na konci období dávkování pro stanovení koncentrací acykloviru v plazmě. Největší koncentrace acykloviru v plazmě byla 99,1 μg/ml (440,5 μM), která byla nalezena ve spojené plazmě odebrané od 6 samic novorozenců s vysokou dávkou (80 mg/kg) 30 minut po podání první dávky. Léčba acyklovirem nezvyšovala mortalitu v novorozeneckém období.
Krysy ve skupině s nízkou dávkou získaly stejnou tělesnou hmotnost jako příslušné kontrolní krysy. Významné (p
Oční vyšetření a světelná mikroskopie neodhalily nepříznivé účinky na vývoj oka. Je třeba zdůraznit, že neexistují žádné morfologické nebo funkční důkazy nepříznivých účinků na vyvíjející se mozek nebo jiné části centrálního nervového systému. Acyklovir je tedy zřetelně odlišný od cytosinarabinosidu, o kterém se uvádí, že způsobuje výraznou cerebelární a retinální dysplazii u novorozených potkanů.
Mutagenita a další krátkodobé studie
Acyclovir byl testován na mutagenní potenciál v řadě systémů in vitro a in vivo: 10. listopadu 2014 Strana 27 z 38
Mikrobiální
Acyclovir byl testován na mutagenní aktivitu v testu Ames Salmonella na plotně; v preinkubační modifikaci Amesova testu; v Rosenkrantz E. coli polA+/polA- testu opravy DNA; a v eukaryotu S. cerevisiae, D-4. Všechny studie byly provedeny jak v přítomnosti, tak v nepřítomnosti exogenní metabolické aktivace savců. Acyclovir neposkytl žádné pozitivní reakce v žádném z těchto systémů.
Předchozí studie Salmonella byly rozšířeny na extrémně vysoké koncentrace za účelem dosažení toxicity. Nebyly pozorovány žádné pozitivní účinky v přítomnosti nebo nepřítomnosti exogenní metabolické aktivace savců při koncentracích acykloviru až do 300 mg/misku nebo 80 mg/ml.
Savčí systémy
Acyclovir byl testován na mutagenní aktivitu v kultivovaných buňkách myšího lymfomu L5178Y, heterozygotních v lokusu thymidinkinázy (TK), měřením rychlosti dopředných mutací k TK-deficienci (TK+/- → TK-/-; další studie byly provedeny na HGPRT lokusu a na markeru rezistence na Ouabain v těchto stejných buňkách. Všechny studie byly provedeny v přítomnosti a v nepřítomnosti exogenní metabolické aktivace savců. Testovaná sloučenina byla mutagenní v lokusu TK při vysokých koncentracích (400 -2 400 μg/ml) (Pro srovnání, horní hranice maximálních plazmatických hladin acykloviru po perorálním podání 200 mg q4h je 0,9 μg/ml.) Byl negativní v lokusu HGPRT a markeru rezistence na Ouabain.Identické výsledky byly získány s metabolickou aktivací i bez ní.
Neprůkazné výsledky bez zjevné odpovědi související s dávkou byly získány, když byla mutagenita acykloviru studována na každém ze 3 lokusů (APRT, HGPRT a rezistence na Ouabain) v buňkách vaječníků čínského křečka (CHO), a to jak v přítomnosti, tak v nepřítomnosti exogenní metabolické aktivace.
Bylo prokázáno, že acyklovir v koncentraci 50 μg/ml (222 μM) po dobu 72hodinové expozice způsobuje statisticky významné zvýšení výskytu morfologicky transformovaných ložisek v důsledku ošetření buněk BALB/C-3T3 in vitro nepřítomnost exogenní metabolické aktivace. Bylo ukázáno, že morfologicky transformovaná ložiska rostou jako nádory po transplantaci do imunosuprimovaných, syngenních, odstavených myší. Nádorové tkáně byly diagnostikovány jako buď nediferencované sarkomy nebo lymfosarkomy.
Acyclovir v koncentracích mezi 8 a 64 μg/ml po dobu 18hodinové expozice neindukoval žádná morfologicky transformovaná ložiska mezi C3H/10T ½ buňkami ošetřenými in vitro v nepřítomnosti exogenní metabolické aktivace.
Acyklovir v koncentracích 62,5 a 125 μg/ml pro 48hodinovou expozici neindukoval žádné chromozomové aberace v kultivovaných lidských lymfocytech bez exogenní metabolické aktivace. Při vyšších koncentracích, 250 a 500 μg/ml po dobu 48hodinové expozice, způsobil acyklovir významný nárůst výskytu poškození chromozomů. Při expozici acykloviru došlo také k významnému poklesu mitotického indexu v závislosti na dávce.
Acyclovir v dávkách 25 a 50 mg/kg/den ip po dobu 5 po sobě jdoucích dnů nevyvolal dominantní letální účinek u samců myší BKA (CPLP). Dále nebyl prokázán dominantní letální účinek na samce a samice myší Charles River CD-1 (ICR) léčených perorálně v dávkách 50, 150 a 450 mg/kg/den, jak je shrnuto pro dvougenerační studii reprodukce/fertility. .
Acyclovir v jednotlivých intraperitoneálních dávkách 25, 50 a 100 mg/kg nedokázal vyvolat chromozomové aberace v buňkách kostní dřeně čínských křečků, když byl zkoumán 24 hodin po podání. Při vyšších nefrotoxických dávkách (500 a 1 000 mg/kg) byl pozorován blastogenní účinek. (Intraperitoneální dávka 500 mg/kg vytváří průměrné maximální plazmatické hladiny u čínských křečků 611 μg/ml (2,72 mM), což je 680krát více než horní hranice maximálních plazmatických hladin u člověka při perorálním dávkování 200 mg q4h).
Acyclovir v jednotlivých intravenózních dávkách 25, 50 a 100 mg/kg nevyvolal chromozomové aberace v buňkách kostní dřeně samců a samic potkanů, když byl zkoumán 6, 24 a 48 hodin po léčbě.
Všechny tyto studie tedy ukázaly, že acyklovir nezpůsobuje jednogenové mutace, ale je schopen rozbít chromozomy.
Imunotoxikologické studie
Acyclovir byl podroben řadě imunologických testů in vitro a in vivo.
Ve dvou testech in vivo, cytotoxicitě zprostředkované lymfocyty a chemotaxi neutrofilů, nevykazoval acyklovir žádné inhibiční účinky při koncentracích až 135 μg/ml (600 μM). Sloučenina inhibovala tvorbu růžice přibližně z 50 % při 0,9 μg/ml (4 μM).
Ve čtyřech in vivo testech na myších, které měřily buněčně zprostředkovanou imunitu (buněčná cytotoxicita závislá na komplementu, buněčná cytotoxicita nezávislá na komplementu, opožděná hypersenzitivita a reakce štěpu vs. hostitel), nevykazoval acyklovir žádné inhibiční účinky v jednotlivých dávkách až do 200 mg/kg podaných 2. den po antigenní stimulaci.
Čtyři denní dávky 100 mg/kg/den neměly žádný významný účinek na Jerne hemolysinové plaky nebo cirkulující protilátku v den 7 po antigenní stimulaci. Když byly Jerneovy hemolysinové plaky a titry protilátek zkoumány čtyři dny po antigenní expozici a jeden den po poslední dávce léku, 100 mg/kg vykazovalo pouze mírný supresivní účinek. Nicméně dávka 200 mg/kg způsobila určitý úbytek hmotnosti (-2,2 g), mírné snížení počtu Jerneových hemolysinových plaků (PFC/slezina byla snížena na 33 % kontroly, PFC/107 WBC na 46,5 % kontroly). Došlo však pouze k malému snížení titru cirkulujícího hemaglutininu (z 8,3 na 6,5) a titru cirkulujícího hemolyzinu (z 9,5 na 8,3) při dávce 200 mg/kg.
experimentech na myších určených k testování, zda acyklovir zesílí imunosupresivní účinek azathioprinu na tvorbu protilátek, bylo zjištěno, že účinky těchto dvou léků nebyly více než aditivní. Pouze dávka 200 mg/kg acykloviru vykazovala zvýšené potlačení protilátkové odpovědi, když byla podávána v kombinaci s azathioprinem v dávkách nad 25 mg/kg.
Byly provedeny studie k vyhodnocení vlivu acykloviru in vitro na funkci lidských lymfocytů. Inhibiční účinky na blastogenezi byly pozorovány pouze v testech zkoumajících maximální koncentrace silných mitogenů, fytohemaglutininu (PHA) a konkanavalinu A (Con A), a pouze při koncentracích léčiva nad 50 μg/ml (222 μM) a byly mnohem menší u monilie a antigeny tetanového toxoidu, kde je blastogenní odpověď charakteristicky méně intenzivní. Byl pozorován velmi malý účinek na cytotoxicitu nebo produkci LIF s výjimkou koncentrací 200 μg/ml (890 μM), kde již byl prokázán přímý cytotoxický účinek. Tyto inhibiční koncentrace daleko převyšují očekávané hladiny z dávek vybraných pro klinickou aplikaci a jsou více než 1000krát vyšší než koncentrace potřebná k inhibici množení herpesviru in vitro.
Byl měřen účinek acykloviru na lidské buňky. Koncentrace 11,2 - 22,5 μg/ml (50-100 μM) inhibuje dělení fibroblastů v různé míře, v závislosti na experimentálním uspořádání a konfluenci monovrstvy. Velikost tohoto účinku byla menší než účinek způsobený adeninarabinosidem nebo lidským leukocytárním interferonem, když byla tato tři antivirová činidla srovnávána v klinicky relevantních koncentracích. Acyclovir také inhiboval inkorporaci thymidinu mononukleárními buňkami periferní krve stimulovanými PHA nebo třemi různými antigeny herpesviru. U těchto buněk byla pozorována lineární křivka dávka-odpověď a jejich proliferace byla z 50 % inhibována 22,5 μg/ml (100 μM) acykloviru. Inhibice byla uplatněna na proliferaci T-buněk bez zjevného účinku na uvolňování lymfokinů nebo na funkci monocytů.
Je třeba také zmínit, že v podrobných subchronických a chronických testech na zvířatech uvedených dříve v tomto souhrnu nebyly žádné důkazy o nepříznivých účincích na imunitní systém, s výjimkou příliš vysokých dávek (50 až 100 mg/kg dvakrát denně) u psů s výraznou lymfoidní hypoplazií došlo.
REFERENCE
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Acyclovir léčba planých neštovic u jinak zdravých dětí. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Acyclovir léčba planých neštovic u jinak zdravých adolescentů. Collaborative Acyclovir Varicella Study Group. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Antivirová léčiva: acyklovir, v Recent Advances in Clinical Pharmacology. Turner P, Shand DG (eds) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Virová rezistence v klinické praxi: shrnutí pětiletých zkušeností s acyklovirem. Farmakologické a klinické přístupy k herpesvirům a virové chemoterapii, Aiso, Japonsko, 10.-13. září 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Virová rezistence, klinické zkušenosti. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Virová rezistence v klinické praxi: shrnutí pětileté zkušenosti s acyklovirem. Proceedings of the International Symposium on Pharmacological and Clinical Approches to Herpes Viruss and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Účinek acykloviru v kombinaci s jinými antiherpetickými látkami na virus varicella zoster in vitro. Am J Med 1982; 73(1A):54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Farmakokinetika více dávek intravenózního acykloviru u pacientů na kontinuální ambulantní peritoneální dialýze. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD a kol. Léčba prvních epizod genitální infekce virem herpes simplex perorálním acyklovirem. Randomizovaná dvojitě zaslepená kontrolovaná studie u normálních subjektů. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C a kol. Izolace a charakterizace rezistentního viru Herpes simplex po terapii acyklovirem. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Charakterizace klinických izolátů viru herpes simplex rezistentních a citlivých na acyklovir od imunokompromitovaného pacienta. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Virus Varicella-Zoster se během terapie nestává odolnější vůči acykloviru. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. Aktivita 9-(2-hydroxyethoxymethyl)guaninu (acykloguanosinu), nového antivirového činidla, in vitro proti herpes viru. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Monitorování citlivosti izolátů viru herpes simplex od pacientů užívajících acyklovir. J Antimicrob Chemother 1986; 18 Suppl B:103-112.
15. Collins P. Citlivost na viry po zavedení acykloviru. Am J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Charakterizace DNA polymerázové mutanty viru herpes simplex od těžce imunokompromitovaného pacienta, který dostával acyklovir. J Gen Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Inhibice růstu herpetických virů izolovaných z lidských infekcí acykloguanosinem. Antimicrob Agents Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Rezistence na antivirotika viru herpes simplex izolovaného od pacienta léčeného acyklovirem. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Mechanismy rezistence k inhibitorům nukleosidových analogů viru herpes simplex. 6th Int Congr Virol 1984; (Abstrakt č. W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF a kol. Srovnávací účinnost antiherpes léků proti různým kmenům viru herpes simplex. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Srovnávací účinnost antiherpes léků v různých buněčných liniích. Antimicrob Agents Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Rezistence virů v klinické praxi. J Antimicrob Chemother 1983; 12 Suppl B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. Dvojitě zaslepená, placebem kontrolovaná studie účinku chronicky podávaného perorálního acykloviru na produkci spermií u mužů s často recidivujícím genitálním herpesem. J Infect Dis 1988 březen; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA a kol. Dvojitě zaslepená studie perorálního acykloviru pro potlačení recidiv infekce virem genitálního herpes simplex. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. Kontrolovaná studie acykloviru pro plané neštovice u normálních dětí. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S et. Charakterizace klinického izolátu HSV-2 obsahujícího ACV-rezistentní mutant, který produkuje thymidinkinázu se změněnou substrátovou specifitou. Devátý Int Herpesvirus Workshop, Seattle, Washington, 24. až 29. srpna 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Klinický izolát viru herpes simplex typu 2, který indukuje thymidinkinázu se změněnou substrátovou specifitou. Antimicrob Agents Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex virus odolný vůči acykloviru. Studium v centru terciární péče. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Foscarnetová terapie pro těžké infekce virem herpes simplex typu 2 rezistentní na acyklovir u pacientů se syndromem získané imunodeficience (AIDS). Nekontrolovaný soud. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Infekce virem herpes simplex rezistentní na acyklovir u pacientů se syndromem získané imunodeficience. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Izolace a charakterizace acyklovir-rezistentních mutant viru herpes simplex. J Gen Virol 1980; 49(1):115-124.
32. Pole HJ. Problém lékové rezistence u virů, v Problematika antivirové terapie. Stuart-Harris CH, Oxford J (Eds) Academic Press, Londýn 1983.
33. Fyfe K. Vzorce recidivy genitálního herpesu po více než 5 letech chronické suprese acykloviru. VIII Int Conf AIDS/III Std Wrld Cong 1992;(B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L a kol. Léčba herpes zoster perorálním acyklovirem. Am J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Infekce virem varicella zoster rezistentní na acyklovir po chronické perorální léčbě acyklovirem u pacientů se syndromem získané imunodeficience (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et al. Prodloužená kontinuální léčba acyklovirem u normálních dospělých s často se opakující infekcí genitálního herpes simplex virem. Studijní skupina Acyclovir. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Vliv hemodialýzy na farmakokinetiku acykloviru u pacientů s chronickým selháním ledvin. Am J Med 1982; 73(1A):202-204.
38. Kurtz T. Bezpečnost a účinnost dlouhodobé supresivní léčby často se opakujícího genitálního herpesu cyklovirem: výsledky 5. roku. 30th Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L a kol. Vliv selhání ledvin na farmakokinetiku acykloviru. Am J Med 1982; 73(1A):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Neočekávaná akumulace acykloviru v mateřském mléce s odhadem expozice kojence. Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Recidivující genitální herpes a supresivní perorální léčba acyklovirem. Vztah mezi klinickým výsledkem a citlivostí na léčivo in vitro. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Citlivost HSV genitálních izolátů po perorálním acykloviru. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. října 1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A a kol. Dvojitě zaslepená, placebem kontrolovaná studie porovnávající dlouhodobou supresivní a krátkodobou perorální terapii acyklovirem při léčbě recidivujícího genitálního herpesu. Am J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack CD, Barry DW. Spektrum citlivosti acykloviru klinických izolátů viru herpes simplex. Am J Med 1982; 73(1A):376-379.
45. McLaren C, Ellis MN, Hunter GA. Kolorimetrický test pro měření citlivosti virů herpes simplex na antivirová činidla. Antiviral Res 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In vitro citlivost na acyklovir u virů genitálního herpes simplex od pacientů léčených acyklovirem. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et al. Dvojitě zaslepená placebem kontrolovaná studie perorálního acykloviru u první epizody genitální infekce virem herpes simplex. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Dlouhodobá suprese acykloviru u často se opakujících genitálních infekcí virem herpes simplex. Multicentrický dvojitě zaslepený pokus. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et al. Prodloužená kontinuální versus intermitentní perorální léčba acyklovirem u normálních dospělých s často se opakující infekcí genitálního herpes simplex virem. Am J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Acyclovir v lidském mateřském mléce. Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et al. Profylaktický perorální acyklovir u recidivujícího genitálního herpesu. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Perorální acyklovir v léčbě herpes zoster v praktické praxi. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Vztah cytohistopatologie genitální herpesvirové infekce k cervikální anaplazii. Cancer Res 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K a kol. Účinnost perorálního acykloviru při léčbě počátečního a recidivujícího genitálního herpesu. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. In vitro citlivost herpesviru na acyklovir u pacientů užívajících supresivní perorální terapii. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. října 1984; (Abstrakt č. 1015).
56. O'Brien JJ, Campoli-Richards DM. Acyclovir. Aktualizovaný přehled jeho antivirové aktivity, farmakokinetických vlastností a terapeutické účinnosti. Drugs 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N a kol. Kontinuální infekce varicella-zoster spojená s rezistencí na acyklovir u dítěte s AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Infekce virem herpes simplex rezistentní vůči acykloviru v důsledku změněné DNA polymerázy. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. V klinických izolátech existují varianty viru Herpes simplex omezující vysoké koncentrace acykloviru. Antimicrob Agents Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Citlivost vakcinačních kmenů viru varicella-zoster k antivirovým sloučeninám. Antimicrob Agents Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Léčba rekurentních infekcí genitálního herpes simplex perorálním acyklovirem. Kontrolovaný soud. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krásný HC. Farmakokinetika acykloviru u pacienta na kontinuální ambulantní peritoneální dialýze. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Patogenita viru herpes simplex typu 1 rezistentního na acyklovir od imunodeficientního dítěte. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Perorální acyklovir k potlačení opakujících se infekcí virem herpes simplex u pacientů s imunodeficiencí. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Potlačení často se opakujícího genitálního herpesu. Placebem kontrolovaná dvojitě zaslepená studie perorálního acykloviru. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Acyclovir potlačení často se opakujícího genitálního herpesu. Účinnost a klesající potřeba během po sobě jdoucích let léčby. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Chronická herpetická infekce u imunokompromitovaného pacienta: zpráva o případu. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Intravenózní acyklovir k léčbě mukokutánní infekce virem herpes simplex po transplantaci dřeně: dvojitě zaslepená studie. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Frekvence a význam viru herpes simplex rezistentního na acyklovir izolovaného od pacientů po transplantaci dřeně, kteří dostávali více cyklů léčby acyklovirem. J Infect Dis 1983; 148(6):1077-1082.
INFORMACE PRO PACIENTA
Pacientky jsou poučeny, aby se poradily se svým lékařem, pokud zaznamenají závažné nebo problematické nežádoucí reakce, otěhotní nebo plánují otěhotnět, zamýšlejí kojit při perorálním podávání přípravku ZOVIRAX (aciklovir) nebo mají jakékoli jiné otázky.
Pacienti by měli být poučeni, aby udržovali dostatečnou hydrataci.
