Sustiva 200mg, 600mg Efavirenz Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je přípravek Sustiva 600 mg a jak se používá?
Sustiva je lék na předpis používaný k léčbě příznaků infekce HIV. Sustiva lze užívat samostatně nebo s jinými léky.
Sustiva patří do třídy léků nazývaných HIV, NNRTI.
Není známo, zda je přípravek Sustiva bezpečný a účinný u dětí mladších 3 měsíců.
Jaké jsou možné vedlejší účinky přípravku Sustiva?
Sustiva může způsobit závažné nežádoucí účinky včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- horečka,
- bolest krku,
- pálení očí,
- bolest kůže,
- červená nebo fialová kožní vyrážka s puchýři a olupováním,
- záchvat,
- halucinace,
- potíže se soustředěním,
- potíže s mluvením nebo pohybem (mohou se objevit měsíce nebo roky po zahájení léčby),
- závrať,
- ospalost,
- zmatek,
- potíže se soustředěním,
- podivné sny,
- nespavost,
- problémy s řečí,
- potíže s rovnováhou nebo pohybem svalů,
- úzkost,
- paranoia,
- neobvyklé chování,
- pocit smutku nebo beznaděje,
- sebevražedné myšlenky,
- nevolnost,
- bolest břicha,
- ztráta chuti k jídlu,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- noční pocení,
- oteklé žlázy,
- opary,
- kašel,
- sípání,
- průjem,
- ztráta váhy,
- potíže s polykáním,
- problémy s rovnováhou nebo pohybem očí,
- slabost,
- bodavý pocit,
- otok krku nebo hrdla (zvětšená štítná žláza),
- menstruační změny a
- impotence
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Sustiva patří:
- nevolnost,
- zvracení,
- závrať,
- ospalost,
- potíže se soustředěním,
- vyrážka,
- bolest hlavy,
- únava,
- problémy se spánkem (nespavost),
- podivné sny a
- změny tvaru nebo umístění tělesného tuku (zejména na pažích, nohou, obličeji, krku, prsou a pasu)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Sustiva. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
SUSTIVA® (efavirenz) je HIV-1 specifický nenukleosidový inhibitor reverzní transkriptázy (NNRTI). Efavirenz je chemicky popsán jako (S)-6-chlor-4-(cyklopropylethynyl)-1,4-dihydro4-(trifluormethyl)-2H-3,1-benzoxazin-2-on. Jeho empirický vzorec je C14H9ClF3NO2 a jeho strukturní vzorec je:
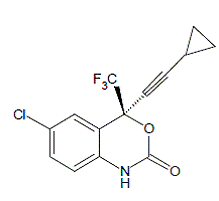
Efavirenz je bílý až slabě růžový krystalický prášek s molekulovou hmotností 315,68. Je prakticky nerozpustný ve vodě (
Kapsle
SUSTIVA je dostupný jako tobolky pro perorální podání obsahující buď 50 mg nebo 200 mg efavirenzu a následující neúčinné složky: monohydrát laktózy, magnesium-stearát, natrium-laurylsulfát a sodnou sůl glykolátu škrobu. Obal kapsle obsahuje následující neaktivní složky a barviva: želatinu, laurylsulfát sodný, oxid titaničitý a/nebo žlutý oxid železitý. Plášť kapslí může také obsahovat oxid křemičitý. Tobolky jsou potištěny inkoustem obsahujícím karmínovou modř 40, modř FD&C č. 2 a oxid titaničitý.
Tablety
SUSTIVA 600 mg je dostupný jako potahované tablety pro perorální podání obsahující 600 mg efavirenzu a následující neúčinné složky: sodná sůl kroskarmelózy, hydroxypropylcelulóza, monohydrát laktózy, magnesium-stearát, mikrokrystalická celulóza a laurylsulfát sodný. Filmový potah obsahuje Opadry Yellow a Opadry Clear. Tablety jsou vyleštěny karnaubským voskem a potištěny fialovým inkoustem Opacode WB.
INDIKACE
SUSTIVA® (efavirenz) v kombinaci s jinými antiretrovirovými látkami je indikován k léčbě infekce virem lidské imunodeficience typu 1 (HIV-1) u dospělých a dětských pacientů ve věku alespoň 3 měsíců a vážících alespoň 3,5 kg.
DÁVKOVÁNÍ A PODÁVÁNÍ
Funkce jater
Monitorujte jaterní funkce před a během léčby přípravkem SUSTIVA (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. SUSTIVA 600 mg se nedoporučuje u pacientů se středně těžkou nebo těžkou poruchou funkce jater (Child Pugh B nebo C) (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Dospělí
Doporučená dávka přípravku SUSTIVA (efavirenz) je 600 mg perorálně jednou denně v kombinaci s inhibitorem proteázy a/nebo nukleosidovými analogovými inhibitory reverzní transkriptázy (NRTI). Doporučuje se užívat SUSTIVA nalačno, nejlépe před spaním. Zvýšené koncentrace efavirenzu pozorované po podání SUSTIVA 600 mg s jídlem mohou vést ke zvýšení frekvence nežádoucích účinků (viz KLINICKÁ FARMAKOLOGIE ]. Dávkování před spaním může zlepšit snášenlivost příznaků nervového systému [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE , a INFORMACE PRO PACIENTA ]. Tobolky nebo tablety SUSTIVA by se měly spolknout neporušené a zapít tekutinou. U pacientů, kteří nemohou polykat tobolky nebo tablety, se doporučuje způsob podávání tobolkovým posypem [viz Způsob podání kapsle postřikem ].
Souběžná antiretrovirová terapie
SUSTIVA musí být podáván v kombinaci s jinými antiretrovirovými léky [viz INDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
Úprava dávkování
Pokud je SUSTIVA 200 mg podáván současně s vorikonazolem, udržovací dávka vorikonazolu by měla být zvýšena na 400 mg každých 12 hodin a dávka SUSTIVA 200 mg by měla být snížena na 300 mg jednou denně s použitím lékové formy tobolky (jedna 200 mg a dvě 50 mg tobolky nebo šest 50 mg tobolek mg tobolky). Tablety SUSTIVA 600 mg se nesmí lámat. [vidět DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE .]
Pokud se SUSTIVA podává společně s rifampinem pacientům s hmotností 50 kg nebo více, doporučuje se zvýšit dávku SUSTIVA 200 mg až 800 mg jednou denně (viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Pediatričtí pacienti
Doporučuje se užívat SUSTIVA 600 mg nalačno, nejlépe před spaním. Tabulka 1 popisuje doporučenou dávku SUSTIVA pro pediatrické pacienty ve věku 3 měsíců nebo starší a s hmotností mezi 3,5 kg a 40 kg [viz KLINICKÁ FARMAKOLOGIE ]. Doporučená dávka SUSTIVA u pediatrických pacientů s hmotností 40 kg nebo vyšší je 600 mg jednou denně. U pediatrických pacientů, kteří nemohou polykat tobolky, může být obsah tobolek podán s malým množstvím potravy nebo kojenecké výživy pomocí způsobu podání tobolky [viz Způsob podání kapsle postřikem ].
Způsob podání kapsle postřikem
Dětským pacientům ve věku alespoň 3 měsíců a vážícím alespoň 3,5 kg a dospělým, kteří nemohou polykat tobolky nebo tablety, lze obsah tobolky podávat s malým množstvím (1 až 2 čajové lžičky) jídla. Použití kojenecké výživy pro míchání by mělo být zvažováno pouze u těch malých kojenců, kteří nemohou spolehlivě konzumovat pevnou stravu. Pacienti a ošetřovatelé by měli být poučeni, aby tobolku otevírali opatrně, aby nedošlo k rozlití nebo rozptýlení obsahu tobolky do vzduchu. Kapsle by měla být držena vodorovně nad malou nádobou a opatrně otočena, aby se otevřela. U pacientů schopných tolerovat pevnou stravu by měl být celý obsah tobolky jemně smíchán s měkkým jídlem vhodným pro jejich věk, jako je jablečný pyré, hroznové želé nebo jogurt, v malé nádobce. U malých kojenců, kteří dostávají směs kapslí a kojenecké výživy, by měl být celý obsah kapsle jemně vmíchán do 2 čajových lžiček rekonstituované kojenecké výživy pokojové teploty v malé nádobě opatrným mícháním malou lžičkou a poté nasát směs do 10 ml perorální dávkovací stříkačka pro podání. Po podání přípravku SUSTIVA-potravina nebo směsi SUSTIVA-u se musí do prázdné míchací nádoby přidat další malé množství (přibližně 2 čajové lžičky) krmiva nebo přípravku, zamíchat, aby se rozptýlily zbytky SUSTIVA-u, a podat pacientovi. Směs SUSTIVA-potravina nebo směs by měla být podána do 30 minut od smíchání. Po dobu 2 hodin po podání SUSTIVA se nesmí konzumovat žádné další jídlo.
Další pokyny pro pacienty týkající se způsobu podávání posypem kapslí jsou uvedeny v označení pacienta schváleném FDA (viz INFORMACE PRO PACIENTA a NÁVOD K POUŽITÍ ).
JAK DODÁVÁNO
Dávkové formy A Síly
Kapsle
200 mg tobolky jsou zlaté barvy, na zadní straně potištěné „SUSTIVA“ na těle a potištěné „200 mg“ na víčku.
50 mg tobolky jsou zlaté a bílé s potiskem „SUSTIVA“ na zlatém víčku a reverzně vytištěným „50 mg“ na bílém těle.
Tablety
600 mg tablety jsou žluté potahované tablety ve tvaru tobolky s potiskem „SUSTIVA“ na obou stranách.
Skladování A Manipulace
Kapsle
Kapsle SUSTIVA® (efavirenz) jsou dostupné následovně:
Tobolky 200 mg jsou zlaté barvy, na rubu s potiskem „SUSTIVA“ na těle a „200 mg“ na víčku.
Láhve po 90 - NDC 0056-0474-92
Tobolky 50 mg jsou zlaté a bílé s potiskem „SUSTIVA“ na zlatém víčku a na zadní straně vytištěným „50 mg“ na bílém těle.
Láhve po 30 - NDC 0056-0470-30
Tablety
Tablety SUSTIVA® (efavirenz) jsou dostupné následovně:
Tablety 600 mg jsou žluté potahované tablety ve tvaru tobolky s potiskem „SUSTIVA“ na obou stranách.
Láhve po 30 - NDC 0056-0510-30
Úložný prostor
SUSTIVA 600 mg tobolky a SUSTIVA tablety by měly být skladovány při teplotě 25 °C (77 °F); povolené výchylky do 15°C-30°C (59°F-86°F) [viz USP Controlled Room Temperature].
Distribuce: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Upraveno: říjen 2020
VEDLEJŠÍ EFEKTY
Nejvýznamnější nežádoucí účinky pozorované u pacientů léčených přípravkem SUSTIVA jsou:
- psychiatrické příznaky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ],
- příznaky nervového systému [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ],
- vyrážka [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze hlášené četnosti nežádoucích účinků přímo srovnávat s četnostmi v jiných klinických studiích a nemusí odrážet četnosti pozorované v klinické praxi.
Nežádoucí účinky u dospělých
Nejčastějšími (>5 % v obou skupinách léčených efavirenzem) nežádoucími účinky alespoň střední závažnosti u pacientů ve studii 006 léčených přípravkem SUSTIVA 200 mg v kombinaci se zidovudinem/lamivudinem nebo indinavirem byly vyrážka, závratě, nauzea, bolest hlavy, únava, nespavost, a zvracení.
Vybrané klinické nežádoucí účinky střední nebo závažné intenzity pozorované u ≥ 2 % pacientů léčených přípravkem SUSTIVA ve dvou kontrolovaných klinických studiích jsou uvedeny v tabulce 2.
Byla hlášena pankreatitida, i když kauzální vztah s efavirenzem nebyl prokázán. Asymptomatické zvýšení hladin sérové amylázy bylo pozorováno u významně vyššího počtu pacientů léčených efavirenzem 600 mg než u kontrolních pacientů (viz Laboratorní abnormality ).
Příznaky nervového systému
1008 pacientů léčených režimy obsahujícími SUSTIVA a 635 pacientů léčených kontrolním režimem v kontrolovaných studiích uvádí Tabulka 3 četnost příznaků různého stupně závažnosti a uvádí míru přerušení pro jeden nebo více z následujících příznaků nervového systému: závratě, nespavost, porucha koncentrace, ospalost, abnormální snění, euforie, zmatenost, agitovanost, amnézie, halucinace, strnulost, abnormální myšlení a depersonalizace [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Frekvence specifických symptomů centrálního a periferního nervového systému jsou uvedeny v tabulce 2.
Psychiatrické symptomy
U pacientů léčených přípravkem SUSTIVA byly hlášeny závažné psychiatrické nežádoucí účinky. V kontrolovaných studiích byly psychiatrické příznaky pozorované s frekvencí vyšší než 2 % u pacientů léčených přípravkem SUSTIVA 600 mg nebo kontrolními režimy deprese (19 %, 16 %), úzkost (13 %, 9 %) a nervozita (7 % , 2 %).
Vyrážka
kontrolovaných klinických studiích byla frekvence vyrážky (všech stupňů, bez ohledu na kauzalitu) 26 % u 1008 dospělých léčených režimy obsahujícími SUSTIVA 200 mg a 17 % u 635 dospělých léčených kontrolním režimem. Většina zpráv o vyrážce byla mírná nebo středně závažná. Frekvence vyrážky 3. stupně byla 0,8 % u pacientů léčených přípravkem SUSTIVA a 0,3 % u kontrolních skupin a frekvence vyrážky 4. stupně byla 0,1 % u přípravku SUSTIVA a 0 u kontrolních skupin. Míra přerušení léčby v důsledku vyrážky byla 1,7 % u pacientů léčených přípravkem SUSTIVA a 0,3 % u kontrolních skupin (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zkušenosti s přípravkem SUSTIVA u pacientů, kteří vysadili jiná antiretrovirová léčiva ze třídy NNRTI, jsou omezené. Devatenáct pacientů, kteří vysadili nevirapin kvůli vyrážce, bylo léčeno přípravkem SUSTIVA. U devíti z těchto pacientů se během léčby přípravkem STOCRIN vyvinula mírná až středně těžká vyrážka a dva z těchto pacientů léčbu ukončili kvůli vyrážce.
Laboratorní abnormality
Vybrané laboratorní abnormality stupně 3-4 hlášené u ≥ 2 % pacientů léčených přípravkem SUSTIVA ve dvou klinických studiích jsou uvedeny v tabulce 4.
Pacienti koinfikovaní hepatitidou B nebo C
pacientů s hepatitidou B a/nebo C v anamnéze by měly být monitorovány jaterní testy. V souboru dlouhodobých údajů ze studie 006 bylo 137 pacientů léčených režimem obsahujícím SUSTIVA (medián trvání léčby 68 týdnů) a 84 léčených s kontrolním režimem (medián trvání, 56 týdnů) byly séropozitivní při screeningu na hepatitidu B (pozitivní povrchový antigen) a/nebo C (pozitivní protilátky proti hepatitidě C). Mezi těmito koinfikovanými pacienty se zvýšení AST na více než pětinásobek ULN vyvinulo u 13 % pacientů ve větvi SUSTIVA a 7 % pacientů v kontrolní větvi a zvýšení ALT na více než pětinásobek ULN se vyvinulo u 20 % pacientů v ramenech SUSTIVA a 7 % pacientů v kontrolním rameni. Mezi koinfikovanými pacienty 3 % těch, kteří byli léčeni režimy obsahujícími SUSTIVA a 2 % v kontrolní větvi, přerušili studii kvůli poruchám jater nebo žlučového systému (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lipidy
některých neinfikovaných dobrovolníků užívajících SUSTIVA bylo pozorováno zvýšení celkového cholesterolu o 10-20 % oproti výchozí hodnotě. U pacientů léčených přípravkem SUSTIVA + zidovudin + lamivudin bylo pozorováno zvýšení celkového cholesterolu bez lačnění přibližně o 20 % a HDL přibližně o 25 % oproti výchozí hodnotě. U pacientů léčených přípravkem SUSTIVA + indinavir bylo pozorováno zvýšení cholesterolu bez lačno přibližně o 40 % a HDL přibližně o 35 % oproti výchozí hodnotě. Hladiny celkového cholesterolu po lačnění ≥240 mg/dl a ≥300 mg/dl byly hlášeny u 34 % a 9 % pacientů léčených přípravkem SUSTIVA + zidovudin + lamivudin; 54 % a 20 % pacientů léčených přípravkem SUSTIVA + indinavir; a 28 % a 4 % pacientů léčených indinavirem + zidovudinem + lamivudinem. Účinky přípravku SUSTIVA 600 mg na triglyceridy a LDL v této studii nebyly dobře charakterizovány, protože vzorky byly odebrány pacientům, kteří nehladovali. Klinický význam těchto nálezů není znám [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nežádoucí účinky u pediatrických pacientů
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze hlášené četnosti nežádoucích účinků přímo srovnávat s četnostmi v jiných klinických studiích a nemusí odrážet četnosti pozorované v klinické praxi.
Hodnocení nežádoucích účinků je založeno na třech klinických studiích u 182 pediatrických pacientů infikovaných HIV-1 (ve věku 3 měsíce až 21 let), kteří dostávali SUSTIVA 200 mg v kombinaci s jinými antiretrovirovými přípravky po dobu mediánu 123 týdnů. Nežádoucí účinky pozorované ve třech studiích byly podobné těm, které byly pozorovány v klinických studiích u dospělých, kromě toho, že vyrážka byla častější u pediatrických pacientů (32 % pro všechny stupně bez ohledu na kauzalitu) a častěji vyššího stupně (tj. závažnější). U dvou (1,1 %) pediatrických pacientů se objevila vyrážka 3. stupně (splývající vyrážka s horečkou, generalizovaná vyrážka) a čtyři (2,2 %) dětští pacienti měli vyrážku 4. stupně (všechny erythema multiforme). Pět pediatrických pacientů (2,7 %) přerušilo studii kvůli vyrážce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku SUSTIVA po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace neznámé velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo jako celek: alergické reakce, astenie, redistribuce/akumulace tělesného tuku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Centrální a periferní nervový systém: abnormální koordinace, ataxie, encefalopatie, poruchy cerebelární koordinace a rovnováhy, křeče, hypoestézie, parestézie, neuropatie, třes, vertigo
Endokrinní: gynekomastie
Gastrointestinální: zácpa, malabsorpce
Kardiovaskulární: návaly horka, bušení srdce
Játra a žlučový systém: zvýšení jaterních enzymů, jaterní selhání, hepatitida.
Metabolické a nutriční: hypercholesterolémie, hypertriglyceridémie
Muskuloskeletální: artralgie, myalgie, myopatie
psychiatrické: agresivní reakce, agitovanost, bludy, emoční labilita, mánie, neuróza, paranoia, psychóza, sebevražda, katatonie
Respirační: dušnost
Kůže a přílohy: erythema multiforme, fotoalergická dermatitida, Stevens-Johnsonův syndrom
Speciální smysly: abnormální vidění, tinnitus
DROGOVÉ INTERAKCE
Potenciál SUSTIVA ovlivnit jiné drogy
Bylo prokázáno, že efavirenz in vivo indukuje CYP3A a CYP2B6. Jiné sloučeniny, které jsou substráty CYP3A nebo CYP2B6, mohou mít snížené plazmatické koncentrace při současném podávání se SUSTIVAem.
Potenciál jiných drog ovlivnit SUSTIVA
U léků, které indukují aktivitu CYP3A (např. fenobarbital, rifampin, rifabutin), se očekává, že zvýší clearance efavirenzu, což povede ke snížení plazmatických koncentrací (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Léky prodlužující QT interval
K dispozici jsou omezené informace o možné farmakodynamické interakci mezi SUSTIVA 600 mg a léky, které prodlužují QTc interval. Při použití efavirenzu bylo pozorováno prodloužení QTc intervalu (viz KLINICKÁ FARMAKOLOGIE ]. Zvažte alternativy k SUSTIVA 600 mg při současném podávání s lékem se známým rizikem Torsade de Pointes.
Zavedené a další potenciálně významné lékové interakce
Lékové interakce s SUSTIVA jsou shrnuty v tabulce 5. Farmakokinetické údaje viz [viz KLINICKÁ FARMAKOLOGIE ] Tabulky 7 a 8. Tato tabulka zahrnuje potenciálně významné interakce, ale není vyčerpávající.
Léky bez klinicky významných interakcí se SUSTIVA
Nedoporučuje se žádná úprava dávkování, pokud se SUSTIVA 600 mg podává s následujícími látkami: antacidy hydroxid hlinitý/hydroxid hořečnatý, azithromycin, cetirizin, famotidin, flukonazol, lorazepam, nelfinavir, nukleosidové inhibitory reverzní transkriptázy (abakavir, emtricitabin, stavuudin fumaratefoksidin, lamivudin, lamivudin, lamivudin ), paroxetin a raltegravir.
Interakce kanabinoidního testu
Efavirenz se neváže na kanabinoidní receptory. Falešně pozitivní výsledky testů na kanabinoidy v moči byly hlášeny u některých screeningových testů u neinfikovaných a HIV-infikovaných subjektů užívajících efavirenz. Doporučuje se potvrzení pozitivních screeningových testů na kanabinoidy specifičtější metodou.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Lékové interakce
Plazmatické koncentrace efavirenzu mohou být změněny substráty, inhibitory nebo induktory CYP3A. Podobně může efavirenz měnit plazmatické koncentrace léků metabolizovaných CYP3A nebo CYP2B6. Nejvýraznějším účinkem efavirenzu v ustáleném stavu je indukce CYP3A a CYP2B6 (viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
Prodloužení QTc
Při použití efavirenzu bylo pozorováno prodloužení QTc intervalu (viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ]. Zvažte alternativy k SUSTIVA 600 mg při současném podávání s lékem se známým rizikem Torsade de Pointes nebo při podávání pacientům s vyšším rizikem Torsade de Pointes.
Odpor
SUSTIVA 200 mg se nesmí používat jako samostatná látka k léčbě infekce HIV-1 ani se nesmí přidávat jako jediná látka k selhávajícímu režimu. Při podávání efavirenzu v monoterapii rychle vzniká rezistentní virus. Při výběru nových antiretrovirových látek, které se mají použít v kombinaci s efavirenzem, je třeba vzít v úvahu možnost zkřížené virové rezistence.
Spoluadministrace se souvisejícími produkty
Současné podávání SUSTIVA s přípravkem ATRIPLA (efavirenz 600 mg/emtricitabin 200 mg/tenofovir-disoproxyl-fumarát 300 mg) se nedoporučuje, pokud to není nutné pro úpravu dávky (např. s rifampinem), protože efavirenz je jednou z jeho léčivých látek.
Psychiatrické symptomy
pacientů léčených přípravkem SUSTIVA byly hlášeny závažné psychiatrické nežádoucí účinky. V kontrolovaných studiích s 1008 pacienty léčenými režimy obsahujícími SUSTIVA 600 mg po průměrnou dobu 2,1 roku a 635 pacienty léčenými kontrolními režimy po dobu průměrně 1,5 roku byla zjištěna frekvence (bez ohledu na kauzalitu) specifických závažných psychiatrických příhod u pacientů, kteří dostávali SUSTIVA nebo kontrolní režimy byly těžké deprese (2,4 %, 0,9 %), sebevražedné myšlenky (0,7 %, 0,3 %), nefatální pokusy o sebevraždu (0,5 %, 0), agresivní chování (0,4 %, 0,5 %), paranoidní reakce (0,4 %, 0,3 %) a manické reakce (0,2 %, 0,3 %). Když byly psychiatrické symptomy podobné těm, které jsou uvedeny výše, zkombinovány a vyhodnoceny jako skupina v multifaktorové analýze údajů ze studie 006, byla léčba efavirenzem spojena se zvýšeným výskytem těchto vybraných psychiatrických symptomů. Další faktory spojené se zvýšeným výskytem těchto psychiatrických symptomů byly injekční užívání drog v anamnéze, psychiatrická anamnéza a užívání psychiatrické medikace při vstupu do studie; podobné asociace byly pozorovány jak ve skupině SUSTIVA, tak v kontrolní skupině. Ve studii 006 se v průběhu studie objevily nové závažné psychiatrické symptomy jak u pacientů léčených přípravkem SUSTIVA, tak u pacientů léčených kontrolním přípravkem. Jedno procento pacientů léčených přípravkem SUSTIVA ukončilo nebo přerušilo léčbu kvůli jednomu nebo více z těchto vybraných psychiatrických symptomů. Po uvedení přípravku na trh byly také příležitostně hlášeny sebevraždy, bludy a chování podobné psychóze, ačkoli z těchto hlášení nelze určit příčinnou souvislost s užíváním SUSTIVA. Postmarketingové případy katatonie byly také hlášeny a mohou být spojeny se zvýšenou expozicí efavirenzu. Pacienti se závažnými psychiatrickými nežádoucími účinky by měli okamžitě vyhledat lékařské vyšetření, aby se posoudila možnost, že symptomy mohou souviset s užíváním SUSTIVA, a pokud ano, aby se určilo, zda rizika pokračování léčby převažují nad přínosy. [vidět NEŽÁDOUCÍ REAKCE .]
Příznaky nervového systému
Padesát tři procent (531/1008) pacientů užívajících SUSTIVA 600 mg v kontrolovaných studiích uvádělo příznaky centrálního nervového systému (jakéhokoli stupně, bez ohledu na kauzalitu) ve srovnání s 25 % (156/635) pacientů užívajících kontrolní režimy [viz NEŽÁDOUCÍ REAKCE ]. Tyto příznaky zahrnovaly, ale nebyly omezeny na, závratě (28,1 % z 1008 pacientů), nespavost (16,3 %), poruchy koncentrace (8,3 %), ospalost (7,0 %), abnormální sny (6,2 %) a halucinace (1,2). %). Tyto příznaky byly závažné u 2,0 % pacientů; a 2,1 % pacientů v důsledku toho přerušilo léčbu. Tyto příznaky obvykle začínají během prvního nebo druhého dne léčby a obvykle vymizí po prvních 2-4 týdnech léčby. Po 4 týdnech terapie se prevalence příznaků nervového systému alespoň střední závažnosti pohybovala od 5 % do 9 % u pacientů léčených režimem obsahujícím SUSTIVA a od 3 % do 5 % u pacientů léčených kontrolním režimem. Pacienti by měli být informováni, že tyto běžné příznaky se pravděpodobně zlepší s pokračující léčbou a nepředpovídají následnému nástupu méně častých psychiatrických příznaků (viz Psychiatrické symptomy ]. Dávkování před spaním může zlepšit snášenlivost těchto příznaků nervového systému [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Analýza dlouhodobých údajů ze studie 006 (medián sledování 180 týdnů, 102 týdnů a 76 týdnů u pacientů léčených přípravkem SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir a indinavir + zidovudin + lamivudin, v tomto pořadí) ukázala, že Po 24 týdnech léčby byla incidence nově vzniklých příznaků nervového systému u pacientů léčených přípravkem SUSTIVA obecně podobná jako v kontrolní větvi obsahující indinavir.
Pozdní neurotoxicita, včetně ataxie a encefalopatie (porucha vědomí, zmatenost, psychomotorické zpomalení, psychóza, delirium), se může objevit měsíce až roky po zahájení léčby efavirenzem. U pacientů s genetickým polymorfismem CYP2B6 se vyskytly některé příhody neurotoxicity s pozdním nástupem, které jsou spojeny se zvýšenými hladinami efavirenzu navzdory standardnímu dávkování SUSTIVA. Pacienti, u kterých se objeví známky a příznaky závažných neurologických nežádoucích účinků, by měli být neprodleně vyšetřeni, aby se posoudila možnost, že tyto příhody mohou souviset s užíváním efavirenzu, a zda je přerušení podávání SUSTIVA 600 mg oprávněné.
Pacienti užívající SUSTIVA 600 mg by měli být upozorněni na možnost aditivních účinků na centrální nervový systém, pokud je SUSTIVA 200 mg užíván současně s alkoholem nebo psychoaktivními léky.
Pacienti, kteří pociťují příznaky centrálního nervového systému, jako jsou závratě, poruchy koncentrace a/nebo ospalost, by se měli vyvarovat potenciálně nebezpečných činností, jako je řízení nebo obsluha strojů.
Embryo-fetální toxicita
Efavirenz může způsobit poškození plodu, pokud je podáván těhotné ženě během prvního trimestru. Informujte ženy s reprodukčním potenciálem, které užívají SUSTIVA 600 mg, aby se vyhnuly otěhotnění. [vidět Použití u konkrétních populací .]
Vyrážka
V kontrolovaných klinických studiích se u 26 % (266/1008) dospělých pacientů léčených 600 mg SUSTIVAu objevila nově vzniklá kožní vyrážka ve srovnání se 17 % (111/635) pacientů léčených v kontrolních skupinách (viz NEŽÁDOUCÍ REAKCE ]. Vyrážka spojená s tvorbou puchýřů, vlhkou deskvamací nebo ulcerací se objevila u 0,9 % (9/1008) pacientů léčených přípravkem SUSTIVA. Incidence vyrážky 4. stupně (např. erythema multiforme, Stevens-Johnsonův syndrom) u dospělých pacientů léčených přípravkem SUSTIVA ve všech studiích a rozšířeném přístupu byla 0,1 %. Vyrážky jsou obvykle mírné až středně závažné makulopapulózní kožní erupce, které se objevují během prvních 2 týdnů od zahájení léčby efavirenzem (medián doby do nástupu vyrážky u dospělých byl 11 dní) a u většiny pacientů, kteří pokračují v léčbě efavirenzem, vyrážka vymizí do 1 měsíc (medián trvání, 16 dní). Míra přerušení léčby pro vyrážku v klinických studiích u dospělých byla 1,7 % (17/1008).
Vyrážka byla hlášena u 59 ze 182 dětských pacientů (32 %) léčených přípravkem SUSTIVA (viz NEŽÁDOUCÍ REAKCE ]. U dvou pediatrických pacientů se objevila vyrážka 3. stupně (splývající vyrážka s horečkou, generalizovaná vyrážka) a čtyři pacienti měli vyrážku 4. stupně (erythema multiforme). Medián doby do nástupu vyrážky u pediatrických pacientů byl 28 dnů (rozmezí 3-1642 dnů). Před zahájením léčby přípravkem SUSTIVA u pediatrických pacientů je třeba zvážit profylaxi vhodnými antihistaminiky.
SUSTIVA 600 mg lze obecně znovu zahájit u pacientů, kteří přerušují léčbu z důvodu vyrážky. SUSTIVA 200 mg by měl být vysazen u pacientů, u kterých se rozvine závažná vyrážka spojená s puchýři, deskvamací, postižením sliznic nebo horečkou. Vhodná antihistaminika a/nebo kortikosteroidy mohou zlepšit snášenlivost a urychlit vymizení vyrážky. U pacientů, kteří měli život ohrožující kožní reakci (např. Stevens-Johnsonův syndrom), je třeba zvážit alternativní léčbu (viz KONTRAINDIKACE ].
Hepatotoxicita
pacientů léčených přípravkem SUSTIVA byly hlášeny postmarketingové případy hepatitidy, včetně fulminantní hepatitidy progredující do selhání jater vyžadující transplantaci nebo vedoucí k úmrtí. Hlášení zahrnovala pacienty se základním onemocněním jater, včetně koinfekce hepatitidou B nebo C, a pacienty bez preexistujícího onemocnění jater nebo jiných identifikovatelných rizikových faktorů.
SUSTIVA 600 mg se nedoporučuje u pacientů se středně těžkou nebo těžkou poruchou funkce jater. U pacientů s mírnou poruchou funkce jater, kteří dostávají SUSTIVA, se doporučuje pečlivé sledování. [vidět NEŽÁDOUCÍ REAKCE a Použití u konkrétních populací ].
U všech pacientů se doporučuje sledování jaterních enzymů před a během léčby [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Zvažte vysazení SUSTIVA 600 mg u pacientů s přetrvávajícím zvýšením sérových transamináz na více než pětinásobek horní hranice normálního rozmezí.Pokud je zvýšení sérových transamináz doprovázeno klinickými známkami nebo příznaky hepatitidy nebo jaterní dekompenzace, přerušte podávání SUSTIVA 200 mg.
Křeče
U dospělých a dětských pacientů užívajících efavirenz byly pozorovány křeče, obvykle v přítomnosti známé anamnézy záchvatů (viz Neklinická toxikologie ]. Opatrnosti je třeba u každého pacienta s anamnézou záchvatů. Pacienti, kteří dostávají souběžně antikonvulziva primárně metabolizovaná játry, jako je fenytoin a fenobarbital, mohou vyžadovat pravidelné monitorování plazmatických hladin (viz DROGOVÉ INTERAKCE ].
Zvýšení lipidů
Léčba přípravkem STOCRIN vedla ke zvýšení koncentrace celkového cholesterolu a triglyceridů [viz NEŽÁDOUCÍ REAKCE ]. Před zahájením léčby přípravkem SUSTIVA 200 mg a v pravidelných intervalech během léčby je třeba provést vyšetření cholesterolu a triglyceridů.
Syndrom imunitní rekonstituce
pacientů léčených kombinovanou antiretrovirovou terapií, včetně přípravku SUSTIVA, byl hlášen syndrom imunitní rekonstituce. Během počáteční fáze kombinované antiretrovirové léčby se u pacientů, jejichž imunitní systém reaguje, může vyvinout zánětlivá odpověď na indolentní nebo reziduální oportunní infekce (jako je infekce Mycobacterium avium, cytomegalovirus, pneumonie způsobená Pneumocystis jiroveci [PCP] nebo tuberkulóza), což může vyžadovat další vyšetření a léčbu.
Autoimunitní poruchy (jako je Gravesova choroba, polymyositida, Guillain-Barrého syndrom a autoimunitní hepatitida) byly také hlášeny v rámci imunitní rekonstituce; doba do nástupu je však variabilnější a může se objevit mnoho měsíců po zahájení léčby.
Redistribuce tuku
pacientů užívajících antiretrovirovou terapii byla pozorována redistribuce/akumulace tělesného tuku včetně centrální obezity, zvětšení dorzocervikálního tuku (buvolí hrb), periferní chřadnutí, ochabování obličeje, zvětšení prsou a „cushingoidní vzhled“. Mechanismus a dlouhodobé důsledky těchto příhod nejsou v současnosti známy. Příčinná souvislost nebyla prokázána.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA a Návod k použití ).
Lékové interakce
Prohlášení pro pacienty a poskytovatele zdravotní péče je uvedeno na etiketách lahvičky s přípravkem: VÝSTRAHA: Zjistěte si informace o lécích, které se NESMÍ užívat spolu se SUSTIVA.
SUSTIVA může interagovat s některými léky; proto pacientům doporučte, aby svému lékaři hlásili použití jakýchkoli jiných léků na předpis nebo bez předpisu.
Všeobecné informace pro pacienty
Informujte pacienty, že SUSTIVA 200 mg nevyléčí infekci HIV-1 a pacienti mohou nadále trpět onemocněními spojenými s infekcí HIV-1, včetně oportunních infekcí. Pacienti by během užívání SUSTIVA měli zůstat v péči lékaře.
Poraďte pacientům, aby se vyvarovali činností, které mohou šířit infekci HIV-1 na ostatní.
- Nesdílejte ani znovu nepoužívejte jehly nebo jiné injekční vybavení.
- Nesdílejte osobní věci, na kterých může být krev nebo tělesné tekutiny, jako jsou zubní kartáčky a žiletky.
- Nemějte žádný druh sexu bez ochrany. Vždy praktikujte bezpečnější sex s použitím latexového nebo polyuretanového kondomu, abyste snížili pravděpodobnost sexuálního kontaktu se spermatem, vaginálním sekretem nebo krví.
- Nekojit. Matky s HIV-1 by neměly kojit, protože HIV-1 se může přenášet na dítě mateřským mlékem.
Pokyny pro dávkování
Poraďte pacientům, aby užívali SUSTIVA každý den podle předpisu. Pokud pacient zapomene užít SUSTIVA, řekněte mu, aby si vynechanou dávku ihned vzal, pokud již není téměř čas na další dávku. Poučte pacienta, aby neužíval 2 dávky najednou a aby si další dávku vzal v pravidelně naplánovanou dobu. Poraďte pacientovi, aby se zeptal poskytovatele zdravotní péče, pokud potřebuje pomoc s plánováním nejvhodnějších časů pro užívání léku.
SUSTIVA 200 mg musí být vždy používán v kombinaci s jinými antiretrovirovými léky. Doporučte pacientům užívat SUSTIVA 600 mg nalačno, nejlépe před spaním. Užívání SUSTIVA s jídlem zvyšuje koncentrace efavirenzu a může zvýšit frekvenci nežádoucích účinků. Dávkování před spaním může zlepšit snášenlivost příznaků nervového systému [viz DÁVKOVÁNÍ A PODÁVÁNÍ a NEŽÁDOUCÍ REAKCE ]. Poskytovatelé zdravotní péče by měli pomáhat rodičům nebo pečovatelům při stanovení nejlepšího dávkovacího schématu SUSTIVA pro kojence a malé děti.
dospělých a dětských pacientů, kteří nemohou polykat tobolky nebo tablety, by pacienti nebo jejich ošetřovatelé měli být poučeni, aby si přečetli a pečlivě dodržovali pokyny pro podávání obsahu tobolek v malém množství jídla nebo kojenecké výživy [viz DÁVKOVÁNÍ A PODÁVÁNÍ a označení pacientů schválené FDA ( INFORMACE PRO PACIENTA a NÁVOD K POUŽITÍ )]. Pacienti by se měli v případě jakýchkoliv dotazů obrátit na svého poskytovatele zdravotní péče nebo lékárníka.
Příznaky nervového systému
Informujte pacienty, že symptomy centrálního nervového systému (NSS) včetně závratí, nespavosti, poruchy koncentrace, ospalosti a abnormálních snů jsou běžně hlášeny během prvních týdnů léčby přípravkem SUSTIVA (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Dávkování před spaním může zlepšit snášenlivost těchto příznaků, které se pravděpodobně zlepší s pokračující léčbou. Upozorněte pacienty na možné aditivní účinky, pokud je SUSTIVA užíván současně s alkoholem nebo psychoaktivními drogami. Poučte pacienty, že pokud se u nich objeví NSS, měli by se vyhnout potenciálně nebezpečným činnostem, jako je řízení nebo obsluha strojů.
Informujte pacienty, že existuje riziko rozvoje neurotoxicity s pozdním nástupem, včetně ataxie a encefalopatie, které se mohou objevit měsíce až roky po zahájení léčby přípravkem SUSTIVA (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Psychiatrické symptomy
Informujte pacienty, že u pacientů užívajících SUSTIVA byly hlášeny závažné psychiatrické příznaky včetně těžké deprese, pokusů o sebevraždu, agresivního chování, bludů, paranoie, symptomů podobných psychóze a katatonie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pokud se u nich objeví závažné psychiatrické nežádoucí účinky, měli by okamžitě vyhledat lékařské vyšetření. Doporučte pacientům, aby informovali svého lékaře o jakékoli anamnéze duševní choroby nebo zneužívání návykových látek.
Vyrážka
Informujte pacienty, že častým nežádoucím účinkem je vyrážka [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Vyrážky obvykle odezní bez jakékoli změny léčby. Protože však vyrážka může být závažná, doporučte pacientům, aby v případě výskytu vyrážky neprodleně kontaktovali svého lékaře.
Hepatotoxicita
Informujte pacienty, aby sledovali včasné varovné příznaky zánětu nebo selhání jater, jako je únava, slabost, nedostatek chuti k jídlu, nevolnost a zvracení, stejně jako pozdější příznaky, jako je žloutenka, zmatenost, otoky břicha a změněná barva stolice, a aby se poradili se svým zdravotnický pracovník neprodleně, pokud se takové příznaky objeví [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Samice reprodukčního potenciálu
Informujte ženy s reprodukčním potenciálem, aby během léčby přípravkem SUSTIVA 600 mg a po dobu 12 týdnů po vysazení přípravku SUSTIVA používaly účinnou antikoncepci a bariérovou metodu. Poraďte pacientkám, aby kontaktovaly svého poskytovatele zdravotní péče, pokud plánují otěhotnět, otěhotnět nebo pokud existuje podezření na těhotenství během léčby SUSTIVA (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Registr expozice v těhotenství
Informujte pacienty, že existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených SUSTIVA během těhotenství [viz Použití u konkrétních populací ].
Redistribuce tuku
Informujte pacienty, že u pacientů užívajících antiretrovirovou léčbu může dojít k redistribuci nebo akumulaci tělesného tuku a že příčina a dlouhodobé zdravotní účinky těchto stavů nejsou známy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
SUSTIVA je registrovaná ochranná známka společnosti Bristol-Myers Squibb Pharma Company. ATRIPLA je ochranná známka společnosti Bristol-Myers Squibb & Gilead Sciences, LLC.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
efavirenzem byly provedeny dlouhodobé studie karcinogenity u myší a potkanů. Myším byly podávány dávky 0, 25, 75, 150 nebo 300 mg/kg/den po dobu 2 let. Incidence hepatocelulárních adenomů a karcinomů a plicních alveolárních/bronchiolových adenomů byla u žen zvýšena nad rámec pozadí. U mužů nebylo pozorováno žádné zvýšení incidence nádorů nad pozadí. U žen nebyla pro tuto studii stanovena žádná NOAEL, protože nádorové nálezy se objevily při všech dávkách. AUC při NOAEL (150 mg/kg) u mužů byla přibližně 0,9krát vyšší než u lidí při doporučené klinické dávce. Ve studii na potkanech nebylo pozorováno žádné zvýšení incidence nádorů při dávkách do 100 mg/kg/den, pro které byly AUC 0,1 (samci) nebo 0,2 (samice) násobkem hodnoty u lidí při doporučené klinické dávce.
Mutageneze
Efavirenz byl negativní v řadě testů genotoxicity in vitro a in vivo. Ty zahrnovaly testy bakteriálních mutací v S. typhimurium a E. coli, testy savčích mutací v ovariálních buňkách čínského křečka, testy chromozomových aberací v lidských lymfocytech periferní krve nebo ovariálních buňkách čínského křečka a in vivo test na mikronukleu myší kostní dřeně.
Zhoršení Plodnosti
Efavirenz nenarušil páření nebo fertilitu samců nebo samic potkanů a neovlivnil spermie léčených samců potkanů. Reprodukční schopnost potomků narozených samicím potkanů, kterým byl podáván efavirenz, nebyla ovlivněna. Hodnoty AUC při hodnotách NOAEL u samců (200 mg/kg) a samic (100 mg/kg) potkanů byly přibližně ≤ 0,15krát vyšší než u lidí při doporučené klinické dávce.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených SUSTIVA 600 mg během těhotenství. Lékařům se doporučuje, aby registrovali pacienty zavoláním do registru antiretrovirových těhotenství na číslo 1-800-258-4263.
Shrnutí rizik
Existují retrospektivní kazuistiky defektů neurální trubice u kojenců, jejichž matky byly vystaveny režimům obsahujícím efavirenz v prvním trimestru těhotenství. Údaje o prospektivních těhotenstvích z Antiretroviral Pregnancy Registry nejsou dostatečné k adekvátnímu posouzení tohoto rizika. Dostupné údaje z Antiretroviral Pregnancy Registry neukazují žádný rozdíl v riziku celkových závažných vrozených vad ve srovnání se základní mírou závažných vrozených vad 2,7 % v referenční populaci USA z Metropolitan Atlanta Congenital Defects Program (MACDP). Ačkoli nebyla prokázána příčinná souvislost mezi expozicí efavirenzu v prvním trimestru a defekty neurální trubice, podobné malformace byly pozorovány ve studiích provedených na opicích v dávkách podobných dávkám u lidí. Kromě toho se fetální a embryonální toxicita objevila u potkanů v dávce desetkrát nižší, než je expozice u člověka při doporučené klinické dávce. Vzhledem k potenciálnímu riziku defektů neurální trubice by se efavirenz neměl používat v prvním trimestru těhotenství. Informujte těhotné ženy o potenciálním riziku pro plod.
Data
Lidská data
Existují retrospektivní postmarketingové zprávy o nálezech odpovídajících defektům neurální trubice, včetně meningomyelokély, vše u kojenců matek vystavených režimům obsahujícím efavirenz v prvním trimestru.
Na základě prospektivních zpráv z registru Antiretroviral Pregnancy Registry (APR) o přibližně 1000 živě narozených po expozici režimům obsahujícím efavirenz (včetně více než 800 živě narozených dětí vystavených v prvním trimestru) nebyl žádný rozdíl mezi efavirenzem a celkovými vrozenými vadami ve srovnání s míra vrozených vad na pozadí 2,7 % v referenční populaci USA z programu Metropolitan Atlanta Congenital Defects Program. Podle prozatímní zprávy APR vydané v prosinci 2014 byla prevalence vrozených vad po expozici v prvním trimestru 2,3 % (95% CI: 1,4 %-3,6 %). Jedním z těchto prospektivně hlášených defektů s expozicí v prvním trimestru byl defekt neurální trubice. Prospektivně byl také hlášen jeden případ anoftalmie s expozicí efavirenzu v prvním trimestru. Tento případ také zahrnoval těžké šikmé obličejové rozštěpy a amniotické bandáže, které mají známou souvislost s anoftalmií.
Údaje o zvířatech
Účinky efavirenzu na embryo-fetální vývoj byly studovány u tří neklinických druhů (opice Cynomolgus, potkani a králíci). U opic byl efavirenz 60 mg/kg/den podáván březím samicím během březosti (20. až 150. den březosti). Mateřské systémové lékové expozice (AUC) byly 1,3krát vyšší než expozice u lidí při doporučené klinické dávce (600 mg/den), přičemž koncentrace léku z pupečníkové žíly plodu byly přibližně 0,7krát vyšší než hodnoty u matky. Tři z 20 plodů/kojenci měly jednu nebo více malformací; u matek, kterým bylo podáváno placebo, nebyly žádné malformované plody nebo kojenci. Malformace, které se vyskytly u těchto tří plodů opic, zahrnovaly anencefalii a jednostrannou anoftalmii u jednoho plodu, mikroftalmii u druhého a rozštěp patra u třetího. Pro tuto studii nebyla stanovena žádná NOAEL (hladina bez pozorovatelných nežádoucích účinků), protože byla hodnocena pouze jedna dávka. U potkanů byl efavirenz podáván buď během organogeneze (7. až 18. den březosti) nebo od 7. dne březosti do 21. dne laktace v dávkách 50, 100 nebo 200 mg/kg/den. Podání 200 mg/kg/den potkanům bylo spojeno se zvýšením incidence časných resorpcí; a dávky 100 mg/kg/den a vyšší byly spojeny s časnou neonatální mortalitou. AUC při NOAEL (50 mg/kg/den) v této studii na potkanech byla 0,1krát vyšší než u lidí při doporučené klinické dávce. Koncentrace léčiva v mléce 10. den laktace byly přibližně 8krát vyšší než koncentrace v mateřské plazmě. U březích králíků nebyl efavirenz ani embryoletální, ani teratogenní, když byl podáván v dávkách 25, 50 a 75 mg/kg/den během období organogeneze (6. až 18. březost). AUC při NOAEL (75 mg/kg/den) u králíků byla 0,4krát vyšší než u lidí při doporučené klinické dávce.
Laktace
Shrnutí rizik
Centra pro kontrolu a prevenci nemocí doporučují, aby matky infikované HIV nekojily své děti, aby se vyhnuly riziku postnatálního přenosu HIV. Vzhledem k možnosti přenosu HIV u kojených dětí doporučte ženám, aby nekojily.
Ženy a muži reprodukčního potenciálu
Kvůli potenciálním teratogenním účinkům by se ženy užívající SUSTIVA neměly otěhotnět. [vidět Těhotenství .]
Těhotenský test
Ženy s reprodukčním potenciálem by měly před zahájením léčby přípravkem SUSTIVA podstoupit těhotenský test.
Antikoncepce
Ženy s reprodukčním potenciálem by měly během léčby přípravkem SUSTIVA 200 mg a po dobu 12 týdnů po vysazení přípravku SUSTIVA 200 mg používat účinnou antikoncepci kvůli dlouhému poločasu efavirenzu. Bariérová antikoncepce by měla být vždy používána v kombinaci s jinými metodami antikoncepce. Hormonální metody, které obsahují progesteron, mohou mít sníženou účinnost [viz DROGOVÉ INTERAKCE ].
Pediatrické použití
Bezpečnost, farmakokinetický profil a virologické a imunologické odpovědi SUSTIVA 600 mg byly hodnoceny u pediatrických pacientů infikovaných HIV-1 ve věku od 3 měsíců do 21 let dosud neléčených antiretrovirotiky (viz. NEŽÁDOUCÍ REAKCE , KLINICKÁ FARMAKOLOGIE , a Klinické studie ]. Typ a frekvence nežádoucích účinků v těchto studiích byly obecně podobné jako u dospělých pacientů s výjimkou vyšší frekvence vyrážky, včetně vyšší frekvence vyrážky stupně 3 nebo 4, u pediatrických pacientů ve srovnání s dospělými (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Použití SUSTIVA u pacientů mladších než 3 měsíce NEBO s tělesnou hmotností nižší než 3,5 kg se nedoporučuje, protože bezpečnost, farmakokinetika a antivirová aktivita SUSTIVA 600 mg nebyla v této věkové skupině hodnocena a existuje riziko rozvoje rezistence na HIV pokud je SUSTIVA poddávkován. vidět DÁVKOVÁNÍ A PODÁVÁNÍ pro doporučení dávkování pro dětské pacienty.
Geriatrické použití
Klinické studie přípravku SUSTIVA 200 mg nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Obecně by měl být výběr dávky pro staršího pacienta opatrný, odrážející vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné terapie.
Poškození jater
SUSTIVA se nedoporučuje u pacientů se středně těžkou nebo těžkou poruchou funkce jater, protože nejsou k dispozici dostatečné údaje ke stanovení, zda je nutná úprava dávky. Pacienti s mírnou poruchou funkce jater mohou být léčeni efavirenzem bez jakékoli úpravy dávky. Vzhledem k rozsáhlému metabolismu efavirenzu zprostředkovanému cytochromem P450 a omezeným klinickým zkušenostem u pacientů s poruchou funkce jater je třeba při podávání SUSTIVA těmto pacientům postupovat opatrně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Někteří pacienti náhodně užívající 600 mg dvakrát denně hlásili zvýšené příznaky nervového systému. U jednoho pacienta se objevily mimovolní svalové kontrakce.
Léčba předávkování přípravkem SUSTIVA 200 mg by měla sestávat z obecných podpůrných opatření, včetně sledování vitálních funkcí a sledování klinického stavu pacienta. K odstranění nevstřebaného léčiva lze použít podání aktivního uhlí. Neexistuje žádné specifické antidotum pro předávkování přípravkem SUSTIVA. Protože se efavirenz silně váže na proteiny, je nepravděpodobné, že by dialýza významně odstranila lék z krve.
KONTRAINDIKACE
- SUSTIVA je kontraindikován u pacientů s dříve prokázanou klinicky významnou přecitlivělostí (např. Stevens-Johnsonův syndrom, erythema multiforme nebo toxické kožní erupce) na kteroukoli složku tohoto přípravku.
- Současné podávání efavirenzu s elbasvirem a grazoprevirem je kontraindikováno (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Efavirenz je antivirotikum [viz Mikrobiologie ].
Farmakodynamika
Elektrofyziologie srdce
Účinek SUSTIVA 600 mg na QTc interval byl hodnocen v otevřené, pozitivní a placebem kontrolované, fixní jednosekvenční 3-dobé, 3 léčebné zkřížené QT studii u 58 zdravých subjektů obohacených o polymorfismy CYP2B6. Průměrná Cmax efavirenzu u subjektů s genotypem CYP2B6 *6/*6 po podávání 600 mg denní dávky po dobu 14 dnů byla 2,25krát vyšší než průměrná Cmax pozorovaná u subjektů s genotypem CYP2B6 *1/*1. Byl pozorován pozitivní vztah mezi koncentrací efavirenzu a prodloužením QTc. Na základě vztahu koncentrace-QTc je průměrné prodloužení QTc a jeho horní hranice 90% intervalu spolehlivosti 8,7 ms a 11,3 ms u subjektů s genotypem CYP2B6*6/*6 po podávání 600 mg denní dávky po dobu 14 dnů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Farmakokinetika
Vstřebávání
Maximálních plazmatických koncentrací efavirenzu 1,6-9,1 μM bylo dosaženo za 5 hodin po jednorázové perorální dávce 100 mg až 1600 mg podané neinfikovaným dobrovolníkům. Zvýšení Cmax a AUC závislé na dávce bylo pozorováno u dávek až do 1600 mg; zvýšení bylo menší než proporcionální, což naznačuje sníženou absorpci při vyšších dávkách.
U pacientů infikovaných HIV-1 v ustáleném stavu byly průměrná Cmax, průměrná Cmin a průměrná AUC úměrná dávce po dávkách 200 mg, 400 mg a 600 mg denně. Čas do dosažení maximálních plazmatických koncentrací byl přibližně 3-5 hodin a ustálených plazmatických koncentrací bylo dosaženo za 6-10 dnů. U 35 pacientů užívajících SUSTIVA 600 mg jednou denně byla Cmax v ustáleném stavu 12,9 ± 3,7 μM (průměr ± SD), Cmin v ustáleném stavu byla 5,6 ± 3,2 μM a AUC byla 184 ± 73 μM•h.
Vliv jídla na orální absorpci:
Kapsle
Podání jedné 600mg dávky tobolek efavirenzu s vysoce tučným/vysokokalorickým jídlem (894 kcal, 54 g tuku, 54 % kalorií z tuku) nebo s jídlem se sníženým obsahem tuku/normálně kalorickým jídlem (440 kcal, 2 g tuk, 4 % kalorií z tuku) bylo spojeno s průměrným zvýšením AUC∞ efavirenzu o 22 % a 17 % a průměrným zvýšením Cmax efavirenzu o 39 % a 51 % ve vztahu k expozicím dosaženým při podávání nalačno . [vidět DÁVKOVÁNÍ A PODÁVÁNÍ a INFORMACE PRO PACIENTA .]
Tablety

Podání jedné 600mg tablety efavirenzu s vysoce tučným/vysokokalorickým jídlem (přibližně 1000 kcal, 500-600 kcal z tuku) bylo spojeno s 28% zvýšením průměrné AUC∞ efavirenzu a 79% zvýšením průměrné Cmax efavirenzu ve vztahu k expozicím dosaženým nalačno. [vidět DÁVKOVÁNÍ A PODÁVÁNÍ a INFORMACE PRO PACIENTA .]
Biologická dostupnost obsahu kapsle smíchaného s potravinovými vehikuly
zdravých dospělých subjektů AUC efavirenzu při podání jako obsah tří 200mg tobolek smíchaných se 2 čajovými lžičkami určitých potravinových vehikul (jablečné pyré, hroznové želé nebo jogurt nebo kojenecká výživa) splnila kritéria bioekvivalence pro AUC podané neporušené formulace tobolek. za podmínek půstu.
Rozdělení
Efavirenz se silně váže (přibližně 99,5-99,75 %) na lidské plazmatické proteiny, především albumin. U pacientů infikovaných HIV-1 (n=9), kteří dostávali SUSTIVA 200 až 600 mg jednou denně po dobu alespoň jednoho měsíce, se koncentrace v mozkomíšním moku pohybovaly od 0,26 do 1,19 % (průměr 0,69 %) odpovídající plazmatické koncentrace. Tento podíl je přibližně 3krát vyšší než u frakce efavirenzu v plazmě nevázané na bílkoviny (volné).
Metabolismus
Studie na lidech a studie in vitro s použitím lidských jaterních mikrozomů prokázaly, že efavirenz je metabolizován hlavně systémem cytochromu P450 na hydroxylované metabolity s následnou glukuronidací těchto hydroxylovaných metabolitů. Tyto metabolity jsou v podstatě neaktivní proti HIV-1. Studie in vitro naznačují, že CYP3A a CYP2B6 jsou hlavními izoenzymy odpovědnými za metabolismus efavirenzu.
Bylo prokázáno, že efavirenz indukuje enzymy CYP, což vede k indukci jeho vlastního metabolismu. Vícenásobné dávky 200–400 mg denně po dobu 10 dnů vedlo k nižšímu než předpokládanému rozsahu akumulace (o 22–42 % nižší) a kratšímu terminálnímu poločasu 40–55 hodin (poločas jedné dávky 52–76 hodin ).
Odstranění
Efavirenz má terminální poločas 52-76 hodin po jednotlivých dávkách a 40-55 hodin po opakovaných dávkách. Byla provedena jednoměsíční studie hmotnostní bilance/vylučování s použitím 400 mg denně s dávkou značenou C podanou 8. den. Přibližně 14–34 % radioaktivního značení bylo nalezeno v moči a 16–61 % ve stolici . Téměř veškeré vylučování radioaktivně značeného léčiva močí bylo ve formě metabolitů. Efavirenz představoval většinu celkové radioaktivity naměřené ve stolici.
Zvláštní populace
Pediatrická
Farmakokinetické parametry efavirenzu v ustáleném stavu u pediatrických pacientů byly předpovězeny populačním farmakokinetickým modelem a jsou shrnuty v tabulce 6 podle hmotnostních rozmezí, která odpovídají doporučeným dávkám.
Pohlaví a rasa
Farmakokinetika efavirenzu u pacientů se zdá být podobná u mužů a žen au studovaných rasových skupin.
Renální poškození
Farmakokinetika efavirenzu nebyla studována u pacientů s renální insuficiencí; méně než 1 % efavirenzu se však vylučuje v nezměněné podobě močí, takže vliv poruchy funkce ledvin na eliminaci efavirenzu by měl být minimální.
Poškození jater
Studie s opakovanými dávkami neprokázala žádný významný vliv na farmakokinetiku efavirenzu u pacientů s mírnou poruchou funkce jater (Child-Pugh třída A) ve srovnání s kontrolami. Nebyly k dispozici dostatečné údaje ke stanovení, zda středně těžké nebo těžké poškození jater (Child-Pugh třída B nebo C) ovlivňuje farmakokinetiku efavirenzu.
Studie lékových interakcí
Bylo prokázáno, že efavirenz in vivo způsobuje indukci jaterních enzymů, čímž zvyšuje biotransformaci některých léků metabolizovaných CYP3A a CYP2B6. Studie in vitro ukázaly, že efavirenz inhiboval izoenzymy CYP 2C9 a 2C19 s hodnotami Ki (8,5-17 μM) v rozmezí pozorovaných plazmatických koncentrací efavirenzu. Ve studiích in vitro efavirenz neinhiboval CYP2E1 a inhiboval CYP2D6 a CYP1A2 (hodnoty Ki 82-160 μM) pouze v koncentracích výrazně vyšších, než jsou koncentrace dosažené klinicky. Současné podávání efavirenzu s léky primárně metabolizovanými izoenzymy CYP2C9, CYP2C19, CYP3A nebo CYP2B6 může vést ke změně plazmatických koncentrací současně podávaného léku. Očekává se, že léky, které indukují aktivitu CYP3A a CYP2B6, zvýší clearance efavirenzu, což povede ke snížení plazmatických koncentrací.
Studie lékových interakcí byly provedeny s efavirenzem a jinými léky, které budou pravděpodobně podávány současně, nebo s léky běžně používanými jako sondy pro farmakokinetické interakce. Účinky společného podávání efavirenzu na Cmax, AUC a Cmin jsou shrnuty v tabulce 7 (účinek efavirenzu na jiná léčiva) a tabulce 8 (účinek jiných léčiv na efavirenz). Informace o klinických doporučeních viz DROGOVÉ INTERAKCE .
Mikrobiologie
Mechanismus působení
Efavirenz je NNRTI HIV-1. Aktivita efavirenzu je zprostředkována převážně nekompetitivní inhibicí reverzní transkriptázy HIV-1. HIV-2 reverzní transkriptáza a lidské buněčné DNA polymerázy α, β, γ a δ nejsou efavirenzem inhibovány.
Antivirová aktivita v buněčné kultuře
Koncentrace efavirenzu inhibující replikaci laboratorních adaptovaných kmenů divokého typu a klinických izolátů v buněčné kultuře o 90–95 % (EC90-95) se pohybovala od 1,7 do 25 nM v lymfoblastoidních buněčných liniích, mononukleárních buňkách periferní krve (PBMC) a makrofágech /monocytární kultury. Efavirenz prokázal antivirovou aktivitu proti kladu B a většině izolátů nekladu B (podtypy A, AE, AG, C, D, F, G, J, N), ale měl sníženou antivirovou aktivitu proti virům skupiny O. Efavirenz prokázal aditivní antivirovou aktivitu bez cytotoxicity proti HIV-1 v buněčné kultuře, když byl kombinován s NNRTI delavirdinem a nevirapinem, NRTI (abakavir, didanosin, emtricitabin, lamivudin, stavudin, tenofovir, zalcitabin, zidovudin), PI (amprenavir, inlopinavir, nelfinavir, ritonavir, saquinavir) a inhibitor fúze enfuvirtid. Efavirenz prokázal aditivní účinek k antagonistické antivirové aktivitě v buněčné kultuře s atazanavirem. Efavirenz nebyl antagonistický s adefovirem používaným k léčbě infekce virem hepatitidy B nebo ribavirinem používaným v kombinaci s interferonem k léčbě infekce virem hepatitidy C.
Odpor
buněčné kultuře
V buněčné kultuře se v přítomnosti léku rychle objevily izoláty HIV-1 se sníženou citlivostí na efavirenz (>380násobné zvýšení hodnoty EC90). Genotypová charakterizace těchto virů identifikovala jednoaminokyselinové substituce L100I nebo V179D, dvojité substituce L100I/V108I a trojité substituce L100I/V179D/Y181C v reverzní transkriptáze.
Klinické studie
Byly získány klinické izoláty se sníženou citlivostí v buněčné kultuře na efavirenz. Jedna nebo více substitucí na aminokyselinových pozicích 98, 100, 101, 103, 106, 108, 188, 190, 225 a 227 v reverzní transkriptáze byla pozorována u pacientů, u kterých selhala léčba efavirenzem v kombinaci s indinavirem nebo se zidovudinem plus lamivudinem. Nejčastěji byla pozorována substituce K103N. Dlouhodobé sledování rezistence (průměrně 52 týdnů, rozmezí 4–106 týdnů) analyzovalo 28 izolátů odpovídajících výchozí hodnotě a virologickému selhání. Šedesát jedna procent (17/28) těchto izolátů se selháním mělo sníženou citlivost na efavirenz v buněčné kultuře s mediánem 88násobné změny citlivosti na efavirenz (hodnota EC50) oproti referenční hodnotě. Nejčastější substitucí NNRTI, která se u těchto izolátů pacientů vyvinula, byla K103N (54 %). Další substituce NNRTI, které se vyvinuly, zahrnovaly L100I (7 %), K101E/Q/R (14 %), V108I (11 %), G190S/T/A (7 %), P225H (18 %) a M230I/L (11 %).
Křížový odpor
Mezi NNRTI byla pozorována zkřížená rezistence. Klinické izoláty dříve charakterizované jako rezistentní na efavirenz byly také fenotypově rezistentní v buněčné kultuře na delavirdin a nevirapin ve srovnání s výchozí hodnotou. Klinické virové izoláty rezistentní na delavirdin a/nebo nevirapin se substitucemi spojenými s rezistencí NNRTI (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, M230X, prokázaly sníženou recepci sefaviru na 230L, v buněčné kultuře. Více než 90 % klinických izolátů rezistentních na NRTI testovaných v buněčné kultuře si zachovalo citlivost na efavirenz.
Toxikologie zvířat
Neustálé křeče byly pozorovány u 6 z 20 opic, které dostávaly efavirenz v dávkách poskytujících hodnoty AUC v plazmě 4- až 13krát vyšší než u lidí po doporučené dávce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Klinické studie
Dospělí
Studie 006 randomizovaná, otevřená studie, porovnávala SUSTIVA (600 mg jednou denně) + zidovudin (ZDV, 300 mg každých 12 hodin) + lamivudin (LAM, 150 mg každých 12 hodin) nebo SUSTIVA (600 mg jednou denně) + indinavir (IDV, 1 000 mg každých 8 hodin) s indinavirem (800 mg každých 8 hodin) + zidovudinem (300 mg každých 12 hodin) + lamivudinem (150 mg každých 12 hodin). Bylo zařazeno dvanáct set šedesát šest pacientů (průměrný věk 36,5 let [rozmezí 18-81], 60 % bělochů, 83 % mužů). Všichni pacienti byli při vstupu do studie bez předchozí léčby efavirenzem, lamivudinem, NNRTI a PI. Střední výchozí počet CD4+ buněk byl 320 buněk/mm3 a střední výchozí hladina HIV-1 RNA byl 4,8 log kopií/ml. Výsledky léčby standardním testem (limit testu 400 kopií/ml) po 48 a 168 týdnech jsou uvedeny v tabulce 9. Plazmatické hladiny HIV RNA byly kvantifikovány standardní (test 400 kopií/ml) a ultrasenzitivní (test 50 kopií/ml). verze testu AMPLICOR HIV-1 MONITOR. Během studie byla v Evropě zavedena verze 1.5 testu, aby se zlepšila detekce viru bez kladu B.
pacientů léčených SUSTIVA + zidovudinem + lamivudinem, SUSTIVA + indinavirem nebo indinavirem + zidovudinem + lamivudinem bylo procento respondentů s HIV-1 RNA
ACTG 364 je randomizovaná, dvojitě zaslepená, placebem kontrolovaná, 48týdenní studie u pacientů již dříve léčených NRTI, kteří dokončili dvě předchozí studie ACTG. Sto devadesát šest pacientů (průměrný věk 41 let [rozmezí 18-76], 74 % bělochů, 88 % mužů) dostávalo NRTI v kombinaci s přípravkem SUSTIVA (600 mg jednou denně) nebo nelfinavirem (NFV, 750 mg třikrát denně nebo SUSTIVA (600 mg jednou denně) + nelfinavir randomizovaným, dvojitě zaslepeným způsobem. Průměrný výchozí počet CD4+ buněk byl 389 buněk/mm3 a průměrná výchozí hladina HIV-1 RNA byla 8130 kopií/ml. Po vstupu do studie byl všem pacientům přidělen nový otevřený režim NRTI, který závisel na jejich předchozí zkušenosti s léčbou NRTI. Mezi léčebnými skupinami nebyl žádný významný rozdíl v průměrném počtu CD4+ buněk; celkové průměrné zvýšení bylo přibližně 100 buněk po 48 týdnech u pacientů, kteří pokračovali ve studijních režimech. Výsledky léčby jsou uvedeny v tabulce 10. Plazmatické hladiny HIV RNA byly kvantifikovány pomocí testu AMPLICOR HIV-1 MONITOR s použitím spodního limitu kvantifikace 500 kopií/ml.
Kaplan-Meierova analýza doby do selhání léčby po dobu 72 týdnů prokazuje delší trvání virologické suprese (HIV RNA
Pediatričtí pacienti
Studie AI266922 je otevřená studie k vyhodnocení farmakokinetiky, bezpečnosti, snášenlivosti a antivirové aktivity přípravku SUSTIVA 200 mg v kombinaci s didanosinem a emtricitabinem u pediatrických pacientů dosud neléčených antiretrovirotiky a pacientů se zkušenostmi s nimi. 37 pacientů ve věku od 3 měsíců do 6 let (medián 0,7 roku) bylo léčeno přípravkem SUSTIVA. Na začátku byl medián plazmatické HIV-1 RNA 5,88 log kopií/ml, medián počtu CD4+ buněk byl 1144 buněk/mm3 a medián procenta CD4+ byl 25 %. Medián doby na studijní terapii byl 60 týdnů; 27 % pacientů přerušilo léčbu před týdnem 48. Pomocí analýzy ITT byl celkový podíl pacientů s HIV RNA
Studie PACTG 1021 byla otevřená studie k hodnocení farmakokinetiky, bezpečnosti, snášenlivosti a antivirové aktivity přípravku SUSTIVA 200 mg v kombinaci s didanosinem a emtricitabinem u pediatrických pacientů, kteří dosud neužívali antiretrovirovou léčbu. 43 pacientům ve věku 3 měsíce až 21 let (medián 9,6 let) byl podáván SUSTIVA. Na začátku byl medián plazmatické HIV-1 RNA 4,8 log kopií/ml, medián počtu CD4+ buněk byl 367 buněk/mm3 a medián procenta CD4+ byl 18 %. Medián doby na studijní terapii byl 181 týdnů; 16 % pacientů přerušilo léčbu před týdnem 48. Při použití analýzy ITT byl celkový podíl pacientů s HIV RNA
Studie PACTG 382 byla otevřená studie k hodnocení farmakokinetiky, bezpečnosti, snášenlivosti a antivirové aktivity přípravku SUSTIVA v kombinaci s nelfinavirem a NRTI u pediatrických pacientů dosud neléčených antiretrovirotiky a pacientů již dříve léčených NRTI. 102 pacientů ve věku od 3 měsíců do 16 let (medián 5,7 let) bylo léčeno přípravkem SUSTIVA. Osmdesát sedm procent pacientů podstoupilo předchozí antiretrovirovou léčbu. Na začátku byl medián plazmatické HIV-1 RNA 4,57 log kopií/ml, medián počtu CD4+ buněk byl 755 buněk/mm3 a medián CD4+ procenta byl 30 %. Medián doby studijní terapie byl 118 týdnů; 25 % pacientů přerušilo léčbu před týdnem 48. Při použití analýzy ITT byl celkový podíl pacientů s HIV RNA
INFORMACE PRO PACIENTA
SUSTIVA® (sus-TEE-vah) (efavirenz) tobolky
SUSTIVA® (sus-TEE-vah) (efavirenz) tablety
Důležité: Zeptejte se svého lékaře nebo lékárníka na léky, které by se neměly užívat spolu se SUSTIVA. Další informace naleznete v části "Co mám říct svému lékaři, než začnu užívat SUSTIVA?"
Přečtěte si tyto informace pro pacienty dříve, než začnete užívat SUSTIVA a pokaždé, když dostanete náhradní náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo léčbě.
Co je SUSTIVA?
SUSTIVA 600 mg je lék na předpis proti HIV-1 (virus lidské imunodeficience typu 1), který se používá s jinými antiretrovirovými léky k léčbě infekce HIV-1 u dospělých a dětí ve věku alespoň 3 měsíců a vážících alespoň 7 liber 12 uncí (3,5 kg). HIV je virus, který způsobuje AIDS (syndrom získaného selhání imunity).
Není známo, zda je SUSTIVA bezpečný a účinný u dětí mladších 3 měsíců nebo u dětí, které váží méně než 7 liber 12 uncí (3,5 kg).
Při použití s jinými antiretrovirovými léky k léčbě infekce HIV-1 může SUSTIVA 600 mg pomoci:
- snížit množství HIV-1 ve vaší krvi. Tomu se říká virová nálož.
- zvýšit počet CD4+ (T) buněk v krvi, které pomáhají bojovat proti dalším infekcím.
Snížení množství HIV-1 a zvýšení počtu CD4+ (T) buněk v krvi může pomoci zlepšit váš imunitní systém. To může snížit riziko úmrtí nebo získání infekcí, ke kterým může dojít, když je váš imunitní systém slabý (oportunní infekce).
SUSTIVA 600 mg neléčí infekci HIV-1 ani AIDS. Měli byste pokračovat v užívání léků proti HIV-1 ke kontrole infekce HIV-1 a snížení počtu onemocnění souvisejících s HIV.
Vyhněte se činnostem, které mohou šířit infekci HIV-1 na ostatní:
- Nesdílejte ani znovu nepoužívejte jehly nebo jiné injekční vybavení.
- Nesdílejte osobní věci, na kterých může být krev nebo tělesné tekutiny, jako jsou zubní kartáčky a žiletky.
- Nemějte žádný druh sexu bez ochrany. Vždy praktikujte bezpečnější sex s použitím latexového nebo polyuretanového kondomu, abyste snížili pravděpodobnost sexuálního kontaktu s tělesnými tekutinami, jako je sperma, vaginální sekrety nebo krev.
Zeptejte se svého lékaře, pokud máte nějaké otázky, jak zabránit přenosu HIV na jiné lidi.
Kdo by neměl užívat SUSTIVA 600 mg?
Neužívejte SUSTIVA jestliže jste alergický/á na efavirenz nebo na kteroukoli složku SUSTIVA. Úplný seznam složek přípravku SUSTIVA naleznete na konci této příbalové informace.
Neužívejte SUSTIVA, pokud v současné době užíváte elbasvir a grazoprevir (ZEPATIER®).
Co mám říci svému lékaři, než začnu užívat SUSTIVA 200 mg?
Než začnete SUSTIVA užívat, informujte svého lékaře, pokud máte nějaké zdravotní potíže, a zejména pokud:
- mít srdeční onemocnění
- měl někdy problém s duševním zdravím
- užili někdy pouliční drogy nebo velké množství alkoholu
- máte problémy s játry, včetně infekce virem hepatitidy B nebo C
- mít v anamnéze záchvaty
- jste těhotná nebo plánujete otěhotnět. SUSTIVA 600 mg může poškodit vaše nenarozené dítě. Pokud můžete otěhotnět, váš poskytovatel zdravotní péče by si měl před zahájením léčby přípravkem SUSTIVA provést těhotenský test. Během užívání přípravku SUSTIVA a 12 týdnů po ukončení léčby přípravkem SUSTIVA byste neměla otěhotnět. Ženy, které mohou otěhotnět, by měly během léčby a 12 týdnů po ukončení léčby přípravkem SUSTIVA používat 2 účinné formy antikoncepce. Bariérová forma antikoncepce by měla být vždy používána spolu s jiným typem antikoncepce.
- Bariérové formy antikoncepce mohou zahrnovat latexový nebo polyuretanový kondom, antikoncepční houbu, diafragmu se spermicidem a cervikální čepici.
- Hormonální formy antikoncepce, jako jsou antikoncepční pilulky, injekce, vaginální kroužky nebo implantáty, nemusí během léčby přípravkem SUSTIVA fungovat.
- Poraďte se se svým lékařem o formách antikoncepce, které lze během léčby přípravkem SUSTIVA používat.
- Registr těhotenství. Pro ženy, které během těhotenství užívají antiretrovirová léčiva, existuje těhotenský registr. Účelem tohoto registru je shromažďovat informace o zdraví vás a vašeho dítěte. Promluvte si se svým lékařem o tom, jak se můžete zúčastnit tohoto registru.
- Pokud užíváte SUSTIVA, nekojte.
- Pokud máte HIV, neměla byste kojit kvůli riziku přenosu HIV na vaše dítě.
Informujte svého lékaře a lékárníka o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
SUSTIVA 600 mg může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek SUSTIVA 600 mg, a může způsobit vážné vedlejší účinky. Pokud spolu s SUSTIVA-em užíváte určité léky, může být množství SUSTIVA 600 mg ve vašem těle příliš nízké a nemusí fungovat při kontrole vaší infekce HIV. Virus HIV ve vašem těle se může stát odolným vůči SUSTIVA nebo jiným lékům proti HIV, které jsou jemu podobné.
Pokud užíváte přípravek ATRIPLA, neměli byste užívat SUSTIVA 600 mg (efavirenz, emtricitabin, tenofovir-disoproxyl-fumarát), pokud Vám to neřekne lékař.
Informujte svého lékaře a lékárníka o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Některé léky se s přípravkem SUSTIVA vzájemně ovlivňují.
Uchovávejte si seznam svých léků, abyste je mohli ukázat svému lékaři a lékárníkovi.
- Můžete požádat svého lékaře nebo lékárníka o seznam léků, které se vzájemně ovlivňují s SUSTIVA.
- Nezačínejte užívat nový lék, aniž byste to řekli svému lékaři. Váš lékař vám může říci, zda je bezpečné užívat SUSTIVA s jinými léky.
Jak mám užívat SUSTIVA?
- Užívejte SUSTIVA 600 mg přesně podle pokynů svého lékaře.
- Neměňte dávku ani nepřestávejte užívat SUSTIVA, pokud vám to neřekne lékař.
- Během léčby přípravkem SUSTIVA zůstaňte v péči svého lékaře.
- SUSTIVA se musí používat s jinými antiretrovirovými léky.
- Užívejte SUSTIVA 1krát denně.
- SUSTIVA se dodává ve formě tablet nebo kapslí.
- Tablety SUSTIVA se nesmí lámat.
- Tablety nebo tobolky SUSTIVA spolkněte celé a zapijte je tekutinou.
Jak a kdy užívat SUSTIVA.
- Měli byste užívat SUSTIVA 600 mg nalačno před spaním. Užívání SUSTIVA 200 mg s jídlem zvyšuje množství léku ve vašem těle. Některé nežádoucí účinky vás mohou obtěžovat méně, pokud užíváte SUSTIVA 600 mg nalačno a před spaním.
- Váš dětský lékař Vám předepíše správnou dávku SUSTIVA 200 mg na základě hmotnosti Vašeho dítěte.
- Pokud máte potíže s polykáním tablet nebo tobolek, sdělte to svému lékaři. Váš lékař může doporučit otevření tobolky SUSTIVA a smíchání obsahu s jídlem nebo kojeneckou výživou. Podívejte se na podrobný „Návod k použití“ na konci těchto Informací pro pacienta, kde se dozvíte, jak správně užívat SUSTIVA 600 mg metodou postřikování tobolkami.
- Dospělí a děti, kteří užívají SUSTIVA 600 mg metodou posypání tobolkami, by neměli jíst 2 hodiny po užití dávky SUSTIVA.
- Děti by neměly dostávat kojeneckou výživu po dobu 2 hodin po užití dávky SUSTIVA metodou posypání kapslí.
- Nenechte si ujít dávku SUSTIVA. Jestliže zapomenete užít SUSTIVA, vezměte si vynechanou dávku ihned, pokud není téměř čas na další dávku. Neužívejte 2 dávky najednou. Užijte si další dávku v pravidelně naplánovanou dobu. Pokud potřebujete pomoc s plánováním nejvhodnějších časů pro užívání léku, zeptejte se svého lékaře nebo lékárníka.
- Jestliže užijete příliš mnoho SUSTIVA-u, zavolejte svého lékaře nebo jděte ihned na pohotovost v nejbližší nemocnici.
- Když vám začne docházet zásoba SUSTIVA 600 mg, získejte další od svého lékaře nebo lékárny. Je důležité nevyčerpat SUSTIVA. Množství HIV-1 ve vaší krvi se může zvýšit, pokud je lék vysazen byť jen na krátkou dobu. Virus se může stát odolným vůči SUSTIVA 600 mg a hůře léčit.
Jaké jsou možné vedlejší účinky přípravku SUSTIVA?
SUSTIVA 600 mg může způsobit závažné nežádoucí účinky, včetně:
Pokud máte závratě, potíže se soustředěním nebo ospalost, neřiďte auto, neobsluhujte stroje ani nedělejte nic, co vyžaduje, abyste byli ve střehu.
Některé příznaky nervového systému (např. zmatenost, pomalé myšlenky a fyzické pohyby a bludy [falešné přesvědčení] nebo halucinace [vidět nebo slyšet věci, které ostatní nevidí nebo neslyší]) se mohou objevit měsíce až roky po zahájení léčby přípravkem SUSTIVA 600 mg. Pokud se některý z těchto příznaků objeví, okamžitě kontaktujte svého poskytovatele zdravotní péče.
Okamžitě informujte svého lékaře, pokud se u Vás objeví některý z následujících příznaků:
- Vážné problémy s duševním zdravím se může stát u lidí, kteří užívají SUSTIVA. Okamžitě informujte svého lékaře, pokud máte některý z následujících příznaků:
- cítit se smutně nebo beznadějně nedůvěřovat druhým lidem
- cítit úzkost nebo neklid slyšet nebo vidět věci, které nejsou skutečné
- máte myšlenky na sebepoškození (sebevraždu) nebo jste se pokusili ublížit sobě nebo jiným
- nejsou schopni se normálně hýbat nebo mluvit
- nejsou schopni rozlišit mezi tím, co je pravdivé nebo skutečné, a tím, co je nepravdivé nebo nereálné
- Příznaky nervového systému jsou časté u lidí, kteří užívají SUSTIVA 200 mg a mohou být závažné. Tyto příznaky obvykle začínají během prvního nebo druhého dne léčby přípravkem SUSTIVA 200 mg a obvykle vymizí po 2 až 4 týdnech léčby. Některé příznaky se mohou objevit měsíce až roky po zahájení léčby přípravkem SUSTIVA. Tyto příznaky se mohou zhoršit, pokud během léčby přípravkem SUSTIVA pijete alkohol, užíváte léky na duševní problémy nebo užíváte určité pouliční drogy. Příznaky mohou zahrnovat:
- závrať
- potíže se soustředěním
- problémové spaní
- ospalost
- neobvyklé sny
- nedostatek koordinace nebo potíže s rovnováhou
- Vyrážka je běžné u SUSTIVA 600 mg, ale někdy může být závažné. Kožní vyrážka obvykle odezní bez jakékoli změny léčby. Pokud se u vás objeví vyrážka s některým z následujících příznaků, okamžitě to sdělte svému lékaři:
- kožní vyrážka se svěděním nebo bez něj
- loupání kůže
- horečka
- vředy v ústech
- otok vašeho obličeje
- červené nebo zanícené oči, jako „růžové oko“ (konjunktivitida)
- puchýře nebo kožní léze
- Problémy s játry, včetně selhání jater a smrti se může stát u lidí, kteří užívají SUSTIVA. Problémy s játry se mohou objevit u lidí bez anamnézy jaterních problémů. Před zahájením léčby přípravkem SUSTIVA 200 mg a během léčby Vám lékař provede krevní testy, aby zkontroloval Vaše játra.
- vaše kůže nebo bílá část vašich očí zežloutne (žloutenka)
- několik dní nebo déle nemáte chuť k jídlu
- vaše moč ztmavne
- je vám špatně od žaludku (nevolnost)
- vaše pohyby střev (stolice) zesvětlí barvu
- máte bolesti v oblasti břicha (břicho).
- Záchvaty se může stát u lidí, kteří užívají SUSTIVA. Záchvaty jsou pravděpodobnější, pokud jste v minulosti měli záchvaty. Informujte svého lékaře, pokud jste měl(a) záchvat nebo pokud užíváte lék na prevenci záchvatů.
- Změny ve vašem imunitním systému (imunitní rekonstituční syndrom) se může stát, když začnete užívat léky proti HIV-1. Váš imunitní systém může zesílit a začít bojovat s infekcemi, které byly ve vašem těle ukryty dlouhou dobu. Informujte svého lékaře, pokud po zahájení léčby HIV-1 začnete mít nové příznaky.
- Změny tělesného tuku se může stát u lidí, kteří užívají léky proti HIV-1. Tyto změny mohou zahrnovat zvýšené množství tuku v horní části zad a krku („buvolí hrb“), prsou a kolem hlavní části vašeho těla (trup). Může také dojít ke ztrátě tuku z nohou, paží a obličeje. Příčina a dlouhodobé zdravotní účinky těchto stavů nejsou známy.
Mezi nejčastější nežádoucí účinky přípravku SUSTIVA 600 mg patří:
- vyrážka
- abnormální sny
- závrať
- únava
- nevolnost
- problémové spaní
- bolest hlavy
- zvracení
- potíže se soustředěním
Někteří pacienti užívající SUSTIVA zaznamenali zvýšené hladiny lipidů (cholesterolu a triglyceridů) v krvi. Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku SUSTIVA. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám SUSTIVA uchovávat?
- Kapsle a tablety SUSTIVA skladujte při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte SUSTIVA a všechny léky mimo dosah dětí.
Obecné informace o SUSTIVA
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte SUSTIVA 600 mg pro stav, pro který nebyl předepsán. Nepodávejte SUSTIVA 600 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékárníka nebo lékaře o informace o přípravku SUSTIVA, který je určen pro zdravotníky. Další informace najdete na www.sustiva.com nebo na čísle 1-800-321-1335.
Jaké jsou složky přípravku SUSTIVA?
Aktivní složka: efavirenz
Neaktivní složky:
SUSTIVA 600 mg tobolky: monohydrát laktózy, magnesium-stearát, laurylsulfát sodný a sodná sůl karboxymethylškrobu. Obal tobolky obsahuje želatinu, laurylsulfát sodný, oxid titaničitý a/nebo žlutý oxid železitý. Obal kapsle může také obsahovat oxid křemičitý. Tobolky jsou potištěny inkoustem obsahujícím karmínovou modř 40, modř FD&C č. 2 a oxid titaničitý.
Tablety SUSTIVA: sodná sůl kroskarmelózy, hydroxypropylcelulóza, monohydrát laktózy, magnesium-stearát, mikrokrystalická celulóza a laurylsulfát sodný. Potah tablety obsahuje Opadry Yellow a Opadry Clear. Tablety jsou vyleštěny karnaubským voskem a potištěny fialovým inkoustem Opacode WB.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
Návod k použití
SUSTIVA® (sus-TEE-vah) (efavirenz) tobolky
Příprava dávky SUSTIVA 600 mg metodou posypání kapslí
Přečtěte si tento Návod k použití dříve, než si připravíte svou první dávku SUSTIVA smíchanou s jídlem nebo kojeneckou výživou pomocí metody posypání kapslí, pokaždé, když dostanete náplň, a podle potřeby. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo léčbě. Zeptejte se svého lékaře nebo lékárníka, pokud máte nějaké otázky ohledně toho, jak míchat nebo podávat dávku SUSTIVA 200 mg metodou postřikování tobolkami.
Důležitá informace:
- Více informací o SUSTIVA 600 mg tobolkách naleznete v příbalové informaci.
- Metoda posypání kapslí pro smíchání obsahu kapslí SUSTIVA s měkkým jídlem nebo kojeneckou výživou může být použita pro dospělé nebo děti, které nemohou polykat kapsle nebo tablety.
- Měli byste užívat SUSTIVA 600 mg nalačno před spaním.
- Neměli byste jíst 2 hodiny po užití SUSTIVA smíchaného s jídlem.
- Děti, které jsou dostatečně staré na to, aby polykaly potravu, by měly dostávat SUSTIVA metodou posypání tobolkami smíchanou s jídlem místo kojenecké výživy.
- Promluvte si se svým lékařem, který vám pomůže rozhodnout o nejlepším rozvrhu podávání SUSTIVA-u smíchaného s kojeneckou kojeneckou výživou pomocí metody posypání kapslí.
Příprava dávky SUSTIVA 600 mg smíchané s jídlem metodou posypání kapslí.
Než si připravíte dávku SUSTIVA 200 mg smíchanou s jídlem metodou posypání kapslí, připravte si následující zásoby:
- papírové ručníky
- lžička pro měření
- malá lžička na míchání a krmení
- malý čistá nádoba (např malý šálek nebo miska)
- měkké potraviny, jako je jablečný protlak, hroznové želé nebo jogurt
Krok 1. Vyberte si čistou, rovnou pracovní plochu. Na pracovní plochu položte čistou papírovou utěrku. Poté položte ostatní zásoby na papírovou utěrku.
Krok 2. Dobře si umyjte a osušte ruce.
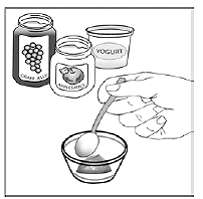
Krok 3 Do malé nádoby vložte 1 až 2 čajové lžičky měkkého jídla, jako je jablečný protlak, hroznové želé nebo jogurt (viz Obrázek A ). Barva a tloušťka jídla se může při smíchání s lékem změnit.
Obrázek A
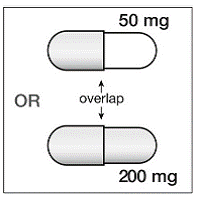
Krok 4. Tobolka SUSTIVA 200 mg obsahuje 2 části. Podívejte se na tobolku SUSTIVA, abyste viděli, která část tobolky překrývá druhou část (viz Obrázek B ).
Obrázek B
Krok 5. Držte kapsli SUSTIVA v boční (horizontální) poloze přímo nad nádobou s jídlem. Držte každý konec tobolky SUSTIVA mezi palci a ukazováčky (viz Obrázek C ).
Obrázek C
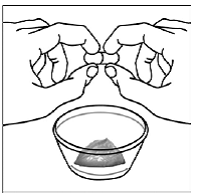
Krok 6. Palcem a ukazováčkem sevřete blízko konce překrývající se části tobolky SUSTIVA 600 mg (viz Obrázek D ).
Obrázek D
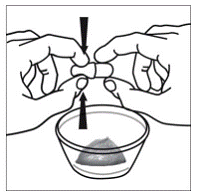
Poté opatrně otočte oba konce tobolky SUSTIVA 600 mg v opačných směrech, abyste ji otevřeli (viz Obrázek E ). Dávejte pozor, abyste obsah kapsle nevylili nebo nerozházeli vzduchem.
Obrázek E

Krok 7. Nasypte obsah tobolky SUSTIVA na jídlo (viz Obrázek F ).
- Zkontrolujte obaly kapslí a ujistěte se, že jsou prázdné.
- Vyhoďte prázdné obaly kapslí.
Obrázek F

Pokud je celková předepsaná dávka více než 1 tobolka, postupujte podle kroků 4 až 7 pro každou tobolku. Nepřidávejte další jídlo.
Kroky 8 až 11 by měly být dokončeny do 30 minut smíchání léku (viz Obrázek G ).
Obrázek G

Krok 8. Pomocí malé lžičky jemně promíchejte obsah kapsle a jídlo (viz Obrázek H ). Sypání se nerozpustí. Směs bude vypadat zrnitě, ale neměla by být hrudkovitá.
Obrázek H
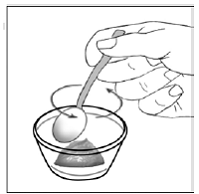
Krok 9. Použijte malou lžičku k podání nebo odebrání směsi jídla a obsahu kapslí. Ujistěte se, že je celá směs spolknuta.
Krok 10. Do prázdné nádoby přidejte ještě asi 2 čajové lžičky jídla a jemně promíchejte malou lžičkou, aby se promíchal s jakýmkoli obsahem kapsle, který může být ještě v nádobě.
Krok 11. Použijte malou lžičku k podání nebo odebrání směsi jídla a obsahu kapslí. Ujistěte se, že jste celou směs spolkli.
Krok 12. Umyjte nádobu a lžíce. Papírovou utěrku vyhoďte a očistěte pracovní plochu. Myjte si ruce.
Příprava dávky SUSTIVA 600 mg smíchané s kojeneckou výživou metodou posypání kapslí
Abyste zajistili, že vaše dítě dostane veškerý lék, nepodávejte obsah tobolek SUSTIVA vašemu dítěti v lahvičce.
Než si připravíte dávku SUSTIVA smíchanou s kojeneckou kojeneckou výživou pomocí metody posypání kapslí, připravte si následující zásoby:
- papírové ručníky
- lžička pro míchání a měření
- malý čistá nádoba (např malý šálek nebo miska) (viz Obrázek I ).
- 10ml perorální dávkovací stříkačka (požádejte o to svého lékárníka) (viz Obrázek I ).
- kojenecká výživa při pokojové teplotě.
Obrázek I
Krok 1. Připravte kojeneckou výživu podle pokynů na obalu kojenecké výživy. K podání léku použijete asi 1 unci vzorce. Jakékoli zbývající umělé mléko by nemělo být dítěti podáváno po dobu 2 hodin.
Krok 2. Vyberte si čistou, rovnou pracovní plochu. Na pracovní plochu položte čistou papírovou utěrku. Na papírovou utěrku položte potřebné zásoby.
Krok 3 Dobře si umyjte a osušte ruce.
Krok 4. Do nádoby nasypte 2 čajové lžičky kojenecké výživy pokojové teploty (viz Obrázek J ).
Obrázek J
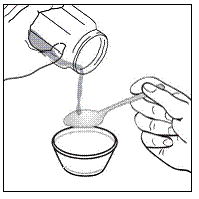
Krok 5. Kapsle SUSTIVA se skládá ze 2 částí. Podívejte se na tobolku SUSTIVA, abyste viděli, která část tobolky překrývá druhou část (viz Obrázek K ).
Obrázek K
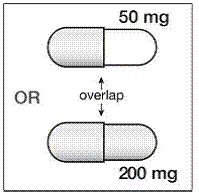
Krok 6. Držte kapsli SUSTIVA v boční (horizontální) poloze přímo nad nádobou s kojeneckou mléčnou výživou. Držte každý konec tobolky SUSTIVA 600 mg mezi palce a ukazováčky (viz. Obrázek L ).
Obrázek L
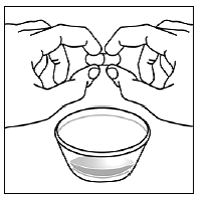
Krok 7. Palcem a ukazováčkem sevřete blízko konce překrývající se části tobolky SUSTIVA (viz Obrázek M ).
Obrázek M
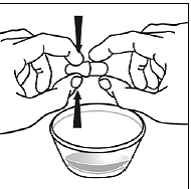
Poté opatrně otočte oba konce tobolky SUSTIVA v opačných směrech, abyste ji otevřeli (viz Obrázek N ). Dávejte pozor, abyste obsah kapsle nevylili nebo nerozházeli vzduchem.
Obrázek N
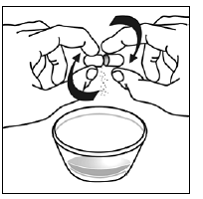
Krok 8. Nasypte obsah tobolky SUSTIVA 600 mg na kojeneckou výživu (viz Obrázek O ).
- Zkontrolujte obaly kapslí a ujistěte se, že jsou prázdné.
- Vyhoďte prázdné obaly kapslí.
Obrázek O
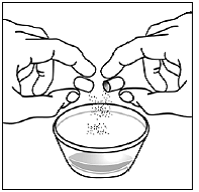
Pokud je celková předepsaná dávka více než 1 tobolka, postupujte podle kroků 5 až 8 pro každou tobolku. Nepřidávejte další kojeneckou výživu.
Kroky 9 až 12 by měly být dokončeny do 30 minut smíchání léku (viz Obrázek P ).
Obrázek P

Krok 9. Držte nádobu jednou rukou. Druhou rukou použijte lžičku k jemnému promíchání obsahu tobolky a kojenecké výživy (viz Obrázek Q ). Sypání se nerozpustí. Směs bude vypadat zrnitě, ale neměla by být hrudkovitá.
Obrázek Q
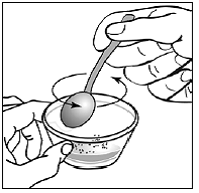
Krok 10. Natažení celé směsi do perorální dávkovací stříkačky:
Obrázek R
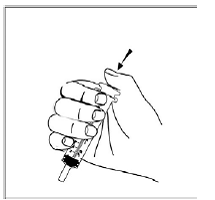
Obrázek S
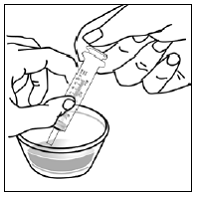
Obrázek T
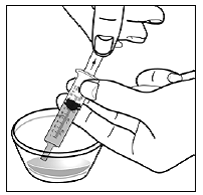
- Zkontrolujte, zda je píst zcela zatlačen do válce stříkačky (viz Obrázek R ).
- Umístěte špičku stříkačky do směsi v nádobě (viz Obrázek S ).
- Pomalu zatáhněte za píst a natáhněte veškerou směs (viz Obrázek T ).
Krok 11. Umístěte špičku stříkačky do úst vašeho dítěte podél vnitřní tváře (viz Obrázek U ). Pomalu zatlačte na píst, abyste dítěti dali veškerou směs.
Obrázek U
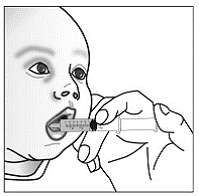
Krok 12. Abyste se ujistili, že je vašemu dítěti podán veškerý lék:
- Opakujte výše uvedený krok 4.
- Zamíchejte lžičkou.
- Poté opakujte Kroky 10 a 11 výše (vidět Obrázek V ).
Obrázek V
Krok 13. Odstraňte píst z perorální dávkovací stříkačky. Umyjte nádobku, lžičku a perorální dávkovací stříkačku. Nechte píst a válec injekční stříkačky vyschnout, než je složíte zpět.
Krok 14. Papírovou utěrku vyhoďte a očistěte pracovní plochu. Myjte si ruce.
Jak mám uchovávat SUSTIVA 600 mg tobolky?
- Uchovávejte tobolky SUSTIVA při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte SUSTIVA 600 mg tobolky a všechny léky mimo dosah dětí.
Tento návod k použití byl schválen US Food and Drug Administration.
