Léky na ženské problémy: Clomid 100mg, 25mg, 50mg Clomiphene Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Clomid 50 mg a jak se používá?
Clomid 100 mg je lék na předpis používaný k léčbě příznaků neplodnosti u žen, které mají ovulační selhání. Clomid lze užívat samostatně nebo s jinými léky.
Clomid patří do třídy léků nazývaných selektivní modulátory estrogenových receptorů.
Není známo, zda je Clomid bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky Clomidu?
Clomid může způsobit závažné nežádoucí účinky, včetně:
- bolest břicha,
- nadýmání,
- nevolnost,
- zvracení,
- průjem,
- rychlé přibírání na váze (zejména v obličeji a střední části),
- malé nebo žádné močení,
- bolest při dýchání,
- rychlý srdeční tep a
- dušnost
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Clomid patří:
- návaly horka (teplo, zarudnutí nebo pocit brnění),
- nevolnost,
- zvracení,
- nadýmání,
- bolest nebo citlivost prsou,
- bolest hlavy a
- krvácení z průniku nebo špinění
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Clomid. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
CLOMID (klomifen citrátové tablety USP) je orálně podávaný, nesteroidní, ovulační stimulant označovaný chemicky jako 2-[p-(2-chlor-1,2-difenylvinyl)fenoxy]triethylamincitrát (1:1). Má molekulový vzorec C26H28ClNO • C6H8O7 a molekulovou hmotnost 598,09. Strukturálně je reprezentován jako:
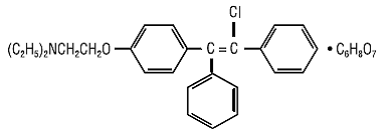
Clomifen citrát je bílý až světle žlutý krystalický prášek v podstatě bez zápachu. Je volně rozpustný v methanolu; rozpustný v ethanolu; mírně rozpustný v acetonu, vodě a chloroformu; a nerozpustný v etheru.
CLOMID 50 mg je směs dvou geometrických izomerů [cis (zuklomifen) a trans (enklomifen)] obsahující 30 % až 50 % cis-izomeru.
Každá tableta s bílou rýhou obsahuje 50 mg klomifen citrátu USP. Tableta také obsahuje následující neaktivní složky: kukuřičný škrob, laktózu, stearát hořečnatý, předželatinovaný kukuřičný škrob a sacharózu.
INDIKACE
CLOMID 100 mg je indikován k léčbě ovulační dysfunkce u žen, které chtějí otěhotnět. Před zahájením léčby přípravkem CLOMID 50 mg musí být vyloučeny nebo adekvátně léčeny překážky bránící otěhotnění. Mezi pacienty, u kterých je největší pravděpodobnost úspěchu při léčbě klomifenem, patří pacientky se syndromem polycystických ovarií (viz VAROVÁNÍ : Ovariální hyperstimulační syndrom ), amenorea-galaktorea syndrom, psychogenní amenorea, post-orální antikoncepční amenorea a některé případy sekundární amenorey neurčené etiologie.
Důležitý je správně načasovaný koitus ve vztahu k ovulaci. Graf bazální tělesné teploty nebo jiné vhodné testy mohou pacientce a jejímu lékaři pomoci určit, zda došlo k ovulaci. Jakmile se ustaví ovulace, každá kúra s přípravkem CLOMID 100 mg by měla být zahájena přibližně 5. den cyklu. Dlouhodobá cyklická terapie se nedoporučuje déle než celkem asi šest cyklů (včetně tří ovulačních cyklů). (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ a OPATŘENÍ .)
CLOMID je indikován pouze u pacientek s prokázanou ovulační dysfunkcí, které splňují níže popsané podmínky:
Kromě toho by pacienti vybraní pro léčbu přípravkem CLOMID měli být vyšetřeni s ohledem na následující:
Neexistují žádné adekvátní nebo dobře kontrolované studie, které by prokázaly účinnost přípravku CLOMID 100 mg v léčbě mužské neplodnosti. Kromě toho byly u mužů užívajících klomifen hlášeny nádory varlat a gynekomastie. Vztah příčiny a účinku mezi hlášenými nádory varlat a podáváním přípravku CLOMID 25 mg není znám.
Ačkoli lékařská literatura navrhuje různé metody, neexistuje žádný všeobecně uznávaný standardní režim pro kombinovanou terapii (tj. CLOMID ve spojení s jinými léky vyvolávajícími ovulaci). Podobně neexistuje žádný standardní režim CLOMID pro indukci ovulace v programech oplodnění in vitro k produkci vajíček pro oplodnění a znovuzavedení. Proto se CLOMID 50 mg pro tato použití nedoporučuje.
DÁVKOVÁNÍ A PODÁVÁNÍ
Obecné úvahy
Na zpracování a léčbu kandidátů pro léčbu přípravkem CLOMID 100 mg by měli dohlížet lékaři se zkušenostmi s léčbou gynekologických nebo endokrinních poruch. Pacienti by měli být vybráni k léčbě přípravkem CLOMID 50 mg pouze po pečlivém diagnostickém zhodnocení (viz INDIKACE ). Plán terapie by měl být nastíněn předem. Před zahájením léčby přípravkem CLOMID je nutné vyloučit nebo adekvátně léčit překážky bránící dosažení cíle terapie. Terapeutický cíl by měl být vyvážen s potenciálními riziky a měl by být prodiskutován s pacientkou a ostatními, kteří se podílejí na dosažení těhotenství.
ovulaci nejčastěji dochází od 5 do 10 dnů po cyklu CLOMID. Koitus by měl být načasován tak, aby se shodoval s očekávanou dobou ovulace. Během této doby mohou být užitečné vhodné testy k určení ovulace.
Doporučené dávkování
Léčba vybraného pacienta by měla začít nízkou dávkou, 50 mg denně (1 tableta) po dobu 5 dnů. Dávka by měla být zvýšena pouze u těch pacientek, u kterých nedochází k ovulaci v reakci na cyklický 50 mg CLOMID. Nízké dávkování nebo trvání léčebného cyklu se doporučuje zejména při podezření na neobvyklou citlivost na hypofyzární gonadotropin, jako je tomu u pacientek se syndromem polycystických ovarií (viz VAROVÁNÍ ; Ovariální hyperstimulační syndrom ).
Pacientku je třeba pečlivě vyšetřit, aby se mezi každým léčebným cyklem vyloučilo těhotenství, zvětšení vaječníků nebo tvorba cyst na vaječnících.
Pokud se plánuje krvácení vyvolané progestinem nebo pokud se před léčbou objeví spontánní děložní krvácení, režim 50 mg denně po dobu 5 dnů by měl být zahájen přibližně 5. den cyklu. Léčba může být zahájena kdykoli u pacientky, která v nedávné době neměla děložní krvácení. Pokud při této dávce dojde k ovulaci, není výhodné zvyšovat dávku v následujících cyklech léčby.
Pokud se po prvním cyklu léčby nezdá, že by došlo k ovulaci, měl by být podán druhý cyklus 100 mg denně (dvě 50mg tablety podávané v jedné denní dávce) po dobu 5 dnů. Tento cyklus může být zahájen již 30 dní po předchozím po provedení opatření k vyloučení přítomnosti těhotenství. Zvyšování dávkování nebo trvání léčby nad 100 mg/den po dobu 5 dnů se nedoporučuje.
Většina pacientek, které ovulují, tak učiní po prvním cyklu terapie. Pokud nedojde k ovulaci po třech cyklech terapie, další léčba přípravkem CLOMID 50 mg se nedoporučuje a pacientka by měla být znovu zhodnocena. Pokud se objeví tři ovulační odpovědi, ale nebylo dosaženo těhotenství, další léčba se nedoporučuje. Pokud po ovulační reakci nedojde k menstruaci, je třeba pacientku znovu zhodnotit. Dlouhodobá cyklická terapie se nedoporučuje déle než celkem asi šest cyklů (viz OPATŘENÍ ).
JAK DODÁVÁNO
NDC 0068-0226-30: 50 mg tablety v krabičkách po 30 tabletách jsou kulaté, bílé, s půlicí rýhou a vyraženým CLOMID 50. Uchovávejte tablety při kontrolované pokojové teplotě 59-86°F (15-30°C). Chraňte před teplem, světlem a nadměrnou vlhkostí a skladujte v uzavřených nádobách.
Výrobce: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Revize: červenec 2017
VEDLEJŠÍ EFEKTY
Nežádoucí účinky klinické studie.
CLOMID je v doporučených dávkách obecně dobře snášen. Nežádoucí účinky byly obvykle mírné a přechodné a většina vymizela okamžitě po ukončení léčby. Nežádoucí účinky hlášené u pacientů léčených klomifencitrátem během klinických studií jsou uvedeny v tabulce 2.
Následující nežádoucí účinky byly hlášeny u méně než 1 % pacientů v klinických studiích: akutní břicho, zvýšená chuť k jídlu, zácpa, dermatitida nebo vyrážka, deprese, průjem, závratě, únava, vypadávání vlasů/suché vlasy, zvýšená frekvence/objem močení, nespavost, točení hlavy, nervové napětí, suchost pochvy, vertigo, přibírání/ztráta hmotnosti.
Pacienti na prodloužené léčbě přípravkem CLOMID 25 mg mohou vykazovat zvýšené hladiny desmosterolu v séru. To je pravděpodobně způsobeno přímým zásahem do syntézy cholesterolu. Sérové steroly u pacientů užívajících doporučenou dávku přípravku CLOMID 50 mg však nejsou významně změněny. Rakovina vaječníků byla zřídka hlášena u pacientek, které užívaly léky na podporu plodnosti. Neplodnost je primárním rizikovým faktorem pro rakovinu vaječníků; epidemiologické údaje však naznačují, že dlouhodobé užívání klomifenu může zvýšit riziko hraničního nebo invazivního nádoru vaječníků.
Postmarketingové nežádoucí příhody
Následující nežádoucí účinky byly zjištěny během používání přípravku Clomid po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo jako celek: Horečka, tinitus, slabost
Kardiovaskulární: Arytmie, bolest na hrudi, edém, hypertenze, palpitace, flebitida, plicní embolie, dušnost, tachykardie, tromboflebitida
Centrální nervový systém: Migréna, parestézie, záchvaty, mrtvice, synkopa
Dermatologické: Akné, alergická reakce, erytém, erythema multiforme, erythema nodosum, hypertrichóza, pruritus, kopřivka
Fetální/neonatální anomálie:
- Abnormální vývoj kostí: kosterní malformace lebky, obličeje, nosních cest, čelisti, ruky, končetiny (ektromelie včetně amelie, hemimelie a fokomelie), chodidla, páteře a kloubů
- Srdeční abnormality: srdeční defekty septa, defekt svalového ventrikulárního septa, otevřený ductus arteriosus, Fallotova tetralogie a koarktace aorty
- Chromozomální poruchy: Downsův syndrom
- Abnormality uší a hluchota
- Abnormality gastrointestinálního traktu: rozštěp rtu a patra, neperforovaný řitní otvor, tracheoezofageální píštěl, diafragmatická kýla, omfalokéla
- Genitální abnormality: hypospadie, kloakální exstrofie
- Malformace plicní tkáně
- Malformace oka a čočky (katarakta)
- Novotvary: neuroektodermální tumor, tumor štítné žlázy, hepatoblastom, lymfocytární leukémie
- Abnormality nervového systému: defekty neurální trubice (anencefalie, meningomyelokéla), mikrocefalie a hydrocefalus
- Renální abnormality: renální ageneze a renální dysgeneze
- Ostatní: nanismus, mentální retardace
Gastrointestinální: Pankreatitida
Genitourinární: Endometrióza, ovariální cysta (zvětšení nebo cysty vaječníků mohou být jako takové komplikovány torzí adnex), krvácení z vaječníků, vejcovodové těhotenství, děložní krvácení, zmenšená tloušťka endometria
Jaterní: Zvýšené transaminázy, hepatitida
Poruchy metabolismu: Hypertriglyceridémie, v některých případech s pankreatitidou
Muskuloskeletální: Artralgie, bolesti zad, myalgie
Novotvary: Játra (hepatický hemangiosarkom, adenom jaterních buněk, hepatocelulární karcinom); prsu (fibrocystické onemocnění, karcinom prsu); endometrium (karcinom endometria); nervový systém (astrocytom, nádor hypofýzy, prolaktinom, neurofibromatóza, multiformní glioblastom, mozkový absces); vaječník (luteom těhotenství, dermoidní cysta vaječníku, karcinom vaječníku); trofoblastický (hydatiformní mol, choriokarcinom); různé (melanom, myelom, perianální cysty, renální buněčný karcinom, Hodgkinův lymfom, karcinom jazyka, karcinom močového měchýře)
psychiatrické: Úzkost, podrážděnost, změny nálady, psychóza
Poruchy zraku: Abnormální akomodace, katarakta, bolest oka, makulární edém, optická neuritida, fotopsie, odchlípení zadního sklivce, retinální krvácení, retinální trombóza, retinální vaskulární spazmus, dočasná nebo dlouhodobá ztráta zraku, možná nevratná.
Jiný: Leukocytóza, porucha štítné žlázy
DROGOVÉ INTERAKCE
Lékové interakce s přípravkem CLOMID nebyly zdokumentovány.
Zneužívání drog a závislost
Tolerance, zneužívání nebo závislost na přípravku CLOMID nebyly hlášeny.
VAROVÁNÍ
Vizuální příznaky
Pacienty je třeba upozornit, že během léčby přípravkem CLOMID se mohou příležitostně objevit rozmazané nebo jiné vizuální příznaky, jako jsou skvrny nebo záblesky (scintilační skotomy). Výskyt těchto zrakových příznaků se zvyšuje se zvyšující se celkovou dávkou nebo délkou léčby. Tyto poruchy zraku jsou obvykle reverzibilní; byly však hlášeny případy prodloužených zrakových poruch, z nichž některé se vyskytly po vysazení přípravku CLOMID 50 mg. Poruchy zraku mohou být nevratné, zvláště při zvýšené dávce nebo délce léčby. Pacienti by měli být upozorněni, že tyto zrakové příznaky mohou učinit takové činnosti, jako je řízení auta nebo obsluha strojů, nebezpečnější než obvykle, zejména za podmínek proměnlivého osvětlení.
Zdá se, že tyto vizuální symptomy jsou způsobeny zesílením a prodloužením dozvuků. Symptomy se často poprvé objevují nebo jsou zvýrazněny expozicí jasně osvětlenému prostředí. Zatímco naměřená zraková ostrost obvykle nebyla ovlivněna, u studovaného pacienta užívajícího 200 mg přípravku CLOMID denně se 7. den léčby rozvinulo zrakové rozmazání, které do 10. dne progredovalo k závažnému snížení zrakové ostrosti. Nebyla nalezena žádná jiná abnormalita a zraková ostrost se vrátila k normálu 3. den po ukončení léčby.
Byly také hlášeny oftalmologicky definovatelné skotomy a změny funkce buněk sítnice (elektroretinografické). U pacienta léčeného během klinických studií se během prodlouženého podávání CLOMID 50 mg vyvinuly fosfeny a skotomy, které vymizely do 32. dne po ukončení léčby.
Postmarketingové sledování nežádoucích účinků také odhalilo další vizuální známky a symptomy během léčby přípravkem CLOMID (viz NEŽÁDOUCÍ REAKCE ).
Zatímco etiologie těchto zrakových symptomů není dosud objasněna, pacienti s jakýmikoli zrakovými symptomy by měli přerušit léčbu a neprodleně provést kompletní oftalmologické vyšetření.
Ovariální hyperstimulační syndrom
Byl hlášen výskyt syndromu ovariální hyperstimulace (OHSS) u pacientek léčených klomifen citrátem k indukci ovulace. OHSS může rychle progredovat (během 24 hodin až několika dnů) a stát se závažnou zdravotní poruchou. V některých případech se OHSS objevil po cyklickém užívání klomifen citrátové terapie nebo při použití klomifen citrátu v kombinaci s gonadotropiny. V souvislosti s OHSS byly hlášeny přechodné abnormality jaterních testů svědčící pro jaterní dysfunkci, které mohou být doprovázeny morfologickými změnami při jaterní biopsii.
OHSS je lékařská příhoda odlišná od nekomplikovaného zvětšení vaječníků. Klinické příznaky tohoto syndromu v těžkých případech mohou zahrnovat hrubé zvětšení vaječníků, gastrointestinální symptomy, ascites, dušnost, oligurii a pleurální výpotek. Kromě toho byly v souvislosti s tímto syndromem hlášeny následující příznaky: perikardiální výpotek, anasarka, hydrothorax, akutní břicho, hypotenze, selhání ledvin, plicní edém, intraperitoneální a ovariální krvácení, hluboká žilní trombóza, torze vaječníků a akutní respirační nouze. Časné varovné příznaky OHSS jsou bolest břicha a distenze, nevolnost, zvracení, průjem a přibývání na váze. Mohou se objevit zvýšené hladiny steroidů v moči, různé stupně nerovnováhy elektrolytů, hypovolémie, hemokoncentrace a hypoproteinémie. Došlo k úmrtí v důsledku hypovolemického šoku, hemokoncentrace nebo tromboembolie. Vzhledem ke křehkosti zvětšených vaječníků v těžkých případech by vyšetření břicha a pánve mělo být prováděno velmi opatrně. Pokud dojde k početí, může dojít k rychlé progresi do těžké formy syndromu.
Aby se minimalizovalo riziko spojené s občasným abnormálním zvětšením vaječníků spojeným s léčbou přípravkem CLOMID 100 mg, měla by být použita nejnižší dávka odpovídající očekávaným klinickým výsledkům. K maximálnímu zvětšení vaječníků, ať už fyziologickému nebo abnormálnímu, může dojít až několik dní po vysazení doporučené dávky přípravku CLOMID. Některé pacientky se syndromem polycystických ovarií, které jsou neobvykle citlivé na gonadotropin, mohou mít přehnanou odpověď na obvyklé dávky přípravku CLOMID. Proto by u pacientek se syndromem polycystických ovarií měla být v prvním cyklu terapie zahájena nejnižší doporučená dávka a co nejkratší doba léčby (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pokud dojde ke zvětšení vaječníků, další léčba přípravkem CLOMID by neměla být podána, dokud se vaječníky nevrátí na velikost před léčbou, a dávka nebo doba trvání dalšího cyklu by se měla snížit. Zvětšení vaječníků a tvorba cyst související s léčbou přípravkem CLOMID 50 mg obvykle spontánně ustoupí během několika dnů nebo týdnů po ukončení léčby. Potenciální přínos následné léčby přípravkem CLOMID 25 mg by v těchto případech měl převýšit riziko. Pokud neexistuje chirurgická indikace k laparotomii, mělo by být takové cystické zvětšení vždy řešeno konzervativně.
Příčinný vztah mezi ovariální hyperstimulací a ovariálním karcinomem nebyl stanoven. Protože však byla navržena korelace mezi rakovinou vaječníků a nuliparitou, neplodností a věkem, pokud ovariální cysty spontánně neregredují, mělo by být provedeno důkladné vyšetření, aby se vyloučila přítomnost ovariální neoplazie.
OPATŘENÍ
Všeobecné
Výběru kandidátů pro terapii CLOMID je třeba věnovat pečlivou pozornost. Před léčbou přípravkem CLOMID a před každým dalším cyklem je nutné vyšetření pánve (viz KONTRAINDIKACE a VAROVÁNÍ ).
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyly provedeny dlouhodobé studie toxicity na zvířatech za účelem hodnocení karcinogenního nebo mutagenního potenciálu klomifen citrátu.
Perorální podávání přípravku CLOMID 25 mg samcům potkanů v dávkách 0,3 nebo 1 mg/kg/den způsobilo snížení plodnosti, zatímco vyšší dávky způsobily dočasnou neplodnost. Perorální dávky 0,1 mg/kg/den u samic potkanů dočasně přerušily normální cyklický vzor vaginálního stěru a zabránily početí. Dávky 0,3 mg/kg/den mírně snížily počet ovulovaných vajíček a corpora lutea, zatímco 3 mg/kg/den ovulaci inhibovaly.
Těhotenství
Souhrn fetálních rizik
Užívání přípravku CLOMID 100 mg u těhotných žen je kontraindikováno, protože léčba přípravkem CLOMID 25 mg u této populace nenabízí žádný přínos.
Dostupné údaje u lidí nenaznačují zvýšené riziko vrozených anomálií nad základní populační riziko. Studie reprodukční toxikologie na zvířatech však prokázaly zvýšenou ztrátu embrya a plodu a strukturální malformace u potomků. Pokud je tento lék užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o možných rizicích pro plod.
Klinické úvahy
Aby se předešlo neúmyslnému podání přípravku CLOMID 25 mg během časného těhotenství, měly by být během každého léčebného cyklu použity vhodné testy ke zjištění, zda dojde k ovulaci a/nebo těhotenství. Pacientky by měly být pečlivě vyšetřeny, aby se mezi každým léčebným cyklem vyloučilo zvětšení ovárií nebo tvorba ovariálních cyst. Další cyklus léčby přípravkem CLOMID by měl být odložen, dokud nebudou tyto stavy vyloučeny.
Lidská data
Dostupné údaje o lidech z epidemiologických studií neukazují žádný zjevný vztah příčiny a účinku mezi perikoncepční expozicí klomifen citrátu a zvýšeným rizikem celkových vrozených vad nebo jakékoli specifické anomálie. Vzhledem k malému počtu případů vrozených anomálií vyskytujících se u žen léčených klomifencitrátem však tyto epidemiologické studie dokázaly pouze vyloučit velké rozdíly v riziku. Studie nezohlednily faktory spojené s ženskou subfertilitou a nebyly schopny se přizpůsobit dalším důležitým faktorům ovlivňujícím plodnost. Dostupné údaje navíc nepodporují zvýšenou míru spontánních potratů u subfertilních žen léčených klomifen citrátem pro indukci ovulace.
Údaje o zvířatech
Perorální podávání klomifen citrátu březím krysám během organogeneze v dávkách 1 až 2 mg/kg/den vedlo k hydramnii a slabým, edematózním plodům se zvlněnými žebry a dalšími dočasnými kostními změnami. Dávky 8 mg/kg/den nebo vyšší také způsobily zvýšenou resorpci a mrtvé plody, dystokii a opožděný porod a 40 mg/kg/den vedly ke zvýšené mateřské úmrtnosti. Jednotlivé dávky 50 mg/kg způsobily fetální kataraktu, zatímco 200 mg/kg způsobily rozštěp patra. Po injekci klomifen citrátu 2 mg/kg myším a potkanům během březosti vykazovalo potomstvo metaplastické změny reprodukčního traktu. U novorozených myší a potkanů, kterým byla injikována během prvních několika dnů života, se také vyvinuly metaplastické změny v děložní a vaginální sliznici, stejně jako předčasné otevření pochvy a anovulační vaječníky. Tyto nálezy jsou podobné abnormálnímu reprodukčnímu chování a sterilitě popsané u jiných estrogenů a antiestrogenů.
králíků byly pozorovány dočasné změny kostí u plodů samic, kterým byly během březosti podávány perorální dávky 20 nebo 40 mg/kg/den, ale ne po dávce 8 mg/kg/den. V těchto studiích nebyly pozorovány žádné trvalé malformace. Také opice rhesus, kterým byly perorálně podávány dávky 1,5 až 4,5 mg/kg/den po různá období během březosti, neměly žádné abnormální potomstvo.
Kojící matky
Není známo, zda se CLOMID vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka, je třeba postupovat opatrně, pokud je CLOMID podáván kojící ženě. U některých pacientů může CLOMID snížit laktaci.
Rakovina vaječníků
Dlouhodobé užívání tablet klomifen citrátu USP může zvýšit riziko hraničního nebo invazivního nádoru vaječníků (viz NEŽÁDOUCÍ REAKCE ).
PŘEDÁVKOVAT
Příznaky a symptomy
Toxické účinky doprovázející akutní předávkování přípravkem CLOMID 50 mg nebyly hlášeny. Známky a příznaky předávkování v důsledku užití větší než doporučené dávky během léčby přípravkem CLOMID 100 mg zahrnují nevolnost, zvracení, vazomotorické návaly, rozmazané vidění, skvrny nebo záblesky, skotomy, zvětšení vaječníků s bolestí pánve nebo břicha. (Vidět KONTRAINDIKACE : Ovariální cysta .)
Orální LD50
Akutní perorální LD50 přípravku CLOMID 25 mg je 1700 mg/kg u myší a 5750 mg/kg u potkanů. Toxická dávka u lidí není známa.
Dialýza
Není známo, zda je CLOMID dialyzovatelný.
Léčba
V případě předávkování je třeba kromě gastrointestinální dekontaminace použít vhodná podpůrná opatření.
KONTRAINDIKACE
Přecitlivělost
CLOMID 100 mg je kontraindikován u pacientů se známou přecitlivělostí nebo alergií na klomifen citrát nebo na některou z jeho složek.
Těhotenství
Použití přípravku CLOMID u těhotných žen je kontraindikováno, protože přípravek CLOMID v této populaci nenabízí žádné výhody.
Dostupné údaje u lidí nenaznačují zvýšené riziko vrozených anomálií, které by převyšovalo riziko základní populace, pokud se používá podle pokynů. Studie reprodukční toxikologie na zvířatech však prokázaly zvýšenou ztrátu embrya a plodu a strukturální malformace u potomků. Pokud je tento lék užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o možných rizicích pro plod. (Vidět OPATŘENÍ : Těhotenství .)
Nemoc jater
Léčba přípravkem CLOMID 25 mg je kontraindikována u pacientů s onemocněním jater nebo s poruchou funkce jater v anamnéze (viz také INDIKACE a NEŽÁDOUCÍ REAKCE ).
Abnormální děložní krvácení
CLOMID 25 mg je kontraindikován u pacientek s abnormálním děložním krvácením nejasného původu (viz INDIKACE ).
Ovariální cysty
CLOMID je kontraindikován u pacientek s ovariálními cystami nebo zvětšením, které není způsobeno syndromem polycystických ovarií (viz INDIKACE a VAROVÁNÍ ).
jiný
CLOMID je kontraindikován u pacientů s nekontrolovanou dysfunkcí štítné žlázy nebo nadledvin nebo v přítomnosti organické intrakraniální léze, jako je nádor hypofýzy (viz INDIKACE ).
KLINICKÁ FARMAKOLOGIE
Akce
CLOMID 25 mg je lék se značnou farmakologickou účinností. Při pečlivém výběru a správné léčbě pacientky se CLOMID 100 mg prokázal jako užitečná terapie pro pacientku s anovulací, která si přeje otěhotnět.
Klomifen citrát je schopen interagovat s tkáněmi obsahujícími estrogenový receptor, včetně hypotalamu, hypofýzy, vaječníků, endometria, vagíny a děložního čípku. Může soutěžit s estrogenem o vazebná místa estrogenových receptorů a může zpomalit doplňování intracelulárních estrogenových receptorů. Klomifen citrát iniciuje sérii endokrinních příhod, které kulminují předovulačním nárůstem gonadotropinů a následnou rupturou folikulu. První endokrinní příhodou v reakci na léčbu klomifenem je zvýšení uvolňování hypofyzárních gonadotropinů. To iniciuje steroidogenezi a folikulogenezi, což má za následek růst ovariálního folikulu a zvýšení cirkulující hladiny estradiolu. Po ovulaci plazmatický progesteron a estradiol stoupají a klesají stejně jako v normálním ovulačním cyklu.
Dostupné údaje naznačují, že jak estrogenní, tak antiestrogenní vlastnosti klomifenu se mohou podílet na zahájení ovulace. Bylo zjištěno, že dva izomery klomifenu mají smíšené estrogenní a antiestrogenní účinky, které se mohou lišit od jednoho druhu k druhému. Některé údaje naznačují, že zuklomifen má větší estrogenní aktivitu než enklomifen.
Klomifen citrát nemá žádné zjevné progestační, androgenní nebo antiandrogenní účinky a nezdá se, že by interferoval s funkcí hypofýzy-nadledvin nebo hypofýzy-štítné žlázy. Ačkoli neexistují žádné důkazy o „přenosovém efektu“ přípravku CLOMID, u některých pacientek po léčbě přípravkem CLOMID 100 mg byly zaznamenány spontánní ovulační menstruace.
Farmakokinetika
Na základě raných studií s klomifencitrátem značeným 14C bylo prokázáno, že lék se u lidí snadno vstřebává orálně a vylučuje se hlavně stolicí. Kumulativní vylučování 14C močí a stolicí bylo po 5 dnech v průměru asi 50 % perorální dávky a 37 % intravenózní dávky. Průměrná exkrece močí byla přibližně 8 % a fekální exkrece přibližně 42 %.
Nějaká značka 14C byla stále přítomna ve výkalech 6 týdnů po podání. Následné studie s jednorázovou dávkou u normálních dobrovolníků ukázaly, že zuklomifen (cis) má delší poločas než enklomifen (trans). Detekovatelné hladiny zuklomifenu přetrvávaly u těchto subjektů déle než měsíc. To může naznačovat stereospecifickou enterohepatální recyklaci nebo sekvestraci zuklomifenu. Je tedy možné, že u žen, které otěhotní v menstruačním cyklu během léčby přípravkem CLOMID, může během časného těhotenství zůstat v těle nějaký aktivní lék.
Klinické studie
Během klinických studií dostalo CLOMID 7 578 pacientek, z nichž některé měly jiné překážky ovulace než ovulační dysfunkce (viz INDIKACE ). V těchto klinických studiích se úspěšná terapie charakterizovaná těhotenstvím objevila u přibližně 30 % těchto pacientek.
Během období klinického hodnocení bylo hlášeno celkem 2635 těhotenství. Z těchto těhotenství byly informace o výsledku k dispozici pouze u 2369 případů. Tabulka 1 shrnuje výsledky těchto případů.
Z hlášených těhotenství byla incidence vícečetných těhotenství 7,98 %: 6,9 % dvojčata, 0,5 % trojčata, 0,3 % čtyřčetná a 0,1 % pětičetná. Ze 165 dvojčetných těhotenství, pro která byly k dispozici dostatečné informace, byl poměr jednovaječných a dvojvaječných dvojčat asi 1:5. Tabulka 1 uvádí míru přežití živě narozených vícečetných dětí.
Po dokončení původních klinických studií byl hlášen porod šestinedělí; žádné z šestinedělí nepřežilo (každé vážilo méně než 400 g), i když každé vypadalo naprosto normálně.
Celkové přežití kojenců z vícečetných těhotenství včetně spontánních potratů, mrtvě narozených dětí a novorozeneckých úmrtí je 73 %.
Fetální/neonatální anomálie a úmrtnost
Následující fetální abnormality byly hlášeny po těhotenství po terapii indukcí ovulace přípravkem CLOMID během klinických studií. Každá z následujících abnormalit plodu byla hlášena v míře
Kromě toho byly během postmarketingového sledování přípravku CLOMID obdrženy zprávy o vrozených anomáliích (viz NEŽÁDOUCÍ REAKCE ).
INFORMACE PRO PACIENTA
Účel a rizika léčby přípravkem CLOMID by měla být pacientovi představena před zahájením léčby. Je třeba zdůraznit, že cílem terapie CLOMID je ovulace pro následné těhotenství. Lékař by měl pacienta poučit se zvláštním ohledem na následující potenciální rizika:
Vizuální příznaky
Upozorněte, že během léčby přípravkem CLOMID nebo krátce po ní se mohou příležitostně objevit rozmazané nebo jiné zrakové příznaky. Pacientovi by mělo být jasné, že v některých případech mohou být poruchy vidění prodloužené a možná ireverzibilní, zejména při zvýšené dávce nebo délce léčby. Varujte, že zrakové příznaky mohou způsobit, že takové činnosti, jako je řízení auta nebo obsluha strojů, jsou nebezpečnější než obvykle, zejména za podmínek proměnlivého osvětlení (viz VAROVÁNÍ ).
Pacient by měl být poučen, aby informoval lékaře, kdykoli se objeví jakékoli neobvyklé zrakové příznaky. Pokud má pacient jakékoli zrakové příznaky, je třeba léčbu přerušit a provést kompletní oftalmologické vyšetření.
Bolest břicha/pánve nebo roztažení
Během léčby přípravkem CLOMID nebo krátce po ní může dojít ke zvětšení vaječníků. Aby se minimalizovalo riziko spojené se zvětšením vaječníků, pacientka by měla být poučena, aby informovala lékaře o jakékoli bolesti břicha nebo pánve, přírůstku hmotnosti, nepohodlí nebo roztažení po užití přípravku CLOMID (viz VAROVÁNÍ ).
Vícečetné těhotenství
Informujte pacientku, že existuje zvýšená pravděpodobnost vícečetného těhotenství, včetně bilaterálního tubárního těhotenství a koexistujícího tubárního a intrauterinního těhotenství, pokud dojde k početí v souvislosti s léčbou přípravkem CLOMID. Je třeba vysvětlit možné komplikace a rizika vícečetného těhotenství.
Spontánní potrat a vrozené anomálie
Informujte pacientku, že dostupné údaje nenaznačují žádné zvýšení četnosti spontánních potratů (potratu) nebo vrozených anomálií při užívání přípravku CLOMID 50 mg matkou ve srovnání s četností v běžné populaci.
Během klinického hodnocení zkušenosti od pacientek se známým výsledkem těhotenství (tabulka 1) ukazují míru spontánních potratů 20,4 % a míru mrtvě narozených 1,0 %. (Vidět Klinické studie ). Mezi porodními anomáliemi spontánně hlášenými jako jednotlivé případy od komerční dostupnosti Clomidu byl podíl defektů neurální trubice vysoký mezi těhotenstvími spojenými s ovulací vyvolanou Clomidem, ale to nebylo podpořeno údaji z populačních studií.
