Fosamax 35mg, 70mg Alendronate Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Fosamax 70 mg a jak se používá?
Fosamax 35 mg je lék na předpis používaný k prevenci a léčbě určitých typů úbytku kostní hmoty (osteoporózy) u dospělých. Fosamax 70 mg lze užívat samostatně nebo s jinými léky.
Fosamax je modifikátor metabolismu vápníku, deriváty bisfosfonátů.
Není známo, zda je přípravek Fosamax bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Fosamax?
Fosamax může způsobit závažné nežádoucí účinky včetně:
- bolest na hrudi
- nové nebo zhoršující se pálení žáhy
- bolest nebo pálení pod žebry nebo v zádech
- těžké pálení žáhy
- pálivá bolest v horní části žaludku nebo vykašlávání krve
- nová nebo neobvyklá bolest ve stehně nebo kyčli
- bolest čelisti
- necitlivost
- otok
- silná bolest kloubů, kostí nebo svalů
- svalové křeče nebo křeče
- pocit necitlivosti nebo brnění kolem úst nebo prstů na rukou nebo nohou
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Fosamax patří:
- pálení žáhy
- žaludeční nevolnost
- bolest břicha
- nevolnost
- průjem
- zácpa
- bolest kostí
- bolest svalů
- bolest kloubů
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Fosamax. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
FOSAMAX (alendronát sodný) je bisfosfonát, který působí jako specifický inhibitor kostní resorpce zprostředkované osteoklasty. Bisfosfonáty jsou syntetické analogy pyrofosfátu, které se vážou na hydroxyapatit nacházející se v kosti.
Alendronát sodný je chemicky popsán jako trihydrát monosodné soli kyseliny (4-amino-1-hydroxybutyliden)bisfosfonové.
Empirický vzorec alendronátu sodného je C4H12NNaO7P2 •3H2O a jeho hmotnost vzorce je 325,12. Strukturní vzorec je:
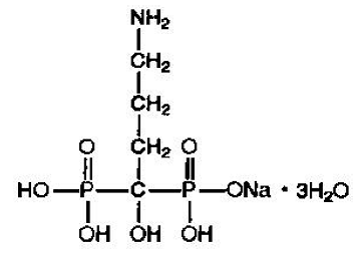
Alendronát sodný je bílý krystalický nehygroskopický prášek. Je rozpustný ve vodě, velmi málo rozpustný v alkoholu a prakticky nerozpustný v chloroformu.
FOSAMAX 70 mg tablety pro perorální podání obsahují 91,37 mg trihydrátu sodné soli alendronátu, což je molární ekvivalent 70 mg volné kyseliny, a následující neúčinné složky: mikrokrystalická celulóza, bezvodá laktóza, sodná sůl kroskarmelózy a stearát hořečnatý.
INDIKACE
Léčba® osteoporózy u žen po menopauze
FOSAMAX je indikován k léčbě osteoporózy u žen po menopauze. U žen po menopauze zvyšuje FOSAMAX 70 mg kostní hmotu a snižuje výskyt zlomenin, včetně zlomenin kyčle a páteře (kompresivní zlomeniny obratlů). [Vidět Klinické studie ]
Prevence osteoporózy u žen po menopauze
FOSAMAX 70 mg je indikován k prevenci postmenopauzální osteoporózy [viz Klinické studie ].
Léčba ke zvýšení kostní hmoty u mužů s osteoporózou
FOSAMAX je indikován k léčbě zvýšení kostní hmoty u mužů s osteoporózou [viz Klinické studie ].
Léčba glukokortikoidy indukované osteoporózy
FOSAMAX je indikován k léčbě glukokortikoidy indukované osteoporózy u mužů a žen užívajících glukokortikoidy v denní dávce ekvivalentní 7,5 mg nebo vyšší prednisonu a kteří mají nízkou hustotu kostních minerálů (viz Klinické studie ].
Léčba Pagetovy choroby kostí
FOSAMAX 35 mg je indikován k léčbě Pagetovy kostní choroby u mužů a žen. Léčba je indikována u pacientů s Pagetovou kostní chorobou, kteří mají alkalickou fosfatázu alespoň dvojnásobek horní hranice normálu, nebo u pacientů se symptomy nebo u pacientů s rizikem budoucích komplikací jejich onemocnění. [Vidět Klinické studie ]
Důležitá omezení použití
Optimální doba užívání nebyla stanovena. Bezpečnost a účinnost přípravku FOSAMAX při léčbě osteoporózy je založena na klinických údajích trvajících čtyři roky. U všech pacientů na léčbě bisfosfonáty by měla být pravidelně přehodnocována potřeba pokračování v léčbě. U pacientů s nízkým rizikem zlomeniny by se mělo zvážit vysazení léku po 3 až 5 letech užívání. U pacientů, kteří přeruší léčbu, by mělo být riziko zlomenin pravidelně přehodnocováno.
DÁVKOVÁNÍ A PODÁVÁNÍ
Přestože jsou na trhu dostupné tablety alendronátu 5 mg, 10 mg, 35 mg a 40 mg, FOSAMAX 35 mg již není na trhu v síle 5 mg, 10 mg, 35 mg a 40 mg.
Ačkoli může být na trhu dostupný perorální roztok alendronátu, perorální roztok FOSAMAX 35 mg již není na trhu.
Léčba Osteoporózy U žen po menopauze
Doporučené dávkování je:
- jedna 70 mg tableta jednou týdně nebo
- jedna lahvička 70 mg perorálního roztoku jednou týdně nebo
- jedna 10mg tableta jednou denně
Prevence osteoporózy u žen po menopauze
Doporučené dávkování je:
- jedna 35 mg tableta jednou týdně nebo
- jedna 5 mg tableta jednou denně
Léčba ke zvýšení kostní hmoty u mužů s osteoporózou
Doporučené dávkování je:
- jedna 70 mg tableta jednou týdně nebo
- jedna lahvička 70 mg perorálního roztoku jednou týdně nebo
- jedna 10mg tableta jednou denně
Léčba glukokortikoidy indukované osteoporózy
Doporučená dávka je jedna 5 mg tableta jednou denně, s výjimkou postmenopauzálních žen, které nedostávají estrogen, pro které je doporučená dávka jedna 10 mg tableta jednou denně.
Léčba Pagetovy choroby kostí
Doporučený léčebný režim je 40 mg jednou denně po dobu šesti měsíců.
Opakovaná léčba Pagetovy choroby
Opakovaná léčba přípravkem FOSAMAX 35 mg může být zvážena po šestiměsíčním období hodnocení po léčbě u pacientů, u kterých došlo k relapsu, na základě zvýšení sérové alkalické fosfatázy, které by mělo být pravidelně měřeno. Opakovaná léčba může být také zvážena u těch, kterým se nepodařilo normalizovat sérovou alkalickou fosfatázu.
Důležité pokyny pro administraci
Poučte pacienty, aby udělali následující:
- Užívejte FOSAMAX alespoň půl hodiny před prvním jídlem, nápojem nebo lékem dne pouze s čistou vodou [viz Informace pro pacienty ]. Jiné nápoje (včetně minerální vody), jídlo a některé léky pravděpodobně snižují absorpci přípravku FOSAMAX [viz DROGOVÉ INTERAKCE ]. Čekání kratší než 30 minut nebo užívání přípravku FOSAMAX 70 mg s jídlem, nápoji (jinými než čistá voda) nebo jinými léky sníží účinek přípravku FOSAMAX 70 mg snížením jeho vstřebávání do těla.
- Užijte FOSAMAX, jakmile vstanete. Pro usnadnění dodání do žaludku a tím snížení možnosti podráždění jícnu je třeba tabletu FOSAMAX 35 mg spolknout a zapít plnou sklenicí vody (6–8 uncí). K usnadnění vyprazdňování žaludku FOSAMAX 70 mg perorální roztok by měl následovat alespoň 2 unce (čtvrt šálku) vody. Pacienti by si neměli lehnout po dobu alespoň 30 minut a do doby po prvním denním jídle. FOSAMAX by se neměl užívat před spaním nebo před denním vstáváním. Nedodržení těchto pokynů může zvýšit riziko nežádoucích účinků jícnu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Informace pro pacienty ].
Doporučení pro suplementaci vápníkem a vitaminem D
Poučte pacienty, aby užívali doplňkový vápník, pokud je dietní příjem nedostatečný [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pacienti se zvýšeným rizikem nedostatku vitaminu D (např. starší 70 let, hospitalizovaní v pečovatelském domě nebo chronicky nemocní) mohou potřebovat suplementaci vitaminu D. Pacienti s gastrointestinálními malabsorpčními syndromy mohou vyžadovat suplementaci vyššími dávkami vitaminu D a je třeba zvážit měření 25-hydroxyvitaminu D.
Pacienti léčení glukokortikoidy by měli dostávat dostatečné množství vápníku a vitamínu D.
Pokyny pro podání pro vynechané dávky
Pokud vynecháte dávku přípravku FOSAMAX jednou týdně, poučte pacienty, aby užili jednu dávku ráno poté, co si vzpomenou. Neměli by užívat dvě dávky ve stejný den, ale měli by se vrátit k užívání jedné dávky jednou týdně, jak bylo původně plánováno ve zvolený den.
JAK DODÁVÁNO
Dávkové formy A Síly
- 70 mg tablety jsou bílé, oválné, nepotahované tablety s kódem 31 na jedné straně a obrysem kosti na druhé straně.
Skladování A Manipulace
Č. 3814 - FOSAMAX tablety, 70 mg, jsou bílé, oválné, nepotahované tablety s kódem 31 na jedné straně a obrysem kosti na druhé straně:
NDC 0006-0031-44 jedno použití blistrové balení po 4 ks.
Úložný prostor
Tablety FOSAMAX
Skladujte v dobře uzavřené nádobě při pokojové teplotě, 15-30°C (59-86°F).
Distribuuje: Merck Sharp & Dohme Corp., dceřiná společnost MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revize: srpen 2019
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Léčba Osteoporózy U žen po menopauze
Denní dávkování
Bezpečnost přípravku FOSAMAX 35 mg při léčbě postmenopauzální osteoporózy byla hodnocena ve čtyřech klinických studiích, do kterých bylo zařazeno 7453 žen ve věku 44-84 let. Studie 1 a studie 2 byly identicky navrženy, tříleté, placebem kontrolované, dvojitě zaslepené, multicentrické studie (Spojené státy americké a nadnárodní n=994); Studie 3 byla tříletá kohorta vertebrálních zlomenin ve studii FIT (Fracture Intervention Trial) (n=2027) a Studie 4 byla čtyřletá kohorta FIT s klinickými zlomeninami (n=4432). Celkově bylo 3620 pacientů vystaveno placebu a 3432 pacientů vystaveno přípravku FOSAMAX. Do těchto klinických studií byli zahrnuti pacienti s již existujícím gastrointestinálním onemocněním a souběžným užíváním nesteroidních protizánětlivých léků. Ve studii 1 a studii 2 všechny ženy dostávaly 500 mg elementárního vápníku ve formě uhličitanu. Ve studii 3 a studii 4 všechny ženy s příjmem vápníku ve stravě nižším než 1000 mg denně dostávaly 500 mg vápníku a 250 mezinárodních jednotek vitamínu D denně.
Mezi pacientkami léčenými alendronátem 10 mg nebo placebem ve studii 1 a studii 2 a mezi všemi pacienty ve studii 3 a studii 4 byla incidence mortality ze všech příčin 1,8 % ve skupině s placebem a 1,8 % ve skupině s FOSAMAX 35 mg. Incidence závažných nežádoucích účinků byla 30,7 % ve skupině s placebem a 30,9 % ve skupině s přípravkem FOSAMAX. Procento pacientů, kteří přerušili studii z důvodu jakéhokoli klinického nežádoucího účinku, bylo 9,5 % ve skupině s placebem a 8,9 % ve skupině s přípravkem FOSAMAX 70 mg. Nežádoucí reakce z těchto studií, které výzkumníci považovali za možná, pravděpodobně nebo určitě související s lékem u více než nebo rovného 1 % pacientů léčených buď FOSAMAX 35 mg nebo placebem, jsou uvedeny v tabulce 1.
Objevila se vyrážka a erytém.
Gastrointestinální nežádoucí účinky
jednoho pacienta léčeného přípravkem FOSAMAX (10 mg/den), který měl v anamnéze peptický vřed a gastrektomii a který současně užíval aspirin, se vyvinul anastomotický vřed s mírným krvácením, což bylo považováno za související s užíváním léků. Aspirin a FOSAMAX byly vysazeny a pacient se uzdravil. V populacích Studie 1 a Studie 2 mělo 49–54 % v anamnéze gastrointestinální poruchy na začátku studie a 54–89 % užívalo nesteroidní protizánětlivé léky nebo aspirin někdy během studií. [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Výsledky laboratorních testů
Ve dvojitě zaslepených, multicentrických, kontrolovaných studiích bylo pozorováno asymptomatické, mírné a přechodné snížení sérového vápníku a fosfátu přibližně u 18 % a 10 % pacientů užívajících FOSAMAX oproti přibližně 12 % a 3 % pacientů užívajících placebo. Incidence snížení sérového vápníku na méně než 8,0 mg/dl (2,0 mM) a sérového fosfátu na méně než nebo rovnou 2,0 mg/dl (0,65 mM) byly v obou léčebných skupinách podobné.
Týdenní dávkování
Bezpečnost FOSAMAXu 70 mg jednou týdně pro léčbu postmenopauzální osteoporózy byla hodnocena v jednoleté, dvojitě zaslepené, multicentrické studii srovnávající FOSAMAX 70 mg jednou týdně a FOSAMAX 10 mg denně. Celkové profily bezpečnosti a snášenlivosti FOSAMAX 70 mg a FOSAMAX 10 mg denně jednou týdně byly podobné. Nežádoucí účinky považované zkoušejícími za možná, pravděpodobně nebo určitě související s lékem u více než nebo rovné 1 % pacientů v kterékoli z léčebných skupin jsou uvedeny v tabulce 2.
Prevence osteoporózy u žen po menopauze
Denní dávkování
Bezpečnost přípravku FOSAMAX 5 mg/den u postmenopauzálních žen ve věku 40-60 let byla hodnocena ve třech dvojitě zaslepených, placebem kontrolovaných studiích zahrnujících více než 1 400 pacientek randomizovaných k léčbě přípravkem FOSAMAX po dobu dvou nebo tří let. V těchto studiích byly celkové bezpečnostní profily přípravku FOSAMAX 5 mg/den a placeba podobné. K přerušení léčby z důvodu jakéhokoli klinického nežádoucího účinku došlo u 7,5 % z 642 pacientů léčených přípravkem FOSAMAX 5 mg/den a u 5,7 % z 648 pacientů léčených placebem.
Týdenní dávkování
Bezpečnost FOSAMAXu 35 mg jednou týdně ve srovnání s FOSAMAXEM 5 mg denně byla hodnocena v jednoleté, dvojitě zaslepené, multicentrické studii se 723 pacienty. Celkové profily bezpečnosti a snášenlivosti FOSAMAX 35 mg a FOSAMAX 5 mg denně byly podobné.
Nežádoucí účinky z těchto studií, které zkoušející považovali za možná, pravděpodobně nebo určitě související s lékem u více než nebo rovného 1 % pacientů léčených buď jednou týdně FOSAMAX 35 mg, FOSAMAX 5 mg/den nebo placebem, jsou uvedeny v tabulce 3 .
Současné užívání s estrogenovou/hormonální substituční terapií
Ve dvou studiích (trvajících jeden a dva roky) u postmenopauzálních žen s osteoporózou (celkem: n=853) byl profil bezpečnosti a snášenlivosti kombinované léčby přípravkem FOSAMAX 10 mg jednou denně a estrogenem ± progestinem (n=354) v souladu s těmi u jednotlivých ošetření.
Osteoporóza u mužů
Ve dvou placebem kontrolovaných, dvojitě zaslepených, multicentrických studiích u mužů (dvouletá studie FOSAMAX 10 mg/den a jednoletá studie FOSAMAX 70 mg jednou týdně) četnost přerušení léčby z důvodu jakéhokoli klinického nežádoucího účinku příhod byly 2,7 % pro FOSAMAX 10 mg/den vs. 10,5 % pro placebo a 6,4 % pro FOSAMAX 70 mg jednou týdně vs. 8,6 % pro placebo. Nežádoucí účinky považované zkoušejícími za možná, pravděpodobně nebo určitě související s lékem u více než nebo rovných 2 % pacientů léčených buď přípravkem FOSAMAX 70 mg nebo placebem jsou uvedeny v tabulce 4.
Osteoporóza indukovaná glukokortikoidy
Ve dvou, jednoletých, placebem kontrolovaných, dvojitě zaslepených, multicentrických studiích u pacientů léčených glukokortikoidy byly profily celkové bezpečnosti a snášenlivosti přípravku FOSAMAX 5 a 10 mg/den obecně podobné jako u placeba. Nežádoucí účinky považované zkoušejícími za možná, pravděpodobně nebo určitě související s lékem u více než nebo rovného 1 % pacientů léčených buď přípravkem FOSAMAX 5 nebo 10 mg/den nebo placebem jsou uvedeny v tabulce 5.
Celkový profil bezpečnosti a snášenlivosti u populace s osteoporózou vyvolanou glukokortikoidy, která pokračovala v léčbě po druhý rok studií (FOSAMAX: n=147), byl v souladu s profilem pozorovaným v prvním roce.
Pagetova kostní choroba
klinických studiích (osteoporóza a Pagetova choroba) byly nežádoucí účinky hlášené u 175 pacientek užívajících FOSAMAX 40 mg/den po dobu 3-12 měsíců podobné jako u žen po menopauze léčených FOSAMAXem 10 mg/den. U pacientů užívajících FOSAMAX 40 mg/den byl však zjevně zvýšený výskyt nežádoucích reakcí v horní části gastrointestinálního traktu (17,7 % FOSAMAX vs. 10,2 % placebo). Jeden případ ezofagitidy a dva případy gastritidy vedly k přerušení léčby.
Navíc muskuloskeletální bolest (kostí, svalů nebo kloubů), která byla popsána u pacientů s Pagetovou chorobou léčených jinými bisfosfonáty, byla vyšetřovateli považována za možná, pravděpodobně nebo určitě související s lékem u přibližně 6 % pacientů. léčených přípravkem FOSAMAX 40 mg/den oproti přibližně 1 % pacientů léčených placebem, ale vzácně vedlo k přerušení léčby. K přerušení léčby z důvodu jakýchkoli klinických nežádoucích účinků došlo u 6,4 % pacientů s Pagetovou chorobou léčených přípravkem FOSAMAX 40 mg/den a u 2,4 % pacientů léčených placebem.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku FOSAMAX po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo jako celek: hypersenzitivní reakce včetně kopřivky a angioedému. U přípravku FOSAMAX byly hlášeny přechodné příznaky myalgie, malátnosti, astenie a horečky, typicky v souvislosti se zahájením léčby. Vyskytla se symptomatická hypokalcémie, obvykle ve spojení s predisponujícími stavy. Periferní edém.
Gastrointestinální: ezofagitida, eroze jícnu, vředy jícnu, striktura nebo perforace jícnu a orofaryngeální ulcerace. Byly také hlášeny žaludeční nebo dvanáctníkové vředy, některé závažné a s komplikacemi [viz DÁVKOVÁNÍ A PODÁVÁNÍ ; VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Byla hlášena lokalizovaná osteonekróza čelisti, obecně spojená s extrakcí zubu a/nebo lokální infekcí s opožděným hojením (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Muskuloskeletální: bolest kostí, kloubů a/nebo svalů, občas těžká a zneschopňující [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]; otoky kloubů; nízkoenergetické diafýzy femuru a subtrochanterické zlomeniny [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nervový systém: závratě a vertigo.
Plicní: akutní exacerbace astmatu.
Kůže: vyrážka (občas s fotosenzitivitou), pruritus, alopecie, závažné kožní reakce, včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy.
Speciální smysly: uveitida, skleritida nebo episkleritida. Cholesteatom zevního zvukovodu (fokální osteonekróza).
DROGOVÉ INTERAKCE
Doplňky vápníku/antacida
Současné podávání přípravku FOSAMAX a vápníku, antacidů nebo perorálních léků obsahujících multivalentní kationty naruší absorpci přípravku FOSAMAX. Proto poučte pacienty, aby po užití přípravku FOSAMAX 35 mg počkali alespoň půl hodiny, než začnou užívat jakékoli jiné perorální léky.
Aspirin
V klinických studiích byla incidence nežádoucích účinků v horní části gastrointestinálního traktu zvýšena u pacientů, kteří dostávali souběžnou léčbu s denními dávkami FOSAMAX 35 mg vyššími než 10 mg a přípravky obsahujícími aspirin.
Nesteroidní protizánětlivé léky
FOSAMAX 35 mg lze podávat pacientům užívajícím nesteroidní protizánětlivé léky (NSAID). V 3leté, kontrolované klinické studii (n=2027), během níž většina pacientů současně užívala NSAID, byla incidence nežádoucích účinků v horní části gastrointestinálního traktu podobná u pacientů užívajících FOSAMAX 5 nebo 10 mg/den ve srovnání s těmi, kteří užívali placebo. Vzhledem k tomu, že užívání NSAID je spojeno s podrážděním gastrointestinálního traktu, je třeba při současném užívání s přípravkem FOSAMAX postupovat opatrně.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Nežádoucí reakce horní části gastrointestinálního traktu
FOSAMAX 35 mg, stejně jako jiné bisfosfonáty podávané perorálně, může způsobit lokální podráždění sliznice horní části gastrointestinálního traktu. Vzhledem k těmto možným dráždivým účinkům a možnému zhoršení základního onemocnění je třeba opatrnosti, pokud se FOSAMAX podává pacientům s aktivními problémy horního gastrointestinálního traktu (jako je známý Barrettův jícen, dysfagie, jiná onemocnění jícnu, gastritida, duodenitida nebo vředy).
pacientů léčených perorálními bisfosfonáty včetně přípravku FOSAMAX byly hlášeny nežádoucí účinky jícnu, jako je ezofagitida, vředy jícnu a eroze jícnu, občas s krvácením a vzácně následované strikturou nebo perforací jícnu. V některých případech byly závažné a vyžadovaly hospitalizaci. Lékaři by proto měli věnovat pozornost jakýmkoli známkám nebo příznakům signalizujícím možnou reakci jícnu a pacienty je třeba poučit, aby přerušili léčbu přípravkem FOSAMAX 70 mg a vyhledali lékařskou pomoc, pokud se u nich rozvine dysfagie, odynofagie, retrosternální bolest nebo nové nebo se zhorší pálení žáhy.
Zdá se, že riziko závažných nežádoucích účinků na jícnu je vyšší u pacientů, kteří po užití perorálních bisfosfonátů včetně FOSAMAX 70 mg ulehnou a/nebo kteří nedokážou spolknout perorální bisfosfonáty včetně FOSAMAX 35 mg s doporučenou plnou sklenicí (6-8 uncí) vody, a /nebo kteří pokračují v užívání perorálních bisfosfonátů včetně přípravku FOSAMAX 70 mg poté, co se rozvinou příznaky naznačující podráždění jícnu. Proto je velmi důležité, aby byly pacientovi poskytnuty úplné pokyny k dávkování a aby je pochopil [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. U pacientů, kteří kvůli mentálnímu postižení nemohou dodržovat pokyny k dávkování, by měla být léčba přípravkem FOSAMAX používána pod příslušným dohledem.
Po uvedení na trh byly hlášeny žaludeční a duodenální vředy při perorálním užívání bisfosfonátů, některé závažné a s komplikacemi, ačkoli v kontrolovaných klinických studiích nebylo pozorováno žádné zvýšené riziko (viz NEŽÁDOUCÍ REAKCE ].
Metabolismus minerálů
Před zahájením léčby přípravkem FOSAMAX je nutné upravit hypokalcémii (viz KONTRAINDIKACE ]. Jiné poruchy ovlivňující metabolismus minerálů (jako je nedostatek vitaminu D) by měly být také účinně léčeny. U pacientů s těmito stavy je třeba během léčby přípravkem FOSAMAX sledovat sérový vápník a příznaky hypokalcémie.
Pravděpodobně kvůli účinkům FOSAMAXu na zvýšení kostního minerálu může dojít k malému asymptomatickému poklesu sérového vápníku a fosfátu, zejména u pacientů s Pagetovou chorobou, u kterých může být rychlost kostního obratu před léčbou výrazně zvýšena, a pacientů užívajících glukokortikoidy, u kterých může být snížena absorpce vápníku.
Zajištění dostatečného příjmu vápníku a vitamínu D je zvláště důležité u pacientů s Pagetovou kostní chorobou au pacientů užívajících glukokortikoidy.
Muskuloskeletální bolest
Po uvedení na trh byly u pacientů užívajících bisfosfonáty, které jsou schváleny pro prevenci a léčbu osteoporózy, hlášeny závažné a příležitostně zneschopňující bolesti kostí, kloubů a/nebo svalů (viz NEŽÁDOUCÍ REAKCE ]. Tato kategorie léků zahrnuje FOSAMAX (alendronát). Většina pacientek byly ženy po menopauze. Doba do nástupu příznaků se pohybovala od jednoho dne do několika měsíců po zahájení léčby. Pokud se objeví závažné příznaky, přestaňte používat. U většiny pacientů došlo po ukončení léčby k úlevě od příznaků. Podskupina měla recidivu symptomů, když byla znovu aplikována stejným lékem nebo jiným bisfosfonátem.
V placebem kontrolovaných klinických studiích s FOSAMAXem byla procenta pacientů s těmito příznaky podobná ve skupinách s FOSAMAX 35 mg a placebem.
Osteonekróza čelisti
Osteonekróza čelisti (ONJ), která se může objevit spontánně, je obecně spojena s extrakcí zubu a/nebo lokální infekcí s opožděným hojením a byla hlášena u pacientů užívajících bisfosfonáty, včetně přípravku FOSAMAX. Známé rizikové faktory pro osteonekrózu čelisti zahrnují invazivní stomatologické výkony (např. extrakce zubů, zubní implantáty, operace kostí), diagnostika rakoviny, souběžné terapie (např. chemoterapie, kortikosteroidy, inhibitory angiogeneze), špatná ústní hygiena a souběžné onemocnění poruchy (např. periodontální a/nebo jiné již existující zubní onemocnění, anémie, koagulopatie, infekce, špatně padnoucí zubní protézy). Riziko ONJ se může zvyšovat s délkou expozice bisfosfonátům.
U pacientů vyžadujících invazivní stomatologické výkony může přerušení léčby bisfosfonáty snížit riziko ONJ. Plán léčby každého pacienta by se měl řídit klinickým úsudkem ošetřujícího lékaře a/nebo orálního chirurga na základě individuálního posouzení přínosu/rizika.
Pacientům, u kterých se během léčby bisfosfonáty rozvine osteonekróza čelisti, by měl být poskytnut péče orálního chirurga. U těchto pacientů může rozsáhlá stomatologická chirurgie k léčbě ONJ zhoršit stav. Přerušení léčby bisfosfonáty by mělo být zváženo na základě individuálního zhodnocení přínosu/rizika.
Atypické subtrochanterické a diafyzární zlomeniny stehenní kosti
U pacientů léčených bisfosfonáty byly hlášeny atypické, nízkoenergetické nebo nízkotraumatické zlomeniny diafýzy femuru. Tyto zlomeniny se mohou vyskytnout kdekoli v diafýze femuru od těsně pod malým trochanterem až nad suprakondylickou laloku a jsou příčné nebo krátké šikmé orientace bez známek rozdrobení. Kauzalita nebyla stanovena, protože tyto zlomeniny se vyskytují také u pacientů s osteoporózou, kteří nebyli léčeni bisfosfonáty.
Atypické zlomeniny femuru se nejčastěji vyskytují s minimálním nebo žádným traumatem postižené oblasti. Mohou být oboustranné a mnoho pacientů uvádí prodromální bolest v postižené oblasti, která se obvykle projevuje jako tupá, bolestivá bolest stehna týdny až měsíce před tím, než dojde ke kompletní zlomenině. Řada zpráv uvádí, že pacienti byli v době zlomeniny také léčeni glukokortikoidy (např. prednisonem).
U každého pacienta s anamnézou expozice bisfosfonátům, který má bolesti stehna nebo třísla, by mělo být podezření na atypickou zlomeninu a měl by být vyšetřen, aby se vyloučila neúplná zlomenina stehenní kosti. Pacienti s atypickou zlomeninou by měli být také vyšetřeni na symptomy a známky zlomeniny na kontralaterální končetině. Je třeba zvážit přerušení léčby bisfosfonáty, dokud nebude zhodnoceno riziko/přínos, na individuálním základě.
Renální poškození
FOSAMAX 35 mg se nedoporučuje u pacientů s clearance kreatininu nižší než 35 ml/min.
Osteoporóza indukovaná glukokortikoidy
Riziko versus přínos FOSAMAXu pro léčbu při denních dávkách glukokortikoidů nižších než 7,5 mg prednisonu nebo ekvivalentu nebylo stanoveno (viz INDIKACE A POUŽITÍ ]. Před zahájením léčby je třeba u mužů i žen zjistit hormonální stav gonád a zvážit vhodnou náhradu.
Měření kostní denzity by mělo být provedeno na začátku léčby a opakováno po 6 až 12 měsících kombinované léčby přípravkem FOSAMAX a glukokortikoidy.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Poučte pacienty, aby si před zahájením léčby přípravkem FOSAMAX přečetli Průvodce léčivými přípravky a aby si jej znovu přečetli při každém obnovení předpisu.
Doporučení pro osteoporózu, včetně suplementace vápníkem a vitaminem D
Poučte pacienty, aby užívali doplňkově vápník a vitamín D, pokud je denní příjem stravy nedostatečný. Cvičení se zátěží by mělo být zváženo spolu s úpravou určitých faktorů chování, jako je kouření cigaret a/nebo nadměrná konzumace alkoholu, pokud tyto faktory existují.
Pokyny pro dávkování
Poučte pacienty, že očekávaného přínosu přípravku FOSAMAX 70 mg lze dosáhnout pouze tehdy, když se zapíjí čistou vodou hned po vstávání v daný den alespoň 30 minut před prvním denním jídlem, nápojem nebo lékem. Ukázalo se, že i dávkování pomerančového džusu nebo kávy výrazně snižuje vstřebávání FOSAMAXu [viz KLINICKÁ FARMAKOLOGIE ].
Poučte pacienty, aby tabletu nežvýkali ani necucali kvůli možné orofaryngeální ulceraci.
Poučte pacienty, aby spolkli každou tabletu přípravku FOSAMAX s plnou sklenicí vody (6-8 uncí), aby se usnadnilo dodání do žaludku a snížilo se tak možné podráždění jícnu. Poučte pacienty, aby po užití perorálního roztoku FOSAMAX 70 mg vypili alespoň 2 unce (čtvrt šálku) vody, aby se usnadnilo vyprazdňování žaludku.
Poučte pacienty, aby neleželi po dobu alespoň 30 minut a do doby po prvním denním jídle.
Poučte pacienty, aby neužívali FOSAMAX před spaním nebo před tím, než vstanete. Pacienti by měli být informováni, že nedodržení těchto pokynů může zvýšit jejich riziko problémů s jícnem.
Poučte pacienty, že pokud se u nich objeví příznaky onemocnění jícnu (jako jsou potíže nebo bolest při polykání, retrosternální bolest nebo nové nebo zhoršující se pálení žáhy), měli by přestat užívat FOSAMAX a poradit se se svým lékařem.
Pokud pacienti vynechají dávku FOSAMAX 70 mg jednou týdně, poučte je, aby si vzali jednu dávku ráno poté, co si vzpomenou. Neměli by užívat dvě dávky ve stejný den, ale měli by se vrátit k užívání jedné dávky jednou týdně, jak bylo původně plánováno ve zvolený den.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
92týdenní studii karcinogenity po perorálním podání při dávkách alendronátu 1, 3 a 10 mg/kg/ došlo ke zvýšení adenomů harderovské žlázy (retroorbitální žláza, která se u lidí nevyskytuje) u samic myší s vysokou dávkou (p=0,003). den (muži) nebo 1, 2 a 5 mg/kg/den (ženy). Tyto dávky jsou ekvivalentní přibližně 0,1 až 1násobku nejvyšší doporučené klinické denní dávky 40 mg na základě plochy povrchu, mg/m². Význam tohoto zjištění pro člověka není znám.
Adenomy parafolikulárních buněk (štítné žlázy) byly zvýšeny u samců potkanů s vysokou dávkou (p=0,003) ve dvouleté studii karcinogenity při perorálním podávání v dávkách 1 a 3,75 mg/kg tělesné hmotnosti. Tyto dávky jsou ekvivalentní přibližně 0,3 a 1násobku klinické denní dávky 40 mg na základě plochy povrchu, mg/m². Význam tohoto zjištění pro člověka není znám.
Alendronát nebyl genotoxický ve zkoušce mikrobiální mutageneze in vitro s metabolickou aktivací a bez ní, v in vitro zkoušce mutageneze savčích buněk, v in vitro alkalickém elučním testu na potkaních hepatocytech a v in vivo zkoušce chromozomálních aberací u myší. V in vitro testu chromozomálních aberací v buňkách vaječníků čínského křečka však alendronát poskytl nejednoznačné výsledky.
Alendronát neměl žádný vliv na fertilitu (samců nebo samic) u potkanů v perorálních dávkách až do 5 mg/kg/den (přibližně 1násobek klinické denní dávky 40 mg na základě plochy povrchu, mg/m²).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje o použití přípravku FOSAMAX u těhotných žen nejsou dostatečné k tomu, aby informovaly o riziku spojeném s užíváním léků pro nepříznivé důsledky pro matku nebo plod. Po zjištění těhotenství přerušte podávání FOSAMAX 35 mg.
reprodukčních studiích na zvířatech denní perorální podávání alendronátu potkanům od doby před pářením do konce březosti nebo laktace prokázalo snížené postimplantační přežití a snížený přírůstek tělesné hmotnosti mláďat počínaje dávkami ekvivalentními méně než polovině nejvyšší doporučené klinické denní dávky 40 mg ( na základě tělesného povrchu, mg/m²). Perorální podávání alendronátu potkanům během organogeneze vedlo ke snížené osifikaci plodu počínaje dávkami 3krát vyššími, než je klinická denní dávka 40 mg. Žádné podobné účinky na plod nebyly pozorovány u březích králíků, kterým byly perorálně podávány dávky během organogeneze v dávkách odpovídajících přibližně 10násobku klinické denní dávky 40 mg.
U potkanů při perorálních dávkách tak nízkých, jako je jedna desetina klinické denní dávky 40 mg, došlo k opožděnému nebo neúspěšnému porodu potomků, protrahovanému porodu a úmrtím matek a plodů v pozdním stádiu březosti v důsledku hypokalcémie matek (viz Data ).
Bisfosfonáty jsou zabudovány do kostní matrice, ze které se v průběhu let postupně uvolňují. Množství bisfosfonátu začleněného do dospělé kosti a dostupného pro uvolnění do systémové cirkulace přímo souvisí s dávkou a délkou užívání bisfosfonátů. V důsledku toho, na základě mechanismu účinku bisfosfonátů, existuje potenciální riziko poškození plodu, převážně skeletálního, pokud žena otěhotní po ukončení léčby bisfosfonáty. Dopad proměnných, jako je doba mezi ukončením léčby bisfosfonáty do početí, konkrétní použitý bisfosfonát a způsob podání (intravenózní versus perorální) na riziko nebyl studován.
Odhadované základní riziko závažných vrozených vad a potratu pro uvedenou populaci (populace) není známo. Všechna těhotenství mají na pozadí riziko vrozených vad, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Data
Údaje o zvířatech
Reprodukční studie u potkanů, kterým byly perorálně podávány dávky před pářením do konce březosti nebo laktace, ukázaly snížené postimplantační přežití počínaje dávkou 2 mg/kg/den a snížený přírůstek tělesné hmotnosti počínaje dávkou 1 mg/kg/den, což jsou dávky odpovídající méně než polovině 40 mg klinické denní dávky založené na tělesném povrchu, mg/m². Incidence neúplné fetální osifikace v obratlech, lebce a sternebrálních kostech byla zvýšena u potkanů, kterým byla podávána perorální dávka během organogeneze počínaje dávkou 10 mg/kg/den (přibližně trojnásobek klinické denní dávky 40 mg). Žádné podobné účinky na plod nebyly pozorovány u březích králíků, kterým byly perorálně během organogeneze podávány dávky až 35 mg/kg/den (což odpovídá přibližně 10násobku klinické denní dávky 40 mg).
Celkový i ionizovaný vápník se u březích potkaních samic, kterým byla perorálně podávána dávka 15 mg/kg/den alendronátu (přibližně 4násobek klinické denní dávky 40 mg), snížil, což vedlo ke zpoždění a selhání porodu. Prodloužený porod v důsledku mateřské hypokalcémie byl pozorován, když byly potkany léčeny od doby před pářením až do březosti počínaje dávkou 0,5 mg/kg/den (přibližně jedna desetina klinické denní dávky 40 mg). Maternotoxicita (úmrtí v pozdních březích) se také vyskytla u samic potkanů, kterým byla perorálně podávána dávka 15 mg/kg/den (přibližně 4násobek klinické denní dávky 40 mg) po různá gestační období. Tato úmrtí matek byla snížena, ale nebyla odstraněna ukončením léčby. Suplementace vápníku v pitné vodě nebo subkutánní minipumpou potkanům, kterým byl perorálně podáván alendronát v dávce 15 mg/kg/den, nemohla zmírnit hypokalcémii ani zabránit úmrtí matek a novorozenců souvisejících s dystokií. Intravenózní suplementace vápníkem však zabránila úmrtí matek, nikoli však novorozeneckých úmrtí.
Laktace
Shrnutí rizik
Není známo, zda je alendronát přítomen v mateřském mléce u lidí, zda ovlivňuje tvorbu mateřského mléka nebo má účinky na kojené dítě. Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky FOSAMAX 70 mg a veškerými potenciálními nežádoucími účinky na kojené dítě z FOSAMAX nebo ze základního stavu matky.
Pediatrické použití
FOSAMAX 70 mg není indikován k použití u pediatrických pacientů.
Bezpečnost a účinnost přípravku FOSAMAX byla zkoumána v randomizované, dvojitě zaslepené, placebem kontrolované dvouleté studii u 139 pediatrických pacientů ve věku 4–18 let s těžkou osteogenesis imperfecta (OI). Sto devět pacientů bylo randomizováno k 5 mg FOSAMAXu 35 mg denně (hmotnost nižší než 40 kg) nebo 10 mg FOSAMAXu 70 mg denně (hmotnost větší nebo rovna 40 kg) a 30 pacientům k placebu. Průměrné výchozí Z-skóre BMD bederní páteře pacientů bylo -4,5. Průměrná změna BMD Z-skóre bederní páteře od výchozí hodnoty do 24. měsíce byla 1,3 u pacientů léčených přípravkem FOSAMAX 35 mg a 0,1 u pacientů léčených placebem. Léčba přípravkem FOSAMAX 35 mg nesnížila riziko zlomenin. Šestnáct procent pacientů s FOSAMAX, kteří utrpěli radiologicky potvrzenou zlomeninu do 12. měsíce studie, mělo při rentgenologickém hodnocení ve 24. měsíci opožděné hojení zlomeniny (remodelaci kalusu) nebo nezhojení zlomeniny ve srovnání s 9 % pacientů léčených placebem. U pacientů léčených přípravkem FOSAMAX data histomorfometrie kostí získaná ve 24. měsíci prokázala snížený kostní obrat a opožděnou dobu mineralizace; nevyskytly se však žádné poruchy mineralizace. Mezi skupinami s FOSAMAX 35 mg a placebem nebyly zjištěny žádné statisticky významné rozdíly ve snížení bolesti kostí. Biologická dostupnost po perorálním podání u dětí byla podobná jako u dospělých.
Celkový bezpečnostní profil přípravku FOSAMAX u pacientů s osteogenesis imperfecta léčených po dobu až 24 měsíců byl obecně podobný jako u dospělých s osteoporózou léčených přípravkem FOSAMAX. U pacientů s osteogenesis imperfecta léčených přípravkem FOSAMAX však byl ve srovnání s placebem zvýšený výskyt zvracení. Během 24měsíčního léčebného období bylo zvracení pozorováno u 32 ze 109 (29,4 %) pacientů léčených přípravkem FOSAMAX 70 mg au 3 z 30 (10 %) pacientů léčených placebem.
Ve farmakokinetické studii se u 6 z 24 pediatrických pacientů s osteogenesis imperfecta, kteří dostali jednorázovou perorální dávku FOSAMAX 35 nebo 70 mg, během 24 až 48 hodin po podání vyvinula horečka, příznaky podobné chřipce a/nebo mírná lymfocytopenie. Tyto příhody, které netrvají déle než 2 až 3 dny a reagují na acetaminofen, jsou v souladu s odpovědí akutní fáze, která byla hlášena u pacientů užívajících bisfosfonáty, včetně přípravku FOSAMAX. [Vidět NEŽÁDOUCÍ REAKCE ]
Geriatrické použití
pacientů užívajících FOSAMAX ve studii FIT (Fracture Intervention Trial) bylo 71 % (n=2302) starších nebo rovných 65 let a 17 % (n=550) bylo starších nebo rovných 75 let. Z pacientů užívajících FOSAMAX 70 mg ve Spojených státech a mezinárodních studiích léčby osteoporózy u žen, studiích osteoporózy u mužů, studiích osteoporózy vyvolané glukokortikoidy a studií Pagetovy choroby [viz Klinické studie ], 45 %, 54 %, 37 % a 70 %, v tomto pořadí, bylo ve věku 65 let nebo více. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti, nelze však vyloučit větší citlivost některých starších jedinců.
Renální poškození
FOSAMAX 70 mg se nedoporučuje u pacientů s clearance kreatininu nižší než 35 ml/min. U pacientů s hodnotami clearance kreatininu mezi 35-60 ml/min není nutná žádná úprava dávkování (viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Protože existují důkazy, že alendronát není metabolizován ani vylučován žlučí, nebyly provedeny žádné studie u pacientů s poruchou funkce jater. Není nutná žádná úprava dávkování [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Významná letalita po jednotlivých perorálních dávkách byla pozorována u samic potkanů a myší při dávce 552 mg/kg (3256 mg/m²) a 966 mg/kg (2898 mg/m²). U samců byly tyto hodnoty mírně vyšší, 626 a 1280 mg/kg. Při perorálních dávkách do 200 mg/kg (4000 mg/m²) u psů nedošlo k žádné letalitě.
Nejsou dostupné žádné specifické informace o léčbě předávkování přípravkem FOSAMAX. V důsledku perorálního předávkování může dojít k hypokalcémii, hypofosfatemii a nežádoucím příhodám v horní části gastrointestinálního traktu, jako jsou žaludeční nevolnost, pálení žáhy, ezofagitida, gastritida nebo vřed. K navázání alendronátu je třeba podat mléko nebo antacida. Vzhledem k riziku podráždění jícnu by nemělo být vyvoláváno zvracení a pacient by měl zůstat zcela vzpřímený.
Dialýza by nebyla prospěšná.
KONTRAINDIKACE
FOSAMAX 35 mg je kontraindikován u pacientů s následujícími stavy:
- Abnormality jícnu, které zpomalují vyprazdňování jícnu, jako je striktura nebo achalázie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Neschopnost stát nebo sedět vzpřímeně po dobu alespoň 30 minut [viz DÁVKOVÁNÍ A PODÁVÁNÍ ; VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nepodávejte FOSAMAX 35 mg perorální roztok pacientům se zvýšeným rizikem aspirace.
- Hypokalcémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Přecitlivělost na kteroukoli složku tohoto produktu. Byly hlášeny hypersenzitivní reakce včetně kopřivky a angioedému (viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Studie na zvířatech ukázaly následující způsob účinku. Na buněčné úrovni vykazuje alendronát přednostní lokalizaci do míst kostní resorpce, konkrétně pod osteoklasty. Osteoklasty normálně přilnou k povrchu kosti, ale postrádají zvlněný okraj, který svědčí o aktivní resorpci. Alendronát neinterferuje s náborem nebo připojením osteoklastů, ale inhibuje aktivitu osteoklastů. Studie na myších zaměřené na lokalizaci radioaktivního [3H]alendronátu v kosti prokázaly asi 10krát vyšší absorpci na povrchu osteoklastů než na povrchu osteoblastů. Kosti vyšetřené 6 a 49 dnů po podání [3H]alendronátu u potkanů a myší ukázaly, že na alendronátu, který byl zabudován uvnitř matrice, se vytvořila normální kost. I když je alendronát obsažen v kostní matrici, není farmakologicky aktivní. K potlačení osteoklastů na nově vytvořených resorpčních površích tedy musí být alendronát podáván kontinuálně. Histomorfometrie na paviánech a krysách ukázala, že léčba alendronátem snižuje kostní obrat (tj. počet míst, na kterých je kost remodelována). Navíc tvorba kosti převyšuje kostní resorpci v těchto remodelačních místech, což vede k progresivnímu nárůstu kostní hmoty.

Farmakodynamika
Alendronát je bisfosfonát, který se váže na kostní hydroxyapatit a specificky inhibuje aktivitu osteoklastů, buněk resorbujících kost. Alendronát snižuje kostní resorpci bez přímého účinku na tvorbu kosti, i když posledně jmenovaný proces je nakonec omezen, protože resorpce a tvorba kosti jsou spojeny během kostní přeměny.
Osteoporóza u žen po menopauze
Osteoporóza se vyznačuje nízkou kostní hmotou, která vede ke zvýšenému riziku zlomenin. Diagnózu lze potvrdit nálezem nízké kostní hmoty, průkazem zlomeniny na rentgenovém snímku, anamnézou osteoporotické zlomeniny nebo ztrátou výšky či kyfózou, svědčící pro zlomeninu obratle (páteře). Osteoporóza se vyskytuje jak u mužů, tak u žen, ale nejběžnější je u žen po menopauze, kdy se kostní obrat zvyšuje a rychlost kostní resorpce převyšuje kostní tvorbu. Tyto změny vedou k postupnému úbytku kostní hmoty a vedou k osteoporóze u významné části žen starších 50 let. Častým důsledkem jsou zlomeniny, obvykle páteře, kyčle a zápěstí. Od 50 do 90 let se riziko zlomeniny kyčle u bílých žen zvyšuje 50krát a riziko zlomeniny obratle 15 až 30krát. Odhaduje se, že přibližně 40 % 50letých žen během zbývajícího života utrpí jednu nebo více zlomenin páteře, kyčle nebo zápěstí související s osteoporózou. Zejména zlomeniny kyčle jsou spojeny se značnou morbiditou, invaliditou a mortalitou.
Denní perorální dávky alendronátu (5, 20 a 40 mg po dobu šesti týdnů) u postmenopauzálních žen vyvolaly biochemické změny svědčící o inhibici kostní resorpce závislé na dávce, včetně snížení hladiny vápníku v moči a markerů degradace kostního kolagenu v moči (jako je deoxypyridinolin a zkřížená spojené N-telopeptidy kolagenu typu I). Tyto biochemické změny měly tendenci se vracet k výchozím hodnotám již 3 týdny po ukončení léčby alendronátem a po 7 měsících se nelišily od placeba.
Dlouhodobá léčba osteoporózy přípravkem FOSAMAX 10 mg/den (po dobu až pěti let) snížila vylučování markerů kostní resorpce, deoxypyridinolinu a zesítěných N-telopeptidů kolagenu typu I přibližně o 50 %, resp. 70 %. k dosažení hladin podobných těm, které jsou pozorovány u zdravých premenopauzálních žen. Podobné snížení bylo pozorováno u pacientů ve studiích prevence osteoporózy, kteří dostávali FOSAMAX 5 mg/den. Snížení rychlosti kostní resorpce indikované těmito markery bylo evidentní již za jeden měsíc a po třech až šesti měsících dosáhlo plató, které se udrželo po celou dobu léčby přípravkem FOSAMAX. Ve studiích léčby osteoporózy FOSAMAX 10 mg/den snižoval markery tvorby kosti, osteokalcin a kostní specifickou alkalickou fosfatázu přibližně o 50 % a celkovou sérovou alkalickou fosfatázu přibližně o 25 až 30 % k dosažení plató po 6 až 12 měsících. Ve studiích prevence osteoporózy FOSAMAX 5 mg/den snižoval osteokalcin přibližně o 40 % a celkovou alkalickou fosfatázu v séru o 15 %. Podobné snížení rychlosti kostního obratu bylo pozorováno u žen po menopauze během jednoročních studií s přípravkem FOSAMAX 70 mg jednou týdně pro léčbu osteoporózy a jednou týdně s přípravkem FOSAMAX 35 mg pro prevenci osteoporózy. Tyto údaje naznačují, že rychlost kostního obratu dosáhla nového ustáleného stavu, navzdory progresivnímu nárůstu celkového množství alendronátu uloženého v kosti.
důsledku inhibice kostní resorpce bylo po léčbě přípravkem FOSAMAX také pozorováno asymptomatické snížení sérových koncentrací vápníku a fosfátů. V dlouhodobých studiích bylo snížení sérového vápníku (přibližně 2 %) a fosfátu (přibližně 4 až 6 %) oproti výchozí hodnotě patrné první měsíc po zahájení léčby přípravkem FOSAMAX 10 mg. Po dobu pětileté léčby nebyl pozorován žádný další pokles sérového vápníku; sérový fosfát se však během tří až pěti let vrátil k hladinám před studiem. Podobné snížení bylo pozorováno u přípravku FOSAMAX 5 mg/den. V jednoročních studiích s jednou týdně FOSAMAX 35 a 70 mg bylo podobné snížení pozorováno po 6 a 12 měsících. Snížení sérového fosfátu může odrážet nejen pozitivní kostní minerální bilanci způsobenou přípravkem FOSAMAX 70 mg, ale také snížení renální reabsorpce fosfátů.
Osteoporóza u mužů
Léčba mužů s osteoporózou přípravkem FOSAMAX 10 mg/den po dobu dvou let snížila vylučování zesíťovaných N-telopeptidů kolagenu typu I přibližně o 60 % a kostně specifické alkalické fosfatázy přibližně o 40 % močí. Podobné snížení bylo pozorováno v jednoleté studii u mužů s osteoporózou, kteří dostávali jednou týdně FOSAMAX 70 mg.
Osteoporóza indukovaná glukokortikoidy
Trvalé užívání glukokortikoidů je běžně spojováno s rozvojem osteoporózy a následnými zlomeninami (zejména obratlů, kyčle a žeber). Vyskytuje se jak u mužů, tak u žen všech věkových kategorií. Osteoporóza nastává v důsledku inhibice tvorby kosti a zvýšené kostní resorpce, což vede k čistému úbytku kostní hmoty. Alendronát snižuje kostní resorpci, aniž by přímo inhiboval tvorbu kosti.
klinických studiích do dvou let' trvání, FOSAMAX 5 a 10 mg/den snižoval zesíťované N-telopeptidy kolagenu typu I (marker kostní resorpce) přibližně o 60 % a snižoval kostně specifickou alkalickou fosfatázu a celkovou sérovou alkalickou fosfatázu (markery tvorby kostí) přibližně 15 až 30 %, respektive 8 až 18 %. V důsledku inhibice kostní resorpce vyvolal FOSAMAX 5 a 10 mg/den asymptomatický pokles sérového vápníku (přibližně 1 až 2 %) a sérového fosfátu (přibližně 1 až 8 %).
Pagetova nemoc kostí
Pagetova kostní choroba je chronické, fokální kosterní onemocnění charakterizované značně zvýšenou a neuspořádanou přestavbou kostí. Nadměrná osteoklastická kostní resorpce je následována osteoblastickou novotvorbou kosti, která vede k nahrazení normální kostní architektury dezorganizovanou, zvětšenou a oslabenou kostní strukturou.
Klinické projevy Pagetovy nemoci se pohybují od nepřítomnosti příznaků až po závažnou morbiditu způsobenou bolestí kostí, deformací kostí, patologickými zlomeninami a neurologickými a jinými komplikacemi. Sérová alkalická fosfatáza, nejčastěji používaný biochemický index aktivity onemocnění, poskytuje objektivní měřítko závažnosti onemocnění a odpovědi na terapii.
FOSAMAX 70 mg přímo snižuje rychlost kostní resorpce, což vede k nepřímému snížení tvorby kosti. V klinických studiích FOSAMAX 40 mg jednou denně po dobu šesti měsíců způsobil významné snížení sérové alkalické fosfatázy a také močových markerů degradace kostního kolagenu. V důsledku inhibice kostní resorpce vyvolal FOSAMAX obecně mírný, přechodný a asymptomatický pokles sérového vápníku a fosfátu.
Farmakokinetika
Vstřebávání
Ve srovnání s intravenózní referenční dávkou byla průměrná perorální biologická dostupnost alendronátu u žen 0,64 % pro dávky v rozmezí od 5 do 70 mg při podání po celonočním hladovění a dvě hodiny před standardizovanou snídaní. Perorální biologická dostupnost 10 mg tablety u mužů (0,59 %) byla podobná jako u žen při podání po celonočním hladovění a 2 hodiny před snídaní.
FOSAMAX 70 mg perorální roztok a FOSAMAX 70 mg tableta jsou stejně biologicky dostupné.
Studie zkoumající vliv načasování jídla na biologickou dostupnost alendronátu byla provedena u 49 žen po menopauze. Biologická dostupnost se snížila (přibližně o 40 %) při podání 10 mg alendronátu buď 0,5 nebo 1 hodinu před standardizovanou snídaní, ve srovnání s dávkováním 2 hodiny před jídlem. Ve studiích léčby a prevence osteoporózy byl alendronát účinný při podávání alespoň 30 minut před snídaní.
Biologická dostupnost byla zanedbatelná, ať byl alendronát podáván se standardizovanou snídaní nebo do dvou hodin po ní. Současné podávání alendronátu s kávou nebo pomerančovým džusem snížilo biologickou dostupnost přibližně o 60 %.
Rozdělení
Předklinické studie (u samců potkanů) ukazují, že alendronát se po intravenózním podání 1 mg/kg přechodně distribuuje do měkkých tkání, ale poté se rychle redistribuuje do kostí nebo se vylučuje močí. Průměrný distribuční objem v ustáleném stavu, s výjimkou kostí, je u lidí alespoň 28 l. Koncentrace léčiva v plazmě po terapeutických perorálních dávkách jsou příliš nízké (méně než 5 ng/ml) pro analytickou detekci. Vazba na bílkoviny v lidské plazmě je přibližně 78 %.
Metabolismus
Neexistují žádné důkazy, že alendronát je metabolizován u zvířat nebo lidí.
Vylučování
Po jednorázové intravenózní dávce [14C]alendronátu bylo přibližně 50 % radioaktivity vyloučeno močí během 72 hodin a ve stolici byla zjištěna malá nebo žádná radioaktivita. Po jedné intravenózní dávce 10 mg byla renální clearance alendronátu 71 ml/min (64, 78; 90% interval spolehlivosti [CI]) a systémová clearance nepřesáhla 200 ml/min. Plazmatické koncentrace klesly o více než 95 % během 6 hodin po intravenózním podání. Konečný poločas u lidí se odhaduje na více než 10 let, což pravděpodobně odráží uvolňování alendronátu ze skeletu. Na základě výše uvedeného se odhaduje, že po 10 letech perorální léčby přípravkem FOSAMAX (10 mg denně) je množství alendronátu denně uvolněného ze skeletu přibližně 25 % množství absorbovaného z gastrointestinálního traktu.
Specifické populace
Rod
Biologická dostupnost a podíl intravenózní dávky vyloučené močí byly u mužů a žen podobné.
Geriatrický
Biologická dostupnost a dispozice (vylučování močí) byly u starších a mladších pacientů podobné. U starších pacientů není nutná úprava dávkování.
Závod
Farmakokinetické rozdíly způsobené rasou nebyly studovány.
Renální poškození
Preklinické studie ukazují, že u potkanů se selháním ledvin je v plazmě, ledvinách, slezině a holenní kosti přítomno rostoucí množství léku. U zdravých kontrol je lék, který není uložen v kosti, rychle vylučován močí. Po 3 týdnech podávání kumulativních intravenózních dávek 35 mg/kg u mladých potkaních samců nebyl nalezen žádný důkaz saturace vychytávání kostí. Přestože u pacientů nebyla provedena žádná formální farmakokinetická studie s poruchou funkce ledvin, je pravděpodobné, že stejně jako u zvířat bude eliminace alendronátu ledvinami u pacientů s poruchou funkce ledvin snížena. Proto lze u pacientek s poruchou funkce ledvin očekávat poněkud větší akumulaci alendronátu v kostech.
pacientů s clearance kreatininu 35 až 60 ml/min není nutná žádná úprava dávkování. FOSAMAX 35 mg se nedoporučuje u pacientek s clearance kreatininu nižší než 35 ml/min kvůli nedostatku zkušeností s alendronátem při selhání ledvin.
Poškození jater
Protože existují důkazy, že alendronát není metabolizován ani vylučován žlučí, nebyly provedeny žádné studie u pacientů s poruchou funkce jater. Není nutná žádná úprava dávkování.
Lékové interakce
Bylo prokázáno, že intravenózní ranitidin zdvojnásobuje biologickou dostupnost perorálního alendronátu. Klinický význam této zvýšené biologické dostupnosti a zda k podobnému zvýšení dojde u pacientů užívajících perorální H2-antagonisty není znám.
U zdravých subjektů nevyvolal perorální prednison (20 mg třikrát denně po dobu pěti dnů) klinicky významnou změnu v perorální biologické dostupnosti alendronátu (průměrné zvýšení v rozmezí od 20 do 44 %).
Produkty obsahující vápník a další multivalentní kationty pravděpodobně narušují absorpci alendronátu.
Toxikologie zvířat a/nebo farmakologie
Relativní inhibiční aktivity na kostní resorpci a mineralizaci alendronátu a etidronátu byly porovnány v Schenkově testu, který je založen na histologickém vyšetření epifýz rostoucích potkanů. V tomto testu byla nejnižší dávka alendronátu, která interferovala s mineralizací kostí (vedoucí k osteomalacii), 6000násobkem antiresorpční dávky. Odpovídající poměr pro etidronát byl jedna ku jedné. Tyto údaje naznačují, že je vysoce nepravděpodobné, že by alendronát podávaný v terapeutických dávkách indukoval osteomalacii.
Klinické studie
Léčba Osteoporózy U žen po menopauze
Denní dávkování
Účinnost FOSAMAX 10 mg denně byla hodnocena ve čtyřech klinických studiích. Studie 1, tříletá, multicentrická, dvojitě zaslepená, placebem kontrolovaná, klinická studie v USA zahrnovala 478 pacientů s BMD T-skóre minus 2,5 nebo nižším s nebo bez předchozí zlomeniny obratle; Studie 2, tříletá, multicentrická, dvojitě zaslepená, placebem kontrolovaná mezinárodní klinická studie zahrnovala 516 pacientů s BMD T-skóre minus 2,5 nebo nižším s předchozí zlomeninou obratle nebo bez ní; Studie 3, tříletá studie Fracture Intervention Trial (FIT), studie, do které bylo zařazeno 2027 postmenopauzálních pacientek s alespoň jednou výchozí zlomeninou obratle; a Studie 4, čtyřletá studie FIT: studie, do které bylo zařazeno 4432 postmenopauzálních pacientek s nízkou kostní hmotou, ale bez výchozí fraktury obratle.
Vliv na výskyt zlomenin
posouzení účinků FOSAMAXu na výskyt vertebrálních zlomenin (zjištěných digitalizovanou rentgenografií; přibližně jedna třetina z nich byla klinicky symptomatická), byly americké a mezinárodní studie zkombinovány v analýze, která porovnávala placebo se skupinami s kombinovaným dávkováním FOSAMAXu (5 nebo 10 mg po dobu tří let nebo 20 mg po dobu dvou let a následně 5 mg po dobu jednoho roku). Došlo ke statisticky významnému snížení podílu pacientů léčených přípravkem FOSAMAX 70 mg, u kterých se vyskytla jedna nebo více nových vertebrálních zlomenin, ve srovnání s pacienty léčenými placebem (3,2 % vs. 6,2 %; snížení relativního rizika o 48 %). Bylo také pozorováno snížení celkového počtu nových zlomenin obratlů (4,2 vs. 11,3 na 100 pacientů). V souhrnné analýze měli pacienti, kteří dostávali FOSAMAX, ztrátu postavy, která byla statisticky významně nižší než u pacientů, kteří dostávali placebo (-3,0 mm vs. -4,6 mm).
Fracture Intervention Trial (FIT) sestávala ze dvou studií u postmenopauzálních žen: tříleté studie u pacientek, které měly alespoň jednu výchozí radiografickou zlomeninu obratle, a čtyřleté studie pacientek s nízkou kostní hmotou, ale bez výchozí zlomeniny obratle. V obou studiích FIT dokončilo studie 96 % randomizovaných pacientů (tj. měli závěrečnou návštěvu na plánovaném konci studie); přibližně 80 % pacientů po dokončení stále užívalo studijní medikaci.
Zkouška s intervencí zlomeniny: Tříletá studie (pacienti s alespoň jednou základní radiografickou zlomeninou obratle)
Tato randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s 2027 pacienty (FOSAMAX 70 mg, n=1022; placebo, n=1005) prokázala, že léčba přípravkem FOSAMAX vedla ke statisticky významnému snížení výskytu zlomenin po třech letech, jak ukazuje tabulka 6 .
Dále v této populaci pacientů s výchozí vertebrální zlomeninou léčba přípravkem FOSAMAX významně snížila výskyt hospitalizací (25,0 % vs. 30,7 %).
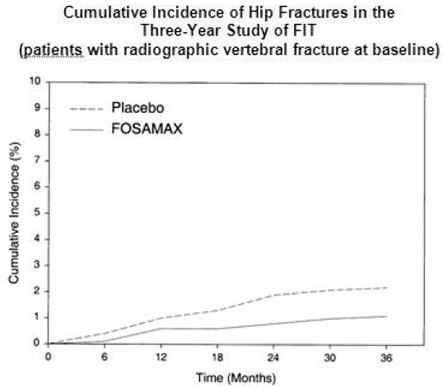
V tříleté studii FIT se zlomeniny kyčle vyskytly u 22 (2,2 %) z 1005 pacientů na placebu au 11 (1,1 %) z 1022 pacientů na FOSAMAX, p=0,047. Obrázek 1 ukazuje kumulativní výskyt zlomenin kyčle v této studii.
Obrázek 1: Kumulativní výskyt zlomenin kyčle ve tříleté studii FIT (pacienti s rentgenovou zlomeninou obratle na začátku)
Zkouška zlomeniny: Čtyřletá studie (pacienti s nízkou kostní hmotou, ale bez základní radiografické zlomeniny obratle)
Tato randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie se 4432 pacienty (FOSAMAX 70 mg, n=2214; placebo, n=2218) dále zkoumala snížení výskytu zlomenin v důsledku FOSAMAXu. Záměrem studie bylo získat ženy s osteoporózou, definovanou jako výchozí BMD krčku femuru alespoň o dvě standardní odchylky pod průměrem pro mladé dospělé ženy. V důsledku následných revizí normativních hodnot BMD krčku stehenní kosti však bylo zjištěno, že 31 % pacientek toto vstupní kritérium nesplňuje, a proto tato studie zahrnovala ženy s osteoporózou i neosteoporotické ženy. Výsledky jsou uvedeny v tabulce 7 pro pacienty s osteoporózou.
Výsledky zlomenin napříč studiemi
tříleté studii FIT snížil FOSAMAX 35 mg procento žen, u kterých došlo k alespoň jedné nové rentgenové zlomenině obratle, z 15,0 % na 7,9 % (47% snížení relativního rizika, p
FOSAMAX snížil procento žen, u kterých se objevily mnohočetné (dvě nebo více) nové vertebrální zlomeniny ze 4,2 % na 0,6 % (87% snížení relativního rizika, p
FOSAMAX 35 mg tedy snížil výskyt radiografických zlomenin obratlů u žen s osteoporózou bez ohledu na to, zda měly nebo neměly předchozí radiografickou zlomeninu obratle.
Vliv na hustotu kostních minerálů
Účinnost FOSAMAX 10 mg jednou denně u postmenopauzálních žen ve věku 44 až 84 let s osteoporózou (denzita kostních minerálů bederní páteře [BMD] alespoň 2 standardní odchylky pod premenopauzálním průměrem) byla prokázána ve čtyřech dvojitých slepé, placebem kontrolované klinické studie trvající dva nebo tři roky' doba trvání.
Obrázek 2 ukazuje průměrné zvýšení BMD bederní páteře, krčku stehenní kosti a trochanteru u pacientů užívajících FOSAMAX 10 mg/den ve srovnání s pacienty léčenými placebem po třech letech pro každou z těchto studií.
Obrázek 2: Studie léčby osteoporózy u žen po menopauze Zvýšení BMD FOSAMAX 10 mg/den po třech letech
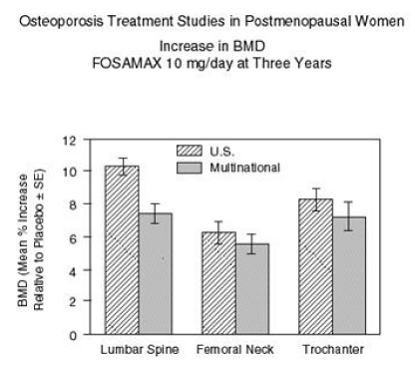
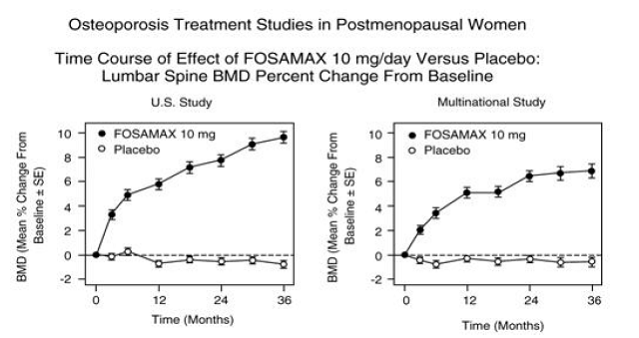
Po třech letech bylo u pacientů, kteří dostávali FOSAMAX 10 mg/den, pozorováno významné zvýšení BMD, ve srovnání s výchozí hodnotou i s placebem na každém místě měření v každé studii. Celková tělesná BMD se také významně zvýšila v každé studii, což naznačuje, že nárůst kostní hmoty páteře a kyčle nenastal na úkor jiných míst skeletu. Zvýšení BMD bylo zřejmé již po třech měsících a pokračovalo po dobu tří let léčby. (Viz obrázek 3 pro výsledky bederní páteře.) Ve dvouletém prodloužení těchto studií vedla léčba 147 pacientů přípravkem FOSAMAX 10 mg/den k pokračujícímu zvyšování BMD v bederní páteři a trochanteru (absolutní dodatečné zvýšení mezi 3. 5: bederní páteř, 0,94 %; trochanter, 0,88 %). BMD v krčku stehenní kosti, předloktí a celého těla byla zachována. FOSAMAX byl podobně účinný bez ohledu na věk, rasu, výchozí rychlost kostního obratu a výchozí BMD ve studovaném rozmezí (alespoň 2 standardní odchylky pod premenopauzálním průměrem).
Obrázek 3: Studie léčby osteoporózy u žen po menopauze Časový průběh účinku přípravku FOSAMAX 10 mg/den versus placebo: Procentuální změna BMD bederní páteře od výchozí hodnoty
U pacientek s postmenopauzální osteoporózou léčených přípravkem FOSAMAX 10 mg/den po dobu jednoho nebo dvou let byly hodnoceny účinky vysazení léčby. Po vysazení nedošlo k žádnému dalšímu nárůstu kostní hmoty a rychlost úbytku kostní hmoty byla podobná jako u skupin s placebem.
Histologie kostí
Histologie kostí u 270 postmenopauzálních pacientek s osteoporózou léčených přípravkem FOSAMAX v dávkách od 1 do 20 mg/den po dobu jednoho, dvou nebo tří let odhalila normální mineralizaci a strukturu, jakož i očekávaný pokles kostního obratu ve srovnání s placebem. Tyto údaje spolu s normální histologií kostí a zvýšenou pevností kostí pozorovanou u potkanů a paviánů vystavených dlouhodobé léčbě alendronátem podporují závěr, že kost vytvořená během léčby přípravkem FOSAMAX 35 mg má normální kvalitu.
Vliv na výšku
FOSAMAX byl po dobu tří nebo čtyř let spojen se statisticky významným snížením ztráty výšky v porovnání s placebem u pacientů s výchozími rentgenovými zlomeninami obratlů a bez nich. Na konci studií FIT byly rozdíly mezi léčebnými skupinami 3,2 mm ve tříleté studii a 1,3 mm ve čtyřleté studii.
Týdenní dávkování
Terapeutická ekvivalence FOSAMAX 70 mg jednou týdně (n=519) a FOSAMAX 10 mg denně (n=370) byla prokázána v jednoleté, dvojitě zaslepené, multicentrické studii u postmenopauzálních žen s osteoporózou. V primární analýze pacientů, kteří dokončili léčbu, bylo průměrné zvýšení BMD bederní páteře oproti výchozí hodnotě po jednom roce 5,1 % (4,8, 5,4 %; 95 % CI) ve skupině 70 mg jednou týdně (n=440) a 5,4 % ( 5,0, 5,8 %; 95 % CI) ve skupině s 10 mg denně (n=330). Tyto dvě léčebné skupiny byly také podobné, pokud jde o zvýšení BMD na jiných místech skeletu. Výsledky analýzy záměrné léčby byly v souladu s primární analýzou pacientů, kteří dokončili léčbu.
Současné užívání s estrogenovou/hormonální substituční terapií (HRT)
Účinky na BMD léčby přípravkem FOSAMAX 10 mg jednou denně a konjugovaným estrogenem (0,625 mg/den), buď samotným nebo v kombinaci, byly hodnoceny ve dvouleté, dvojitě zaslepené, placebem kontrolované studii u žen s postmenopauzální osteoporózou po hysterektomii (n= 425). Po dvou letech bylo zvýšení BMD bederní páteře oproti výchozí hodnotě významně vyšší u kombinace (8,3 %) než u estrogenu nebo samotného FOSAMAXu (obojí 6,0 %).
Účinky na BMD, když byl FOSAMAX 35 mg přidán ke stabilním dávkám (po dobu alespoň jednoho roku) HRT (estrogen ± progestin), byly hodnoceny v jednoleté, dvojitě zaslepené, placebem kontrolované studii u žen s postmenopauzální osteoporózou (n=428). Přidání FOSAMAXU 10 mg jednou denně k HRT vedlo po jednom roce k významně většímu zvýšení BMD bederní páteře (3,7 %) oproti samotné HRT (1,1 %).
těchto studiích bylo pozorováno významné zvýšení nebo příznivé trendy v BMD u kombinované terapie ve srovnání se samotnou HRT v celé kyčli, krčku femuru a trochanteru. Nebyl pozorován žádný významný účinek na celkovou tělesnou BMD.
Histomorfometrické studie transiliakálních biopsií u 92 subjektů prokázaly normální kostní architekturu. Ve srovnání s placebem došlo po 18 měsících kombinované léčby přípravkem FOSAMAX 35 mg a HRT k 98% supresi kostního obratu (stanoveno podle mineralizujícího povrchu), 94 % při samotném přípravku FOSAMAX 35 mg a 78 % při samotné HRT. Dlouhodobé účinky kombinovaného přípravku FOSAMAX 35 mg a HST na výskyt zlomenin a hojení zlomenin nebyly studovány.
Prevence osteoporózy u žen po menopauze
Denní dávkování
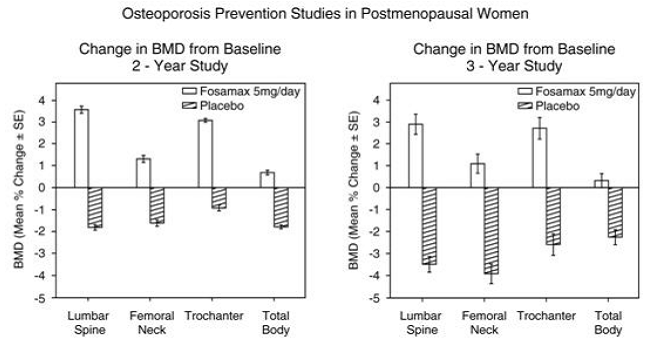
Prevence úbytku kostní hmoty byla prokázána ve dvou dvojitě zaslepených, placebem kontrolovaných studiích u žen po menopauze ve věku 40–60 let. Tisíc šest set devět pacientek (FOSAMAX 5 mg/den; n=498), které byly alespoň šest měsíců po menopauze, bylo zařazeno do dvouleté studie bez ohledu na jejich výchozí BMD. V druhé studii bylo po dobu až tří let léčeno 447 pacientek (FOSAMAX 5 mg/den; n=88), které byly mezi šesti měsíci a třemi roky po menopauze. U pacientů léčených placebem byly pozorovány ztráty BMD přibližně 1 % za rok v oblasti páteře, kyčle (krček stehenní kosti a trochanteru) a celého těla. Na rozdíl od toho FOSAMAX 5 mg/den zabránil ztrátě kostní hmoty u většiny pacientů a vyvolal významný nárůst průměrné kostní hmoty na každém z těchto míst (viz obrázek 4). Navíc FOSAMAX 5 mg/den snížil rychlost úbytku kostní hmoty na předloktí přibližně o polovinu ve srovnání s placebem. FOSAMAX 5 mg/den byl u této populace podobně účinný bez ohledu na věk, dobu od menopauzy, rasu a výchozí rychlost kostního obratu.
Obrázek 4: Studie prevence osteoporózy u žen po menopauze
Histologie kostí
Histologie kostí byla normální u 28 pacientů, u kterých byla provedena biopsie na konci tří let a kteří dostávali FOSAMAX v dávkách až 10 mg/den.
Týdenní dávkování
Terapeutická ekvivalence FOSAMAX 35 mg (n=362) jednou týdně a FOSAMAX 5 mg denně (n=361) byla prokázána v jednoleté, dvojitě zaslepené, multicentrické studii u žen po menopauze bez osteoporózy. V primární analýze pacientů, kteří dokončili léčbu, bylo průměrné zvýšení BMD bederní páteře oproti výchozí hodnotě po jednom roce 2,9 % (2,6, 3,2 %; 95 % CI) ve skupině s 35 mg jednou týdně (n=307) a 3,2 % ( 2,9, 3,5 %; 95 % CI) ve skupině s 5 mg denně (n=298). Tyto dvě léčebné skupiny byly také podobné, pokud jde o zvýšení BMD na jiných místech skeletu. Výsledky analýzy záměrné léčby byly v souladu s primární analýzou pacientů, kteří dokončili léčbu.
Léčba ke zvýšení kostní hmoty u mužů s osteoporózou
Účinnost přípravku FOSAMAX 35 mg u mužů s hypogonadální nebo idiopatickou osteoporózou byla prokázána ve dvou klinických studiích.
Denní dávkování
Dvouletá, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie s přípravkem FOSAMAX 10 mg jednou denně zahrnovala celkem 241 mužů ve věku 31 až 87 let (průměr 63). Všichni pacienti ve studii měli buď T-skóre BMD menší nebo rovné -2 v krčku stehenní kosti a menší nebo rovné -1 v bederní páteři, nebo výchozí osteoporotickou zlomeninu a BMD T-skóre menší než nebo rovná -1 na krčku stehenní kosti. Po dvou letech byla průměrná zvýšení BMD ve srovnání s placebem u mužů užívajících FOSAMAX 10 mg/den významná na následujících místech: bederní páteř, 5,3 %; krček stehenní kosti, 2,6 %; trochanter, 3,1 %; a celkové tělo, 1,6 %. Léčba přípravkem FOSAMAX 70 mg také snížila ztrátu výšky (FOSAMAX, -0,6 mm vs. placebo, -2,4 mm).
Týdenní dávkování
Jednoletá, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie s jednou týdně FOSAMAX 70 mg zahrnovala celkem 167 mužů ve věku 38 až 91 let (průměr 66). Pacienti ve studii měli buď T-skóre BMD menší nebo rovné -2 v krčku stehenní kosti a menší nebo rovné -1 v bederní páteři, nebo T-skóre BMD menší nebo rovné -2 v oblasti bederní páteře a menší nebo rovné -1 na krčku femuru nebo základní osteoporotická zlomenina a BMD T-skóre menší nebo rovné -1 na krčku femuru. Po jednom roce byla průměrná zvýšení BMD ve srovnání s placebem u mužů užívajících FOSAMAX 70 mg jednou týdně významná na následujících místech: bederní páteř, 2,8 %; krček stehenní kosti, 1,9 %; trochanter, 2,0 %; a celkové tělo 1,2 %. Tato zvýšení BMD byla podobná jako po jednom roce ve studii s 10 mg jednou denně.
obou studiích byly odpovědi BMD podobné bez ohledu na věk (vyšší nebo rovna 65 let vs. méně než 65 let), funkci gonád (výchozí hodnota testosteronu nižší než 9 ng/dl vs. vyšší nebo rovna 9 ng/dl) nebo výchozí BMD (T-skóre krčku stehenní kosti a bederní páteře menší nebo rovné -2,5 vs. větší než -2,5).
Léčba glukokortikoidy indukované osteoporózy
Účinnost přípravku FOSAMAX 5 a 10 mg jednou denně u mužů a žen užívajících glukokortikoidy (nejméně 7,5 mg/den prednisonu nebo ekvivalentu) byla prokázána ve dvou, jednoletých, dvojitě zaslepených, randomizovaných, placebem kontrolovaných, multicentrických studiích prakticky identický design, jeden byl proveden ve Spojených státech a druhý v 15 různých zemích (Multinational [který také zahrnoval FOSAMAX 2,5 mg/den]). Do těchto studií bylo zařazeno 232 a 328 pacientů ve věku 17 až 83 let s různými onemocněními vyžadujícími glukokortikoidy. Pacienti dostávali doplňkově vápník a vitamín D. Obrázek 5 ukazuje průměrné zvýšení BMD bederní páteře, krčku stehenní kosti a trochanteru ve srovnání s placebem u pacientů, kteří dostávali FOSAMAX 5 mg/den v každé studii.
Obrázek 5: Studie u pacientů léčených glukokortikoidy Zvýšení BMD FOSAMAX 5 mg/den po jednom roce
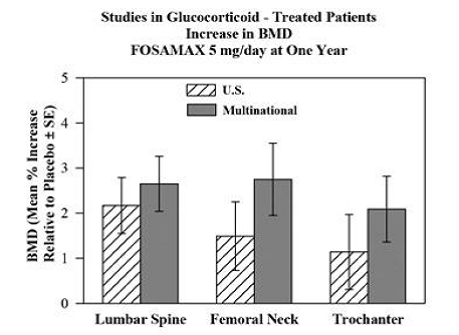
Po jednom roce bylo pozorováno významné zvýšení BMD v porovnání s placebem v kombinovaných studiích na každém z těchto míst u pacientů, kteří dostávali FOSAMAX 5 mg/den. U pacientů léčených placebem došlo k významnému poklesu BMD v krčku femuru (-1,2 %) a menší poklesy byly pozorovány v bederní páteři a trochanteru. Celková tělesná BMD byla udržována pomocí FOSAMAX 5 mg/den. Zvýšení BMD u FOSAMAX 10 mg/den bylo podobné jako u FOSAMAXu 5 mg/den u všech pacientek s výjimkou postmenopauzálních žen, které nedostávaly estrogenovou terapii. U těchto žen byla zvýšení (ve srovnání s placebem) s FOSAMAXem 10 mg/den větší než s FOSAMAXem 5 mg/den v oblasti bederní páteře (4,1 % vs. 1,6 %) a trochanteru (2,8 % vs. 1,7 %), ale ne na jiných stránkách. FOSAMAX 35 mg byl účinný bez ohledu na dávku nebo délku užívání glukokortikoidů. Navíc byl FOSAMAX podobně účinný bez ohledu na věk (méně než 65 vs. větší nebo rovný 65 let), rasu (bělošský vs. jiné rasy), pohlaví, základní onemocnění, výchozí BMD, výchozí kostní obrat a použití s různé běžné léky.
Histologie kostí byla normální u 49 pacientů s biopsií na konci jednoho roku, kteří dostávali FOSAMAX v dávkách až 10 mg/den.
Z původních 560 pacientů v těchto studiích pokračovalo 208 pacientů, kteří zůstali na alespoň 7,5 mg/den prednisonu nebo ekvivalentu, do jednoročního dvojitě zaslepeného prodloužení. Po dvou letech léčby se BMD páteře zvýšila o 3,7 % a 5,0 % ve srovnání s placebem s FOSAMAX 5 a 10 mg/den, v tomto pořadí. Významné zvýšení BMD (ve srovnání s placebem) bylo také pozorováno v krčku femuru, trochanteru a celém těle.
Po jednom roce došlo u 2,3 % pacientů léčených přípravkem FOSAMAX 5 nebo 10 mg/den (sdružený) oproti 3,7 % pacientů léčených placebem k nové zlomenině obratle (nevýznamná). Ve sledované populaci po dobu dvou let však léčba přípravkem FOSAMAX (skupiny se společným dávkováním: 5 nebo 10 mg po dobu dvou let nebo 2,5 mg po dobu jednoho roku a následně 10 mg po dobu jednoho roku) významně snížila výskyt pacientů s novou zlomeninou obratle (FOSAMAX 0,7 % vs. placebo 6,8 %).
Léčba Pagetovy choroby kostí
Účinnost přípravku FOSAMAX 40 mg jednou denně po dobu šesti měsíců byla prokázána ve dvou dvojitě zaslepených klinických studiích u mužů a žen se středně těžkou až těžkou Pagetovou chorobou (alkalická fosfatáza alespoň dvojnásobek horní hranice normálu): placebo -kontrolovaná mezinárodní studie a srovnávací studie v USA s etidronátem disodným 400 mg/den. Obrázek 6 ukazuje průměrné procentuální změny od výchozí hodnoty v séru alkalické fosfatázy po dobu až šesti měsíců randomizované léčby.
Obrázek 6: Studie účinku Pagetovy kostní choroby na sérovou alkalickou fosfatázu přípravku FOSAMAX 40 mg/den versus placebo nebo etidronát 400 mg/den
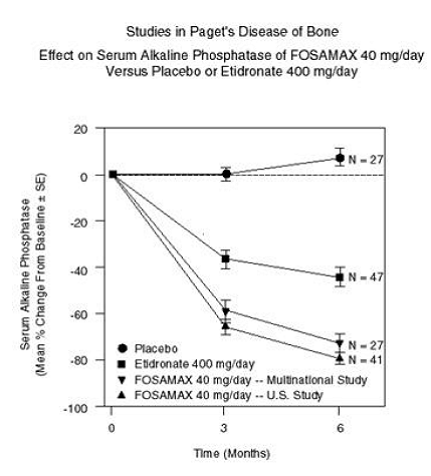
Po šesti měsících byla suprese alkalické fosfatázy u pacientů léčených přípravkem FOSAMAX významně vyšší než suprese dosažená etidronátem a kontrastovala s úplným nedostatkem odpovědi u pacientů léčených placebem. Odpověď (definovaná buď jako normalizace sérové alkalické fosfatázy nebo pokles od výchozí hodnoty vyšší nebo rovný 60 %) se objevila přibližně u 85 % pacientů léčených přípravkem FOSAMAX v kombinovaných studiích oproti 30 % ve skupině s etidronátem a 0 % ve skupině s placebem skupina. FOSAMAX 70 mg byl podobně účinný bez ohledu na věk, pohlaví, rasu, předchozí užívání jiných bisfosfonátů nebo výchozí alkalickou fosfatázu ve studovaném rozmezí (alespoň dvojnásobek horní hranice normy).
Histologie kostí byla hodnocena u 33 pacientů s Pagetovou chorobou léčených přípravkem FOSAMAX 40 mg/den po dobu 6 měsíců. Stejně jako u pacientů léčených pro osteoporózu [viz Klinické studie ], FOSAMAX nenarušil mineralizaci a byl pozorován očekávaný pokles rychlosti kostního obratu. Během léčby přípravkem FOSAMAX se vytvořila normální lamelární kost, a to i v případě, že již existující kost byla tkaná a dezorganizovaná. Celkově lze konstatovat, že údaje o kostní histologii podporují závěr, že kost vytvořená během léčby přípravkem FOSAMAX 35 mg má normální kvalitu.
INFORMACE PRO PACIENTA
FOSAMAX® Tablety (FOSS-ah-max) (alendronát sodný).
Než začnete užívat přípravek FOSAMAX 70 mg, přečtěte si Průvodce léčivy, který je dodáván s přípravkem FOSAMAX 70 mg, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tento průvodce léky nenahrazuje rozhovor s lékařem o vašem zdravotním stavu nebo léčbě. Máte-li jakékoli otázky týkající se přípravku FOSAMAX, poraďte se se svým lékařem.
Jaké jsou nejdůležitější informace, které bych měl vědět o FOSAMAX 70 mg?
FOSAMAX 70 mg může způsobit závažné nežádoucí účinky včetně:
1. Problémy s jícnem.
U některých lidí, kteří užívají FOSAMAX 35 mg, se mohou rozvinout problémy s jícnem (trubice, která spojuje ústa a žaludek).
Tyto problémy zahrnují podráždění, záněty nebo vředy jícnu, které mohou někdy krvácet.
- Je důležité, abyste užíval(a) FOSAMAX 70 mg přesně podle předpisu, aby se snížila pravděpodobnost vzniku problémů s jícnem. (Viz část „Jak mám užívat FOSAMAX?“)
- Přestaňte užívat přípravek FOSAMAX a ihned zavolejte svému lékaři, pokud se u Vás objeví bolest na hrudi, nové nebo se zhorší pálení žáhy nebo pokud máte potíže nebo bolest při polykání.
2. Nízké hladiny vápníku v krvi (hypokalcémie).
FOSAMAX může snížit hladinu vápníku ve Vaší krvi. Pokud máte nízkou hladinu vápníku v krvi předtím, než začnete užívat FOSAMAX, může se během léčby zhoršit. Vaše nízká hladina vápníku v krvi musí být léčena předtím, než začnete užívat FOSAMAX. Většina lidí s nízkou hladinou vápníku v krvi nemá příznaky, ale někteří lidé mohou mít příznaky. Okamžitě zavolejte svého lékaře, pokud máte příznaky nízké hladiny vápníku v krvi, jako jsou:
- Křeče, záškuby nebo křeče ve svalech
- Necitlivost nebo mravenčení v prstech na rukou, nohou nebo kolem úst
Váš lékař vám může předepsat vápník a vitamín D, aby vám pomohl předejít nízkým hladinám vápníku v krvi, když užíváte FOSAMAX. Užívejte vápník a vitamín D podle pokynů svého lékaře.
3. Bolest kostí, kloubů nebo svalů.
U některých lidí, kteří užívají FOSAMAX, se vyvine silná bolest kostí, kloubů nebo svalů.
4. Závažné problémy s čelistní kostí (osteonekróza).
Při užívání přípravku FOSAMAX se mohou objevit závažné problémy s čelistní kostí. Před zahájením léčby přípravkem FOSAMAX by Vám měl lékař prohlédnout ústa. Váš lékař vám může říci, abyste před zahájením léčby přípravkem FOSAMAX navštívili svého zubního lékaře. Je důležité, abyste během léčby přípravkem FOSAMAX správně pečovali o ústa.
5. Neobvyklé zlomeniny stehenní kosti.
U některých lidí se vyvinuly neobvyklé zlomeniny stehenní kosti. Příznaky zlomeniny mohou zahrnovat novou nebo neobvyklou bolest v kyčli, tříslech nebo stehně.
Okamžitě zavolejte svého lékaře, pokud máte některý z těchto nežádoucích účinků.
Co je FOSAMAX 70 mg?
- FOSAMAX 70 mg je lék na předpis používaný k:
- Léčba nebo prevence osteoporózy u žen po menopauze. Pomáhá snížit pravděpodobnost zlomeniny kyčle nebo páteře (zlomení).
- Zvýšení kostní hmoty u mužů s osteoporózou.
- Léčba osteoporózy u mužů i žen, kteří užívají kortikosteroidy.
Léčte některé muže a ženy, kteří mají Pagetovu chorobu kostí.
Není známo, jak dlouho FOSAMAX 70 mg působí k léčbě a prevenci osteoporózy. Měli byste pravidelně navštěvovat svého lékaře, abyste zjistili, zda je pro vás FOSAMAX 70 mg stále vhodný.
FOSAMAX není určen k použití u dětí.
Kdo by neměl užívat FOSAMAX 70 mg?
Neužívejte FOSAMAX, jestliže:
- Máte určité problémy s jícnem, trubicí, která spojuje ústa se žaludkem
- Nemůžete stát nebo sedět vzpřímeně po dobu nejméně 30 minut
- Máte nízké hladiny vápníku v krvi
- Jste alergičtí na FOSAMAX 70 mg nebo na kteroukoli jeho složku. Seznam složek je na konci tohoto letáku.
Co mám říct svému lékaři, než začnu užívat FOSAMAX 35 mg?
Před zahájením léčby přípravkem FOSAMAX se poraďte se svým lékařem, pokud:
- Máte problémy s polykáním
- Máte žaludeční nebo zažívací potíže
- Mít nízkou hladinu vápníku v krvi
- Naplánujte si zubní operaci nebo odstranění zubů
- Máte problémy s ledvinami
- Bylo vám řečeno, že máte potíže se vstřebáváním minerálů v žaludku nebo střevech (malabsorpční syndrom)
- Jste těhotná, snažíte se otěhotnět nebo máte podezření, že jste těhotná. Pokud otěhotníte během užívání přípravku FOSAMAX, přestaňte jej užívat a kontaktujte svého lékaře. Není známo, zda FOSAMAX může poškodit vaše nenarozené dítě.
- Kojíte nebo plánujete kojit. Není známo, zda FOSAMAX přechází do vašeho mléka a může poškodit vaše dítě.
Zejména informujte svého lékaře, pokud užíváte:
- antacida
- aspirin
- Nesteroidní protizánětlivé léky (NSAID).
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Některé léky mohou ovlivnit účinek přípravku FOSAMAX 70 mg.
Znát léky, které užíváte. Uchovávejte si jejich seznam a ukažte jej svému lékaři a lékárníkovi pokaždé, když dostanete nový lék.
Jak mám užívat FOSAMAX 35 mg?
- Užívejte FOSAMAX 35 mg přesně podle pokynů svého lékaře.
- FOSAMAX účinkuje, pouze pokud se užívá nalačno.
- Užívejte FOSAMAX 35 mg, jakmile ráno vstanete a než si dáte první jídlo, pití nebo jiný lék.
- Užívejte FOSAMAX, když sedíte nebo stojíte.
- Tabletu přípravku FOSAMAX nežvýkejte ani necucejte.
- Tabletu FOSAMAX spolkněte pouze s plnou sklenicí (6-8 uncí) čisté vody.
- Ne užívejte FOSAMAX s minerální vodou, kávou, čajem, sodou nebo džusem.
- Jestliže užíváte Alendronate Daily:
- Užívejte 1 tabletu alendronátu jednou denně, každý den poté, co ráno vstanete a předtím, než si dáte první jídlo, pití nebo jiný lék.
- Jestliže užíváte FOSAMAX jednou týdně:
- Vyberte si den v týdnu, který nejlépe vyhovuje vašemu rozvrhu.
- Užívejte 1 dávku přípravku FOSAMAX každý týden ve vámi zvolený den poté, co vstanete a než si dáte první jídlo, pití nebo jiný lék.
- Jestliže užíváte Alendronate Daily:
Po spolknutí tablety FOSAMAX 35 mg vyčkejte alespoň 30 minut:
- Než si lehnete. Můžete sedět, stát nebo chodit a dělat běžné činnosti, jako je čtení.
- Než si dáte první jídlo nebo pití, kromě čisté vody.
- Než začnete užívat jiné léky, včetně antacid, vápníku a dalších doplňků a vitamínů.
Po užití přípravku FOSAMAX a poté, co sníte první jídlo dne, si nelehejte alespoň 30 minut.
Pokud vynecháte dávku přípravku FOSAMAX 70 mg, neužívejte ji později během dne. Užijte vynechanou dávku následující ráno poté, co si vzpomenete, a poté se vraťte k normálnímu rozvrhu. Neužívejte 2 dávky ve stejný den.
Jestliže jste užil(a) příliš mnoho přípravku FOSAMAX 70 mg, zavolejte svého lékaře. Nesnažte se zvracet. Nelehejte si.
Jaké jsou možné nežádoucí účinky přípravku FOSAMAX 70 mg?
FOSAMAX může způsobit závažné nežádoucí účinky.
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o FOSAMAX?"
Nejčastějšími nežádoucími účinky přípravku FOSAMAX 70 mg jsou:
- Bolest v oblasti žaludku (břicha).
- Pálení žáhy
- Zácpa
- Průjem
- Žaludeční nevolnost
- Bolest kostí, kloubů nebo svalů
- Nevolnost
Můžete mít alergické reakce, jako je kopřivka nebo otok obličeje, rtů, jazyka nebo hrdla.
Bylo hlášeno zhoršení astmatu.
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku FOSAMAX. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám FOSAMAX uchovávat?
- Uchovávejte FOSAMAX 35 mg při pokojové teplotě, 59 °F až 86 °F (15 °C až 30 °C).
- Uchovávejte FOSAMAX v těsně uzavřené nádobě.
Uchovávejte FOSAMAX a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku FOSAMAX.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte FOSAMAX 35 mg na stav, pro který nebyl předepsán. Nedávejte FOSAMAX 35 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o FOSAMAX. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku FOSAMAX, které jsou určeny pro zdravotníky. Pro více informací navštivte: www.FOSAMAX.com nebo volejte 1-800-622-4477 (bezplatně).
Jaké jsou složky přípravku FOSAMAX?
Účinná látka: alendronát sodný
Neaktivní složky: mikrokrystalická celulóza, bezvodá laktóza, sodná sůl kroskarmelózy, magnesium-stearát.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
