Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Diflucan a jak se používá?
Diflucan je lék na předpis používaný k léčbě příznaků plísňových infekcí. Diflucan 50 mg lze užívat samostatně nebo s jinými léky.
Diflucan 100 mg patří do třídy léků nazývaných antimykotika.
Jaké jsou vedlejší účinky přípravku Diflucan 150 mg?
Diflucan 100 mg může způsobit závažné nežádoucí účinky, včetně:
- rychlý nebo bušení srdce,
- chvění v tvé hrudi,
- dušnost,
- náhlá závrať,
- horečka,
- zimnice,
- bolesti těla,
- příznaky chřipky,
- snadná tvorba modřin nebo krvácení,
- neobvyklá slabost,
- záchvat (křeče),
- kožní vyrážka nebo léze,
- ztráta chuti k jídlu,
- bolest v horní části žaludku,
- tmavá moč,
- stolice hliněné barvy, a
- zežloutnutí očí nebo kůže (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Diflucan patří:
- nevolnost,
- bolest břicha,
- průjem,
- žaludeční nevolnost,
- bolest hlavy,
- závratě a
- změny ve vašem vnímání chuti
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Diflucan. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
DIFLUCAN® (flukonazol), první z nové podtřídy syntetických triazolových antifungálních činidel, je dostupný jako tablety pro perorální podání, jako prášek pro perorální suspenzi.
Flukonazol je chemicky označen jako 2,4-difluor-a,al-bis(1H-1,2,4-triazol-1-ylmethyl)benzylalkohol s empirickým vzorcem C13H12F2N6O a molekulovou hmotností 306,3. Strukturní vzorec je:
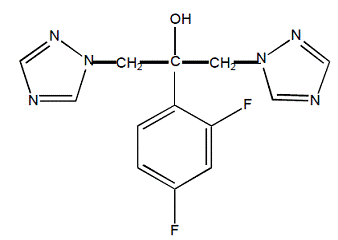
Flukonazol je bílá krystalická pevná látka, která je mírně rozpustná ve vodě a fyziologickém roztoku.
Tablety DIFLUCAN obsahují 50, 100, 150 nebo 200 mg flukonazolu a následující neaktivní složky: mikrokrystalická celulóza, bezvodý hydrogenfosforečnan vápenatý, povidon, sodná sůl kroskarmelózy, barvivo hlinitý lak FD&C Red č. 40 a stearát hořečnatý.
DIFLUCAN pro perorální suspenzi obsahuje 350 mg nebo 1400 mg flukonazolu a následující neúčinné složky: sacharózu, dihydrát citronanu sodného, bezvodou kyselinu citronovou, benzoát sodný, oxid titaničitý, koloidní oxid křemičitý, xanthanovou gumu a přírodní pomerančové aroma. Po rekonstituci s 24 ml destilované vody nebo čištěné vody (USP) obsahuje každý ml rekonstituované suspenze 10 mg nebo 40 mg flukonazolu.
INDIKACE
DIFLUCAN (flukonazol) je indikován k léčbě:
- Vaginální kandidóza (vaginální kvasinkové infekce způsobené Candidou).
- Orofaryngeální a ezofageální kandidóza. V otevřených nesrovnávacích studiích s relativně malým počtem pacientů byl DIFLUCAN účinný také při léčbě kandidových infekcí močových cest, peritonitidy a systémových kandidových infekcí včetně kandidémie, diseminované kandidózy a pneumonie.
- Kryptokoková meningitida. Než předepíšete DIFLUCAN (flukonazol) pacientům s AIDS s kryptokokovou meningitidou, viz. Klinické studie sekce. Studie srovnávající DIFLUCAN 150 mg s amfotericinem B u pacientů neinfikovaných HIV nebyly provedeny.
Profylaxe
DIFLUCAN je také indikován ke snížení výskytu kandidózy u pacientů podstupujících transplantaci kostní dřeně, kteří dostávají cytotoxickou chemoterapii a/nebo radiační terapii.
Před léčbou by měly být odebrány vzorky pro kultivaci hub a další relevantní laboratorní studie (sérologie, histopatologie), aby se izolovaly a identifikovaly kauzální organismy. Terapie může být zahájena dříve, než jsou známy výsledky kultivací a jiných laboratorních studií; jakmile však budou tyto výsledky k dispozici, měla by být antiinfekční léčba odpovídajícím způsobem upravena.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování a podávání u dospělých
Jedna dávka
Vaginální kandidóza
Doporučená dávka přípravku DIFLUCAN pro vaginální kandidózu je 150 mg v jedné perorální dávce.
Vícenásobná dávka
JELIKOŽ JE PERORÁLNÍ Vstřebání RYCHLÉ A TÉMĚŘ ÚPLNÉ, JE DENNÍ DÁVKA DIFLUCANU (FLUKONAZOL) STEJNÁ PRO PERORÁLNÍ (TABLETY A SUSPENZE) I INTRAVENÓZNÍ PODÁNÍ. Obecně se první den léčby doporučuje nasycovací dávka ve výši dvojnásobku denní dávky, aby byly plazmatické koncentrace blízké rovnovážnému stavu do druhého dne léčby.
Denní dávka přípravku DIFLUCAN 100 mg pro léčbu infekcí jiných než vaginální kandidóza by měla být založena na infikujícím organismu a odpovědi pacientky na léčbu. Léčba by měla pokračovat, dokud klinické parametry nebo laboratorní testy neukážou, že aktivní plísňová infekce ustoupila. Nedostatečná doba léčby může vést k opakování aktivní infekce. Pacienti s AIDS a kryptokokovou meningitidou nebo recidivující orofaryngeální kandidózou obvykle vyžadují udržovací léčbu, aby se zabránilo relapsu.
Orofaryngeální kandidóza
Doporučená dávka přípravku DIFLUCAN pro orofaryngeální kandidózu je 200 mg první den, poté 100 mg jednou denně. Klinické známky orofaryngeální kandidózy obecně odezní během několika dnů, ale léčba by měla pokračovat alespoň 2 týdny, aby se snížila pravděpodobnost relapsu.
Kandidóza jícnu
Doporučená dávka přípravku DIFLUCAN 200 mg při kandidóze jícnu je 200 mg první den, poté 100 mg jednou denně. Mohou být použity dávky až 400 mg/den na základě lékařského posouzení pacientovy odpovědi na terapii. Pacienti s kandidózou jícnu by měli být léčeni minimálně tři týdny a minimálně dva týdny po vymizení příznaků.
Systémové infekce Candida
U systémových infekcí Candida včetně kandidémie, diseminované kandidózy a pneumonie nebylo stanoveno optimální terapeutické dávkování a délka léčby. V otevřených, nekomparativních studiích na malém počtu pacientů byly použity dávky až 400 mg denně.
Infekce močových cest a peritonitida
Pro léčbu kandidových infekcí močových cest a peritonitidy byly v otevřených, nesrovnávacích studiích na malém počtu pacientů použity denní dávky 50 až 200 mg.
Kryptokoková meningitida
Doporučená dávka pro léčbu akutní kryptokokové meningitidy je 400 mg první den, poté 200 mg jednou denně. Může být použita dávka 400 mg jednou denně na základě lékařského posouzení pacientovy odpovědi na terapii. Doporučená délka léčby pro úvodní terapii kryptokokové meningitidy je 10 až 12 týdnů po kultivaci mozkomíšního moku. Doporučená dávka přípravku DIFLUCAN 150 mg k potlačení relapsu kryptokokové meningitidy u pacientů s AIDS je 200 mg jednou denně.
Profylaxe u pacientů podstupujících transplantaci kostní dřeně
Doporučená denní dávka přípravku DIFLUCAN pro prevenci kandidózy u pacientů podstupujících transplantaci kostní dřeně je 400 mg jednou denně. Pacienti, u kterých se očekává závažná granulocytopenie (méně než 500 buněk neutrofilů/mm³), by měli zahájit profylaxi přípravkem DIFLUCAN několik dní před očekávaným nástupem neutropenie a pokračovat 7 dní poté, co počet neutrofilů stoupne nad 1000 buněk/mm³.
Dávkování a podávání u dětí
Následující schéma ekvivalence dávek by mělo obecně zajistit ekvivalentní expozici u pediatrických a dospělých pacientů:
Zkušenosti s přípravkem DIFLUCAN u novorozenců jsou omezeny na farmakokinetické studie u předčasně narozených novorozenců. (Vidět KLINICKÁ FARMAKOLOGIE .) Na základě prodlouženého poločasu rozpadu pozorovaného u předčasně narozených novorozenců (gestační věk 26 až 29 týdnů) by tyto děti měly v prvních dvou týdnech života dostávat stejnou dávku (mg/kg) jako starší děti, ale podávat každých 72 hodin. Po prvních dvou týdnech by těmto dětem měla být dávka podávána jednou denně. Nejsou dostupné žádné informace o farmakokinetice přípravku DIFLUCAN u donošených novorozenců.
Orofaryngeální kandidóza
Doporučená dávka přípravku DIFLUCAN 150 mg pro orofaryngeální kandidózu u dětí je 6 mg/kg první den, poté 3 mg/kg jednou denně. Léčba by měla být podávána alespoň 2 týdny, aby se snížila pravděpodobnost relapsu.
Kandidóza jícnu
Pro léčbu kandidózy jícnu je doporučená dávka přípravku DIFLUCAN u dětí 6 mg/kg první den, poté 3 mg/kg jednou denně. Mohou být použity dávky až 12 mg/kg/den na základě lékařského posouzení pacientovy odpovědi na terapii. Pacienti s kandidózou jícnu by měli být léčeni minimálně tři týdny a minimálně 2 týdny po vymizení příznaků.
Systémové infekce Candida
Pro léčbu kandidémie a roztroušené infekce Candida byly v otevřené, nekomparativní studii na malém počtu dětí použity denní dávky 6 až 12 mg/kg/den.
Kryptokoková meningitida
Pro léčbu akutní kryptokokové meningitidy je doporučená dávka 12 mg/kg první den, poté 6 mg/kg jednou denně. Může být použita dávka 12 mg/kg jednou denně na základě lékařského posouzení pacientovy odpovědi na terapii. Doporučená délka léčby pro úvodní terapii kryptokokové meningitidy je 10 až 12 týdnů po kultivaci mozkomíšního moku. K potlačení relapsu kryptokokové meningitidy u dětí s AIDS je doporučená dávka přípravku DIFLUCAN 6 mg/kg jednou denně.
Dávkování u pacientů s poruchou funkce ledvin
Flukonazol je primárně vylučován ledvinami jako nezměněný lék. U vaginální kandidózy není nutné upravovat terapii jednorázovou dávkou z důvodu poruchy funkce ledvin. U pacientů s poruchou funkce ledvin, kteří budou dostávat opakované dávky DIFLUCANu, by měla být podána úvodní nasycovací dávka 50 mg až 400 mg. Po nasycovací dávce by denní dávka (podle indikace) měla vycházet z následující tabulky:
Pacienti na hemodialýze by měli po každé hemodialýze dostat 100 % doporučené dávky; ve dnech bez dialýzy by pacienti měli dostávat sníženou dávku podle jejich clearance kreatininu.
Toto jsou navrhované úpravy dávky na základě farmakokinetiky po podání více dávek. V závislosti na klinickém stavu může být zapotřebí další úprava.
Pokud je sérový kreatinin jediným dostupným měřítkem funkce ledvin, měl by se k odhadu clearance kreatininu u dospělých použít následující vzorec (na základě pohlaví, hmotnosti a věku pacienta):
Muži: Hmotnost (kg) × (140 – věk)/ 72 × sérový kreatinin (mg/100 ml)
Ženy: 0,85 × nad hodnotou
Přestože farmakokinetika flukonazolu nebyla studována u dětí s renální insuficiencí, snížení dávky u dětí s renální insuficiencí by mělo být stejné jako u dospělých. K odhadu clearance kreatininu u dětí lze použít následující vzorec:
× lineární délka nebo výška (cm)/ sérový kreatinin (mg/100 ml)
(Kde K=0,55 pro děti starší 1 roku a 0,45 pro kojence.)
Správa
DIFLUCAN 100 mg se podává perorálně. DIFLUCAN lze užívat s jídlem nebo bez jídla.
Pokyny pro míchání perorální suspenze
Připravte suspenzi v době dávkování následovně: poklepávejte lahvičkou, dokud všechen prášek volně nevytéká. Pro rekonstituci přidejte 24 ml destilované vody nebo čištěné vody (USP) do lahvičky s flukonazolem a důkladně protřepejte, aby se prášek suspendoval. Každá lahvička dodá 35 ml suspenze. Koncentrace rekonstituovaných suspenzí jsou následující:
Poznámka: Před použitím perorální suspenzi dobře protřepejte. Rekonstituovanou suspenzi uchovávejte mezi 86 °F (30 °C) a 41 °F (5 °C) a nepoužitou část po 2 týdnech zlikvidujte. Chraňte před mrazem.
JAK DODÁVÁNO
DIFLUCAN 100 mg tablety Růžové lichoběžníkové tablety obsahující 50, 100 nebo 200 mg flukonazolu jsou baleny v lahvičkách nebo jednodávkových blistrech. Tablety flukonazolu 150 mg jsou růžové a oválného tvaru, balené v blistru s jednou dávkou.
Tablety DIFLUCAN se dodávají následovně:
DIFLUCAN 50 mg tablety : Vyryto „DIFLUCAN“ a „50“ na přední straně a „ROERIG“ na zadní straně.
NDC 0049-3410-30 Láhve po 30
DIFLUCAN 100 mg tablety : Vyryto „DIFLUCAN“ a „100“ na přední straně a „ROERIG“ na zadní straně.
NDC 0049-3420-30 Láhve po 30 NDC 0049-3420-41 Jednodávkové balení po 100 ks
DIFLUCAN 150 mg tablety : Vyryto „DIFLUCAN“ a „150“ na přední straně a „ROERIG“ na zadní straně.
NDC 0049-3500-79 Jednodávkové balení po 1
DIFLUCAN 200 mg tablety : Vyryto „DIFLUCAN“ a „200“ na přední straně a „ROERIG“ na zadní straně.
NDC 0049-3430-30 Láhve po 30 NDC 0049-3430-41 Jednodávkové balení po 100 ks
Úložný prostor
Tablety uchovávejte při teplotě do 30 °C (86 °F).
DIFLUCAN 100 mg pro perorální suspenzi : DIFLUCAN pro perorální suspenzi se dodává jako prášek s pomerančovou příchutí, který poskytuje 35 ml na lahvičku následovně:
NDC 0049-3440-19 Flukonazol 350 mg v lahvičce NDC 0049-3450-19 Flukonazol 1400 mg na lahvičku
Úložný prostor
Suchý prášek skladujte při teplotě do 30 °C. Rekonstituovanou suspenzi uchovávejte mezi 86 °F (30 °C) a 41 °F (5 °C) a nepoužitou část po 2 týdnech zlikvidujte. Chraňte před mrazem.
Distribuce: Roerig Division of Pfizer Inc., NY, NY 10017. Revize: říjen 2021
VEDLEJŠÍ EFEKTY
DIFLUCAN je obecně dobře snášen.
U některých pacientů, zejména u pacientů se závažným základním onemocněním, jako je AIDS a rakovina, byly během léčby flukonazolem a srovnávacími látkami pozorovány změny ve výsledcích renálních a hematologických funkčních testů a jaterní abnormality, ale klinický význam a vztah k léčbě jsou nejisté.
U pacientek, které dostávají jednu dávku pro vaginální kandidózu
Během srovnávacích klinických studií provedených ve Spojených státech amerických bylo 448 pacientek s vaginální kandidózou léčeno DIFLUCANem v jedné dávce 150 mg. Celková incidence nežádoucích účinků možná souvisejících s DIFLUCANem byla 26 %. U 422 pacientů užívajících aktivní srovnávací látky byla incidence 16 %. Nejčastější nežádoucí účinky související s léčbou hlášené u pacientek, které dostávaly 150 mg jednorázové dávky flukonazolu na vaginitidu, byly bolest hlavy (13 %), nauzea (7 %) a bolest břicha (6 %). Další nežádoucí účinky hlášené s incidencí rovnou nebo vyšší než 1 % zahrnovaly průjem (3 %), dyspepsii (1 %), závratě (1 %) a poruchu chuti (1 %). Většina hlášených nežádoucích účinků byla mírná až středně závažná. Vzácně byly z marketingových zkušeností hlášeny angioedém a anafylaktická reakce.
U pacientů, kteří dostávají více dávek pro jiné infekce
Šestnáct procent z více než 4 000 pacientů léčených přípravkem DIFLUCAN (flukonazol) v klinických studiích trvajících 7 dní nebo více zaznamenalo nežádoucí účinky. Léčba byla přerušena u 1,5 % pacientů kvůli nežádoucím klinickým příhodám a u 1,3 % pacientů kvůli abnormalitám laboratorních testů.
Klinické nežádoucí příhody byly hlášeny častěji u pacientů infikovaných HIV (21 %) než u pacientů neinfikovaných HIV (13 %); vzory u pacientů infikovaných HIV a pacientů neinfikovaných HIV však byly podobné. Podíl pacientů přerušujících léčbu z důvodu klinických nežádoucích účinků byl v obou skupinách podobný (1,5 %).
Následující klinické nežádoucí účinky související s léčbou se vyskytly s incidencí 1 % nebo vyšší u 4 048 pacientů užívajících DIFLUCAN 50 mg po dobu 7 nebo více dnů v klinických studiích: nauzea 3,7 %, bolest hlavy 1,9 %, kožní vyrážka 1,8 %, zvracení 1,7 %, břišní dutina bolest 1,7 % a průjem 1,5 %.
Hepato-biliární
kombinovaných klinických studiích a marketingových zkušenostech se během léčby přípravkem DIFLUCAN vyskytly vzácné případy závažných jaterních reakcí. (Vidět VAROVÁNÍ .) Spektrum těchto jaterních reakcí se pohybovalo od mírného přechodného zvýšení transamináz až po klinickou hepatitidu, cholestázu a fulminantní jaterní selhání, včetně úmrtí. Případy fatálních jaterních reakcí se vyskytovaly především u pacientů se závažným základním onemocněním (převážně AIDS nebo malignita) a často při souběžném užívání více léků. Přechodné jaterní reakce, včetně hepatitidy a žloutenky, se objevily u pacientů bez dalších identifikovatelných rizikových faktorů. V každém z těchto případů se jaterní funkce vrátily na výchozí hodnoty po vysazení přípravku DIFLUCAN.
Ve dvou srovnávacích studiích hodnotících účinnost DIFLUCANu na potlačení relapsu kryptokokové meningitidy bylo pozorováno statisticky významné zvýšení mediánu hladin AST (SGOT) z výchozí hodnoty 30 IU/l na 41 IU/l v jedné studii a 34 IU/L až 66 IU/L v druhém. Celková míra zvýšení sérových transamináz na více než 8násobek horní hranice normálu byla v klinických studiích přibližně 1 % u pacientů léčených flukonazolem. Tato zvýšení se objevila u pacientů se závažným základním onemocněním, převážně AIDS nebo malignitami, z nichž většina dostávala souběžně více léků, včetně mnoha známých jako hepatotoxických. Výskyt abnormálně zvýšených sérových transamináz byl vyšší u pacientů užívajících DIFLUCAN současně s jedním nebo více z následujících léků: rifampinem, fenytoinem, isoniazidem, kyselinou valproovou nebo perorálními hypoglykemickými přípravky na bázi sulfonylmočoviny.
Postmarketingové zkušenosti
Kromě toho se po uvedení přípravku na trh vyskytly následující nežádoucí účinky.
Imunologické: Ve vzácných případech byla hlášena anafylaxe (včetně angioedému, edému obličeje a svědění).
Tělo jako celek: Astenie, únava, horečka, malátnost.
Kardiovaskulární: Prodloužení QT intervalu, torsade de pointes. (Vidět OPATŘENÍ .)
Centrální nervový systém: Záchvaty, závratě.
Hematopoetické a lymfatické: Leukopenie, včetně neutropenie a agranulocytózy, trombocytopenie.
Metabolické: Hypercholesterolémie, hypertriglyceridémie, hypokalémie.
Gastrointestinální: Cholestáza, sucho v ústech, hepatocelulární poškození, dyspepsie, zvracení.
Další smysly: Chuťová perverze.
Muskuloskeletální systém: myalgie.
Nervový systém: Nespavost, parestézie, somnolence, třes, vertigo.
Kůže a přílohy: Akutní generalizovaná exantematózní pustulóza, léková erupce včetně fixované lékové erupce, zvýšené pocení, exfoliativní kožní poruchy včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy, léková reakce s eozinofilií a systémovými příznaky (DRESS) (viz VAROVÁNÍ ), alopecie.
Nežádoucí účinky u dětí
Vzor a výskyt nežádoucích účinků a laboratorních abnormalit zaznamenaných během pediatrických klinických studií jsou srovnatelné s těmi, které byly pozorovány u dospělých.
V klinických studiích fáze II/III provedených ve Spojených státech a v Evropě bylo 577 dětských pacientů ve věku od 1 dne do 17 let léčeno přípravkem DIFLUCAN v dávkách až 15 mg/kg/den po dobu až 1 616 dnů. U třinácti procent dětí se vyskytly nežádoucí účinky související s léčbou. Nejčastěji hlášenými příhodami byly zvracení (5 %), bolest břicha (3 %), nauzea (2 %) a průjem (2 %). Léčba byla přerušena u 2,3 % pacientů kvůli nežádoucím klinickým příhodám a u 1,4 % pacientů kvůli abnormalitám laboratorních testů. Většina laboratorních abnormalit souvisejících s léčbou byla zvýšení transamináz nebo alkalické fosfatázy.
Procento pacientů s vedlejšími účinky souvisejícími s léčbou
DROGOVÉ INTERAKCE
(Vidět KONTRAINDIKACE .) Flukonazol je středně silný inhibitor CYP2C9 a CYP3A4. Flukonazol je také silným inhibitorem CYP2C19. Pacienti léčení přípravkem DIFLUCAN, kteří jsou současně léčeni léky s úzkým terapeutickým oknem metabolizovaným prostřednictvím CYP2C9 a CYP3A4, by měli být sledováni z hlediska nežádoucích účinků spojených se souběžně podávanými léky. Kromě pozorovaných/zdokumentovaných interakcí uvedených níže existuje riziko zvýšené plazmatické koncentrace dalších sloučenin metabolizovaných CYP2C9, CYP2C19 a CYP3A4 podávaných současně s flukonazolem. Proto je třeba při používání těchto kombinací postupovat opatrně a pacienty je třeba pečlivě sledovat. Inhibiční účinek flukonazolu na enzymy přetrvává 4 až 5 dnů po ukončení léčby flukonazolem kvůli dlouhému poločasu flukonazolu. Byly pozorovány klinicky nebo potenciálně významné lékové interakce mezi přípravkem DIFLUCAN 200 mg a následujícími látkami/třídami a jsou podrobněji popsány níže:
Alfentanil
Studie pozorovala snížení clearance a distribučního objemu a také prodloužení t½ alfentanilu po současné léčbě flukonazolem. Možným mechanismem účinku je inhibice CYP3A4 flukonazolem. Může být nutné upravit dávkování alfentanilu.
Amiodaron
Současné podávání flukonazolu s amiodaronem může zvýšit prodloužení QT intervalu. Je-li nutné současné užívání flukonazolu a amiodaronu, zejména s vysokými dávkami flukonazolu (800 mg), je třeba postupovat opatrně.
Amitriptylin, nortriptylin
Flukonazol zvyšuje účinek amitriptylinu a nortriptylinu. 5-nortriptylin a/nebo S-amitriptylin lze měřit na začátku kombinované terapie a po 1 týdnu. V případě potřeby je třeba upravit dávkování amitriptylinu/nortriptylinu.
Amfotericin B
Současné podávání flukonazolu a amfotericinu B infikovaným normálním a imunosuprimovaným myším ukázalo následující výsledky: malý aditivní antimykotický účinek u systémové infekce Candida albicans, žádná interakce u intrakraniální infekce Cryptococcus neoformans a antagonismus těchto dvou léků u systémové infekce A fumigatus. Klinický význam výsledků získaných v těchto studiích není znám.
azithromycin
Otevřená, randomizovaná, třícestná zkřížená studie u 18 zdravých subjektů hodnotila účinek jedné 1200mg perorální dávky azithromycinu na farmakokinetiku jednorázové 800mg perorální dávky flukonazolu a také účinky flukonazolu na farmakokinetiku azithromycinu. Mezi flukonazolem a azithromycinem nedošlo k žádné významné farmakokinetické interakci.
Blokátory vápníkových kanálů
Někteří antagonisté vápníkových kanálů (nifedipin, isradipin, amlodipin, verapamil a felodipin) jsou metabolizováni CYP3A4. Flukonazol má potenciál zvýšit systémovou expozici antagonistům kalciových kanálů. Doporučuje se časté sledování nežádoucích účinků.
karbamazepin
Flukonazol inhibuje metabolismus karbamazepinu a bylo pozorováno zvýšení sérového karbamazepinu o 30 %. Existuje riziko rozvoje toxicity karbamazepinu. Úprava dávkování karbamazepinu může být nezbytná v závislosti na měření koncentrace/účinku.
celekoxib
Během současné léčby flukonazolem (200 mg denně) a celekoxibem (200 mg) se Cmax celekoxibu zvýšily o 68 % a AUC o 134 %. Při kombinaci s flukonazolem může být nezbytná polovina dávky celekoxibu.
Antikoagulancia kumarinového typu
Protrombinový čas se může prodloužit u pacientů užívajících současně DIFLUCAN 150 mg a antikoagulancia kumarinového typu. Po uvedení přípravku na trh byly, stejně jako u jiných azolových antimykotik, hlášeny krvácivé příhody (podlitiny, epistaxe, gastrointestinální krvácení, hematurie a melena) ve spojení se zvýšením protrombinového času u pacientů užívajících flukonazol současně s warfarinem. U pacientů užívajících DIFLUCAN 50 mg a antikoagulancia kumarinového typu se doporučuje pečlivé sledování protrombinového času. Může být nutná úprava dávky warfarinu. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
cyklofosfamid
Kombinovaná léčba cyklofosfamidem a flukonazolem vede ke zvýšení sérového bilirubinu a sérového kreatininu. Kombinaci lze použít při zvýšeném zvážení rizika zvýšení sérového bilirubinu a sérového kreatininu.
Cyklosporin
DIFLUCAN 100 mg významně zvyšuje hladiny cyklosporinu u pacientů po transplantaci ledvin s poruchou funkce ledvin nebo bez ní. U pacientů užívajících DIFLUCAN a cyklosporin se doporučuje pečlivé sledování koncentrací cyklosporinu a sérového kreatininu. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí Tato kombinace může být použita snížením dávky cyklosporinu v závislosti na koncentraci cyklosporinu.
Fentanyl
Byl hlášen jeden fatální případ možné interakce fentanyl-flukonazol. Autor usoudil, že pacient zemřel na intoxikaci fentanylem. Navíc v randomizované zkřížené studii s 12 zdravými dobrovolníky bylo prokázáno, že flukonazol významně zpomaluje eliminaci fentanylu. Zvýšená koncentrace fentanylu může vést k respirační depresi.
Inhibitory HMG-CoA reduktázy
Riziko myopatie a rhabdomyolýzy se zvyšuje při současném podávání flukonazolu s inhibitory HMG-CoA reduktázy metabolizovanými prostřednictvím CYP3A4, jako je atorvastatin a simvastatin, nebo prostřednictvím CYP2C9, jako je fluvastatin. Je-li nutná současná léčba, pacient by měl být sledován kvůli symptomům myopatie a rhabdomyolýzy a měla by být monitorována kreatininkináza. Inhibitory HMG-CoA reduktázy by měly být vysazeny, pokud je pozorováno výrazné zvýšení kreatininkinázy nebo je diagnostikována nebo podezření na myopatii/rhabdomyolýzu.
hydrochlorothiazid
Ve farmakokinetické interakční studii zvýšilo současné podávání více dávek hydrochlorothiazidu zdravým dobrovolníkům užívajícím flukonazol plazmatické koncentrace flukonazolu o 40 %. Účinek tohoto rozsahu by neměl vyžadovat změnu v dávkovacím režimu flukonazolu u subjektů užívajících současně diuretika.
Ibrutinib
Středně silné inhibitory CYP3A4, jako je flukonazol, mohou zvýšit plazmatické koncentrace ibrutinibu a zvýšit riziko nežádoucích účinků spojených s ibrutinibem. Pokud se ibrutinib a flukonazol podávají souběžně, snižte dávku ibrutinibu podle pokynů v informacích o předepisování ibrutinibu a pacient by měl být často sledován z hlediska jakýchkoli nežádoucích účinků spojených s ibrutinibem.
Lemborexant
Současné podávání flukonazolu zvýšilo Cmax lemborexantu přibližně 1,6krát a AUC 4,2krát, v daném pořadí, u nichž se očekává zvýšení rizika nežádoucích účinků, jako je somnolence. Vyhněte se současnému užívání přípravku DIFLUCAN s lemborexantem.
losartan
Flukonazol inhibuje metabolismus losartanu na jeho aktivní metabolit (E-31 74), který je odpovědný za většinu antagonismu vůči receptoru angiotenzinu II, ke kterému dochází během léčby losartanem. Pacienti by měli mít neustále monitorován krevní tlak.
metadon
Flukonazol může zvýšit sérovou koncentraci metadonu. Může být nutné upravit dávkování metadonu.
Nesteroidní protizánětlivé léky
Cmax a AUC flurbiprofenu byly zvýšeny o 23 % a 81 %, v daném pořadí, při současném podávání s flukonazolem ve srovnání s podáváním samotného flurbiprofenu. Podobně se Cmax a AUC farmakologicky aktivního izomeru [S-(+)-ibuprofenu] zvýšily o 15 % a 82 %, když byl flukonazol podáván současně s racemickým ibuprofenem (400 mg) ve srovnání s podáváním samotného racemického ibuprofenu.
Ačkoli to není specificky studováno, flukonazol má potenciál zvýšit systémovou expozici jiných nesteroidních protizánětlivých léků (NSAID), které jsou metabolizovány CYP2C9 (např. naproxen, lornoxicam, meloxicam, diklofenak). Doporučuje se časté sledování nežádoucích účinků a toxicity související s NSAID. Může být nutné upravit dávkování NSAID.
Olaparib
Středně silné inhibitory CYP3A4, jako je flukonazol, zvyšují plazmatické koncentrace olaparibu; současné užívání se nedoporučuje. Pokud se kombinaci nelze vyhnout, snižte dávku olaparibu podle pokynů v Informacích o předepisování přípravku LYNPARZA® (Olaparib).
Orální antikoncepce
Byly provedeny dvě farmakokinetické studie s kombinovanou perorální antikoncepcí s opakovaným podáváním flukonazolu. Ve studii s 50 mg flukonazolu nebyly zjištěny žádné relevantní účinky na hladinu hormonů, zatímco při dávce 200 mg denně byly AUC ethinylestradiolu a levonorgestrelu zvýšeny o 40 % a 24 %. Je tedy nepravděpodobné, že by opakované podávání flukonazolu v těchto dávkách mělo vliv na účinnost kombinované perorální antikoncepce.
Orální hypoglykemie
Klinicky významná hypoglykémie může být vyvolána použitím DIFLUCANu s perorálními hypoglykemickými přípravky; bylo hlášeno jedno úmrtí v důsledku hypoglykémie v souvislosti s kombinovaným užíváním DIFLUCAN 150 mg a glyburidu. DIFLUCAN snižuje metabolismus tolbutamidu, glyburidu a glipizidu a zvyšuje plazmatickou koncentraci těchto látek. Pokud je DIFLUCAN 100 mg užíván současně s těmito nebo jinými perorálními hypoglykemickými přípravky obsahujícími sulfonylmočovinu, je třeba pečlivě sledovat koncentrace glukózy v krvi a podle potřeby upravit dávku sulfonylmočoviny. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
fenytoin
DIFLUCAN zvyšuje plazmatické koncentrace fenytoinu. Doporučuje se pečlivé sledování koncentrací fenytoinu u pacientů užívajících DIFLUCAN 50 mg a fenytoin. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
pimozid
Ačkoli to nebylo studováno in vitro ani in vivo, současné podávání flukonazolu s pimozidem může vést k inhibici metabolismu pimozidu. Zvýšené plazmatické koncentrace pimozidu mohou vést k prodloužení QT intervalu a vzácnému výskytu torsade de pointes. Současné podávání flukonazolu a pimozidu je kontraindikováno.
Prednison
Byla zaznamenána kazuistika, že u pacienta s transplantovanými játry léčeného prednisonem se rozvinula akutní insuficience kůry nadledvin, když byla přerušena 3měsíční terapie flukonazolem. Vysazení flukonazolu pravděpodobně způsobilo zvýšenou aktivitu CYP3A4, což vedlo ke zvýšenému metabolismu prednisonu. Pacienti dlouhodobě léčeni flukonazolem a prednisonem by měli být po vysazení flukonazolu pečlivě sledováni kvůli insuficienci kůry nadledvin.
Chinidin
Ačkoli to nebylo studováno in vitro ani in vivo, současné podávání flukonazolu s chinidinem může vést k inhibici metabolismu chinidinu. Užívání chinidinu bylo spojeno s prodloužením QT intervalu a vzácným výskytem torsade de pointes. Současné podávání flukonazolu a chinidinu je kontraindikováno. (Vidět KONTRAINDIKACE .)
rifabutin
Existují zprávy, že při současném podávání flukonazolu s rifabutinem dochází k interakci, která vede ke zvýšení sérových hladin rifabutinu až o 80 %. U pacientů, kterým byly současně podávány flukonazol a rifabutin, byly hlášeny případy uveitidy. Pacienti užívající současně rifabutin a flukonazol by měli být pečlivě sledováni. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
rifampin
Rifampin zvyšuje metabolismus současně podávaného DIFLUCANU. V závislosti na klinických okolnostech je třeba zvážit zvýšení dávky přípravku DIFLUCAN 200 mg, pokud je podáván s rifampinem. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
saquinavir
Flukonazol zvyšuje AUC saquinaviru přibližně o 50 %, Cmax přibližně o 55 % a snižuje clearance saquinaviru přibližně o 50 % v důsledku inhibice jaterního metabolismu saquinaviru prostřednictvím CYP3A4 a inhibice P-glykoproteinu. Může být nutné upravit dávkování saquinaviru.
Krátkodobě působící benzodiazepiny
Po perorálním podání midazolamu vedl flukonazol k podstatnému zvýšení koncentrací midazolamu a psychomotorických účinků. Tento účinek na midazolam se zdá být výraznější po perorálním podání flukonazolu než po intravenózním podání flukonazolu. Pokud jsou krátkodobě působící benzodiazepiny, které jsou metabolizovány systémem cytochromu P450, podávány současně s flukonazolem, je třeba zvážit snížení dávky benzodiazepinů a pacienty je třeba náležitě sledovat. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
Sirolimus
Flukonazol zvyšuje plazmatické koncentrace sirolimu pravděpodobně inhibicí metabolismu sirolimu prostřednictvím CYP3A4 a P-glykoproteinu. Tato kombinace může být použita s úpravou dávkování sirolimu v závislosti na měření účinku/koncentrace.
takrolimus
Flukonazol může zvýšit sérové koncentrace perorálně podávaného takrolimu až 5krát v důsledku inhibice metabolismu takrolimu prostřednictvím CYP3A4 ve střevech. Při intravenózním podání takrolimu nebyly pozorovány žádné významné farmakokinetické změny. Zvýšené hladiny takrolimu byly spojeny s nefrotoxicitou. Dávkování perorálně podávaného takrolimu by mělo být sníženo v závislosti na koncentraci takrolimu. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
Theofylin
DIFLUCAN 50 mg zvyšuje sérové koncentrace theofylinu. Doporučuje se pečlivé sledování sérových koncentrací theofylinu u pacientů užívajících DIFLUCAN 100 mg a theofylin. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
tofacitinib
Systémová expozice tofacitinibu se zvyšuje, pokud je tofacitinib podáván současně s flukonazolem. Snižte dávku tofacitinibu, pokud je podáván současně s flukonazolem (tj. z 5 mg dvakrát denně na 5 mg jednou denně, jak je uvedeno na štítku XELJANZ [tofacitinib]). (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
tolvaptan
Plazmatická expozice tolvaptanu se významně zvyšuje (200 % v AUC; 80 % v Cmax), když je tolvaptan, substrát CYP3A4, podáván společně s flukonazolem, středně silným inhibitorem CYP3A4. Tato interakce může vést k riziku významného zvýšení nežádoucích účinků spojených s tolvaptanem, zejména významné diurézy, dehydratace a akutního selhání ledvin. Pokud se tolvaptan a flukonazol podávají souběžně, dávka tolvaptanu by měla být snížena podle pokynů v informacích o předepisování tolvaptanu a pacient by měl být často sledován z hlediska jakýchkoli nežádoucích účinků spojených s tolvaptanem.
triazolam
Flukonazol zvyšuje AUC triazolamu (jednorázová dávka) přibližně o 50 %, Cmax o 20 % až 32 % a zvyšuje t½ o 25 % až 50 % v důsledku inhibice metabolismu triazolamu. Může být nutné upravit dávkování triazolamu.
Vinca alkaloidy
Ačkoli to nebylo studováno, flukonazol může zvýšit plazmatické hladiny vinka alkaloidů (např. vinkristin a vinblastin) a vést k neurotoxicitě, která je pravděpodobně způsobena inhibičním účinkem na CYP3A4.
Vitamín A
Na základě kazuistiky u jednoho pacienta, který dostával kombinovanou léčbu kyselinou all-trans-retinoidní (kyselá forma vitaminu A) a flukonazolem, se vyvinuly nežádoucí účinky související s centrálním nervovým systémem (CNS) ve formě pseudotumoru cerebri, který vymizel po přerušení léčby flukonazolem. Tuto kombinaci lze použít, ale je třeba mít na paměti výskyt nežádoucích účinků souvisejících s CNS.
vorikonazol
Vyhněte se současnému podávání vorikonazolu a flukonazolu. Doporučuje se sledování nežádoucích účinků a toxicity související s vorikonazolem; zvláště pokud je léčba vorikonazolem zahájena do 24 hodin po poslední dávce flukonazolu. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí .)
zidovudin
Flukonazol zvyšuje Cmax zidovudinu o 84 % a AUC o 74 % v důsledku přibližně 45% snížení clearance zidovudinu po perorálním podání. Poločas zidovudinu byl rovněž prodloužen přibližně o 128 % po kombinované léčbě s flukonazolem. Pacienti užívající tuto kombinaci by měli být sledováni z hlediska rozvoje nežádoucích účinků souvisejících se zidovudinem. Může být zváženo snížení dávky zidovudinu.

Lékaři by si měli být vědomi toho, že studie interakcí s jinými léky, než které jsou uvedeny v části CLINICKÁ FARMAKOLOGIE, nebyly provedeny, ale takové interakce se mohou vyskytnout.
VAROVÁNÍ
OPATŘENÍ
Všeobecné
Některé azoly, včetně flukonazolu, byly spojovány s prodloužením QT intervalu na elektrokardiogramu. Flukonazol způsobuje prodloužení QT intervalu prostřednictvím inhibice proudu usměrňovače draslíkového kanálu (Ikr). Prodloužení QT intervalu způsobené jinými léčivými přípravky (jako je amiodaron) může být zesíleno inhibicí cytochromu P450 (CYP) 3A4. (Vidět OPATŘENÍ : Lékové interakce .) Během postmarketingového sledování se u pacientů užívajících flukonazol vyskytly vzácné případy prodloužení QT intervalu a torsade de pointes. Většina těchto hlášení se týkala vážně nemocných pacientů s mnoha zaměňujícími rizikovými faktory, jako je strukturální onemocnění srdce, abnormality elektrolytů a souběžná medikace, která k tomu mohla přispět. Pacienti s hypokalémií a pokročilým srdečním selháním mají zvýšené riziko výskytu život ohrožujících komorových arytmií a torsade de pointes.
Flukonazol by měl být podáván s opatrností pacientům s těmito potenciálně proarytmickými stavy.
Současné užívání flukonazolu a erythromycinu má potenciál zvýšit riziko kardiotoxicity (prodloužený QT interval, torsade de pointes) a následně náhlé srdeční smrti. Této kombinaci je třeba se vyhnout.
Flukonazol by měl být podáván s opatrností pacientům s renální dysfunkcí.
U pacientů užívajících azoly, včetně flukonazolu, byla hlášena adrenální insuficience. U pacientů užívajících flukonazol byly hlášeny reverzibilní případy adrenální insuficience.
DIFLUCAN 100 mg prášek pro perorální suspenzi obsahuje sacharózu a neměl by být podáván pacientům s dědičnou fruktózou, malabsorpcí glukózy/galaktózy a nedostatkem sacharázy-izomaltázy.
Při řízení vozidel nebo obsluze strojů je třeba vzít v úvahu, že se příležitostně mohou objevit závratě nebo záchvaty.
Jedna dávka
Pohodlí a účinnost režimu jednorázové perorální tablety flukonazolu pro léčbu vaginálních kvasinkových infekcí by měla být zvážena oproti přijatelnosti vyššího výskytu nežádoucích účinků souvisejících s lékem u DIFLUCANu (26 %) oproti intravaginálním lékům (16 %) v USA srovnávací klinické studie. (Vidět NEŽÁDOUCÍ REAKCE a Klinické studie .)
Neklinická toxikologie
Karcinogeneze, mutageneze a zhoršování plodnosti
Flukonazol nevykazoval žádné známky karcinogenního potenciálu u myší a potkanů léčených perorálně po dobu 24 měsíců v dávkách 2,5 mg/kg/den, 5 mg/kg/den nebo 10 mg/kg/den (přibližně 2 až 7násobek doporučené dávky pro člověka ). Samci potkanů léčených 5 mg/kg/den a 10 mg/kg/den měli zvýšený výskyt hepatocelulárních adenomů.
Flukonazol, s metabolickou aktivací nebo bez ní, byl negativní v testech na mutagenitu u čtyř kmenů S. typhimurium a v systému myšího lymfomu L5178Y. Cytogenetické studie in vivo (buňky kostní dřeně myší, po perorálním podání flukonazolu) a in vitro (lidské lymfocyty vystavené flukonazolu v dávce 1000 mcg/ml) neprokázaly žádné známky chromozomálních mutací.
Flukonazol neovlivnil fertilitu samců nebo samic potkanů léčených perorálně denními dávkami 5 mg/kg, 10 mg/kg nebo 20 mg/kg nebo parenterálními dávkami 5 mg/kg, 25 mg/kg nebo 75 mg /kg, ačkoli začátek porodu byl mírně opožděn při dávce 20 mg/kg PO. V intravenózní perinatální studii u potkanů v dávce 5 mg/kg, 20 mg/kg a 40 mg/kg byly u několika samic pozorovány dystokie a prodloužení porodu při dávce 20 mg/kg (přibližně 5 až 15násobek doporučené dávky pro člověka ) a 40 mg/kg, ale ne při 5 mg/kg. Poruchy porodu se projevily mírným zvýšením počtu mrtvě narozených mláďat a snížením přežití novorozenců při těchto dávkách. Účinky na porod u potkanů jsou v souladu s druhově specifickými vlastnostmi snižujícími estrogen, které produkují vysoké dávky flukonazolu. Taková hormonální změna nebyla pozorována u žen léčených flukonazolem. (Vidět KLINICKÁ FARMAKOLOGIE .)
Těhotenství
Teratogenní účinky
Potenciál poškození plodu
Je třeba se vyhnout použití v těhotenství s výjimkou pacientek se závažnými nebo potenciálně život ohrožujícími plísňovými infekcemi, u kterých lze flukonazol použít, pokud očekávaný přínos převáží možné riziko pro plod. Několik publikovaných kazuistik popisuje typ zřetelných vrozených anomálií u kojenců vystavených in utero vysokým dávkám mateřského flukonazolu (400 až 800 mg/den) během většiny nebo celého prvního trimestru. Tyto hlášené anomálie jsou podobné těm, které byly pozorovány ve studiích na zvířatech. U žen ve fertilním věku, které jsou léčeny přípravkem DIFLUCAN 400 až 800 mg/den, by měla být zvážena účinná antikoncepční opatření, která by měla pokračovat po celou dobu léčby a přibližně 1 týden (5 až 6 poločasů) po poslední dávce. Pokud se DIFLUCAN používá během těhotenství nebo pokud pacientka otěhotní během užívání léku, pacientka by měla být informována o potenciálním riziku pro plod. Spontánní potraty a vrozené abnormality byly na základě retrospektivních epidemiologických studií navrženy jako potenciální rizika spojená s 150 mg flukonazolu v jedné nebo opakované dávce v prvním trimestru těhotenství. Neexistují žádné adekvátní a dobře kontrolované studie s přípravkem DIFLUCAN 150 mg u těhotných žen. (Vidět VAROVÁNÍ : Potenciál poškození plodu .)
Lidská data
Kazuistiky popisují charakteristický a vzácný vzorec vrozených vad u kojenců, jejichž matky dostávaly vysoké dávky (400 až 800 mg/den) flukonazolu během většiny nebo celého prvního trimestru těhotenství. Mezi rysy pozorované u těchto kojenců patří brachycefalie, abnormální facies, abnormální calvariální vývoj, rozštěp patra, vyklenutí stehenní kosti, tenká žebra a dlouhé kosti, artrogrypóza a vrozená srdeční vada. Tyto účinky jsou podobné účinkům pozorovaným ve studiích na zvířatech.
Epidemiologické studie naznačují potenciální riziko spontánního potratu a vrozených abnormalit u kojenců, jejichž matky byly léčeny 150 mg flukonazolu v jedné nebo opakované dávce v prvním trimestru, ale tyto epidemiologické studie mají svá omezení a tyto nálezy nebyly potvrzeny v kontrolovaných klinických studiích. zkoušky.
Údaje o zvířatech
Flukonazol byl podáván orálně březím králíkům během organogeneze ve dvou studiích v dávkách 5 mg/kg, 10 mg/kg a 20 mg/kg a 5 mg/kg, 25 mg/kg a 75 mg/kg, v daném pořadí. Přírůstek hmotnosti matky byl narušen při všech úrovních dávek (přibližně 0,25 až 4násobek klinické dávky 400 mg na základě srovnání plochy povrchu těla [BSA]) a k potratům došlo při dávce 75 mg/kg (přibližně 4násobek klinické dávky 400 mg na základě BSA); nebyly pozorovány žádné nežádoucí účinky na plod.
několika studiích, ve kterých březí krysy dostávaly flukonazol perorálně během organogeneze, byl přírůstek hmotnosti matek narušen a hmotnost placenty byla zvýšena při dávce 25 mg/kg. Při dávce 5 mg/kg nebo 10 mg/kg nebyly pozorovány žádné účinky na plod; zvýšení fetálních anatomických variant (nadpočetná žebra, dilatace ledvinné pánvičky) a zpoždění osifikace byly pozorovány při dávkách 25 mg/kg a 50 mg/kg a vyšších. Při dávkách v rozmezí 80 až 320 mg/kg (přibližně 2 až 8násobek klinické dávky 400 mg na základě BSA) byla embryoletalita u potkanů zvýšená a fetální abnormality zahrnovaly zvlněná žebra, rozštěp patra a abnormální kraniofaciální osifikaci. Tyto účinky jsou v souladu s inhibicí syntézy estrogenu u potkanů a mohou být výsledkem známých účinků sníženého estrogenu na březost, organogenezi a porod.
Kojící matky
Na základě údajů ze studie u 10 kojících žen, které dočasně nebo trvale přerušily kojení 5 dní až 19 měsíců po porodu, byl flukonazol přítomen v mateřském mléce v nízkých hladinách po podání jedné dávky 150 mg. Odhadovaná denní kojenecká dávka flukonazolu z mateřského mléka (za předpokladu průměrné spotřeby mléka 150 ml/kg/den) na základě průměrné maximální koncentrace mléka (2,61 mcg/ml [rozmezí: 1,57 až 3,65 mcg/ml] za 5,2 hodiny po dávka) byla 0,39 mg/kg/den, což je přibližně 13 % doporučené pediatrické dávky pro orofaryngeální kandidózu. (Značená pediatrická dávka je 6 mg/kg/den první den a poté 3 mg/kg/den; odhadovaná dávka pro kojence je 13 % z udržovací dávky 3 mg/kg/den). Nejsou k dispozici žádné údaje o hladinách flukonazolu v mléce po opakovaném použití nebo po vysokých dávkách flukonazolu. Publikovaný průzkum 96 kojících žen, které byly léčeny flukonazolem v dávce 150 mg každý druhý den (průměrně 7,3 tobolky [rozsah 1 až 29 tobolek]) pro kandidózu prsů související s laktací, neuvedl u kojenců žádné závažné nežádoucí účinky. Při podávání DIFLUCANu kojící ženě je třeba postupovat opatrně.
Pediatrické použití
Otevřená, randomizovaná, kontrolovaná studie prokázala, že DIFLUCAN 100 mg je účinný při léčbě orofaryngeální kandidózy u dětí ve věku od 6 měsíců do 13 let. (Vidět Klinické studie .)
Použití přípravku DIFLUCAN 200 mg u dětí s kryptokokovou meningitidou, kandidovou ezofagitidou nebo systémovými kandidovými infekcemi je podpořeno účinností prokázanou pro tyto indikace u dospělých a výsledky několika malých nekomparativních pediatrických klinických studií. Kromě toho farmakokinetické studie u dětí (viz KLINICKÁ FARMAKOLOGIE ) stanovili proporcionalitu dávky mezi dětmi a dospělými. (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ .)
nekomparativní studii u dětí se závažnými systémovými plísňovými infekcemi, z nichž většina byla kandidémie, byla účinnost přípravku DIFLUCAN podobná účinnosti hlášené při léčbě kandidémie u dospělých. Ze 17 subjektů s kultivačně potvrzenou kandidémií bylo 11 ze 14 (79 %) s výchozími příznaky (3 byly asymptomatické) klinicky vyléčeno; U 13/15 (87 %) hodnotitelných pacientů došlo na konci léčby k mykologickému vyléčení, ale u dvou z těchto pacientů došlo k relapsu za 10 a 18 dnů po ukončení léčby.
Účinnost přípravku DIFLUCAN pro supresi kryptokokové meningitidy byla úspěšná u 4 z 5 dětí léčených ve studii flukonazolu ze soucitu s použitím flukonazolu k léčbě život ohrožující nebo závažné mykózy. Neexistují žádné informace o účinnosti flukonazolu v primární léčbě kryptokokové meningitidy u dětí.
Bezpečnostní profil přípravku DIFLUCAN 200 mg u dětí byl studován u 577 dětí ve věku od 1 dne do 17 let, které dostávaly dávky v rozmezí od 1 do 15 mg/kg/den po dobu 1 až 1 616 dnů. (Vidět NEŽÁDOUCÍ REAKCE .)
Účinnost přípravku DIFLUCAN nebyla stanovena u kojenců mladších 6 měsíců. (Vidět KLINICKÁ FARMAKOLOGIE .) Malý počet pacientů (29) ve věku od 1 dne do 6 měsíců byl bezpečně léčen přípravkem DIFLUCAN.
Geriatrické použití
pacientů bez AIDS byly nežádoucí účinky pravděpodobně související s léčbou flukonazolem hlášeny u méně pacientů ve věku 65 let a starších (9 %, n = 339) než u mladších pacientů (14 %, n = 2 240). Nebyl však konzistentní rozdíl mezi staršími a mladšími pacienty s ohledem na jednotlivé nežádoucí účinky. Z nejčastěji hlášených (>1 %) nežádoucích účinků se u většího podílu starších pacientů vyskytly vyrážka, zvracení a průjem. Podobné podíly starších pacientů (2,4 %) a mladších pacientů (1,5 %) přerušily léčbu flukonazolem kvůli nežádoucím účinkům. Po uvedení přípravku na trh byly spontánní zprávy o anémii a akutním selhání ledvin častější u pacientů ve věku 65 let nebo starších než u pacientů ve věku 12 až 65 let. Vzhledem k dobrovolnému charakteru zpráv a přirozenému nárůstu výskytu anémie a renálního selhání u starších osob však není možné stanovit příčinnou souvislost s expozicí léku.
Kontrolované klinické studie flukonazolu nezahrnovaly dostatečný počet pacientů ve věku 65 let a starších, aby bylo možné vyhodnotit, zda v každé indikaci reagují odlišně od mladších pacientů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty.
Flukonazol je primárně vylučován ledvinami jako nezměněný lék. Vzhledem k tomu, že u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba věnovat pozornost úpravě dávky na základě clearance kreatininu. Může být užitečné sledovat funkci ledvin. (Vidět KLINICKÁ FARMAKOLOGIE a DÁVKOVÁNÍ A PODÁVÁNÍ .)
PŘEDÁVKOVAT
Byly hlášeny případy předávkování flukonazolem doprovázené halucinacemi a paranoidním chováním.
V případě předávkování by měla být zahájena symptomatická léčba (s podpůrnými opatřeními a výplachem žaludku, pokud je to klinicky indikováno).
Flukonazol je z velké části vylučován močí. 3hodinová hemodialýza snižuje plazmatické hladiny přibližně o 50 %.
myší a potkanů, kterým byly podávány velmi vysoké dávky flukonazolu, zahrnovaly klinické účinky u obou druhů sníženou motilitu a dýchání, ptózu, slzení, slinění, inkontinenci moči, ztrátu vzpřimovacího reflexu a cyanózu; smrti někdy předcházely klonické křeče.
KONTRAINDIKACE
DIFLUCAN (flukonazol) je kontraindikován u pacientů, u kterých se projevila přecitlivělost na flukonazol nebo na kteroukoli z jeho pomocných látek. Neexistují žádné informace o zkřížené přecitlivělosti mezi flukonazolem a jinými azolovými antimykotiky. Při předepisování DIFLUCANu pacientům s přecitlivělostí na jiné azoly je třeba postupovat opatrně. Současné podávání jiných léků, o kterých je známo, že prodlužují QT interval a které jsou metabolizovány prostřednictvím enzymu CYP3A4, jako je erytromycin, pimozid a chinidin, je kontraindikováno u pacientů užívajících flukonazol. (Vidět KLINICKÁ FARMAKOLOGIE : Studie lékových interakcí a OPATŘENÍ .)
KLINICKÁ FARMAKOLOGIE
Farmakokinetika a metabolismus
Farmakokinetické vlastnosti flukonazolu jsou po intravenózním nebo perorálním podání podobné. U normálních dobrovolníků je biologická dostupnost perorálně podaného flukonazolu více než 90 % ve srovnání s intravenózním podáním. Bioekvivalence byla stanovena mezi 100 mg tabletou a oběma sílami suspenze, když byly podávány v jedné dávce 200 mg.
Maximální plazmatické koncentrace (Cmax) u normálních dobrovolníků nalačno se objevují mezi 1 a 2 hodinami s konečným poločasem eliminace z plazmy přibližně 30 hodin (rozmezí: 20 až 50 hodin) po perorálním podání.
U normálních dobrovolníků nalačno vede podání jedné perorální dávky 400 mg DIFLUCANu (flukonazolu) k průměrné Cmax 6,72 mcg/ml (rozmezí: 4,12 až 8,08 mcg/ml) a po jednotlivých perorálních dávkách 50 až 400 mg flukonazolu plazmatické koncentrace a plocha pod křivkou plazmatické koncentrace-čas (AUC) jsou úměrné dávce.
Údaje o Cmax a AUC ze studie účinku jídla zahrnující podávání tablet DIFLUCAN (flukonazol) zdravým dobrovolníkům nalačno a s jídlem s vysokým obsahem tuku ukázaly, že expozice léku není ovlivněna jídlem. Proto lze DIFLUCAN užívat bez ohledu na jídlo. (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ .)
Rovnovážných koncentrací je dosaženo během 5 až 10 dnů po perorálním podání dávek 50 až 400 mg podávaných jednou denně. Podání úvodní dávky (1. den) ve výši dvojnásobku obvyklé denní dávky vede k plazmatickým koncentracím blízkým rovnovážnému stavu do druhého dne. Zdánlivý distribuční objem flukonazolu se blíží objemu celkové tělesné vody. Vazba na plazmatické proteiny je nízká (11 až 12 %). Po jednorázovém nebo opakovaném perorálním podání po dobu až 14 dnů flukonazol proniká do všech studovaných tělesných tekutin (viz tabulka níže ). U normálních dobrovolníků byly koncentrace flukonazolu ve slinách stejné nebo mírně vyšší než plazmatické koncentrace bez ohledu na dávku, cestu nebo délku podávání. U pacientů s bronchiektáziemi byly koncentrace flukonazolu ve sputu po jednorázové perorální dávce 150 mg rovné plazmatickým koncentracím jak 4, tak 24 hodin po dávce. U pacientů s plísňovou meningitidou jsou koncentrace flukonazolu v mozkomíšním moku (CSF) přibližně 80 % odpovídajících plazmatických koncentrací.
Jedna perorální dávka 150 mg flukonazolu podaná 27 pacientkám pronikla do vaginální tkáně, což mělo za následek poměr tkáň:plazma v rozmezí od 0,94 do 1,14 během prvních 48 hodin po podání dávky.
Jedna perorální dávka 150 mg flukonazolu podaná 14 pacientkám pronikla do vaginální tekutiny, což mělo za následek poměr tekutina:plazma v rozmezí od 0,36 do 0,71 během prvních 72 hodin po podání.
normálních dobrovolníků je flukonazol primárně vylučován ledvinami, přičemž přibližně 80 % podané dávky se objeví v moči jako nezměněné léčivo. Asi 11 % dávky se vylučuje močí ve formě metabolitů.
Farmakokinetika flukonazolu je výrazně ovlivněna snížením funkce ledvin. Existuje inverzní vztah mezi poločasem eliminace a clearance kreatininu. U pacientů s poruchou funkce ledvin může být nutné snížit dávku přípravku DIFLUCAN. (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ .) 3hodinová hemodialýza snižuje plazmatické koncentrace přibližně o 50 %.
U normálních dobrovolníků bylo podávání DIFLUCANu (dávky v rozmezí od 200 mg do 400 mg jednou denně po dobu až 14 dnů) spojeno s malými a nekonzistentními účinky na koncentrace testosteronu, koncentrace endogenních kortikosteroidů a odpověď kortizolu stimulovaná adrenokortikotropním hormonem (ACTH).
Farmakokinetika u dětí
dětí byly hlášeny následující farmakokinetické údaje {střední (% cv)}:
Clearance korigovaná na tělesnou hmotnost nebyla v těchto studiích ovlivněna věkem. Průměrná tělesná clearance u dospělých je uváděna jako 0,23 (17 %) ml/min/kg.
U předčasně narozených novorozenců (gestační věk 26 až 29 týdnů) byla průměrná (% cv) clearance do 36 hodin po narození 0,180 (35 %, N=7) ml/min/kg, která se s časem zvyšovala na průměr 0,218 ( 31 %, N=9) ml/min/kg o šest dní později a 0,333 (56 %, N=4) ml/min/kg o 12 dní později. Podobně byl poločas 73,6 hodin, který se s časem snižoval na průměr 53,2 hodin o šest dní později a 46,6 hodin o 12 dní později.
Farmakokinetika u starších osob
Farmakokinetická studie byla provedena u 22 subjektů ve věku 65 let nebo starších, kterým byla podávána jedna perorální dávka 50 mg flukonazolu. Deset z těchto pacientů užívalo současně diuretika. Cmax byla 1,54 mcg/ml a objevila se 1,3 hodiny po dávce. Průměrná AUC byla 76,4 ± 20,3 mcg•h/ml a průměrný terminální poločas byl 46,2 hodin. Tyto hodnoty farmakokinetických parametrů jsou vyšší než analogické hodnoty uváděné u normálních mladých mužských dobrovolníků. Současné podávání diuretik významně nezměnilo AUC nebo Cmax. Kromě toho clearance kreatininu (74 ml/min), procento léčiva získaného v nezměněné podobě v moči (0 až 24 hodin, 22 %) a odhady renální clearance flukonazolu (0,124 ml/min/kg) u starších osob byly obecně nižší. než ti mladší dobrovolníci. Zdá se tedy, že změna dispozice flukonazolu u starších osob souvisí se sníženou funkcí ledvin charakteristickou pro tuto skupinu. Graf terminálního eliminačního poločasu každého subjektu versus clearance kreatininu ve srovnání s předpokládaným poločasem – křivkou clearance kreatininu odvozenou od normálních subjektů a subjektů s různým stupněm renální insuficience ukázal, že 21 z 22 subjektů spadalo do 95% mez spolehlivosti křivek předpokládaného poločasu vymizení kreatininu. Tyto výsledky jsou v souladu s hypotézou, že vyšší hodnoty farmakokinetických parametrů pozorované u starších subjektů ve srovnání s normálními mladými dobrovolníky mužského pohlaví jsou způsobeny sníženou funkcí ledvin, která se očekává u starších osob.
Studie lékových interakcí
(Vidět DROGOVÉ INTERAKCE )
Orální antikoncepce
Perorální antikoncepce byla podávána v jedné dávce před i po perorálním podání DIFLUCANu 50 mg jednou denně po dobu 10 dnů u 10 zdravých žen. Po podání 50 mg DIFLUCANu nebyl žádný významný rozdíl v AUC ethinylestradiolu nebo levonorgestrelu. Průměrné zvýšení AUC ethinylestradiolu bylo 6 % (rozmezí: – 47 až 108 %) a AUC levonorgestrelu se zvýšilo o 17 % (rozmezí: 33 až 141 %).
Ve druhé studii dostávalo dvacet pět normálních žen denní dávky 200 mg DIFLUCAN 150 mg tablety nebo placebo po dobu dvou deseti dnů. Mezi léčebnými cykly byl jeden měsíc, přičemž všichni jedinci dostávali DIFLUCAN během jednoho cyklu a placebo během druhého. Pořadí studijní léčby bylo náhodné. Jednotlivé dávky perorální antikoncepční tablety obsahující levonorgestrel a ethinylestradiol byly podávány poslední den léčby (den 10) obou cyklů. Po podání 200 mg DIFLUCANu bylo průměrné procento zvýšení AUC pro levonorgestrel ve srovnání s placebem 25 % (rozmezí: –12 až 82 %) a průměrné procento zvýšení pro ethinylestradiol ve srovnání s placebem bylo 38 % (rozmezí: – 11 až 101 %). Obě tato zvýšení byla statisticky významně odlišná od placeba.
Třetí studie hodnotila potenciální interakci podávání flukonazolu 300 mg jednou týdně 21 normálním ženám užívajícím perorální antikoncepci obsahující ethinylestradiol a norethindron. V této placebem kontrolované, dvojitě zaslepené, randomizované, dvoucestné zkřížené studii provedené během tří cyklů léčby perorální antikoncepcí vedlo dávkování flukonazolu k malému zvýšení středních AUC ethinylestradiolu a norethindronu ve srovnání s podobným dávkováním placeba. Průměrné hodnoty AUC ethinylestradiolu a norethindronu se zvýšily o 24 % (95% interval CI: 18 až 31 %) a 13 % (95% interval intervalu spolehlivosti: 8 až 18 %) ve srovnání s placebem. Léčba flukonazolem nezpůsobila snížení AUC ethinylestradiolu u žádného jednotlivého subjektu v této studii ve srovnání s dávkováním placeba. Individuální hodnoty AUC norethindronu poklesly velmi mírně (
Cimetidin
DIFLUCAN 100 mg byl podán jako jednorázová perorální dávka samostatně a dvě hodiny po jednorázové dávce 400 mg cimetidinu šesti zdravým dobrovolníkům mužského pohlaví. Po podání cimetidinu došlo k významnému poklesu AUC a Cmax flukonazolu. Došlo k průměrnému ± SD snížení AUC flukonazolu o 13 % ± 11 % (rozmezí: –3,4 až –31 %) a Cmax se snížilo o 19 % ± 14 % (rozmezí: –5 až –40 %). Podání cimetidinu 600 mg až 900 mg intravenózně po dobu čtyř hodin (od jedné hodiny před do 3 hodin po jednorázové perorální dávce DIFLUCAN 200 mg) však neovlivnilo biologickou dostupnost ani farmakokinetiku flukonazolu u 24 zdravých dobrovolníků mužského pohlaví. .
Antacid
Podání Maaloxu® (20 ml) 14 normálním mužským dobrovolníkům bezprostředně před jednorázovou dávkou DIFLUCAN 100 mg nemělo žádný vliv na absorpci nebo eliminaci flukonazolu.
hydrochlorothiazid
Současné perorální podávání 100 mg DIFLUCANu a 50 mg hydrochlorothiazidu po dobu 10 dnů 13 normálním dobrovolníkům vedlo k významnému zvýšení AUC a Cmax flukonazolu ve srovnání s DIFLUCANem podávaným samostatně. Došlo k průměrnému ± SD zvýšení AUC a Cmax flukonazolu o 45 % ± 31 % (rozsah: 19 až 114 %) a 43 % ± 31 % (rozmezí: 19 až 122 %), v daném pořadí. Tyto změny jsou připisovány průměrnému ± SD snížení renální clearance o 30 % ± 12 % (rozmezí: –10 až –50 %).
rifampin
Podání jedné perorální dávky 200 mg DIFLUCANu 200 mg po 15 dnech podávání rifampinu v dávce 600 mg denně osmi zdravým dobrovolníkům mužského pohlaví vedlo k významnému snížení AUC flukonazolu a významnému zvýšení zjevné perorální clearance flukonazolu. Bylo zjištěno průměrné ± SD snížení AUC flukonazolu o 23 % ± 9 % (rozmezí: –13 až –42 %). Zjevná perorální clearance flukonazolu se zvýšila o 32 % ± 17 % (rozmezí: 16 až 72 %). Poločas flukonazolu se snížil z 33,4 ± 4,4 hodin na 26,8 ± 3,9 hodin. (Vidět OPATŘENÍ .)
Warfarin
Po jednorázové dávce warfarinu (15 mg) podané 13 normálním mužským dobrovolníkům po perorálním podání DIFLUCANu 200 mg denně po dobu 14 dnů došlo k významnému zvýšení odpovědi na protrombinový čas (plocha pod křivkou protrombinového času v čase) ve srovnání s podáváním samotného warfarinu. Bylo zjištěno průměrné ± SD zvýšení protrombinové časové odpovědi (plocha pod křivkou protrombinový čas-čas) o 7 % ± 4 % (rozmezí: –2 až 13 %). (Vidět OPATŘENÍ .) Průměr je založen na údajích od 12 subjektů, protože jeden ze 13 subjektů zaznamenal dvojnásobné zvýšení odpovědi protrombinového času.
fenytoin
AUC fenytoinu byla stanovena po 4 dnech podávání fenytoinu (200 mg denně, perorálně po dobu 3 dnů a následně 250 mg intravenózně pro jednu dávku) jak s podáváním flukonazolu, tak bez něj (perorální DIFLUCAN 200 mg denně po dobu 16 dnů) u 10 normálních mužů dobrovolníci. Došlo k významnému zvýšení AUC fenytoinu. Průměrné ± SD zvýšení AUC fenytoinu bylo 88 % ± 68 % (rozmezí: 16 až 247 %). Absolutní velikost této interakce není známa kvůli přirozeně nelineárnímu rozložení fenytoinu. (Vidět OPATŘENÍ .)
Cyklosporin
AUC a Cmax cyklosporinu byly stanoveny před a po podání flukonazolu 200 mg denně po dobu 14 dnů u osmi pacientů po transplantaci ledviny, kteří byli na léčbě cyklosporinem po dobu nejméně 6 měsíců a na stabilní dávce cyklosporinu po dobu nejméně 6 týdnů. Po podání flukonazolu došlo k významnému zvýšení AUC, Cmax, Cmin cyklosporinu (24hodinová koncentrace) ak významnému snížení zdánlivé perorální clearance. Průměrné ± SD zvýšení AUC bylo 92 % ± 43 % (rozmezí: 18 až 147 %). Cmax se zvýšila o 60 % ± 48 % (rozmezí: –5 až 133 %). C se zvýšil o 157 % ± 96 % (rozsah: 33 až 360 %). Zdánlivá perorální clearance se snížila o 45 % ± 15 % (rozmezí: –15 až –60 %). (Vidět OPATŘENÍ .)
zidovudin
Plazmatické koncentrace zidovudinu byly stanoveny dvakrát (před a po flukonazolu 200 mg denně po dobu 15 dnů) u 13 dobrovolníků s AIDS nebo ARC, kteří byli na stabilní dávce zidovudinu po dobu alespoň dvou týdnů. Po podání flukonazolu došlo k významnému zvýšení AUC zidovudinu. Průměrné ± SD zvýšení AUC bylo 20 % ± 32 % (rozmezí: –27 až 104 %). Poměr metabolitu GZDV k mateřskému léčivu se po podání flukonazolu významně snížil ze 7,6 ± 3,6 na 5,7 ± 2,2.
Theofylin
Farmakokinetika theofylinu byla stanovena z jedné intravenózní dávky aminofylinu (6 mg/kg) před a po perorálním podání flukonazolu 200 mg denně po dobu 14 dnů u 16 normálních mužských dobrovolníků. Došlo k významnému zvýšení AUC, Cmax a poločasu theofylinu s odpovídajícím snížením clearance. Průměrná ± SD AUC theofylinu se zvýšila o 21 % ± 16 % (rozmezí: –5 až 48 %). Cmax se zvýšila o 13 % ± 17 % (rozmezí: –13 až 40 %). Clearance theofylinu se snížila o 16 % ± 11 % (rozmezí: – 32 až 5 %). Poločas theofylinu se zvýšil z 6,6 ± 1,7 hodiny na 7,9 ± 1,5 hodiny. (Vidět OPATŘENÍ .)
Chinidin
Ačkoli to nebylo studováno in vitro ani in vivo, současné podávání flukonazolu s chinidinem může vést k inhibici metabolismu chinidinu. Užívání chinidinu bylo spojeno s prodloužením QT intervalu a vzácným výskytem torsade de pointes. Současné podávání flukonazolu a chinidinu je kontraindikováno. (Vidět KONTRAINDIKACE a OPATŘENÍ .)
Orální hypoglykemie
Účinky flukonazolu na farmakokinetiku sulfonylmočovinových perorálních hypoglykemických látek tolbutamidu, glipizidu a glyburidu byly hodnoceny ve třech placebem kontrolovaných studiích u normálních dobrovolníků. Všichni jedinci dostávali sulfonylmočovinu samotnou jako jednu dávku a znovu jako jednu dávku po podávání DIFLUCANu 100 mg denně po dobu 7 dnů. V těchto třech studiích mělo 22/46 (47,8 %) pacientů léčených přípravkem DIFLUCAN a 9/22 (40,1 %) pacientů léčených placebem příznaky odpovídající hypoglykémii. (Vidět OPATŘENÍ .)
tolbutamid
U 13 normálních mužských dobrovolníků došlo po podání flukonazolu k významnému zvýšení AUC a Cmax tolbutamidu (jednorázová dávka 500 mg). Bylo zjištěno průměrné ± SD zvýšení AUC tolbutamidu o 26 % ± 9 % (rozmezí: 12 až 39 %). Cmax tolbutamidu se zvýšila o 11 % ± 9 % (rozmezí: – 6 až 27 %). (Vidět OPATŘENÍ .)
glipizid
AUC a Cmax glipizidu (jednorázová dávka 2,5 mg) byly významně zvýšeny po podání flukonazolu u 13 normálních mužských dobrovolníků. Došlo k průměrnému ± SD zvýšení AUC o 49 % ± 13 % (rozmezí: 27 až 73 %) a zvýšení Cmax o 19 % ± 23 % (rozsah: – 11 až 79 %). (Vidět OPATŘENÍ .)
Glyburide
AUC a Cmax glyburidu (5 mg jednotlivá dávka) byly významně zvýšeny po podání flukonazolu u 20 normálních mužských dobrovolníků. Došlo k průměrnému ± SD zvýšení AUC o 44 % ± 29 % (rozmezí: –13 až 115 %) a Cmax se zvýšilo o 19 % ± 19 % (rozmezí: –23 až 62 %). Pět subjektů vyžadovalo perorální podání glukózy po požití glyburidu po 7 dnech podávání flukonazolu. (Vidět OPATŘENÍ .)
rifabutin
Byly publikovány zprávy, že při současném podávání flukonazolu s rifabutinem dochází k interakci, která vede ke zvýšeným hladinám rifabutinu v séru. (Vidět OPATŘENÍ .)
takrolimus
Byly publikovány zprávy, že při současném podávání flukonazolu s takrolimem dochází k interakci, která vede ke zvýšení sérových hladin takrolimu. (Vidět OPATŘENÍ .)
midazolam
Vliv flukonazolu na farmakokinetiku a farmakodynamiku midazolamu byl zkoumán v randomizované zkřížené studii u 12 dobrovolníků. Ve studii subjekty požily placebo nebo 400 mg flukonazolu v den 1 a následně 200 mg denně ode dne 2 do dne 6. Kromě toho byla první den perorálně požita dávka 7,5 mg midazolamu, intravenózně bylo podáno 0,05 mg/kg čtvrtý den a 7,5 mg perorálně šestý den. Flukonazol snížil clearance iv midazolamu o 51 %. První den podávání zvýšil flukonazol AUC midazolamu o 259 % a C o 150 %. Šestý den podávání zvýšil flukonazol AUC midazolamu o 259 % a C o 74 %. Psychomotorické účinky midazolamu byly významně zvýšeny po perorálním podání midazolamu, ale nebyly významně ovlivněny po intravenózním podání midazolamu.
Druhá randomizovaná, dvojitě falešná, placebem kontrolovaná, zkřížená studie ve třech fázích byla provedena za účelem stanovení účinku cesty podání flukonazolu na interakci mezi flukonazolem a midazolamem. V každé fázi byl subjektům podáván perorálně flukonazol 400 mg a intravenózní fyziologický roztok; perorální placebo a intravenózní flukonazol 400 mg; a perorální placebo a IV fyziologický roztok. Po flukonazolu/placebu byla požita perorální dávka 7,5 mg midazolamu. AUC a Cmax midazolamu byly významně vyšší po perorálním než intravenózním podání flukonazolu. Perorální flukonazol zvýšil AUC midazolamu o 272 % a Cmax o 129 %. IV flukonazol zvýšil AUC midazolamu o 244 % a Cmax o 79 %. Jak perorální, tak i.v. flukonazol zvýšil farmakodynamické účinky midazolamu. (Vidět OPATŘENÍ .)
azithromycin
Otevřená, randomizovaná, třícestná zkřížená studie u 18 zdravých subjektů hodnotila účinek jedné 800mg perorální dávky flukonazolu na farmakokinetiku jednorázové 1200mg perorální dávky azithromycinu a také účinky azithromycinu na farmakokinetiku flukonazolu. Mezi flukonazolem a azithromycinem nedošlo k žádné významné farmakokinetické interakci.
vorikonazol
Vorikonazol je substrátem pro izoenzymy CYP2C9 a CYP3A4. Současné podávání perorálního vorikonazolu (400 mg Q12h po dobu 1 dne, poté 200 mg Q12h po dobu 2,5 dne) a perorálního flukonazolu (400 mg v den 1, poté 200 mg Q24h po dobu 4 dnů) 6 zdravým mužským subjektům vedlo ke zvýšení Cmax a AUCτ vorikonazolu v průměru o 57 % (90 % CI: 20 % až 107 %) a 79 % (90 % CI: 40 % až 128 %). V následné klinické studii zahrnující 8 zdravých mužských subjektů snížené dávkování a/nebo frekvence vorikonazolu a flukonazolu tento účinek neodstranilo ani nezmenšilo. Současné podávání vorikonazolu a flukonazolu v jakékoli dávce se nedoporučuje. Pokud je vorikonazol podáván následně po flukonazolu, zvláště během 24 hodin od poslední dávky flukonazolu, doporučuje se pečlivé sledování nežádoucích účinků souvisejících s vorikonazolem. (Vidět OPATŘENÍ .)
tofacitinib
Současné podávání flukonazolu (400 mg 1. den a 200 mg jednou denně po dobu 6 dnů [2. – 7. den]) a tofacitinibu (30 mg jednorázová dávka 5. den) zdravým subjektům vedlo ke zvýšení průměrných hodnot AUC a Cmax tofacitinibu přibližně 79 % (90% CI: 64 % až 96 %) a 27 % (90 % CI: 12 % až 44 %) ve srovnání s podáváním samotného tofacitinibu. (Vidět OPATŘENÍ .)
Mikrobiologie
Mechanismus působení
Flukonazol je vysoce selektivní inhibitor enzymu lanosterol 14-α-demethylázy závislého na houbovém cytochromu P450. Tento enzym přeměňuje lanosterol na ergosterol. Následná ztráta normálních sterolů koreluje s akumulací 14-α-methyl sterolů v houbách a může být odpovědná za fungistatickou aktivitu flukonazolu. Demethylace savčích buněk je mnohem méně citlivá na inhibici flukonazolu.
Odpor
Potenciál rozvoje rezistence na flukonazol je dobře znám. Izoláty hub vykazující sníženou citlivost na jiné azoly mohou také vykazovat sníženou citlivost na flukonazol. Četnost vývoje lékové rezistence u různých hub, pro které je tento lék indikován, není známa.
Flukonazolová rezistence může vzniknout v důsledku modifikace kvality nebo kvantity cílového enzymu (lanosterol 14-α-demethylázy), sníženého přístupu k cíli léčiva nebo některé kombinace těchto mechanismů.
Bodové mutace v genu (ERG11) kódujícím cílový enzym vedou ke změně cíle se sníženou afinitou k azolům. Nadměrná exprese ERG11 vede k produkci vysokých koncentrací cílového enzymu, což vytváří potřebu vyšších intracelulárních koncentrací léčiva pro inhibici všech molekul enzymu v buňce.
Druhý hlavní mechanismus lékové rezistence zahrnuje aktivní eflux flukonazolu z buňky prostřednictvím aktivace dvou typů multilékových efluxních transportérů; hlavní facilitátory (kódované geny MDR) a ty ze superrodiny ATP-vazebných kazet (kódované geny CDR). Upregulace genu MDR vede k rezistenci vůči flukonazolu, zatímco upregulace genů CDR může vést k rezistenci vůči více azolům.
Rezistence u Candida glabrata obvykle zahrnuje upregulaci CDR genů vedoucí k rezistenci vůči více azolům. Pro izolát, kde je minimální inhibiční koncentrace (MIC) kategorizována jako střední (16 až 32 mcg/ml), se doporučuje nejvyšší dávka flukonazolu.
Candida krusei by měla být považována za rezistentní vůči flukonazolu. Zdá se, že rezistence u C. krusei je zprostředkována sníženou citlivostí cílového enzymu na inhibici činidlem.
Byly hlášeny případy superinfekce jinými druhy Candida než C. albicans, které často nejsou ze své podstaty citlivé na DIFLUCAN (např. Candida krusei). Takové případy mohou vyžadovat alternativní antifungální léčbu.
Antimikrobiální aktivita
Bylo prokázáno, že flukonazol je účinný proti většině izolátů následujících mikroorganismů jak in vitro, tak u klinických infekcí.
Candida albicans Candida glabrata (mnoho izolátů je středně citlivých) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám. Nejméně 90 % následujících hub vykazuje in vitro MIC menší nebo rovnou citlivému bodu zlomu pro flukonazol (https://www.fda.gov/STIC) proti izolátům podobného rodu nebo skupiny organismů. Účinnost flukonazolu při léčbě klinických infekcí způsobených těmito houbami však nebyla prokázána v adekvátních a dobře kontrolovaných klinických studiích.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei by měla být považována za rezistentní vůči flukonazolu. Zdá se, že rezistence u C. krusei je zprostředkována sníženou citlivostí cílového enzymu na inhibici činidlem.
Byly hlášeny případy superinfekce jinými druhy Candida než C. albicans, které často nejsou ze své podstaty citlivé na DIFLUCAN (např. Candida krusei). Takové případy mohou vyžadovat alternativní antifungální léčbu.
Testování citlivosti
Konkrétní informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: https://www.fda.gov/STIC.
Klinické studie
Kryptokoková meningitida
V multicentrické studii porovnávající DIFLUCAN (200 mg/den) s amfotericinem B (0,3 mg/kg/den) pro léčbu kryptokokové meningitidy u pacientů s AIDS odhalila multivariační analýza tři faktory před léčbou, které předpovídaly úmrtí v průběhu léčby: abnormální duševní stav, titr kryptokokového antigenu v mozkomíšním moku vyšší než 1:1024 a počet bílých krvinek v mozkomíšním moku nižší než 20 buněk/mm³. Mortalita mezi vysoce rizikovými pacienty byla 33 % a 40 % u pacientů s amfotericinem B a DIFLUCANem, v daném pořadí (p=0,58), s celkovým úmrtím 14 % (9 ze 63 subjektů) a 18 % (24 ze 131 subjektů) ve 2 větvích studie (p=0,48). Zbývá stanovit optimální dávky a režimy pro pacienty s akutní kryptokokovou meningitidou a s vysokým rizikem selhání léčby. (Saag a kol. N Engl J Med 1992; 326:83-9.)
Vaginální kandidóza
USA byly provedeny dvě adekvátní a dobře kontrolované studie s použitím 150 mg tablety. V obou byly výsledky flukonazolového režimu srovnatelné s kontrolním režimem (klotrimazol nebo mikonazol intravaginálně po dobu 7 dnů) jak klinicky, tak statisticky při vyhodnocení jednoho měsíce po léčbě.
Míra terapeutického vyléčení, definovaná jako úplné vymizení známek a symptomů vaginální kandidózy (klinické vyléčení), spolu s negativním KOH vyšetřením a negativní kultivací na Candidu (mikrobiologická eradikace), byla 55 % jak ve skupině s flukonazolem, tak ve vaginálních přípravcích skupina.
Přibližně tři čtvrtiny zařazených pacientek měly akutní vaginitidu (
Podstatně více gastrointestinálních příhod bylo hlášeno ve skupině s flukonazolem ve srovnání se skupinou s vaginálním přípravkem. Většina událostí byla mírná až střední. Vzhledem k tomu, že flukonazol byl podáván v jedné dávce, nedošlo k žádnému přerušení léčby.
Pediatrické studie
Orofaryngeální kandidóza
Byla provedena otevřená srovnávací studie účinnosti a bezpečnosti DIFLUCANu (2 až 3 mg/kg/den) a perorálního nystatinu (400 000 IU 4krát denně) u imunokompromitovaných dětí s orofaryngeální kandidózou. Míra klinické a mykologické odpovědi byla vyšší u dětí léčených flukonazolem.
Klinické vyléčení na konci léčby bylo hlášeno u 86 % pacientů léčených flukonazolem ve srovnání se 46 % pacientů léčených nystatinem. Mykologicky bylo 76 % pacientů léčených flukonazolem eradikován infekční organismus ve srovnání s 11 % pacientů léčených nystatinem.
Podíl pacientů s klinickým relapsem 2 týdny po ukončení léčby byl 14 % u subjektů užívajících DIFLUCAN a 16 % u subjektů užívajících nystatin. 4 týdny po ukončení léčby bylo procento pacientů s klinickým relapsem 22 % pro DIFLUCAN 150 mg a 23 % pro nystatin.
INFORMACE PRO PACIENTA
DIFLUCAN® (barvivo-FLEW-kan) (flukonazol) Tablety
Tato příbalová informace obsahuje důležité informace o přípravku DIFLUCAN. Nemá to nahrazovat pokyny vašeho poskytovatele zdravotní péče. Před užitím DIFLUCANu si pozorně přečtěte tyto informace. Zeptejte se svého poskytovatele zdravotní péče, pokud některým z těchto informací nerozumíte nebo pokud se chcete o DIFLUCANu dozvědět více.
Co je DIFLUCAN 100 mg?
DIFLUCAN je lék na předpis používaný k léčbě vaginálních kvasinkových infekcí způsobených kvasinkou zvanou Candida. DIFLUCAN 150 mg pomáhá zastavit přílišné množení kvasinek ve vagíně, takže kvasinková infekce odezní.
DIFLUCAN 150 mg se liší od jiných způsobů léčby vaginálních kvasinkových infekcí, protože jde o tablety užívané ústy. DIFLUCAN se používá i pro jiné stavy. Tato příbalová informace se však týká pouze použití přípravku DIFLUCAN 50 mg k léčbě vaginálních kvasinkových infekcí. Informace o použití DIFLUCAN 200 mg z jiných důvodů získáte od svého poskytovatele zdravotní péče. Informace o vaginálních kvasinkových infekcích naleznete v části této příbalové informace.
Co je vaginální kvasinková infekce?
Je normální, že se určité množství kvasinek nachází v pochvě. Někdy začne v pochvě růst příliš mnoho kvasinek a to může způsobit kvasinkovou infekci. Vaginální kvasinkové infekce jsou běžné. Přibližně tři ze čtyř dospělých žen budou mít během svého života alespoň jednu vaginální kvasinkovou infekci.
Některé léky a zdravotní stavy mohou zvýšit vaši šanci na kvasinkovou infekci. Pokud jste těhotná, máte cukrovku, užíváte antikoncepční pilulky nebo užíváte antibiotika, můžete dostat kvasinkové infekce častěji než jiné ženy. Osobní hygiena a určité druhy oblečení mohou zvýšit vaše šance na získání kvasinkové infekce. Požádejte svého poskytovatele zdravotní péče o tipy, co můžete udělat, abyste zabránili vaginálním kvasinkovým infekcím. Pokud dostanete vaginální kvasinkovou infekci, můžete mít některý z následujících příznaků:
- svědění
- pocit pálení při močení
- zarudnutí
- bolestivost
- hustý bílý poševní výtok, který vypadá jako tvaroh
Pokud máte, DIFLUCAN neužívejte.
- užívejte následující léky:
- chinidin
- erythromycin
- pimozid
- jste alergický(á) na flukonazol, účinnou látku přípravku DIFLUCAN 50 mg nebo na kteroukoli složku přípravku DIFLUCAN. Úplný seznam složek přípravku DIFLUCAN naleznete na konci této příbalové informace pro pacienty.
Než začnete užívat DIFLUCAN, informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, pokud:
- mít problémy s játry
- mít problémy s ledvinami
- máte srdeční problémy včetně srdečních arytmií
- máte hypokalémii (nízký obsah draslíku)
- jste těhotná nebo plánujete otěhotnět. Okamžitě informujte svého poskytovatele zdravotní péče, pokud během užívání DIFLUCANu otěhotníte. Vy a váš poskytovatel zdravotní péče se rozhodnete, zda je pro vás DIFLUCAN 100 mg vhodný. Pokud můžete otěhotnět, měla byste během užívání DIFLUCANu a 1 týden po poslední dávce používat antikoncepční metodu (antikoncepční metodu).
- kojíte nebo plánujete kojit. DIFLUCAN může přecházet do vašeho mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení vašeho dítěte, když užíváte DIFLUCAN.
Než začnete užívat DIFLUCAN, informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- léky na diabetes, jako je glyburid, tolbutamid, glipizid
- léky na krevní tlak, jako je hydrochlorothiazid, losartan, amlodipin, verapamil, nifedipin nebo felodipin
- léky na ředění krve, jako je warfarin
- cyklosporin, takrolimus nebo sirolimus (používané k prevenci odmítnutí transplantovaných orgánů)
- rifampin nebo rifabutin na tuberkulózu
- fenytoin nebo karbamazepin ke kontrole záchvatů
- theofylin ke kontrole astmatu
- chinidin (používaný k úpravě poruch srdečního rytmu)
- amiodaron (používá se k léčbě nerovnoměrného srdečního rytmu „arytmií“);
- amitriptylin nebo nortriptylin na depresi
- pimozid pro psychiatrické onemocnění
- amfotericin B nebo vorikonazol pro mykotické infekce
- erythromycin pro bakteriální infekce
- olaparib, cyklofosfamid nebo vinka alkaloidy, jako je vinkristin nebo vinblastin k léčbě rakoviny
- fentanyl, alfentanil nebo metadon na chronickou bolest
- ibrutinib používaný k léčbě rakoviny krve
- lemborexant, používaný k léčbě nespavosti
- léky snižující hladinu lipidů, jako je atorvastatin, simvastatin a fluvastatin
- nesteroidní protizánětlivá léčiva včetně celekoxibu, ibuprofenu a naproxenu
- prednison, steroid používaný k léčbě kožních, gastrointestinálních, hematologických nebo respiračních poruch
- antivirové léky používané k léčbě HIV, jako je saquinavir nebo zidovudin
- tofacitinib pro revmatoidní artritidu
- doplněk stravy s vitamínem A
- tolvaptan používaný k léčbě hyponatremie (nízké hladiny sodíku v krvi) nebo ke zpomalení poklesu funkce ledvin
Protože pro tyto léky existuje mnoho značek, obraťte se na svého poskytovatele zdravotní péče nebo lékárníka, pokud máte nějaké dotazy.
Jak mám užívat DIFLUCAN?
- Užívejte DIFLUCAN přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- Užívejte DIFLUCAN 100 mg ústy s jídlem nebo bez jídla.
- Pokud užijete příliš mnoho přípravku DIFLUCAN 50 mg, zavolejte svého poskytovatele zdravotní péče nebo jděte na nejbližší pohotovost.
Čemu se mám vyhnout při užívání DIFLUCAN 150 mg?
DIFLUCAN může způsobit závratě a záchvaty. Neřiďte ani neobsluhujte stroje, dokud nebudete vědět, jak na vás DIFLUCAN působí.
Jaké jsou možné vedlejší účinky přípravku DIFLUCAN 150 mg?
DIFLUCAN 50 mg může způsobit závažné nežádoucí účinky včetně:
- vážné problémy s játry. některých lidí se závažnými zdravotními problémy se během užívání DIFLUCANu vyvinuly závažné jaterní problémy, které se staly život ohrožujícími nebo způsobily smrt. Někdy mohou být tyto problémy s játry zvráceny, když přestanete užívat DIFLUCAN. Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte příznaky závažných jaterních problémů, včetně:
- tmavě zbarvená moč
- silné svědění kůže
- zežloutnutí kůže a očí (žloutenka)
- světle zbarvená stolice
- únava
- zvracení
- ztráta chuti k jídlu
- závažné alergické reakce: Ve vzácných případech se při užívání DIFLUCANu vyskytly závažné alergické reakce (anafylaxe). Přestaňte užívat DIFLUCAN 50 mg, zavolejte svého poskytovatele zdravotní péče nebo jděte ihned na pohotovost v nejbližší nemocnici, pokud se u vás objeví jakékoli známky nebo příznaky alergické reakce, včetně:
- dušnost
- horečka
- otok očních víček
- kašel
- kožní vyrážka, kopřivka, puchýře nebo olupování kůže
- obličeje, úst, krku nebo jakékoli jiné části těla
- sípání
- bušení srdce nebo uší
- zimnice
- vážné kožní problémy. některých lidí s vážnými zdravotními problémy se během užívání DIFLUCANu vyvinuly vážné kožní problémy, které způsobily smrt. Okamžitě informujte svého poskytovatele zdravotní péče, pokud se u vás během užívání DIFLUCANu objeví vyrážka.
Mezi nejčastější nežádoucí účinky přípravku DIFLUCAN 200 mg patří:
- bolest hlavy
- závrať
- průjem
- bolest břicha
- nevolnost nebo žaludeční nevolnost
- změny ve způsobu chuti jídla
Mezi další nežádoucí účinky patří:
- nedostatek adrenalinu: U některých lidí, kteří užívali DIFLUCAN, se vyvinula adrenální insuficience, která byla reverzibilní. Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte příznaky adrenální insuficience, včetně:
- dlouhotrvající únava
- svalová slabost
- ztráta chuti k jídlu
- ztráta váhy
- bolest břicha
- závrať
- nevolnost
- zvracení
- závratě nebo záchvaty.
Toto nejsou všechny možné vedlejší účinky přípravku DIFLUCAN.
Zavolejte svého poskytovatele zdravotní péče a požádejte o radu ohledně vedlejších účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat DIFLUCAN?
Tablety DIFLUCAN uchovávejte při teplotě do 30 °C (86 °F).
Uchovávejte DIFLUCAN 50 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání přípravku DIFLUCAN.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte DIFLUCAN 50 mg na stav, pro který nebyl předepsán. Nedávejte DIFLUCAN jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého poskytovatele zdravotní péče o informace o přípravku DIFLUCAN 200 mg, který je určen pro zdravotníky.
Jaké složky obsahuje DIFLUCAN 150 mg?
Aktivní složka: flukonazol
Neaktivní složky: mikrokrystalická celulóza, bezvodý hydrogenfosforečnan vápenatý, povidon, sodná sůl kroskarmelózy, barvivo na bázi hliníkového laku FD&C Red č. 40 a stearát hořečnatý.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv
