Estrace 1mg, 2mg Estradiol Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Estrace a jak se používá?
Estrace je lék na předpis používaný k léčbě příznaků metastatického karcinomu prsu, osteoporózy, nízké hladiny estrogenu (hypoestrogenismu), vulvální a vaginální atrofie v menopauze. Estrace 1 mg lze užívat samostatně nebo s jinými léky.
Estrace 1 mg patří do třídy léků nazývaných deriváty estrogenu.
Není známo, zda je přípravek Estrace 1 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Estrace 1 mg?
Estrace může způsobit závažné nežádoucí účinky včetně:
- bolest nebo tlak na hrudi,
- bolest šířící se do čelisti nebo ramene,
- nevolnost,
- pocení,
- náhlá necitlivost nebo slabost (zejména na jedné straně těla),
- náhlá silná bolest hlavy,
- nezřetelná řeč,
- problémy se zrakem nebo rovnováhou,
- náhlá ztráta zraku,
- bodavá bolest na hrudi,
- pocit nedostatku vzduchu,
- vykašlávání krve,
- bolest nebo teplo v jedné nebo obou nohách,
- otok nebo citlivost žaludku,
- zežloutnutí kůže nebo očí (žloutenka),
- problémy s pamětí,
- zmatek,
- neobvyklé chování,
- neobvyklé vaginální krvácení,
- pánevní bolest,
- bulka v tvém prsu,
- zvracení,
- zácpa,
- zvýšená žízeň nebo močení,
- svalová slabost,
- bolest kostí, an
- d
- nedostatek energie
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Estrace patří:
- nevolnost,
- zvracení,
- průjem,
- žaludeční křeče,
- změny nálady,
- problémy se spánkem (nespavost),
- bolest hlavy,
- bolesti zad,
- bolest prsou,
- příznaky nachlazení (ucpaný nos, bolest dutin, bolest v krku),
- přibývání na váze,
- řídnoucí vlasy na hlavě,
- vaginální svědění nebo výtok,
- změny ve vaší menstruaci a
- průlomové krvácení
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Estrace. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
ESTROGENY ZVYŠUJÍ RIZIKO RAKOVINY ENDOMETRIA
Je důležité pečlivé klinické sledování všech žen užívajících estrogeny. Ve všech případech nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního vaginálního krvácení by měla být provedena adekvátní diagnostická opatření, včetně odběru vzorků endometria, je-li to indikováno, k vyloučení malignity. Neexistují žádné důkazy o tom, že by užívání „přirozených“ estrogenů vedlo k odlišnému profilu endometriálního rizika než „syntetické“ estrogeny v ekvivalentních dávkách estrogenu. (Vidět VAROVÁNÍ , Zhoubné novotvary , Rakovina endometria .)
KARDIOVASKULÁRNÍ A DALŠÍ RIZIKA
Estrogeny s nebo bez progestinů by se neměly používat k prevenci kardiovaskulárních onemocnění. (Vidět VAROVÁNÍ , Kardiovaskulární poruchy .)
Studie Women's Health Initiative (WHI) oznámila zvýšené riziko infarktu myokardu, mrtvice, invazivního karcinomu prsu, plicní embolie a hluboké žilní trombózy u postmenopauzálních žen (ve věku 50 až 79 let) během 5 let léčby perorálními konjugované estrogeny (CE 0,625 mg) v kombinaci s medroxyprogesteronacetátem (MPA 2,5 mg) ve srovnání s placebem. (Vidět KLINICKÁ FARMAKOLOGIE , Klinické studie .)
Women's Health Initiative Memory Study (WHIMS), podstudie WHI, hlásila zvýšené riziko rozvoje pravděpodobné demence u postmenopauzálních žen ve věku 65 let nebo starších během 4 let léčby perorálními konjugovanými estrogeny plus medroxyprogesteron acetát ve srovnání s placebem . Není známo, zda se toto zjištění týká mladších žen po menopauze nebo žen užívajících léčbu samotnými estrogeny. (Vidět KLINICKÁ FARMAKOLOGIE , Klinické studie .)
Jiné dávky perorálních konjugovaných estrogenů s medroxyprogesteron acetátem a další kombinace a dávkové formy estrogenů a progestinů nebyly v klinických studiích WHI studovány a při absenci srovnatelných údajů je třeba předpokládat, že tato rizika jsou podobná. Kvůli těmto rizikům by měly být estrogeny s nebo bez progestinů předepisovány v nejnižších účinných dávkách a po nejkratší dobu v souladu s cíli a riziky léčby pro jednotlivé ženy.
POPIS
ESTRACE® (estradiolové tablety, USP) pro perorální podání obsahuje 0,5, 1 nebo 2 mg mikronizovaného estradiolu na tabletu. Estradiol (17ß-estradiol) je bílá, krystalická pevná látka, chemicky popsaná jako estra-1,3,5,(10)-trien-3,17ß-diol. Strukturní vzorec je:
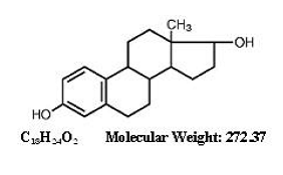
Neaktivní ingredience: Koloidní oxid křemičitý, kukuřičný škrob, hydrogenfosforečnan vápenatý, monohydrát laktózy, magnesium-stearát a sodná sůl glykolátu škrobu. Navíc 1 mg obsahuje také FD&C blue no. 1 hliníkový lak a D&C červená č. 27 hliníkové jezero. 2 mg také obsahuje FD&C blue no. 1 hliníkový lak a FD&C žlutá č. 5 (tartrazin) hliníkový lak.
INDIKACE
ESTRACE (estradiolové tablety, USP) je indikován v:
DÁVKOVÁNÍ A PODÁVÁNÍ
Když je estrogen předepsán ženám po menopauze s dělohou, měl by být také zahájen progestin, aby se snížilo riziko rakoviny endometria. Žena bez dělohy nepotřebuje progestin. Užívání estrogenu samotného nebo v kombinaci s progestinem by mělo být s nejnižší účinnou dávkou a po nejkratší dobu v souladu s cíli a riziky léčby pro jednotlivé ženy. Pacienti by měli být pravidelně přehodnocováni, jak je to klinicky vhodné (např. 3měsíční až 6měsíční intervaly), aby se zjistilo, zda je léčba stále nezbytná (viz VAROVÁNÍ V KRABIČCE a VAROVÁNÍ ). U žen, které mají dělohu, by měla být provedena adekvátní diagnostická opatření, jako je odběr endometria, pokud je to indikováno, k vyloučení malignity v případech nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního vaginálního krvácení.
Pacienti by měli začít s nejnižší dávkou pro danou indikaci.
1. Pro léčbu středně těžkých až těžkých vazomotorických symptomů, vulvální a vaginální atrofie spojené s menopauzou by měla být zvolena nejnižší dávka a režim, který bude kontrolovat symptomy, a medikace by měla být co nejrychleji přerušena.
Pokusy vysadit nebo omezit léčbu by měly být prováděny v 3měsíčních až 6měsíčních intervalech. Obvyklá počáteční dávka je 1 až 2 mg estradiolu denně upravená podle potřeby ke kontrole přítomných příznaků. Minimální účinná dávka pro udržovací léčbu by měla být stanovena titrací. Podávání by mělo být cyklické (např. 3 týdny na a 1 týden bez).
2. K léčbě ženského hypoestrogenismu způsobeného hypogonadismem, kastrací nebo primárním selháním vaječníků.
Léčba se obvykle zahajuje dávkou 1 až 2 mg estradiolu denně, upravenou podle potřeby ke kontrole přítomných příznaků; minimální účinná dávka pro udržovací léčbu by měla být stanovena titrací.
3. K léčbě rakoviny prsu, pouze pro paliaci, u vhodně zvolených žen a mužů s metastatickým onemocněním.
Doporučená dávka je 10 mg třikrát denně po dobu alespoň tří měsíců.
4. K léčbě pokročilého androgen-dependentního karcinomu prostaty, pouze pro paliaci.
Doporučená dávka je 1 až 2 mg třikrát denně. Účinnost terapie může být posouzena stanovením fosfatázy i symptomatickým zlepšením pacienta.
5. Pro prevenci osteoporózy.
Při předepisování pouze za účelem prevence postmenopauzální osteoporózy by měla být terapie zvažována pouze u žen s významným rizikem osteoporózy a pro které nejsou neestrogenové léky považovány za vhodné.
Nejnižší účinná dávka ESTRACE 2 mg nebyla stanovena.
JAK DODÁVÁNO
ESTRACE® (estradiolové tablety, USP) jsou dostupné jako:
0,5 mg Bílá až téměř bílá, oválná, plochá tableta se zkosenými hranami s půlicí rýhou. Vyraženo 720 / ½ na vroubkované straně a toaleta na druhé straně. K dispozici v lahvích:
100 tablet NDC 0430-0720-24
1 mg : Světle fialová, oválná, plochá tableta se zkosenými hranami s půlicí rýhou. Vyraženo 721 / 1 na vryté straně a toaleta na druhé straně. K dispozici v lahvích:
100 tablet NDC 0430-0721-24
2 mg : Zelená, oválná, plochá tableta se zkosenými hranami s půlicí rýhou. Vyraženo 722 / 2 na rýhované straně a toaleta na druhé straně. K dispozici v lahvích:
100 tablet NDC 0430-0722-24
Uchovávejte při teplotě 20 ° až 25 ° C (68 ° až 77 ° F) [Viz USP řízená pokojová teplota ].
Dávkujte v těsné nádobě odolné vůči světlu, jak je definováno v USP, s uzávěrem odolným proti otevření dětmi (podle potřeby).
UCHOVÁVEJTE TOTO A VŠECHNY LÉKY MIMO DOSAH DĚTÍ.
Výrobce: TEVA PHARMACEUTICALS USA Sellersville, PA 18960. Prodejce: Warner Chilcott (US), LLC, Rockaway, NJ 07866, 1-800-521-8813. Revize: září 2013
VEDLEJŠÍ EFEKTY
Vidět VAROVÁNÍ V KRABIČCE , VAROVÁNÍ a OPATŘENÍ .
Při léčbě estrogenem a/nebo progestinem byly hlášeny následující další nežádoucí účinky.
Genitourinární systém
Změny ve vzorcích vaginálního krvácení a abnormální krvácení nebo průtok z vysazení; krvácení z průniku, špinění, dysmenorea Zvětšení děložních leiomyomů Vaginitida, včetně vaginální kandidózy Změna množství cervikální sekrece Změny cervikálního ektropia Rakovina vaječníků; hyperplazie endometria; rakovina endometria
Prsa
Citlivost, zvětšení, bolest, výtok z bradavek, galaktorea; fibrocystické změny prsu; rakovina prsu
Kardiovaskulární
Hluboká a povrchová žilní trombóza; plicní embolie; tromboflebitida; infarkt myokardu; mrtvice; zvýšení krevního tlaku
Gastrointestinální
Nevolnost, zvracení Křeče v břiše, nadýmání Cholestatická žloutenka Zvýšený výskyt onemocnění žlučníku Pankreatitida Zvětšení jaterních hemangiomů
Kůže
Chloasma nebo melasma, které mohou přetrvávat po vysazení léku Erythema multiforme Erythema nodosum Hemoragická erupce Ztráta vlasů na hlavě Hirsutismus Pruritus, vyrážka
Oči
Cévní trombóza sítnice Zesílení zakřivení rohovky Nesnášenlivost kontaktních čoček
Centrální nervový systém
Bolest hlavy, migréna, závratě Duševní deprese Chorea Nervozita, poruchy nálady, podrážděnost Exacerbace epilepsie Demence
Smíšený
Zvýšení nebo snížení hmotnosti Snížená tolerance sacharidů Zhoršení porfyrie Edém Artralgie; křeče v nohou Změny libida Kopřivka Angioedém Anafylaktoidní/anafylaktické reakce Hypokalcémie Exacerbace astmatu Zvýšené triglyceridy
DROGOVÉ INTERAKCE
Interakce drog/laboratorních testů
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
Vidět VAROVÁNÍ V KRABIČCE .
Kardiovaskulární poruchy
Estrogenová a estrogenová/progestinová terapie je spojována se zvýšeným rizikem kardiovaskulárních příhod, jako je infarkt myokardu a cévní mozková příhoda, stejně jako žilní trombóza a plicní embolie (žilní tromboembolismus nebo VTE). Pokud se některý z nich objeví nebo je na něj podezření, estrogeny by měly být okamžitě vysazeny.
Rizikové faktory pro arteriální vaskulární onemocnění (např. hypertenze, diabetes mellitus, užívání tabáku, hypercholesterolemie a obezita) a/nebo žilní tromboembolismus (např. osobní nebo rodinná anamnéza VTE, obezita a systémový lupus erythematodes) by měly být vhodně řízeny.
Ischemická choroba srdeční A Cévní mozková příhoda
Ve studii Women's Health Initiative (WHI) byl pozorován nárůst počtu infarktů myokardu a mozkových mrtvic u žen užívajících CE ve srovnání s placebem. Tato pozorování jsou předběžná a studie pokračuje. (Vidět KLINICKÁ FARMAKOLOGIE , Klinické studie .)
V podstudii CE/MPA WHI bylo pozorováno zvýšené riziko příhod koronárního srdečního onemocnění (CHD) (definovaných jako nefatální infarkt myokardu a úmrtí na ICHS) u žen užívajících CE/MPA ve srovnání s ženami užívajícími placebo (37 oproti 30 na 10 000 osob let). Nárůst rizika byl pozorován v prvním roce a přetrvával.
Ve stejné podstudii WHI bylo pozorováno zvýšené riziko cévní mozkové příhody u žen užívajících CE/MPA ve srovnání s ženami užívajícími placebo (29 vs 21 na 10 000 žen-roků). Zvýšení rizika bylo pozorováno po prvním roce a přetrvávalo.
postmenopauzálních žen s prokázaným srdečním onemocněním (n = 2 763, průměrný věk 66,7 let) proběhla kontrolovaná klinická studie sekundární prevence kardiovaskulárních onemocnění (Heart and Estrogen/Progestin Replacement Study; HERS) léčba CE/MPA (0,625 mg/2,5 mg na den) neprokázal žádný kardiovaskulární přínos. Během průměrného sledování 4,1 roku léčba CE/MPA nesnížila celkový výskyt ICHS u žen po menopauze s prokázanou koronární chorobou srdeční. Ve skupině léčené CE/MPA bylo více ICHS než ve skupině s placebem v roce 1, ale ne během následujících let. Dva tisíce tři sta dvacet jedna žen z původní studie HERS souhlasilo s účastí na otevřeném rozšíření HERS, HERS II. Průměrná doba sledování u HERS II byla dalších 2,7 roku, celkem tedy 6,8 roku. Četnost ICHS byla srovnatelná u žen ve skupině CE/MPA a ve skupině s placebem v HERS, HERS II a celkově.
Velké dávky estrogenu (5 mg konjugovaných estrogenů denně), srovnatelné s dávkami používanými k léčbě rakoviny prostaty a prsu, prokázaly ve velké prospektivní klinické studii u mužů riziko nefatálního infarktu myokardu, plicní embolie a tromboflebitida.
Venózní tromboembolismus (VTE).
Ve studii Women's Health Initiative (WHI) bylo pozorováno zvýšení VTE u žen užívajících CE ve srovnání s placebem. Tato pozorování jsou předběžná a studie pokračuje. (Vidět KLINICKÁ FARMAKOLOGIE , Klinické studie .)
V podstudii CE/MPA WHI byl pozorován 2krát vyšší výskyt VTE, včetně hluboké žilní trombózy a plicní embolie, u žen užívajících CE/MPA ve srovnání s ženami užívajícími placebo. Četnost VTE byla 34 na 10 000 žen/rok ve skupině CE/MPA ve srovnání s 16 na 10 000 žen/rok ve skupině s placebem. Zvýšení rizika VTE bylo pozorováno během prvního roku a přetrvávalo.
Pokud je to možné, estrogeny by měly být vysazeny alespoň 4 až 6 týdnů před operací typu spojeného se zvýšeným rizikem tromboembolie nebo během období delší imobilizace.
Maligní novotvary
Endometriální rakovina
Užívání neoponovaných estrogenů u žen s intaktní dělohou bylo spojeno se zvýšeným rizikem rakoviny endometria. Hlášené riziko karcinomu endometria mezi uživatelkami estrogenu bez odporu je asi 2 až 12krát vyšší než u žen, které neužívají, a zdá se závislé na délce léčby a na dávce estrogenu. Většina studií neprokazuje žádné významné zvýšené riziko spojené s užíváním estrogenů po dobu kratší než jeden rok. Největší riziko se zdá být spojeno s dlouhodobým užíváním – se zvýšeným rizikem 15 až 24krát po dobu pěti až deseti let nebo déle – a toto riziko přetrvává po dobu 8 až více než 15 let po ukončení léčby estrogeny.
Důležité je klinické sledování všech žen užívajících kombinace estrogen/progestin (viz OPATŘENÍ ). Ve všech případech nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního vaginálního krvácení by měla být provedena adekvátní diagnostická opatření, včetně odběru vzorků endometria, je-li to indikováno, k vyloučení malignity. Neexistují žádné důkazy o tom, že by použití přirozených estrogenů mělo za následek odlišný profil endometriálního rizika než syntetické estrogeny s ekvivalentní dávkou estrogenu. Bylo prokázáno, že přidání progestinu k estrogenové terapii snižuje riziko hyperplazie endometria, která může být prekurzorem rakoviny endometria.
Rakovina prsu
Bylo hlášeno, že užívání estrogenů a progestinů ženami po menopauze zvyšuje riziko rakoviny prsu. Nejdůležitější randomizovanou klinickou studií poskytující informace o této problematice je podstudie CE/MPA Women's Health Initiative (WHI) (viz. KLINICKÁ FARMAKOLOGIE , Klinické studie ). Výsledky observačních studií jsou obecně v souladu s výsledky klinické studie WHI a neuvádějí žádné významné rozdíly v riziku rakoviny prsu mezi různými estrogeny nebo progestiny, dávkami nebo cestami podávání.
Podstudie CE/MPA WHI zaznamenala zvýšené riziko rakoviny prsu u žen, které užívaly CE/MPA po průměrnou dobu sledování 5,6 let. Observační studie také zaznamenaly zvýšené riziko kombinované terapie estrogenem/progestinem a menší zvýšené riziko terapie samotným estrogenem po několika letech užívání. Ve studii WHI a z observačních studií se zvýšené riziko zvyšovalo s délkou užívání. Z observačních studií se zdálo, že se riziko vrátilo na výchozí hodnotu přibližně za pět let po ukončení léčby. Kromě toho pozorovací studie naznačují, že riziko rakoviny prsu bylo vyšší a ukázalo se dříve u kombinované terapie estrogen/progestin ve srovnání s terapií samotným estrogenem.
podstudii CE/MPA uvádělo 26 % žen předchozí užívání samotného estrogenu a/nebo kombinované hormonální terapie estrogen/progestin. Po průměrné době sledování 5,6 let během klinické studie bylo celkové relativní riziko invazivního karcinomu prsu 1,24 (95% interval spolehlivosti 1,01-1,54) a celkové absolutní riziko bylo 41 vs 33 případů na 10 000 žen-roků. CE/MPA ve srovnání s placebem. Mezi ženami, které uváděly předchozí užívání hormonální terapie, bylo relativní riziko invazivního karcinomu prsu 1,86 a absolutní riziko bylo 46 vs 25 případů na 10 000 žen-roků pro CE/MPA ve srovnání s placebem. Mezi ženami, které dříve neužívaly hormonální terapii, bylo relativní riziko invazivního karcinomu prsu 1,09 a absolutní riziko CE/MPA bylo 40 vs 36 případů na 10 000 žen-roků ve srovnání s placebem. Ve stejné podstudii byly invazivní karcinomy prsu větší a diagnostikované v pokročilejším stádiu ve skupině CE/MPA ve srovnání se skupinou s placebem. Metastatické onemocnění bylo vzácné bez zjevného rozdílu mezi těmito dvěma skupinami. Jiné prognostické faktory, jako je histologický podtyp, stupeň a stav hormonálního receptoru, se mezi skupinami nelišily.
Bylo hlášeno, že použití estrogenu a progestinů vede ke zvýšení abnormálních mamografií vyžadujících další hodnocení. Všechny ženy by měly podstupovat každoroční vyšetření prsů poskytovatelem zdravotní péče a provádět měsíční samovyšetření prsů. Kromě toho by mamografické vyšetření mělo být naplánováno na základě věku pacientky, rizikových faktorů a předchozích výsledků mamografie.
Demence
Ve studii Women's Health Initiative Memory Study (WHIMS) bylo studováno 4 532 obecně zdravých postmenopauzálních žen ve věku 65 let a starších, z nichž 35 % bylo ve věku 70 až 74 let a 18 % bylo 75 let nebo více. Po průměrném sledování 4 roky dostalo 40 žen léčených CE/MPA (1,8 %, n = 2 229) a 21 žen ve skupině s placebem (0,9 %, n = 2 303) diagnózu pravděpodobné demence. Relativní riziko CE/MPA oproti placebu bylo 2,05 (95% interval spolehlivosti 1,21 – 3,48) a bylo podobné u žen s anamnézou užívání hormonů v menopauze před WHIMS i bez ní. Absolutní riziko pravděpodobné demence u CE/MPA oproti placebu bylo 45 oproti 22 případům na 10 000 žen/rok a absolutní zvýšené riziko u CE/MPA bylo 23 případů na 10 000 žen/rok. Není známo, zda se tato zjištění týkají mladších žen po menopauze. (Vidět KLINICKÁ FARMAKOLOGIE , Klinické studie a OPATŘENÍ , Geriatrické použití .)
Není známo, zda tato zjištění platí pro terapii samotnými estrogeny.
Onemocnění žlučníku
Bylo hlášeno 2- až 4násobné zvýšení rizika onemocnění žlučníku vyžadujícího chirurgický zákrok u žen po menopauze užívajících estrogeny.
Hyperkalcémie
Podávání estrogenů může vést k těžké hyperkalcémii u pacientek s rakovinou prsu a kostními metastázami. Pokud dojde k hyperkalcémii, je třeba užívání léku přerušit a přijmout vhodná opatření ke snížení hladiny vápníku v séru.
Vizuální abnormality
U pacientek užívajících estrogeny byla hlášena retinální vaskulární trombóza. Při náhlé částečné nebo úplné ztrátě zraku nebo náhlém nástupu proptózy, diplopie nebo migrény přerušte léčbu až do vyšetření. Pokud vyšetření odhalí edém papily nebo retinální vaskulární léze, estrogeny by měly být trvale vysazeny.
OPATŘENÍ
Všeobecné
Přidání progestinu, když žena neprodělala hysterektomii
Studie přidávání progestinu po dobu 10 nebo více dnů cyklu podávání estrogenu nebo denně s estrogenem v kontinuálním režimu uvádějí nižší výskyt endometriální hyperplazie, než jaký by byl vyvolán samotnou estrogenovou léčbou. Hyperplazie endometria může být prekurzorem rakoviny endometria.
Existují však možná rizika, která mohou být spojena s užíváním progestinů s estrogeny ve srovnání s režimy samotnými estrogeny. Patří mezi ně možné zvýšené riziko rakoviny prsu.
Zvýšený krevní tlak
V malém počtu kazuistik bylo podstatné zvýšení krevního tlaku připisováno idiosynkratickým reakcím na estrogeny. Ve velké, randomizované, placebem kontrolované klinické studii nebyl pozorován generalizovaný účinek estrogenů na krevní tlak. Při užívání estrogenu je třeba v pravidelných intervalech kontrolovat krevní tlak.
Hypertriglyceridémie
U pacientek s již existující hypertriglyceridémií může být estrogenová terapie spojena se zvýšením plazmatických triglyceridů vedoucím k pankreatitidě a dalším komplikacím.
Zhoršená funkce jater a cholestatická žloutenka v minulosti
Estrogeny mohou být špatně metabolizovány u pacientů s poruchou funkce jater. U pacientek s anamnézou cholestatické žloutenky spojené s užíváním estrogenů v minulosti nebo s těhotenstvím je třeba postupovat opatrně a v případě recidivy je třeba léčbu přerušit.
Hypotyreóza
Podávání estrogenů vede ke zvýšení hladin globulinu vázajícího štítnou žlázu (TBG). Pacienti s normální funkcí štítné žlázy mohou kompenzovat zvýšený TBG tvorbou většího množství hormonu štítné žlázy, a tak udržovat sérové koncentrace volného T4 a T3 v normálním rozmezí. U pacientek závislých na substituční terapii hormony štítné žlázy, které také užívají estrogeny, mohou být nutné zvýšené dávky substituční terapie štítné žlázy. U těchto pacientů by měla být sledována funkce štítné žlázy, aby se hladina jejich volného hormonu štítné žlázy udržela v přijatelném rozmezí.
Zadržování tekutin
Protože estrogeny mohou způsobit určitý stupeň retence tekutin, vyžadují pacientky se stavy, které mohou být ovlivněny tímto faktorem, jako je astma, epilepsie, migréna a srdeční nebo renální dysfunkce, pečlivé sledování, když jsou estrogeny předepisovány.
Hypokalcémie
Estrogeny by měly být používány s opatrností u jedinců s těžkou hypokalcémií.
Rakovina vaječníků
Podstudie CE/MPA WHI uvedla, že estrogen plus progestin zvyšují riziko rakoviny vaječníků. Po průměrné době sledování 5,6 roku bylo relativní riziko karcinomu ovaria pro CE/MPA oproti placebu 1,58 (95% interval spolehlivosti 0,77 – 3,24), ale nebylo statisticky významné. Absolutní riziko CE/MPA oproti placebu bylo 4,2 oproti 2,7 případů na 10 000 žen-roků. V některých epidemiologických studiích bylo užívání samotného estrogenu, zejména po dobu deseti nebo více let, spojeno se zvýšeným rizikem rakoviny vaječníků. Jiné epidemiologické studie tyto souvislosti nenalezly.
Exacerbace endometriózy
Endometrióza může být exacerbována podáváním estrogenů. U žen léčených po hysterektomii terapií samotnými estrogeny bylo hlášeno několik případů maligní transformace reziduálních endometriálních implantátů. U pacientek, o kterých je známo, že mají po hysterektomii reziduální endometriózu, je třeba zvážit přidání progestinu.
Exacerbace jiných stavů
Estrogeny mohou způsobit exacerbaci astmatu, diabetes mellitus, epilepsii, migrénu nebo porfyrii, systémový lupus erythematodes a jaterní hemangiomy a měly by být používány s opatrností u žen s těmito onemocněními.
ESTRACE (estradiolové tablety, USP), 2 mg, obsahuje FD&C Yellow č. 5 (tartrazin), který může u některých citlivých jedinců způsobit reakce alergického typu (včetně bronchiálního astmatu). Přestože je celkový výskyt senzitivity FD&C Yellow č. 5 (tartrazin) v běžné populaci nízký, často se vyskytuje u pacientů, kteří mají také přecitlivělost na aspirin.
Informace pro pacienta
Lékařům se doporučuje diskutovat o INFORMACE PRO PACIENTA příbalový leták s pacienty, kterým ESTRACE předepisují.
Laboratorní testy
Podávání estrogenu by mělo být zahájeno nejnižší dávkou schválenou pro indikaci a poté by se mělo řídit spíše klinickou odpovědí než hladinami hormonů v séru (např. estradiol, FSH). (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ sekce.)
Karcinogeneze, mutageneze, zhoršení plodnosti
Dlouhodobé kontinuální podávání estrogenu s progestinem a bez něj u žen s dělohou i bez dělohy prokázalo zvýšené riziko rakoviny endometria, rakoviny prsu a rakoviny vaječníků. (Vidět VAROVÁNÍ V KRABIČCE , VAROVÁNÍ a OPATŘENÍ .)
Dlouhodobé kontinuální podávání přírodních a syntetických estrogenů u některých druhů zvířat zvyšuje frekvenci karcinomů prsu, dělohy, děložního čípku, pochvy, varlat a jater.
Kategorie těhotenství X
Estrace 2 mg by se neměl užívat během těhotenství. (Vidět KONTRAINDIKACE .)
Kojící matky
Bylo prokázáno, že podávání estrogenu kojícím matkám snižuje množství a kvalitu mléka. V mléce matek užívajících tento lék bylo zjištěno detekovatelné množství estrogenů. Při podávání ESTRACE 1 mg kojící ženě je třeba opatrnosti.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena. Bylo prokázáno, že velké a opakované dávky estrogenu po delší dobu urychlují uzavírání epifýz, což má za následek malý vzrůst v dospělosti, pokud je léčba zahájena před dokončením fyziologické puberty u normálně se vyvíjejících dětí. U pacientů, u kterých není růst kostí úplný, se doporučuje pravidelné sledování kostního zrání a účinků na epifyzární centra.
Estrogenová léčba prepubertálních dětí také indukuje předčasný vývoj prsou a vaginální kornifikaci a může potenciálně vyvolat vaginální krvácení u dívek. U chlapců může léčba estrogeny modifikovat normální pubertální proces. Všechny ostatní fyziologické a nežádoucí reakce, u kterých se ukázalo, že souvisejí s estrogenovou léčbou dospělých, se mohou potenciálně vyskytnout u pediatrické populace, včetně tromboembolických poruch a stimulace růstu některých nádorů. Proto by měly být estrogeny podávány pediatrickým pacientům pouze tehdy, je-li to jasně indikováno, a vždy by měla být použita nejnižší účinná dávka.
Geriatrické použití
Bezpečnost a účinnost tablet ESTRACE u geriatrických pacientů nebyla stanovena. Obecně platí, že výběr dávky pro staršího pacienta by měl být opatrný, obvykle začíná na spodní hranici dávkovacího rozmezí, což odráží nejvyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Ve studii Women's Health Initiative Memory Study, zahrnující 4 532 žen ve věku 65 let a starších, sledovaných v průměru 4 roky, bylo 82 % (n = 3 729) ve věku 65 až 74 let, zatímco 18 % (n = 803) bylo ve věku 75 let a více. Většina žen (80 %) předtím hormonální terapii neužívala. U žen léčených konjugovanými estrogeny a medroxyprogesteron acetátem bylo hlášeno dvojnásobné zvýšení rizika rozvoje pravděpodobné demence. Alzheimerova choroba byla nejčastější klasifikací pravděpodobné demence jak ve skupině s konjugovanými estrogeny plus medroxyprogesteron acetát, tak ve skupině s placebem. Devadesát procent případů pravděpodobné demence se vyskytlo u 54 % žen starších 70 let. VAROVÁNÍ , Demence .)
Není známo, zda tato zjištění platí pro terapii samotnými estrogeny.
PŘEDÁVKOVAT
Po akutním požití velkých dávek perorální antikoncepce obsahujících estrogen malými dětmi nebyly hlášeny závažné nežádoucí účinky. Předávkování estrogenem může způsobit nevolnost a zvracení a u žen se může objevit krvácení z vysazení.
KONTRAINDIKACE
Estrogeny by neměly být používány u jedinců s některým z následujících stavů:
KLINICKÁ FARMAKOLOGIE
Endogenní estrogeny jsou z velké části zodpovědné za vývoj a udržování ženského reprodukčního systému a sekundárních pohlavních znaků. Ačkoli cirkulující estrogeny existují v dynamické rovnováze metabolických interkonverzí, estradiol je hlavním intracelulárním lidským estrogenem a je podstatně účinnější než jeho metabolity, estron a estriol na úrovni receptoru.
Primárním zdrojem estrogenu u normálně cyklujících dospělých žen je ovariální folikul, který vylučuje 70 až 500 mcg estradiolu denně, v závislosti na fázi menstruačního cyklu. Po menopauze je většina endogenních estrogenů produkována přeměnou androstendionu, vylučovaného kůrou nadledvin, na estron periferními tkáněmi. Estron a sulfát-konjugovaná forma, estronsulfát, jsou tedy nejhojnější cirkulující estrogeny u postmenopauzálních žen.
Estrogeny působí prostřednictvím vazby na jaderné receptory v tkáních citlivých na estrogen. Dosud byly identifikovány dva estrogenové receptory. Ty se u jednotlivých tkání liší v poměru.
Cirkulující estrogeny modulují hypofyzární sekreci gonadotropinů, luteinizačního hormonu (LH) a folikuly stimulujícího hormonu (FSH), prostřednictvím mechanismu negativní zpětné vazby. Estrogeny působí tak, že snižují zvýšené hladiny těchto hormonů pozorované u žen po menopauze.
Farmakokinetika
Rozdělení
Distribuce exogenních estrogenů je podobná jako u endogenních estrogenů. Estrogeny jsou v těle široce distribuovány a obecně se nacházejí ve vyšších koncentracích v cílových orgánech pohlavních hormonů. Estrogeny cirkulují v krvi z velké části vázané na globulin vázající pohlavní hormony (SHBG) a albumin.
Metabolismus
Exogenní estrogeny jsou metabolizovány stejným způsobem jako endogenní estrogeny. Cirkulující estrogeny existují v dynamické rovnováze metabolických interkonverzí. Tyto přeměny probíhají především v játrech. Estradiol je reverzibilně přeměněn na estron a oba mohou být přeměněny na estriol, což je hlavní metabolit v moči. Estrogeny také podléhají enterohepatální recirkulaci prostřednictvím sulfátové a glukuronidové konjugace v játrech, biliární sekreci konjugátů do střeva a hydrolýze ve střevě s následnou reabsorpcí. U postmenopauzálních žen existuje významný podíl cirkulujících estrogenů jako sulfátové konjugáty, zejména estronsulfát, který slouží jako cirkulující rezervoár pro tvorbu aktivnějších estrogenů.
Vylučování
Estradiol, estron a estriol jsou vylučovány močí spolu s glukuronidovými a sulfátovými konjugáty.
Zvláštní populace
Nebyly provedeny žádné farmakokinetické studie u zvláštních skupin pacientů, včetně pacientů s poruchou funkce ledvin nebo jater.
Lékové interakce
Studie in vitro a in vivo ukázaly, že estrogeny jsou částečně metabolizovány cytochromem P450 3A4 (CYP3A4). Proto mohou induktory nebo inhibitory CYP3A4 ovlivnit metabolismus estrogenu. Induktory CYP3A4, jako jsou přípravky z třezalky tečkované (Hypericum perforatum), fenobarbital, karbamazepin a rifampin, mohou snižovat plazmatické koncentrace estrogenů, což může mít za následek snížení terapeutických účinků a/nebo změny profilu děložního krvácení. Inhibitory CYP3A4, jako je erytromycin, klarithromycin, ketokonazol, itrakonazol, ritonavir a grapefruitová šťáva, mohou zvýšit plazmatické koncentrace estrogenů a mohou mít nežádoucí účinky.
Klinické studie
Osteoporóza
Většina prospektivních studií účinnosti pro tuto indikaci byla provedena u bílých žen v menopauze, bez stratifikace podle jiných rizikových faktorů, a mají tendenci vykazovat všeobecně prospěšný účinek na kost.
Výsledky dvouleté, randomizované, placebem kontrolované, dvojitě zaslepené studie s dávkovacím rozmezím ukázaly, že léčba 0,5 mg estradiolu denně po dobu 23 dnů (28denní cyklus) zabraňuje úbytku kostní hmoty obratlů u žen po menopauze. Když je estrogenová terapie přerušena, kostní hmota klesá rychlostí srovnatelnou s obdobím bezprostředně po menopauze. Neexistuje žádný důkaz, že estrogenová substituční terapie obnovuje kostní hmotu na premenopauzální úroveň.
Studie iniciativy pro zdraví žen
Women's Health Initiative (WHI) zaregistrovala celkem 27 000 převážně zdravých postmenopauzálních žen, aby vyhodnotila rizika a přínosy buď samotného užívání perorálních 0,625 mg konjugovaných estrogenů (CE) denně, nebo perorálního užívání konjugovaných 0,625 mg estrogeny plus 2,5 mg medroxyprogesteron acetátu (MPA) denně ve srovnání s placebem v prevenci některých chronických onemocnění. Primárním cílovým parametrem byla incidence ischemické choroby srdeční (ICHS) (nefatální infarkt myokardu a úmrtí na ICHS), přičemž primárním studovaným nežádoucím výsledkem byl invazivní karcinom prsu. „Globální index“ zahrnoval nejčasnější výskyt ICHS, invazivní rakovinu prsu, mrtvici, plicní embolii (PE), rakovinu endometria, kolorektální rakovinu, zlomeninu kyčle nebo úmrtí z jiné příčiny. Studie nehodnotila účinky CE nebo CE/MPA na symptomy menopauzy.
Podstudie CE/MPA byla předčasně ukončena, protože podle předem definovaného pravidla pro zastavení převyšovalo zvýšené riziko rakoviny prsu a kardiovaskulárních příhod stanovené přínosy zahrnuté v „globálním indexu“. Výsledky podstudie CE/MPA, do které bylo zahrnuto 16 608 žen (průměrný věk 63 let, rozmezí 50 až 79 let; 83,9 % bělochů, 6,5 % černochů, 5,5 % hispánců), po průměrné době sledování 5,2 let uvádí tab. 1 níže:
U výsledků zahrnutých do „globálního indexu“ bylo absolutní nadměrné riziko na 10 000 žen-roků ve skupině léčené CE/MPA o 7 více příhod ICHS, 8 více cévních mozkových příhod, 8 více PE a 8 více invazivních karcinomů prsu, zatímco absolutní snížení rizika na 10 000 žen-roků bylo o 6 méně kolorektálních karcinomů a o 5 méně zlomenin kyčle. Absolutní nadměrné riziko příhod zahrnutých do „globálního indexu“ bylo 19 na 10 000 žen-roků. Mezi skupinami nebyl žádný rozdíl z hlediska mortality ze všech příčin. (Vidět VAROVÁNÍ V KRABIČCE , VAROVÁNÍ , a OPATŘENÍ .)
Studie paměti iniciativy Women's Health Initiative
Do studie Women’s Health Initiative Memory Study (WHIMS), podstudie WHI, bylo zařazeno 4 532 převážně zdravých žen po menopauze ve věku 65 let a starších (47 % bylo ve věku 65 až 69 let, 35 % bylo ve věku 70 až 74 let a 18 let). % bylo ve věku 75 let a více), aby se vyhodnotily účinky CE/MPA (0,625 mg konjugovaných estrogenů plus 2,5 mg medroxyprogesteron acetátu) na výskyt pravděpodobné demence (primární výsledek) ve srovnání s placebem.
Po průměrném sledování 4 roky byla u 40 žen ve skupině s estrogenem/progestinem (45 na 10 000 žen-roků) au 21 ve skupině s placebem (22 na 10 000 žen-roků) diagnostikována pravděpodobná demence. Relativní riziko pravděpodobné demence ve skupině s hormonální terapií bylo 2,05 (95% CI, 1,21 až 3,48) ve srovnání s placebem. Rozdíly mezi skupinami se ukázaly v prvním roce léčby. Není známo, zda se tato zjištění týkají mladších žen po menopauze. (Vidět VAROVÁNÍ V KRABICE a VAROVÁNÍ , Demence .)
INFORMACE PRO PACIENTA
ÚVOD
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat ESTRACE 2 mg, a přečtěte si, co dostanete pokaždé, když si ESTRACE doplníte. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
JAKÉ JSOU NEJDŮLEŽITĚJŠÍ INFORMACE, KTERÉ BYCH MĚL VĚDĚT O ESTRACE (HORMON ESTROGENU)?
- Estrogeny zvyšují pravděpodobnost vzniku rakoviny dělohy.
Okamžitě oznamte jakékoli neobvyklé vaginální krvácení, když užíváte estrogeny. Vaginální krvácení po menopauze může být varovným příznakem rakoviny dělohy. Váš poskytovatel zdravotní péče by měl zkontrolovat jakékoli neobvyklé vaginální krvácení, aby zjistil příčinu.
- Nepoužívejte estrogeny s nebo bez progestinů k prevenci srdečních onemocnění, srdečních záchvatů nebo mrtvice.
Užívání estrogenů s nebo bez progestinů může zvýšit vaše šance na infarkt, mrtvici, rakovinu prsu a krevní sraženiny. Užívání estrogenů s progestiny může zvýšit riziko demence. Vy a váš poskytovatel zdravotní péče byste měli pravidelně mluvit o tom, zda stále potřebujete léčbu přípravkem ESTRACE.
CO JE ESTRACE?
ESTRACE je lék, který obsahuje estrogenní hormony.
K ČEMU SE ESTRACE POUŽÍVÁ?
ESTRACE 1 mg se používá k:
- snížit střední až silné návaly horka
Estrogeny jsou hormony produkované ženskými vaječníky. Mezi 45. a 55. rokem věku vaječníky normálně přestávají produkovat estrogeny. To vede k poklesu hladiny estrogenu v těle, což způsobuje „změnu života“ nebo menopauzu (konec měsíčních menstruačních období). Někdy jsou oba vaječníky odstraněny během operace před přirozenou menopauzou. Náhlý pokles hladiny estrogenu způsobuje „chirurgickou menopauzu“.
Když hladiny estrogenu začnou klesat, u některých žen se objeví velmi nepříjemné příznaky, jako jsou pocity tepla v obličeji, krku a hrudníku nebo náhlé silné pocity tepla a pocení („návaly horka“ nebo „návaly horka“). U některých žen jsou příznaky mírné a nebudou potřebovat estrogeny. U jiných žen mohou být příznaky závažnější. Vy a váš poskytovatel zdravotní péče byste měli pravidelně mluvit o tom, zda stále potřebujete léčbu přípravkem ESTRACE.
Cvičení se zátěží, jako je chůze nebo běh, a užívání vápníku s doplňky vitamínu D mohou také snížit vaše šance na postmenopauzální osteoporózu. Před zahájením cvičení je důležité promluvit si o cvičení a doplňcích stravy se svým poskytovatelem zdravotní péče.
léčba suchosti, svědění a pálení v pochvě nebo kolem ní, potíže s močením nebo pálení při močení spojené s menopauzou
Vy a váš poskytovatel zdravotní péče byste měli pravidelně mluvit o tom, zda stále potřebujete léčbu přípravkem ESTRACE ke kontrole těchto problémů. Pokud používáte ESTRACE pouze k léčbě suchosti, svědění a pálení v pochvě a kolem ní, promluvte si se svým poskytovatelem zdravotní péče o tom, zda by pro vás nebyl lepší topický vaginální produkt.
- léčit určité stavy, kdy vaječníky mladé ženy přirozeně neprodukují dostatek estrogenu
- k léčbě určitých typů abnormálního vaginálního krvácení v důsledku hormonální nerovnováhy, pokud váš lékař nezjistil žádnou závažnou příčinu krvácení
- léčit některé druhy rakoviny ve zvláštních situacích, u mužů a žen
- zabránit řídnutí kostí
Osteoporóza z menopauzy je řídnutí kostí, které je činí slabšími a snadněji se lámou. Pokud užíváte ESTRACE 1 mg pouze k prevenci osteoporózy z menopauzy, poraďte se se svým poskytovatelem zdravotní péče o tom, zda by pro vás nebyla lepší jiná léčba nebo lék bez estrogenů. Vy a váš poskytovatel zdravotní péče byste měli pravidelně mluvit o tom, zda máte pokračovat v léčbě ESTRACE.
KDO BY NEMĚL UŽÍVAT ESTRACE 2 mg?
Nezačínejte užívat ESTRACE 2 mg, pokud:
- máte neobvyklé vaginální krvácení, které nebylo vyhodnoceno vaším lékařem (viz VAROVÁNÍ NA RÁMEČKU)
Neobvyklé vaginální krvácení může být varovným příznakem rakoviny dělohy, zvláště pokud k němu dojde po menopauze. Váš lékař musí zjistit příčinu krvácení, aby mohl doporučit správnou léčbu. Užívání estrogenů bez návštěvy lékaře vám může způsobit vážné poškození, pokud je vaše vaginální krvácení způsobeno rakovinou dělohy.
- v současné době mají nebo jste měli určité druhy rakoviny
Estrogeny mohou zvýšit riziko některých typů rakoviny, včetně rakoviny prsu nebo dělohy. Pokud máte nebo jste měli rakovinu, poraďte se se svým poskytovatelem zdravotní péče o tom, zda byste měli užívat ESTRACE.
(U některých pacientů s rakovinou prsu nebo prostaty mohou pomoci estrogeny.)
- měl v posledním roce mrtvici nebo srdeční infarkt
- v současné době máte nebo jste měli krevní sraženiny
- máte nebo jste měl(a) problémy s játry
- jste alergičtí na ESTRACE nebo na kteroukoli jeho složku
Seznam složek přípravku ESTRACE naleznete na konci této příbalové informace.
Tablety ESTRACE 2 mg obsahují tartrazin, který může u některých vnímavých jedinců způsobit reakce alergického typu (včetně bronchiálního astmatu). Přestože je celkový výskyt senzitivity FD&C Yellow č. 5 (tartrazin) v běžné populaci nízký, často se vyskytuje u pacientů, kteří mají také přecitlivělost na aspirin.
- myslíte, že byste mohla být těhotná
Sdělte svému poskytovateli zdravotní péče:
- pokud kojíte
Hormon v ESTRACE 1 mg může přecházet do vašeho mléka
- všech svých zdravotních problémech
Váš poskytovatel zdravotní péče vás možná bude muset pečlivěji zkontrolovat, pokud máte určité stavy, jako je astma (sípání), epilepsie (záchvaty), migréna, endometrióza, lupus, problémy se srdcem, játry, štítnou žlázou, ledvinami nebo máte vysoké hladiny vápníku ve vaší krvi.
- o všech lécích, které užíváte
To zahrnuje léky na předpis i bez předpisu, vitamíny a bylinné doplňky. Některé léky mohou ovlivnit účinek přípravku ESTRACE 1 mg. ESTRACE 1 mg může také ovlivnit účinek jiných léků.
- jestliže máte podstoupit operaci nebo budete v klidu na lůžku
Možná budete muset přestat užívat estrogeny.
JAK MÁM UŽÍVAT ESTRACE?
1. Začněte na nejnižší dávce a poraďte se se svým poskytovatelem zdravotní péče o tom, jak dobře na vás tato dávka působí.
2. Estrogeny by měly být používány v nejnižší možné dávce pro vaši léčbu pouze po dobu nezbytně nutnou. Vy a váš poskytovatel zdravotní péče byste měli pravidelně (například každé 3 až 6 měsíců) mluvit o dávce, kterou užíváte, a o tom, zda stále potřebujete léčbu přípravkem ESTRACE.
JAKÉ JSOU MOŽNÉ NEŽÁDOUCÍ ÚČINKY ESTROGENŮ?
Méně časté, ale závažné nežádoucí účinky zahrnují:
- Rakovina prsu
- Rakovina dělohy
- Mrtvice
- Infarkt
- Krevní sraženiny
- Demence
- Onemocnění žlučníku
- Rakovina vaječníků
Toto jsou některé z varovných příznaků závažných nežádoucích účinků:
- Bulky v prsou
- Neobvyklé vaginální krvácení
- Závratě a mdloby
- Změny v řeči
- Silné bolesti hlavy
- Bolest na hrudi
- Dušnost
- Bolesti nohou
- Změny vidění
- Zvracení
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u vás objeví některý z těchto varovných příznaků nebo jakýkoli jiný neobvyklý příznak, který se vás týká.
Mezi běžné nežádoucí účinky patří:
- Bolest hlavy
- Bolest prsou
- Nepravidelné vaginální krvácení nebo špinění
- Křeče žaludku/břicha, nadýmání
- Nevolnost a zvracení
- Ztráta vlasů
Mezi další nežádoucí účinky patří:
- Vysoký krevní tlak
- Problémy s játry
- Vysoká hladina cukru v krvi
- Zadržování tekutin
- Zvětšení benigních nádorů ("fibroidů") dělohy
- Skvrnité ztmavnutí pokožky, zejména na obličeji
- Vaginální kvasinková infekce
Toto nejsou všechny možné vedlejší účinky přípravku ESTRACE. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
CO MŮŽU UDĚLAT PRO SNÍŽENÍ ŠANCÍ NA VÁŽNÉ VEDLEJŠÍ ÚČINKY S ESTRACE?
Pokud používáte estrogeny, můžete snížit svá rizika tím, že budete dělat tyto věci:
- Promluvte si se svým poskytovatelem zdravotní péče:
- Dávejte pozor na známky potíží
Pokud se některý z těchto varovných signálů (nebo jiné neobvyklé příznaky) objeví během užívání estrogenů, okamžitě zavolejte svého lékaře:
Abnormální krvácení z pochvy (možná rakovina dělohy)
Bolesti v lýtkách nebo na hrudi, náhlá dušnost nebo kašel krve (možná sraženina v nohách nebo plicích)
Silná bolest hlavy nebo zvracení, závratě, mdloby, změny vidění nebo řeči, slabost nebo necitlivost paže nebo nohy (možná sraženina v mozku nebo oku)
Bulky v prsou (možná rakovina prsu; požádejte svého lékaře nebo zdravotníka, aby vám ukázal, jak si měsíčně vyšetřit prsa)
Zežloutnutí kůže nebo očí (možný problém s játry)
Bolest, otok nebo citlivost v břiše (možný problém se žlučníkem)
OBECNÉ INFORMACE O BEZPEČNÉM A EFEKTIVNÍM POUŽÍVÁNÍ ESTRACE
Léky jsou někdy předepisovány na stavy, které nejsou uvedeny v příbalových informacích pro pacienty. Neužívejte ESTRACE 2 mg na stavy, pro které nebyl předepsán. Nedávejte ESTRACE 1 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
UCHOVÁVEJTE ESTRACE MIMO DOSAH DĚTÍ
Tato příbalová informace obsahuje souhrn nejdůležitějších informací o přípravku ESTRACE. Pokud byste chtěli další informace, promluvte si se svým poskytovatelem zdravotní péče nebo lékárníkem. Můžete požádat o informace o ESTRACE, které jsou určeny pro zdravotníky. Další informace získáte na bezplatném čísle 1-800-521-8813.
JAKÉ JSOU INGREDIENCE V ESTRACE?
Neaktivní ingredience: Koloidní oxid křemičitý, kukuřičný škrob, hydrogenfosforečnan vápenatý, monohydrát laktózy, magnesium-stearát a sodná sůl glykolátu škrobu. Navíc 1 mg obsahuje také FD&C blue no. 1 hliníkový lak a D&C červená č. 27 hliníkové jezero. 2 mg také obsahuje FD&C blue no. 1 hliníkový lak a FD&C žlutá č. 5 (tartrazin) hliníkový lak.
