Provera 5mg, 10mg Medroxyprogesterone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Provera a jak se používá?
Provera 10 mg je lék na předpis používaný k léčbě příznaků silného menstruačního krvácení, chybějícího nebo nepravidelného menstruačního krvácení a jako antikoncepce. Provera 10 mg lze užívat samostatně nebo s jinými léky.
Provera 5 mg patří do třídy léků nazývaných Antineoplastika, Hormony, Progestiny.
Není známo, zda je přípravek Provera bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Provera 10 mg?
Provera 5 mg může způsobit závažné nežádoucí účinky, včetně:
- vaginální krvácení (pokud jste již prošli menopauzou),
- točení hlavy,
- bulka v prsou,
- Deprese,
- problémy se spánkem (nespavost),
- závrať,
- změny nálady,
- bolest hlavy,
- horečka,
- zežloutnutí kůže nebo očí (žloutenka),
- otoky rukou, kotníků nebo nohou,
- bolest nebo tlak na hrudi,
- bolest šířící se do čelisti nebo ramene,
- nevolnost,
- pocení,
- náhlá necitlivost nebo slabost,
- náhlá silná bolest hlavy,
- nezřetelná řeč,
- problémy se zrakem,
- problémy s vaší rovnováhou,
- náhlý kašel,
- sípání,
- zrychlené dýchání,
- vykašlávání krve a
- bolest v noze (nebo obojí) s otokem, teplem a zarudnutím
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Provera 10 mg patří:
- špinění nebo krvácení z průniku,
- změny ve vaší menstruaci,
- vaginální svědění nebo výtok,
- citlivost prsou nebo výtok,
- bolest hlavy,
- závrať,
- pocit nervozity nebo deprese,
- modřiny nebo otoky vašich žil,
- nadýmání,
- zadržování tekutin,
- změny nálady,
- problémy se spánkem (nespavost),
- svědění,
- vyrážka,
- akné,
- růst vlasů,
- ztráta vlasů na hlavě,
- žaludeční nevolnost,
- nadýmání,
- nevolnost,
- přírůstek hmotnosti a
- změny vidění nebo potíže s nošením kontaktních čoček
VAROVÁNÍ
KARDIOVASKULÁRNÍ PORUCHY, RAKOVINA PRSU A PRAVDĚPODOBNÁ DEMENCE PRO TERAPII ESTROGEN PLUS PROGESTIN
Kardiovaskulární poruchy a pravděpodobná demence
Léčba estrogeny a progestinem by neměla být používána k prevenci kardiovaskulárních onemocnění nebo demence. (Vidět Klinické studie a VAROVÁNÍ , Kardiovaskulární poruchy a pravděpodobná demence .)
Podstudie Women's Health Initiative (WHI) estrogen plus progestin oznámila zvýšené riziko hluboké žilní trombózy (DVT), plicní embolie (PE), mrtvice a infarktu myokardu (MI) u postmenopauzálních žen (50 až 79 let věku). ) během 5,6 let léčby denními perorálními konjugovanými estrogeny (CE) [0,625 mg] v kombinaci s medroxyprogesteron acetátem (MPA) [2,5 mg] ve srovnání s placebem. (Vidět Klinické studie a VAROVÁNÍ , Kardiovaskulární poruchy .)
WHI Memory Study (WHIMS) doplňková studie estrogen plus progestin zaznamenala zvýšené riziko rozvoje pravděpodobné demence u postmenopauzálních žen ve věku 65 let nebo starších během 4 let léčby denním CE (0,625 mg) v kombinaci s MPA (2,5 mg), relativní na placebo. Není známo, zda se toto zjištění týká mladších žen po menopauze. (Vidět Klinické studie a VAROVÁNÍ , Pravděpodobná demence a OPATŘENÍ , Geriatrické použití .)
Rakovina prsu
Podstudie WHI estrogen plus progestin prokázala zvýšené riziko invazivního karcinomu prsu. (Vidět Klinické studie a VAROVÁNÍ , Maligní novotvar , Rakovina prsu .)
Při absenci srovnatelných údajů je třeba předpokládat, že tato rizika jsou podobná u jiných dávek CE a MPA a jiných kombinací a dávkových forem estrogenů a progestinů.
Progestiny s estrogeny by měly být předepisovány v nejnižších účinných dávkách a po nejkratší dobu v souladu s cíli a riziky léčby pro jednotlivé ženy.
POPIS
Tablety PROVERA® obsahují medroxyprogesteron acetát, což je derivát progesteronu. Je to bílý až téměř bílý krystalický prášek bez zápachu, stabilní na vzduchu, tající mezi 200 a 210 °C. Je snadno rozpustný v chloroformu, rozpustný v acetonu a dioxanu, těžce rozpustný v alkoholu a methanolu, těžce rozpustný v etheru a nerozpustný ve vodě.
Chemický název medroxyprogesteron acetátu je pregn-4-en-3, 20-dion, 17-(acetyloxy)-6-methyl-, (6a)-. Strukturní vzorec je:
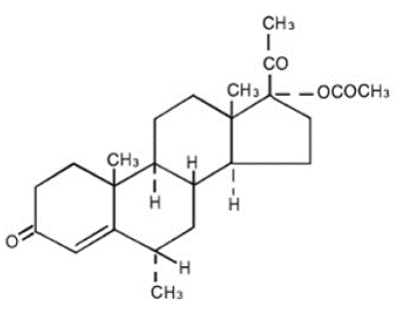
Každá tableta PROVERA 5 mg pro perorální podání obsahuje 2,5 mg, 5 mg nebo 10 mg medroxyprogesteron acetátu a následující neúčinné složky: stearát vápenatý, kukuřičný škrob, laktózu, minerální olej, kyselinu sorbovou, sacharózu a mastek. 2,5 mg tableta obsahuje FD&C Yellow č. 6.
INDIKACE
PROVERA 5 mg tablety jsou indikovány k léčbě sekundární amenorey a abnormálního děložního krvácení v důsledku hormonální nerovnováhy při absenci organické patologie, jako jsou myomy nebo rakovina dělohy. Jsou také indikovány pro použití při prevenci hyperplazie endometria u nehysterektomizovaných postmenopauzálních žen, které denně dostávají perorálně 0,625 mg tablety s konjugovanými estrogeny.
DÁVKOVÁNÍ A PODÁVÁNÍ
Sekundární amenorea
Tablety PROVERA 10 mg lze podávat v dávkách 5 nebo 10 mg denně po dobu 5 až 10 dnů. Dávka pro navození optimální sekreční transformace endometria, které bylo adekvátně aktivováno buď endogenním nebo exogenním estrogenem, je 10 mg přípravku PROVERA 10 mg denně po dobu 10 dnů. V případech sekundární amenorey lze léčbu zahájit kdykoli. Krvácení z vysazení progestinu se obvykle objeví během tří až sedmi dnů po ukončení léčby přípravkem PROVERA 10 mg.
Abnormální děložní krvácení v důsledku hormonální nerovnováhy při absenci organické patologie
Počínaje vypočteným 16. nebo 21. dnem menstruačního cyklu lze podávat 5 nebo 10 mg přípravku PROVERA 10 mg denně po dobu 5 až 10 dnů. K dosažení optimální sekreční transformace endometria, které bylo adekvátně aktivované buď endogenním nebo exogenním estrogenem, se doporučuje 10 mg přípravku PROVERA 10 mg denně po dobu 10 dnů počínaje 16. dnem cyklu. Krvácení z vysazení progestinu se obvykle objeví během tří až sedmi dnů po ukončení léčby přípravkem PROVERA. Pacientky s anamnézou opakujících se epizod abnormálního děložního krvácení mohou mít prospěch z plánovaného menstruačního cyklu s přípravkem PROVERA.
Snížení hyperplazie endometria u žen po menopauze, které denně dostávají 0,625 mg konjugovaných estrogenů
Když je estrogen předepsán ženám po menopauze s dělohou, měl by být také zahájen progestin, aby se snížilo riziko rakoviny endometria. Žena bez dělohy nepotřebuje progestin. Užívání estrogenu samotného nebo v kombinaci s progestinem by mělo být s nejnižší účinnou dávkou a po nejkratší dobu v souladu s cíli a riziky léčby pro jednotlivé ženy. Pacienti by měli být pravidelně přehodnocováni, jak je to klinicky vhodné (například 3 až 6měsíční intervaly), aby se zjistilo, zda je léčba stále nezbytná (viz VAROVÁNÍ ). U žen, které mají dělohu, by měla být provedena adekvátní diagnostická opatření, jako je odběr endometria, pokud je to indikováno, k vyloučení malignity v případech nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního vaginálního krvácení.
Tablety PROVERA lze podávat v dávkách 5 nebo 10 mg denně po dobu 12 až 14 po sobě jdoucích dnů v měsíci u žen po menopauze, které denně dostávají 0,625 mg konjugovaných estrogenů, a to buď počínaje 1. dnem cyklu nebo 16. dnem cyklu.
Pacienti by měli začít s nejnižší dávkou.
Nejnižší účinná dávka přípravku PROVERA nebyla stanovena.
JAK DODÁVÁNO
PROVERA 10 mg tablety jsou k dispozici v následujících silách a velikostech balení:
2,5 mg (bodovaný, kulatý, oranžový)
Láhve po 30 NDC 0009-0064-06 Láhve po 100 ks NDC 0009-0064-04
5 mg (bodovaný, šestihranný, bílý)
Láhve po 100 NDC 0009-0286-03
10 mg (bodovaný, kulatý, bílý)
Láhve po 100 NDC 0009-0050-02 Láhve po 500 NDC 0009-0050-11
Skladujte při kontrolované pokojové teplotě 20° až 25°C (68° až 77°F) [viz USP ].
"Uchovávejte mimo dosah dětí"
Distribuuje: Pharmacia & Upjohn Company, divize společnosti Pfizer Inc., NY, NY 10017. Revize: srpen 2015
VEDLEJŠÍ EFEKTY
Vidět VAROVÁNÍ V KRABIČCE , VAROVÁNÍ , a OPATŘENÍ .
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Následující nežádoucí účinky byly hlášeny u žen užívajících přípravek PROVERA 10 mg tablety bez současné léčby estrogeny:
Genitourinární systém
Abnormální děložní krvácení (nepravidelné, zvýšení, snížení), změna menstruačního toku, krvácení z průniku, špinění, amenorea, změny cervikální eroze a cervikální sekrece.
Prsa
Byla hlášena citlivost prsů, mastodynie nebo galaktorea.
Kardiovaskulární
Byly hlášeny tromboembolické poruchy včetně tromboflebitidy a plicní embolie.
Gastrointestinální
Nevolnost, cholestatická žloutenka.
Kůže
Objevily se reakce z přecitlivělosti zahrnující kopřivku, pruritus, edém a generalizovanou vyrážku. Objevilo se akné, reakce z přecitlivělosti zahrnující kopřivku, pruritus, edém a generalizovanou vyrážku. Bylo hlášeno akné, alopecie a hirsutismus.
Oči
Neurookulární léze, například retinální trombóza a optická neuritida.
Centrální nervový systém
Duševní deprese, nespavost, somnolence, závratě, bolesti hlavy, nervozita.
Smíšený
Hypersenzitivní reakce (například anafylaxe a anafylaktoidní reakce, angioedém), vyrážka (alergická) se svěděním a bez něj, změna hmotnosti (zvýšení nebo snížení), pyrexie, edém/retence tekutin, únava, snížená glukózová tolerance.
Při léčbě estrogenem a progestinem byly hlášeny následující nežádoucí účinky.
Genitourinární systém
Abnormální děložní krvácení/špinění nebo průtok; průlomové krvácení; špinění; dysmenoreální/pánevní bolest; zvýšení velikosti děložních leiomyomů; vaginitida, včetně vaginální kandidózy; změna množství cervikální sekrece; změny cervikálního ektropia; rakovina vaječníků; hyperplazie endometria; rakovina endometria.
Prsa
Citlivost, zvětšení, bolest, výtok z bradavek, galaktorea; fibrocystické změny prsu; rakovina prsu.
Kardiovaskulární
Hluboká a povrchová žilní trombóza; plicní embolie; tromboflebitida; infarkt myokardu; mrtvice; zvýšení krevního tlaku.
Gastrointestinální
Nevolnost, zvracení; křeče v břiše, nadýmání; cholestatická žloutenka; zvýšený výskyt onemocnění žlučníku; pankreatitida; zvětšení jaterních hemangiomů.
Kůže
chloasma nebo melasma, které mohou přetrvávat po vysazení léku; erythema multiforme; erythema nodosum; hemoragická erupce; ztráta vlasů na pokožce hlavy; hirsutismus; svědění, vyrážka.
Oči
Trombóza cév sítnice, nesnášenlivost kontaktních čoček.
Centrální nervový systém
Bolest hlavy; migréna; závrať; duševní deprese; chorea; nervozita; poruchy nálady; podrážděnost; exacerbace epilepsie, demence.
Smíšený
Zvýšení nebo snížení hmotnosti; snížená tolerance sacharidů; zhoršení porfyrie; otok; arthalgie; křeče v nohou; změny libida; kopřivka, angioedém, anafylaktoidní/anafylaktické reakce; hypokalcémie; exacerbace astmatu; zvýšené triglyceridy.
DROGOVÉ INTERAKCE
Interakce mezi drogami a laboratorními testy
Následující laboratorní výsledky mohou být ovlivněny užíváním estrogenu a progestinové terapie:
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
Vidět VAROVÁNÍ V KRABIČCE .
Kardiovaskulární poruchy
Při léčbě estrogenem a progestinem bylo hlášeno zvýšené riziko PE, DVT, mrtvice a IM. Pokud se některá z těchto příhod objeví nebo je na ni podezření, léčba estrogenem a progestinem by měla být okamžitě přerušena.
Rizikové faktory pro arteriální vaskulární onemocnění (například hypertenze, diabetes mellitus, užívání tabáku, hypercholesterolémie a obezita) a/nebo žilní tromboembolismus (VTE) (například osobní nebo rodinná anamnéza VTE, obezita a systémový lupus erythematodes) by měly být vhodně řízeny.
Mrtvice
podstudii WHI estrogen plus progestin bylo hlášeno statisticky významné zvýšení rizika cévní mozkové příhody u žen ve věku 50 až 79 let užívajících CE (0,625 mg) plus MPA (2,5 mg) ve srovnání s ženami ve stejné věkové skupině, které dostávaly placebo (33 oproti 25 na 10 000 žen-roků). (Vidět Klinické studie .) Nárůst rizika byl prokázán po prvním roce a přetrvával. Pokud dojde k cévní mozkové příhodě nebo je na ni podezření, léčba estrogeny a progestinem by měla být okamžitě přerušena.
Ischemická choroba srdeční
V podstudii WHI estrogen plus progestin bylo statisticky nevýznamné zvýšené riziko ICHS hlášených u žen užívajících denně CE (0,625 mg) plus MPA (2,5 mg) ve srovnání s ženami, které dostávaly placebo (41 oproti 34 na 10 000 žen-roků ). V roce 1 bylo prokázáno zvýšení relativního rizika a v letech 2 až 5 byl hlášen trend ke snižování relativního rizika.
postmenopauzálních žen s prokázaným srdečním onemocněním (n = 2 763, průměrný věk 66,7 let) v kontrolované klinické studii sekundární prevence kardiovaskulárních onemocnění (Heart and Estrogen/Progestin Replacement Study [HERS]) byla denní léčba CE (0,625 mg ) plus MPA (2,5 mg) neprokázaly žádný kardiovaskulární přínos. Během průměrného sledování 4,1 roku léčba CE plus MPA nesnížila celkovou četnost ICHS u postmenopauzálních žen s prokázanou ischemickou chorobou srdeční. Ve skupině léčené CE plus MPA bylo více ICHS než ve skupině s placebem v roce 1, ale ne během následujících let. Dva tisíce tři sta dvacet jedna (2 321) žen z původní studie HERS souhlasilo s účastí na otevřeném rozšíření HERS, HERS II. Průměrná doba sledování u HERS II byla dalších 2,7 roku, celkem tedy 6,8 roku. Četnost ICHS byla srovnatelná u žen ve skupině CE plus MPA a ve skupině s placebem v HERS, HERS II a celkově.
Žilní tromboembolismus
podstudii WHI estrogen plus progestin byl hlášen statisticky významný 2krát vyšší výskyt VTE (DVT a PE) u žen užívajících denně CE (0,625 mg) plus MPA (2,5 mg) ve srovnání s ženami užívajícími placebo (35 oproti 17 na 10 000 ženských let). Bylo také prokázáno statisticky významné zvýšení rizika jak HŽT (26 versus 13 na 10 000 žen-roků), tak PE (18 versus 8 na 10 000 žen-roků). Zvýšení rizika VTE bylo prokázáno během prvního roku a přetrvávalo. (Vidět Klinické studie .) Pokud se VTE objeví nebo je podezření na VTE, léčba estrogeny a progestinem by měla být okamžitě přerušena.
Pokud je to možné, estrogeny a progestiny by měly být vysazeny alespoň 4 až 6 týdnů před operací typu spojeného se zvýšeným rizikem tromboembolie nebo během období delší imobilizace.
Maligní novotvary
Rakovina prsu
Nejdůležitější randomizovanou klinickou studií poskytující informace o rakovině prsu u uživatelek estrogenu a progestinů je podstudie WHI s denním CE (0,625 mg) plus MPA (2,5 mg). Po průměrné době sledování 5,6 roku uváděla podstudie estrogen plus progestin zvýšené riziko invazivního karcinomu prsu u žen, které denně užívaly CE plus MPA.
této podstudii uvádělo předchozí použití léčby samotným estrogenem nebo estrogenem plus progestinem 26 procent žen. Relativní riziko invazivního karcinomu prsu bylo 1,24 a absolutní riziko bylo 41 oproti 33 případům na 10 000 žen-roků pro CE plus MPA ve srovnání s placebem. Mezi ženami, které uváděly předchozí užívání hormonální terapie, bylo relativní riziko invazivního karcinomu prsu 1,86 a absolutní riziko bylo 46 oproti 25 případům na 10 000 žen-roků pro CE plus MPA ve srovnání s placebem. Mezi ženami, které dříve neužívaly hormonální terapii, bylo relativní riziko invazivního karcinomu prsu 1,09 a absolutní riziko bylo 40 oproti 36 případům na 10 000 žen-roků pro CE plus MPA ve srovnání s placebem. Ve stejné podstudii byly invazivní karcinomy prsu větší, měly vyšší pravděpodobnost pozitivních uzlin a byly diagnostikovány v pokročilejším stádiu ve skupině CE (0,625 mg) plus MPA (2,5 mg) ve srovnání se skupinou s placebem. Metastatické onemocnění bylo vzácné bez zjevného rozdílu mezi těmito dvěma skupinami. Jiné prognostické faktory, jako je histologický podtyp, stupeň a stav hormonálního receptoru, se mezi skupinami nelišily. (Vidět Klinické studie .)
souladu s klinickou studií WHI pozorovací studie také uvádějí zvýšené riziko rakoviny prsu při léčbě estrogenem a progestinem a menší riziko při léčbě samotným estrogenem po několika letech užívání. Riziko se zvyšovalo s délkou užívání a zdálo se, že se vrací na výchozí hodnoty během přibližně 5 let po ukončení léčby (podstatné údaje o riziku po ukončení léčby mají pouze observační studie). Observační studie také naznačují, že riziko rakoviny prsu bylo vyšší a ukázalo se dříve při léčbě estrogenem a progestinem ve srovnání s terapií samotným estrogenem. Tyto studie však nezjistily významné rozdíly v riziku rakoviny prsu mezi různými kombinacemi estrogenu a progestinů nebo cestami podávání.
Bylo hlášeno, že použití estrogenu a progestinů vede ke zvýšení abnormálních mamografií vyžadujících další hodnocení. Všechny ženy by měly podstupovat každoroční vyšetření prsů poskytovatelem zdravotní péče a provádět měsíční samovyšetření prsů. Kromě toho by mamografické vyšetření mělo být naplánováno na základě věku pacientky, rizikových faktorů a předchozích výsledků mamografie.
Endometriální rakovina
žen s dělohou bylo hlášeno zvýšené riziko rakoviny endometria při použití neoponované estrogenové terapie. Hlášené riziko rakoviny endometria mezi uživatelkami estrogenu bez odporu je asi 2 až 12krát vyšší než u žen, které neužívají, a zdá se závislé na délce léčby a na dávce estrogenu. Většina studií neprokazuje žádné významné zvýšené riziko spojené s užíváním estrogenů po dobu kratší než 1 rok. Největší riziko se zdá být spojeno s dlouhodobým užíváním, se zvýšeným rizikem 15 až 24krát po dobu 5 až 10 let nebo déle. Bylo prokázáno, že toto riziko přetrvává po dobu nejméně 8 až 15 let po ukončení léčby estrogeny.
Důležitý je klinický dohled nad všemi ženami užívajícími estrogen plus progestinovou terapii. Ve všech případech nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního genitálního krvácení by měla být provedena adekvátní diagnostická opatření, včetně odběru vzorků endometria, je-li to indikováno, k vyloučení malignity. Neexistují žádné důkazy o tom, že by použití přirozených estrogenů mělo za následek odlišný profil endometriálního rizika než syntetické estrogeny s ekvivalentní dávkou estrogenu. Bylo prokázáno, že přidání progestinu k estrogenové terapii snižuje riziko hyperplazie endometria, která může být prekurzorem rakoviny endometria.
Rakovina vaječníků
Podstudie WHI estrogen plus progestin zaznamenala statisticky nevýznamné zvýšení rizika rakoviny vaječníků. Po průměrné době sledování 5,6 roku bylo relativní riziko karcinomu ovaria pro CE plus MPA oproti placebu 1,58 (95% CI, 0,77–3,24). Absolutní riziko CE plus MPA bylo 4 oproti 3 případům na 10 000 žen-roků. V některých epidemiologických studiích bylo užívání estrogenu plus progestinů a přípravků obsahujících pouze estrogen, zejména po dobu 5 nebo více let, spojeno se zvýšeným rizikem rakoviny vaječníků. Avšak trvání expozice spojené se zvýšeným rizikem není konzistentní ve všech epidemiologických studiích a některé neuvádějí žádnou souvislost.
Pravděpodobná demence
doplňkové studii WHI s estrogenem a progestinem WHI byla populace 4 532 postmenopauzálních žen ve věku 65 až 79 let randomizována k denní léčbě CE (0,625 mg) plus MPA (2,5 mg) nebo placebu. Po průměrném sledování 4 roky byla u 40 žen ve skupině CE plus MPA au 21 žen ve skupině s placebem diagnostikována pravděpodobná demence. Relativní riziko pravděpodobné demence pro CE plus MPA oproti placebu bylo 2,05 (95% CI, 1,21–3,48). Absolutní riziko pravděpodobné demence u CE plus MPA oproti placebu bylo 45 oproti 22 případům na 10 000 žen-roků. Není známo, zda se tato zjištění týkají mladších žen po menopauze. (Vidět Klinické studie a OPATŘENÍ , Geriatrické použití .)
Vizuální abnormality
Pokud dojde k náhlé částečné nebo úplné ztrátě zraku nebo k náhlému nástupu proptózy, diplopie nebo migrény, přerušte léčbu estrogeny a progestinem až do vyšetření. Pokud vyšetření odhalí edém papily nebo retinální vaskulární léze, léčba estrogenem a progestinem by měla být trvale ukončena.
OPATŘENÍ
Všeobecné
Přidání progestinu, když žena neprodělala hysterektomii
Studie přidávání progestinu po dobu 10 nebo více dnů cyklu podávání estrogenu nebo denně s estrogenem v kontinuálním režimu uvádějí nižší výskyt endometriální hyperplazie, než jaký by byl vyvolán samotnou estrogenovou léčbou. Hyperplazie endometria může být prekurzorem rakoviny endometria.
Existují však možná rizika, která mohou být spojena s užíváním progestinů s estrogeny ve srovnání s režimy samotnými estrogeny. Patří mezi ně zvýšené riziko rakoviny prsu.
Neočekávané abnormální vaginální krvácení
V případech neočekávaného abnormálního vaginálního krvácení jsou indikována adekvátní diagnostická opatření.

Zvýšený krevní tlak
Krevní tlak by měl být monitorován v pravidelných intervalech při léčbě estrogenem a progestinem.
Hypertriglyceridémie
žen s již existující hypertriglyceridémií může být léčba estrogenem a progestinem spojena se zvýšením plazmatických triglyceridů vedoucím k pankreatitidě. Zvažte přerušení léčby, pokud se objeví pankreatitida.
Poškození jater a/nebo cholestatická žloutenka v minulosti
Estrogeny a progestiny mohou být u žen s poruchou funkce jater špatně metabolizovány. U žen s anamnézou cholestatické žloutenky spojené s užíváním estrogenů v minulosti nebo s těhotenstvím je třeba opatrnosti a v případě recidivy je třeba léčbu přerušit.
Zadržování tekutin
Progestiny mohou způsobit určitý stupeň zadržování tekutin. Ženy, které mají stavy, které mohou být ovlivněny tímto faktorem, jako je poškození srdce nebo ledvin, vyžadují pečlivé sledování, když jsou předepisovány estrogeny a progestin.
Hypokalcémie
Léčba estrogeny a progestinem by měla být používána s opatrností u žen s hypoparatyreózou, protože se může objevit estrogenem indukovaná hypokalcémie.
Exacerbace jiných stavů
Léčba estrogeny a progestinem může způsobit exacerbaci astmatu, diabetes mellitus, epilepsii, migrénu, porfyrii, systémový lupus erythematodes a jaterní hemangiomy a měla by být používána s opatrností u žen s těmito stavy.
Informace pro pacienta
Lékařům se doporučuje diskutovat o INFORMACE PRO PACIENTA leták se ženami, kterým přípravek PROVERA předepisují.
dětí, jejichž matky jsou vystaveny progestinům během prvního trimestru těhotenství, může být zvýšené riziko drobných vrozených vad. Možným rizikem pro dítě mužského pohlaví je hypospadie, stav, kdy je otvor penisu spíše na spodní straně než na špičce penisu. Tento stav se přirozeně vyskytuje u přibližně 5 až 8 z 1000 narozených mužů. Riziko může být zvýšeno expozicí přípravku PROVERA. U miminek se může objevit zvětšení klitorisu a splynutí stydkých pysků. Jasná souvislost mezi hypospadií, zvětšením klitorisu a labiální fúzí s použitím přípravku PROVERA však nebyla stanovena.
Informujte pacientku o důležitosti hlášení expozice přípravku PROVERA 5 mg v časném těhotenství.
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogenita
Bylo prokázáno, že dlouhodobé intramuskulární podávání medroxyprogesteron acetátu vyvolává u psů bígl nádory mléčné žlázy. Nebyly prokázány žádné karcinogenní účinky spojené s perorálním podáváním medroxyprogesteron acetátu potkanům a myším.
Dlouhodobé kontinuální podávání terapie estrogenem a progestinem prokázalo zvýšené riziko rakoviny prsu a rakoviny vaječníků. (Vidět VAROVÁNÍ a OPATŘENÍ .)
Genotoxicita
Medroxyprogesteron acetát nebyl mutagenní v řadě testů genetické toxicity in vitro nebo in vivo.
Plodnost
Medroxyprogesteron acetát ve vysokých dávkách je lékem proti plodnosti a lze očekávat, že vysoké dávky zhoršují plodnost až do ukončení léčby.
Těhotenství
Kategorie těhotenství X
PROVERA by se neměla užívat během těhotenství. (Vidět KONTRAINDIKACE .)
U dětí, jejichž matky byly vystaveny přípravku PROVERA 10 mg během prvního trimestru těhotenství, může být zvýšené riziko hypospadie, zvětšení klitorisu a splynutí labií. Jasná souvislost mezi těmito stavy a užíváním přípravku PROVERA však nebyla stanovena.
Kojící matky
PROVERA by se neměla užívat během kojení. Detekovatelná množství progestinu byla identifikována v mateřském mléce kojících matek užívajících progestiny.
Pediatrické použití
Tablety PROVERA 10 mg nejsou indikovány u dětí. Klinické studie u pediatrické populace nebyly provedeny.
Geriatrické použití
Do klinických studií s použitím samotného přípravku PROVERA nebyl zapojen dostatečný počet geriatrických žen, aby bylo možné určit, zda se ženy ve věku nad 65 let liší od mladších subjektů v odpovědi na samotný přípravek PROVERA.
Studie iniciativy pro zdraví žen
V podstudii WHI estrogen plus progestin (denní CE [0,625 mg] plus MPA [2,5 mg] oproti placebu) bylo vyšší relativní riziko nefatální cévní mozkové příhody a invazivního karcinomu prsu u žen starších 65 let. (Vidět Klinické studie .)
Studie paměti iniciativy Women's Health Initiative
V doplňkových studiích WHIMS u žen po menopauze ve věku 65 až 79 let bylo ve srovnání s placebem zvýšené riziko rozvoje pravděpodobné demence u žen užívajících samotný estrogen nebo estrogen plus progestin. (Vidět VAROVÁNÍ , Pravděpodobná demence .)
Vzhledem k tomu, že obě doplňkové studie byly provedeny u žen ve věku 65 až 79 let, není známo, zda se tato zjištění vztahují na mladší ženy po menopauze. (Vidět VAROVÁNÍ , Pravděpodobná demence .)
PŘEDÁVKOVAT
Předávkování estrogeny a progestinovou terapií může u žen způsobit nevolnost a zvracení, citlivost prsů, závratě, bolesti břicha, ospalost/únavu a krvácení z vysazení. Léčba předávkování spočívá ve vysazení CE plus MPA spolu se zavedením vhodné symptomatické péče.
KONTRAINDIKACE
PROVERA 10 mg je kontraindikována u žen s některým z následujících stavů:
KLINICKÁ FARMAKOLOGIE
Medroxyprogesteron acetát (MPA) podávaný perorálně nebo parenterálně v doporučených dávkách ženám s adekvátním endogenním estrogenem přeměňuje proliferativní na sekreční endometrium. Byly zaznamenány androgenní a anabolické účinky, ale lék zjevně postrádá významnou estrogenní aktivitu. Zatímco parenterálně podávaná MPA inhibuje produkci gonadotropinu, což následně brání dozrávání folikulů a ovulaci, dostupné údaje naznačují, že k tomu nedochází, když se obvykle doporučovaná perorální dávka podává v jedné denní dávce.
Farmakokinetika
Farmakokinetika MPA byla stanovena u 20 žen po menopauze po jednorázovém podání osmi tablet PROVERA 2,5 mg nebo jednorázovém podání dvou tablet PROVERA 10 mg nalačno. V jiné studii byla farmakokinetika MPA v ustáleném stavu stanovena za podmínek nalačno u 30 žen po menopauze po denním podávání jedné tablety PROVERA 10 mg po dobu 7 dnů. V obou studiích byla MPA kvantifikována v séru pomocí validované metody plynové chromatografie-hmotnostní spektrometrie (GC-MS). Odhady farmakokinetických parametrů MPA po jedné a více dávkách tablet PROVERA byly velmi variabilní a jsou shrnuty v tabulce 1.
Vstřebávání
Nebylo provedeno žádné specifické zkoumání absolutní biologické dostupnosti MPA u lidí. MPA se rychle vstřebává z gastrointestinálního traktu a maximální koncentrace MPA se dosáhne za 2 až 4 hodiny po perorálním podání.
Podávání přípravku PROVERA s jídlem zvyšuje biologickou dostupnost MPA. Dávka 10 mg přípravku PROVERA 10 mg, podaná bezprostředně před jídlem nebo po jídle, zvýšila Cmax MPA (50 až 70 %) a AUC (18 až 33 %). Poločas MPA se s jídlem nezměnil.
Rozdělení
MPA se přibližně z 90 % váže na protein, primárně na albumin; s globulinem vázajícím pohlavní hormony nedochází k žádné vazbě MPA.
Metabolismus
Po perorálním podání je MPA rozsáhle metabolizován v játrech prostřednictvím hydroxylace s následnou konjugací a eliminací v moči.
Vylučování
Většina metabolitů MPA je vylučována močí jako glukuronidové konjugáty, pouze malé množství je vylučováno jako sulfáty.
Specifické populace
Jaterní nedostatečnost
MPA je téměř výhradně eliminován jaterním metabolismem. U 14 pacientů s pokročilým onemocněním jater byla dispozice MPA významně změněna (snížená eliminace). U pacientů se ztukovatěním jater bylo průměrné procento dávky vyloučené do 24hodinové moči jako intaktní MPA po dávce 10 mg nebo 100 mg 7,3 % a 6,4 %.
Renální insuficience
Vliv poruchy funkce ledvin na farmakokinetiku přípravku PROVERA 5 mg nebyl studován.
Lékové interakce
Medroxyprogesteron acetát (MPA) je metabolizován in vitro primárně hydroxylací prostřednictvím CYP3A4. Specifické studie lékových interakcí hodnotící klinické účinky induktorů nebo inhibitorů CYP3A4 na MPA nebyly provedeny. Induktory a/nebo inhibitory CYP3A4 mohou ovlivnit metabolismus MPA.
Klinické studie
Účinky na endometrium
Ve 3leté, dvojitě zaslepené, placebem kontrolované studii s 356 nehysterektomizovanými ženami po menopauze ve věku 45 až 64 let randomizovaných k podávání placeba (n=119), 0,625 mg pouze konjugovaného estrogenu (n=119) nebo 0,625 mg konjugovaného estrogenu plus cyklický přípravek PROVERA (n=118), výsledky ukázaly snížené riziko hyperplazie endometria ve skupině léčené 10 mg přípravku PROVERA 5 mg plus 0,625 mg konjugovaných estrogenů ve srovnání se skupinou, která dostávala pouze 0,625 mg konjugovaných estrogenů. Viz tabulka 2.
Ve druhé jednoleté studii bylo 832 postmenopauzálních žen ve věku 45 až 65 let léčeno denní dávkou 0,625 mg konjugovaného estrogenu (1.–28. den), plus buď 5 mg cyklické PROVERY nebo 10 mg cyklické PROVERY (15.–28. den), nebo pouze 0,625 mg konjugovaného estrogenu denně. Léčebné skupiny, které dostávaly 5 nebo 10 mg cyklického přípravku PROVERA (15.–28. den) plus denně konjugované estrogeny, vykazovaly významně nižší míru hyperplazie ve srovnání se skupinou pouze s konjugovanými estrogeny. Viz tabulka 3.
Studie iniciativy pro zdraví žen
WHI zahrnula přibližně 27 000 převážně zdravých postmenopauzálních žen do dvou podstudií, aby zhodnotila rizika a přínosy denní perorální CE (0,625 mg) – samotné nebo v kombinaci s MPA (2,5 mg) ve srovnání s placebem v prevenci některých chronických onemocnění. Primárním cílovým parametrem byl výskyt ischemické choroby srdeční (ICHS) (definované jako nefatální IM, tichý IM a úmrtí na ICHS), přičemž primárním nežádoucím výsledkem byl invazivní karcinom prsu. „Globální index“ zahrnoval nejčasnější výskyt ICHS, invazivní karcinom prsu, mrtvici, PE, karcinom endometria (pouze v podstudii CE plus MPA), kolorektální karcinom, zlomeninu kyčle nebo úmrtí z jiné příčiny. Tyto podstudie nehodnotily účinky samotného CE nebo CE plus MPA na symptomy menopauzy.
Podstudie WHI Estrogen Plus Progestin
Podstudie WHI estrogen plus progestin byla brzy ukončena. Podle předem definovaného pravidla zastavení překročilo po průměrném sledování 5,6 roku léčby zvýšené riziko invazivního karcinomu prsu a kardiovaskulárních příhod stanovené přínosy zahrnuté do „globálního indexu“. Absolutní nadměrné riziko příhod zahrnutých do „globálního indexu“ bylo 19 na 10 000 žen-roků.
U těch výsledků zahrnutých do „globálního indexu“ WHI, které dosáhly statistické významnosti po 5,6 letech sledování, bylo absolutní nadměrné riziko na 10 000 žen-roků ve skupině léčené CE plus MPA 7 více příhod ICHS, 8 více cévních mozkových příhod, 10 více PE a 8 více invazivních karcinomů prsu, zatímco absolutní snížení rizika na 10 000 žen-roků bylo o 6 méně kolorektálních karcinomů a 5 méně zlomenin kyčle.
Výsledky podstudie CE plus MPA, která zahrnovala 16 608 žen (průměrný věk 63 let, rozmezí 50 až 79; 83,9 procenta bělochů, 6,8 procenta černochů, 5,4 procenta hispánců, 3,9 procenta ostatní) jsou uvedeny v tabulce 4. Tyto výsledky odrážejí centrálně posuzovaná data po průměrné době sledování 5,6 let.
Načasování zahájení léčby estrogenem a progestinem vzhledem k začátku menopauzy může ovlivnit celkový profil rizika a přínosu. Podstudie WHI estrogen plus progestin stratifikovaná podle věku ukázala u žen ve věku 50 až 59 let nesignifikantní trend ke snížení rizika celkové mortality [hazard ratio (HR) 0,69 (95% CI, 0,44–1,07)].
Studie paměti iniciativy Women's Health Initiative
Do doplňkové studie WHI obsahující estrogen plus progestin WHI bylo zařazeno 4 532 převážně zdravých žen po menopauze ve věku 65 let a starších (47 procent bylo ve věku 65 až 69 let, 35 procent bylo ve věku 70 až 74 let a 18 procent bylo 75 let věk a starší), aby se vyhodnotily účinky denní CE (0,625 mg) plus MPA (2,5 mg) na výskyt pravděpodobné demence (primární výsledek) ve srovnání s placebem.
Po průměrném sledování 4 roky bylo relativní riziko pravděpodobné demence u CE plus MPA oproti placebu 2,05 (95% CI, 1,21–3,48). Absolutní riziko pravděpodobné demence u CE plus MPA oproti placebu bylo 45 oproti 33 na 10 000 žen-roků. Pravděpodobná demence, jak je definována v této studii, zahrnovala Alzheimerovu chorobu (AD), vaskulární demenci (VaD) a smíšený typ (s rysy AD i VaD). Nejčastější klasifikací pravděpodobné demence v léčené skupině a skupině s placebem byla AD. Vzhledem k tomu, že doplňková studie byla provedena u žen ve věku 65 až 79 let, není známo, zda se tato zjištění vztahují na mladší ženy po menopauze. (Vidět VAROVÁNÍ , Pravděpodobná demence a OPATŘENÍ , Geriatrické použití ).
INFORMACE PRO PACIENTA
PROVERA (pro-VE-rah) (medroxyprogesteron acetát) tablety, USP
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat přípravek PROVERA, a přečtěte si, co dostanete pokaždé, když doplníte svůj předpis na přípravek PROVERA. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku PROVERA (hormon progestin)?
- Nepoužívejte estrogeny s progestiny k prevenci srdečních onemocnění, srdečních záchvatů, mrtvice nebo demence (pokles mozkových funkcí).
- Užívání estrogenů s progestiny může zvýšit vaši šanci na infarkt, mrtvici, rakovinu prsu a krevní sraženiny.
- Užívání estrogenů s progestiny může zvýšit vaši šanci na demenci, na základě studie u žen ve věku 65 let nebo starších.
- Vy a váš poskytovatel zdravotní péče byste měli pravidelně mluvit o tom, zda stále potřebujete léčbu přípravkem PROVERA.
Co je PROVERA 10 mg?
PROVERA je léčivý přípravek, který obsahuje medroxyprogesteron acetát, progestinový hormon.
Na co se přípravek PROVERA 5 mg používá?
PROVERA se používá k:
- Léčba zastavených menstruačních období nebo k léčbě abnormálního děložního krvácení. U žen s dělohou, které nejsou těhotné, které přestanou mít pravidelnou menstruaci nebo které začnou mít nepravidelnou menstruaci, může dojít k poklesu hladiny progesteronu. Promluvte si se svým poskytovatelem zdravotní péče o tom, zda je PROVERA 10 mg pro vás to pravé.
- Snižte své šance na získání rakoviny dělohy (dělohy). U postmenopauzálních žen s dělohou, které užívají estrogeny, sníží užívání progestinů v kombinaci s estrogenem vaši šanci, že onemocníte rakovinou dělohy (dělohy).
Kdo by neměl užívat přípravek PROVERA?
Nezačínejte užívat přípravek PROVERA, pokud:
- mají neobvyklé vaginální krvácení
- v současné době mají nebo jste měli určité druhy rakoviny Estrogen plus progestin mohou zvýšit vaši šanci na získání určitých typů rakoviny, včetně rakoviny prsu. Pokud máte nebo jste měli rakovinu, poraďte se se svým poskytovatelem zdravotní péče o tom, zda byste měli přípravek PROVERA používat.
- měl mrtvici nebo infarkt
- v současné době máte nebo jste měli krevní sraženiny
- v současné době máte nebo jste měl(a) problémy s játry
- jste alergičtí na přípravek PROVERA 10 mg nebo na kteroukoli jeho složku Viz seznam složek přípravku PROVERA na konci této příbalové informace.
- myslíte, že byste mohla být těhotná PROVERA není pro těhotné ženy. Pokud si myslíte, že byste mohla být těhotná, měla byste si udělat těhotenský test a znát výsledky. Pokud je test pozitivní, přípravek PROVERA nepoužívejte a poraďte se se svým poskytovatelem zdravotní péče. U dětí, jejichž matky užívaly přípravek PROVERA během prvních 4 měsíců těhotenství, může být zvýšené riziko drobných vrozených vad. PROVERA by se neměla používat jako těhotenský test.
Co mám sdělit svému poskytovateli zdravotní péče, než začnu užívat přípravek PROVERA 10 mg? Než začnete přípravek PROVERA 5 mg užívat, informujte svého poskytovatele zdravotní péče, pokud:
- mít nějaké jiné zdravotní problémy Váš poskytovatel zdravotní péče vás možná bude muset pečlivěji zkontrolovat, pokud máte určité stavy, jako je astma (sípání), epilepsie (záchvaty), cukrovka, migréna, endometrióza (silná pánevní bolest), lupus nebo problémy se srdcem, játry, štítnou žlázou, ledviny nebo máte vysokou hladinu vápníku v krvi.
- jdou na operaci nebo budou v klidu na lůžku Váš poskytovatel zdravotní péče vás bude informovat, zda musíte přestat užívat přípravek PROVERA.
- kojím Hormon v přípravku PROVERA může přecházet do vašeho mateřského mléka.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Některé léky mohou ovlivnit účinek přípravku PROVERA. PROVERA může také ovlivnit účinek jiných léků.
Jak mám užívat PROVERA 10 mg?
Začněte na nejnižší dávce a poraďte se se svým poskytovatelem zdravotní péče o tom, jak dobře pro vás tato dávka funguje. Nejnižší účinná dávka přípravku PROVERA nebyla stanovena. Vy a váš poskytovatel zdravotní péče byste měli pravidelně (každé 3 až 6 měsíců) mluvit o dávce, kterou užíváte, a o tom, zda stále potřebujete léčbu přípravkem PROVERA.
Jaké jsou možné vedlejší účinky přípravku PROVERA?
Při užívání samotného přípravku PROVERA 10 mg byly hlášeny následující nežádoucí účinky:
- citlivost prsou
- sekrece mateřského mléka
- průlomové krvácení
- špinění (menší vaginální krvácení)
- nepravidelné menstruace
- amenorea (nepřítomnost menstruace)
- vaginální sekrety
- bolesti hlavy
- nervozita
- závrať
- Deprese
- nespavost, ospalost, únava
- příznaky podobné premenstruačnímu syndromu
- tromboflebitida (zánět žil)
- krevní sraženina
- svědění, kopřivka, kožní vyrážka
- akné
- vypadávání vlasů, růst vlasů
- obtíže v oblasti břicha
- nevolnost
- nadýmání
- horečka
- zvýšení hmotnosti
- otok
- změny vidění a citlivost na kontaktní čočky
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u Vás objeví kopřivka, problémy s dýcháním, otok obličeje, úst, jazyka nebo krku
Při užívání přípravku PROVERA 5 mg s estrogenem byly hlášeny následující nežádoucí účinky.
Nežádoucí účinky jsou seskupeny podle toho, jak závažné jsou a jak často se vyskytují, když jste léčeni.
Mezi závažné, ale méně časté nežádoucí účinky patří:
- infarkt
- mrtvice
- krevní sraženiny
- demence
- rakovina prsu
- rakovina dělohy
- rakovina vaječníku
- vysoký krevní tlak
- vysoká hladina cukru v krvi
- onemocnění žlučníku
- problémy s játry
- změny hladin hormonů štítné žlázy
- zvětšení benigních nádorů („myomy“)
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u vás objeví některý z následujících varovných příznaků nebo jiné neobvyklé příznaky, které se vás týkají:
- nové bulky v prsou
- neobvyklé vaginální krvácení
- změny vidění a řeči
- náhlé nové silné bolesti hlavy
- silné bolesti na hrudi nebo nohou s nebo bez dušnosti, slabosti a únavy
- ztráta paměti nebo zmatenost
Méně závažné, ale časté nežádoucí účinky zahrnují:
- bolest hlavy
- bolest prsou
- nepravidelné vaginální krvácení nebo špinění
- žaludeční nebo břišní křeče, nadýmání
- nevolnost a zvracení
- ztráta vlasů
- zadržování tekutin
- vaginální kvasinková infekce
Toto nejsou všechny možné vedlejší účinky přípravku PROVERA s estrogenem nebo bez estrogenu. Pro více informací požádejte svého poskytovatele zdravotní péče nebo lékárníka o radu ohledně nežádoucích účinků. Informujte svého poskytovatele zdravotní péče, pokud máte nežádoucí účinek, který vás obtěžuje nebo nezmizí. Nežádoucí účinky můžete hlásit společnosti Pfizer na čísle 1-800-438-1985 nebo FDA na čísle 1-800-FDA-1088.
Co mohu udělat pro snížení pravděpodobnosti závažných nežádoucích účinků přípravku PROVERA 10 mg?
- Pravidelně se poraďte se svým poskytovatelem zdravotní péče o tom, zda máte pokračovat v užívání přípravku PROVERA. Přidání progestinu se obecně doporučuje ženám s dělohou, aby se snížilo riziko vzniku rakoviny dělohy (dělohy).
- Okamžitě navštivte svého poskytovatele zdravotní péče, pokud během užívání přípravku PROVERA dostanete vaginální krvácení.
- Nechejte si každý rok udělat vyšetření pánve, prsu a mamograf (rentgen prsu), pokud vám váš poskytovatel zdravotní péče neřekne něco jiného. Pokud členové vaší rodiny měli rakovinu prsu nebo pokud jste někdy měla bulky v prsu nebo abnormální mamograf, možná budete muset podstupovat vyšetření prsu častěji.
- Pokud máte vysoký krevní tlak, vysoký cholesterol (tuk v krvi), cukrovku, máte nadváhu nebo užíváte tabák, můžete mít vyšší pravděpodobnost onemocnění srdce. Požádejte svého poskytovatele zdravotní péče o způsoby, jak snížit pravděpodobnost onemocnění srdce.
Obecné informace o bezpečném a efektivním používání přípravku PROVERA
- Léky jsou někdy předepisovány na stavy, které nejsou uvedeny v příbalových informacích pro pacienty.
- Neužívejte přípravek PROVERA na stavy, pro které nebyl předepsán.
- Nedávejte PROVERU jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Uchovávejte PROVERA 10 mg mimo dosah dětí.
Tato příbalová informace obsahuje souhrn nejdůležitějších informací o přípravku PROVERA. Pokud byste chtěli další informace, promluvte si se svým poskytovatelem zdravotní péče nebo lékárníkem. Můžete požádat o informace o přípravku PROVERA 10 mg, který je určen pro zdravotníky. Další informace získáte na bezplatném čísle 1-800-438-1985.
Jaké jsou složky přípravku PROVERA?
Jedna tableta PROVERA 5 mg pro perorální podání obsahuje 2,5 mg, 5 mg nebo 10 mg medroxyprogesteron acetátu.
Neaktivní složky: stearát vápenatý, kukuřičný škrob, laktóza, minerální olej, kyselina sorbová, sacharóza, mastek. 2,5 mg tableta obsahuje FD&C Yellow č. 6.
Štítek tohoto produktu mohl být aktualizován. Aktuální úplné informace o předepisování naleznete na www.pfizer.com
