Ponstel 250mg, 500mg Mefenamic Acid Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
PONSTEL® (kyselina mefenamová) tobolky, USP 250 mg
Kardiovaskulární riziko
- NSAID mohou způsobit zvýšené riziko závažných kardiovaskulárních trombotických příhod, infarktu myokardu a mrtvice, které mohou být fatální. Toto riziko se může zvyšovat s délkou užívání. Pacienti s kardiovaskulárním onemocněním nebo rizikovými faktory pro kardiovaskulární onemocnění mohou být více ohroženi (viz VAROVÁNÍ ).
- PONSTEL® (kyselina mefenamová) je kontraindikován k léčbě perioperační bolesti při operaci bypassu koronární artérie (CABG) (viz VAROVÁNÍ ).
Gastrointestinální riziko
- NSAID způsobují zvýšené riziko závažných gastrointestinálních nežádoucích účinků včetně krvácení, ulcerace a perforace žaludku nebo střev, které mohou být fatální. Tyto události se mohou objevit kdykoli během používání a bez varovných příznaků. Starší pacienti jsou vystaveni většímu riziku závažných gastrointestinálních příhod (viz VAROVÁNÍ ).
POPIS
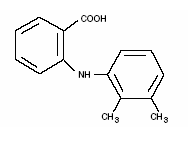
Ponstel® (kyselina mefenamová) je členem fenamátové skupiny nesteroidních protizánětlivých léků (NSAID). Každá tobolka s modrým pruhem slonové kosti obsahuje 250 mg kyseliny mefenamové pro perorální podání. Kyselina mefenamová je bílý až šedobílý mikrokrystalický prášek bez zápachu s bodem tání 230°-231°C a rozpustností ve vodě 0,004 % při pH 7,1. Chemický název je kyselina N-2,3-xylylanthranilová. Molekulová hmotnost je 241,29. Její molekulový vzorec je C15H15NO2 a strukturní vzorec kyseliny mefenamové je:
Každá kapsle obsahuje také laktózu, NF. Plášť a/nebo pásek kapsle obsahuje kyselinu citrónovou, USP; D&C žlutá č. 10; FD&C modrá č. 1; FD&C červená č. 3; FD&C žlutá č. 6; želatina, NF; glycerol monooleát; oxid křemičitý, NF; benzoát sodný, NF; laurylsulfát sodný, NF; oxid titaničitý, USP.
INDIKACE
Než se rozhodnete použít PONSTEL (kyselina mefenamová), pečlivě zvažte potenciální přínosy a rizika přípravku PONSTEL (kyselina mefenamová) a dalších možností léčby. Používejte nejnižší účinnou dávku po co nejkratší dobu v souladu s individuálními cíli léčby pacienta (viz VAROVÁNÍ ).
PONSTEL (kyselina mefenamová) je indikován:
- K úlevě od mírné až středně silné bolesti u pacientů ve věku 14 let, kdy léčba nepřesáhne jeden týden (7 dní).
- K léčbě primární dysmenorey.
DÁVKOVÁNÍ A PODÁVÁNÍ
Než se rozhodnete použít PONSTEL (kyselina mefenamová), pečlivě zvažte potenciální přínosy a rizika přípravku PONSTEL (kyselina mefenamová) a dalších možností léčby. Používejte nejnižší účinnou dávku po co nejkratší dobu v souladu s individuálními cíli léčby pacienta (viz VAROVÁNÍ ).
Po pozorování odpovědi na počáteční léčbu PONSTELem (kyselina mefenamová) by měla být dávka a frekvence upravena tak, aby vyhovovala individuálním potřebám pacienta.
Pro úlevu od akutní bolesti u dospělých a dospívajících ve věku 14 let je doporučená dávka 500 mg jako úvodní dávka a následně 250 mg každých 6 hodin podle potřeby, obvykle nepřesahující jeden týden.4
Pro léčbu primární dysmenorey je doporučená dávka 500 mg jako počáteční dávka následovaná 250 mg každých 6 hodin, podávaná perorálně, počínaje nástupem krvácení a souvisejícími příznaky. Klinické studie ukazují, že účinná léčba může být zahájena se začátkem menstruace a neměla by být nutná déle než 2 až 3 dny.5
JAK DODÁVÁNO
Ponstel (kyselina mefenamová) je k dispozici jako 250mg tobolky s modrým pruhem slonoviny s potiskem „FHPC 400“ a „PONSTEL® (kyselina mefenamová)“.
VEDLEJŠÍ EFEKTY
U pacientů užívajících Ponstel (kyselina mefenamová) nebo jiná NSAID jsou nejčastěji hlášenými nežádoucími účinky vyskytujícími se přibližně u 1–10 % pacientů:
Gastrointestinální zkušenosti včetně - bolesti břicha, zácpy, průjmu, dyspepsie, plynatosti, hrubého krvácení/perforace, pálení žáhy, nevolnosti, GI vředů (žaludečních/duodenálních), zvracení, abnormální funkce ledvin, anémie, závratě, otoku, zvýšených jaterních enzymů, bolesti hlavy, zvýšená doba krvácení, svědění, vyrážky, tinitus
Další nežádoucí účinky hlášené příležitostně a uvedené zde podle tělesného systému zahrnují:
Tělo jako celek - horečka, infekce, sepse
Kardiovaskulární systém - městnavé srdeční selhání, hypertenze, tachykardie, synkopa
Zažívací ústrojí - sucho v ústech, ezofagitida, žaludeční/peptické vředy, gastritida, gastrointestinální krvácení, glositida, hematemeza, hepatitida, žloutenka
Hemický a lymfatický systém - ekchymóza, eozinofilie, leukopenie, melena, purpura, rektální krvácení, stomatitida, trombocytopenie
Metabolické a nutriční - změny hmotnosti
Nervový systém úzkost, astenie, zmatenost, deprese, abnormální sny, ospalost; nespavost, malátnost, nervozita, parestézie, ospalost, třes, vertigo
Dýchací systém - astma, dušnost
Kůže a přílohy - alopecie, fotosenzitivita, pruritus, pot
Zvláštní smysly - rozmazané vidění
Urogenitální systém - cystitida, dysurie, hematurie, intersticiální nefritida, oligurie/polyurie, proteinurie, selhání ledvin
Další nežádoucí účinky, které se vyskytují vzácně, jsou:
Tělo jako celek - anafylaktoidní reakce, změny chuti k jídlu, smrt
Kardiovaskulární systém - arytmie, hypotenze, infarkt myokardu, palpitace, vaskulitida
Zažívací ústrojí - říhání, selhání jater, pankreatitida
Hemický a lymfatický systém - agranulocytóza, hemolytická anémie, aplastická anémie, lymfadenopatie, pancytopenie
Metabolické a nutriční - hyperglykémie
Nervový systém - křeče, kóma, halucinace, meningitida.
Respirační respirační deprese, zápal plic
Kůže a přílohy - angioedém, toxická epidermální nekróza, erythema multiforme, exfoliativní dermatitida, Stevens-Johnsonův syndrom, kopřivka
Zvláštní smysly - zánět spojivek, porucha sluchu
DROGOVÉ INTERAKCE
Řada sloučenin je inhibitory CYP2C9. Studie lékových interakcí kyseliny mefenamové a těchto sloučenin nebyly provedeny. Je třeba vzít v úvahu možnost změny bezpečnosti a účinnosti, pokud se Ponstel (kyselina mefenamová) používá současně s těmito léky.
ACE-inhibitory
Zprávy naznačují, že NSAID mohou snižovat antihypertenzní účinek inhibitorů ACE. Tuto interakci je třeba vzít v úvahu u pacientů užívajících NSAID současně s ACE inhibitory.
Aspirin
Když je PONSTEL (kyselina mefenamová) podáván s aspirinem, jeho vazba na proteiny je snížena, i když clearance volného PONSTELu (kyselina mefenamová) není změněna. Klinický význam této interakce není znám; nicméně, stejně jako u jiných NSAID, se současné podávání KYSELINY MEFENAMOVÉ a aspirinu obecně nedoporučuje z důvodu možného zvýšení nežádoucích účinků.
Diuretika
Klinické studie, stejně jako postmarketingová pozorování, ukázaly, že PONSTEL (kyselina mefenamová) může u některých pacientů snížit natriuretický účinek furosemidu a thiazidů. Tato odpověď byla přičítána inhibici syntézy renálních prostaglandinů. Během souběžné léčby nesteroidními antirevmatiky by měl být pacient pečlivě sledován s ohledem na známky selhání ledvin (viz BEZPEČNOSTNÍ OPATŘENÍ, Účinky na ledviny ), jakož i k zajištění diuretické účinnosti.
Lithium
NSAID vyvolaly zvýšení plazmatických hladin lithia a snížení renální clearance lithia. Průměrná minimální koncentrace lithia se zvýšila o 15 % a renální clearance se snížila přibližně o 20 %. Tyto účinky byly připisovány inhibici syntézy renálních prostaglandinů NSAID. Při současném podávání NSAID a lithia by tedy subjekty měly být pečlivě sledovány z hlediska známek toxicity lithia.
methotrexát
Bylo popsáno, že NSAID kompetitivně inhibují akumulaci methotrexátu v řezech králičích ledvin. To může naznačovat, že by mohly zvýšit toxicitu methotrexátu. Při současném podávání NSAID s methotrexátem je třeba opatrnosti.
Warfarin
Účinky warfarinu a NSAID na gastrointestinální krvácení jsou synergické, takže uživatelé obou drog společně mají riziko vážného gastrointestinálního krvácení vyšší než uživatelé obou drog samostatně.
Antacida
Ve studii s jednorázovou dávkou (n=6) požití antacida obsahujícího 1,7 gramu hydroxidu hořečnatého s 500 mg kyseliny mefenamové zvýšilo Cmax kyseliny mefenamové o 125 % a AUC o 36 %.1
Interakce drog/laboratorních testů
Ponstel (kyselina mefenamová) může prodloužit protrombinový čas.4 Proto je při podávání léku pacientům užívajícím perorální antikoagulancia nutné časté monitorování protrombinového času.
Po podání kyseliny mefenamové může při použití diazotabletového testu dojít k falešně pozitivní reakci na močovou žluč. Při podezření na biliurii je třeba provést další diagnostické postupy, jako je Harrisonův spotový test.
REFERENCE
4. Glazko AJ: Experimentální pozorování kyseliny flufenamové, mefenamové a meklofenamové. Část III. Metabolická dispozice, ve Fenamates in Medicine. A Symposium, Londýn, 1966. Annals of Physical Medicine, Supplement, str. 23-36, 1967.
VAROVÁNÍ
Kardiovaskulární účinky
Kardiovaskulární trombotické příhody
Klinické studie několika COX-2 selektivních a neselektivních NSAID trvající až tři roky prokázaly zvýšené riziko závažných kardiovaskulárních (KV) trombotických příhod, infarktu myokardu a cévní mozkové příhody, které mohou být fatální. Všechna NSAID, selektivní i neselektivní COX-2, mohou mít podobné riziko. Vyšší riziko mohou mít pacienti se známým KV onemocněním nebo rizikovými faktory KV onemocnění. Aby se minimalizovalo potenciální riziko nežádoucích KV příhod u pacientů léčených NSAID, měla by se používat nejnižší účinná dávka po co nejkratší možnou dobu. Lékaři a pacienti by měli zůstat ostražití pro rozvoj takových příhod, a to i v případě absence předchozích KV symptomů. Pacienti by měli být informováni o známkách a/nebo příznacích závažných KV příhod a o krocích, které je třeba učinit, pokud k nim dojde.
Neexistují žádné konzistentní důkazy, že současné užívání aspirinu zmírňuje zvýšené riziko závažných kardiovaskulárních trombotických příhod spojených s užíváním NSAID. Současné užívání aspirinu a NSAID zvyšuje riziko závažných GI příhod (viz GI VAROVÁNÍ ).
Dvě velké, kontrolované klinické studie COX-2 selektivního NSAID pro léčbu bolesti v prvních 10-14 dnech po operaci CABG zjistily zvýšený výskyt infarktu myokardu a cévní mozkové příhody (viz KONTRAINDIKACE ).
Hypertenze
NSAID, včetně PONSTEL (kyselina mefenamová), mohou vést k nástupu nové hypertenze nebo ke zhoršení již existující hypertenze, přičemž obojí může přispívat ke zvýšené incidenci KV příhod. Pacienti užívající thiazidy nebo kličková diuretika mohou mít při užívání NSAID zhoršenou odpověď na tyto terapie. NSAID, včetně PONSTEL (kyselina mefenamová), by se měla používat s opatrností u pacientů s hypertenzí. Krevní tlak (TK) by měl být pečlivě sledován během zahájení léčby NSAID a v průběhu léčby.
Městnavé srdeční selhání a edém
U některých pacientů užívajících NSAID byla pozorována retence tekutin a edém. PONSTEL (kyselina mefenamová) by měl být používán s opatrností u pacientů s retencí tekutin nebo srdečním selháním.
Gastrointestinální účinky – riziko ulcerace, krvácení a perforace
NSAID, včetně PONSTELu (kyselina mefenamová), mohou způsobit závažné gastrointestinální (GI) nežádoucí příhody včetně zánětu, krvácení, ulcerace a perforace žaludku, tenkého střeva nebo tlustého střeva, které mohou být fatální. Tyto závažné nežádoucí účinky se mohou u pacientů léčených NSAID objevit kdykoli, s varovnými příznaky nebo bez nich. Pouze jeden z pěti pacientů, u kterých se vyvine závažný nežádoucí účinek v horní části GI při léčbě NSAID, je symptomatický. Vředy v horní části gastrointestinálního traktu, velké krvácení nebo perforace způsobené NSAID se vyskytují přibližně u 1 % pacientů léčených po dobu 3-6 měsíců au přibližně 2-4 % pacientů léčených po dobu jednoho roku. Tyto trendy pokračují s delším trváním užívání, čímž se zvyšuje pravděpodobnost rozvoje závažné GI příhody někdy v průběhu terapie. Ani krátkodobá terapie však není bez rizika.
NSAID by měla být předepisována s extrémní opatrností u pacientů s předchozí anamnézou vředové choroby nebo gastrointestinálního krvácení. Pacienti s anamnézou peptického vředu a/nebo gastrointestinálního krvácení, kteří užívají NSAID, mají více než 10násobně zvýšené riziko rozvoje GI krvácení ve srovnání s pacienty bez žádného z těchto rizikových faktorů. Mezi další faktory, které zvyšují riziko GI krvácení u pacientů léčených NSAID, patří současné užívání perorálních kortikosteroidů nebo antikoagulancií, delší trvání léčby NSAID, kouření, konzumace alkoholu, vyšší věk a špatný celkový zdravotní stav. Většina spontánních hlášení fatálních GI příhod je u starších nebo oslabených pacientů, a proto je třeba věnovat zvláštní péči léčbě této populace.
Aby se minimalizovalo potenciální riziko nežádoucích GI příhod u pacientů léčených NSAID, měla by se používat nejnižší účinná dávka po co nejkratší možnou dobu. Pacienti a lékaři by měli během léčby nesteroidními antirevmatiky sledovat známky a příznaky gastrointestinální ulcerace a krvácení a v případě podezření na závažný gastrointestinální nežádoucí účinek okamžitě zahájit další vyšetření a léčbu. To by mělo zahrnovat přerušení podávání NSAID, dokud není vyloučena závažná GI nežádoucí příhoda. U vysoce rizikových pacientů je třeba zvážit alternativní terapie, které nezahrnují NSAID.
Renální účinky
Dlouhodobé podávání NSAID vedlo k renální papilární nekróze a jinému poškození ledvin. Renální toxicita byla také pozorována u pacientů, u kterých mají renální prostaglandiny kompenzační roli při udržování renální perfuze. U těchto pacientů může podávání nesteroidního antiflogistika způsobit na dávce závislé snížení tvorby prostaglandinů a sekundárně i renálního prokrvení, což může urychlit zjevnou renální dekompenzaci. Pacienti s největším rizikem této reakce jsou pacienti s poruchou funkce ledvin, srdečním selháním, jaterní dysfunkcí, pacienti užívající diuretika a ACE inhibitory a starší lidé. Po přerušení léčby NSAID obvykle následuje návrat do stavu před léčbou.
Pokročilé onemocnění ledvin
Nejsou dostupné žádné informace pro kontrolované studie týkající se použití PONSTEL (kyselina mefenamová) u pacientů s pokročilým onemocněním ledvin. Léčba přípravkem PONSTEL (kyselina mefenamová) se proto u těchto pacientů s pokročilým onemocněním ledvin nedoporučuje (viz KONTRAINDIKACE ).
Anafylaktoidní reakce
Stejně jako u jiných NSAID se mohou anafylaktoidní reakce objevit u pacientů bez známé předchozí expozice PONSTELu (kyselina mefenamová). PONSTEL (kyselina mefenamová) by se neměl podávat pacientům s aspirinovou triádou. Tento komplex příznaků se typicky vyskytuje u astmatických pacientů, kteří trpí rýmou s nosními polypy nebo bez nich, nebo kteří vykazují těžký, potenciálně fatální bronchospasmus po užití aspirinu nebo jiných NSAID (viz KONTRAINDIKACE a BEZPEČNOSTNÍ OPATŘENÍ - Preexistující astma ). V případech, kdy dojde k anafylaktoidní reakci, je třeba vyhledat pohotovostní pomoc.
Kožní reakce
NSAID, včetně PONSTEL (kyselina mefenamová), mohou způsobit závažné kožní nežádoucí účinky, jako je exfoliativní dermatitida, Stevens-Johnsonův syndrom (SJS) a toxická epidermální nekrolýza (TEN), které mohou být fatální. Tyto závažné události mohou nastat bez varování. Pacienti by měli být informováni o známkách a příznacích závažných kožních projevů a užívání léku by mělo být přerušeno při prvním výskytu kožní vyrážky nebo jakýchkoli jiných příznaků hypersenzitivity.
Těhotenství
V pozdním těhotenství, stejně jako u jiných NSAID, je třeba se vyhnout PONSTELu (kyselina mefenamová), protože může způsobit předčasné uzavření ductus arteriosus.
OPATŘENÍ
Všeobecné
Nelze očekávat, že PONSTEL (kyselina mefenamová) nahrazuje kortikosteroidy nebo léčí nedostatečnost kortikosteroidů. Náhlé vysazení kortikosteroidů může vést k exacerbaci onemocnění. U pacientů na prodloužené léčbě kortikosteroidy by měla být léčba pomalu snižována, pokud se rozhodne kortikosteroidy vysadit.
Farmakologická aktivita PONSTELu (kyselina mefenamová) při snižování horečky a zánětu může snížit užitečnost těchto diagnostických příznaků při detekci komplikací předpokládaných neinfekčních bolestivých stavů.
Účinky na játra
Hraniční zvýšení jednoho nebo více jaterních testů se může objevit až u 15 % pacientů užívajících NSAID, včetně PONSTELu (kyselina mefenamová). Tyto laboratorní abnormality mohou progredovat, mohou zůstat nezměněny nebo mohou být přechodné při pokračující léčbě. V klinických studiích s NSAID bylo u přibližně 1 % pacientů hlášeno výrazné zvýšení ALT nebo AST (přibližně trojnásobek nebo vícenásobek horní hranice normy). Kromě toho byly hlášeny vzácné případy závažných jaterních reakcí, včetně žloutenky a fatální fulminantní hepatitidy, jaterní nekrózy a jaterního selhání, z nichž některé měly fatální následky.
Pacient se symptomy a/nebo známkami naznačujícími jaterní dysfunkci nebo u kterého došlo k abnormálnímu jaternímu testu, by měl být vyšetřen na známky rozvoje závažnější jaterní reakce během léčby přípravkem PONSTEL (kyselina mefenamová). Pokud se vyvinou klinické známky a příznaky odpovídající onemocnění jater nebo pokud se objeví systémové projevy (např. eozinofilie, vyrážka atd.), PONSTEL (kyselina mefenamová) by měl být přerušen.
Hematologické účinky
pacientů užívajících NSAID, včetně PONSTELu (kyselina mefenamová), je někdy pozorována anémie. To může být způsobeno zadržováním tekutin, ztrátou krve v GI nebo neúplně popsaným účinkem na erytropoézu. U pacientů dlouhodobě léčených NSAID, včetně PONSTEL (kyselina mefenamová), by měl být zkontrolován hemoglobin nebo hematokrit, pokud vykazují jakékoli známky nebo příznaky anémie. NSAID inhibují agregaci krevních destiček a bylo prokázáno, že u některých pacientů prodlužují dobu krvácení. Na rozdíl od aspirinu je jejich účinek na funkci krevních destiček kvantitativně menší, kratšího trvání a reverzibilní. Pacienti užívající PONSTEL (kyselina mefenamová), kteří mohou být nepříznivě ovlivněni změnami funkce krevních destiček, jako jsou pacienti s poruchami koagulace nebo pacienti užívající antikoagulancia, by měli být pečlivě sledováni.
Preexistující astma
Pacienti s astmatem mohou mít astma citlivé na aspirin. Užívání aspirinu u pacientů s astmatem citlivým na aspirin bylo spojeno s těžkým bronchospasmem, který může být smrtelný. Vzhledem k tomu, že u takových pacientů citlivých na aspirin byla hlášena zkřížená reaktivita, včetně bronchospasmu, mezi aspirinem a jinými nesteroidními protizánětlivými léky, PONSTEL (kyselina mefenamová) by neměl být podáván pacientům s touto formou citlivosti na aspirin a měl by být používán s opatrností pacientů s preexistujícím astmatem.
Informace pro pacienty
Pacienti by měli být informováni o následujících informacích před zahájením léčby NSAID a pravidelně v průběhu probíhající léčby. Pacienti by měli být také vyzváni, aby si přečetli NSAID Průvodce léky který doprovází každý vydaný předpis.
Laboratorní testy
Vzhledem k tomu, že závažné ulcerace a krvácení GI traktu se mohou objevit bez varovných příznaků, lékaři by měli sledovat známky nebo příznaky GI krvácení. U pacientů dlouhodobě léčených NSAID by se měl pravidelně kontrolovat CBC a chemický profil. Pokud se vyvinou klinické známky a příznaky odpovídající onemocnění jater nebo ledvin, objeví se systémové projevy (např. eozinofilie, vyrážka atd.) nebo pokud abnormální jaterní testy přetrvávají nebo se zhorší, Ponstel (kyselina mefenamová) by měla být přerušena.
Těhotenství
Teratogenní účinky
Kategorie těhotenství C
Reprodukční studie provedené na potkanech a králících neprokázaly známky vývojových abnormalit. Reprodukční studie na zvířatech však ne vždy předpovídají lidskou reakci. Neexistují žádné adekvátní nebo dobře kontrolované studie u těhotných žen. Postel by měl být používán v těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Neteratogenní účinky
Vzhledem ke známým účinkům nesteroidních protizánětlivých léků na kardiovaskulární systém plodu (uzavření ductus arteriosus) je třeba se vyhnout použití během těhotenství (zejména v pozdním těhotenství).
Práce a dodávka
Ve studiích na potkanech s NSAID, stejně jako s jinými léky, o kterých je známo, že inhibují syntézu prostaglandinů, se objevil zvýšený výskyt dystokie, opožděný porod a snížené přežití mláďat. Účinky Ponstelu (kyseliny mefenamové) na porod a porod u těhotných žen nejsou známy.
Kojící matky
Stopová množství Ponstelu (kyselina mefenamová) mohou být přítomna v mateřském mléce a přenášet se na kojené dítě.7 Vzhledem k potenciálu závažných nežádoucích reakcí u kojených dětí na PONSTEL (kyselina mefenamová) by se mělo rozhodnout, zda přerušit kojení nebo vysadit lék s přihlédnutím k důležitosti léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů mladších 14 let nebyla stanovena.
Geriatrické použití
Klinické studie s Ponstelem (kyselina mefenamová) nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Stejně jako u všech NSAID je třeba opatrnosti při léčbě starších osob (65 let a starších).
Je známo, že tento lék je v podstatě vylučován ledvinami a riziko toxických reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin (viz KLINICKÁ FARMAKOLOGIE a NEŽÁDOUCÍ UDÁLOSTI).
REFERENCE
7. Buchanan RA a kol. Vylučování kyseliny mefenamové mateřským mlékem. Curr Ther Res. 10:592, 1968.
PŘEDÁVKOVAT
Příznaky po akutním předávkování NSAID jsou obvykle omezeny na letargii, ospalost, nevolnost, zvracení a bolest v epigastriu, které jsou obvykle reverzibilní při podpůrné péči. Gastrointestinální hypertenze, akutní selhání ledvin, respirační deprese a kóma se mohou objevit, ale jsou vzácné. Při terapeutickém požití NSAID byly hlášeny anafylaktoidní reakce, které se mohou objevit po předávkování.
Pacienti by měli být léčeni symptomatickou a podpůrnou péčí po předávkování NSAID. Neexistují žádná specifická antidota. U pacientů pozorovaných do 4 hodin po požití se symptomy nebo po velkém předávkování (5 až 10 násobek obvyklé dávky). Forsírovaná diuréza, alkalizace moči, hemodialýza nebo hemoperfuze nemusí být užitečné kvůli vysoké vazbě na proteiny.
KONTRAINDIKACE
PONSTEL (kyselina mefenamová) je kontraindikován u pacientů se známou přecitlivělostí na kyselinu mefenamovou.
PONSTEL (kyselina mefenamová) by se neměl podávat pacientům, kteří po užití aspirinu nebo jiných NSAID prodělali astma, kopřivku nebo reakce alergického typu. U těchto pacientů byly hlášeny závažné, vzácně fatální, anafylaktické reakce na NSAID (viz VAROVÁNÍ - Anafylaktoidní reakce a BEZPEČNOSTNÍ OPATŘENÍ - Preexistující astma ).
PONSTEL (kyselina mefenamová) je kontraindikován k léčbě perioperační bolesti při operaci bypassu koronární artérie (CABG) (viz VAROVÁNÍ ).
Ponstel (kyselina mefenamová) je kontraindikován u pacientů s akutní aktivní ulcerací nebo chronickým zánětem horního nebo dolního gastrointestinálního traktu.
Ponstel (kyselina mefenamová) by se neměl používat u pacientů s již existujícím onemocněním ledvin.
KLINICKÁ FARMAKOLOGIE
Farmakodynamika
Ponstel (kyselina mefenamová) je nesteroidní protizánětlivé léčivo (NSAID), které vykazuje protizánětlivé, analgetické a antipyretické účinky na zvířecích modelech. Mechanismus účinku Ponstel (kyselina mefenamová), stejně jako u jiných NSAID, není zcela objasněn, ale může souviset s inhibicí prostaglandinsyntetázy.
Farmakokinetika
Vstřebávání
Kyselina mefenamová se po perorálním podání rychle vstřebává. Ve dvou studiích s jednorázovou perorální dávkou 500 mg byl průměrný rozsah absorpce 30,5 mcg/h/ml (17 % CV).1,2 Biologická dostupnost tobolky ve vztahu k IV dávce nebo perorálnímu roztoku nebyla studována.
Po jedné 1 gramové perorální dávce byly hlášeny průměrné maximální plazmatické hladiny v rozmezí 10-20 mcg/ml3. Maximálních plazmatických hladin je dosaženo za 2 až 4 hodiny a eliminační poločas je přibližně 2 hodiny. Po opakovaných dávkách jsou plazmatické hladiny úměrné dávce bez známek akumulace léčiva. Ve studii s opakovanými dávkami u normálních dospělých subjektů (n=6), kteří dostávali 1 gramové dávky kyseliny mefenamové čtyřikrát denně, bylo dosaženo koncentrace v rovnovážném stavu 20 mcg/ml druhý den podávání, což odpovídá krátkému poločasu život.
Vliv potravy na rychlost a rozsah absorpce kyseliny mefenamové nebyl studován. Bylo prokázáno, že současné požití antacid obsahujících hydroxid hořečnatý významně zvyšuje rychlost a rozsah absorpce kyseliny mefenamové (viz BEZPEČNOSTNÍ OPATŘENÍ: DROGOVÉ INTERAKCE ).1
Rozdělení
Bylo hlášeno, že kyselina mefenamová se váže na albumin z více než 90 %.9 Vztah nenavázané frakce ke koncentraci léku nebyl studován. Zdánlivý distribuční objem (Vzss/F) odhadovaný po 500mg perorální dávce kyseliny mefenamové byl 1,06 l/kg.2
Na základě svých fyzikálních a chemických vlastností se očekává, že Ponstel (kyselina mefenamová) bude vylučován do lidského mateřského mléka.
Metabolismus
Kyselina mefenamová je metabolizována enzymem CYP2C9 cytochromu P450 na kyselinu 3-hydroxymethylmefenamovou (Metabolit I). Může dojít k další oxidaci na kyselinu 3-karboxymefenamovou (Metabolit II).10 Aktivita těchto metabolitů nebyla studována. Metabolity mohou podléhat glukuronidaci a kyselina mefenamová je také glukuronidována přímo. Maximální plazmatická hladina přibližně 20 mcg/ml byla pozorována za 3 hodiny pro hydroxymetabolit a jeho glukuronid (n=6) po jedné dávce 1 gramu. Podobně maximální plazmatická hladina 8 mcg/ml byla pozorována za 6-8 hodin pro karboxy metabolit a jeho glukuronid.3
Vylučování
Přibližně padesát dva procent dávky kyseliny mefenamové se vylučuje do moči primárně jako glukuronidy kyseliny mefenamové (6 %), kyseliny 3-hydroxymefenamové (25 %) a kyseliny 3-karboxymefenamové (21 %). Fekální cesta eliminace představuje až 20 % dávky, především ve formě nekonjugované kyseliny 3-karboxymefenamové.3
Eliminační poločas kyseliny mefenamové je přibližně dvě hodiny. Poločasy metabolitů I a II nebyly přesně popsány, ale zdá se, že jsou delší než u původní sloučeniny.3 Metabolity se mohou akumulovat u pacientů se selháním ledvin nebo jater. Glukuronid kyseliny mefenamové se může nevratně vázat na plazmatické proteiny. Vzhledem k tomu, že vylučování ledvinami i játry jsou významnými cestami eliminace, může být nutné upravit dávkování u pacientů s dysfunkcí ledvin nebo jater. Ponstel (kyselina mefenamová) by se neměl podávat pacientům s již existujícím onemocněním ledvin nebo pacientům s významně narušenou funkcí ledvin.
TABULKA 1: Odhady farmakokinetických parametrů pro kyselinu mefenamovou
Zvláštní populace
Pediatrická
Ponstel (kyselina mefenamová) nebyl dostatečně zkoumán u pediatrických pacientů mladších 14 let. Studie u 17 předčasně narozených dětí, kterým byla podávána dávka 2 mg/kg, ukázala, že poločas byl asi pětkrát delší než u dospělých, což je v souladu s nízkou aktivitou metabolických enzymů u novorozenců. Průměrná Cmax v této studii byla 4 mcg/ml (rozmezí 2,9-6,1). Průměrná doba do dosažení maximální koncentrace (Tmax) byla 8 hodin (rozmezí 2-18 hodin).11
Závod
Farmakokinetické rozdíly způsobené rasou nebyly zjištěny.
Jaterní nedostatečnost
Farmakokinetika kyseliny mefenamové nebyla u pacientů s jaterní dysfunkcí studována. Vzhledem k tomu, že jaterní metabolismus je významnou cestou eliminace kyseliny mefenamové, mohou pacienti s akutním a chronickým onemocněním jater vyžadovat snížené dávky Ponstelu (kyseliny mefenamové) ve srovnání s pacienty s normální funkcí jater.
Renální insuficience
Farmakokinetika kyseliny mefenamové nebyla zkoumána u subjektů s renální insuficiencí. Vzhledem k tomu, že kyselina mefenamová, její metabolity a konjugáty jsou primárně vylučovány ledvinami, existuje možnost akumulace metabolitů kyseliny mefenamové. Ponstel (kyselina mefenamová) by se neměl podávat pacientům s již existujícím onemocněním ledvin nebo pacientům s významně narušenou funkcí ledvin.
Klinické studie
kontrolovaných, dvojitě zaslepených, klinických studiích byl Ponstel (kyselina mefenamová) hodnocen pro léčbu primární křečovité dysmenorey. Parametry použité při určování účinnosti zahrnovaly hodnocení bolesti jak pacientem, tak zkoušejícím; potřeba souběžné analgetické medikace; a hodnocení změny frekvence a závažnosti symptomů charakteristických pro křečovou dysmenoreu. Pacienti dostávali buď Ponstel (kyselina mefenamová), 500 mg (2 tobolky) jako počáteční dávku 250 mg každých 6 hodin, nebo placebo při nástupu krvácení nebo bolesti, podle toho, co začalo dříve. Po třech menstruačních cyklech byly pacientky převedeny na alternativní léčbu na další tři cykly. Ponstel (kyselina mefenamová) byl ve všech parametrech významně lepší než placebo a obě léčby (lék i placebo) byly stejně tolerovány.
REFERENCE
1. Neuvonen PJ, Kivisto KT: Zvýšení absorpce léčiva antacidy. Nepoznaná léková interakce. Clin Pharmacokinet. 27:120-8, srpen 1994.
2. Tall AR, Mistilits SP: Studie o Ponstanovi (kyselina mefenamová): I. Gastrointestinální ztráta krve; II. Absorpce a vylučování nové formulace. J Int Med Res (Velká Británie). 1975, 3(3) str. 176-82.
3. Winder CV, Kaump DH, Glazko a kol.: Experimentální pozorování kyseliny flufenamové, mefenamové a meklofenamové. AnnPhys Med (Eng), Suppl str. 7-49.1967.
9. Champion GD, Graham GG: Farmakokinetika nesteroidních protizánětlivých látek. Aust NZ J Med. 8 (Supp 1): 94-100, červen 1978.
10. McGurk KA, Remmel RP, Hosagrahara VP, Tosh D, Burchell B: Reaktivita 1-o-acylglukuronidu kyseliny mefenamové s proteiny in vitro a ex vivo. Drug Metab Dispos. Srpen 1996, 24 (8) str. 842-9.
11. Ito K, Niida Y, Sato J et al: Farmakokinetika kyseliny mefenamové u předčasně narozených dětí s otevřeným ductus arteriosus. Acta Paediatr JPN. 36 (4): 387-91, 1994.
INFORMACE PRO PACIENTA
Průvodce léky pro nesteroidní protizánětlivé léky (NSAID)
(Seznam léků na předpis NSAID naleznete na konci této Příručky pro léky.)
Jaké jsou nejdůležitější informace, které bych měl vědět o lécích nazývaných nesteroidní protizánětlivé léky (NSAID)?
Nesteroidní protizánětlivé léky mohou zvýšit riziko srdečního infarktu nebo mrtvice, které mohou vést k úmrtí. Tato šance se zvyšuje:
- při delším užívání léků NSAID
- u lidí, kteří mají srdeční onemocnění
Nesteroidní protizánětlivé léky by se nikdy neměly používat těsně před nebo po operaci srdce nazývané „bypass koronární artérie (CABG).
Léky ze skupiny NSAID mohou kdykoli během léčby způsobit vředy a krvácení do žaludku a střev.
Vředy a krvácení:
- může nastat bez varovných příznaků
- může způsobit smrt
Pravděpodobnost, že osoba dostane vřed nebo krvácení, se zvyšuje s:
- užívání léků nazývaných „kortikosteroidy“ a „antikoagulancia“
- delší používání
- kouření
- pití alkoholu
- vyšší věk
- mít špatné zdraví
NSAID by se měly používat pouze:
- přesně podle předpisu
- v nejnižší možné dávce pro vaši léčbu
- na co nejkratší potřebnou dobu
Co jsou to nesteroidní protizánětlivé léky (NSAID)?
NSAID léky se používají k léčbě bolesti a zarudnutí, otoku a tepla (zánět) ze zdravotních stavů, jako jsou:
- různé typy artritidy
- menstruační křeče a jiné typy krátkodobých bolestí
Kdo by neměl užívat nesteroidní protizánětlivé léky (NSAID)?
Neužívejte léky NSAID:
- jestliže jste měl(a) astmatický záchvat, kopřivku nebo jinou alergickou reakci na aspirin nebo jakýkoli jiný NSAID lék
- pro bolest těsně před nebo po operaci srdečního bypassu
Sdělte svému poskytovateli zdravotní péče:
- o všech svých zdravotních potížích.
- o všech lécích, které užíváte. NSAID a některé další léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky. Uchovávejte si seznam svých léků, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi.
- pokud jste těhotná. Nesteroidní protizánětlivé léky by neměly užívat těhotné ženy v pozdní fázi těhotenství.
- pokud kojíte. Promluvte si se svým lékařem.
Jaké jsou možné vedlejší účinky nesteroidních protizánětlivých léků (NSAID)?
Získejte okamžitou pomoc v případě nouze, pokud máte některý z následujících příznaků:
- dušnost nebo potíže s dýcháním
- bolest na hrudi
- slabost v jedné části nebo straně vašeho těla
- nezřetelná řeč
- otok obličeje nebo hrdla
Zastavte svůj lék NSAID a okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků:
To nejsou všechny nežádoucí účinky léků NSAID. Pro více informací o lécích typu NSAID se poraďte se svým poskytovatelem zdravotní péče nebo lékárníkem.
Další informace o nesteroidních protizánětlivých lécích (NSAID)
- Aspirin je lék NSAID, ale nezvyšuje riziko srdečního infarktu. Aspirin může způsobit krvácení do mozku, žaludku a střev. Aspirin může také způsobit vředy v žaludku a střevech.
- Některé z těchto léků NSAID se prodávají v nižších dávkách bez lékařského předpisu (volně prodejné). Poraďte se se svým poskytovatelem zdravotní péče před používáním volně prodejných NSAID po dobu delší než 10 dní.
NSAID léky, které vyžadují lékařský předpis
Tento průvodce léky byl schválen americkým Úřadem pro kontrolu potravin a léčiv. Datum účinnosti: 19.02.2008
