Prometrium 100mg, 200mg Progesterone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Prometrium 100 mg a jak se používá?
Prometrium 200 mg je lék na předpis používaný k prevenci léčby příznaků hyperplazie endometria a příznaků sekundární amenorey (absence menstruace nebo menstruace). Prometrium lze užívat samostatně nebo s jinými léky.
Prometrium patří do třídy léků nazývaných progestiny.
Není známo, zda je přípravek Prometrium 200 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Prometrium?
Prometrium může způsobit závažné nežádoucí účinky, včetně:
- neobvyklé vaginální krvácení,
- bolest nebo pálení při močení,
- bulka v prsou,
- náhlé problémy se zrakem,
- těžká bolest hlavy,
- bolest za očima,
- Deprese,
- problémy se spánkem,
- slabost,
- změny nálady,
- silné závratě,
- ospalost,
- pocit točení,
- zmatek,
- dušnost,
- bolest nebo tlak na hrudi,
- bolest šířící se do čelisti nebo ramene,
- nevolnost,
- pocení,
- bolest v horní části žaludku,
- svědění,
- únava,
- ztráta chuti k jídlu,
- tmavě zbarvená moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- náhlá necitlivost nebo slabost,
- náhlá silná bolest hlavy,
- nezřetelná řeč ,
- potíže s mluvením nebo s rovnováhou,
- náhlý kašel,
- sípání,
- zrychlené dýchání,
- vykašlávání krve,
- bolest nohy,
- otok v noze a
- teplo nebo zarudnutí v jedné nebo obou nohách
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Prometrium 100 mg patří:
- ospalost,
- závrať,
- bolest prsou,
- změny nálady,
- bolest hlavy,
- zácpa,
- průjem,
- pálení žáhy,
- nadýmání,
- otoky rukou nebo nohou,
- bolest kloubů,
- návaly horka a
- vaginální výtok
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Prometrium. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
KARDIOVASKULÁRNÍ PORUCHY, RAKOVINA PRSU a PRAVDĚPODOBNÁ DEMENCE PRO TERAPII ESTROGEN PLUS PROGESTIN
Kardiovaskulární poruchy a pravděpodobná demence
Léčba estrogeny a progestinem by se neměla používat k prevenci kardiovaskulárních onemocnění nebo demence. (Vidět Klinické studie a VAROVÁNÍ , Kardiovaskulární poruchy a pravděpodobná demence. )
Podstudie Women's Health Initiative (WHI) estrogen plus progestin oznámila zvýšené riziko hluboké žilní trombózy, plicní embolie, mrtvice a infarktu myokardu u postmenopauzálních žen (ve věku 50 až 79 let) během 5,6 let léčby denním perorálním konjugovaným estrogeny (CE) [0,625 mg] v kombinaci s medroxyprogesteronacetátem (MPA) [2,5 mg] ve srovnání s placebem. (Vidět Klinické studie a VAROVÁNÍ , Kardiovaskulární poruchy. )
Doplňková studie WHI Memory Study (WHIMS) estrogen plus progestin WHI oznámila zvýšené riziko rozvoje pravděpodobné demence u postmenopauzálních žen ve věku 65 let nebo starších během 4 let léčby denním CE (0,625 mg) v kombinaci s MPA (2,5 mg ), ve srovnání s placebem. Není známo, zda se toto zjištění týká mladších žen po menopauze. (Vidět Klinické studie a VAROVÁNÍ , Pravděpodobná demence a OPATŘENÍ , Geriatrické použití .)
Rakovina prsu
Podstudie WHI estrogen plus progestin také prokázala zvýšené riziko invazivní rakoviny prsu. (Vidět Klinické studie a VAROVÁNÍ , Zhoubné novotvary, rakovina prsu .)
Při absenci srovnatelných údajů je třeba předpokládat, že tato rizika jsou podobná u jiných dávek CE a MPA a jiných kombinací a dávkových forem estrogenů a progestinů.
Progestiny s estrogeny by měly být předepisovány v nejnižších účinných dávkách a po nejkratší dobu v souladu s cíli a riziky léčby pro jednotlivé ženy.
POPIS
PROMETRIUM (progesteron, USP) Kapsle obsahují mikronizovaný progesteron pro perorální podání. Progesteron má molekulovou hmotnost 314,47 a molekulový vzorec C21H30O2. Progesteron (pregn-4-en-3, 20-dion) je bílý nebo krémově bílý krystalický prášek bez zápachu prakticky nerozpustný ve vodě, rozpustný v alkoholu, acetonu a dioxanu a těžce rozpustný v rostlinných olejích, stabilní na vzduchu, tající mezi 126 °C a 131 °C. Strukturní vzorec je:
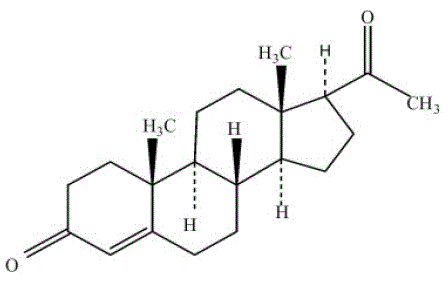
Progesteron je syntetizován z výchozí látky z rostlinného zdroje a je chemicky identický s progesteronem lidského ovariálního původu. Kapsle PROMETRIUM jsou k dispozici v několika silách, aby poskytovaly flexibilitu dávkování pro optimální řízení. PROMETRIUM tobolky obsahují 100 mg nebo 200 mg mikronizovaného progesteronu.
Mezi neaktivní složky PROMETRIUM Capsules 100 mg patří: arašídový olej NF, želatina NF, glycerin USP, lecitin NF, oxid titaničitý USP, FD&C Red No. 40 a D&C Yellow No. 10. Neaktivní složky PROMETRIUM 100 mg Capsules 200 mg : arašídový olej NF, želatina NF, glycerin USP, lecitin NF, oxid titaničitý USP, D&C žlutá č. 10 a FD&C žlutá č. 6.
INDIKACE
PROMETRIUM 200 mg tobolky jsou indikovány k použití v prevenci hyperplazie endometria u postmenopauzálních žen bez hysterektomie, které užívají tablety s konjugovanými estrogeny. Jsou také indikovány pro použití při sekundární amenoree.
DÁVKOVÁNÍ A PODÁVÁNÍ
Prevence hyperplazie endometria
PROMETRIUM 100 mg tobolky by se měly podávat v jedné denní dávce před spaním, 200 mg perorálně po dobu 12 dnů postupně v 28denním cyklu, ženám po menopauze s dělohou, které denně užívají tablety s konjugovanými estrogeny.
Léčba sekundární amenorey
PROMETRIUM 100 mg tobolky lze podávat v jedné denní dávce 400 mg před spaním po dobu 10 dnů.
Některé ženy mohou mít potíže s polykáním tobolek PROMETRIUM. U těchto žen by měly být kapsle PROMETRIUM zapíjeny sklenicí vody ve stoje.
JAK DODÁVÁNO
PROMETRIUM (progesteron, USP) tobolky 100 mg jsou kulaté tobolky broskvové barvy s černým potiskem „SV“.
NDC 0032-1708-01 (láhev po 100)
PROMETRIUM (progesteron, USP) tobolky 200 mg jsou oválné, světle žluté tobolky s černým potiskem „SV2“.
NDC 0032-1711-01 (láhev po 100)
Skladujte při teplotě 25 °C (77 °F); povolené výchylky do 15° až 30°C (59° až 86°F) [Viz USP Controlled Room Temperature].
Chraňte před nadměrnou vlhkostí.
Dávkujte v těsné nádobě odolné vůči světlu, jak je definováno v USP/NF, spolu s příbalovou informací pro pacienta.
Uchovávejte mimo dosah dětí.
Výrobce: Catalent Pharma Solutions, St. Petersburg, FL 33716. Revize: září 2013
VEDLEJŠÍ EFEKTY
Vidět BOX VAROVÁNÍ , VAROVÁNÍ a OPATŘENÍ .
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
V multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické studii byly účinky přípravku PROMETRIUM 100mg Capsules na endometrium studovány u celkem 875 žen po menopauze. Tabulka 6 uvádí nežádoucí účinky větší nebo rovné 2 procentům žen, které dostávaly cyklické kapsle PROMETRIUM 200 mg denně (12 dní v cyklu kalendářního měsíce) s 0,625 mg konjugovaných estrogenů nebo placeba.
TABULKA 6. Nežádoucí účinky (≥ 2 %) hlášené v placebem kontrolované studii s 875 pacientkami u postmenopauzálních žen během 3letého období [procento (%) hlásících pacientek]
Účinky na sekundární amenoreu
V multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické studii byly účinky přípravku PROMETRIUM Capsules na sekundární amenoreu studovány u 49 postmenopauzálních žen, které byly primárně imunizovány estrogenem. Tabulka 7 uvádí nežádoucí účinky větší nebo rovné 5 procentům žen, které dostávaly PROMETRIUM 100 mg tobolky nebo placebo.
TABULKA 7. Nežádoucí účinky (≥ 5 %) hlášené u pacientek užívajících 400 mg/den v placebem kontrolované studii u postmenopauzálních žen s primovaným estrogenem
multicentrické, paralelní skupině, otevřené studii postmarketingového dávkování, sestávající ze tří po sobě jdoucích 28denních léčebných cyklů, bylo 220 premenopauzálních žen se sekundární amenoreou randomizováno k denní léčbě konjugovanými estrogeny (0,625 mg konjugovaných estrogenů) a PROMETRIUM 100 mg tobolky, 300 mg denně (n=113) nebo PROMETRIUM Capsules, 400 mg denně (n=107) po dobu 10 dnů každého léčebného cyklu. Celkově nejčastěji hlášenými nežádoucími účinky souvisejícími s léčbou, hlášenými u více než nebo rovných 5 procent subjektů, byly nauzea, únava, vaginální mykóza, nazofaryngitida, infekce horních cest dýchacích, bolest hlavy, závratě, citlivost prsů, abdominální distenze, akné dysmenorea, změny nálady a infekce močových cest.
Postmarketingové zkušenosti
přípravku PROMETRIUM 200 mg tobolky byly hlášeny následující další nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Genitourinární systém
karcinom endometria, hypospadie, intrauterinní smrt, menoragie, menstruační porucha, metroragie, ovariální cysta, spontánní potrat.
Kardiovaskulární
oběhový kolaps, vrozená srdeční vada (včetně defektu komorového septa a otevřeného ductus arteriosus), hypertenze, hypotenze, tachykardie.
Gastrointestinální
akutní pankreatitida, cholestáza, cholestatická hepatitida, dysfagie, selhání jater, nekróza jater, hepatitida, zvýšené hodnoty jaterních testů (včetně zvýšení alaninaminotransferázy, zvýšení aspartátaminotransferázy, zvýšení gama-glutamyltransferázy), žloutenka, oteklý jazyk.
Kůže
alopecie, pruritus, kopřivka.
Oči
rozmazané vidění, diplopie, poruchy vidění.
Centrální nervový systém
agrese, křeče, depersonalizace, snížené vědomí, dezorientace, dysartrie, ztráta vědomí, parestézie, sedace, strnulost, synkopa (s hypotenzí a bez ní), přechodný ischemický záchvat, sebevražedné myšlenky.
Během počáteční terapie několik žen zažilo konstelaci mnoha nebo všech následujících příznaků: extrémní závratě a/nebo ospalost, rozmazané vidění, nezřetelná řeč, potíže s chůzí, ztráta vědomí, závratě, zmatenost, dezorientace, pocit opilosti a dušnost.
Smíšený
abnormální chůze, anafylaktická reakce, artralgie, zvýšená hladina glukózy v krvi, dušení, rozštěp rtu, rozštěp patra, potíže s chůzí, dušnost, edém obličeje, abnormální pocit, pocit opilosti, přecitlivělost, astma, svalové křeče, svírání hrdla, tinitus, závratě, snížení hmotnosti , hmotnost se zvýšila.
DROGOVÉ INTERAKCE
Interakce mezi drogami a laboratorními testy
Následující laboratorní výsledky mohou být ovlivněny užíváním estrogenu a progestinové terapie:
- Zvýšená retence sulfobromoftaleinu a další testy jaterních funkcí.
- Koagulační testy: zvýšení protrombinových faktorů VII, VIII, IX a X.
- Stanovení pregnandiolu.
- Funkce štítné žlázy: zvýšení PBI a butanolem extrahovatelného proteinu vázaného jódu a snížení T3 hodnoty příjmu.
VAROVÁNÍ
Vidět BOX VAROVÁNÍ .
Kardiovaskulární poruchy
Při léčbě estrogeny a progestinem bylo hlášeno zvýšené riziko plicní embolie, hluboké žilní trombózy (DVT), mrtvice a infarktu myokardu. Pokud se některý z nich objeví nebo je na něj podezření, léčba estrogeny s progestinem by měla být okamžitě přerušena.
Rizikové faktory pro arteriální vaskulární onemocnění (například hypertenze, diabetes mellitus, užívání tabáku, hypercholesterolémie a obezita) a/nebo žilní tromboembolismus (například osobní nebo rodinná anamnéza žilního tromboembolismu [VTE], obezita a systémový lupus erythematodes ) je třeba náležitě spravovat.
Mrtvice
V podstudii Women's Health Initiative (WHI) estrogen plus progestin bylo hlášeno statisticky významné zvýšení rizika cévní mozkové příhody u žen ve věku 50 až 79 let, které dostávaly denně CE (0,625 mg) plus MPA (2,5 mg) ve srovnání se ženami ve stejném věku. skupina dostávající placebo (33 oproti 25 na 10 000 žen-roků). Nárůst rizika byl prokázán po prvním roce a přetrvával. (Vidět Klinické studie .) Pokud dojde k cévní mozkové příhodě nebo existuje podezření na ni, léčba estrogeny a progestinem by měla být okamžitě přerušena.
Ischemická choroba srdeční
podstudii WHI estrogen plus progestin bylo statisticky nevýznamné zvýšené riziko příhod koronárního srdečního onemocnění (CHD) (definovaných jako nefatální infarkt myokardu [IM], tichý infarkt myokardu nebo úmrtí na ICHS) hlášené u žen dostávajících denně CE (0,625 mg) plus MPA (2,5 mg) ve srovnání s ženami užívajícími placebo (41 oproti 34 na 10 000 žen-roků). V roce 1 bylo prokázáno zvýšení relativního rizika a v letech 2 až 5 byl hlášen trend ke snižování relativního rizika. (Viz. Klinické studie .)
postmenopauzálních žen s prokázaným srdečním onemocněním (n = 2 763, průměrný věk 66,7 let) byla v kontrolované klinické studii sekundární prevence kardiovaskulárních onemocnění (Heart and Estrogen/Progestin Replacement Study [HERS]) léčba denním CE (0,625 mg) plus MPA (2,5 mg) neprokázaly žádný kardiovaskulární přínos. Během průměrného sledování 4,1 roku léčba CE plus MPA nesnížila celkovou četnost ICHS u postmenopauzálních žen s prokázanou ischemickou chorobou srdeční. Ve skupině léčené CE plus MPA bylo více ICHS než ve skupině s placebem v roce 1, ale ne během následujících let. Dva tisíce tři sta dvacet jedna (2 321) žen z původní studie HERS souhlasilo s účastí na otevřeném rozšíření HERS, HERS II. Průměrná doba sledování u HERS II byla dalších 2,7 roku, celkem tedy 6,8 roku. Četnost ICHS byla srovnatelná u žen ve skupině CE plus MPA a ve skupině s placebem v HERS, HERS II a celkově.
Žilní tromboembolismus
V podstudii WHI estrogen plus progestin byl hlášen statisticky významný 2krát vyšší výskyt VTE (DVT a plicní embolie [PE]) u žen užívajících denně CE (0,625 mg) plus MPA (2,5 mg) ve srovnání s ženami užívajícími placebo ( 35 oproti 17 na 10 000 žen-roků). Bylo také prokázáno statisticky významné zvýšení rizika jak HŽT (26 versus 13 na 10 000 žen-roků), tak PE (18 versus 8 na 10 000 žen-roků). Zvýšení rizika VTE bylo prokázáno během prvního roku a přetrvávalo. (Vidět Klinické studie .) Pokud se VTE objeví nebo je podezření na VTE, léčba estrogeny a progestinem by měla být okamžitě přerušena.
Pokud je to možné, estrogeny s progestinem by měly být vysazeny alespoň 4 až 6 týdnů před operací typu spojeného se zvýšeným rizikem tromboembolie nebo během období delší imobilizace.
Maligní novotvary
Rakovina prsu
Nejdůležitější randomizovaná klinická studie poskytující informace o rakovině prsu u uživatelek estrogenu a progestinů je podstudie Women's Health Initiative (WHI) s denní CE (0,625 mg) plus MPA (2,5 mg). Po průměrné době sledování 5,6 roku uváděla podstudie estrogen plus progestin zvýšené riziko invazivního karcinomu prsu u žen, které denně užívaly CE plus MPA. V této podstudii uvádělo předchozí použití léčby samotným estrogenem nebo estrogenem plus progestinem 26 procent žen. Relativní riziko invazivního karcinomu prsu bylo 1,24 (95 procent nCI, 1,01-1,54) a absolutní riziko bylo 41 oproti 33 případům na 10 000 žen-roků pro CE plus MPA ve srovnání s placebem. Mezi ženami, které uváděly předchozí užívání hormonální terapie, bylo relativní riziko invazivního karcinomu prsu 1,86 a absolutní riziko bylo 46 oproti 25 případům na 10 000 žen-roků pro estrogen plus progestin ve srovnání s placebem. Mezi ženami, které dříve neužívaly hormonální terapii, bylo relativní riziko invazivního karcinomu prsu 1,09 a absolutní riziko CE plus MPA bylo 40 oproti 36 případům na 10 000 žen-roků ve srovnání s placebem. Ve stejné podstudii byly invazivní karcinomy prsu větší, měly vyšší pravděpodobnost pozitivních uzlin a byly diagnostikovány v pokročilejším stádiu ve skupině CE (0,625 mg) plus MPA (2,5 mg) ve srovnání se skupinou s placebem. Metastatické onemocnění bylo vzácné, bez zjevného rozdílu mezi těmito dvěma skupinami. Jiné prognostické faktory, jako je histologický podtyp, stupeň a stav hormonálního receptoru, se mezi skupinami nelišily. (Vidět Klinické studie .)
souladu s klinickými studiemi WHI pozorovací studie také uváděly zvýšené riziko rakoviny prsu při léčbě estrogenem a progestinem a menší zvýšené riziko při léčbě samotným estrogenem po několika letech užívání. Riziko se zvyšovalo s délkou užívání a zdálo se, že se vrací na výchozí hodnoty během přibližně 5 let po ukončení léčby (podstatné údaje o riziku po ukončení léčby mají pouze observační studie). Observační studie také naznačují, že riziko rakoviny prsu bylo vyšší a ukázalo se dříve při léčbě estrogenem a progestinem ve srovnání s terapií samotným estrogenem. Tyto studie však obecně nezjistily významné rozdíly v riziku rakoviny prsu mezi různými kombinacemi, dávkami nebo cestami podávání estrogenu a progestinů.
Bylo hlášeno, že použití estrogenu a progestinů vede ke zvýšení abnormálních mamografií vyžadujících další hodnocení. Všechny ženy by měly podstupovat každoroční vyšetření prsů poskytovatelem zdravotní péče a provádět měsíční samovyšetření prsů. Kromě toho by mamografické vyšetření mělo být naplánováno na základě věku pacientky, rizikových faktorů a předchozích výsledků mamografie.
Endometriální rakovina
žen s dělohou bylo hlášeno zvýšené riziko rakoviny endometria při použití neoponované estrogenové terapie. Hlášené riziko rakoviny endometria mezi uživatelkami estrogenu bez odporu je asi 2 až 12krát vyšší než u žen, které neužívají, a zdá se závislé na délce léčby a na dávce estrogenu. Většina studií neprokazuje žádné významné zvýšené riziko spojené s užíváním estrogenů po dobu kratší než 1 rok. Největší riziko se zdá být spojeno s prodlouženým užíváním, se zvýšeným rizikem 15 až 24krát po dobu 5 až 10 let nebo déle a bylo prokázáno, že toto riziko přetrvává po dobu nejméně 8 až 15 let po ukončení léčby estrogeny.
Důležitý je klinický dohled nad všemi ženami užívajícími estrogen plus progestinovou terapii. Adekvátní diagnostická opatření, včetně řízeného nebo náhodného odběru endometria, pokud je to indikováno, by měla být provedena k vyloučení malignity ve všech případech nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního genitálního krvácení. Neexistují žádné důkazy o tom, že by použití přirozených estrogenů mělo za následek odlišný profil endometriálního rizika než syntetické estrogeny s ekvivalentní dávkou estrogenu. Bylo prokázáno, že přidání progestinu k estrogenové terapii u žen po menopauze snižuje riziko hyperplazie endometria, která může být prekurzorem rakoviny endometria.
Rakovina vaječníků
Podstudie WHI estrogen plus progestin zaznamenala statisticky nevýznamné zvýšení rizika rakoviny vaječníků. Po průměrné době sledování 5,6 roku bylo relativní riziko rakoviny vaječníků pro CE plus MPA oproti placebu 1,58 (95 procent nCI, 0,77 – 3,24). Absolutní riziko CE plus MPA oproti placebu bylo 4 versus 3 případy na 10 000 žen-roků. V některých epidemiologických studiích bylo užívání estrogenu plus progestinů a přípravků obsahujících pouze estrogen, zejména po dobu 5 nebo více let, spojeno se zvýšeným rizikem rakoviny vaječníků. Avšak trvání expozice spojené se zvýšeným rizikem není konzistentní ve všech epidemiologických studiích a některé neuvádějí žádnou souvislost.
Pravděpodobná demence
V estrogen plus progestin Women's Health Initiative Memory Study (WHIMS), doplňkové studii WHI, byla populace 4 532 postmenopauzálních žen ve věku 65 až 79 let randomizována k denní CE (0,625 mg) plus MPA (2,5 mg) nebo placebu.
doplňkové studii WHIMS estrogen plus progestin byla po průměrném sledování 4 roky u 40 žen ve skupině CE plus MPA a u 21 žen ve skupině s placebem diagnostikována pravděpodobná demence. Relativní riziko pravděpodobné demence pro estrogen plus progestin oproti placebu bylo 2,05 (95% CI, 1,21-3,48). Absolutní riziko pravděpodobné demence u CE plus MPA oproti placebu bylo 45 oproti 22 případům na 10 000 žen-roků. Není známo, zda se tato zjištění týkají mladších žen po menopauze. (Vidět Klinické studie a OPATŘENÍ , Geriatrické použití .)
Abnormality vidění
U pacientek užívajících estrogen byla hlášena retinální vaskulární trombóza. Pokud dojde k náhlé částečné nebo úplné ztrátě zraku, nebo pokud dojde k náhlému nástupu proptózy, diplopie nebo migrény, přerušte léčbu estrogeny a progestinem až do vyšetření. Pokud vyšetření odhalí edém papily nebo retinální vaskulární léze, léčba estrogenem a progestinem by měla být trvale ukončena.
OPATŘENÍ
Všeobecné
Přidání progestinu, když žena neprodělala hysterektomii
Studie přidávání progestinu po dobu 10 nebo více dnů cyklu podávání estrogenu nebo denně s estrogenem v kontinuálním režimu uvádějí nižší výskyt endometriální hyperplazie, než jaký by byl vyvolán samotnou estrogenovou léčbou. Hyperplazie endometria může být prekurzorem rakoviny endometria.
Existují však možná rizika, která mohou být spojena s užíváním progestinů s estrogeny ve srovnání s režimy samotnými estrogeny. Patří mezi ně zvýšené riziko rakoviny prsu.
Zadržování tekutin
Progesteron může způsobit určitý stupeň zadržování tekutin. Ženy s onemocněními, které mohou být ovlivněny tímto faktorem, jako je srdeční nebo renální dysfunkce, vyžadují pečlivé sledování.
Závratě a ospalost
PROMETRIUM Capsules může způsobit přechodné závratě a ospalost a měl by být používán s opatrností při řízení motorových vozidel nebo obsluze strojů. PROMETRIUM tobolky by se měly užívat jako jedna denní dávka před spaním.
Informace pro pacienta
Všeobecné
Tento produkt obsahuje arašídový olej a neměl by být používán, pokud jste alergičtí na arašídy.
Lékařům se doporučuje prodiskutovat obsah příbalové informace s pacienty, kterým přípravek PROMETRIUM 100 mg tobolky předepisují.
Karcinogeneze, mutageneze, zhoršení plodnosti
Progesteron nebyl testován na karcinogenitu u zvířat při perorálním podání. Když se implantoval do samiček myší, progesteron produkoval karcinomy mléčné žlázy, ovariální granulózní buněčné nádory a endometriální stromální sarkomy. U psů způsobily dlouhodobé intramuskulární injekce nodulární hyperplazii a benigní a maligní nádory mléčné žlázy. Subkutánní nebo intramuskulární injekce progesteronu zkrátily dobu latence a zvýšily výskyt nádorů mléčné žlázy u potkanů dříve léčených chemickým karcinogenem.
Progesteron neprokázal genotoxicitu ve studiích in vitro pro bodové mutace nebo pro poškození chromozomů. In vivo studie poškození chromozomů přinesly pozitivní výsledky u myší při orálních dávkách 1000 mg/kg a 2000 mg/kg. Bylo prokázáno, že exogenně podávaný progesteron inhibuje ovulaci u řady druhů a očekává se, že vysoké dávky podávané po delší dobu by narušily plodnost až do ukončení léčby.
Těhotenství
PROMETRIUM Kapsle by se neměly užívat během těhotenství. (Vidět KONTRAINDIKACE ).
Těhotenství kategorie B
Reprodukční studie byly provedeny na myších v dávkách až 9násobku perorální dávky pro člověka, na potkanech v dávkách až 44násobku perorální dávky u lidí, na králících v dávce 10 mcg/den podávané lokálně v děloze pomocí implantovaného zařízení u morčat v dávkách přibližně jedné poloviny perorální dávky pro člověka a u opic rhesus v dávkách přibližně dávky pro člověka, vše na základě plochy povrchu těla, a odhalily malé nebo žádné známky poškození plodnosti nebo poškození plodu v důsledku progesteronu.
Kojící ženy
V mléce kojících žen užívajících progestiny byla identifikována detekovatelná množství progestinu. Při podávání přípravku PROMETRIUM 100 mg tobolky kojící ženě je třeba postupovat opatrně.
Pediatrické použití
PROMETRIUM tobolky nejsou indikovány u dětí. Klinické studie u pediatrické populace nebyly provedeny.
Geriatrické použití
Do klinických studií využívajících tobolky PROMETRIUM nebyl zapojen dostatečný počet geriatrických žen, aby se zjistilo, zda se osoby starší 65 let liší od mladších subjektů v odpovědi na tobolky PROMETRIUM 200 mg.
Studie iniciativy pro zdraví žen
V podstudii Women's Health Initiative (WHI) estrogen plus progestin (denní CE [0,625 mg] plus MPA [2,5 mg] oproti placebu) bylo vyšší relativní riziko nefatální mrtvice a invazivního karcinomu prsu u žen starších 65 let . (Vidět Klinické studie a VAROVÁNÍ , Kardiovaskulární poruchy a Zhoubné novotvary. )
Studie paměti iniciativy Women's Health Initiative
Ve studii Women's Health Initiative Memory Study (WHIMS) u postmenopauzálních žen ve věku 65 až 79 let bylo v doplňkové studii estrogen plus progestin ve srovnání s placebem zvýšené riziko rozvoje pravděpodobné demence. (Vidět Klinické studie a VAROVÁNÍ , Pravděpodobná demence. )
PŘEDÁVKOVAT
Nebyly provedeny žádné studie o předávkování u lidí. V případě předávkování je třeba léčbu přípravkem PROMETRIUM Capsules přerušit a pacienta léčit symptomaticky.
KONTRAINDIKACE
PROMETRIUM Capsules by neměly užívat ženy s některým z následujících stavů:
KLINICKÁ FARMAKOLOGIE
PROMETRIUM 200 mg tobolky jsou perorální léková forma mikronizovaného progesteronu, který je chemicky identický s progesteronem ovariálního původu. Perorální biologická dostupnost progesteronu se zvyšuje mikronizací.
Farmakokinetika
Vstřebávání
Po perorálním podání progesteronu ve formě mikronizované měkké želatinové kapsle bylo dosaženo maximálních sérových koncentrací během 3 hodin. Absolutní biologická dostupnost mikronizovaného progesteronu není známa. Tabulka 1 shrnuje průměrné farmakokinetické parametry u postmenopauzálních žen po pěti perorálních denních dávkách PROMETRIUM Capsules 100 mg ve formě mikronizované měkké želatinové kapsle.
TABULKA 1. Farmakokinetické parametry PROMETRIUM 200mg tobolek
Koncentrace progesteronu v séru se zdály být lineární a úměrné dávce po podání více dávek přípravku PROMETRIUM 200 mg tobolky 100 mg v rozmezí dávek 100 mg denně až 300 mg denně u žen po menopauze. Přestože dávky vyšší než 300 mg denně nebyly u žen studovány, sérové koncentrace ze studie na dobrovolnících mužského pohlaví se zdály lineární a úměrné dávce mezi 100 mg denně a 400 mg denně. Farmakokinetické parametry u mužských dobrovolníků byly obecně v souladu s parametry pozorovanými u žen po menopauze.
Rozdělení
Progesteron je přibližně z 96 procent až 99 procent vázán na sérové proteiny, především na sérový albumin (50 až 54 procent) a transkortin (43 až 48 procent).
Metabolismus
Progesteron je metabolizován primárně v játrech převážně na pregnanedioly a pregnanolony. Pregnanedioly a pregnanolony jsou konjugovány v játrech na glukuronidové a sulfátové metabolity. Metabolity progesteronu, které jsou vylučovány žlučí, mohou být dekonjugovány a mohou být dále metabolizovány ve střevě redukcí, dehydroxylací a epimerizací.
Vylučování
Glukuronidové a sulfátové konjugáty pregnandiolu a pregnanolonu jsou vylučovány žlučí a močí. Metabolity progesteronu jsou vylučovány převážně ledvinami. Metabolity progesteronu, které jsou vylučovány žlučí, mohou podléhat enterohepatální recyklaci nebo mohou být vylučovány stolicí.
Zvláštní populace
Farmakokinetika přípravku PROMETRIUM Capsules nebyla hodnocena u pacientů s nízkou tělesnou hmotností nebo u obézních pacientů.
Jaterní nedostatečnost
Vliv poruchy funkce jater na farmakokinetiku přípravku PROMETRIUM 100 mg tobolky nebyl studován.
Renální insuficience
Vliv poruchy funkce ledvin na farmakokinetiku přípravku PROMETRIUM Capsules nebyl studován.
Interakce jídlo-lék
Současné požití potravy zvýšilo biologickou dostupnost přípravku PROMETRIUM 100 mg tobolky ve srovnání se stavem nalačno, když byl podáván ženám po menopauze v dávce 200 mg.
Lékové interakce
Metabolismus progesteronu lidskými jaterními mikrozomy byl inhibován ketokonazolem (IC50
Současné podávání konjugovaných estrogenů a PROMETRIUM 200 mg tobolek 29 ženám po menopauze během 12denního období vedlo ke zvýšení koncentrací celkového estronu (Cmax 3,68 ng/ml až 4,93 ng/ml) a celkových koncentrací ekvilinu (Cmax 3,2 m2. ng/ml) a snížení koncentrací cirkulujícího 17p estradiolu (Cmax 0,037 ng/ml až 0,030 ng/ml). Poločas konjugovaných estrogenů byl podobný při současném podávání tobolek PROMETRIUM. Tabulka 2 shrnuje farmakokinetické parametry.
TABULKA 2. Průměrné (± SD) farmakokinetické parametry pro estradiol, estron a ekvilin po společném podávání konjugovaných estrogenů 0,625 mg a kapslí PROMETRIUM 200 mg po dobu 12 dnů ženám po menopauze
Klinické studie
Účinky na endometrium
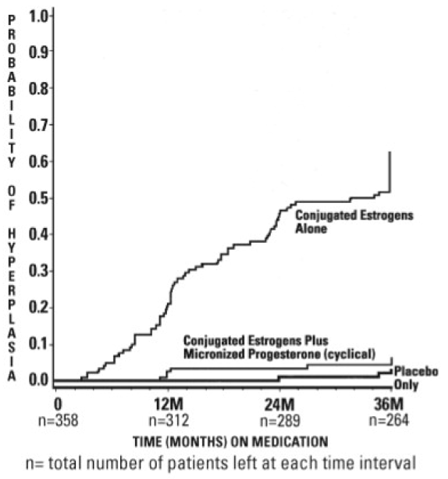
randomizované, dvojitě zaslepené klinické studii bylo 358 postmenopauzálních žen, každá s intaktní dělohou, léčeno po dobu až 36 měsíců. Léčebné skupiny byly: PROMETRIUM Capsules v dávce 200 mg denně po dobu 12 dnů na 28denní cyklus v kombinaci s konjugovanými estrogeny 0,625 mg denně (n=120); pouze konjugované estrogeny 0,625 mg denně (n=119); nebo placebo (n=119). Subjekty ve všech třech léčebných skupinách byly primárně bělošské ženy (87 procent nebo více v každé skupině). Výsledky výskytu hyperplazie endometria u žen léčených až 3 roky jsou uvedeny v tabulce 3. Srovnání skupiny léčené PROMETRIUM Capsules plus konjugované estrogeny se skupinou pouze konjugovanými estrogeny ukázalo významně nižší míru hyperplazie (6 procent kombinovaný produkt versus 64 procent samotného estrogenu) ve skupině léčené PROMETRIUM Capsules plus konjugované estrogeny po dobu 36 měsíců léčby.
TABULKA 3. Výskyt hyperplazie endometria u žen podstupujících 3letou léčbu
Časy do diagnózy hyperplazie endometria během 36 měsíců léčby jsou uvedeny na obrázku 1. Tento obrázek graficky ilustruje, že podíl pacientek s hyperplazií byl významně vyšší ve skupině s konjugovanými estrogeny (64 procent) ve srovnání se skupinou s konjugovanými estrogeny plus PROMETRIUM Capsules (6 procent).
Obrázek 1. Doba do hyperplazie u žen, které dostávají až 36 měsíců léčby
Míry přerušení léčby kvůli hyperplazii během 36 měsíců léčby jsou uvedeny v tabulce 4. Pro jakýkoli stupeň hyperplazie byla míra přerušení u pacientek, které dostávaly konjugované estrogeny plus PROMETRIUM 100 mg tobolky, podobná jako u skupiny s pouze placebem, míra přerušení léčby u pacientek, které dostávaly samotné konjugované estrogeny, byla významně vyšší. Ženy, které trvale ukončily léčbu z důvodu hyperplazie, byly demograficky podobné jako u celkové populace ve studii.
TABULKA 4. Míra přerušení léčby kvůli hyperplazii po dobu 36 měsíců léčby
Účinky na sekundární amenoreu
jednocentrické, randomizované, dvojitě zaslepené klinické studii, která zahrnovala premenopauzální ženy se sekundární amenoreou po dobu nejméně 90 dnů, vedlo podávání 10 dnů léčby přípravkem PROMETRIUM 200 mg Capsules k tomu, že u 80 procent žen došlo ke krvácení z vysazení do 7 dnů od posledního dávka PROMETRIUM 100 mg tobolky, 300 mg denně (n=20), ve srovnání s 10 procenty žen, u kterých došlo ke krvácení z vysazení ve skupině s placebem (n=21).
V multicentrické otevřené studii po uvedení přípravku na trh s paralelními skupinami, která zahrnovala premenopauzální ženy se sekundární amenoreou po dobu alespoň 90 dnů, bylo podávání přípravku PROMETRIUM 100mg Capsules po dobu 10 dnů během dvou 28denních léčebných cyklů, 300 mg denně (n= 107) nebo 400 mg denně (n=99) vedly ke krvácení z vysazení u 73,8 procenta a 76,8 procenta žen.
Rychlost sekreční transformace byla hodnocena v multicentrické, randomizované, dvojitě zaslepené klinické studii u postmenopauzálních žen, které byly stimulovány estrogenem. PROMETRIUM 100 mg tobolky podávané perorálně po dobu 10 dnů v dávce 400 mg denně (n=22) vyvolalo kompletní sekreční změny v endometriu u 45 procent žen ve srovnání s 0 procenty ve skupině s placebem (n=23).
Druhá multicentrická, paralelní, otevřená studie postmarketingového dávkování u premenopauzálních žen se sekundární amenoreou po dobu alespoň 90 dnů také hodnotila rychlost sekreční transformace. Všechny subjekty dostávaly denně perorálně konjugované estrogeny během 3 po sobě jdoucích 28denních léčebných cyklů a kapsle PROMETRIUM, 300 mg denně (n=107) nebo 400 mg denně (n=99) po dobu 10 dnů každého léčebného cyklu. Míra úplné transformace sekrece byla 21,5 procenta a 28,3 procenta.
Studie iniciativy pro zdraví žen
Women's Health Initiative (WHI) zahrnula přibližně 27 000 převážně zdravých postmenopauzálních žen do dvou podstudií s cílem posoudit rizika a přínosy denního perorálního konjugovaného estrogenu (CE) [0,625 mg] – samotných nebo v kombinaci s medroxyprogesteron acetátem (MPA) [2,5 mg]. ve srovnání s placebem v prevenci některých chronických onemocnění. Primárním cílovým parametrem byla incidence ischemické choroby srdeční [(CHD) definovaná jako nefatální infarkt myokardu (MI), tichý IM a úmrtí na ICHS], přičemž primárním nežádoucím výsledkem byl invazivní karcinom prsu. „Globální index“ zahrnoval nejčasnější výskyt ICHS, invazivní rakovinu prsu, mrtvici, plicní embolii (PE), rakovinu endometria (pouze v podstudii CE plus MPA), kolorektální rakovinu, zlomeninu kyčle nebo úmrtí z jiné příčiny. Tyto dílčí studie nehodnotily účinky samotného CE nebo CE plus MPA na symptomy menopauzy.
Podstudie WHI Estrogen Plus Progestin
Podstudie WHI estrogen plus progestin byla brzy ukončena. Podle předem definovaného pravidla pro ukončení léčby, po průměrném sledování 5,6 roku léčby, zvýšené riziko rakoviny prsu a kardiovaskulárních příhod přesáhlo specifikované přínosy zahrnuté do „globálního indexu“. Absolutní nadměrné riziko událostí v „globálním indexu“ bylo 19 na 10 000 žen-roků.
U těch výsledků zahrnutých do „globálního indexu“ WHI, které dosáhly statistické významnosti po 5,6 letech sledování, bylo absolutní nadměrné riziko na 10 000 žen-roků ve skupině léčené CE plus MPA 7 více příhod ICHS, 8 více cévních mozkových příhod, 10 více PE a 8 více invazivních karcinomů prsu, zatímco absolutní snížení rizika na 10 000 žen-roků bylo o 6 méně kolorektálních karcinomů a o 5 méně zlomenin kyčle.
Výsledky podstudie estrogen plus progestin, která zahrnovala 16 608 žen (průměrný věk 63 let, rozmezí 50 až 79; 83,9 procenta bělochů, 6,8 procenta černochů, 5,4 procenta hispánců, 3,9 procenta ostatní) jsou uvedeny v tabulce 5. posuzovaná data po průměrné době sledování 5,6 let.
TABULKA 5. Relativní a absolutní riziko pozorované v podstudii Estrogen Plus Progestin WHI v průměru 5,6 roku a, b
Načasování zahájení léčby estrogenem a progestinem vzhledem k začátku menopauzy může ovlivnit celkový profil rizika a přínosu. Podstudie WHI estrogen plus progestin stratifikovaná podle věku ukázala u žen ve věku 50 až 59 let nevýznamný trend ke snížení rizika celkové mortality [poměr rizika (HR) 0,69 (95% CI, 0,44-1,07)].
Studie paměti iniciativy Women's Health Initiative
Do studie estrogen plus progestin Women's Health Initiative Memory Study (WHIMS), doplňková studie WHI, bylo zařazeno 4 532 převážně zdravých žen po menopauze ve věku 65 let a starších (47 procent bylo ve věku 65 až 69 let; 35 procent bylo ve věku 70 až 74 let). věk a 18 procent bylo ve věku 75 let a více), aby se vyhodnotily účinky denní CE (0,625 mg) plus MPA (2,5 mg) na výskyt pravděpodobné demence (primární výsledek) ve srovnání s placebem.
Po průměrném sledování 4 roky bylo relativní riziko pravděpodobné demence u CE plus MPA oproti placebu 2,05 (95% CI, 1,21 – 3,48). Absolutní riziko pravděpodobné demence u CE plus MPA oproti placebu bylo 45 oproti 22 na 10 000 žen-roků. Pravděpodobná demence, jak je definována v této studii, zahrnovala Alzheimerovu chorobu (AD), vaskulární demenci (VaD) a smíšený typ (s rysy AD i VaD). Nejčastější klasifikací pravděpodobné demence v léčené skupině a skupině s placebem byla AD. Vzhledem k tomu, že doplňková studie byla provedena u žen ve věku 65 až 79 let, není známo, zda se tato zjištění vztahují na mladší ženy po menopauze. (Vidět VAROVÁNÍ , Pravděpodobná demence a OPATŘENÍ , Geriatrické použití .)
INFORMACE PRO PACIENTA
PROMETRIUM® (progesteron, USP) Kapsle 100 mg a 200 mg
Přečtěte si tyto INFORMACE PRO PACIENTA dříve, než začnete užívat PROMETRIUM 200 mg tobolky, a přečtěte si, co získáte pokaždé, když si doplníte svůj předpis na přípravek PROMETRIUM 100 mg tobolky. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
JAKÉ JSOU NEJDŮLEŽITĚJŠÍ INFORMACE, KTERÉ BYCH MĚL VĚDĚT O PROMETRIUM 100mg TOPSLECH (progesteronový hormon)?
- Progestiny s estrogeny by se neměly používat k prevenci srdečních onemocnění, srdečních záchvatů, mrtvice nebo demence.
- Užívání progestinů s estrogeny může zvýšit vaši šanci na infarkt, mrtvici, rakovinu prsu a krevní sraženiny.
- Použití progestinů s estrogeny může zvýšit vaši šanci na demenci, na základě studie u žen ve věku 65 let a starších.
- Vy a váš poskytovatel zdravotní péče byste měli pravidelně mluvit o tom, zda stále potřebujete léčbu přípravkem PROMETRIUM 100 mg tobolky.
TENTO PRODUKT OBSAHUJE ARAŠÍDOVÝ OLEJ A NEMĚL BY SE POUŽÍVAT, POKUD JSTE NA ARAŠÍDY ALERGICKÝ.
Co je PROMETRIUM 200 mg tobolky?
PROMETRIUM 100 mg tobolky obsahují ženský hormon zvaný progesteron.
Na co se PROMETRIUM 100mg tobolky používá?
Léčba menstruačních nepravidelností
PROMETRIUM 200 mg tobolky se používají k léčbě sekundární amenorey (absence menstruace u žen, které již dříve menstruovaly) v důsledku poklesu progesteronu. Když neprodukujete dostatek progesteronu, mohou se objevit menstruační nepravidelnosti. Pokud váš poskytovatel zdravotní péče zjistil, že vaše tělo samo o sobě neprodukuje dostatek progesteronu, může vám být předepsán PROMETRIUM 200mg Capsules k zajištění potřebného progesteronu.
Ochrana endometria (výstelky dělohy)
PROMETRIUM 200 mg tobolky se používají v kombinaci s léky obsahujícími estrogen u postmenopauzálních žen s dělohou. Užívání samotného estrogenu zvyšuje možnost vzniku stavu zvaného hyperplazie endometria, který může vést k rakovině děložní sliznice. Ženám s dělohou se obecně doporučuje přidání progestinu, aby se snížilo riziko vzniku rakoviny dělohy (dělohy).
Kdo by neměl užívat kapsle PROMETRIUM?
Nezačínejte užívat PROMETRIUM tobolky, pokud:
- Jsou alergičtí na arašídy
- Máte neobvyklé vaginální krvácení
- V současné době máte nebo jste měli určité druhy rakoviny Léčba estrogeny a progestinem může zvýšit šanci na získání určitých typů rakoviny, včetně rakoviny prsu nebo dělohy. Pokud máte nebo jste měli rakovinu, poraďte se se svým poskytovatelem zdravotní péče o tom, zda byste měli užívat PROMETRIUM Capsules.
- Měl mrtvici nebo infarkt
- V současné době máte nebo jste měli krevní sraženiny
- současné době máte nebo jste měli problémy s játry
- Jste alergičtí na kapsle PROMETRIUM nebo na některou z jeho složek Viz seznam složek přípravku PROMETRIUM 200 mg tobolky na konci této příbalové informace.
- Myslíš, že můžeš být těhotná
Sdělte svému poskytovateli zdravotní péče:
- Pokud kojíte. Hormon v PROMETRIUM 100mg tobolkách může přecházet do vašeho mateřského mléka.
- O všech vašich zdravotních problémech. Váš poskytovatel zdravotní péče vás možná bude muset pečlivěji zkontrolovat, pokud máte určité stavy, jako je astma (sípání), epilepsie (záchvaty), cukrovka, migréna, endometrióza, lupus, problémy se srdcem, játry, štítnou žlázou nebo ledvinami nebo máte vysoké hladiny vápníku ve vaší krvi.
- O všech lécích, které užíváte. To zahrnuje léky na předpis i bez předpisu, vitamíny a bylinné doplňky. Některé léky mohou ovlivnit účinek přípravku PROMETRIUM 100 mg tobolky. PROMETRIUM tobolky mohou také ovlivnit, jak účinkují vaše další léky.
Jak mám užívat PROMETRIUM 200 mg tobolky?
Jaké jsou možné vedlejší účinky PROMETRIUM Capsules?
Nežádoucí účinky jsou seskupeny podle toho, jak jsou závažné a jak často se vyskytují, když jste léčeni:
Mezi závažné, ale méně časté nežádoucí účinky patří:
- Riziko pro plod: Případy rozštěpu patra, rozštěpu rtu, hypospadie, defektu komorového septa, otevřeného ductus arteriosus a dalších vrozených srdečních vad.
- Abnormální srážení krve: Cévní mozková příhoda, srdeční infarkt, plicní embolie, ztráta zraku nebo slepota.
Některé z varovných příznaků závažných nežádoucích účinků zahrnují:
- Změny vidění nebo řeči
- Náhlé nové silné bolesti hlavy
- Silné bolesti na hrudi nebo nohou s nebo bez dušnosti, slabosti a únavy
- Závratě a mdloby
- Zvracení
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u vás objeví některý z těchto varovných příznaků nebo jakékoli jiné neobvyklé příznaky, které se vás týkají.
Méně závažné, ale časté nežádoucí účinky zahrnují:
- Bolesti hlavy
- Bolest prsou
- Nepravidelné vaginální krvácení nebo špinění
- Křeče v žaludku nebo břiše, nadýmání
- Nevolnost a zvracení
- Ztráta vlasů
- Zadržování tekutin
- Vaginální kvasinková infekce
To nejsou všechny možné vedlejší účinky přípravku PROMETRIUM 200 mg tobolky. Pro více informací požádejte svého poskytovatele zdravotní péče nebo lékárníka o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit společnosti AbbVie Inc. na čísle 1-800-633-9110 nebo FDA na čísle 1-800-FDA-1088.
Co mohu udělat, abych snížil své šance na výskyt závažných nežádoucích účinků u PROMETRIUM 100 mg tobolky?
- Pravidelně se poraďte se svým poskytovatelem zdravotní péče o tom, zda máte pokračovat v užívání přípravku PROMETRIUM 100 mg tobolky.
- Okamžitě navštivte svého poskytovatele zdravotní péče, pokud během užívání kapslí PROMETRIUM dostanete neobvyklé vaginální krvácení.
- Nechejte si každý rok udělat vyšetření pánve, prsu a mamograf (rentgen prsu), pokud vám váš poskytovatel zdravotní péče neřekne něco jiného. Pokud členové vaší rodiny měli rakovinu prsu nebo pokud jste někdy měla bulky v prsu nebo abnormální mamograf, možná budete muset podstupovat vyšetření prsu častěji.
- Pokud máte vysoký krevní tlak, vysoký cholesterol (tuk v krvi), cukrovku, máte nadváhu nebo užíváte tabák, můžete mít vyšší pravděpodobnost onemocnění srdce. Požádejte svého poskytovatele zdravotní péče o způsoby, jak snížit vaše šance na onemocnění srdce.
Obecné informace o bezpečném a účinném používání kapslí PROMETRIUM
- Léky jsou někdy předepisovány na stavy, které nejsou uvedeny v příbalových informacích pro pacienty. Neužívejte PROMETRIUM tobolky na stavy, pro které nebyl předepsán.
- Váš poskytovatel zdravotní péče předepsal tento lék pouze vám a vám. Nedávejte PROMETRIUM tobolky jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
- PROMETRIUM 200 mg tobolky se má užívat jako jedna denní dávka před spaním. Některé ženy mohou během počáteční léčby pociťovat extrémní závratě a/nebo ospalost. V několika případech mohou příznaky zahrnovat rozmazané vidění, potíže s mluvením, potíže s chůzí a abnormální pocity. Pokud zaznamenáte tyto příznaky, okamžitě je proberte se svým poskytovatelem zdravotní péče.
- Buďte opatrní při řízení motorových vozidel nebo obsluze strojů, protože se mohou objevit závratě nebo ospalost.
Kapsle PROMETRIUM uchovávejte mimo dosah dětí.
Tato příbalová informace obsahuje souhrn nejdůležitějších informací o přípravku PROMETRIUM 100 mg tobolky. Pokud byste chtěli další informace, promluvte si se svým poskytovatelem zdravotní péče nebo lékárníkem. Můžete požádat o informace o PROMETRIUM 100mg tobolkách, které jsou určeny pro zdravotníky. Další informace získáte na bezplatném čísle 1-800-633-9110.
Jaké jsou složky v kapslích PROMETRIUM?
Účinná látka: 100 mg nebo 200 mg mikronizovaného progesteronu
Mezi neaktivní složky PROMETRIUM Capsules 100 mg patří: arašídový olej NF, želatina NF, glycerin USP, lecitin NF, oxid titaničitý USP, FD&C červená č. 40 a D&C žlutá č. 10.
Mezi neaktivní složky PROMETRIUM Capsules 200 mg patří: arašídový olej NF, želatina NF, glycerin USP, lecitin NF, oxid titaničitý USP, D&C žlutá č. 10 a FD&C žlutá č. 6.
JAK DODÁVÁNO
PROMETRIUM 200 mg tobolky 100 mg jsou kulaté tobolky broskvové barvy s černým potiskem „SV“.
PROMETRIUM 100 mg tobolky 200 mg jsou oválné, světle žluté tobolky s černým potiskem „SV2“.
Skladujte při teplotě 25 °C (77 °F); povolené výchylky do 15° až 30°C (59° až 86°F) [Viz USP Controlled Room Temperature].
