Parlodel 2.5mg Bromocriptine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Parlodel a jak se používá?
Parlodel 2,5 mg je lék na předpis používaný k léčbě příznaků dysfunkcí souvisejících s hyperprolaktinemií, Parkinsonovy choroby a akromegalie. Parlodel 2,5 mg lze užívat samostatně nebo s jinými léky.
Parlodel 2,5 mg patří do třídy léků nazývaných antiparkinsonika, dopaminoví agonisté; hyperprolaktinémie; Metabolické a endokrinní, jiné.
Není známo, zda je Parlodel 2,5 mg bezpečný a účinný u dětí mladších 10 let.
Jaké jsou možné vedlejší účinky přípravku Parlodel?
Parlodel může způsobit závažné nežádoucí účinky včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- problémy se zrakem,
- neustálá rýma,
- bolest na hrudi,
- bolest při dýchání,
- rychlý srdeční tep,
- zrychlené dýchání,
- dušnost,
- bolesti zad,
- otoky kotníků nebo nohou,
- močí méně nebo vůbec ne,
- zmatek,
- halucinace,
- točení hlavy,
- bolest hlavy,
- hlad,
- slabost,
- pocení,
- třes,
- podrážděnost,
- potíže se soustředěním,
- mimovolní pohyby svalů,
- ztráta rovnováhy nebo koordinace,
- krvavá nebo dehtovitá stolice,
- vykašlávání krve,
- zvratky, které vypadají jako kávová sedlina,
- těžká bolest hlavy,
- rozmazané vidění,
- bzučení v tvých uších,
- úzkost,
- zmatek,
- bolest na hrudi,
- dušnost,
- nerovnoměrné srdeční tepy a
- záchvaty
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Parlodel 2,5 mg patří:
- závrať,
- pocit točení,
- mírná ospalost,
- únava,
- mírná bolest hlavy,
- depresivní nálada,
- problémy se spánkem (nespavost),
- suchá ústa,
- ucpaný nos,
- žaludeční nevolnost,
- nevolnost,
- zvracení,
- bolest břicha,
- ztráta chuti k jídlu,
- průjem,
- zácpa a
- pocit chladu nebo necitlivosti v prstech
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Parlodel. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
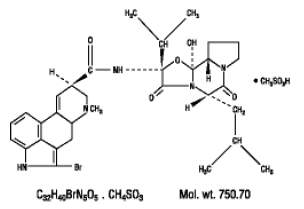
POPIS
Parlodel® (bromokriptin mesylát) je námelový derivát se silnou agonistickou aktivitou dopaminového receptoru. Každá tableta Parlodel® (bromokriptin mesylát) SnapTabs® pro perorální podání obsahuje 2½ mg a každá tobolka obsahuje 5 mg bromokriptinu (jako mesylát). Bromokriptin mesylát je chemicky označen jako Ergotaman-3',6',18-trion, 2-brom-12'-hydroxy-2'-(1-methylethyl)-5'-( 2-methylpropyl)-, (5'a)-monomethansulfonát (sůl).
Strukturní vzorec je:
2,5 mg SnapTabs®
Aktivní složka: bromokriptin mesylát, USP
Neaktivní ingredience: koloidní oxid křemičitý, laktóza, stearát hořečnatý, povidon, škrob a další složka
5 mg kapsle
Aktivní složka: bromokriptin mesylát, USP
Neaktivní ingredience: koloidní oxid křemičitý, želatina, laktóza, stearát hořečnatý, červený oxid železitý, oxid křemičitý, laurylsulfát sodný, škrob, oxid titaničitý, žlutý oxid železitý a další složka
INDIKACE
Dysfunkce spojené s hyperprolaktinemií
Parlodel (bromokriptin mesylát) je indikován k léčbě dysfunkcí spojených s hyperprolaktinémie počítaje v to amenorea s nebo bez galaktorea, neplodnost nebo hypogonadismus . Léčba přípravkem Parlodel 2,5 mg je indikována u pacientů s adenomy vylučující prolaktin , což může být základní základní endokrinopatie přispívající k výše uvedeným klinickým projevům. Snížení v velikost nádoru byla prokázána u mužů i žen s makroadenomy. V případech, kdy je zvolena adenektomie, může být před operací použita léčba Parlodelem 2,5 mg ke snížení nádorové hmoty.
Akromegalie
Léčba Parlodelem 2,5 mg je indikována k léčbě akromegalie. Léčba Parlodelem, samotná nebo jako přídatná terapie s ozářením hypofýzy nebo chirurgickým zákrokem, snižuje sérový růstový hormon o 50 % nebo více u přibližně ½ léčených pacientů, i když obvykle ne na normální hladiny.
Vzhledem k tomu, že účinky zevního ozařování hypofýzy nemusí být maximální po několik let, doplňková léčba přípravkem Parlodel 2,5 mg nabízí potenciální přínos dříve, než se účinky ozáření projeví.
Parkinsonova choroba
Parlodel 2,5 mg SnapTabs nebo tobolky jsou indikovány k léčbě známek a příznaků idiopatické nebo postencefalické Parkinsonovy choroby. Jako doplňková léčba k levodopě (samotné nebo s inhibitorem periferní dekarboxylázy) může léčba Parlodelem poskytnout další terapeutické výhody u těch pacientů, kteří jsou v současné době udržováni na optimálních dávkách levodopy, u těch, u kterých se začíná zhoršovat (vyvíjí se tolerance) k léčbě levodopou a ti, u kterých došlo k „selhání konce dávky“ při léčbě levodopou. Léčba přípravkem Parlodel 2,5 mg může umožnit snížení udržovací dávky levodopy, a tak může zmírnit výskyt a/nebo závažnost nežádoucích účinků spojených s dlouhodobou léčbou levodopou, jako jsou abnormální mimovolní pohyby (např. dyskineze) a výrazné výkyvy funkce motoru (fenomén „on-off“). Pokračující účinnost léčby Parlodelem 2,5 mg během léčby trvající déle než 2 roky nebyla stanovena.
Údaje nejsou dostatečné k vyhodnocení potenciálního přínosu léčby nově diagnostikované Parkinsonovy choroby přípravkem Parlodel. Studie však ukázaly významně více nežádoucích účinků (zejména nauzea, halucinace, zmatenost a hypotenze) u pacientů léčených Parlodelem než u pacientů léčených levodopou/karbidopou. Pacienti nereagující na levodopu jsou špatnými kandidáty na léčbu Parlodelem.
DÁVKOVÁNÍ A PODÁVÁNÍ
Všeobecné
Doporučuje se užívat Parlodel (bromokriptin mesylát) s jídlem. Pacienti by měli být během zvyšování dávky často hodnoceni, aby se určila nejnižší dávka, která vyvolá terapeutickou odpověď.
Hyperprolaktinemické indikace
Počáteční dávka přípravku Parlodel SnapTabs u dospělých je jedna ½ až jedna 2½ mg tableta s půlicí rýhou denně. Další 2½ mg tableta může být přidána k léčebnému režimu podle snášenlivosti každých 2 až 7 dní, dokud není dosaženo optimální terapeutické odpovědi. Terapeutická dávka se u klinicky studovaných dospělých pohybovala v rozmezí 2,5-15 mg denně.
Na základě omezených údajů u dětí ve věku 11 až 15 let (viz Pediatrické použití ) počáteční dávka je jedna ½ až jedna 2½ mg tableta s půlicí rýhou denně. Dávkování může být nutné zvyšovat podle snášenlivosti, dokud není dosaženo terapeutické odpovědi. Terapeutická dávka se pohybovala od 2,5 do 10 mg denně u dětí s adenomy hypofýzy vylučujícími prolaktin.
Aby se snížila pravděpodobnost dlouhodobé expozice Parlodelu, pokud by došlo k neočekávanému těhotenství, měla by být ve spojení s léčbou Parlodelem 2,5 mg používána mechanická antikoncepce, dokud se neobnoví normální ovulační menstruační cykly. U pacientek, které si přejí otěhotnět, lze antikoncepci vysadit.
Poté, pokud se menstruace nedostaví do 3 dnů od očekávaného data, je třeba léčbu přípravkem Parlodel 2,5 mg přerušit a provést těhotenský test.
Akromegalie
Prakticky u všech pacientů s akromegalií, kteří jsou léčeni přípravkem Parlodel 2,5 mg, dochází také ke snížení cirkulujících hladin růstového hormonu. Proto pravidelné hodnocení cirkulujících hladin růstového hormonu bude ve většině případů sloužit jako vodítko při určování terapeutického potenciálu Parlodelu. Pokud po krátké zkoušce s léčbou Parlodel nedojde k žádnému významnému snížení hladin růstového hormonu, je třeba pečlivě zhodnotit klinické rysy onemocnění, a pokud nedošlo k žádné změně, je třeba zvážit úpravu dávkování nebo přerušení léčby .
Počáteční doporučená dávka je jedna ½ až jedna 2½ mg tableta Parlodel SnapTabs při odpočinku (s jídlem) po dobu 3 dnů. Další jedna ½ až 1 tableta SnapTabs by měla být přidána do léčebného režimu podle tolerance každých 3 až 7 dní, dokud pacient nezíská optimální terapeutický přínos. Pacienti by měli být měsíčně přehodnocováni a dávkování upraveno na základě snížení růstového hormonu nebo klinické odpovědi. Obvyklé optimální rozmezí terapeutické dávky přípravku Parlodel se u většiny pacientů pohybuje od 20 do 30 mg/den. Maximální dávka by neměla překročit 100 mg/den.
Pacienti léčení ozařováním hypofýzy by měli být vysazeni z léčby Parlodelem 2,5 mg jednou ročně, aby bylo možné posoudit jak klinické účinky záření na proces onemocnění, tak i účinky léčby Parlodelem. Obvykle je pro tento účel dostatečná ochranná lhůta 4 až 8 týdnů. Opakovaný výskyt příznaků/příznaků nebo zvýšení hladiny růstového hormonu naznačují, že proces onemocnění je stále aktivní a je třeba zvážit další kúry Parlodelu.
Parkinsonova choroba
Základním principem léčby přípravkem Parlodel 2,5 mg je zahájit léčbu nízkou dávkou a na individuálním základě pomalu zvyšovat denní dávku, dokud není dosaženo maximální terapeutické odpovědi. Dávkování levodopy během tohoto úvodního období by mělo být pokud možno zachováno. Počáteční dávka přípravku Parlodel 2,5 mg je jedna ½ 2½ mg tablety SnapTabs dvakrát denně s jídlem. Vyšetření se doporučuje ve 2týdenních intervalech během titrace dávky, aby se zajistilo, že nebude překročena nejnižší dávka vyvolávající optimální terapeutickou odpověď. V případě potřeby lze dávku každých 14 až 28 dní zvýšit o 2½ mg/den s jídlem. Pokud by bylo vhodné snížit dávku levodopy kvůli nežádoucím účinkům, denní dávka Parlodelu, pokud je zvyšována, by měla být prováděna postupně v malých (2½ mg) přírůstcích.
Bezpečnost Parlodelu nebyla prokázána v dávkách přesahujících 100 mg/den.
JAK DODÁVÁNO
Parlodel (bromokriptin mesylát) SnapTabs
2½ mg
Parlodel je k dispozici v lahvičce obsahující 30 a 100 tablet po 2 ½ mg, každá lahvička obsahuje vysoušedlo.
Kulaté, šedobílé SnapTabs se zkosenými hranami, každý obsahující 2½ mg bromokriptinu (jako mesylát). Vyryto „PARLODEL 2½“ na jedné straně a „017“ na straně s rýhou. Vyhovuje disolučnímu testu USP 1.
Balíčky po 30 - NDC 30698-202-30 Balíčky po 100 - NDC 30698-202-01
Kapsle Parlodel (bromokriptin mesylát).
5 mg
Karamelové a bílé tobolky, každá obsahuje 5 mg bromokriptinu (jako mesylát). Na jedné polovině vytištěno červeným inkoustem „PARLODEL 5 mg“ a na druhé polovině „102“.
Balíčky po 30 - NDC 30698-201-30 Balíčky po 100 - NDC 30698-201-01
Skladovat a vydávat
Skladujte při teplotě 20 až 25 °C; povolené výchylky do 59° až 86°F (15° až 30°C) [Viz USP Controlled Room Temperature].
Dávkujte v těsné nádobě odolné vůči světlu.
Vyrábí a distribuuje: Validus Pharmaceuticals LLC Parsippany, NJ 07054. Revize: červenec 2021
VEDLEJŠÍ EFEKTY
Nežádoucí účinky z klinických studií
Hyperprolaktinemické indikace
Výskyt nežádoucích účinků je poměrně vysoký (69 %), ale ty jsou obecně mírného až středního stupně. Léčba byla přerušena u přibližně 5 % pacientů kvůli nežádoucím účinkům. Tyto v sestupném pořadí četnosti jsou: nevolnost (49 %), bolest hlavy (19 %), závratě (17 %), únava (7 %), točení hlavy (5 %), zvracení (5 %), křeče v břiše (4 %) , ucpaný nos (3 %), zácpa (3 %), průjem (3 %) a ospalost (3 %).
Léčbu Parlodelem (bromokriptin mesylát) může doprovázet mírný hypotenzní účinek. Výskyt nežádoucích účinků lze zmírnit dočasným snížením dávky na ½ tablety SnapTabs 2 nebo 3krát denně. U pacientů užívajících Parlodel 2,5 mg k léčbě velkých prolaktinomů bylo hlášeno několik případů cerebrospinální rinorey. K tomu došlo vzácně, obvykle pouze u pacientů, kteří v minulosti podstoupili transsfenoidální operaci, ozařování hypofýzy nebo obojí a kteří dostávali Parlodel 2,5 mg pro recidivu nádoru. Může se také objevit u dříve neléčených pacientů, jejichž nádor zasahuje do sfénoidního sinu.
Akromegalie
Nejčastější nežádoucí účinky, které se vyskytly u akromegalických pacientů léčených přípravkem Parlodel 2,5 mg, byly: nauzea (18 %), zácpa (14 %), posturální/ortostatická hypotenze (6 %), anorexie (4 %), sucho v ústech/ucpaný nos (4 %), poruchy trávení/dyspepsie (4 %), digitální vazospasmus (3 %), ospalost/únava (3 %) a zvracení (2 %).
Méně časté nežádoucí účinky (méně než 2 %) byly: gastrointestinální krvácení, závratě, exacerbace Raynaudova syndromu, bolest hlavy a synkopa. Vzácně (méně než 1 %) vypadávání vlasů, potenciace alkoholem, mdloby, točení hlavy, arytmie, ventrikulární tachykardie, snížená potřeba spánku, zrakové halucinace, malátnost, dušnost, bradykardie, závratě, parestézie, pomalost, vazovagální záchvat, bludná psychóza, paranoie byla hlášena nespavost, točení hlavy, snížená tolerance chladu, mravenčení v uších, bledost obličeje a svalové křeče.
Parkinsonova choroba
klinických studiích, ve kterých byl Parlodel 2,5 mg podáván se současným snížením dávky levodopy/karbidopy, byly nejčastějšími nově se objevujícími nežádoucími účinky: nauzea, abnormální mimovolní pohyby, halucinace, zmatenost, fenomén „on-off“, závratě, ospalost, mdloby/mdloby, zvracení, astenie, břišní diskomfort, poruchy vidění, ataxie, nespavost, deprese, hypotenze, dušnost, zácpa a vertigo.
Méně časté nežádoucí účinky, se kterými se lze setkat, zahrnují: anorexii, úzkost, blefarospasmus, sucho v ústech, dysfagii, otoky nohou a kotníků, erytromelalgii, epileptiformní záchvaty, únavu, bolest hlavy, letargii, skvrnitost kůže, ucpaný nos, nervozitu, noční můry, parestézie, kožní vyrážka, frekvence močení, inkontinence moči, retence moči a vzácně známky a příznaky ergotismu, jako je brnění prstů, studené nohy, necitlivost, svalové křeče chodidel a nohou nebo exacerbace Raynaudova syndromu.
Abnormality v laboratorních testech mohou zahrnovat zvýšení dusíku močoviny v krvi, SGOT, SGPT, GGPT, CPK, alkalické fosfatázy a kyseliny močové, které je obvykle přechodné a nemá klinický význam.
Nežádoucí reakce z postmarketingových zkušeností
Následující nežádoucí účinky byly hlášeny během používání Parlodelu po schválení (kombinované všechny indikace). Vzhledem k tomu, že nežádoucí účinky ze spontánních hlášení jsou hlášeny dobrovolně z populace nejisté velikosti, není obecně možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Psychiatrické poruchy: Zmatenost, psychomotorická agitace/excitace, halucinace, psychotické poruchy, nespavost, zvýšení libida, hypersexualita a impulzivní/kompulzivní chování (včetně hazardních her, utrácení a jiných intenzivních nutkání).
Poruchy nervového systému: Bolest hlavy, ospalost, závratě, dyskineze, somnolence, parestézie, nadměrná somnolence během dne, náhlý nástup spánku.
Oční poruchy: Poruchy vidění, rozmazané vidění.
Poruchy ucha a labyrintu: Tinnitus.
Srdeční poruchy: Perikardiální výpotek, konstrikční perikarditida, tachykardie, bradykardie, arytmie, fibróza srdeční chlopně.
Cévní poruchy: Hypotenze, ortostatická hypotenze (velmi vzácně vedoucí k synkopě), reverzibilní bledost prstů na rukou a nohou vyvolaná chladem (zejména u pacientů s Raynaudovým fenoménem v anamnéze).
Respirační, hrudní a mediastinální poruchy: Nosní kongesce, pleurální výpotek, pleurální fibróza, zánět pohrudnice, plicní fibróza, dyspnoe.
Gastrointestinální poruchy: Nevolnost, zácpa, zvracení, sucho v ústech, průjem, bolest břicha, retroperitoneální fibróza, gastrointestinální vřed, gastrointestinální krvácení.
Poruchy kůže a podkoží: Alergické kožní reakce, vypadávání vlasů.
Poruchy svalové a kosterní soustavy a pojivové tkáně: Křeče v nohou.
Celkové poruchy a reakce v místě aplikace: Únava, periferní edém, syndrom připomínající neuroleptický maligní syndrom při náhlém vysazení Parlodelu, abstinenční příznaky (včetně apatie, úzkosti, deprese, únavy, nespavosti, pocení a bolesti) s postupným snižováním nebo po vysazení (viz OPATŘENÍ ).
Nežádoucí události pozorované za jiných podmínek
Pacientky po porodu (viz výše VAROVÁNÍ )
poporodních studiích s přípravkem Parlodel 2,5 mg mělo 23 procent léčených pacientek po porodu alespoň 1 vedlejší účinek, ale ty byly obecně mírného až středního stupně. Léčba byla přerušena přibližně u 3 % pacientů. Nejčastěji se vyskytující nežádoucí účinky byly: bolest hlavy (10 %), závratě (8 %), nauzea (7 %), zvracení (3 %), únava (1,0 %), synkopa (0,7 %), průjem (0,4 %) a křeče (0,4 %). Snížení krevního tlaku (≥ 20 mm Hg systolického a ≥ 10 mm Hg diastolického) se vyskytlo u 28 % pacientek alespoň jednou během prvních 3 dnů po porodu; ty byly obvykle přechodné povahy. Zprávy o mdlobách v šestinedělí mohou pravděpodobně souviset s tímto účinkem. V postmarketingových zkušenostech v USA zahrnují hlášené závažné nežádoucí účinky 72 případů záchvatů (včetně 4 případů status epilepticus), 30 případů mrtvice a 9 případů infarktu myokardu u pacientek po porodu. Případy záchvatů nebyly nutně doprovázeny rozvojem hypertenze. Neustávající a často progresivně silná bolest hlavy, někdy doprovázená poruchou vidění, často předchází hodiny až dny mnoha případům záchvatů a/nebo mrtvice. U většiny pacientek se neprokázala žádná z hypertenzních poruch těhotenství včetně eklampsie, preeklampsie nebo těhotenstvím indukované hypertenze. Jeden případ cévní mozkové příhody byl spojen s trombózou sagitálního sinu a další byl spojen s cerebrální a cerebelární vaskulitidou. Jeden případ infarktu myokardu byl spojen s nevysvětlenou diseminovanou intravaskulární koagulací a druhý se vyskytl ve spojení s použitím jiného námelového alkaloidu. Vztah těchto nežádoucích účinků k podávání Parlodelu nebyl stanoven.
Ve vzácných případech byly u žen po porodu léčených Parlodelem hlášeny závažné nežádoucí účinky, včetně hypertenze, infarktu myokardu, záchvatů, mrtvice nebo psychických poruch. U některých pacientů předcházela rozvoji záchvatů nebo mrtvice silná bolest hlavy a/nebo přechodné poruchy vidění. I když je příčinná souvislost těchto příhod s lékem nejistá, u žen po porodu užívajících Parlodel se doporučuje pravidelné monitorování krevního tlaku. Pokud se rozvine hypertenze, závažná, progresivní nebo neustupující bolest hlavy (s poruchami zraku nebo bez nich) nebo známky toxicity na CNS, podávání Parlodelu 2,5 mg by mělo být přerušeno a pacient by měl být neprodleně vyšetřen.
Zvláštní opatrnosti je zapotřebí u pacientů, kteří byli nedávno léčeni nebo jsou současně léčeni léky, které mohou měnit krevní tlak, např. vazokonstriktory, jako jsou sympatomimetika nebo námelové alkaloidy včetně ergometrinu nebo methylergometrinu, a jejich současné užívání v šestinedělí se nedoporučuje.
Chcete-li nahlásit PODezření na NEŽÁDOUCÍ REAKCE, kontaktujte společnost Validus Pharmaceuticals LLC na čísle 1-866-982-5438 nebo FDA na čísle 1-800-FDA-1088 nebo www.fda.gov/medwatch.
DROGOVÉ INTERAKCE
Riziko užívání Parlodelu v kombinaci s jinými léky nebylo systematicky hodnoceno, ale alkohol může potencovat nežádoucí účinky Parlodelu. Parlodel 2,5 mg může interagovat s antagonisty dopaminu, butyrofenony a některými dalšími látkami. Sloučeniny v těchto kategoriích mají za následek sníženou účinnost Parlodelu: fenothiaziny, haloperidol, metoklopramid a pimozid. Bromokriptin je substrátem CYP3A4. Proto je třeba opatrnosti při současném podávání léků, které jsou silnými inhibitory tohoto enzymu (jako jsou azolová antimykotika, inhibitory HIV proteázy). Bylo prokázáno, že současné užívání makrolidových antibiotik, jako je erythromycin, zvyšuje plazmatické hladiny bromokriptinu (průměrné hodnoty AUC a Cmax se zvýšily 3,7krát a 4,6krát).1 Souběžná léčba akromegalických pacientů bromokriptinem a oktreotidem vedla ke zvýšení hladiny bromokriptinu (AUC bromokriptinu se zvýšila asi o 38 %).4 Současné užívání Parlodelu s jinými námelovými alkaloidy se nedoporučuje. Úprava dávky může být nezbytná v případech, kdy se používají vysoké dávky bromokriptinu (jako je indikace Parkinsonovy choroby).
VAROVÁNÍ
Protože u pacientek s nádory hypofýzy byla zjištěna hyperprolaktinémie s amenoreou/galaktoreou a neplodností, je před léčbou Parlodelem (bromokriptin mesylát) indikováno kompletní vyšetření hypofýzy.
Pokud během podávání Parlodelu dojde k otěhotnění, je nutné pečlivé sledování těchto pacientek. Adenomy vylučující prolaktin se mohou rozšířit a může dojít ke kompresi zrakových nebo jiných kraniálních nervů, což je nezbytným chirurgickým zákrokem na hypofýze. Ve většině případů se komprese vyřeší po dodání. Bylo hlášeno, že opětovné zahájení léčby přípravkem Parlodel 2,5 mg vedlo ke zlepšení zorných polí pacientek, u kterých došlo během těhotenství ke kompresi nervu. Bezpečnost léčby přípravkem Parlodel 2,5 mg během těhotenství pro matku a plod nebyla stanovena.
Parlodel 2,5 mg je spojován s ospalostí a epizodami náhlého nástupu spánku, zejména u pacientů s Parkinsonovou chorobou. Byl hlášen náhlý nástup spánku během denních činností, v některých případech bez vědomí nebo varovných příznaků. Pacienti musí být o tom informováni a musí jim být doporučeno, aby během léčby bromokriptinem neřídili ani neobsluhovali stroje. Pacienti, u kterých se vyskytla somnolence a/nebo epizoda náhlého nástupu spánku, nesmí řídit ani obsluhovat stroje. Dále může být zváženo snížení dávkování nebo ukončení terapie.
Symptomatická hypotenze se může objevit u pacientů léčených přípravkem Parlodel z jakékoli indikace. V poporodních studiích s Parlodelem bylo pozorováno snížení systolického a diastolického tlaku vleže o více než 20 mm a 10 mm Hg, v daném pořadí, u téměř 30 % pacientek užívajících Parlodel. Příležitostně byl pokles systolického tlaku vleže až o 50-59 mm Hg.
Vzhledem k tomu, že zejména během prvních dnů léčby se mohou příležitostně objevit hypotenzní reakce vedoucí ke snížení bdělosti, je třeba věnovat zvláštní pozornost řízení vozidel nebo obsluze strojů.
Zatímco u některých pacientek se na začátku léčby přípravkem Parlodel 2,5 mg objeví hypotenze, ve vzácných případech byly u žen po porodu léčených přípravkem Parlodel 2,5 mg k inhibici laktace hlášeny závažné nežádoucí účinky, včetně hypertenze, infarktu myokardu, křečí, cévní mozkové příhody. Byla hlášena hypertenze, někdy na začátku léčby, ale často se rozvíjející ve druhém týdnu léčby; byly také hlášeny záchvaty jak s předchozím rozvojem hypertenze, tak bez něj; mrtvice byly hlášeny většinou u pacientek po porodu, jejichž prenatální a porodnický průběh byl nekomplikovaný. Mnoho z těchto pacientů, kteří prodělali záchvaty (včetně případů status epilepticus) a/nebo mrtvice, uvádělo, že se u nich rozvinula stálá a často progresivně silná bolest hlavy hodiny až dny před akutní příhodou. Některým případům mrtvice a záchvatů také předcházely poruchy vidění (rozmazané vidění a přechodná kortikální slepota). Byly také hlášeny případy akutního infarktu myokardu.
Přestože nebyla prokázána příčinná souvislost mezi podáváním Parlodelu a hypertenzí, záchvaty, mrtvicemi a infarktem myokardu u žen po porodu, použití léku k prevenci fyziologické laktace nebo u pacientek s nekontrolovanou hypertenzí se nedoporučuje. U pacientek léčených pro hyperprolaktinémii by měl být Parlodel 2,5 mg vysazen, když je diagnostikováno těhotenství (viz OPATŘENÍ , Hyperprolaktinemické stavy ). V případě, že je Parlodel 2,5 mg znovu nasazen ke kontrole rychle se rozšiřujícího makroadenomu (viz OPATŘENÍ , Hyperprolaktinemické stavy a pacientka má těhotenskou hypertenzní poruchu, musí být zvážen přínos pokračování Parlodelu oproti možnému riziku jeho užívání během těhotenství s hypertenzní poruchou. Pokud se Parlodel používá k léčbě akromegalie nebo Parkinsonovy choroby u pacientek, které následně otěhotní, je třeba rozhodnout, zda je léčba nadále z lékařského hlediska nezbytná nebo zda ji lze ukončit. Pokud se pokračuje, měl by být lék vysazen u těch, u kterých se mohou objevit hypertenzní poruchy v těhotenství (včetně eklampsie, preeklampsie nebo těhotenstvím indukované hypertenze), pokud není vysazení Parlodelu považováno za lékařsky kontraindikované. Vzhledem k možnosti interakce mezi Parlodelem a jinými námelovými alkaloidy se současné užívání těchto léků nedoporučuje. Pravidelné monitorování krevního tlaku, zejména během prvních týdnů léčby, je rozumné. Pokud se rozvine hypertenze, závažná, progresivní nebo neustupující bolest hlavy (s poruchou zraku nebo bez ní) nebo známky toxicity na CNS, léková terapie by měla být přerušena a pacient by měl být okamžitě vyšetřen. Zvláštní pozornost je třeba věnovat pacientům, kteří byli nedávno léčeni nebo jsou současně léčeni léky, které mohou měnit krevní tlak. Jejich současné užívání v šestinedělí se nedoporučuje.
pacientů užívajících přípravek Parlodel, zejména při dlouhodobé léčbě vysokými dávkami, byly hlášeny pleurální a perikardiální výpotky, jakož i pleurální a plicní fibróza a konstriktivní perikarditida. Pacienti s nevysvětlitelnými pleuropulmonálními poruchami by měli být důkladně vyšetřeni a mělo by se zvážit ukončení léčby Parlodelem 2,5 mg. V těch případech, kdy byla léčba Parlodelem 2,5 mg ukončena, se změny pomalu vrátily k normálu.
U několika pacientů užívajících Parlodel, zejména při dlouhodobé léčbě vysokými dávkami, byla hlášena retroperitoneální fibróza. Pro zajištění rozpoznání retroperitoneální fibrózy v časném reverzibilním stadiu se doporučuje u této kategorie pacientů sledovat její projevy (např. bolesti zad, otoky dolních končetin, porucha funkce ledvin). Léčba přípravkem Parlodel by měla být vysazena, pokud jsou diagnostikovány nebo podezření na fibrotické změny v retroperitoneu.
OPATŘENÍ
Všeobecné
Byly hlášeny případy, kdy pacienti pociťovali intenzivní nutkání k hazardním hrám, zvýšené sexuální touhy, intenzivní nutkání nekontrolovatelně utrácet peníze a/nebo jiné intenzivní nutkání a neschopnost ovládat tyto nutkání při užívání jednoho nebo více léků, včetně Parlodelu 2,5 mg , které zvyšují centrální dopaminergní tonus. V některých případech, i když ne ve všech, bylo hlášeno, že tato nutkání ustala, když byla dávka snížena nebo byla léčba přerušena. Vzhledem k tomu, že pacienti nemusí rozpoznat toto chování jako abnormální, je důležité, aby se předepisující lékaři konkrétně zeptali pacientů nebo jejich pečovatelů na rozvoj nových nebo zvýšených nutkání hrát hazardní hry, sexuální touhy, nekontrolované utrácení nebo jiné touhy během léčby Parlodelem 2,5 mg na Parkinsonovu chorobu. nebo dysfunkce spojené s hyperprolaktinemií. Pokud se u pacienta během užívání Parlodelu objeví takové nutkání, měli by lékaři zvážit snížení dávky nebo ukončení léčby.
Bezpečnost a účinnost Parlodelu (bromokriptin mesylát) nebyla stanovena u pacientů s onemocněním ledvin nebo jater. Při podávání Parlodelu současně s jinými léky, o kterých je známo, že snižují krevní tlak, je třeba postupovat opatrně.
Lék by měl být používán s opatrností u pacientů s psychózou nebo kardiovaskulárním onemocněním v anamnéze. Pokud jsou akromegalické pacientky nebo pacientky s prolaktinomem nebo Parkinsonovou chorobou během těhotenství léčeny přípravkem Parlodel 2,5 mg, měly by být pečlivě sledovány, zvláště v poporodním období, pokud mají v anamnéze kardiovaskulární onemocnění.
Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, závažným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
Hyperprolaktinemické stavy
Poruchy zorného pole jsou známou komplikací makroprolaktinomu. Účinná léčba přípravkem Parlodel 2,5 mg vede ke snížení hyperprolaktinémie a často k ústupu zrakového postižení. U některých pacientů se však může přes normalizované hladiny prolaktinu a zmenšení nádoru následně vyvinout sekundární zhoršení zorného pole, které může být důsledkem trakce na optické chiasma, které je staženo do nyní částečně prázdné selly. V těchto případech se může porucha zorného pole zlepšit snížením dávky bromokriptinu, zatímco dojde k určitému zvýšení prolaktinu a určité reexpanzi nádoru. Monitorování zorných polí u pacientů s makroprolaktinomem se proto doporučuje pro včasné rozpoznání ztráty sekundárního pole v důsledku chiasmální herniace a přizpůsobení dávkování léku.
Relativní účinnost Parlodelu oproti chirurgickému zákroku při zachování zorných polí není známa. Pacienti s rychle progredující ztrátou zorného pole by měli být vyšetřeni neurochirurgem, který jim pomůže rozhodnout o nejvhodnější terapii.
Vzhledem k tomu, že těhotenství je často terapeutickým cílem u mnoha hyperprolaktinemických pacientek s amenoreou/galaktoreou a hypogonadismem (neplodností), je pro detekci přítomnosti adenomu vylučujícího prolaktin nezbytné pečlivé vyšetření hypofýzy. Pacientky, které neusilují o otěhotnění, nebo pacientky s rozsáhlými adenomy, by měly být poučeny, aby během léčby přípravkem Parlodel používaly jiné antikoncepční prostředky než perorální antikoncepci. Vzhledem k tomu, že otěhotnění může nastat před opětovným zahájením menstruace, doporučuje se provést těhotenský test alespoň každé 4 týdny během období amenorey a po opětovném zahájení menstruace vždy, když pacientka menstruaci vynechá. Léčba přípravkem Parlodel SnapTabs nebo tobolkami by měla být přerušena, jakmile bylo zjištěno těhotenství. Pacientky musí být během těhotenství pečlivě sledovány, zda se u nich nevyskytují známky a příznaky, které mohou signalizovat zvětšení dříve nedetekovaného nebo existujícího nádoru vylučujícího prolaktin. Přerušení léčby přípravkem Parlodel u pacientů se známými makroadenomy bylo ve většině případů spojeno s rychlým opětovným růstem nádoru a zvýšením sérového prolaktinu.
Výtok z mozkomíšního moku byl pozorován u některých pacientů s adenomy vylučujícími prolaktin léčených Parlodelem.
Akromegalie
U některých akromegalických pacientů léčených Parlodelem byl pozorován digitální vazospasmus citlivý na chlad. Pokud by se odezva objevila, lze ji zvrátit snížením dávky přípravku Parlodel 2,5 mg a lze jí předejít udržováním prstů v teple. Byly hlášeny případy závažného gastrointestinálního krvácení z peptických vředů, některé fatální. Ačkoli neexistují žádné důkazy o tom, že by Parlodel 2,5 mg zvyšoval výskyt peptických vředů u akromegalických pacientů, příznaky naznačující peptický vřed by měly být důkladně vyšetřeny a vhodně léčeny. Pacienti s anamnézou peptického vředu nebo gastrointestinálního krvácení by měli být během léčby přípravkem Parlodel pečlivě sledováni.
několika pacientů byla hlášena možná expanze tumoru během léčby přípravkem Parlodel. Vzhledem k tomu, že přirozená historie nádorů vylučujících růstový hormon není známa, měli by být všichni pacienti pečlivě sledováni, a pokud se objeví známky expanze nádoru, je třeba zvážit přerušení léčby a alternativní postupy.
Parkinsonova choroba
Bezpečnost při dlouhodobém užívání po dobu delší než 2 roky v dávkách požadovaných pro parkinsonismus nebyla stanovena.
Jako u každé chronické terapie se doporučuje pravidelné hodnocení jaterních, hematopoetických, kardiovaskulárních a renálních funkcí. Může se objevit symptomatická hypotenze, a proto je třeba při léčbě pacientů užívajících antihypertenziva postupovat opatrně.
Vysoké dávky Parlodelu 2,5 mg mohou být spojeny se zmateností a duševními poruchami. Protože se u pacientů s parkinsonskou nemocí může projevit mírný stupeň demence, je třeba při léčbě těchto pacientů postupovat opatrně.
Parlodel podávaný samostatně nebo současně s levodopou může způsobit halucinace (zrakové nebo sluchové). Halucinace obvykle vymizí snížením dávky; občas je nutné vysadit Parlodel 2,5 mg. Vzácně po vysokých dávkách přetrvávaly halucinace několik týdnů po vysazení Parlodelu.
Stejně jako u levodopy je třeba opatrnosti při podávání Parlodelu pacientům s anamnézou infarktu myokardu, kteří mají reziduální síňovou, nodální nebo ventrikulární arytmii.
Retroperitoneální fibróza byla hlášena u několika pacientů, kteří dostávali dlouhodobou léčbu (2 až 10 let) přípravkem Parlodel 2,5 mg v dávkách v rozmezí 30-140 mg denně.
Epidemiologické studie prokázaly, že pacienti s Parkinsonovou nemocí mají vyšší riziko (2 přibližně 6krát vyšší) rozvoje melanomu než běžná populace. Není jasné, zda pozorované zvýšené riziko bylo způsobeno Parkinsonovou chorobou nebo jinými faktory, jako jsou léky používané k léčbě Parkinsonovy choroby. Z výše uvedených důvodů se pacientům a poskytovatelům doporučuje často a pravidelně monitorovat výskyt melanomů při použití Parlodelu v jakékoli indikaci. V ideálním případě by pravidelné kožní prohlídky měli provádět příslušně kvalifikovaní jedinci (např. dermatologové).
Vysazování Parlodelu by mělo být prováděno postupně, kdykoli je to možné, i když má pacient zůstat na levodopě. V souvislosti s rychlým snížením dávky, vysazením nebo změnami antiparkinsonické léčby byl hlášen komplex příznaků připomínající neuroleptický maligní syndrom (charakterizovaný zvýšenou teplotou, svalovou rigiditou, změněným vědomím a autonomní nestabilitou), bez jiné zjevné etiologie.
Příznaky zahrnující apatii, úzkost, depresi, únavu, nespavost, pocení a bolest byly hlášeny během snižování dávky nebo po vysazení agonistů dopaminu, včetně Parlodelu. Tyto příznaky obecně nereagují na levodopu. Před vysazením Parlodelu by měli být pacienti informováni o možných abstinenčních příznacích a během a po vysazení Parlodelu by měli být pečlivě sledováni. V případě závažných abstinenčních příznaků lze zvážit opětovné podání agonisty dopaminu v nejnižší účinné dávce.
Karcinogeneze, mutageneze, zhoršení plodnosti
74týdenní studie byla provedena na myších s použitím dietních hladin bromokriptin mesylátu ekvivalentních perorálním dávkám 10 a 50 mg/kg/den. Byla provedena 100týdenní studie na potkanech s použitím dietních hladin ekvivalentních perorálním dávkám 1,7, 9,8 a 44 mg/kg/den. Nejvyšší dávky testované u myší a potkanů byly přibližně 2,5krát a 4,4krát vyšší než maximální dávka pro člověka podaná v kontrolovaných klinických studiích (100 mg/den) na základě plochy povrchu těla. Zhoubné nádory dělohy, endometria a myometria, byly nalezeny u potkanů následovně: 0/50 kontrolních samic, 2/50 samic dostávajících 1,7 mg/kg denně, 7/49 samic dostávajících 9,8 mg/kg denně a 9/50 samic dostávalo 44 mg/kg denně. Výskyt těchto novotvarů je pravděpodobně způsoben vysokým poměrem estrogen/progesteron, který se vyskytuje u krys v důsledku účinku bromokriptin mesylátu inhibujícího prolaktin. Endokrinní mechanismy, o kterých se předpokládá, že se podílejí na potkanech, nejsou u lidí přítomny. Není známa žádná korelace mezi malignitami dělohy vyskytujícími se u potkanů léčených bromokriptinem a rizikem pro člověka. Na rozdíl od nálezů u krys, dělohy z myší usmrcených po 74 týdnech léčby nevykazovaly známky změn souvisejících s lékem.
Bromokriptin mesylát byl hodnocen z hlediska mutagenního potenciálu v řadě testů, které zahrnovaly test Amesovy bakteriální mutace, mutagenní aktivitu in vitro na fibroblastech čínského křečka V79, cytogenetickou analýzu buněk kostní dřeně čínského křečka po léčbě in vivo a mikronukleární test in vivo na mutagenní potenciál u myší.
V žádném z těchto testů nebyly získány žádné mutagenní účinky.
Fertilita a reprodukční výkon u samic potkanů nebyly nepříznivě ovlivněny léčbou bromokriptinem nad předpokládaný pokles hmotnosti mláďat v důsledku potlačení laktace. U samců léčených 50 mg/kg tohoto léku byly páření a plodnost v normálním rozmezí. Zvýšená perinatální ztráta byla způsobena v podskupinách samic, utracených 21. den po porodu (pp) po páření se samci léčenými nejvyšší dávkou (50 mg/kg).
Těhotenství
Kategorie B
Podání 10-30 mg/kg bromokriptinu 2 kmenům krys ve dnech 6 až 15 postkoitum (pc) stejně jako jedna dávka 10 mg/kg v den 5 narušilo nidaci. Tři mg/kg podané ve dnech 6 až 15 neměly účinek na nidaci a nevyvolaly žádné anomálie. U zvířat léčených od 8. do 15. dne, tj. po implantaci, vyvolalo 30 mg/kg zvýšenou prenatální mortalitu ve formě zvýšeného výskytu embryonální resorpce. Jedna anomálie, aplazie páteřních obratlů a žeber, byla nalezena ve skupině 262 plodů pocházejících z samic léčených 30 mg/kg bromokriptinu. U potomků samic léčených během peri- nebo postnatálního období nebyly zjištěny žádné fetotoxické účinky.
Byly provedeny dvě studie na králících (2 kmeny) ke stanovení potenciálu interferovat s nidací. Hladiny dávek 100 nebo 300 mg/kg/den od 1. do 6. dne neovlivnily nepříznivě nidaci. Vysoká dávka byla přibližně 63násobkem maximální dávky u člověka podávané v kontrolovaných klinických studiích (100 mg/den), na základě plochy povrchu těla. U bílých králíků z Nového Zélandu došlo k určité úmrtnosti embryí při dávce 300 mg/kg, což bylo odrazem zjevné mateřské toxicity. Byly provedeny tři studie na 2 kmenech králíků za účelem stanovení teratologického potenciálu bromokriptinu v dávkách 3, 10, 30, 100 a 300 mg/kg podaných od 6. do 18. dne. Ve 2 studiích se žluto-stříbrným kmenem rozštěp patra byl nalezen u 3 a 2 plodů při dávkách toxických pro matku 100 a 300 mg/kg, v daném pořadí. Jeden kontrolní plod také vykazoval tuto anomálii. Ve třetí studii provedené s novozélandskými bílými králíky za použití identického protokolu nebyly vytvořeny žádné rozštěpy patra.
žádného ze 6 potomků 6 opic nebyly při dávce 2 mg/kg vyvolány žádné teratologické nebo embryotoxické účinky bromokriptinu.
Byly shromážděny informace týkající se 1276 těhotenství u žen užívajících Parlodel. Ve většině případů byl Parlodel vysazen do 8 týdnů těhotenství (průměrně 28,7 dne), avšak 8 pacientek dostávalo lék nepřetržitě po celou dobu těhotenství. Průměrná denní dávka pro všechny pacienty byla 5,8 mg (rozmezí 1-40 mg).
Z těchto 1276 těhotenství bylo 1088 donošených (4 mrtvě narozené), 145 samovolných potratů (11,4 %) a 28 umělých potratů (2,2 %). Navíc 12 extrauterinních gravidit a 3 hydatidiformní moly (dvakrát u stejné pacientky) způsobily předčasné ukončení těhotenství. Tato data jsou příznivě srovnatelná s mírou potratů (11 % -25 %) uváděnou pro těhotenství indukovaná klomifen citrátem, menopauzálním gonadotropinem a choriovým gonadotropinem.
Ačkoli spontánní potraty často zůstávají nehlášené, zejména před 20. týdnem těhotenství, jejich frekvence se odhaduje na 15 %.
Incidence vrozených vad v populaci se obecně pohybuje od 2 % do 4,5 %. Incidence u 1109 živě narozených od pacientů užívajících bromokriptin je 3,3 %.
Neexistuje žádný náznak, že by Parlodel 2,5 mg přispíval k typu nebo výskytu vrozených vad u této skupiny kojenců.
Kojící matky
Parlodel 2,5 mg by se neměl používat během kojení u žen po porodu.
Pediatrické použití
Bezpečnost a účinnost bromokriptinu pro léčbu adenomů hypofýzy secernujících prolaktin byla stanovena u pacientů ve věku 16 až dospělých. Nejsou k dispozici žádné údaje o použití bromokriptinu u pediatrických pacientů mladších 8 let. Jeden 8letý pacient léčený bromokriptinem pro makroadenom hypofýzy secernující prolaktin byl hlášen bez terapeutické odpovědi.
Použití bromokriptinu k léčbě adenomů vylučujících prolaktin u pediatrických pacientů ve věkové skupině 11 až 16 let je podpořeno důkazy z dobře kontrolovaných studií u dospělých s dalšími údaji u omezeného počtu (n=14) dětí a dospívající ve věku 11 až 15 let s makro- a mikroadenomy hypofýzy vylučujícími prolaktin, kteří byli léčeni bromokriptinem. Ze 14 hlášených pacientů mělo 9 úspěšných výsledků, 3 částečné odpovědi a 2 nereagovali na léčbu bromokriptinem. Chronický hypopituitarismus komplikoval léčbu makroadenomu u 5 respondentů, a to jak u pacientů užívajících samotný bromokriptin, tak u těch, kteří dostávali bromokriptin v kombinaci s chirurgickou léčbou a/nebo ozařováním hypofýzy.
Bezpečnost a účinnost bromokriptinu u pediatrických pacientů nebyla stanovena pro žádnou jinou indikaci uvedenou v části INDIKACE A POUŽITÍ.
Geriatrické použití
Klinické studie pro Parlodel 2,5 mg nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda starší reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti, včetně hlášení nežádoucích účinků po uvedení přípravku na trh, však nezjistily rozdíly v odpovědi nebo snášenlivosti mezi staršími a mladšími pacienty. I když nebyly pozorovány žádné rozdíly v účinnosti nebo profilu nežádoucích účinků u geriatrických pacientů užívajících Parlodel 2,5 mg, nelze kategoricky vyloučit větší citlivost některých starších jedinců. Obecně by měl být výběr dávky pro staršího pacienta opatrný, počínaje spodním koncem dávkovacího rozmezí, odrážející vyšší frekvenci snížené jaterní, renální nebo srdeční funkce a souběžného onemocnění nebo jiné farmakoterapie v této populaci.
PŘEDÁVKOVAT
Nejčastěji hlášené známky a příznaky spojené s akutním předávkováním Parlodelem (bromokriptin mesylát) jsou: nevolnost, zvracení, zácpa, pocení, závratě, bledost, těžká hypotenze, malátnost, zmatenost, letargie, ospalost, bludy, halucinace a opakované zívání. Smrtelná dávka nebyla stanovena a léčivo má velmi široké rozpětí bezpečnosti. K jednomu úmrtí však došlo u pacienta, který spáchal sebevraždu neznámým množstvím Parlodelu 2,5 mg a chlorochinu.
Léčba předávkování spočívá v odstranění léku zvracením (pokud je při vědomí), výplachem žaludku, aktivním uhlím nebo fyziologickým roztokem katarze. Nezbytný je pečlivý dohled a zaznamenávání příjmu a výdeje tekutin. Hypotenze by měla být léčena uložením pacienta do Trendelenburgovy polohy a podáním IV tekutin. Pokud nelze dosáhnout uspokojivé úlevy od hypotenze použitím výše uvedených opatření v jejich plném rozsahu, je třeba zvážit použití vazopresorů.
Ojediněle byly hlášeny případy dětí, které náhodně požily Parlodel. Zvracení, somnolence a horečka byly hlášeny jako nežádoucí účinky. Pacienti se uzdravili buď spontánně během několika hodin, nebo po vhodné léčbě.
KONTRAINDIKACE
Hypersenzitivita na bromokriptin nebo na kteroukoli pomocnou látku přípravku Parlodel (bromokriptin mesylát), nekontrolovaná hypertenze a citlivost na jakékoli námelové alkaloidy. U pacientek léčených pro hyperprolaktinémii by měl být Parlodel 2,5 mg vysazen, když je diagnostikováno těhotenství (viz OPATŘENÍ , Hyperprolaktinemické stavy ). V případě, že je Parlodel 2,5 mg znovu nasazen ke kontrole rychle se rozšiřujícího makroadenomu (viz OPATŘENÍ , Hyperprolaktinemické stavy a pacientka má těhotenskou hypertenzní poruchu, musí být zvážen přínos pokračování Parlodelu oproti možnému riziku jeho užívání během těhotenství s hypertenzní poruchou. Pokud se Parlodel používá k léčbě akromegalie, prolaktinomu nebo Parkinsonovy choroby u pacientek, které následně otěhotní, je třeba rozhodnout, zda je léčba nadále z lékařského hlediska nezbytná nebo zda ji lze ukončit. Pokud se pokračuje, měl by být lék vysazen u těch, u kterých se mohou objevit hypertenzní poruchy v těhotenství (včetně eklampsie, preeklampsie nebo těhotenstvím indukované hypertenze), pokud není vysazení Parlodelu považováno za lékařsky kontraindikované.
Lék by neměl být používán během poporodního období u žen s anamnézou ischemické choroby srdeční a jiných závažných kardiovaskulárních onemocnění, pokud vysazení není považováno za lékařsky kontraindikované. Pokud je lék užíván v poporodním období, pacient by měl být pečlivě sledován.
KLINICKÁ FARMAKOLOGIE
Parlodel (bromokriptin mesylát) je agonista dopaminového receptoru, který aktivuje postsynaptické dopaminové receptory. Dopaminergní neurony v tuberoinfundibulárním procesu modulují sekreci prolaktinu z předního laloku hypofýzy sekrecí prolaktinového inhibičního faktoru (považovaného za dopamin); v corpus striatum se dopaminergní neurony účastní řízení motorických funkcí. Klinicky Parlodel 2,5 mg významně snižuje plazmatické hladiny prolaktinu u pacientů s fyziologicky zvýšeným prolaktinem a také u pacientů s hyperprolaktinemií. Inhibice fyziologické laktace stejně jako galaktorey při patologických hyperprolaktinemických stavech se dosahuje v dávkách, které neovlivňují sekreci jiných tropních hormonů z předního laloku hypofýzy. Experimenty ukázaly, že bromokriptin vyvolává dlouhodobé stereotypní chování u hlodavců a otáčivé chování u potkanů s jednostrannými lézemi v substantia nigra. Tyto účinky, charakteristické pro účinky produkované dopaminem, jsou inhibovány antagonisty dopaminu a naznačují přímý účinek bromokriptinu na striatální dopaminové receptory.
Bromokriptin mesylát je nehormonální, nestrogenní látka, která inhibuje sekreci prolaktinu u lidí, s malým nebo žádným účinkem na ostatní hormony hypofýzy, s výjimkou pacientů s akromegalií, kde u většiny pacientů snižuje zvýšené hladiny růstového hormonu v krvi.
Bromokriptin mesylát vytváří svůj terapeutický účinek při léčbě Parkinsonovy choroby, klinického stavu charakterizovaného progresivním nedostatkem syntézy dopaminu v substantia nigra, přímou stimulací dopaminových receptorů v corpus striatum. Na rozdíl od toho levodopa uplatňuje svůj terapeutický účinek pouze po konverzi na dopamin neurony substantia nigra, o kterých je známo, že jsou v této populaci pacientů numericky zmenšeny.
Farmakokinetika
Vstřebávání
Po podání jednorázové dávky tablet Parlodel 2,5 mg, 2 x 2,5 mg 5 zdravým dobrovolníkům nalačno, byly průměrné maximální plazmatické hladiny bromokriptinu, doba k dosažení maximálních plazmatických koncentrací a poločas eliminace 465 pg/ml ± 226, 2,5 hod ± 2, resp. 4,85 hod.1 Byl nalezen lineární vztah mezi jednotlivými dávkami Parlodelu 2,5 mg a Cmax a AUC v rozmezí dávek 1 až 7,5 mg.2 Farmakokinetika metabolitů bromokriptinu nebyla popsána.
Jídlo významně neovlivnilo systémovou expozici bromokriptinu po podání tablet Parlodel, 2,5 mg.3 Doporučuje se užívat Parlodel 2,5 mg s jídlem kvůli vysokému procentu subjektů, které zvracejí po podání bromokriptinu nalačno.
Po Parlodelu 5 mg podávaném dvakrát denně po dobu 14 dnů byly Cmax bromokriptinu a AUC v ustáleném stavu 628 ± 375 pg/ml a 2377 ± 1186 pg*h/ml, v tomto pořadí.4
Rozdělení
Experimenty in vitro ukázaly, že bromokriptin byl z 90 % až 96 % vázán na sérový albumin.
Metabolismus
Bromokriptin prochází rozsáhlou biotransformací při prvním průchodu játry, což se odráží v komplexních metabolitových profilech a v téměř úplné absenci původního léčiva v moči a stolici.
Studie in vitro s použitím lidských jaterních mikrozomů ukázaly, že bromokriptin má vysokou afinitu k CYP3A a hydroxylace na prolinovém kruhu cyklopeptidové skupiny tvořily hlavní metabolickou cestu.5 Inhibitory a/nebo silné substráty pro CYP3A4 by proto mohly inhibovat clearance bromokriptinu a olova. na zvýšené úrovně. (vidět OPATŘENÍ , DROGOVÉ INTERAKCE sekce). Účast dalších hlavních enzymů CYP jako 2D6, 2C8 a 2C19 na metabolismu bromokriptinu nebyla hodnocena. Bromokriptin je také inhibitorem CYP3A4 s vypočtenou hodnotou IC50 1,69 μM.6 Vzhledem k nízkým terapeutickým koncentracím bromokriptinu u pacientů (Cmax=0,82 nM) by neměla významná změna metabolismu druhého léčiva, jehož clearance je zprostředkována CYP3A4 být očekáván. Potenciální účinek bromokriptinu a jeho metabolitů působit jako induktory enzymů CYP nebyl popsán.
Vylučování
Asi 82 % a 5,6 % perorálně podané radioaktivní dávky bylo nalezeno ve stolici a v moči. Kyselina bromolysergová a kyselina bromoizolysergová tvoří polovinu radioaktivity v moči.5
Specifické populace
Vliv Renální Poškození
Vliv funkce ledvin na farmakokinetiku bromokriptinu nebyl hodnocen.
Vzhledem k tomu, že původní léčivo a metabolity jsou téměř úplně vylučovány prostřednictvím metabolismu a pouze 6 % eliminováno ledvinami, poškození ledvin nemusí mít významný dopad na farmakokinetiku bromokriptinu a jeho metabolitů (viz OPATŘENÍ , Všeobecné ).
Účinek Poškození jater
Vliv poškození jater na PK Parlodelu a jeho metabolitů nebyl hodnocen. Vzhledem k tomu, že Parlodel je eliminován hlavně metabolismem, může poškození jater zvýšit plazmatické hladiny bromokriptinu, proto může být nutná opatrnost (viz OPATŘENÍ , Všeobecné ).
Vliv věku, rasy a pohlaví na farmakokinetiku bromokriptinu a jeho metabolitů nebyl hodnocen.
Klinické studie
Asi v 75 % případů amenorey a galaktorey terapie Parlodelem 2,5 mg zcela nebo téměř úplně potlačí galaktoreu a znovu zahájí normální ovulační menstruační cykly.
Menstruace je obvykle znovu zahájena před úplným potlačením galaktorey; doba na to je v průměru 6 až 8 týdnů. Někteří pacienti však zareagují během několika dní a jiným to může trvat až 8 měsíců.
Kontrola galaktorey může trvat déle v závislosti na stupni stimulace prsní tkáně před léčbou. Po 8 až 12 týdnech je obvykle pozorováno alespoň 75% snížení sekrece. Někteří pacienti nemusí reagovat ani po 12 měsících léčby.
U mnoha akromegalických pacientů způsobuje Parlodel 2,5 mg rychlé a trvalé snížení cirkulujících hladin růstového hormonu v séru.
1 Nelson, M. et. al. (1990). Farmakokinetické hodnocení erythromycinu a kofeinu podávaných s bromokriptinem. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz a kol. (1980). Farmakokinetika bromokriptinu u člověka. In: Golstein, M. Calne, DB, et. Al (eds.). Námelové sloučeniny a funkce mozku: Neuroendokrinní a neuropsychiatrické aspekty, str. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic,J. (1991). Vliv potravy a metoklopramidu na farmakokinetiku a vedlejší účinky bromokriptinu. Eur J Drug Metab Pharmacokinet; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E., and Jervell, J., (1994). Srovnání oktreotidu, bromokriptinu nebo kombinace obou léků u akromegalie. Journal of Clinical Endocrinology & Metabolism; Vol 79, 461-465
5 Peyronneau MA, Delaforge M, Riviere R a kol. 1994. Vysoká afinita ergopeptidů k CYP P450 3A. Význam jejich peptidové části pro rozpoznání P450 a hydroxylaci bromokriptinu. Eur J Biochem 223:947-56.
Wynalda, MA, Wienkers, LC (1997). Hodnocení potenciálních interakcí mezi agonisty dopaminového receptoru a různými lidskými enzymy cytochromu P450 pomocí jednoduchého in vitro inhibičního screeningu. Drug Metab Dispos; 25:1211-14.
INFORMACE PRO PACIENTA
Během klinických studií byly na počátku léčby přípravkem Parlodel 2,5 mg hlášeny závratě, ospalost, mdloby, mdloby a synkopy. V postmarketingových hlášeních byl přípravek Parlodel spojován s ospalostí a epizodami náhlého nástupu spánku, zejména u pacientů s Parkinsonovou chorobou. Velmi vzácně byl hlášen náhlý nástup spánku během denních činností, v některých případech bez vědomí nebo varovných příznaků. Všichni pacienti užívající Parlodel by měli být varováni, pokud jde o zapojení do činností vyžadujících rychlé a přesné reakce, jako je řízení automobilu nebo obsluha strojů. Pacienti léčení Parlodelem 2,5 mg, u nichž se objevuje ospalost a/nebo epizody náhlého spánku, musí být upozorněni, aby neřídili ani neprováděli činnosti, při kterých by zhoršená bdělost mohla vystavit je nebo jiné riziku vážného zranění nebo smrti (např. obsluha strojů).
Pacienti užívající Parlodel 2,5 mg pro hyperprolaktinemické stavy spojené s makroadenomem nebo ti, kteří podstoupili předchozí transsfenoidální operaci, by měli být informováni, aby hlásili svému lékaři jakýkoli přetrvávající vodnatý výtok z nosu. Pacienti užívající Parlodel 2,5 mg k léčbě makroadenomu by měli být informováni, že přerušení léčby může být spojeno s rychlým opětovným růstem nádoru a recidivou jejich původních příznaků.
Pacienti a jejich pečovatelé by měli být upozorněni na možnost, že pacienti mohou pociťovat intenzivní nutkání nekontrolovatelně utrácet peníze, intenzivní touhy hrát hazardní hry, zvýšené sexuální touhy a další intenzivní touhy a neschopnost ovládat tato nutkání během užívání přípravku Parlodel. Poraďte pacientům a jejich pečovatelům, aby informovali svého poskytovatele zdravotní péče, pokud se u nich během léčby Parlodelem objeví nové nebo zvýšené nekontrolované výdaje, touhy po hazardních hrách, sexuální touhy nebo jiné touhy [viz OPATŘENÍ ].
Zejména během prvních dnů léčby se mohou příležitostně objevit hypotenzní reakce, které mají za následek sníženou bdělost, zvláštní opatrnosti je třeba věnovat řízení vozidla nebo obsluze strojů.
Informujte pacienty, aby kontaktovali svého poskytovatele zdravotní péče, pokud si přejí ukončit užívání přípravku Parlodel nebo snížit dávku přípravku Parlodel. Informujte pacienty, kterým byla předepsána nižší dávka nebo kterým byl lék vysazen, aby informovali svého poskytovatele zdravotní péče, pokud mají abstinenční příznaky, jako je horečka, svalová ztuhlost, změněné vědomí, apatie, úzkost, deprese, únava, nespavost, pocení nebo bolest (viz OPATŘENÍ ).
