Celebrex 100mg, 200mg Celecoxib Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Celebrex 100 mg a jak se používá?
Celebrex 200 mg je lék na předpis používaný k léčbě příznaků akutní bolesti nebo zánětu. Celebrex lze užívat samostatně nebo s jinými léky.
Celebrex 100 mg patří do třídy léků nazývaných nesteroidní protizánětlivé léky (NSAID).
Není známo, zda je přípravek Celebrex bezpečný a účinný u dětí mladších 2 let.
Jaké jsou možné vedlejší účinky přípravku Celebrex 100 mg?
Celebrex 200 mg může způsobit závažné nežádoucí účinky, včetně:
- otok,
- rychlý nárůst hmotnosti,
- dušnost,
- krvavá nebo dehtovitá stolice,
- vykašlávání krve nebo zvratků, které vypadají jako kávová sedlina,
- nevolnost,
- bolest břicha v pravé horní části,
- svědění,
- únava,
- tmavá moč,
- zežloutnutí kůže nebo očí (žloutenka),
- malé nebo žádné močení,
- otoky nohou nebo kotníků,
- cítit se unaveně,
- bledá kůže,
- závratě a
- studené ruce a nohy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Celebrex patří:
- bolest břicha,
- pálení žáhy,
- plyn,
- průjem,
- zácpa,
- nevolnost,
- zvracení,
- otoky rukou nebo nohou,
- závratě, an
- d
- příznaky nachlazení (ucpaný nos, kýchání, bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Celebrex. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
RIZIKO VÁŽNÝCH KARDIOVASKULÁRNÍCH A GASTROINTESTINÁLNÍCH PŘÍHOD
Kardiovaskulární trombotické příhody
- Nesteroidní protizánětlivé léky (NSAID) způsobují zvýšené riziko závažných kardiovaskulárních trombotických příhod, včetně infarktu myokardu a mrtvice, které mohou být smrtelné. Toto riziko se může objevit na začátku léčby a může se zvyšovat s délkou užívání. [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
- CELEBREX je kontraindikován při operaci bypassu koronární artérie (CABG). [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
Gastrointestinální krvácení, ulcerace a perforace
- NSAID způsobují zvýšené riziko závažných gastrointestinálních (GI) nežádoucích příhod včetně krvácení, ulcerace a perforace žaludku nebo střev, které mohou být fatální. Tyto události se mohou objevit kdykoli během používání a bez varovných příznaků. Starší pacienti a pacienti s předchozí anamnézou peptického vředu a/nebo GI krvácení jsou vystaveni většímu riziku závažných (GI) příhod. [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
POPIS
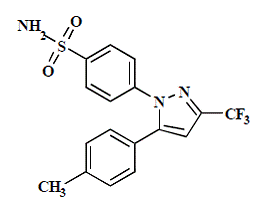
CELEBREX (celecoxib) kapsle je nesteroidní protizánětlivé léčivo, dostupné jako kapsle obsahující 50 mg, 100 mg, 200 mg a 400 mg celekoxibu pro perorální podání. Chemický název je 4-[5-(4-methylfenyl)-3-(trifluormethyl)-lH-pyrazol-l-yl]benzensulfonamid a je to pyrazol substituovaný diarylem. Molekulová hmotnost je 381,38. Jeho molekulární vzorec je C17H14F3N3O2S a má následující chemickou strukturu:
Celecoxib je bílý až téměř bílý prášek s pKa 11,1 (sulfonamidová skupina). Celecoxib je hydrofobní (log P je 3,5) a je prakticky nerozpustný ve vodném prostředí při fyziologickém pH.
Mezi neúčinné složky přípravku CELEBREX 200 mg patří: sodná sůl kroskarmelózy, jedlé inkousty, želatina, monohydrát laktózy, magnesium-stearát, povidon a natrium-laurylsulfát.
INDIKACE
Je indikován CELEBREX
Osteoartritida (OA)
Pro léčbu známek a symptomů OA [viz Klinické studie ].
Revmatoidní artritida (RA)
Pro léčbu známek a symptomů RA [viz Klinické studie ].
Juvenilní revmatoidní artritida (JRA)
Pro léčbu známek a příznaků JRA u pacientů ve věku 2 let a starších [viz Klinické studie ].
Ankylozující spondylitida (AS)
Pro léčbu známek a symptomů AS [viz Klinické studie ].
Akutní bolest
Pro zvládání akutní bolesti u dospělých [viz Klinické studie ].
Primární dysmenorea
Pro léčbu primární dysmenorey [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Všeobecné pokyny pro dávkování
Před rozhodnutím o použití přípravku CELEBREX pečlivě zvažte potenciální přínosy a rizika přípravku CELEBREX a dalších možností léčby. Použijte nejnižší účinnou dávku po co nejkratší dobu v souladu s individuálními cíli léčby pacienta [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Tyto dávky lze podávat bez ohledu na načasování jídla.
Osteoartróza
Pro OA je dávka 200 mg denně podávaná jako jedna dávka nebo jako 100 mg dvakrát denně.
Revmatoidní artritida
Pro RA je dávka 100 mg až 200 mg dvakrát denně.
Juvenilní revmatoidní artritida
U JRA je dávkování pro pediatrické pacienty (ve věku 2 let a starší) založeno na hmotnosti. Pro pacienty ≥10 kg až ≤25 kg je doporučená dávka 50 mg dvakrát denně. Pro pacienty >25 kg je doporučená dávka 100 mg dvakrát denně.
Pro pacienty, kteří mají potíže s polykáním tobolek, lze obsah tobolky CELEBREX přidat do jablečného pyré. Celý obsah kapsle se opatrně vysype na zarovnanou čajovou lžičku studeného jablečného pyré nebo jablečného pyré o pokojové teplotě a ihned se zapije vodou. Obsah kapslí na jablečném pyré je stabilní až 6 hodin v chlazených podmínkách (2°C až 8°C/35°F až 45°F).
Ankylozující spondylitida
AS je dávka přípravku CELEBREX 200 mg denně v jedné (jednou denně) nebo rozdělených (dvakrát denně) dávkách. Pokud není po 6 týdnech pozorován žádný účinek, může být užitečné vyzkoušet 400 mg denně. Pokud není pozorován žádný účinek po 6 týdnech při dávce 400 mg denně, odpověď není pravděpodobná a je třeba zvážit alternativní možnosti léčby.
Léčba akutní bolesti a léčba primární dysmenorey
Pro zvládání akutní bolesti a léčbu primární dysmenorey je počáteční dávka 400 mg, po které v případě potřeby první den následuje další dávka 200 mg. V následujících dnech je doporučená dávka 200 mg dvakrát denně podle potřeby.
Zvláštní populace
Poškození jater
U pacientů se středně těžkou poruchou funkce jater (Child-Pugh třída B) snižte dávku o 50 %. Použití přípravku CELEBREX 100 mg u pacientů s těžkou poruchou funkce jater se nedoporučuje (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací , a KLINICKÁ FARMAKOLOGIE ].
Slabé metabolizátory substrátů CYP2C9
dospělých pacientů, o kterých je známo nebo je podezření, že jsou pomalí metabolizátoři CYP2C9 na základě genotypu nebo předchozí anamnézy/zkušenosti s jinými substráty CYP2C9 (jako je warfarin, fenytoin), zahajte léčbu polovinou nejnižší doporučené dávky.
U pacientů s JRA, o kterých je známo nebo je podezření, že jsou pomalí metabolizátoři CYP2C9, zvažte použití alternativní léčby (viz Použití ve specifických populacích a KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
CELEBREX (celecoxib) tobolky:
50 mg bílá s bílým potištěným rubem na červeném pruhu těla a víčku s označením 7767 na víčku a 50 na těle.
100 mg bílá s bílým potiskem na modrém proužku těla a víčku s označením 7767 na víčku a 100 na těle.
200 mg bílá, s reverzním tištěným bílým na zlatém pásku s označením 7767 na uzávěru a 200 na těle.
400 mg bílá, s rubem vytištěným bílým na zeleném pruhu s označením 7767 na uzávěru a 400 na těle.
Skladování A Manipulace
CELEBREX (celecoxib) 50 mg tobolky jsou bílé s bílým potiskem na červeném proužku těla a víčku s označením 7767 na víčku a 50 na těle, dodávané jako:
CELEBREX (celecoxib) 100 mg tobolky jsou bílé s bílým potištěným rubem na modrém proužku těla a víčku s označením 7767 na víčku a 100 na těle, dodávané jako:
CELEBREX (celecoxib) 200 mg tobolky jsou bílé, s reverzně potištěným bílým na zlatém pásku s označením 7767 na víčku a 200 na těle, dodávané jako:
CELEBREX (celecoxib) 400 mg tobolky jsou bílé, se zadním potištěným bílým na zeleném pruhu s označením 7767 na theca a 400 na těle, dodávané jako:
Úložný prostor
Skladujte při pokojové teplotě 20 °C až 25 °C (68 °F až 77 °F); povolené odchylky mezi 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ].
Distribuce: GD Searle LLC, divize společnosti Pfizer Inc, NY, NY 10017. Revize: duben 2021
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Kardiovaskulární trombotické příhody [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- GI krvácení, ulcerace a perforace [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypertenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Srdeční selhání a edém [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Renální toxicita a hyperkalémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Anafylaktické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hematologická toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi. Informace o nežádoucích účincích z klinických studií však poskytují základ pro identifikaci nežádoucích příhod, které se zdají souviset s užíváním drog, a pro přibližné míry.
Z pacientů léčených přípravkem CELEBREX v kontrolovaných klinických studiích před uvedením přípravku na trh bylo přibližně 4 250 pacientů s OA, přibližně 2 100 pacientů s RA a přibližně 1 050 pacientů s pooperační bolestí. Více než 8 500 pacientů dostávalo celkovou denní dávku přípravku CELEBREX 200 mg 200 mg (100 mg dvakrát denně nebo 200 mg jednou denně) nebo více, včetně více než 400 pacientů léčených dávkou 800 mg (400 mg dvakrát denně). Přibližně 3 900 pacientů dostávalo CELEBREX v těchto dávkách po dobu 6 měsíců nebo déle; přibližně 2 300 z nich jej obdrželo po dobu 1 roku nebo déle a 124 z nich jej obdrželo po dobu 2 let nebo déle.
Předmarketingové studie s kontrolovanou artritidou
Tabulka 1 uvádí všechny nežádoucí příhody, bez ohledu na kauzalitu, vyskytující se u ≥ 2 % pacientů užívajících CELEBREX 100 mg z 12 kontrolovaných studií provedených u pacientů s OA nebo RA, které zahrnovaly placebo a/nebo pozitivní kontrolní skupinu. Vzhledem k tomu, že těchto 12 studií mělo různou dobu trvání a pacienti ve studiích nemuseli být exponováni po stejnou dobu, tato procenta nezachycují kumulativní míry výskytu.
V placebem nebo aktivní látkou kontrolovaných klinických studiích byla míra přerušení léčby z důvodu nežádoucích účinků 7,1 % u pacientů užívajících CELEBREX a 6,1 % u pacientů užívajících placebo. Mezi nejčastější důvody pro přerušení kvůli nežádoucím účinkům ve skupinách léčených přípravkem CELEBREX byly dyspepsie a bolesti břicha (uvedené jako důvody pro přerušení u 0,8 % a 0,7 % pacientů s přípravkem CELEBREX). Mezi pacienty, kteří dostávali placebo, 0,6 % přerušilo léčbu kvůli dyspepsii a 0,6 % vysadilo kvůli bolesti břicha.
Následující nežádoucí účinky se vyskytly u 0,1 % až 1,9 % pacientů léčených přípravkem CELEBREX (100 mg až 200 mg dvakrát denně nebo 200 mg jednou denně):
Gastrointestinální: Zácpa, divertikulitida, dysfagie, říhání, ezofagitida, gastritida, gastroenteritida, gastroezofageální reflux, hemoroidy, hiátová kýla, melena, sucho v ústech, stomatitida, tenesmus, zvracení
Kardiovaskulární: Zhoršená hypertenze, angina pectoris, porucha koronárních tepen, infarkt myokardu
Všeobecné: Hypersenzitivita, alergická reakce, bolest na hrudi, cysta NOS, generalizovaný edém, otok obličeje, únava, horečka, návaly horka, příznaky podobné chřipce, bolest, periferní bolest
Centrální, periferní nervový systém: Křeče nohou, hypertonie, hypoestézie, migréna, parestézie, vertigo
Sluch a vestibulární: Hluchota, tinitus
Srdeční frekvence a rytmus: Palpitace, tachykardie
Játra a žluče: Zvýšení jaterních enzymů (včetně zvýšení SGOT, zvýšení SGPT)
Metabolické a nutriční: zvýšení močovinového dusíku v krvi (BUN), zvýšení kreatinfosfokinázy (CPK), hypercholesterolémie, hyperglykémie, hypokalémie, zvýšení NPN, zvýšení kreatininu, zvýšení alkalické fosfatázy, zvýšení hmotnosti
Muskuloskeletální: Artralgie, artróza, myalgie, synovitida, tendinitida
Krevní destičky (krvácení nebo srážení): Ekchymóza, epistaxe, trombocytémie,
psychiatrické: Anorexie, úzkost, zvýšená chuť k jídlu, deprese, nervozita, somnolence
Hemic: Anémie
Respirační: Bronchitida, bronchospasmus, zhoršení bronchospasmu, kašel, dušnost, laryngitida, pneumonie
Kůže a přílohy: Alopecie, dermatitida, fotosenzitivní reakce, pruritus, erytematózní vyrážka, makulopapulární vyrážka, kožní porucha, suchá kůže, zvýšené pocení, kopřivka
Poruchy v místě aplikace: Celulitida, kontaktní dermatitida
Močové: Albuminurie, cystitida, dysurie, hematurie, frekvence močení, ledvinový kámen
Následující závažné nežádoucí příhody (kauzalita nebyla hodnocena) se vyskytly u
Kardiovaskulární: Synkopa, městnavé srdeční selhání, ventrikulární fibrilace, plicní embolie, cerebrovaskulární příhoda, periferní gangréna, tromboflebitida
Gastrointestinální: Střevní obstrukce, perforace střeva, gastrointestinální krvácení, kolitida s krvácením, perforace jícnu, pankreatitida, ileus
Všeobecné: Sepse, náhlá smrt
Játra a žluče: Cholelitiáza
Hemické a lymfatické: Trombocytopenie
Nervový: Ataxie, sebevražda [viz DROGOVÉ INTERAKCE ]
Renální: Akutní selhání ledvin
Celecoxib Long-Term Arthritis Safety Study
[vidět Klinické studie ]
Hematologické příhody: Výskyt klinicky významného snížení hemoglobinu (>2 g/dl) byl nižší u pacientů užívajících přípravek CELEBREX 400 mg dvakrát denně (0,5 %) ve srovnání s pacienty užívajícími buď diklofenak 75 mg dvakrát denně (1,3 %) nebo ibuprofen 800 mg třikrát denně 1,9 %. Nižší výskyt příhod u přípravku CELEBREX byl zachován s použitím aspirinu nebo bez něj [viz KLINICKÁ FARMAKOLOGIE ].
Odstoupení od smlouvy/závažné nežádoucí příhody: Kaplan-Meierův kumulativní podíl po 9 měsících pro vysazení kvůli nežádoucím účinkům u přípravku CELEBREX 100 mg, diklofenaku a ibuprofenu byl 24 %, 29 % a 26 %. Četnost závažných nežádoucích příhod (tj. způsobujících hospitalizaci nebo pocit ohrožení života nebo jinak lékařsky významného), bez ohledu na kauzalitu, se mezi léčebnými skupinami nelišila (8 %, 7 % a 8 %).
Studie juvenilní revmatoidní artritidy
Ve 12týdenní, dvojitě zaslepené, aktivně kontrolované studii bylo 242 pacientů s JRA ve věku 2 až 17 let léčeno celekoxibem nebo naproxenem; 77 pacientů s JRA bylo léčeno celekoxibem 3 mg/kg dvakrát denně, 82 pacientů bylo léčeno celekoxibem 6 mg/kg dvakrát denně a 83 pacientů bylo léčeno naproxenem 7,5 mg/kg dvakrát denně. Nejčastěji se vyskytující (≥5 %) nežádoucí účinky u pacientů léčených celekoxibem byly bolest hlavy, horečka (pyrexie), bolest v horní části břicha, kašel, nazofaryngitida, bolest břicha, nauzea, artralgie, průjem a zvracení. Nejčastěji se vyskytující (≥5 %) nežádoucí účinky u pacientů léčených naproxenem byly bolest hlavy, nauzea, zvracení, horečka, bolest v horní části břicha, průjem, kašel, bolest břicha a závratě (tabulka 2). Ve srovnání s naproxenem neměl celekoxib v dávkách 3 a 6 mg/kg dvakrát denně žádný pozorovatelný škodlivý účinek na růst a vývoj v průběhu 12týdenní dvojitě zaslepené studie. Mezi léčebnými skupinami nebyl žádný podstatný rozdíl v počtu klinických exacerbací uveitidy nebo systémových rysů JRA.
Ve 12týdenní otevřené prodloužené dvojitě zaslepené studii popsané výše bylo 202 pacientů s JRA léčeno celekoxibem v dávce 6 mg/kg dvakrát denně. Výskyt nežádoucích účinků byl podobný jako v průběhu dvojitě zaslepené studie; neobjevily se žádné neočekávané nežádoucí účinky klinického významu.
Další studie před schválením
Nežádoucí příhody ze studií ankylozující spondylitidy
Celkem 378 pacientů bylo léčeno přípravkem CELEBREX 200 mg ve studiích AS kontrolovaných placebem a aktivní látkou. Byly studovány dávky až do 400 mg jednou denně. Typy nežádoucích účinků hlášených ve studiích AS byly podobné těm, které byly hlášeny ve studiích OA/RA.
Nežádoucí příhody ze studií analgezie a dysmenorey
Přibližně 1 700 pacientů bylo léčeno přípravkem CELEBREX 200 mg ve studiích analgezie a dysmenorey. Všichni pacienti ve studiích bolesti po orálním chirurgickém zákroku dostali jednu dávku studovaného léku. Dávky až 600 mg/den přípravku CELEBREX 200 mg byly studovány ve studiích primární dysmenorey a bolesti po ortopedické operaci. Typy nežádoucích účinků ve studiích analgezie a dysmenorey byly podobné těm, které byly hlášeny ve studiích artritidy. Jedinou další hlášenou nežádoucí příhodou byla alveolární osteitida (suchá jamka) po extrakci zubů ve studiích bolesti po orálním chirurgickém zákroku.
Zkušební verze APC a PreSAP
Nežádoucí reakce z dlouhodobých, placebem kontrolovaných studií prevence polypů
Expozice přípravku CELEBREX ve studiích APC a PreSAP byla 400 mg až 800 mg denně po dobu až 3 let (viz Klinické studie ].
Některé nežádoucí účinky se objevily u vyššího procenta pacientů než ve studiích s artritidou před uvedením na trh (doba léčby až 12 týdnů; viz Nežádoucí příhody ze studií kontrolované artritidy před uvedením přípravku CELEBREX 200 mg na trh výše). Nežádoucí účinky, u kterých byly tyto rozdíly u pacientů léčených přípravkem CELEBREX větší ve srovnání s předmarketingovými studiemi s artritidou, byly následující:
Následující další nežádoucí účinky se objevily u ≥ 0,1 % a
Poruchy nervového systému: Mozkový infarkt
Oční poruchy: Sklivce, spojivkové krvácení
Ucho a labyrint: Labyrintitida
Srdeční poruchy: Nestabilní angina pectoris, inkompetence aortální chlopně, ateroskleróza koronárních tepen, sinusová bradykardie, ventrikulární hypertrofie
Cévní poruchy: Hluboká žilní trombóza
Poruchy reprodukčního systému a prsou: Ovariální cysta
Vyšetřování: Zvýšení draslíku v krvi, zvýšení sodíku v krvi, snížení testosteronu v krvi
Zranění, otravy a procedurální komplikace: Epikondylitida, ruptura šlachy
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku CELEBREX po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Kardiovaskulární: Vaskulitida, hluboká žilní trombóza
Všeobecné: Anafylaktoidní reakce, angioedém
Játra a žluče: Nekróza jater, hepatitida, žloutenka, jaterní selhání
Hemické a lymfatické: Agranulocytóza, aplastická anémie, pancytopenie, leukopenie
Metabolické: Hypoglykémie, hyponatrémie
Nervový: Aseptická meningitida, ageuzie, anosmie, fatální intrakraniální krvácení
Renální: Intersticiální nefritida
DROGOVÉ INTERAKCE
Klinicky významné lékové interakce s celekoxibem jsou uvedeny v tabulce 3.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Kardiovaskulární trombotické příhody
Klinické studie několika selektivních a neselektivních NSAID pro cyklooxygenázu-2 (COX-2) trvající až tři roky prokázaly zvýšené riziko závažných kardiovaskulárních (KV) trombotických příhod, včetně infarktu myokardu (MI) a cévní mozkové příhody, které mohou být fatální. Na základě dostupných údajů není jasné, že riziko KV trombotických příhod je u všech NSAID podobné. Relativní nárůst závažných KV trombotických příhod nad výchozí hodnotu způsobený užíváním NSAID se zdá být podobný u pacientů se známým KV onemocněním nebo rizikovými faktory KV onemocnění i bez nich. Pacienti se známým KV onemocněním nebo rizikovými faktory však měli vyšší absolutní incidenci nadměrných závažných KV trombotických příhod, a to kvůli jejich zvýšené výchozí frekvenci. Některé observační studie zjistily, že toto zvýšené riziko závažných KV trombotických příhod začalo již v prvních týdnech léčby. Zvýšení KV trombotického rizika bylo nejkonzistentněji pozorováno při vyšších dávkách.
Ve studii APC (Adenoma Prevention with Celecoxib) bylo ve skupině léčené přípravkem CELEBREX 400 mg dvakrát denně a CELEBREX 200 mg dvakrát denně asi trojnásobně zvýšené riziko složeného cílového ukazatele kardiovaskulární smrti, IM nebo cévní mozkové příhody ve srovnání s placebem. Zvýšení v obou skupinách s dávkou celekoxibu oproti pacientům léčeným placebem bylo způsobeno především zvýšeným výskytem infarktu myokardu (viz Klinické studie ].
Randomizovaná kontrolovaná studie s názvem Prospective Randomized Evaluation of Celecoxib Integrated Safety vs. Ibuprofen or Naproxen (PRECISION) byla provedena za účelem posouzení relativního kardiovaskulárního trombotického rizika inhibitoru COX-2, celekoxibu, ve srovnání s neselektivními NSAID naproxenem a ibuprofenem. Celecoxib 100 mg dvakrát denně byl non-inferiorní než naproxen 375 až 500 mg dvakrát denně a ibuprofen 600 až 800 mg třikrát denně pro složený cílový parametr Antiagregačních studií' Collaboration (APTC), která se skládá z kardiovaskulární smrti (včetně hemoragické smrti), nefatálního infarktu myokardu a nefatální mrtvice [viz Klinické studie ].
Aby se minimalizovalo potenciální riziko nežádoucí KV příhody u pacientů léčených NSAID, používejte nejnižší účinnou dávku po co nejkratší možnou dobu. Lékaři a pacienti by měli zůstat ostražití ohledně rozvoje takových příhod po celou dobu léčby, a to i v případě, že se nevyskytnou předchozí KV symptomy. Pacienti by měli být informováni o příznacích závažných KV příhod a o krocích, které je třeba učinit, pokud k nim dojde.
Neexistují žádné konzistentní důkazy, že současné užívání aspirinu zmírňuje zvýšené riziko závažných kardiovaskulárních trombotických příhod spojených s užíváním NSAID. Současné užívání aspirinu a NSAID, jako je celekoxib, zvyšuje riziko závažných gastrointestinálních (GI) příhod (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Stav po operaci bypassu koronární tepny (CABG).
Dvě velké, kontrolované klinické studie COX-2 selektivního NSAID pro léčbu bolesti v prvních 10 až 14 dnech po operaci CABG zjistily zvýšený výskyt infarktu myokardu a cévní mozkové příhody. NSAID jsou kontraindikována při CABG [viz KONTRAINDIKACE ].
Pacienti po IM
Observační studie provedené v Dánském národním registru prokázaly, že pacienti léčení NSAID v období po IM měli zvýšené riziko reinfarktu, úmrtí související s kardiovaskulárními chorobami a mortalitu ze všech příčin počínaje prvním týdnem léčby. Ve stejné kohortě byla incidence úmrtí v prvním roce po IM 20 na 100 osoboroků u pacientů léčených NSAID ve srovnání s 12 na 100 osoboroků u pacientů neexponovaných NSAID. Přestože absolutní míra úmrtí po prvním roce po infarktu myokardu poněkud poklesla, zvýšené relativní riziko úmrtí u uživatelů NSAID přetrvávalo alespoň po další čtyři roky sledování.
Vyhněte se použití přípravku CELEBREX 100 mg u pacientů s nedávným infarktem myokardu, pokud se neočekává, že přínosy převáží riziko rekurentních KV trombotických příhod. Pokud se CELEBREX používá u pacientů s nedávným infarktem myokardu, sledujte pacienty, zda se u nich nevyskytují známky srdeční ischemie.
Gastrointestinální krvácení, ulcerace a perforace
NSAID, včetně celekoxibu, způsobují závažné gastrointestinální (GI) nežádoucí účinky včetně zánětu, krvácení, ulcerace a perforace jícnu, žaludku, tenkého střeva nebo tlustého střeva, které mohou být fatální. Tyto závažné nežádoucí účinky se mohou u pacientů léčených přípravkem CELEBREX objevit kdykoli, s varovnými příznaky nebo bez nich. Pouze jeden z pěti pacientů, u kterých se vyvine závažný nežádoucí účinek v horní části GI při léčbě NSAID, je symptomatický. Vředy v horní části gastrointestinálního traktu, velké krvácení nebo perforace způsobené NSAID se vyskytly u přibližně 1 % pacientů léčených po dobu 3 až 6 měsíců au přibližně 2 % až 4 % pacientů léčených po dobu jednoho roku. Ani krátkodobá terapie NSA však není bez rizika.
Rizikové faktory GI krvácení, ulcerace a perforace
Pacienti s předchozí anamnézou peptického vředu a/nebo GI krvácení, kteří užívali NSAID, měli více než 10násobně zvýšené riziko rozvoje GI krvácení ve srovnání s pacienty bez těchto rizikových faktorů. Mezi další faktory, které zvyšují riziko GI krvácení u pacientů léčených NSAID, patří delší trvání léčby NSAID; současné užívání perorálních kortikosteroidů, protidestičkových léků (jako je aspirin), antikoagulancií; nebo selektivní inhibitory zpětného vychytávání serotoninu (SSRI); kouření; užívání alkoholu; vyšší věk; a špatný celkový zdravotní stav. Většina postmarketingových hlášení o fatálních gastrointestinálních příhodách se objevila u starších nebo oslabených pacientů. Kromě toho mají pacienti s pokročilým onemocněním jater a/nebo koagulopatií zvýšené riziko GI krvácení.
Výskyt komplikovaných a symptomatických vředů byl 0,78 % po devíti měsících u všech pacientů ve studii CLASS a 2,19 % u podskupiny s nízkou dávkou ASA. Pacienti ve věku 65 let a starší měli incidenci 1,40 % po devíti měsících, 3,06 % při užívání ASA (viz Klinické studie ].
Strategie k minimalizaci GI rizik u pacientů léčených NSAID
- Používejte nejnižší účinnou dávku po co nejkratší možnou dobu.
- Vyhněte se podávání více než jednoho NSAID současně.
- Vyhněte se použití u pacientů s vyšším rizikem, pokud se neočekává, že přínosy převáží zvýšené riziko krvácení. U takových pacientů, stejně jako u pacientů s aktivním gastrointestinálním krvácením, zvažte jinou léčbu než NSAID.
- Během léčby nesteroidními antirevmatiky buďte ostražití na známky a příznaky GI ulcerace a krvácení.
- Pokud je podezření na závažnou gastrointestinální nežádoucí příhodu, okamžitě zahajte vyhodnocení a léčbu a přerušte léčbu přípravkem CELEBREX 200 mg, dokud není závažná gastrointestinální nežádoucí příhoda vyloučena.
- Při současném užívání nízkých dávek kyseliny acetylsalicylové pro srdeční profylaxi sledujte pacienty pečlivěji, zda se u nich neprojeví gastrointestinální krvácení (viz DROGOVÉ INTERAKCE ].
Hepatotoxicita
V klinických studiích bylo u přibližně 1 % pacientů léčených NSAID hlášeno zvýšení ALT nebo AST (trojnásobek nebo vícenásobek horní hranice normy [ULN]). Kromě toho byly hlášeny vzácné, někdy fatální, případy těžkého poškození jater, včetně fulminantní hepatitidy, jaterní nekrózy a jaterního selhání.
Zvýšení ALT nebo AST (méně než trojnásobek ULN) se může objevit až u 15 % pacientů léčených NSAID včetně celekoxibu.
V kontrolovaných klinických studiích s přípravkem CELEBREX 200 mg byl výskyt hraničních zvýšení (větší než nebo rovný 1,2krát a menší než trojnásobek horní hranice normy) jaterních enzymů 6 % u přípravku CELEBREX a 5 % u placeba a přibližně 0,2 % pacientů užívajících CELEBREX a 0,3 % pacientů užívajících placebo mělo výrazné zvýšení ALT a AST.
Informujte pacienty o varovných příznacích a příznacích hepatotoxicity (např. nevolnost, únava, letargie, průjem, pruritus, žloutenka, citlivost v pravém horním kvadrantu a příznaky podobné chřipce). Pokud se rozvinou klinické známky a příznaky odpovídající onemocnění jater nebo pokud se objeví systémové projevy (např. eozinofilie, vyrážka), okamžitě přerušte léčbu přípravkem CELEBREX a proveďte klinické vyšetření pacienta.
Hypertenze
NSAID, včetně přípravku CELEBREX 200 mg, mohou vést k novému nástupu hypertenze nebo ke zhoršení již existující hypertenze, přičemž obojí může přispívat ke zvýšenému výskytu KV příhod. Pacienti užívající inhibitory angiotenzin konvertujícího enzymu (ACE), thiazidová diuretika nebo kličková diuretika mohou mít zhoršenou odpověď na tyto terapie při užívání NSAID (viz DROGOVÉ INTERAKCE ].
Vidět Klinické studie pro další údaje o krevním tlaku pro CELEBREX.
Sledujte krevní tlak (TK) během zahájení léčby NSAID a v průběhu léčby.
Srdeční Selhání A Edém
The Coxib a tradiční NSAID Trialists' Kolaborativní metaanalýza randomizovaných kontrolovaných studií prokázala přibližně dvojnásobný nárůst hospitalizací pro srdeční selhání u pacientů selektivně léčených COX-2 a neselektivních pacientů léčených NSAID ve srovnání s pacienty léčenými placebem. Ve studii dánského národního registru pacientů se srdečním selháním užívání NSAID zvýšilo riziko infarktu myokardu, hospitalizace pro srdeční selhání a úmrtí.
U některých pacientů léčených NSAID byla navíc pozorována retence tekutin a edém. Použití celekoxibu může ztlumit KV účinky několika terapeutických látek používaných k léčbě těchto zdravotních stavů (např. diuretik, ACE inhibitorů nebo blokátorů receptorů angiotenzinu [ARB]) [viz DROGOVÉ INTERAKCE ].
Ve studii CLASS [viz Klinické studie ], kumulativní míry podle Kaplan-Meiera po 9 měsících u pacientů s periferním edémem léčených přípravkem CELEBREX 400 mg dvakrát denně (4násobek a 2násobek doporučených dávek OA a RA), ibuprofen 800 mg třikrát denně a diklofenak 75 mg dvakrát denně byly 4,5 %, 6,9 % a 4,7 %.
Vyhněte se použití přípravku CELEBREX 200 mg u pacientů se závažným srdečním selháním, pokud se neočekává, že přínosy převáží riziko zhoršení srdečního selhání. Pokud se přípravek CELEBREX 100 mg používá u pacientů se závažným srdečním selháním, sledujte pacienty, zda se u nich nevyskytují známky zhoršení srdečního selhání.
Renální toxicita a hyperkalémie
Renální toxicita
Dlouhodobé podávání NSAID vedlo k renální papilární nekróze a jinému poškození ledvin.
Renální toxicita byla také pozorována u pacientů, u kterých mají renální prostaglandiny kompenzační roli při udržování renální perfuze. U těchto pacientů může podávání NSAID způsobit na dávce závislé snížení informací o prostaglandech a sekundárně i renálního průtoku krve, což může urychlit zjevnou renální dekompenzaci. Největší riziko této reakce jsou pacienti s poruchou funkce ledvin, dehydratací, hypovolémií, srdečním selháním, jaterní dysfunkcí, ti, kteří užívají diuretika, ACE inhibitory nebo ARB, a starší lidé. Po přerušení léčby NSAID obvykle následuje návrat do stavu před léčbou.
Z kontrolovaných klinických studií nejsou dostupné žádné informace týkající se použití přípravku CELEBREX 100 mg u pacientů s pokročilým onemocněním ledvin. Renální účinky přípravku CELEBREX mohou urychlit progresi renální dysfunkce u pacientů s již existujícím onemocněním ledvin.
Před zahájením léčby přípravkem CELEBREX upravte stav objemu u dehydratovaných nebo hypovolemických pacientů. Monitorujte renální funkce u pacientů s poruchou funkce ledvin nebo jater, srdečním selháním, dehydratací nebo hypovolémií během užívání přípravku CELEBREX (viz DROGOVÉ INTERAKCE ]. Vyhněte se použití přípravku CELEBREX 200 mg u pacientů s pokročilým onemocněním ledvin, pokud se neočekává, že přínosy převáží riziko zhoršení funkce ledvin. Pokud se přípravek CELEBREX 200 mg používá u pacientů s pokročilým onemocněním ledvin, sledujte pacienty, zda se u nich neobjeví známky zhoršení funkce ledvin.
Hyperkalémie
Při užívání NSAID bylo hlášeno zvýšení koncentrace draslíku v séru, včetně hyperkalémie, a to i u některých pacientů bez poškození ledvin. U pacientů s normální funkcí ledvin byly tyto účinky připisovány ahyporenimicko-hypoaldosteronismu.
Anafylaktické reakce
Celecoxib je spojován s anafylaktickými reakcemi u pacientů se známou hypersenzitivitou na celekoxib i bez ní au pacientů s astmatem citlivým na aspirin. Celebrex 200 mg je sulfonamid a jak NSAID, tak sulfonamidy mohou způsobit alergické reakce včetně anafylaktických příznaků a život ohrožujících nebo méně závažných astmatických epizod u některých vnímavých lidí [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pokud dojde k jakékoli anafylaktické reakci, vyhledejte pohotovostní pomoc.
Exacerbace astmatu souvisejícího s citlivostí na aspirin
Subpopulace pacientů s astmatem může mít astma citlivé na aspirin, které může zahrnovat chronickou rinosinusitidu komplikovanou nosními polypy; těžký, potenciálně fatální bronchospasmus; a/nebo nesnášenlivost aspirinu a jiných NSAID. Protože u takových pacientů citlivých na aspirin byla hlášena zkřížená reaktivita mezi aspirinem a jinými NSAID, CELEBREX je kontraindikován u pacientů s touto formou citlivosti na aspirin (viz KONTRAINDIKACE ]. Pokud se přípravek CELEBREX používá u pacientů s již existujícím astmatem (bez známé citlivosti na kyselinu acetylsalicylovou), sledujte pacienty z hlediska změn známek a příznaků astmatu.
Závažné kožní reakce
Po léčbě přípravkem Celebrex 200 mg se objevily závažné kožní reakce, včetně erythema multiforme, exfoliativní dermatitidy, Stevens-Johnsonova syndromu (SJS), toxické epidermální nekrolýzy (TEN), lékové reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizované exantematózní pustulózy ( AGEP). Tyto závažné události se mohou objevit bez varování a mohou být smrtelné.
Informujte pacienty o známkách a příznacích závažných kožních reakcí a aby přerušili užívání přípravku CELEBREX 100 mg při prvním výskytu kožní vyrážky nebo jakýchkoli jiných příznaků přecitlivělosti. CELEBREX 200 mg je kontraindikován u pacientů s předchozími závažnými kožními reakcemi na NSAID (viz KONTRAINDIKACE ].
Léková reakce s eozinofilií a systémovými příznaky (DRESS)
pacientů užívajících NSAID, jako je CELEBREX, byla hlášena léková reakce s eozinofilií a systémovými příznaky (DRESS). Některé z těchto událostí byly smrtelné nebo život ohrožující. DRESS se typicky, i když ne výlučně, projevuje horečkou, vyrážkou, lymfadenopatií a/nebo otokem obličeje. Jiné klinické projevy mohou zahrnovat hepatitidu, nefritidu, hematologické abnormality, myokarditidu nebo myozitidu. Někdy mohou příznaky DRESS připomínat akutní virovou infekci. Často je přítomna eozinofilie. Vzhledem k tomu, že tato porucha je ve svém projevu proměnlivá, mohou se na ní podílet i jiné orgánové systémy, které zde nejsou uvedeny. Je důležité si uvědomit, že časné projevy přecitlivělosti, jako je horečka nebo lymfadenopatie, mohou být přítomny, i když vyrážka není zjevná. Pokud jsou takové známky nebo příznaky přítomny, přerušte léčbu přípravkem CELEBREX 200 mg a okamžitě pacienta vyhodnoťte.
Fetální toxicita
Předčasné uzavření Fetal Ductus Arteriosus
Vyhněte se užívání NSAID, včetně přípravku CELEBREX 100 mg, u těhotných žen přibližně ve 30. týdnu těhotenství a později. NSAID, včetně přípravku CELEBREX, zvyšují riziko předčasného uzavření ductus arteriosus plodu přibližně v tomto gestačním věku.
Oligohydramnion/novorozenecké poškození ledvin
Užívání NSAID, včetně přípravku CELEBREX, přibližně ve 20. týdnu těhotenství nebo později v těhotenství může způsobit fetální renální dysfunkci vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin. Tyto nežádoucí účinky jsou pozorovány v průměru po dnech až týdnech léčby, ačkoli oligohydramnion byl zřídka hlášen již 48 hodin po zahájení NSAID. Oligohydramnion je často, ale ne vždy, po přerušení léčby reverzibilní. Komplikace prodlouženého oligohydramnia mohou například zahrnovat kontraktury končetin a opožděné dozrávání plic. V některých postmarketingových případech poškození funkce ledvin novorozenců byly vyžadovány invazivní postupy, jako je výměnná transfuze nebo dialýza.
Pokud je léčba NSAID nezbytná mezi 20. a 30. týdnem těhotenství, omezte užívání přípravku CELEBREX na nejnižší účinnou dávku a na nejkratší možnou dobu. Pokud léčba přípravkem CELEBREX přesáhne 48 hodin, zvažte ultrazvukové monitorování plodové vody. Pokud se objeví oligohydramnion, přerušte léčbu přípravkem CELEBREX a sledujte podle klinické praxe [viz Použití u konkrétních populací ].
Hematologická toxicita
U pacientů léčených NSAID se objevila anémie. To může být způsobeno okultní nebo hrubou ztrátou krve, zadržováním tekutin nebo neúplně popsaným vlivem na erytropoézu. Pokud má pacient léčený přípravkem CELEBREX jakékoli známky nebo příznaky anémie, sledujte hemoglobin nebo hematokrit.
V kontrolovaných klinických studiích byla incidence anémie 0,6 % u přípravku CELEBREX a 0,4 % u placeba. U pacientů dlouhodobě léčených přípravkem CELEBREX 200 mg by měl být zkontrolován hemoglobin nebo hematokrit, pokud se u nich projeví jakékoli známky nebo příznaky anémie nebo ztráty krve.
NSAID, včetně přípravku CELEBREX 100 mg, mohou zvýšit riziko krvácivých příhod. Toto riziko mohou zvýšit přidružená onemocnění, jako jsou poruchy koagulace nebo současné užívání warfarinu, jiných antikoagulancií, protidestičkových léků (např. aspirin), SSRI a inhibitorů zpětného vychytávání serotoninu a noradrenalinu (SNRI). Sledujte u těchto pacientů známky krvácení [viz DROGOVÉ INTERAKCE ].
Maskování Zánětu A Horečky
Farmakologická aktivita přípravku CELEBREX 100 mg při snižování zánětu a možná i horečky může snížit užitečnost diagnostických příznaků při detekci infekcí.

Laboratorní monitorování
Protože závažné GI krvácení, hepatotoxicita a poškození ledvin se mohou objevit bez varovných příznaků nebo známek, zvažte pravidelné sledování pacientů na dlouhodobé léčbě NSAID pomocí CBC a chemického profilu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
kontrolovaných klinických studiích se zvýšené BUN vyskytovaly častěji u pacientů užívajících přípravek CELEBREX ve srovnání s pacientem, synem placeba. Tato laboratorní abnormalita byla také pozorována u pacientů, kteří v těchto studiích dostávali srovnávací NSAID. Klinický význam této abnormality nebyl stanoven.
Diseminovaná intravaskulární koagulace (DIC)
Vzhledem k riziku diseminované intravaskulární koagulace při použití přípravku CELEBREX 200 mg u pediatrických pacientů se systémovým nástupem JRA sledujte pacienty s ohledem na známky a příznaky abnormální srážlivosti nebo krvácení a informujte pacienty a jejich ošetřovatele, aby příznaky hlásili co nejdříve.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ), který doprovází každý vydaný předpis. Před zahájením léčby přípravkem CELEBREX a pravidelně v průběhu probíhající léčby informujte pacienty, rodiny nebo jejich pečovatele o následujících informacích.
Kardiovaskulární trombotické příhody
Informujte pacienty, aby byli ostražití na příznaky kardiovaskulárních trombotických příhod, včetně bolesti na hrudi, dušnosti, slabosti nebo nezřetelné řeči, a aby kterýkoli z těchto příznaků okamžitě hlásili svému poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Gastrointestinální krvácení, ulcerace a perforace
Doporučte pacientům, aby svému poskytovateli zdravotní péče hlásili příznaky ulcerací a krvácení, včetně bolesti v epigastriu, dyspepsie, melény a hematemézy. Při současném užívání nízkých dávek aspirinu pro srdeční profylaxi informujte pacienty o zvýšeném riziku a známkách a příznacích gastrointestinálního krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hepatotoxicita
Informujte pacienty o varovných příznacích a příznacích hepatotoxicity (např. nevolnost, únava, letargie, pruritus, průjem, žloutenka, citlivost v pravém horním kvadrantu a příznaky podobné chřipce). Pokud k tomu dojde, poučte pacienty, aby přestali užívat přípravek CELEBREX 200 mg a okamžitě vyhledali lékařskou léčbu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ].
Srdeční Selhání A Edém
Poraďte pacientům, aby byli ostražití na příznaky městnavého srdečního selhání včetně dušnosti, nevysvětlitelného přírůstku hmotnosti nebo edému a aby kontaktovali svého poskytovatele zdravotní péče, pokud se takové příznaky objeví [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Anafylaktické reakce
Informujte pacienty o známkách anafylaktické reakce (např. potíže s dýcháním, otok obličeje nebo hrdla). Poučte pacienty, aby vyhledali okamžitou pohotovostní pomoc, pokud k tomu dojde [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vážné kožní reakce, včetně ŠATY
Informujte pacienty, aby okamžitě přestali užívat přípravek CELEBREX 100 mg, pokud se u nich objeví jakýkoli typ vyrážky nebo horečky, a aby co nejdříve kontaktovali svého poskytovatele zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ženská plodnost
Informujte ženy s reprodukčním potenciálem, které si přejí otěhotnět, že NSAID, včetně přípravku CELEBREX 200 mg, mohou být spojeny s viditelným zpožděním ovulace (viz Použití u konkrétních populací ].
Fetální toxicita
Informujte těhotné ženy, aby se vyvarovaly užívání přípravku CELEBREX a dalších NSAID počínaje 30. týdnem těhotenství kvůli riziku předčasného uzavření ductus arteriosus plodu. Pokud je léčba přípravkem CELEBREX 200 mg potřebná pro těhotnou ženu mezi 20. až 30. týdnem těhotenství, upozorněte ji, že může být nutné sledovat oligohydramnion, pokud léčba trvá déle než 48 hodin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Vyhněte se současnému užívání NSAID
Informujte pacienty, že současné užívání přípravku CELEBREX s jinými NSAID nebo salicyláty (např. diflunisal, salsalát) se nedoporučuje kvůli zvýšenému riziku gastrointestinální toxicity a malému nebo žádnému zvýšení účinnosti (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ]. Upozorněte pacienty, že NSAID mohou být přítomna v „volně prodejných“ lécích k léčbě nachlazení, horečky nebo nespavosti.
Užívání NSAID a nízké dávky aspirinu
Informujte pacienty, aby neužívali nízkou dávku aspirinu současně s přípravkem CELEBREX 200 mg, dokud si nepromluví se svým poskytovatelem zdravotní péče [viz DROGOVÉ INTERAKCE ].
Označení tohoto produktu mohlo být aktualizováno. Nejnovější informace o předepisování naleznete na www.pfizer.com.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Celecoxib nebyl karcinogenní u potkanů Sprague-Dawley, kterým byly perorálně podávány dávky až 200 mg/kg u samců a 10 mg/kg u samic (přibližně 2- až 4násobek expozice u člověka, měřeno pomocí AUC0-24 při 200 mg dvakrát denně nebo u myší, kterým byly po dobu dvou let podávány perorální dávky až 25 mg/kg u samců a 50 mg/kg u samic (přibližně stejné jako expozice u člověka, měřeno pomocí AUC0-24 při 200 mg dvakrát denně).
Mutageneze
Celecoxib nebyl mutagenní v Amesově testu a mutačním testu v buňkách ovarií čínského křečka (CHO) ani klastogenní v testu chromozomové aberace v CHO buňkách a in vivo mikronukleárním testu v kostní dřeni potkana.
Zhoršení Plodnosti
Celecoxib neměl žádný vliv na samčí nebo samičí fertilitu nebo samčí reprodukční funkce u potkanů při perorálních dávkách až 600 mg/kg/den (přibližně 11násobek expozice u člověka při dávce 200 mg dvakrát denně na základě AUC0-24). Při dávce ≥50 mg/kg/den (přibližně 6násobek expozice u člověka na základě AUC0-24 při dávce 200 mg dvakrát denně) došlo ke zvýšené preimplantační ztrátě.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Užívání NSAID, včetně přípravku CELEBREX 200 mg, může způsobit předčasné uzavření ductus arteriosus plodu a fetální renální dysfunkci vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin. Kvůli těmto rizikům omezte dávku a délku užívání přípravku CELEBREX 200 mg mezi přibližně 20. a 30. týdnem těhotenství a vyhněte se užívání přípravku CELEBREX přibližně ve 30. týdnu těhotenství a později v těhotenství (viz Klinické úvahy, Data ).
Předčasné uzavření Fetal Ductus Arteriosus
Užívání NSAID, včetně přípravku CELEBREX, přibližně ve 30. týdnu těhotenství nebo později v těhotenství zvyšuje riziko předčasného uzavření ductus arteriosus plodu.
Oligohydramnion/novorozenecké poškození ledvin
Užívání NSAID přibližně ve 20. týdnu těhotenství nebo později v těhotenství bylo spojeno s případy fetální renální dysfunkce vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin.
Údaje z observačních studií týkající se dalších potenciálních embryofetálních rizik užívání NSAID u žen v prvním nebo druhém trimestru těhotenství jsou neprůkazné. V reprodukčních studiích na zvířatech byla pozorována úmrtí embryí a plodů a nárůst bráničních kýl u potkanů, kterým byl celekoxib podáván denně během období organogeneze v perorálních dávkách přibližně 6násobku maximální doporučené dávky pro člověka (MRHD) 200 mg dvakrát denně. Kromě toho byly u králíků pozorovány strukturální abnormality (např. defekty septa, srostlá žebra, srostlé hrudní kosti a deformované hrudní kosti), kterým byly během období organogeneze podávány denní perorální dávky celekoxibu přibližně 2krát vyšší než MRHD (viz Data ). Na základě údajů na zvířatech se prokázalo, že prostaglandiny hrají důležitou roli v permeabilitě cév endometria, implantaci blastocyst a decidualizaci. Ve studiích na zvířatech vedlo podávání inhibitorů syntézy prostaglandinů, jako je celekoxib, ke zvýšeným pre- a postimplantačním ztrátám. Bylo také prokázáno, že prostaglandiny hrají důležitou roli ve vývoji ledvin plodu. V publikovaných studiích na zvířatech bylo hlášeno, že inhibitory syntézy prostaglandinů narušují vývoj ledvin, když jsou podávány v klinicky relevantních dávkách.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Fetální/neonatální nežádoucí reakce
Předčasné uzavření Fetal Ductus Arteriosus
Vyhněte se užívání NSA u žen přibližně ve 30. týdnu těhotenství a později v těhotenství, protože NSAID, včetně přípravku CELEBREX 200 mg, mohou způsobit předčasné uzavření ductus arteriosus plodu (viz Data ).
Oligohydramnion / neonatální poškození ledvin:
Je-li nutné NSAID přibližně ve 20. týdnu těhotenství nebo později v těhotenství, omezte použití na nejnižší účinnou dávku a nejkratší možnou dobu trvání. Pokud léčba přípravkem CELEBREX přesáhne 48 hodin, zvažte sledování oligohydramnion pomocí ultrazvuku. Pokud se objeví oligohydramnion, přerušte léčbu přípravkem CELEBREX a pokračujte podle klinické praxe (viz Data ).
Práce nebo dodávka
Neexistují žádné studie o účincích přípravku CELEBREX během porodu. Ve studiích na zvířatech NSAID, včetně celekoxibu, inhibují syntézu prostaglandinů, způsobují opožděný porod a zvyšují výskyt mrtvého porodu.
Data
Lidská data
Dostupné údaje neprokazují přítomnost nebo nepřítomnost vývojové toxicity související s použitím přípravku CELEBREX.
Předčasné uzavření Fetal Ductus Arteriosus
Publikovaná literatura uvádí, že použití NSAID přibližně ve 30. týdnu těhotenství a později v těhotenství může způsobit předčasné uzavření ductus arteriosus plodu.
Oligohydramnion/novorozenecké poškození ledvin
Publikované studie a postmarketingové zprávy popisují užívání NSAID u matky přibližně ve 20. týdnu těhotenství nebo později v těhotenství spojené s fetální renální dysfunkcí vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin. Tyto nežádoucí účinky jsou pozorovány v průměru po dnech až týdnech léčby, ačkoli oligohydramnion byl zřídka hlášen již 48 hodin po zahájení NSAID. V mnoha případech, ale ne ve všech, byl pokles plodové vody přechodný a reverzibilní po vysazení léku. Existuje omezený počet kazuistik užívání NSAID u matek a neonatální renální dysfunkce bez oligohydramnia, z nichž některé byly ireverzibilní. Některé případy neonatální renální dysfunkce vyžadovaly léčbu invazivními postupy, jako je výměnná transfuze nebo dialýza.
Metodologická omezení těchto postmarketingových studií a zpráv zahrnují nedostatek kontrolní skupiny; omezené informace týkající se dávky, trvání a načasování expozice léku; a současné užívání jiných léků. Tato omezení znemožňují stanovení spolehlivého odhadu rizika nepříznivých fetálních a neonatálních výsledků při užívání NSAID matkou. Vzhledem k tomu, že publikované údaje o bezpečnosti týkající se neonatálních výsledků zahrnovaly většinou předčasně narozené děti, je zobecnění určitých hlášených rizik pro donošené dítě vystavené NSAID při užívání matkou nejisté.
Údaje o zvířatech
Celecoxib v perorálních dávkách ≥ 150 mg/kg/den (přibližně dvojnásobek lidské expozice při 200 mg dvakrát denně, měřeno pomocí AUC0 – 24), způsobil zvýšený výskyt defektů komorového septa, vzácné události a fetálních změn, jako je např. žebra srostlá, hrudní kost srostlá a hrudní kost zdeformovaná, když byli králíci léčeni během organogeneze. Bylo pozorováno na dávce závislé zvýšení bráničních kýl, když byl potkanům podáván celekoxib v perorálních dávkách ≥ 30 mg/kg/den (přibližně 6násobek expozice u člověka na základě AUC 0 – 24 při 200 mg dvakrát denně pro RA) v průběhu organogeneze. U potkanů vedla expozice celekoxibu během časného embryonálního vývoje k preimplantačním a postimplantačním ztrátám při perorálních dávkách ≥50 mg/kg/den (přibližně 6násobek expozice u člověka na základě AUC 0 – 24 při 200 mg dvakrát denně pro RA).
Při perorálních dávkách do 100 mg/kg u potkanů celekoxib nevyvolal žádné známky opožděného porodu nebo porodu (přibližně 7násobek expozice u člověka, měřeno pomocí AUC 0 – 24 při dávce 200 mg dvakrát denně). Účinky přípravku CELEBREX na porod u těhotných žen nejsou známy.
Laktace
Shrnutí rizik
Omezené údaje ze 3 publikovaných zpráv, které zahrnovaly celkem 12 kojících žen, ukázaly nízké hladiny CELEBREXU v mateřském mléce. Vypočtená průměrná denní dávka pro kojence byla 10 až 40 mcg/kg/den, což je méně než 1 % terapeutické dávky založené na hmotnosti pro dvouleté dítě. Zpráva o dvou kojených dětech ve věku 17 a 22 měsíců neprokázala žádné nežádoucí účinky. Při podávání přípravku CELEBREX 100 mg kojící ženě je třeba postupovat opatrně. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky CELEBREX a veškerými potenciálními nepříznivými účinky na kojené dítě z CELEBREX 200 mg nebo ze základního stavu matky.
Ženy a muži reprodukčního potenciálu
Neplodnost
Ženy
Na základě mechanismu účinku může použití prostaglandinů zprostředkovaných NSAID, včetně přípravku CELEBREX, oddálit nebo zabránit prasknutí ovariálních folikulů, které je u některých žen spojováno s reverzibilní neplodností. Publikované studie na zvířatech ukázaly, že podávání inhibitorů syntézy prostaglandinů má potenciál narušit prostaglandiny zprostředkovanou rupturu folikulů potřebnou pro ovulaci. Malé studie u žen léčených NSAID také prokázaly reverzibilní zpoždění ovulace. Zvažte vysazení NSAID, včetně přípravku CELEBREX 200 mg, u žen, které mají potíže s početím nebo které podstupují vyšetření neplodnosti.
Pediatrické použití
CELEBREX 200 mg je schválen k úlevě od známek a příznaků juvenilní revmatoidní artritidy u pacientů ve věku 2 let a starších. Bezpečnost a účinnost nebyla u dětí studována déle než šest měsíců. Dlouhodobá kardiovaskulární toxicita u dětí vystavených přípravku CELEBREX 100 mg nebyla hodnocena a není známo, zda mohou být dlouhodobá rizika podobná jako u dospělých vystavených přípravku CELEBREX nebo jiným selektivním a neselektivním NSAID COX-2 (viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a Klinické studie ].
Použití celekoxibu u pacientů ve věku 2 až 17 let s pauciartikulárním, polyartikulárním průběhem JRA nebo u pacientů se systémovým nástupem JRA bylo studováno ve 12týdenní, dvojitě zaslepené, aktivně kontrolované, farmakokinetické, bezpečnosti a účinnosti studie s 12týdenní otevřené prodloužení. Celecoxib nebyl studován u pacientů mladších 2 let, u pacientů s tělesnou hmotností nižší než 10 kg (22 liber) au pacientů s aktivními systémovými rysy. Pacienti se systémovým nástupem JRA (bez aktivních systémových znaků) se zdají být ohroženi rozvojem abnormálních koagulačních laboratorních testů. U některých pacientů se systémovým nástupem JRA byly celekoxib i naproxen spojeny s mírným prodloužením aktivovaného parciálního tromboplastinového času (APTT), ale nikoli protrombinového času (PT). Pokud jsou NSAID včetně celekoxibu používány u pacientů se systémovým nástupem JRA, sledujte pacienty s ohledem na známky a příznaky abnormální srážlivosti nebo krvácení kvůli riziku diseminované intravaskulární koagulace. Pacienti se systémovým nástupem JRA by měli být sledováni pro vývoj abnormálních koagulačních testů [viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE , Toxikologie zvířat , Klinické studie ].
pediatrických pacientů identifikovaných jako pomalí metabolizátoři CYP2C9 by měly být zváženy alternativní terapie pro léčbu JRA (viz Slabé metabolizátory substrátů CYP2C9 ].
Geriatrické použití
Starší pacienti jsou ve srovnání s mladšími pacienty vystaveni většímu riziku závažných kardiovaskulárních, gastrointestinálních a/nebo renálních nežádoucích reakcí spojených s NSAID. Pokud očekávaný přínos pro staršího pacienta převáží tato potenciální rizika, začněte s dávkováním na spodní hranici dávkovacího rozmezí a sledujte pacienty kvůli nežádoucím účinkům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
celkového počtu pacientů, kteří dostávali CELEBREX 100 mg v klinických studiích před schválením, bylo více než 3 300 ve věku 65 – 74 let, zatímco přibližně 1 300 dalších pacientů bylo ve věku 75 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné podstatné rozdíly v účinnosti. V klinických studiích porovnávajících funkci ledvin měřenou pomocí GFR, BUN a kreatininu a funkci krevních destiček měřenou dobou krvácení a agregací destiček se výsledky mezi staršími a mladými dobrovolníky nelišily. Nicméně, stejně jako u jiných NSAID, včetně těch, které selektivně inhibují COX-2, bylo po uvedení na trh více spontánních hlášení o fatálních GI příhodách a akutním selhání ledvin u starších pacientů než u mladších pacientů (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Poškození jater
Denní doporučená dávka tobolek CELEBREX u pacientů se středně těžkou poruchou funkce jater (Child-Pugh třída B) by měla být snížena o 50 %. Použití přípravku CELEBREX u pacientů s těžkou poruchou funkce jater se nedoporučuje (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Renální poškození
CELEBREX se nedoporučuje u pacientů s těžkou renální insuficiencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Slabé metabolizátory substrátů CYP2C9
U pacientů, o kterých je známo nebo je podezření, že jsou pomalí metabolizátoři CYP2C9 (tj. CYP2C9*3/*3), na základě genotypu nebo předchozí anamnézy/zkušenosti s jinými substráty CYP2C9 (jako je warfarin, fenytoin), podávejte CELEBREX 200 mg počínaje polovinou nejnižší doporučená dávka. Alternativní léčba by měla být zvážena u pacientů s JRA identifikovaných jako pomalí metabolizátoři CYP2C9 [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Symptomy po akutním předávkování NSAID byly typicky omezeny na letargii, ospalost, nauzeu, zvracení a bolest v epigastriu, které byly obvykle reverzibilní podpůrnou péčí. Objevilo se gastrointestinální krvácení. Hypertenze, akutní selhání ledvin, respirační deprese a kóma se vyskytly, ale byly vzácné [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Během klinických studií nebylo hlášeno žádné předávkování přípravkem CELEBREX 200 mg. Dávky až do 2400 mg/den po dobu až 10 dnů u 12 pacientů nevedly k závažné toxicitě. Nejsou dostupné žádné informace o odstranění celekoxibu hemodialýzou, ale vzhledem k jeho vysokému stupni vazby na plazmatické proteiny (>97 %) je nepravděpodobné, že by dialýza byla při předávkování užitečná.
Ošetřujte pacienty symptomatickou a podpůrnou péčí po předávkování NSAID. Neexistují žádná specifická antidota. Zvažte zvracení a/nebo aktivní uhlí (60 až 100 gramů u dospělých, 1 až 2 gramy na kg tělesné hmotnosti u pediatrických pacientů) a/nebo osmotické katarzi u symptomatických pacientů pozorovaných do čtyř hodin po požití nebo u pacientů s velkým předávkováním ( 5 až 10násobek doporučené dávky). Forsírovaná diuréza, alkalizace moči, hemodialýza nebo hemoperfuze nemusí být užitečné kvůli vysoké vazbě na proteiny.
Pro další informace o léčbě předávkování kontaktujte toxikologické centrum (1-800-222-1222).
KONTRAINDIKACE
CELEBREX je kontraindikován u následujících pacientů:
- Známá přecitlivělost (např. anafylaktické reakce a závažné kožní reakce) na celekoxib, jakékoli složky léčivého přípravku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Anamnéza astmatu, kopřivky nebo jiných reakcí alergického typu po užití aspirinu nebo jiných NSAID. U těchto pacientů byly hlášeny těžké, někdy fatální, anafylaktické reakce na NSAID (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- V prostředí operace CABG [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- U pacientů, u kterých byly prokázány reakce alergického typu na sulfonamidy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Celecoxib má analgetické, protizánětlivé a antipyretické vlastnosti.
Předpokládá se, že mechanismus účinku přípravku CELEBREX 100 mg je způsoben inhibicí syntézy prostaglandinů, primárně prostřednictvím inhibice COX-2.
Celecoxib je silný inhibitor syntézy prostaglandinů in vitro. Koncentrace celekoxibu dosažené během léčby vyvolaly účinky in vivo. Prostaglandiny senzibilizují aferentní nervy a zesilují účinek bradykininu při vyvolávání bolesti na zvířecích modelech. Prostaglandiny jsou mediátory zánětu. Vzhledem k tomu, že celekoxib je inhibitor syntézy prostaglandinů, jeho mechanismus účinku může být způsoben poklesem prostaglandinů v periferních tkáních.
Farmakodynamika
Krevní destičky
klinických studiích s normálními dobrovolníky neměl CELEBREX v jednorázových dávkách až 800 mg a opakovaných dávkách 600 mg dvakrát denně po dobu až 7 dnů (vyšší než doporučené terapeutické dávky) žádný účinek na snížení agregace krevních destiček nebo prodloužení doby krvácení. Vzhledem k nedostatku účinku na krevní destičky CELEBREX 100 mg nenahrazuje aspirin pro kardiovaskulární profylaxi. Není známo, zda existují nějaké účinky přípravku CELEBREX na krevní destičky, které mohou přispívat ke zvýšenému riziku závažných kardiovaskulárních trombotických nežádoucích příhod spojených s užíváním přípravku CELEBREX.
Zadržování tekutin
Inhibice syntézy PGE2 může vést k retenci sodíku a vody prostřednictvím zvýšené reabsorpce v ledvinové medulární tlusté vzestupné kličce Henle a možná i dalších segmentech distálního nefronu. Zdá se, že PGE2 ve sběrných kanálcích inhibuje reabsorpci vody tím, že působí proti působení antidiuretického hormonu.
Farmakokinetika
Celecoxib vykazuje zvýšení expozice úměrné dávce po perorálním podání až do 200 mg dvakrát denně a menší než proporcionální zvýšení při vyšších dávkách. Má rozsáhlou distribuci a vysokou vazbu na bílkoviny. Je primárně metabolizován CYP2C9 s poločasem přibližně 11 hodin.
Vstřebávání
Maximální plazmatické hladiny celekoxibu se objevují přibližně 3 hodiny po perorální dávce. Za podmínek nalačno jsou maximální plazmatické hladiny (Cmax) i plocha pod křivkou (AUC) zhruba úměrné dávce až do 200 mg dvakrát denně; při vyšších dávkách dochází k menšímu než proporcionálnímu zvýšení Cmax a AUC (viz Účinky jídla ). Studie absolutní biologické dostupnosti nebyly provedeny. Při opakovaném podávání je rovnovážného stavu dosaženo v den 5 nebo dříve. Farmakokinetické parametry celekoxibu u skupiny zdravých subjektů jsou uvedeny v tabulce 4.
Účinky jídla
Když byly tobolky CELEBREX 200 mg užity s jídlem s vysokým obsahem tuku, maximální plazmatické hladiny byly opožděny asi o 1 až 2 hodiny se zvýšením celkové absorpce (AUC) o 10 % až 20 %. Za podmínek nalačno, při dávkách nad 200 mg, dochází k menšímu než proporcionálnímu zvýšení Cmax a AUC, což je považováno za důsledek nízké rozpustnosti léčiva ve vodném médiu.
Současné podávání přípravku CELEBREX s antacidami obsahujícími hliník a hořčík vedlo ke snížení plazmatických koncentrací celekoxibu se snížením Cmax o 37 % a AUC o 10 %. CELEBREX v dávkách až 200 mg dvakrát denně lze podávat bez ohledu na načasování jídla. Vyšší dávky (400 mg dvakrát denně) by měly být podávány s jídlem, aby se zlepšila absorpce.
zdravých dospělých dobrovolníků byla celková systémová expozice (AUC) celekoxibu ekvivalentní, když byl celekoxib podáván jako neporušená tobolka nebo obsah tobolky posypaný jablečným pyré. Po podání obsahu tobolek na jablečném pyré nedošlo k žádným významným změnám Cmax, Tmax nebo t½ [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rozdělení
U zdravých jedinců se celekoxib v rozmezí klinických dávek silně váže na proteiny (~97 %). Studie in vitro ukazují, že celekoxib se váže primárně na albumin a v menší míře na α-kyselý glykoprotein. Zdánlivý distribuční objem v ustáleném stavu (V/F) je přibližně 400 l, což naznačuje rozsáhlou distribuci do tkání. Celecoxib se přednostně neváže na červené krvinky.
Odstranění
Metabolismus
Metabolismus celekoxibu je primárně zprostředkován prostřednictvím CYP2C9. V lidské plazmě byly identifikovány tři metabolity, primární alkohol, odpovídající karboxylová kyselina a její glukuronidový konjugát. Tyto metabolity jsou neaktivní jako inhibitory COX-1 nebo COX-2.
Vylučování
Celecoxib je eliminován převážně jaterním metabolismem, přičemž v moči a stolici se objeví malé množství (
Specifické populace
Geriatrický
rovnovážném stavu měli starší jedinci (nad 65 let) o 40 % vyšší Cmax a o 50 % vyšší AUC ve srovnání s mladými jedinci. U starších žen jsou Cmax a AUC celekoxibu vyšší než u starších mužů, ale tato zvýšení jsou způsobena především nižší tělesnou hmotností u starších žen. Úprava dávky u starších pacientů není obecně nutná. U pacientů s tělesnou hmotností nižší než 50 kg však zahajte léčbu nejnižší doporučenou dávkou [viz Použití u konkrétních populací ].
Pediatrická
Farmakokinetika celekoxibu v rovnovážném stavu podávaného jako zkušební perorální suspenze byla hodnocena u 152 pacientů s JRA ve věku 2 roky až 17 let s hmotností ≥ 10 kg s pauciartikulárním nebo polyartikulárním průběhem JRA au pacientů se systémovým nástupem JRA. Populační farmakokinetická analýza ukázala, že perorální clearance (neupravená podle tělesné hmotnosti) celekoxibu se zvyšuje méně než úměrně zvyšující se hmotnosti, přičemž u pacientů s hmotností 10 kg a 25 kg se předpokládá, že mají o 40 % a 24 % nižší clearance ve srovnání s dospělým RA o hmotnosti 70 kg trpěliví.
Při podávání 50mg tobolek pacientům s JRA vážícím ≥12 až ≤25 kg dvakrát denně a 100mg tobolek pacientům s JRA vážícím >25 kg by mělo být dosaženo plazmatických koncentrací podobných těm, které byly pozorovány v klinické studii, která prokázala non-inferioritu celekoxibu vůči naproxen 7,5 mg/kg dvakrát denně [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Celecoxib nebyl studován u pacientů s JRA ve věku do 2 let, u pacientů s tělesnou hmotností nižší než 10 kg (22 liber) nebo starších 24 týdnů.
Závod
Metaanalýza farmakokinetických studií naznačila přibližně o 40 % vyšší AUC celekoxibu u černochů ve srovnání s bělochy. Příčina a klinický význam tohoto nálezu nejsou známy.
Poškození jater
Farmakokinetická studie u subjektů s mírnou (Child-Pugh třída A) a středně těžkou (Child-Pugh třída B) poruchou jater ukázala, že AUC celekoxibu v ustáleném stavu je zvýšena asi o 40 % a 180 %, v tomto pořadí, nad hodnotu pozorovanou u zdravých kontrol předměty. Proto by měla být denní doporučená dávka tobolek CELEBREX snížena o přibližně 50 % u pacientů se středně těžkou poruchou funkce jater (Child-Pugh třída B). Pacienti s těžkou poruchou funkce jater (Child-Pugh třída C) nebyli studováni. Použití přípravku CELEBREX u pacientů s těžkou poruchou funkce jater se nedoporučuje [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Renální poškození
Ve srovnání ve zkřížených studiích byla AUC celekoxibu přibližně o 40 % nižší u pacientů s chronickou renální insuficiencí (GFR35 – 60 ml/min) než u subjektů s normální funkcí ledvin. Nebyl nalezen žádný významný vztah mezi GFR a clearance celekoxibu. Pacienti s těžkou renální insuficiencí nebyli studováni. Podobně jako ostatní NSAID se CELEBREX 200 mg nedoporučuje u pacientů s těžkou renální insuficiencí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Studie lékových interakcí
Studie in vitro ukazují, že celekoxib není inhibitorem cytochromu P450 2C9, 2C19 nebo 3A4.
Studie in vivo prokázaly následující:
Aspirin
Když byly NSAID podávány s aspirinem, vazba NSAID na proteiny byla snížena, ačkoli clearance volného NSAID se nezměnila. Klinický význam této interakce není znám. Viz tabulka 3 pro klinicky významné lékové interakce NSAID s aspirinem [viz DROGOVÉ INTERAKCE ].
Lithium
Ve studii provedené u zdravých subjektů se průměrné plazmatické hladiny lithia v ustáleném stavu zvýšily přibližně o 17 % u subjektů užívajících lithium 450 mg dvakrát denně s přípravkem CELEBREX 200 mg dvakrát denně ve srovnání s subjekty užívajícími samotné lithium [viz DROGOVÉ INTERAKCE ].
flukonazol
Současné podávání flukonazolu v dávce 200 mg jednou denně vedlo k dvojnásobnému zvýšení plazmatické koncentrace celekoxibu. Toto zvýšení je způsobeno inhibicí metabolismu celekoxibu prostřednictvím P450 2C9 flukonazolem [viz DROGOVÉ INTERAKCE ].
Jiné drogy
Účinky celekoxibu na farmakokinetiku a/nebo farmakodynamiku glyburidu, ketokonazolu, [viz DROGOVÉ INTERAKCE ], fenytoin a tolbutamid byly studovány in vivo a nebyly nalezeny klinicky významné interakce.
Farmakogenomika
Aktivita CYP2C9 je snížena u jedinců s genetickými polymorfismy, které vedou ke snížené enzymatické aktivitě, jako jsou ty homozygotní pro polymorfismy CYP2C9*2 a CYP2C9*3. Omezené údaje ze 4 publikovaných zpráv, které zahrnovaly celkem 8 subjektů s homozygotním genotypem CYP2C9*3/*3, ukázaly systémové hladiny celekoxibu, které byly u těchto subjektů 3 až 7krát vyšší ve srovnání se subjekty s CYP2C9*1/*1 nebo * I/*3 genotypy. Farmakokinetika celekoxibu nebyla hodnocena u subjektů s jinými polymorfismy CYP2C9, jako jsou *2, *5, *6, *9 a *11. Odhaduje se, že frekvence homozygotního *3/*3 genotypu je 0,3 % až 1,0 % v různých etnických skupinách [viz. DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Toxikologie zvířat
juvenilních potkanů byl pozorován zvýšený výskyt základních nálezů spermatokély s nebo bez sekundárních změn, jako je epididymalická pospermie, jakož i minimální až mírná dilatace semenotvorných kanálků. Tyto reprodukční nálezy, i když zjevně souvisely s léčbou, nezvýšily výskyt nebo závažnost s dávkou a mohou naznačovat exacerbaci spontánního stavu. Podobné reprodukční nálezy nebyly pozorovány ve studiích u juvenilních nebo dospělých psů nebo u dospělých potkanů léčených celekoxibem. Klinický význam tohoto pozorování není znám.
Klinické studie
Osteoartróza
CELEBREX 200 mg prokázal významné snížení bolesti kloubů ve srovnání s placebem. CELEBREX byl hodnocen z hlediska léčby známek a příznaků OA kolena a kyčle v placebem a aktivní látkou kontrolovaných klinických studiích trvajících až 12 týdnů. U pacientů s OA vedla léčba přípravkem CELEBREX 100 mg dvakrát denně nebo 200 mg jednou denně ke zlepšení indexu osteoartrózy WOMAC (Western Ontario and McMaster Universities), což je kombinace bolesti, ztuhlosti a funkčních ukazatelů u OA. Ve třech 12týdenních studiích bolesti doprovázejících vzplanutí OA poskytly CELEBREX 100 mg dávky 100 mg dvakrát denně a 200 mg dvakrát denně významné snížení bolesti během 24 až 48 hodin od zahájení podávání. Při dávkách 100 mg dvakrát denně nebo 200 mg dvakrát denně se ukázalo, že účinnost přípravku CELEBREX 200 mg je podobná účinnosti naproxenu 500 mg dvakrát denně. Dávky 200 mg dvakrát denně neposkytly žádný další přínos oproti dávce 100 mg dvakrát denně. Ukázalo se, že celková denní dávka 200 mg je stejně účinná, ať už je podávána jako 100 mg dvakrát denně nebo 200 mg jednou denně.
Revmatoidní artritida
CELEBREX prokázal významné snížení citlivosti/bolesti kloubů a otoku kloubů ve srovnání s placebem. Přípravek CELEBREX 100 mg byl hodnocen pro léčbu známek a příznaků RA v klinických studiích kontrolovaných placebem a aktivní látkou, které trvaly až 24 týdnů. V těchto studiích bylo prokázáno, že CELEBREX je lepší než placebo, a to pomocí ACR20 Responder Index, což je složený z klinických, laboratorních a funkčních měření u RA. Dávky přípravku CELEBREX 100 mg dvakrát denně a 200 mg dvakrát denně měly podobnou účinnost a obě byly srovnatelné s naproxenem 500 mg dvakrát denně.
Ačkoli CELEBREX 100 mg dvakrát denně a 200 mg dvakrát denně poskytl podobnou celkovou účinnost, někteří pacienti získali další přínos z dávky 200 mg dvakrát denně. Dávky 400 mg dvakrát denně neposkytly žádný další přínos oproti dávce 100 mg až 200 mg dvakrát denně.
Juvenilní revmatoidní artritida (NCT00652925)
Ve 12týdenní, randomizované, dvojitě zaslepené, aktivně kontrolované, paralelní skupinové, multicentrické studii non-inferiority byli pacienti ve věku od 2 let do 17 let s pauciartikulárním, polyartikulárním průběhem JRA nebo JRA se systémovým začátkem (s aktuálně neaktivními systémovými rysy ), dostávali jednu z následujících léčeb: celekoxib 3 mg/kg (maximálně 150 mg) dvakrát denně; celekoxib 6 mg/kg (maximálně 300 mg) dvakrát denně; nebo naproxen 7,5 mg/kg (maximálně 500 mg) dvakrát denně. Míry odezvy byly založeny na kritériu JRA Definition of Improvement větší nebo rovné 30 % (JRA DOI 30), které je složenou z klinických, laboratorních a funkčních měření JRA. Míra odpovědi JRA DOI 30 ve 12. týdnu byla 69 %, 80 % a 67 % ve skupinách léčených celekoxibem 3 mg/kg dvakrát denně, celekoxibem 6 mg/kg dvakrát denně a naproxenem 7,5 mg/kg dvakrát denně.
Účinnost a bezpečnost přípravku CELEBREX 100 mg pro JRA nebyla studována déle než šest měsíců. Dlouhodobá kardiovaskulární toxicita u dětí vystavených přípravku CELEBREX 200 mg nebyla hodnocena a není známo, zda dlouhodobé riziko může být podobné riziku pozorovanému u dospělých vystavených přípravku CELEBREX 100 mg nebo jiným COX-2 selektivním a neselektivním NSAID. vidět VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ankylozující spondylitida
CELEBREX byl hodnocen u pacientů s AS ve dvou placebem a aktivní látkou kontrolovaných klinických studiích v trvání 6 a 12 týdnů. V těchto studiích bylo prokázáno, že CELEBREX v dávkách 100 mg dvakrát denně, 200 mg jednou denně a 400 mg jednou denně je statisticky lepší než placebo ve všech třech primárních měřeních účinnosti hodnotících globální intenzitu bolesti (vizuální analogová škála), globální aktivitu onemocnění (Visual Analogue Scale) a funkční poškození (Bath Ankylosing Spondylitis Functional Index). Ve 12týdenní studii nebyl žádný rozdíl v rozsahu zlepšení mezi dávkami 200 mg a 400 mg přípravku CELEBREX 200 mg ve srovnání průměrné změny oproti výchozí hodnotě, ale bylo zde větší procento pacientů, kteří reagovali na přípravek CELEBREX 400 mg, 53 %, než na CELEBREX 200 mg, 44 %, za použití kritérií hodnocení odpovědi na ankylozující spondylitidu (ASAS20). ASAS 20 definuje respondér jako zlepšení od výchozí hodnoty alespoň o 20 % a absolutní zlepšení alespoň o 10 mm, na stupnici od 0 mm do 100 mm, v alespoň třech ze čtyř následujících domén: globální bolest pacienta, ankylozující spondylitida z koupele Funkční index a zánět. Analýza respondérů také neprokázala žádnou změnu v počtu respondérů po 6 týdnech.
Analgezie, včetně primární dysmenorey
V akutních analgetických modelech bolesti po orálním chirurgickém zákroku, bolesti po ortopedickém chirurgickém zákroku a primární dysmenorey zmírnil CELEBREX 100 mg bolest, která byla pacienty hodnocena jako středně závažná až závažná. Jednotlivé dávky [viz DÁVKOVÁNÍ A PODÁVÁNÍ ] přípravku CELEBREX 200 mg poskytlo úlevu od bolesti do 60 minut.
Studie kardiovaskulárních výsledků: Prospektivní randomizované hodnocení integrované bezpečnosti celekoxibu vs. ibuprofen nebo naproxen (PŘESNOST; NCT00346216)
Design
Studie PRECISION byla dvojitě zaslepená randomizovaná kontrolovaná studie kardiovaskulární bezpečnosti u pacientů s OA a RA s vysokým rizikem kardiovaskulárního onemocnění nebo s vysokým rizikem kardiovaskulárního onemocnění srovnávající celekoxib s naproxenem a ibuprofenem. Pacienti byli randomizováni do počáteční dávky celekoxibu 100 mg dvakrát denně, ibuprofenu 600 mg třikrát denně nebo naproxenu 375 mg dvakrát denně s možností eskalace dávky podle potřeby pro zvládání bolesti. Na základě označených dávek nemohli pacienti s OA randomizovaní na celekoxib dávku eskalovat.
Primární cíl, Antiagregační studie' Kompozit Collaboration (APTC) byl nezávisle posuzovaný kompozit kardiovaskulárního úmrtí (včetně hemoragické smrti), nefatálního infarktu myokardu a nefatální cévní mozkové příhody s 80% schopností vyhodnotit non-inferioritu. Všem pacientům byl předepsán otevřený esomeprazol (20 – 40 mg) na ochranu žaludku. Randomizace léčby byla stratifikována podle výchozích nízkých dávek aspirinu.
Kromě toho proběhla 4měsíční dílčí studie hodnotící účinky těchto tří léků na krevní tlak měřený ambulantním monitorováním.
Výsledek
Mezi subjekty s OA pouze 0,2 % (17/7259) zvýšilo celekoxib na dávku 200 mg dvakrát denně, zatímco 54,7 % (3946/7208) zvýšilo ibuprofen na 800 mg třikrát denně a 54,8 % (3937/7178) naproxenes na dávku 500 mg dvakrát denně. Mezi subjekty s RA 55,7 % (453/813) eskalovalo celekoxib na dávku 200 mg dvakrát denně, 56,5 % (470/832) zvýšilo ibuprofen na 800 mg třikrát denně a 54,6 % (432/791) zvýšilo naproxen dávka 500 mg dvakrát denně; populace RA však tvořila pouze 10 % populace ve studii.
Protože relativně málo pacientů s celekoxibem celkově (5,8 % [470/8072]) zvýšilo dávku na 200 mg dvakrát denně, nejsou výsledky studie PRECISION vhodné pro stanovení relativní KV bezpečnosti celekoxibu v dávce 200 mg dvakrát denně ve srovnání s ibuprofenem a naproxen v užívaných dávkách.
Primární koncový bod
Studie měla dvě předem specifikované analytické populace:
- Populace intent-to-treat (ITT): Skládá se ze všech randomizovaných subjektů sledovaných po dobu maximálně 30 měsíců
- Modifikovaná populace zamýšlená k léčbě (mITT): Skládá se ze všech randomizovaných subjektů, které dostaly alespoň jednu dávku studovaného léku a následovala alespoň jedna návštěva po výchozím stavu až do ukončení léčby, plus 30 dnů nebo 43 měsíců
Celecoxib v dávce 100 mg dvakrát denně ve srovnání s naproxenem nebo ibuprofenem v užívaných dávkách splnil všechna čtyři předem specifikovaná kritéria non-inferiority (p
Výsledky primární analýzy pro ITT a mITT jsou popsány v tabulce 5.
populaci ITT analýzy po dobu 30 měsíců byla mortalita ze všech příčin 1,6 % ve skupině celekoxibu, 1,8 % ve skupině ibuprofenu a 2,0 % ve skupině naproxenu.
Podstudie ambulantního monitorování krevního tlaku (ABPM).
V dílčí studii PRECISION-ABPM z celkového počtu 444 analyzovatelných pacientů ve 4. měsíci celekoxib podávaný v dávce 100 mg dvakrát denně snížil průměrný 24hodinový systolický krevní tlak (SBP) o 0,3 mmHg, zatímco ibuprofen a naproxen v užívaných dávkách zvýšily průměrný 24hodinový SBP o 3,7 a 1,6 mmHg, v daném pořadí. Tyto změny vedly ke statisticky významnému a klinicky významnému rozdílu 3,9 mmHg (p=0,0009) mezi celekoxibem a ibuprofenem a statisticky nevýznamným rozdílem 1,8 (p=0,119) mmHg mezi celekoxibem a naproxenem.
Speciální studia
Studie prevence adenomatózních polypů (NCT00005094 a NCT00141193)
Kardiovaskulární bezpečnost byla hodnocena ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných, tříletých studiích zahrnujících pacienty se sporadickými adenomatózními polypy léčenými přípravkem CELEBREX: studie APC (Adenoma Prevention with Celecoxib) a studie PreSAP (Prevention of Spontaneous Adenomatous Polyps). . Ve studii APC došlo během 3 let léčby celekoxibem k nárůstu složeného cílového parametru (posuzovaného) kardiovaskulárního úmrtí, infarktu myokardu nebo cévní mozkové příhody závislém na dávce ve srovnání s placebem. Studie PreSAP neprokázala statisticky významné zvýšené riziko pro stejný složený cílový bod (posuzováno):
- Ve studii APC byly poměry rizik ve srovnání s placebem pro složený cílový parametr (posuzovaný) kardiovaskulární smrt, infarkt myokardu nebo cévní mozkovou příhodu 3,4 (95% CI 1,4 – 8,5) s celekoxibem 400 mg dvakrát denně a 2,8 (95 % CI 1,1 – 7,2) s celekoxibem 200 mg dvakrát denně. Kumulativní četnosti pro tento složený cílový parametr za 3 roky byly 3,0 % (20/671 subjektů) a 2,5 % (17/685 subjektů), v tomto pořadí, ve srovnání s 0,9 % (6/679 subjektů) při léčbě placebem. Zvýšení v obou skupinách s dávkou celekoxibu oproti pacientům léčeným placebem bylo způsobeno především zvýšenou incidencí infarktu myokardu.
- Ve studii PreSAP byl poměr rizik pro stejný složený cílový ukazatel (posuzovaný) 1,2 (95% CI 0,6 – 2,4) u celekoxibu 400 mg jednou denně ve srovnání s placebem. Kumulativní míry pro tento složený cílový parametr za 3 roky byly 2,3 % (21/933 subjektů) a 1,9 % (12/628 subjektů).
Klinické studie jiných COX-2 selektivních a neselektivních NSAID trvající až tři roky prokázaly zvýšené riziko závažných kardiovaskulárních trombotických příhod, infarktu myokardu a cévní mozkové příhody, které mohou být fatální. V důsledku toho jsou všechna NSAID považována za potenciálně spojená s tímto rizikem.
Celecoxib Long-Term Arthritis Safety Study (CLASS)
Jednalo se o prospektivní, dlouhodobou, bezpečnostní studii provedenou po uvedení přípravku na trh u přibližně 5 800 pacientů s OA a 2 200 pacientů s RA. Pacienti dostávali CELEBREX 400 mg dvakrát denně (4násobek a 2násobek doporučených dávek OA a RA), ibuprofen 800 mg třikrát denně nebo diklofenak 75 mg dvakrát denně (běžné terapeutické dávky). Medián expozice pro CELEBREX (n = 3 987) a diklofenak (n = 1 996) byl 9 měsíců, zatímco ibuprofen (n = 1 985) byl 6 měsíců. Primárním cílovým parametrem této výsledné studie byl výskyt komplikovaných vředů (gastrointestinální krvácení, perforace nebo obstrukce). Pacientům bylo umožněno souběžně užívat nízkou dávku (≤ 325 mg/den) aspirinu (ASA) pro kardiovaskulární profylaxi (podskupiny ASA: CELEBREX, n = 882; diklofenak, n = 445; ibuprofen, n = 412). Rozdíly ve výskytu komplikovaných ulcerací mezi přípravkem CELEBREX 200 mg a kombinovanou skupinou ibuprofenu a diklofenaku nebyly statisticky významné.
pacientů užívajících CELEBREX a současně nízkou dávku ASA (N=882) se vyskytl 4krát vyšší výskyt komplikovaných vředů ve srovnání s těmi, kteří neužívali ASA (N=3105). Výskyt komplikovaných vředů podle Kaplana-Meiera po 9 měsících byl 1,12 % oproti 0,32 % u pacientů s nízkou dávkou ASA a u pacientů bez ASA [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Odhadované kumulativní četnosti komplikovaných a symptomatických vředů po 9 měsících u pacientů léčených přípravkem CELEBREX 400 mg dvakrát denně jsou popsány v tabulce 7. Tabulka 7 také uvádí výsledky pro pacienty mladší nebo starší 65 let. Rozdíl v rychlostech mezi CELEBREX 200 mg samotným a CELEBREX 100 mg se skupinami ASA může být způsoben vyšším rizikem gastrointestinálních příhod u uživatelů ASA.
malého počtu pacientů s vředovou chorobou v anamnéze byla míra komplikovaných a symptomatických vředů u pacientů užívajících CELEBREX 100 mg samotný nebo CELEBREX 100 mg s ASA 2,56 % (n=243) a 6,85 % (n=91) při 48 týdnů. Tyto výsledky je třeba očekávat u pacientů s předchozí anamnézou vředové choroby [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Výsledky kardiovaskulární bezpečnosti byly také hodnoceny ve studii CLASS. Kaplan-Meier kumulativní četnost závažných kardiovaskulárních tromboembolických nežádoucích příhod hlášených zkoušejícím (včetně IM, plicní embolie, hluboké žilní trombózy, nestabilní anginy pectoris, přechodných ischemických ataků a ischemických cerebrovaskulárních příhod) neprokázala žádné rozdíly mezi léčbou přípravkem CELEBREX 200 mg, diklofenakem nebo ibuprofenakem. skupiny. Kumulativní míry u všech pacientů po devíti měsících pro CELEBREX, diklofenak a ibuprofen byly 1,2 %, 1,4 % a 1,1 %, v tomto pořadí. Kumulativní míry u uživatelů bez ASA po devíti měsících v každé ze tří léčebných skupin byly menší než 1 %. Kumulativní četnost infarktu myokardu u uživatelů bez ASA po devíti měsících v každé ze tří léčebných skupin byla nižší než 0,2 %. Ve studii CLASS nebyla žádná skupina s placebem, což omezuje možnost určit, zda tři testované léky neměly zvýšené riziko KV příhod nebo zda všechny zvyšovaly riziko v podobné míře. Ve studii CLASS byly zjištěny kumulativní míry Kaplan-Meierova periferního edému po 9 měsících u pacientů užívajících CELEBREX 400 mg dvakrát denně (4násobek a 2násobek doporučených dávek OA a RA), ibuprofen 800 mg třikrát denně a diklofenaku 75 mg dvakrát denně byly 4,5 %, 6,9 % a 4,7 %, v uvedeném pořadí. Výskyt hypertenze ze studie CLASS u pacientů léčených CELEBREXEM, ibuprofenem a diklofenakem byl 2,4 %, 4,2 % a 2,5 %.
Endoskopické studie
Korelace mezi nálezy krátkodobých endoskopických studií s přípravkem CELEBREX a relativním výskytem klinicky významných závažných příhod v horní části GI při dlouhodobém užívání nebyla stanovena. Závažné klinicky významné krvácení do horního GI traktu bylo pozorováno u pacientů užívajících CELEBREX 100 mg v kontrolovaných a otevřených studiích (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Klinické studie ].
Byla provedena randomizovaná, dvojitě zaslepená studie u 430 pacientů s RA, ve které bylo provedeno endoskopické vyšetření po 6 měsících. Incidence endoskopických vředů u pacientů užívajících CELEBREX 200 mg dvakrát denně byla 4 % oproti 15 % u pacientů užívajících diklofenak SR 75 mg dvakrát denně. Nicméně CELEBREX nebyl statisticky odlišný od diklofenaku pro klinicky relevantní GI výsledky ve studii CLASS (viz Klinické studie ].
Incidence endoskopických vředů byla studována ve dvou 12týdenních, placebem kontrolovaných studiích u 2157 pacientů s OA a RA, u kterých výchozí endoskopie neprokázaly žádné vředy. Neexistoval žádný vztah mezi dávkou pro výskyt gastroduodenálních vředů a dávkou přípravku CELEBREX (50 mg až 400 mg dvakrát denně). Incidence u naproxenu 500 mg dvakrát denně byla ve dvou studiích 16,2 % a 17,6 %, u placeba 2,0 % a 2,3 % a u všech dávek přípravku CELEBREX se incidence pohybovala mezi 2,7 % – 5,9 %. Nebyly provedeny žádné velké studie klinických výsledků, které by porovnávaly klinicky relevantní výsledky GI s přípravkem CELEBREX a naproxenem.
V endoskopických studiích přibližně 11 % pacientů užívalo aspirin (≤ 325 mg/den). Ve skupinách CELEBREX se zdálo, že výskyt endoskopických vředů je vyšší u uživatelů aspirinu než u neužívajících. Zvýšený výskyt vředů u těchto uživatelů aspirinu byl však nižší než výskyt endoskopických vředů pozorovaný ve skupinách s aktivním komparátorem, s aspirinem nebo bez něj.
INFORMACE PRO PACIENTA
Průvodce léky pro nesteroidní protizánětlivé léky (NSAID)
Jaké jsou nejdůležitější informace, které bych měl vědět o lécích nazývaných nesteroidní protizánětlivé léky (NSAID)?
NSAID mohou způsobit závažné nežádoucí účinky, včetně:
- Zvýšené riziko srdečního infarktu nebo mrtvice, které mohou vést k smrti. Toto riziko se může objevit na začátku léčby a může se zvýšit:
- se zvyšujícími se dávkami NSAID
- při delším užívání NSAID
Neužívejte NSAID těsně před nebo po operaci srdce nazývané „bypass koronární artérie (CABG). Vyhněte se užívání NSAID po nedávném srdečním infarktu, pokud vám to neřekne váš poskytovatel zdravotní péče. Pokud užíváte NSAID po nedávném srdečním infarktu, můžete mít zvýšené riziko dalšího srdečního infarktu.
- Zvýšené riziko krvácení, vředů a trhlin (perforace) jícnu (trubice vedoucí z úst do žaludku), žaludku a střev:
- kdykoliv během používání
- bez varovných příznaků
- které mohou způsobit smrt
- Riziko vzniku vředu nebo krvácení se zvyšuje s:
- žaludeční vředy nebo krvácení do žaludku nebo střev při užívání NSAID v minulosti
- užívání léků nazývaných „kortikosteroidy“, „protidestičkové léky“, „antikoagulancia“, „SSRI“ nebo „SNRI“
- zvyšující se dávky NSAID
- delší užívání NSAID
- kouření
- pití alkoholu
- vyšší věk
- špatný zdravotní stav
- pokročilé onemocnění jater
- problémy s krvácením
- NSAID by se měly používat pouze:
- přesně podle předpisu
- v nejnižší možné dávce pro vaši léčbu
- na co nejkratší potřebnou dobu
Co jsou NSAID?
NSAID se používají k léčbě bolesti a zarudnutí, otoku a tepla (zánětu) ze zdravotních stavů, jako jsou různé typy artritidy, menstruační křeče a jiné typy krátkodobé bolesti.
Kdo by neměl užívat NSAID?
Neužívejte NSAID:
- jestliže jste měl(a) astmatický záchvat, kopřivku nebo jinou alergickou reakci na aspirin nebo jiné NSAID.
- těsně před nebo po operaci bypassu srdce.
Než začnete užívat NSAID, informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- máte problémy s játry nebo ledvinami
- mají vysoký krevní tlak
- mít astma
- jste těhotná nebo plánujete otěhotnět. Užívání NSAID přibližně ve 20. týdnu těhotenství nebo později může poškodit vaše nenarozené dítě. Pokud potřebujete užívat NSAID déle než 2 dny, když jste mezi 20. a 30. týdnem těhotenství, váš poskytovatel zdravotní péče možná bude muset sledovat množství tekutiny ve vaší děloze kolem vašeho dítěte. Přibližně po 30 týdnech těhotenství byste neměla užívat NSAID
- kojíte nebo plánujete kojit.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis nebo volně prodejných léků, vitamínů nebo bylinných doplňků. NSAID a některé další léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky. Nezačínejte užívat žádný nový lék, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče.
Jaké jsou možné vedlejší účinky NSAID?
NSAID mohou způsobit závažné nežádoucí účinky, včetně:
Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o lécích nazývaných nesteroidní protizánětlivé léky (NSAID)?
- nový nebo horší vysoký krevní tlak
- srdeční selhání
- problémy s játry včetně selhání jater
- problémy s ledvinami včetně selhání ledvin
- nízký počet červených krvinek (anémie)
- život ohrožující kožní reakce
- život ohrožující alergické reakce
Mezi další nežádoucí účinky NSAID patří: bolest žaludku, zácpa, průjem, plynatost, pálení žáhy, nevolnost, zvracení a závratě.
Pokud se u vás objeví některý z následujících příznaků, okamžitě vyhledejte pomoc v nouzi:
- dušnost nebo potíže s dýcháním
- bolest na hrudi
- slabost v jedné části nebo straně vašeho těla
- nezřetelná řeč
- otok obličeje nebo hrdla
Přestaňte užívat NSAID a okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u Vás objeví některý z následujících příznaků:
- nevolnost
- unavenější nebo slabší než obvykle
- průjem
- svědění
- vaše kůže nebo oči vypadají žlutě
- poruchy trávení nebo bolesti žaludku
- příznaky podobné chřipce
- zvracet krev
- máte krev ve střevech nebo je černá a lepkavá jako dehet
- neobvyklý nárůst hmotnosti
- kožní vyrážka nebo puchýře s horečkou
- otoky paží, nohou, rukou a chodidel
Pokud užijete příliš mnoho NSAID, zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc.
To nejsou všechny možné vedlejší účinky NSAID. Další informace o NSAID získáte u svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Další informace o NSAID
- Aspirin je NSAID, ale nezvyšuje riziko srdečního infarktu. Aspirin může způsobit krvácení do mozku, žaludku a střev. Aspirin může také způsobit vředy v žaludku a střevech.
- Některá NSAID se prodávají v nižších dávkách bez lékařského předpisu (volně prodejné). Poraďte se se svým poskytovatelem zdravotní péče před používáním volně prodejných NSAID po dobu delší než 10 dní.
Obecné informace o bezpečném a účinném užívání NSAID
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte NSAID pro stav, pro který nebyly předepsány. Nedávejte NSAID jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Pokud byste chtěli více informací o NSAID, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o NSAID, které jsou určeny pro zdravotníky.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
