Imitrex 100mg, 25mg, 50mg Sumatriptan Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Imitrex 25 mg a jak se používá?
Imitrex 100 mg je lék na předpis používaný k léčbě příznaků migrénové bolesti hlavy a klastrové bolesti hlavy. Imitrex lze užívat samostatně nebo s jinými léky.
Imitrex 50 mg je antimigrenikum, agonista seratoninového 5-HT-receptoru.
Není známo, zda je přípravek Imitrex 50 mg bezpečný a účinný u dětí mladších 18 let a použití se nedoporučuje u geriatrických pacientů.
Jaké jsou možné vedlejší účinky přípravku Imitrex 50 mg?
Imitrex 25 mg může způsobit závažné nežádoucí účinky, včetně:
- náhlá, silná bolest žaludku,
- průjem s přítomností krve nebo bez ní,
- silná bolest na hrudi,
- bolest v čelisti nebo rameni,
- dušnost,
- nepravidelný srdeční tep,
- záchvat (křeče),
- křeče v nohou,
- necitlivost nebo mravenčení v nohou nebo chodidlech,
- palčivá bolest nohou nebo chodidel,
- pocit chladu v nohách nebo chodidlech,
- změny barvy nohou nebo chodidel,
- bolest kyčle,
- nevolnost,
- zvracení,
- pocení nebo třesavka,
- míchání,
- halucinace,
- horečka,
- svalová ztuhlost,
- ztráta koordinace,
- náhlá necitlivost nebo slabost na jedné straně těla,
- nezřetelná řeč,
- potíže s viděním,
- špatná rovnováha a
- náhlá silná bolest hlavy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Imitrex patří:
- bolest nebo tlak na hrudi, krku nebo čelisti,
- tlak v jakékoli části vašeho těla,
- necitlivost nebo mravenčení,
- pocit horka nebo chladu,
- závrať,
- ospalost,
- slabost,
- nepříjemná chuť po použití nosního léku,
- bolest, pálení, necitlivost nebo mravenčení v nose nebo krku po použití nosního léku a
- rýma nebo ucpaný nos po použití nosního léku
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Imitrex. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
IMITREX 50 mg injekce obsahuje sumatriptan sukcinát, selektivního agonistu 5-HT1B/1D receptoru. Sumatriptan sukcinát je chemicky označen jako 3-[2-(dimethylamino)ethyl]-N-methyl-indol5-methansulfonamid sukcinát (1:1) a má následující strukturu:
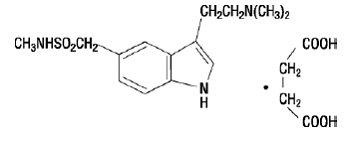
Empirický vzorec je C14H21N3O2S•C4H6O4, což představuje molekulovou hmotnost 413,5. Sumatriptan sukcinát je bílý až téměř bílý prášek, který je snadno rozpustný ve vodě a ve fyziologickém roztoku.
Injekce IMITREX je čirý, bezbarvý až světle žlutý, sterilní, nepyrogenní roztok pro subkutánní injekci. Každých 0,5 ml injekčního roztoku IMITREX 8 mg/ml obsahuje 4 mg sumatriptanu (báze) jako sukcinátovou sůl a 3,8 mg chloridu sodného, USP ve vodě na injekci, USP. Každých 0,5 ml injekčního roztoku IMITREX 12 mg/ml obsahuje 6 mg sumatriptanu (báze) jako sukcinátovou sůl a 3,5 mg chloridu sodného, USP ve vodě na injekci, USP. Rozsah pH obou roztoků je přibližně 4,2 až 5,3. Osmolalita obou injekcí je 291 mOsmol.
INDIKACE
IMITREX® Injection je indikován u dospělých k (1) akutní léčbě migrény, s aurou nebo bez aury, a (2) akutní léčbě klastrové bolesti hlavy.
Omezení použití
- Používejte pouze v případě, že byla stanovena jasná diagnóza migrény nebo klastrové bolesti hlavy. Pokud pacient nereaguje na první záchvat migrény nebo klastrové bolesti hlavy léčený přípravkem IMITREX 50 mg Injection, znovu zvažte diagnózu před podáním přípravku IMITREX Injection k léčbě jakýchkoli následných záchvatů.
- IMITREX Injection není indikován k prevenci migrény nebo záchvatů skupinové bolesti hlavy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o dávkování
Maximální jednotlivá doporučená dávka přípravku IMITREX 25 mg Injection pro dospělé pro akutní léčbu migrény nebo skupinové bolesti hlavy je 6 mg podaných subkutánně. K léčbě migrény, pokud vedlejší účinky omezují dávku, mohou být použity nižší dávky (1 mg až 5 mg) [viz Klinické studie ]. Pro léčbu klastrové bolesti hlavy nebyla stanovena účinnost nižších dávek.
Maximální kumulativní dávka, kterou lze podat za 24 hodin, je 12 mg, dvě 6mg injekce s odstupem alespoň 1 hodiny. Druhá dávka 6 mg by měla být zvážena pouze v případě, že byla pozorována určitá odpověď na první injekci.
Podávání pomocí pera IMITREX STATdose Pen®
Autoinjektor (IMITREX 25 mg STATdose Pen) je k dispozici pro použití se 4 mg a 6 mg předplněnými zásobními vložkami do injekčních stříkaček. S tímto zařízením pronikne jehla přibližně 1/4 palce (5 až 6 mm). Injekce je určena pro subkutánní podání a je třeba se vyhnout intramuskulárnímu nebo intravaskulárnímu podání. Poučte pacienty o správném používání pera IMITREX 100 mg STATdose Pen a nařiďte jim, aby používali místa vpichu s přiměřenou tloušťkou kůže a podkoží, aby se přizpůsobila délce jehly.
Podávání jiných dávek přípravku IMITREX než 4 nebo 6 mg
pacientů, kteří dostávají dávky jiné než 4 mg nebo 6 mg, použijte 6mg jednodávkovou lahvičku; nepoužívejte pero IMITREX 50 mg STATdose Pen. Před podáním vizuálně zkontrolujte injekční lahvičku, zda neobsahuje částice a nezměnila barvu. Nepoužívejte, pokud jsou zaznamenány částice a zabarvení.
JAK DODÁVÁNO
Dávkové formy A Síly
- Injekce: 4mg a 6mg jednodávkové předplněné zásobní vložky do injekční stříkačky pro použití s perem IMITREX STATdose Pen.
- Injekce: 6mg jednodávková injekční lahvička.
Skladování A Manipulace
IMITREX 100 mg injekce obsahuje sumatriptan (bázi) jako sukcinátovou sůl a je dodáván jako čirý, bezbarvý až světle žlutý, sterilní, nepyrogenní roztok takto:
Předplněná injekční stříkačka a/nebo autoinjektorové pero
Každé balení obsahuje příbalovou informaci pro pacienty a návod k použití.
IMITREX 100 mg STATdose System®, 4 mg , obsahující 1 pero IMITREX 25 mg STATdose Pen, 2 předplněné zásobníky na jednodávkové injekční stříkačky a 1 přepravní pouzdro ( NDC 0173-0739-00).
IMITREX 100 mg STATdávkový systém, 6 mg obsahující 1 pero IMITREX STATdose Pen, 2 předplněné zásobníky jednodávkových injekčních stříkaček a 1 přepravní pouzdro ( NDC 0173-0479-00).
Dvě 4mg jednodávkové předplněné injekční stříkačky náplně pro použití se systémem IMITREX STATdose ( NDC 0173-0739-02).
Dvě 6mg jednodávkové předplněné injekční stříkačky zásobní vložky pro použití se systémem IMITREX 25 mg STATdose System ( NDC 0173-0478-00).
Jednodávková lahvička
IMITREX 25 mg injekční lahvička s jednou dávkou (6 mg/0,5 ml) v krabičkách obsahujících 5 lahviček ( NDC 01730449-02).
Uchovávejte při teplotě 2° až 30°C (36° až 86°F). Chraňte před světlem.
GlaxoSmithKline, Research Triangle Park, NC 27709
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Ischemie myokardu, infarkt myokardu a Prinzmetalova angina pectoris [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Arytmie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Bolest/těsnost/tlak na hrudi, krku, krku a/nebo čelisti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Cévní mozkové příhody [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Jiné vazospazmatické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Bolesti hlavy z nadužívání léků [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšení krevního tlaku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Migréna
Tabulka 1 uvádí nežádoucí účinky, které se objevily ve 2 placebem kontrolovaných klinických studiích v USA u pacientů s migrénou (studie 2 a 3) buď po jednorázové 6mg dávce IMITREX 100mg Injection, nebo po placebu. V tabulce 1 jsou zahrnuty pouze reakce, které se vyskytly s frekvencí 2 % nebo více ve skupinách léčených IMITREX Injection 6 mg a které se vyskytly s frekvencí vyšší než ve skupině s placebem.
Výskyt nežádoucích účinků v kontrolovaných klinických studiích nebyl ovlivněn pohlavím ani věkem pacientů. K posouzení vlivu rasy na výskyt nežádoucích účinků nebyly k dispozici dostatečné údaje.
Cluster Bolest hlavy
V kontrolovaných klinických studiích hodnotících účinnost přípravku IMITREX 50 mg Injection jako léčby klastrové bolesti hlavy (studie 4 a 5) nebyly zjištěny žádné nové významné nežádoucí účinky, které již nebyly identifikovány ve studiích přípravku IMITREX 100 mg u pacientů s migrénou.
Celkově byla frekvence nežádoucích účinků hlášených ve studiích klastrové bolesti hlavy obecně nižší než ve studiích s migrénou. Mezi výjimky patří hlášení parestézie (5 % IMITREX, 0 % placebo), nauzea a zvracení (4 % IMITREX, 0 % placebo) a bronchospasmus (1 % IMITREX 50 mg, 0 % placebo).
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během postregistračního užívání IMITREX 50 mg tablety, IMITREX nosní sprej a IMITREX 50 mg injekce. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Kardiovaskulární
Hypotenze, palpitace.
Neurologický
Dystonie, třes.
DROGOVÉ INTERAKCE
Léky obsahující námel
Bylo hlášeno, že léky obsahující námel způsobují prodloužené vazospastické reakce. Protože tyto účinky mohou být aditivní, je kontraindikováno použití léků obsahujících ergotamin nebo léků typu ergotamínu (jako je dihydroergotamin nebo methysergid) a IMITREX 25 mg Injection během 24 hodin od sebe.
Inhibitory monoaminoxidázy-A
Inhibitory MAO-A zvyšují systémovou expozici dvojnásobně. Proto je použití injekce IMITREX u pacientů užívajících inhibitory MAO-A kontraindikováno (viz KLINICKÁ FARMAKOLOGIE ].
Další 5-HT1 agonisté
Vzhledem k tomu, že jejich vazospastické účinky mohou být aditivní, je současné podávání přípravku IMITREX Injection a jiných 5-HT1 agonistů (např. triptanů) během 24 hodin od sebe kontraindikováno.
Selektivní inhibitory zpětného vychytávání serotoninu / Inhibitory zpětného vychytávání serotoninu a norepinefrinu a serotoninový syndrom
Při současném podávání triptanů a SSRI, SNRI, TCA a inhibitorů MAO byly hlášeny případy serotoninového syndromu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Ischemie myokardu, infarkt myokardu a Prinzmetalova angina
Použití přípravku IMITREX Injection je kontraindikováno u pacientů s ischemickou nebo vazospastickou ICHS. Vzácně byly hlášeny závažné nežádoucí účinky na srdce, včetně akutního infarktu myokardu, které se objevily během několika hodin po podání injekce IMITREX. Některé z těchto reakcí se objevily u pacientů bez známé ICHS. IMITREX 100 mg injekce může způsobit vazospasmus koronární artérie (Prinzmetalova angina), a to i u pacientů bez ICHS v anamnéze.
Před podáním injekce IMITREX proveďte kardiovaskulární vyšetření u pacientů dosud neléčených triptanem, kteří mají více kardiovaskulárních rizikových faktorů (např. zvýšený věk, diabetes, hypertenze, kouření, obezita, silná rodinná anamnéza ICHS). Pokud se objeví ICHS nebo vazospasmus koronární artérie, je IMITREX 100 mg injekce kontraindikován. U pacientů s více kardiovaskulárními rizikovými faktory, kteří mají negativní kardiovaskulární hodnocení, zvažte podání první dávky přípravku IMITREX Injection v prostředí pod lékařským dohledem a provedení elektrokardiogramu (EKG) bezprostředně po podání přípravku IMITREX Injection. U takových pacientů zvažte pravidelné kardiovaskulární vyšetření u intermitentních dlouhodobých uživatelů přípravku IMITREX 100 mg Injection.
Arytmie
Život ohrožující poruchy srdečního rytmu, včetně ventrikulární tachykardie a ventrikulární fibrilace vedoucí k úmrtí, byly hlášeny během několika hodin po podání agonistů 5-HT1. Pokud k těmto poruchám dojde, přerušte aplikaci IMITREX Injection. IMITREX Injection je kontraindikován u pacientů s Wolff-Parkinson-White syndromem nebo arytmiemi spojenými s jinými poruchami srdeční akcesorní převodní dráhy.
Hrudník, hrdlo, krk a/nebo bolest/těsnost/tlak čelisti
Pocity napětí, bolesti, tlaku a tíhy v prekordiu, krku, krku a čelisti se běžně objevují po léčbě přípravkem IMITREX Injection a jsou obvykle nekardiálního původu. Pokud však mají tito pacienti vysoké kardiální riziko, proveďte vyšetření srdce. Použití IMITREX Injection je kontraindikováno u pacientů s CAD a pacientů s Prinzmetalovou variantou anginy pectoris.
Cévní mozkové příhody
pacientů léčených agonisty 5-HT1 se vyskytlo mozkové krvácení, subarachnoidální krvácení a cévní mozková příhoda a některé vedly k úmrtím. V řadě případů se zdá možné, že cerebrovaskulární příhody byly primární, agonista 5-HT1 byl podáván v nesprávném přesvědčení, že prožívané symptomy byly důsledkem migrény, i když tomu tak nebylo. Pacienti s migrénou mohou mít také zvýšené riziko určitých cerebrovaskulárních příhod (např. mrtvice, krvácení, TIA). Pokud dojde k cerebrovaskulární příhodě, přerušte podávání přípravku IMITREX Injection.
Před léčbou bolestí hlavy u pacientů, u kterých nebyla dříve diagnostikována migréna nebo klastrová bolest hlavy nebo u pacientů s atypickými příznaky, vylučte jiné potenciálně závažné neurologické stavy. IMITREX Injection je kontraindikován u pacientů s anamnézou cévní mozkové příhody nebo TIA.
Jiné vazospasmové reakce
IMITREX 25 mg injekce může způsobit nekoronární vazospastické reakce, jako je periferní vaskulární ischemie, gastrointestinální vaskulární ischemie a infarkt (projevující se bolestí břicha a krvavým průjmem), infarkt sleziny a Raynaudův syndrom. U pacientů, kteří po použití jakéhokoli 5-HT1 agonisty pociťují symptomy nebo známky naznačující nekoronární vazospasmickou reakci, vylučte před podáním dalších injekcí IMITREX vazospastickou reakci.
Při užívání 5-HT1 agonistů byly hlášeny případy přechodné a trvalé slepoty a významné částečné ztráty zraku. Protože poruchy zraku mohou být součástí záchvatu migrény, příčinná souvislost mezi těmito příhodami a použitím 5-HT1 agonistů nebyla jasně stanovena.
Nadužívání léků Bolest hlavy
Nadužívání léků na akutní migrénu (např. ergotamin, triptany, opioidy nebo kombinace těchto léků po dobu 10 nebo více dnů v měsíci) může vést k exacerbaci bolesti hlavy (bolesti hlavy z nadužívání léků). Bolesti hlavy z nadměrného užívání léků se mohou projevovat jako každodenní bolesti hlavy podobné migréně nebo jako výrazné zvýšení frekvence záchvatů migrény. Může být nezbytná detoxikace pacientů, včetně vysazení nadužívaných léků, a léčba abstinenčních příznaků (které často zahrnují přechodné zhoršení bolesti hlavy).
serotoninový syndrom
Serotoninový syndrom se může objevit u injekce IMITREX, zejména při současném podávání se selektivními inhibitory zpětného vychytávání serotoninu (SSRI), inhibitory zpětného vychytávání serotoninu a norepinefrinu (SNRI), tricyklickými antidepresivy (TCA) a inhibitory MAO [viz DROGOVÉ INTERAKCE ]. Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, hypertermii), neuromuskulární aberace (např. hyperreflexie, nekoordinovanost) a/nebo gastrointestinální příznaky (např. nevolnost, zvracení, průjem). K nástupu symptomů obvykle dochází během minut až hodin po podání nové nebo větší dávky serotonergního léku. Při podezření na serotoninový syndrom přerušte podávání přípravku IMITREX Injection.
Zvýšení krevního tlaku
Významné zvýšení krevního tlaku, včetně hypertenzní krize s akutním poškozením orgánových systémů, bylo vzácně hlášeno u pacientů léčených 5-HT1 agonisty, včetně pacientů bez anamnézy hypertenze. Monitorujte krevní tlak u pacientů léčených přípravkem IMITREX. IMITREX Injection je kontraindikován u pacientů s nekontrolovanou hypertenzí.
Anafylaktické/anafylaktoidní reakce
pacientů užívajících IMITREX se objevily anafylaktické/anafylaktoidní reakce. Takové reakce mohou být život ohrožující nebo smrtelné. Obecně platí, že anafylaktické reakce na léky se častěji vyskytují u jedinců s anamnézou citlivosti na více alergenů. IMITREX 50 mg injekce je kontraindikován u pacientů s anamnézou hypersenzitivní reakce na IMITREX.
Záchvaty
Po podání přípravku IMITREX byly hlášeny záchvaty. Některé se vyskytly u pacientů buď s anamnézou záchvatů, nebo se současnými stavy predisponujícími k záchvatům. Existují také zprávy u pacientů, kde žádné takové predispoziční faktory nejsou zjevné. IMITREX Injection by měl být používán s opatrností u pacientů s epilepsií v anamnéze nebo se stavy spojenými se sníženým prahem křečí.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA a návod k použití ).
Riziko ischemie a/nebo infarktu myokardu, Prinzmetalovy anginy, jiných příhod souvisejících s vazospasmem, arytmií a cerebrovaskulárních příhod
Informujte pacienty, že IMITREX 50 mg Injection může způsobit závažné kardiovaskulární nežádoucí účinky, jako je infarkt myokardu nebo cévní mozková příhoda. I když závažné kardiovaskulární příhody mohou nastat bez varovných příznaků, pacienti by si měli všímat známek a příznaků bolesti na hrudi, dušnosti, nepravidelného srdečního tepu, výrazného zvýšení krevního tlaku, slabosti a nezřetelné řeči a měli by požádat o lékařskou pomoc, pokud jsou pozorovány jakékoli indikativní známky nebo příznaky. Informujte pacienty o důležitosti tohoto sledování [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Anafylaktické/anafylaktoidní reakce
Informujte pacienty, že u pacientů užívajících IMITREX 100 mg injekce se objevily anafylaktické/anafylaktoidní reakce. Takové reakce mohou být život ohrožující nebo smrtelné. Obecně platí, že anafylaktické reakce na léky se pravděpodobněji vyskytují u jedinců s anamnézou citlivosti na více alergenů [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Současné užívání s jinými triptany nebo námelovými léky
Informujte pacienty, že použití přípravku IMITREX 50 mg Injection do 24 hodin od jiného triptanu nebo léku ergotového typu (včetně dihydroergotaminu nebo methysergidu) je kontraindikováno (viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
serotoninový syndrom
Varujte pacienty před rizikem serotoninového syndromu při použití injekce IMITREX nebo jiných triptanů, zejména při kombinovaném použití s SSRI, SNRI, TCA a inhibitory MAO (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Nadužívání léků Bolest hlavy
Informujte pacienty, že užívání léků na akutní migrénu po dobu 10 nebo více dní v měsíci může vést k exacerbaci bolesti hlavy a povzbuďte pacienty, aby zaznamenávali frekvenci bolesti hlavy a užívání drog (např. vedením deníku bolesti hlavy) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těhotenství
Informujte pacienty, že IMITREX 25 mg injekce by se neměl používat během těhotenství, pokud potenciální přínos neospravedlňuje potenciální riziko pro plod (viz Použití u konkrétních populací ].
Kojící matky
Informujte pacienty, aby informovali svého poskytovatele zdravotní péče, pokud kojí nebo plánují kojit [viz Použití ve specifických populacích ].
Schopnost provádět složité úkoly
Léčba přípravkem IMITREX 25 mg injekce může způsobit somnolenci a závratě; poučte pacienty, aby po podání přípravku IMITREX 25mg Injection zhodnotili svou schopnost provádět složité úkoly.
Jak se IMITREX 100 mg injekce používá
Poskytněte pacientům instrukce o správném použití přípravku IMITREX 100 mg Injection, pokud jsou schopni si sami aplikovat IMITREX 50 mg Injection v situacích bez lékařského dohledu.
Informujte pacienty, že jehla v peru IMITREX STATdose Pen proniká přibližně 1/4 palce (5 až 6 mm). Informujte pacienty, že injekce je určena k subkutánnímu podání a je třeba se vyhnout intramuskulárnímu nebo intravaskulárnímu podání. Poučte pacienty, aby používali místa vpichu s přiměřenou tloušťkou kůže a podkoží, aby se přizpůsobila délce jehly.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Ve studiích karcinogenity u myší a potkanů, kterým byl sumatriptan podáván perorálně po dobu 78 týdnů, respektive 104 týdnů, v dávkách až 160 mg/kg/den (nejvyšší dávka u potkanů byla snížena z 360 mg/kg/den během týdne 21 ). Nejvyšší dávka u myší a potkanů byla přibližně 130 a 260krát vyšší než jednotlivá MRHD 6 mg podaná subkutánně na základě mg/m². U žádného druhu nebylo prokázáno zvýšení počtu nádorů souvisejících s podáváním sumatriptanu.
Mutageneze
Sumatriptan byl negativní v testech in vitro (bakteriální reverzní mutace [Ames], mutace genových buněk u čínského křečka V79/HGPRT, chromozomální aberace v lidských lymfocytech) a in vivo (mikronukleus potkana).
Zhoršení plodnosti
Když byl sumatriptan podáván subkutánní injekcí samcům a samicím potkanů před a během období páření, nebyly zjištěny žádné známky poškození plodnosti v dávkách až 60 mg/kg/den nebo přibližně 100násobku jednorázové dávky 6 mg pro člověka. mg/m² základ. Když byl sumatriptan (5, 50, 500 mg/kg/den) podáván perorálně samcům a samičkám potkanů před a během období páření, došlo ke snížení plodnosti souvisejícímu s léčbou sekundárním ke snížení páření u zvířat léčených dávkami vyšší než 5 mg/kg/den. Není jasné, zda toto zjištění bylo způsobeno účinkem na muže nebo ženy nebo obojí.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství C
Neexistují žádné adekvátní a dobře kontrolované studie přípravku IMITREX 50 mg Injection u těhotných žen. Ve studiích vývojové toxicity u potkanů a králíků bylo perorální podávání sumatriptanu březím zvířatům spojeno s embryoletalitou, abnormalitami plodu a mortalitou mláďat. Při intravenózním podání březím králíkům byl sumatriptan embryoletální. IMITREX 100 mg injekce by měl být podáván během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Perorální podávání sumatriptanu březím potkanům během období organogeneze vedlo ke zvýšenému výskytu abnormalit fetálních krevních cév (cervikothorakálních a umbilikálních). Nejvyšší dávka bez účinku na embryofetální vývojovou toxicitu v míře byla 60 mg/kg/den nebo přibližně 100násobek jedné maximální doporučené dávky pro člověka (MRHD) 6 mg podané subkutánně na základě mg/m². Perorální podávání sumatriptanu březím králíkům během období organogeneze vedlo ke zvýšenému výskytu embryoletality a fetálních cervikotorakálních vaskulárních a skeletálních abnormalit. Intravenózní podávání sumatriptanu březím králíkům během období organogeneze vedlo ke zvýšenému výskytu embryoletality. Nejvyšší perorální a intravenózní dávky bez účinku na vývojovou toxicitu u králíků byly 15 a 0,75 mg/kg/den, nebo přibližně 50, respektive 2násobek jednorázové MRHD 6 mg podané subkutánně na základě mg/m².
Perorální podávání sumatriptanu potkanům před a během březosti vedlo k embryofetální toxicitě (snížení tělesné hmotnosti, snížená osifikace, zvýšený výskyt kosterních abnormalit). Nejvyšší dávka bez účinku byla 50 mg/kg/den nebo přibližně 80násobek jedné MRHD 6 mg podané subkutánně na základě mg/m². U potomků březích potkanů léčených perorálně sumatriptanem během organogeneze došlo ke snížení přežití mláďat. Nejvyšší dávka bez účinku pro tento účinek byla 60 mg/kg/den nebo přibližně 100násobek jednotlivé MRHD 6 mg podané subkutánně na základě mg/m². Perorální podávání sumatriptanu březím krysám během druhé fáze březosti a během laktace vedlo ke snížení přežití mláďat. Nejvyšší dávka bez účinku pro toto zjištění byla 100 mg/kg/den, neboli přibližně 160násobek jednotlivé MRHD 6 mg podané subkutánně na základě mg/m².
Kojící matky
Sumatriptan se po subkutánním podání vylučuje do lidského mléka. Expozici kojenců sumatriptanu lze minimalizovat tím, že se 12 hodin po léčbě přípravkem IMITREX 50 mg injekce vyvarujete kojení.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena. IMITREX 100 mg injekce se nedoporučuje používat u pacientů mladších 18 let.
Dvě kontrolované klinické studie hodnotily IMITREX nosní sprej (5 až 20 mg) u 1 248 dětských migreniků ve věku 12 až 17 let, kteří léčili jeden záchvat. Studie neprokázaly účinnost přípravku IMITREX nosní sprej ve srovnání s placebem při léčbě migrény u pediatrických pacientů. Nežádoucí účinky pozorované v těchto klinických studiích byly podobné povahy jako nežádoucí účinky hlášené v klinických studiích u dospělých.
Pět kontrolovaných klinických studií (2 studie s jedním záchvatem, 3 studie s vícenásobným záchvatem) hodnotících perorální IMITREX (25 až 100 mg) u pediatrických pacientů ve věku 12 až 17 let zahrnovalo celkem 701 dětských migrén. Tyto studie neprokázaly účinnost perorálního přípravku IMITREX 25 mg ve srovnání s placebem v léčbě migrény u pediatrických pacientů. Nežádoucí účinky pozorované v těchto klinických studiích byly podobné povahy jako nežádoucí účinky hlášené v klinických studiích u dospělých. Frekvence všech nežádoucích účinků u těchto pacientů se zdála být závislá jak na dávce, tak na věku, přičemž mladší pacienti hlásili reakce častěji než starší pediatričtí pacienti.
Postmarketingové zkušenosti dokumentují, že u pediatrické populace se po subkutánním, perorálním a/nebo intranazálním podání IMITREXu objevily závažné nežádoucí účinky. Tato hlášení zahrnují reakce podobné povahy těm, které byly hlášeny vzácně u dospělých, včetně mrtvice, ztráty zraku a úmrtí. Infarkt myokardu byl hlášen u 14letého muže po užití perorálního přípravku IMITREX; klinické příznaky se objevily do 1 dne po podání léku. Klinické údaje ke stanovení frekvence závažných nežádoucích účinků u pediatrických pacientů, kteří mohou dostávat subkutánně, perorálně nebo intranazálně IMITREX, nejsou v současné době k dispozici.
Geriatrické použití
Klinické studie přípravku IMITREX 100 mg Injection nezahrnovaly dostatečný počet pacientů ve věku 65 let a starších, aby bylo možné určit, zda reagují odlišně od mladších pacientů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Kardiovaskulární vyšetření se doporučuje u geriatrických pacientů, kteří mají jiné kardiovaskulární rizikové faktory (např. diabetes, hypertenze, kouření, obezita, silná rodinná anamnéza ICHS) před podáním injekce IMITREX [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
PŘEDÁVKOVAT
Po intravenózním podání IMITREX 50 mg injekce byl pozorován koronární vazospasmus (viz KONTRAINDIKACE ]. Z údajů na zvířatech (psi 0,1 g/kg, potkani 2 g/kg) lze očekávat předávkování, které může způsobit křeče, třes, nečinnost, erytém končetin, sníženou frekvenci dýchání, cyanózu, ataxii, mydriázu, reakce v místě vpichu ( deskvamace, vypadávání vlasů a tvorba strupů) a paralýza.
Eliminační poločas sumatriptanu je asi 2 hodiny [viz KLINICKÁ FARMAKOLOGIE ]; proto by sledování pacientů po předávkování přípravkem IMITREX Injection mělo pokračovat alespoň 10 hodin nebo dokud symptomy nebo příznaky přetrvávají.
Není známo, jaký vliv má hemodialýza nebo peritoneální dialýza na sérové koncentrace sumatriptanu.
KONTRAINDIKACE
IMITREX Injection je kontraindikován u pacientů s:
- Ischemická choroba koronárních arterií (CAD) (angina pectoris, anamnéza infarktu myokardu nebo dokumentovaná němá ischemie) nebo vazospasmus koronární arterie, včetně Prinzmetalovy anginy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Wolff-Parkinson-White syndrom nebo arytmie spojené s jinými poruchami srdeční akcesorní vodivé dráhy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Anamnéza mrtvice nebo tranzitorní ischemické ataky (TIA) nebo anamnéza hemiplegické nebo bazilární migrény, protože tito pacienti mají vyšší riziko mrtvice (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Onemocnění periferních cév [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Ischemická choroba střev [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Nekontrolovaná hypertenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Nedávné použití (tj. do 24 hodin) léků obsahujících ergotamin, léků typu ergotamínu (jako je dihydroergotamin nebo methysergid) nebo jiného agonisty 5-hydroxytryptaminu1 (5-HT1) [viz DROGOVÉ INTERAKCE ].
- Současné podávání inhibitoru monoaminooxidázy (MAO)-A nebo nedávné (během 2 týdnů) použití inhibitoru MAO-A [viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
- Hypersenzitivita na IMITREX (pozorovaný angioedém a anafylaxe) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Těžká porucha funkce jater (viz KLINICKÁ FARMAKOLOGIE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Sumatriptan se s vysokou afinitou váže na lidské klonované 5-HT1B/1D receptory. Sumatriptan pravděpodobně uplatňuje své terapeutické účinky při léčbě migrény a klastrových bolestí hlavy prostřednictvím agonistických účinků na 5-HT1B/1D receptorech na intrakraniální krevní cévy a senzorické nervy trigeminálního systému, což vede ke zúžení kraniálních cév a inhibici prozánětlivého neuropeptidu uvolnění.
Farmakodynamika
Krevní tlak
Významné zvýšení krevního tlaku, včetně hypertenzní krize, bylo hlášeno u pacientů s hypertenzí v anamnéze a bez ní (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Periferní (malé) tepny
U zdravých dobrovolníků (N = 18) se ve studii hodnotící účinky sumatriptanu na periferní (malé cévy) arteriální reaktivitu nepodařilo detekovat klinicky významné zvýšení periferní rezistence.
Tepová frekvence
Přechodné zvýšení krevního tlaku pozorované u některých pacientů v klinických studiích prováděných během vývoje sumatriptanu jako léčby migrény nebylo doprovázeno žádnými klinicky významnými změnami srdeční frekvence.
Farmakokinetika
Absorpce a biologická dostupnost
Biologická dostupnost sumatriptanu po subkutánní injekci 18 zdravým mužským subjektům byla 97 % ± 16 % hodnoty získané po intravenózní injekci.
Po jedné 6mg subkutánní manuální injekci do deltového svalu paže u 18 zdravých mužů (věk: 24 ± 6 let, hmotnost: 70 kg) byla maximální sérová koncentrace (Cmax) sumatriptanu (průměr ± standardní odchylka) 74 ± 15 ng/ml a doba dosažení maximální koncentrace (Tmax) byla 12 minut po injekci (rozmezí: 5 až 20 minut). V této studii stejná dávka injikovaná subkutánně do stehna poskytla Cmax 61 ± 15 ng/ml při manuální injekci oproti 52 ± 15 ng/ml při autoinjektorových technikách. Tmax nebo absorbované množství nebyly významně změněny ani místem, ani technikou injekce.
Rozdělení
Vazba na proteiny stanovená rovnovážnou dialýzou v koncentračním rozmezí 10 až 1 000 ng/ml je nízká, přibližně 14 % až 21 %. Účinek sumatriptanu na proteinovou vazbu jiných léků nebyl hodnocen.
Po subkutánní injekci 6 mg do deltového svalu paže u 9 mužů (průměrný věk: 33 let, průměrná hmotnost: 77 kg) byl distribuční objem centrálního kompartmentu sumatriptanu 50 ± 8 litrů a distribuční poločas byl 15 ± 2 minuty.
Metabolismus
In vitro studie s lidskými mikrozomy naznačují, že sumatriptan je metabolizován MAO, převážně A izoenzymem. Většina radioaktivně značené dávky sumatriptanu vyloučené močí je hlavní metabolit indoloctová kyselina (IAA) nebo IAA glukuronid, oba jsou neaktivní.
Odstranění
Po jednorázové 6mg subkutánní dávce bylo 22 % ± 4 % vyloučeno močí jako nezměněný sumatriptan a 38 % ± 7 % jako metabolit IAA.
Po subkutánní injekci 6 mg do oblasti deltového svalu paže byla systémová clearance sumatriptanu 1 194 ± 149 ml/min a terminální poločas byl 115 ± 19 minut.
Specifické populace
Stáří
Farmakokinetika sumatriptanu u starších osob (průměrný věk: 72 let, 2 muži a 4 ženy) au subjektů s migrénou (průměrný věk: 38 let, 25 mužů a 155 žen) byla podobná jako u zdravých mužů (průměrný věk: 30 let).
Poškození jater
Byl hodnocen vliv mírného až středně těžkého onemocnění jater na farmakokinetiku subkutánně podávaného sumatriptanu. Ve farmakokinetice subkutánně podaného sumatriptanu u subjektů se středně těžkou poruchou funkce jater nebyly ve srovnání se zdravými kontrolami žádné významné rozdíly. Farmakokinetika subkutánně podávaného sumatriptanu u pacientů s těžkou poruchou funkce jater nebyla studována. Použití IMITREX Injection u této populace je kontraindikováno [viz KONTRAINDIKACE ].
Závod
Systémová clearance a Cmax subkutánně podaného sumatriptanu byly podobné u černých (n = 34) a bělochů (n = 38) zdravých mužů.
Studie lékových interakcí
Inhibitory monoaminoxidázy-A
Ve studii se 14 zdravými ženami snížila předchozí léčba inhibitorem MAO-A clearance subkutánního sumatriptanu, což vedlo k dvojnásobnému zvýšení plochy pod křivkou koncentrace sumatriptanu v plazmě-čas (AUC), což odpovídá 40% zvýšení v poločasu eliminace.
Toxikologie zvířat a/nebo farmakologie
Zákal rohovky
U psů, kteří dostávali perorálně sumatriptan, se vyvinula zákal rohovky a defekty v epitelu rohovky. Zákal rohovky byl pozorován při nejnižší testované dávce, 2 mg/kg/den, a byl přítomen po 1 měsíci léčby. V 60týdenní studii byly zaznamenány defekty v epitelu rohovky. Dřívější vyšetření na tyto toxicity nebyla provedena a nebyly stanoveny dávky bez účinku; relativní plazmatická expozice při nejnižší testované dávce však byla přibližně trojnásobkem lidské expozice po 6mg subkutánní dávce.
Klinické studie
Migréna
kontrolovaných klinických studiích zahrnujících více než 1 000 pacientů během záchvatů migrény, kteří pociťovali středně silnou nebo silnou bolest a 1 nebo více příznaků uvedených v tabulce 3, začal nástup úlevy již 10 minut po injekci 6 mg IMITREX 50 mg. Nižší dávky přípravku IMITREX 100 mg Injection se mohou také ukázat jako účinné, i když podíl pacientů, kteří dosáhli adekvátní úlevy, byl snížen a latence k této úlevě je větší při nižších dávkách.
Ve studii 1 bylo porovnáno 6 různých dávek přípravku IMITREX 100 mg Injection (n = 30 v každé skupině) s placebem (n = 62), v uspořádání s jedním útokem v paralelních skupinách bylo zjištěno, že vztah mezi dávkou a odezvou je takový, jak je ukázáno v tabulce 2.
Ve 2 randomizovaných, placebem kontrolovaných klinických studiích přípravku IMITREX 25 mg Injection 6 mg u 1 104 pacientů se středně těžkou nebo těžkou migrénovou bolestí (studie 2 a 3) byl nástup úlevy méně než 10 minut. Úleva od bolesti hlavy, definovaná snížením bolesti ze silné nebo středně těžké na mírnou nebo žádnou bolest hlavy, bylo dosaženo u 70 % pacientů během 1 hodiny po jednorázové 6mg subkutánní dávce IMITREX Injection. Přibližně u 82 % pacientů léčených přípravkem IMITREX 6 mg došlo k úlevě od bolesti hlavy au 65 % pacientů došlo k úlevě od bolesti do 2 hodin.
Tabulka 3 ukazuje 1- a 2hodinové výsledky účinnosti pro IMITREX Injection 6 mg ve studiích 2 a 3.
IMITREX 100 mg injekce také zmírnil fotofobii, fonofobii (citlivost na zvuk), nevolnost a zvracení spojené s záchvaty migrény. Podobná účinnost byla pozorována, když si pacienti sami podávali IMITREX 50 mg Injection pomocí IMITREX 100 mg STATdose Pen.

Účinnost injekce IMITREX nebyla ovlivněna tím, zda byla migréna spojena s aurou, délkou záchvatu, pohlavím nebo věkem pacienta nebo současným užíváním běžných profylaktických léků proti migréně (např. betablokátorů).
Cluster Bolest hlavy
Účinnost přípravku IMITREX Injection při akutní léčbě klastrové bolesti hlavy byla prokázána ve 2 randomizovaných, dvojitě zaslepených, placebem kontrolovaných, 2dobých zkřížených studiích (studie 4 a 5). Byli zařazeni pacienti ve věku 21 až 65 let a byli instruováni, aby do 10 minut od nástupu léčili středně těžkou až velmi silnou bolest hlavy. Úleva od bolesti hlavy byla definována jako snížení závažnosti bolesti hlavy na mírnou nebo žádnou bolest. V obou studiích byl podíl jedinců, u kterých došlo k úlevě za 10 nebo 15 minut, významně vyšší u pacientů, kteří dostávali 6 mg injekce IMITREX ve srovnání s těmi, kteří dostávali placebo (viz tabulka 4).
Odhad kumulativní pravděpodobnosti, že pacient s klastrovou bolestí hlavy získá úlevu po léčbě buď IMITREX 25 mg injekcí nebo placebem, je uveden na obrázku 1.
Obrázek 1: Čas do úlevy od klastrové bolesti hlavy od doby injekce 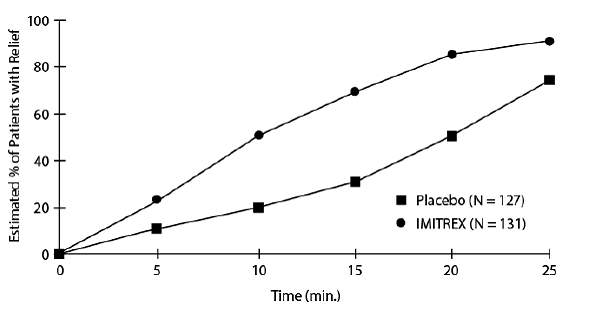
aObrázek používá Kaplan-Meierův (limit produktu) Survivorship Plot. Pacienti užívající záchrannou medikaci byli po 15 minutách cenzurováni.
Graf byl zkonstruován s údaji od pacientů, kteří buď zažili úlevu, nebo nevyžadovali (nežádali) záchrannou medikaci během 2 hodin po léčbě. V důsledku toho jsou data v grafu odvozena pouze od podskupiny 258 léčených bolestí hlavy (u 52 ze 127 bolestí hlavy léčených placebem a 18 ze 131 bolestí hlavy léčených IMITREX 50 mg injekce byla nutná záchranná medikace).
Jiné údaje naznačují, že léčba přípravkem IMITREX 25 mg injekce není spojena se zvýšením časné recidivy bolesti hlavy a má malý vliv na výskyt později se vyskytujících bolestí hlavy (tj. těch, které se objeví po 2, ale před 18 nebo 24 hodinami).
INFORMACE PRO PACIENTA
IMITREX® (IM-i-trex) (sumatriptan sukcinát) Injekce
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat IMITREX a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o IMITREX?
IMITREX může způsobit závažné nežádoucí účinky, včetně:
Infarkt a další srdeční problémy. Srdeční problémy mohou vést ke smrti.
Přestaňte užívat IMITREX 25 mg a okamžitě vyhledejte lékařskou pomoc, pokud máte některý z následujících příznaků srdečního infarktu:
- nepohodlí ve středu hrudníku, které trvá déle než několik minut nebo které odezní a vrátí se
- silné napětí, bolest, tlak nebo tíhu na hrudi, krku, krku nebo čelisti
- bolest nebo nepohodlí v pažích, zádech, krku, čelisti nebo žaludku
- dušnost s nebo bez hrudníku
- polije studený pot
- nevolnost nebo zvracení
- pocit točení hlavy
IMITREX není určen pro lidi s rizikovými faktory pro srdeční onemocnění, pokud není provedeno vyšetření srdce a neukáže se žádný problém. Máte vyšší riziko srdečních onemocnění, pokud:
- mají vysoký krevní tlak
- mají vysokou hladinu cholesterolu
- kouř
- mají nadváhu
- mít cukrovku
- mají v rodinné anamnéze srdeční onemocnění
Co je IMITREX?
IMITREX Injection je lék na předpis používaný k léčbě akutních migrénových bolestí hlavy s aurou nebo bez aurou a akutních skupinových bolestí hlavy u dospělých, u kterých byla diagnostikována migréna nebo clusterové bolesti hlavy.
IMITREX 50 mg se nepoužívá k léčbě jiných typů bolestí hlavy, jako jsou hemiplegické (které způsobují, že se nemůžete pohybovat na jedné straně těla) nebo basilární (vzácná forma migrény s aurou) migrény.
IMITREX 100 mg se nepoužívá k prevenci nebo snížení počtu migrén nebo skupinových bolestí hlavy, které máte.
Není známo, zda je IMITREX 100 mg bezpečný a účinný u dětí do 18 let.
Kdo by neměl užívat IMITREX 100 mg?
Neužívejte IMITREX 50 mg, pokud máte:
- srdeční problémy nebo srdeční problémy v anamnéze
- zúžení krevních cév do nohou, paží, žaludku nebo ledvin (onemocnění periferních cév)
- nekontrolovaný vysoký krevní tlak
- závažné problémy s játry
- hemiplegické migrény nebo bazilární migrény. Pokud si nejste jisti, zda máte tyto typy migrén, zeptejte se svého poskytovatele zdravotní péče.
- měl mrtvici, přechodné ischemické ataky (TIA) nebo problémy s krevním oběhem
- užil/a jste během posledních 24 hodin některý z následujících léků:
- almotriptan (AXERT®)
- eletriptan (RELPAX®)
- frovatriptan (FROVA®)
- naratriptan (AMERGE®)
- rizatriptan (MAXALT®, MAXALT-MLT®)
- sumatriptan a naproxen (TREXIMET®)
- ergotaminy (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihydroergotamin (DHE 45®, MIGRANAL®) Pokud si nejste jisti, zda je váš lék uveden výše, zeptejte se svého poskytovatele zdravotní péče.
- alergie na sumatriptan nebo na kteroukoli složku přípravku IMITREX. Úplný seznam složek přípravku IMITREX naleznete na konci této příbalové informace.
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku IMITREX?
Než začnete IMITREX užívat, informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- mají vysoký krevní tlak
- mají vysoký cholesterol
- mít cukrovku
- kouř
- mají nadváhu
- máte srdeční problémy nebo máte v rodinné anamnéze srdeční problémy nebo mrtvici
- mít problémy s ledvinami
- mít problémy s játry
- měli epilepsii nebo záchvaty
- nepoužívají účinnou antikoncepci
- otěhotnět během užívání přípravku IMITREX
- kojíte nebo plánujete kojit. IMITREX 25 mg přechází do vašeho mateřského mléka a může poškodit vaše dítě. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte, pokud užíváte IMITREX.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků.
IMITREX a některé další léky se mohou navzájem ovlivňovat a způsobit závažné nežádoucí účinky.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte antidepresiva nazývaná:
- selektivní inhibitory zpětného vychytávání serotoninu (SSRI)
- inhibitory zpětného vychytávání serotoninu a norepinefrinu (SNRI)
- tricyklická antidepresiva (TCA)
- inhibitory monoaminooxidázy (MAOI)
Pokud si nejste jisti, požádejte svého poskytovatele zdravotní péče nebo lékárníka o seznam těchto léků.
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče nebo lékárníkovi, když dostanete nový lék.
Jak mám užívat IMITREX 100 mg?
- Někteří lidé by měli užít svou první dávku přípravku IMITREX 25 mg v ordinaci svého poskytovatele zdravotní péče nebo v jiném lékařském zařízení. Zeptejte se svého poskytovatele zdravotní péče, zda byste měli užít svou první dávku v lékařském prostředí.
- Používejte IMITREX 50 mg přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- Váš poskytovatel zdravotní péče může změnit vaši dávku. Neměňte svou dávku, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče.
- U dospělých je obvyklá dávka jedna injekce podaná těsně pod kůži.
- Měli byste si podat injekci, jakmile začnou příznaky vaší bolesti hlavy, ale můžete ji podat kdykoli během záchvatu migrény nebo skupinové bolesti hlavy.
- Pokud jste po první injekci nezaznamenali žádnou úlevu, nepodávejte druhou injekci, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče.
- Pokud se vaše bolest hlavy vrátí nebo se vám jen trochu uleví po první injekci, můžete si vzít druhou injekci 1 hodinu po první injekci, ale ne dříve.
- Neužívejte více než 12 mg během 24 hodin.
- Pokud užijete příliš mnoho přípravku IMITREX 25 mg, zavolejte svého poskytovatele zdravotní péče nebo jděte ihned na pohotovost v nejbližší nemocnici.
- Měli byste si zapsat, kdy máte bolesti hlavy a kdy užíváte IMITREX, abyste si mohli promluvit se svým poskytovatelem zdravotní péče o tom, jak na vás IMITREX 25 mg působí.
Čemu se mám vyhnout při užívání přípravku IMITREX?
IMITREX může způsobit závratě, slabost nebo ospalost. Pokud máte tyto příznaky, neřiďte auto, neobsluhujte stroje ani neprovádějte nic, kde musíte být ve střehu.
Jaké jsou možné vedlejší účinky přípravku IMITREX 25 mg?
IMITREX může způsobit závažné nežádoucí účinky. Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o IMITREX?"
Tyto závažné nežádoucí účinky zahrnují:
- změny barvy nebo citlivosti prstů na rukou a nohou (Raynaudův syndrom)
- žaludeční a střevní potíže (ischemické příhody gastrointestinálního traktu a tlustého střeva). Příznaky gastrointestinální ischemické příhody a příhody tlustého střeva zahrnují:
- náhlá nebo silná bolest žaludku
- bolest žaludku po jídle
- ztráta váhy
- nevolnost nebo zvracení
- zácpa nebo průjem
- krvavý průjem
- horečka
- problémy s krevním oběhem nohou a chodidel (periferní vaskulární ischemie). Příznaky periferní vaskulární ischemie zahrnují:
- křeče a bolest v nohou nebo kyčlích
- pocit tíhy nebo napětí ve svalech nohou
- pálivá nebo bolestivá bolest nohou nebo prstů při odpočinku
- necitlivost, brnění nebo slabost nohou
- pocit chladu nebo změny barvy na jedné nebo obou nohách nebo chodidlech
- kopřivka (svědivé hrbolky); otok jazyka, úst nebo hrdla
- bolesti hlavy z nadužívání léků. Někteří lidé, kteří užívají příliš mnoho injekcí přípravku IMITREX 100 mg, mohou mít horší bolesti hlavy (bolesti hlavy z nadužívání léků). Pokud se vaše bolesti hlavy zhorší, může se váš poskytovatel zdravotní péče rozhodnout léčbu přípravkem IMITREX ukončit.
- serotoninový syndrom. Serotoninový syndrom je vzácný, ale závažný problém, který se může vyskytnout u lidí užívajících IMITREX, zvláště pokud je IMITREX 50 mg užíván s antidepresivy nazývanými SSRI nebo SNRI. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků serotoninového syndromu:
- mentální změny, jako je vidění věcí, které neexistují (halucinace), neklid nebo kóma
- rychlý srdeční tep
- změny krevního tlaku
- vysoká tělesná teplota
- napjaté svaly
- potíže s chůzí
- záchvaty. Záchvaty se vyskytly u lidí užívajících IMITREX, kteří nikdy předtím záchvaty neměli. Promluvte si se svým poskytovatelem zdravotní péče o své možnosti mít záchvaty, když užíváte IMITREX.
Mezi nejčastější nežádoucí účinky přípravku IMITREX 50 mg Injection patří:
- bolest nebo zarudnutí v místě vpichu
- mravenčení nebo necitlivost ve vašich rukou nebo nohou
- závrať
- pocit tepla, horka, pálení v obličeji (návaly horka)
- nepohodlí nebo ztuhlost v krku
- pocit slabosti, ospalosti nebo únavy
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku IMITREX. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám IMITREX Injection uchovávat?
- Uchovávejte IMITREX při teplotě 2 °C až 30 °C (36 °F až 86 °F).
- Uchovávejte svůj lék mimo světlo.
- Uchovávejte svůj lék v přiloženém obalu nebo kufříku.
Uchovávejte IMITREX a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku IMITREX
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalových informacích pro pacienty. Nepoužívejte IMITREX pro stav, pro který nebyl předepsán. Nedávejte IMITREX 25 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o přípravku IMITREX. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku IMITREX, který je určen pro zdravotnické pracovníky.
Pro více informací navštivte www.gsk.com nebo volejte 1-888-825-5249.
Jaké jsou složky přípravku IMITREX Injection?
Účinná látka: sumatriptan sukcinát
Neaktivní složky: chlorid sodný, voda na injekci
Tyto informace pro pacienty a návod k použití byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
Návod k použití pro pacienta
Dávkovací systém IMITREX STAT
Než začnete systém IMITREX STATdose System používat, přečtěte si tento návod k použití. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě. Vy a váš poskytovatel zdravotní péče byste si měli o přípravku IMITREX 25 mg injekce promluvit, když jej začnete užívat, a při pravidelných kontrolách.
Uchovávejte systém IMITREX STATdose mimo dosah dětí.
Před použitím systému IMITREX STATdose System
Když poprvé otevřete krabici systému IMITREX 25 mg STATdose System, balení Cartridge Pack a IMITREX STATdose Pen® jsou již v přenosném pouzdře pro vaše pohodlí.
Šedá a modrá Přenosný kufřík se používá k uchovávání vyloženého pera a kazetového balení, když se nepoužívají.
The Balíček kazet pojme 2 jednotlivě utěsněné Injekční náplně Každá injekční stříkačka obsahuje 1 dávku injekce IMITREX® (sumatriptan sukcinát). Balení se zásobníkem pro 4 mg sílu tohoto léku je žluté a balení se zásobníkem pro sílu 6 mg je modré (jak je znázorněno). K dispozici jsou balení náhradních kazet.
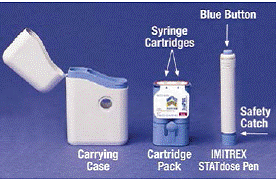
Šedá a modrá Pero se používá k automatické injekci 1 dávky léku z injekční stříkačky. Nedotýkejte se Modré tlačítko dokud nepřitisknete pero na kůži, abyste podali dávku. Pokud jej stisknete kdykoli jindy, můžete ztratit dávku. The Bezpečnostní pojistka zabraňuje náhodnému vystřelení pera, dokud nebudete připraveni. Pero bude fungovat pouze tehdy, když šedou část válce posunete dolů k modré části. Před vložením nové injekční stříkačky se vždy ujistěte, že bílá prostřikovací tyčinka nevyčnívá z konce pera (jak je znázorněno na obrázku B). Pokud vyčnívá, ztratíte tuto dávku.
Jak vložit pero IMITREX STATdose Pen
Pero nevkládejte, dokud nejste připraveni si injekci podat. Během vkládání pera se nedotýkejte modrého tlačítka na horní straně pera (viz obrázek A).
Obrázek A 
Obrázek B 
1. Otevřete víko přenosného pouzdra. Ochranné plomby na 2 stříkačkách jsou označeny „A“ a „B“ (viz Obrázek A vložka ).
Vždy používejte zásobník injekční stříkačky označený „A“ před zásobníkem označeným „B“, abyste měli přehled o dávkách. Nepoužívejte, pokud je při prvním otevření přepravního pouzdra poškozeno nebo chybí těsnění.
2. Odtrhněte jednu z plomb prokazujících porušení (viz Obrázek A ). Vyhoďte těsnění. Otevřete víko nad zásobníkem stříkačky.
3. Držte pero za výstupky v horní části. Vyjměte pero z přenosného pouzdra (viz Obrázek B ).
Zkontrolujte, zda bílá prostřikovací tyčinka nevyčnívá ze spodního konce pera (viz Obrázek B vložka ). Pokud vyčnívá, vložte pero zpět do přenosného pouzdra a pevně zatlačte, dokud neucítíte, že zaklapne. Vyjměte pero z přenosného pouzdra.
Obrázek C 
4. Vložte pero do balení se zásobníkem. Otočte jím doprava (ve směru hodinových ručiček), dokud se již nebude otáčet (asi o půl otáčky) (viz Obrázek C ).
5. Uchopte nabité pero za výstupky a vytáhněte je přímo ven (viz Obrázek D ). Možná budete muset za pero silně zatáhnout, ale to je normální. Modré tlačítko zatím nemačkejte.
Obrázek D 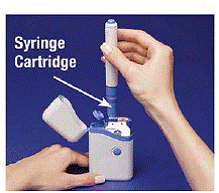
Pero je nyní připraveno k použití. Ne vložte nabité pero zpět do přenosného pouzdra, protože to poškodí jehlu.
Jak používat dávkovací pero IMITREX STAT k užívání léku
Před aplikací léku si vyberte oblast s vrstvou tukové tkáně (viz obrázek E nebo obrázek F). Zeptejte se svého poskytovatele zdravotní péče, pokud máte otázku, kam si aplikovat lék.
Pro přípravu oblasti kůže, kam má být IMITREX injikován, otřete místo vpichu tampónem napuštěným alkoholem. Před podáním injekce se této oblasti znovu nedotýkejte.
Obrázek E nebo obrázek F Obrázek G 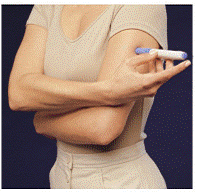
6. Aniž byste stiskli modré tlačítko, zatlačte naložené pero pevně na kůži tak, aby šedý válec sklouzl dolů směrem k modré části, která drží zásobník injekční stříkačky (viz Obrázek D ). (Tím se uvolní bezpečnostní západka, která zabraňuje náhodnému vystřelení pera, dokud nebudete připraveni.)
7. Stiskněte modré tlačítko. Držte pero nehybně alespoň 5 sekund . Pokud je pero odebráno z kůže příliš brzy, nevyloučí se veškerý lék.
8 Po 5 sekundách , opatrně sejměte pero z kůže. Jehla se ukáže (viz Obrázek G ). Nedotýkejte se jehly.
Jak vyjmout dávkovací pero IMITREX STAT po užití léku
Ihned poté, co si perem vezmete dávku, musíte vrátit použitou injekční stříkačku do balení se zásobníkem.
Obrázek H Obrázek I a obrázek J 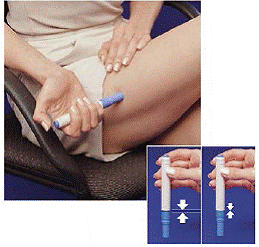
9. Zatlačte pero dolů do prázdné strany balení náplně až na doraz (viz Obrázek H ).
10. Otočte perem doleva (proti směru hodinových ručiček) asi o půl otáčky, dokud se neuvolní ze zásobníku injekční stříkačky (viz Obrázek I ).
11. Vytáhněte prázdné pero z kazety (viz Obrázek J ).
Protože bylo pero nyní použito, bude ze spodního konce pera trčet bílá nástřiková tyč (viz Obrázek J ).
12. Zavřete víko kazety nad použitou kazetou s injekční stříkačkou. Když jsou použité zásobníky injekčních stříkaček vloženy správně, je balení zásobníků jednorázové ochranné pouzdro, které vám pomůže vyhnout se píchnutí jehlou a správně používat injekční stříkačky.
13. Vložte pero zpět do přenosného pouzdra a pevně jej zatlačte, dokud neucítíte, že zaklapne. Zavřete víko přenosného pouzdra. Tím je pero připraveno na další použití.
Pokud se víko nezavře, zatlačte pero dolů, dokud neucítíte, že zaklapne. Poté zavřete víko.
Jak vyjmout použitou kazetu
Po použití obou zásobníků injekčních stříkaček vyjměte balení zásobníků z přepravního pouzdra. Nikdy znovu nepoužívejte ani nerecyklujte zásobník injekční stříkačky.
Obrázek K Obrázek L 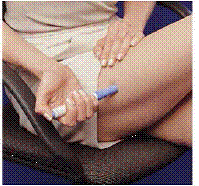
14. Otevřete víko přenosného pouzdra.
15. Jednou rukou uchopte pouzdro na přenášení a stiskněte 2 tlačítka na obou stranách pouzdra (viz Obrázek K ).
16. Druhou rukou opatrně vytáhněte sadu kazet (viz Obrázek L ).
17. Balení kazet vyhoďte nebo je zlikvidujte podle pokynů vašeho poskytovatele zdravotní péče. Mohou existovat zvláštní státní a místní zákony pro likvidaci použitých jehel a stříkaček. Vždy uchovávejte mimo dosah dětí.
Jak vložit novou sadu kazet
Obrázek M Obrázek N a obrázek O 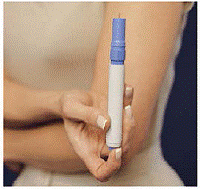
18. Vyjměte novou sadu kazet z krabice. Nesnímejte plomby prokazující porušení (viz obrázek M).
19. Vložte sadu kazet do přepravního pouzdra. Hladce jej posuňte dolů (viz Obrázek N ).
20. Cartridge Pack zacvakne na místo, když 2 tlačítka prosvítají otvory v přepravním kufříku (viz Obrázek O ). Zavřete víko.
Tyto informace pro pacienty a návod k použití byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
