Imuran 50mg, 25mg Azathioprine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Imuran a jak se používá?
Imuran 25 mg je lék na předpis používaný k léčbě příznaků revmatoidní artritidy a jako prevence rejekce transplantátu. Imuran lze užívat samostatně nebo s jinými léky.
Imuran 25 mg patří do třídy léků nazývaných DMARDs, imunomodulátory; Imunosupresiva.
Jaké jsou možné vedlejší účinky přípravku Imuran?
Imuran 25 mg může způsobit závažné nežádoucí účinky, včetně:
- horečka,
- oteklé žlázy,
- bolesti těla,
- noční pocení,
- necítit se dobře,
- bledá kůže,
- vyrážka,
- snadná tvorba modřin nebo krvácení,
- studené ruce a nohy,
- točení hlavy,
- dušnost,
- bolest v horní části žaludku, která se může rozšířit do ramene,
- pocit sytosti po jídle jen malého množství,
- ztráta váhy,
- známky infekce (horečka, zimnice, slabost, příznaky chřipky, bolest v krku, kašel, bolest nebo pálení při močení),
- těžká nevolnost,
- zvracení,
- průjem,
- rychlý srdeční tep,
- tmavá moč a
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Imuran 50 mg patří:
- nevolnost,
- průjem,
- bolest břicha,
- vypadávání vlasů a
- vyrážka
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Imuran. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
MALIGNANCE
Chronická imunosuprese s IMURANem, purinovým antimetabolitem, zvyšuje riziko malignity u lidí. Zprávy o malignitě zahrnují potransplantační lymfom a hepatosplenický T-buněčný lymfom (HSTCL) u pacientů se zánětlivým onemocněním střev. Lékaři užívající tento lék by měli být dobře obeznámeni s tímto rizikem, stejně jako s mutagenním potenciálem pro muže i ženy a s možnou hematologickou toxicitou. Lékaři by měli pacienty informovat o riziku malignity u přípravku IMURAN. Vidět VAROVÁNÍ .
POPIS
IMURAN (azathioprin), imunosupresivní antimetabolit, je dostupný ve formě tablet pro perorální podání. Každá tableta s rýhou obsahuje 50 mg azathioprinu a neaktivní složky laktózu, stearát hořečnatý, bramborový škrob, povidon a kyselinu stearovou.
Azathioprin je chemicky 6-[(l-methyl-4-nitro-lH-imidazol-5-yl)thio]-lH-purin. Strukturní vzorec azathioprinu je:
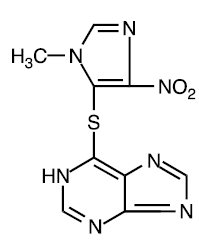
Je to imidazolylový derivát 6-merkaptopurinu a mnoho jeho biologických účinků je podobných účinkům mateřské sloučeniny.
Azathioprin je nerozpustný ve vodě, ale může být rozpuštěn přidáním jednoho molárního ekvivalentu alkálie. Azathioprin je stabilní v roztoku při neutrálním nebo kyselém pH, ale k hydrolýze na merkaptopurin dochází v přebytku hydroxidu sodného (0,1N), zvláště při zahřívání. Ke konverzi na merkaptopurin dochází také v přítomnosti sulfhydrylových sloučenin, jako je cystein, glutathion a sirovodík.
INDIKACE
IMURAN je indikován jako doplněk k prevenci rejekce při homotransplantaci ledvin. Je také indikován k léčbě aktivní revmatoidní artritidy ke snížení známek a symptomů.
Homotransplantace ledvin
IMURAN je indikován jako doplněk k prevenci rejekce při homotransplantaci ledvin. Zkušenosti s více než 16 000 transplantacemi ukazují 5leté přežití pacientů 35 % až 55 %, ale to závisí na dárci, shodě HLA antigenů, protidárcovské nebo anti-B-buněčné aloantigenní protilátce a dalších proměnných. Účinek přípravku IMURAN na tyto proměnné nebyl testován v kontrolovaných studiích.
Revmatoidní artritida
IMURAN je indikován k léčbě aktivní revmatoidní artritidy (RA) ke snížení známek a symptomů. Aspirin, nesteroidní protizánětlivé léky a/nebo nízké dávky glukokortikoidů mohou během léčby přípravkem IMURAN pokračovat. Kombinované použití přípravku IMURAN 25 mg s chorobu modifikujícími antirevmatickými léky (DMARD) nebylo studováno z hlediska přidaného přínosu nebo neočekávaných nežádoucích účinků. Použití přípravku IMURAN s těmito látkami nelze doporučit.
DÁVKOVÁNÍ A PODÁVÁNÍ
TESTOVÁNÍ TPMT NEMŮŽE NAHRADIT SLEDOVÁNÍ KOMPLETNÍHO KREVNÍHO POČTU (CBC) U PACIENTŮ, KTEŘÍ JSOU IMURAN. Genotypování nebo fenotypování TPMT lze použít k identifikaci pacientů s chybějící nebo sníženou aktivitou TPMT. Pacienti s nízkou nebo chybějící aktivitou TPMT jsou vystaveni zvýšenému riziku rozvoje těžké, život ohrožující myelotoxicity z přípravku IMURAN, pokud jsou podávány konvenční dávky. Lékaři mohou zvážit alternativní terapie u pacientů, kteří mají nízkou nebo chybějící aktivitu TPMT (homozygotní pro nefunkční alely). IMURAN 25 mg by měl být podáván s opatrností pacientům s jednou nefunkční alelou (heterozygotní), u kterých existuje riziko snížené aktivity TPMT, která může vést k toxicitě při podávání konvenčních dávek. U pacientů se sníženou aktivitou TPMT se doporučuje snížení dávky. U pacientů s abnormálními výsledky CBC, kteří nereagují na snížení dávky, lze zvážit brzké vysazení léku.
Homotransplantace ledvin
Dávka přípravku IMURAN 50 mg potřebná k prevenci rejekce a minimalizaci toxicity se bude u jednotlivých pacientů lišit; to vyžaduje pečlivé řízení. Počáteční dávka je obvykle 3 až 5 mg/kg denně, počínaje okamžikem transplantace. IMURAN se obvykle podává v jedné denní dávce v den transplantace a v menšině případů 1 až 3 dny před transplantací. Obvykle je možné snížit dávku na udržovací úrovně 1 až 3 mg/kg denně. Dávka přípravku IMURAN 50 mg by se neměla zvyšovat na toxické hladiny z důvodu hrozící rejekce. Přerušení léčby může být nezbytné pro závažnou hematologickou nebo jinou toxicitu, i když odmítnutí homograftu může být důsledkem vysazení léku.
Revmatoidní artritida
IMURAN 50 mg se obvykle podává denně. Počáteční dávka by měla být přibližně 1,0 mg/kg (50 až 100 mg) podávaná v jedné dávce nebo v režimu dvakrát denně. Dávka může být zvyšována, počínaje 6. až 8. týdnem a poté postupně ve 4týdenních intervalech, pokud nedochází k závažné toxicitě a pokud je počáteční odpověď neuspokojivá. Přírůstky dávky by měly být 0,5 mg/kg denně až do maximální dávky 2,5 mg/kg denně. Terapeutická odpověď nastává po několika týdnech léčby, obvykle 6 až 8; adekvátní zkouška by měla trvat minimálně 12 týdnů. Pacienti, u kterých nedošlo ke zlepšení po 12 týdnech, mohou být považováni za refrakterní. U pacientů s klinickou odpovědí lze v podávání přípravku IMURAN 50 mg dlouhodobě pokračovat, ale pacienti by měli být pečlivě sledováni a je třeba se pokusit o postupné snižování dávky, aby se snížilo riziko toxicity.
Udržovací terapie by měla být na nejnižší účinné dávce a podávaná dávka může být snižována postupně se změnami o 0,5 mg/kg nebo přibližně 25 mg denně každé 4 týdny, zatímco ostatní terapie jsou konstantní. Optimální délka udržovací léčby IMURAN 50 mg nebyla stanovena. IMURAN lze vysadit náhle, ale jsou možné opožděné účinky.
Použití při renální dysfunkci
Relativně oliguričtí pacienti, zejména pacienti s tubulární nekrózou v období bezprostředně po kadaverózní transplantaci, mohou mít opožděnou clearance IMURANu nebo jeho metabolitů, mohou být zvláště citliví na tento lék a obvykle jim jsou podávány nižší dávky.
Je třeba zvážit postupy pro správnou manipulaci a likvidaci tohoto imunosupresivního antimetabolitu. Na toto téma bylo publikováno několik pokynů.25-31 Neexistuje obecná shoda, že všechny postupy doporučené v pokynech jsou nezbytné nebo vhodné.
JAK DODÁVÁNO
50 mg překrývající se kruhové, žluté až téměř bílé tablety s půlicí rýhou s potiskem „IMURAN“ a „50“ na každé tabletě; láhev 100 ( NDC 65483-590-10).
Uchovávejte při teplotě 15° až 25°C (59° až 77°F) na suchém místě a chraňte před světlem.
REFERENCE
25. Doporučení pro bezpečnou manipulaci s parenterálními antineoplastiky. Washington, DC: Divize bezpečnosti; Oddělení lékáren klinického centra a onkologické ošetřovatelské služby, Státní zdravotní ústav; 1992. Ministerstvo zdravotnictví a sociálních služeb USA. Public Health Service Publication NIH 92-2621.
26. Rada AMA pro vědecké záležitosti. Pokyny pro zacházení s parenterálními antineoplastiky. JAMA. 1985; 253:15901592.
27. National Study Commission on Cytotoxic Exposure. Doporučení pro zacházení s cytotoxickými látkami. 1987. Dostupné od Louise P. Jeffreyho, předsedy, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Klinická onkologická společnost Austrálie. Směrnice a doporučení pro bezpečnou manipulaci s antineoplastickými látkami. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Bezpečné zacházení s chemoterapeutickými látkami: zpráva z The Mount Sinai Medical Center. CA Cancer J pro lékaře. 1983; 33:258-263.
30. Americká společnost nemocničních lékárníků. Bulletin technické pomoci ASHP o manipulaci s cytotoxickými a nebezpečnými léky. Am J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. Pokyny pro pracovní praxi OSHA pro personál zabývající se cytotoxickými (antineoplastickými) léky. Am J Hosp Pharm, 1996; 43:1193-1204.
Vyrobeno společností Pharmaceutics International, Inc. Hunt Valley, MD 21031 pro Prometheus Laboratories Inc. San Diego, CA 92121. Revize: únor 2014
VEDLEJŠÍ EFEKTY
Hlavní a potenciálně závažné toxické účinky přípravku IMURAN jsou hematologické a gastrointestinální. Významná jsou také rizika sekundární infekce a malignity (viz VAROVÁNÍ ). Četnost a závažnost nežádoucích účinků závisí na dávce a délce trvání přípravku IMURAN, jakož i na pacientově základním onemocnění nebo na souběžných terapiích. Výskyt hematologické toxicity a neoplazie, se kterými se setkáváme ve skupinách příjemců renálního homograftu, je významně vyšší než ve studiích používajících IMURAN 25 mg pro revmatoidní artritidu. Relativní výskyty v klinických studiích jsou shrnuty níže:
Hematologické
Leukopenie a/nebo trombocytopenie jsou závislé na dávce a mohou se objevit později v průběhu léčby přípravkem IMURAN. Snížení dávky nebo dočasné vysazení může vést ke zvrácení těchto toxicit. Infekce se může objevit jako sekundární projev suprese kostní dřeně nebo leukopenie, ale výskyt infekce při homotransplantaci ledvin je 30 až 60krát vyšší než u revmatoidní artritidy. Byly hlášeny anémie, včetně makrocytární anémie a/nebo krvácení.
Genotypizace nebo fenotypizace TPMT může pomoci identifikovat pacienty s nízkou nebo chybějící aktivitou TPMT (homozygotní pro nefunkční alely), kteří jsou vystaveni zvýšenému riziku těžké, život ohrožující myelosuprese z přípravku IMURAN. Vidět KLINICKÁ FARMAKOLOGIE , VAROVÁNÍ a OPATŘENÍ : Laboratorní testy . Smrt spojená s pancytopenií byla hlášena u pacientů s chybějící aktivitou TPMT užívajících azathioprin.6,20
Gastrointestinální
Nevolnost a zvracení se mohou objevit během prvních několika měsíců léčby přípravkem IMURAN 50 mg a vyskytly se přibližně u 12 % z 676 pacientů s revmatoidní artritidou. Frekvenci žaludečních poruch lze často snížit podáváním léku v rozdělených dávkách a/nebo po jídle. U některých pacientů však může být nauzea a zvracení závažné a mohou být doprovázeny příznaky, jako je průjem, horečka, malátnost a myalgie (viz OPATŘENÍ ). Zvracení s bolestí břicha se může vzácně objevit u hypersenzitivní pankreatitidy. Je známo, že hepatotoxicita, která se projevuje zvýšením sérové alkalické fosfatázy, bilirubinu a/nebo sérových transamináz, se vyskytuje po použití azathioprinu, především u příjemců aloštěpů. Hepatotoxicita byla u pacientů s revmatoidní artritidou méně častá (méně než 1 %). Hepatotoxicita po transplantaci se nejčastěji objevuje do 6 měsíců po transplantaci a je obecně reverzibilní po přerušení léčby přípravkem IMURAN. Vzácné, ale život ohrožující jaterní venookluzivní onemocnění spojené s chronickým podáváním azathioprinu bylo popsáno u pacientů po transplantaci a u jednoho pacienta užívajícího IMURAN pro panuveitidu.21,22,23 Periodické měření sérových transamináz, alkalické fosfatázy a bilirubinu je indikován pro včasnou detekci hepatotoxicity. Pokud je klinicky podezření na venookluzivní onemocnění jater, IMURAN by měl být trvale vysazen.
Ostatní
Byly hlášeny další vedlejší účinky s nízkou frekvencí. Patří mezi ně kožní vyrážky, alopecie, horečka, artralgie, průjem, steatorea, negativní dusíková bilance, reverzibilní intersticiální pneumonitida, hepatosplenický T-buněčný lymfom (viz VAROVÁNÍ – Malignita ) a Sweetův syndrom (akutní febrilní neutrofilní dermatóza).
DROGOVÉ INTERAKCE
Používejte s Allopurinolem
Jedna z cest inaktivace azathioprinu je inhibována alopurinolem. Pacientům, kteří užívají IMURAN 50 mg současně a alopurinol, by měla být snížena dávka přípravku IMURAN 50 mg přibližně na 1/3 až 1/4 obvyklé dávky. U pacientů s nízkou nebo chybějící aktivitou TPMT, kteří dostávají IMURAN 50 mg a alopurinol, se doporučuje zvážit další snížení dávky nebo alternativní léčbu, protože jsou ovlivněny obě cesty inaktivace TPMT i XO. Vidět KLINICKÁ FARMAKOLOGIE , VAROVÁNÍ , OPATŘENÍ : Laboratorní testy a NEŽÁDOUCÍ REAKCE sekce.
Používejte s aminosalicyláty
Existují in vitro důkazy, že deriváty aminosalicylátů (např. sulfasalazin, mesalazin nebo olsalazin) inhibují enzym TPMT. Současné užívání těchto látek s přípravkem IMURAN 50 mg by mělo být prováděno s opatrností.
Použití s jinými látkami ovlivňujícími myelopoézu
Léky, které mohou ovlivnit produkci leukocytů, včetně kotrimoxazolu, mohou vést k přehnané leukopenii, zejména u příjemců transplantátu ledvin.
Používejte s inhibitory angiotenzin konvertujícího enzymu
Bylo hlášeno, že použití inhibitorů angiotenzin-konvertujícího enzymu ke kontrole hypertenze u pacientů užívajících azathioprin vyvolává anémii a těžkou leukopenii.
Používejte s Warfarinem
IMURAN může inhibovat antikoagulační účinek warfarinu.
Používejte s ribavirinem
Bylo hlášeno, že použití ribavirinu k léčbě hepatitidy C u pacientů užívajících azathioprin vyvolává těžkou pancytopenii a může zvýšit riziko myelotoxicity související s azathioprinem. Inosinmonofosfátdehydrogenáza (IMDH) je nezbytná pro jednu z metabolických drah azathioprinu. Je známo, že ribavirin inhibuje IMDH, což vede k akumulaci metabolitu azathioprinu, 6-methylthioionosinmonofosfátu (6MTITP), který je spojen s myelotoxicitou (neutropenie, trombocytopenie a anémie). Pacienti užívající azathioprin s ribavirinem by měli mít kompletní krevní obraz, včetně počtu krevních destiček, monitorován týdně první měsíc, dvakrát měsíčně druhý a třetí měsíc léčby a poté měsíčně nebo častěji, pokud jsou nutné změny dávkování nebo jiné změny terapie.
REFERENCE
6. Údaje v souboru, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Myelosuprese vyvolaná azathioprinem u pacientů po transplantaci srdce s deficitem thiopurin methyltransferázy. Lanceta. 1993; 341:436.
21. Přečtěte si AE, Wiesner RH, LaBrecque DR, et al. Jaterní venookluzivní onemocnění spojené s transplantací ledvin a terapií azathioprinem. Ann Intern Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azathioprin a jaterní venookluzivní onemocnění u pacientů po transplantaci ledvin. Gastroenterologie. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Venookluzivní onemocnění jater u pacientů užívajících imunosupresivní léčbu. Vircows Arch A Pathol Anat Histol. 1982; 395:245-256.
VAROVÁNÍ
Malignita
pacientů užívajících imunosupresiva, včetně přípravku IMURAN 50 mg, je zvýšené riziko rozvoje lymfomu a dalších malignit, zejména kůže. Lékaři by měli pacienty informovat o riziku malignity u přípravku IMURAN. Jako obvykle u pacientů se zvýšeným rizikem rakoviny kůže je třeba omezit expozici slunečnímu a ultrafialovému světlu nošením ochranného oděvu a používáním opalovacího krému s vysokým ochranným faktorem.
Po transplantaci
Je známo, že pacienti po transplantaci ledvin mají zvýšené riziko malignity, převážně rakoviny kůže a retikulárních buněk nebo lymfomatózních nádorů. Riziko potransplantačních lymfomů může být zvýšeno u pacientů, kteří dostávají agresivní léčbu imunosupresivy, včetně přípravku IMURAN. Imunosupresivní medikamentózní léčba by proto měla být udržována na nejnižších účinných hladinách.
Revmatoidní artritida
Jsou dostupné informace o riziku malignity při užívání přípravku IMURAN 50 mg u revmatoidní artritidy (viz NEŽÁDOUCÍ REAKCE ). Nebylo možné přesně definovat riziko malignity způsobené přípravkem IMURAN. Údaje naznačují, že riziko může být zvýšené u pacientů s revmatoidní artritidou, i když nižší než u pacientů po transplantaci ledviny. U pacientů s revmatoidní artritidou, kteří dostávali IMURAN, však byly hlášeny akutní myeloidní leukémie a také solidní nádory.
Zánětlivé onemocnění střev
pacientů léčených přípravkem IMURAN byly po uvedení na trh hlášeny případy hepatosplenického T-buněčného lymfomu (HSTCL), což je vzácný typ T-buněčného lymfomu. Tyto případy měly velmi agresivní průběh onemocnění a byly smrtelné. Většina hlášených případů se vyskytla u pacientů s Crohnovou chorobou nebo ulcerózní kolitidou a většina byla u dospívajících a mladých dospělých mužů. Někteří z pacientů byli léčeni přípravkem IMURAN v monoterapii a někteří dostávali souběžnou léčbu blokátorem TNFα v době diagnózy nebo před ní. Bezpečnost a účinnost přípravku IMURAN 25 mg k léčbě Crohnovy choroby a ulcerózní kolitidy nebyla stanovena.
Cytopenie
pacientů léčených přípravkem IMURAN se může objevit těžká leukopenie, trombocytopenie, anémie včetně makrocytární anémie a/nebo pancytopenie. Může také dojít k těžkému útlumu kostní dřeně. Pacienti se střední aktivitou thiopurin S-methyl transferázy (TPMT) mohou mít zvýšené riziko myelotoxicity, pokud dostávají konvenční dávky přípravku IMURAN. Pacienti s nízkou nebo chybějící aktivitou TPMT jsou vystaveni zvýšenému riziku rozvoje těžké, život ohrožující myelotoxicity, pokud dostávají konvenční dávky přípravku IMURAN. Genotypizace nebo fenotypizace TPMT může pomoci identifikovat pacienty, kteří mají zvýšené riziko rozvoje toxicity přípravku IMURAN 50 mg.2-9 (viz OPATŘENÍ : Laboratorní testy ). Hematologické toxicity jsou závislé na dávce a mohou být závažnější u pacientů po transplantaci ledvin, u kterých dochází k rejekci homograftu. Doporučuje se, aby pacienti užívající IMURAN měli kompletní krevní obraz, včetně počtu krevních destiček, týdně během prvního měsíce, dvakrát měsíčně během druhého a třetího měsíce léčby a poté měsíčně nebo častěji, pokud jsou nutné změny dávkování nebo jiné změny terapie. Může dojít k opožděné hematologické supresi. Okamžité snížení dávky nebo dočasné vysazení léku může být nezbytné, pokud dojde k rychlému poklesu nebo trvale nízkému počtu leukocytů nebo k jiným známkám útlumu kostní dřeně. Leukopenie nekoreluje s terapeutickým účinkem; proto by se dávka neměla záměrně zvyšovat, aby se snížil počet bílých krvinek.
Závažné infekce
Pacienti užívající imunosupresiva, včetně přípravku Imuran 25 mg, jsou vystaveni zvýšenému riziku bakteriálních, virových, mykotických, protozoálních a oportunních infekcí, včetně reaktivace latentních infekcí. Tyto infekce mohou vést k vážným, včetně smrtelným následkům.
Progresivní multifokální leukoencefalopatie
U pacientů léčených imunosupresivy, včetně Imuranu, byly hlášeny případy infekce spojené s JC virem vedoucí k progresivní multifokální leukoencefalopatii (PML), někdy fatální. Rizikové faktory pro PML zahrnují léčbu imunosupresivními terapiemi a poškození imunitní funkce. Zvažte diagnózu PML u každého pacienta s nově vzniklými neurologickými projevy a zvažte konzultaci s neurologem, pokud je to klinicky indikováno. Zvažte snížení množství imunosuprese u pacientů, u kterých se rozvine PML. U pacientů po transplantaci zvažte riziko, které snížená imunosuprese představuje pro štěp.
Vliv na spermie u zvířat
Bylo hlášeno, že IMURAN způsobuje dočasnou depresi spermatogeneze a snížení životaschopnosti spermií a počtu spermií u myší v dávkách 10krát vyšších, než je lidská terapeutická dávka;10 ke snížení procenta plodných páření došlo, když zvířata dostala 5 mg/kg.11
Těhotenství
Kategorie těhotenství D
IMURAN může při podání těhotné ženě způsobit poškození plodu. IMURAN 50 mg by neměl být podáván během těhotenství bez pečlivého zvážení poměru rizika a přínosu. Kdykoli je to možné, je třeba se vyhnout použití přípravku IMURAN u těhotných pacientek. Tento lék by se neměl používat k léčbě revmatoidní artritidy u těhotných žen.12
IMURAN je teratogenní u králíků a myší, pokud je podáván v dávkách ekvivalentních dávce pro člověka (5 mg/kg denně). Abnormality zahrnovaly kosterní malformace a viscerální anomálie.11
několika dětí narozených příjemcům renálního aloštěpu na IMURAN se vyskytly omezené imunologické a jiné abnormality. V podrobné kazuistice13 byla zaznamenána lymfopenie, snížené hladiny IgG a IgM, infekce CMV a snížený stín brzlíku u dítěte narozeného matce, která dostávala 150 mg azathioprinu a 30 mg prednisonu denně po celou dobu těhotenství. Po 10 týdnech byla většina funkcí normalizována. DeWitte et al popsali pancytopenii a těžkou imunodeficienci u předčasně narozeného dítěte, jehož matka dostávala 125 mg azathioprinu a 12,5 mg prednisonu denně.14 Byly publikovány dvě zprávy o abnormálních fyzikálních nálezech. Williamson a Karp popsali dítě narozené s preaxiální polydaktylií, jehož matka dostávala azathioprin 200 mg denně a prednison 20 mg každý druhý den během těhotenství.15 Tallent et al popsali dítě s velkou myelomeningokélou v horní bederní oblasti, bilaterální luxací kyčlí a bilaterálním talipes equinovarus. Otec byl na dlouhodobé terapii azathioprinem.16
Před použitím přípravku IMURAN u pacientů s reprodukčním potenciálem musí být pečlivě zvážen přínos versus riziko. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Pokud je tento lék užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o potenciálním riziku pro plod. Ženám ve fertilním věku je třeba doporučit, aby se vyvarovaly otěhotnění.
OPATŘENÍ
Všeobecné
Byla hlášena gastrointestinální hypersenzitivní reakce charakterizovaná těžkou nevolností a zvracením. Tyto příznaky mohou být také doprovázeny průjmem, vyrážkou, horečkou, malátností, myalgiemi, zvýšením jaterních enzymů a příležitostně hypotenzí. Příznaky gastrointestinální toxicity se nejčastěji rozvinou během prvních několika týdnů léčby přípravkem IMURAN 25 mg a jsou reverzibilní po vysazení léku. Reakce se může opakovat během několika hodin po opětovném podání jedné dávky přípravku IMURAN.
Laboratorní testy
Kompletní monitorování krevního obrazu (CBC).
Pacienti užívající přípravek IMURAN 25 mg by měli mít kompletní krevní obraz, včetně počtu krevních destiček, týdně během prvního měsíce, dvakrát měsíčně během druhého a třetího měsíce léčby, poté měsíčně nebo častěji, pokud jsou nutné změny dávkování nebo jiné změny terapie.
Testování TPMT
Doporučuje se, aby byla u TPMT zvážena buď genotypová nebo fenotypová pacientka. Metody fenotypizace a genotypizace jsou komerčně dostupné. Nejběžnější nefunkční alely spojené se sníženou úrovní aktivity TPMT jsou TPMT*2, TPMT*3A a TPMT*3C. Pacienti se dvěma nefunkčními alelami (homozygotní) mají nízkou nebo chybějící aktivitu TPMT a pacienti s jednou nefunkční alelou (heterozygotní) mají střední aktivitu. Přesné výsledky fenotypizace (aktivita TPMT červených krvinek) nejsou možné u pacientů, kteří nedávno dostali krevní transfuzi. Testování TPMT lze také zvážit u pacientů s abnormálními výsledky CBC, které nereagují na snížení dávky. U těchto pacientů se doporučuje včasné vysazení léku. TESTOVÁNÍ TPMT NEMŮŽE NAHRADIT SLEDOVÁNÍ KOMPLETNÍHO KREVNÍHO POČTU (CBC) U PACIENTŮ, KTEŘÍ JSOU IMURAN. Vidět KLINICKÁ FARMAKOLOGIE , VAROVÁNÍ , NEŽÁDOUCÍ REAKCE a DÁVKOVÁNÍ A PODÁVÁNÍ sekce.
Karcinogeneze, mutageneze, zhoršení plodnosti
Vidět VAROVÁNÍ sekce.
Těhotenství
Teratogenní účinky
Kategorie těhotenství D. Vidět VAROVÁNÍ sekce.
Kojící matky
Užívání přípravku IMURAN 25 mg u kojících matek se nedoporučuje. Azathioprin nebo jeho metabolity jsou přenášeny v nízkých hladinách, a to jak transplacentárně, tak v mateřském mléce.17,18,19 Vzhledem k možnosti tumorigenicity prokázané u azathioprinu by se mělo rozhodnout, zda přerušit kojení nebo přerušit léčbu, přičemž je třeba vzít v úvahu význam léku pro matku.
Pediatrické použití
Bezpečnost a účinnost azathioprinu u pediatrických pacientů nebyla stanovena.
REFERENCE
2. Weinshilboum R. Farmakogenetika thiopurinu: klinické a molekulární studie thiopurin methyltransferázy. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Genový lokus thiopurin S-methyltransferázy – důsledky pro klinickou farmakogenomiku. Farmakogenomika. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, a kol. Pancytopenie související s azathioprinem – deficit enzymu způsobený běžným genetickým polymorfismem: přehled. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Snížená aktivita thiopurin methyltransferázy a rozvoj nežádoucích účinků léčby azathioprinem u pacientů s revmatoidní artritidou. Arthritis Rheum. 1998; 41:18581866.
6. Údaje v souboru, Prometheus Laboratories Inc.
7. Yates ČR, Krynetski EY, Loennechen T, et al. Molekulární diagnostika deficitu thiopurin S-methyltransferázy: genetický základ pro intoleranci azathioprinu a merkaptopurinu. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA a kol. Genotyp thiopurin methyltransferázy předpovídá závažnou toxicitu azathioprinu limitující terapii. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Význam stavu thiopurin methyltransferázy u revmatologických pacientů užívajících azathioprin. Revmatologie. 2004; 43:13-18.
10. Clark JM. Mutagenita azathioprinu u myší, Drosophila melanogaster a Neurospora crassa. Mutat Res. 1975; 28:87-99.
11. Údaje ve složce, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Těhotenství po transplantaci ledvin. Ann Intern Med. 1975; 82:113-114. Redakční poznámky.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Účinky prednisonu a azathioprinu podávaných matce během těhotenství na novorozence. J Pediatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Neonatální pancytopenie a těžká kombinovaná imunodeficience spojená s prenatálním podáváním azathioprinu a prednisonu. J Pediatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Teratogenita azathioprinu: přehled literatury a kazuistiky. Obstet Gynecol. 1981; 58:247-250.
16. Talent MB, Simmons RL, Najarian JS. Vrozené vady u dítěte mužského příjemce transplantované ledviny. JAMA. 1970; 211: 1854-1855.
17. Údaje ve složce, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Imunosuprese během těhotenství: přenos azathioprinu a jeho metabolitů z matky na plod. Am J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Kojení po transplantaci ledviny. Transplant Proc. 1982; 14: 605-609.
PŘEDÁVKOVAT
Orální LD50 pro jednotlivé dávky přípravku IMURAN 50 mg u myší a potkanů jsou 2500 mg/kg a 400 mg/kg, v daném pořadí. Velmi vysoké dávky tohoto antimetabolitu mohou vést k hypoplazii dřeně, krvácení, infekci a smrti. Asi 30 % IMURANu se váže na sérové proteiny, ale přibližně 45 % je odstraněno během 8hodinové hemodialýzy.24 Byl hlášen jeden případ pacienta po transplantaci ledviny, který požil jednu dávku 7500 mg IMURANu. Okamžitými toxickými reakcemi byly nauzea, zvracení a průjem, následované mírnou leukopenií a mírnými abnormalitami jaterních funkcí. Počet bílých krvinek, SGOT a bilirubin se vrátily k normálu 6 dní po předávkování.
KONTRAINDIKACE
IMURAN 25 mg by neměl být podáván pacientům, u kterých se projevila přecitlivělost na lék. IMURAN by se neměl používat k léčbě revmatoidní artritidy u těhotných žen. Pacienti s revmatoidní artritidou, kteří byli dříve léčeni alkylačními látkami (cyklofosfamid, chlorambucil, melfalan nebo jiné), mohou mít při léčbě přípravkem IMURAN vysoké riziko malignity.
REFERENCE
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Farmakokinetika azathioprinu při hemodialýze. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
KLINICKÁ FARMAKOLOGIE
Azathioprin se po perorálním podání dobře vstřebává. Maximální sérová radioaktivita nastává za 1 až 2 hodiny po perorálním podání 35S-azathioprinu a rozpadá se s poločasem 5 hodin. Toto není odhad poločasu samotného azathioprinu, ale je to rychlost rozpadu pro všechny metabolity drogy obsahující 35S. Vzhledem k rozsáhlému metabolismu je pouze zlomek radioaktivity přítomen jako azathioprin. Obvyklé dávky vytvářejí krevní hladiny azathioprinu az něj odvozeného merkaptopurinu, které jsou nízké ( PŘEDÁVKOVÁNÍ .
Azathioprin je metabolizován na 6-merkaptopurin (6-MP). Obě sloučeniny jsou rychle eliminovány z krve a jsou oxidovány nebo methylovány v erytrocytech a játrech; po 8 hodinách není v moči detekovatelný žádný azathioprin ani merkaptopurin. K aktivaci 6-merkaptopurinu dochází prostřednictvím hypoxanthin-guanin fosforibosyltransferázy (HGPRT) a řady multienzymatických procesů zahrnujících kinázy za vzniku 6-thioguaninových nukleotidů (6-TGN) jako hlavních metabolitů (viz. Schéma metabolismu na obrázku 1 ). Cytotoxicita azathioprinu je částečně způsobena inkorporací 6-TGN do DNA.
6-MP prochází dvěma hlavními cestami inaktivace (obrázek 1). Jedním z nich je methylace thiolu, která je katalyzována enzymem thiopurin S-methyltransferázou (TPMT), za vzniku neaktivního metabolitu methyl-6-MP (6-MeMP). Aktivita TPMT je řízena genetickým polymorfismem.1,2,3 U bělochů a Afroameričanů přibližně 10 % populace zdědí jednu nefunkční alelu TPMT (heterozygotní), která uděluje střední aktivitu TPMT, a 0,3 % zdědí dvě nefunkční TPMT alely (homozygotní) pro nízkou nebo chybějící aktivitu TPMT. Nefunkční alely jsou u Asiatů méně časté. Aktivita TPMT nepřímo koreluje s hladinami 6-TGN v erytrocytech a pravděpodobně i v jiných hematopoetických tkáních, protože tyto buňky mají zanedbatelné aktivity xanthinoxidázy (zapojené do jiné inaktivační dráhy), takže methylace TPMT je jedinou inaktivační cestou. Pacienti se střední aktivitou TPMT mohou mít zvýšené riziko myelotoxicity, pokud dostávají konvenční dávky přípravku IMURAN. Pacienti s nízkou nebo chybějící aktivitou TPMT mají zvýšené riziko rozvoje závažné, život ohrožující myelotoxicity, pokud dostávají konvenční dávky přípravku IMURAN.4-9 Genotypizace nebo fenotypizace TPMT (aktivita TPMT červených krvinek) může pomoci identifikovat pacienty, kteří mají zvýšenou riziko rozvoje toxicity přípravku IMURAN 25 mg.2,3,7,8,9 Přesné výsledky fenotypizace (aktivita TPMT červených krvinek) nejsou možné u pacientů, kteří nedávno dostali krevní transfuzi. Vidět VAROVÁNÍ , OPATŘENÍ : DROGOVÉ INTERAKCE , OPATŘENÍ : Laboratorní testy a NEŽÁDOUCÍ REAKCE sekce.
Obrázek 1 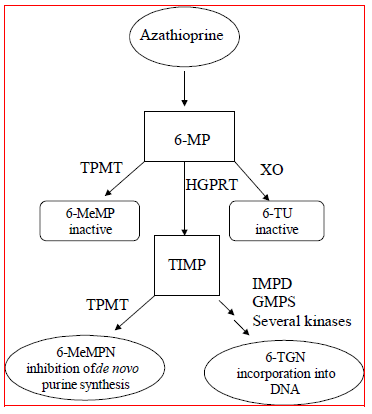 Obrázek 1. Metabolická dráha azathioprinu: konkurenční dráhy vedou k inaktivaci TPMT nebo XO nebo k inkorporaci cytotoxických nukleotidů do DNA.
Obrázek 1. Metabolická dráha azathioprinu: konkurenční dráhy vedou k inaktivaci TPMT nebo XO nebo k inkorporaci cytotoxických nukleotidů do DNA.
GMPS: guanosinmonofosfát syntetáza; HGPRT: hypoxanthin-guanin-fosforibosyl-transferáza; IMPD: inosinmonofosfátdehydrogenáza; MeMP: methylmerkaptopurin; MeMPN: methylmerkaptopurinový nukleotid; TGN: Thioguanin nukleotidy; TIMP: thioinosinmonofosfát; TPMT: thiopurin S-methyltransferáza; TU kyselina thiourová; XO: Xanthin oxidáza (Upraveno podle Pharmacogenomics 2002; 3: 89-98; a Cancer Res 2001; 61: 5810-5816.)
Další inaktivační cestou je oxidace, která je katalyzována xantinoxidázou (XO) za vzniku kyseliny 6-thiourové. Inhibice xanthinoxidázy u pacientů užívajících alopurinol (ZYLOPRIM®) je základem pro snížení dávky azathioprinu potřebné u těchto pacientů (viz OPATŘENÍ : DROGOVÉ INTERAKCE ). Podíl metabolitů se u jednotlivých pacientů liší a to pravděpodobně odpovídá za různou velikost a trvání účinků léku. Renální clearance pravděpodobně není důležitá pro predikci biologické účinnosti nebo toxicity, i když se u pacientů se špatnou funkcí ledvin praktikuje snížení dávky.
Přežití homograftu
Použití azathioprinu pro inhibici rejekce renálního homograftu je dobře zavedeno, mechanismus(y) tohoto účinku jsou poněkud nejasné. Lék potlačuje hypersenzitivitu buněčně zprostředkovaného typu a způsobuje různé změny v produkci protilátek. Potlačení účinků T-buněk, včetně ablace suprese T-buněk, je závislé na časovém vztahu k antigennímu stimulu nebo přihojení. Toto činidlo má malý účinek na zavedenou rejekci štěpu nebo sekundární reakce.
Změny ve specifických imunitních odpovědích nebo imunologických funkcích u příjemců transplantátu je obtížné specificky vztáhnout k imunosupresi azathioprinem. Tito pacienti mají subnormální odpovědi na vakcíny, nízký počet T-buněk a abnormální fagocytózu buněk periferní krve, ale jejich mitogenní odpovědi, sérové imunoglobuliny a sekundární protilátkové odpovědi jsou obvykle normální.
Imunozánětlivá odpověď
Azathioprin potlačuje projevy onemocnění i základní patologii na zvířecích modelech autoimunitního onemocnění. Například závažnost adjuvantní artritidy je snížena azathioprinem.
Mechanismy, kterými azathioprin ovlivňuje autoimunitní onemocnění, nejsou známy. Azathioprin je imunosupresivní, testy opožděné hypersenzitivity a buněčné cytotoxicity jsou potlačeny ve větší míře než reakce protilátek. U potkaního modelu adjuvantní artritidy bylo prokázáno, že azathioprin inhibuje hyperplazii lymfatických uzlin, která předchází nástupu příznaků onemocnění. Jak imunosupresivní, tak terapeutické účinky na zvířecích modelech jsou závislé na dávce. Azathioprin je považován za pomalu působící lék a účinky mohou přetrvávat i po vysazení léku.
REFERENCE
1. Lennard L. Klinická farmakologie 6-merkaptopurinu. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Farmakogenetika thiopurinu: klinické a molekulární studie thiopurin methyltransferázy. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Genový lokus thiopurin S-methyltransferázy – důsledky pro klinickou farmakogenomiku. Farmakogenomika. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, a kol. Pancytopenie související s azathioprinem – deficit enzymu způsobený běžným genetickým polymorfismem: přehled. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Snížená aktivita thiopurin methyltransferázy a rozvoj nežádoucích účinků léčby azathioprinem u pacientů s revmatoidní artritidou. Arthritis Rheum. 1998; 41:18581866.
6. Údaje v souboru, Prometheus Laboratories Inc.
7. Yates ČR, Krynetski EY, Loennechen T, et al. Molekulární diagnostika deficitu thiopurin S-methyltransferázy: genetický základ pro intoleranci azathioprinu a merkaptopurinu. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA a kol. Genotyp thiopurin methyltransferázy předpovídá závažnou toxicitu azathioprinu limitující terapii. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Význam stavu thiopurin methyltransferázy u revmatologických pacientů užívajících azathioprin. Revmatologie. 2004; 43:13-18.
INFORMACE PRO PACIENTA
Pacienti, kteří zahajují léčbu přípravkem IMURAN, by měli být informováni o nutnosti pravidelných kontrol krevního obrazu během užívání léku a měli by být vyzváni, aby svému lékaři hlásili jakékoli neobvyklé krvácení nebo modřiny. Měli by být informováni o nebezpečí infekce během užívání přípravku IMURAN a požádáni, aby hlásili známky a příznaky infekce svému lékaři. Pacientovi je třeba věnovat pečlivé pokyny k dávkování, zvláště pokud je IMURAN podáván v přítomnosti zhoršené funkce ledvin nebo současně s alopurinolem (viz DROGOVÉ INTERAKCE pododdíl a DÁVKOVÁNÍ A PODÁVÁNÍ ). Pacientky je třeba upozornit na možná rizika užívání přípravku IMURAN 50 mg během těhotenství a během kojení. Pacientovi je třeba vysvětlit zvýšené riziko malignity po léčbě přípravkem IMURAN.
