Ditropan 2.5mg, 5mg Oxybutynin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Ditropan a jak se používá?
Ditropan je lék na předpis používaný k léčbě příznaků hyperaktivního močového měchýře. Ditropan 5 mg lze užívat samostatně nebo s jinými léky.
Ditropan patří do třídy léků nazývaných Antispasmodic Agents, Urinary.
Není známo, zda je Ditropan bezpečný a účinný u dětí mladších 5 let.
Jaké jsou možné vedlejší účinky přípravku Ditropan?
Ditropan může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- zácpa,
- rozmazané vidění,
- tunelové vidění,
- bolest očí,
- vidět halo kolem světel,
- malé nebo žádné močení,
- bolestivé nebo obtížné močení,
- pocit žízně nebo horka,
- neschopnost močit,
- silné pocení a
- horkou a suchou pokožku
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Ditropan patří:
- závrať,
- ospalost,
- rozmazané vidění,
- suchá ústa,
- průjem a
- zácpa
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Ditropan. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Každá rýhovaná bikonvexní, modře vyrytá tableta DITROPAN® (oxybutyninchlorid) obsahuje 5 mg oxybutyninchloridu. Chemicky je oxybutyninchlorid d,l (racemický) 4-diethylamino-2-butinylfenylcyklohexylglykolát hydrochlorid. The
empirický vzorec oxybutyninchloridu je C22H31NO3•HCl. Strukturní vzorec je uveden níže:
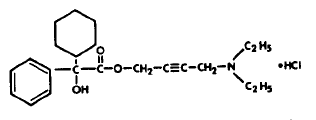
Oxybutyninchlorid je bílá krystalická pevná látka s molekulovou hmotností 393,9. Je snadno rozpustný ve vodě a kyselinách, ale relativně nerozpustný v zásadách.
Tablety DITROPAN také obsahují stearát vápenatý, FD&C Blue #1 Lake, laktózu a mikrokrystalickou celulózu.
Tablety DITROPAN jsou určeny k perorálnímu podání.
Terapeutická kategorie: Antispasmodikum, anticholinergikum.
INDIKACE
DITROPAN 2,5 mg XL® (oxybutyninchlorid) je muskarinový antagonista indikovaný k léčbě hyperaktivního močového měchýře se symptomy urgentní inkontinence moči, urgence a frekvence.
DITROPAN XL® je také indikován k léčbě dětských pacientů ve věku 6 let a starších s příznaky nadměrné aktivity detruzoru spojené s neurologickým stavem (např. rozštěp páteře).
DÁVKOVÁNÍ A PODÁVÁNÍ
DITROPAN 2,5 mg XL® se musí polykat celý s pomocí tekutin a nesmí se žvýkat, dělit ani drtit.
DITROPAN XL® může být podáván s jídlem nebo bez jídla.
Dospělí
Doporučená počáteční dávka přípravku DITROPAN 5 mg XL® je 5 nebo 10 mg jednou denně přibližně ve stejnou dobu každý den. Dávkování může být upraveno po 5 mg, aby se dosáhlo rovnováhy mezi účinností a snášenlivostí (až do maxima 30 mg/den). Obecně může úprava dávkování probíhat přibližně v týdenních intervalech.
Pediatričtí pacienti ve věku 6 let a starší
Doporučená počáteční dávka přípravku DITROPAN 5 mg XL® je 5 mg jednou denně přibližně ve stejnou dobu každý den. Dávkování může být upraveno po 5 mg, aby se dosáhlo rovnováhy mezi účinností a snášenlivostí (až do maxima 20 mg/den).
JAK DODÁVÁNO
Dávkové formy A Síly
DITROPAN 5 mg XL tablety s prodlouženým uvolňováním jsou dostupné jako 5 a 10 mg tablety pro perorální podání:
5 mg : Světle žlutá, kulatá, tableta s „5 XL“ potištěným na jedné straně černým inkoustem.
10 mg Růžová, kulatá, tableta s „10 XL“ potištěným na jedné straně černým inkoustem.
Skladování A Manipulace
DITROPAN XL® tablety s prodlouženým uvolňováním jsou k dispozici ve dvou dávkovacích silách, 5 mg (světle žlutá) a 10 mg (růžová) a na jedné straně jsou potištěny „5 XL“ nebo „10 XL“ černým inkoustem. DITROPAN XL® tablety s prodlouženým uvolňováním jsou dodávány v lahvičkách po 100 tabletách.
Úložný prostor
Skladujte při teplotě 25 °C (77 °F); výlety povoleny do 15 – 30 °C (59 – 86 °F) [viz USP řízená pokojová teplota ]. Chraňte před vlhkostí a vlhkostí.
Uchovávejte mimo dosah dětí.
Výrobce: ALZA Corporation, Vacaville, CA 95688, Technologický produkt ALZA OROS. Vyrobeno pro: Janssen Pharmaceuticals, Inc., Titusville, NJ 08560. Revize: září 2019
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie probíhají za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Bezpečnost a účinnost přípravku DITROPAN 2,5 mg XL® (5 až 30 mg/den) byla hodnocena u 774 dospělých subjektů, které se zúčastnily pěti dvojitě zaslepených, kontrolovaných klinických studií. Ve čtyřech z pěti studií byl Ditropan 5 mg IR (5 až 20 mg/den u 199 subjektů) aktivním komparátorem. Nežádoucí účinky hlášené ≥ 1 % subjektů jsou uvedeny v tabulce 1.
Míra přerušení léčby z důvodu nežádoucích účinků byla 4,4 % u DITROPAN XL® ve srovnání s 0 % u Ditropanu IR. Nejčastější nežádoucí reakcí způsobující vysazení studované medikace bylo sucho v ústech (0,7 %).
Následující nežádoucí účinky byly hlášeny u Poruchy metabolismu a výživy: anorexie, zadržování tekutin; Cévní poruchy: návaly horka; Respirační, hrudní a mediastinální poruchy: dysfonie; Gastrointestinální poruchy: dysfagie, časté pohyby střev; Celkové poruchy a reakce v místě aplikace: nepohodlí na hrudi, žízeň.
Postmarketingové zkušenosti
Následující další nežádoucí účinky byly hlášeny z celosvětových postmarketingových zkušeností s přípravkem DITROPAN 5 mg XL®. Protože postmarketingové reakce jsou hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Infekce a nákazy: Infekce močových cest; Psychiatrické poruchy: psychotické poruchy, agitovanost, stav zmatenosti, halucinace, poruchy paměti, abnormální chování; Poruchy nervového systému: křeče; Oční poruchy: glaukom; Respirační, hrudní a mediastinální poruchy: ucpaný nos; Srdeční poruchy: arytmie, tachykardie, palpitace, prodloužení QT intervalu; Cévní poruchy: návaly horka, hypertenze; Poruchy kůže a podkožní tkáně: vyrážka; Poruchy ledvin a močových cest: impotence; Obecné poruchy a podmínky v místě podání: hypersenzitivní reakce, včetně angioedému s obstrukcí dýchacích cest, kopřivkou a edémem obličeje; anafylaktické reakce vyžadující hospitalizaci pro neodkladnou léčbu; Zranění, otravy a procedurální komplikace: pád.
Mezi další nežádoucí účinky hlášené u některých dalších přípravků s oxybutyninchloridem patří: cykloplegie, mydriáza a suprese laktace. V jednom hlášeném případě bylo současné užívání oxybutyninu s karbamazepinem a dantrolenem spojeno s nežádoucími účinky, jako je zvracení, ospalost, zmatenost, nestabilita, nezřetelná řeč a nystagmus, což naznačuje toxicitu karbamazepinu.
DROGOVÉ INTERAKCE
Současné užívání oxybutyninu s jinými anticholinergními léky nebo s jinými látkami, které způsobují sucho v ústech, zácpu, somnolenci (ospalost) a/nebo jiné anticholinergikum podobné účinky, může zvýšit frekvenci a/nebo závažnost těchto účinků.
Anticholinergika mohou potenciálně měnit absorpci některých současně podávaných léků v důsledku anticholinergních účinků na gastrointestinální motilitu. To může být znepokojující u léků s úzkým terapeutickým indexem. Anticholinergní činidla mohou také antagonizovat účinky prokinetických činidel, jako je metoklopramid.
Průměrné plazmatické koncentrace oxybutyninu byly přibližně 2krát vyšší, když byl DITROPAN 5 mg XL® podáván s ketokonazolem, silným inhibitorem CYP3A4. Jiné inhibitory enzymového systému cytochromu P450 3A4, jako jsou antimykotika (např. itrakonazol a mikonazol) nebo makrolidová antibiotika (např. erythromycin a klarithromycin), mohou měnit průměrné farmakokinetické parametry oxybutyninu (tj. Cmax a AUC). Klinický význam těchto potenciálních interakcí není znám. Při současném podávání takových léků je třeba postupovat opatrně.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Angioedém
U oxybutyninu byl hlášen angioedém obličeje, rtů, jazyka a/nebo hrtanu. V některých případech se angioedém objevil po první dávce. Angioedém spojený s otokem horních cest dýchacích může být život ohrožující. Pokud dojde k postižení jazyka, hypofaryngu nebo hrtanu, oxybutynin by měl být okamžitě vysazen a měla by být okamžitě poskytnuta vhodná léčba a/nebo opatření nezbytná k zajištění průchodnosti dýchacích cest.
Účinky na centrální nervový systém
Oxybutynin je spojen s anticholinergními účinky na centrální nervový systém (CNS) [viz NEŽÁDOUCÍ REAKCE ]. Byly hlášeny různé anticholinergní účinky na CNS, včetně halucinací, agitovanosti, zmatenosti a somnolence. U pacientů je třeba sledovat známky anticholinergních účinků na CNS, zejména v prvních měsících po zahájení léčby nebo po zvýšení dávky. Informujte pacienty, aby neřídili nebo neobsluhovali těžké stroje, dokud nebudou vědět, jak na ně DITROPAN XL® působí. Pokud se u pacienta objeví anticholinergní účinky na CNS, je třeba zvážit snížení dávky nebo vysazení léku.
DITROPAN XL® by měl být používán s opatrností u pacientů s již existující demencí léčených inhibitory cholinesterázy kvůli riziku zhoršení příznaků.
DITROPAN XL® by měl být používán s opatrností u pacientů s Parkinsonovou nemocí kvůli riziku zhoršení příznaků.
Zhoršení Příznaků Myasthenia Gravis
DITROPAN XL® by měl být používán s opatrností u pacientů s myasthenia gravis kvůli riziku zhoršení příznaků.
Zhoršení příznaků snížené gastrointestinální motility u pacientů s autonomní neuropatií
DITROPAN 2,5 mg XL® by měl být používán s opatrností u pacientů s autonomní neuropatií kvůli riziku zhoršení příznaků snížené gastrointestinální motility.
Zadržování moči
DITROPAN 5 mg XL® by měl být podáván s opatrností pacientům s klinicky významnou obstrukcí výtoku močového měchýře kvůli riziku retence moči (viz KONTRAINDIKACE ].
Gastrointestinální nežádoucí účinky
DITROPAN 2,5 mg XL® by měl být podáván s opatrností pacientům s gastrointestinálními obstrukčními poruchami kvůli riziku retence žaludku (viz KONTRAINDIKACE ].
DITROPAN XL®, stejně jako jiná anticholinergika, může snižovat gastrointestinální motilitu a měl by být používán s opatrností u pacientů s onemocněními, jako je ulcerózní kolitida a střevní atonie.
DITROPAN 2,5 mg XL® by měl být používán s opatrností u pacientů, kteří mají gastroezofageální reflux a/nebo kteří současně užívají léky (jako jsou bisfosfonáty), které mohou způsobit nebo zhoršit ezofagitidu.
Stejně jako u jakéhokoli jiného nedeformovatelného materiálu je třeba opatrnosti při podávání přípravku DITROPAN XL® pacientům s již existujícím závažným gastrointestinálním zúžením (patologickým nebo iatrogenním). Vzácně byly hlášeny obstrukční symptomy u pacientů se známými strikturami v souvislosti s požitím jiných léků v nedeformovatelných formulacích s řízeným uvolňováním.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
24měsíční studie na potkanech při dávkách oxybutyninchloridu 20, 80 a 160 mg/kg/den neprokázala žádné známky karcinogenity. Tyto dávky jsou přibližně 6, 25 a 50násobek maximální expozice u člověka, na základě ekvivalentní dávky u člověka s přihlédnutím k normalizaci plochy povrchu těla.
Oxybutyninchlorid nevykazoval žádné zvýšení mutagenní aktivity při testování v testovacích systémech Schizosaccharomyces pompholiciformis, Saccharomyces cerevisiae a Salmonella typhimurium.
Reprodukční studie s oxybutyninchloridem u myší, potkanů, křečků a králíků neprokázaly žádné známky poškození fertility.
Použití u konkrétních populací
Těhotenství
Těhotenství kategorie B
Neexistují žádné adekvátní a dobře kontrolované studie s použitím DITROPAN 5 mg XL® u těhotných žen. DITROPAN XL® by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos pro pacientku převáží riziko pro pacientku a plod. Ženám, které otěhotní během léčby DITROPAN XL®, se doporučuje, aby kontaktovaly svého lékaře.
Shrnutí rizik
Na základě údajů na zvířatech se předpokládá, že oxybutynin má nízkou pravděpodobnost zvýšení rizika nežádoucích vývojových účinků nad základní riziko.
Údaje o zvířatech
Reprodukční studie s oxybutyninchloridem u myší, potkanů, křečků a králíků neprokázaly žádné známky poškození plodnosti nebo poškození zvířecího plodu.
Kojící matky
Není známo, zda se oxybutynin vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka, je třeba postupovat opatrně, když je DITROPAN 5 mg XL® podáván kojící ženě.
Pediatrické použití
Bezpečnost a účinnost přípravku DITROPAN XL® byla studována u 60 dětí v 24týdenní, otevřené, nerandomizované studii. Pacienti byli ve věku 6 – 15 let, všichni měli příznaky hyperaktivity detruzoru ve spojení s neurologickým onemocněním (např. rozštěp páteře), všichni používali čistou intermitentní katetrizaci a všichni v současné době užívali oxybutyninchlorid. Výsledky studie prokázaly, že podávání DITROPAN 2,5 mg XL® 5 až 20 mg/den bylo spojeno se zvýšením průměrného objemu moči na katetrizaci oproti výchozí hodnotě ze 108 ml na 136 ml, zvýšením průměrného objemu moči od výchozí hodnoty po ranním probuzení ze 148 ml na 189 ml a zvýšení průměrného procenta katetrizací bez epizody úniku od výchozí hodnoty z 34 % na 51 %.
Urodynamické výsledky byly v souladu s klinickými výsledky. Podávání DITROPAN XL® vedlo ke zvýšení průměrné maximální cystometrické kapacity oproti výchozí hodnotě ze 185 ml na 254 ml, snížení průměrného tlaku detruzoru při maximální cystometrické kapacitě od výchozí hodnoty ze 44 cm H2O na 33 cm H2O a snížení procenta pacientů vykazujících neinhibované kontrakce detruzoru (nejméně 15 cm HO) od 60 % do 28 %.
Farmakokinetika přípravku DITROPAN 5 mg XL® u těchto pacientů byla v souladu s farmakokinetikou hlášenou u dospělých (viz KLINICKÁ FARMAKOLOGIE ].
DITROPAN 5 mg XL® se nedoporučuje u pediatrických pacientů, kteří nemohou tabletu spolknout celou bez žvýkání, dělení nebo drcení, nebo u dětí mladších 6 let.
Geriatrické použití
Četnost a závažnost anticholinergních účinků hlášených pacienty mladšími 65 let a pacienty ve věku 65 let a staršími byly podobné. Farmakokinetika DITROPAN XL® byla podobná u všech studovaných pacientů (do 78 let věku).
Renální poškození
Nebyly provedeny žádné studie s DITROPAN XL® u pacientů s poruchou funkce ledvin.
Poškození jater
Nebyly provedeny žádné studie s DITROPANem 2,5 mg XL® u pacientů s poruchou funkce jater.
PŘEDÁVKOVAT
Při léčbě předávkování je třeba zvážit nepřetržité uvolňování oxybutyninu z DITROPAN 5 mg XL®. Pacienti by měli být sledováni po dobu nejméně 24 hodin. Léčba by měla být symptomatická a podpůrná. Může být podáváno katarzní činidlo.
Předávkování oxybutyninchloridem bylo spojeno s anticholinergními účinky včetně excitace centrálního nervového systému, zrudnutí, horečky, dehydratace, srdeční arytmie, zvracení a retence moči.
Požití 100 mg oxybutyninchloridu ve spojení s alkoholem bylo hlášeno u 13letého chlapce, u kterého došlo ke ztrátě paměti, a u 34leté ženy, u které se rozvinul strnulost, následovaná dezorientací a neklidem po probuzení, rozšířené zorničky, suché kůže, srdeční arytmie a zadržování moči. Oba pacienti se plně zotavili symptomatickou léčbou.
KONTRAINDIKACE
DITROPAN 2,5 mg XL® je kontraindikován u pacientů s retencí moči, retencí žaludku a jinými závažnými stavy snížené gastrointestinální motility, nekontrolovaným glaukomem s úzkým úhlem.
DITROPAN 2,5 mg XL® je také kontraindikován u pacientů, u kterých byla prokázána přecitlivělost na léčivou látku nebo jiné složky přípravku. Byly hlášeny reakce z přecitlivělosti, včetně anafylaxe a angioedému.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Oxybutynin uvolňuje hladké svalstvo močového měchýře. Oxybutyninchlorid má přímý antispasmodický účinek na hladké svalstvo a inhibuje muskarinový účinek acetylcholinu na hladké svalstvo. Na kosterních neuromuskulárních spojeních nebo autonomních gangliích se nevyskytují žádné blokující účinky (antinikotinové účinky).
Antimuskarinová aktivita spočívá převážně v R-izomeru. Metabolit, desethyloxybutynin, má ve studiích in vitro podobnou farmakologickou aktivitu jako oxybutynin.
Farmakodynamika
U pacientů se stavy charakterizovanými mimovolními kontrakcemi močového měchýře cystometrické studie prokázaly, že oxybutynin zvyšuje kapacitu močového měchýře (vezikální), snižuje frekvenci neinhibovaných kontrakcí detruzoru a oddaluje počáteční touhu po močení.
Farmakokinetika
Vstřebávání
Po první dávce DITROPAN XL® se plazmatické koncentrace oxybutyninu zvyšují po dobu 4 až 6 hodin; poté jsou ustálené koncentrace udržovány po dobu až 24 hodin, čímž se minimalizují výkyvy mezi maximálními a nejnižšími koncentracemi spojenými s oxybutyninem.
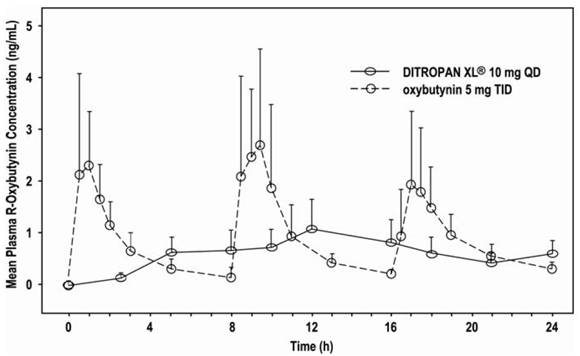
Relativní biologická dostupnost R- a S-oxybutyninu z DITROPAN XL® je 156 %, respektive 187 %, ve srovnání s oxybutyninem. Průměrné farmakokinetické parametry pro R- a S-oxybutynin jsou shrnuty v tabulce 2. Profily plazmatické koncentrace-čas pro R- a S-oxybutynin mají podobný tvar; Obrázek 1 ukazuje profil pro R-oxybutynin.
Obrázek 1: Průměrné plazmatické koncentrace R-oxybutyninu po jedné dávce DITROPAN XL® 10 mg a oxybutyninu 5 mg podaných každých 8 hodin (n=23 pro každou léčbu).
Ustáleného stavu plazmatických koncentrací oxybutyninu je dosaženo do 3. dne opakovaného podávání DITROPANu XL® bez pozorované akumulace léčiva nebo změn farmakokinetických parametrů oxybutyninu a desethyloxybutyninu.
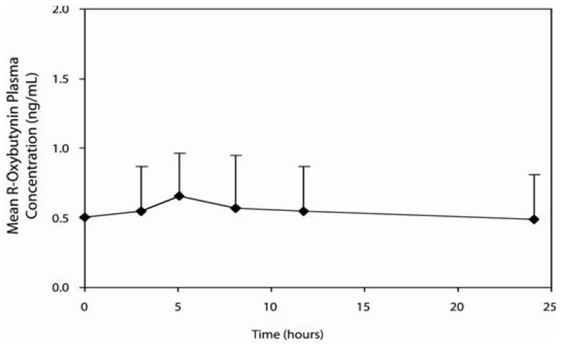
Farmakokinetika DITROPAN 5 mg XL® v ustáleném stavu byla studována u 19 dětí ve věku 5 – 15 let s hyperaktivitou detruzoru spojenou s neurologickým stavem (např. spina bifida). Děti byly na DITROPANu 2,5 mg XL® v celkové denní dávce v rozmezí od 5 do 20 mg (0,10 až 0,77 mg/kg). K získání vzorků séra byla použita technika řídkého odběru vzorků. Když jsou všechna dostupná data normalizována na ekvivalent 5 mg denně DITROPAN XL®, průměrné farmakokinetické parametry odvozené pro R- a S-oxybutynin a R- a S-desethyloxybutynin jsou shrnuty v tabulce 3. Profily plazmatických koncentrací pro R- a S-oxybutynin mají podobný tvar; Obrázek 2 ukazuje profil pro R-oxybutynin, když jsou všechna dostupná data normalizována na ekvivalent 5 mg za den.
Obrázek 2: Průměrné plazmatické koncentrace R-oxybutyninu v ustáleném stavu (± SD) po podání 5 až 20 mg DITROPAN 5 mg XL® jednou denně u dětí ve věku 5 – 15 let. Graf představuje všechna dostupná data normalizovaná na ekvivalent DITROPAN XL® 5 mg jednou denně.
Účinky jídla
Rychlost a rozsah absorpce a metabolismu oxybutyninu jsou podobné za podmínek nasycení a nalačno.
Rozdělení
Oxybutynin je po systémové absorpci široce distribuován v tělesných tkáních. Distribuční objem je 193 l po intravenózním podání 5 mg oxybutyninchloridu. Oba enantiomery oxybutyninu se silně váží (>99 %) na plazmatické proteiny. Oba enantiomery N-desethyloxybutyninu jsou také vysoce vázány (>97 %) na plazmatické proteiny. Hlavním vazebným proteinem je alfa-1 kyselý glykoprotein.
Metabolismus
Oxybutynin je primárně metabolizován enzymovými systémy cytochromu P450, zejména CYP3A4, který se nachází převážně v játrech a střevní stěně. Mezi jeho metabolické produkty patří kyselina fenylcyklohexylglykolová, která je farmakologicky neaktivní, a desethyloxybutynin, který je farmakologicky aktivní. Po podání DITROPAN 2,5 mg XL® jsou plazmatické koncentrace R- a S-desethyloxybutyninu 73 % a 92 % koncentrací pozorovaných u oxybutyninu.
Vylučování
Oxybutynin je extenzivně metabolizován v játrech, přičemž méně než 0,1 % podané dávky se vylučuje v nezměněné podobě močí. Také méně než 0,1 % podané dávky se vyloučí jako metabolit desethyloxybutynin.
Proporcionalita dávky
Farmakokinetické parametry oxybutyninu a desethyloxybutyninu (Cmax a AUC) po podání 5 – 20 mg DITROPAN 5 mg XL® jsou úměrné dávce.
Použití u konkrétních populací
Pediatrická
Farmakokinetika DITROPAN 2,5 mg XL® byla hodnocena u 19 dětí ve věku 5 – 15 let s hyperaktivitou detruzoru spojenou s neurologickým stavem (např. spina bifida). Farmakokinetika přípravku DITROPAN 2,5 mg XL® u těchto pediatrických pacientů byla v souladu s farmakokinetikou hlášenou u dospělých (viz tabulky 2 a 3 a obrázky 1 a 2 výše).
Rod
Neexistují žádné významné rozdíly ve farmakokinetice oxybutyninu u zdravých mužských a ženských dobrovolníků po podání DITROPAN 2,5 mg XL®.
Závod
Dostupné údaje naznačují, že po podání DITROPANu 2,5 mg XL® nejsou u zdravých dobrovolníků žádné významné rozdíly ve farmakokinetice oxybutyninu na základě rasy.
Klinické studie
DITROPAN 5 mg XL® byl hodnocen pro léčbu pacientů s hyperaktivním měchýřem se symptomy urgentní inkontinence moči, urgence a frekvence ve třech kontrolovaných studiích účinnosti. Většina pacientů byli bělošští (89,0 %) a ženy (91,9 %) s průměrným věkem 59 let (rozmezí 18 až 98 let). Vstupní kritéria vyžadovala, aby pacienti trpěli urgentní nebo smíšenou inkontinencí (s převahou nutkání), o čemž svědčí ≥ 6 epizod urgentní inkontinence za týden a ≥ 10 mikcí za den. Studie 1 byla navržena s fixní eskalací dávky, zatímco další dvě studie používaly návrh úpravy dávky, ve kterém byla konečná dávka každého pacienta upravena tak, aby byla vyvážena mezi zlepšením symptomů inkontinence a snášenlivostí vedlejších účinků. Všechny tři studie zahrnovaly pacienty, o kterých bylo známo, že reagují na oxybutynin nebo jiné anticholinergní léky, a tito pacienti byli udržováni na konečné dávce po dobu až 2 týdnů.
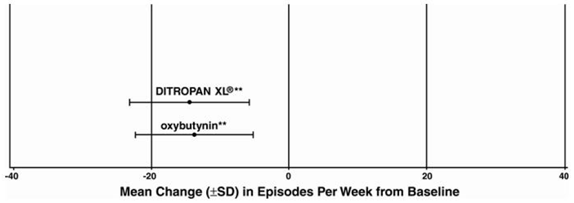
Výsledky účinnosti pro tři kontrolované studie jsou uvedeny v následujících tabulkách 4, 5 a 6 a na obrázcích 3, 4 a 5.
Obrázek 3: Průměrná změna (±SD) v epizodách urgentní močové inkontinence za týden od výchozího stavu (studie 1)
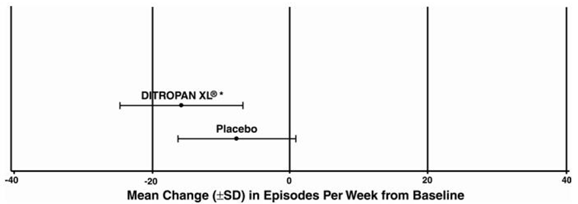
Obrázek 4: Průměrná změna (±SD) v epizodách urgentní močové inkontinence za týden od výchozího stavu (studie 2)
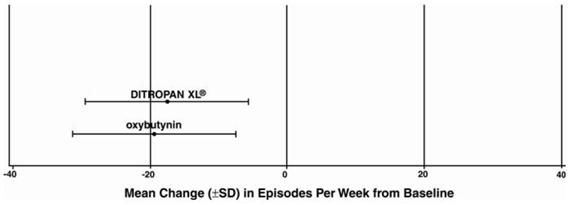
Obrázek 5: Průměrná změna (±SD) v epizodách urgentní močové inkontinence za týden od výchozího stavu (studie 3)
INFORMACE PRO PACIENTA
- Pacienti by měli být informováni, že oxybutynin může vyvolat angioedém, který může vést k život ohrožující obstrukci dýchacích cest. Pacienti by měli být poučeni, aby okamžitě ukončili léčbu oxybutyninem a okamžitě vyhledali lékařskou pomoc, pokud se u nich objeví otok jazyka, edém hrtanu nebo potíže s dýcháním.
- Pacienti by měli být informováni, že anticholinergní (antimuskarinová) činidla, jako je DITROPAN XL®, mohou způsobit klinicky významné nežádoucí účinky související s anticholinergní aktivitou, jako jsou:
- Zadržování moči a zácpa
- Útlum tepla v důsledku sníženého pocení. Pokud jsou anticholinergní léky podávány v přítomnosti vysoké okolní teploty, může dojít k tepelnému oslabení.
- Pacienti by měli být informováni, že anticholinergní léky, jako je DITROPAN 5 mg XL®, mohou způsobit ospalost (somnolenci), závratě nebo rozmazané vidění. Pacientům je třeba doporučit, aby byli opatrní při rozhodování o zapojení se do potenciálně nebezpečných činností, dokud nebudou stanoveny účinky DITROPAN XL®.
- Pacienti by měli být informováni, že alkohol může zvýšit ospalost způsobenou anticholinergními látkami, jako je DITROPAN XL®.
- Pacienti by měli být informováni, že DITROPAN 5 mg XL® by se měl polykat celý s pomocí tekutin. Pacienti by neměli tablety žvýkat, dělit ani drtit. Lék je obsažen v neabsorbovatelném obalu navrženém tak, aby uvolňoval léčivo řízenou rychlostí. Obal tablety je vyloučen z těla; pacienti by se neměli znepokojovat, pokud si ve stolici občas všimnou něčeho, co vypadá jako tableta.
- DITROPAN 5 mg XL® se má užívat každý den přibližně ve stejnou dobu.
