Maxalt 5mg, 10mg Rizatriptan Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Maxalt a jak se používá?
Maxalt je lék na předpis používaný k léčbě příznaků migrény. Maxalt 10 mg lze užívat samostatně nebo s jinými léky.
Maxalt patří do třídy léků nazývaných agonisté serotoninových 5-HT-receptorů; Antimigrenózní látky.
Není známo, zda je přípravek Maxalt 5 mg bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Maxalt?
Maxalt může způsobit závažné nežádoucí účinky včetně:
- náhlá a silná bolest žaludku,
- krvavý průjem,
- chladný pocit,
- necitlivost nohou a rukou,
- těžká bolest hlavy,
- rozmazané vidění,
- bušení do krku nebo uší,
- bolest nebo tlak na hrudi,
- bolest šířící se do čelisti nebo ramene,
- nevolnost,
- pocení,
- míchání,
- halucinace,
- horečka,
- chvění,
- rychlý srdeční tep,
- svalová ztuhlost,
- cukání,
- ztráta koordinace,
- nevolnost,
- ztráta koordinace,
- zvracení,
- průjem,
- náhlá necitlivost nebo slabost (zejména na jedné straně těla),
- náhlá silná bolest hlavy,
- nezřetelná řeč a
- problémy s viděním nebo rovnováhou
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Maxalt patří:
- závrať,
- ospalost,
- pocit únavy a
- bolest nebo pocit tlaku v krku nebo na hrudi
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Maxalt. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
MAXALT 10 mg obsahuje rizatriptan benzoát, selektivního agonistu receptoru 5-hydroxytryptamin1B/1D (5-HT1B/1D).
Rizatriptanbenzoát je chemicky popsán jako: N,N-dimethyl-5-(1H-1,2,4-triazol-1-ylmethyl)-1Hindol-3-ethanamin monobenzoát a jeho strukturní vzorec je:
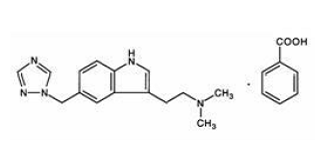
Jeho empirický vzorec je C15H19N5•C7H6O2, což představuje molekulovou hmotnost volné báze 269,4. Rizatriptan benzoát je bílá až téměř bílá krystalická pevná látka, která je rozpustná ve vodě v koncentraci přibližně 42 mg na ml (vyjádřeno jako volná báze) při 25 °C.
Tablety MAXALT 5 mg a tablety MAXALT-MLT, které se rozpadají v ústech, jsou k dispozici pro perorální podání v síle 5 a 10 mg (což odpovídá 7,265 mg nebo 14,53 mg benzoátové soli). Každá lisovaná tableta obsahuje následující neaktivní složky: monohydrát laktózy, mikrokrystalickou celulózu, předbobtnalý škrob, oxid železitý (červený) a magnesium-stearát. Každá lyofilizovaná tableta rozpadající se v ústech obsahuje následující neaktivní složky: želatinu, mannitol, glycin, aspartam a mátovou příchuť.
INDIKACE
MAXALT® a MAXALT-MLT® jsou indikovány k akutní léčbě migrény s aurou nebo bez aury u dospělých a dětských pacientů ve věku 6 až 17 let.
Omezení použití
- MAXALT by měl být používán pouze v případě, že byla stanovena jasná diagnóza migrény. Pokud pacient nereaguje na první záchvat migrény léčený přípravkem MAXALT 10 mg, je třeba před podáním přípravku MAXALT 5 mg k léčbě jakýchkoli následných záchvatů znovu zvážit diagnózu migrény.
- MAXALT 10 mg není indikován k použití při léčbě hemiplegické nebo bazilární migrény (viz KONTRAINDIKACE ].
- MAXALT 10 mg není indikován k prevenci záchvatů migrény.
- Bezpečnost a účinnost přípravku MAXALT 5 mg nebyla u klastrové bolesti hlavy stanovena.
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o dávkování u dospělých
Doporučená počáteční dávka přípravku MAXALT je buď 5 mg nebo 10 mg pro akutní léčbu migrény u dospělých. Dávka 10 mg může poskytnout větší účinek než dávka 5 mg, ale může mít větší riziko nežádoucích účinků (viz Klinické studie ].
Předávkování u dospělých
Ačkoli účinnost druhé dávky nebo následných dávek nebyla stanovena v placebem kontrolovaných studiích, pokud se migréna vrátí, může být druhá dávka podána 2 hodiny po první dávce. Maximální denní dávka by neměla překročit 30 mg za 24 hodin. Bezpečnost léčby v průměru více než čtyř bolestí hlavy za 30 dnů nebyla stanovena.
Informace o dávkování u pediatrických pacientů (věk 6 až 17 let)
Dávkování u dětských pacientů je založeno na tělesné hmotnosti pacienta. Doporučená dávka přípravku MAXALT 10 mg je 5 mg u pacientů s hmotností nižší než 40 kg (88 lb) a 10 mg u pacientů s hmotností 40 kg (88 lb) nebo více.
Účinnost a bezpečnost léčby více než jednou dávkou MAXALTu během 24 hodin u pediatrických pacientů ve věku 6 až 17 let nebyla stanovena.
Podávání MAXALT-MLT perorálně se rozpadajících tablet
MAXALT-MLT perorálně se rozpadajících tablet není podávání s tekutinou nutné. Tablety rozpadající se v ústech jsou baleny v blistru ve vnějším hliníkovém sáčku a pacienti by měli blistr z vnějšího sáčku vyjmout až těsně před podáním dávky. Pak se má blistr odloupnout suchýma rukama a orálně se rozpadající tableta položit na jazyk, kde se rozpustí a spolkne se slinami.
Úprava dávkování pro pacienty na propranololu
Dospělí pacienti
U dospělých pacientů užívajících propranolol se doporučuje pouze 5 mg dávka MAXALT 5 mg, maximálně však 3 dávky během 24 hodin (15 mg) [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Pediatričtí pacienti
U pediatrických pacientů s hmotností 40 kg (88 lb) nebo více, kteří užívají propranolol, se doporučuje pouze jedna 5 mg dávka přípravku MAXALT (maximální dávka 5 mg za 24 hodin). MAXALT by neměl být předepisován dětským pacientům léčeným propranololem, kteří váží méně než 40 kg (88 lb) (viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety MAXALT
- mg tablety jsou světle růžové lisované tablety ve tvaru tobolky s kódem MRK na jedné straně a 266 na druhé straně.
- 10 mg tablety jsou světle růžové lisované tablety ve tvaru tobolky s kódem MAXALT 5 mg na jedné straně a MRK 267 na druhé straně.
MAXALT-MLT orálně se rozpadající tablety
- 5 mg perorálně se rozpadající tablety jsou bílé až téměř bílé, kulaté lyofilizované tablety s vyraženým upraveným trojúhelníkem na jedné straně.
- 10 mg perorálně se rozpadající tablety jsou bílé až téměř bílé, kulaté lyofilizované tablety s vyraženým upraveným čtvercem na jedné straně.
Skladování A Manipulace
č. 3732 - MAXALT Tablety, 5 mg , jsou světle růžové, tobolkovité, lisované tablety s kódováním
MRK na jedné straně a 266 na druhé straně:
NDC 0006-0266-18, karton po 18 tabletách.
č. 3733 - MAXALT 5 mg tablety, 10 mg , jsou světle růžové lisované tablety ve tvaru tobolky s kódem MAXALT 10 mg na jedné straně a MRK 267 na druhé straně:
NDC 0006-0267-18, karton po 18 tabletách.
č. 3800 - MAXALT-MLT tablety rozvolňující ústa, 5 mg jsou bílé až téměř bílé, kulaté lyofilizované orálně se rozpadající tablety s vyraženým modifikovaným trojúhelníkem na jedné straně a o rozměrech 10,0-11,5 mm (ze strany na stranu) s příchutí máty peprné. Každá tableta rozpadající se v ústech je jednotlivě balena v blistru uvnitř hliníkového sáčku (sáčku). Dodávají se následovně:
NDC 0006-3800-18, 6 x přepravní pouzdro na jednotku 3 tablety rozpadající se v ústech (celkem 18 tablet).
č. 3801 - MAXALT-MLT tablety rozvolňující ústa, 10 mg jsou bílé až téměř bílé, kulaté lyofilizované perorálně se rozpadající tablety s vyraženým upraveným čtvercem na jedné straně a o rozměrech 12,0-13,8 mm (ze strany na stranu) s příchutí máty peprné. Každá tableta rozpadající se v ústech je jednotlivě balena v blistru uvnitř hliníkového sáčku (sáčku). Dodávají se následovně:
NDC 0006-3801-18, 6 x přepravní pouzdro na jednotku 3 tablety rozpadající se v ústech (celkem 18 tablet).
Úložný prostor
Uchovávejte MAXALT 5 mg tablety při pokojové teplotě, 15°C-30°C (59°F-86°F).
Uchovávejte MAXALT-MLT perorálně se rozpadající tablety při pokojové teplotě, 15°C-30°C (59°F-86°F).
Distribuce: Merck Sharp & Dohme Corp., dceřiná společnost MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Upraveno: říjen 2019
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Ischemie myokardu, infarkt myokardu a Prinzmetalova angina [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Arytmie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Bolest hrudníku, krku, krku a / nebo čelisti / těsnost / tlak [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Cévní mozkové příhody [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Jiné vazospasmové reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Nadužívání léků Bolest hlavy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Zvýšení krevního tlaku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Dospělí
Výskyt v kontrolovaných klinických studiích
Nežádoucí účinky přípravku MAXALT byly hodnoceny v kontrolovaných klinických studiích, které zahrnovaly více než 3 700 dospělých pacientů, kteří dostávali jednu nebo více dávek tablet MAXALT. Nejčastějšími nežádoucími účinky během léčby přípravkem MAXALT (≥ 5 % v obou léčebných skupinách a vyšší než u placeba) byly astenie/únava, somnolence, bolest/pocit tlaku a závratě. Zdá se, že tyto nežádoucí účinky souvisejí s dávkou.
Tabulka 1 uvádí nežádoucí účinky (výskyt ≥ 2 % a vyšší než u placeba) po jedné dávce MAXALT 5 mg u dospělých.
Frekvence nežádoucích účinků v klinických studiích se nezvýšila, když byly užity až tři dávky během 24 hodin. Frekvence nežádoucích účinků se nezměnila ani při současném užívání léků běžně užívaných k profylaxi migrény (včetně propranololu), perorálních kontraceptiv nebo analgetik. Výskyt nežádoucích účinků nebyl ovlivněn věkem ani pohlavím. K posouzení vlivu rasy na výskyt nežádoucích účinků nebyly k dispozici dostatečné údaje.
Další události pozorované ve spojení s Administrací MAXALT u dospělých
následující části jsou uvedeny frekvence méně často hlášených nežádoucích účinků, které nebyly hlášeny v jiných částech označení. Protože zprávy zahrnují události pozorované v otevřených studiích, nelze úlohu přípravku MAXALT 5 mg v jejich příčinné souvislosti spolehlivě určit. Navíc variabilita spojená s hlášením nežádoucích příhod, terminologie používaná k popisu nežádoucích příhod, omezuje hodnotu poskytovaných kvantitativních odhadů četnosti. Frekvence příhod se vypočítá jako počet pacientů, kteří užívali MAXALT a nahlásili příhodu, dělený celkovým počtem pacientů vystavených MAXALTu (N=3716). Všechny hlášené příhody se vyskytly s incidencí ≥1 % nebo se předpokládá, že jsou přiměřeně spojeny s užíváním léku. Příhody jsou dále klasifikovány v rámci kategorií tělesných systémů a vyjmenovány v pořadí klesající frekvence pomocí následujících definic: časté nežádoucí příhody jsou ty, které jsou definovány jako ty, které se vyskytují u alespoň (>)1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; a vzácné nežádoucí účinky jsou ty, které se vyskytují u méně než 1/1000 pacientů.
Všeobecné: Vzácně se vyskytoval edém obličeje. Vzácné byly synkopy a edém/otoky.
Atypické pocity: Časté byly pocity tepla.
Kardiovaskulární: Časté bylo bušení srdce. Méně časté byly tachykardie, studené končetiny a bradykardie.
Zažívací: Časté byly průjmy a zvracení. Méně časté byly dyspepsie, edém jazyka a abdominální distenze.
Muskuloskeletální: Méně časté byly svalová slabost, ztuhlost, myalgie a svalové křeče/křeče.
Neurologické/psychiatrické: Časté byly hypoestézie, euforie a třes. Méně časté byly vertigo, nespavost, zmatenost/dezorientace, abnormality chůze, poruchy paměti a agitovanost.
Respirační: Častá byla dušnost. Méně častý byl edém hltanu.
Speciální smysly: Méně časté bylo rozmazané vidění a tinnitus. Vzácný byl otok očí.
Kůže a kožní příloha: Časté bylo zarudnutí. Méně časté byly pocení, pruritus, vyrážka a kopřivka. Vzácný byl erytém, návaly horka.
Profil nežádoucích účinků pozorovaný u MAXALT-MLT perorálně se rozpadajících tablet byl podobný jako u MAXALT 10 mg tablety.
Pediatričtí pacienti ve věku 6 až 17 let
Incidence v kontrolovaných klinických studiích u pediatrických pacientů
Nežádoucí účinky na MAXALT-MLT byly hodnoceny v kontrolované klinické studii akutní léčby migrény (studie 7), která zahrnovala celkem 1382 dětských pacientů ve věku 6-17 let, z nichž 977 (72 %) podalo alespoň jednu dávku studijní léčby (MAXALT-MLT a/nebo placebo) [viz Klinické studie ]. Výskyt nežádoucích účinků hlášených u pediatrických pacientů v akutní klinické studii byl podobný u pacientů, kteří dostávali MAXALT, jako u pacientů, kteří dostávali placebo. Očekává se, že profil nežádoucích účinků u pediatrických pacientů bude podobný jako u dospělých.
Další události pozorované v souvislosti s podáváním MAXALT-MLT u dětských pacientů
následující části jsou uvedeny frekvence méně často hlášených nežádoucích účinků. Protože zprávy zahrnují události pozorované v otevřených studiích, nelze úlohu MAXALT-MLT v jejich příčině spolehlivě určit. Navíc variabilita spojená s hlášením nežádoucích příhod, terminologie používaná k popisu nežádoucích příhod, omezuje hodnotu poskytovaných kvantitativních odhadů četnosti.
Frekvence příhod se vypočítá jako počet dětských pacientů ve věku 6 až 17 let, kteří užívali MAXALT-MLT a nahlásili příhodu, dělený celkovým počtem pacientů vystavených MAXALT-MLT (N=1068). Všechny hlášené příhody se vyskytly s incidencí ≥1 % nebo se předpokládá, že jsou přiměřeně spojeny s užíváním léku. Příhody jsou dále klasifikovány v rámci tříd orgánových systémů a vyjmenovány v pořadí klesající frekvence pomocí následujících definic: časté nežádoucí příhody jsou ty, které se vyskytují u (>)1/100 pediatrických pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pediatrických pacientů; a vzácné nežádoucí účinky jsou ty, které se vyskytují u méně než 1/1000 pacientů.
Všeobecné: Častá byla únava.
Poruchy ucha a labyrintu: Vzácně byla hypoakuzie.
Gastrointestinální poruchy: Časté byly bolesti břicha.
Poruchy nervového systému: Méně časté byly abnormální koordinace, poruchy pozornosti a presynkopa.
Psychiatrické poruchy: Vzácně byly halucinace.
Postmarketingové zkušenosti
Následující část vyjmenovává potenciálně důležité nežádoucí účinky, které se vyskytly v klinické praxi a které byly spontánně hlášeny různým systémům sledování. Vyjmenované události zahrnují všechny kromě těch, které již byly uvedeny v jiných částech označování nebo těch, které jsou příliš obecné na to, aby byly informativní. Vzhledem k tomu, že zprávy citují spontánně hlášené události z celosvětových postmarketingových zkušeností, nelze frekvenci událostí a roli přípravku MAXALT 5 mg v jejich příčinné souvislosti spolehlivě určit.
Neurologické/psychiatrické: Záchvat.
Všeobecné: Alergické stavy včetně anafylaxe/anafylaktoidní reakce, angioedému, sípání a toxické epidermální nekrolýzy (viz KONTRAINDIKACE ].
Speciální smysly: Dysgeuzie.
DROGOVÉ INTERAKCE
Propranolol
Dávka MAXALT 5 mg by měla být upravena u pacientů léčených propranololem, protože bylo prokázáno, že propranolol zvyšuje plazmatickou AUC rizatriptanu o 70 % (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Léky obsahující námel
Bylo hlášeno, že léky obsahující námel způsobují prodloužené vazospastické reakce. Protože tyto účinky mohou být aditivní, je kontraindikováno užívání léků obsahujících ergotamin nebo léků typu ergotamínu (jako je dihydroergotamin nebo methysergid) a MAXALT 5 mg do 24 hodin (viz KONTRAINDIKACE ].
Další 5-HT1 agonisté
Vzhledem k tomu, že jejich vazospastické účinky mohou být aditivní, je současné podávání MAXALT 10 mg a jiných 5-HT1 agonistů během 24 hodin od sebe kontraindikováno [viz KONTRAINDIKACE ].
SSRI/SNRI a serotoninový syndrom
Při současném podávání triptanů a selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) nebo inhibitorů zpětného vychytávání serotoninu a norepinefrinu (SNRI) byly hlášeny případy serotoninového syndromu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Inhibitory monoaminoxidázy
MAXALT je kontraindikován u pacientů užívajících inhibitory MAO-A a neselektivní inhibitory MAO. Specifický inhibitor MAO-A zvýšil systémovou expozici rizatriptanu a jeho metabolitu [viz KONTRAINDIKACE a KLINICKÁ FARMAKOLOGIE ].
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Ischemie myokardu, infarkt myokardu a Prinzmetalova angina
MAXALT by neměl být podáván pacientům s ischemickou nebo vazospastickou chorobou koronárních tepen. Vzácně byly hlášeny závažné nežádoucí účinky na srdce, včetně akutního infarktu myokardu, které se objevily během několika hodin po podání přípravku MAXALT. Některé z těchto reakcí se objevily u pacientů bez známého onemocnění koronárních tepen (CAD). Agonisté 5-HT1, včetně MAXALT 5 mg, mohou způsobit vazospasmus koronárních tepen (Prinzmetalova angina), a to i u pacientů bez ICHS v anamnéze.
Pacienti dosud neléčení triptanem, kteří mají více kardiovaskulárních rizikových faktorů (např. zvýšený věk, diabetes, hypertenze, kouření, obezita, silná rodinná anamnéza ICHS), by měli podstoupit kardiovaskulární vyšetření před podáním přípravku MAXALT. Pokud existují známky ICHS nebo vazospasmu koronárních tepen, MAXALT by neměl být podáván (viz KONTRAINDIKACE ]. U pacientů s negativním kardiovaskulárním vyšetřením je třeba zvážit podání první dávky MAXALTu v prostředí pod lékařským dohledem a provedení elektrokardiogramu (EKG) bezprostředně po podání MAXALTu 10 mg. U intermitentních dlouhodobých uživatelů MAXALTu, kteří mají kardiovaskulární rizikové faktory, je třeba zvážit pravidelné kardiovaskulární vyšetření.
Arytmie
Život ohrožující poruchy srdečního rytmu, včetně ventrikulární tachykardie a ventrikulární fibrilace vedoucí k úmrtí, byly hlášeny během několika hodin po podání agonistů 5-HT1. Pokud se tyto poruchy objeví, přerušte podávání MAXALT 10 mg.
Bolest/Test/Tlak na hrudi, krku, krku a/nebo čelisti
Stejně jako u jiných agonistů 5-HT1 se po léčbě přípravkem MAXALT 5 mg běžně objevují pocity těsnosti, bolesti, tlaku a tíhy v prekordiu, krku, krku a čelisti a obvykle nemají kardiální původ. Pokud je však podezření na kardiální původ, pacienti by měli být vyšetřeni. Pacienti s prokázanou ICHS a pacienti s Prinzmetalovou variantou anginy pectoris by neměli dostávat agonisty 5-HT1.
Cévní mozkové příhody
U pacientů léčených agonisty 5-HT1 se vyskytlo mozkové krvácení, subarachnoidální krvácení a cévní mozková příhoda a některé vedly k úmrtím. V řadě případů se zdá možné, že cerebrovaskulární příhody byly primární, agonista 5-HT1 byl podáván v nesprávném přesvědčení, že prožívané symptomy byly důsledkem migrény, i když tomu tak nebylo. Pacienti s migrénou mohou mít také zvýšené riziko určitých cerebrovaskulárních příhod (např. mrtvice, krvácení, tranzitorní ischemické ataky). Pokud dojde k cerebrovaskulární příhodě, přerušte podávání MAXALTu.
Stejně jako u jiných akutních terapií migrény je třeba před léčbou bolestí hlavy u pacientů, u kterých nebyla dříve diagnostikována migréna, au pacientů s migrénou, kteří mají atypické příznaky, věnovat pozornost vyloučení jiných potenciálně závažných neurologických stavů. MAXALT by neměl být podáván pacientům s anamnézou cévní mozkové příhody nebo tranzitorní ischemické ataky (viz KONTRAINDIKACE ].
Jiné vazospasmové reakce
Agonisté 5-HT1, včetně MAXALT, mohou způsobit nekoronární vazospastické reakce, jako je periferní vaskulární ischemie, gastrointestinální vaskulární ischemie a infarkt (projevující se bolestí břicha a krvavým průjmem), infarkt sleziny a Raynaudův syndrom. U pacientů, u kterých se po použití jakéhokoli 5-HT1 agonisty objeví příznaky nebo známky naznačující nekoronární vazospasmickou reakci, je třeba před podáním dalších dávek MAXALT 10 mg vyloučit suspektní vazospasmickou reakci.
Při užívání 5-HT1 agonistů byly hlášeny případy přechodné a trvalé slepoty a významné částečné ztráty zraku. Protože poruchy zraku mohou být součástí záchvatu migrény, příčinná souvislost mezi těmito příhodami a použitím 5-HT1 agonistů nebyla jasně stanovena.
Nadužívání léků Bolest hlavy
Nadužívání léků na akutní migrénu (např. ergotamin, triptany, opioidy nebo kombinace léků po dobu 10 nebo více dní v měsíci) může vést k exacerbaci bolesti hlavy (bolesti hlavy z nadužívání léků). Bolesti hlavy z nadměrného užívání léků se mohou projevovat jako každodenní bolesti hlavy podobné migréně nebo jako výrazné zvýšení frekvence záchvatů migrény. Může být nezbytná detoxikace pacientů, včetně vysazení nadužívaných léků, a léčba abstinenčních příznaků (které často zahrnují přechodné zhoršení bolesti hlavy).
serotoninový syndrom
Serotoninový syndrom se může objevit u triptanů, včetně MAXALT 10 mg, zejména při současném podávání se selektivními inhibitory zpětného vychytávání serotoninu (SSRI), inhibitory zpětného vychytávání serotoninu a norepinefrinu (SNRI), tricyklickými antidepresivy (TCA) a inhibitory MAO [viz DROGOVÉ INTERAKCE ]. Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, kóma), autonomní nestabilitu (např. tachykardie, labilní krevní tlak, hypertermie), neuromuskulární aberace (např. hyperreflexie, nekoordinace) a/nebo gastrointestinální příznaky (např. nevolnost zvracení, průjem). K nástupu příznaků může dojít během minut až hodin po podání nové nebo větší dávky serotonergního léku. Léčba MAXALTem by měla být přerušena, pokud je podezření na serotoninový syndrom (viz DROGOVÉ INTERAKCE a INFORMACE PRO PACIENTA ].
Zvýšení krevního tlaku
Významné zvýšení krevního tlaku, včetně hypertenzní krize s akutním poškozením orgánových systémů, bylo vzácně hlášeno u pacientů s hypertenzí v anamnéze nebo bez ní, kteří dostávali agonisty 5-HT1, včetně přípravku MAXALT. U zdravých mladých dospělých mužů a žen, kteří dostávali maximální dávky MAXALTu (10 mg každé 2 hodiny ve 3 dávkách), bylo pozorováno mírné zvýšení krevního tlaku (přibližně 2-3 mmHg). MAXALT je kontraindikován u pacientů s nekontrolovanou hypertenzí (viz KONTRAINDIKACE ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Riziko ischemie myokardu a/nebo infarktu, Prinzmetalovy anginy pectoris, jiných příhod souvisejících s vazospasmem a cerebrovaskulárních příhod
Informujte pacienty, že MAXALT může způsobit závažné kardiovaskulární nežádoucí účinky, jako je infarkt myokardu nebo cévní mozková příhoda. I když závažné kardiovaskulární příhody mohou nastat bez varovných příznaků, pacienti by si měli dávat pozor na známky a příznaky bolesti na hrudi, dušnost, slabost, nezřetelnou řeč a měli by požádat o lékařskou pomoc, když pozorují jakékoli indikativní známky nebo příznaky. Pacienti by měli být informováni o důležitosti tohoto sledování [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
serotoninový syndrom
Pacienti by měli být upozorněni na riziko serotoninového syndromu při užívání MAXALT 10 mg nebo jiných triptanů, zejména při kombinovaném užívání se selektivními inhibitory zpětného vychytávání serotoninu (SSRI) nebo inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
Těhotenství
Informujte pacienty, že MAXALT by neměl být používán během těhotenství, pokud potenciální přínos neospravedlňuje potenciální riziko pro plod (viz Použití u konkrétních populací ].
Laktace
Informujte pacienty, aby informovali svého poskytovatele zdravotní péče, pokud kojí nebo plánují kojit [viz Použití u konkrétních populací ].
Schopnost provádět složité úkoly
Vzhledem k tomu, že migrény nebo léčba přípravkem MAXALT 10 mg může způsobit ospalost a závratě, poučte pacienty, aby zhodnotili svou schopnost provádět složité úkoly během záchvatů migrény a po podání přípravku MAXALT.
Nadužívání léků Bolest hlavy
Informujte pacienty, že užívání léků na akutní migrénu po dobu 10 nebo více dní v měsíci může vést k exacerbaci bolesti hlavy, a povzbuďte pacienty, aby zaznamenávali frekvenci bolesti hlavy a užívání drog (např. tím, že si vedou deník bolesti hlavy) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Manipulace s balením orálně se rozpadajících tablet
Poučte pacienty, aby nevyjímali blistr z vnějšího hliníkového sáčku, dokud nejsou připraveni použít tabletu rozpadající se v ústech uvnitř [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pacienti s fenylketonurií
Informujte pacienty s fenylketonurií, že MAXALT-MLT perorálně se rozpadající tablety obsahují fenylalanin (složka aspartamu). Každá 5mg perorálně se rozpadající tableta obsahuje 1,1 mg fenylalaninu a každá 10mg perorálně se rozpadající tableta obsahuje 2,1 mg fenylalaninu [viz Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Studie perorální karcinogenity rizatriptanu byly provedeny u myší (100 týdnů) a potkanů (106 týdnů) v dávkách až 125 mg/kg/den. Nebylo prokázáno zvýšení incidence nádorů souvisejících s rizatriptanem u žádného druhu. Plazmatické expozice (AUC) při nejvyšší testované dávce byly přibližně 150krát (myši) a 240krát (potkani) vyšší než u lidí při maximální doporučené dávce pro člověka (MRHD) 30 mg/den.
Mutageneze
Rizatriptan nebyl ani mutagenní, ani klastogenní v řadě studií genetické toxicity in vitro a in vivo, včetně: testu mikrobiální mutageneze (Ames), testu in vitro mutageneze savčích buněk a testů chromozomálních aberací a testu in vivo chromozomálních aberací u myší.
Zhoršení Plodnosti
Perorální podávání rizatriptanu (0, 2, 10 nebo 100 mg/kg/den) samičkám potkanů před a během páření a pokračující během březosti a laktace nemělo žádný vliv na fertilitu; při nejvyšší testované dávce však byla pozorována změněná estrální cykličnost a zpoždění v době páření. Plazmatická expozice při dávce bez účinku (10 mg/kg/den) pro reprodukční toxicitu byla přibližně 15krát vyšší než u lidí při MRHD.
Perorální podávání rizatriptanu (0, 5, 35 nebo 250 mg/kg/den) samcům potkanů před a během páření nevedlo k žádnému zhoršení fertility nebo reprodukční schopnosti. Plazmatická expozice (AUC) při nejvyšší testované dávce byla přibližně 550krát vyšší než u lidí při MRHD.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje o použití přípravku MAXALT u těhotných žen u lidí nejsou dostatečné pro vyvození závěrů o riziku závažných vrozených vad a potratu souvisejícím s užíváním léků.
Ve studiích na zvířatech byla pozorována vývojová toxicita po perorálním podání rizatriptanu během březosti (snížení tělesné hmotnosti plodu u potkanů) nebo během těhotenství a kojení (zvýšená úmrtnost, snížená tělesná hmotnost a neurobehaviorální poškození u potomků potkanů) při plazmatických expozicích matek vyšší než očekávané v terapeutických dávkách u lidí [viz Údaje o zvířatech ].
V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %. Hlášená míra závažných vrozených vad u porodů ženám s migrénou se pohybuje od 2,2 % do 2,9 % a hlášená míra potratů byla 17 %, což je podobné procento hlášené u žen bez migrény.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
U žen s migrénou existuje zvýšené riziko nepříznivých perinatálních následků u matky, včetně preeklampsie a gestační hypertenze.
Data
Lidská data
Registr těhotenství pro MAXALT neidentifikoval v období 1998 až 2018 žádný vzor vrozených anomálií nebo jiných nepříznivých porodních výsledků. Na nedostatek identifikace jakéhokoli vzoru je však třeba pohlížet opatrně, protože počet prospektivních hlášení s informacemi o výsledku byla nízká a neposkytovala dostatečnou sílu pro detekci zvýšeného rizika jednotlivých vrozených vad spojených s užíváním MAXALT. Kromě toho došlo k významné ztrátě sledování v prospektivních zprávách o těhotenství, což dále komplikuje hodnocení souvislosti mezi MAXALTem a jakýmkoliv vzorem vrozených anomálií nebo jiných nepříznivých porodních výsledků.
Ve studii využívající údaje ze švédského lékařského registru narození byly živě narozené ženy, které uvedly, že během těhotenství užívaly triptany nebo námel, srovnávány s těmi, které tak neučinily. Ze 157 porodů s expozicí rizatriptanu v prvním trimestru se 7 dětí narodilo s malformacemi (relativní riziko 1,01 [95% CI: 0,40 až 2,08]). Studie využívající propojená data z lékařského registru narození Norska s norskou databází preskripcí porovnávala výsledky těhotenství u žen, které si během těhotenství vyplatily recepty na triptany, a také u skupiny srovnávané s migrénou, která si vyplatila recepty na triptany pouze před těhotenstvím, ve srovnání s kontrolní skupina populace. Z 310 žen, které si během prvního trimestru vyplatily předpis na rizatriptan, mělo 10 kojence s velkými vrozenými malformacemi (OR 1,03 [95% CI: 0,55 až 1,93]), zatímco u 271 žen, které si vyplatily předpis na rizatriptan dříve, ale ne během , těhotenství, 12 mělo děti s velkými vrozenými malformacemi (OR 1,48 [95% CI: 0,83 až 2,64]), každé ve srovnání s populační srovnávací skupinou.
Údaje o zvířatech
Když byl rizatriptan (0, 2, 10 nebo 100 mg/kg/den) podáván perorálně březím potkanům během organogeneze, bylo při nejvyšších testovaných dávkách pozorováno snížení tělesné hmotnosti plodu. Při střední dávce (10 mg/kg/den), což byla dávka, která neovlivňovala nežádoucí účinky na embryofetální vývoj, byla plazmatická expozice (AUC) přibližně 15krát vyšší než u lidí při maximální doporučené dávce pro člověka (MRHD) 30 mg/den. Když byl rizatriptan (0, 5, 10 nebo 50 mg/kg/den) podáván orálně březím králíkům během organogeneze, nebyly pozorovány žádné nežádoucí účinky na plod. Plazmatická expozice (AUC) při nejvyšší testované dávce byla 115krát vyšší než u lidí při MRHD. U obou druhů byl prokázán placentární přenos léčiva na plod.
Perorální podávání rizatriptanu (0, 2, 10 nebo 100 mg/kg/den) samičkám potkanů před pářením a během páření a pokračující během březosti a laktace vedlo ke snížení tělesné hmotnosti u potomstva od narození a během laktace vůbec, ale nejnižší testovaná dávka (2 mg/kg/den). Plazmatická expozice (AUC) při dávce bez účinku (2 mg/kg/den) pro nepříznivé účinky na postnatální vývoj byla podobná jako u lidí při MRHD.
Perorální podávání rizatriptanu (0, 5, 100 nebo 250 mg/kg/den) během organogeneze a laktace vedlo k novorozenecké úmrtnosti, snížení tělesné hmotnosti (která přetrvávala až do dospělosti) a ke zhoršení neurobehaviorálních funkcí u potomků vůbec, kromě nejnižší dávky testováno. Plazmatická expozice (AUC) při dávce bez účinku na nežádoucí účinky na postnatální vývoj (5 mg/kg/den) byla přibližně 8krát vyšší než u lidí při MRHD.
Laktace
Shrnutí rizik
Neexistují žádné údaje o přítomnosti rizatriptanu nebo jakýchkoli aktivních metabolitů v mateřském mléce nebo o účincích rizatriptanu na kojené dítě nebo na produkci mléka.
Rizatriptan byl vylučován do mléka potkanů, přičemž hladiny v mléce byly přibližně 6krát vyšší než v mateřské plazmě.
Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky MAXALT nebo MAXALT-MLT a veškerými potenciálními nežádoucími účinky MAXALT nebo MAXALT-MLT na kojené dítě nebo základním onemocněním matky.
Data
Po perorálním podání rizatriptanu kojícím potkanům v dávce 100 mg/kg/den překročily koncentrace léčiva rizatriptanu ve vzorcích mléka plazmatické koncentrace léčiva u matky přibližně 6krát.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů mladších 6 let nebyla stanovena. Účinnost a bezpečnost přípravku MAXALT 5 mg v akutní léčbě migrény u pacientů ve věku 6 až 17 let byla stanovena v adekvátní a dobře kontrolované studii [viz Klinické studie ].
Výskyt nežádoucích účinků hlášených u pediatrických pacientů v akutní klinické studii byl podobný u pacientů, kteří dostávali MAXALT 5 mg, jako u pacientů, kteří dostávali placebo. Očekává se, že profil nežádoucích účinků u pediatrických pacientů bude podobný jako u dospělých.
Geriatrické použití
Klinické studie s MAXALTem 5 mg nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty.
Přestože farmakokinetika rizatriptanu byla podobná u starších osob (ve věku ≥ 65 let) au mladších dospělých (n=17), obecně by měla být volba dávky pro staršího pacienta opatrná, počínaje spodním koncem dávkovacího rozmezí. To odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné farmakoterapie.
Geriatričtí pacienti, kteří mají jiné kardiovaskulární rizikové faktory (např. diabetes, hypertenze, kouření, obezita, silná rodinná anamnéza ischemické choroby srdeční), by měli podstoupit kardiovaskulární vyšetření před podáním přípravku MAXALT (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pacienti s fenylketonurií
Tablety rozvolňující ústa obsahují fenylalanin (složka aspartamu). 5 mg a 10 mg tablety rozpadající se v ústech obsahují 1,1 mg a 2,1 mg fenylalaninu.
PŘEDÁVKOVAT
Během klinických studií u dospělých nebylo hlášeno žádné předávkování přípravkem MAXALT.
Někteří dospělí pacienti, kteří dostali 40 mg přípravku MAXALT 5 mg buď jednorázově nebo ve dvou dávkách s dvouhodinovým intervalem mezi dávkami, měli závratě a ospalost.
V klinické farmakologické studii, ve které 12 dospělých subjektů dostalo MAXALT 5 mg v celkové kumulativní dávce 80 mg (podané během čtyř hodin), se u dvou subjektů objevila synkopa, závratě, bradykardie včetně AV blokády třetího stupně, zvracení a/nebo inkontinence .
V dlouhodobé, otevřené studii zahrnující 606 léčených pediatrických migreniků ve věku 12 až 17 let (z nichž 432 bylo léčeno po dobu nejméně 12 měsíců), užívalo 151 pacientů (25 %) dvě 10mg dávky MAXALT-MLT během 24 hodin. Nežádoucí reakce u 3 z těchto pacientů zahrnovaly abdominální diskomfort, únavu a dušnost.
Navíc na základě farmakologie MAXALT 10 mg se může po předávkování objevit hypertenze nebo ischemie myokardu. U pacientů s podezřením na předávkování přípravkem MAXALT by měla být zvážena gastrointestinální dekontaminace (tj. výplach žaludku následovaný aktivním uhlím). Klinické a elektrokardiografické sledování by mělo pokračovat po dobu nejméně 12 hodin, i když nejsou pozorovány klinické příznaky.
Účinky hemo- nebo peritoneální dialýzy na sérové koncentrace rizatriptanu nejsou známy.
KONTRAINDIKACE
MAXALT 5 mg je kontraindikován u pacientů s:
- Ischemická choroba koronárních tepen (angina pectoris, anamnéza infarktu myokardu nebo dokumentovaná němá ischemie) nebo jiné významné základní kardiovaskulární onemocnění [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Vasospasmus koronárních tepen včetně Prinzmetalovy anginy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Historie cévní mozkové příhody nebo tranzitorní ischemické ataky (TIA) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Onemocnění periferních cév (PVD) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Ischemická choroba střev [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Nekontrolovaná hypertenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Nedávné použití (tj. do 24 hodin) jiného agonisty 5-HT1, léků obsahujících ergotamin nebo léků typu námel (jako je dihydroergotamin nebo methysergid) [viz DROGOVÉ INTERAKCE ].
- Hemiplegická nebo bazilární migréna [viz INDIKACE ].
- Současné podávání nebo nedávné vysazení (tj. během 2 týdnů) inhibitoru MAO-A [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
- Hypersenzitivita na rizatriptan nebo na kteroukoli pomocnou látku (pozorovaný angioedém a anafylaxe) (viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Rizatriptan se s vysokou afinitou váže na lidské klonované 5-HT1B/1D receptory. MAXALT 10 mg pravděpodobně uplatňuje své terapeutické účinky při léčbě migrenózních bolestí hlavy tím, že se váže na 5-HT1B/1D receptory umístěné na intrakraniálních krevních cévách a senzorických nervech trojklaného nervu.
Farmakokinetika
Vstřebávání
Rizatriptan je po perorálním podání zcela absorbován. Průměrná absolutní biologická dostupnost přípravku MAXALT 10 mg tableta po perorálním podání je asi 45 % a průměrných maximálních plazmatických koncentrací (Cmax) je dosaženo přibližně za 1-1,5 hodiny (Tmax). Nezdálo se, že by přítomnost migrenózní bolesti hlavy ovlivnila absorpci nebo farmakokinetiku rizatriptanu. Jídlo nemá žádný významný vliv na biologickou dostupnost rizatriptanu, ale zpožďuje dobu dosažení maximální koncentrace o hodinu. V klinických studiích byl MAXALT 10 mg podáván bez ohledu na jídlo.
Biologická dostupnost a Cmax rizatriptanu byly po podání tablet MAXALT a perorálně se rozpadajících tablet MAXALT-MLT podobné, ale rychlost absorpce je u přípravku MAXALT-MLT poněkud pomalejší, s Tmax zpožděným až o 0,7 hodiny. AUC rizatriptanu je přibližně o 30 % vyšší u žen než u mužů. Při opakovaném podávání nedošlo k žádné akumulaci.
Rozdělení
Průměrný distribuční objem je přibližně 140 litrů u mužů a 110 litrů u žen. Rizatriptan se minimálně (14 %) váže na plazmatické proteiny.
Metabolismus
Primární cestou metabolismu rizatriptanu je oxidativní deaminace monoaminooxidázou-A (MAO-A) na metabolit kyseliny indoloctové, který není aktivní na receptoru 5-HT1B/1D. N-monodesmethyl-rizatriptan, metabolit s aktivitou podobnou aktivitě mateřské sloučeniny na 5-HT1B/1D receptoru, se tvoří v menší míře. Plazmatické koncentrace N-monodesmethyl-rizatriptanu jsou přibližně 14 % koncentrací původní sloučeniny a je eliminován podobnou rychlostí. Jiné minoritní metabolity, N-oxid, 6-hydroxysloučenina a sulfátový konjugát 6-hydroxymetabolitu, nejsou na 5-HT1B/1D receptoru aktivní.
Odstranění
Celková radioaktivita podané dávky zjištěná během 120 hodin v moči a stolici byla 82 % a 12 %, v daném pořadí, po jednorázovém 10 mg perorálním podání 14C-rizatriptanu. Po perorálním podání 14C-rizatriptanu představoval rizatriptan asi 17 % cirkulující plazmatické radioaktivity. Přibližně 14 % perorální dávky se vylučuje močí jako nezměněný rizatriptan, zatímco 51 % se vylučuje jako metabolit kyseliny indoloctové, což ukazuje na podstatný metabolismus prvního průchodu játry.
Plazmatický poločas rizatriptanu u mužů a žen je v průměru 2-3 hodiny.
Izoformy cytochromu P450
Rizatriptan není inhibitorem aktivit izoforem 3A4/5, 1A2, 2C9, 2C19 nebo 2E1 lidského jaterního cytochromu P450; rizatriptan je kompetitivní inhibitor (Ki=1400 nM) cytochromu P450 2D6, ale pouze ve vysokých, klinicky irelevantních koncentracích.
Zvláštní populace
Geriatrický
Farmakokinetika rizatriptanu u zdravých starších dobrovolníků bez migrény (ve věku 65-77 let) byla podobná jako u mladších dobrovolníků bez migrény (věk 18-45 let).
Pediatrická
Farmakokinetika rizatriptanu byla stanovena u pediatrických migreniků ve věku 6 až 17 let. Expozice po podání jedné dávky 5 mg MAXALT-MLT pediatrickým pacientům s hmotností 20-39 kg (44-87 lb) nebo 10 mg MAXALT-MLT pediatrickým pacientům s hmotností ≥ 40 kg (88 lb) byly podobné těm, které byly pozorovány po jednorázové dávce podání 10 mg MAXALT-MLT dospělým.
Rod
Průměrné AUC0-∞ a Cmax rizatriptanu (10 mg perorálně) byly přibližně o 30 % a 11 % vyšší u žen ve srovnání s muži, zatímco Tmax se vyskytoval přibližně ve stejnou dobu.
Poškození jater
Po perorálním podání pacientům s poruchou funkce jater způsobenou mírnou až středně těžkou alkoholickou cirhózou jater byly plazmatické koncentrace rizatriptanu podobné u pacientů s mírnou jaterní insuficiencí ve srovnání s kontrolní skupinou subjektů s normální funkcí jater; plazmatické koncentrace rizatriptanu byly přibližně o 30 % vyšší u pacientů se středně těžkou jaterní insuficiencí.
Renální poškození
U pacientů s poruchou funkce ledvin (clearance kreatininu 10-60 ml/min/1,73 m2) se AUC0-∞ rizatriptanu významně nelišila od AUC0-∞ jedinců s normální funkcí ledvin. U hemodialyzovaných pacientů (clearance kreatininu
Závod
Farmakokinetická data neodhalila žádné významné rozdíly mezi africkými Američany a bělochy.
Lékové interakce
[Viz také DROGOVÉ INTERAKCE ]
Inhibitory monoaminoxidázy
Rizatriptan je metabolizován hlavně prostřednictvím monoaminooxidázy, podtypu „A“ (MAO-A). Plazmatické koncentrace rizatriptanu mohou být zvýšeny léky, které jsou selektivními inhibitory MAO-A (např. moklobemid) nebo neselektivními inhibitory MAO [typ A a B] (např. isokarboxazid, fenelzin, tranylcypromin a pargylin). Ve studii lékových interakcí, kdy byl MAXALT 10 mg podáván subjektům (n=12), kteří dostávali souběžnou léčbu selektivním, reverzibilním inhibitorem MAO-A, moklobemidem 150 mg třikrát denně, došlo k průměrnému zvýšení AUC a Cmax rizatriptanu o 119 % a 41 %, v uvedeném pořadí; a AUC aktivního N-monodesmethyl metabolitu rizatriptanu byla zvýšena o více než 400 %. Lze očekávat, že interakce bude větší u ireverzibilních inhibitorů MAO. U pacientů užívajících selektivní inhibitory MAO-B se neočekává žádná farmakokinetická interakce [viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
Propranolol
Ve studii současného podávání propranololu 240 mg/den a jednorázové dávky rizatriptanu 10 mg u zdravých dospělých subjektů (n=11) byla průměrná plazmatická AUC rizatriptanu během podávání propranololu zvýšena o 70 % a čtyřnásobné zvýšení byl pozorován u jednoho subjektu. AUC aktivního N-monodesmethyl metabolitu rizatriptanu nebyla ovlivněna propranololem (viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
nadolol/metoprolol
Ve studii lékových interakcí byly u zdravých subjektů hodnoceny účinky opakovaných dávek nadololu 80 mg nebo metoprololu 100 mg každých 12 hodin na farmakokinetiku jednorázové dávky 10 mg rizatriptanu (n=12). Nebyly pozorovány žádné farmakokinetické interakce.
paroxetin
Ve studii interakce mezi selektivním inhibitorem zpětného vychytávání serotoninu (SSRI) paroxetinem 20 mg/den po dobu dvou týdnů a jednorázovou dávkou MAXALT 10 mg u zdravých subjektů (n=12) nebyly zjištěny plazmatické koncentrace rizatriptanu ani jeho bezpečnostní profil byli ovlivněni paroxetinem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a INFORMACE PRO PACIENTA ].
Orální antikoncepce
Ve studii současného podávání perorální antikoncepce během 6 dnů podávání MAXALTu (10-30 mg/den) zdravým dobrovolnicím (n=18) neovlivnil rizatriptan plazmatické koncentrace ethinylestradiolu nebo norethindronu.
Klinické studie
Dospělí
Účinnost přípravku MAXALT 5 mg tablety byla stanovena ve čtyřech multicentrických, randomizovaných, placebem kontrolovaných studiích. Pacienti zařazení do těchto studií byli primárně ženy (84 %) a bělochy (88 %) s průměrným věkem 40 let (rozmezí 18 až 71). Pacienti byli poučeni, aby léčili středně těžkou až silnou bolest hlavy. Odpověď na bolest hlavy, definovaná jako snížení střední nebo silné bolesti hlavy na žádnou nebo mírnou bolest hlavy, byla hodnocena po dobu až 2 hodin (studie 1) nebo až 4 hodiny po podání dávky (studie 2, 3 a 4). Byly hodnoceny související příznaky nauzey, fotofobie a fonofobie a udržení odpovědi až 24 hodin po dávce. Druhá dávka přípravku MAXALT 10 mg tablety byla povolena 2 až 24 hodin po podání pro léčbu recidivující bolesti hlavy ve studiích 1 a 2. Další analgetika a/nebo antiemetika byla povolena 2 hodiny po počáteční léčbě pro záchranu ve všech čtyřech studiích.
Ve všech studiích bylo procento pacientů, kteří dosáhli odpovědi na bolest hlavy 2 hodiny po léčbě, významně vyšší u pacientů, kteří dostávali buď MAXALT 5 nebo 10 mg, ve srovnání s těmi, kteří dostávali placebo. V samostatné studii se dávky 2,5 mg nelišily od placeba. Dávky vyšší než 10 mg byly spojeny se zvýšeným výskytem nežádoucích účinků. Výsledky ze čtyř kontrolovaných studií jsou shrnuty v tabulce 2.
Srovnání účinnosti léků na základě výsledků získaných v různých klinických studiích nemusí být spolehlivé. Vzhledem k tomu, že studie jsou prováděny v různých časech, s různými vzorky pacientů, různými zkoušejícími, používající různá kritéria a/nebo různé interpretace stejných kritérií, za různých podmínek (dávka, dávkovací režim atd.), kvantitativní odhady léčebné odpovědi a lze očekávat, že načasování odezvy se bude v jednotlivých studiích značně lišit.
Odhadovaná pravděpodobnost dosažení počáteční odpovědi na bolest hlavy do 2 hodin po léčbě ve sdružených studiích 1, 2, 3 a 4 je znázorněna na obrázku 1.
Obrázek 1: Odhadovaná pravděpodobnost dosažení počáteční reakce na bolest hlavy za 2 hodiny ve sdružených studiích 1, 2, 3 a 4* 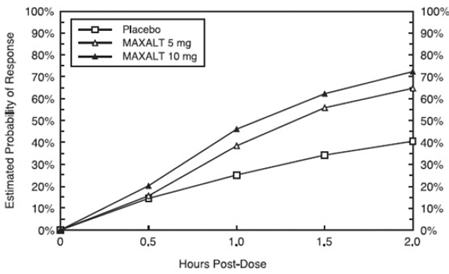
U pacientů s fotofobií, fonofobií a nauzeou spojenou s migrénou na začátku léčby byl po podání přípravku MAXALT ve srovnání s placebem snížený výskyt těchto příznaků.
Dvě až 24 hodin po počáteční dávce studované léčby bylo pacientům umožněno použít další léčbu pro odpověď na bolest ve formě druhé dávky studované léčby nebo jiné medikace. Odhadovaná pravděpodobnost, že pacienti užívají druhou dávku nebo jinou medikaci na migrénu během 24 hodin po počáteční dávce studijní léčby, je shrnuta na obrázku 2.
Obrázek 2: Odhadovaná pravděpodobnost, že pacienti užívají druhou dávku MAXALT 10mg tablet nebo jiného léku na migrénu během 24 hodin po úvodní dávce studijní léčby ve sdružených studiích 1, 2, 3 a 4* 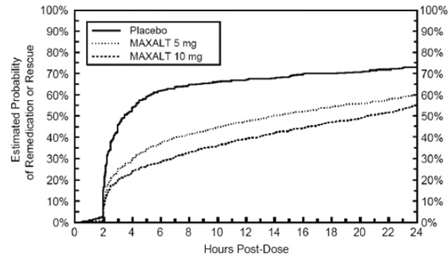
Účinnost nebyla ovlivněna přítomností aury; podle pohlaví nebo věku pacienta; nebo současným užíváním běžných profylaktických léků na migrénu (např. betablokátory, blokátory kalciových kanálů, tricyklická antidepresiva) nebo perorální antikoncepce. Ve dvou dalších podobných studiích nebyla účinnost ovlivněna vztahem k menstruaci. K posouzení dopadu rasy na účinnost nebyly k dispozici dostatečné údaje.
MAXALT-MLT orálně se rozpadající tablety
Účinnost MAXALT-MLT byla stanovena ve dvou multicentrických, randomizovaných, placebem kontrolovaných studiích, které byly podobného designu jako studie MAXALT Tablets (studie 5 a 6). Pacienti byli poučeni, aby léčili středně těžkou až silnou bolest hlavy. Pacienti léčení v těchto studiích byli primárně ženy (88 %) a bělochy (95 %) s průměrným věkem 42 let (rozmezí 18–72).
obou studiích bylo procento pacientů, kteří dosáhli odpovědi na bolest hlavy 2 hodiny po léčbě, významně vyšší u pacientů, kteří dostávali buď MAXALT-MLT 5 nebo 10 mg, ve srovnání s těmi, kteří dostávali placebo. Výsledky ze studií 5 a 6 jsou shrnuty v tabulce 3.
Odhadovaná pravděpodobnost dosažení počáteční odpovědi na bolest hlavy do 2 hodin po léčbě MAXALT-MLT ve sdružených studiích 5 a 6 je znázorněna na obrázku 3.
Obrázek 3: Odhadovaná pravděpodobnost dosažení počáteční reakce na bolest hlavy pomocí MAXALT-MLT za 2 hodiny ve sdružených studiích 5 a 6* 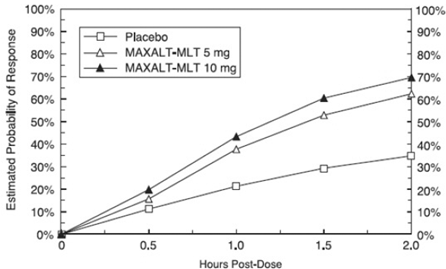
U pacientů s fotofobií a fonofobií spojenou s migrénou na počátku léčby byl po podání MAXALT-MLT ve srovnání s placebem snížený výskyt těchto příznaků.
Dvě až 24 hodin po počáteční dávce studované léčby bylo pacientům umožněno použít další léčbu pro odpověď na bolest ve formě druhé dávky studované léčby nebo jiné medikace. Odhadovaná pravděpodobnost, že pacienti užívají druhou dávku nebo jinou medikaci na migrénu během 24 hodin po počáteční dávce studijní léčby, je shrnuta na obrázku 4.
Obrázek 4: Odhadovaná pravděpodobnost pacientů užívajících druhou dávku MAXALT-MLT nebo jiného léku na migrénu během 24 hodin po úvodní dávce studijní léčby ve sdružených studiích 5 a 6* 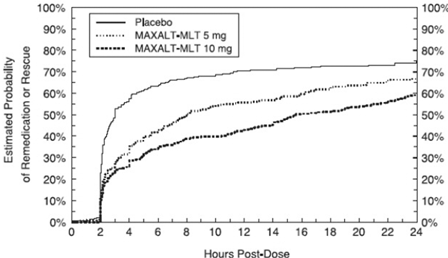
Pediatričtí pacienti ve věku 6 až 17 let
Účinnost MAXALT-MLT u pediatrických pacientů ve věku 6 až 17 let byla hodnocena v multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické studii s paralelními skupinami (studie 7). Pacienti museli mít alespoň 6měsíční anamnézu záchvatů migrény (s aurou nebo bez aury), které obvykle trvaly 3 hodiny nebo déle (pokud nebyly léčeny). Populace pacientů historicky nereagovala na léčbu NSAID a acetaminofenem.
Pacienti byli instruováni k léčbě jednoho záchvatu migrény s bolestí hlavy střední až silné intenzity. Léčebná fáze studie měla dvě fáze. Stádium 1 bylo použito k identifikaci pacientů nereagujících na placebo, kteří poté vstoupili do fáze 2, ve které byli pacienti randomizováni k MAXALT-MLT nebo placebu. Při použití strategie dávkování založené na hmotnosti dostávali pacienti s hmotností 20 kg až
Průměrný věk zkoumané populace pacientů byl 13 let. Šedesát jedna procent pacientů byli běloši a 56 procent pacientů byly ženy. Procento pacientů, kteří dosáhli primárního cílového bodu účinnosti bez bolesti hlavy 2 hodiny po léčbě, bylo významně vyšší u pacientů, kteří dostávali MAXALT-MLT, ve srovnání s těmi, kteří dostávali placebo (33 % vs. 24 %). Výsledky studie 7 jsou shrnuty v tabulce 4.
Pozorované procento pediatrických pacientů, kteří nedosáhli žádné bolesti hlavy do 2 hodin po počáteční léčbě přípravkem MAXALT-MLT, je znázorněno na obrázku 5.
Obrázek 5: Pozorované procento pacientů, kteří nehlásili žádnou bolest hlavy do 2 hodin po dávce ve studii 7 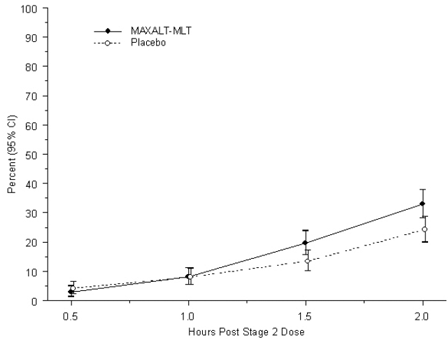
Prevalence explorativních koncových bodů absence příznaků spojených s migrénou (nauzea, fotofobie a fonofobie) 2 hodiny po užití dávky se statisticky významně nelišila mezi pacienty, kteří dostávali MAXALT-MLT, a těmi, kteří dostávali placebo.
INFORMACE PRO PACIENTA
MAXALT® (max-awlt)
MAXALT-MLT® (rizatriptan benzoát) tablety a orálně se rozpadající tablety
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat MAXALT® a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo vaší léčbě.
Pokud není uvedeno jinak, informace v této příbalové informaci se vztahují jak na tablety MAXALT 10 mg, tak na tablety MAXALT-MLT®, které se rozpadají v ústech.
Co je MAXALT?
MAXALT je lék na předpis, který patří do třídy léků nazývaných Triptany. MAXALT je dostupný jako tradiční tableta (MAXALT) a jako perorálně se rozpadající tableta (MAXALT-MLT).
MAXALT 5 mg a MAXALT-MLT se používají k léčbě záchvatů migrény s aurou nebo bez aury u dospělých au dětí ve věku 6 až 17 let.
MAXALT 5 mg se nemá používat k prevenci záchvatů migrény.
MAXALT není určen k léčbě hemiplegických nebo bazilárních migrén.
Není známo, zda je MAXALT bezpečný a účinný při léčbě klastrových bolestí hlavy.
Není známo, zda je užívání více než 1 dávky MAXALTu během 24 hodin bezpečné a účinné u dětí ve věku 6 až 17 let.
Není známo, zda je MAXALT bezpečný a účinný u dětí mladších 6 let.
Kdo by neměl užívat MAXALT?
Neužívejte MAXALT, jestliže:
- máte nebo jste měli srdeční problémy
- máte nebo jste měli mrtvici nebo tranzitorní ischemickou ataku (TIA)
- máte nebo jste měl(a) problémy s krevními cévami včetně ischemické choroby střev
- máte nekontrolovaný vysoký krevní tlak
- jste v posledních 24 hodinách užil(a) jiné léky Triptan
- během posledních 24 hodin užili léky obsahující námel
- trpíte hemiplegickou nebo bazilární migrénou
- užívat inhibitor monoaminooxidázy (MAO) nebo jste v posledních 2 týdnech užíval inhibitor MAO
- jste alergický(á) na rizatriptan-benzoát nebo na kteroukoli další složku přípravku MAXALT. Úplný seznam složek přípravku MAXALT naleznete na konci této příbalové informace.
Před užitím tohoto léku se poraďte se svým lékařem, pokud máte některý z výše uvedených stavů nebo si nejste jistý(á), zda některý z těchto léků užíváte.
Co mám říci svému lékaři, než začnu užívat MAXALT?
Než začnete MAXALT užívat, informujte svého lékaře, pokud:
- máte nebo jste měl(a) problémy se srdcem, vysoký krevní tlak, bolest na hrudi nebo dušnost
- máte nějaké rizikové faktory pro srdeční problémy nebo problémy s krevními cévami, jako jsou:
- vysoký krevní tlak
- vysoký cholesterol
- kouření
- obezita
- cukrovka
- rodinná anamnéza srdečních problémů
- jste po menopauze
- jste muž starší 40 let
- trpíte fenylketonurií (PKU). MAXALT-MLT tablety rozpadající se v ústech obsahují fenylalanin.
- máte problémy s ledvinami nebo játry
- mít jakýkoli jiný zdravotní stav
- jste těhotná nebo plánujete otěhotnět. Není známo, zda MAXALT poškodí vaše nenarozené dítě. Pokud otěhotníte během užívání přípravku MAXALT 5 mg, poraďte se se svým poskytovatelem zdravotní péče.
- kojíte nebo plánujete kojit. Není známo, zda MAXALT 10 mg přechází do mateřského mléka. Pokud užíváte MAXALT, poraďte se se svým lékařem o nejlepším způsobu výživy svého dítěte.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků.
MAXALT 10 mg a jiné léky se mohou vzájemně ovlivňovat a způsobit nežádoucí účinky. MAXALT může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku MAXALT 5 mg.
Zejména informujte svého lékaře, pokud užíváte:
- léky obsahující propranolol, jako je Inderal®, Inderal® LA nebo Innopran® XL
- léky používané k léčbě poruch nálady, včetně selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) nebo inhibitorů zpětného vychytávání serotoninu a noradrenalinu (SNRI).
Pokud si nejste jistý(á), požádejte svého lékaře nebo lékárníka o seznam těchto léků.
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému lékaři a lékárníkovi, když dostanete nový lék.
Jak mám užívat MAXALT?
- Užívejte MAXALT přesně podle pokynů svého lékaře.
- Váš lékař Vám řekne, jaké množství MAXALT 5 mg máte užívat a kdy jej máte užívat.
- Jak užívat MAXALT-MLT:
- Tablety MAXALT-MLT, které se rozpadají v ústech, ponechejte v přiloženém balení, dokud nebudete připraveni je užít. Až budete připraveni si to vzít:
- Vyjměte blistr z fóliového sáčku. Neprotlačujte tabletu MAXALT-MLT rozpadající se v ústech blistrem.
- Suchýma rukama odloupněte blistr a položte si tabletu MAXALT-MLT, která se rozkládá v ústech, na jazyk. Tableta se rozpustí a spolkne se slinami. K požití tablety rozpadající se v ústech není potřeba žádná tekutina.
- Tablety MAXALT-MLT, které se rozpadají v ústech, ponechejte v přiloženém balení, dokud nebudete připraveni je užít. Až budete připraveni si to vzít:
- Pokud se vaše bolest hlavy vrátí po první dávce MAXALT 10 mg:
- Pro dospělé: druhá dávka může být podána 2 hodiny po první dávce. Neužívejte více než 30 mg MAXALTu během 24 hodin (například neužívejte více než 3 10mg tablety během 24 hodin).
- Pro děti ve věku 6 až 17 let: Není známo, zda je užívání více než 1 dávky přípravku MAXALT 5 mg během 24 hodin bezpečné a účinné. Poraďte se se svým lékařem o tom, co dělat, pokud vaše bolest hlavy nezmizí nebo se vrátí.
- Jestliže jste užil(a) příliš mnoho přípravku MAXALT 5 mg, zavolejte svého lékaře nebo jděte ihned na pohotovost v nejbližší nemocnici.
Čemu se mám při užívání MAXALTu vyhnout?
MAXALT 5 mg může způsobit závratě, slabost nebo mdloby. Pokud máte tyto příznaky, neřiďte auto, neobsluhujte stroje ani nedělejte nic, co vyžaduje, abyste byli ve střehu.
Jaké jsou možné vedlejší účinky přípravku MAXALT 5 mg?
MAXALT 5 mg může způsobit závažné nežádoucí účinky. Zavolejte svého lékaře nebo jděte na pohotovost do nejbližší nemocnice, pokud si myslíte, že máte některý ze závažných nežádoucích účinků přípravku MAXALT, včetně:
- infarkt. Příznaky srdečního infarktu mohou zahrnovat:
- nepohodlí na hrudi ve středu hrudníku, které trvá déle než několik minut nebo které odezní a vrátí se
- nepohodlí na hrudi, které pociťuje jako nepříjemný tlak, svírání, plnost nebo bolest
- bolest nebo nepohodlí v pažích, zádech, krku, čelisti nebo žaludku
- dušnost s nebo bez hrudníku
- polije studený pot
- nevolnost nebo zvracení
- pocit točení hlavy
- mrtvice. Příznaky mrtvice mohou zahrnovat následující náhlé příznaky:
- necitlivost nebo slabost v obličeji, paži nebo noze, zejména na jedné straně těla
- zmatenost, problémy s mluvením nebo porozuměním
- problémy se viděním na jedno nebo obě oči
- problémy s chůzí, závratě, ztráta rovnováhy nebo koordinace
- silná bolest hlavy bez známé příčiny
- problémy s krevními cévami. Příznaky problémů s krevními cévami mohou zahrnovat:
- bolest břicha
- krvavý průjem
- problémy se zrakem
- chlad a necitlivost rukou a nohou
- serotoninový syndrom. Stav nazývaný serotoninový syndrom se může objevit, když se léky Triptan, jako je MAXALT, užívají s některými jinými léky. Příznaky serotoninového syndromu mohou zahrnovat:
- míchání
- halucinace
- kóma
- rychlý srdeční tep
- rychlé změny vašeho krevního tlaku
- zvýšená tělesná teplota
- svalový spasmus
- ztráta koordinace
- nevolnost, zvracení nebo průjem
- zvýšený krevní tlak.
Mezi nejčastější nežádoucí účinky přípravku MAXALT u dospělých patří:
- pocit ospalosti nebo únavy
- bolest nebo tlak na hrudi nebo v krku
- závrať
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Pokud užíváte MAXALT 10 mg příliš často, může to mít za následek chronické bolesti hlavy. V takových případech byste měli kontaktovat svého lékaře, protože možná budete muset přestat užívat MAXALT.
Toto nejsou všechny možné vedlejší účinky přípravku MAXALT. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA1088.
Jak mám MAXALT uchovávat?
- Uchovávejte MAXALT při pokojové teplotě mezi 59 °F až 86 °F (15 °C až 30 °C).
- Léky, které jsou zastaralé nebo již nepotřebné, bezpečně vyhoďte.
Uchovávejte MAXALT 10 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání přípravku MAXALT.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte MAXALT pro stav, pro který nebyl předepsán. Nepodávejte MAXALT jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o přípravku MAXALT. Pokud byste chtěli více informací, poraďte se se svým lékařem. Můžete požádat svého lékárníka nebo lékaře o informace o přípravku MAXALT, které jsou určeny pro zdravotníky.
Pro více informací přejděte na www.maxalt.com.
Jaké složky obsahuje MAXALT?
Účinná látka v MAXALT 10 mg a MAXALT-MLT perorálně se rozpadajících tabletách:
rizatriptan benzoát.
Neaktivní složky v MAXALT: monohydrát laktózy, mikrokrystalická celulóza, předbobtnalý škrob, oxid železitý (červený) a magnesium-stearát.
Neaktivní složky v perorálně se rozpadajících tabletách MAXALT-MLT: želatina, mannitol, glycin, aspartam a mátová příchuť.
MAXALT-MLT orálně se rozpadající tablety obsahují aspartam, zdroj fenylalaninu.
Fenylketonurika:
MAXALT-MLT perorálně se rozpadající tablety 5 mg obsahují 1,1 mg fenylalaninu. MAXALT-MLT perorálně se rozpadající tablety 10 mg obsahují 2,1 mg fenylalaninu.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
