Naprelan 250mg, 500mg Naproxen Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Naprelan a jak se používá?
Naprelan je lék na předpis používaný k léčbě příznaků revmatoidní artritidy, osteoartritidy, ankylosinové spondylitidy, dysmenorey, akutní dny a bolesti. Naprelan lze užívat samostatně nebo s jinými léky.
Naprelan patří do třídy léků nazývaných NSAID.
Není známo, zda je přípravek Naprelan 250 mg bezpečný a účinný u dětí mladších 2 let.
Jaké jsou možné nežádoucí účinky přípravku Naprelan 500 mg?
Naprelan může způsobit závažné nežádoucí účinky včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- snadná tvorba modřin nebo krvácení,
- obtížné nebo bolestivé polykání,
- zvonění v uších,
- změny nálady,
- změny v množství moči,
- nevysvětlitelný ztuhlý krk,
- změny vidění,
- otoky kotníků a nohou,
- neobvyklá únava,
- neobvyklé a náhlé zvýšení hmotnosti,
- tmavá moč,
- přetrvávající nevolnost nebo zvracení,
- ztráta chuti k jídlu,
- bolest břicha,
- zežloutnutí očí nebo kůže (žloutenka) a
- těžké závratě
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Naprelan patří:
- žaludeční nevolnost,
- nevolnost,
- pálení žáhy,
- bolest hlavy,
- zvýšený krevní tlak
- ospalost a
- závrať
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Naprelan. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
RIZIKO VÁŽNÝCH KARDIOVASKULÁRNÍCH A GASTROINTESTINÁLNÍCH PŘÍHOD
Kardiovaskulární trombotické příhody
- Nesteroidní protizánětlivé léky (NSAID) způsobují zvýšené riziko závažných kardiovaskulárních trombotických příhod, včetně infarktu myokardu a mrtvice, které mohou být fatální. Toto riziko se může objevit na začátku léčby a může se zvyšovat s délkou užívání (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
- NAPRELAN je kontraindikován při operaci koronárního arteriálního bypassu (CABG) (viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Gastrointestinální krvácení, ulcerace a perforace
- NSAID způsobují zvýšené riziko závažných gastrointestinálních (GI) nežádoucích příhod včetně krvácení, ulcerace a perforace žaludku nebo střev, které mohou být fatální. Tyto události se mohou objevit kdykoli během používání a bez varovných příznaků. Starší pacienti a pacienti s předchozí anamnézou peptického vředu a/nebo GI krvácení jsou vystaveni většímu riziku závažných GI příhod (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
POPIS
NAPRELAN (naproxen sodný) tablety s řízeným uvolňováním jsou nesteroidní protizánětlivé léky dostupné jako tablety s řízeným uvolňováním v síle 375 mg, 500 mg a 750 mg pro perorální podání. Chemický název je kyselina 2-naftalenoctová, 6-methoxy-α-methyl-sodná sůl, (S)-. Molekulová hmotnost je 252,24. Jeho molekulový vzorec je C14H13NaO3 a má následující chemickou strukturu.
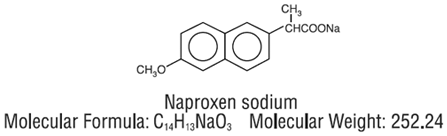
Naproxen sodný je krystalický prášek bez zápachu, bílé až krémové barvy. Je rozpustný v methanolu a vodě. NAPRELAN 250 mg tablety obsahují 412,5 mg, 550 mg nebo 825 mg sodné soli naproxenu, což odpovídá 375 mg, 500 mg a 750 mg naproxenu a 37,5 mg, 50 mg a 75 mg sodíku. Každá tableta NAPRELAN 250 mg také obsahuje následující neaktivní složky: amoniomethakrylátový kopolymer typu A, amoniomethakrylátový kopolymer typu B, kyselina citrónová, krospovidon, magnesium-stearát, kopolymer kyseliny methakrylové typu A, mikrokrystalická celulóza, povidon a mastek. Potah tablety obsahuje hydroxypropylmethylcelulózu, polyethylenglykol a oxid titaničitý.
INDIKACE
NAPRELAN 250 mg tablety je indikován k léčbě:
- revmatoidní artritida (RA)
- osteoartróza (OA)
- ankylozující spondylitida (AS)
- tendinitida, burzitida
- akutní dna
- primární dysmenorea (PD)
- úleva od mírné až střední bolesti
 [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Všeobecné pokyny pro dávkování
Než se rozhodnete NAPRELAN užívat, pečlivě zvažte potenciální přínosy a rizika NAPRELANU a dalších možností léčby. Použijte nejnižší účinnou dávku po co nejkratší dobu v souladu s individuálními cíli léčby pacienta [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Po pozorování odpovědi na úvodní léčbu přípravkem NAPRELAN by měla být dávka a frekvence upravena tak, aby vyhovovala individuálním potřebám pacienta.
Revmatoidní artritida, osteoartritida a ankylozující spondylitida
Doporučená počáteční dávka přípravku NAPRELAN tablety u dospělých jsou dvě tablety NAPRELAN 375 mg (750 mg) jednou denně, jedna tableta NAPRELAN 750 mg (750 mg) jednou denně nebo dvě tablety NAPRELAN 500 mg (1 000 mg) jednou denně. U pacientů, kteří již užívají naproxen 250 mg, 375 mg nebo 500 mg dvakrát denně (ráno a večer), může být jejich celková denní dávka nahrazena přípravkem NAPRELAN 500 mg tablety v jedné denní dávce.
Během dlouhodobého podávání může být dávka přípravku NAPRELAN 250 mg tablety upravena nahoru nebo dolů v závislosti na klinické odpovědi pacienta. U pacientů, kteří dobře snášejí nižší dávky přípravku NAPRELAN tablety, může být dávka zvýšena na dvě tablety NAPRELAN 750 mg (1 500 mg) nebo tři tablety NAPRELAN 500 mg (1 500 mg) jednou denně po omezenou dobu, pokud je vyšší hladina protizánětlivých /je nutná analgetická aktivita. Při léčbě pacientů, zejména při vyšších dávkách, by měl lékař pozorovat dostatečně zvýšený klinický přínos, aby vyrovnal potenciální zvýšené riziko [viz KLINICKÁ FARMAKOLOGIE ]. U každého pacienta by měla být vyhledána a použita nejnižší účinná dávka. Symptomatické zlepšení artritidy obvykle začíná během jednoho týdne; k dosažení terapeutického přínosu však může být vyžadována léčba po dobu dvou týdnů.
Léčba bolesti, primární dysmenorey a akutní tendinitidy a burzitidy
Doporučená počáteční dávka jsou dvě tablety NAPRELAN 500 mg (1 000 mg) jednou denně. U pacientů vyžadujících větší analgetický přínos lze po omezenou dobu užívat dvě tablety NAPRELAN 750 mg (1 500 mg) nebo tři tablety NAPRELAN 500 mg (1 500 mg). Poté by celková denní dávka neměla překročit dvě tablety NAPRELAN 500 mg (1 000 mg).
Akutní dna
Doporučená dávka první den jsou dvě až tři tablety NAPRELAN 500 mg (1 000 až 1 500 mg) jednou denně, poté dvě tablety NAPRELAN 500 mg (1 000 mg) jednou denně, dokud záchvat neodezní.
Úprava dávkování u pacientů s poruchou funkce jater
U pacientů s poruchou funkce ledvin nebo jater nebo u starších pacientů je třeba zvážit nižší dávku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Studie naznačují, že ačkoli se celková plazmatická koncentrace naproxenu nemění, nenavázaná plazmatická frakce naproxenu je u starších osob zvýšena. Pokud jsou vyžadovány vysoké dávky, doporučuje se opatrnost a u starších pacientů může být nutná určitá úprava dávkování. Stejně jako u jiných léků používaných u starších pacientů je rozumné používat nejnižší účinnou dávku.
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety s řízeným uvolňováním NAPRELAN (naproxen sodný) jsou dostupné následovně:
- NAPRELAN 375: bílá tableta ve tvaru tobolky s „N“ na jedné straně a „375“ na druhé straně. Jedna tableta obsahuje naproxen sodný 412,5 mg, což odpovídá 375 mg naproxenu.
- NAPRELAN 500: bílá tableta ve tvaru tobolky s „N“ na jedné straně a „500“ na druhé straně. Jedna tableta obsahuje naproxen sodný 550 mg, což odpovídá 500 mg naproxenu.
- NAPRELAN 750: bílá tableta ve tvaru tobolky s „N“ na jedné straně a „750“ na druhé straně. Jedna tableta obsahuje naproxen sodný 825 mg, což odpovídá 750 mg naproxenu.
Skladování A Manipulace
NAPRELAN (naproxen sodný) 375 mg, 500 mg a 750 mg jsou tablety s řízeným uvolňováním dodávané jako:
NAPRELAN 375 : bílá tableta ve tvaru tobolky s „N“ na jedné straně a „375“ na druhé straně; v lahvích po 100; NDC 52427-272-01. Jedna tableta obsahuje naproxen sodný 412,5 mg, což odpovídá 375 mg naproxenu.
NAPRELAN 500 : bílá tableta ve tvaru tobolky s „N“ na jedné straně a „500“ na druhé straně; v lahvích po 75; NDC 52427-273-75. Jedna tableta obsahuje naproxen sodný 550 mg, což odpovídá 500 mg naproxenu.
NAPRELAN 750 : bílá tableta ve tvaru tobolky s „N“ na jedné straně a „750“ na druhé straně; v lahvích po 30; NDC 52427-274-30. Jedna tableta obsahuje naproxen sodný 825 mg, což odpovídá 750 mg naproxenu.
Úložný prostor
Skladujte při pokojové teplotě, 20° až 25°C (68° až 77°F), povoleny výkyvy 15° až 30°C (59° až 86°F) [viz USP Controlled Room Temperature]. LÉKÁRNICE: Dávkujte v dobře uzavřené nádobě.
Distribuce: Almatica Pharma, Inc. Morristown, NJ 07960 USA. Upraveno: duben 2021
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Kardiovaskulární trombotické příhody [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- GI krvácení, ulcerace a perforace [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypertenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Srdeční selhání a edém [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Renální toxicita a hyperkalémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Anafylaktické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hematologická toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Jako u všech léků této třídy závisí frekvence a závažnost nežádoucích účinků na několika faktorech: na dávce léku a délce léčby; věk, pohlaví, fyzický stav pacienta; jakékoli souběžné lékařské diagnózy nebo jednotlivé rizikové faktory. Následující nežádoucí účinky jsou rozděleny do tří částí na základě frekvence a toho, zda existuje možnost příčinné souvislosti mezi užíváním léku a těmito nežádoucími účinky. V těch reakcích uvedených jako „Pravděpodobná příčinná souvislost“ existuje alespoň jeden případ pro každou nežádoucí reakci, kde existují důkazy naznačující, že existuje příčinná souvislost mezi užíváním drogy a hlášenou událostí. Hlášené nežádoucí účinky byly založeny na výsledcích dvou dvojitě zaslepených kontrolovaných klinických studií trvajících tři měsíce s dalším devítiměsíčním otevřeným prodloužením. Celkem 542 pacientů dostávalo tablety NAPRELAN buď ve dvojitě zaslepeném období, nebo v devítiměsíčním otevřeném prodloužení. Z těchto 542 pacientů dostalo 232 NAPRELAN tablety, 167 bylo původně léčeno Naprosynem® a 143 bylo původně léčeno placebem. Nežádoucí účinky hlášené pacienty, kteří užívali NAPRELAN 500 mg tablety, jsou uvedeny podle tělesného systému. Tyto nežádoucí účinky pozorované u naproxenu, které však nebyly hlášeny v kontrolovaných studiích s tabletami NAPRELAN, jsou uvedeny kurzívou.
Nejčastějšími nežádoucími účinky z dvojitě zaslepených a otevřených klinických studií byly bolesti hlavy (15 %), následované dyspepsií (14 %) a chřipkovým syndromem (10 %). Výskyt dalších nežádoucích účinků vyskytujících se u 3 % až 9 % pacientů je označen hvězdičkou.
Tyto reakce vyskytující se u méně než 3 % pacientů jsou nevýrazné.
Incidence větší než 1 % (pravděpodobná příčinná souvislost)
Tělo jako celek - Bolest (záda)*, bolest*, infekce*, horečka, zranění (nehoda), astenie, bolest na hrudi, bolest hlavy (15 %), chřipkový syndrom (10 %).
Gastrointestinální - Nevolnost*, průjem*, zácpa*, bolest břicha*, plynatost, gastritida, zvracení, dysfagie, dyspepsie (14%), pálení žáhy*, stomatitida.
hematologické - Anémie, ekchymóza.
Respirační - Faryngitida*, rýma*, sinusitida*, bronchitida, zvýšený kašel.
Renální - Infekce močových cest*, cystitida.
Dermatologické - Kožní vyrážka*, kožní vyrážky*, ekchymózy*, purpura.
Metabolismus a výživa - Periferní edém, hyperglykémie.
Centrální nervový systém - Závratě, parestézie, nespavost, ospalost*, točení hlavy.
Kardiovaskulární - Hypertenze, edém*, dušnost*, palpitace.
Muskuloskeletální - Křeče (nohy), myalgie, artralgie, poruchy kloubů, poruchy šlach.
Speciální smysly - Tinnitus*, poruchy sluchu, poruchy zraku.
Všeobecné - Žízeň.
Výskyt menší než 1 % (pravděpodobná příčinná souvislost)
Tělo jako celek - Absces, monilie, ztuhlý krk, bolest šíje, zvětšené břicho, karcinom, celulitida, celkový otok, LE syndrom, malátnost, porucha sliznice, alergická reakce, bolest pánve.
Gastrointestinální - Anorexie, cholecystitida, cholelitiáza, říhání, GI krvácení, rektální krvácení, aftózní stomatitida, stomatitida vřed, vřed v ústech, žaludeční vřed, periodontální absces, kardiospasmus, kolitida, ezofagitida, gastroenteritida, GI porucha, rektální porucha, porucha zubů, hepatosplenomegalie abnormality, meléna, vřed jícnu, hematemeza, žloutenka, pankreatitida, nekróza.
Renální - Dysmenorea, dysurie, abnormalita funkce ledvin, nykturie, porucha prostaty, pyelonefritida, karcinom prsu, inkontinence moči, ledvinový kámen, selhání ledvin, menoragie, metroragie, novotvar prsu, nefroskleróza, hematurie, bolest ledvin, pyurie, abnormální moč, frekvence močení, močení retence, děložní spasmus, vaginitida, glomerulární nefritida, hyperkalémie, intersticiální nefritida, nefrotický syndrom, onemocnění ledvin, selhání ledvin, renální papilární nekróza.
hematologické - Leukopenie, prodloužená doba krvácení, eozinofilie, abnormální RBC, abnormální WBC, trombocytopenie, agranulocytóza, granulocytopenie.
Centrální nervový systém - Deprese, úzkost, hypertonie, nervozita, neuralgie, neuritida, vertigo, amnézie, zmatenost, koordinace, abnormální diplopie, emoční labilita, subdurální hematom, paralýza, snové abnormality, neschopnost koncentrace, svalová slabost.
Dermatologické: Angiodermatitida, herpes simplex, suchá kůže, pocení, kožní vředy, akné, alopecie, kontaktní dermatitida, ekzém, herpes zoster, porucha nehtů, nekróza kůže, podkožní uzlík, pruritus, kopřivka, novotvar kůže, fotosenzitivní dermatitida, fotosenzitivní reakce připomínající porfyrii kožní tarda epidermolysis bullosa.
Speciální smysly - Amblyopie, skleritida, katarakta, konjunktivitida, hluchota, porucha uší, keratokonjunktivitida, porucha slzení, zánět středního ucha, bolest oka.
Kardiovaskulární - Angina pectoris, ischemická choroba srdeční, infarkt myokardu, hluboká tromboflebitida, vazodilatace, vaskulární anomálie, arytmie, blokáda raménka, abnormální EKG, srdeční selhání vpravo, krvácení, migréna, aortální stenóza, synkopa, tachykardie, městnavé srdeční selhání.
Respirační - Astma, dušnost, plicní edém, laryngitida, plicní porucha, epistaxe, pneumonie, respirační tíseň, respirační porucha, eozinofilní pneumonitida.
Muskuloskeletální - Myastenie, poruchy kostí, spontánní zlomeniny kostí, fibrotendinitida, bolest kostí, ptóza, křeče obecně, burzitida.
Metabolismus a výživa - Zvýšení kreatininu, glukosurie, hypercholesterémie, albuminurie, alkalóza, zvýšení BUN, dehydratace, edém, snížení glukózové tolerance, hyperurikémie, hypokalémie, zvýšení SGOT, zvýšení SGPT, snížení hmotnosti.
Všeobecné - Anafylaktoidní reakce, angioneurotický edém, menstruační poruchy, hypoglykémie, pyrexie (zimnice a horečky).
Výskyt méně než 1 % (příčinná souvislost neznámá)
Další nežádoucí účinky uvedené na štítku na obalu naproxenu, které však nebyly hlášeny těmi, kteří dostávali tablety NAPRELAN, jsou uvedeny kurzívou. Tato pozorování jsou uvedena jako varovné informace pro lékaře.
hematologické - Aplastická anémie, hemolytická anémie.
Centrální nervový systém - Aseptická meningitida, kognitivní dysfunkce.
Dermatologické - Epidermální nekrolýza, erythema multiforme, Stevens-Johnsonův syndrom.
Gastrointestinální - Nepeptická GI ulcerace, ulcerózní stomatitida.
Kardiovaskulární - Vaskulitida.
DROGOVÉ INTERAKCE
Viz Tabulka 1 pro klinicky významné lékové interakce s naproxenem.
Interakce drog/laboratorních testů
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Kardiovaskulární trombotické příhody
Klinické studie několika COX-2 selektivních a neselektivních NSAID trvající až tři roky prokázaly zvýšené riziko závažných kardiovaskulárních (KV) trombotických příhod, včetně infarktu myokardu (MI) a cévní mozkové příhody, které mohou být fatální. Na základě dostupných údajů není jasné, že riziko KV trombotických příhod je u všech NSAID podobné. Relativní nárůst závažných KV trombotických příhod nad výchozí hodnotu způsobený užíváním NSAID se zdá být podobný u pacientů se známým KV onemocněním nebo rizikovými faktory KV onemocnění i bez nich. Pacienti se známým KV onemocněním nebo rizikovými faktory však měli vyšší absolutní incidenci nadměrných závažných KV trombotických příhod, a to kvůli jejich zvýšené výchozí frekvenci. Některé observační studie zjistily, že toto zvýšené riziko závažných KV trombotických příhod začalo již v prvních týdnech léčby. Zvýšení KV trombotického rizika bylo nejkonzistentněji pozorováno při vyšších dávkách.
Aby se minimalizovalo potenciální riziko nežádoucí KV příhody u pacientů léčených NSAID, používejte nejnižší účinnou dávku po co nejkratší možnou dobu. Lékaři a pacienti by měli zůstat ostražití ohledně rozvoje takových příhod po celou dobu léčby, a to i v případě, že se nevyskytnou předchozí KV symptomy. Pacienti by měli být informováni o příznacích závažných KV příhod a o krocích, které je třeba učinit, pokud k nim dojde.
Neexistují žádné konzistentní důkazy, že současné užívání aspirinu zmírňuje zvýšené riziko závažných kardiovaskulárních trombotických příhod spojených s užíváním NSAID. Současné užívání aspirinu a NSAID, jako je naproxen, zvyšuje riziko závažných gastrointestinálních (GI) příhod (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Stav po operaci bypassu koronární tepny (CABG).
Dvě velké, kontrolované klinické studie COX-2 selektivního NSAID pro léčbu bolesti v prvních 10 – 14 dnech po operaci CABG zjistily zvýšený výskyt infarktu myokardu a cévní mozkové příhody. NSAID jsou kontraindikována při CABG [viz KONTRAINDIKACE ].
Pacienti po IM
Observační studie provedené v Dánském národním registru prokázaly, že pacienti léčení NSAID v období po IM měli zvýšené riziko reinfarktu, úmrtí související s kardiovaskulárními chorobami a mortalitu ze všech příčin počínaje prvním týdnem léčby. Ve stejné kohortě byla incidence úmrtí v prvním roce po IM 20 na 100 osoboroků u pacientů léčených NSAID ve srovnání s 12 na 100 osoboroků u pacientů neexponovaných NSAID. Přestože absolutní míra úmrtí po prvním roce po infarktu myokardu poněkud poklesla, zvýšené relativní riziko úmrtí u uživatelů NSAID přetrvávalo alespoň po další čtyři roky sledování.
Vyhněte se použití přípravku NAPRELAN 250 mg u pacientů s nedávným infarktem myokardu, pokud se neočekává, že přínosy převáží riziko rekurentních KV trombotických příhod. Pokud se NAPRELAN používá u pacientů s nedávným infarktem myokardu, sledujte u pacientů známky srdeční ischemie.
Gastrointestinální krvácení, ulcerace a perforace
NSAID, včetně naproxenu, způsobují závažné gastrointestinální (GI) nežádoucí příhody včetně zánětu, krvácení, ulcerace a perforace jícnu, žaludku, tenkého střeva nebo tlustého střeva, které mohou být fatální. Tyto závažné nežádoucí účinky se mohou u pacientů léčených NSAID objevit kdykoli, s varovnými příznaky nebo bez nich. Pouze jeden z pěti pacientů, u kterých se vyvine závažný nežádoucí účinek v horní části GI při léčbě NSAID, je symptomatický. Vředy v horní části gastrointestinálního traktu, velké krvácení nebo perforace způsobené NSAID se vyskytly u přibližně 1 % pacientů léčených po dobu 3 až 6 měsíců au přibližně 2 % až 4 % pacientů léčených po dobu jednoho roku. Ani krátkodobá terapie NSA však není bez rizika.
Rizikové faktory GI krvácení, ulcerace a perforace
Pacienti s předchozí anamnézou peptického vředu a/nebo GI krvácení, kteří užívali NSAID, měli více než 10násobně zvýšené riziko rozvoje GI krvácení ve srovnání s pacienty bez těchto rizikových faktorů. Mezi další faktory, které zvyšují riziko GI krvácení u pacientů léčených NSAID, patří delší trvání léčby NSAID; současné užívání perorálních kortikosteroidů, aspirinu, antikoagulancií nebo selektivních inhibitorů zpětného vychytávání serotoninu (SSRI); kouření; užívání alkoholu; vyšší věk; a špatný celkový zdravotní stav. Většina postmarketingových hlášení fatálních GI příhod se objevila u starších nebo oslabených pacientů. Kromě toho mají pacienti s pokročilým onemocněním jater a/nebo koagulopatií zvýšené riziko GI krvácení.
Strategie k minimalizaci GI rizik u pacientů léčených NSAID
- Používejte nejnižší účinnou dávku po co nejkratší možnou dobu.
- Vyhněte se podávání více než jednoho NSAID současně.
- Vyhněte se použití u pacientů s vyšším rizikem, pokud se neočekává, že přínosy převáží zvýšené riziko krvácení. U takových pacientů, stejně jako u pacientů s aktivním gastrointestinálním krvácením, zvažte jinou léčbu než NSAID.
- Během léčby nesteroidními antirevmatiky buďte ostražití na známky a příznaky GI ulcerace a krvácení.
- Pokud je podezření na závažnou gastrointestinální nežádoucí příhodu, okamžitě zahajte hodnocení a léčbu a přerušte léčbu přípravkem NAPRELAN 250 mg, dokud nebude vyloučena závažná gastrointestinální nežádoucí příhoda.
- Při současném užívání nízkých dávek kyseliny acetylsalicylové pro srdeční profylaxi sledujte pacienty pečlivěji, zda se u nich neprojeví gastrointestinální krvácení (viz DROGOVÉ INTERAKCE ].
Hepatotoxicita
V klinických studiích bylo u přibližně 1 % pacientů léčených NSAID hlášeno zvýšení ALT nebo AST (trojnásobek nebo vícenásobek horní hranice normy [ULN]). Kromě toho byly hlášeny vzácné, někdy fatální, případy těžkého poškození jater, včetně fulminantní hepatitidy, jaterní nekrózy a jaterního selhání.
Zvýšení ALT nebo AST (méně než trojnásobek ULN) se může objevit až u 15 % pacientů léčených NSAID včetně naproxenu.
Informujte pacienty o varovných příznacích a příznacích hepatotoxicity (např. nevolnost, únava, letargie, průjem, pruritus, žloutenka, citlivost v pravém horním kvadrantu a příznaky podobné chřipce). Pokud se rozvinou klinické známky a příznaky odpovídající onemocnění jater nebo pokud se objeví systémové projevy (např. eozinofilie, vyrážka atd.), okamžitě přerušte léčbu přípravkem NAPRELAN 500 mg a proveďte klinické vyšetření pacienta.
Hypertenze
NSAID, včetně NAPRELANu, mohou vést k novému propuknutí nebo zhoršení již existující hypertenze, přičemž obojí může přispívat ke zvýšené incidenci KV příhod. Pacienti užívající inhibitory angiotenzin konvertujícího enzymu (ACE), thiazidová diuretika nebo kličková diuretika mohou mít zhoršenou odpověď na tyto terapie při užívání NSAID (viz DROGOVÉ INTERAKCE ].
Sledujte krevní tlak (TK) během zahájení léčby NSAID a v průběhu léčby.
Srdeční Selhání A Edém
Metaanalýza randomizovaných kontrolovaných studií Coxib and traditional NSAID Trialists’ Collaboration prokázala přibližně dvojnásobný nárůst hospitalizací pro srdeční selhání u pacientů selektivně léčených COX-2 a neselektivních pacientů léčených NSAID ve srovnání s pacienty léčenými placebem. Ve studii dánského národního registru pacientů se srdečním selháním užívání NSAID zvýšilo riziko infarktu myokardu, hospitalizace pro srdeční selhání a úmrtí.
U některých pacientů léčených NSAID byla navíc pozorována retence tekutin a edém. Použití naproxenu může oslabit KV účinky několika terapeutických látek používaných k léčbě těchto zdravotních stavů (např. diuretik, ACE inhibitorů nebo blokátorů receptorů angiotenzinu [ARB]) [viz DROGOVÉ INTERAKCE ].
Vyhněte se užívání přípravku NAPRELAN 250 mg u pacientů se závažným srdečním selháním, pokud se neočekává, že přínosy převáží riziko zhoršení srdečního selhání. Pokud se NAPRELAN používá u pacientů se závažným srdečním selháním, sledujte pacienty, zda se u nich nevyskytují známky zhoršení srdečního selhání.
Renální toxicita a hyperkalémie
Renální toxicita
Dlouhodobé podávání NSAID vedlo k renální papilární nekróze a jinému poškození ledvin.
Renální toxicita byla také pozorována u pacientů, u kterých mají renální prostaglandiny kompenzační roli při udržování renální perfuze. U těchto pacientů může podávání NSAID způsobit na dávce závislé snížení tvorby prostaglandinů a sekundárně i renálního průtoku krve, což může urychlit zjevnou renální dekompenzaci. Největší riziko této reakce jsou pacienti s poruchou funkce ledvin, dehydratací, hypovolémií, srdečním selháním, jaterní dysfunkcí, ti, kteří užívají diuretika a ACE inhibitory nebo ARB, a starší lidé. Po přerušení léčby NSAID obvykle následuje návrat do stavu před léčbou.
kontrolovaných klinických studií nejsou dostupné žádné informace týkající se použití NAPRELNU u pacientů s pokročilým onemocněním ledvin. Renální účinky přípravku NAPRELAN 250 mg mohou urychlit progresi renální dysfunkce u pacientů s již existujícím onemocněním ledvin.
U dehydratovaných nebo hypovolemických pacientů upravte stav objemu před zahájením léčby přípravkem NAPRELAN. Monitorujte funkci ledvin u pacientů s poruchou funkce ledvin nebo jater, srdečním selháním, dehydratací nebo hypovolémií během užívání přípravku NAPRELAN (viz DROGOVÉ INTERAKCE ]. Vyhněte se užívání přípravku NAPRELAN 500 mg u pacientů s pokročilým onemocněním ledvin, pokud se neočekává, že přínosy převáží riziko zhoršení funkce ledvin. Pokud se NAPRELAN používá u pacientů s pokročilým onemocněním ledvin, sledujte u pacientů známky zhoršení funkce ledvin.
Hyperkalémie
Při užívání NSAID bylo hlášeno zvýšení koncentrace draslíku v séru, včetně hyperkalémie, a to i u některých pacientů bez poškození ledvin. U pacientů s normální funkcí ledvin byly tyto účinky připisovány hyporeninemicko-hypoaldosteronistickému stavu.
Anafylaktické reakce
Naproxen byl spojován s anafylaktickými reakcemi u pacientů se známou hypersenzitivitou na naproxen i bez ní a u pacientů s astmatem citlivým na aspirin (viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pokud dojde k anafylaktické reakci, vyhledejte pohotovostní pomoc.
Exacerbace astmatu souvisejícího s citlivostí na aspirin
Subpopulace pacientů s astmatem může mít astma citlivé na aspirin, které může zahrnovat chronickou rinosinusitidu komplikovanou nosními polypy; těžký, potenciálně fatální bronchospasmus; a/nebo nesnášenlivost aspirinu a jiných NSAID. Protože u takových pacientů citlivých na aspirin byla hlášena zkřížená reaktivita mezi aspirinem a jinými NSAID, je NAPRELAN 250 mg kontraindikován u pacientů s touto formou citlivosti na aspirin (viz KONTRAINDIKACE ]. Pokud se přípravek NAPRELAN používá u pacientů s již existujícím astmatem (bez známé citlivosti na kyselinu acetylsalicylovou), sledujte pacienty z hlediska změn známek a příznaků astmatu.
Závažné kožní reakce
NSAID, včetně naproxenu, mohou způsobit závažné kožní nežádoucí reakce, jako je exfoliativní dermatitida, Stevens-Johnsonův syndrom (SJS) a toxická epidermální nekrolýza (TEN), které mohou být fatální. Tyto závažné události mohou nastat bez varování. Informujte pacienty o známkách a příznacích závažných kožních reakcí a přerušte užívání přípravku NAPRELAN 500 mg při prvním výskytu kožní vyrážky nebo jakýchkoli jiných příznaků přecitlivělosti.
NAPRELAN je kontraindikován u pacientů s předchozími závažnými kožními reakcemi na NSAID (viz KONTRAINDIKACE ].
Léková reakce s eozinofilií a systémovými příznaky (DRESS)
pacientů užívajících NSAID, jako je NAPRELAN, byla hlášena léková reakce s eozinofilií a systémovými příznaky (DRESS). Některé z těchto událostí byly smrtelné nebo život ohrožující. DRESS se typicky, i když ne výlučně, projevuje horečkou, vyrážkou, lymfadenopatií a/nebo otokem obličeje. Jiné klinické projevy mohou zahrnovat hepatitidu, nefritidu, hematologické abnormality, myokarditidu nebo myozitidu. Někdy mohou příznaky DRESS připomínat akutní virovou infekci. Často je přítomna eozinofilie. Vzhledem k tomu, že tato porucha je ve svém projevu proměnlivá, mohou se na ní podílet i jiné orgánové systémy, které zde nejsou uvedeny. Je důležité si uvědomit, že časné projevy přecitlivělosti, jako je horečka nebo lymfadenopatie, mohou být přítomny, i když vyrážka není zjevná. Pokud jsou takové známky nebo příznaky přítomny, přerušte léčbu přípravkem NAPRELAN a okamžitě pacienta vyhodnoťte.
Fetální toxicita
Předčasné uzavření Fetal Ductus Arteriosus
Vyhněte se užívání NSAID, včetně NAPRELANu, u těhotných žen přibližně ve 30. týdnu těhotenství a později. NSAID, včetně NAPRELANu, zvyšují riziko předčasného uzávěru ductus arteriosus plodu přibližně v tomto gestačním věku.
Oligohydramnion/novorozenecké poškození ledvin
Užívání NSAID, včetně NAPRELAN 500 mg, přibližně ve 20. týdnu těhotenství nebo později v těhotenství může způsobit fetální renální dysfunkci vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin. Tyto nežádoucí účinky jsou pozorovány v průměru po dnech až týdnech léčby, ačkoli oligohydramnion byl zřídka hlášen již 48 hodin po zahájení NSAID. Oligohydramnion je často, ale ne vždy, po přerušení léčby reverzibilní. Komplikace prodlouženého oligohydramnia mohou například zahrnovat kontraktury končetin a opožděné dozrávání plic. V některých postmarketingových případech poškození funkce ledvin novorozenců byly vyžadovány invazivní postupy, jako je výměnná transfuze nebo dialýza.
Pokud je léčba NSAID nezbytná mezi 20. a 30. týdnem těhotenství, omezte užívání přípravku NAPRELAN 500 mg na nejnižší účinnou dávku a co nejkratší dobu. Pokud léčba NAPRELANem přesáhne 48 hodin, zvažte ultrazvukové monitorování plodové vody. Pokud se objeví oligohydramnion, přerušte NAPRELAN a sledujte podle klinické praxe [viz Použití u konkrétních populací ].
Hematologická toxicita
U pacientů léčených NSAID se objevila anémie. To může být způsobeno okultní nebo hrubou ztrátou krve, zadržováním tekutin nebo neúplně popsaným vlivem na erytropoézu. Pokud má pacient léčený přípravkem NAPRELAN 500 mg jakékoli známky nebo příznaky anémie, sledujte hemoglobin nebo hematokrit.
NSAID, včetně NAPRELANu, mohou zvýšit riziko krvácivých příhod. Toto riziko mohou zvýšit přidružená onemocnění, jako jsou poruchy koagulace, současné užívání warfarinu, jiných antikoagulancií, protidestičkových látek (např. aspirin), inhibitorů zpětného vychytávání serotoninu (SSRI) a inhibitorů zpětného vychytávání serotoninu a norepinefrinu (SNRI). Sledujte u těchto pacientů známky krvácení [viz DROGOVÉ INTERAKCE ].
Maskování Zánětu A Horečky
Farmakologická aktivita přípravku NAPRELAN 250 mg při snižování zánětu a možná i horečky může snížit užitečnost diagnostických příznaků při detekci infekcí.
Laboratorní monitorování
Protože závažné GI krvácení, hepatotoxicita a poškození ledvin se mohou objevit bez varovných příznaků nebo známek, zvažte pravidelné sledování pacientů na dlouhodobé léčbě NSAID pomocí CBC a chemického profilu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ), který doprovází každý vydaný předpis. Před zahájením léčby přípravkem NAPRELAN 500 mg a pravidelně v průběhu probíhající léčby informujte pacienty, rodiny nebo jejich pečovatele o následujících informacích.
Kardiovaskulární trombotické příhody
Informujte pacienty, aby byli ostražití na příznaky kardiovaskulárních trombotických příhod, včetně bolesti na hrudi, dušnosti, slabosti nebo nezřetelné řeči, a aby kterýkoli z těchto příznaků okamžitě hlásili svému poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Gastrointestinální krvácení, ulcerace a perforace
NAPRELAN 500 mg, stejně jako ostatní NSAID, může způsobit gastrointestinální potíže a vzácně i závažné gastrointestinální nežádoucí účinky, jako jsou vředy a krvácení, které mohou vést k hospitalizaci a dokonce smrti. Poraďte pacientům, aby svému poskytovateli zdravotní péče hlásili příznaky ulcerací a krvácení, včetně bolesti v epigastriu, dyspepsie, meleny a hematemézy. Při současném užívání nízkých dávek aspirinu pro srdeční profylaxi informujte pacienty o zvýšeném riziku a známkách a příznacích gastrointestinálního krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hepatotoxicita
Informujte pacienty o varovných příznacích a příznacích hepatotoxicity (např. nevolnost, únava, letargie, svědění, průjem, žloutenka, citlivost v pravém horním kvadrantu a příznaky podobné chřipce). Pokud k tomu dojde, poučte pacienty, aby přestali NAPRELAN a vyhledali okamžitou lékařskou léčbu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Srdeční Selhání A Edém
Poraďte pacientům, aby byli ostražití na příznaky městnavého srdečního selhání včetně dušnosti, nevysvětlitelného přírůstku hmotnosti nebo edému a aby kontaktovali svého poskytovatele zdravotní péče, pokud se takové příznaky objeví [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Anafylaktické reakce
Informujte pacienty o známkách anafylaktické reakce (např. potíže s dýcháním, otok obličeje nebo hrdla). Poučte pacienty, aby vyhledali okamžitou pohotovostní pomoc, pokud k tomu dojde [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vážné kožní reakce, včetně ŠATY
NAPRELAN 500 mg, stejně jako ostatní NSAID, může způsobit závažné kožní nežádoucí účinky, jako je exfoliativní dermatitida, SJS a TEN, které mohou vést k hospitalizaci a dokonce smrti. Informujte pacienty, aby okamžitě přestali užívat NAPRELAN, pokud se u nich objeví jakýkoli typ vyrážky nebo horečky, a aby co nejdříve kontaktovali svého poskytovatele zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ženská plodnost
Informujte ženy s reprodukčním potenciálem, které si přejí otěhotnět, že NSAID, včetně NAPRELAN 250 mg, mohou být spojeny s reverzibilním zpožděním ovulace (viz Použití u konkrétních populací ].
Fetální toxicita
Informujte těhotné ženy, aby se vyvarovaly užívání NAPRELAN 500 mg a jiných NSAID počínaje 30. týdnem těhotenství kvůli riziku předčasného uzavření ductus arteriosus plodu. Pokud je u těhotné ženy mezi 20. až 30. týdnem těhotenství nutná léčba přípravkem NAPRELAN 500 mg, upozorněte ji, že může být nutné sledovat oligohydramnion, pokud léčba trvá déle než 48 hodin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Vyhněte se současnému užívání NSAID
Informujte pacienty, že současné užívání NAPRELANu s jinými NSAID nebo salicyláty (např. diflunisal, salsalát) se nedoporučuje kvůli zvýšenému riziku gastrointestinální toxicity a malému nebo žádnému zvýšení účinnosti (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ]. Upozorněte pacienty, že NSAID mohou být přítomna v „volně prodejných“ lécích k léčbě nachlazení, horečky nebo nespavosti.
Užívání NSAID a nízké dávky aspirinu
Informujte pacienty, aby neužívali nízké dávky aspirinu současně s NAPRELAN 250 mg, dokud si nepromluví se svým poskytovatelem zdravotní péče [viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Byla provedena dvouletá studie na potkanech s cílem vyhodnotit karcinogenní potenciál naproxenu v dávkách 8 mg/kg/den, 16 mg/kg/den a 24 mg/kg/den (0,05, 0,1 a 0,16násobek maximální doporučené dávky denní dávka pro člověka 1 500 mg/den na základě srovnání plochy povrchu těla). Nebyly nalezeny žádné důkazy o tumorigenicitě.
Mutageneze
Studie hodnotící mutagenní potenciál Naprosyn Suspension nebyly dokončeny.
Zhoršení Plodnosti
Studie hodnotící vliv naproxenu na mužskou nebo ženskou plodnost nebyly dokončeny.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Užívání NSAID, včetně NAPRELAN 500 mg, může způsobit předčasné uzavření ductus arteriosus plodu a fetální renální dysfunkci vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin. Kvůli těmto rizikům omezte dávku a délku užívání přípravku NAPRELAN 500 mg mezi přibližně 20. a 30. týdnem těhotenství a vyhněte se užívání přípravku NAPRELAN 500 mg přibližně ve 30. týdnu těhotenství a později v těhotenství (viz Klinické úvahy , Data ).
Předčasné uzavření Fetal Ductus Arteriosus
Užívání NSAID, včetně NAPRELAN 500 mg, přibližně ve 30. týdnu těhotenství nebo později v těhotenství zvyšuje riziko předčasného uzávěru ductus arteriosus plodu.
Oligohydramnion/novorozenecké poškození ledvin
Užívání NSAID přibližně ve 20. týdnu těhotenství nebo později v těhotenství bylo spojeno s případy fetální renální dysfunkce vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin.
Údaje z observačních studií týkající se dalších potenciálních embryofetálních rizik užívání NSAID u žen v prvním nebo druhém trimestru těhotenství jsou neprůkazné. V reprodukčních studiích na zvířatech u potkanů, králíků a myší nebyly zjištěny žádné známky teratogenity nebo poškození plodu, když byl naproxen podáván během období organogeneze v dávkách 0,13, 0,26 a 0,6násobku maximální doporučené denní dávky pro člověka 1 500 mg/den. Na základě údajů na zvířatech se prokázalo, že prostaglandiny hrají důležitou roli v permeabilitě cév endometria, implantaci blastocyst a decidualizaci. Ve studiích na zvířatech vedlo podávání inhibitorů syntézy prostaglandinů, jako je naproxen, ke zvýšeným ztrátám před a po implantaci. Bylo také prokázáno, že prostaglandiny hrají důležitou roli ve vývoji ledvin plodu. V publikovaných studiích na zvířatech bylo hlášeno, že inhibitory syntézy prostaglandinů narušují vývoj ledvin, když jsou podávány v klinicky relevantních dávkách.
Odhadované základní riziko závažných vrozených vad a potratu pro uvedenou populaci (populace) není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Fetální/neonatální nežádoucí reakce
Předčasný uzávěr fetálního duktus arteriosus: Vyvarujte se užívání NSAID u žen přibližně ve 30. týdnu těhotenství a později v těhotenství, protože NSAID, včetně NAPRELANu, mohou způsobit předčasné uzavření fetálního ductus arteriosus (viz Data ).
Oligohydramnion/novorozenecká renální insuficience: Je-li nutné NSAID přibližně ve 20. týdnu těhotenství nebo později v těhotenství, omezte použití na nejnižší účinnou dávku a nejkratší možnou dobu trvání. Pokud léčba přípravkem NAPRELAN 500 mg přesáhne 48 hodin, zvažte sledování oligohydramnionu ultrazvukem. Pokud se objeví oligohydramnion, přerušte léčbu přípravkem NAPRELAN 500 mg a sledujte podle klinické praxe (viz. Data ).
Práce nebo dodávka
Neexistují žádné studie o účincích přípravku NAPRELAN 500 mg během porodu nebo porodu. Ve studiích na zvířatech NSAID, včetně sodné soli naproxenu, inhibují syntézu prostaglandinů, způsobují opožděný porod, zvyšují výskyt dystokie a zvyšují výskyt mrtvorozených dětí.
Data
Lidská data
Existují určité důkazy, které naznačují, že při použití inhibitorů syntézy prostaglandinů k oddálení předčasného porodu existuje zvýšené riziko neonatálních komplikací, jako je nekrotizující enterokolitida, otevřený ductus arteriosus a intrakraniální krvácení. Léčba naproxenem podávaná v pozdním těhotenství za účelem oddálení porodu byla spojena s přetrvávající plicní hypertenzí, renální dysfunkcí a abnormálními hladinami prostaglandinu E u předčasně narozených dětí. Vzhledem ke známému účinku léků této třídy na kardiovaskulární systém lidského plodu (uzavření ductus arteriosus) je třeba se vyhnout použití během třetího trimestru.
Předčasné uzavření Fetal Ductus Arteriosus
Publikovaná literatura uvádí, že použití NSAID přibližně ve 30. týdnu těhotenství a později v těhotenství může způsobit předčasné uzavření ductus arteriosus plodu.
Oligohydramnion/novorozenecké poškození ledvin
Publikované studie a postmarketingové zprávy popisují užívání NSAID u matky ve 20. týdnu těhotenství nebo později v těhotenství spojené s fetální renální dysfunkcí vedoucí k oligohydramniu a v některých případech neonatálnímu poškození ledvin. Tyto nežádoucí účinky jsou pozorovány v průměru po dnech až týdnech léčby, ačkoli oligohydramnion byl zřídka hlášen již 48 hodin po zahájení NSAID. V mnoha případech, ale ne ve všech, byl pokles plodové vody přechodný a reverzibilní po vysazení léku. Existuje omezený počet kazuistik užívání NSAID u matek a neonatální renální dysfunkce bez oligohydramnia, z nichž některé byly ireverzibilní. Některé případy neonatální renální dysfunkce vyžadovaly léčbu invazivními postupy, jako je výměnná transfuze nebo dialýza.
Metodologická omezení těchto postmarketingových studií a zpráv zahrnují nedostatek kontrolní skupiny; omezené informace týkající se dávky, trvání a načasování expozice léku; a současné užívání jiných léků. Tato omezení znemožňují stanovení spolehlivého odhadu rizika nepříznivých fetálních a neonatálních výsledků při užívání NSAID matkou. Vzhledem k tomu, že publikované údaje o bezpečnosti týkající se neonatálních výsledků zahrnovaly většinou předčasně narozené děti, je zobecnění určitých hlášených rizik pro donošené dítě vystavené NSAID při užívání matkou nejisté.
Údaje o zvířatech
Reprodukční studie byly provedeny na potkanech při dávce 20 mg/kg/den (0,13násobek maximální doporučené denní dávky pro člověka 1500 mg/den na základě srovnání plochy povrchu těla), králíků při dávce 20 mg/kg/den (0,26násobek maximální doporučené dávky u lidí denní dávka na základě srovnání tělesného povrchu) a myši při dávce 170 mg/kg/den (0,6násobek maximální doporučené denní dávky pro člověka na základě srovnání tělesného povrchu) bez známek poškození plodnosti nebo poškození plodu v důsledku lék. Na základě údajů na zvířatech se prokázalo, že prostaglandiny hrají důležitou roli v permeabilitě cév endometria, implantaci blastocyst a decidualizaci. Ve studiích na zvířatech vedlo podávání inhibitorů syntézy prostaglandinů, jako je naproxen sodný, ke zvýšeným ztrátám před a po implantaci.
Laktace
Shrnutí rizik
Anion naproxenu byl nalezen v mléce kojících žen v koncentraci přibližně 1 % koncentrace v plazmě. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky NAPRELAN a veškerými potenciálními nežádoucími účinky NAPRELANu nebo základního stavu matky na kojené dítě.
Ženy a muži reprodukčního potenciálu
Neplodnost
Ženy
Na základě mechanismu účinku může použití NSAID zprostředkovaných prostaglandiny, včetně NAPRELANu, oddálit nebo zabránit ruptuře ovariálních folikulů, která je u některých žen spojována s reverzibilní neplodností. Publikované studie na zvířatech ukázaly, že podávání inhibitorů syntézy prostaglandinů má potenciál narušit prostaglandiny zprostředkovanou rupturu folikulů potřebnou pro ovulaci. Malé studie u žen léčených NSAID také prokázaly reverzibilní zpoždění ovulace. Zvažte vysazení NSAID, včetně NAPRELANU 250 mg, u žen, které mají potíže s početím nebo které podstupují vyšetření neplodnosti.
Pediatrické použití
Bezpečnost a účinnost přípravku NAPRELAN 500 mg u pediatrické populace nebyla stanovena.
Geriatrické použití
Starší pacienti jsou ve srovnání s mladšími pacienty vystaveni většímu riziku závažných kardiovaskulárních, gastrointestinálních a/nebo renálních nežádoucích reakcí spojených s NSAID. Pokud očekávaný přínos pro staršího pacienta převáží tato potenciální rizika, začněte s dávkováním na spodní hranici dávkovacího rozmezí a sledujte pacienty kvůli nežádoucím účinkům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Je známo, že naproxen a jeho metabolity jsou v podstatě vylučovány ledvinami a riziko nežádoucích reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Protože u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, buďte u této populace pacientů opatrní a může být užitečné sledovat funkci ledvin [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Symptomy po akutním předávkování NSAID byly typicky omezeny na letargii, ospalost, nauzeu, zvracení a epigastrickou bolest, které byly obvykle reverzibilní podpůrnou péčí. Objevilo se gastrointestinální krvácení. Hypertenze, akutní selhání ledvin, respirační deprese a kóma se vyskytly, ale byly vzácné [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Několik pacientů zažilo záchvaty, ale není jasné, zda souvisely s drogou či nikoli. Není známo, jaká dávka drogy by byla život ohrožující.
Ošetřujte pacienty symptomatickou a podpůrnou péčí po předávkování NSAID. Neexistují žádná specifická antidota. Hemodialýza nesnižuje plazmatickou koncentraci naproxenu kvůli vysokému stupni jeho vazby na proteiny. Zvažte zvracení a/nebo aktivní uhlí (60 až 100 gramů u dospělých, 1 až 2 gramy na kg tělesné hmotnosti u pediatrických pacientů) a/nebo osmotické katarzi u symptomatických pacientů pozorovaných do čtyř hodin po požití nebo u pacientů s velkým předávkováním ( 5 až 10násobek doporučené dávky). Forsírovaná diuréza, alkalizace moči, hemodialýza nebo hemoperfuze nemusí být užitečné kvůli vysoké vazbě na proteiny.
Pro další informace o léčbě předávkování kontaktujte toxikologické centrum (1-800-222-1222).
KONTRAINDIKACE
NAPRELAN 500 mg je kontraindikován u následujících pacientů:
Známá přecitlivělost (např. anafylaktické reakce a závažné kožní reakce) na naproxen nebo kteroukoli složku léčivého přípravku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Anamnéza astmatu, kopřivky nebo jiných reakcí alergického typu po užití aspirinu nebo jiných NSAID. U těchto pacientů byly hlášeny těžké, někdy fatální, anafylaktické reakce na NSAID (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Při operaci bypassu koronární artérie (CABG) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Naproxen má analgetické, protizánětlivé a antipyretické vlastnosti.
Mechanismus účinku NAPRELANu, stejně jako jiných NSAID, není zcela objasněn, ale zahrnuje inhibici cyklooxygenázy (COX-1 a COX-2).
Naproxen sodný je silný inhibitor syntézy prostaglandinů in vitro. Koncentrace sodné soli naproxenu dosažené během léčby vyvolaly účinky in vivo. Prostaglandiny senzibilizují aferentní nervy a zesilují účinek bradykininu při vyvolávání bolesti na zvířecích modelech.
Prostaglandiny jsou mediátory zánětu. Protože naproxen sodný je inhibitor syntézy prostaglandinů, jeho mechanismus účinku může být způsoben poklesem prostaglandinů v periferních tkáních.
Farmakodynamika
Ve studii se zdravými dobrovolníky, 10 dní současného podávání naproxenu 220 mg jednou denně s nízkou dávkou aspirinu s okamžitým uvolňováním (81 mg) prokázalo interakci s protidestičkovou aktivitou aspirinu měřenou % inhibice tromboxanu B2 v séru za 24 hodin po dávce 10. den [98,7 % (samotný aspirin) oproti 93,1 % (naproxen a aspirin)]. Interakce byla pozorována i po vysazení naproxenu 11. den (zatímco dávka aspirinu pokračovala), ale normalizovala se 13. den. Ve stejné studii byla interakce větší, když byl naproxen podán 30 minut před aspirinem [98,7 % oproti 87,7 %]. a minimální, když byl aspirin podán 30 minut před naproxenem [98,7 % vs. 95,4 %].
Po podání naproxenu 220 mg dvakrát denně s nízkou dávkou aspirinu s okamžitým uvolňováním (první dávka naproxenu podaná 30 minut před aspirinem) byla interakce minimální 24 hodin po dávce 10. den [98,7 % vs. 95,7 %]. Interakce však byla výraznější po vysazení naproxenu (vymytí) 11. den [98,7 % vs. 84,3 %] a zcela se nenormalizovala do 13. dne [98,5 % vs. 90,7 %]. [vidět DROGOVÉ INTERAKCE ].
Farmakokinetika
když je naproxen samotný dobře absorbován, forma sodné soli je absorbována rychleji, což vede k vyšším maximálním plazmatickým hladinám pro danou dávku. Přibližně 30 % celkové dávky naproxenu sodného v tabletách NAPRELAN 500 mg je přítomno v lékové formě jako složka s okamžitým uvolňováním. Zbývající sodná sůl naproxenu je potažena jako mikročástice, aby bylo zajištěno trvalé uvolňování. Po perorálním podání jsou plazmatické hladiny naproxenu detekovány do 30 minut po podání, přičemž maximální plazmatické hladiny se objevují přibližně 5 hodin po podání. Pozorovaný terminální eliminační poločas naproxenu jak ze sodné soli naproxenu s okamžitým uvolňováním, tak z tablet NAPRELAN je přibližně 15 hodin. Ustáleného stavu hladin naproxenu je dosaženo za 3 dny a tomu odpovídá i stupeň akumulace naproxenu v krvi.
Průměrné koncentrace naproxenu v plazmě 24 subjektů (+/-2SD) (ustálený stav, den 5)
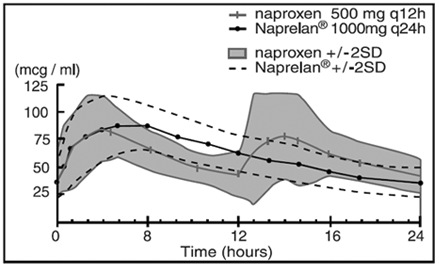
Farmakokinetické parametry v den 5 v ustáleném stavu (průměr 24 subjektů)
Vstřebávání
Samotný naproxen je rychle a úplně absorbován z GI traktu s in vivo biologickou dostupností 95 %. Na základě farmakokinetického profilu nastává fáze vstřebávání přípravku NAPRELAN 250 mg tablety během prvních 4 až 6 hodin po podání. To se shoduje s rozpadem tablety v žaludku, tranzitem mikročástic s postupným uvolňováním přes tenké střevo a do proximálního tlustého střeva. U zdravých dobrovolníků byla provedena zobrazovací studie in vivo, která potvrzuje rychlý rozpad matrice tablety a disperzi mikročástic.
Rychlost absorpce z částicové složky NAPRELAN Tablets s prodlouženým uvolňováním je pomalejší než u běžných tablet sodné soli naproxenu. Právě toto prodloužení procesů absorpce léčiva udržuje plazmatické hladiny a umožňuje dávkování jednou denně.
Účinky jídla
Nebyly pozorovány žádné významné účinky jídla, když byla 24 subjektům podána jedna dávka přípravku NAPRELAN 500 mg tablety 500 mg buď po celonočním hladovění, nebo 30 minut po jídle. Stejně jako u běžných formulací naproxenu a naproxenu sodného způsobuje jídlo po podání přípravku NAPRELAN 250 mg tablety mírné snížení rychlosti absorpce naproxenu.
Rozdělení
Naproxen má distribuční objem 0,16 l/kg. V terapeutických hladinách je naproxen vázán z více než 99 % na albumin. Při dávkách naproxenu vyšších než 500 mg/den dochází k menšímu než proporcionálnímu zvýšení plazmatických hladin v důsledku zvýšení clearance způsobené saturací vazby na plazmatické proteiny při vyšších dávkách. Koncentrace nevázaného naproxenu se však dále zvyšuje úměrně s dávkou. Tablety NAPRELAN vykazují podobné charakteristiky úměrné dávce.
Odstranění
Metabolismus
Naproxen je rozsáhle metabolizován na 6-0-desmethyl naproxen a jak původní, tak metabolity neindukují metabolizující enzymy.
Vylučování
Eliminační poločas přípravku NAPRELAN 500 mg tablety a konvenčního naproxenu je přibližně 15 hodin. Podmínky ustáleného stavu jsou dosaženy po 2 až 3 dávkách tablet NAPRELAN. Většina léčiva se vylučuje močí, primárně jako nezměněný naproxen (méně než 1 %), 6-0-desmethyl naproxen (méně než 1 %) a jejich glukuronid nebo jiné konjugáty (66 až 92 %). Malé množství (
Specifické populace
Pediatrická
S přípravkem NAPRELAN 500 mg tablety nebyly provedeny žádné pediatrické studie, takže bezpečnost přípravku NAPRELAN 500 mg tablety u pediatrické populace nebyla stanovena.
Poškození jater
Chronické alkoholické onemocnění jater a pravděpodobně další onemocnění se sníženými nebo abnormálními plazmatickými proteiny (albumin) snižují celkovou plazmatickou koncentraci naproxenu, ale plazmatická koncentrace nevázaného naproxenu je zvýšená. Pokud jsou vyžadovány vysoké dávky, doporučuje se opatrnost a u těchto pacientů může být nutná určitá úprava dávkování. Je rozumné používat nejnižší účinnou dávku.
Renální poškození
Farmakokinetika naproxenu nebyla stanovena u subjektů s renální insuficiencí. Vzhledem k tomu, že naproxen je metabolizován a konjugáty jsou primárně vylučovány ledvinami, existuje možnost akumulace metabolitů naproxenu v přítomnosti renální insuficience. Eliminace naproxenu je snížena u pacientů s těžkou poruchou funkce ledvin. Přípravky obsahující naproxen se nedoporučují používat u pacientů se středně těžkou až těžkou a těžkou poruchou funkce ledvin (clearance kreatininu VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Studie lékových interakcí
Aspirin
Když byly NSAID podávány s aspirinem, vazba NSAID na proteiny byla snížena, ačkoli clearance volného NSAID se nezměnila. Klinický význam této interakce není znám. Viz tabulka 1 pro klinicky významné lékové interakce NSAID s aspirinem [viz DROGOVÉ INTERAKCE ].
Klinické studie
Revmatoidní artritida
Použití přípravku NAPRELAN 500 mg tablety k léčbě známek a příznaků revmatoidní artritidy bylo hodnoceno ve 12týdenní dvojitě zaslepené, randomizované studii kontrolované placebem a aktivní látkou u 348 pacientů. Dvě tablety NAPRELAN 500 mg (1000 mg) jednou denně a tablety naproxenu 500 mg dvakrát denně (1000 mg) byly účinnější než placebo. Klinická účinnost byla prokázána po jednom týdnu a pokračovala po dobu trvání studie.
Osteoartróza
Použití přípravku NAPRELAN Tablets k léčbě známek a příznaků osteoartrózy kolene bylo hodnoceno ve 12týdenní dvojitě zaslepené studii kontrolované placebem a aktivní látkou u 347 pacientů. Dvě tablety NAPRELAN 500 mg (1 000 mg) jednou denně a tablety naproxenu 500 mg dvakrát denně (1 000 mg) byly účinnější než placebo. Klinická účinnost byla prokázána po jednom týdnu a pokračovala po dobu trvání studie.
Analgezie
Nástup analgetického účinku tablet NAPRELAN byl pozorován během 30 minut ve farmakokinetické/farmakodynamické studii u pacientů s bolestí po orálním chirurgickém výkonu. V kontrolovaných klinických studiích byl naproxen používán v kombinaci se zlatem, D-penicilaminem, methotrexátem a kortikosteroidy. Jeho použití v kombinaci se salicylátem se nedoporučuje, protože existují důkazy, že aspirin zvyšuje rychlost vylučování naproxenu, a údaje nejsou dostatečné k prokázání toho, že naproxen a aspirin produkují větší zlepšení než u samotného aspirinu. Kromě toho, stejně jako u jiných NSAID, může tato kombinace vést k vyšší frekvenci nežádoucích účinků, než bylo prokázáno u každého přípravku samostatně.
Speciální studia
Ve dvojitě zaslepené randomizované studii s paralelními skupinami dostávalo 19 subjektů buď dvě tablety NAPRELAN 500 mg (1 000 mg) jednou denně nebo tablety naproxenu 500 mg (1 000 mg) dvakrát denně po dobu 7 dnů. Skóre slizniční biopsie a endoskopické skóre byly nižší u subjektů, které dostávaly tablety NAPRELAN. V další dvojitě zaslepené, randomizované, zkřížené studii dostávalo 23 subjektů dvě tablety NAPRELAN 500 mg (1 000 mg) jednou denně, tablety naproxenu 500 mg (1 000 mg) dvakrát denně a aspirin 650 mg čtyřikrát denně (2 600 mg) po dobu 7 dnů každý. U tablet NAPRELAN bylo pozorováno významně méně duodenálních erozí než u naproxenu nebo aspirinu. Jak u tablet NAPRELAN, tak u naproxenu bylo pozorováno významně méně žaludečních erozí než u aspirinu. Klinický význam těchto nálezů není znám.
INFORMACE PRO PACIENTA
Průvodce léky pro nesteroidní protizánětlivé léky (NSAID)
Jaké jsou nejdůležitější informace, které bych měl vědět o lécích nazývaných nesteroidní protizánětlivé léky (NSAID)?
NSAID mohou způsobit závažné nežádoucí účinky, včetně:
- Zvýšené riziko srdečního infarktu nebo mrtvice, které mohou vést k smrti. Toto riziko se může objevit na začátku léčby a může se zvýšit:
- se zvyšujícími se dávkami NSAID
- při delším užívání NSAID
Neužívejte NSAID těsně před nebo po operaci srdce nazývané „koronární arteriální bypass (CABG).“ Neužívejte NSAID po nedávném srdečním infarktu, pokud vám to neřekne váš poskytovatel zdravotní péče. Pokud užíváte NSAID po nedávném srdečním infarktu, můžete mít zvýšené riziko dalšího srdečního infarktu.
- Zvýšené riziko krvácení, vředů a trhlin (perforace) jícnu (trubice vedoucí z úst do žaludku), žaludku a střev:
- kdykoliv během používání
- bez varovných příznaků
- které mohou způsobit smrt
Riziko vzniku vředu nebo krvácení se zvyšuje s:
- žaludeční vředy nebo krvácení do žaludku nebo střev při užívání NSAID v minulosti
- užívání léků nazývaných „kortikosteroidy“, „antikoagulancia“, „SSRI“ nebo „SNRI“
- zvyšující se dávky NSAID
- vyšší věk
- delší užívání NSAID
- špatný zdravotní stav
- kouření
- pokročilé onemocnění jater
- pití alkoholu
- problémy s krvácením
NSAID by se měly používat pouze:
- přesně podle předpisu
- v nejnižší možné dávce pro vaši léčbu
- na co nejkratší potřebnou dobu
Co jsou NSAID?
NSAID se používají k léčbě bolesti a zarudnutí, otoku a tepla (zánětu) ze zdravotních stavů, jako jsou různé typy artritidy, menstruační křeče a jiné typy krátkodobé bolesti.
Kdo by neměl užívat NSAID?
Neužívejte NSAID:
- jestliže jste měl(a) astmatický záchvat, kopřivku nebo jinou alergickou reakci na aspirin nebo jiné NSAID.
- těsně před nebo po operaci bypassu srdce.
Než začnete užívat NSAID, informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- máte problémy s játry nebo ledvinami
- mají vysoký krevní tlak
- mít astma
- jste těhotná nebo plánujete otěhotnět. Užívání NSAID přibližně ve 20. týdnu těhotenství nebo později může poškodit vaše nenarozené dítě. Pokud potřebujete užívat NSAID déle než 2 dny, když jste mezi 20. a 30. týdnem těhotenství, váš poskytovatel zdravotní péče možná bude muset sledovat množství tekutiny ve vaší děloze kolem vašeho dítěte. Neměli byste brát NSAID asi po 30 týdnech těhotenství.
- kojíte nebo plánujete kojit.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis nebo volně prodejných léků, vitamínů nebo bylinných doplňků. NSAID a některé další léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky. Nezačínejte užívat žádný nový lék, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče.
Jaké jsou možné vedlejší účinky NSAID?
NSAID mohou způsobit závažné nežádoucí účinky, včetně:
Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o lécích nazývaných nesteroidní protizánětlivé léky (NSAID)?
- nový nebo horší vysoký krevní tlak
- srdeční selhání
- problémy s játry včetně selhání jater
- problémy s ledvinami včetně selhání ledvin
- nízký počet červených krvinek (anémie)
- život ohrožující kožní reakce
- život ohrožující alergické reakce
Mezi další nežádoucí účinky NSAID patří: bolest žaludku, zácpa, průjem, plynatost, pálení žáhy, nevolnost, zvracení a závratě.
Pokud se u vás objeví některý z následujících příznaků, okamžitě vyhledejte pomoc v nouzi:
- dušnost nebo potíže s dýcháním
- nezřetelná řeč
- bolest na hrudi
- otok obličeje nebo hrdla
- slabost v jedné části nebo straně vašeho těla
Přestaňte užívat NSAID a okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u Vás objeví některý z následujících příznaků:
- nevolnost
- zvracet krev
- unavenější nebo slabší než obvykle
- máte krev ve střevech nebo je černá a lepkavá jako dehet
- průjem
- svědění
- neobvyklý nárůst hmotnosti
- vaše kůže nebo oči vypadají žlutě
- kožní vyrážka nebo puchýře s horečkou
- poruchy trávení nebo bolesti žaludku
- otoky paží, nohou, rukou a chodidel
- příznaky podobné chřipce
Pokud užijete příliš mnoho NSAID, zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc.
To nejsou všechny možné vedlejší účinky NSAID. Další informace o NSAID získáte u svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Další informace o NSAID
- Aspirin je NSAID, ale nezvyšuje riziko srdečního infarktu. Aspirin může způsobit krvácení do mozku, žaludku a střev. Aspirin může také způsobit vředy v žaludku a střevech.
- Některá NSA se prodávají v nižších dávkách bez lékařského předpisu (volně prodejné). Poraďte se se svým poskytovatelem zdravotní péče před používáním volně prodejných NSAID po dobu delší než 10 dní.
Obecné informace o bezpečném a účinném užívání NSAID
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte NSAID pro stav, pro který nebyly předepsány. Nedávejte NSAID jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Pokud byste chtěli více informací o NSAID, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o NSAID, které jsou určeny pro zdravotníky.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
