Léčba bolesti: Lioresal 10mg, 25mg Baclofen Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je přípravek Lioresal 10 mg intratekálně a jak se používá?
Lioresal Intrathecal je lék na předpis používaný k léčbě příznaků spasticity. Lioresal Intrathecal lze používat samostatně nebo s jinými léky.
Lioresal Intrathecal patří do třídy léků nazývaných relaxanty kosterního svalstva.
Není známo, zda je přípravek Lioresal Intrathecal bezpečný a účinný u dětí mladších 12 let.
Jaké jsou možné vedlejší účinky přípravku Lioresal 25 mg intratekálně?
Lioresal 10 mg intratekálně může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- těžká ospalost,
- slabé nebo mělké dýchání,
- zmatek,
- halucinace,
- svědění, brnění nebo škubání v rukou, pažích, chodidlech nebo nohou,
- horečka a
- záchvat
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Lioresal 25 mg intratekálně patří:
- ospalost,
- závrať,
- slabost,
- únava,
- bolest hlavy,
- problémy se spánkem (nespavost),
- nevolnost,
- zácpa a
- močí častěji než obvykle
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Lioresal Intrathecal. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Náhlé vysazení intratekálního baklofenu bez ohledu na příčinu vedlo k následkům, které zahrnují vysokou horečku, změněný mentální stav, přehnanou odrazovou spasticitu a svalovou rigiditu, která ve vzácných případech pokročila k rhabdomyolýze, mnohočetnému selhání orgánových systémů a smrti.
Prevence náhlého vysazení intratekálního baklofenu vyžaduje pečlivou pozornost věnovanou programování a monitorování infuzního systému, plánování doplňování a postupům a alarmům pumpy. Pacienti a ošetřovatelé by měli být poučeni o důležitosti dodržování plánovaných návštěv pro doplňování a měli by být poučeni o časných příznacích vysazení baklofenu. Zvláštní pozornost by měla být věnována pacientům se zjevným rizikem (např. poranění míchy v T-6 nebo vyšší, komunikační potíže, anamnéza abstinenčních příznaků po perorálním nebo intratekálním baklofenu). Další informace o lékaři a pacientovi po implantaci naleznete v technické příručce implantabilního infuzního systému (viz VAROVÁNÍ ).
POPIS
LIORESAL INTRATHECAL (injekce baklofenu) je svalový relaxant a antispastikum. Její chemický název je kyselina 4-amino-3-(4-chlorfenyl) butanová a její strukturní vzorec je:
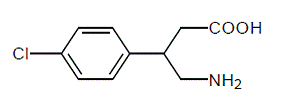
Baclofen je bílý až téměř bílý krystalický prášek bez zápachu nebo prakticky bez zápachu s molekulovou hmotností 213,66. Je málo rozpustný ve vodě, velmi málo rozpustný v methanolu a nerozpustný v chloroformu.
LIORESAL INTRATHECAL je sterilní, apyrogenní, izotonický roztok bez antioxidantů, konzervačních látek nebo jiných potenciálně neurotoxických aditiv určený pouze k intratekálnímu podání. Lék je stabilní v roztoku při 37 °C a kompatibilní s CSF. Každý mililitr LIORESAL INTRATHECAL obsahuje baklofen USP 50 mcg, 500 mcg nebo 2000 mcg a chlorid sodný 9 mg ve vodě na injekci; Rozsah pH je 5,0 - 7,0. Každá ampule je určena POUZE K JEDNORÁZOVÉMU POUŽITÍ. Veškerou nepoužitou část zlikvidujte. NEPOUŽÍVEJTE AUTOKLÁVU.
INDIKACE
LIORESAL 10 mg INTRATHECAL (injekce baklofenu) je indikován k použití při léčbě těžké spasticity. Pacienti by měli nejprve reagovat na screeningovou dávku intratekálního baklofenu před zvážením dlouhodobé infuze prostřednictvím implantabilní pumpy. Pro spasticitu míšního původu by měla být chronická infuze LIORESAL INTRATHECAL prostřednictvím implantabilní pumpy vyhrazena pro pacienty, kteří nereagují na perorální léčbu baklofenem, nebo pro ty, kteří mají při účinných dávkách netolerovatelné nežádoucí účinky na CNS. Pacienti se spasticitou způsobenou traumatickým poraněním mozku by měli počkat alespoň jeden rok po poranění, než zváží dlouhodobou intratekální léčbu baklofenem. LIORESAL INTRATHECAL je určen k použití intratekální cestou v jednotlivých bolusových testovacích dávkách (prostřednictvím spinálního katétru nebo lumbální punkce) a pro chronické použití pouze v implantovatelných pumpách schválených FDA speciálně pro podávání LIORESAL INTRATHECAL do intratekálního prostoru.
Spasticita Míšního Původu
Důkazy podporující účinnost přípravku LIORESAL INTRATHECAL byly získány v randomizovaných, kontrolovaných výzkumech, které porovnávaly účinky buď jedné intratekální dávky nebo třídenní intratekální infuze přípravku LIORESAL INTRATHECAL s placebem u pacientů s těžkou spasticitou a křečemi způsobenými buď poraněním míchy nebo mnohočetným skleróza. LIORESAL 10 mg INTRATHECAL byl lepší než placebo v obou hlavních použitých ukazatelích výsledku: změna od výchozí hodnoty v Ashworthově hodnocení spasticity a frekvence křečí.
Spasticita Cerebrálního Původu
Účinnost přípravku LIORESAL INTRATHECAL byla zkoumána ve třech kontrolovaných klinických studiích; dva zařazeni pacienti s dětskou mozkovou obrnou a jeden zařazený pacient se spasticitou v důsledku předchozího poranění mozku. První studie, randomizovaná kontrolovaná zkřížená studie s 51 pacienty s dětskou mozkovou obrnou, poskytla silné, statisticky významné výsledky; LIORESAL INTRATHECAL byl lepší než placebo ve snížení spasticity měřené pomocí Ashworthovy škály. Druhá zkřížená studie byla provedena u 11 pacientů se spasticitou způsobenou poraněním mozku. Navzdory malé velikosti vzorku poskytla studie téměř významnou testovou statistiku (p= 0,066) a poskytla směrově příznivé výsledky. Poslední studie však neposkytla data, která by bylo možné spolehlivě analyzovat.
Léčbu LIORESAL 10 mg INTRATHECAL lze považovat za alternativu k destruktivním neurochirurgickým postupům. Před implantací zařízení pro chronickou intratekální infuzi LIORESAL 10 mg INTRATHECAL musí pacienti ve screeningové studii vykázat odpověď na LIORESAL 10 mg INTRATHECAL (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
DÁVKOVÁNÍ A PODÁVÁNÍ
Specifické pokyny a bezpečnostní opatření pro programování pumpy a/nebo doplňování rezervoáru naleznete v příručce výrobce implantovatelné pumpy schválené pro intratekální infuzi. Existují různé pumpy s různým objemem nádržky a k dispozici jsou různé doplňovací sady. Je důležité znát všechny tyto produkty, abyste mohli vybrat vhodnou doplňovací sadu pro konkrétní používané čerpadlo.
Screeningová fáze
Před implantací pumpy a zahájením chronické infuze LIORESAL INTRATHECAL (injekce baklofenu) musí pacienti prokázat pozitivní klinickou odpověď na bolusovou dávku LIORESAL INTRATHECAL podanou intratekálně ve screeningové studii. Screeningová studie využívá LIORESAL INTRATHECAL v koncentraci 50 mcg/ml. Pro použití ve screeningové studii je k dispozici 1 ml ampule (50 mcg/ml). Postup screeningu je následující. Počáteční bolus obsahující 50 mikrogramů v objemu 1 mililitr se podá do intratekálního prostoru barbotáží po dobu ne kratší než jednu minutu. Pacient je sledován během následujících 4 až 8 hodin. Pozitivní odpověď spočívá ve významném snížení svalového tonu a/nebo frekvence a/nebo závažnosti křečí. Pokud je počáteční odpověď nižší, než je žádoucí, může být podána druhá bolusová injekce 24 hodin po první. Druhá screeningová bolusová dávka se skládá ze 75 mikrogramů v 1,5 mililitrech. Pacient by měl být opět sledován v intervalu 4 až 8 hodin. Pokud je odpověď stále nedostatečná, lze o 24 hodin později podat konečnou bolusovou screeningovou dávku 100 mikrogramů ve 2 mililitrech.
Pediatričtí pacienti
Počáteční screeningová dávka pro dětské pacienty je stejná jako u dospělých pacientů, tj. 50 mcg. U velmi malých pacientů však může být nejprve vyzkoušena screeningová dávka 25 mcg. Pacienti, kteří nereagují na intratekální bolus 100 mcg, by neměli být považováni za kandidáty na implantovanou pumpu pro chronickou infuzi.
Období titrace dávky po implantaci
Ke stanovení počáteční celkové denní dávky LIORESAL INTRATHECAL po implantaci by měla být screeningová dávka, která poskytla pozitivní účinek, zdvojnásobena a podávána po dobu 24 hodin, pokud účinnost bolusové dávky nebyla udržována déle než 8 hodin, kdy V tomto případě by počáteční denní dávkou měla být screeningová dávka podávaná během 24 hodin. Během prvních 24 hodin (tj. dokud není dosaženo ustáleného stavu) by se dávka neměla zvyšovat.
Dospělí pacienti se spasticitou míšního původu
Po prvních 24 hodinách by se u dospělých pacientů měla denní dávka pomalu zvyšovat o 10–30 % a pouze jednou za 24 hodin, dokud není dosaženo požadovaného klinického účinku.
Dospělí pacienti se spasticitou cerebrálního původu
Po prvních 24 hodinách by se měla denní dávka pomalu zvyšovat o 5–15 % pouze jednou za 24 hodin, dokud není dosaženo požadovaného klinického účinku.
Pediatričtí pacienti
Po prvních 24 hodinách by se měla denní dávka pomalu zvyšovat o 5–15 % pouze jednou za 24 hodin, dokud není dosaženo požadovaného klinického účinku. Pokud nedojde k podstatné klinické odpovědi na zvýšení denní dávky, zkontrolujte správnou funkci pumpy a průchodnost katétru. Pacienti musí být během fáze screeningu a období titrace dávky bezprostředně po implantaci pečlivě sledováni v plně vybaveném prostředí s personálem. V případě život ohrožujících nebo nesnesitelných vedlejších účinků by mělo být okamžitě k dispozici resuscitační vybavení.
Udržovací terapie
Spasticita pacientů s míšním původem
Klinickým cílem je udržet svalový tonus co nejblíže normálu a minimalizovat frekvenci a závažnost křečí v co největší míře, aniž by to vyvolalo netolerovatelné vedlejší účinky. Velmi často je třeba upravit udržovací dávku během prvních měsíců léčby, zatímco se pacienti přizpůsobují změnám životního stylu v důsledku zmírnění spasticity. Během periodického doplňování pumpy může být denní dávka zvýšena o 10-40%, ale ne více než 40%, aby se udržela adekvátní kontrola symptomů. Pokud se u pacientů objeví nežádoucí účinky, může být denní dávka snížena o 10–20 %. Většina pacientů vyžaduje postupné zvyšování dávky v průběhu času k udržení optimální odpovědi během chronické terapie. Náhlý velký požadavek na eskalaci dávky naznačuje komplikaci katétru (tj. zalomení nebo uvolnění katétru).
Udržovací dávka pro dlouhodobou kontinuální infuzi přípravku LIORESAL 10 mg INTRATHECAL (injekce baklofenu) se pohybovala od 12 mcg/den do 2003 mcg/den, přičemž většina pacientů byla adekvátně udržována na 300 mikrogramech až 800 mikrogramech denně. S denními dávkami vyššími než 1000 mcg/den jsou omezené zkušenosti. Stanovení optimální dávky LIORESAL INTRATHECAL vyžaduje individuální titraci. Měla by být použita nejnižší dávka s optimální odpovědí.
Spasticita pacientů cerebrálního původu
Klinickým cílem je udržet svalový tonus co nejblíže normálu a minimalizovat frekvenci a závažnost křečí v co největší míře, aniž by to vyvolalo netolerovatelné vedlejší účinky, nebo titrovat dávku na požadovaný stupeň svalového tonu pro optimální funkce. Velmi často je třeba upravit udržovací dávku během prvních měsíců léčby, zatímco se pacienti přizpůsobují změnám životního stylu v důsledku zmírnění spasticity. Během periodického doplňování pumpy může být denní dávka zvýšena o 5-20 %, ale ne více než o 20 %, aby se udržela adekvátní kontrola symptomů. Pokud se u pacientů objeví nežádoucí účinky, může být denní dávka snížena o 10–20 %. Mnoho pacientů vyžaduje postupné zvyšování dávky v průběhu času k udržení optimální odpovědi během chronické terapie. Náhlý velký požadavek na eskalaci dávky naznačuje komplikaci katétru (tj. zalomení nebo uvolnění katétru).
Udržovací dávka pro dlouhodobou kontinuální infuzi přípravku LIORESAL 25 mg INTRATHECAL (injekce baklofenu) se pohybovala od 22 mcg/den do 1400 mcg/den, přičemž většina pacientů byla adekvátně udržována na 90 až 703 mikrogramech denně. V klinických studiích pouze 3 ze 150 pacientů vyžadovali denní dávky vyšší než 1000 mcg/den.
Pediatričtí pacienti
U pacientů se spasticitou cerebrálního původu použijte stejná doporučení pro dávkování. Pediatričtí pacienti do 12 let v klinických studiích zřejmě vyžadovali nižší denní dávku. Průměrná denní dávka pro pacienty do 12 let byla 274 mcg/den, v rozmezí 24 až 1199 mcg/den. Nezdá se, že by se požadavek na dávkování u pediatrických pacientů starších 12 let nelišil od požadavků u dospělých pacientů. Stanovení optimální dávky LIORESAL INTRATHECAL vyžaduje individuální titraci. Měla by být použita nejnižší dávka s optimální odpovědí.
Potenciální potřeba úpravy dávky při chronickém používání
Během dlouhodobé léčby se přibližně 5 % (28/627) pacientů stane odolných vůči zvyšujícím se dávkám. Není dostatek zkušeností, aby bylo možné učinit pevná doporučení pro toleranční léčbu; tato „tolerance“ však byla příležitostně léčena v nemocnici „drogovou dovolenou“ spočívající v postupném snižování dávky LIORESAL 25 mg INTRATHECAL během 2 až 4 týdnů a přechodu na alternativní metody léčby spasticity. Po „drogové dovolené“ může být přípravek LIORESAL INTRATHECAL znovu zahájen v počáteční kontinuální infuzní dávce.
Stabilita
Parenterální léčivé přípravky by měly být před podáním zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a nádoba dovolí.
Specifikace dodávky
Konkrétní koncentrace, která by měla být použita, závisí na celkové požadované denní dávce a také na rychlosti podávání pumpou. LIORESAL 10 mg INTRATHECAL může vyžadovat naředění při použití s určitými implantovatelnými pumpami. Konkrétní doporučení naleznete v příručce výrobce.
Návod na přípravu
Promítání
Použijte pouze 1 ml screeningovou ampuli (50 mcg/ml) pro bolusovou injekci do subarachnoidálního prostoru. Pro bolusovou dávku 50 mcg použijte 1 ml screeningové ampule. Použijte 1,5 ml 50 mcg/ml injekce baklofenu pro bolusovou dávku 75 mcg. Pro maximální screeningovou dávku 100 mcg použijte 2 ml 50 mcg/ml injekce baklofenu (2 screeningové ampule).
Údržba
Pro pacienty, kteří vyžadují jiné koncentrace než 500 mcg/ml nebo 2000 mcg/ml, LIORESAL INTRATHECAL musí být zředěn .
LIORESAL 10 mg INTRATHEKÁLNÍ musí být zředěn se sterilním chloridem sodným pro injekci bez konzervačních látek, USP
Doručovací režim
LIORESAL 10 mg INTRATHECAL se nejčastěji podává v režimu kontinuální infuze bezprostředně po implantaci. U pacientů s implantovanými programovatelnými pumpami, kteří dosáhli relativně uspokojivé kontroly při kontinuální infuzi, lze dalšího přínosu dosáhnout použitím složitějších schémat podávání LIORESAL INTRATHECAL. Například pacienti, kteří mají v noci zvýšené křeče, mohou vyžadovat 20% zvýšení jejich hodinové rychlosti infuze. Změny průtoku by měly být naprogramovány tak, aby začaly dvě hodiny před časem požadovaného klinického účinku.
JAK DODÁVÁNO
LIORESAL INTRATHECAL (injekce baklofenu) je balen v ampulích na jedno použití obsahující 0,05 mg/1 ml (50 mcg/ml), 10 mg/20 ml (500 mcg/ml), 10 mg/5 ml (2000 mcg/ml) nebo 40 mg/20 ml ( 2000 mcg/ml) dodávané takto:
Screeningová dávka (model 8563s): pět ampulí, z nichž každá obsahuje 0,05 mg/1 ml (50 mcg/ml) ( NDC 70257-562-55).
LIORESAL INTRATHECAL (injekce baklofenu) Doplňovací sady Každá doplňovací sada obsahuje uvedené množství LIORESAL INTRATHECAL, sadu pro přípravu léčiva, sadu pro plnění pumpy s příslušenstvím, které je kompatibilní s infuzními systémy Medtronic SynchroMed®, a související pokyny.
Model 8561 : jedna ampule obsahující 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-01).
Model 8562 : dvě ampule, každá obsahuje 10 mg/5 ml (2000 mcg/ml) ( NDC 70257-561-02).
Model 8564 : jedna ampule obsahující 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-01).
Model 8565 : dvě ampule, každá obsahuje 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-02).
Model 8566 : dvě ampule, každá obsahuje 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-02).
Úložný prostor
Nevyžaduje chlazení.
Neuchovávejte při teplotě nad 86° F (30° C).
Chraňte před mrazem.
Nesterilizujte teplem.
Distribuuje: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Revize: leden 2019
VEDLEJŠÍ EFEKTY
Spasticita původu míchy - klinické studie
Běžně pozorované u pacientů se spasticitou míšního původu
V klinických studiích před a po uvedení na trh byly nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním přípravku LIORESAL 25 mg INTRATHECAL (injekce baklofenu), které nebyly pozorovány s ekvivalentní incidencí u pacientů léčených placebem,: ospalost, závratě, nauzea, hypotenze, bolest hlavy, křeče a hypotonie.
Souvisí s přerušením léčby
8/474 pacientů se spasticitou míšního původu, kteří dostávali dlouhodobou infuzi přípravku LIORESAL 25 mg INTRATHECAL v klinických studiích před a po uvedení na trh v USA, přerušilo léčbu kvůli nežádoucím účinkům. Patří sem: infekce kapsy pumpy (3), meningitida (2), dehiscence rány (1), gynekologické myomy (1) a přetlak pumpy (1) s neznámými, pokud vůbec nějakými následky. U 11 pacientů, u kterých se v důsledku předávkování vyvinulo kóma, byla léčba dočasně přerušena, ale všichni byli následně znovu zahájeni, a proto nebyli považováni za skutečné přerušení.
Smrtelné případy
Vidět VAROVÁNÍ .
Výskyt v řízených zkouškách
Zkušenosti s LIORESAL INTRATHECAL (injekce baklofenu) získané v paralelních, placebem kontrolovaných, randomizovaných studiích poskytují pouze omezený základ pro odhad výskytu nežádoucích účinků, protože studie trvaly velmi krátce (do tří dnů infuze) a zahrnovaly pouze celkem 63 pacientů. Následující příhody se vyskytly mezi 31 pacienty, kteří dostávali LIORESAL INTRATHECAL (injekce baklofenu) ve dvou randomizovaných, placebem kontrolovaných studiích: hypotenze (2), závratě (2), bolest hlavy (2), dušnost (1). U 32 pacientů užívajících placebo v těchto studiích nebyly hlášeny žádné nežádoucí účinky.
Události pozorované během hodnocení před a po uvedení přípravku LIORESAL INTRATHECAL na trh
Nežádoucí účinky spojené s užíváním přípravku LIORESAL 25 mg INTRATHECAL odrážejí zkušenosti získané u 576 pacientů prospektivně sledovaných ve Spojených státech. Dostávali LIORESAL INTRATHECAL po dobu jednoho dne (screening) (N = 576) až po více než osm let (udržování) (N = 10). Obvyklá screeningová bolusová dávka podávaná před implantací pumpy v těchto studiích byla typicky 50 mcg. Udržovací dávka se pohybovala od 12 mcg do 2003 mcg denně. Vzhledem k otevřené, nekontrolované povaze zážitku nelze v mnoha případech spolehlivě posoudit příčinnou souvislost mezi pozorovanými příhodami a podáním přípravku LIORESAL INTRATHECAL a je známo, že mnoho hlášených nežádoucích příhod se vyskytuje v souvislosti se základním léčeným onemocněním. Nicméně mnohé z častěji hlášených reakcí – hypotonie, ospalost, závratě, parestézie, nauzea/zvracení a bolest hlavy – zjevně souvisejí s drogou.
Nežádoucí účinky hlášené během všech studií v USA (kontrolovaných i nekontrolovaných) jsou uvedeny v následující tabulce. Osm ze 474 pacientů, kteří dostávali chronickou infuzi prostřednictvím implantovaných pump, mělo nežádoucí účinky, které vedly k přerušení dlouhodobé léčby v pre- a postmarketingových studiích.
VÝSKYT NEJČASTĚJŠÍCH (≥1 %) NEŽÁDOUCÍCH PŘÍHODŮ U PACIENTŮ SE SPASTICITOU MÁŠNÍHO PŮVODU V PROSPEKTIVNĚ MONITOROVANÝCH KLINICKÝCH STUDIECH
Kromě častějších (1 % nebo více) nežádoucích příhod hlášených u prospektivně sledovaných 576 domácích pacientů v pre- a postmarketingových studiích mají zkušenosti od dalších 194 pacientů vystavených LIORESAL 25 mg INTRATHECAL (injekce baklofenu) ze zahraničních studií bylo hlášeno. Byly hlášeny následující nežádoucí účinky, které nejsou popsány v tabulce a jsou řazeny sestupně podle frekvence a klasifikovány podle tělesného systému:
Nervový systém: Abnormální chůze, abnormální myšlení, třes, amnézie, záškuby, vazodilitace, cerebrovaskulární příhoda, nystagmus, porucha osobnosti, psychotická deprese, cerebrální ischemie, emoční labilita, euforie, hypertonie, ileus, drogová závislost, nekoordinace, paranoidní reakce a ptóza.
Zažívací ústrojí: Plynatost, dysfagie, dyspepsie a gastroenteritida.
Kardiovaskulární: Posturální hypotenze, bradykardie, palpitace, synkopa, ventrikulární arytmie, hluboká tromboflebitida, bledost a tachykardie.
Respirační: Porucha dýchání, aspirační pneumonie, hyperventilace, plicní embolie a rýma.
Urogenitální: Hematurie a selhání ledvin.
Kůže a přílohy: Alopecie a pocení.
Poruchy metabolismu a výživy: Hubnutí, albuminurie, dehydratace a hyperglykémie.
Speciální smysly: Abnormální vidění, abnormalita akomodace, fotofobie, ztráta chuti a tinitus.
Tělo jako celek: Sebevražda, nedostatečný účinek léku, bolest břicha, hypotermie, ztuhlost krku, bolest na hrudi, zimnice, edém obličeje, chřipkový syndrom a předávkování.
Hemický a lymfatický systém: Anémie.
Spasticita cerebrálního původu - Klinické studie
Běžně pozorované
V klinických studiích před uvedením na trh patřily mezi nejčastěji pozorované nežádoucí příhody spojené s užíváním přípravku LIORESAL 25 mg INTRATHECAL (injekce baklofenu), které nebyly pozorovány s ekvivalentní incidencí u pacientů léčených placebem: agitovanost, zácpa, somnolence, leukocytóza, zimnice, močový retence a hypotonie.
Souvisí s přerušením léčby
Devět z 211 pacientů užívajících přípravek LIORESAL INTRATHECAL v klinických studiích před uvedením přípravku na trh v USA přerušilo dlouhodobou infuzi kvůli nežádoucím účinkům spojeným s intratekální terapií.
Devět nežádoucích účinků, které vedly k přerušení léčby, bylo: infekce (3), úniky CSF (2), meningitida (2), drenáž (1) a nezvladatelná kontrola trupu (1).
Smrtelné případy
U pacientů v klinických studiích zahrnujících pacienty se spasticitou cerebrálního původu byla hlášena tři úmrtí, z nichž žádné nebylo připisováno přípravku LIORESAL 10 mg INTRATHECAL. Vidět Upozornění na další úmrtí hlášená u pacientů se spinální spasticitou .
Výskyt v řízených zkouškách
Zkušenosti s LIORESAL INTRATHECAL (injekce baklofenu) získané v paralelních, placebem kontrolovaných, randomizovaných studiích poskytují pouze omezený základ pro odhad výskytu nežádoucích účinků, protože studie zahrnovaly celkem 62 pacientů vystavených jedinému intratekálnímu bolusu 50 mcg. Následující příhody se vyskytly u 62 pacientů užívajících LIORESAL 10 mg INTRATHECAL ve dvou randomizovaných, placebem kontrolovaných studiích zahrnujících pacienty s dětskou mozkovou obrnou a pacienty s poraněním hlavy: agitovanost, zácpa, ospalost, leukocytóza, nauzea, zvracení, nystagmus, zimnice, retence moči a hypotonie.
Události pozorované během hodnocení před uvedením přípravku LIORESAL 25 mg INTRATHECAL na trh
Nežádoucí účinky spojené s užíváním LIORESAL INTRATHECAL odrážejí zkušenosti získané u celkem 211 amerických pacientů se spasticitou mozkového původu, z nichž 112 byli dětští pacienti (ve věku do 16 let při zařazení). Lék LIORESAL INTRATHECAL dostávali po dobu jednoho dne (screening) (N= 211) až 84 měsíců (udržovací léčba) (N= 1). Obvyklá screeningová bolusová dávka podávaná před implantací pumpy v těchto studiích byla 50-75 mcg. Udržovací dávka se pohybovala od 22 mcg do 1400 mcg denně. Dávky používané u této populace pacientů pro dlouhodobou infuzi jsou obecně nižší než dávky požadované u pacientů se spasticitou míšního původu.
Kvůli otevřené, nekontrolované povaze zážitku nelze v mnoha případech spolehlivě posoudit příčinnou souvislost mezi pozorovanými událostmi a podáním přípravku LIORESAL INTRATHECAL. Nicméně mnohé z častěji hlášených reakcí – ospalost, závratě, bolest hlavy, nauzea, hypotenze, hypotonie a kóma – zjevně souvisejí s drogou.
Nejčastější (≥1 %) nežádoucí příhody hlášené během všech klinických studií jsou uvedeny v následující tabulce. Devět pacientů přerušilo dlouhodobou léčbu kvůli nežádoucím účinkům.
VÝSKYT NEJČASTĚJŠÍCH (≥ 1 %) NEŽÁDOUCÍCH UDÁLOSTÍ U PACIENTŮ SE SPASTICITOU MOZKOVÉHO PŮVODU V PROSPEKTIVNĚ MONITOROVANÝCH KLINICKÝCH STUDIECH
Byly hlášeny častější (1 % nebo více) nežádoucí účinky hlášené u prospektivně sledovaných 211 pacientů vystavených přípravku LIORESAL 25 mg INTRATHECAL (injekce baklofenu). V celkové kohortě byly hlášeny následující nežádoucí příhody, které nejsou popsány v tabulce a jsou seřazeny podle klesající frekvence a klasifikované podle tělesného systému:
Nervový systém: Akatizie, ataxie, zmatenost, deprese, opistotonos, amnézie, úzkost, halucinace, hysterie, nespavost, nystagmus, porucha osobnosti, snížené reflexy a vazodilitace.
Zažívací ústrojí: Dysfagie, fekální inkontinence, gastrointestinální krvácení a porucha jazyka.
Kardiovaskulární: Bradykardie.
Respirační: Apnoe, dušnost a hyperventilace.
Urogenitální: Abnormální ejakulace, ledvinový kámen, oligurie a vaginitida.
Kůže a přílohy: Vyrážka, pocení, alopecie, kontaktní dermatitida a kožní vředy.
Speciální smysly: Abnormalita ubytování.
Tělo jako celek: Smrt, horečka, bolesti břicha, karcinom, malátnost a podchlazení.
Hemický a lymfatický systém: Leukocytóza a petechiální vyrážka.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly hlášeny během používání přípravku LIORESAL INTRATHECAL po schválení. Protože jsou tyto události hlášeny dobrovolně z populace nejisté velikosti, není možné spolehlivě odhadnout jejich četnost.
Muskuloskeletální
Byl hlášen vznik skoliózy nebo zhoršení již existující skoliózy.
Urogenitální
Byly hlášeny sexuální dysfunkce u mužů a žen, včetně sníženého libida a dysfunkce orgasmu. Rovněž byla hlášena erektilní dysfunkce u mužů. Po vysazení baklofenu byl hlášen priapismus.
DROGOVÉ INTERAKCE
Neexistují dostatečné systematické zkušenosti s používáním přípravku LIORESAL INTRATHECAL v kombinaci s jinými léky k predikci specifických lékových interakcí. Interakce připisované kombinovanému použití přípravku LIORESAL INTRATHECAL a epidurálního morfinu zahrnují hypotenzi a dušnost.
VAROVÁNÍ
LIORESAL INTRATHECAL je určen k použití v jednotlivých bolusových intratekálních injekcích (prostřednictvím katétru umístěného v lumbálním intratekálním prostoru nebo injekcí lumbální punkcí) a v implantovatelných pumpách schválených FDA speciálně pro intratekální podávání baklofenu. Vzhledem k možnosti potenciálně život ohrožujícího útlumu CNS, kardiovaskulárního kolapsu a/nebo respiračního selhání musí být lékaři adekvátně vyškoleni a edukováni v chronické intratekální infuzní terapii.
Pumpový systém by neměl být implantován, dokud nebude adekvátně vyhodnocena odpověď pacienta na bolusovou injekci LIORESAL 10 mg INTRATHECAL. Vyhodnocení (sestávající ze screeningového postupu: viz DÁVKOVÁNÍ A PODÁVÁNÍ vyžaduje, aby byl přípravek LIORESAL 25 mg INTRATHECAL podáván do intratekálního prostoru katetrem nebo lumbální punkcí. Kvůli rizikům spojeným se screeningovým postupem a úpravou dávkování po implantaci pumpy musí být tyto fáze prováděny v prostředí s lékařským dohledem a přiměřeně vybaveném podle pokynů uvedených v části Dávkování a podávání.
Mělo by být k dispozici resuscitační zařízení.
Po chirurgické implantaci pumpy, zejména během počátečních fází používání pumpy, by měl být pacient pečlivě sledován, dokud si není jisté, že odpověď pacienta na infuzi je přijatelná a přiměřeně stabilní.
Při každé příležitosti, kdy je upravena rychlost dávkování pumpy a/nebo koncentrace LIORESAL INTRATHECAL (injekce baklofenu) v zásobníku, je nutné pečlivé lékařské sledování, dokud není jisté, že odpověď pacienta na infuzi je přijatelná a přiměřeně stabilní.
Je povinné, aby pacient, všichni pečovatelé o pacienta a lékaři odpovědní za pacienta obdrželi adekvátní informace o rizicích tohoto způsobu léčby. Veškerý zdravotnický personál a ošetřovatelé by měli být poučeni o 1) známkách a příznacích předávkování, 2) postupech, které je třeba dodržovat v případě předávkování, a 3) řádné domácí péči o pumpu a místo zavedení.
Předávkovat
Příznaky předávkování se mohou objevit náhle nebo zákeřně. Akutní masivní předávkování se může projevit jako kóma. Méně náhlé a/nebo méně závažné formy předávkování se mohou projevit známkami ospalosti, točení hlavy, závratí, ospalosti, respirační deprese, záchvatů, rostrální progrese hypotonie a ztráty vědomí progredující do kómatu. Pokud se zdá pravděpodobné předávkování, pacient by měl být okamžitě převezen do nemocnice k posouzení a vyprázdnění zásobníku pumpy. V dosud hlášených případech předávkování obecně souviselo s poruchou pumpy, neúmyslnou subkutánní injekcí nebo chybou v dávkování. (Vidět Příznaky a léčba předávkování drogami .)
Při plnění implantabilní pumpy schválené FDA je třeba postupovat mimořádně opatrně. Taková čerpadla by měla být doplňována pouze přes přepážku pro doplňování zásobníku. K neúmyslné injekci do podkožní tkáně může dojít, pokud není správně přístupná přepážka pro doplňování zásobníku. Některé pumpy jsou také vybaveny přístupovým portem katetru, který umožňuje přímý přístup k intratekálnímu katetru. Přímá injekce do tohoto přístupového portu katetru nebo neúmyslná injekce do podkožní tkáně může způsobit život ohrožující předávkování.
Vybrání
Náhlé vysazení intratekálního baklofenu bez ohledu na příčinu vedlo k následkům, které zahrnovaly vysokou horečku, změněný mentální stav, přehnanou odrazovou spasticitu a svalovou rigiditu, která ve vzácných případech progredovala do rhabdomyolýzy, vícečetné selhání orgánových systémů a smrt. Během prvních 9 let po uvedení přípravku na trh bylo hlášeno 27 případů vysazení dočasně souvisejících s ukončením léčby baklofenem; šest pacientů zemřelo. Ve většině případů se abstinenční příznaky objevily během hodin až několika dnů po přerušení léčby baklofenem. Mezi běžné důvody pro náhlé přerušení intratekální baklofenové terapie patřila porucha katétru (zejména odpojení), nízký objem v zásobníku pumpy a konec životnosti baterie pumpy; lidská chyba mohla v některých případech hrát kauzální nebo přispívající roli. Byly také hlášeny případy intratekální hmoty na špičce implantovaného katétru vedoucí k abstinenčním příznakům, většina z nich zahrnovala lékárenské směsi analgetik (viz OPATŘENÍ ).
Prevence náhlého vysazení intratekálního baklofenu vyžaduje pečlivou pozornost věnovanou programování a monitorování infuzního systému, plánování doplňování a postupům a alarmům pumpy. Pacienti a ošetřovatelé by měli být poučeni o důležitosti dodržování plánovaných návštěv pro doplňování a měli by být poučeni o časných příznacích vysazení baklofenu.
Všichni pacienti, kteří dostávají intratekální léčbu baklofenem, jsou potenciálně ohroženi abstinencí. Časné příznaky vysazení baklofenu mohou zahrnovat návrat výchozí spasticity, pruritus, hypotenzi a parestézie. Při přerušení léčby intratekálním baklofenem se může vyvinout nebo opakovat priapismus. Některé klinické charakteristiky pokročilého intratekálního abstinenčního syndromu baklofenu mohou připomínat autonomní dysreflexii, infekci (sepse), maligní hypertermii, neurolepticko-maligní syndrom nebo jiné stavy spojené s hypermetabolickým stavem nebo rozšířenou rhabdomyolýzou.
Rychlá, přesná diagnostika a léčba na pohotovosti nebo na jednotce intenzivní péče jsou důležité, aby se zabránilo potenciálně život ohrožujícímu centrálnímu nervovému systému a systémovým účinkům intratekálního vysazení baklofenu. Navrhovanou léčbou pro intratekální vysazení baklofenu je obnovení intratekálního baklofenu při nebo téměř stejné dávce jako před přerušením léčby. Pokud je však obnovení intratekálního podávání opožděno, léčba GABA-ergními agonisty, jako je perorální nebo enterální baklofen nebo perorální, enterální nebo intravenózní benzodiazepiny, může zabránit potenciálně fatálním následkům. Na samotný perorální nebo enterální baklofen nelze spoléhat, že zastaví progresi intratekálního vysazení baklofenu.
Záchvaty byly hlášeny během předávkování a po vysazení přípravku LIORESAL 25 mg INTRATHECAL, stejně jako u pacientů udržovaných na terapeutických dávkách přípravku LIORESAL INTRATHECAL.
Smrtelné případy
Spasticita Míšního Původu
Bylo hlášeno 16 úmrtí mezi 576 pacienty v USA léčenými LIORESAL 10 mg INTRATHECAL (injekce baklofenu) v pre- a postmarketingových studiích hodnocených k prosinci 1992. Protože tito pacienti byli léčeni v nekontrolovaných klinických podmínkách, není možné s konečnou platností určit, co roli, pokud nějakou, LIORESAL INTRATHECAL sehrál v jejich smrti.
Jako skupina byli pacienti, kteří zemřeli, relativně mladí (průměrný věk byl 47 s rozmezím od 25 do 63), ale většina trpěla těžkou spasticitou trvající mnoho let, byli nechodící, měli různé zdravotní komplikace jako zápal plic, močové cesty infekce a dekubity a/nebo dostávali souběžně více léků. Případ od případu přezkoumání klinického průběhu 16 pacientů, kteří zemřeli, neodhalilo žádné jedinečné příznaky, symptomy nebo laboratorní výsledky, které by naznačovaly, že léčba přípravkem LIORESAL INTRATHECAL způsobila jejich smrt. Dva pacienti však utrpěli náhlou a neočekávanou smrt během 2 týdnů po implantaci pumpy a jeden pacient zemřel neočekávaně po screeningu.
Jeden pacient, 44letý muž s RS, zemřel v nemocnici druhý den po implantaci pumpy. Pitva prokázala těžkou fibrózu koronárního převodního systému. Druhá pacientka, 52letá žena s RS a anamnézou infarktu myokardu dolní stěny, byla nalezena mrtvá na lůžku 12 dní po implantaci pumpy, 2 hodiny poté, co měla zdokumentované normální vitální funkce. Pitva odhalila plicní kongesci a bilaterální pleurální výpotky. Není možné určit, zda LIORESAL INTRATHECAL přispěl k těmto úmrtím. Třetí pacient podstoupil tři screeningové studie baklofenu. Jeho anamnéza zahrnovala SCI, aspirační pneumonii, septický šok, diseminovanou intravaskulární koagulopatii, těžkou metabolickou acidózu, jaterní toxicitu a status epilepticus. Dvanáct dní po screeningu (neimplantován) opět prodělal status epilepticus s následným výrazným neurologickým zhoršením. Na základě předchozího poučení nebyla provedena mimořádná resuscitační opatření a pacient zemřel.
Spasticita Cerebrálního Původu
Mezi 211 pacienty léčenými přípravkem LIORESAL INTRATHECAL v premarketingových studiích k březnu 1996 došlo ke třem úmrtím. Tato úmrtí nebyla připisována terapii.
Přeinfuze
Dodání většího objemu léku, než je naprogramovaná rychlost (nadměrná infuze), může vést k neočekávanému předávkování nebo stažení způsobenému předčasným vyprázdněním zásobníku pumpy. Viz návod výrobce čerpadla a pokyny pro doplňování nádrže.
OPATŘENÍ
Děti by měly mít dostatečnou tělesnou hmotnost pro umístění implantovatelné pumpy pro chronickou infuzi. Konkrétní doporučení naleznete v příručce výrobce čerpadla.
Bezpečnost a účinnost u pediatrických pacientů mladších 4 let nebyla stanovena.
Promítání
Pacienti by před screeningovou studií s přípravkem LIORESAL INTRATHECAL (injekce baklofenu) měli být bez infekce, protože přítomnost systémové infekce může narušovat hodnocení pacientovy odpovědi na bolus LIORESAL 10 mg INTRATHECAL.
Implantace pumpy
Pacienti by před implantací pumpy měli být bez infekce, protože přítomnost infekce může zvýšit riziko chirurgických komplikací. Kromě toho může dávkování komplikovat systémová infekce.
Úprava dávky pumpy a titrace
U většiny pacientů bude nutné v průběhu času dávku postupně zvyšovat, aby byla zachována účinnost; náhlý požadavek na podstatnou eskalaci dávky typicky indikuje komplikaci katetru (tj. zalomení nebo uvolnění katetru).
Doplňování nádrže musí provádět plně vyškolený a kvalifikovaný personál podle pokynů výrobce čerpadla. K neúmyslné injekci do podkožní tkáně může dojít, pokud není správně přístupná přepážka pro doplňování zásobníku. Subkutánní injekce může vést k příznakům systémového předávkování nebo časnému vyčerpání zásobníku. Intervaly doplňování by měly být pečlivě vypočítány, aby se zabránilo vyčerpání rezervoáru, protože by to vedlo k návratu těžké spasticity a případně abstinenčních příznaků.
Při plnění je vyžadována přísná aseptická technika, aby se zabránilo bakteriální kontaminaci a vážné infekci. Po každém doplnění nebo manipulaci se zásobníkem léčiva by měla následovat doba sledování odpovídající klinické situaci.
Při plnění implantabilní pumpy schválené FDA, která je vybavena injekčním portem, který umožňuje přímý přístup k intratekálnímu katétru, je třeba dbát mimořádné opatrnosti. Přímá injekce do katetru přes přístupový port katetru může způsobit život ohrožující předávkování.
Další úvahy týkající se úpravy dávkování
Může být důležité titrovat dávku pro udržení určitého stupně svalového tonusu a umožnit občasné křeče, aby: 1) pomohly podpořit oběhové funkce, 2) případně zabránily vzniku hluboké žilní trombózy, 3) optimalizovaly aktivity každodenního života a usnadnily péči .
S výjimkou naléhavých případů souvisejících s předávkováním by měla být dávka přípravku LIORESAL 25 mg INTRATHECAL obvykle snižována pomalu, pokud je lék z jakéhokoli důvodu vysazen.
Je třeba se pokusit přerušit souběžnou perorální antispasticitu, aby se předešlo možnému předávkování nebo nežádoucím lékovým interakcím, a to buď před screeningem, nebo po implantaci a zahájení chronické infuze LIORESAL INTRATHECAL. Snížení a vysazení perorálních antispasmotik by mělo být prováděno pomalu a za pečlivého sledování lékařem. Je třeba se vyhnout náhlému snížení nebo vysazení souběžně podávaných antispastik.
Ospalost
U pacientů užívajících přípravek LIORESAL INTRATHECAL byla hlášena ospalost. Pacienti by měli být upozorněni na provoz automobilů nebo jiných nebezpečných strojů a činnosti, které se sníženou bdělostí stávají nebezpečnými. Pacienti by měli být také upozorněni, že tlumivé účinky přípravku LIORESAL INTRATHECAL (injekce baklofenu) na centrální nervový systém mohou být aditivní k účinkům alkoholu a jiných látek tlumících CNS.
Intrathekální mše
Byly hlášeny případy intratekální hmoty na špičce implantovaného katétru, většina z nich zahrnovala analgetické přísady smíšené v lékárnách. Nejčastějšími symptomy spojenými s intratekální hmotou jsou: 1) snížená terapeutická odpověď (zhoršení spasticity, návrat spasticity, když byla dříve dobře kontrolována, abstinenční příznaky, špatná odpověď na zvyšující se dávky nebo časté nebo velké zvyšování dávky), 2) bolest, 3) neurologický deficit/dysfunkce. Kliničtí lékaři by měli pacienty na intraspinální léčbě pečlivě sledovat, zda se u nich neobjeví jakékoli nové neurologické známky nebo příznaky. U pacientů s novými neurologickými příznaky nebo symptomy připomínajícími intratekální masu zvažte neurochirurgickou konzultaci, protože mnoho příznaků zánětlivého útvaru není nepodobných příznakům, které pociťují pacienti s těžkou spasticitou způsobenou jejich onemocněním. V některých případech může být vhodné provedení zobrazovacího postupu k potvrzení nebo vyloučení diagnózy intratekálního útvaru.
Opatření u zvláštních populací pacientů
Opatrná titrace dávky přípravku LIORESAL 10 mg INTRATHECAL je nutná, když je spasticita nezbytná k udržení vzpřímeného držení těla a rovnováhy v lokomoci nebo kdykoli se spasticita používá k dosažení optimální funkce a péče.
Pacienti trpící psychotickými poruchami, schizofrenií nebo stavy zmatenosti by měli být léčeni přípravkem LIORESAL INTRATHECAL opatrně a měli by být pečlivě sledováni, protože při perorálním podání byly pozorovány exacerbace těchto stavů.
LIORESAL INTRATHECAL by měl být používán s opatrností u pacientů s autonomní dysreflexií v anamnéze. Přítomnost nociceptivních stimulů nebo náhlé vysazení přípravku LIORESAL 10 mg INTRATHECAL (injekce baklofenu) může způsobit autonomní dysreflexní epizodu.
Protože LIORESAL je primárně vylučován v nezměněné podobě ledvinami, měl by být podáván s opatrností pacientům s poruchou funkce ledvin a může být nutné snížit dávkování.
Laboratorní testy
Žádné specifické laboratorní testy nejsou považovány za nezbytné pro léčbu pacientů na LIORESAL INTRATHECAL.
Karcinogeneze, mutageneze a poškození plodnosti
U potkanů, kteří dostávali baklofen perorálně po dobu dvou let, nebyl pozorován žádný nárůst nádorů. Nebyly provedeny adekvátní testy genotoxicity baklofenu.
Těhotenství
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Ve studiích na zvířatech měl baklofen při perorálním podání březím potkanům nežádoucí účinky na embryofetální vývoj. LIORESAL 25 mg INTRATHECAL by měl být užíván během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Baklofen podávaný perorálně zvýšil výskyt strukturálních abnormalit plodu (omfalokély) u potkanů. U samic bylo pozorováno snížení příjmu potravy a přírůstek tělesné hmotnosti. Strukturální abnormality plodu nebyly pozorovány u myší ani králíků
Kojící matky
matek léčených perorálním LIORESALEM (baklofen USP) v terapeutických dávkách přechází účinná látka do mléka. Není známo, zda jsou detekovatelné hladiny léku přítomny v mléce kojících matek užívajících LIORESAL 25 mg INTRATHECAL. Obecným pravidlem je, že kojení by mělo být prováděno v době, kdy pacient dostává přípravek LIORESAL 25 mg INTRATHECAL, pouze pokud potenciální přínos ospravedlňuje potenciální rizika pro kojence.
Pediatrické použití
Děti by měly mít dostatečnou tělesnou hmotnost pro umístění implantovatelné pumpy pro chronickou infuzi. Konkrétní doporučení naleznete v příručce výrobce čerpadla.
Bezpečnost a účinnost u pediatrických pacientů mladších 4 let nebyla stanovena.
Úvahy založené na zkušenostech s perorálním LIORESAL (baklofen USP)
U samic potkanů léčených chronicky perorálním přípravkem LIORESAL bylo pozorováno na dávce závislé zvýšení výskytu ovariálních cyst. U asi 4 % pacientek s roztroušenou sklerózou, které byly léčeny perorálním přípravkem LIORESAL 25 mg po dobu až jednoho roku, byly palpací nalezeny ovariální cysty. Ve většině případů tyto cysty spontánně zmizely, zatímco pacienti pokračovali v podávání léku. Odhaduje se, že ovariální cysty se spontánně vyskytují přibližně u 1 % až 5 % normální ženské populace.
PŘEDÁVKOVAT
Zvláštní pozornost je třeba věnovat rozpoznání známek a příznaků předávkování, zejména během počáteční fáze screeningu a titrace dávky, ale také při opětovném zavedení přípravku LIORESAL INTRATHECAL po období přerušení léčby.
Příznaky předávkování LIORESAL INTRATHECAL
Ospalost, točení hlavy, závratě, ospalost, respirační deprese, hypotermie, záchvaty, rostrální progrese hypotonie a ztráta vědomí progredující do kómatu do 72 hodin. doba trvání. Ve většině hlášených případů bylo kóma po vysazení léku reverzibilní bez následků. Příznaky předávkování přípravkem LIORESAL 25 mg INTRATHECAL byly hlášeny u citlivého dospělého pacienta po podání intratekálního bolusu 25 mcg.
Doporučení k léčbě předávkování
Neexistuje žádné specifické antidotum pro léčbu předávkování přípravkem LIORESAL INTRATHECAL (injekce baklofenu); obvykle by však měly být provedeny následující kroky:
Není-li lumbální punkce kontraindikována, je třeba zvážit odebrání 30–40 ml CSF ke snížení koncentrace baklofenu v CSF.
KONTRAINDIKACE
Přecitlivělost na baklofen. LIORESAL INTRATHECAL se nedoporučuje pro intravenózní, intramuskulární, subkutánní nebo epidurální podání.
KLINICKÁ FARMAKOLOGIE
Přesný mechanismus účinku baklofenu jako myorelaxantu a antispasticity není zcela objasněn. Baclofen inhibuje jak monosynaptické, tak polysynaptické reflexy na míšní úrovni, pravděpodobně snížením uvolňování excitačních neurotransmiterů z primárních aferentních zakončení, i když se mohou objevit i účinky na supraspinálních místech a přispět k jeho klinickému účinku. Baclofen je strukturním analogem inhibičního neurotransmiteru kyseliny gama-aminomáselné (GABA) a může uplatnit své účinky stimulací podtypu receptoru GABAB.
LIORESAL INTRATHECAL, pokud je zaveden přímo do intratekálního prostoru, umožňuje dosažení účinných koncentrací v CSF s výslednými plazmatickými koncentracemi 100krát nižšími, než jaké se vyskytují při perorálním podání.
lidí, stejně jako u zvířat, bylo prokázáno, že baklofen má obecně tlumivé vlastnosti na CNS, jak naznačuje produkce sedace s tolerancí, somnolencí, ataxií a respirační a kardiovaskulární depresí.
Farmakodynamika LIORESAL INTRATHECAL
Intratekální bolus
Dospělí pacienti
Nástup účinku je obecně půl hodiny až jednu hodinu po intratekálním bolusu. Maximální spasmolytický účinek je pozorován přibližně čtyři hodiny po podání dávky a účinky mohou trvat čtyři až osm hodin. Nástup, maximální odpověď a trvání účinku se mohou u jednotlivých pacientů lišit v závislosti na dávce a závažnosti příznaků.
Pediatričtí pacienti
Nástup, maximální odpověď a trvání účinku jsou podobné jako u dospělých pacientů.
Kontinuální infuze
Antispastický účinek přípravku LIORESAL 25 mg INTRATHECAL je poprvé patrný za 6 až 8 hodin po zahájení kontinuální infuze. Maximální aktivita je pozorována za 24 až 48 hodin.
Kontinuální infuze
Pro dětské pacienty nejsou k dispozici žádné další informace.
Farmakokinetika přípravku LIORESAL 25 mg INTRATHECAL
Farmakokinetika clearance CSF přípravku LIORESAL 25 mg INTRATHECAL vypočítaná ze studií intratekálního bolusu nebo kontinuální infuze se blíží obratu CSF, což naznačuje, že eliminace je odstraněním CSF hromadným průtokem.
Intratekální bolus
Po bolusové lumbální injekci 50 nebo 100 mcg LIORESAL 10 mg INTRATHECAL u sedmi pacientů byl průměrný poločas eliminace CSF 1,51 hodiny během prvních čtyř hodin a průměrná clearance CSF byla přibližně 30 ml/hod.
Kontinuální infuze
Průměrná clearance CSF pro LIORESAL 10 mg INTRATHECAL (injekce baklofenu) byla přibližně 30 ml/hod ve studii zahrnující deset pacientů na kontinuální intratekální infuzi. Očekává se, že souběžné plazmatické koncentrace baklofenu během intratekálního podání budou nízké (0-5 ng/ml).
Omezené farmakokinetické údaje naznačují, že během infuze baklofenu se podél neuroosy vytvoří lumbálně-cisternální koncentrační gradient přibližně 4:1. To je založeno na simultánním odběru CSF přes cisternální a lumbální kohoutek u 5 pacientů dostávajících kontinuální infuzi baklofenu v lumbální úrovni v dávkách spojených s terapeutickou účinností; variabilita mezi pacienty byla velká. Gradient nebyl změněn polohou.
Šest dětských pacientů (ve věku 8-18 let), kteří dostávali kontinuální intratekální infuzi baklofenu v dávkách 77-400 mcg/den, mělo plazmatické hladiny baklofenu blízké nebo nižší než 10 ng/ml.
INFORMACE PRO PACIENTA
PrLIORESAL Intratekální (baklofen) Injekce 0,05 mg/ml, 0,5 mg/ml a 2 mg/ml
Pouze pro intratekální injekci a infuzi
Tento leták je částí III třídílné „Produktové monografie“ vydané v době, kdy byl LIORESAL IT schválen k prodeji v Kanadě, a je navržen speciálně pro spotřebitele. Tato příbalová informace je shrnutím a neřekne vám vše o LIORESAL 10mg IT. Máte-li jakékoli dotazy týkající se léku, kontaktujte svého lékaře nebo lékárníka.
O TOMTO LÉKU
K čemu se přípravek používá:
LIORESAL 25 mg Intrathecal patří do skupiny léků nazývaných myorelaxancia. Používá se ke snížení a zmírnění nadměrné ztuhlosti a/nebo křečí vyskytujících se při různých onemocněních, jako je například roztroušená skleróza, onemocnění nebo poranění míchy a některé poruchy mozku.
Co to dělá:
Roztok se injikuje nebo podává infuzí do tekutého prostoru kolem míchy pomocí speciální pumpy, která se implantuje pod kůži vašeho břicha. Z pumpy je konstantní množství roztoku dodáváno do prostoru tekutiny kolem míchy pomocí malé hadičky.
Díky příznivému účinku na svalové kontrakce a následné úlevě od bolesti zlepšuje LIORESAL Intrathecal vaši pohyblivost a schopnost zvládat každodenní aktivity bez pomoci. LIORESAL 25 mg vám také pomůže lépe využít fyzioterapii.
Kdy by se neměl používat:
Neměli byste být léčeni přípravkem LIORESALIT, pokud:
- jste alergický/á (přecitlivělý/á) na přípravek LIORESAL 25 mg intratekálně nebo na kteroukoli další složku přípravku LIORESAL 10 mg intratekálně uvedenou níže.
Jaká je léčivá látka:
baklofen.
Jaké jsou neléčivé složky:
LIORESAL 25 mg IT obsahuje: chlorid sodný a vodu na injekci
V jakých dávkových formách se dodává:
LIORESAL 25 mg intratekálně (injekce baklofenu) 0,05 mg/ml: Každá 1 ml ampule obsahuje 0,05 mg baklofenu pro intratekální podání.
LIORESAL Intrathekální (injekce baklofenu) 0,5 mg/ml: Každá 20ml ampule obsahuje 10 mg baklofenu pro intratekální podání.
LIORESAL 25 mg intratekálně (injekce baklofenu) 2 mg/ml: Každá 5ml ampule obsahuje 10 mg baklofenu pro intratekální podání.
VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ
LIORESAL 10mg Intrathecal je vhodný pro mnoho, ale ne pro všechny pacienty se svalovými křečemi.
Před užitím přípravku LIORESAL 25 mgIT se poraďte se svým lékařem nebo lékárníkem, pokud:
- mít jakýkoli druh infekce
- trpíte Parkinsonovou chorobou nebo některými duševními chorobami doprovázenými zmateností
- máte epilepsii (záchvaty)
- mít cukrovku
- měl někdy problémy se srdcem
- měl někdy problémy s ledvinami
- mít problémy s dýcháním
- máte akutní bolest žaludku nebo střev
- máte narušený krevní oběh ve vašem mozku
- jste někdy zažili náhlé epizody vysokého krevního tlaku, úzkosti, nadměrného pocení, „husí kůže“, bušení hlavy a neobvykle pomalého srdečního tepu v důsledku nadměrné reakce vašeho nervového systému na podněty, jako je roztažení močového měchýře a střeva, podráždění kůže a bolest
Pokud se Vás cokoli z výše uvedeného týká, lékař Vám možná nebude chtít tento lék podat nebo bude chtít učinit zvláštní opatření. Pokud jste svému lékaři o žádné z těchto věcí neřekl/a, řekněte mu/jí dříve, než začnete LIORESAL 25 mg intratekální léčbu.
Pokud si myslíte, že můžete být alergický, požádejte o radu svého lékaře.
Řízení a obsluha strojů: LIORESAL Intrathecal může způsobit ospalost nebo závratě. Buďte opatrní, když řídíte auto nebo obsluhujete stroje nebo děláte věci, které vyžadují pečlivou pozornost, dokud se nebudete opět cítit normálně.
INTERAKCE S TÍMTO LÉKEM
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to io rostlinných lécích a lécích bez předpisu (volně prodejné). Některé další léky mohou interagovat s přípravkem LIORESAL 10 mgIT. Váš lékař může změnit dávkování nebo někdy vysadit některý z léků. To je zvláště důležité pro následující léky:
- jiné léky na spastický stav
- léky na Parkinsonovu chorobu
- léky na epilepsii
- léky používané k léčbě poruch nálady, jako jsou antidepresiva a lithium
- léky na vysoký krevní tlak
- jiné léky, které ovlivňují ledviny, např. ibuprofen
- opiáty pro úlevu od bolesti
- léky, které vám pomáhají spát nebo vás uklidňují
- léky, které zpomalují centrální nervový systém, např. antihistaminika a sedativa (některé z nich lze zakoupit volně).
Vždy informujte svého lékaře nebo zdravotní sestru o všech lécích, které užíváte. To znamená léky, které jste si zakoupili sami, i léky na předpis od vašeho lékaře.
Buďte opatrní, pokud během léčby přípravkem LIORESAL 25 mg Intrathecal pijete alkoholické nápoje, protože můžete pociťovat větší ospalost nebo závratě než obvykle.
SPRÁVNÉ POUŽÍVÁNÍ TOHOTO LÉKU
Obvyklá dávka
LIORESAL Intrathecal mohou podávat pouze zkušení lékaři za použití speciálního lékařského vybavení. Budete muset zůstat v nemocnici, alespoň na začátku léčby.
Váš lékař vám vstříkne malé množství přípravku LIORESAL Intrathecal do míchy, aby zjistil, zda zlepšuje vaše svalové křeče. Pokud ano, bude vám pod kůži implantována speciální pumpa. Pumpa vám bude neustále podávat malé množství léku.
Může trvat několik dní, než zjistíte množství léku, které vám nejlépe vyhovuje, váš lékař vás bude během této doby bedlivě sledovat.
Poté vás lékař bude chtít pravidelně navštěvovat, aby zkontroloval váš pokrok a ujistil se, že vaše pumpa funguje dobře.
JE NAnejvýš DŮLEŽITÉ DODRŽOVAT TERMÍNY PRO DOPLNĚNÍ PUMPY, JINAK SE MOHOU OPAKOVAT KŘEČE, PROTOŽE NEDOSTÁVÁTE DOSTATEČNĚ VYSOKOU DÁVKU LIORESAL INTRATHEKAL. SVALOVÁ SPASTICITA SE V NÁSLEDKU NEMUSÍ ZLEPŠIT NEBO SE MŮŽE ZHORŠIT.
Pokud se svalová spasticita nezlepšuje nebo pokud znovu začnete mít křeče, ať už postupně nebo náhle, okamžitě kontaktujte svého lékaře.
Informace o správné domácí péči o pumpu a místo zavedení naleznete v literatuře výrobce pumpy.
Monitorování během léčby přípravkem LIORESAL 10 mg intratekálně
Během fáze screeningu a období titrace dávky bezprostředně po implantaci pumpy budete pečlivě sledováni v plně vybaveném prostředí s personálem. Budete pravidelně hodnoceni z hlediska vašich požadavků na dávkování, možných vedlejších účinků nebo důkazů infekce. Bude také zkontrolováno fungování doručovacího systému.
Těhotenství a kojení
Pokud jste těhotná nebo těhotenství plánujete, informujte svého lékaře, protože LIORESAL 25 mg Intrathecal by se neměl užívat během těhotenství nebo pokud kojíte. Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoli lék.
Váš lékař s vámi prodiskutuje potenciální riziko užívání přípravku LIORESAL 25 mg intrathekal během těhotenství.
Lékař rozhodne, zda můžete v těchto zvláštních situacích dostat LIORESAL 10 mg intratekálně. Pouze velmi malá množství přípravku LIORESAL 10 mg procházejí do mateřského mléka. Zeptejte se svého lékaře, pokud chcete kojit.
Předávkovat
V případě předávkování lékem okamžitě kontaktujte praktického lékaře, pohotovostní oddělení nemocnice nebo regionální toxikologické středisko, i když se neobjeví žádné příznaky.
Příznaky předávkování se mohou objevit náhle nebo nenápadně, např. poruchou pumpy. Je velmi důležité, abyste vy a vaši pečující rozpoznali známky předávkování. Pokud zaznamenáte některý z následujících příznaků nebo jejich kombinaci, informujte neprodleně svého lékaře, protože množství léku, které dostáváte, může být příliš vysoké:
- neobvyklá svalová slabost (příliš malý svalový tonus)
- ospalost
- točení hlavy nebo závratě
- nadměrné slinění
- nevolnost nebo zvracení
- potíže s dýcháním, záchvaty nebo ztráta vědomí
- abnormálně nízká tělesná teplota
Zmeškaná dávka
Náhlé vysazení přípravku LIORESAL 10 mg intratekálně může vést k vážným zdravotním problémům a ve vzácných případech bylo smrtelné.
Známky toho, že pumpa nefunguje správně nebo že nedodává správné množství léků, zahrnují zvýšení nebo návrat spasticity, svědění, nízký krevní tlak, točení hlavy, pocit brnění, vysokou horečku, změněný duševní stav a svalovou ztuhlost nebo nové svalová slabost nebo paralýza. Je důležité, abyste ihned informovali svého lékaře, pokud zaznamenáte některý z výše uvedených příznaků.
NEŽÁDOUCÍ ÚČINKY A CO S NIMI DĚLAT
Stejně jako u všech léků se mohou u pacientů léčených přípravkem LIORESAL 25 mg Intrathecal objevit některé nežádoucí účinky, které se ale nemusí vyskytnout u každého. Ty se vyskytují častěji na začátku léčby během pobytu v nemocnici, ale mohou se objevit i později a měly by být zkontrolovány se svým lékařem.
Velmi časté: Ospalost, svalová slabost
Společný: Pocit úzkosti, sedace a únavy (vyčerpání), slabost v nohou, ztuhlost svalů, závrať/točení hlavy, bolest hlavy, ospalost, pocit nevolnosti a/nebo zvracení, brnění rukou a nohou, nespavost, nezřetelná řeč, zápal plic , slabost, zimnice, únava, bolest, sucho v ústech, kožní vyrážka a/nebo svědění, otoky kotníků, chodidel nebo dolních končetin, oteklý obličej, neobvyklá nervozita nebo neklid, zmatenost/dezorientace, zácpa, průjem, snížená chuť k jídlu, slinění, horečka/třesavka, problémy s močením, sexuální potíže.
Méně časté: Změny nálady nebo duševní změny, paranoia, pocit extrémního štěstí (euforie), ztráta svalové koordinace (ataxie), abnormálně nízká tělesná teplota, ztráta paměti, neustálé nekontrolovatelné pohyby očí, snížené vnímání chuti, potíže s polykáním, bolest břicha, vypadávání vlasů, Nadměrné pocení.
Vzácný: Neklid, abnormálně pomalé dýchání.
Informujte svého lékaře, pokud zaznamenáte jakýkoli jiný účinek. Některé vedlejší účinky mohou být spojeny se systémem podávání.
VÁŽNÉ NEŽÁDOUCÍ ÚČINKY, JAK ČASTO SE DĚJE A CO S NIMI DĚLAT
Toto není úplný seznam vedlejších účinků. V případě jakýchkoli neočekávaných účinků při užívání přípravku LIORESAL IT kontaktujte svého lékaře nebo lékárníka.
JAK TO UCHOVÁVAT
Uchovávejte LIORESAL 10mg IT ampule při teplotě 15-30°C (chráňte před teplem). Chraňte před mrazem. Nesterilizujte teplem.
Uchovávejte všechny léky mimo dosah a dohled dětí.
Tento lék je předepsán pro váš konkrétní zdravotní problém a pouze pro vaši vlastní potřebu. Nedávejte jiným lidem.
Nepoužívejte zastaralé léky. Bezpečně je zlikvidujte mimo dosah dětí nebo je vezměte do lékárny, která je zlikviduje za vás.
HLÁŠENÍ PODEZŘENÝCH VEDLEJŠÍCH ÚČINKŮ
Jakékoli podezření na nežádoucí účinky spojené s používáním zdravotnických produktů můžete hlásit Kanadskému programu vigilance jedním z následujících 3 způsobů:
- Zpráva online na www.healthcanada.gc.ca/medeffect
- Volejte na bezplatné číslo 1-866-234-2345
- Vyplňte formulář pro hlášení o bdělosti Kanady a:
- Faxujte zdarma na číslo 1-866-678-6789 nebo
- Mail na: Canada Vigilance Program, Health Canada, Postal Locator 0701E, Ottawa, Ontario, K1A 0K9
Štítky s placeným poštovným, kanadský formulář pro hlášení bdělosti a pokyny pro hlášení nežádoucích účinků jsou k dispozici na webových stránkách MedEffect™ Canada na adrese www.healthcanada.gc.ca/medeffect.
POZNÁMKA: Pokud potřebujete informace týkající se zvládání nežádoucích účinků, kontaktujte svého zdravotníka. Kanadský program vigilance neposkytuje lékařské poradenství.
VÍCE INFORMACÍ
Tento dokument a celou monografii produktu, připravenou pro zdravotníky, lze nalézt na: http://www.novartis.ca nebo kontaktováním sponzora, společnosti Novartis Pharmaceuticals Canada Inc, na čísle: 1-800-363-8883
