Abilify 10mg, 15mg, 20mg Aripiprazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.

Co je Abilify 20 mg a jak se používá?
Abilify je lék na předpis používaný k léčbě příznaků schizofrenie, bipolární poruchy I (manické deprese) a velké depresivní poruchy. Abilify 10 mg lze užívat samostatně nebo s jinými léky. Abilify je antipsychotikum, antimanické činidlo.
- Není známo, zda je přípravek Abilify bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Abilify 15 mg?
Abilify 15 mg může způsobit závažné nežádoucí účinky, včetně:
- silné rozrušení nebo úzkost,
- pocit neklidu,
- cukání nebo nekontrolovatelné pohyby očí, rtů, jazyka, obličeje, paží nebo nohou,
- vzhled obličeje jako maska,
- potíže s polykáním,
- problémy s řečí,
- záchvat (křeče),
- myšlenky na sebevraždu nebo sebepoškozování,
- ztuhlé nebo ztuhlé svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- třes (třes),
- pocit točení hlavy,
- zimnice,
- bolest krku,
- vředy v ústech,
- kožní vředy,
- kašel,
- potíže s dýcháním,
- zvýšená žízeň,
- zvýšené močení,
- sucho v ústech a
- ovocný zápach dechu
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Abilify 20 mg patří:
- nekontrolované pohyby svalů,
- úzkost,
- pocit neklidu,
- přibývání na váze,
- nevolnost,
- zvracení,
- zácpa,
- zvýšená chuť k jídlu,
- bolest hlavy,
- závrať,
- ospalost,
- cítit se unaveně,
- problémy se spánkem (nespavost),
- ucpaný nos a
- bolest krku
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Abilify. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
ZVÝŠENÁ ÚMRTNOST U STARŠÍCH PACIENTŮ S PSYCHÓZOU SOUVISEJÍCÍ S DEMENCÍ a SEBEVRAŽDOVÝMI MYŠLENKAMI A CHOVÁNÍM S ANTIDEPRESIVY
U starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. ABILIFY 20 mg není schválen pro léčbu pacientů s psychózou související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Antidepresiva v krátkodobých studiích zvyšovala riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých. Tyto studie neprokázaly zvýšení rizika sebevražedných myšlenek a chování při užívání antidepresiv u pacientů starších 24 let; došlo ke snížení rizika při užívání antidepresiv u pacientů ve věku 65 let a starších (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
U pacientů všech věkových kategorií, u kterých byla zahájena léčba antidepresivy, pečlivě sledujte, zda nedochází ke zhoršení a k výskytu sebevražedných myšlenek a chování. Informujte rodiny a pečovatele o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
POPIS
Aripiprazol je psychotropní léčivo, které je dostupné jako ABILIFY® (aripiprazol) tablety, ABILIFY DISCMELT® (aripiprazol) perorálně se rozpadající tablety, ABILIFY® (aripiprazol) perorální roztok a ABILIFY® (aripiprazol) injekční roztok, intramuskulární roztok. Aripiprazol je 7-[4-[4-(2,3-dichlorfenyl)-1-piperazinyl]butoxy]-3,4-dihydrokarbostyril. Empirický vzorec je C23H27Cl2N3O2 a jeho molekulová hmotnost je 448,38. Chemická struktura je:
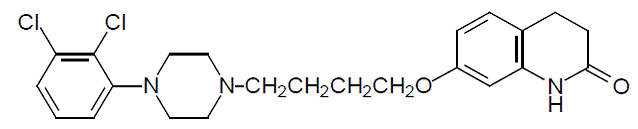
ABILIFY Tablety jsou dostupné v síle 2 mg, 5 mg, 10 mg, 15 mg, 20 mg a 30 mg. Mezi neaktivní složky patří kukuřičný škrob, hydroxypropylcelulóza, monohydrát laktózy, magnesium-stearát a mikrokrystalická celulóza. Mezi barviva patří oxid železitý (žlutý nebo červený) a FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT perorálně se rozpadající tablety jsou dostupné v 10 mg a 15 mg síle. Mezi neaktivní složky patří acesulfam draselný, aspartam, křemičitan vápenatý, sodná sůl kroskarmelózy, krospovidon, vanilkový krém (přírodní a umělé příchutě), stearát hořečnatý, mikrokrystalická celulóza, oxid křemičitý, kyselina vinná a xylitol. Mezi barviva patří oxid železitý (žlutý nebo červený) a FD&C Blue No. 2 Aluminium Lake.
ABILIFY perorální roztok je čirý, bezbarvý až světle žlutý roztok dostupný v koncentraci 1 mg/ml. Mezi neaktivní složky tohoto roztoku patří edetát disodný, fruktóza, glycerin, kyselina dl-mléčná, methylparaben, propylenglykol, propylparaben, hydroxid sodný, sacharóza a čištěná voda. Ústní roztok je ochucen přírodním pomerančovým krémem a dalšími přírodními příchutěmi.
ABILIFY Injection je k dispozici v jednodávkových injekčních lahvičkách jako připravený k použití, 9,75 mg/1,3 ml (7,5 mg/ml) čirý, bezbarvý, sterilní, vodný roztok pouze pro intramuskulární použití. Mezi neúčinné složky tohoto roztoku patří 199,5 mg sulfobutylether β-cyklodextrinu (SBECD), 10,4 mg kyseliny vinné, qs až pH 4,3 hydroxidu sodného a qs až 1,33 ml vody na injekci.
INDIKACE
ABILIFY perorální tablety, perorálně se rozpadající tablety a perorální roztok jsou indikovány k léčbě:
- Schizofrenie [viz Klinické studie ]
- Akutní léčba manických a smíšených epizod spojených s bipolární poruchou I [viz Klinické studie ]
- Doplňková léčba velké depresivní poruchy [viz Klinické studie ]
- Podrážděnost spojená s autistickou poruchou [viz Klinické studie ]
- Léčba Touretteovy poruchy [viz Klinické studie ]
ABILIFY Injection je indikován k léčbě:
- Agitovanost spojená se schizofrenií nebo bipolární mánií [viz Klinické studie ]
DÁVKOVÁNÍ A PODÁVÁNÍ
Schizofrenie
Dospělí
Doporučená počáteční a cílová dávka pro ABILIFY je 10 nebo 15 mg/den podávaná v režimu jednou denně bez ohledu na jídlo. Přípravek ABILIFY byl systematicky hodnocen a bylo prokázáno, že je účinný v rozmezí dávek 10 až 30 mg/den, pokud je podáván ve formě tablet; nicméně dávky vyšší než 10 nebo 15 mg/den nebyly účinnější než 10 nebo 15 mg/den. Zvýšení dávky by se obecně nemělo provádět dříve než za 2 týdny, což je doba potřebná k dosažení ustáleného stavu [viz Klinické studie ].
Udržovací léčba: Udržení účinnosti u schizofrenie bylo prokázáno ve studii zahrnující pacienty se schizofrenií, kteří byli symptomaticky stabilní na jiných antipsychotických lécích po dobu 3 měsíců nebo déle. Tito pacienti byli přerušeni z těchto léků a randomizováni buď k ABILIFY 15 mg/den, nebo placebu, a byl u nich pozorován relaps (viz Klinické studie ]. Pacienti by měli být pravidelně přehodnocováni, aby bylo možné určit pokračující potřebu udržovací léčby.
Dospívající
Doporučená cílová dávka přípravku ABILIFY je 10 mg/den. Aripiprazol byl studován u dospívajících pacientů ve věku 13 až 17 let se schizofrenií v denních dávkách 10 mg a 30 mg. Počáteční denní dávka tabletové formulace u těchto pacientů byla 2 mg, která byla titrována na 5 mg po 2 dnech a na cílovou dávku 10 mg po dalších 2 dnech. Následná zvýšení dávky by měla být podávána v krocích po 5 mg. Nebylo prokázáno, že by dávka 30 mg/den byla účinnější než dávka 10 mg/den. ABILIFY lze podávat bez ohledu na jídlo [viz Klinické studie ]. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Přechod z jiných antipsychotik
Neexistují žádné systematicky shromažďované údaje, které by konkrétně řešily přechod pacientů se schizofrenií z jiných antipsychotik na ABILIFY 20 mg nebo týkající se současného podávání s jinými antipsychotiky. Zatímco u některých pacientů se schizofrenií může být přijatelné okamžité ukončení předchozí antipsychotické léčby, pro jiné může být nejvhodnější postupnější vysazování. Ve všech případech by měla být minimalizována doba překrývajícího se podávání antipsychotik.
Bipolární porucha I
Akutní léčba manických a smíšených epizod
Dospělí
Doporučená počáteční dávka u dospělých je 15 mg podávaná jednou denně jako monoterapie a 10 mg až 15 mg podávaná jednou denně jako doplňková léčba lithiem nebo valproátem. ABILIFY 10 mg lze podávat bez ohledu na jídlo. Doporučená cílová dávka přípravku ABILIFY je 15 mg/den, jako monoterapie nebo jako přídatná léčba lithiem nebo valproátem. Dávka může být zvýšena na 30 mg/den na základě klinické odpovědi. Bezpečnost dávek nad 30 mg/den nebyla v klinických studiích hodnocena.
Pediatrie
Doporučená počáteční dávka u pediatrických pacientů (10 až 17 let) v monoterapii je 2 mg/den, s titrací na 5 mg/den po 2 dnech a cílová dávka 10 mg/den po dalších 2 dnech. Doporučené dávkování jako doplňková léčba k lithiu nebo valproátu je stejné. Následná zvýšení dávky, pokud je to nutné, by měla být podávána v přírůstcích 5 mg/den. ABILIFY lze podávat bez ohledu na jídlo [viz Klinické studie ].
Doplňková léčba velké depresivní poruchy
Dospělí
Doporučená počáteční dávka přípravku ABILIFY jako doplňkové léčby u pacientů, kteří již užívají antidepresivum, je 2 až 5 mg/den. Doporučené rozmezí dávkování je 2 až 15 mg/den. Úprava dávkování až na 5 mg/den by měla probíhat postupně, v intervalech ne kratších než 1 týden (viz Klinické studie ]. Pacienti by měli být pravidelně přehodnocováni, aby bylo možné určit pokračující potřebu udržovací léčby.
Podrážděnost spojená s autistickou poruchou
Pediatričtí pacienti (6 až 17 let)
Doporučený rozsah dávkování pro léčbu dětských pacientů s podrážděností spojenou s autistickou poruchou je 5 až 15 mg/den.
Dávkování by mělo být zahájeno dávkou 2 mg/den. Dávka by měla být zvýšena na 5 mg/den, s následným zvýšením na 10 nebo 15 mg/den, pokud je to nutné. Úpravy dávky až na 5 mg/den by měly probíhat postupně, v intervalech ne kratších než 1 týden (viz Klinické studie ]. Pacienti by měli být pravidelně přehodnocováni, aby bylo možné určit pokračující potřebu udržovací léčby.
Tourettova porucha
Pediatričtí pacienti (6 až 18 let)
Doporučený rozsah dávkování pro Tourettovu poruchu je 5 až 20 mg/den.
U pacientů s hmotností nižší než 50 kg by dávkování mělo být zahájeno dávkou 2 mg/den s cílovou dávkou 5 mg/den po 2 dnech. U pacientů, kteří nedosahují optimální kontroly tiků, lze dávku zvýšit na 10 mg/den. Úprava dávkování by měla probíhat postupně v intervalech ne kratších než 1 týden.
U pacientů s hmotností 50 kg nebo více by mělo být dávkování zahájeno dávkou 2 mg/den po dobu 2 dnů a poté zvýšeno na 5 mg/den po dobu 5 dnů s cílovou dávkou 10 mg/den 8. den. zvýšena až na 20 mg/den u pacientů, kteří nedosahují optimální kontroly tiků. Úprava dávkování by měla probíhat postupně po 5 mg/den v intervalech ne kratších než 1 týden. [Vidět Klinické studie ].
Pacienti by měli být pravidelně přehodnocováni, aby bylo možné určit pokračující potřebu udržovací léčby.
Agitovanost spojená se schizofrenií nebo bipolární mánií (intramuskulární injekce)
Dospělí
Doporučená dávka u těchto pacientů je 9,75 mg. Doporučené rozmezí dávkování je 5,25 až 15 mg. U 15 mg ve srovnání s 9,75 mg nebyl prokázán žádný další přínos. Pokud to klinické faktory vyžadují, lze zvážit nižší dávku 5,25 mg. Pokud po počáteční dávce přetrvává neklid vyžadující druhou dávku, lze podat kumulativní dávky až do celkové dávky 30 mg/den. Účinnost opakovaných dávek injekce ABILIFY 10 mg u agitovaných pacientů však nebyla v kontrolovaných klinických studiích systematicky hodnocena. Bezpečnost celkových denních dávek vyšších než 30 mg nebo injekcí podávaných častěji než každé 2 hodiny nebyla v klinických studiích dostatečně hodnocena (viz Klinické studie ].
Pokud je klinicky indikována pokračující léčba ABILIFY, perorální ABILIFY v rozmezí 10 až 30 mg/den by měl co nejdříve nahradit injekci ABILIFY [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Podávání ABILIFY Injection
Pro podání ABILIFY 10 mg injekce natáhněte požadovaný objem roztoku do injekční stříkačky, jak je uvedeno v tabulce 1. Zlikvidujte veškerou nepoužitou část.
ABILIFY Injection je určen pouze k intramuskulárnímu podání. Nepodávejte intravenózně nebo subkutánně. Aplikujte pomalu hluboko do svalové hmoty.
Parenterální léčivé přípravky by měly být před podáním vizuálně zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a nádoba dovolí.
Úpravy dávkování pro Cytochrom P450
Úprava dávkování se doporučuje u pacientů, kteří jsou známými pomalými metabolizátory CYP2D6, a u pacientů užívajících současně inhibitory CYP3A4 nebo inhibitory CYP2D6 nebo silné induktory CYP3A4 (viz tabulka 2). Když je současně podávaný lék vysazen z kombinované terapie, dávka ABILIFY 10 mg by měla být upravena na původní úroveň. Po vysazení současně podávaného induktoru CYP3A4 by měla být dávka přípravku ABILIFY snížena na původní úroveň během 1 až 2 týdnů. U pacientů, kteří mohou dostávat kombinaci silných, středně silných a slabých inhibitorů CYP3A4 a CYP2D6 (např. silný inhibitor CYP3A4 a středně silný inhibitor CYP2D6 nebo středně silný inhibitor CYP3A4 se středně silným inhibitorem CYP2D6), může být dávka snížena na jednu -čtvrtina (25 %) obvyklé dávky zpočátku a poté upravena tak, aby bylo dosaženo příznivé klinické odpovědi.
Pokud se pacientům s velkou depresivní poruchou podává ABILIFY adjuvans, ABILIFY 10 mg se má podávat bez úpravy dávkování, jak je uvedeno v Dávkování a způsob podání (2.3).
Dávkování perorálního roztoku
Perorální roztok může být nahrazen tabletami na bázi mg na mg až do úrovně dávky 25 mg. Pacienti užívající 30 mg tablety by měli dostat 25 mg roztoku [viz KLINICKÁ FARMAKOLOGIE ].
Dávkování tablet, které se rozpadají v ústech
Dávkování pro ABILIFY 10 mg perorálně se rozpadající tablety je stejné jako pro perorální tablety [viz výše sekce ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety ABILIFY® (aripiprazol) jsou dostupné, jak je popsáno v tabulce 3.
ABILIFY DISCMELT® (aripiprazol) perorálně se rozpadající tablety jsou dostupné, jak je popsáno v tabulce 4.
ABILIFY® (aripiprazol) perorální roztok (1 mg/ml) je čirý, bezbarvý až světle žlutý roztok, dodávaný v lahvičkách s dětskou pojistkou spolu s kalibrovanou perorální dávkovací nádobkou.
ABILIFY® (aripiprazol) Injekce pro intramuskulární použití je čirý, bezbarvý roztok dostupný jako roztok 9,75 mg/1,3 ml (7,5 mg/ml) připravený k použití v čirých skleněných lahvičkách typu 1.
Skladování A Manipulace
ABILIFY® (aripiprazol) tablety mají označení na jedné straně a jsou k dispozici v sílách a baleních uvedených v tabulce 32.
ABILIFY 15 mg DISCMELT® (aripiprazol) perorálně se rozpadající tablety jsou kulaté tablety s označením na obou stranách. ABILIFY 15 mg DISCMELT je dostupný v silách a baleních uvedených v tabulce 33.
ABILIFY® (aripiprazol) perorální roztok (1 mg/ml) se dodává v lahvičkách s dětskou pojistkou spolu s kalibrovanou perorální dávkovací nádobkou. ABILIFY 20 mg perorální roztok je dostupný následovně:
150ml láhev NDC 59148-013-15
ABILIFY® (aripiprazol) Injekce pro intramuskulární použití je k dispozici jako roztok 9,75 mg/1,3 ml (7,5 mg/ml) připravený k použití v čirých skleněných lahvičkách typu 1 takto:
9,75 mg/1,3 ml jednodávková lahvička NDC 59148-016-65
Úložný prostor
Tablety
Skladujte při teplotě 25 °C (77 °F); povolené odchylky mezi 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ].
Orální roztok
Skladujte při teplotě 25 °C (77 °F); povolené odchylky mezi 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ]. Otevřené lahvičky perorálního roztoku ABILIFY lze používat po dobu až 6 měsíců po otevření, ne však po uplynutí doby použitelnosti na lahvičce. Lahvičku a její obsah je třeba po uplynutí doby použitelnosti zlikvidovat.
Injekce
Skladujte při teplotě 25 °C (77 °F); povolené odchylky mezi 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ]. Chraňte před světlem uchováváním v původním obalu. Uchovávejte v kartonu do doby použití.
Distribuováno a prodáváno společností Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc.,. Rev Srpen 2019
VEDLEJŠÍ EFEKTY
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Zvýšená úmrtnost u starších pacientů s psychózou související s demencí [viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Cerebrovaskulární nežádoucí příhody, včetně mrtvice [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých [viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Neuroleptický maligní syndrom (NMS) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Tardivní dyskineze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Metabolické změny [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Patologické hráčství a jiné kompulzivní chování [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Ortostatická hypotenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Falls [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Leukopenie, neutropenie a agranulocytóza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty/křeče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Potenciál pro kognitivní a motorické poruchy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Regulace tělesné teploty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sebevražda [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Dysfagie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Nejčastějšími nežádoucími účinky u dospělých pacientů v klinických studiích (≥10 %) byly nauzea, zvracení, zácpa, bolest hlavy, závratě, akatizie, úzkost, nespavost a neklid.
Nejčastějšími nežádoucími účinky v pediatrických klinických studiích (≥10 %) byly somnolence, bolest hlavy, zvracení, extrapyramidová porucha, únava, zvýšená chuť k jídlu, nespavost, nauzea, nazofaryngitida a zvýšení tělesné hmotnosti.
Bezpečnost přípravku ABILIFY byla hodnocena u 13 543 dospělých pacientů, kteří se účastnili klinických studií s opakovanými dávkami u schizofrenie, bipolární poruchy, velké depresivní poruchy, demence Alzheimerova typu, Parkinsonovy choroby a alkoholismu a kteří měli přibližně 7 619 pacientoroků expozice perorálnímu ABILIFY 10 mg a 749 pacientů s expozicí ABILIFY injekci. Celkem 3390 pacientů bylo léčeno perorálním přípravkem ABILIFY po dobu alespoň 180 dnů a 1933 pacientů léčených perorálním přípravkem ABILIFY mělo alespoň 1 rok expozice.
ABILIFY 15 mg byla hodnocena z hlediska bezpečnosti u 1 686 pacientů (6 až 18 let), kteří se účastnili opakovaných dávek, klinických studií u schizofrenie, bipolární mánie, autistické poruchy nebo Touretteovy poruchy a kteří měli přibližně 1 342 pacientoroků expozice perorálnímu přípravku ABILIFY . Celkem 959 pediatrických pacientů bylo léčeno perorálním přípravkem ABILIFY po dobu alespoň 180 dnů a 556 pediatrických pacientů léčených perorálním přípravkem ABILIFY 10 mg mělo expozici po dobu alespoň 1 roku.
Podmínky a délka léčby přípravkem ABILIFY (monoterapie a přídatná léčba antidepresivy nebo stabilizátory nálady) zahrnovaly (v překrývajících se kategoriích) dvojitě zaslepené, srovnávací a nekomparativní otevřené studie, hospitalizované a ambulantní studie, studie s fixní a flexibilní dávkou, a krátkodobé a dlouhodobé expozice.
Zkušenosti z klinických studií
Dospělí pacienti se schizofrenií
Následující zjištění jsou založena na souboru pěti placebem kontrolovaných studií (čtyři 4týdenní a jedna 6týdenní), ve kterých byl perorálně podáván ABILIFY 15 mg v dávkách od 2 do 30 mg/den.
Běžně pozorované nežádoucí účinky
Jedinou běžně pozorovanou nežádoucí reakcí spojenou s užíváním přípravku ABILIFY 20 mg u pacientů se schizofrenií (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY alespoň dvakrát vyšší než u placeba) byla akatizie (ABILIFY 8 %; placebo 4 %).
Dospělí pacienti s bipolární mánií
Monoterapie
Následující nálezy jsou založeny na souboru 3týdenních placebem kontrolovaných studií bipolární mánie, ve kterých byl perorálně podáván ABILIFY 15 mg v dávkách 15 nebo 30 mg/den.
Běžně pozorované nežádoucí účinky
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku ABILIFY u pacientů s bipolární mánií (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY 15 mg alespoň dvakrát vyšší než u placeba) jsou uvedeny v tabulce 16.
Méně časté nežádoucí reakce u dospělých
Tabulka 17 uvádí souhrnnou incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během akutní terapie (až 6 týdnů u schizofrenie a až 3 týdny u bipolární mánie), včetně pouze těch reakcí, které se objevily u 2 % nebo více pacientů léčených přípravkem ABILIFY (dávky ≥2 mg/den) a jejichž incidence u pacientů léčených přípravkem ABILIFY 20 mg byla vyšší než incidence u pacientů léčených placebem v kombinovaném souboru údajů.
Zkoumání populačních podskupin neodhalilo žádné jasné důkazy o rozdílném výskytu nežádoucích účinků na základě věku, pohlaví nebo rasy.
Dospělí pacienti s doplňkovou terapií s bipolární mánií
Následující zjištění jsou založena na placebem kontrolované studii u dospělých pacientů s bipolární poruchou, ve které byl ABILIFY 15 mg podáván v dávkách 15 nebo 30 mg/den jako přídatná léčba lithiem nebo valproátem.
Nežádoucí účinky spojené s přerušením léčby
Ve studii pacientů, kteří již tolerovali lithium nebo valproát jako monoterapii, byla míra přerušení léčby z důvodu nežádoucích účinků 12 % u pacientů léčených adjuvantně ABILIFY ve srovnání s 6 % u pacientů léčených adjuvantním placebem. Nejčastějšími nežádoucími účinky spojenými s přerušením léčby u pacientů s přídavnou léčbou ABILIFY ve srovnání s pacienty léčenými placebem byly akatizie (5 % a 1 %) a třes (2 % a 1 %, v tomto pořadí).
Běžně pozorované nežádoucí účinky
Často pozorované nežádoucí účinky spojené s adjuvantní léčbou ABILIFY a lithiem nebo valproátem u pacientů s bipolární mánií (výskyt 5 % nebo vyšší a výskyt alespoň dvakrát vyšší než u přídavné léčby placebem) byly: akatizie, nespavost a extrapyramidová porucha.
Méně časté nežádoucí reakce u dospělých pacientů s doplňkovou terapií u bipolární mánie
Tabulka 18 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během akutní léčby (až 6 týdnů), včetně pouze těch reakcí, které se vyskytly u 2 % nebo více pacientů léčených adjuvantem ABILIFY (dávky 15 nebo 30 mg/den) a lithiem nebo valproátem a jejichž incidence u pacientů léčených touto kombinací byla vyšší než incidence u pacientů léčených placebem plus lithiem nebo valproátem.
Pediatričtí pacienti (13 až 17 let) se schizofrenií
Následující zjištění jsou založena na jedné 6týdenní, placebem kontrolované studii, ve které byl perorální ABILIFY podáván v dávkách v rozmezí od 2 do 30 mg/den.
Nežádoucí účinky spojené s přerušením léčby
Incidence přerušení léčby z důvodu nežádoucích účinků mezi pediatrickými pacienty léčenými ABILIFY a placebem (13 až 17 let) byla 5 % a 2 %.
Běžně pozorované nežádoucí účinky
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku ABILIFY 10 mg u dospívajících pacientů se schizofrenií (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY alespoň dvakrát vyšší než u placeba) byly extrapyramidové poruchy, somnolence a třes.
Pediatričtí pacienti (10 až 17 let) s bipolární mánií
Následující zjištění jsou založena na jedné 4týdenní, placebem kontrolované studii, ve které byl perorální přípravek ABILIFY podáván v dávkách 10 nebo 30 mg/den.
Nežádoucí účinky spojené s přerušením léčby
Výskyt přerušení léčby z důvodu nežádoucích účinků mezi pediatrickými pacienty (10 až 17 let) léčenými přípravkem ABILIFY a placebem byl 7 % a 2 %.
Běžně pozorované nežádoucí účinky
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku ABILIFY 20 mg u pediatrických pacientů s bipolární mánií (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY alespoň dvakrát vyšší než u placeba) jsou uvedeny v tabulce 19.
Pediatričtí pacienti (6 až 17 let) s autistickou poruchou
Následující zjištění jsou založena na dvou 8týdenních, placebem kontrolovaných studiích, ve kterých byl perorálně podáván ABILIFY 20 mg v dávkách 2 až 15 mg/den.
Nežádoucí účinky spojené s přerušením léčby
Výskyt přerušení léčby z důvodu nežádoucích účinků mezi pediatrickými pacienty (6 až 17 let) léčenými přípravkem ABILIFY a placebem byl 10 % a 8 %.
Běžně pozorované nežádoucí účinky
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku ABILIFY u dětských pacientů s autistickou poruchou (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY 10 mg alespoň dvakrát vyšší než u placeba) jsou uvedeny v tabulce 20.
Pediatričtí pacienti (6 až 18 let) s Tourettovou poruchou
Následující zjištění jsou založena na jedné 8týdenní a jedné 10týdenní, placebem kontrolované studii, ve které byl perorální přípravek ABILIFY 15 mg podáván v dávkách 2 až 20 mg/den.
Nežádoucí účinky spojené s přerušením léčby
Výskyt přerušení z důvodu nežádoucích účinků mezi pediatrickými pacienty léčenými ABILIFY a placebem (6 až 18 let) byl 7 % a 1 %, v tomto pořadí.
Běžně pozorované nežádoucí účinky
Běžně pozorované nežádoucí účinky spojené s užíváním přípravku ABILIFY u pediatrických pacientů s Tourettovou poruchou (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY 10 mg alespoň dvakrát vyšší než u placeba) jsou uvedeny v tabulce 21.
Méně časté nežádoucí reakce u dětských pacientů (6 až 18 let) se schizofrenií, bipolární mánií, autistickou poruchou nebo Tourettovou poruchou
Tabulka 22 uvádí souhrnnou incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během akutní terapie (až 6 týdnů u schizofrenie, až 4 týdny u bipolární mánie, až 8 týdnů u autistické poruchy a až 10 týdnů u Touretteovy poruchy), včetně pouze těch reakcí, které se vyskytly u 2 % nebo více dětských pacientů léčených přípravkem ABILIFY (dávky ≥ 2 mg/den) a jejichž incidence u pacientů léčených přípravkem ABILIFY 10 mg byla vyšší než u pacientů léčených přípravkem ABILIFY placebo.
Dospělí pacienti, kteří dostávají ABILIFY jako doplňkovou léčbu velké depresivní poruchy
Následující zjištění jsou založena na souboru dvou placebem kontrolovaných studií u pacientů s velkou depresivní poruchou, ve kterých byl ABILIFY 20 mg podáván v dávkách 2 mg až 20 mg jako doplňková léčba k pokračující antidepresivní léčbě.
Nežádoucí účinky spojené s přerušením léčby
Výskyt přerušení z důvodu nežádoucích účinků byl 6 % u pacientů s přídavnou léčbou ABILIFY a 2 % u pacientů s přídavnou léčbou placebem.
Běžně pozorované nežádoucí účinky
Často pozorované nežádoucí účinky spojené s užíváním doplňkového přípravku ABILIFY 15 mg u pacientů s velkou depresivní poruchou (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY 15 mg alespoň dvojnásobný než u placeba) byly: akatizie, neklid, nespavost, zácpa, únava a rozmazané vidění.
Méně časté nežádoucí reakce u dospělých pacientů s velkou depresivní poruchou
Tabulka 23 uvádí souhrnnou incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během akutní terapie (až 6 týdnů), včetně pouze těch nežádoucích účinků, které se vyskytly u 2 % nebo více pacientů léčených doplňkově ABILIFY (dávky ≥2 mg/den) a jejichž incidence u pacientů léčených adjuvantně ABILIFY 10 mg byla vyšší než incidence u pacientů léčených adjuvantní placebem v kombinovaném souboru údajů.
Pacienti s neklidem spojeným se schizofrenií nebo bipolární mánií (intramuskulární injekce)
Následující nálezy jsou založeny na souboru tří placebem kontrolovaných studií u pacientů s neklidem spojeným se schizofrenií nebo bipolární mánií, ve kterých byla injekce ABILIFY 20 mg podávána v dávkách 5,25 mg až 15 mg.
Běžně pozorované nežádoucí účinky
pacientů s neklidem spojeným se schizofrenií a bipolární mánií (výskyt 5 % nebo vyšší a výskyt přípravku ABILIFY 20 mg nejméně dvakrát vyšší než u placeba) byl pozorován jeden často pozorovaný nežádoucí účinek (nauzea) spojený s použitím 10 mg injekce ABILIFY.
Méně časté nežádoucí reakce u pacientů s neklidem spojeným se schizofrenií nebo bipolární mánií
Tabulka 24 uvádí souhrnnou incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se objevily během akutní terapie (24 hodin), včetně pouze těch nežádoucích účinků, které se vyskytly u 2 % nebo více pacientů léčených injekcí ABILIFY (dávky ≥ 5,25 mg /den) a u kterých byla incidence u pacientů léčených injekčně ABILIFY 15 mg vyšší než incidence u pacientů léčených placebem v kombinovaném souboru údajů.
Nežádoucí účinky závislé na dávce
Schizofrenie
Vztahy mezi dávkou a odezvou pro výskyt nežádoucích účinků souvisejících s léčbou byly hodnoceny ze čtyř studií u dospělých pacientů se schizofrenií porovnávajícími různé fixní dávky (2, 5, 10, 15, 20 a 30 mg/den) perorálního ABILIFY s placebem. Tato analýza, rozvrstvená podle studie, ukázala, že jedinou nežádoucí reakcí s možným vztahem k dávce a odpovědi, a pak nejvýraznější pouze u 30 mg, byla somnolence [včetně sedace]; (incidence byla placebo, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
Ve studii pediatrických pacientů (ve věku 13 až 17 let) se schizofrenií se zdálo, že tři běžné nežádoucí účinky mají možný vztah k odpovědi na dávku: extrapyramidová porucha (incidence byla placebo 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); somnolence (incidence byly placebo, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); a třes (incidence byly placebo, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Bipolární mánie
Ve studii pediatrických pacientů (ve věku 10 až 17 let) s bipolární mánií měly čtyři běžné nežádoucí účinky možný vztah mezi dávkou a odpovědí po 4 týdnech; extrapyramidová porucha (incidence placeba, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); somnolence (incidence byly placebo, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); akatizie (výskyty byly placebo, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); a hypersekrece slin (incidence byly placebo, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Autistická porucha
Ve studii pediatrických pacientů (ve věku 6 až 17 let) s autistickou poruchou měla jedna častá nežádoucí reakce možný vztah mezi dávkou a odpovědí: únava (výskyty byly placebo, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5 %).
Tourettova porucha
Ve studii pediatrických pacientů (ve věku 7 až 17 let) s Tourettovou poruchou neměly žádné běžné nežádoucí reakce vztah mezi dávkou a odpovědí.
Extrapyramidové příznaky
Schizofrenie
krátkodobých, placebem kontrolovaných studiích u schizofrenie u dospělých byl výskyt hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů léčených přípravkem ABILIFY 13 % oproti 12 % u placeba; a výskyt příhod souvisejících s akatizií u pacientů léčených přípravkem ABILIFY byl 8 % oproti 4 % u placeba. V krátkodobé, placebem kontrolované studii schizofrenie u pediatrických pacientů (13 až 17 let) byl výskyt hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů léčených přípravkem ABILIFY 25 % vs. placebo; a výskyt příhod souvisejících s akatizií u pacientů léčených přípravkem ABILIFY byl 9 % oproti 6 % u placeba.
Objektivně shromážděná data z těchto studií byla shromážděna na Simpson Angus Rating Scale (pro EPS), Barnes Akathisia Scale (pro akatizii) a Assessment of Involuntary Movement Scale (pro dyskineze). Ve studiích se schizofrenií u dospělých objektivně shromážděná data neprokázala rozdíl mezi ABILIFY 10 mg a placebem, s výjimkou Barnesovy škály Akathisie (ABILIFY 20 mg, 0,08; placebo, -0,05). Ve studii pediatrické (13 až 17 let) schizofrenie objektivně shromážděná data neprokázala rozdíl mezi ABILIFY 20 mg a placebem, s výjimkou Simpson Angus Rating Scale (ABILIFY 20 mg, 0,24; placebo, -0,29).
Podobně, v dlouhodobé (26týdenní), placebem kontrolované studii schizofrenie u dospělých, objektivně shromáždila data na Simpson Angus Rating Scale (pro EPS), Barnes Akathisia Scale (pro akatizii) a Assessments of Involuntary Pohybové škály (pro dyskineze) neukázaly rozdíl mezi ABILIFY a placebem.
Bipolární mánie
krátkodobých, placebem kontrolovaných studiích u bipolární mánie u dospělých byl výskyt hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů léčených přípravkem ABILIFY v monoterapii 16 % oproti 8 % u placeba a incidence příhod souvisejících s akatizií u pacientů léčených přípravkem ABILIFY v monoterapii bylo 13 % oproti 4 % u placeba. V 6týdenní, placebem kontrolované studii u bipolární mánie při přídavné léčbě lithiem nebo valproátem byla incidence hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů s přídavnou léčbou ABILIFY 15 % oproti 8 % u přídavných placebo a incidence příhod souvisejících s akatizií u pacientů s přídavnou léčbou ABILIFY byla 19 % vs. 5 % u pacientů s přídavným placebem. V krátkodobé, placebem kontrolované studii u bipolární mánie u pediatrických pacientů (10 až 17 let) byla incidence hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů léčených přípravkem ABILIFY 26 % vs. 5 %. u placeba a výskyt příhod souvisejících s akatizií u pacientů léčených přípravkem ABILIFY byl 10 % oproti 2 % u placeba.
Ve studiích bipolární mánie u dospělých s monoterapií ABILIFY, Simpson Angus Rating Scale a Barnes Akathisia Scale ukázaly významný rozdíl mezi ABILIFY 15 mg a placebem (ABILIFY, 0,50; placebo, -0,01 a ABILIFY 10 mg, 0,21; placebo)., -0,0,50,0,50; Změny ve vyhodnocení stupnice nedobrovolného pohybu byly podobné u skupin ABILIFY 15 mg a placeba. Ve studiích bipolární mánie s ABILIFY 20 mg jako doplňkovou terapií buď lithiem, nebo valproátem, Simpson Angus Rating Scale a Barnes Akathisia Scale ukázaly významný rozdíl mezi doplňkovým ABILIFY a doplňkovým placebem (ABILIFY 20 mg, 0,73; a placebo, 0,07 ABILIFY 0,30, placebo 0,11). Změny ve vyhodnocení stupnice nedobrovolného pohybu byly podobné pro přídatnou léčbu ABILIFY 20 mg a přídavnou placebo. V pediatrické (10 až 17 let), krátkodobé studii bipolární mánie, Simpson Angus Rating Scale ukázala významný rozdíl mezi ABILIFY 10 mg a placebem (ABILIFY 15 mg, 0,90; placebo, -0,05). Změny ve škále Barnes Akathisia a hodnocení nedobrovolných pohybů byly podobné pro skupiny s ABILIFY 20 mg a placebo.
Velká depresivní porucha
V krátkodobých, placebem kontrolovaných studiích u velké depresivní poruchy byla incidence hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů s přídatnou léčbou ABILIFY 8 % vs. 5 % u pacientů s přídavnou léčbou placebem; a incidence příhod souvisejících s akatizií u pacientů s přídavnou léčbou ABILIFY byla 25 % vs. 4 % u pacientů s přídavnou léčbou placebem.
Ve studiích s velkou depresivní poruchou prokázaly Simpson Angus Rating Scale a Barnes Akathisia Scale významný rozdíl mezi doplňkovou ABILIFY a doplňkovou placebem (ABILIFY 10 mg, 0,31; placebo, 0,03 a ABILIFY, 0,22; placebo, 0,02). Změny ve vyhodnocení škál nedobrovolného pohybu byly podobné pro skupiny s adjuvans ABILIFY a adjuvantní placebo.
Autistická porucha
krátkodobých, placebem kontrolovaných studiích s autistickou poruchou u pediatrických pacientů (6 až 17 let) byla incidence hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů léčených přípravkem ABILIFY 18 % vs. 2 %. u placeba a výskyt příhod souvisejících s akatizií u pacientů léčených přípravkem ABILIFY byl 3 % oproti 9 % u placeba.
V pediatrických (6 až 17 let) studiích krátkodobé autistické poruchy prokázala Simpson Angus Rating Scale významný rozdíl mezi ABILIFY a placebem (ABILIFY 20 mg, 0,1; placebo, -0,4). Změny ve škále Barnes Akathisia a hodnocení nedobrovolných pohybů byly podobné pro skupiny s ABILIFY 10 mg a placebo.
Tourettova porucha
krátkodobých, placebem kontrolovaných studiích u Touretteovy poruchy u pediatrických pacientů (6 až 18 let) byla incidence hlášených příhod souvisejících s EPS, s výjimkou příhod souvisejících s akatizií, u pacientů léčených přípravkem ABILIFY 7 % oproti 6 %. u placeba a incidence příhod souvisejících s akatizií u pacientů léčených ABILIFY byla 4 % oproti 6 % u placeba.
V pediatrických (6 až 18 let) krátkodobých studiích s Tourettovou poruchou nebyly změny v Simpson Angus Rating Scale, Barnes Akathisia Scale a Assessment of Involuntary Movement Scale klinicky významně odlišné pro ABILIFY 15 mg a placebo.
Agitovanost spojená se schizofrenií nebo bipolární mánií
placebem kontrolovaných studiích u pacientů s neklidem spojeným se schizofrenií nebo bipolární mánií byl výskyt hlášených příhod souvisejících s EPS s výjimkou příhod souvisejících s akatizií u pacientů léčených přípravkem ABILIFY 2 % oproti 2 % u placeba a výskyt akatizie- u pacientů léčených přípravkem ABILIFY byla 2 % vs. 0 % u placeba. Objektivně shromážděná data na Simpson Angus Rating Scale (pro EPS) a Barnes Akathisia Scale (pro akatizii) pro všechny léčebné skupiny neprokázala rozdíl mezi ABILIFY 10 mg a placebem.
Dystonie
Příznaky dystonie, prodloužené abnormální kontrakce svalových skupin, se mohou objevit u vnímavých jedinců během prvních několika dnů léčby. Dystonické příznaky zahrnují: křeče šíjových svalů, někdy progredující do sevření hrdla, potíže s polykáním, potíže s dýcháním a/nebo vyčnívání jazyka. I když se tyto příznaky mohou objevit při nízkých dávkách, vyskytují se častěji as větší závažností při vysoké účinnosti a při vyšších dávkách antipsychotik první generace. Zvýšené riziko akutní dystonie je pozorováno u mužů a mladších věkových skupin.
Další zjištění pozorovaná v klinických studiích
Nežádoucí účinky v dlouhodobých, dvojitě zaslepených, placebem kontrolovaných studiích
Nežádoucí účinky hlášené ve 26týdenní, dvojitě zaslepené studii porovnávající perorální ABILIFY 10 mg a placebo u pacientů se schizofrenií byly obecně v souladu s těmi, které byly hlášeny v krátkodobých, placebem kontrolovaných studiích, s výjimkou vyššího výskytu třesu [8 % (12/153) pro ABILIFY 20 mg vs. 2 % (3/153) pro placebo]. V této studii byla většina případů třesu mírné intenzity (8/12 mírná a 4/12 střední), vyskytla se na počátku léčby (9/12 ≤ 49 dní) a měla omezenou dobu trvání (7/12 ≤ 10 dní). Třes zřídka vedl k přerušení (
Další nežádoucí účinky pozorované během předmarketingového hodnocení přípravku ABILIFY
Následující seznam nezahrnuje reakce: 1) již uvedené v předchozích tabulkách nebo jinde v označení, 2) u nichž byla drogová příčina vzdálená, 3) které byly tak obecné, že nebyly informativní, 4) které nebyly považovány za závažné klinické důsledky, nebo 5) které se vyskytly s rychlostí stejnou nebo nižší než u placeba.
Reakce jsou kategorizovány podle tělesného systému podle následujících definic: časté nežádoucí reakce jsou ty, které se vyskytují alespoň u 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; vzácné reakce jsou ty, které se vyskytují u méně než 1/1000 pacientů:
Dospělí - perorální podání
Poruchy krve a lymfatického systému: vzácné - trombocytopenie
Srdeční poruchy: vzácné - bradykardie, palpitace, vzácné - flutter síní, kardiorespirační zástava, atrioventrikulární blokáda, fibrilace síní, angina pectoris, ischemie myokardu, infarkt myokardu, kardiopulmonální selhání
Oční poruchy: zřídka - fotofobie; vzácné - diplopie
Gastrointestinální poruchy: vzácné - gastroezofageální refluxní choroba
Obecné poruchy a podmínky v místě podání: časté - astenie; vzácné - periferní edém, bolest na hrudi; vzácné - edém obličeje
Poruchy jater a žlučových cest: vzácné - hepatitida, žloutenka
Poruchy imunitního systému : vzácné - přecitlivělost
Zranění, otrava a procedurální komplikace: řídký - pád; vzácné - úpal
Vyšetřování: časté - snížení hmotnosti, zřídka - zvýšení jaterních enzymů, zvýšení glukózy v krvi, zvýšení laktátdehydrogenázy v krvi, zvýšení gama glutamyltransferázy; vzácné - zvýšení prolaktinu v krvi, zvýšení močoviny v krvi, zvýšení kreatininu v krvi, zvýšení bilirubinu v krvi, prodloužení QT na elektrokardiogramu, zvýšení glykosylovaného hemoglobinu
Poruchy metabolismu a výživy: časté - anorexie; vzácné - hypokalémie, hyponatrémie, hypoglykémie
Poruchy svalové a kosterní soustavy a pojivové tkáně: vzácné - svalová slabost, svalové napětí; vzácné - rabdomyolýza, snížená pohyblivost
Poruchy nervového systému: vzácné - parkinsonismus, poruchy paměti, rigidita ozubeného kola, hypokineze, bradykineze; vzácné - akineze, myoklonus, abnormální koordinace, porucha řeči, křeče Grand Mal;
Psychiatrické poruchy: vzácné - agrese, ztráta libida, delirium; vzácné - zvýšené libido, anorgasmie, tik, vražedné myšlenky, katatonie, náměsíčnost
Poruchy ledvin a močových cest: vzácné - retence moči, nykturie
Poruchy reprodukčního systému a prsu: zřídka - erektilní dysfunkce; vzácné - gynekomastie, nepravidelná menstruace, amenorea, bolest prsů, priapismus
Respirační, hrudní a mediastinální poruchy: vzácné - ucpaný nos, dušnost
Poruchy kůže a podkožní tkáně: vzácné - vyrážka, hyperhidróza, pruritus, fotosenzitivní reakce, alopecie; vzácné - kopřivka
Cévní poruchy: vzácné - hypotenze, hypertenze
Pediatričtí pacienti - perorální podání
Většina nežádoucích účinků pozorovaných ve sloučené databázi 1 686 dětských pacientů ve věku 6 až 18 let byla pozorována také u dospělé populace. Další nežádoucí účinky pozorované u pediatrické populace jsou uvedeny níže.
Oční poruchy zřídka - okulogyrická krize
Gastrointestinální poruchy: zřídka -suchý jazyk, křeče jazyka
Vyšetřování: časté - zvýšený inzulín v krvi
Poruchy nervového systému: řídký - spánek mluvit
Poruchy ledvin a močových cest časté - enuréza
Poruchy kůže a podkožní tkáně: vzácné - hirsutismus
Dospělí - intramuskulární injekce
Většina nežádoucích účinků pozorovaných ve sloučené databázi 749 dospělých pacientů léčených injekcí ABILIFY byla také pozorována u dospělé populace léčené perorálním přípravkem ABILIFY. Další nežádoucí účinky pozorované u populace s injekčním podáním ABILIFY jsou uvedeny níže.
Obecné poruchy a podmínky v místě podání: ≥1/100 pacientů - reakce v místě vpichu; ≥1/1000 pacientů a
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku ABILIFY po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné stanovit kauzální vztah k expozici léku: výskyty alergické reakce (anafylaktická reakce, angioedém, laryngospasmus, pruritus/urtikarie nebo orofaryngeální spasmus), patologické hráčství škytavka a kolísání hladiny glukózy v krvi.
DROGOVÉ INTERAKCE
Léky s klinicky významnými interakcemi s ABILIFY
Léky, které nemají žádné klinicky důležité interakce s ABILIFY
Na základě farmakokinetických studií není nutná žádná úprava dávkování přípravku ABILIFY, pokud je podáván současně s famotidinem, valproátem, lithiem, lorazepamem.
Navíc není nutná žádná úprava dávkování pro substráty CYP2D6 (např. dextrometorfan, fluoxetin, paroxetin nebo venlafaxin), CYP2C9 (např. warfarin), CYP2C19 (např. omeprazol, warfarin, escitalopram) nebo CYP3A4 (např. dextromethorfan). při současném podávání s ABILIFY. Navíc není nutná žádná úprava dávkování u valproátu, lithia, lamotriginu, lorazepamu nebo sertralinu při současném podávání s ABILIFY (viz KLINICKÁ FARMAKOLOGIE ].
Zneužívání drog a závislost
Kontrolovaná látka
ABILIFY není kontrolovaná látka.
Zneužívání
ABILIFY nebyl systematicky studován u lidí z hlediska jeho potenciálu pro zneužívání, toleranci nebo fyzickou závislost. V důsledku toho by pacienti měli být pečlivě vyšetřeni na anamnézu zneužívání drog a tito pacienti by měli být pečlivě sledováni, zda se u nich nevyskytují známky nesprávného užívání nebo zneužívání přípravku ABILIFY 20 mg (např. rozvoj tolerance, zvýšení dávky, chování při vyhledávání drog).
Závislost
Ve studiích fyzické závislosti u opic byly po náhlém přerušení dávkování pozorovány abstinenční příznaky. I když klinické studie neodhalily žádnou tendenci k nějakému chování při vyhledávání drog, tato pozorování nebyla systematická a na základě těchto omezených zkušeností není možné předpovědět, do jaké míry bude léčivo působící na CNS zneužito, odkloněno, a/nebo zneužity po uvedení na trh.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí
Zvýšená úmrtnost
starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. ABILIFY (aripiprazol) není schválen pro léčbu pacientů s psychózou související s demencí (viz BOXED WARNING ).
Zkušenosti s bezpečností u starších pacientů s psychózou spojenou s Alzheimerovou chorobou
Ve třech, 10týdenních, placebem kontrolovaných studiích přípravku ABILIFY 10 mg u starších pacientů s psychózou spojenou s Alzheimerovou chorobou (n=938; průměrný věk: 82,4 let; rozmezí: 56-99 let) byly nežádoucí účinky, které byly hlášeny s incidencí ≥ 3 % a incidence ABILIFY 15 mg alespoň dvakrát vyšší než u placeba byla letargie  [placebo 2 %, ABILIFY 5 %], ospalost (včetně sedace) [placebo 3 %, ABILIFY 8 %] a inkontinence (především , močová inkontinence) [placebo 1%, ABILIFY 5%], nadměrné slinění [placebo 0%, ABILIFY 4%] a závratě [placebo 1%, ABILIFY 4%].
Bezpečnost a účinnost přípravku ABILIFY 15 mg při léčbě pacientů s psychózou spojenou s demencí nebyla stanovena. Pokud se předepisující lékař rozhodne léčit takové pacienty přípravkem ABILIFY 15 mg, posuďte, zda se neobjevily potíže s polykáním nebo nadměrná ospalost, které by mohly predisponovat k náhodnému poranění nebo aspiraci [viz VAROVÁNÍ V KRABICE ].
Cerebrovaskulární nežádoucí příhody, včetně mrtvice
V placebem kontrolovaných klinických studiích (dvě studie s flexibilními dávkami a jedna studie s fixní dávkou) psychózy související s demencí byl u pacientů léčených přípravkem ABILIFY zaznamenán zvýšený výskyt cerebrovaskulárních nežádoucích příhod (např. mozková mrtvice, tranzitorní ischemická ataka), včetně úmrtí ( průměrný věk: 84 let; rozmezí: 78-88 let). Ve studii s fixní dávkou byl u pacientů léčených přípravkem ABILIFY statisticky významný vztah odpovědi na dávku pro cerebrovaskulární nežádoucí příhody. ABILIFY není schválen pro léčbu pacientů s psychózou související s demencí [viz VAROVÁNÍ V KRABICE ].
Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a dalších) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (ve věku 18–24 let) s MDD. a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl mezi léky a placebem v počtu případů suicidality na 1000 léčených pacientů) jsou uvedeny v tabulce 5.
žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými se vyskytly sebevraždy, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny u dospělých a dětských pacientů léčených antidepresivy pro MDD i pro jiné indikace, psychiatrické i nepsychiatrické. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky popsané výše. , jakož i vznik suicidality, a takové příznaky neprodleně hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro ABILIFY by měly být napsány na nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese.
Je třeba poznamenat, že ABILIFY 20 mg není schválen pro použití při léčbě deprese u pediatrické populace.
Neuroleptický maligní syndrom (NMS)
Při podávání antipsychotik, včetně přípravku ABILIFY, se může objevit potenciálně fatální komplex symptomů, někdy označovaný jako neuroleptický maligní syndrom (NMS). vzácné případy NMS se vyskytly během léčby ABILIFY 15 mg v celosvětové klinické databázi. Klinickými projevy NMS jsou hyperpyrexie, svalová rigidita, změněný duševní stav a známky autonomní nestability (nepravidelný puls nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní selhání ledvin.
Diagnostické hodnocení pacientů s tímto syndromem je složité. Při stanovení diagnózy je důležité vyloučit případy, kdy klinický obraz zahrnuje jak závažné onemocnění (např. pneumonie, systémová infekce), tak neléčené nebo nedostatečně léčené extrapyramidové příznaky a symptomy (EPS). Další důležitá hlediska v diferenciální diagnóze zahrnují centrální anticholinergní toxicitu, úpal, horečku po drogách a primární patologii centrálního nervového systému.
Léčba NMS by měla zahrnovat: 1) okamžité vysazení antipsychotik a jiných léků, které nejsou nezbytné pro souběžnou léčbu; 2) intenzivní symptomatická léčba a lékařské sledování; a 3) léčba jakýchkoli doprovodných vážných zdravotních problémů, pro které je k dispozici specifická léčba. Neexistuje obecná shoda ohledně specifických farmakologických léčebných režimů pro nekomplikovaný NMS.
Vyžaduje-li pacient po zotavení z NMS léčbu antipsychotickými léky, je třeba pečlivě zvážit případné znovuzavedení lékové terapie. Pacient by měl být pečlivě sledován, protože byly hlášeny recidivy NMS.
Tardivní dyskineze
U pacientů léčených antipsychotiky se může vyvinout syndrom potenciálně ireverzibilních, mimovolních, dyskinetických pohybů. Ačkoli se zdá, že prevalence syndromu je nejvyšší u starších osob, zejména u starších žen, není možné spoléhat na odhady prevalence, které by na začátku antipsychotické léčby předpověděly, u kterých pacientů se syndrom pravděpodobně rozvine. Není známo, zda se antipsychotické léčivé přípravky liší svým potenciálem způsobit tardivní dyskinezi.
Předpokládá se, že riziko rozvoje tardivní dyskineze a pravděpodobnost, že se stane ireverzibilní, se zvyšuje s délkou léčby a celkovou kumulativní dávkou antipsychotik podávaných pacientovi. Syndrom se však může vyvinout, i když mnohem méně často, po relativně krátkých obdobích léčby nízkými dávkami.
Tardivní dyskineze může částečně nebo úplně odeznít, pokud je antipsychotická léčba vysazena. Antipsychotická léčba sama o sobě však může potlačit (nebo částečně potlačit) známky a symptomy syndromu, a tím případně maskovat základní proces. Účinek, který má symptomatická suprese na dlouhodobý průběh syndromu, není znám.
Vzhledem k těmto úvahám by měl být ABILIFY předepisován způsobem, který s největší pravděpodobností minimalizuje výskyt tardivní dyskineze. Chronická antipsychotická léčba by měla být obecně vyhrazena pro pacienty, kteří trpí chronickým onemocněním, o kterém (1) je známo, že reagují na antipsychotika, a (2) pro které není dostupná nebo vhodná alternativní, stejně účinná, ale potenciálně méně škodlivá léčba. U pacientů, kteří vyžadují chronickou léčbu, je třeba hledat nejnižší dávku a nejkratší dobu trvání léčby, která vede k uspokojivé klinické odpovědi. Potřeba pokračování v léčbě by měla být pravidelně přehodnocována.
Pokud se u pacienta na ABILIFY objeví známky a příznaky tardivní dyskineze, je třeba zvážit vysazení léku. Někteří pacienti však mohou vyžadovat léčbu přípravkem ABILIFY 15 mg navzdory přítomnosti syndromu.
Metabolické změny
Atypická antipsychotika jsou spojována s metabolickými změnami, které zahrnují hyperglykémii/diabetes mellitus, dyslipidémii a nárůst tělesné hmotnosti. I když bylo prokázáno, že všechny léky ve třídě vyvolávají určité metabolické změny, každý lék má svůj vlastní specifický rizikový profil.
Hyperglykémie/Diabetes Mellitus
U pacientů léčených atypickými antipsychotiky byla hlášena hyperglykémie, v některých případech extrémní a spojená s ketoacidózou nebo hyperosmolárním kómatem nebo smrtí. U pacientů léčených přípravkem ABILIFY byly hlášeny případy hyperglykémie (viz NEŽÁDOUCÍ REAKCE ]. Posouzení vztahu mezi atypickým užíváním antipsychotik a glukózovými abnormalitami je komplikováno možností zvýšeného základního rizika diabetes mellitus u pacientů se schizofrenií a zvyšujícím se výskytem diabetes mellitus v běžné populaci. Vzhledem k těmto matoucím faktorům není vztah mezi atypickým užíváním antipsychotik a nežádoucími účinky souvisejícími s hyperglykémií zcela pochopen. Epidemiologické studie však naznačují zvýšené riziko nežádoucích účinků souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky. Protože přípravek ABILIFY nebyl v době provádění těchto studií na trhu, není známo, zda je přípravek ABILIFY spojen s tímto zvýšeným rizikem. Přesné odhady rizik nežádoucích reakcí souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky nejsou k dispozici.
Pacienti s prokázanou diagnózou diabetes mellitus, u kterých byla zahájena léčba atypickými antipsychotiky, by měli být pravidelně sledováni, zda nedochází ke zhoršení glukózové kontroly. Pacienti s rizikovými faktory pro diabetes mellitus (např. obezita, rodinná anamnéza diabetu), kteří zahajují léčbu atypickými antipsychotiky, by měli podstoupit vyšetření glykémie nalačno na začátku léčby a pravidelně během léčby. U každého pacienta léčeného atypickými antipsychotiky je třeba sledovat příznaky hyperglykémie včetně polydipsie, polyurie, polyfagie a slabosti. Pacienti, u kterých se během léčby atypickými antipsychotiky objeví příznaky hyperglykémie, by měli podstoupit vyšetření glykémie nalačno. V některých případech hyperglykémie ustoupila po vysazení atypického antipsychotika; někteří pacienti však vyžadovali pokračování v antidiabetické léčbě i přes vysazení podezřelého léku.
Dospělí
analýze 13 placebem kontrolovaných monoterapeutických studií u dospělých, primárně se schizofrenií nebo bipolární poruchou, nebyla průměrná změna glykémie nalačno u pacientů léčených přípravkem ABILIFY (+4,4 mg/dl; střední expozice 25 dní; N=1057) signifikantně jiné než u pacientů léčených placebem (+2,5 mg/dl; střední expozice 22 dní; N=799). Tabulka 6 ukazuje podíl pacientů léčených přípravkem ABILIFY s normální a hraniční glykémií nalačno na začátku (medián expozice 25 dní), kteří měli v souvislosti s léčbou vysokou hladinu glukózy nalačno, ve srovnání s pacienty léčenými placebem (medián expozice 22 dní).
Po 24 týdnech se průměrná změna glykémie nalačno u pacientů léčených přípravkem ABILIFY významně nelišila od pacientů léčených placebem [+2,2 mg/dl (n=42) a +9,6 mg/dl (n=28), v tomto pořadí] .
Průměrná změna glykémie nalačno u pacientů s velkou depresivní poruchou léčených přípravkem ABILIFY (+0,7 mg/dl; střední expozice 42 dní; N=241) se významně nelišila od pacientů léčených placebem (+0,8 mg/dl; medián expozice 42 dní; N=246). Tabulka 7 ukazuje podíl dospělých pacientů se změnami hladin glukózy nalačno ze dvou placebem kontrolovaných doplňkových studií (medián expozice 42 dní) u pacientů s velkou depresivní poruchou.
Pediatričtí pacienti a dospívající
V analýze dvou placebem kontrolovaných studií u dospívajících se schizofrenií (13 až 17 let) a pediatrických pacientů s bipolární poruchou (10 až 17 let) byla průměrná změna glykémie nalačno u pacientů léčených přípravkem ABILIFY (+4,8 mg/dl; se střední expozicí 43 dnů; N=259) se významně nelišila od pacientů léčených placebem (+1,7 mg/dl; s mediánem expozice 42 dnů; N=123).
analýze dvou placebem kontrolovaných studií u pediatrických a dospívajících pacientů s podrážděností spojenou s autistickou poruchou (6 až 17 let) s mediánem expozice 56 dnů byla průměrná změna glykémie nalačno u pacientů léčených přípravkem ABILIFY (–0,2 mg /dl; N=83) se významně nelišila od pacientů léčených placebem (-0,6 mg/dl; N=33).
V analýze dvou placebem kontrolovaných studií u pediatrických a dospívajících pacientů s Tourettovou poruchou (6 až 18 let) s mediánem expozice 57 dní byla průměrná změna glykémie nalačno u pacientů léčených přípravkem ABILIFY (0,79 mg/dl; N=90) se významně nelišila od pacientů léčených placebem (-1,66 mg/dl; N=58).
Tabulka 8 ukazuje podíl pacientů se změnami hladin glukózy nalačno od sdružených dospívajících schizofrenií a pediatrických bipolárních pacientů (medián expozice 42–43 dnů), ze dvou placebem kontrolovaných studií u pediatrických pacientů (6 až 17 let) s podrážděností s autistickou poruchou (medián expozice 56 dní) a ze dvou placebem kontrolovaných studií u pediatrických pacientů (6 až 18 let) s Touretteovou poruchou (medián expozice 57 dní).
Po 12 týdnech v souhrnných studiích se schizofrenií a pediatrickou bipolární poruchou se průměrná změna glykémie nalačno u pacientů léčených přípravkem ABILIFY významně nelišila od pacientů léčených placebem [+2,4 mg/dl (n=81) a +0,1 mg /dl (n=15), v tomto pořadí].
Dyslipidémie
U pacientů léčených atypickými antipsychotiky byly pozorovány nežádoucí změny lipidů.
Nebyly žádné významné rozdíly mezi pacienty léčenými přípravkem ABILIFY a pacienty léčenými placebem v poměru se změnami z normálních na klinicky významné hladiny celkového cholesterolu nalačno/bez lačno, triglyceridů nalačno, LDL na lačno a HDL nalačno/bez lačno. Analýzy pacientů s alespoň 12 nebo 24týdenní expozicí byly omezeny malým počtem pacientů.
Dospělí
Tabulka 9 ukazuje podíl dospělých pacientů, primárně ze souhrnných placebem kontrolovaných studií monoterapie schizofrenie a bipolární poruchy, se změnami celkového cholesterolu (shromážděný ze 17 studií; střední expozice 21 až 25 dnů), triglyceridů nalačno (shromážděných z osmi studií; medián expozice 42 dní), LDL cholesterol nalačno (shromážděný z osmi studií; střední expozice 39 až 45 dní, s výjimkou pacientů léčených placebem s normálními hodnotami LDL nalačno, kteří měli střední expozici při léčbě 24 dní) a HDL cholesterol (sdružený z devíti studie, střední expozice 40 až 42 dní).
Ve studiích monoterapie u dospělých byl podíl pacientů ve 12. a 24. týdnu se změnami celkového cholesterolu (na lačno/bez lačno), triglyceridů nalačno a LDL cholesterolu nalačno podobný mezi pacienty léčenými přípravkem ABILIFY a placebem: 12 týdnů, celkový cholesterol (na lačno/bez půstu), 1/71 (1,4 %) vs. 3/74 (4,1 %); Triglyceridy nalačno, 8/62 (12,9 %) vs. 5/37 (13,5 %); LDL cholesterol nalačno, 0/34 (0 %) vs. 1/25 (4,0 %); a ve 24. týdnu celkový cholesterol (na lačno/bez půstu), 1/42 (2,4 %) vs. 3/37 (8,1 %); Triglyceridy nalačno, 5/34 (14,7 %) vs. 5/20 (25 %); LDL cholesterol nalačno, 0/22 (0 %) vs. 1/18 (5,6 %), resp.
Tabulka 10 ukazuje podíl pacientů se změnami celkového cholesterolu (na lačno/bez lačnění), triglyceridů nalačno, LDL cholesterolu nalačno a HDL cholesterolu ze dvou placebem kontrolovaných doplňkových studií u dospělých pacientů s velkou depresivní poruchou (medián expozice 42 dní).
Pediatričtí pacienti a dospívající
Tabulka 11 ukazuje podíl dospívajících se schizofrenií (13 až 17 let) a pediatrických pacientů s bipolární poruchou (10 až 17 let) se změnami celkového cholesterolu a HDL cholesterolu (shromážděno ze dvou placebem kontrolovaných studií; střední expozice 42 až 43 dní ) a triglyceridy nalačno (shromážděné ze dvou placebem kontrolovaných studií; střední expozice 42 až 44 dní).
Ve studiích monoterapie u dospívajících se schizofrenií a pediatrických pacientů s bipolární poruchou byl podíl pacientů ve 12. a 24. týdnu se změnami celkového cholesterolu z normálního na vysoký (nalačno/bez lačno), triglyceridů nalačno a LDL cholesterolu nalačno mezi ABILIFY - pacienti a pacienti léčení placebem: po 12 týdnech celkový cholesterol (nalačno/nehladověl), 0/57 Â (0 %) vs. 0/15 (0 %); Triglyceridy nalačno, 2/72 (2,8 %) vs. 1/14 (7,1 %); a ve 24. týdnu celkový cholesterol (nalačno/nehladovět), 0/36 (0 %) vs. 0/12 (0 %); Triglyceridy nalačno, 1/47 (2,1 %) vs. 1/10 (10,0 %).
Tabulka 12 ukazuje podíl pacientů se změnami celkového cholesterolu (na lačno/bez lačnění) a triglyceridů nalačno (medián expozice 56 dní) a HDL cholesterolu (medián expozice 55 až 56 dní) ze dvou placebem kontrolovaných studií u pediatrických pacientů (6 až 17 let) s podrážděností spojenou s autistickou poruchou.
Tabulka 13 ukazuje podíl pacientů se změnami celkového cholesterolu (na lačno/bez lačnění) a triglyceridů nalačno (medián expozice 57 dní) a HDL cholesterolu (medián expozice 57 dní) ze dvou placebem kontrolovaných studií u pediatrických pacientů (6 až 18 let) s Tourettovou poruchou.
Přibývání na váze
Při užívání atypických antipsychotik bylo pozorováno zvýšení tělesné hmotnosti. Doporučuje se klinické sledování hmotnosti.
Dospělí
V analýze 13 placebem kontrolovaných monoterapeutických studií, primárně z kombinované schizofrenie a bipolární poruchy, s mediánem expozice 21 až 25 dnů, byla průměrná změna tělesné hmotnosti u pacientů léčených přípravkem ABILIFY +0,3 kg (N=1673) ve srovnání do –0,1 kg (N=1100) u placebem kontrolovaných pacientů. Po 24 týdnech byla průměrná změna tělesné hmotnosti od výchozí hodnoty u pacientů léčených přípravkem ABILIFY – 1,5 kg (n=73) ve srovnání s –0,2 kg (n=46) u pacientů léčených placebem.
Ve studiích s přidáním přípravku ABILIFY k antidepresivům pacienti nejprve dostávali 8 týdnů antidepresivní léčby a následně 6 týdnů doplňkové léčby přípravkem ABILIFY 10 mg nebo placebem navíc k jejich pokračující léčbě antidepresivy. Průměrná změna tělesné hmotnosti u pacientů užívajících jako přídatnou léčbu ABILIFY byla +1,7 kg (N=347) ve srovnání s +0,4 kg (N=330) u pacientů užívajících jako přídavné placebo.
Tabulka 14 ukazuje procento dospělých pacientů s hmotnostním přírůstkem ≥7 % tělesné hmotnosti podle indikace.
Pediatričtí pacienti a dospívající
V analýze dvou placebem kontrolovaných studií u dospívajících se schizofrenií (13 až 17 let) a pediatrických pacientů s bipolární poruchou (10 až 17 let) s mediánem expozice 42 až 43 dnů byla průměrná změna tělesné hmotnosti u pacientů léčených přípravkem ABILIFY pacientů byla +1,6 kg (N=381) ve srovnání s +0,3 kg (N=187) u pacientů léčených placebem. Po 24 týdnech byla průměrná změna tělesné hmotnosti od výchozí hodnoty v
Pacienti léčení přípravkem ABILIFY měli +5,8 kg (n=62) ve srovnání s +1,4 kg (n=13) u pacientů užívajících placebo.
Ve dvou krátkodobých, placebem kontrolovaných studiích u pacientů (6 až 17 let) s podrážděností spojenou s autistickou poruchou s mediánem expozice 56 dnů byla průměrná změna tělesné hmotnosti u pacientů léčených přípravkem ABILIFY +1,6 kg (n=209 ) ve srovnání s +0,4 kg (n=98) u pacientů léčených placebem.
Ve dvou krátkodobých, placebem kontrolovaných studiích u pacientů (6 až 18 let) s Touretteovou poruchou s mediánem expozice 57 dní byla průměrná změna tělesné hmotnosti u pacientů léčených přípravkem ABILIFY +1,5 kg (n=105 ) ve srovnání s +0,4 kg (n=66) u pacientů léčených placebem.
Tabulka 15 ukazuje procento pediatrických a dospívajících pacientů s hmotnostním přírůstkem ≥7 % tělesné hmotnosti podle indikace.
otevřené studii, do které byli zařazeni pacienti ze dvou placebem kontrolovaných studií s dospívajícími se schizofrenií (13 až 17 let) a dětskými pacienty s bipolární poruchou (10 až 17 let), dokončilo 73,2 % pacientů (238/325) 26. týdnech léčby přípravkem ABILIFY. Po 26 týdnech přibralo 32,8 % pacientů ≥ 7 % své tělesné hmotnosti, neupravené pro normální růst. Pro úpravu na normální růst byla odvozena z-skóre (měřená ve směrodatných odchylkách [SD]), která se normalizují pro přirozený růst dětských pacientů a dospívajících srovnáním s věkově a genderově odpovídajícími populačními standardy. Změna z-skóre
otevřené studii, do které byli zařazeni pacienti ze dvou krátkodobých, placebem kontrolovaných studií, pacienti (6 až 17 let) s podrážděností spojenou s autistickou poruchou, stejně jako pacienti de novo, dokončilo 60,3 % (199/330) jednu rok terapie s ABILIFY. Průměrná změna z-skóre hmotnosti byla 0,26 SD pro pacienty, kteří dostávali >9 měsíců léčby.
Při léčbě pediatrických pacientů z jakékoli indikace by měl být přírůstek hmotnosti sledován a posuzován v porovnání s přírůstkem očekávaným pro normální růst.
Patologické hráčství a jiné kompulzivní chování
Postmarketingové kazuistiky naznačují, že pacienti mohou během užívání aripiprazolu pociťovat intenzivní nutkání, zejména po hraní, a neschopnost ovládat tyto nutkání. Mezi další nutkavé touhy, uváděné méně často, patří: sexuální touhy, nakupování, přejídání nebo záchvatovité přejídání a další impulzivní nebo kompulzivní chování. Vzhledem k tomu, že pacienti nemusí rozpoznat toto chování jako abnormální, je důležité, aby se předepisující lékaři zeptali pacientů nebo jejich pečovatelů konkrétně na rozvoj nových nebo intenzivních nutkání k hraní hazardních her, nutkavých sexuálních nutkání, nutkavého nakupování, záchvatovitého nebo nutkavého přejídání nebo jiných nutkání během léčby. s aripiprazolem. Je třeba poznamenat, že symptomy kontroly impulzů mohou být spojeny se základní poruchou. V některých případech, i když ne ve všech, bylo hlášeno, že nutkání přestalo, když byla dávka snížena nebo byla léčba přerušena. Kompulzivní chování může mít za následek poškození pacienta a ostatních, pokud není rozpoznáno. Pokud se u pacienta objeví takové nutkání, zvažte snížení dávky nebo ukončení léčby.
Ortostatická hypotenze
ABILIFY 20 mg může způsobit ortostatickou hypotenzi, pravděpodobně kvůli svému antagonismu α1-adrenergních receptorů. Výskyt příhod spojených s ortostatickou hypotenzí z krátkodobých, placebem kontrolovaných studií u dospělých pacientů s perorálním ABILIFY (n=2467) zahrnoval (incidence ABILIFY 20 mg, incidence placeba) ortostatickou hypotenzi (1 %, 0,3 %), posturální závratě ( 0,5 %, 0,3 %) a synkopa (0,5 %, 0,4 %); pediatrických pacientů ve věku 6 až 18 let (n=732) užívajících perorální ABILIFY zahrnovalo ortostatickou hypotenzi (0,5 %, 0 %), posturální závratě (0,4 %, 0 %) a synkopu (0,2 %, 0 %); a pacientů na ABILIFY injekci (n=501) zahrnovaly ortostatickou hypotenzi (0,6 %, 0 %), posturální závratě (0,2 %, 0,5 %) a synkopu (0,4 %, 0 %) [viz NEŽÁDOUCÍ REAKCE ].
Výskyt významné ortostatické změny krevního tlaku (definované jako pokles systolického krevního tlaku ≥20 mmHg doprovázený zvýšením srdeční frekvence ≥25 tepů/min při srovnání hodnot ve stoje a vleže) se u přípravku ABILIFY významně nelišil od placeba (výskyt ABILIFY , výskyt placeba): u dospělých pacientů léčených perorálně ABILIFY (4 %, 2 %), u pediatrických perorálních
Pacienti léčení ABILIFY ve věku 6 až 18 let (0,4 %, 1 %) nebo pacienti léčení ABILIFY 15 mg injekčně (3 %, 2 %).
ABILIFY 20 mg by se měl používat s opatrností u pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemická choroba srdeční, srdeční selhání nebo poruchy převodu), cerebrovaskulárním onemocněním nebo stavy, které by mohly pacienty predisponovat k hypotenzi (dehydratace, hypovolémie a léčba antihypertenzivy léky) [viz DROGOVÉ INTERAKCE ].
Pokud je parenterální léčba benzodiazepiny považována za nezbytnou navíc k injekční léčbě ABILIFY, pacienti by měli být sledováni kvůli nadměrné sedaci a ortostatické hypotenzi (viz DROGOVÉ INTERAKCE ].
Falls
Antipsychotika, včetně ABILIFY 10 mg, mohou způsobit ospalost, posturální hypotenzi, motorickou a senzorickou nestabilitu, což může vést k pádům a následně ke zlomeninám nebo jiným zraněním. U pacientů s nemocemi, stavy nebo léky, které by mohly tyto účinky zhoršit, dokončete posouzení rizika pádu při zahájení antipsychotické léčby a opakovaně u pacientů na dlouhodobé antipsychotické léčbě.
Leukopenie, neutropenie a agranulocytóza
V klinických studiích a/nebo po uvedení přípravku na trh byly hlášeny případy leukopenie a neutropenie dočasně související s antipsychotiky, včetně přípravku ABILIFY. Byla také hlášena agranulocytóza.
Mezi možné rizikové faktory leukopenie/neutropenie patří již existující nízký počet bílých krvinek (WBC)/absolutní počet neutrofilů (ANC) a leukopenie/neutropenie v anamnéze. U pacientů s anamnézou klinicky významného nízkého počtu WBC/ANC nebo leukopenie/neutropenie vyvolané léky provádějte často během prvních měsíců léčby kompletní krevní obraz (CBC). U takových pacientů zvažte přerušení léčby přípravkem ABILIFY při prvních známkách klinicky významného poklesu počtu WBC při absenci jiných příčinných faktorů.
Monitorujte pacienty s klinicky významnou neutropenií kvůli horečce nebo jiným symptomům nebo známkám infekce, a pokud se takové příznaky nebo příznaky objeví, okamžitě léčte. U pacientů s těžkou neutropenií (absolutní počet neutrofilů
Záchvaty/křeče
krátkodobých, placebem kontrolovaných studiích se u pacientů s anamnézou záchvatů vylučující záchvaty/křeče vyskytly u 0,1 % (3/2 467) nediagnostikovaných dospělých pacientů léčených perorálním přípravkem ABILIFY 20 mg, u 0,1 % (1/732) dětských pacientů (6 až 18 let) a u 0,2 % (1/501) dospělých pacientů léčených ABILIFY 15 mg injekčně.
Stejně jako u jiných antipsychotik by měl být ABILIFY 15 mg používán s opatrností u pacientů se záchvaty v anamnéze nebo se stavy, které snižují práh záchvatů. Stavy, které snižují práh záchvatů, mohou být častější v populaci ve věku 65 let nebo starší.
Potenciál pro kognitivní a motorické poruchy
ABILIFY, stejně jako jiná antipsychotika, může mít potenciál narušit úsudek, myšlení nebo motorické dovednosti. Například v krátkodobých, placebem kontrolovaných studiích byla ospalost (včetně sedace) hlášena následovně (výskyt ABILIFY, výskyt placeba): u dospělých pacientů (n=2467) léčených perorálním přípravkem ABILIFY (11 %, 6 %), u dětských pacientů ve věku 6 až 17 let (n=611) (24 %, 6 %) au dospělých pacientů (n=501) na ABILIFY injekci (9 %, 6 %). Somnolence (včetně sedace) vedla k přerušení u 0,3 % (8/2 467) dospělých pacientů a 3 % (20/732) dětských pacientů (6 až 18 let) perorálního ABILIFY 10 mg v krátkodobých, placebem kontrolovaných studiích, ale nevedlo k přerušení žádného dospělého pacienta na ABILIFY injekci.
Navzdory relativně mírnému zvýšenému výskytu těchto příhod ve srovnání s placebem by pacienti měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že je léčba přípravkem ABILIFY 15 mg nepříznivě neovlivňuje.
Regulace tělesné teploty
Narušení schopnosti těla snižovat tělesnou teplotu se připisuje antipsychotikům. Při předepisování přípravku ABILIFY 10 mg pacientům, kteří budou mít stavy, které mohou přispívat ke zvýšení tělesné teploty (např. namáhavé cvičení, vystavení extrémnímu horku, souběžnou léčbu s anticholinergní aktivitou nebo dehydrataci), se doporučuje náležitá opatrnost. [vidět NEŽÁDOUCÍ REAKCE ].
Sebevražda
Možnost pokusu o sebevraždu je vlastní psychotickým onemocněním, bipolární poruše a velké depresivní poruše a lékovou terapii by měl doprovázet pečlivý dohled nad vysoce rizikovými pacienty. Předpisy pro ABILIFY by měly být napsány na nejmenší množství v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování [viz NEŽÁDOUCÍ REAKCE ].
Dysfagie
Dysmotilita jícnu a aspirace jsou spojovány s užíváním antipsychotik, včetně ABILIFY. Aspirační pneumonie je častou příčinou morbidity a mortality u starších pacientů, zejména u pacientů s pokročilou Alzheimerovou demencí. ABILIFY a další antipsychotika by měly být používány opatrně u pacientů s rizikem aspirační pneumonie (viz Zvýšená úmrtnost u starších pacientů s psychózou související s demencí a NEŽÁDOUCÍ REAKCE ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Diskutujte o následujících problémech s pacienty, kterým byl předepsán přípravek ABILIFY:
Klinické zhoršení deprese a rizika sebevraždy
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Rodiny a pečovatelé pacientů by měli být poučeni, aby každý den hledali výskyt těchto příznaků, protože změny mohou být náhlé. Takové příznaky by měly být hlášeny pacientovi předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, začínají náhle nebo nejsou součástí symptomů pacienta. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o výhodách a rizicích spojených s léčbou přípravkem ABILIFY a měli by jim poradit, jak správně používat. Pro společnost ABILIFY je k dispozici příručka pro pacienty, která obsahuje informace o „antidepresivních lécích, depresi a jiných vážných duševních onemocněních a sebevražedných myšlenkách nebo akcích“. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Příručku o medikaci, a měl by jim pomoci porozumět jejímu obsahu. Pacienti by měli mít příležitost prodiskutovat obsah Příručky pro léky a získat odpovědi na případné otázky. Je třeba poznamenat, že ABILIFY není schválen jako samostatný přípravek pro léčbu deprese a nebyl hodnocen u pediatrické velké depresivní poruchy.
Patologické hráčství a jiné kompulzivní chování
Informujte pacienty a jejich pečovatele o možnosti, že mohou pociťovat nutkavé nutkání nakupovat, intenzivní nutkání k hazardním hrám, nutkavé sexuální touhy, záchvatovité přejídání a/nebo jiné nutkavé touhy a neschopnost ovládat tato nutkání při užívání aripiprazolu. V některých případech, ale ne ve všech, bylo hlášeno, že nutkání přestalo, když byla dávka snížena nebo zastavena [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Použití tablety rozpadající se v ústech
Neotevírejte blistr, dokud nebudete připraveni k podání. Chcete-li vyjmout jednu tabletu, otevřete balení a odloupněte fólii na blistru, abyste odkryli tabletu. Neprotlačujte tablet přes fólii, protože by to mohlo tabletu poškodit. Ihned po otevření blistru suchýma rukama vyjměte tabletu a položte celou tabletu ABILIFY DISCMELT na jazyk. Ve slinách dochází k rychlému rozpadu tablety. Doporučuje se užívat přípravek ABILIFY DISCMELT bez tekutiny. V případě potřeby jej však lze zapít tekutinou. Nepokoušejte se tablet rozdělit.
Zásah do kognitivního a motorického výkonu
Vzhledem k tomu, že ABILIFY může mít potenciál narušit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že je léčba ABILIFY nepříznivě neovlivňuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Souběžná medikace
Pacienti by měli být poučeni, aby informovali své lékaře, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože existuje možnost interakcí [viz DROGOVÉ INTERAKCE ].
Tepelná expozice a dehydratace
Pacienti by měli být informováni o vhodné péči, aby se zabránilo přehřátí a dehydrataci [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Obsah cukru
Pacienti by měli být informováni, že každý ml ABILIFY 10 mg perorálního roztoku obsahuje 400 mg sacharózy a 200 mg fruktózy.
Těhotenství
Informujte pacientky, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem ABILIFY otěhotní nebo plánují otěhotnět. Informujte pacienty, že ABILIFY 20 mg může u novorozence způsobit extrapyramidové a/nebo abstinenční příznaky (neklid, hypertonie, hypotonie, třes, ospalost, respirační tíseň a poruchy příjmu potravy). Informujte pacienty, že existuje registr těhotenství, který monitoruje výsledky těhotenství u žen vystavených ABILIFY 15 mg během těhotenství [viz Použití u konkrétních populací ].
Fenylketonurika
Fenylalanin je součástí aspartamu. Každá tableta ABILIFY DISCMELT pro perorální rozpad obsahuje následující množství: 10 mg, 1,12 mg fenylalaninu a 15 mg, 1,68 mg fenylalaninu.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Celoživotní studie karcinogenity byly provedeny u myší ICR, potkanů F344 a potkanů Sprague-Dawley (SD). Aripiprazol byl podáván po dobu 2 let v dietě v dávkách 1, 3, 10 a 30 mg/kg/den myším ICR a 1, 3 a 10 mg/kg/den potkanům F344 (0,2, 0,5, 2 a 5násobek a 0,3násobek, 1násobek a 3násobek MRHD 30 mg/den na základě mg/m² tělesného povrchu, v daném pořadí). Kromě toho byly potkanům SD podávány perorálně po dobu 2 let dávky 10, 20, 40 a 60 mg/kg/den, což je 3, 6, 13 a 19násobek MRHD na základě mg/m² plochy povrchu těla. Aripiprazol neindukoval nádory u samců myší nebo samců potkanů. U samic myší byla incidence adenomů hypofýzy a adenokarcinomů a adenoakantomů mléčné žlázy zvýšena při dietních dávkách 3 až 30 mg/kg/den (0,5 až 5násobek MRHD). U samic potkanů byl výskyt fibroadenomů mléčné žlázy zvýšen při dietní dávce 10 mg/kg/den (3násobek MRHD); a incidence adrenokortikálních karcinomů a kombinovaných adrenokortikálních adenomů/karcinomů byla zvýšena při perorální dávce 60 mg/kg/den (19násobek MRHD).
Po chronickém podávání jiných antipsychotik bylo u hlodavců zjištěno zvýšení novotvarů mléčné žlázy, hypofýzy a endokrinního pankreatu a předpokládá se, že je zprostředkováno prodlouženým antagonismem dopaminových D2-receptorů a hyperprolaktinemií. Sérový prolaktin nebyl měřen ve studiích kancerogenity aripiprazolu. Zvýšení sérových hladin prolaktinu však bylo pozorováno u myších samic ve 13týdenní dietní studii při dávkách spojených s nádory mléčné žlázy a hypofýzy. Sérový prolaktin nebyl u samic potkanů zvýšen ve 4týdenních a 13týdenních dietních studiích při dávce spojené s nádory mléčné žlázy. Význam nálezů endokrinních nádorů zprostředkovaných prolaktinem u hlodavců pro lidské riziko není jasný.
Mutageneze
Mutagenní potenciál aripiprazolu byl testován in vitro bakteriálním reverzním mutačním testem, in vitro bakteriálním testem opravy DNA, in vitro testem přímé genové mutace v buňkách myšího lymfomu, in vitro testem chromozomálních aberací v plicích čínského křečka (CHL) in vivo mikronukleový test u myší a neplánovaný test syntézy DNA u krys. Aripiprazol a metabolit (2,3-DCPP) byly klastogenní v in vitro testu chromozomálních aberací v buňkách CHL s metabolickou aktivací i bez ní. Metabolit, 2,3DCPP, zvýšil numerické aberace v in vitro testu v CHL buňkách bez metabolické aktivace. Pozitivní odpověď byla získána v mikronukleárním testu in vivo u myší; odpověď však byla způsobena mechanismem nepovažovaným za relevantní pro člověka.
Zhoršení Plodnosti
Samice potkanů byly léčeny perorálně aripiprazolem od 2 týdnů před pářením do 7. dne březosti v dávkách 2, 6 a 20 mg/kg/den, což jsou 0,6, 2 a 6násobky MRHD 30 mg/den na základě mg/m² tělesného povrchu. Nepravidelnosti estrálního cyklu a zvýšené žluté tělísko byly pozorovány při všech dávkách, ale nebylo pozorováno žádné poškození fertility. Zvýšená preimplantační ztráta byla pozorována při 2 a 6násobku MRHD a snížená hmotnost plodu byla pozorována při 6násobku MRHD.
Samci potkanů byli léčeni perorálně aripiprazolem od 9 týdnů před pářením až do páření v dávkách 20, 40 a 60 mg/kg/den, což je 6, 13 a 19násobek MRHD 30 mg/den na základě mg/ m² plochy povrchu těla. Poruchy spermatogeneze byly pozorovány při 19násobku MRHD a atrofie prostaty byla pozorována při 13 a 19násobku MRHD bez poškození fertility.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených atypickým antipsychotikům, včetně ABILIFY, během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty kontaktováním Národního registru těhotenství pro atypická antipsychotika na čísle 1-866-961-2388 nebo navštivte http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Shrnutí rizik
Novorozenci vystavení antipsychotikům, včetně ABILIFY 20 mg, během třetího trimestru těhotenství, jsou vystaveni riziku extrapyramidových a/nebo abstinenčních příznaků po porodu (viz Klinické úvahy ). Celkově dostupné údaje z publikovaných epidemiologických studií těhotných žen vystavených aripiprazolu neprokázaly s lékem spojené riziko závažných vrozených vad, potratu nebo nepříznivých následků pro matku nebo plod (viz Data ). Existují rizika pro matku spojená s neléčenou schizofrenií, bipolární poruchou I nebo velkou depresivní poruchou a s expozicí antipsychotikům, včetně přípravku ABILIFY, během těhotenství (viz Klinické úvahy ).
V reprodukčních studiích na zvířatech bylo perorální a intravenózní podávání aripiprazolu během organogeneze u potkanů a/nebo králíků v dávkách 10, resp. smrt plodu, snížená hmotnost plodu, nesestouplá varlata, opožděná osifikace skeletu, abnormality skeletu a brániční kýla. Perorální a intravenózní podávání aripiprazolu během pre- a postnatálního období potkanům v dávkách 10krát vyšších, než je MRHD na základě mg/m² plochy povrchu těla, vedlo k prodloužení březosti, mrtvě narozených mláďat, snížení hmotnosti mláďat a snížení přežití mláďat (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s nemocí
Pro matku existuje riziko neléčené schizofrenie nebo bipolární poruchy I, včetně zvýšeného rizika relapsu, hospitalizace a sebevraždy. Schizofrenie a bipolární porucha I jsou spojeny se zvýšenými nepříznivými perinatálními následky, včetně předčasného porodu. Není známo, zda je to přímý důsledek onemocnění nebo jiných komorbidních faktorů.
Prospektivní, longitudinální studie sledovala 201 těhotných žen s anamnézou velké depresivní poruchy, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Ženy, které vysadily antidepresiva během těhotenství, měly větší pravděpodobnost recidivy těžké deprese než ženy, které v antidepresivech pokračovaly. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Fetální/neonatální nežádoucí reakce
Extrapyramidové a/nebo abstinenční příznaky, včetně agitovanosti, hypertonie, hypotonie, třesu, somnolence, respirační tísně a poruchy příjmu potravy byly hlášeny u novorozenců, kteří byli vystaveni antipsychotikům (včetně ABILIFY) během třetího trimestru těhotenství. Tyto příznaky mají různou závažnost. Monitorujte novorozence na extrapyramidové a/nebo abstinenční příznaky a příslušně řiďte příznaky. Někteří novorozenci se zotavili během hodin nebo dnů bez specifické léčby; ostatní vyžadovali delší hospitalizaci.
Data
Lidská data
Publikovaná data z observačních studií, registrů narození a kazuistik o užívání atypických antipsychotik v těhotenství neuvádějí jednoznačnou souvislost s antipsychotiky a velkými vrozenými vadami. Retrospektivní studie z databáze Medicaid zahrnující 9258 žen vystavených antipsychotikům během těhotenství neprokázala celkové zvýšené riziko závažných vrozených vad.
Údaje o zvířatech
Ve studiích na zvířatech aripiprazol prokázal vývojovou toxicitu, včetně možných teratogenních účinků u potkanů a králíků.
březích potkanů léčených perorálně aripiprazolem během organogeneze v dávkách 3, 10 a 30 mg/kg/den, což jsou přibližně 1, 3 a 10násobek MRHD 30 mg/den na základě mg/m² tělesného povrchu, a mírné prodloužení gestace a zpoždění ve vývoji plodu, o čemž svědčí snížená hmotnost plodu a nesestouplá varlata, byly pozorovány při 10násobku MRHD. Zpožděná osifikace skeletu byla pozorována při 3 a 10násobku MRHD. Porození potomci měli zvýšený výskyt hepatodiafragmatických uzlů a brániční kýly byly pozorovány při 10násobku MRHD (ostatní dávkové skupiny nebyly pro tyto nálezy vyšetřovány). Postnatálně bylo opožděné otevření pochvy pozorováno při 3 a 10násobku MRHD. Zhoršená reprodukční výkonnost (snížená plodnost, corpora lutea, implantáty, živé plody a zvýšená postimplantační ztráta, pravděpodobně zprostředkovaná účinky na samičí potomstvo) byla pozorována při 10násobku MRHD; nebyly však žádné důkazy, které by naznačovaly, že tyto vývojové účinky byly sekundární k mateřské toxicitě.
březích potkanů, kterým byl během organogeneze intravenózně injikován aripiprazol v dávkách 3, 9 a 27 mg/kg/den, což jsou 1, 3 a 9násobek MRHD 30 mg/den na základě mg/m² tělesného povrchu, se snížil hmotnost plodu a opožděná osifikace skeletu byly pozorovány při 9násobku MRHD; tato dávka také způsobila toxicitu pro matku.
U březích králíků léčených perorálně aripiprazolem během organogeneze v dávkách 10, 30 a 100 mg/kg/den, které jsou 6, 19 a 65násobkem MRHD 30 mg/den na základě mg/m² tělesného povrchu, došlo ke snížení mateřské konzumace potravin a zvýšená potratovost a také zvýšená úmrtnost plodu byla pozorována na 65násobku MHRD. Snížená hmotnost plodu a zvýšený výskyt srostlých hrudních kostí byly pozorovány při 19 a 65násobku MRHD.
březích králíků, kterým byl aripiprazol intravenózně injikován během organogeneze v dávkách 3, 10 a 30 mg/kg/den, což jsou 2, 6 a 19násobek MRHD 30 mg/den na základě mg/m² tělesného povrchu, se snížil hmotnost plodu, zvýšené abnormality plodu (primárně skeletální) a snížená osifikace skeletu plodu byly pozorovány při 19násobku MRHD; tato dávka také způsobila toxicitu pro matku. Dávka bez účinku na plod byla 10 mg/kg/den, což je 6násobek MRHD.
U potkanů léčených perorálně aripiprazolem peri- a postnatálně od 17. dne březosti do 21. dne po porodu v dávkách 3, 10 a 30 mg/kg/den, což je 1, 3 a 10násobek MRHD 30 mg/den na základě mg/m² plochy tělesného povrchu byla pozorována mírná toxicita pro matku a mírně prodloužená gestace při 10násobku MHRD. Při této dávce bylo také pozorováno zvýšení počtu mrtvě narozených mláďat a snížení hmotnosti mláďat (přetrvávající do dospělosti) a přežití.
potkanů, kterým byl aripiprazol podáván intravenózně od 6. dne březosti do 20. dne laktace v dávkách 3, 8 a 20 mg/kg/den, což jsou 1, 3 a 6násobek MRHD 30 mg/den na základě mg/m² plocha povrchu těla byla pozorována zvýšená porodnost při 3 a 6násobku MRHD; a snížení hmotnosti a přežití mláďat v časném postnatálním období bylo pozorováno při 6násobku MRHD; tyto dávky také způsobily určitou toxicitu pro matku. Nebyly pozorovány žádné účinky na postnatální behaviorální a reprodukční vývoj.
Laktace
Shrnutí rizik
Omezené údaje z publikované literatury uvádějí přítomnost aripiprazolu v lidském mateřském mléce v relativních dávkách pro kojence v rozmezí 0,7 % až 8,3 % dávky upravené podle hmotnosti matky. Existují zprávy o nízkém přírůstku hmotnosti u kojených dětí vystavených aripiprazolu a zprávy o nedostatečném přísunu mléka u kojících žen užívajících aripiprazol.
Rozvoj a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky ABILIFY a případnými nežádoucími účinky na kojené dítě ze strany ABILIFY nebo ze základního stavu matky.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů s velkou depresivní poruchou nebo agitovaností spojenou se schizofrenií nebo bipolární mánií nebyla stanovena.
Farmakokinetika aripiprazolu a dehydro-aripiprazolu u pediatrických pacientů ve věku 10 až 17 let byla po korekci na rozdíly v tělesné hmotnosti podobná jako u dospělých (viz KLINICKÁ FARMAKOLOGIE ].
Schizofrenie
Bezpečnost a účinnost u pediatrických pacientů se schizofrenií byla stanovena v 6týdenní, placebem kontrolované klinické studii u 202 pediatrických pacientů ve věku 13 až 17 let [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , a Klinické studie ]. Ačkoli udržovací účinnost u pediatrických pacientů nebyla systematicky hodnocena, udržovací účinnost lze extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů aripiprazolu u dospělých a pediatrických pacientů.
Bipolární porucha I
Bezpečnost a účinnost u pediatrických pacientů s bipolární mánií byla stanovena ve 4týdenní, placebem kontrolované klinické studii u 197 pediatrických pacientů ve věku 10 až 17 let [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , a Klinické studie ]. Ačkoli udržovací účinnost u pediatrických pacientů nebyla systematicky hodnocena, udržovací účinnost lze extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů aripiprazolu u dospělých a pediatrických pacientů.
Účinnost adjuvans ABILIFY 10 mg se současným lithiem nebo valproátem v léčbě manických nebo smíšených epizod u pediatrických pacientů nebyla systematicky hodnocena. Takovou účinnost a nedostatek farmakokinetických interakcí mezi aripiprazolem a lithiem nebo valproátem lze však extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů aripiprazolu u dospělých a pediatrických pacientů.
Podrážděnost spojená s autistickou poruchou
Bezpečnost a účinnost u pediatrických pacientů prokazujících podrážděnost spojenou s autistickou poruchou byla stanovena ve dvou 8týdenních, placebem kontrolovaných klinických studiích u 212 pediatrických pacientů ve věku 6 až 17 let [viz INDIKACE A POUŽITÍ , DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , a Klinické studie ]. U pediatrických pacientů (ve věku 6 až 17 let) s podrážděností spojenou s autistickou poruchou byla provedena udržovací studie. První fází této studie byla otevřená fáze s flexibilním dávkováním (aripiprazol 2 až 15 mg/den), ve které byli pacienti stabilizováni (definováno jako > 25% zlepšení na subškále ABC-I a CGI-I hodnocení „hodně zlepšilo“ nebo „velmi zlepšilo“) na ABILIFY po dobu 12 po sobě jdoucích týdnů. Celkově bylo 85 pacientů stabilizováno a vstoupilo do druhé, 16týdenní, dvojitě zaslepené fáze, kde byli randomizováni, aby buď pokračovali v léčbě přípravkem ABILIFY, nebo přešli na placebo. V této studii nebyla prokázána účinnost přípravku ABILIFY pro udržovací léčbu podrážděnosti spojené s autistickou poruchou.
Tourettova porucha
Bezpečnost a účinnost aripiprazolu u pediatrických pacientů s Touretteovou poruchou byla stanovena v jedné 8týdenní (ve věku 7 až 17 let) a jedné 10týdenní studii (ve věku 6 až 18 let) u 194 pediatrických pacientů [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , a Klinické studie ]. Udržovací účinnost u pediatrických pacientů nebyla systematicky hodnocena.
Studie na mladých zvířatech
Aripiprazol u juvenilních potkanů způsobil mortalitu, klinické příznaky CNS, zhoršenou paměť a učení a opožděné pohlavní dospívání, když byl podáván v perorálních dávkách 10, 20, 40 mg/kg/den od odstavení (ve věku 21 dnů) do dospělosti (ve věku 80 dnů) . Při dávce 40 mg/kg/den byla u obou pohlaví pozorována mortalita, snížená aktivita, roztažené zadní končetiny, shrbené držení těla, ataxie, třes a další příznaky CNS. Kromě toho bylo u samců pozorováno opožděné pohlavní dospívání. Při všech dávkách a způsobem závislým na dávce, zhoršená paměť a učení, zvýšená motorická aktivita a histopatologické změny v hypofýze (atrofie), nadledvinách (hypertrofie adrenokortikální), mléčných žlázách (hyperplazie a zvýšená sekrece) a ženských reprodukčních orgánech ( byla pozorována vaginální mucifikace, atrofie endometria, snížení ovariálních žlutých tělísek). Změny v ženských reprodukčních orgánech byly považovány za sekundární ke zvýšení hladiny prolaktinu v séru. Hladinu bez pozorovaných nežádoucích účinků (NOAEL) nebylo možné určit a při nejnižší testované dávce 10 mg/kg/den neexistuje žádné bezpečnostní rozpětí ve vztahu k systémovým expozicím (AUC0-24) pro aripiprazol nebo jeho hlavní aktivní metabolit u dospívajících v maximální doporučené pediatrické dávce 15 mg/den. Všechny účinky související s léčivem byly reverzibilní po 2měsíčním období zotavení a většina účinků léčiva u juvenilních potkanů byla také pozorována u dospělých potkanů z dříve provedených studií.
Aripiprazol u juvenilních psů (ve věku 2 měsíce) způsobil CNS klinické příznaky třesu, hypoaktivity, ataxie, lehu a omezeného používání zadních končetin, když byl podáván perorálně po dobu 6 měsíců v dávkách 3, 10, 30 mg/kg/den. Průměrná tělesná hmotnost a hmotnostní přírůstek byly sníženy až o 18 % u žen ve všech lékových skupinách ve srovnání s kontrolními hodnotami. NOAEL nebylo možné stanovit a při nejnižší testované dávce 3 mg/kg/den neexistuje žádné bezpečnostní rozpětí ve vztahu k systémovým expozicím (AUC0-24) pro aripiprazol nebo jeho hlavní aktivní metabolit u dospívajících při maximální doporučené pediatrické dávka 15 mg/den. Všechny účinky související s lékem byly reverzibilní po 2měsíčním období zotavení.
Geriatrické použití
U starších pacientů se nedoporučuje žádná úprava dávkování (viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a KLINICKÁ FARMAKOLOGIE ].
13 543 pacientů léčených perorálním ABILIFY 15 mg v klinických studiích bylo 1 073 (8 %) ve věku ≥ 65 let a 799 (6 %) bylo ve věku ≥ 75 let. Placebem kontrolované studie perorálního ABILIFY 10 mg u schizofrenie, bipolární mánie nebo velké depresivní poruchy nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů.
Ze 749 pacientů léčených injekcí ABILIFY v klinických studiích bylo 99 (13 %) ve věku ≥ 65 let a 78 (10 %) bylo ve věku ≥ 75 let. Placebem kontrolované studie injekce ABILIFY u pacientů s neklidem spojeným se schizofrenií nebo bipolární mánií nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně od mladších subjektů.
ABILIFY 15 mg není schválen pro léčbu pacientů s psychózou spojenou s Alzheimerovou chorobou [viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Špatní metabolizátoři CYP2D6
Úprava dávkování se doporučuje u známých pomalých metabolizátorů CYP2D6 kvůli vysokým koncentracím aripiprazolu. Přibližně 8 % bělochů a 3 – 8 % černochů/Afroameričanů nedokáže metabolizovat substráty CYP2D6 a jsou klasifikováni jako pomalí metabolizátoři (PM) [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater a ledvin
Žádná úprava dávkování přípravku ABILIFY není nutná na základě pacientových jaterních funkcí (mírné až těžké jaterní poškození, Child-Pugh skóre mezi 5 a 15) nebo renálních funkcí (mírné až závažné poškození ledvin, glomerulární filtrace mezi 15 a 90 ml/min) [viz KLINICKÁ FARMAKOLOGIE ].
Jiné specifické populace
Není nutná žádná úprava dávkování přípravku ABILIFY na základě pohlaví, rasy nebo kouření pacienta [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Pro klasifikaci nežádoucích účinků byla použita terminologie MedDRA.
Lidská zkušenost
klinických studiích a po uvedení přípravku na trh byly celosvětově hlášeny nežádoucí účinky úmyslného nebo náhodného předávkování perorálním ABILIFY. Patří mezi ně předávkování perorálním přípravkem ABILIFY 20 mg samotným a v kombinaci s jinými látkami. U samotného ABILIFY nebyla hlášena žádná úmrtnost. Největší známá dávka se známým výsledkem zahrnovala akutní požití 1260 mg perorálního ABILIFY (42násobek maximální doporučené denní dávky) pacientem, který se zcela uzdravil. Úmyslné nebo náhodné předávkování bylo také hlášeno u dětí (ve věku 12 let a mladších) zahrnující perorální požití 10 mg ABILIFY až do 195 mg bez úmrtí.
Časté nežádoucí účinky (hlášené alespoň u 5 % všech případů předávkování) hlášené při perorálním předávkování přípravkem ABILIFY (samotným nebo v kombinaci s jinými látkami) zahrnují zvracení, somnolenci a třes. Mezi další klinicky důležité známky a příznaky pozorované u jednoho nebo více pacientů s předávkováním ABILIFY (samotným nebo s jinými látkami) patří acidóza, agresivita, zvýšená hladina aspartátaminotransferázy, fibrilace síní, bradykardie, kóma, stav zmatenosti, křeče, zvýšená hladina kreatinfosfokinázy v krvi, snížená hladina vědomí, hypertenze, hypokalémie, hypotenze, letargie, ztráta vědomí, prodloužení QRS komplexu, prodloužení QT, aspirace pneumonie, zástava dechu, status epilepticus a tachykardie.
Řízení Předávkování
Nejsou dostupné žádné specifické informace o léčbě předávkování přípravkem ABILIFY. V případě předávkování je třeba provést elektrokardiogram a je-li přítomno prodloužení QT intervalu, mělo by být zahájeno monitorování srdce. V opačném případě by se léčba předávkování měla soustředit na podpůrnou terapii, udržování adekvátních dýchacích cest, oxygenaci a ventilaci a zvládání symptomů. Pečlivý lékařský dohled a sledování by mělo pokračovat, dokud se pacient neuzdraví.
Dřevěné uhlí
V případě předávkování přípravkem ABILIFY 10 mg může být brzké podání živočišného uhlí užitečné k částečnému zabránění absorpce aripiprazolu. Podání 50 g aktivního uhlí jednu hodinu po jednorázové 15mg perorální dávce ABILIFY snížilo průměrnou AUC a Cmax aripiprazolu o 50 %.
Hemodialýza
Ačkoli neexistují žádné informace o účinku hemodialýzy při léčbě předávkování přípravkem ABILIFY, není pravděpodobné, že by hemodialýza byla užitečná při léčbě předávkování, protože aripiprazol se ve vysoké míře váže na plazmatické proteiny.
KONTRAINDIKACE
ABILIFY 15 mg je kontraindikován u pacientů s anamnézou hypersenzitivní reakce na aripiprazol. Reakce se pohybovaly od svědění / kopřivky po anafylaxi [viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku aripiprazolu u schizofrenie nebo bipolární mánie není jasný. Nicméně účinnost aripiprazolu v uvedených indikacích by mohla být zprostředkována kombinací částečné agonistické aktivity na D2 a 5-HT1A receptorech a antagonistické aktivity na 5-HT2A receptorech.
Farmakodynamika
Aripiprazol vykazuje vysokou afinitu k dopaminu D2 a D3, serotoninovým 5-HT1A a 5-HT2A receptorům (hodnoty Ki 0,34 nM, 0,8 nM, 1,7 nM a 3,4 nM, v tomto pořadí), střední afinitu k dopaminu D4, serotoninu a serotoninu 5-HT7, alfa1-adrenergní a histaminové H1 receptory (hodnoty Ki 44 nM, 15 nM, 39 nM, 57 nM a 61 nM, v daném pořadí) a střední afinita k místu zpětného vychytávání serotoninu (Ki = 98 nM). Aripiprazol nemá žádnou znatelnou afinitu k cholinergním muskarinovým receptorům (IC50>1000 nM).
Farmakokinetika
Aktivita ABILIFY je pravděpodobně primárně způsobena mateřským léčivem, aripiprazolem, a v menší míře jeho hlavním metabolitem, dehydro-aripiprazolem, u kterého bylo prokázáno, že má afinitu k D2 receptorům podobnou mateřskému léčivu a představuje 40 % mateřského léčiva. expozice léku v plazmě. Průměrné eliminační poločasy jsou asi 75 hodin a 94 hodin pro aripiprazol a dehydro-aripiprazol. Koncentrace v ustáleném stavu jsou dosaženy během 14 dnů od podání obou aktivních složek. Akumulaci aripiprazolu lze předvídat z farmakokinetiky jednorázové dávky. V ustáleném stavu je farmakokinetika aripiprazolu úměrná dávce. Eliminace aripiprazolu probíhá především prostřednictvím jaterního metabolismu zahrnujícího dva izoenzymy P450, CYP2D6 a CYP3A4. U pomalých metabolizátorů CYP2D6 je průměrný poločas eliminace aripiprazolu přibližně 146 hodin.
Farmakokinetické studie ukázaly, že ABILIFY 10 mg DISCMELT perorálně se rozpadající tablety jsou bioekvivalentní s ABILIFY 15 mg tablety.
Ústní podání
Vstřebávání
Tableta: Aripiprazol se po podání tablety dobře vstřebává, přičemž maximální plazmatické koncentrace se objevují během 3 hodin až 5 hodin; absolutní perorální biologická dostupnost tabletové formulace je 87 %. ABILIFY 10 mg lze podávat s jídlem nebo bez jídla. Podání 15 mg tablety ABILIFY se standardním vysoce tučným jídlem významně neovlivnilo Cmax nebo AUC aripiprazolu nebo jeho aktivního metabolitu dehydro-aripiprazolu, ale zpozdilo Tmax o 3 hodiny u aripiprazolu a o 12 hodin u dehydro-aripiprazolu.
Perorální roztok: Aripiprazol se dobře vstřebává, když je podáván perorálně jako roztok. Při ekvivalentních dávkách byly plazmatické koncentrace aripiprazolu z roztoku vyšší než z tabletové formy. Ve studii relativní biologické dostupnosti porovnávající farmakokinetiku 30 mg aripiprazolu jako perorálního roztoku s 30 mg tabletami aripiprazolu u zdravých subjektů byly poměry geometrického průměru Cmax a AUC roztoku k tabletám 122 % a 114 % [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Farmakokinetika aripiprazolu po jedné dávce byla lineární a úměrná dávce mezi dávkami 5 mg až 30 mg.
Rozdělení
Distribuční objem aripiprazolu v ustáleném stavu po intravenózním podání je vysoký (404 l nebo 4,9 l/kg), což ukazuje na rozsáhlou extravaskulární distribuci. V terapeutických koncentracích se aripiprazol a jeho hlavní metabolit váží z více než 99 % na sérové proteiny, především na albumin. U zdravých lidských dobrovolníků, kterým byl podáván aripiprazol v dávce 0,5 až 30 mg/den po dobu 14 dnů, došlo k obsazení D2 receptoru závislému na dávce, což naznačuje penetraci aripiprazolu do mozku u lidí.
Metabolismus A Eliminace
Aripiprazol je primárně metabolizován třemi biotransformačními cestami: dehydrogenací, hydroxylací a N-dealkylací. Na základě studií in vitro jsou enzymy CYP3A4 a CYP2D6 zodpovědné za dehydrogenaci a hydroxylaci aripiprazolu a N-dealkylace je katalyzována CYP3A4. Aripiprazol je převládající lékovou skupinou v systémovém oběhu. V ustáleném stavu představuje aktivní metabolit dehydro-aripiprazol asi 40 % AUC aripiprazolu v plazmě.
Po jednorázové perorální dávce aripiprazolu značeného [14C] bylo přibližně 25 % a 55 % podané radioaktivity nalezeno v moči a ve stolici. Méně než 1 % nezměněného aripiprazolu bylo vyloučeno močí a přibližně 18 % perorálně podané dávky bylo nalezeno nezměněno ve stolici.
Studie lékových interakcí
Účinky jiných léků na expozice aripiprazolu a dehydro-aripiprazolu jsou shrnuty na obrázku 1 a obrázku 2, v daném pořadí. Na základě simulace se očekává 4,5násobné zvýšení středních hodnot Cmax a AUC v ustáleném stavu, když jsou extenzivním metabolizátorům CYP2D6 podávány silné inhibitory CYP2D6 a CYP3A4. U pomalých metabolizátorů CYP2D6 podávaných se silnými inhibitory CYP3A4 se očekává trojnásobné zvýšení středních hodnot Cmax a AUC v ustáleném stavu.
Obrázek 1: Účinky jiných léků na farmakokinetiku aripiprazolu 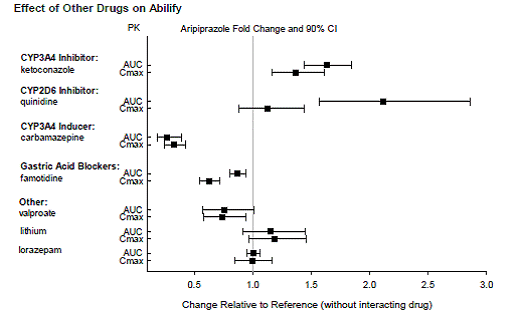
Obrázek 2: Účinky jiných léčiv na farmakokinetiku dehydro-aripiprazolu 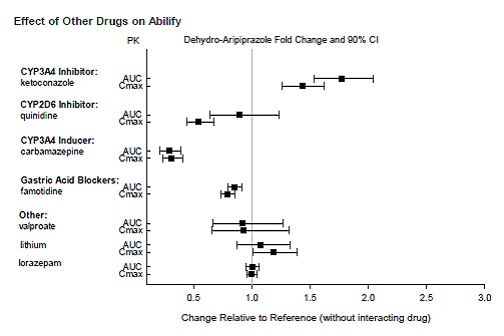
Účinky ABILIFY 15 mg na expozice jiných léků jsou shrnuty na obrázku 3. Populační PK analýza u pacientů s velkou depresivní poruchou neprokázala žádnou podstatnou změnu plazmatických koncentrací fluoxetinu (20 nebo 40 mg/den), paroxetinu CR (37,5 nebo 50 mg/den) nebo sertralin (100 nebo 150 mg/den) dávkovaný do ustáleného stavu. Plazmatické koncentrace fluoxetinu v ustáleném stavu se zvýšily asi o 18 % a norfluoxetinu o 36 % a koncentrace paroxetinu se snížily asi o 27 %. Plazmatické koncentrace sertralinu a desmethylsertralinu v ustáleném stavu se podstatně nezměnily, když byly tyto antidepresivní terapie podávány současně s aripiprazolem.
Obrázek 3: Účinky ABILIFY 15 mg na farmakokinetiku jiných léků 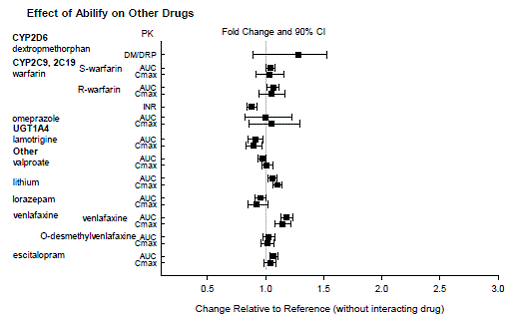
Studie u specifických populací
Expozice aripiprazolu a dehydro-aripiprazolu ve specifických populacích jsou shrnuty na obrázku 4 a obrázku 5, v daném pořadí. Navíc u pediatrických pacientů (ve věku 10 až 17 let), kterým byl podáván ABILIFY (20 mg až 30 mg), byla clearance aripiprazolu korigovaná na tělesnou hmotnost podobná jako u dospělých.
Obrázek 4: Účinky vnitřních faktorů na farmakokinetiku aripiprazolu 
Obrázek 5: Účinky vnitřních faktorů na farmakokinetiku dehydro-aripiprazolu 
Intramuskulární podání
Ve dvou farmakokinetických studiích injekčního aripiprazolu podávaného intramuskulárně zdravým subjektům byly střední doby dosažení maximálních plazmatických koncentrací za 1 hodinu a 3 hodiny. 5 mg intramuskulární injekce aripiprazolu měla absolutní biologickou dostupnost 100 %. Geometrický průměr maximální koncentrace dosažené po intramuskulární dávce byl v průměru o 19 % vyšší než Cmax perorální tablety. Zatímco systémová expozice po dobu 24 hodin byla obecně podobná mezi injekcí aripiprazolu podanou intramuskulárně a po podání perorální tablety, AUC aripiprazolu v prvních 2 hodinách po intramuskulární injekci byla o 90 % vyšší než AUC po stejné dávce jako tableta. U stabilních pacientů se schizofrenií nebo schizoafektivní poruchou byla farmakokinetika aripiprazolu po intramuskulárním podání lineární v rozmezí dávek 1 mg až 45 mg. Ačkoli metabolismus injekčního aripiprazolu nebyl systematicky hodnocen, neočekává se, že intramuskulární způsob podání změní metabolické cesty.
Toxikologie zvířat a/nebo farmakologie
Aripiprazol způsobil degeneraci sítnice u albínských potkanů ve 26týdenní studii chronické toxicity při dávce 60 mg/kg/den a ve dvouleté studii karcinogenity při dávkách 40 a 60 mg/kg/den, které jsou 13 a 19krát vyšší MRHD 30 mg/den na základě mg/m² plochy povrchu těla. Hodnocení sítnice albínských myší a opic neodhalilo známky degenerace sítnice. Další studie k dalšímu hodnocení mechanismu nebyly provedeny. Význam tohoto zjištění pro lidské riziko není znám.
Klinické studie
Účinnost perorálních přípravků ABILIFY (aripiprazol) byla stanovena v následujících adekvátních a dobře kontrolovaných studiích:
- Čtyři krátkodobé studie a jedna udržovací studie u dospělých pacientů a jedna krátkodobá studie u dospívajících (ve věku 13-17 let) se schizofrenií (viz Klinické studie ]
- Čtyři krátkodobé monoterapeutické studie a jedna 6týdenní doplňková studie u dospělých pacientů a jedna krátkodobá monoterapeutická studie u pediatrických pacientů (věk 1017) s manickými nebo smíšenými epizodami [viz Klinické studie ]
- Jedna udržovací monoterapeutická studie a jedna udržovací přídavná studie u dospělých pacientů s bipolární poruchou I [viz Klinické studie ]
- Dvě krátkodobé studie u dospělých pacientů s MDD, kteří během aktuální epizody neměli adekvátní odpověď na antidepresivní léčbu [viz Klinické studie ]
- Dvě krátkodobé studie u pediatrických pacientů (ve věku 6-17 let) pro léčbu podrážděnosti spojené s autistickou poruchou (viz Klinické studie ]
- Dvě krátkodobé studie u pediatrických pacientů (ve věku 6-18 let) s Tourettovou poruchou [viz Klinické studie ]
Účinnost injekční formulace ABILIFY (aripiprazol) byla stanovena v následujících adekvátních a dobře kontrolovaných studiích:
- Tři 24hodinové studie u agitovaných dospělých pacientů se schizofrenií nebo manickými/smíšenými epizodami bipolární poruchy I [viz Klinické studie ]
Schizofrenie
Dospělí
Účinnost ABILIFY 15 mg při léčbě schizofrenie byla hodnocena v pěti krátkodobých (4týdenní a 6týdenní), placebem kontrolovaných studiích u hospitalizovaných pacientů s akutní recidivou, kteří převážně splňovali kritéria DSM-III/IV pro schizofrenii. Čtyři z pěti studií byly schopny odlišit ABILIFY od placeba, ale jedna studie, nejmenší, nikoli. Tři z těchto studií také zahrnovaly aktivní kontrolní skupinu sestávající buď z risperidonu (jedna studie) nebo haloperidolu (dvě studie), ale nebyly navrženy tak, aby umožňovaly srovnání přípravku ABILIFY 20 mg a aktivních komparátorů.
Ve čtyřech pozitivních studiích pro ABILIFY 10 mg byla pro hodnocení psychiatrických známek a symptomů použita čtyři primární měření. Účinnost byla hodnocena pomocí celkového skóre na škále pozitivních a negativních syndromů (PANSS). PANSS je 30 položková škála, která měří pozitivní symptomy schizofrenie (7 položek), negativní symptomy schizofrenie (7 položek) a obecnou psychopatologii (16 položek), každá je hodnocena na stupnici od 1 (nepřítomnost) do 7 (extrémní). ; celkové skóre PANSS se pohybuje od 30 do 210. Hodnocení klinického globálního dojmu (CGI) odráží dojem zkušeného pozorovatele, který je plně obeznámen s projevy schizofrenie, o celkovém klinickém stavu pacienta.
Ve 4týdenní studii (n=414) porovnávající dvě fixní dávky přípravku ABILIFY (15 nebo 30 mg/den) s placebem byly obě dávky přípravku ABILIFY 10 mg lepší než placebo v celkovém skóre PANSS (studie 1 v tabulce 26), PANSS pozitivní subškála a skóre CGI závažnosti. Kromě toho byla dávka 15 mg lepší než placebo v negativní subškále PANSS.
Ve 4týdenní studii (n=404) porovnávající dvě fixní dávky ABILIFY (20 nebo 30 mg/den) s placebem byly obě dávky ABILIFY lepší než placebo v celkovém skóre PANSS (studie 2 v tabulce 26), PANSS pozitivní subškála, PANSS negativní subškála a skóre CGI závažnosti.
V 6týdenní studii (n=420) porovnávající tři fixní dávky přípravku ABILIFY (10, 15 nebo 20 mg/den) s placebem byly všechny tři dávky přípravku ABILIFY lepší než placebo v celkovém skóre PANSS (studie 3 v tabulce 26), PANSS pozitivní subškála a PANSS negativní subškála.
6týdenní studii (n=367) porovnávající tři fixní dávky přípravku ABILIFY (2, 5 nebo 10 mg/den) s placebem byla dávka 10 mg přípravku ABILIFY lepší než placebo v celkovém skóre PANSS (studie 4 v Tabulka 26), primární měřítko výsledku studie. Dávky 2 a 5 mg neprokázaly v primárním výsledném ukazateli převahu nad placebem.
Účinnost denních dávek 10, 15, 20 a 30 mg byla stanovena ve dvou studiích pro každou dávku. Mezi těmito dávkami nebyl žádný důkaz, že by skupiny s vyšší dávkou nabízely nějakou výhodu oproti skupině s nejnižší dávkou v těchto studiích.
Zkoumání podskupin populace neodhalilo žádné jasné důkazy o rozdílné citlivosti na základě věku, pohlaví nebo rasy.
Do dlouhodobější studie bylo zařazeno 310 hospitalizovaných nebo ambulantních pacientů splňujících kritéria DSM-IV pro schizofrenii, kteří byli v anamnéze symptomaticky stabilní na jiných antipsychotických lécích po dobu 3 měsíců nebo déle. Těmto pacientům byla vysazena antipsychotická léčba a byli randomizováni k ABILIFY 15 mg/den nebo placebu po dobu až 26 týdnů sledování relapsu. Relaps během dvojitě zaslepené fáze byl definován jako skóre zlepšení CGI ≥5 (minimálně horší), skóre ≥5 (středně závažné) v položkách nepřátelství nebo nespolupráce v PANSS nebo ≥20% zvýšení celkového skóre PANSS. Pacienti, kteří dostávali ABILIFY 15 mg/den, zaznamenali významně delší dobu do relapsu během následujících 26 týdnů ve srovnání s těmi, kteří dostávali placebo (Studie 5 na obrázku 6).
Pediatričtí pacienti
Účinnost přípravku ABILIFY (aripiprazol) v léčbě schizofrenie u pediatrických pacientů (ve věku 13 až 17 let) byla hodnocena v jedné 6týdenní placebem kontrolované studii u ambulantních pacientů, kteří splnili kritéria DSM-IV pro schizofrenii a měli skóre PANSS ≥70 na začátku. V této studii (n=302) porovnávající dvě fixní dávky přípravku ABILIFY (10 nebo 30 mg/den) s placebem byla dávka ABILIFY 15 mg titrována od 2 mg/den do cílové dávky za 5 dní v léčebném rameni 10 mg/den a za 11 dní v rameni s léčbou 30 mg/den. Obě dávky ABILIFY byly lepší než placebo v celkovém skóre PANSS (studie 6 v tabulce 26), což je primární měřítko výsledku studie. Dávka 30 mg/den se neprokázala jako účinnější než dávka 10 mg/den. Ačkoli udržovací účinnost u pediatrických pacientů nebyla systematicky hodnocena, udržovací účinnost lze extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů aripiprazolu u dospělých a pediatrických pacientů.
Obrázek 6: Kaplan-Meierův odhad kumulativního podílu pacientů s relapsem (studie schizofrenie 5) 
Bipolární porucha
Akutní léčba manických a smíšených epizod
Dospělí
Monoterapie
Účinnost ABILIFY 10 mg jako monoterapie při akutní léčbě manických epizod byla stanovena ve čtyřech 3týdenních placebem kontrolovaných studiích u hospitalizovaných pacientů, kteří splnili kritéria DSM-IV pro bipolární poruchu I s manickými nebo smíšenými epizodami. Tyto studie zahrnovaly pacienty s psychotickými rysy nebo bez nich a dvě ze studií také zahrnovaly pacienty s rychlým cyklováním nebo bez něj.
Primárním nástrojem používaným pro hodnocení manických příznaků byla Young Mania Rating Scale (Y-MRS), 11položková škála hodnocená lékařem tradičně používaná k hodnocení stupně manické symptomatologie v rozsahu od 0 (žádné manické rysy) do 60 ( maximální skóre). Klíčový sekundární nástroj zahrnoval Clinical Global Impression-Bipolar (CGI-BP) Scale.
Ve čtyřech pozitivních, 3týdenních, placebem kontrolovaných studiích (n=268; n=248; n=480; n=485), které hodnotily ABILIFY v rozmezí 15 mg až 30 mg, jednou denně (s počáteční dávkou 30 mg/den ve dvou studiích a 15 mg/den ve dvou studiích), ABILIFY 20 mg byl lepší než placebo ve snížení celkového skóre Y-MRS (studie 1-4 v tabulce 27) a skóre závažnosti onemocnění CGI-BP (mánie). Ve dvou studiích s počáteční dávkou 15 mg/den bylo 48 % a 44 % pacientů v koncovém bodě na 15 mg/den. Ve dvou studiích s počáteční dávkou 30 mg/den bylo 86 % a 85 % pacientů v koncovém bodě na 30 mg/den.
Doplňková terapie
Účinnost adjuvantní léčby ABILIFY se současným lithiem nebo valproátem v léčbě manických nebo smíšených epizod byla stanovena v 6týdenní placebem kontrolované studii (n=384) s 2týdenní zaváděcí fází monoterapie stabilizátorem nálady u dospělých pacientů kteří splnili kritéria DSM-IV pro bipolární poruchu I. Tato studie zahrnovala pacienty s manickými nebo smíšenými epizodami as psychotickými rysy nebo bez nich.
pacientů byla zahájena otevřená léčba lithiem (0,6 až 1,0 mEq/l) nebo valproátem (50 až 125 μg/ml) v terapeutických sérových hladinách a zůstali na stabilních dávkách po dobu 2 týdnů. Na konci 2 týdnů byli pacienti s nedostatečnou odpovědí (celkové skóre YMRS ≥ 16 a ≤ 25 % zlepšení celkového skóre Y-MRS) na lithium nebo valproát randomizováni k podávání buď ABILIFY (15 mg/den nebo zvýšení na 30 mg/den již v den 7) nebo placebo jako přídatná léčba s otevřeným lithiem nebo valproátem. V 6týdenní, placebem kontrolované fázi bylo adjuvantní ABILIFY začínající dávkou 15 mg/den se současným lithiem nebo valproátem (v terapeutickém rozmezí 0,6 až 1,0 mEq/l nebo 50 až 125 μg/ml, v daném pořadí) lepší než lithium nebo valproát s přídavným placebem při snížení celkového skóre YMRS (studie 5 v tabulce 27) a skóre závažnosti onemocnění (mánie) CGI-BP. 71 % pacientů, kterým byl současně podáván valproát a 62 % pacientů, kterým bylo současně podáváno lithium, bylo na konci 6 týdnů na dávce 15 mg/den.
Pediatričtí pacienti
Účinnost přípravku ABILIFY 15 mg v léčbě bipolární poruchy I u pediatrických pacientů (ve věku 10 až 17 let) byla hodnocena v jedné 4týdenní placebem kontrolované studii (n=296) u ambulantních pacientů, kteří splnili kritéria DSM-IV pro bipolární poruchu I manické nebo smíšené epizody s psychotickými rysy nebo bez nich a měl jsem skóre Y-MRS ≥20 na začátku. Tato dvojitě zaslepená, placebem kontrolovaná studie porovnávala dvě fixní dávky přípravku ABILIFY (10 nebo 30 mg/den) s placebem. Dávka ABILIFY 20 mg byla zahájena na 2 mg/den, která byla titrována na 5 mg/den po 2 dnech a na cílovou dávku za 5 dní v léčebném rameni 10 mg/den a za 13 dní v 30 mg/den denní léčba rameno. Obě dávky ABILIFY 10 mg byly lepší než placebo ve změně od výchozí hodnoty do týdne 4 v celkovém skóre Y-MRS (studie 6 v tabulce 27).
Udržovací léčba bipolární poruchy I
Monoterapie Udržovací terapie
dospělých pacientů splňujících kritéria DSM-IV pro bipolární poruchu I s nedávnou manickou nebo smíšenou epizodou, kteří byli stabilizováni na otevřeném podávání ABILIFY 20 mg a kteří si udrželi klinickou odpověď po dobu nejméně 6 týdnů, byla provedena udržovací studie. První fází této studie bylo období otevřené stabilizace, ve kterém byli hospitalizovaní i ambulantní pacienti klinicky stabilizováni a poté udržováni na otevřeném ABILIFY (15 nebo 30 mg/den, s počáteční dávkou 30 mg/den) po dobu nejméně 6 po sobě jdoucích týdnů. Sto šedesát jedna ambulantních pacientů bylo poté randomizováno dvojitě zaslepeným způsobem, buď ke stejné dávce ABILIFY, kterou dostávali na konci stabilizačního a udržovacího období, nebo k placebu, a poté byli sledováni kvůli manickému nebo depresivnímu relapsu. Během randomizační fáze byla ABILIFY lepší než placebo včas v počtu kombinovaných afektivních relapsů (manických plus depresivních), což je primární měřítko výsledku této studie (Studie 7 na obrázku 7). Během dvojitě zaslepené léčebné fáze bylo pozorováno celkem 55 náladových událostí. Devatenáct bylo ze skupiny ABILIFY a 36 ze skupiny s placebem. Počet pozorovaných manických epizod ve skupině ABILIFY 15 mg (6) byl nižší než ve skupině s placebem (19), zatímco počet depresivních epizod ve skupině ABILIFY (9) byl podobný jako ve skupině s placebem (11). .
Zkoumání podskupin populace neodhalilo žádné jasné důkazy o rozdílné citlivosti na základě věku a pohlaví; v každé z etnických skupin však nebyl dostatečný počet pacientů, aby bylo možné adekvátně posoudit rozdíly mezi skupinami.
Obrázek 7: Kaplan-Meierův odhad kumulativního podílu pacientů s relapsem (bipolární studie 7) 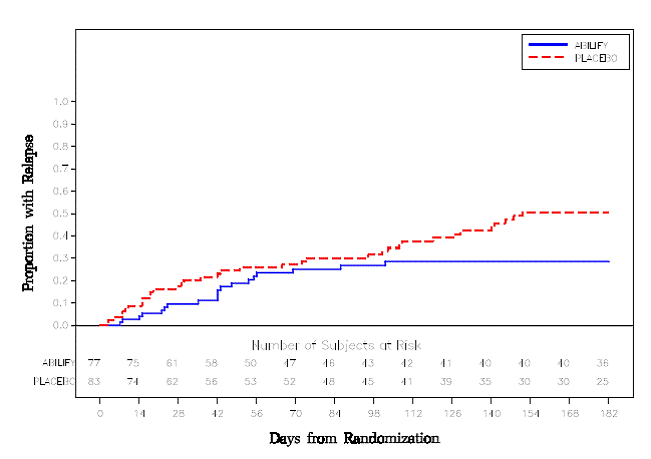
Doplňková udržovací terapie
dospělých pacientů splňujících kritéria DSMIV pro bipolární poruchu I s nedávnou manickou nebo smíšenou epizodou byla provedena doplňková udržovací studie. U pacientů byla zahájena otevřená léčba lithiem (0,6 až 1,0 mEq/l) nebo valproátem (50 až 125 μg/ml) v terapeutických sérových hladinách a zůstali na stabilních dávkách po dobu 2 týdnů. Na konci 2 týdnů pacienti, u kterých se neprokázala adekvátní odpověď (celkové skóre Y-MRS ≥16 a ≤35% zlepšení celkového skóre Y-MRS) na lithium nebo valproát, dostali ABILIFY s počáteční dávkou 15 mg/den s možností zvýšit na 30 mg nebo snížit na 10 mg již 4. den jako doplňkovou léčbu s otevřeným lithiem nebo valproátem. Před randomizací bylo u pacientů na kombinaci jednoduše zaslepeného přípravku ABILIFY a lithia nebo valproátu požadováno udržení stability (celkové skóre Y-MRS a MADRS ≤12) po dobu 12 po sobě jdoucích týdnů. Tři sta třicet sedm pacientů bylo poté randomizováno dvojitě zaslepeným způsobem buď ke stejné dávce ABILIFY 20 mg, kterou užívali na konci stabilizačního období, nebo k placebu plus lithiu nebo valproátu a poté byli sledováni na manické, smíšené nebo relapsu deprese po dobu maximálně 52 týdnů. ABILIFY 15 mg byla lepší než placebo v primárním koncovém bodě, době od randomizace do relapsu k jakékoli náladové události (Studie 8 na obrázku 8). Náladová událost byla definována jako hospitalizace pro manickou, smíšenou nebo depresivní epizodu, přerušení studie z důvodu nedostatečné účinnosti doprovázené skóre Y-MRS > 16 a/nebo MADRS > 16, nebo SAE zhoršení nemoci doprovázené Y- MRS skóre >16 a/nebo MADRS >16. Během dvojitě zaslepené léčebné fáze bylo pozorováno celkem 68 náladových událostí. Dvacet pět bylo ze skupiny ABILIFY 20 mg a 43 bylo ze skupiny s placebem. Počet pozorovaných manických epizod ve skupině ABILIFY 15 mg (7) byl nižší než ve skupině s placebem (19), zatímco počet depresivních epizod ve skupině ABILIFY (14) byl podobný jako ve skupině s placebem (18). . Kaplan-Meierovy křivky času od randomizace do relapsu k jakékoli náladové události během 52týdenní, dvojitě zaslepené léčebné fáze pro skupiny ABILIFY 10 mg a placebo jsou uvedeny na obrázku 8.
Obrázek 8: Kaplan-Meierův odhad kumulativního podílu pacientů s relapsem jakékoli náladové události (bipolární studie 8) 
Zkoumání podskupin populace neodhalilo žádné jasné důkazy o rozdílné citlivosti na základě věku a pohlaví; v každé z etnických skupin však nebyl dostatečný počet pacientů, aby bylo možné adekvátně posoudit rozdíly mezi skupinami.
Doplňková léčba velké depresivní poruchy
Dospělí
Účinnost přípravku ABILIFY 15 mg v přídatné léčbě velké depresivní poruchy (MDD) byla prokázána ve dvou krátkodobých (6týdenních), placebem kontrolovaných studiích u dospělých pacientů splňujících kritéria DSM-IV pro MDD, kteří neměli adekvátní odpověď na předchozí antidepresivní léčbu (1 až 3 cykly) v současné epizodě a kteří také neprokázali adekvátní odpověď na 8 týdnů prospektivní antidepresivní léčby (paroxetin s řízeným uvolňováním, venlafaxin s prodlouženým uvolňováním, fluoxetin, escitalopram nebo sertralin). Neadekvátní odpověď na prospektivní léčbu byla definována jako méně než 50% zlepšení oproti 17-položkové verzi Hamiltonovy škály pro hodnocení deprese (HAMD17), minimální skóre HAMD17 14 a hodnocení Clinical Global Impressions Improvement, které není lepší než minimální zlepšení. Neadekvátní odpověď na předchozí léčbu byla definována jako méně než 50% zlepšení, jak bylo pacientem vnímáno po minimálně 6 týdnech antidepresivní léčby v minimální účinné dávce nebo nad ní.
Primárním nástrojem používaným pro hodnocení symptomů deprese byla Montgomery-Asbergova škála hodnocení deprese (MADRS), 10-položková škála hodnocená lékařem používaná k hodnocení stupně depresivní symptomatologie. Klíčovým sekundárním nástrojem byla Sheehanova škála postižení (SDS), 3-položkový sebehodnotící nástroj používaný k hodnocení dopadu deprese na tři domény fungování, přičemž každá položka byla hodnocena od 0 (vůbec ne) do 10 (extrémní).
Ve dvou studiích (n=381, n=362) byla ABILIFY 15 mg lepší než placebo ve snížení průměrného celkového skóre MADRS (studie 1, 2 v tabulce 28). V jedné studii byl ABILIFY také lepší než placebo ve snížení průměrného skóre SDS.
obou studiích pacienti dostávali ABILIFY 15 mg jako doplněk k antidepresivům v dávce 5 mg/den. Na základě snášenlivosti a účinnosti lze dávky upravovat po 5 mg přírůstcích s týdenním odstupem. Povolené dávky byly: 2, 5, 10, 15 mg/den a pro pacienty, kteří neužívali silné inhibitory CYP2D6 fluoxetin a paroxetin, 20 mg/den. Průměrná konečná dávka na konci obou studií byla 10,7 a 11,4 mg/den.
Vyšetření populačních podskupin neodhalilo známky rozdílné odpovědi na základě věku, výběru prospektivního antidepresiva nebo rasy. Pokud jde o pohlaví, menší průměrné snížení celkového skóre MADRS bylo pozorováno u mužů než u žen.
Podrážděnost spojená s autistickou poruchou
Pediatričtí pacienti
Účinnost přípravku ABILIFY (aripiprazol) při léčbě podrážděnosti spojené s autistickou poruchou byla stanovena ve dvou 8týdenních placebem kontrolovaných studiích u pediatrických pacientů (ve věku 6 až 17 let), kteří splnili kritéria DSM-IV pro autistickou poruchu a projevené chování, jako je záchvaty vzteku, agrese, sebepoškozující chování nebo kombinace těchto problémů. Více než 75 % těchto subjektů bylo mladších 13 let.
Účinnost byla hodnocena pomocí dvou hodnotících škál: Aberrant Behavior Checklist (ABC) a škála Clinical Global Impression-Improvement (CGI-I). Primárním výsledným měřítkem v obou studiích byla změna z výchozí hodnoty na cílový bod v subškále dráždivosti ABC (ABC-I). Subškála ABC-I měřila příznaky podrážděnosti u autistické poruchy.
Výsledky těchto zkoušek jsou následující:
jedné z 8týdenních, placebem kontrolovaných studií dostávali děti a dospívající s autistickou poruchou (n=98) ve věku 6 až 17 let denní dávky placeba nebo ABILIFY 2 až 15 mg/den. Přípravek ABILIFY, počínaje dávkou 2 mg/den s povoleným zvýšením až na 15 mg/den na základě klinické odpovědi, významně zlepšil skóre na subškále ABC-I a na stupnici CGI-I ve srovnání s placebem. Průměrná denní dávka ABILIFY 10 mg na konci 8týdenní léčby byla 8,6 mg/den (Studie 1 v tabulce 29).
další 8týdenní, placebem kontrolované studii u dětí a dospívajících s autistickou poruchou (n=218), ve věku 6 až 17 let, byly podávány tři fixní dávky přípravku ABILIFY (5 mg/den, 10 mg/den nebo 15 mg/ den) byly porovnány s placebem. Dávkování ABILIFY začalo na 2 mg/den a po jednom týdnu bylo zvýšeno na 5 mg/den. Po druhém týdnu byla zvýšena na 10 mg/den u pacientů v ramenech s dávkou 10 a 15 mg a po třetím týdnu byla zvýšena na 15 mg/den v rameni s léčbou 15 mg/den (studie 2 v Tabulka 29). Všechny tři dávky přípravku ABILIFY významně zlepšily skóre na subškále ABC-I ve srovnání s placebem.
Tourettova porucha
Pediatričtí pacienti
Účinnost přípravku ABILIFY (aripiprazol) v léčbě Touretteovy poruchy byla stanovena v jedné 8týdenní (ve věku 7 až 17 let) a jedné 10týdenní (ve věku 6 až 18 let), placebem kontrolované studii pediatričtí pacienti (ve věku 6 až 18 let), kteří splnili kritéria DSM-IV pro Touretteovu poruchu a měli celkové Tic skóre (TTS) ≥ 20 - 22 na Yale Global Tic Severity Scale (YGTSS). YGTSS je plně ověřená škála navržená pro měření aktuální závažnosti tiků. Účinnost byla hodnocena pomocí dvou hodnotících škál: 1) celkové Tic skóre (TTS) YGTSS a 2) škála klinických globálních dojmů pro Tourettův syndrom (CGI-TS), což je souhrnná míra stanovená klinikem, která bere v úvahu všechny dostupné informace o pacientovi. Více než 65 % těchto pacientů bylo mladších 13 let.
Primárním výsledným měřítkem v obou studiích byla změna TTS YGTSS od výchozího k cílovému bodu. Hodnocení pro TTS se provádí v 5 různých rozměrech na stupnici od 0 do 5 pro motorické a vokální tiky. Součet těchto 10 skóre poskytuje TTS (tj. 0-50).
Výsledky těchto zkoušek jsou následující:
8týdenní, placebem kontrolované studii s fixní dávkou byly děti a dospívající s Touretteovou poruchou (n=133), ve věku 7 až 17 let, randomizováni v poměru 1:1:1 k nízké dávce ABILIFY, vysoké dávce ABILIFY 15 mg nebo placebo. Cílové dávky pro skupiny s nízkou a vysokou dávkou ABILIFY 10 mg byly založeny na hmotnosti. Pacienti s hmotností
Obrázek 9: Nejmenší čtverec střední hodnoty změny od výchozí hodnoty v YGTSS TTS za týden (Tourette's Disorder Study 1) 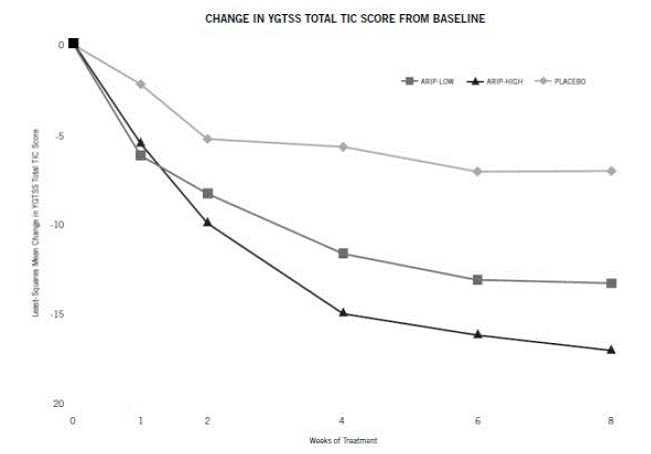
V 10týdenní, placebem kontrolované studii s flexibilním dávkováním u dětí a dospívajících s Touretteovou poruchou (n=61), ve věku 6 až 18 let, dostávali pacienti denní dávky placeba nebo ABILIFY počínaje 2 mg/ den s povoleným zvýšením až na 20 mg/den na základě klinické odpovědi. ABILIFY prokázala statisticky významně zlepšené skóre na stupnici YGTSS TTS ve srovnání s placebem (Studie 2 v tabulce 30). Průměrná denní dávka přípravku ABILIFY na konci 10týdenní léčby byla 6,54 mg/den.
Agitovanost spojená se schizofrenií nebo bipolární mánií
Účinnost intramuskulárního ABILIFY pro injekci k léčbě agitovanosti byla stanovena ve třech krátkodobých (24hodinových), placebem kontrolovaných studiích u agitovaných hospitalizovaných pacientů ze dvou diagnostických skupin: schizofrenie a bipolární porucha I (manické nebo smíšené epizody s nebo bez psychotických rysů). Každá ze studií zahrnovala jediné aktivní srovnávací léčebné rameno buď injekce haloperidolu (studie schizofrenie) nebo injekce lorazepamu (studie bipolární mánie). Pacienti mohli dostat až tři injekce během 24hodinových léčebných období; pacienti však nemohli dostat druhou injekci dříve než po počátečním 2hodinovém období, kdy bylo hodnoceno primární měřítko účinnosti. Pacienti zařazení do studií museli: (1) být klinickými výzkumníky posouzeni jako klinicky vzrušení a klinicky vhodní kandidáti pro léčbu intramuskulární medikací a (2) vykazovat úroveň agitovanosti, která dosáhla nebo přesáhla prahové skóre ≥15 na pět položek zahrnujících škálu pozitivních a negativních syndromů (PANSS) Excited Component (tj. položky špatné kontroly impulzů, napětí, nepřátelství, nespolupráce a vzrušení) s alespoň dvěma skóre jednotlivých položek ≥4 pomocí bodovacího systému 1-7 (1 = nepřítomný, 4 = mírný, 7 = extrémní). Ve studiích bylo průměrné výchozí skóre PANSS Excited Component 19 se skóre v rozmezí od 15 do 34 (z maximálního skóre 35), což naznačuje převážně mírné úrovně neklidu, přičemž někteří pacienti zažívali mírné nebo těžké úrovně neklidu. Primárním měřítkem účinnosti použitým pro hodnocení známek a symptomů agitovanosti v těchto studiích byla změna v PANSS Excited Component od výchozí hodnoty 2 hodiny po injekci. Klíčovým sekundárním měřítkem byla škála klinického globálního dojmu zlepšení (CGI-I). Výsledky zkoušek jsou následující:
placebem kontrolované studii u agitovaných hospitalizovaných pacientů, kteří převážně splňují kritéria DSM-IV pro schizofrenii (n=350), byly hodnoceny čtyři fixní injekční dávky ABILIFY 20 mg 1 mg, 5,25 mg, 9,75 mg a 15 mg. 2 hodiny po injekci byly dávky 5,25 mg, 9,75 mg a 15 mg statisticky lepší než placebo v PANSS Excited Component (studie 1 v tabulce 31) a na škále CGII.
Ve druhé placebem kontrolované studii u agitovaných hospitalizovaných pacientů, kteří převážně splňují kritéria DSM-IV pro schizofrenii (n=445), byla hodnocena jedna fixní injekční dávka ABILIFY 15 mg 9,75 mg. 2 hodiny po injekci byla ABILIFY pro injekci statisticky lepší než placebo v PANSS Excited Component (studie 2 v tabulce 31) a na škále CGI-I.
placebem kontrolované studii u agitovaných hospitalizovaných pacientů splňujících kritéria DSMIV pro bipolární poruchu I (manická nebo smíšená) (n=291) byly hodnoceny dvě fixní injekční dávky ABILIFY 10 mg 9,75 mg a 15 mg. 2 hodiny po injekci byly obě dávky statisticky lepší než placebo v PANSS Excited Component (studie 3 v tabulce 31).
Zkoumání podskupin populace (věk, rasa a pohlaví) neodhalilo žádnou rozdílnou citlivost na základě těchto podskupin.
INFORMACE PRO PACIENTA
ABILIFY® (aripiprazol) Tablety
ABILIFY DISCMELT® (aripiprazol) Orálně se rozpadající tablety
ABILIFY® (aripiprazol) perorální roztok
ABILIFY® (aripiprazol) Injekce Pouze pro intramuskulární podání
Jaké jsou nejdůležitější informace, které bych měl vědět o ABILIFY 20 mg?
(Další nežádoucí účinky naleznete také v části „Jaké jsou možné vedlejší účinky přípravku ABILIFY?“)
Při užívání přípravku ABILIFY se mohou objevit závažné nežádoucí účinky, včetně:
- Zvýšené riziko úmrtí u starších pacientů s psychózou související s demencí: Léky jako ABILIFY 10 mg mohou zvýšit riziko úmrtí u starších lidí, kteří ztratili kontakt s realitou (psychóza) kvůli zmatenosti a ztrátě paměti (demence). ABILIFY není schválen pro léčbu pacientů s psychózou související s demencí.
- Riziko sebevražedných myšlenek nebo činů: Antidepresiva, deprese a jiná závažná duševní onemocnění a sebevražedné myšlenky nebo činy:
1. Antidepresiva mohou u některých dětí, dospívajících a mladých dospělých během prvních měsíců léčby zvýšit sebevražedné myšlenky nebo činy.
2. Deprese a jiná závažná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek a činů. Někteří lidé mohou mít zvláště vysoké riziko sebevražedných myšlenek nebo činů. Patří mezi ně lidé, kteří mají (nebo mají v rodinné anamnéze) bipolární nemoc (nazývanou také maniodepresivní nemoc) nebo sebevražedné myšlenky nebo činy.
3. Jak mohu sledovat a snažit se předcházet sebevražedným myšlenkám a činům u sebe nebo člena rodiny?
- Věnujte zvýšenou pozornost všem změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Dodržujte všechny následné návštěvy u poskytovatele zdravotní péče podle plánu. Zavolejte poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte poskytovatele zdravotní péče, pokud máte vy nebo váš rodinný příslušník některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- myšlenky na sebevraždu nebo smrt
- pokusy o sebevraždu
- nová nebo horší deprese
- nová nebo horší úzkost
- pocit velkého rozrušení nebo neklidu
- panický záchvat
- potíže se spánkem (nespavost)
- nová nebo horší podrážděnost
- chovat se agresivně, být naštvaný nebo násilný
- působící na nebezpečné impulsy
- extrémní nárůst aktivity a mluvení (mánie)
- jiné neobvyklé změny v chování nebo náladě
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili s poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité probrat všechna rizika léčby deprese a také rizika její neléčení. Pacienti a jejich rodiny nebo jiní pečovatelé by měli s poskytovatelem zdravotní péče diskutovat o všech možnostech léčby, nejen o užívání antidepresiv.
- Antidepresiva mají další vedlejší účinky. Promluvte si s poskytovatelem zdravotní péče o vedlejších účincích léku předepsaného vám nebo vašemu rodinnému příslušníkovi.
- Antidepresiva mohou interagovat s jinými léky. Znát všechny léky, které užíváte vy nebo váš rodinný příslušník. Uchovávejte seznam všech léků, abyste je mohli ukázat poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
- Ne všechna antidepresiva předepisovaná dětem jsou schválena FDA pro použití u dětí. Pro více informací se poraďte s poskytovatelem zdravotní péče vašeho dítěte.
Co je ABILIFY?
- ABILIFY 20 mg perorální tablety, perorálně se rozpadající tablety a perorální roztok jsou léky na předpis používané k léčbě:
- Schizofrenie
- manické nebo smíšené epizody, ke kterým dochází u bipolární poruchy I
- velká depresivní porucha (MDD), když je ABILIFY 20 mg užíván s antidepresivy
- podrážděnost spojená s autistickou poruchou
- Tourettova porucha
- ABILIFY Injection je lék na předpis používaný k léčbě:
- agitovanost spojená se schizofrenií nebo bipolární mánií
Není známo, zda je přípravek ABILIFY 10 mg bezpečný nebo účinný u dětí:
- do 13 let se schizofrenií
- do 10 let s bipolární poruchou I
- do 6 let s podrážděností spojenou s autistickou poruchou
- do 6 let s Tourettovou poruchou
Pokud ano, neužívejte ABILIFY 20 mg jste alergický(á) na aripiprazol nebo na kteroukoli složku přípravku ABILIFY. Úplný seznam složek v ABILIFY naleznete na konci tohoto Průvodce léčivy.
Před užitím přípravku ABILIFY 15 mg informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda máte nebo jste měli:
- cukrovka nebo vysoká hladina cukru v krvi u vás nebo ve vaší rodině; Váš poskytovatel zdravotní péče by měl kontrolovat hladinu cukru v krvi před zahájením léčby přípravkem ABILIFY 10 mg a také během léčby.
- záchvaty (křeče).
- nízký nebo vysoký krevní tlak.
- srdeční problémy nebo mrtvice.
- těhotenství nebo plánuje otěhotnět. Není známo, zda ABILIFY poškodí vaše nenarozené dítě.
- Pokud otěhotníte během užívání přípravku ABILIFY 10 mg, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro atypická antipsychotika. Můžete se zaregistrovat na telefonním čísle 1-866-961-2388 nebo na http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- kojíte nebo plánujete kojit. ABILIFY přechází do mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení vašeho dítěte, pokud dostáváte ABILIFY.
- nízký počet bílých krvinek.
- fenylketonurii. ABILIFY DISCMELT perorálně se rozpadající tablety obsahují fenylalanin.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
ABILIFY a jiné léky se mohou navzájem ovlivňovat a způsobit tak možné závažné nežádoucí účinky. ABILIFY může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku ABILIFY.
Váš poskytovatel zdravotní péče vám může říci, zda je bezpečné užívat přípravek ABILIFY s jinými léky. Během užívání přípravku ABILIFY nezačínejte ani neukončujte žádné léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče. Znát léky, které užíváte. Uchovávejte si seznam svých léků, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat ABILIFY 20 mg?
- Užívejte přípravek ABILIFY 10 mg přesně podle pokynů svého poskytovatele zdravotní péče. Neměňte dávku ani nepřestávejte sami užívat ABILIFY.
- ABILIFY 20 mg lze užívat s jídlem nebo bez jídla.
- Tablety ABILIFY se polykají celé.
- Pokud vynecháte dávku přípravku ABILIFY 20 mg, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku ABILIFY 10 mg současně.
- Jestliže Vám byl předepsán ABILIFY DISCMELT, užívejte jej následovně:
- Neotvírejte blistr, dokud nebudete připraveni vzít si tabletu DISCMELT.
- Chcete-li vyjmout jednu tabletu DISCMELT, otevřete balení a odloupněte fólii na blistru, abyste odkryli tabletu.
- Neprotlačujte tablet přes fólii, protože by to mohlo tabletu poškodit.
- Ihned po otevření blistru suchýma rukama vyjměte tabletu a položte celou tabletu ABILIFY DISCMELT na jazyk.
- Ve slinách dochází k rychlému rozpadu tablety. Doporučuje se užívat ABILIFY 10 mg DISCMELT bez tekutiny. V případě potřeby jej však lze zapít tekutinou.
- Nepokoušejte se tablet DISCMELT rozdělit.
- Pokud užijete příliš mnoho přípravku ABILIFY, okamžitě zavolejte svého poskytovatele zdravotní péče nebo toxikologické centrum na číslo 1-800-222-1222 nebo jděte na pohotovost v nejbližší nemocnici.
Čemu se mám vyhnout při užívání ABILIFY 10 mg?
- Neřiďte, neobsluhujte těžké stroje ani neprovádějte jiné nebezpečné činnosti, dokud nezjistíte, jak na vás ABILIFY 10 mg působí. ABILIFY 20 mg může způsobit ospalost.
- Vyhněte se přehřátí nebo dehydrataci.
- Nepřetěžujte se.
- V horkém počasí zůstaňte pokud možno uvnitř na chladném místě.
- Drž se mimo slunce. Nenoste příliš mnoho nebo těžké oblečení.
- Pít hodně vody.
Jaké jsou možné vedlejší účinky přípravku ABILIFY?
ABILIFY 10 mg může způsobit závažné nežádoucí účinky, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o ABILIFY 10 mg?"
- Cévní mozková příhoda u starších lidí (cerebrovaskulární problémy), která může vést ke smrti
- Neuroleptický maligní syndrom (NMS). Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte některé nebo všechny z následujících příznaků: vysoká horečka, ztuhlé svaly, zmatenost, pocení, změny pulsu, srdeční frekvence a krevního tlaku. Mohou to být příznaky vzácného a vážného stavu, který může vést ke smrti. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z těchto příznaků.
- Nekontrolované pohyby těla (tardivní dyskineze). ABILIFY může způsobit pohyby, které nemůžete ovládat ve svém obličeji, jazyku nebo jiných částech těla. Tardivní dyskineze nemusí vymizet, i když přestanete užívat přípravek ABILIFY. Tardivní dyskineze může také začít poté, co přestanete užívat přípravek ABILIFY.
- Problémy s vaším metabolismem, jako jsou:
- Vysoká hladina cukru v krvi (hyperglykémie) a cukrovka. některých lidí, kteří užívají ABILIFY, může dojít ke zvýšení hladiny cukru v krvi. Extrémně vysoká hladina cukru v krvi může vést ke kómatu nebo smrti. Máte-li cukrovku nebo rizikové faktory cukrovky (jako je nadváha nebo cukrovka v rodinné anamnéze), měl by váš poskytovatel zdravotní péče kontrolovat hladinu cukru v krvi před zahájením léčby přípravkem ABILIFY a během léčby.
Zavolejte svého poskytovatele zdravotní péče, pokud máte některý z těchto příznaků vysoké hladiny cukru v krvi při užívání přípravku ABILIFY:
- cítit velkou žízeň
- potřeba močit více než obvykle
- cítit velký hlad
- cítit se slabý nebo unavený
- cítit se špatně od žaludku
- cítíte se zmateně nebo váš dech voní ovocně
- Zvýšené hladiny tuků (cholesterolu a triglyceridů) v krvi.
- Přibývání na váze. Vy a váš poskytovatel zdravotní péče byste měli pravidelně kontrolovat svou váhu.
- Neobvyklé nutkání. Někteří lidé užívající ABILIFY 15 mg měli neobvyklá nutkání, jako je hraní hazardních her, záchvatovité přejídání nebo jídlo, které nemůžete ovládat (kompulzivní), nutkavé nakupování a sexuální touhy. Pokud si vy nebo vaši rodinní příslušníci všimnete, že máte neobvyklé nutkání nebo chování, promluvte si se svým poskytovatelem zdravotní péče.
- Ortostatická hypotenze (snížený krevní tlak). Při příliš rychlém vstávání ze sedu nebo lehu se mohou objevit závratě nebo mdloby.
- Falls. ABILIFY může způsobit ospalost nebo závratě, může způsobit pokles krevního tlaku při změně polohy a může zpomalit vaše myšlení a motoriku, což může vést k pádům, které mohou způsobit zlomeniny nebo jiná zranění.
- Nízký počet bílých krvinek
- Záchvaty (křeče)
- Problémy s kontrolou tělesné teploty, zvláště když hodně cvičíte nebo jste v oblasti, která je velmi horká. Je důležité, abyste pili vodu, abyste se vyhnuli dehydrataci. Viz „Čemu se mám vyvarovat při užívání přípravku ABILIFY 15 mg?
- Obtížné polykání, které může způsobit, že se jídlo nebo tekutina dostane do plic.
Mezi nejčastější nežádoucí účinky přípravku ABILIFY 10 mg u dospělých patří:
- Nevolnost
- závrať
- zvracení
- úzkost
- zácpa
- nespavost
- bolest hlavy
- neklid
- rozmazané vidění
- onemocnění horních cest dýchacích
- vnitřní pocit neklidu/potřeba pohybu (akatizie)
Mezi nejčastější nežádoucí účinky přípravku ABILIFY u dětí patří:
- Ospalý
- nespavost
- bolest hlavy
- nevolnost
- zvracení
- ucpaný nos
- únava
- přibývání na váze
- zvýšená nebo snížená chuť k jídlu
- nekontrolované pohyby, jako je neklid, třes
- zvýšené slinění nebo slinění
- svalová ztuhlost
Toto nejsou všechny možné vedlejší účinky přípravku ABILIFY.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat ABILIFY?
- Uchovávejte ABILIFY 15 mg při pokojové teplotě, mezi 68 °F až 77 °F (20 °C až 25 °C).
- Otevřené lahvičky ABILIFY 10 mg perorálního roztoku lze používat po dobu až 6 měsíců po otevření, ne však po uplynutí doby použitelnosti na lahvičce.
Uchovávejte ABILIFY a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání ABILIFY
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte ABILIFY 20 mg na stav, pro který nebyl předepsán. Nedávejte ABILIFY 20 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku ABILIFY 10 mg, který byl napsán pro zdravotnické pracovníky.
Jaké jsou složky v ABILIFY?
Aktivní složka: aripiprazol
Neaktivní složky:
kukuřičný škrob, hydroxypropylcelulóza, monohydrát laktózy, magnesium-stearát a mikrokrystalická celulóza. Mezi barviva patří oxid železitý (žlutý nebo červený) a FD&C Blue No. 2 Aluminium Lake
ABILIFY 10 mg DISCMELT perorálně se rozpadající tablety: acesulfam draselný, aspartam (který obsahuje fenylalanin), křemičitan vápenatý, sodná sůl kroskarmelózy, krospovidon, vanilkový krém (přírodní a umělé příchutě), stearát hořečnatý, mikrokrystalická celulóza, oxid křemičitý, kyselina vinná a xylitol. Mezi barviva patří oxid železitý (žlutý nebo červený) a FD&C Blue No. 2 Aluminium Lake
ABILIFY perorální roztok: edetát disodný, fruktóza (200 mg na ml), glycerin, kyselina dl-mléčná, methylparaben, propylenglykol, propylparaben, hydroxid sodný, sacharóza (400 mg na ml) a čištěná voda. Ústní roztok je ochucen přírodním pomerančovým krémem a dalšími přírodními příchutěmi
Pro více informací o ABILIFY přejděte na www.abilify.com nebo volejte 1-800-438-6055.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv
