Luvox 100mg, 50mg Fluvoxamine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Luvox (fluvoxamin maleát) a jak se používá?
Luvox 100 mg je lék na předpis používaný k léčbě příznaků obsedantně-kompulzivní poruchy. Luvox lze užívat samostatně nebo s jinými léky.
Luvox 100 mg patří do třídy léků nazývaných antidepresiva, SSRI.
Není známo, zda je přípravek Luvox 100 mg bezpečný a účinný u dětí mladších 8 let.
Jaké jsou možné vedlejší účinky přípravku Luvox?
Luvox může způsobit závažné nežádoucí účinky včetně:
- úzkost,
- závodní myšlenky,
- rizikové chování,
- problémy se spánkem (nespavost),
- pocity extrémního štěstí nebo podrážděnosti,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halo kulatá světla,
- křeče (záchvaty),
- změny hmotnosti nebo chuti k jídlu,
- snadná tvorba modřin nebo neobvyklé krvácení,
- bolest hlavy,
- zmatek,
- problémy s pamětí,
- těžká slabost,
- ztráta koordinace,
- pocit nejistoty,
- velmi ztuhlé (tuhé) svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- třes,
- točení hlavy,
- míchání,
- halucinace,
- pocení,
- chvění
- rychlý srdeční tep,
- ztuhlost svalů,
- cukání,
- nevolnost,
- zvracení a
- průjem
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Luvox 50 mg patří:
- ospalost,
- závrať,
- třes,
- pocit úzkosti,
- depresivní nálada,
- problémy se spánkem (nespavost),
- žaludeční nevolnost,
- plyn,
- ztráta chuti k jídlu,
- nevolnost,
- zvracení,
- průjem,
- suchá ústa,
- zívání,
- bolest krku,
- bolest svalů,
- pocení,
- vyrážka,
- silná menstruace,
- snížená chuť na sex,
- abnormální ejakulace a
- potíže s orgasmem
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Luvox. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
SEBEVRAŽDA A ANTIDEPRESIVA
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití přípravku Fluvox 50mgamine maleát tablety nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. Fluvox 50mgamine maleátové tablety nejsou schváleny pro použití u pediatrických pacientů s výjimkou pacientů s obsedantně kompulzivní poruchou (OCD). [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ - Klinické zhoršení a riziko sebevraždy ].
POPIS
Fluvoxamin maleát je selektivní inhibitor zpětného vychytávání serotoninu (5-HT) (SSRI) patřící do chemické řady, 2-aminoethyloximethery aralkylketonů.
Chemicky je označen jako 5-methoxy-4'-(trifluormethyl)valerofenon-(E)-O-(2-aminoethyl)oximmaleát (1:1) a má empirický vzorec C15H21O2N2F3•C4H4O4. Jeho molekulová hmotnost je 434,41. Strukturní vzorec je:
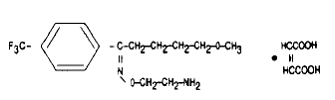
Fluvox 100mgamin maleát je bílý až téměř bílý krystalický prášek bez zápachu, který je těžko rozpustný ve vodě, snadno rozpustný v ethanolu a chloroformu a prakticky nerozpustný v diethyletheru.
Tablety fluvoxamin maleátu jsou dostupné v síle 25 mg, 50 mg a 100 mg pro perorální podání. Kromě účinné látky, fluvox 100 mg amin maleátu, obsahuje každá tableta následující neaktivní složky: karnaubský vosk, hypromelóza, mannitol, polyethylenglykol, polysorbát 80, předbobtnalý škrob (bramborový), oxid křemičitý, stearylfumarát sodný, škrob (kukuřice), a oxid titaničitý. Tablety 50 mg a 100 mg také obsahují syntetické oxidy železa.
INDIKACE
Obsedantně kompulzivní porucha
Tablety fluvoxamin maleátu jsou indikovány k léčbě obsesí a kompulzí u pacientů s obsedantně kompulzivní poruchou (OCD), jak je definováno v DSM-III-R nebo DSM-IV. Obsese nebo nutkání způsobují značné utrpení, jsou časově náročné nebo významně narušují sociální nebo pracovní fungování.
Obsedantně kompulzivní porucha je charakterizována opakujícími se a přetrvávajícími představami, myšlenkami, impulsy nebo představami (obsesemi), které jsou ego-dystonické a/nebo opakující se, účelné a záměrné chování (kompulze), které osoba rozpoznává jako nadměrné nebo nepřiměřené.
Účinnost Fluvox 100mgamine maleátových tablet byla stanovena ve čtyřech studiích u ambulantních pacientů s OCD: dvě 10týdenní studie u dospělých, jedna 10týdenní studie u pediatrických pacientů (ve věku 8-17 let) a jedna udržovací studie u dospělých [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Dospělí
Doporučená počáteční dávka přípravku Fluvox 50 mg maleátové tablety u dospělých pacientů je 50 mg podávaná v jedné denní dávce před spaním. V kontrolovaných klinických studiích, které stanovily účinnost tablet fluvoxamin maleátu u OCD, byla pacientům titrována dávka v rozmezí 100 až 300 mg/den. V důsledku toho by měla být dávka zvyšována po 50 mg každých 4 až 7 dní, jak je tolerováno, dokud není dosaženo maximálního terapeutického přínosu, přičemž by neměla překročit 300 mg denně. Doporučuje se podat celkovou denní dávku vyšší než 100 mg rozdělenou do dvou dílčích dávek. Pokud se dávky neshodují, měla by se větší dávka podat před spaním.
Pediatrická populace (děti a dospívající)
Doporučená počáteční dávka tablet fluvoxamin maleátu u pediatrické populace (ve věku 8-17 let) je 25 mg podávaná jako jedna denní dávka před spaním. V kontrolované klinické studii, která stanovila účinnost tablet fluvoxamin maleátu u OCD, byla pediatrickým pacientům (ve věku 8-17 let) titrována dávka v rozmezí 50 až 200 mg/den. Při dávkování pediatrickým pacientům by měli lékaři vzít v úvahu věkové a genderové rozdíly. Maximální dávka u dětí do 11 let by neměla překročit 200 mg/den. Terapeutického účinku u dětí ženského pohlaví lze dosáhnout nižšími dávkami. K dosažení terapeutického přínosu může být indikována úprava dávky u dospívajících (až do maximální dávky pro dospělé 300 mg). Dávka by měla být zvyšována po 25 mg každých 4 až 7 dní, jak je tolerováno, dokud není dosaženo maximálního terapeutického přínosu. Doporučuje se podat celkovou denní dávku vyšší než 50 mg rozdělenou do dvou dílčích dávek. Pokud se dvě rozdělené dávky neshodují, měla by se větší dávka podat před spaním.
Starší pacienti nebo pacienti s poškozením jater
U starších pacientů a pacientů s poruchou funkce jater byla pozorována snížená clearance fluvoxamin maleátu. V důsledku toho může být vhodné upravit počáteční dávku a následnou titraci dávky pro tyto skupiny pacientů.
Přechod pacienta na nebo z inhibitoru monoaminooxidázy (MAOI) určeného k léčbě psychiatrických poruch
Mezi vysazením IMAO určeného k léčbě psychiatrických poruch a zahájením léčby přípravkem Fluvox 50 mg maleát tablety by mělo uplynout alespoň 14 dní. Naopak, po ukončení užívání přípravku Fluvox 100mgamine maleate Tablets by mělo uplynout alespoň 14 dní před zahájením IMAO určeného k léčbě psychiatrických poruch (viz KONTRAINDIKACE ].
Použití tablet fluvoxamin maleátu s jinými IMAO, jako je linezolid nebo methylenová modř
Nezačínejte léčbu fluvoxamin maleátem u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, protože existuje zvýšené riziko serotoninového syndromu. U pacienta, který vyžaduje naléhavější léčbu psychiatrického stavu, je třeba zvážit další intervence, včetně hospitalizace [viz KONTRAINDIKACE ].
některých případech může pacient, který již dostává léčbu přípravkem Fluvox 50mgamine maleate tablety, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou dostupné přijatelné alternativy k léčbě linezolidem nebo intravenózní metylenovou modří a potenciální přínosy linezolidu nebo intravenózní léčby methylenovou modří u konkrétního pacienta převažují nad riziky serotoninového syndromu, tablety fluvoxamin maleátu by měly být okamžitě ukončeny a podávání linezolidu nebo intravenózního lze podávat methylenovou modř. Pacient by měl být sledován na příznaky serotoninového syndromu po dobu dvou týdnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Terapie přípravkem Fluvox 100mgaminemaleate tablety může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg u přípravku Fluvox 100mgamine maleate tablety není jasné. Lékař by si však měl být vědom možnosti vzniku symptomů serotoninového syndromu při takovém použití [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Udržovací/pokračovací prodloužená léčba
Je obecně dohodnuto, že obsedantně kompulzivní porucha vyžaduje několik měsíců nebo déle trvalé farmakologické léčby. Přínos udržení pacientů s OCD na fluvoxamin maleátových tabletách po dosažení odpovědi po průměrné trvání asi 4 týdnů v 10týdenní jednoduše zaslepené fázi, během které byli pacienti titrováni na účinek, byl prokázán v kontrolované studii [viz Klinické testy ].
Lékař, který se rozhodne užívat fluvoxamin maleátové tablety po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta.
Přerušení léčby tabletami fluvoxamin maleátu
Byly hlášeny příznaky spojené s vysazením jiných SSRI nebo SNRI [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pacienti by měli být sledováni s ohledem na výskyt těchto příznaků při přerušení léčby. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, lze zvážit obnovení předchozí předepsané dávky. Následně může lékař pokračovat ve snižování dávky, ale pozvolnějším tempem.
JAK DODÁVÁNO
Dávkové formy A Síly
Fluvoxamin maleátové tablety USP jsou dostupné jako:
Tablety 25 mg: bez rýhy, bílé, eliptické, potahované (vyraženo „1222“ na jedné straně)
Tablety 50 mg: žluté, eliptické, potahované tablety s půlicí rýhou (vyraženo „1225“ na jedné straně a půlicí rýha na druhé straně)
Tablety 100 mg: béžové, eliptické, potahované tablety s půlicí rýhou (vyraženo „1221“ na jedné straně a půlicí rýha na druhé straně)
Skladování A Manipulace
Fluvox 50mgamine maleátové tablety USP jsou dostupné v následujících sílách, barvách, potiskech a prezentacích:
bez rýhy, bílé, eliptické, potažené filmem (vyraženo „1222“ na jedné straně)
Láhve po 100 .............. NDC 62559-158-01
rýhovaná, žlutá, elipsovitá, potažená filmem (vyraženo „1225“ na jedné straně a rýha na druhé straně)
Láhve po 100 .............. NDC 62559-159-01
rýhovaná, béžová, eliptická, potažená filmem (vyraženo „1221“ na jedné straně a rýha na druhé straně)
Láhve po 100 .............. NDC 62559-160-01
Uchovávejte mimo dosah dětí.
Tablety fluvoxamin maleátu by měly být chráněny před vysokou vlhkostí a skladovány při 20° až 25°C (68° až 77°F); povoleny výchylky do 15° až 30°C (59° až 86°F) [viz USP řízená pokojová teplota ].
Dávkujte v těsných nádobách.
Výrobce: ANI Pharmaceuticals, Inc., Baudette, MN 56623. Revize: červenec 2021
VEDLEJŠÍ EFEKTY
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Nežádoucí účinky vedoucí k přerušení léčby
Z 1087 pacientů s OCD a depresí léčených fluvoxamin maleátem v kontrolovaných klinických studiích v Severní Americe, 22 % přerušilo léčbu kvůli nežádoucí reakci. Nežádoucí účinky, které vedly k přerušení léčby u nejméně 2 % pacientů léčených fluvoxamin maleátem v těchto studiích, byly: nauzea (9 %), nespavost (4 %), ospalost (4 %), bolest hlavy (3 %) a astenie, zvracení , nervozita, neklid a závratě (každý 2 %).
Výskyt v řízených zkouškách
Běžně pozorované nežádoucí účinky v kontrolovaných klinických studiích
Fluvox 100mgamine maleátové tablety byly studovány v 10týdenních krátkodobých kontrolovaných studiích OCD (N=320) a deprese (N=1350). Obecně byla míra nežádoucích účinků podobná ve dvou souborech údajů i ve studii pediatrické OCD. Nejčastěji pozorované nežádoucí účinky spojené s užíváním tablet fluvoxamin maleátu a pravděpodobně související s lékem (výskyt 5 % nebo vyšší a nejméně dvakrát vyšší než u placeba) odvozené z tabulky 2 byly: nauzea, somnolence, nespavost, astenie, nervozita, dyspepsie, abnormální ejakulace, pocení, anorexie, třes a zvracení. V souboru dvou studií zahrnujících pouze pacienty s OCD byly pomocí výše uvedeného pravidla identifikovány následující další reakce: anorgasmie, snížené libido, sucho v ústech, rýma, poruchy chuti a frekvence močení. Ve studii pediatrických pacientů s OCD byly pomocí výše uvedeného pravidla identifikovány následující další reakce: agitovanost, deprese, dysmenorea, flatulence, hyperkineze a vyrážka.
Nežádoucí reakce vyskytující se s výskytem 1 %
Tabulka 2 uvádí nežádoucí účinky, které se vyskytly u dospělých s frekvencí 1 % nebo více a byly častější než ve skupině s placebem u pacientů léčených tabletami fluvoxamin maleátu ve dvou krátkodobých placebem kontrolovaných studiích OCD (10 týdnů) a depresi studie (6 týdnů), ve kterých byla pacientům podávána dávka v rozmezí obecně 100 až 300 mg/den. Tato tabulka ukazuje procento pacientů v každé skupině, kteří měli alespoň jeden výskyt reakce v určité době během léčby. Hlášené nežádoucí účinky byly klasifikovány pomocí standardní terminologie slovníku založeného na COSTART.
Předepisující lékař by si měl být vědom toho, že tyto údaje nelze použít k předpovědi výskytu nežádoucích účinků v průběhu obvyklé lékařské praxe, kde se charakteristiky pacienta a další faktory mohou lišit od těch, které převládaly v klinických studiích. Podobně nelze uvedené frekvence porovnávat s údaji získanými z jiných klinických studií zahrnujících různé způsoby léčby, použití a zkoušející. Uvedené údaje však poskytují předepisujícímu lékaři určitý základ pro odhad relativního podílu léčivých a nelékových faktorů na míře výskytu vedlejších účinků ve studované populaci.
TABULKA 2: MÍRY VÝSKYTU NEŽÁDOUCÍ REAKCE – LÉČBA PODLE TĚLESNÉHO SYSTÉMU U DOSPĚLÝCH POPULACE S OCD A DEPRESÍ KOMBINOVANĚ1
Nežádoucí reakce ve studiích OCD kontrolovaných placebem, které jsou výrazně odlišné (definované jako alespoň dvojnásobný rozdíl) v míře od souhrnných měr reakcí ve studiích OCD a deprese Placebem kontrolovaných studiích
Reakcemi ve studiích OCD s dvojnásobným poklesem četnosti ve srovnání s četností reakcí ve studiích OCD a deprese byly dysfagie a amblyopie (většinou rozmazané vidění). Navíc došlo k přibližně 25% snížení nevolnosti.
Reakce ve studiích OCD s dvojnásobným zvýšením četnosti ve srovnání s četností reakcí ve studiích OCD a deprese byly: astenie, abnormální ejakulace (většinou opožděná ejakulace), úzkost, rýma, anorgasmie (u mužů), deprese, snížené libido, faryngitida , agitovanost, impotence, myoklonus/záškuby, žízeň, ztráta hmotnosti, křeče v nohách, myalgie a retence moči. Tyto reakce jsou ve studiích OCD uvedeny v pořadí podle klesajícího počtu.
Jiné nežádoucí účinky u pediatrické populace s OCD
pediatrických pacientů (N=57) léčených přípravkem Fluvox 100 mg maleátové tablety byl celkový profil nežádoucích účinků obecně podobný profilu pozorovanému ve studiích u dospělých, jak je uvedeno v tabulce 2. Nicméně následující nežádoucí účinky, které se neobjevují v tabulce 2, byly hlášeny u dvou nebo více pediatrických pacientů a byly častější u tablet fluvoxamin maleát než u placeba: zvýšený kašel, dysmenorea, ekchymóza, emoční labilita, epistaxe, hyperkineze, manická reakce, vyrážka, sinusitida a snížení hmotnosti.
Mužská a ženská sexuální dysfunkce s SSRI
Ačkoli změny v sexuální touze, sexuální výkonnosti a sexuální spokojenosti se často objevují jako projevy psychiatrické poruchy a se stárnutím, mohou být také důsledkem farmakologické léčby. Některé důkazy zejména naznačují, že takové nežádoucí sexuální zážitky mohou způsobit selektivní inhibitory zpětného vychytávání serotoninu (SSRI).
Spolehlivé odhady výskytu a závažnosti nežádoucích zážitků zahrnujících sexuální touhu, výkon a spokojenost je obtížné získat, částečně proto, že pacienti a lékaři se mohou zdráhat o nich diskutovat. V souladu s tím odhady výskytu nežádoucích sexuálních zkušeností a výkonu uvedené v označení produktů pravděpodobně podhodnocují jejich skutečný výskyt.
Tabulka 3 uvádí výskyt sexuálních vedlejších účinků hlášených nejméně 2 % pacientů užívajících Fluvox 100 mg maleátové tablety v placebem kontrolovaných studiích u deprese a OCD.
TABULKA 3: PROCENTO PACIENTŮ HLÁSÍCÍCH SEXUÁLNÍ NEŽÁDOUCÍ REAKCE V DOSPĚLÝCH PLACEBEM KONTROLOVANÝCH STUDIECH PŘI OCD A DEPRESI
Neexistují žádné adekvátní a dobře kontrolované studie zkoumající sexuální dysfunkci při léčbě fluvoxaminem.
Léčba přípravkem Fluvox 50 mg byla spojena s několika případy priapismu. V těchto případech se známým výsledkem se pacienti zotavili bez následků a po vysazení fluvoxu 50 mg.
když je obtížné znát přesné riziko sexuální dysfunkce spojené s užíváním SSRI, lékaři by se měli běžně dotazovat na takové možné vedlejší účinky.
Změny vitálních funkcí
Srovnání skupin s fluvoxamin maleátem a placebem v oddělených souborech krátkodobých studií OCD a deprese na (1) změně mediánu od výchozího stavu na různých proměnných vitálních funkcí a na (2) incidenci pacientů splňujících kritéria pro potenciálně důležité změny oproti výchozímu stavu na různých vitálních funkcích proměnné příznaky neodhalily žádné důležité rozdíly mezi fluvoxamin maleátem a placebem.
Laboratorní změny
Srovnání skupin fluvoxamin maleátu a placeba v samostatných souborech krátkodobých studií OCD a deprese na (1) změně mediánu od výchozí hodnoty na různých proměnných chemického složení séra, hematologie a analýzy moči a na (2) incidenci pacientů splňujících kritéria pro potenciálně důležité změny od výchozího stavu na základě různých proměnných chemického složení séra, hematologie a analýzy moči neodhalily žádné důležité rozdíly mezi fluvoxem 100 mg amin maleátem a placebem.
Změny EKG
Srovnání skupin fluvox 50 mg amin maleátu a placeba v samostatných souborech krátkodobých studií OCD a deprese na (1) průměrné změně od výchozí hodnoty na různých proměnných EKG a na (2) incidenci pacientů splňujících kritéria pro potenciálně důležité změny oproti výchozí hodnotě na různých EKG proměnné neodhalily žádné důležité rozdíly mezi fluvoxamin maleátem a placebem.
Další reakce pozorované během předmarketingového hodnocení tablet Fluvox 100 mg maleát
Během premarketingových klinických studií prováděných v Severní Americe a Evropě byly podávány opakované dávky fluvoxamin maleátu pro celkovou kombinovanou expozici 2737 pacientům u pacientů trpících OCD nebo velkou depresivní poruchou. Nežádoucí reakce spojené s touto expozicí byly zaznamenány klinickými výzkumníky pomocí deskriptivní terminologie podle vlastního výběru. V důsledku toho není možné poskytnout smysluplný odhad podílu jedinců, u kterých se vyskytly nežádoucí reakce, aniž by se nejprve seskupily podobné typy nežádoucích reakcí do omezeného (tj. sníženého) počtu kategorií standardních reakcí.
tabulkách, které následují, byla ke klasifikaci hlášených nežádoucích účinků použita standardní terminologie slovníku založená na COSTART. Pokud byl výraz COSTART pro reakci tak obecný, že byl neinformativní, byl nahrazen výrazem informativnějším. Uvedené frekvence proto představují podíl 2737 pacientů vystavených opakovaným dávkám fluvox 100mgaminomaleinátu, u kterých se při podávání fluvoxamin maleátu objevila reakce uvedeného typu alespoň jednou. Všechny hlášené reakce jsou zahrnuty v seznamu níže, s následujícími výjimkami: 1) ty reakce již uvedené v tabulce 2, která uvádí četnost výskytu běžných nežádoucích účinků v placebem kontrolovaných klinických studiích OCD a deprese, jsou vyloučeny; 2) ty reakce, u kterých nebyla drogová příčina považována za pravděpodobnou, jsou vynechány; 3) reakce, pro které byl termín COSTART příliš vágní na to, aby měl klinický význam a nemohl být nahrazen více informativním termínem; a 4) reakce, které byly hlášeny pouze u jednoho pacienta a které nebyly posouzeny jako potenciálně závažné, nejsou zahrnuty. Je důležité zdůraznit, že ačkoli se hlášené reakce vyskytly během léčby fluvoxamin maleátem, nebyla prokázána příčinná souvislost s fluvoxamin maleátem.
Reakce jsou dále klasifikovány v rámci kategorií tělesných systémů a vyjmenovány v pořadí klesající frekvence pomocí následujících definic: časté nežádoucí reakce jsou definovány jako ty, které se vyskytují jednou nebo vícekrát u alespoň 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují mezi 1/100 a 1/1000 pacientů; a vzácné nežádoucí účinky jsou ty, které se vyskytují u méně než 1/1000 pacientů.
Tělo jako celek - Časté: malátnost; Méně časté: fotosenzitivní reakce a pokus o sebevraždu.
Kardiovaskulární systém - Časté: synkopa.
Zažívací ústrojí - Méně časté: gastrointestinální krvácení a meléna; Vzácné: hemateméza.
Hemický a lymfatický systém - Méně časté: anémie a ekchymóza; Vzácné: purpura.
Metabolické a nutriční systémy - Časté: přibývání na váze a hubnutí.
Nervový systém - Časté: hyperkineze, manická reakce a myoklonus; Méně časté: abnormální sny, akatizie, křeče, dyskineze, dystonie, euforie, extrapyramidový syndrom a záškuby; Vzácné: abstinenční syndrom.
Dýchací systém - Méně časté: epistaxe. Vzácné: hemoptýza a laryngismus.
Kůže - Méně časté: kopřivka.
Urogenitální systém* - Méně časté: hematurie, menoragie a vaginální krvácení; Vzácné: hematospermie.
* Na základě počtu mužů nebo žen, podle potřeby.
Postmarketingové zprávy
Následující nežádoucí účinky byly zjištěny během užívání přípravku Fluvox 100mgamine maleate tablety po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Dobrovolné zprávy o nežádoucích účincích u pacientů užívajících Fluvox 50 mg maleát tablety, které byly přijímány od uvedení na trh a mají neznámou příčinnou souvislost s užíváním fluvoxamin maleátových tablet, zahrnují: akutní selhání ledvin, agranulocytózu, amenoreu, anafylaktické reakce, angioedém, aplastickou anémii, bulózní erupci , Henochova-Schoenleinova purpura, hepatitida, ileus, pankreatitida, porfyrie, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, vaskulitida a ventrikulární tachykardie (včetně torsades de pointes).
DROGOVÉ INTERAKCE
Možné interakce s léky, které inhibují nebo jsou metabolizovány izoenzymy cytochromu P450
Mnohočetné izoenzymy jaterního cytochromu P450 se účastní oxidativní biotransformace velkého počtu strukturálně odlišných léčiv a endogenních sloučenin. Dostupné znalosti týkající se vztahu fluvoxaminu a izoenzymového systému cytochromu P450 byly získány převážně z farmakokinetických interakčních studií provedených u zdravých dobrovolníků, ale jsou k dispozici i některé předběžné údaje in vitro. Na základě zjištění podstatných interakcí fluvoxu 50mgaminu s některými z těchto léků [viz pozdější části této části a také VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] a omezené údaje in vitro pro CYP3A4 se zdá, že fluvox 100 mg inhibuje několik izoenzymů cytochromu P450, o kterých je známo, že se podílejí na metabolismu jiných léčiv, jako jsou: CYP1A2 (např. warfarin, theofylin, propranolol, tizanidin), CYP2C9 (např. warfarin), CYP3A4 (např. alprazolam) a CYP2C19 (např. omeprazol).
Údaje in vitro naznačují, že fluvoxamin je relativně slabým inhibitorem CYP2D6.
Přibližně 7 % normální populace má genetický kód, který vede ke snížení úrovně aktivity CYP2D6. Takoví jedinci byli označováni jako „špatní metabolizátoři“ (PM) léků, jako je debrisochin, dextromethorfan a tricyklická antidepresiva. Zatímco žádné z léků studovaných na lékové interakce významně neovlivnilo farmakokinetiku fluvoxu 50 mg, in vivo studie farmakokinetiky fluvoxaminu po jednorázové dávce u 13 PM subjektů prokázala změněné farmakokinetické vlastnosti ve srovnání s 16 „extenzivními metabolizátory“ (EM): průměrná Cmax, AUC a poločas se zvýšil o 52 %, 200 % a 62 %, v tomto pořadí, u PM ve srovnání se skupinou EM. To naznačuje, že fluvox 100 mg je metabolizován, alespoň částečně, prostřednictvím CYP2D6. Opatrnosti je třeba u pacientů, o kterých je známo, že mají snížené hladiny aktivity CYP2D6, au těch, kteří současně užívají léky, o nichž je známo, že inhibují tento izoenzym cytochromu P450 (např. chinidin).
Metabolismus fluvoxaminu nebyl plně charakterizován a účinky silné inhibice izoenzymu cytochromu P450, jako je ketokonazolová inhibice CYP3A4, na metabolismus fluvoxu 100 mg nebyly studovány.
Klinicky významná interakce fluvoxaminu je možná s léky s úzkým terapeutickým poměrem, jako je pimozid, warfarin, theofylin, některé benzodiazepiny, omeprazol a fenytoin. Pokud se má přípravek Fluvox 100mgamine maleát tablety podávat spolu s lékem, který je eliminován oxidativním metabolismem a má úzké terapeutické okno, měly by být pečlivě sledovány plazmatické hladiny a/nebo farmakodynamické účinky druhého léku, alespoň dokud nebudou podmínky ustáleného stavu dosáhl [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
CNS aktivní léky
Antipsychotika: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Benzodiazepiny: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Alprazolam: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Diazepam: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Lorazepam: Studie opakovaných dávek fluvoxamin maleátu (50 mg dvakrát denně) u zdravých dobrovolníků mužského pohlaví (N=12) a jednorázové dávky lorazepamu (jednorázová dávka 4 mg) neprokázala žádnou významnou farmakokinetickou interakci. V průměru jak samotný lorazepam, tak lorazepam s fluvoxaminem způsobily podstatné snížení kognitivních funkcí; avšak společné podávání fluvoxaminu a lorazepamu nevedlo k větším průměrným poklesům ve srovnání se samotným lorazepamem.
Alkohol: Studie zahrnující jednotlivé dávky 40 g ethanolu (v jedné studii perorální podání a ve druhé intravenózní) a opakované podávání fluvoxu 100 mg aminmaleinátu (50 mg dvakrát denně) neprokázaly žádný účinek žádného léku na farmakokinetiku nebo farmakodynamiku druhého léku. Stejně jako u jiných psychotropních léků je třeba pacientům doporučit, aby se během užívání fluvoxamin maleátových tablet vyhýbali alkoholu.
karbamazepin: Při současném podávání fluvox 100mgaminomaleátu a karbamazepinu byly hlášeny zvýšené hladiny karbamazepinu a příznaky toxicity.
klozapin: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Lithium: Stejně jako u jiných serotonergních léků může lithium zesilovat serotonergní účinky fluvoxaminu, a proto je třeba tuto kombinaci používat s opatrností. Při současném podávání fluvox 50 mg amin maleátu a lithia byly hlášeny záchvaty.
metadon: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Inhibitory monoaminoxidázy: Vidět DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Pimozid: Vidět KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Ramelteon: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Serotonergní léky: Vidět DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
takrin: Ve studii na 13 zdravých dobrovolnících mužského pohlaví byla jednorázová dávka 40 mg takrinu přidaná k fluvoxu 50 mg/den podávanému v ustáleném stavu spojena s pětinásobným a osminásobným zvýšením Cmax a AUC takrinu ve srovnání s podávání samotného takrinu. U pěti subjektů se po společném podání objevila nauzea, zvracení, pocení a průjem, což je v souladu s cholinergními účinky takrinu.
Thioridazin: Vidět KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
tizanidin: Vidět KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Tricyklická antidepresiva (TCA): Při současném podávání fluvoxamin maleátu a amitriptylinu, klomipraminu nebo imipraminu byly hlášeny významně zvýšené hladiny TCA v plazmě. Při současném podávání tablet fluvoxamin maleátu a TCA je nutná opatrnost; může být nutné monitorovat plazmatické koncentrace TCA a snížit dávku TCA.
Triptany: Po uvedení přípravku na trh byly vzácně hlášeny serotoninový syndrom při užívání SSRI a triptanu. Pokud je současná léčba fluvoxem 50 mg s triptanem klinicky opodstatněná, doporučuje se pečlivé sledování pacienta, zejména při zahájení léčby a při zvyšování dávky (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sumatriptan: Po uvedení přípravku na trh byly vzácně hlášeny pacienty se slabostí, hyperreflexií a poruchou koordinace po použití selektivního inhibitoru zpětného vychytávání serotoninu (SSRI) a sumatriptanu. Pokud je současná léčba sumatriptanem a SSRI (např. fluoxetin, fluvoxamin, paroxetin, sertralin) klinicky opodstatněná, doporučuje se vhodné sledování pacienta.
Tryptofan: Tryptofan může zvýšit serotonergní účinky fluvoxaminu, a proto je třeba tuto kombinaci používat s opatrností. Při současném podávání fluvoxamin maleátu a tryptofanu bylo hlášeno silné zvracení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Jiné drogy
Alosetron: Vidět KONTRAINIDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a příbalový leták Lotronex™ (alosetron).
digoxin: Podávání fluvoxu 100 mg amin maleátu 100 mg denně po dobu 18 dnů (N=8) významně neovlivnilo farmakokinetiku 1,25 mg jednotlivé intravenózní dávky digoxinu.
Diltiazem: Při současném podávání fluvoxamin maleátu a diltiazemu byla hlášena bradykardie.
mexiletina: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Propranolol a další beta-blokátory: Současné podávání fluvoxamin maleátu 100 mg denně a propranololu 160 mg denně normálním dobrovolníkům vedlo k průměrnému pětinásobnému zvýšení (rozmezí 2 až 17) minimálních plazmatických koncentrací propranololu. V této studii došlo k mírné potenciaci propranololem indukovaného snížení srdeční frekvence a snížení zátěžového diastolického tlaku.
Při současném podávání fluvoxamin maleátu a metoprololu byl hlášen jeden případ bradykardie a hypotenze a druhý případ ortostatické hypotenze.
Pokud se propranolol nebo metoprolol podává současně s přípravkem Fluvox 50 mg, doporučuje se snížení počáteční dávky betablokátoru a opatrnější titrace dávky. U tablet fluvoxamin maleátu není nutná žádná úprava dávkování.
Současné podávání fluvoxamin maleátu 100 mg denně s atenololem 100 mg denně (N=6) neovlivnilo plazmatické koncentrace atenololu. Na rozdíl od propranololu a metoprololu, které jsou metabolizovány v játrech, je atenolol eliminován primárně ledvinami.
teofylin: Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Warfarin a další léky, které interferují s hemostázou (NSAID, aspirin atd.): Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ .
Účinky Kouření Na Metabolismus Fluvoxaminu
U kuřáků došlo k 25% zvýšení metabolismu fluvoxu 100 mg ve srovnání s nekuřáky.
Elektrokonvulzivní terapie (ECT)
Neexistují žádné klinické studie, které by stanovily přínosy nebo rizika kombinovaného použití ECT a fluvox 100 mg amin maleátu.
Zneužívání drog a závislost
Kontrolovaná látka
Tablety fluvoxamin maleátu nejsou kontrolovanou látkou.
Závislost
Potenciál zneužívání, tolerance a fyzické závislosti na fluvox 100mgaminomaleátu byl studován na modelu primátů. Nebyl nalezen žádný důkaz o jevech závislosti. Účinky vysazení fluvoxamin maleátových tablet nebyly v kontrolovaných klinických studiích systematicky hodnoceny. Tablety fluvoxamin maleátu nebyly v klinických studiích systematicky studovány na potenciální zneužití, ale v klinických studiích nebyly žádné známky chování při vyhledávání drog. Je však třeba poznamenat, že pacienti s rizikem drogové závislosti byli systematicky vylučováni z výzkumných studií fluvox 100mgaminomaleinátu. Obecně není možné na základě předklinických nebo premarketingových klinických zkušeností předpovědět, do jaké míry bude léčivo aktivní v CNS po uvedení na trh zneužito, odkloněno a/nebo zneužito. V důsledku toho by lékaři měli pacienty pečlivě vyhodnotit, zda v anamnéze nezískávali drogy, a pozorně tyto pacienty sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání fluvoxamin maleátu (tj. rozvoj tolerance, zvyšování dávky, chování vyhledávající drogu).
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Klinické zhoršení a riziko sebevraždy
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a další) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (ve věku 18-24 let) s velkou depresivní poruchou ( MDD) a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl lék-placebo v počtu případů sebevraždy na 1000 léčených pacientů) jsou uvedeny v tabulce 1.
TABULKA 1: ROZDÍLY DROGA-PLACEBO V POČTU PŘÍPADŮ SEBEVRAŽDA NA 1000 LÉČENÝCH PACIENTŮ
V žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými došlo k sebevraždám, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Pokud bylo přijato rozhodnutí přerušit léčbu, měla by být medikace snižována tak rychle, jak je to možné, ale s vědomím, že náhlé přerušení může být spojeno s určitými příznaky a riziky [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky popsané výše. , jakož i vznik suicidality, a takové příznaky neprodleně hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro tablety fluvoxamin maleátu by měly být napsány pro nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese. Je třeba poznamenat, že Fluvox 50mgamine maleátové tablety nejsou schváleny pro použití při léčbě bipolární deprese.
serotoninový syndrom
Vývoj potenciálně život ohrožujícího serotoninového syndromu byl hlášen u SNRI a SSRI, včetně fluvoxamin maleátových tablet, samotných, ale zejména při současném užívání serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, busipironu, amfetaminů a třezalka tečkovaná) a s léky, které zhoršují metabolismus serotoninu (zejména IMAO, jak ty určené k léčbě psychiatrických poruch, tak i další, jako je linezolid a intravenózní methylenová modř).
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární aberace (např. třes, rigiditu, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu.
Současné užívání fluvoxamin maleátových tablet s IMAO určenými k léčbě psychiatrických poruch je kontraindikováno. Tablety fluvoxamin maleátu by také neměly být zahájeny u pacientů, kteří jsou léčeni IMAO, jako je linezolid nebo intravenózní methylenová modř. Všechny zprávy s methylenovou modří, které poskytly informace o cestě podání, zahrnovaly intravenózní podání v rozmezí dávek 1 mg/kg až 8 mg/kg. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Mohou nastat okolnosti, kdy je nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř u pacienta užívajícího Fluvox 50 mg maleátové tablety. Fluvox 50mgamine maleátové tablety by měly být přerušeny před zahájením léčby IMAO (viz KONTRAINDIKACE , DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pokud je současné užívání tablet fluvoxamin maleátu s jinými serotonergními léky, včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu, amfetaminů a třezalky tečkované, klinicky oprávněné, pacienti by měli být informováni o potenciální zvýšené riziko serotoninového syndromu, zejména při zahájení léčby a při zvyšování dávky.
Léčba tabletami fluvoxamin maleátu a jakýmikoli souběžně podávanými serotonergními látkami by měla být okamžitě přerušena, pokud se vyskytnou výše uvedené příhody, a měla by být zahájena podpůrná symptomatická léčba.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně tablet fluvoxamin maleátu, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, kteří nemají patentovanou iridektomii.
Potenciální interakce thioridazinu
Účinek fluvoxaminu (25 mg dvakrát denně po dobu jednoho týdne) na koncentrace thioridazinu v ustáleném stavu byl hodnocen u 10 hospitalizovaných mužů se schizofrenií. Koncentrace thioridazinu a jeho dvou aktivních metabolitů, mesoridazinu a sulforidazinu, se po současném podání fluvoxu 100 mg zvýšily trojnásobně.
Podávání thioridazinu vyvolává na dávce závislé prodloužení QTc intervalu, které je spojeno se závažnými ventrikulárními arytmiemi, jako jsou arytmie typu torsades de pointes, a náhlou smrtí. Je pravděpodobné, že tato zkušenost podceňuje míru rizika, které by mohlo nastat při vyšších dávkách thioridazinu. Kromě toho může být účinek fluvoxu 100 mg ještě výraznější, pokud je podáván ve vyšších dávkách. Fluvoxamin a thioridazin by proto neměly být podávány současně [viz KONTRAINDIKACE ].
Potenciální interakce tizanidinu
Fluvoxamin je silný inhibitor CYP1A2 a tizanidin je substrátem CYP1A2. Účinek fluvoxu 50 mg (100 mg denně po dobu 4 dnů) na farmakokinetiku a farmakodynamiku jednotlivé dávky 4 mg tizanidinu byl studován u 10 zdravých mužů. Cmax tizanidinu byla zvýšena přibližně 12krát (rozmezí 5krát až 32krát), poločas eliminace byl prodloužen téměř 3krát a AUC se zvýšila 33krát (rozmezí 14krát až 103krát). Průměrný maximální účinek na krevní tlak byl pokles systolického krevního tlaku o 35 mm Hg, pokles diastolického krevního tlaku o 20 mm Hg a snížení srdeční frekvence o 4 tepy/min. Ospalost byla významně zvýšena a výkon v psychomotorické úloze byl významně narušen. Fluvoxamin a tizanidin by se neměly užívat společně [viz KONTRAINDIKACE ].
Potenciální interakce pimozidu
Pimozid je metabolizován izoenzymem cytochromu P4503A4 a bylo prokázáno, že ketokonazol, silný inhibitor CYP3A4, blokuje metabolismus tohoto léčiva, což vede ke zvýšeným plazmatickým koncentracím původního léčiva. Zvýšená plazmatická koncentrace pimozidu způsobuje prodloužení QT intervalu a je spojována s ventrikulární tachykardií typu torsades de pointes, někdy fatální. Jak je uvedeno níže, podstatná farmakokinetická interakce byla pozorována u fluvoxu 100 mg v kombinaci s alprazolamem, lékem, o kterém je známo, že je metabolizován CYP3A4. Ačkoli nebylo definitivně prokázáno, že fluvox 100 mg je silný inhibitor CYP3A4, vzhledem k podstatné interakci fluvoxu 50 mg s alprazolamem tomu tak pravděpodobně je. V důsledku toho se doporučuje, aby se fluvoxamin nepoužíval v kombinaci s pimozidem [viz KONTRAINDIKACE ].
Potenciální interakce Alosetronu
Protože je alosetron metabolizován řadou jaterních enzymů metabolizujících léky CYP, mohou induktory nebo inhibitory těchto enzymů měnit clearance alosetronu. Fluvox 50 mg je známým silným inhibitorem CYP1A2 a také inhibuje CYP3A4, CYP2C9 a CYP2C19. Ve farmakokinetické studii dostávalo 40 zdravých žen fluvox 100 mg ve zvyšujících se dávkách od 50 mg do 200 mg denně po dobu 16 dnů se současným podáváním alosetronu 1 mg poslední den. Fluvox 50 mg zvýšil průměrnou plazmatickou koncentraci alosetronu (AUC) přibližně 6krát a prodloužil poločas přibližně 3krát. [Vidět KONTRAINDIKACE a příbalový leták Lotronex™ (alosetron)].
Další potenciálně důležité lékové interakce
Benzodiazepiny
Benzodiazepiny metabolizované jaterní oxidací (např. alprazolam, midazolam, triazolam atd.) by měly být používány s opatrností, protože clearance těchto léků je pravděpodobně snížena fluvoxaminem. Je nepravděpodobné, že by fluvox 100 mg ovlivňoval clearance benzodiazepinů metabolizovaných glukuronidací (např. lorazepam, oxazepam, temazepam).
Alprazolam
Když byly fluvoxamin maleát (100 mg qd) a alprazolam (1 mg qd) současně podávány do ustáleného stavu, byly plazmatické koncentrace a další farmakokinetické parametry (AUC, Cmax, T½) alprazolamu přibližně dvojnásobné oproti hodnotám pozorovaným při podávání samotného alprazolamu; perorální clearance byla snížena asi o 50 %. Zvýšené plazmatické koncentrace alprazolamu vedly ke snížení psychomotorické výkonnosti a paměti. Tato interakce, která nebyla zkoumána při použití vyšších dávek fluvoxaminu, může být výraznější, pokud je současně podávána denní dávka 300 mg, zejména proto, že fluvox 50 mg vykazuje nelineární farmakokinetiku v rozmezí dávek 100-300 mg. Pokud je alprazolam podáván současně s přípravkem Fluvox 50 mg maleát tablety, počáteční dávka alprazolamu by měla být snížena alespoň na polovinu a doporučuje se titrace na nejnižší účinnou dávku. U Fluvox 100 mg maleátových tablet není nutná žádná úprava dávkování.
Diazepam
Současné podávání tablet fluvoxamin maleátu a diazepamu se obecně nedoporučuje. Protože fluvoxamin snižuje clearance jak diazepamu, tak jeho aktivního metabolitu, Ndesmethyldiazepamu, existuje velká pravděpodobnost podstatné akumulace obou druhů během chronického současného podávání.
Důkazy podporující závěr, že se nedoporučuje souběžné podávání fluvoxaminu a diazepamu, jsou odvozeny ze studie, ve které byla zdravým dobrovolníkům užívajícím 150 mg/den fluvox 50mgaminu podávána jedna perorální dávka 10 mg diazepamu. U těchto subjektů (N=8) byla clearance diazepamu snížena o 65 % a clearance N-desmethyldiazepamu na úroveň, která byla příliš nízká pro měření v průběhu 2týdenní studie.
Je pravděpodobné, že tato zkušenost významně podhodnocuje stupeň akumulace, který by mohl nastat při opakovaném podávání diazepamu. Navíc, jak bylo uvedeno u alprazolamu, účinek fluvoxu 50 mg může být ještě výraznější, když je podáván ve vyšších dávkách.
V souladu s tím by diazepam a fluvoxamin neměly být běžně podávány současně.
klozapin
Zvýšené hladiny klozapinu v séru byly hlášeny u pacientů užívajících fluvox 100mgamineát a klozapin. Vzhledem k tomu, že se zdá, že záchvaty související s klozapinem a ortostatická hypotenze souvisejí s dávkou, riziko těchto nežádoucích účinků může být vyšší, pokud jsou fluvoxamin a klozapin podávány současně. Při současném užívání fluvoxamin maleátu a klozapinu by měli být pacienti pečlivě sledováni.

metadon
Při podávání fluvox 50mgaminmaleinátu pacientům, kteří dostávali udržovací léčbu metadonem, byly hlášeny významně zvýšené poměry metadonu (hladina v plazmě:dávka), přičemž u jednoho pacienta se objevily příznaky intoxikace opiáty. Příznaky z vysazení opioidů byly hlášeny po vysazení fluvoxamin maleátu u jiného pacienta.
Mexiletin
Účinek fluvoxaminu v ustáleném stavu (50 mg dvakrát denně po dobu 7 dnů) na farmakokinetiku mexiletinu (200 mg) po jedné dávce byl hodnocen u 6 zdravých japonských mužů. Clearance mexiletinu byla po současném podání s fluvoxem 100 mg snížena o 38 % ve srovnání se samotným mexiletinem. Pokud jsou fluvoxamin a mexiletin podávány současně, měly by být monitorovány hladiny mexiletinu v séru.
Ramelteon
Když byl fluvox 50 mg 100 mg dvakrát denně podáván po dobu 3 dnů před jednorázovým společným podáním ramelteonu 16 mg a fluvoxaminu, AUC pro ramelteon se zvýšila přibližně 190krát a Cmax se zvýšila přibližně 70krát ve srovnání s ramelteonem podávaným samostatně. Ramelteon by se neměl používat v kombinaci s fluvoxaminem.
Theofylin
Účinek ustáleného stavu fluvoxu 50 mg (50 mg dvakrát denně) na farmakokinetiku jednorázové dávky theofylinu (375 mg jako 442 mg aminofylinu) byl hodnocen u 12 zdravých nekuřáků mužských dobrovolníků. Clearance theofylinu byla snížena přibližně 3krát. Pokud je tedy theofylin podáván současně s fluvoxamin maleátem, jeho dávka by měla být snížena na jednu třetinu obvyklé denní udržovací dávky a měly by být monitorovány plazmatické koncentrace theofylinu. U Fluvox 100 mg maleátových tablet není nutná žádná úprava dávkování.
Warfarin a další léky, které interferují s hemostázou (NSAID, aspirin atd.)
Uvolňování serotoninu krevními destičkami hraje důležitou roli v hemostáze. Epidemiologické studie případové kontroly a kohorty prokázaly souvislost mezi užíváním psychofarmak, která interferují se zpětným vychytáváním serotoninu, a výskytem krvácení do horní části gastrointestinálního traktu. Tyto studie také ukázaly, že současné užívání NSAID nebo aspirinu může toto riziko krvácení zesílit. Pacienti by tedy měli být upozorněni na užívání těchto léků současně s fluvoxaminem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Warfarin
Když byl fluvox 50mgamineát (50 mg třikrát denně) podáván současně s warfarinem po dobu dvou týdnů, plazmatické koncentrace warfarinu se zvýšily o 98 % a protrombinový čas se prodloužil. Proto by u pacientů užívajících perorální antikoagulancia a tablety fluvoxamin maleátu měl být sledován protrombinový čas a dávka antikoagulancia by měla být odpovídajícím způsobem upravena. U tablet fluvoxamin maleátu není nutná žádná úprava dávkování.
Přerušení léčby přípravkem Fluvox 100mgamine maleátové tablety
Během uvádění tablet fluvoxamin maleátu na trh a dalších SSRI a SNRI (inhibitory zpětného vychytávání serotoninu a norepinefrinu) byly spontánně hlášeny nežádoucí účinky po vysazení těchto léků, zejména pokud jsou náhlé, včetně následujících: dysforická nálada, podrážděnost, agitovanost, závratě senzorické poruchy (např. parestézie, jako jsou pocity elektrického šoku), úzkost, zmatenost, bolest hlavy, letargie, emoční labilita, nespavost a hypománie. I když tyto příhody obecně samy odezní, byly hlášeny závažné příznaky z vysazení.
Při ukončování léčby přípravkem Fluvox 50 mg maleát tablety je třeba u pacientů tyto příznaky sledovat. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, lze zvážit obnovení předchozí předepsané dávky. Následně může lékař pokračovat ve snižování dávky, ale pozvolnějším tempem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Abnormální krvácení
SSRI a SNRI, včetně tablet fluvoxamin maleátu, mohou zvýšit riziko krvácivých příhod. Současné užívání aspirinu, nesteroidních protizánětlivých léků, warfarinu a dalších antikoagulancií může toto riziko zvýšit. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Krvácení související s SSRI a SNRI se pohybovalo od ekchymóz, hematomů, epistaxe a petechií až po život ohrožující krvácení.
Pacienti by měli být upozorněni na riziko krvácení spojeného se současným užíváním přípravku Fluvox 100mgamine maleát tablety a NSAID, aspirinu nebo jiných léků, které ovlivňují koagulaci (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Aktivace mánie/hypománie
Během premarketingových studií zahrnujících primárně depresivní pacienty se hypománie nebo mánie objevily přibližně u 1 % pacientů léčených fluvoxaminem. V desetitýdenní pediatrické studii OCD se u 2 z 57 pacientů (4 %) léčených fluvoxaminem objevily manické reakce ve srovnání s žádným ze 63 pacientů s placebem. Aktivace mánie/hypománie byla také hlášena u malé části pacientů s velkou afektivní poruchou, kteří byli léčeni jinými dostupnými antidepresivy. Stejně jako u všech antidepresiv je třeba u pacientů s mánií v anamnéze používat tablety fluvoxamin maleátu opatrně.
Záchvaty
Během premarketingových studií byly záchvaty hlášeny u 0,2 % pacientů léčených fluvoxaminem. Při podávání léku pacientům s anamnézou křečových poruch se doporučuje opatrnost. Fluvox 100 mg je třeba se vyhnout pacientům s nestabilní epilepsií a pacienti s kontrolovanou epilepsií by měli být pečlivě sledováni. Léčba fluvoxaminem by měla být přerušena, pokud se objeví záchvaty nebo pokud se frekvence záchvatů zvýší.
Hyponatrémie
Hyponatremie se může objevit v důsledku léčby SSRI a SNRI, včetně tablet fluvoxamin maleátu. V mnoha případech se zdá, že tato hyponatremie je výsledkem syndromu nevhodného antidiuretického hormonu (SIADH). Byly hlášeny případy se sérovým sodíkem nižším než 110 mmol/l. Starší pacienti mohou mít větší riziko rozvoje hyponatremie s SSRI a SNRI (viz Použití u konkrétních populací ]. Také pacienti užívající diuretika nebo jinak objemově vyčerpaní mohou být vystaveni většímu riziku. U pacientů se symptomatickou hyponatrémií by mělo být zváženo vysazení přípravku Fluvox 100mgamine maleate tablety a měla by být zahájena vhodná lékařská intervence.
Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, které mohou vést k pádům. Známky a symptomy spojené se závažnějšími a/nebo akutními případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt.
Použití u pacientů se souběžným onemocněním
Pečlivě monitorované klinické zkušenosti s přípravkem Fluvox 50 mg maleát tablety u pacientů se souběžným systémovým onemocněním jsou omezené. Při podávání tablet fluvoxamin maleátu pacientům s onemocněními nebo stavy, které by mohly ovlivnit hemodynamické odpovědi nebo metabolismus, se doporučuje opatrnost.
Tablety fluvoxamin maleátu nebyly hodnoceny ani používány v žádném znatelném rozsahu u pacientů s nedávnou anamnézou infarktu myokardu nebo nestabilního srdečního onemocnění. Pacienti s těmito diagnózami byli během premarketingového testování produktu systematicky vylučováni z mnoha klinických studií. Vyhodnocení elektrokardiogramů u pacientů s depresí nebo OCD, kteří se účastnili předmarketingových studií, neodhalilo žádné rozdíly mezi fluvoxem 100 mg a placebem ve výskytu klinicky významných změn na EKG.
Pacienti s poruchou funkce jater
U pacientů s dysfunkcí jater byla clearance fluvoxu 50 mg snížena přibližně o 30 %. Pacienti s jaterní dysfunkcí by měli začít s nízkou dávkou tablet fluvoxamin maleátu a pomalu ji zvyšovat za pečlivého sledování.
Laboratorní testy
Nedoporučují se žádné specifické laboratorní testy.
Sexuální dysfunkce
Užívání SSRI, včetně tablet fluvoxamin maleátu, může způsobit příznaky sexuální dysfunkce (viz NEŽÁDOUCÍ REAKCE 4)]. U mužských pacientů může mít užívání SSRI za následek zpoždění nebo selhání ejakulace, snížení libida a erektilní dysfunkci. U pacientek může mít užívání SSRI za následek snížení libida a opožděný nebo chybějící orgasmus.
Je důležité, aby se předepisující lékaři zeptali na sexuální funkce před zahájením léčby fluvoxamin maleátem a konkrétně se zeptali na změny sexuální funkce během léčby, protože sexuální funkce nemusí být spontánně hlášeny. Při hodnocení změn sexuální funkce je důležité získat podrobnou anamnézu (včetně načasování nástupu příznaků), protože sexuální příznaky mohou mít jiné příčiny, včetně základní psychiatrické poruchy. Diskutujte o možných strategiích řízení, které pomohou pacientům činit informovaná rozhodnutí o léčbě.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o výhodách a rizicích spojených s léčbou tabletami fluvoxamin maleátové kyseliny a měli by jim poradit vhodné použití. Pro fluvox 100 mg maleátové tablety je k dispozici příručka pro pacienty s léčivými přípravky o „antidepresivech, depresi a jiných vážných duševních onemocněních a sebevražedných myšlenkách nebo akcích“. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Příručku o medikaci, a měl by jim pomoci porozumět jejímu obsahu. Pacienti by měli mít příležitost prodiskutovat obsah Příručky pro léky a získat odpovědi na případné otázky. Úplný text Příručky k medikaci je přetištěn na konci tohoto dokumentu.
Pacienti by měli být upozorněni na následující problémy a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání přípravku Fluvox 100 mg maleát tablety.
Klinické zhoršení a riziko sebevraždy
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Rodiny a pečovatelé pacientů by měli být poučeni, aby každý den hledali výskyt těchto příznaků, protože změny mohou být náhlé. Takové příznaky by měly být hlášeny pacientovi předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, začínají náhle nebo nejsou součástí symptomů pacienta. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možná i změny v léčbě (viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
serotoninový syndrom
Pacienti by měli být upozorněni na riziko serotoninového syndromu, zejména při současném užívání fluvoxaminu s jinými serotonergními látkami (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů a třezalky tečkované). [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glaukom s uzavřeným úhlem
Pacienti by měli být upozorněni, že užívání tablet fluvoxamin maleátu může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a mají profylaktický postup (např. iridektomie), pokud jsou náchylní [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Rušení s kognitivním nebo motorickým výkonem
Vzhledem k tomu, že jakýkoli psychoaktivní lék může zhoršit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být upozorněni na obsluhu nebezpečných strojů, včetně automobilů, dokud si nejsou jisti, že léčba přípravkem Fluvox 100 mg maleát tablety nepříznivě neovlivňuje jejich schopnost zapojit se do takových činností.
Těhotenství
- Informujte těhotné ženy, aby informovaly svého poskytovatele zdravotní péče, pokud otěhotní nebo plánují otěhotnět během léčby tabletami fluvoxamin maleátu.
- Informujte pacienty, že užívání fluvoxamin maleátových tablet v pozdním těhotenství může vést ke zvýšenému riziku neonatálních komplikací vyžadujících prodlouženou hospitalizaci, respirační podporu, sondovou výživu a/nebo přetrvávající plicní hypertenzi novorozenců (PPHN).
- Upozorněte ženy, že při vysazení antidepresiv existuje riziko relapsu.
- Informujte ženy, že existuje registr expozice těhotenství, který monitoruje výsledky těhotenství u žen vystavených tabletám fluvoxamin maleátu během těhotenství [viz Použití u konkrétních populací ].
Laktace
Poraďte kojícím ženám, které používají Fluvox 100mgamine maleátové tablety, aby sledovaly kojence na průjem, zvracení, snížený spánek a neklid a aby vyhledaly lékařskou péči, pokud si všimnou těchto příznaků [viz Použití u konkrétních populací ].
Souběžná medikace
Pacienti by měli být poučeni, aby informovali své lékaře, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože existuje možnost klinicky významných interakcí s přípravkem Fluvox 50mgamine maleate tablety.
Pacienti by měli být upozorněni na současné užívání fluvoxaminu a NSAID, aspirinu nebo jiných léků, které ovlivňují koagulaci, protože kombinované užívání psychofarmak, které interferují se zpětným vychytáváním serotoninu, a tyto látky byly spojeny se zvýšeným rizikem krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vzhledem k možnosti zvýšeného rizika závažných nežádoucích účinků včetně závažného snížení krevního tlaku a sedace při současném užívání fluvoxaminu a tizanidinu by se fluvox 50 mg neměl používat s tizanidinem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vzhledem k potenciálu zvýšeného rizika závažných nežádoucích reakcí při současném užívání fluvoxaminu a alosetronu by se fluvox 50mgamine neměl používat s LotronexemTM (alosetron) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sexuální dysfunkce
Informujte pacienty, že užívání přípravku Fluvox 50mgamine maleát tablety může způsobit příznaky sexuální dysfunkce u mužů i žen. Informujte pacienty, že by měli se svým poskytovatelem zdravotní péče prodiskutovat jakékoli změny v sexuální funkci a potenciální strategie řízení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Alkohol
Stejně jako u jiných psychotropních léků by pacienti měli být poučeni, aby se během užívání přípravku Fluvox 50mgamine maleát tablety vyhýbali alkoholu.
Alergické reakce
Pacientům je třeba doporučit, aby informovali svého lékaře, pokud se u nich během léčby přípravkem Fluvoxamin Maleate Tablety objeví vyrážka, kopřivka nebo související alergický jev.
Všechny uvedené názvy značek jsou registrované ochranné známky příslušných vlastníků a nejsou ochrannými známkami společnosti ANI Pharmaceuticals, Inc.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Nebyla prokázána karcinogenita u potkanů léčených perorálně fluvoxamin maleátem po dobu 30 měsíců nebo u křečků léčených perorálně fluvox 50 mg amin maleátem po dobu 20 (samice) nebo 26 (samci) měsíců. Denní dávky ve skupinách s vysokou dávkou v těchto studiích byly v průběhu studie zvýšeny z minima 160 mg/kg na maximum 240 mg/kg u potkanů a z minima 135 mg/kg na maximum 240 mg/kg u křečků. Maximální dávka 240 mg/kg je přibližně 5krát, respektive 6krát (u křečků a krys), MRHD podávaná dětem na základě mg/m².
Mutageneze
Žádný důkaz genotoxického potenciálu nebyl pozorován v mikronukleovém testu na myších, in vitro testu chromozomových aberací nebo Amesově mikrobiálním mutagenním testu s metabolickou aktivací nebo bez ní.
Zhoršení Plodnosti
Ve studii, ve které byl samcům a samičkám potkanů podáván fluvox 100 mg/kg (60, 120 nebo 240 mg/kg) před a během páření a březosti, byla plodnost narušena při perorálních dávkách 120 mg/kg (trojnásobek MRHD podaných dospívajících na bázi mg/m²) nebo vyšší, o čemž svědčí zvýšená latence do páření, snížený počet spermií, snížená hmotnost nadvarlete a snížená četnost těhotenství. Kromě toho se při nejvyšší dávce snížil počet implantací a embryí (6krát vyšší než MRHD u dospívajících na základě mg/m²). Dávka bez účinku na poruchu plodnosti byla 60 mg/kg (1,6násobek MRHD podávaného dospívajícím na základě mg/m²).
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených antidepresivům během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty zavoláním do Národního registru těhotenství pro antidepresiva na čísle 1-844-405-6185 nebo online na adrese https://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/antidepressants/.
Shrnutí rizik
Dlouhodobé zkušenosti s fluvoxem 100 mg u těhotných žen po desetiletí, založené na publikovaných observačních studiích, neodhalily jasné riziko závažných vrozených vad nebo potratu spojené s užíváním léků (viz Data ). Existují rizika spojená s neléčenou depresí v těhotenství a rizika perzistující plicní hypertenze novorozenců (PPHN) a špatná novorozenecká adaptace při expozici selektivním inhibitorům zpětného vychytávání serotoninu (SSRI), včetně fluvoxaminu, během těhotenství (viz Klinické úvahy ).
Když byly březím potkanům podávány perorálně fluvoxamin během období organogeneze, byla pozorována zvýšená embryofetální smrt a zvýšený výskyt fetálních očních abnormalit (složené sítnice) při dávkách ≥3násobku maximální doporučené dávky pro člověka (MRHD) 300 mg/den podávané dospívajících na základě mg/m². Kromě toho byla pozorována snížená tělesná hmotnost plodu při dávce 6násobku MRHD podávané dospívajícím na základě mg/m². U králíků léčených fluvoxaminem během období organogeneze až do dávky 2násobku MRHD podávané dospívajícím na základě mg/m² nebyly pozorovány žádné nežádoucí účinky na vývoj. Když byl fluvox 50 mg podáván perorálně potkanům během březosti a laktace, byla pozorována zvýšená mortalita mláďat při narození při dávce 2krát vyšší, než je MRHD podávaná dospívajícím na základě mg/m². Kromě toho bylo pozorováno snížení tělesné hmotnosti a přežití mláďat při dávkách ≥ 0,13násobku MRHD podávaných dospívajícím (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s nemocí
U žen, které během těhotenství vysadily antidepresiva, je větší pravděpodobnost, že dojde k relapsu těžké deprese, než u žen, které v antidepresivech pokračují. Toto zjištění pochází z prospektivní, longitudinální studie, která sledovala 201 těhotných žen s anamnézou závažné depresivní poruchy, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Fetální/neonatální nežádoucí reakce
novorozenců vystavených fluvoxamin maleátovým tabletám a dalším SSRI nebo SNRI pozdě ve třetím trimestru se vyvinuly komplikace vyžadující prodlouženou hospitalizaci, podporu dýchání a výživu sondou. Takové komplikace mohou nastat ihned po porodu. Hlášené klinické nálezy zahrnovaly respirační tíseň, cyanózu, apnoe, záchvaty, teplotní nestabilitu, potíže s krmením, zvracení, hypoglykémii, hypotonii, hypertonii, hyperreflexii, třes, nervozitu, podrážděnost a neustálý pláč. Tyto rysy jsou v souladu buď s přímým toxickým účinkem SSRI a SNRI, nebo případně se syndromem z vysazení léku. Je třeba poznamenat, že v některých případech je klinický obraz v souladu se serotoninovým syndromem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Data
Lidská data
Expozice SSRI během pozdního těhotenství může mít zvýšené riziko perzistující plicní hypertenze novorozenců (PPHN). PPHN se vyskytuje u 1–2 na 1000 živě narozených dětí v obecné populaci a je spojena se značnou novorozeneckou morbiditou a mortalitou.
Údaje o zvířatech
Když byly březím krysám podávány perorální dávky fluvoxu 100 mg/kg (60, 120 nebo 240 mg/kg) během období organogeneze, byla pozorována vývojová toxicita ve formě zvýšené embryofetální smrti a zvýšený výskyt abnormalit oka plodu (složené sítnice). dávky 120 mg/kg nebo vyšší (3násobek MRHD 300 mg/den, podávaný dospívajícím na základě mg/m²). Snížení tělesné hmotnosti plodu bylo pozorováno při vysoké dávce 240 mg/kg/den (6násobek MRHD podávaného dospívajícím na základě mg/m²). Dávka bez účinku na vývojovou toxicitu v této studii byla 60 mg/kg/den (1,6násobek MRHD podávaného dospívajícím na základě mg/m²).
Ve studii, ve které byly březím králíkům podávány dávky až 40 mg/kg (přibližně 2,1násobek MRHD podávaných dospívajícím na základě mg/m²) během období organogeneze, nebyly pozorovány žádné nežádoucí účinky na embryofetální vývoj.
jiných reprodukčních studiích, ve kterých byly samičkám potkanů podávány perorálně během březosti a laktace (5, 20, 80 nebo 160 mg/kg), byla pozorována zvýšená úmrtnost mláďat při narození při dávkách 80 mg/kg/den (dvojnásobek MRHD podávané dospívajícím na bázi mg/m²) nebo vyšší a při všech dávkách byly pozorovány poklesy tělesné hmotnosti a přežití mláďat (dávka s nízkým účinkem přibližně 0,13krát vyšší než MRHD podávaná dospívajícím na bázi mg/m²).
Laktace
Údaje z publikované literatury uvádějí přítomnost fluvoxaminu v lidském mléce (viz Data ). Ve většině případů matek užívajících fluvox 50 mg během kojení nebyly hlášeny žádné nežádoucí účinky na kojené dítě. Existují však zprávy o průjmu, zvracení, sníženém spánku a neklidu (viz Klinické úvahy ). Neexistují žádné údaje o účinku fluvoxu 100 mg na produkci mléka. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky fluvox 50 mg a veškerými potenciálními nežádoucími účinky fluvoxaminu nebo základního stavu matky na kojené dítě.
Klinické úvahy
U kojenců vystavených fluvoxaminu prostřednictvím mateřského mléka sledujte průjem, zvracení, snížený spánek a neklid.
Data
Koncentrace léku v mléce ≤ 425 ng/ml byly pozorovány po podávání fluvoxu 100 mg/den matce v dávce 25 mg/den až 300 mg/den v publikovaných kazuistikách a kazuistikách.
Ženy a muži reprodukčního potenciálu
Neplodnost
Nálezy na zvířatech naznačují, že při užívání fluvoxu 50 mg může být narušena plodnost (viz Neklinická toxikologie ].
Pediatrické použití
Účinnost fluvox 100mgamin maleátu při léčbě obsedantně kompulzivní poruchy byla prokázána v 10týdenní multicentrické placebem kontrolované studii se 120 ambulantními pacienty ve věku 8-17 let. Kromě toho 99 z těchto ambulantních pacientů pokračovalo v otevřené léčbě fluvoxamin maleátem po dobu dalšího jednoho až tří let, což odpovídá 94 pacientorokům. Profil nežádoucích účinků pozorovaný v této studii byl obecně podobný profilu pozorovanému ve studiích dospělých s fluvoxaminem [viz NEŽÁDOUCÍ REAKCE , DÁVKOVÁNÍ A PODÁVÁNÍ ].
V souvislosti s užíváním fluvoxaminu a dalších SSRI byla pozorována snížená chuť k jídlu a úbytek hmotnosti. V důsledku toho se doporučuje pravidelné sledování hmotnosti a růstu, pokud má léčba dítěte SSRI pokračovat dlouhodobě.
Rizika, pokud nějaká existují, která mohou být spojena s prodlouženým užíváním fluvoxu 50 mg u dětí a dospívajících s OCD, nebyla systematicky hodnocena. Předepisující lékař by si měl uvědomit, že důkazy, o které se opírá k závěru, že fluvoxamin je bezpečný pro použití u dětí a dospívajících, pocházejí z relativně krátkodobých klinických studií az extrapolace zkušeností získaných u dospělých pacientů. Konkrétně neexistují žádné studie, které by přímo vyhodnocovaly účinky dlouhodobého užívání fluvoxaminu na růst, vývoj kognitivního chování a dospívání dětí a dospívajících. Ačkoli neexistuje žádné potvrzení, které by naznačovalo, že fluvoxamin má schopnost nepříznivě ovlivňovat růst, vývoj nebo zrání, nepřítomnost takových zjištění není přesvědčivým důkazem absence potenciálu fluvoxaminu mít nepříznivé účinky při chronickém užívání [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Bezpečnost a účinnost u jiné pediatrické populace než u pediatrických pacientů s OCD nebyla stanovena [viz VAROVÁNÍ V KRABICE ; VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Každý, kdo zvažuje použití přípravku Fluvox 100 mg maleátové tablety u dětí nebo dospívajících, musí vyvážit potenciální rizika s klinickou potřebou.
Geriatrické použití
Přibližně 230 pacientů, kteří se účastnili kontrolovaných předmarketingových studií s tabletami fluvoxamin maleátu, bylo ve věku 65 let nebo více. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědi mezi staršími a mladšími pacienty. Nicméně SSRI a SNRI, včetně tablet fluvoxamin maleátu, byly spojeny s několika případy klinicky významné hyponatremie u starších pacientů, kteří mohou být vystaveni většímu riziku této nežádoucí příhody (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Kromě toho je clearance fluvoxaminu snížena asi o 50 % u starších pacientů ve srovnání s mladšími pacienty [viz KLINICKÁ FARMAKOLOGIE a nelze vyloučit ani větší citlivost některých starších jedinců. V důsledku toho je třeba u starších pacientů zvážit nižší počáteční dávku a během zahájení léčby je třeba přípravek Fluvox 50mgamine maleát tablety pomalu titrovat.
PŘEDÁVKOVAT
Při předávkování fluvoxem 100 mg tablety byly hlášeny následující případy:
- Záchvaty, které mohou být opožděné, a změněný duševní stav včetně kómatu.
- Kardiovaskulární toxicita, která může být opožděná, včetně prodloužení QRS a QTc intervalu. Nejčastěji se vyskytuje hypertenze, ale vzácně se může vyskytnout hypotenze samotná nebo se spoluužívajícími látkami včetně alkoholu.
- serotoninový syndrom (vyšší riziko mohou mít pacienti s vícenásobným předávkováním jinými proserotonergními léky).
U pacientů, kteří se dostaví časně po předávkování fluvoxaminem, by měla být zvážena gastrointestinální dekontaminace aktivním uhlím.
Zvažte kontaktování toxikologického centra (1-800-221-2222) nebo lékařského toxikologa ohledně doporučení pro léčbu předávkování.
KONTRAINDIKACE
Spoluadministrativa
Současné podávání tizanidinu, thioridazinu, alosetronu nebo pimozidu s přípravkem Fluvox 50mgamine maleát tablety je kontraindikováno (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Serotoninový syndrom a inhibitory monoaminooxidázy (MAOI)
Užívání IMAO určených k léčbě psychiatrických poruch tabletami fluvoxamin maleátu nebo během 14 dnů po ukončení léčby tabletami fluvoxamin maleátu je kontraindikováno kvůli zvýšenému riziku serotoninového syndromu. Užívání přípravku Fluvox 50mgaminemaleate tablety do 14 dnů po ukončení užívání IMAO určeného k léčbě psychiatrických poruch je také kontraindikováno (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zahájení užívání tablet fluvoxamin maleátu u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř, je také kontraindikováno kvůli zvýšenému riziku serotoninového syndromu (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Předpokládá se, že mechanismus účinku fluvox 50mgamin maleátu u obsedantně kompulzivní poruchy je spojen s jeho specifickou inhibicí zpětného vychytávání serotoninu v mozkových neuronech. V preklinických studiích in vitro i in vivo bylo prokázáno, že přípravek Fluvox 100 mg je účinným inhibitorem transportéru zpětného vychytávání serotoninu.
Farmakodynamika
Ve studiích in vitro neměl fluvox 100 mg amin maleát žádnou významnou afinitu k histaminergním, alfa nebo beta adrenergním, muskarinovým nebo dopaminergním receptorům. Má se za to, že antagonismus některých z těchto receptorů souvisí s různými sedativními, kardiovaskulárními, anticholinergními a extrapyramidovými účinky některých psychofarmak.
Farmakokinetika
Vstřebávání
Absolutní biologická dostupnost fluvoxamin maleátu je 53 %. Perorální biologická dostupnost není významně ovlivněna potravou.
Ve studii proporcionality dávky zahrnující fluvoxamin maleát v dávkách 100, 200 a 300 mg/den po dobu 10 po sobě jdoucích dnů u 30 normálních dobrovolníků bylo rovnovážného stavu dosaženo přibližně po týdnu podávání. Maximální plazmatické koncentrace v ustáleném stavu se objevily během 3 až 8 hodin po podání a dosáhly průměrných koncentrací 88, 283 a 546 ng/ml. Fluvoxamin měl tedy v tomto dávkovém rozmezí nelineární farmakokinetiku, tj. vyšší dávky fluvox 100mgamaminmaleinátu produkovaly nepoměrně vyšší koncentrace, než se předpokládalo z nižší dávky.
Rozdělení
Průměrný zdánlivý distribuční objem fluvoxaminu je přibližně 25 l/kg, což naznačuje rozsáhlou tkáňovou distribuci.
Přibližně 80 % fluvoxu 100 mg se váže na plazmatické bílkoviny, většinou albumin, v rozmezí koncentrací 20 až 2000 ng/ml.
Metabolismus
Fluvox 100mgamineát je rozsáhle metabolizován v játrech; hlavními metabolickými cestami jsou oxidativní demetylace a deaminace. Po 5 mg radioaktivně značené dávce fluvox 100 mg amin maleátu bylo identifikováno devět metabolitů, které tvoří přibližně 85 % produktů fluvoxu 100 mg vylučovaných močí. Hlavním lidským metabolitem byl fluvox 100mgaminokyselina, která spolu se svým N-acetylovaným analogem představovala asi 60 % produktů vylučovaných močí. Třetí metabolit, fluvoxethanol, vzniklý oxidativní deaminací, představoval asi 10 %. Fluvox 100mgamine kyselina a fluvox 100mgethanol byly testovány v in vitro testu inhibice zpětného vychytávání serotoninu a norepinefrinu u krys; byly neaktivní s výjimkou slabého účinku bývalého metabolitu na inhibici vychytávání serotoninu (o 1-2 řády méně účinné než mateřská sloučenina). Přibližně 2 % fluvoxu 100 mg se vyloučilo močí v nezměněné podobě (viz DROGOVÉ INTERAKCE ].
Odstranění
Po perorální dávce fluvox 50mgaminomaleinátu značeného 14C (5 mg) se průměrně 94 % produktů souvisejících s léčivem objevilo v moči během 71 hodin.
Průměrný plazmatický poločas fluvoxu 100 mg v ustáleném stavu po opakovaných perorálních dávkách 100 mg/den zdravým mladým dobrovolníkům byl 15,6 hodin.
Starší subjekty
Ve studii fluvoxamin maleátových tablet v dávce 50 a 100 mg srovnávající starší osoby (ve věku 66-73 let) a mladé subjekty (ve věku 19-35 let) byly průměrné maximální plazmatické koncentrace u starších osob o 40 % vyšší. Vícedávkový eliminační poločas fluvoxu 50 mg byl 17,4 a 25,9 hodin u starších osob ve srovnání s 13,6 a 15,6 hodin u mladých jedinců v rovnovážném stavu pro dávky 50 a 100 mg, v tomto pořadí. U starších pacientů byla clearance fluvoxu 100 mg snížena asi o 50 %, a proto by měly být tablety Fluvox 100 mg maleát pomalu titrovány během zahájení léčby (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pediatrické předměty
Farmakokinetika opakovaných dávek fluvoxu 50 mg byla stanovena u dětí mužského a ženského pohlaví (ve věku 6-11 let) a dospívajících (ve věku 12-17 let). Plazmatické koncentrace fluvoxu 100 mg v ustáleném stavu byly 2-3krát vyšší u dětí než u dospívajících. AUC a Cmax u dětí byly 1,5 až 2,7krát vyšší než u dospívajících. (Viz Tabulka 4.) Stejně jako u dospělých vykazovali děti i dospívající nelineární farmakokinetiku po více dávkách. Děti ženského pohlaví vykazovaly významně vyšší AUC (0-12) a Cmax ve srovnání s dětmi mužského pohlaví, a proto mohou nižší dávky tablet fluvoxamin maleát vyvolat terapeutický přínos. (Viz tabulka 5.) U adolescentů nebyly pozorovány žádné rozdíly mezi pohlavími. Plazmatické koncentrace fluvoxaminu v ustáleném stavu byly podobné u dospělých a dospívajících při dávce 300 mg/den, což ukazuje, že expozice fluvoxu 100 mg/den byla podobná u těchto dvou populací. (Viz tabulka 4.) K dosažení terapeutického přínosu může být indikována úprava dávky u dospívajících (až do maximální dávky pro dospělé 300 mg) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
TABULKA 4: POROVNÁNÍ PRŮMĚRNÝCH (SD) FLUVOX 50mgAMINOVÝCH FARMAKOKINETICKÝCH PARAMETRŮ MEZI DĚTMI, DOLESCENTY A DOSPĚLÝMI
TABULKA 5: POROVNÁNÍ PRŮMĚRNÝCH (SD) FLUVOX 50mgAMINOVÝCH FARMAKOKINETICKÝCH PARAMETRŮ MEZI DĚTMI MUŽŮ A ŽEN (6-11 LET)
Onemocnění jater a ledvin
Srovnání zkřížených studií (zdraví jedinci versus pacienti s jaterní dysfunkcí) naznačovalo 30% snížení clearance fluvoxu 50 mg ve spojení s jaterní dysfunkcí. Průměrné minimální plazmatické koncentrace u pacientů s poruchou funkce ledvin (clearance kreatininu 5 až 45 ml/min) po 4 a 6 týdnech léčby (50 mg dvakrát denně, N=13) byly vzájemně srovnatelné, což naznačuje, že u těchto pacientů nedochází k žádné akumulaci fluvoxaminu [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Klinické studie
Studie OCD u dospělých
Účinnost tablet fluvoxamin maleátu pro léčbu obsedantně kompulzivní poruchy (OCD) byla prokázána ve dvou 10týdenních multicentrických studiích s paralelními skupinami dospělých ambulantních pacientů. Pacienti v těchto studiích byli titrováni na celkovou denní dávku fluvox 50mgamineát maleátu 150 mg/den během prvních dvou týdnů studie, poté byla dávka upravena v rozmezí 100-300 mg/den (podle schématu bid). na základě reakce a tolerance. Pacienti v těchto studiích měli středně závažnou až závažnou OCD (DSM-III-R), s průměrným výchozím hodnocením na Yale-Brown Obsessive Compulsive Scale (Y-BOCS), celkové skóre 23. U pacientů užívajících fluvox 50mgamineát maleát došlo v průměru ke snížení 4 až 5 jednotek na celkové skóre Y-BOCS ve srovnání se snížením o 2 jednotky u pacientů s placebem.
Tabulka 6 uvádí klasifikaci výsledků podle léčebných skupin na položce Globální zlepšení škály Clinical Global Impressions (CGI) pro obě studie dohromady.
TABULKA 6: KLASIFIKACE VÝSLEDKŮ (%) U POLOŽKY GLOBÁLNÍHO ZLEPŠENÍ CGI PRO DOPLŇUJÍCÍ V SOUBORU DVOU DOSPĚLÝCH STUDII OCD
Průzkumné analýzy vlivu věku a pohlaví na výsledky nenaznačily žádnou rozdílnou citlivost na základě věku nebo pohlaví.
Studie údržby OCD pro dospělé
udržovací studii u dospělých ambulantních pacientů s OCD bylo 114 pacientů splňujících kritéria DSM-IV pro OCD a se skóre Yale-Brown Obsessive Compulsive Scale (Y-BOCS) ≥ 18 titrováno na účinnou dávku fluvoxamin maleátových tablet 100 až 300 mg /den jako součást úvodní 10týdenní jednoduše zaslepené léčebné fáze. Odpověď na léčbu během této jednoduše zaslepené fáze byla definována jako skóre Y-BOCS alespoň o 30 % nižší než výchozí hodnota na konci 8. a 10. týdne. Z pacientů, kteří odpověděli, byla jejich průměrná doba trvání odpovědi 4 týdny. Pacienti, kteří reagovali během této počáteční fáze, byli randomizováni buď k pokračování v léčbě přípravkem Fluvox 50 mg maleátové tablety (N=56) nebo k placebu (N=58) ve dvojitě zaslepené fázi za účelem pozorování relapsu. Relaps během dvojitě zaslepené fáze byl definován jako zvýšení skóre Y-BOCS alespoň o 30 % nad výchozí hodnotu pro tuto fázi nebo odmítnutí pacienta pokračovat v léčbě kvůli podstatnému nárůstu symptomů OCD. Ve dvojitě zaslepené fázi měli pacienti, kteří dostávali pokračující léčbu tabletami fluvoxamin maleát, v průměru významně nižší míru relapsů než pacienti, kteří dostávali placebo.
Zkoumání populačních podskupin z této studie neodhalilo žádný jasný důkaz rozdílného udržovacího účinku na základě věku nebo pohlaví.
Pediatrická studie OCD
Účinnost tablet fluvoxamin maleátu pro léčbu OCD byla také prokázána v 10týdenní multicentrické studii s paralelními skupinami u pediatrické ambulantní populace (děti a dospívající ve věku 8–17 let). Pacienti v této studii byli titrováni na celkovou denní dávku fluvoxu 100 mg/den přibližně 100 mg/den během prvních dvou týdnů studie, poté byla dávka upravena v rozmezí 50-200 mg/den (podle schématu bid) na základě reakce a tolerance. Všichni pacienti měli středně těžkou až těžkou OCD (DSM-III-R) s průměrným výchozím hodnocením na dětské Yale-Brown Obsessive Compulsive Scale (CY-BOCS) celkovém skóre 24. U pacientů užívajících fluvox 100mgamineát maleát došlo v průměru ke snížení přibližně šest jednotek na celkovém skóre CY-BOCS ve srovnání se snížením o tři jednotky u pacientů s placebem.
Tabulka 7 uvádí klasifikaci výsledků podle léčebných skupin na položce Globální zlepšení na stupnici Clinical Global Impression (CGI) pro pediatrickou studii.
TABULKA 7 : KLASIFIKACE VÝSLEDKŮ (%) NA POLOŽCE ZLEPŠENÍ CGI-GLOBAL PRO KONTROLY PEDIATRICKÉ STUDIE
Post hoc průzkumné analýzy vlivu pohlaví na výsledky nenaznačily žádnou rozdílnou citlivost na základě pohlaví. Další průzkumné analýzy odhalily výrazný účinek léčby ve věkové skupině 8-11 let a v podstatě žádný účinek ve věkové skupině 12-17 let. I když význam těchto výsledků není jasný, 2-3krát vyšší rovnovážné plazmatické koncentrace fluvoxaminu u dětí ve srovnání s dospívajícími [viz KLINICKÁ FARMAKOLOGIE ] naznačuje, že snížená expozice u dospívajících mohla být faktorem a že k dosažení terapeutického přínosu může být indikována úprava dávky u dospívajících (až do maximální dávky pro dospělé 300 mg).
INFORMACE PRO PACIENTA
Fluvox 100 mg (Chřipka VOX ah meen) Maleátové tablety
Než začnete užívat Fluvox 100mgamine maleátové tablety a pokaždé, když dostanete náhradní náplň, přečtěte si Příručku pro léky, která je dodávána s tabletami Fluvox 100mgamine maleate. Mohou se objevit nové informace. Tento průvodce léky nenahrazuje rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě. Promluvte si se svým poskytovatelem zdravotní péče, pokud je něco, čemu nerozumíte nebo se o tom chcete dozvědět více.
Jaké jsou nejdůležitější informace, které bych měl vědět o tabletách Fluvox 50mgamine maleate?
Fluvoxamin je stejný druh léku jako léky používané k léčbě deprese a může způsobit závažné nežádoucí účinky, včetně:
1. Sebevražedné myšlenky nebo činy:
- Tablety fluvoxamin maleát a antidepresiva mohou zvýšit sebevražedné myšlenky nebo činy u některých dětí, dospívajících nebo mladých dospělých během prvních měsíců léčby nebo při změně dávky.
- Deprese nebo jiná vážná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek nebo činů.
- Sledujte tyto změny a ihned zavolejte svému poskytovateli zdravotní péče, pokud si všimnete:
- Nové nebo náhlé změny nálady, chování, jednání, myšlenek nebo pocitů, zvláště pokud jsou závažné.
- Těmto změnám věnujte zvláštní pozornost při zahájení léčby přípravkem Fluvox 100mgaminem maleátem nebo při změně dávky.
Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče a mezi návštěvami volejte, pokud máte obavy z příznaků.
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo zavolejte 911 v případě nouze, zvláště pokud jsou nové, horší nebo vás znepokojují:
- pokusy o sebevraždu
- působící na nebezpečné impulsy
- chovat se agresivně nebo násilně
- myšlenky na sebevraždu nebo smrt
- nová nebo horší deprese
- nové nebo horší záchvaty úzkosti nebo paniky
- pocit rozrušení, neklidu, vzteku nebo podrážděnosti
- problémové spaní
- zvýšená aktivita nebo mluvení více, než je pro vás normální
- jiné neobvyklé změny v chování nebo náladě
Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo v případě nouze zavolejte 911. Tablety fluvoxamin maleátu mohou být spojeny s těmito závažnými nežádoucími účinky:
2. Serotoninový syndrom: Tento stav může být život ohrožující a může zahrnovat:
- neklid, halucinace, kóma nebo jiné změny duševního stavu
- problémy s koordinací nebo svalové záškuby (nadměrně aktivní reflexy)
- rychlý srdeční tep, vysoký nebo nízký krevní tlak
- pocení nebo horečka
- nevolnost, zvracení nebo průjem
- svalová ztuhlost
3. Problémy se zrakem
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
4. Těžké alergické reakce:
- potíže s dýcháním
- otok obličeje, jazyka, očí nebo úst
- vyrážka, svědivé šrámy (kopřivka) nebo puchýře, samotné nebo s horečkou nebo bolestí kloubů
5. Abnormální krvácení: Fluvox 100 mg maleátové tablety a antidepresiva mohou zvýšit riziko krvácení nebo modřin, zvláště pokud užíváte warfarin na ředění krve (Coumadin®, Jantoven®) nebo nesteroidní protizánětlivé léky (NSAID, jako je ibuprofen, naproxen nebo aspirin).
6. Záchvaty nebo křeče
7. Manické epizody:
- výrazně zvýšená energie
- vážné potíže se spánkem
- závodní myšlenky
- bezohledné chování
- neobvykle velkolepé nápady
- nadměrné štěstí nebo podrážděnost
- mluvit více nebo rychleji než obvykle
8. Změny chuti k jídlu nebo hmotnosti. U dětí a dospívajících by měla být během léčby sledována výška a hmotnost.
9. Nízká hladina soli (sodíku) v krvi. Starší lidé mohou být tímto více ohroženi. Příznaky mohou zahrnovat:
- bolest hlavy
- slabost nebo pocit nejistoty
- zmatenost, problémy se soustředěním nebo myšlením nebo problémy s pamětí
10. Sexuální problémy (dysfunkce). Užívání selektivních inhibitorů zpětného vychytávání serotoninu (SSRI), včetně přípravku Fluvox 50mgamine maleate tablety, může způsobit sexuální problémy.
- Příznaky u mužů mohou zahrnovat:
- Zpožděná ejakulace nebo neschopnost ejakulace
- Snížená chuť na sex
- Problémy s dosažením nebo udržením erekce
- Příznaky u žen mohou zahrnovat:
- Snížená chuť na sex
- Odložený orgasmus nebo neschopnost dosáhnout orgasmu
Promluvte si se svým poskytovatelem zdravotní péče, pokud se u Vás během léčby přípravkem Fluvox 50mgaminem maleát tablety objeví jakékoli změny ve vaší sexuální funkci nebo pokud máte nějaké otázky nebo obavy ohledně sexuálních problémů. Může existovat léčba, kterou může navrhnout váš poskytovatel zdravotní péče.
Nepřestávejte užívat tablety fluvoxamin maleátu, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
Příliš rychlé ukončení užívání tablet fluvoxamin maleátu může způsobit vážné příznaky, včetně:
- úzkost, podrážděnost, povznesená nebo špatná nálada, pocit neklidu nebo změny ve spánkových návycích
- bolest hlavy, pocení, nevolnost, závratě
- pocity podobné elektrickému šoku, třes, zmatenost
Co jsou tablety fluvoxamin maleátu?
Fluvoxamin maleátové tablety jsou lék na předpis používaný k léčbě obsedantně kompulzivní poruchy (OCD). Je důležité promluvit si se svým poskytovatelem zdravotní péče o rizicích léčby OCD a také o rizicích neléčení. Všechny možnosti léčby byste měli probrat se svým poskytovatelem zdravotní péče.
Poraďte se se svým poskytovatelem zdravotní péče, pokud si nemyslíte, že se váš stav po léčbě přípravkem Fluvox 100mgamine maleate tablety zlepšuje.
Kdo by neměl užívat Fluvox 100mgamine maleát tablety?
Neužívejte tablety fluvoxamin maleát, pokud:
- jste alergický(á) na fluvox 50mgamineát nebo na kteroukoli složku přípravku Fluvoxaminemaleát. Úplný seznam složek v tabletách Fluvox 50mgamine maleate najdete na konci tohoto Průvodce léčivy.
- užívat inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu.
- Neužívejte IMAO do 2 týdnů po ukončení užívání fluvoxamin maleátových tablet, pokud to nenařídí váš lékař.
- Nezačínejte s přípravkem Fluvox 50 mg, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš lékař.
Lidé, kteří užívají fluvoxamin maleátové tablety v době těsně před IMAO, mohou mít závažné nebo dokonce život ohrožující vedlejší účinky. Okamžitě vyhledejte lékařskou pomoc, pokud máte některý z těchto příznaků:
-
- vysoká horečka
- nekontrolované svalové křeče
- ztuhlé svaly
- rychlé změny srdeční frekvence nebo krevního tlaku
- zmatek
- ztráta vědomí (omdlít)
- užívejte Mellaril® (thioridazin). Neužívejte přípravek Mellaril do 2 týdnů po ukončení užívání přípravku Fluvox 50 mg, protože to může způsobit vážné problémy se srdečním rytmem nebo náhlou smrt.
- užívejte Orap® (pimozid), protože užívání tohoto léku s přípravkem Fluvox 50mgamine maleate tablety může způsobit vážné problémy se srdečním rytmem nebo náhlou smrt.
- užívejte Zanaflex® (tizanidin). Tablety fluvoxamin maleátu by mohly zvýšit množství přípravku Zanaflex ve vašem těle, což by mohlo zvýšit jeho působení a vedlejší účinky. To může zahrnovat ospalost a pokles krevního tlaku a ovlivnit, jak dobře děláte věci, které vyžadují pozornost.
- Vezměte Lotronex® (alosetron). Tablety Fluvox 50mgamineát mohou zvýšit množství Lotronexu ve vašem těle, což by mohlo zvýšit jeho účinky a nežádoucí účinky.
Co mám sdělit svému poskytovateli zdravotní péče, než začnu užívat Fluvox 50mgamine maleátové tablety? Zeptejte se, pokud si nejste jisti.
Před zahájením užívání tablet fluvoxamin maleátu informujte svého poskytovatele zdravotní péče, pokud:
- Berete určité léky, např.
- Inhibitory monoaminooxidázy (MAOI), jako je Emsam® (selegilin), Nardil® (fenelzin) nebo Parnate® (tranylcypromin)
- Mellaril® (thioridazin): používá se k léčbě duševních problémů nebo problémů s náladou
- Zanaflex® (tizanidin): používá se k léčbě spasticity (stav, při kterém se svaly neustále stahují a křeče)
- Orap® (pimozid): používá se k léčbě Tourettova syndromu (stav mozku způsobující tiky)
- Lotronex® (alosetron): používá se k léčbě stavu s průjmem, pokračující bolestí žaludku, křečemi a nadýmáním
- Triptany: používají se k léčbě migrény
- Léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně tricyklických látek, lithia, SSRI, SNRI nebo antipsychotik
- Tramadol: používá se ke snížení bolesti
- Benzodiazepiny: používané ke snížení úzkosti, stresu, emočního rozrušení nebo záchvatů; pomáhá vám spát; pomáhá při odvykání alkoholu; snižuje neklid; a uvolňuje svaly
- Metadon: používá se k úlevě od bolesti nebo k pomoci při závislosti
- Clozapin: používá se k léčbě duševních poruch
- Mexiletin: používá se k léčbě abnormalit srdečního rytmu
- Theofylin: používá se k léčbě otoků dýchacích cest v plicích, k uvolnění svalů na hrudi ke zmírnění dušnosti, často k léčbě astmatu
- Warfarin a další léky, které ovlivňují srážení krve
- Diuretika k léčbě vysokého krevního tlaku, městnavého srdečního selhání nebo otoků
- Volně prodejné doplňky, jako je tryptofan nebo třezalka tečkovaná
- mít problémy s játry
- mít problémy s ledvinami
- mít problémy se srdcem
- máte nebo jste měli záchvaty nebo křeče
- trpíte bipolární poruchou nebo mánií
- máte nízké hladiny sodíku v krvi
- mít v anamnéze mrtvici
- mají vysoký krevní tlak
- máte nebo jste měli problémy s krvácením
- jste těhotná nebo plánujete otěhotnět. Poraďte se se svým poskytovatelem zdravotní péče o riziku pro vaše nenarozené dítě, pokud užíváte Fluvox 50 mg tablety maleát.
- Promluvte si se svým poskytovatelem zdravotní péče o výhodách a rizicích léčby OCD během těhotenství.
- Pokud otěhotníte během léčby přípravkem Fluvox 50mgamine maleate tablety, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro antidepresiva. Registrovat se můžete na telefonním čísle 1-844-405-6185.
- kojíte nebo plánujete kojit. Tablety fluvoxamin maleátu přecházejí do vašeho mateřského mléka. Poraďte se se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení vašeho dítěte během užívání tablet Fluvox 50mgamine maleate.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Tablety fluvoxamin maleátu a některé léky se mohou vzájemně ovlivňovat, nemusí stejně dobře fungovat nebo mohou způsobit závažné nežádoucí účinky.
Váš poskytovatel zdravotní péče nebo lékárník vám může říci, zda je bezpečné užívat tablety fluvoxamin maleát s jinými léky. Nezačínejte ani neukončujte žádné léky během užívání tablet fluvoxamin maleát, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
Pokud užíváte Fluvox 100 mg maleátové tablety, neměli byste užívat žádné jiné léky, které obsahují fluvoxamin, včetně: LUVOX 50 mg CR®
Jak mám užívat tablety fluvoxamin maleátu?
- Tablety fluvoxamin maleátu užívejte přesně podle předpisu. Váš poskytovatel zdravotní péče možná bude muset změnit dávku přípravku Fluvox 100 mg maleátové tablety, dokud pro vás nebude správná dávka.
- Fluvox 100mgamine maleát tablety lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku přípravku Fluvoxamin-Maleate Tablety, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku Fluvox 100mgamine maleát tablety současně.
- Pokud užijete příliš mnoho tablet Fluvox 50 mg, okamžitě zavolejte svého poskytovatele zdravotní péče nebo toxikologické centrum nebo vyhledejte pohotovostní léčbu.
Čemu se mám vyvarovat při užívání přípravku Fluvox 50mgamine maleát tablety?
Fluvox 100mgamine maleát tablety může způsobit ospalost nebo může ovlivnit vaši schopnost rozhodovat se, jasně myslet nebo rychle reagovat. Neměli byste řídit, obsluhovat těžké stroje nebo dělat jiné nebezpečné činnosti, dokud nezjistíte, jak na vás tablety fluvoxamin maleát působí. Během užívání tablet fluvoxamin maleát nepijte alkohol.
Jaké jsou možné vedlejší účinky přípravku Fluvox 100mgamine maleátové tablety?
- Tablety fluvoxamin maleátu mohou způsobit závažné nežádoucí účinky, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o tabletách Fluvox 100 mg maleát?"
Pocit úzkosti nebo potíže se spánkem
Časté možné nežádoucí účinky u lidí, kteří užívají Fluvox 100mgamine maleát tablety, zahrnují:
- nevolnost
- ospalost
- slabost
- špatné trávení
- pocení
- ztráta chuti k jídlu
- třepání
- zvracení
- opožděná ejakulace
- neschopnost dosáhnout orgasmu
- snížená chuť na sex
- suchá ústa
- ucpaný nos
- neobvyklá chuť
- časté močení
Další nežádoucí účinky u dětí a dospívajících zahrnují:
- neklid nebo abnormální zvýšení aktivity
- pocit deprese nebo smutku
- nadměrná plynatost
- silné menstruace
- vyrážka
- možná zpomalená rychlost růstu a změna hmotnosti.
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí. Toto nejsou všechny možné vedlejší účinky přípravku Fluvox 50 mg maleátové tablety. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
ZAVOLEJTE SVÉHO LÉKAŘE, POŽÁDÁ VÁM LÉKAŘSKOU PORADU O NEŽÁDOUCÍCH ÚČINCÍCH. NEŽÁDOUCÍ ÚČINKY MŮŽETE HLÁSIT na čísle 1-800-308-6755 nebo FDA na čísle 1-800-FDA-1088
Jak mám uchovávat Fluvox 50mgamine maleát tablety?
Tablety fluvoxamin maleátu skladujte při pokojové teplotě mezi 59 °F až 86 °F (15 °C až 30 °C).
- Uchovávejte tablety fluvoxamin maleátu mimo vysokou vlhkost.
- Uchovávejte lahvičku s tabletami fluvoxamin maleátu pevně uzavřenou.
Uchovávejte fluvoxamin maleát tablety a všechny léky mimo dosah dětí.
Obecné informace o tabletách Fluvox 100mgamine maleate
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte fluvoxamin maleátové tablety pro stav, pro který nebyl předepsán. Nedávejte Fluvox 100 mg maleátové tablety jiným lidem, i když mají stejné onemocnění. Může jim to ublížit.
Tento průvodce léčivy shrnuje nejdůležitější informace o tabletách fluvoxamin maleátu. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o tabletách fluvoxamin maleát, které jsou určeny pro zdravotnické pracovníky.
Pro více informací o tabletách Fluvox 50mgamine maleate zavolejte na bezplatné číslo 1-800-308-6755 nebo přejděte na www.anipharmaceuticals.com.
Jaké jsou složky tablet fluvoxamin maleátu?
Účinná látka: Fluvoxamin maleát
Neaktivní složky:
Tablety 25 mg: karnaubský vosk, hypromelóza, mannitol, polyethylenglykol, polysorbát 80, předbobtnalý škrob (bramborový), oxid křemičitý, stearylfumarát sodný, škrob (kukuřice) a oxid titaničitý.
Tablety 50 mg a 100 mg: Kromě výše uvedených neaktivních složek obsahují syntetické oxidy železa.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
