Effexor 37.5mg, 75mg Venlafaxine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
INFORMACE PRO PACIENTA
Effexor (venlafaxin) (ven-la-fax-een) Tablety, USP
Přečtěte si Průvodce léky, který je dodáván s tabletami venlafaxinu, USP, než je začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tento průvodce léky nenahrazuje rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě. Promluvte si se svým poskytovatelem zdravotní péče, pokud je něco, čemu nerozumíte nebo se o tom chcete dozvědět více.
Jaké jsou nejdůležitější informace, které bych měl vědět o Venlafaxine Tablets, USP?
Tablety venlafaxinu, USP a další antidepresiva mohou způsobit závažné nežádoucí účinky, včetně:
1. Sebevražedné myšlenky nebo činy:
- Tablety venlafaxinu, USP a další antidepresiva mohou zvýšit sebevražedné myšlenky nebo akce u některých dětí, dospívajících nebo mladých dospělých během prvních několika měsíců léčby nebo při změně dávky.
- Deprese nebo jiná vážná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek nebo činů.
- Sledujte tyto změny a ihned zavolejte svému poskytovateli zdravotní péče, pokud si všimnete:
- Nové nebo náhlé změny nálady, chování, jednání, myšlenek nebo pocitů, zvláště pokud jsou závažné.
- Těmto změnám věnujte zvláštní pozornost při podávání tablet venlafaxinu, zahájení léčby USP nebo při změně dávky.
Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče a mezi návštěvami volejte, pokud máte obavy z příznaků.
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo zavolejte 911 v případě nouze, zvláště pokud jsou nové, horší nebo vás znepokojují:
- pokusy o sebevraždu
- působící na nebezpečné impulsy
- chovat se agresivně nebo násilně
- myšlenky na sebevraždu nebo smrt
- nová nebo horší deprese
- nové nebo horší záchvaty úzkosti nebo paniky
- pocit rozrušení, neklidu, vzteku nebo podrážděnosti
- problémové spaní
- zvýšená aktivita nebo mluvení více, než je pro vás normální
- jiné neobvyklé změny v chování nebo náladě
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo volejte 911 v případě nouze. Tablety Venlafaxine, USP mohou být spojeny s těmito závažnými nežádoucími účinky:
2. Serotoninový syndrom
Tento stav může být život ohrožující a může zahrnovat:
- neklid, halucinace, kóma nebo jiné změny duševního stavu
- problémy s koordinací nebo svalové záškuby (nadměrně aktivní reflexy)
- rychlý srdeční tep, vysoký nebo nízký krevní tlak
- pocení nebo horečka
- nevolnost, zvracení nebo průjem
- svalová ztuhlost
3. Změny krevního tlaku. Tablety venlafaxinu, USP mohou:
- zvýšit svůj krevní tlak. Kontrolujte vysoký krevní tlak před zahájením léčby a pravidelně kontrolujte krevní tlak
4. Zvětšené zorničky (mydriáza).
5. Úzkost a nespavost.
6. Změny chuti k jídlu nebo hmotnosti.
- dětí a dospívajících by měla být během léčby sledována výška a hmotnost
7. Manické/hypomanické epizody:
- výrazně zvýšená energie
- vážné potíže se spánkem
- závodní myšlenky
- bezohledné chování
- neobvykle velkolepé nápady
- nadměrné štěstí nebo podrážděnost
- mluvit více nebo rychleji než obvykle
8. Nízká hladina soli (sodíku) v krvi.
Starší lidé mohou být tímto více ohroženi. Příznaky mohou zahrnovat:
- bolest hlavy
- slabost nebo pocit nejistoty
- zmatenost, problémy se soustředěním nebo myšlením nebo problémy s pamětí
9. Záchvaty nebo křeče.
10. Abnormální krvácení: tablety venlafaxinu, USP a další antidepresiva mohou zvýšit riziko krvácení nebo modřin, zvláště pokud užíváte warfarin na ředění krve (Coumadin®, Jantoven®), nesteroidní protizánětlivé léčivo (NSAID, např. ibuprofen nebo naproxen) nebo aspirin.
11. Zvýšený cholesterol.
12. Onemocnění plic a zápal plic: tablety venlafaxinu, USP mohou způsobit vzácné plicní problémy. Příznaky zahrnují:
- zhoršující se dušnost
- kašel
- nepohodlí na hrudi
13. Těžké alergické reakce:
- potíže s dýcháním
- otok obličeje, jazyka, očí nebo úst
- vyrážka, svědivé šrámy (kopřivka) nebo puchýře, samotné nebo s horečkou nebo bolestí kloubů
14. Vizuální problémy:
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
Nepřestávejte přípravek Venlafaxine Tablets, USP, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče. Příliš rychlé vysazení tablet venlafaxinu, USP nebo příliš rychlá změna z jiného antidepresiva může způsobit vážné příznaky včetně:
- úzkost, podrážděnost
- pocit únavy, neklid nebo problémy se spánkem
- bolest hlavy, pocení, závratě
- pocity podobné elektrickému šoku, třes, zmatenost, noční můry
- zvracení, nevolnost, průjem
Co je Venlafaxine Tablets, USP?
Venlafaxin tablety, USP je lék na předpis používaný k léčbě deprese. Je důležité mluvit se svým poskytovatelem zdravotní péče o rizicích léčby deprese a také o rizicích jejího neléčení. Všechny možnosti léčby byste měli probrat se svým poskytovatelem zdravotní péče.
Promluvte si se svým poskytovatelem zdravotní péče, pokud si nemyslíte, že se váš stav zlepšuje pomocí tablet venlafaxinu, léčby USP.
Kdo by neměl užívat Venlafaxine Tablets, USP?
- Neužívejte tablety venlafaxinu, USP, pokud:
- jste alergičtí na tablety venlafaxinu, USP nebo na kteroukoli složku v tabletách venlafaxinu, USP. Úplný seznam složek v tabletách venlafaxinu, USP, najdete na konci tohoto Průvodce léčivy.
- mají nekontrolovaný glaukom s úzkým úhlem
- užívat inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu.
- Neužívejte IMAO do 7 dnů po ukončení užívání tablet venlafaxinu, USP, pokud to nenařídí váš lékař.
- Nezačínejte užívat tablety venlafaxinu, USP, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš lékař.
Lidé, kteří užívají Venlafaxine Tablets, USP v blízkosti MAOI, mohou mít vážné nebo dokonce život ohrožující vedlejší účinky. Okamžitě vyhledejte lékařskou pomoc, pokud máte některý z těchto příznaků:
- vysoká horečka
- nekontrolované svalové křeče
- ztuhlé svaly
- rychlé změny srdeční frekvence nebo krevního tlaku
- zmatek
- ztráta vědomí (omdlít)
Co bych měl říct svému poskytovateli zdravotní péče před užitím Venlafaxine Tablets, USP? Zeptejte se, pokud si nejste jisti.
Před zahájením užívání tablet venlafaxinu, USP, informujte svého poskytovatele zdravotní péče, pokud:
- Berete určité léky, např.
- Léky používané k léčbě migrénových bolestí hlavy, jako jsou:
- triptany
- Léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, jako jsou:
- tricyklická antidepresiva
- lithium
- SSRI
- SNRI
- antipsychotické léky
- Léky používané k léčbě bolesti, jako jsou:
- tramadol
- Léky používané k ředění krve, jako jsou:
- warfarin
- Léky používané k léčbě pálení žáhy, jako jsou:
- Cimetidin
- Volně prodejné léky nebo doplňky, jako jsou:
- Aspirin nebo jiná NSAID
- tryptofan
- Třezalka tečkovaná
- mít problémy se srdcem
- mít cukrovku
- mít problémy s játry
- mít problémy s ledvinami
- mít problémy se štítnou žlázou
- mít glaukom
- máte nebo jste měli záchvaty nebo křeče
- trpíte bipolární poruchou nebo mánií
- máte nízké hladiny sodíku v krvi
- mají vysoký krevní tlak
- mají vysoký cholesterol
- máte nebo jste měli problémy s krvácením
- jste těhotná nebo plánujete otěhotnět. Není známo, zda tablety venlafaxinu, USP poškodí vaše nenarozené dítě. Promluvte si se svým poskytovatelem zdravotní péče o výhodách a rizicích léčby deprese během těhotenství
- kojíte nebo plánujete kojit. Některé tablety venlafaxinu, USP, mohou přecházet do vašeho mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte při užívání tablet venlafaxinu, USP.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a bez předpisu, vitamínů a bylinných doplňků. Tablety venlafaxinu, USP a některé léky se mohou vzájemně ovlivňovat, nemusí stejně dobře fungovat nebo mohou způsobit závažné nežádoucí účinky.
Váš poskytovatel zdravotní péče nebo lékárník vám může říci, zda je bezpečné užívat tablety venlafaxinu, USP s vašimi dalšími léky. Nezačínejte ani nezastavujte žádný lék při užívání tablet venlafaxinu, USP, aniž byste se nejprve poradil s poskytovatelem zdravotní péče.
Pokud užíváte tablety venlafaxinu, USP, neměli byste užívat žádné jiné léky, které obsahují (venlafaxin), včetně: venlafaxinu HCl.
Jak mám užívat Venlafaxine Tablets, USP?
- Vezměte venlafaxin tablety, USP přesně podle předpisu. Váš poskytovatel zdravotní péče možná bude muset změnit dávku tablet venlafaxinu, USP, dokud pro vás nebude správná dávka.
- Tablety venlafaxinu, USP se mají užívat s jídlem.
- Pokud vynecháte dávku tablet venlafaxinu, USP, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky tablet venlafaxinu, USP současně.
- Pokud užijete příliš mnoho tablet venlafaxinu, USP, okamžitě zavolejte svého poskytovatele zdravotní péče nebo centrum pro kontrolu jedů nebo vyhledejte pohotovostní léčbu.
- Při přechodu z jiného antidepresiva na tablety venlafaxinu může váš lékař chtít nejprve snížit dávku původního antidepresiva, aby se zabránilo nežádoucím účinkům
Co bych se měl vyvarovat při užívání Venlafaxine Tablets, USP?
Tablety venlafaxinu, USP mohou způsobit ospalost nebo mohou ovlivnit vaši schopnost rozhodovat se, jasně myslet nebo rychle reagovat.
Neměli byste řídit, obsluhovat těžké stroje nebo dělat jiné nebezpečné činnosti, dokud nevíte, jak vás tablety venlafaxinu, USP ovlivňují. Při užívání tablet venlafaxinu nepijte alkohol, USP.
Jaké jsou možné vedlejší účinky Venlafaxine Tablets, USP?
Tablety venlafaxinu, USP mohou způsobit závažné nežádoucí účinky, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o Venlafaxine Tablets, USP?"
- Zvýšený cholesterol – nechejte si pravidelně kontrolovat cholesterol
- Novorozenci, jejichž matky užívají tablety venlafaxinu, USP ve třetím trimestru mohou mít problémy hned po narození, včetně:
- problémy s krmením a dýcháním
- záchvaty
- třes, nervozita nebo neustálý pláč
- Glaukom s úzkým úhlem/zvětšené zornice.
Pravidelně kontrolujte oční tlak, pokud:
- máte v anamnéze zvýšený oční tlak
- jsou ohroženy určitými typy glaukomu
Časté možné vedlejší účinky u lidí, kteří užívají tablety venlafaxinu, USP zahrnují:
neobvyklé sny
- sexuální problémy
- ztráta chuti k jídlu, zácpa, průjem, nevolnost nebo zvracení nebo sucho v ústech
- pocit únavy, únavy nebo přílišné ospalosti
- změna spánkových návyků, problémy se spánkem
- zívání
- třes nebo třes
- závratě, rozmazané vidění
- pocení
- pocit úzkosti, nervozity nebo nervozity
- bolest hlavy
- zvýšení srdeční frekvence
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky tablet venlafaxinu, USP.
Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
ZAVOLEJTE SVÉHO LÉKAŘE, POŽÁDÁ VÁM LÉKAŘSKOU PORADU O NEŽÁDOUCÍCH ÚČINCÍCH. NEŽÁDOUCÍ ÚČINKY MŮŽETE HLÁSIT FDA NA ČÍSLE 1-800-FDA-1088.
Jak mám uchovávat tablety Venlafaxine, USP?
- Skladujte při teplotě 20° až 25°C (68° až 77°F), povolené výkyvy 15° až 30°C (59° až 86°F) [Viz USP řízená pokojová teplota ].
- Uchovávejte tablety velafaxinu, USP na suchém místě.
Uchovávejte Venlafaxine Tablets, USP a všechny léky mimo dosah dětí.
Obecné informace o tabletách venlafaxinu, USP Léky jsou někdy předepisovány pro jiné účely, než jsou ty, které jsou uvedeny v Průvodci léky. Nepoužívejte tablety venlafaxinu, USP pro stav, pro který nebyl předepsán. Nedávejte venlafaxinové tablety, USP jiným lidem, i když mají stejný stav. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o tabletách venlafaxinu, USP. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o tabletách venlafaxinu, USP, které jsou určeny pro zdravotnické pracovníky.
Chcete-li nahlásit PODEZŘELNÉ NEŽÁDOUCÍ REAKCE, kontaktujte Sun Pharmaceutical Industries, Inc. na čísle 1-800-818-4555.
Jaké jsou složky přípravku Venlafaxine Tablets, USP?
Účinná látka: (venlafaxin)
Neaktivní složky:
- Tablety: mikrokrystalická celulóza, monohydrát laktosy, předbobtnalý škrob, sodná sůl karboxymethylškrobu, červený oxid železitý, žlutý oxid železitý, koloidní oxid křemičitý a magnesium-stearát
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv pro všechna antidepresiva.
INDIKACE
Velká depresivní porucha
Kapsle s prodlouženým uvolňováním Effexor XR (venlafaxin hydrochlorid) jsou indikovány k léčbě velké depresivní poruchy (MDD). Účinnost byla stanovena ve třech krátkodobých (4, 8 a 12 týdnů) a dvou dlouhodobých udržovacích studiích.
Generalizovaná úzkostná porucha
Effexor XR je indikován k léčbě generalizované úzkostné poruchy (GAD). Účinnost byla stanovena ve dvou 8týdenních a dvou 26týdenních placebem kontrolovaných studiích.
Sociální úzkostná porucha
Effexor XR je indikován k léčbě sociální úzkostné poruchy (SAD), známé také jako sociální fobie. Účinnost byla stanovena ve čtyřech 12týdenních a jedné 26týdenní, placebem kontrolovaných studiích.
Panická porucha
Effexor XR je indikován k léčbě panické poruchy (PD) s agorafobií nebo bez ní. Účinnost byla stanovena ve dvou 12týdenních placebem kontrolovaných studiích.
DÁVKOVÁNÍ A PODÁVÁNÍ
Effexor 37,5 mg XR by měl být podáván v jedné dávce s jídlem, buď ráno nebo večer, každý den přibližně ve stejnou dobu [viz KLINICKÁ FARMAKOLOGIE ]. Každá tobolka by se měla spolknout celá s tekutinou a nerozdělovat, drtit, žvýkat ani vkládat do vody, nebo ji lze podat opatrným otevřením tobolky a posypáním celého obsahu na lžíci jablečného pyré. Tato směs léčivo/potravina by měla být spolknuta okamžitě bez žvýkání a následována sklenicí vody, aby bylo zajištěno úplné spolknutí pelet (sféroidů).
Velká depresivní porucha
Pro většinu pacientů je doporučená počáteční dávka přípravku Effexor 37,5 mg XR 75 mg denně podaná v jedné dávce. U některých pacientů může být žádoucí začít na 37,5 mg denně po dobu 4 až 7 dnů, aby se novým pacientům umožnilo přizpůsobit se medikaci před zvýšením na 75 mg denně. Pacienti, kteří nereagují na počáteční dávku 75 mg denně, mohou mít prospěch ze zvýšení dávky na maximum 225 mg denně. Dávky by se měly podle potřeby zvyšovat až o 75 mg denně a měly by být prováděny v intervalech ne kratších než 4 dny, protože ustáleného stavu plazmatických hladin venlafaxinu a jeho hlavních metabolitů je u většiny pacientů dosaženo do 4. dne [vidět KLINICKÁ FARMAKOLOGIE ]. V klinických studiích stanovujících účinnost byla titrace směrem nahoru povolena v intervalech 2 týdnů nebo delších.
Je třeba poznamenat, že zatímco maximální doporučená dávka pro ambulantní pacienty se středně těžkou depresí je také 225 mg denně pro přípravek Effexor (s okamžitým uvolňováním), hospitalizovaní pacienti s těžší depresí v jedné studii vývojového programu pro tento přípravek reagovali na průměrnou dávku 350 mg denně (rozmezí 150 až 375 mg denně). Není známo, zda jsou vyšší dávky přípravku Effexor 37,5 mg XR potřeba u pacientů s těžší depresí; nicméně zkušenosti s Effexorem 75 mg XR v dávkách vyšších než 225 mg denně jsou velmi omezené.
Generalizovaná úzkostná porucha
Pro většinu pacientů je doporučená počáteční dávka přípravku Effexor XR 75 mg denně podaná v jedné dávce. U některých pacientů může být žádoucí začít na 37,5 mg denně po dobu 4 až 7 dnů, aby se novým pacientům umožnilo přizpůsobit se medikaci před zvýšením na 75 mg denně. Pacienti, kteří nereagují na počáteční dávku 75 mg denně, mohou mít prospěch ze zvýšení dávky na maximum 225 mg denně. Dávky by se měly podle potřeby zvyšovat až o 75 mg denně a měly by být prováděny v intervalech ne kratších než 4 dny, protože ustáleného stavu plazmatických hladin venlafaxinu a jeho hlavních metabolitů je u většiny pacientů dosaženo do 4. dne [vidět KLINICKÁ FARMAKOLOGIE ].
Sociální úzkostná porucha (sociální fobie)
Doporučená dávka je 75 mg denně, podaná v jedné dávce. Nebylo prokázáno, že by vyšší dávky přinášely nějaký další přínos.
Panická porucha
Doporučená počáteční dávka přípravku Effexor 75 mg XR je 37,5 mg denně po dobu 7 dnů. Pacienti, kteří nereagují na dávku 75 mg denně, mohou mít prospěch ze zvýšení dávky na maximum přibližně 225 mg denně. Dávky by se měly podle potřeby zvyšovat až o 75 mg denně a měly by být prováděny v intervalech ne kratších než 7 dní.
Přechod pacientů z tablet Effexor 37,5 mg
Pacienti s depresí, kteří jsou v současné době léčeni terapeutickou dávkou Effexoru (okamžité uvolnění), mohou být převedeni na Effexor 37,5 mg XR v nejbližší ekvivalentní dávce (mg denně), např. 37,5 mg venlafaxinu dvakrát denně na 75 mg Effexor 75 mg XR jednou denně. Mohou však být nutné individuální úpravy dávkování.
Specifické populace
Pacienti s poruchou funkce jater
Celková denní dávka by měla být snížena o 50 % u pacientů s mírnou (Child-Pugh=5-6) až středně těžkou (Child-Pugh=7-9) poruchou funkce jater. U pacientů s těžkou poruchou funkce jater (Child-Pugh=10-15) nebo jaterní cirhózou může být nutné snížit dávku o 50 % nebo více [viz Použití u konkrétních populací ].
Pacienti s poruchou ledvin
Celková denní dávka by měla být snížena o 25 % až 50 % u pacientů s mírnou (CLcr = 60-89 ml/min) nebo středně těžkou (CLcr = 30-59 ml/min) poruchou funkce ledvin. U pacientů podstupujících hemodialýzu nebo s těžkou poruchou funkce ledvin (CLcr Použití u konkrétních populací ].
Udržovací léčba
Neexistují žádné dostupné důkazy z kontrolovaných studií, které by naznačovaly, jak dlouho by pacienti s MDD, GAD, SAD nebo PD měli být léčeni přípravkem Effexor 75 mg XR.
Všeobecně se souhlasí s tím, že akutní epizody MDD vyžadují několik měsíců nebo déle trvalé farmakologické terapie po reakci na akutní epizodu. Effexor XR/Effexor prokázal pokračování odpovědi v klinických studiích až 52 týdnů při stejné dávce, na kterou pacienti reagovali během počáteční léčby (viz Klinické studie ]. Není známo, zda dávka přípravku Effexor XR potřebná pro udržovací léčbu je totožná s dávkou potřebnou k dosažení počáteční odpovědi. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby a vhodná dávka pro takovou léčbu.
U pacientů s GAD a SAD se Effexor 37,5 mg XR ukázal jako účinný v 6měsíčních klinických studiích. Potřeba pokračování v medikaci u pacientů s GAD a SAD, kteří se zlepšili léčbou Effexorem XR, by měla být pravidelně přehodnocována.
V klinické studii pro PD pacienti, kteří pokračovali v užívání přípravku Effexor 75 mg XR ve stejné dávce, na kterou reagovali během prvních 12 týdnů léčby, zaznamenali statisticky významně delší dobu do relapsu než pacienti randomizovaní na placebo [viz Klinické studie ]. Potřeba pokračování v medikaci u pacientů s PD, kteří se zlepšili léčbou Effexorem XR, by měla být pravidelně přehodnocována.
Ukončení výroby Effexor XR
Při ukončování léčby přípravkem Effexor 37,5 mg XR se doporučuje spíše postupné snižování dávky než náhlé vysazení. V klinických studiích s Effexorem 37,5 mg XR bylo snižování dosaženo snížením denní dávky o 75 mg v týdenních intervalech. Může být nutná individualizace zúžení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. U některých pacientů může být nutné přerušení léčby po dobu několika měsíců.
Přechod pacientů na nebo z inhibitoru monoaminooxidázy (MAOI) určeného k léčbě psychiatrických poruch
Mezi vysazením IMAO (určeného k léčbě psychiatrických poruch) a zahájením léčby přípravkem Effexor XR by mělo uplynout alespoň 14 dní. Kromě toho by po ukončení užívání přípravku Effexor XR mělo uplynout alespoň 7 dní před zahájením IMAO určeného k léčbě psychiatrických poruch (viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a DROGOVÉ INTERAKCE ].
Použití přípravku Effexor XR s jinými IMAO, jako je linezolid nebo intravenózní methylenová modř
Nezačínejte léčbu přípravkem Effexor 75 mg XR u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, protože existuje zvýšené riziko serotoninového syndromu. U pacienta, který vyžaduje naléhavější léčbu psychiatrického stavu, je třeba zvážit další intervence, včetně hospitalizace [viz KONTRAINDIKACE ].
některých případech může pacient, který již dostává léčbu přípravkem Effexor 37,5 mg XR, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou k dispozici přijatelné alternativy k linezolidu nebo intravenózní methylenové modři a potenciální přínosy léčby linezolidem nebo intravenózní methylenovou modří u konkrétního pacienta převažují nad riziky serotoninového syndromu, měl by být Effexor XR okamžitě ukončen a linezolid nebo intravenózní methylenová modř lze podávat. Sledujte pacienta na příznaky serotoninového syndromu po dobu 7 dnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Léčba přípravkem Effexor 75 mg XR může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg současně s Effexorem XR není jasné. Lékař by si však měl být vědom možnosti vzniku symptomů serotoninového syndromu při takovém použití [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
JAK DODÁVÁNO
Dávkové formy A Síly
Effexor 37,5 mg XR® (venlafaxin hydrochlorid) tobolky s prodlouženým uvolňováním jsou dostupné v následujících silách:
- 37,5 mg tobolky (šedé víčko/broskvové tělo s „W“ a „Effexor 75mg XR“ na víčku a „37,5“ na těle)
- 75 mg tobolky (broskvové víčko a tělo s „W“ a „Effexor 37,5 mg XR“ na víčku a „75“ na těle)
- 150 mg tobolky (tmavě oranžové víčko a tělo s „W“ a „Effexor 75mg XR“ na víčku a „150“ na těle)
Skladování A Manipulace
Effexor XR® (venlafaxin hydrochlorid) tobolky s prodlouženým uvolňováním jsou k dispozici následovně:
NDC 0008-0837-20, lahvička s 15 kapslemi v jednoúčelovém balení. NDC 0008-0837-21, lahvička s 30 kapslemi v jednoúčelovém balení. NDC 0008-0837-22, lahvička s 90 kapslemi v jednoúčelovém balení. NDC 0008-0837-03, karton s 10 blistrovými stripy Redipak®, každý po 10 tobolkách.
NDC 0008-0833-20, lahvička s 15 kapslemi v balení na jedno použití. NDC 0008-0833-21, lahvička s 30 kapslemi v jednoúčelovém balení. NDC 0008-0833-22, lahvička s 90 kapslemi v jednoúčelovém balení. NDC 0008-0833-03, karton s 10 blistrovými stripy Redipak® po 10 tobolkách.
NDC 0008-0836-20, lahvička s 15 kapslemi v jednoúčelovém balení. NDC 0008-0836-21, lahvička s 30 kapslemi v jednoúčelovém balení. NDC 0008-0836-22, lahvička s 90 kapslemi v balení na jedno použití. NDC 0008-0836-03, karton s 10 blistrovými stripy Redipak®, každý po 10 tobolkách.
- 37,5 mg , šedý uzávěr/broskvové tělo s „W“ a „Effexor XR“ na uzávěru a „37,5“ na těle.
- 75 mg , broskvový uzávěr a tělo s „W“ a „Effexor 37,5 mg XR“ na uzávěru a „75“ na těle.
- 150 mg tmavě oranžový uzávěr a tělo s „W“ a „Effexor XR“ na uzávěru a „150“ na těle.
Skladujte při kontrolované pokojové teplotě, 20° až 25°C (68° až 77°F).
Balení na jednotku použití je určeno k vydávání jako jednotka.
Distribuuje: Wyeth Pharmaceuticals LLC, dceřiná společnost Pfizer Inc, Philadelpia, PA 19101. Revize: listopad 2021
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech štítku:
- Přecitlivělost [viz KONTRAINDIKACE ]
- Sebevražedné myšlenky a chování u dětí, dospívajících a dospělých [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšení krevního tlaku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Abnormální krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Aktivace mánie/hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvat [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Změny hmotnosti a výšky u dětských pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Změny chuti k jídlu u dětských pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Intersticiální plicní onemocnění a eozinofilní pneumonie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sexuální dysfunkce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Nejčastější nežádoucí reakce
Nejčastěji pozorované nežádoucí účinky v databázi klinických studií u pacientů léčených přípravkem Effexor XR v MDD, GAD, SAD a PD (výskyt ≥ 5 % a alespoň dvojnásobný výskyt placeba) byly: nauzea (30,0 %), somnolence (15,3 %), sucho v ústech (14,8 %), pocení (11,4 %), abnormální ejakulace (9,9 %), anorexie (9,8 %), zácpa (9,3 %), impotence (5,3 %) a snížené libido (5,1 %).
Nežádoucí účinky hlášené jako důvody pro přerušení léčby
V kombinaci v krátkodobých, placebem kontrolovaných premarketingových studiích pro všechny indikace, 12 % z 3 558 pacientů, kteří dostávali Effexor XR (37,5-225 mg), přerušilo léčbu kvůli nežádoucí zkušenosti, ve srovnání se 4 % z 2 197 pacientů léčených placebem. v těch studiích.Nejčastější nežádoucí účinky vedoucí k přerušení léčby u ≥ 1 % pacientů léčených přípravkem Effexor XR v krátkodobých studiích (až 12 týdnů) napříč indikacemi jsou uvedeny v tabulce 7.
Běžné nežádoucí reakce ve studiích kontrolovaných placebem
Počet pacientů dostávajících více dávek Effexoru XR během premarketingového hodnocení pro každou schválenou indikaci je uveden v tabulce 8. Podmínky a trvání expozice venlafaxinu ve všech vývojových programech se velmi lišily a zahrnovaly (v překrývajících se kategoriích) otevřené a dvojité slepé studie, nekontrolované a kontrolované studie, nemocniční (pouze Effexor) a ambulantní studie, studie s fixní dávkou a titrační studie.
Výskyt častých nežádoucích účinků (ty, které se vyskytly u ≥ 2 % pacientů léčených Effexorem XR [357 pacientů s MDD, 1 381 pacientů s GAD, 819 pacientů se SAD a 1 001 pacientů s PD] a častěji než u pacientů s placebem) u pacientů léčených Effexorem XR krátce -termínované, placebem kontrolované klinické studie s fixní a flexibilní dávkou (dávky 37,5 až 225 mg denně) jsou uvedeny v tabulce 9.
Profil nežádoucích účinků se mezi různými populacemi pacientů podstatně nelišil.
Jiné nežádoucí účinky pozorované v klinických studiích
Tělo jako celek: Fotosenzitivní reakce, zimnice
Kardiovaskulární systém: Posturální hypotenze, synkopa, hypotenze, tachykardie
Zažívací ústrojí: Gastrointestinální krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ],
bruxismus Hemický/lymfatický systém: Ekchymóza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Metabolické/nutriční: Hypercholesterolémie, přibývání na váze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], hubnutí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Nervový systém: Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], manická reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], agitovanost, zmatenost, akatizie, halucinace, hypertonie, myoklonus, depersonalizace, apatie
Kůže a přílohy: Kopřivka, pruritus, vyrážka, alopecie
Speciální smysly: Mydriáza, abnormalita akomodace, tinitus, perverze chuti
Urogenitální systém: Retence moči, poruchy močení, inkontinence moči, zvýšená frekvence močení, menstruační poruchy spojené se zvýšeným krvácením nebo zvýšeným nepravidelným krvácením (např. menoragie, metroragie)
Změny vitálních funkcí
placebem kontrolovaných premarketingových studiích došlo ke zvýšení průměrného krevního tlaku (viz tabulka 10). U většiny indikací bylo u pacientů léčených přípravkem Effexor 37,5 mg XRs evidentní na dávce závislé zvýšení průměrného systolického a diastolického krevního tlaku vleže. Ve všech klinických studiích MDD, GAD, SAD a PD zaznamenalo 1,4 % pacientů ve skupinách Effexor XR zvýšení SDBP o ≥ 15 mm Hg spolu s krevním tlakem ≥ 105 mm Hg, ve srovnání s 0,9 % pacientů ve skupině Effexor XR. placebo skupiny. Podobně u 1 % pacientů ve skupinách s Effexorem 37,5 mg XR došlo ke zvýšení SSBP o ≥ 20 mm Hg s krevním tlakem ≥ 180 mm Hg ve srovnání s 0,3 % pacientů ve skupinách s placebem.
Léčba Effexorem 37,5 mg XR byla spojena s trvalou hypertenzí (definovanou jako diastolický krevní tlak vleže na zádech [SDBP] ≥ 90 mm Hg a ≥ 10 mm Hg nad výchozí hodnotou při třech po sobě jdoucích návštěvách při léčbě (viz tabulka 11). Nedostatečný počet). pacientů dostávalo v klinických studiích průměrné dávky Effexoru XR vyšší než 300 mg denně, aby se plně vyhodnotil výskyt trvalého zvýšení krevního tlaku při těchto vyšších dávkách.
Effexor 37,5 mg XR byl spojen s průměrným zvýšením tepové frekvence ve srovnání s placebem v předmarketingových placebem kontrolovaných studiích (viz tabulka 12) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Laboratorní změny
Cholesterol v séru
Effexor XR byl spojen s průměrným konečným zvýšením sérových koncentrací cholesterolu ve srovnání s průměrným konečným poklesem pro placebo v klinických studiích MDD, GAD, SAD a PD před uvedením na trh (tabulka 13).
Léčba Effexorem 75 mg XR (venlafaxin hydrochlorid) v tobolkách s prodlouženým uvolňováním po dobu až 12 týdnů v předmarketingových placebem kontrolovaných studiích pro velkou depresivní poruchu byla spojena s průměrným konečným zvýšením koncentrace sérového cholesterolu po terapii přibližně o 1,5 mg/dl ve srovnání s průměrné konečné snížení o 7,4 mg/dl pro placebo. Léčba přípravkem Effexor XR po dobu až 8 týdnů a až 6 měsíců v předmarketingových placebem kontrolovaných studiích GAD byla spojena s průměrným konečným zvýšením koncentrace cholesterolu v séru během léčby přibližně o 1,0 mg/dl a 2,3 mg/dl, v daném pořadí, zatímco u subjektů s placebem došlo průměrné konečné snížení o 4,9 mg/dl a 7,7 mg/dl, v daném pořadí. Léčba přípravkem Effexor XR po dobu až 12 týdnů a až 6 měsíců v předmarketingových placebem kontrolovaných studiích sociální úzkostné poruchy byla spojena s průměrným konečným zvýšením koncentrace cholesterolu v séru během léčby přibližně o 7,9 mg/dl a 5,6 mg/dl, v uvedeném pořadí. s průměrným konečným poklesem 2,9 a 4,2 mg/dl, v daném pořadí, pro placebo. Léčba Effexorem XR po dobu až 12 týdnů v předmarketingových placebem kontrolovaných studiích panické poruchy byla spojena s průměrným konečným zvýšením koncentrace cholesterolu v séru během léčby přibližně o 5,8 mg/dl ve srovnání s průměrným konečným snížením o 3,7 mg/dl u placeba.
Pacienti léčení přípravkem Effexor (s okamžitým uvolňováním) po dobu alespoň 3 měsíců v placebem kontrolovaných 12měsíčních prodloužených studiích měli průměrné konečné zvýšení celkového cholesterolu během léčby o 9,1 mg/dl ve srovnání s poklesem o 7,1 mg/dl u pacientů užívajících placebo. léčených pacientů. Toto zvýšení bylo závislé na trvání během období studie a mělo tendenci být větší s vyššími dávkami. Klinicky relevantní zvýšení sérového cholesterolu, definované jako 1) konečné zvýšení sérového cholesterolu během terapie ≥50 mg/dl od výchozí hodnoty a na hodnotu ≥261 mg/dl, nebo 2) průměrné zvýšení sérového cholesterolu ≥ během terapie 50 mg/dl od výchozí hodnoty a na hodnotu ≥261 mg/dl bylo zaznamenáno u 5,3 % pacientů léčených venlafaxinem a 0,0 % pacientů léčených placebem.
Triglyceridy v séru
Effexor 75 mg XR byl spojen s průměrným konečným zvýšením sérových triglyceridů nalačno ve srovnání s placebem v premarketingových klinických studiích SAD a PD po dobu až 12 týdnů (souhrnná data) a trvání 6 měsíců (tabulka 14).
Pediatričtí pacienti
Obecně byl profil nežádoucích účinků venlafaxinu (v placebem kontrolovaných klinických studiích) u dětí a dospívajících (ve věku 6 až 17 let) podobný jako u dospělých. Stejně jako u dospělých byla pozorována snížená chuť k jídlu, úbytek hmotnosti, zvýšený krevní tlak a zvýšený cholesterol v séru [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
V pediatrických klinických studiích byla pozorována nežádoucí reakce, sebevražedné myšlenky.
U pediatrických pacientů byly pozorovány zejména následující nežádoucí účinky: bolest břicha, agitovanost, dyspepsie, ekchymóza, epistaxe a myalgie.
Nežádoucí účinky zjištěné během používání po schválení
Následující nežádoucí účinky byly zjištěny během postregistračního použití Effexoru XR. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku:
Tělo jako celek: Anafylaxe, angioedém
Kardiovaskulární systém: prodloužení QT intervalu, ventrikulární fibrilace, komorová tachykardie (včetně torsade de pointes), takotsubo kardiomyopatie
Zažívací ústrojí: Pankreatitida
Hemický/lymfatický systém: Krvácení sliznice [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], krevní dyskrazie (včetně agranulocytózy, aplastické anémie, neutropenie a pancytopenie), prodloužená doba krvácení, trombocytopenie
Metabolické/nutriční: Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], Syndrom nevhodné sekrece antidiuretického hormonu (SIADH) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], abnormální jaterní testy, hepatitida, zvýšený prolaktin
Muskuloskeletální: Rabdomyolýza
Nervový systém: Neuroleptický maligní syndrom (NMS) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], serotonergní syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], delirium, extrapyramidové reakce (včetně dystonie a dyskineze), porucha koordinace a rovnováhy, tardivní dyskineze
Dýchací systém: Dušnost, intersticiální plicní onemocnění, plicní eozinofilie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Kůže a přílohy: Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, erythema multiforme
Speciální smysly: Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
DROGOVÉ INTERAKCE
Centrální nervový systém (CNS) – aktivní léky
Riziko užívání venlafaxinu v kombinaci s jinými léky působícími na CNS nebylo systematicky hodnoceno. V důsledku toho se doporučuje opatrnost, pokud se Effexor XR užívá v kombinaci s jinými léky působícími na CNS.
Inhibitory monoaminoxidázy
Nežádoucí účinky, z nichž některé byly závažné, byly hlášeny u pacientů, kteří nedávno ukončili léčbu IMAO a začali s antidepresivy s farmakologickými vlastnostmi podobnými Effexoru XR (SNRI nebo SSRI), nebo u pacientů, u kterých byla nedávno ukončena léčba SNRI nebo SSRI. k zahájení MAOI [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Serotonergní léky
Na základě mechanismu účinku přípravku Effexor XR a potenciálu pro serotoninový syndrom se doporučuje opatrnost, pokud je Effexor XR podáván společně s jinými léky, které mohou ovlivnit serotonergní neurotransmiterové systémy, jako jsou triptany, SSRI, další SNRI, linezolid (antibiotikum, reverzibilní neselektivní IMAO), lithium, tramadol nebo třezalka tečkovaná. Pokud je současná léčba přípravkem Effexor XR a těmito léky klinicky opodstatněná, doporučuje se pečlivé sledování pacienta, zejména při zahájení léčby a při zvyšování dávky. Současné užívání přípravku Effexor 75 mg XR s doplňky tryptofanu se nedoporučuje [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léky, které interferují s hemostázou (např. NSAID, Aspirin a Warfarin)
Uvolňování serotoninu krevními destičkami hraje důležitou roli v hemostáze. Užívání psychofarmak, které interferují se zpětným vychytáváním serotoninu, je spojeno s výskytem krvácení z horní části gastrointestinálního traktu a současné užívání NSAID nebo aspirinu může toto riziko krvácení zesílit (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Při současném podávání SSRI a SNRI s warfarinem byly hlášeny změněné antikoagulační účinky, včetně zvýšeného krvácení. Při zahájení nebo ukončení léčby přípravkem Effexor 37,5 mg XR by pacienti léčení warfarinem měli být pečlivě sledováni.
Přípravky na hubnutí
Bezpečnost a účinnost léčby venlafaxinem v kombinaci s látkami snižujícími hmotnost, včetně fenterminu, nebyla stanovena. Současné podávání přípravku Effexor XR a přípravků na hubnutí se nedoporučuje. Effexor XR není indikován pro hubnutí samostatně nebo v kombinaci s jinými přípravky.
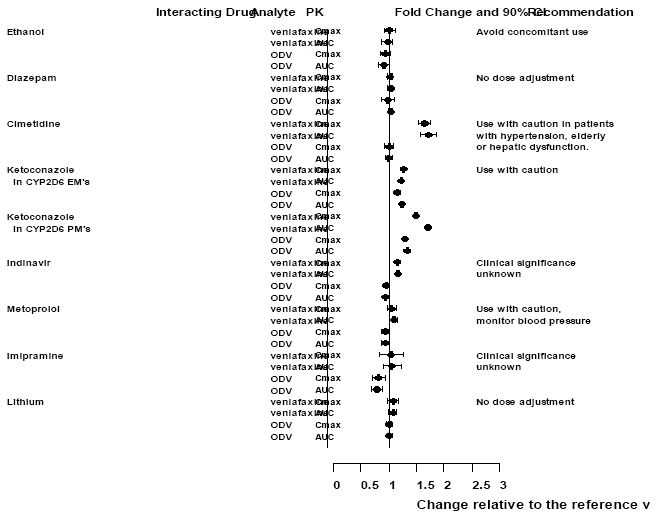
Účinky jiných léků na Effexor XR
Obrázek 1: Účinek interagujících léků na farmakokinetiku venlafaxinu a aktivního metabolitu O-desmethylvenlafaxinu (ODV).
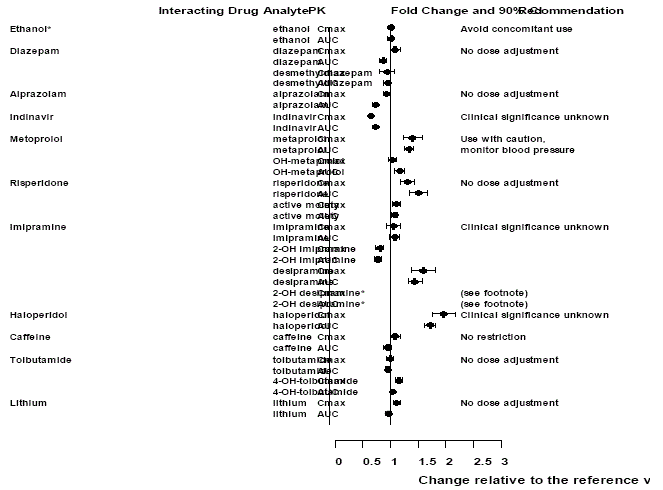
Účinky Effexor XR na jiné léky
Obrázek 2: Účinek venlafaxinu na farmakokinetiku interagujících léčiv a jejich aktivních metabolitů.
Poznámka

*Podávání venlafaxinu ve stabilním režimu nezvětšovalo psychomotorické a psychometrické účinky vyvolané etanolem u stejných subjektů, když nedostávali venlafaxin.
Interakce mezi drogami a laboratorními testy
U pacientů užívajících venlafaxin byly hlášeny falešně pozitivní screeningové imunotesty moči na fencyklidin (PCP) a amfetamin. To je způsobeno nedostatečnou specifitou screeningových testů. Falešně pozitivní výsledky testů lze očekávat několik dní po ukončení léčby venlafaxinem. Potvrzující testy, jako je plynová chromatografie/hmotnostní spektrometrie, odliší venlafaxin od PCP a amfetaminu.
Zneužívání drog a závislost
Kontrolovaná látka
Effexor 75mg XR není kontrolovaná látka.
Zneužívání
Zatímco venlafaxin nebyl v klinických studiích systematicky studován z hlediska jeho potenciálu ke zneužívání, v klinických studiích nebyly žádné známky chování při vyhledávání drog. Na základě předmarketingových zkušeností však není možné předpovědět, do jaké míry bude léčivo působící na CNS po uvedení na trh zneužito, odkloněno a/nebo zneužito. V důsledku toho by měli lékaři pečlivě vyhodnotit pacienty, zda v anamnéze neužívali drogy, a tyto pacienty pečlivě sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání venlafaxinu (např. rozvoj tolerance, zvyšování dávky, chování při vyhledávání drog).
Závislost
Studie in vitro odhalily, že venlafaxin nemá prakticky žádnou afinitu k opiátovým, benzodiazepinovým, fencyklidinovým (PCP) nebo N-methyl-D-asparagovým receptorům (NMDA).
U hlodavců nebyla zjištěna žádná významná stimulační aktivita venlafaxinu na CNS. Ve studiích diskriminace drog na primátech venlafaxin nevykazoval žádnou významnou závislost na zneužívání stimulantů nebo depresivních látek.
Účinky vysazení byly hlášeny u pacientů užívajících venlafaxin [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a dalších) prokázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých (ve věku 18–24 let) s MDD a jiné psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií 9 antidepresiv u více než 4 400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék versus placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl mezi léky a placebem v počtu případů suicidality na 1 000 léčených pacientů) jsou uvedeny v tabulce 1.
žádné z pediatrických studií nedošlo k sebevraždě. Ve studiích pro dospělé došlo k sebevraždám, ale počet nebyl dostatečný k tomu, aby bylo možné učinit závěr o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, neklid, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny u dospělých a dětských pacientů léčených antidepresivy pro MDD, stejně jako pro jiné indikace, psychiatrické i nepsychiatrické. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Pokud bylo učiněno rozhodnutí přerušit léčbu, měla by být léčba snižována tak rychle, jak je to možné, ale s vědomím, že náhlé přerušení může být spojeno s určitými příznaky [viz Syndrom vysazení a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro MDD nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další symptomy popsané výše, např. stejně jako vznik suicidality a takové příznaky okamžitě hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro Effexor XR by měly být napsány pro nejmenší množství tobolek v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese. Je třeba poznamenat, že Effexor XR není schválen pro použití při léčbě bipolární deprese.
serotoninový syndrom
Rozvoj potenciálně život ohrožujícího serotoninového syndromu byl hlášen u inhibitorů zpětného vychytávání serotoninu a norepinefrinu (SNRI) a SSRI, včetně samotného Effexoru XR, ale zejména při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadol, tryptofan, buspiron, amfetaminy a třezalka tečkovaná) a s léky, které narušují metabolismus zejména serotoninu, IMAO, a to jak ty, které jsou určeny k léčbě psychiatrických poruch, tak další, jako je linezolid nebo intravenózní methylenová modř).
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium, kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, hypertermii, pocení, návaly horka a závratě), neuromuskulární příznaky (např. třes, rigiditu, myoklonus , hyperreflexie, nekoordinovanost); záchvaty a gastrointestinální příznaky (např. nevolnost, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu.
Současné užívání přípravku Effexor XR s IMAO (určenými k léčbě psychiatrických poruch) je kontraindikováno. Effexor XR by také neměl být zahájen u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř. Všechny zprávy s methylenovou modří, které poskytly informace o cestě podání, zahrnovaly intravenózní podání v rozmezí dávek 1 mg/kg až 8 mg/kg. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Mohou nastat okolnosti, kdy je nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř u pacienta užívajícího Effexor 37,5 mg XR. Effexor XR by měl být přerušen před zahájením léčby IMAO (viz KONTRAINDIKACE , DÁVKOVÁNÍ A PODÁVÁNÍ , a DROGOVÉ INTERAKCE ].
Pokud je současné užívání Effexoru 37,5 mg XR s jinými serotonergními léky (např. triptany, tricyklickými antidepresivy, mirtazapinem, fentanylem, lithiem, tramadolem, buspironem, amfetaminy, tryptofanem nebo třezalkou tečkovanou) klinicky oprávněné, pečlivé sledování pacienta, zvláště při zahájení léčby a zvýšení dávky [viz DROGOVÉ INTERAKCE ]. Pacienti by měli být upozorněni na potenciální riziko serotoninového syndromu. Pokud se vyskytnou výše uvedené příhody, léčba přípravkem Effexor XR a jakýmikoli souběžně podávanými serotonergními látkami by měla být okamžitě přerušena a měla by být zahájena podpůrná symptomatická léčba.
Zvýšení krevního tlaku
V kontrolovaných studiích došlo ke zvýšení systolického a diastolického krevního tlaku v závislosti na dávce a také k případům trvalé hypertenze (viz NEŽÁDOUCÍ REAKCE ].
Před zahájením léčby přípravkem Effexor 37,5 mg XR a pravidelně během léčby sledujte krevní tlak. Kontrolujte již existující hypertenzi před zahájením léčby přípravkem Effexor 75 mg XR. Buďte opatrní při léčbě pacientů s již existující hypertenzí nebo kardiovaskulárními nebo cerebrovaskulárními stavy, které mohou být zhoršeny zvýšením krevního tlaku. Trvalé zvýšení krevního tlaku může vést k nepříznivým následkům. U přípravku Effexor XR byly hlášeny případy zvýšeného krevního tlaku vyžadující okamžitou léčbu. U pacientů, u kterých dochází k trvalému zvýšení krevního tlaku, zvažte snížení dávky nebo přerušení léčby.
Ve všech klinických studiích s Effexorem 37,5 mg došlo u 1,4 % pacientů ve skupinách léčených přípravkem Effexor XR ke zvýšení diastolického krevního tlaku vleže (SDBP) o ≥ 105 mm Hg o ≥ 15 mm Hg ve srovnání s 0,9 % pacientů ve skupinách s placebem. Podobně u 1 % pacientů ve skupinách léčených Effexorem 75 mg XR došlo ke zvýšení systolického krevního tlaku vleže (SSBP) o ≥ 20 mm Hg s krevním tlakem ≥ 180 mm Hg ve srovnání s 0,3 % pacientů ve skupinách s placebem [viz tabulka 10 v NEŽÁDOUCÍ REAKCE ]. Léčba Effexorem 75 mg XR byla spojena s trvalou hypertenzí (definovanou jako SDBP ≥ 90 mm Hg a ≥ 10 mm Hg nad výchozí hodnotou v důsledku léčby při třech po sobě jdoucích návštěvách při léčbě [viz tabulka 11 v NEŽÁDOUCÍ REAKCE ]. Nedostatečný počet pacientů dostával v klinických studiích průměrné dávky přípravku Effexor 37,5 mg XR nad 300 mg denně, aby bylo možné plně vyhodnotit výskyt trvalého zvýšení krevního tlaku při těchto vyšších dávkách.
Abnormální krvácení
SSRI a SNRI, včetně Effexor 37,5 mg XR, mohou zvýšit riziko krvácivých příhod, od ekchymóz, hematomů, epistaxe, petechií a gastrointestinálního krvácení až po život ohrožující krvácení. Současné užívání aspirinu, nesteroidních protizánětlivých léků (NSAID), warfarinu a dalších antikoagulancií nebo jiných léků, o nichž je známo, že ovlivňují funkci krevních destiček, může toto riziko zvýšit. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Varujte pacienty před rizikem krvácení spojeného se současným užíváním přípravku Effexor 75 mg XR a NSAID, aspirinu nebo jiných léků ovlivňujících koagulaci.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně Effexor XR, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii.
Aktivace mánie/hypománie
Mánie nebo hypománie byly hlášeny u pacientů léčených přípravkem Effexor 37,5 mg XR v premarketingových studiích u MDD, SAD a PD (viz tabulka 2). Mánie/hypománie byla také hlášena u malé části pacientů s poruchami nálady, kteří byli léčeni jinými dostupnými léky k léčbě MDD. Effexor 37,5 mg XR by měl být používán s opatrností u pacientů s mánií nebo hypománií v anamnéze.
Syndrom vysazení
Symptomy z vysazení byly systematicky hodnoceny u pacientů užívajících venlafaxin, včetně prospektivních analýz klinických studií u GAD a retrospektivních přehledů studií u MDD a SAD. Bylo zjištěno, že náhlé vysazení nebo snížení dávky venlafaxinu v různých dávkách je spojeno s výskytem nových příznaků, jejichž frekvence se zvyšovala se zvyšující se hladinou dávky as delším trváním léčby. Mezi hlášené příznaky patří neklid, anorexie, úzkost, zmatenost, zhoršená koordinace a rovnováha, průjem, závratě, sucho v ústech, dysforická nálada, fascikulace, únava, příznaky podobné chřipce, bolesti hlavy, hypománie, nespavost, nevolnost, nervozita, noční můry, poruchy smyslů ( včetně elektrických pocitů podobných šoku), somnolence, pocení, třes, závratě a zvracení.
Po uvedení přípravku na trh byly hlášeny závažné příznaky z vysazení, které mohou být vleklé a závažné. Úplná sebevražda, sebevražedné myšlenky, agresivita a násilné chování byly pozorovány u pacientů během snižování dávky přípravku Effexor 75 mg XR, včetně vysazení. Jiné postmarketingové zprávy popisují změny vidění (jako je rozmazané vidění nebo potíže se zaostřováním) a zvýšený krevní tlak po vysazení nebo snížení dávky přípravku Effexor XR.
Během marketingu Effexoru XR, jiných SNRI a SSRI byly spontánně hlášeny další nežádoucí účinky, které se vyskytly po vysazení těchto léků, zvláště když byly náhlé, včetně následujících: podrážděnost, letargie, emoční labilita, tinnitus a záchvaty.
Při ukončování léčby přípravkem Effexor XR je třeba u pacientů sledovat výskyt těchto příznaků. Doporučuje se spíše postupné snižování dávky než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, lze zvážit obnovení předchozí předepsané dávky. Následně může poskytovatel zdravotní péče pokračovat ve snižování dávky, ale pozvolnějším tempem. U některých pacientů může být nutné přerušení léčby po dobu několika měsíců [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Záchvaty
Při léčbě venlafaxinem se vyskytly záchvaty. Effexor 75mg XR, stejně jako mnoho antidepresiv, by měl být používán s opatrností u pacientů s anamnézou záchvatů a měl by být přerušen u každého pacienta, u kterého se záchvaty rozvinou. [Musí zmírnit riziko: Rizikové faktory, souběžné léky, které snižují práh záchvatů.]
Hyponatrémie
Hyponatremie se může objevit v důsledku léčby SSRI a SNRI, včetně přípravku Effexor 37,5 mg XR. V mnoha případech se zdá, že hyponatrémie je výsledkem syndromu nevhodné sekrece antidiuretického hormonu (SIADH). Byly hlášeny případy se sérovým sodíkem nižším než 110 mmol/l. Starší pacienti mohou mít větší riziko rozvoje hyponatremie s SSRI a SNRI (viz Použití u konkrétních populací ]. Také pacienti užívající diuretika nebo ti, kteří jsou jinak objemově vyčerpaní, mohou být více ohroženi. Zvažte vysazení Effexoru 37,5 mg XR u pacientů se symptomatickou hyponatrémií a zahajte vhodnou lékařskou intervenci.
Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, které mohou vést k pádům. Známky a symptomy spojené se závažnějšími a/nebo akutními případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt.
Změny hmotnosti a výšky u dětských pacientů
Změny hmotnosti
Průměrná změna tělesné hmotnosti a výskyt úbytku hmotnosti (procento pacientů, kteří ztratili 3,5 % nebo více) v placebem kontrolovaných pediatrických studiích u MDD, GAD a SAD jsou uvedeny v tabulkách 3 a 4.
Ztráta hmotnosti nebyla omezena na pacienty s anorexií související s léčbou [viz Změny chuti k jídlu u dětských pacientů ].
Rizika spojená s dlouhodobým užíváním přípravku Effexor 75 mg XR byla hodnocena v otevřené studii MDD u dětí a dospívajících, kteří dostávali Effexor XR po dobu až šesti měsíců. U dětí a dospívajících ve studii došlo k nárůstu hmotnosti, který byl nižší, než se očekávalo, na základě údajů od vrstevníků stejného věku a pohlaví. Rozdíl mezi pozorovaným přírůstkem hmotnosti a očekávaným přírůstkem hmotnosti byl větší u dětí (
Změny výšky
Tabulka 5 ukazuje průměrné zvýšení výšky u pediatrických pacientů v krátkodobých, placebem kontrolovaných studiích MDD, GAD a SAD. Rozdíly ve zvýšení výšky ve studiích GAD a MDD byly nejpozoruhodnější u pacientů mladších dvanácti let.
V šestiměsíční otevřené studii MDD došlo u dětí a dospívajících k nárůstu výšky, který byl nižší, než se očekávalo, na základě údajů od vrstevníků stejného věku a pohlaví. Rozdíl mezi pozorovanou a očekávanou rychlostí růstu byl větší u dětí (
Změny chuti k jídlu u dětských pacientů
Snížená chuť k jídlu (uváděná jako anorexie související s léčbou) byla častěji pozorována u pacientů léčených přípravkem Effexor XR oproti pacientům léčeným placebem v předmarketingovém hodnocení přípravku Effexor XR pro MDD, GAD a SAD (viz tabulka 6).
Intersticiální plicní onemocnění a eozinofilní pneumonie
Intersticiální plicní onemocnění a eozinofilní pneumonie spojené s léčbou venlafaxinem byly hlášeny vzácně. Možnost těchto nežádoucích účinků by měla být zvážena u pacientů léčených venlafaxinem, kteří mají progresivní dušnost, kašel nebo dyskomfort na hrudi. Takoví pacienti by měli podstoupit okamžité lékařské vyšetření a mělo by se zvážit přerušení léčby venlafaxinem.
Sexuální dysfunkce
Užívání SNRI, včetně Effexor XR, může způsobit příznaky sexuální dysfunkce (viz NEŽÁDOUCÍ REAKCE ]. U mužských pacientů může mít užívání SNRI za následek zpoždění nebo selhání ejakulace, snížení libida a erektilní dysfunkci. U pacientek může mít užívání SNRI za následek snížení libida a opožděný nebo chybějící orgasmus.
Je důležité, aby se předepisující lékaři zeptali na sexuální funkce před zahájením léčby přípravkem Effexor 37,5 mg XR a konkrétně se zeptali na změny sexuální funkce během léčby, protože sexuální funkce nemusí být spontánně hlášeny. Při hodnocení změn sexuální funkce je důležité získat podrobnou anamnézu (včetně načasování nástupu příznaků), protože sexuální příznaky mohou mít jiné příčiny, včetně základní psychiatrické poruchy. Diskutujte o možných strategiích řízení, které pomohou pacientům činit informovaná rozhodnutí o léčbě.
Informace pro pacienty
Viz FDA-schváleno INFORMACE PRO PACIENTA ( Průvodce léky ).
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o výhodách a rizicích spojených s léčbou přípravkem Effexor 37,5 mg XR a měli by jim poradit, jak správně používat. Pro Effexor 75mg XR je k dispozici příručka pro pacienty s léky na téma „Antidepresivní léky, deprese a jiná vážná duševní onemocnění a sebevražedné myšlenky nebo činy“. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Příručku o medikaci, a měl by jim pomoci porozumět jejímu obsahu. Pacienti by měli mít příležitost prodiskutovat obsah Příručky pro léky a získat odpovědi na případné otázky. Úplný text Příručky k medikaci je přetištěn na konci tohoto dokumentu. Pacienti by měli být informováni o následujících problémech a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání přípravku Effexor XR.
Sebevražedné myšlenky a chování
Doporučte pacientům, jejich rodinám a pečovatelům, aby hledali výskyt sebevražednosti, zhoršení deprese a dalších psychiatrických symptomů (úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie, psychomotorický neklid, hypománie, mánie, jiné neobvyklé změny v chování), zvláště na začátku léčby a při zvyšování nebo snižování dávky. Takové symptomy by měly být hlášeny pacientovi předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, mají náhlý nástup nebo nebyly součástí symptomů pacienta. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování (viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Souběžná medikace
Informujte pacienty užívající Effexor XR, aby neužívali současně jiné přípravky obsahující venlafaxin nebo desvenlafaxin. Zdravotničtí pracovníci by měli pacienty poučit, aby neužívali Effexor XR s IMAO nebo do 14 dnů po ukončení IMAO a aby před zahájením IMAO počkali 7 dní po ukončení Effexoru XR [viz KONTRAINDIKACE ].
serotoninový syndrom
Pacienti by měli být upozorněni na riziko serotoninového syndromu při současném užívání přípravku Effexor 75 mg XR a triptanů, tramadolu, amfetaminů, tryptofanových doplňků, s antipsychotiky nebo jinými antagonisty dopaminu nebo jinými serotonergními látkami (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Zvýšený krevní tlak
Informujte pacienty, že by měli pravidelně sledovat krevní tlak, když užívají Effexor XR [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Abnormální krvácení
Pacienti by měli být upozorněni na současné užívání přípravku Effexor 75 mg XR a NSAID, aspirinu, warfarinu nebo jiných léků ovlivňujících koagulaci, protože kombinované užívání psychofarmak, které interferují se zpětným vychytáváním serotoninu, a tyto látky byly spojeny se zvýšeným rizikem krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glaukom s uzavřeným úhlem
Pacienti by měli být upozorněni, že užívání přípravku Effexor XR může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a mají profylaktický postup (např. iridektomie), pokud jsou náchylní [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Aktivace mánie/hypománie
Poraďte pacientům, jejich rodinám a pečovatelům, aby sledovali známky aktivace mánie/hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kardiovaskulární/cerebrovaskulární onemocnění
Při podávání Effexoru XR pacientům s kardiovaskulárními, cerebrovaskulárními poruchami nebo poruchami metabolismu lipidů se doporučuje opatrnost (viz NEŽÁDOUCÍ REAKCE ].
Zvýšení hladiny cholesterolu a triglyceridů v séru
Informujte pacienty, že může dojít ke zvýšení celkového cholesterolu, LDL a triglyceridů a že lze zvážit měření sérových lipidů (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Syndrom vysazení
Informujte pacienty, aby nepřestávali užívat přípravek Effexor 75 mg XR, aniž by si nejprve promluvili se svým zdravotníkem. Pacienti by si měli být vědomi, že při vysazení Effexoru XR se mohou objevit účinky z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Sexuální dysfunkce
Informujte pacienty, že užívání přípravku Effexor XR může vyvolat příznaky sexuální dysfunkce u mužů i žen. Informujte pacienty, že by měli se svým poskytovatelem zdravotní péče prodiskutovat jakékoli změny v sexuální funkci a potenciální strategie řízení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zásah do kognitivního a motorického výkonu
Varujte pacienty před obsluhou nebezpečných strojů, včetně automobilů, dokud si nebudou přiměřeně jisti, že léčba Effexorem 37,5 mg XR nepříznivě neovlivňuje jejich schopnost zapojit se do takových činností.
Alkohol
Informujte pacienty, aby se při užívání Effexor 37,5 mg XR vyhýbali alkoholu [viz DROGOVÉ INTERAKCE ].
Alergické reakce
Poraďte pacientům, aby informovali svého lékaře, pokud se u nich objeví alergické jevy, jako je vyrážka, kopřivka, otoky nebo potíže s dýcháním.
Těhotenství
Informujte pacientky, aby informovaly svého lékaře, pokud během léčby otěhotní nebo plánují otěhotnět [viz Použití u konkrétních populací ].
Ošetřovatelství
Poraďte pacientům, aby informovali svého lékaře, pokud kojí dítě [viz Použití u konkrétních populací ].
Zbytkové sféroidy
Effexor XR obsahuje sféroidy, které pomalu uvolňují léčivo do trávicího traktu. Nerozpustná část těchto sféroidů je eliminována a pacienti mohou zaznamenat průchod sféroidů stolicí nebo kolostomií. Pacienti by měli být informováni, že aktivní léčivo již bylo absorbováno v době, kdy pacient uvidí sféroidy.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Léčba venlafaxinem u myší nebo potkanů nezvýšila výskyt nádorů. Venlafaxin byl podáván myším žaludeční sondou po dobu 18 měsíců v dávkách až 120 mg/kg za den, což byl 1,7násobek maximální doporučené dávky u člověka na základě mg/m2. Venlafaxin byl také podáván potkanům orální sondou po dobu 24 měsíců v dávkách až 120 mg/kg denně. U potkanů, kterým byla podávána dávka 120 mg/kg, byly plazmatické koncentrace venlafaxinu při pitvě 1krát (krysí samci) a 6krát (krysí samice) plazmatické koncentrace pacientů, kterým byla podávána maximální doporučená dávka pro člověka. Plazmatické hladiny O-desmethyl metabolitu (ODV) byly u potkanů nižší než u pacientů, kterým byla podávána maximální doporučená dávka. O-desmethylvenlafaxin (ODV), hlavní lidský metabolit venlafaxinu, podávaný perorální sondou myším a potkanům po dobu 2 let nezvýšil výskyt nádorů v žádné studii. Myši dostávaly ODV v dávkách až 500/300 mg/kg/den (dávka snížena po 45 týdnech dávkování). Expozice při dávce 300 mg/kg/den je 9krát vyšší než u lidské dávky 225 mg/den. Potkani dostávali ODV v dávkách až 300 mg/kg/den (samci) nebo 500 mg/kg/den (samice). Expozice při nejvyšší dávce je přibližně 8krát (muži) nebo 11krát (ženy) vyšší než dávka pro člověka 225 mg/den.
Mutageneze
Venlafaxin a hlavní lidský metabolit, ODV, nebyly mutagenní v Amesově testu reverzních mutací u bakterií Salmonella nebo testu na dopředné genové mutace savčích buněk ovary čínského křečka/HGPRT. Venlafaxin také nebyl mutagenní ani klastogenní v in vitro testu transformace myších buněk BALB/c-3T3, testu výměny sesterských chromatid v kultivovaných buňkách vaječníků čínského křečka nebo v testu in vivo chromozomálních aberací v kostní dřeni potkana. ODV nebyl klastogenní v in vitro testu na chromozomální aberaci buněk vaječníků čínského křečka ani v in vivo testu na chromozomální aberaci u potkanů.
Zhoršení Plodnosti
Studie reprodukce a fertility venlafaxinu u potkanů neprokázaly žádné nežádoucí účinky venlafaxinu na samčí nebo samičí fertilitu při perorálních dávkách až 2krát vyšších, než je maximální doporučená dávka pro člověka 225 mg/den na základě mg/m2. Snížená plodnost však byla pozorována ve studii, ve které byli samci a samice potkanů léčeni O-desmethylvenlafaxinem (ODV), hlavním lidským metabolitem venlafaxinu, před a během páření a březosti. K tomu došlo při expozici ODV (AUC) přibližně 2 až 3krát vyšší, než je dávka spojená s lidskou dávkou venlafaxinu 225 mg/den.
Použití u konkrétních populací
Těhotenství
Teratogenní účinky
Kategorie těhotenství C
Venlafaxin nezpůsobil malformace u potomků potkanů nebo králíků, kterým byly podávány dávky až 2,5násobek (potkan) nebo 4násobek (králík) maximální doporučené denní dávky u člověka na základě mg/m2. U potkanů však došlo ke snížení hmotnosti mláďat, zvýšení počtu mrtvě narozených mláďat a zvýšení počtu úmrtí mláďat během prvních 5 dnů laktace, kdy dávkování začalo během březosti a pokračovalo až do odstavení. Příčina těchto úmrtí není známa. Tyto účinky se objevily při 2,5násobku (mg/m2) maximální denní dávky u člověka. Dávka bez účinku na mortalitu potkaních mláďat byla 0,25krát vyšší než dávka pro člověka na základě mg/m2. V reprodukčních vývojových studiích na potkanech a králících s O-desmethylvenlafaxinem (ODV), hlavním lidským metabolitem venlafaxinu, nebyly pozorovány známky teratogenity při expozičním rozmezí 13 u potkanů a 0,3 u králíků. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Effexor XR by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Neteratogenní účinky
U novorozenců vystavených Effexoru 37,5 mg XR, jiným SNRI nebo SSRI koncem třetího trimestru se vyvinuly komplikace vyžadující prodlouženou hospitalizaci, podporu dýchání a výživu sondou. Takové komplikace mohou nastat ihned po porodu. Hlášené klinické nálezy zahrnovaly respirační tíseň, cyanózu, apnoe, záchvaty, teplotní nestabilitu, potíže s krmením, zvracení, hypoglykémii, hypotonii, hypertonii, hyperreflexii, třes, nervozitu, podrážděnost a neustálý pláč. Tyto rysy jsou v souladu buď s přímým toxickým účinkem SSRI a SNRI, nebo možná se syndromem z vysazení léku. Je třeba poznamenat, že v některých případech je klinický obraz v souladu se serotoninovým syndromem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ]. Při léčbě těhotné ženy přípravkem Effexor XR během třetího trimestru by měl lékař pečlivě zvážit možná rizika a přínosy léčby.
Práce a dodání
Účinek venlafaxinu na porod a porod u lidí není znám.
Kojící matky
Bylo hlášeno, že venlafaxin a ODV se vylučují do lidského mléka. Vzhledem k potenciálu závažných nežádoucích reakcí u kojených dětí z přípravku Effexor XR by mělo být rozhodnuto, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
S přípravkem Effexor XR byly provedeny dvě placebem kontrolované studie u 766 pediatrických pacientů s MDD a dvě placebem kontrolované studie u 793 pediatrických pacientů s GAD a údaje nebyly dostatečné pro podporu tvrzení o použití u pediatrických pacientů.
Každý, kdo zvažuje použití Effexor XR u dítěte nebo dospívajícího, musí vyvážit potenciální rizika s klinickou potřebou [viz BOX VAROVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Ačkoli nebyly navrženy žádné studie, které by primárně zhodnotily vliv Effexoru 37,5 mg XR na růst, vývoj a dospívání dětí a dospívajících, provedené studie naznačují, že Effexor XR může nepříznivě ovlivnit hmotnost a výšku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pokud by mělo být rozhodnuto léčit dětského pacienta přípravkem Effexor XR, doporučuje se během léčby pravidelné sledování hmotnosti a výšky, zvláště pokud má léčba pokračovat dlouhodobě (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Bezpečnost léčby přípravkem Effexor 75 mg XR u pediatrických pacientů nebyla systematicky hodnocena pro chronickou léčbu delší než šest měsíců. Ve studiích provedených u pediatrických pacientů (ve věku 6-17 let) byl výskyt zvýšení krevního tlaku a cholesterolu považovaný za klinicky významný u pediatrických pacientů podobný jako u dospělých pacientů. V důsledku toho se opatření pro dospělé vztahují na dětské pacienty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Geriatrické použití
Procento pacientů v klinických studiích pro Effexor 37,5 mg XR pro MDD, GAD, SAD a PD, kteří byli ve věku 65 let nebo starší, je uvedeno v tabulce 15.
Nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti mezi geriatrickými pacienty a mladšími pacienty a jiné hlášené klinické zkušenosti obecně neidentifikovaly rozdíly v odpovědi mezi staršími a mladšími pacienty. Nelze však vyloučit větší citlivost některých starších jedinců. SSRI a SNRI, včetně Effexor XR, byly spojeny s případy klinicky významné hyponatremie u starších pacientů, kteří mohou být vystaveni většímu riziku této nežádoucí příhody (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
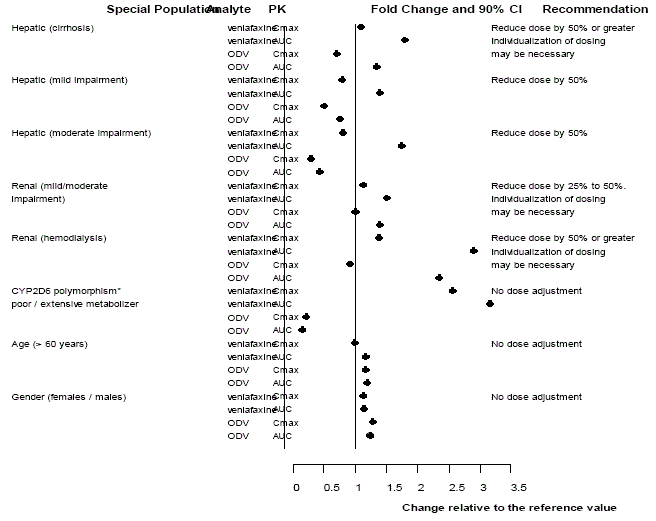
Farmakokinetika venlafaxinu a ODV se u starších pacientů podstatně nemění [viz KLINICKÁ FARMAKOLOGIE ] (viz obrázek 3). U starších osob se nedoporučuje žádná úprava dávky pouze na základě věku, i když jiné klinické okolnosti, z nichž některé mohou být u starších osob častější, jako je poškození ledvin nebo jater, mohou vyžadovat snížení dávky (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Věk A Pohlaví
Populační farmakokinetická analýza 404 pacientů léčených přípravkem Effexor ze dvou studií zahrnujících režimy dvakrát denně i třikrát denně ukázala, že minimální plazmatické hladiny venlafaxinu nebo ODV normalizované na dávku se neměnily podle věkových nebo genderových rozdílů. Úprava dávkování na základě věku nebo pohlaví pacienta obecně není nutná [viz DÁVKOVÁNÍ A PODÁVÁNÍ ] (viz tabulka 15).
Použití v podskupinách pacientů
Obrázek 3: Farmakokinetika venlafaxinu a jeho metabolitu O-desmethylvenlafaxinu (ODV) ve zvláštních populacích.
PŘEDÁVKOVAT
Lidská zkušenost
Během předmarketingových hodnocení přípravku Effexor 75 mg XR (pro MDD, GAD, SAD a PD) a Effexor (pro MDD) bylo hlášeno dvacet případů akutního předávkování přípravkem Effexor (6 a 14 hlášení u pacientů s Effexorem XR a Effexorem 75 mg, v tomto pořadí) buď samostatně nebo v kombinaci s jinými drogami a/nebo alkoholem.
Nejčastěji hlášeným příznakem byla somnolence. Mezi další hlášené symptomy patřily parestézie všech čtyř končetin, středně závrať, nevolnost, necitlivost rukou a nohou a návaly horka a nachlazení 5 dní po předávkování. Ve většině případů nebyly s předávkováním spojeny žádné známky nebo příznaky. Většina hlášení se týkala požití, kdy celková požitá dávka venlafaxinu nebyla odhadnuta více než několikanásobně vyšší než obvyklá terapeutická dávka. U jednoho pacienta, který požil 2,75 g venlafaxinu, byly pozorovány dvě generalizované křeče a prodloužení QTc na 500 ms, ve srovnání se 405 ms na začátku. U dvou dalších pacientů byla hlášena mírná sinusová tachykardie.
Opatření přijatá k léčbě předávkování zahrnovala žádnou léčbu, hospitalizaci a symptomatickou léčbu a hospitalizaci plus léčbu aktivním uhlím. Všichni pacienti se uzdravili.
postmarketingových zkušenostech se předávkování venlafaxinem vyskytlo převážně v kombinaci s alkoholem a/nebo jinými léky. Mezi nejčastěji hlášené příhody při předávkování patří tachykardie, změny úrovně vědomí (v rozsahu od somnolence po kóma), mydriáza, záchvaty a zvracení.
Byly hlášeny změny na elektrokardiogramu (např. prodloužení QT intervalu, blokáda raménka, prodloužení QRS), ventrikulární tachykardie, bradykardie, hypotenze, rhabdomyolýza, vertigo, nekróza jater, serotoninový syndrom a úmrtí.
Publikované retrospektivní studie uvádějí, že předávkování venlafaxinem může být spojeno se zvýšeným rizikem fatálních následků ve srovnání s rizikem pozorovaným u antidepresiv SSRI, ale nižším než u tricyklických antidepresiv. Epidemiologické studie ukázaly, že pacienti léčení venlafaxinem mají vyšší preexistující zátěž rizikovými faktory sebevraždy než pacienti léčení SSRI. Není jasné, do jaké míry lze zjištění zvýšeného rizika fatálních následků přičíst toxicitě venlafaxinu při předávkování, na rozdíl od některých charakteristik u pacientů léčených venlafaxinem. Předpisy pro Effexor 75 mg XR by měly být napsány pro nejmenší množství tobolek v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Řízení Předávkování
Obraťte se na Certified Poison Control Center pro aktuální pokyny a rady (1-800-222-1222 nebo www.poison.org). V případě předávkování poskytněte podpůrnou péči, včetně pečlivého lékařského dohledu a sledování. Léčba by se měla skládat z obecných opatření používaných při zvládání předávkování jakýmkoli lékem. Zvažte možnost předávkování více drogami. Zajistěte dostatečné dýchací cesty, okysličení a ventilaci. Sledujte srdeční rytmus a životní funkce. Poskytněte podpůrná a symptomatická opatření.
KONTRAINDIKACE
Přecitlivělost
Hypersenzitivita na venlafaxin-hydrochlorid, desvenlafaxin sukcinát nebo na kteroukoli pomocnou látku v přípravku
Současné užívání s inhibitory monoaminooxidázy (MAOI)
Užívání IMAO (určených k léčbě psychiatrických poruch) současně s přípravkem Effexor 75 mg XR nebo do 7 dnů po ukončení léčby přípravkem Effexor XR je kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu. Užívání přípravku Effexor 37,5 mg XR do 14 dnů po ukončení léčby IMAO (určeného k léčbě psychiatrických poruch) je také kontraindikováno (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a DROGOVÉ INTERAKCE ].
Zahájení léčby přípravkem Effexor XR u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř, je také kontraindikováno kvůli zvýšenému riziku serotoninového syndromu (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Přesný mechanismus antidepresivního účinku venlafaxinu u lidí není znám, ale předpokládá se, že souvisí s potenciací serotoninu a norepinefrinu v centrálním nervovém systému prostřednictvím inhibice jejich zpětného vychytávání. Neklinické studie prokázaly, že venlafaxin a jeho aktivní metabolit, ODV, jsou silné a selektivní inhibitory zpětného vychytávání serotoninu a norepinefrinu neurony a slabé inhibitory zpětného vychytávání dopaminu.
Farmakodynamika
Venlafaxin a ODV nemají in vitro žádnou významnou afinitu k muskarinovo-cholinergním, H1-histaminergním nebo α1 adrenergním receptorům. Předpokládá se, že farmakologická aktivita na těchto receptorech je spojena s různými anticholinergními, sedativními a kardiovaskulárními účinky pozorovanými u jiných psychotropních léků. Venlafaxin a ODV nevykazují inhibiční aktivitu na monoaminooxidázu (MAO).
Elektrofyziologie srdce
Účinek venlafaxinu na QT interval byl hodnocen v randomizované, dvojitě zaslepené, placebem a pozitivně kontrolované třídobé zkřížené důkladné QT studii u 54 zdravých dospělých subjektů. U venlafaxinu 450 mg nebyl zjištěn žádný významný účinek na prodloužení QT intervalu.
Farmakokinetika
Rovnovážných koncentrací venlafaxinu a ODV v plazmě je dosaženo během 3 dnů po perorální léčbě opakovanými dávkami. Venlafaxin a ODV vykazovaly lineární kinetiku v rozmezí dávek 75 až 450 mg denně. Průměr ± SD plazmatická clearance venlafaxinu v ustáleném stavu a ODV je 1,3 ± 0,6 a 0,4 ± 0,2 l/h/kg, v daném pořadí; zdánlivý poločas eliminace je 5±2 hodiny a 11±2 hodiny; a zdánlivý (ustálený) distribuční objem je 7,5±3,7 a 5,7±1,8 l/kg, v daném pořadí. Venlafaxin a ODV se v terapeutických koncentracích minimálně váží na plazmatické proteiny (27 %, resp. 30 %).
Absorpce a distribuce
Venlafaxin se dobře vstřebává a rozsáhle metabolizuje v játrech. ODV je hlavním aktivním metabolitem. Na základě studií hmotnostní bilance je absorbováno nejméně 92 % jednorázové perorální dávky venlafaxinu. Absolutní biologická dostupnost venlafaxinu je přibližně 45 %.
Podávání přípravku Effexor 37,5 mg XR (150 mg jednou denně) obecně vedlo k nižším hodnotám Cmax a pozdějším Tmax než u přípravku Effexor (s okamžitým uvolňováním) podávaného dvakrát denně (tabulka 16). Když byly stejné denní dávky venlafaxinu podávány buď jako tableta s okamžitým uvolňováním nebo jako tobolka s prodlouženým uvolňováním, expozice venlafaxinu i ODV byla u těchto dvou léčeb podobná a kolísání plazmatických koncentrací bylo mírně nižší u Effexoru 37,5 mg XR kapsle. Proto Effexor XR poskytuje pomalejší rychlost absorpce, ale stejný rozsah absorpce ve srovnání s tabletou s okamžitým uvolňováním.
Jídlo neovlivnilo biologickou dostupnost venlafaxinu ani jeho aktivního metabolitu ODV. Doba podání (AM versus PM) neovlivnila farmakokinetiku venlafaxinu a ODV ze 75 mg tobolky Effexor 75 mg XR.
Venlafaxin není silně vázán na plazmatické proteiny; proto podání Effexoru 37,5 mg XR pacientovi užívajícímu jiný lék, který se vysoce váže na proteiny, by nemělo způsobit zvýšené volné koncentrace jiného léku.
Metabolismus A Eliminace
Po absorpci podléhá venlafaxin rozsáhlému presystémovému metabolismu v játrech, primárně na ODV, ale také na N-desmethylvenlafaxin, N,O-didesmethylvenlafaxin a další minoritní metabolity. Studie in vitro ukazují, že tvorba ODV je katalyzována CYP2D6; toto bylo potvrzeno v klinické studii, která ukazuje, že pacienti s nízkými hladinami CYP2D6 (pomalí metabolizátoři) měli zvýšené hladiny venlafaxinu a snížené hladiny ODV ve srovnání s lidmi s normálními hladinami CYP2D6 (extenzivní metabolizátoři) [viz Použití u konkrétních populací ].
Přibližně 87 % dávky venlafaxinu se objeví v moči během 48 hodin jako nezměněný venlafaxin (5 %), nekonjugovaný ODV (29 %), konjugovaný ODV (26 %) nebo jiné méně významné neaktivní metabolity (27 %). Renální eliminace venlafaxinu a jeho metabolitů je tedy primární cestou vylučování.
Klinické studie
Velká depresivní porucha
Účinnost kapslí Effexor 75 mg XR (venlafaxin hydrochlorid) s prodlouženým uvolňováním jako léčba velké depresivní poruchy (MDD) byla stanovena ve dvou placebem kontrolovaných, krátkodobých (8 týdnů pro studii 1; 12 týdnů pro studii 2), flexibilních - studie dávek, s dávkami začínajícími na 75 mg za den a v rozmezí do 225 mg za den u dospělých ambulantních pacientů splňujících kritéria DSM-III-R nebo DSM-IV pro MDD. U ambulantních pacientů se středně těžkou depresí byla počáteční dávka venlafaxinu 75 mg denně. V obou studiích Effexor XR prokázal nadřazenost nad placebem v primárním měření účinnosti definovaném jako změna od výchozí hodnoty v celkovém skóre HAM-D-21 ke konečné návštěvě, Effexor XR také prokázal nadřazenost nad placebem v klíčovém sekundárním koncovém bodě účinnosti, klinickém Globální dojmy (CGI) Stupnice závažnosti onemocnění. Zkoumání genderových podskupin studované populace neodhalilo žádnou rozdílnou citlivost na základě pohlaví.
Čtyřtýdenní studie u hospitalizovaných pacientů splňujících kritéria DSM-III-R pro MDD s melancholií s použitím Effexoru 37,5 mg v rozmezí 150 až 375 mg denně (rozdělených do schématu třikrát denně) prokázala nadřazenost Effexoru nad placebo na základě celkového skóre HAM-D-21. Průměrná dávka u pacientů, kteří dokončili léčbu, byla 350 mg denně (studie 3).
dlouhodobější studii byli dospělí ambulantní pacienti s MDD, kteří reagovali během 8týdenní otevřené studie na Effexor 37,5 mg XR (75, 150 nebo 225 mg, jednou denně každé ráno), randomizováni k pokračování ve stejném přípravku Effexor XR dávka nebo placebo až po dobu 26 týdnů sledování relapsu. Odpověď během otevřené fáze byla definována jako bodové skóre CGI závažnosti onemocnění ≤3 a celkové skóre HAM-D-21 ≤10 při hodnocení 56. dne. Relaps během dvojitě zaslepené fáze byl definován následovně: (1) znovuobjevení se závažné depresivní poruchy definované kritérii DSM-IV a bodové skóre závažnosti onemocnění podle CGI ≥4 (středně nemocné), (2) 2 po sobě jdoucí CGI Položka skóre závažnosti onemocnění ≥4 nebo (3) konečné skóre položky CGI závažnosti onemocnění ≥4 pro každého pacienta, který ze studie z jakéhokoli důvodu odstoupil. U pacientů, kteří dostávali pokračující léčbu Effexorem 37,5 mg XR, došlo během následujících 26 týdnů ke statisticky významně nižší míře relapsů ve srovnání s těmi, kteří dostávali placebo (studie 4).
Ve druhé dlouhodobější studii dospělí ambulantní pacienti s MDD, recidivujícího typu, kteří reagovali (celkové skóre HAM-D21 ≤ 12 při hodnocení 56. dne) a nadále se zlepšovali [definováno jako splněná následující kritéria pro dny 56 až 180 : (1) žádné HAM-D-21 celkové skóre ≥ 20; (2) ne více než 2 celková skóre HAM39 D-21 > 10 a (3) žádná jednotlivá CGI položka skóre závažnosti onemocnění ≥ 4 (středně nemocná)] během úvodních 26 týdnů léčby Effexorem [100 až 200 mg na den, v režimu dvakrát denně] byli randomizováni k pokračování ve stejné dávce Effexor nebo k placebu. Období sledování pacientů s ohledem na relaps, definované jako bodové skóre závažnosti onemocnění podle CGI ≥ 4, trvalo až 52 týdnů. Pacienti, kteří dostávali pokračující léčbu přípravkem Effexor, zaznamenali statisticky významně nižší míru relapsů během následujících 52 týdnů ve srovnání s těmi, kteří dostávali placebo (studie 5).
Generalizovaná úzkostná porucha
Účinnost Effexoru XR jako léčby generalizované úzkostné poruchy (GAD) byla stanovena ve dvou 8týdenních placebem kontrolovaných studiích s fixní dávkou (75 až 225 mg denně), jedné 6měsíční, placebem kontrolované, flexibilní - studie s dávkou (75 až 225 mg denně) a jedna 6měsíční, placebem kontrolovaná studie s fixní dávkou (37,5, 75 a 150 mg denně) u dospělých ambulantních pacientů splňujících kritéria DSM-IV pro GAD.
jedné 8týdenní studii Effexor XR prokázal převahu nad placebem u dávek 75, 150 a 225 mg za den, měřeno celkovým skóre Hamilton Rating Scale for Anxiety (HAM-A), úzkost a napětí HAM-A. položky a škála klinických globálních dojmů (CGI). Dávky 75 a 150 mg denně však nebyly tak konzistentně účinné jako nejvyšší dávka (studie 1). Druhá 8týdenní studie hodnotící dávky 75 a 150 mg denně a placebo ukázala, že obě dávky byly u některých stejných výsledků účinnější než placebo; dávka 75 mg denně však byla konzistentněji účinnější než dávka 150 mg denně (studie 2). Vztah mezi dávkou a odezvou pro účinnost u GAD nebyl jasně stanoven ve studovaném rozmezí dávek 75 až 225 mg za den.
Dvě 6měsíční studie, jedna hodnotící dávky Effexoru 75 mg XR 37,5, 75 a 150 mg denně (studie 3) a druhá hodnotící dávky Effexoru XR 75 až 225 mg denně (studie 4), ukázaly, že denní dávky 75 mg nebo vyšší byly během 6 měsíců léčby účinnější než placebo v HAM-A celkem, jak v položkách úzkosti a napětí HAM-A, tak na škále CGI. I když existovaly také důkazy pro lepší než placebo u dávky 37,5 mg denně, tato dávka nebyla tak konzistentně účinná jako vyšší dávky.
Zkoumání genderových podskupin studované populace neodhalilo žádnou rozdílnou citlivost na základě pohlaví.
Sociální úzkostná porucha (také známá jako sociální fobie)
Účinnost přípravku Effexor 37,5 mg XR jako léčby sociální úzkostné poruchy (SAD) byla stanovena ve čtyřech dvojitě zaslepených, 12týdenních, multicentrických, placebem kontrolovaných studiích s flexibilním dávkováním (studie 1-4) a jedna dvojitě zaslepená, s paralelními skupinami, 6měsíční, placebem kontrolovaná studie s fixní/flexibilní dávkou, která zahrnovala dávky v rozmezí 75 až 225 mg denně u dospělých ambulantních pacientů splňujících kritéria DSM-IV pro SAD (studie 5 ).
V těchto pěti studiích byl přípravek Effexor 75 mg XR statisticky významně účinnější než placebo při změně celkového skóre Liebowitzovy škály sociální úzkosti (LSAS) od výchozího k cílovému bodu. V 6měsíční studii nebyly žádné důkazy o větší účinnosti skupiny 150 až 225 mg denně ve srovnání se skupinou 75 mg denně.
Vyšetření podskupin studované populace neodhalilo žádnou rozdílnou citlivost na základě pohlaví. V těchto studiích nebyl dostatek informací k určení vlivu věku nebo rasy na výsledek.
Panická porucha
Účinnost přípravku Effexor XR jako léčby panické poruchy (PD) byla stanovena ve dvou dvojitě zaslepených, 12týdenních, multicentrických, placebem kontrolovaných studiích u dospělých ambulantních pacientů splňujících kritéria DSM-IV pro PD, s agorafobií nebo bez ní. Pacienti dostávali fixní dávky 75 nebo 150 mg denně v jedné studii (studie 1) a 75 nebo 225 mg denně ve druhé studii (studie 2).
Účinnost byla hodnocena na základě výsledků ve třech proměnných: (1) procento pacientů bez záchvatů paniky s úplnými příznaky na škále Panic and Anticipatory Anxiety Scale (PAAS); (2) průměrná změna od výchozí hodnoty k cílovému bodu na celkovém skóre na stupnici závažnosti panické poruchy (PDSS); a (3) procento pacientů hodnocených jako respondéři (hodně zlepšené nebo velmi zlepšené) na stupnici zlepšení klinických globálních dojmů (CGI). V těchto dvou studiích byl Effexor XR statisticky významně účinnější než placebo (pro každou fixní dávku) ve všech třech koncových bodech, ale vztah mezi dávkou a odezvou nebyl jasně stanoven.
Vyšetření podskupin studované populace neodhalilo žádnou rozdílnou citlivost na základě pohlaví. V těchto studiích nebyl dostatek informací k určení vlivu věku nebo rasy na výsledek.
dlouhodobější studii (studie 3) byli dospělí ambulantní pacienti splňující kritéria DSM-IV pro PD, kteří reagovali během 12týdenní otevřené fáze přípravkem Effexor 75 mg XR (75 až 225 mg denně), náhodně přiřazeni k pokračování ve stejném přípravku Effexor 75 mg dávku XR (75, 150 nebo 225 mg) nebo přejít na placebo pro pozorování relapsu za dvojitě zaslepených podmínek. Odpověď během otevřené fáze byla definována jako ≤ 1 panická ataka s plnými příznaky za týden během posledních 2 týdnů otevřené fáze a skóre zlepšení CGI 1 (velmi se zlepšilo) nebo 2 (výrazně se zlepšilo). Relaps během dvojitě zaslepené fáze byl definován jako 2 nebo více záchvatů paniky s plnými příznaky týdně po dobu 2 po sobě jdoucích týdnů nebo přerušení kvůli ztrátě účinnosti, jak určili výzkumníci během studie. Randomizovaní pacienti byli ve stavu odpovědi průměrně 34 dní před randomizací. V randomizované fázi, která následovala po 12týdenním otevřeném období, pacienti užívající pokračující Effexor 75 mg XR zaznamenali statisticky významně delší dobu do relapsu.
Pediatričtí pacienti
přípravkem Effexor XR byly provedeny dvě placebem kontrolované studie u 766 pediatrických pacientů s MDD a dvě placebem kontrolované studie u 793 pediatrických pacientů s GAD a údaje nebyly dostatečné pro podporu tvrzení o použití u pediatrických pacientů.
Co je Effexor a jak se používá?
Effexor je lék na předpis používaný k léčbě příznaků deprese, generalizované úzkosti, sociální úzkosti a panické poruchy. Effexor lze užívat samostatně nebo s jinými léky.
Effexor patří do třídy léků nazývaných antidepresiva, selektivní inhibitory zpětného vychytávání serotoninu a norepinefrinu (SNRI).
Jaké jsou možné vedlejší účinky přípravku Effexor 37,5 mg?
Effexor může způsobit závažné nežádoucí účinky včetně:
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halos kulatá světla,
- snadná tvorba modřin nebo krvácení (krvácení z nosu, krvácení z dásní),
- krev ve vaší moči nebo stolici,
- vykašlávání krve,
- kašel,
- tlak na hrudi,
- potíže s dýcháním,
- křeče (záchvaty),
- bolest hlavy,
- zmatek,
- nezřetelná řeč,
- těžká slabost,
- zvracení,
- ztráta koordinace,
- pocit nejistoty,
- velmi ztuhlé (tuhé) svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- otřesy a
- točení hlavy
- Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
- Mezi nejčastější vedlejší účinky přípravku Effexor patří:
- závrať,
- ospalost,
- úzkost,
- pocit nervozity,
- problémy se spánkem (nespavost),
- změny vidění,
- nevolnost,
- zvracení,
- průjem,
- změny hmotnosti nebo chuti k jídlu,
- suchá ústa,
- zívání,
- zvýšené pocení,
- snížená chuť na sex,
- impotence,
- abnormální ejakulace a
- potíže s orgasmem
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Effexor. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
Sebevražednost a antidepresiva
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití tablet venlafaxinu, USP nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. Tablety venlafaxinu, USP nejsou schváleny pro použití u dětských pacientů. (Vidět VAROVÁNÍ : Klinické zhoršení a riziko sebevraždy , INFORMACE PRO PACIENTA , a OPATŘENÍ : Pediatrické použití ).
POPIS
Tablety venlafaxinu, USP jsou strukturálně nové antidepresivum pro perorální podávání. Je označen (R/S)-1-[2-(dimethylamino)-1-(4-methoxyfenyl)ethyl]cyklohexanol hydrochlorid nebo (±)-1-[a-[(dimethyl-amino)methyl]-p- methoxybenzyl]cyklohexanol hydrochlorid a má empirický vzorec C17H27NO2 HC1. Jeho molekulová hmotnost je 313,87. Strukturní vzorec je uveden níže.
Venlafaxin hydrochlorid je bílá až téměř bílá krystalická pevná látka s rozpustností 572 mg/ml ve vodě (upraveno na iontovou sílu 0,2 M pomocí chloridu sodného). Jeho rozdělovací koeficient oktanol:voda (0,2 M chlorid sodný) je 0,43.
Lisované tablety obsahují venlafaxin hydrochlorid, USP ekvivalent 25 mg, 37,5 mg, 50 mg, 75 mg nebo 100 mg báze venlafaxinu a následující neaktivní složky: mikrokrystalická celulóza, monohydrát laktózy, předbobtnalý škrob, sodná sůl glykolátu škrobu, červený oxid železitý, žlutý oxid železitý, koloidní oxid křemičitý a stearát hořečnatý.
