Elavil 10mg, 25mg, 50mg Amitriptyline Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Elavil a jak se používá?
Elavil 10 mg je lék na předpis používaný k léčbě příznaků úzkosti nebo neklidu s depresí a schizofrenie s depresí. Elavil lze užívat samostatně nebo s jinými léky.
Elavil patří do třídy léků nazývaných psychoterapeutická komba.
Není známo, zda je přípravek Elavil bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Elavil 25 mg?
Elavil může způsobit závažné nežádoucí účinky, včetně:
- snadná tvorba modřin nebo krvácení,
- přetrvávající pálení žáhy,
- třes,
- mimika jako maska,
- svalové křeče,
- silná bolest žaludku,
- snížená sexuální touha,
- zvětšená nebo bolestivá prsa,
- černá stolice,
- zvratky, které vypadají jako kávová sedlina,
- silné závratě,
- mdloby,
- záchvaty,
- bolest oka, zarudnutí nebo otok,
- změny vidění,
- horečka,
- svalová ztuhlost,
- silný zmatek,
- pocení a
- rychlý nebo nepravidelný srdeční tep
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Elavil patří:
- ospalost,
- závrať,
- suchá ústa,
- rozmazané vidění,
- zácpa,
- přírůstek hmotnosti a
- potíže s močením
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Elavil. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Sebevražednost a antidepresiva
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití tablet amitriptylin-hydrochloridu nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. Tablety amitriptylin hydrochloridu nejsou schváleny pro použití u pediatrických pacientů (viz VAROVÁNÍ: Klinické zhoršení a riziko sebevraždy, INFORMACE PRO PACIENTA a BEZPEČNOSTNÍ OPATŘENÍ: Pediatrické použití.)
POPIS
Amitriptylin HC1 je 3-(10,11-dihydro-5H-dibenzo[a,d]cyklohepten-5-yliden)-N,N-dimethyl-1-propanamin hydrochlorid. Jeho empirický vzorec je C20H23N•HCl a jeho strukturní vzorec je:
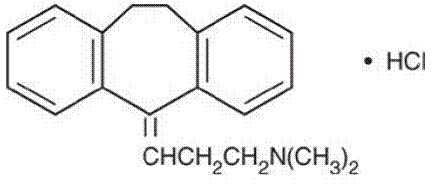
Amitriptylin HCl, derivát dibenzocykloheptadienu, má molekulovou hmotnost 313,87. Je to bílá krystalická sloučenina bez zápachu, která je volně rozpustná ve vodě.
Amitriptylin HCl se dodává jako 10 mg, 25 mg, 50 mg, 75 mg, 100 mg nebo 150 mg tablety. Každá tableta obsahuje následující neaktivní složky: koloidní oxid křemičitý, hypromelóza, monohydrát laktózy, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, polysorbát, sodná sůl glykolátu škrobu a oxid titaničitý. 10mg tablety také obsahují FD&C blue #1 lake. 25mg tablety také obsahují D&C yellow #10 lake a FD&C blue #2 lake. 50 mg tablety také obsahují syntetický černý oxid železitý, syntetický červený oxid železitý a syntetický žlutý oxid železitý. 75mg tablety také obsahují FD&C yellow #6 lake. 100mg tablety také obsahují D&C red #33 lake a FD&C red #40 lake. 150mg tablety také obsahují FD&C blue #2 lake a FD&C yellow #6 lake.
INDIKACE
Pro zmírnění příznaků deprese. Endogenní deprese bude pravděpodobněji zmírněna než jiné depresivní stavy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování by mělo být zahájeno na nízké úrovni a mělo by se postupně zvyšovat, přičemž je třeba pečlivě sledovat klinickou odpověď a jakékoli známky intolerance.
Počáteční dávkování pro dospělé
Pro ambulantní pacienty obvykle postačuje 75 mg amitriptylin HCl denně v rozdělených dávkách. V případě potřeby může být tato dávka zvýšena na celkovou dávku 150 mg denně. Zvýšení dávek se provádí přednostně pozdě odpoledne a/nebo před spaním. Sedativní účinek může být zřejmý dříve, než je zaznamenán antidepresivní účinek, ale vývoj adekvátního terapeutického účinku může trvat až 30 dní.
Alternativní metodou zahájení terapie u ambulantních pacientů je začít s 50 až 100 mg amitriptylinu HCl před spaním. Tuto dávku lze podle potřeby zvýšit o 25 nebo 50 mg v dávce před spaním až na celkovou dávku 150 mg denně.
Hospitalizovaní pacienti mohou zpočátku vyžadovat 100 mg denně. V případě potřeby lze dávku postupně zvyšovat na 200 mg denně. Malý počet hospitalizovaných pacientů může potřebovat až 300 mg denně.
Dospívající A Starší Pacienti
Obecně se pro tyto pacienty doporučují nižší dávky. 10 mg 3krát denně s 20 mg před spaním může být uspokojivé u dospívajících a starších pacientů, kteří netolerují vyšší dávky.
Údržba
Obvyklá udržovací dávka amitriptylinu HCl je 50 až 100 mg denně. U některých pacientů stačí 40 mg denně. Pro udržovací terapii může být celková denní dávka podána v jedné dávce, výhodně před spaním. Když bylo dosaženo uspokojivého zlepšení, dávka by měla být snížena na nejnižší množství, které udrží úlevu od příznaků. Je vhodné pokračovat v udržovací léčbě 3 měsíce nebo déle, aby se snížila možnost relapsu.
Použití u pediatrických pacientů
Vzhledem k nedostatku zkušeností s používáním tohoto léku u dětských pacientů se v současné době nedoporučuje u pacientů do 12 let.
Plazmatické hladiny
Vzhledem k velkým rozdílům v absorpci a distribuci tricyklických antidepresiv v tělesných tekutinách je obtížné přímo korelovat plazmatické hladiny a terapeutický účinek. Stanovení plazmatických hladin však může být užitečné při identifikaci pacientů, kteří se zdají mít toxické účinky a mohou mít nadměrně vysoké hladiny, nebo pacientů, u kterých existuje podezření na nedostatek absorpce nebo noncompliance. Vzhledem k prodloužené době střevního průchodu a sníženému metabolismu v játrech u starších pacientů jsou plazmatické hladiny obecně vyšší pro podanou perorální dávku amitriptylin-hydrochloridu než u mladších pacientů.
Starší pacienti by měli být pečlivě sledováni a kvantitativní sérové hladiny by měly být stanoveny podle klinicky vhodného stavu. Úprava dávkování by měla být provedena podle klinické odpovědi pacienta, nikoli na základě plazmatických hladin.**
JAK DODÁVÁNO
10 mg tablety jsou modré, kulaté, nerýhované, potahované tablety, s vyraženým „2101“ na jedné straně a vyraženým „V“ na druhé straně. Dodávají se následovně:
Láhve po 30: NDC 0603-2212-16 Láhve po 90: NDC 0603-2212-02 Láhve po 100: NDC 0603-2212-21 Láhve po 1000: NDC 0603-2212-32
25 mg tablety jsou žluté, kulaté, nerýhované, potahované tablety, s vyraženým „2102“ na jedné straně a vyraženým „V“ na druhé straně. Dodávají se následovně:
Láhve po 90: NDC 0603-2213-02 Láhve po 100: NDC 0603-2213-21 Láhve po 1000: NDC 0603-2213-32 Láhve po 2500: NDC 0603-2213-30
50 mg tablety jsou béžové, kulaté, nerýhované, potahované tablety, s vyraženým „2103“ na jedné straně a vyraženým „V“ na druhé straně. Dodávají se následovně:
Láhve po 100: NDC 0603-2214-21 Láhve po 1000: NDC 0603-2214-32
75 mg tablety jsou oranžové, kulaté, nerýhované, potahované tablety, s vyraženým „2104“ a „V“. Dodávají se následovně:
Láhve po 100: NDC 0603-2215-21 Láhve po 300: NDC 0603-2215-25
100 mg tablety jsou fialové, kulaté, nerýhované, potahované tablety s vyraženým „2105“ a „V“. Dodávají se následovně:
Láhve po 100: NDC 0603-2216-21 Láhve po 300: NDC 0603-2216-25
150 mg tablety jsou modré potahované tablety ve tvaru tobolky, bez rýhy, s vyraženým „2106“ na jedné straně a vyraženým „V“ na druhé straně. Dodávají se následovně:
Láhve po 100: NDC 0603-2217-21 Láhve po 300: NDC 0603-2217-25
Skladování A Manipulace
Úložný prostor
Skladujte v dobře uzavřené nádobě. Skladujte při teplotě 20°-25°C (68°-77°F) [viz USP řízená pokojová teplota ]. Kromě toho musí být amitriptylinové tablety chráněny před světlem a skladovány v dobře uzavřené nádobě odolné proti světlu
REFERENCE
Ayd FJ Jr: Amitriptylinová terapie pro depresivní reakce. Psychosomatika 1960;1:320–325.
Diamond S: Lidský metabolizátor amitriptylinu označeného uhlíkem 14. Curr Ther Res, březen 1965, str. 170–175.
Dorfman W: Klinické zkušenosti s amitriptylinem: Předběžná zpráva. Psychosomatika 1960;1:153– 155.
Fallette JM, Stasney ČR, Mintz AA: Otrava amitriptylinem léčená fysostigminem. South Med J 1970;63:1492–1493.
Hollister LE, Total JE, Johnson M, et al: Kontrolované srovnání amitriptylinu, imipraminu a placeba u hospitalizovaných pacientů s depresí. J Nerv Ment Dis 1964;139:370–375.
Hordern A, Burt CG, Holt NF: Depresivní stavy: farmakoterapeutická studie, studie Springfield. Springfield, Ill, Charles C. Thomas, 1965. Jenike MA: Léčba afektivní nemoci u starších lidí pomocí léků a elektrokonvulzivní terapie. J Geriatr Psychiatry 1989; 22(1):77–112.
Klerman GL, Cole JO: Klinická farmakologie imipraminu a příbuzných antidepresiv. Int J Psychiatry 1976;3:267–304.
Liu B, Anderson G, Mittman N, et al: Použití selektivních inhibitorů zpětného vychytávání serotoninu nebo tricyklických antidepresiv a riziko zlomenin kyčle u starších lidí. Lancet 1998; 351(9112):1303–1307.
McConaghy N, Joffe AD, Kingston WA, et al: Korelace klinických znaků ambulantních pacientů s depresí s odpovědí na amitriptylin a protriptylin. Br J Psychiatry 1968;114:103–106.
McDonald IM, Perkins M, Marjerrison G, et al: Kontrolované srovnání amitriptylinu a elektrokonvulzivní terapie v léčbě deprese. Am J Psychiatry 1966;122:1427–1431.
Slovis T, Ott J, Teitelbaum D, et al: Fyzostigminová terapie při akutní otravě tricyklickými antidepresivy. Clin Toxicol 1971;4:451–459.
Symposium o depresi se speciálními studiemi nového antidepresiva, amitriptylinu. Dis Nerv Syst, (2. část) květen 1961, str. 5–56.
*Na základě maximální doporučené dávky amitriptylinu 150 mg/den nebo 3 mg/kg/den pro pacienta s hmotností 50 kg.
**Hollister LE: Monitorování plazmatických koncentrací tricyklických antidepresiv. JAMA 1979; 241(23):2530–2533.
Elavil 25 mg tablety jsou žluté, kulaté, nerýhované, potahované tablety, s vyraženým „2102“ na jedné straně a vyraženým „V“ na druhé straně. Dodávají se následovně: Láhve po 100: NDC 69874-422-10
Výrobce: Qualitest Pharmaceuticals/Vintage Pharmaceuticals, Huntsville, AL 35811. Výrobce: Thompson Medical Solutions, Birmingham, AL 35242. Revize: duben 2016
VEDLEJŠÍ EFEKTY
Nebyly poskytnuty žádné informaceDROGOVÉ INTERAKCE
Léky metabolizované P450 2D6
Biochemická aktivita izozymu cytochromu P450 2D6 (debrisochin hydroxyláza) metabolizujícího léčivo je u podskupiny kavkazské populace snížena (asi 7 až 10 % bělochů jsou tzv. „špatní metabolizátoři“); spolehlivé odhady prevalence snížené aktivity isozymu P450 2D6 mezi asijskými, africkými a dalšími populacemi zatím nejsou k dispozici. Špatní metabolizátoři mají při podávání obvyklých dávek vyšší plazmatické koncentrace tricyklických antidepresiv (TCA), než se očekávalo. V závislosti na frakci léčiva metabolizovaného P450 2D6 může být zvýšení plazmatické koncentrace malé nebo poměrně velké (8násobné zvýšení plazmatické AUC TCA).
Některá léčiva navíc inhibují aktivitu tohoto isozymu a dělají normální metabolizátory podobné pomalým metabolizátorům. Jednotlivec, který je stabilní na dané dávce TCA, se může stát náhle toxickým, když je mu současně podáván jeden z těchto inhibičních léků. Mezi léky, které inhibují cytochrom P450 2D6, patří některé, které nejsou metabolizovány enzymem (chinidin; cimetidin) a mnohé, které jsou substráty pro P450 2D6 (mnoho dalších antidepresiv, fenothiaziny a antiarytmika typu 1C propafenon a flekainid). Zatímco všechny selektivní inhibitory zpětného vychytávání serotoninu (SSRI), např. fluoxetin, sertralin a paroxetin, inhibují P450 2D6, mohou se lišit v rozsahu inhibice. Rozsah, v jakém mohou interakce SSRI-TCA představovat klinické problémy, bude záviset na stupni inhibice a farmakokinetice příslušného SSRI. Přesto je třeba opatrnosti při současném podávání TCA s kterýmkoli ze SSRI a také při přechodu z jedné třídy na druhou. Obzvláště důležité je, že před zahájením léčby TCA u pacienta, kterému je fluoxetin vysazen, musí uplynout dostatečná doba vzhledem k dlouhému poločasu mateřského a aktivního metabolitu (může být zapotřebí alespoň 5 týdnů).
Současné užívání tricyklických antidepresiv s léky, které mohou inhibovat cytochrom P450 2D6, může vyžadovat nižší dávky, než jsou obvykle předepisovány buď pro tricyklické antidepresivum, nebo pro jiný lék. Kromě toho, kdykoli je jedno z těchto dalších léků vysazeno z souběžné léčby, může být vyžadována zvýšená dávka tricyklického antidepresiva. Je žádoucí monitorovat plazmatické hladiny TCA, kdykoli se má TCA podávat společně s jiným lékem, o kterém je známo, že je inhibitorem P450 2D6.
Inhibitory monoaminoxidázy
Vidět KONTRAINDIKACE sekce. Guanethidin nebo podobně působící sloučeniny; léky na štítnou žlázu; alkohol, barbituráty a další látky tlumící CNS; a disulfiram – viz VAROVÁNÍ sekce. Pokud je amitriptylin-hydrochlorid podáván s anticholinergními látkami nebo sympatomimetiky, včetně adrenalinu v kombinaci s lokálními anestetiky, je nutný pečlivý dohled a pečlivá úprava dávkování.
Hyperpyrexie byla hlášena při podávání amitriptylin-hydrochloridu s anticholinergiky nebo s neuroleptiky, zejména během horkého počasí.
U pacientů užívajících tricyklická antidepresiva v kombinaci s léky anticholinergního typu se může objevit paralytický ileus.
Udává se, že cimetidin snižuje jaterní metabolismus určitých tricyklických antidepresiv, čímž zpomaluje eliminaci a zvyšuje ustálené koncentrace těchto léků. Klinicky významné účinky byly hlášeny u tricyklických antidepresiv při současném užívání s cimetidinem. Po přidání cimetidinu do léčebného režimu bylo hlášeno zvýšení plazmatických hladin tricyklických antidepresiv a zvýšení frekvence a závažnosti nežádoucích účinků, zejména anticholinergik. Vysazení cimetidinu u dobře kontrolovaných pacientů užívajících tricyklická antidepresiva a cimetidin může snížit plazmatické hladiny a účinnost antidepresiv.
Pokud pacienti dostávají současně velké dávky ethchlorvynolu, doporučuje se opatrnost. Přechodné delirium bylo hlášeno u pacientů, kteří byli léčeni jedním gramem ethchlorvynolu a 75 až 150 mg amitriptylin-hydrochloridu.
VEDLEJŠÍ EFEKTY
V každé kategorii jsou uvedeny následující nežádoucí účinky v pořadí klesající závažnosti. V seznamu je zahrnuto několik nežádoucích účinků, které nebyly u tohoto konkrétního léku hlášeny. Farmakologické podobnosti mezi tricyklickými antidepresivy však vyžadují, aby byla při podávání amitriptylinu zvážena každá z reakcí.
Kardiovaskulární: Infarkt myokardu; mrtvice; nespecifické změny EKG a změny AV vedení; srdeční blok; arytmie; hypotenze, zejména ortostatická hypotenze; synkopa; hypertenze; tachykardie; palpitace.
CNS a neuromuskulární: Kóma; záchvaty; halucinace; klam; stavy zmatenosti; dezorientace; nekoordinovanost; ataxie; třes; periferní neuropatie; necitlivost, brnění a parestézie končetin; extrapyramidové symptomy včetně abnormálních mimovolních pohybů a tardivní dyskineze; dysartrii; narušená koncentrace; vzrušení; úzkost; nespavost; neklid; noční můry; ospalost; závrať; slabost; únava; bolest hlavy; syndrom nepřiměřené sekrece ADH (antidiuretického hormonu); tinnitus; změna obrazců EEG.
Anticholinergní: Paralytický ileus; hyperpyrexie; zadržování moči; dilatace močových cest; zácpa; rozmazané vidění, porucha akomodace, zvýšený oční tlak, mydriáza; suchá ústa.
Alergický: Vyrážka; kopřivka; fotosenzibilizace; edém obličeje a jazyka.
Hematologické: útlum kostní dřeně včetně agranulocytózy, leukopenie, trombocytopenie; purpura; eozinofilie.
Gastrointestinální: Vzácně hepatitida (včetně změněné funkce jater a žloutenky); nevolnost; epigastrické potíže; zvracení; anorexie; stomatitida; zvláštní chuť; průjem; otok příušní žlázy; černý jazyk.
Endokrinní: otok varlat a gynekomastie u mužů; zvětšení prsou a galaktorea u žen; zvýšené nebo snížené libido; impotence; zvýšení a snížení hladiny cukru v krvi.
Jiný: alopecie; otok; přírůstek nebo ztráta hmotnosti; frekvence močení; zvýšené pocení.
Abstinenční příznaky: Po delším podávání může náhlé ukončení léčby vyvolat nevolnost, bolest hlavy a malátnost. Bylo hlášeno, že postupné snižování dávky vyvolalo během dvou týdnů přechodné příznaky včetně podrážděnosti, neklidu a poruch snů a spánku.
Tyto příznaky nenaznačují závislost. Vzácně byly hlášeny případy mánie nebo hypománie, ke kterým došlo během 2 až 7 dnů po ukončení chronické léčby tricyklickými antidepresivy.
Příčinná souvislost neznámá: Další reakce hlášené za okolností, kdy nebylo možné stanovit příčinnou souvislost, jsou uvedeny jako varovné informace pro lékaře.
Tělo jako celek: Lupus-like syndrom (migrační artritida, pozitivní ANA a revmatoidní faktor).
Zažívací: Jaterní selhání, ageuzie.
Postmarketingové nežádoucí příhody
Syndrom připomínající neuroleptický maligní syndrom (NMS) byl velmi vzácně hlášen po zahájení nebo zvýšení dávky amitriptylin-hydrochloridu, a to se souběžnými léky, o nichž je známo, že způsobují NMS, nebo bez nich. Symptomy zahrnovaly svalovou rigiditu, horečku, změny duševního stavu, pocení, tachykardii a třes.
Velmi vzácné případy serotoninového syndromu (SS) byly hlášeny u amitriptylin-hydrochloridu v kombinaci s jinými léky, které mají známou souvislost s SS.
U amitriptylinu byly hlášeny velmi vzácné případy kardiomyopatie.
VAROVÁNÍ
Klinické zhoršení a riziko sebevraždy
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a dalších) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (1824 let) s velkou depresivní poruchou ( MDD) a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl lék-placebo v počtu případů sebevraždy na 1000 léčených pacientů) jsou uvedeny v tabulce 1.
žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými se vyskytly sebevraždy, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky. popsané výše, stejně jako vznik suicidality a takové příznaky okamžitě hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro tablety amitriptylin-hydrochloridu by měly být napsány pro nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese. Je třeba poznamenat, že tablety amitriptylin hydrochloridu nejsou schváleny pro použití při léčbě bipolární deprese.
Amitriptylin-hydrochlorid může blokovat antihypertenzní účinek guanethidinu nebo podobně působících sloučenin.
Měl by být používán s opatrností u pacientů s anamnézou záchvatů a vzhledem k jeho účinku podobnému atropinu u pacientů s anamnézou retence moči nebo glaukomu s uzavřeným úhlem. U pacientů s glaukomem s uzavřeným úhlem mohou dokonce i průměrné dávky vyvolat záchvat.
Pacienti s kardiovaskulárními poruchami by měli být pečlivě sledováni. Bylo hlášeno, že tricyklická antidepresiva, včetně amitriptylin-hydrochloridu, zejména při podávání ve vysokých dávkách, způsobují arytmie, sinusovou tachykardii a prodlužují dobu převodu. U léků této třídy byl hlášen infarkt myokardu a cévní mozková příhoda.
Při podávání amitriptylin-hydrochloridu pacientům s hypertyreózou nebo těm, kteří dostávají léky na štítnou žlázu, je nutný pečlivý dohled.
Amitriptylin-hydrochlorid může zvýšit reakci na alkohol a účinky barbiturátů a jiných látek tlumících CNS. U pacientů, kteří mohou nadměrně konzumovat alkohol, je třeba mít na paměti, že potenciace může zvýšit nebezpečí spojené s jakýmkoli pokusem o sebevraždu nebo předávkováním. Při současném podávání amitriptylinu a disulfiramu bylo hlášeno delirium.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv, včetně tablet amitriptylin hydrochloridu, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii.
Použití v těhotenství
Kategorie těhotenství C
Teratogenní účinky nebyly pozorovány u myší, potkanů nebo králíků, když byl amitriptylin podáván perorálně v dávkách 2 až 40 mg/kg/den (až 13násobek maximální doporučené dávky pro člověka*). Studie v literatuře ukázaly, že amitriptylin je teratogenní u myší a křečků, když je podáván různými způsoby podávání v dávkách 28 až 100 mg/kg/den (9 až 33násobek maximální doporučené dávky pro člověka), což vede k četným malformacím. Jiná studie na potkanech uvedla, že perorální dávka 25 mg/kg/den (8násobek maximální doporučené dávky pro člověka) způsobila zpoždění v osifikaci obratlových těl plodů bez dalších známek embryotoxicity. U králíků bylo hlášeno, že perorální dávka 60 mg/kg/den (20násobek maximální doporučené dávky pro člověka) způsobila neúplnou osifikaci lebečních kostí.
Bylo prokázáno, že amitriptylin prochází placentou. Ačkoli příčinná souvislost nebyla prokázána, bylo hlášeno několik nežádoucích účinků, včetně účinků na CNS, deformací končetin nebo opožděného vývoje, u kojenců, jejichž matky užívaly amitriptylin během těhotenství. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Amitriptylin-hydrochlorid by měl být během těhotenství podáván pouze v případě, že potenciální přínos pro matku ospravedlňuje potenciální riziko pro plod.
Kojící matky
Amitriptylin se vylučuje do mateřského mléka. V jedné zprávě, ve které pacientka dostávala amitriptylin 100 mg/den během kojení svého dítěte, byly v séru matky detekovány hladiny 83 až 141 ng/ml. V mateřském mléce byly nalezeny hladiny 135 až 151 ng/ml, ale v séru kojence nebylo možné detekovat žádné stopy léku.
Vzhledem k potenciálu závažných nežádoucích účinků amitriptylinu u kojených dětí je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Použití u pediatrických pacientů
Vzhledem k nedostatku zkušeností s používáním tohoto léku u dětských pacientů se v současné době nedoporučuje u pacientů do 12 let.
OPATŘENÍ
U pacientů se schizofrenií se mohou vyvinout zvýšené příznaky psychózy; pacienti s paranoidní symptomatologií mohou mít tyto symptomy přehnané. U pacientů s depresí, zejména u pacientů se známým maniodepresivním onemocněním, může dojít k posunu do mánie nebo hypománie. Za těchto okolností může být dávka amitriptylinu snížena nebo může být souběžně podáván hlavní trankvilizér, jako je perfenazin.
Možnost sebevraždy u pacientů s depresí zůstává, dokud nedojde k významné remisi. Potenciálně sebevražední pacienti by neměli mít přístup k velkému množství tohoto léku. Předpisy by měly být napsány na nejmenší možné množství.
Současné podávání amitriptylin hydrochloridu a terapie elektrošoky může zvýšit rizika spojená s takovou terapií. Taková léčba by měla být omezena na pacienty, pro které je nezbytná.
Pokud je to možné, lék by měl být vysazen několik dní před plánovaným chirurgickým zákrokem.
Bylo hlášeno jak zvýšení, tak snížení hladiny cukru v krvi.
Amitriptylin-hydrochlorid by měl být používán s opatrností u pacientů s poruchou funkce jater.
Informace pro pacienty
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o výhodách a rizicích spojených s léčbou tabletami amitriptylin-hydrochloridu a měli by jim poradit, jak správně používat. Pacient Průvodce léky „antidepresivních lécích, depresi a jiných vážných duševních onemocněních a sebevražedných myšlenkách nebo akcích“ je k dispozici pro tablety amitriptylin-hydrochloridu. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Průvodce léky a měl by jim pomoci pochopit jeho obsah. Pacienti by měli dostat příležitost prodiskutovat obsah tohoto dokumentu Průvodce léky a získat odpovědi na případné otázky. Kompletní text Průvodce léky je přetištěno na konci tohoto dokumentu.
Pacienti by měli být informováni o následujících problémech a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání tablet amitriptylin-hydrochloridu.
Během léčby amitriptylin-hydrochloridem by pacienti měli být poučeni o možném poškození mentálních a/nebo fyzických schopností nezbytných pro provádění nebezpečných činností, jako je obsluha strojů nebo řízení motorových vozidel.
Pacienty je třeba upozornit, že užívání tablet amitriptylin-hydrochloridu může způsobit mírnou dilataci papily, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a pokud jsou citliví, podstoupí profylaktický postup (např. iridektomie).
Klinické zhoršení a riziko sebevraždy
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Rodiny a pečovatelé pacientů by měli být poučeni, aby každý den hledali výskyt těchto příznaků, protože změny mohou být náhlé. Takové příznaky by měly být hlášeny pacientovu předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, začínají náhle nebo nejsou součástí pacientových příznaků. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě.
Pediatrické použití
Bezpečnost a účinnost u pediatrické populace nebyla stanovena (viz BOX VAROVÁNÍ a VAROVÁNÍ - Klinické zhoršení a riziko sebevraždy ). Každý, kdo zvažuje použití tablet amitriptylin-hydrochloridu u dětí nebo dospívajících, musí vyvážit potenciální rizika s klinickou potřebou.
Geriatrické použití
Klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně platí, že výběr dávky pro staršího pacienta by měl být opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, souběžného onemocnění a jiné lékové terapie u starších pacientů.
Starší pacienti jsou zvláště citliví na anticholinergní vedlejší účinky tricyklických antidepresiv včetně amitriptylin hydrochloridu. Mezi periferní anticholinergní účinky patří tachykardie, retence moči, zácpa, sucho v ústech, rozmazané vidění a exacerbace glaukomu s úzkým úhlem. Anticholinergní účinky na centrální nervový systém zahrnují kognitivní poruchy, psychomotorické zpomalení, zmatenost, sedaci a delirium. U starších pacientů užívajících amitriptylin-hydrochlorid může být zvýšené riziko pádů. Starší pacienti by měli začít s nízkými dávkami amitriptylin-hydrochloridu a měli by je pečlivě sledovat (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
PŘEDÁVKOVAT
důsledku předávkování touto třídou léků může dojít k úmrtí. Při úmyslném předávkování tricyklickými antidepresivy je běžné požití více drog (včetně alkoholu). Vzhledem k tomu, že řízení je složité a mění se, doporučuje se, aby lékař kontaktoval toxikologické centrum pro aktuální informace o léčbě. Příznaky a příznaky toxicity se rychle rozvíjejí po předávkování tricyklickými antidepresivy; proto je co nejdříve vyžadováno monitorování v nemocnici.
Projevy
Mezi kritické projevy předávkování patří: srdeční dysrytmie, těžká hypotenze, křeče a deprese CNS, včetně kómatu. Změny na elektrokardiogramu, zejména v ose nebo šířce QRS, jsou klinicky významnými indikátory toxicity tricyklických antidepresiv. Navíc posun osy vpravo v terminálním QRS komplexu spolu s prodlouženým QT intervalem a sinusovou tachykardií jsou specifické a citlivé indikátory předávkování tricyklickými látkami první generace. Absence těchto zjištění není vylučující. Může se také objevit prodloužený PR interval, změny ST-T vlny, komorová tachykardie a fibrilace.
Další příznaky předávkování mohou zahrnovat: zhoršenou kontraktilitu myokardu, zmatenost, poruchy koncentrace, přechodné zrakové halucinace, rozšířené zornice, poruchy oční motility, agitovanost, hyperaktivní reflexy, polyradikuloneuropatii, strnulost, ospalost, svalovou ztuhlost, zvracení, hypotermii, hyperpyrexii nebo jiné příznaků uvedených v části NEŽÁDOUCÍ ÚČINKY.
Řízení
Všeobecné
Získejte EKG a okamžitě zahajte monitorování srdce. Chraňte pacientovy dýchací cesty, zaveďte intravenózní hadičku a zahajte dekontaminaci žaludku. Je nutné minimálně šest hodin sledování s monitorováním srdce a sledováním známek CNS nebo respirační deprese, hypotenze, srdečních dysrytmií a/nebo převodních bloků a záchvatů. Pokud se kdykoli během tohoto období objeví známky toxicity, je nutné dlouhodobé sledování. Existují kazuistiky pacientů, kteří podlehli fatálním dysrytmiím pozdě po předávkování; tito pacienti měli před smrtí klinické známky významné otravy a většina z nich byla dekontaminována gastrointestinálním traktem. Sledování plazmatických hladin léčiva by nemělo vést k léčbě pacienta.
Gastrointestinální dekontaminace
Všichni pacienti s podezřením na předávkování tricyklickými antidepresivy by měli dostat gastrointestinální dekontaminaci. To by mělo zahrnovat výplach žaludku ve velkém objemu následovaný aktivním uhlím. Pokud je vědomí narušeno, je třeba před výplachem zajistit dýchací cesty. EMESIS JE KONTRAINDIKOVANÁ.
Kardiovaskulární
Maximální trvání QRS z končetiny ≥ 0,10 sekundy může být nejlepším ukazatelem závažnosti předávkování. K udržení pH séra v rozmezí 7,45 až 7,55 by měl být použit intravenózní hydrogenuhličitan sodný. Pokud je reakce na pH nedostatečná, lze také použít hyperventilaci. Současné užívání hyperventilace a bikarbonátu sodného by mělo být prováděno s extrémní opatrností, s častým monitorováním Ph. pH > 7,60 nebo pCO2
Ve vzácných případech může být hemoperfuze prospěšná při akutní refrakterní kardiovaskulární nestabilitě u pacientů s akutní toxicitou. Nicméně hemodialýza, peritoneální dialýza, výměnné transfuze a forsírovaná diuréza byly obecně hlášeny jako neúčinné při otravě tricyklickými antidepresivy.
CNS
U pacientů s útlumem CNS se doporučuje časná intubace kvůli možnosti náhlého zhoršení. Záchvaty by měly být kontrolovány benzodiazepiny, nebo pokud jsou neúčinné, jinými antikonvulzivními látkami (např. fenobarbitalem, fenytoinem).
Fysostigmin se nedoporučuje kromě léčby život ohrožujících příznaků, které nereagují na jiné terapie, a to pouze po konzultaci s toxikologickým centrem.
Psychiatrické sledování
Vzhledem k tomu, že předávkování je často záměrné, mohou se pacienti během fáze zotavení pokusit o sebevraždu jinými způsoby. Vhodné může být doporučení psychiatra.
Pediatrický management
Principy léčby předávkování u dětí a dospělých jsou podobné. Důrazně se doporučuje, aby lékař kontaktoval místní toxikologické centrum pro konkrétní pediatrickou léčbu.
KONTRAINDIKACE
Amitriptylin-hydrochlorid je kontraindikován u pacientů, kteří na něj dříve vykazovali přecitlivělost. Neměl by být podáván současně s inhibitory monoaminooxidázy. U pacientů užívajících současně tricyklická antidepresiva a léky inhibující monoaminooxidázu se vyskytly hyperpyretické krize, těžké křeče a úmrtí. Je-li žádoucí nahradit inhibitor monoaminooxidázy amitriptylin hydrochloridem, mělo by po ukončení jeho podávání uplynout minimálně 14 dní. Léčba amitriptylin-hydrochloridem by pak měla být zahájena opatrně s postupným zvyšováním dávky, dokud není dosaženo optimální odpovědi.
Amitriptylin-hydrochlorid by neměl být podáván s cisapridem kvůli možnému prodloužení QT intervalu a zvýšenému riziku arytmie.
Tento lék se nedoporučuje používat během akutní fáze zotavení po infarktu myokardu.
KLINICKÁ FARMAKOLOGIE
Amitriptylin hydrochlorid je antidepresivum se sedativními účinky. Mechanismus jeho účinku u člověka není znám. Nejedná se o inhibitor monoaminooxidázy a nepůsobí primárně stimulací centrálního nervového systému.
Amitriptylin inhibuje mechanismus membránové pumpy odpovědný za vychytávání norepinefrinu a serotoninu v adrenergních a serotonergních neuronech. Farmakologicky může tento účinek zesílit nebo prodloužit aktivitu neuronů, protože zpětné vychytávání těchto biogenních aminů je fyziologicky důležité pro ukončení přenosové aktivity. Někteří věří, že tato interference se zpětným vychytáváním norepinefrinu a/nebo serotoninu je základem antidepresivní aktivity amitriptylinu.
Metabolismus
Studie u člověka po perorálním podání léčiva značeného 14C ukázaly, že amitriptylin je rychle absorbován a metabolizován. Radioaktivita plazmy byla prakticky zanedbatelná, i když významné množství radioaktivity se objevilo v moči za 4 až 6 hodin a polovina až jedna třetina léku byla vyloučena během 24 hodin.
Amitriptylin je metabolizován N-demethylací a můstkovou hydroxylací u člověka, králíka a potkana. Prakticky celá dávka je vylučována jako glukuronidový nebo sulfátový konjugát metabolitů, přičemž v moči se objevuje malé množství nezměněného léku. Mohou být zapojeny další metabolické cesty.
INFORMACE PRO PACIENTA
Antidepresiva, deprese a jiné závažné duševní choroby a sebevražedné myšlenky nebo činy
Přečtěte si Příručku o medikaci, která je dodávána s vámi nebo s antidepresivy vašeho člena rodiny. Tato příručka o medikaci je pouze o riziku sebevražedných myšlenek a činů s antidepresivy. Promluvte si se svým poskytovatelem zdravotní péče nebo s poskytovatelem zdravotní péče o:
- všechna rizika a přínosy léčby antidepresivy
- všechny možnosti léčby deprese nebo jiné vážné duševní choroby
Jaké jsou nejdůležitější informace, které bych měl vědět o antidepresivech, depresi a jiných vážných duševních onemocněních a sebevražedných myšlenkách nebo akcích?
- Věnujte zvýšenou pozornost všem změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Dodržujte všechny následné návštěvy u poskytovatele zdravotní péče podle plánu. Zavolejte poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte poskytovatele zdravotní péče, pokud máte vy nebo váš rodinný příslušník některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- myšlenky na sebevraždu nebo smrt
- pokusy o sebevraždu
- nová nebo horší deprese
- nová nebo horší úzkost
- pocit velkého rozrušení nebo neklidu
- panický záchvat
- potíže se spánkem (nespavost)
- nová nebo horší podrážděnost
- chovat se agresivně, být naštvaný nebo násilný
- působící na nebezpečné impulsy
- extrémní nárůst aktivity a mluvení (mánie)
- jiné neobvyklé změny v chování nebo náladě
- Problémy se zrakem: bolest oka, změny vidění, otok nebo zarudnutí v oku nebo v jeho okolí
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili s poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Vizuální problémy. Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité probrat všechna rizika léčby deprese a také rizika její neléčení. Pacienti a jejich rodiny nebo jiní pečovatelé by měli s poskytovatelem zdravotní péče diskutovat o všech možnostech léčby, nejen o užívání antidepresiv.
- Antidepresiva mají další vedlejší účinky. Promluvte si s poskytovatelem zdravotní péče o vedlejších účincích léku předepsaného vám nebo vašemu rodinnému příslušníkovi.
- Antidepresiva mohou interagovat s jinými léky . Znát všechny léky, které užíváte vy nebo váš rodinný příslušník. Uchovávejte seznam všech léků, abyste je mohli ukázat poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
- Ne všechna antidepresiva předepisovaná dětem jsou schválena FDA pro použití u dětí. Pro více informací se poraďte s poskytovatelem zdravotní péče vašeho dítěte.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv pro všechna antidepresiva.
