Wellbutrin 150mg, 300mg Bupropion Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Wellbutrin 150 mg a jak se používá?
Wellbutrin 150 mg je lék na předpis používaný k léčbě příznaků velké deprese a sezónní afektivní poruchy. Wellbutrin 150 mg lze užívat samostatně nebo s jinými léky.
Wellbutrin 150 mg patří do třídy léků nazývaných antidepresiva, inhibitory zpětného vychytávání dopaminu, antidepresiva, jiné, pomůcky na odvykání kouření.
Jaké jsou možné vedlejší účinky přípravku Wellbutrin 150 mg?
Wellbutrin může způsobit závažné nežádoucí účinky, včetně:
- záchvat (křeče),
- zmatek,
- neobvyklé změny nálady nebo chování,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halo kolem světel,
- rychlý nebo nepravidelný srdeční tep,
- závodní myšlenky,
- zvýšená energie,
- bezohledné chování,
- cítit se extrémně šťastný nebo podrážděný,
- mluví více než obvykle a
- vážné problémy se spánkem
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Wellbutrin patří:
- suchá ústa,
- ucpaný nos,
- problémy se zrakem,
- problémy se sluchem,
- nevolnost,
- zvracení,
- zácpa,
- problémy se spánkem (nespavost),
- třes,
- pocení,
- pocit úzkosti nebo nervozity,
- rychlé tepy,
- zmatek,
- míchání,
- nepřátelství,
- vyrážka,
- bolest hlavy,
- závratě a
- bolest kloubů
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Wellbutrinu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088
VAROVÁNÍ
SEBEvražedné myšlenky a chování
SEBEVRAŽDA A ANTIDEPRESIVA
Antidepresiva v krátkodobých studiích zvyšovala riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých. Tyto studie neprokázaly zvýšení rizika sebevražedných myšlenek a chování při užívání antidepresiv u subjektů starších 24 let; došlo ke snížení rizika při užívání antidepresiv u subjektů ve věku 65 let a starších (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
pacientů všech věkových kategorií, u kterých byla zahájena léčba antidepresivy, pečlivě sledujte, zda nedochází ke zhoršení a výskytu sebevražedných myšlenek a chování. Informujte rodiny a pečovatele o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
POPIS
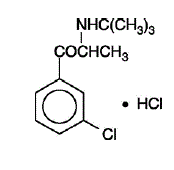
WELLBUTRIN (bupropion hydrochlorid), antidepresivum třídy aminoketonů, chemicky nesouvisí s tricyklickým, tetracyklickým, selektivním inhibitorem zpětného vychytávání serotoninu nebo jinými známými antidepresivy. Jeho struktura se velmi podobá struktuře diethylpropionu; je příbuzný fenylethylaminu. Je označen jako (±)-1-(3-chlorfenyl)-2-[(1,1-dimethylethyl)amino]-1-propanon hydrochlorid. Molekulová hmotnost je 276,2. Molekulární vzorec je C13H18ClNO•HCl. Bupropion hydrochloridový prášek je bílý, krystalický a vysoce rozpustný ve vodě. Má hořkou chuť a vyvolává pocit lokální anestézie na ústní sliznici. Strukturní vzorec je:
WELLBUTRIN se dodává pro perorální podání jako 75 mg (žluto-zlaté) a 100 mg (červené) potahované tablety. Každá tableta obsahuje uvedené množství bupropion hydrochloridu a neaktivní složky: 75mg tableta – D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcelulóza, hypromelóza, mikrokrystalická celulóza, polyethylenglykol, mastek a oxid titaničitý; 100mg tableta – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcelulóza, hypromelóza, mikrokrystalická celulóza, polyethylenglykol, mastek a oxid titaničitý.
INDIKACE
WELLBUTRIN (bupropion hydrochlorid) je indikován k léčbě velké depresivní poruchy (MDD), jak je definováno v Diagnostickém a statistickém manuálu (DSM).
Účinnost přípravku WELLBUTRIN 300 mg v léčbě velké depresivní epizody byla stanovena ve dvou 4týdenních kontrolovaných hospitalizovaných studiích a jedné 6týdenní kontrolované ambulantní studii u dospělých subjektů s MDD [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Všeobecné pokyny k použití
Abyste minimalizovali riziko záchvatu, zvyšujte dávku postupně [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Zvýšení dávky by nemělo překročit 100 mg/den v období 3 dnů. Tablety ELLBUTRIN se polykají celé a nedrtí, nedělí ani nežvýkají. Wellbutrin 300 mg lze užívat s jídlem nebo bez jídla.
Doporučená počáteční dávka je 200 mg/den, podaná jako 100 mg dvakrát denně. Po 3 dnech podávání může být dávka zvýšena na 300 mg/den, podaná jako 100 mg 3krát denně, s alespoň 6 hodinami mezi jednotlivými dávkami. Dávkování nad 300 mg/den lze provést pomocí 75 nebo 100 mg tablet.
U pacientů, kteří nevykazují žádné klinické zlepšení po několika týdnech léčby dávkou 300 mg/den, lze uvažovat o maximální dávce 450 mg/den, podávaných v rozdělených dávkách, každá ne více než 150 mg. Podávejte 100 mg tabletu 4krát denně, abyste nepřekročili limit 150 mg v jedné dávce.
Všeobecně se souhlasí s tím, že akutní epizody deprese vyžadují několik měsíců nebo déle antidepresivní léčbu nad rámec odpovědi v akutní epizodě. Není známo, zda je dávka přípravku Wellbutrin potřebná pro udržovací léčbu totožná s dávkou, která poskytla počáteční odpověď. Pravidelně přehodnocujte potřebu udržovací léčby a vhodnou dávku pro takovou léčbu.
Úprava dávky u pacientů s poruchou funkce jater
U pacientů se středně těžkou až těžkou poruchou funkce jater (Child-Pugh skóre: 7 až 15) je maximální dávka přípravku Wellbutrin 150 mg 75 mg/den. U pacientů s mírnou poruchou funkce jater (Child-Pugh skóre: 5 až 6) zvažte snížení dávky a/nebo frekvence dávkování (viz Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE ].
Úprava dávky u pacientů s poruchou ledvin
Zvažte snížení dávky a/nebo frekvence přípravku Wellbutrin 150 mg u pacientů s poruchou funkce ledvin (Glomerulární filtrace nižší než 90 ml/min) (viz Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE ].
Přechod pacienta na antidepresivum inhibitoru monoaminooxidázy (MAOI) nebo z něj
Mezi vysazením IMAO určeného k léčbě deprese a zahájením léčby přípravkem Wellbutrin by mělo uplynout alespoň 14 dní. Naopak, po vysazení přípravku Wellbutrin by mělo uplynout alespoň 14 dní před zahájením léčby antidepresivem MAOI [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
Použití Wellbutrinu s reverzibilními MAOI, jako je linezolid nebo methylenová modř
Nezahajujte léčbu přípravkem WELLBUTRIN 300 mg u pacienta, který je léčen reverzibilními IMAO, jako je linezolid nebo intravenózní methylenová modř. Lékové interakce mohou zvýšit riziko hypertenzních reakcí. U pacienta, který vyžaduje urgentnější léčbu psychiatrického stavu, je třeba zvážit nefarmakologické intervence včetně hospitalizace [viz. KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
některých případech může pacient, který již dostává léčbu přípravkem Wellbutrin, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou k dispozici přijatelné alternativy k léčbě linezolidem nebo intravenózní methylenovou modří a potenciální přínosy léčby linezolidem nebo intravenózní methylenovou modří u konkrétního pacienta převažují nad riziky hypertenzních reakcí, měl by být přípravek WELLBUTRIN 300 mg okamžitě ukončen a linezolid nebo intravenózní methylen modrá může být podávána. Pacient by měl být sledován po dobu 2 týdnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Léčba přípravkem WELLBUTRIN 300 mg může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři.
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg u přípravku Wellbutrin 300 mg není jasné. Klinik by si však měl být vědom možnosti lékové interakce při takovém použití [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
JAK DODÁVÁNO
Dávkové formy A Síly
- 75 mg – žluto-zlaté, kulaté, bikonvexní tablety s potiskem „WELLBUTRIN 75“.
- 100 mg – červené, kulaté, bikonvexní tablety s potiskem „WELLBUTRIN 100“.
Skladování A Manipulace
WELLBUTRIN 150 mg tablety, 75 mg bupropion hydrochloridu, jsou žluto-zlaté, kulaté, bikonvexní tablety potištěné „WELLBUTRIN 75“ v lahvičkách po 100 ( NDC 0173-0177-55).
Tablety WELLBUTRIN, 100 mg bupropion hydrochloridu, jsou červené, kulaté, bikonvexní tablety s potiskem „WELLBUTRIN 100“ v lahvičkách po 100 ( NDC 0173-0178-55).
Skladujte při pokojové teplotě, 20° až 25°C (68° až 77°F); povoleny výchylky mezi 15°C a 30°C (59°F a 86°F) [Viz USP řízená pokojová teplota ]. Chraňte před světlem a vlhkostí.
Vyrobeno pro: GlaxoSmithKline, Research Triangle Park,. Upraveno: listopad 2019
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Sebevražedné myšlenky a chování u dospívajících a mladých dospělých [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Neuropsychiatrické příznaky a riziko sebevraždy při léčbě odvykání kouření [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvat [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypertenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Aktivace mánie nebo hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Psychóza a další neuropsychiatrické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie probíhají za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Nežádoucí účinky vedoucí k přerušení léčby
Nežádoucí účinky byly dostatečně problematické, aby způsobily přerušení léčby přípravkem Wellbutrin u přibližně 10 % z 2 400 subjektů a zdravých dobrovolníků, kteří se účastnili klinických studií během počátečního vývoje přípravku. Mezi častější příhody způsobující přerušení patří neuropsychiatrické poruchy (3,0 %), především agitovanost a abnormality duševního stavu; gastrointestinální poruchy (2,1 %), především nauzea a zvracení; neurologické poruchy (1,7 %), především záchvaty, bolesti hlavy a poruchy spánku; a dermatologické problémy (1,4 %), především vyrážky. Je však důležité poznamenat, že k mnoha z těchto příhod došlo při dávkách, které překračují doporučenou denní dávku.
Běžně pozorované nežádoucí účinky
Nežádoucí reakce, se kterými se běžně setkáváme u subjektů léčených přípravkem Wellbutrin, jsou neklid, sucho v ústech, nespavost, bolest hlavy/migréna, nevolnost/zvracení, zácpa, třes, závratě, nadměrné pocení, rozmazané vidění, tachykardie, zmatenost, vyrážka, nepřátelství, srdeční arytmie a sluchové rušení.
Tabulka 2 shrnuje nežádoucí účinky, které se vyskytly v placebem kontrolovaných studiích s výskytem alespoň 1 % subjektů užívajících přípravek Wellbutrin 150 mg a častěji u těchto subjektů než ve skupině s placebem.
Jiné nežádoucí účinky pozorované během klinického vývoje Wellbutrinu
Podmínky a trvání expozice ELLBUTRINU se velmi lišily a podstatná část zkušeností byla získána v otevřených a nekontrolovaných klinických podmínkách. Během této zkušenosti byly hlášeny četné nežádoucí příhody; bez příslušných kontrol však není možné s jistotou určit, které události byly nebo nebyly způsobeny WELLBUTRIN. Následující výčet je uspořádán podle orgánového systému a popisuje události z hlediska jejich relativní četnosti hlášení v databázi.
Používají se následující definice frekvence: Časté nežádoucí účinky jsou definovány jako ty, které se vyskytují alespoň u 1/100 subjektů. Méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1 000 subjektů, zatímco vzácné jsou ty, které se vyskytují u méně než 1/1 000 subjektů.
Kardiovaskulární Častý byl edém; méně časté byly bolest na hrudi, abnormality elektrokardiogramu (EKG) (předčasné tepy a nespecifické změny ST-T) a dušnost/dušnost; vzácné byly zrudnutí a infarkt myokardu.
Dermatologické: Zřídka byla alopecie.
Endokrinní: Méně častá byla gynekomastie; vzácná byla glykosurie.
Gastrointestinální: Méně časté byly dysfagie, porucha žízně a poškození jater/žloutenka; vzácná byla perforace střeva.
Genitourinární: Častá byla nykturie; méně časté byly vaginální podráždění, otok varlat, infekce močových cest, bolestivá erekce a zpomalená ejakulace; vzácné byly enuréza a inkontinence moči.
Neurologický: Časté byly ataxie/inkoordinace, záchvaty, myoklonus, dyskineze a dystonie; méně časté byly mydriáza, vertigo a dysartrie; vzácné byly abnormality elektroencefalogramu (EEG) a zhoršená pozornost.
Neuropsychiatrické: Časté byly mánie/hypománie, zvýšené libido, halucinace, snížení sexuálních funkcí a deprese; méně časté byly poruchy paměti, depersonalizace, psychóza, dysforie, nestabilita nálady, paranoia a formální porucha myšlení; vzácné byly sebevražedné myšlenky.
Ústní stížnosti: Častá byla stomatitida; méně časté byly bolesti zubů, bruxismus, podráždění dásní a orální edém.
Respirační: Méně časté byly bronchitida a dušnost/dušnost; vzácná byla plicní embolie.
Speciální smysly: Méně časté byly poruchy vidění; vzácná byla diplopie.
Nespecifické: Časté byly příznaky podobné chřipce; vzácná byla nespecifická bolest; vzácné bylo předávkování.
Změněná Chuť A Váha
Ztráta hmotnosti větší než 5 liber. se objevilo u 28 % subjektů užívajících Wellbutrin. Tato incidence je přibližně dvojnásobná než u srovnatelných subjektů léčených tricyklickými léky nebo placebem. Kromě toho, zatímco 35 % subjektů užívajících tricyklická antidepresiva přibralo na váze, pouze 9,4 % subjektů léčených ELLBUTRInem. Pokud je tedy úbytek hmotnosti hlavním příznakem depresivního onemocnění pacienta, měl by být zvážen anorektický a/nebo váhový potenciál přípravku Wellbutrin.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly identifikovány během užívání přípravku Wellbutrin po schválení a nejsou popsány jinde na štítku. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo (obecné)
Artralgie, myalgie a horečka s vyrážkou a dalšími příznaky naznačujícími opožděnou hypersenzitivitu. Tyto příznaky mohou připomínat sérovou nemoc [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kardiovaskulární
Hypertenze (v některých případech závažná), ortostatická hypotenze, srdeční blok třetího stupně.
Endokrinní
Hyponatrémie, syndrom nepřiměřené sekrece antidiuretického hormonu, hyperglykémie, hypoglykémie.
Gastrointestinální
Ezofagitida, hepatitida.
Hemické A Lymfatické
Ekchymóza, leukocytóza, leukopenie, trombocytopenie. Při současném podávání bupropionu s warfarinem byly pozorovány změněné PT a/nebo INR, vzácně spojené s hemoragickými nebo trombotickými komplikacemi.
Muskuloskeletální
Svalová rigidita/horečka/rhabdomyolýza, svalová slabost.
Nervový systém
Agrese, kóma, dokonaná sebevražda, delirium, snové abnormality, paranoidní představy, parestézie, parkinsonismus, neklid, pokus o sebevraždu, demaskování tardivní dyskineze.
Kůže A Přílohy
Stevens-Johnsonův syndrom, angioedém, exfoliativní dermatitida, kopřivka.
Speciální smysly
Tinnitus, zvýšený nitrooční tlak.
DROGOVÉ INTERAKCE
Potenciál jiných léků ovlivnit Wellbutrin
Bupropion je primárně metabolizován na hydroxybupropion prostřednictvím CYP2B6. Proto existuje možnost lékových interakcí mezi Wellbutrinem a léky, které jsou inhibitory nebo induktory CYP2B6.
Inhibitory CYP2B6
Ticlopidin a Clopidogrel
Souběžná léčba těmito léky může zvýšit expozici bupropionu, ale snížit expozici hydroxybupropionu. Na základě klinické odpovědi může být nutná úprava dávkování přípravku Wellbutrin při současném podávání s inhibitory CYP2B6 (např. tiklopidinem nebo klopidogrelem) (viz KLINICKÁ FARMAKOLOGIE ].
Induktory CYP2B6
Ritonavir, Lopinavir a Efavirenz
Současná léčba těmito léky může snížit expozici bupropionu a hydroxybupropionu. Při současném podávání s ritonavirem, lopinavirem nebo efavirenzem může být nutné zvýšit dávku přípravku ELLBUTRIN (viz KLINICKÁ FARMAKOLOGIE ], ale neměla by překročit maximální doporučenou dávku.
Karbamazepin, fenobarbital, fenytoin
když nejsou systematicky studovány, mohou tyto léky indukovat metabolismus bupropionu a mohou snižovat expozici bupropionu (viz KLINICKÁ FARMAKOLOGIE ]. Pokud se bupropion užívá současně s induktorem CYP, může být nutné zvýšit dávku bupropionu, ale maximální doporučená dávka by neměla být překročena.
Potenciál pro Wellbutrin 300 mg ovlivnit jiné léky
Léky metabolizované CYP2D6
Bupropion a jeho metabolity (erythrohydrobupropion, threohydrobupropion, hydroxybupropion) jsou inhibitory CYP2D6. Současné podávání ELLBUTRINU s léky, které jsou metabolizovány CYP2D6, proto může zvýšit expozici léků, které jsou substráty CYP2D6. Mezi taková léčiva patří některá antidepresiva (např. venlafaxin, nortriptylin, imipramin, desipramin, paroxetin, fluoxetin a sertralin), antipsychotika (např. haloperidol, risperidon, thioridazin), betablokátory (např. metoprolol) a typ 1C (antiarytmika propafenon a flekainid). Při současném užívání s Wellbutrinem může být nutné snížit dávku těchto substrátů CYP2D6, zejména u léků s úzkým terapeutickým indexem.
Léky, které vyžadují metabolickou aktivaci CYP2D6, aby byly účinné (např. tamoxifen), by teoreticky mohly mít sníženou účinnost, pokud by byly podávány současně s inhibitory CYP2D6, jako je bupropion. Pacienti léčení současně přípravkem Wellbutrin a takovými léky mohou vyžadovat zvýšené dávky léku (viz KLINICKÁ FARMAKOLOGIE ].
Digoxin
Současné podávání přípravku Wellbutrin s digoxinem může snížit plazmatické hladiny digoxinu. Monitorujte plazmatické hladiny digoxinu u pacientů léčených současně Wellbutrinem a digoxinem (viz KLINICKÁ FARMAKOLOGIE ].
Léky, které snižují práh záchvatů
Při současném podávání ELLBUTRINU s jinými léky, které snižují práh záchvatů (např. jiné bupropionové přípravky, antipsychotika, antidepresiva, teofylin nebo systémové kortikosteroidy), buďte extrémně opatrní. Používejte nízké počáteční dávky a dávku zvyšujte postupně [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Dopaminergní léky (Levodopa a Amantadin)
Bupropion, levodopa a amantadin mají agonistické účinky dopaminu. Při současném podávání bupropionu s levodopou nebo amantadinem byla hlášena toxicita pro CNS. Nežádoucí účinky zahrnovaly neklid, agitovanost, třes, ataxii, poruchy chůze, vertigo a závratě. Předpokládá se, že toxicita vyplývá z kumulativních účinků agonisty dopaminu. Při současném podávání přípravku Wellbutrin 150 mg s těmito léky buďte opatrní.
Používejte s alkoholem
Po uvedení přípravku na trh byly vzácně hlášeny nežádoucí neuropsychiatrické příhody nebo snížená tolerance alkoholu u pacientů, kteří během léčby přípravkem Wellbutrin pili alkohol. Konzumaci alkoholu během léčby přípravkem Wellbutrin je třeba minimalizovat nebo se jí vyhnout.
Inhibitory MAO
Bupropion inhibuje zpětné vychytávání dopaminu a norepinefrinu. Současné užívání IMAO a bupropionu je kontraindikováno, protože existuje zvýšené riziko hypertenzních reakcí, pokud je bupropion užíván současně s IMAO. Studie na zvířatech ukazují, že akutní toxicitu bupropionu zvyšuje inhibitor MAO fenelzin. Mezi vysazením IMAO určeného k léčbě deprese a zahájením léčby přípravkem Wellbutrin by mělo uplynout alespoň 14 dní. Naopak, po vysazení přípravku Wellbutrin 150 mg by mělo uplynout alespoň 14 dní před zahájením léčby antidepresivem MAOI [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE ].
Interakce mezi drogami a laboratorními testy
U pacientů užívajících bupropion byly hlášeny falešně pozitivní screeningové testy moči na amfetaminy. To je způsobeno nedostatečnou specifitou některých screeningových testů. I po přerušení léčby bupropionem mohou být výsledky testů falešně pozitivní. Potvrzující testy, jako je plynová chromatografie/hmotnostní spektrometrie, odliší bupropion od amfetaminů.
Zneužívání drog a závislost
Kontrolovaná látka
Bupropion není kontrolovaná látka.
Zneužívání
Lidé
Kontrolované klinické studie prováděné na normálních dobrovolnících, na subjektech s anamnézou zneužívání více drog a na subjektech s depresí ukázaly určité zvýšení motorické aktivity a agitovanosti/vzrušení, často typické pro centrální stimulační aktivitu.
V populaci jedinců, kteří měli zkušenost se zneužíváním drog, vyvolala jedna perorální dávka 400 mg bupropionu mírnou aktivitu podobnou amfetaminu ve srovnání s placebem na subškále Morphine-Benzedrine of the Addiction Research Center Inventories (ARCI) a skóre vyšší než placebo, ale méně než 15 mg stimulantu dextroamfetaminu schématu II na stupnici lajků ARCI. Tyto škály měří obecné pocity euforie a zálibu v drogách, které jsou často spojeny s potenciálem zneužití.
Zjištění v klinických studiích však není známo, že by spolehlivě předpovídaly potenciál zneužívání drog. Nicméně důkazy ze studií s jednorázovou dávkou naznačují, že doporučená denní dávka bupropionu podávaného perorálně v rozdělených dávkách pravděpodobně nebude významně posilovat osoby zneužívající amfetamin nebo stimulanty CNS. Vyšší dávky (které nebylo možné testovat kvůli riziku záchvatu) však mohou být mírně atraktivní pro ty, kteří zneužívají léky stimulující CNS.
Wellbutrin je určen pouze k perorálnímu podání. Byla hlášena inhalace rozdrcených tablet nebo injekce rozpuštěného bupropionu. Při intranazálním nebo parenterálním podání bupropionu byly hlášeny záchvaty a/nebo případy úmrtí.
Zvířata
Studie na hlodavcích a primátech prokázaly, že bupropion vykazuje některé farmakologické účinky společné pro psychostimulancia. U hlodavců bylo prokázáno, že zvyšuje lokomotorickou aktivitu, vyvolává mírnou stereotypní odezvu chování a zvyšuje míru odezvy v několika paradigmatech chování řízeného rozvrhem. V modelech primátů hodnotících pozitivně posilující účinky psychoaktivních drog byl bupropion podáván nitrožilně. U potkanů bupropion vyvolal diskriminační stimulační účinky podobné amfetaminu a kokainu v paradigmatech diskriminace drog používaných k charakterizaci subjektivních účinků psychoaktivních drog.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých
pacientů s MDD, dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidalita) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a toto riziko může přetrvávat až do významného dochází k remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje dlouhodobá obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku sebevražednosti u některých pacientů během raných fází léčby.
Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (selektivní inhibitory zpětného vychytávání serotoninu [SSRI] a další) ukazují, že tyto léky zvyšují riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých (ve věku 18 let). až 24) s MDD a jinými psychiatrickými poruchami. Krátkodobé klinické studie neprokázaly u dospělých starších 24 let zvýšení rizika suicidality u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4 400 subjektů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 subjektů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších subjektů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl mezi léky a placebem v počtu případů sebevraždy na 1 000 léčených subjektů) jsou uvedeny v tabulce 1.
žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými se vyskytly sebevraždy, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá [viz VAROVÁNÍ V RÁMCI].
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro MDD nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další symptomy popsané výše, např. stejně jako vznik suicidality a takové příznaky okamžitě hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro přípravek Wellbutrin 150 mg by měly být napsány na nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Neuropsychiatrické nežádoucí příhody a riziko sebevraždy při léčbě odvykání kouření
WELLBUTRIN není schválen pro léčbu odvykání kouření; obsahuje však stejnou účinnou látku jako lék na odvykání kouření ZYBAN. U pacientů užívajících bupropion k odvykání kouření byly hlášeny závažné neuropsychiatrické nežádoucí účinky. Tyto postmarketingové zprávy zahrnovaly změny nálady (včetně deprese a mánie), psychózu, halucinace, paranoiu, bludy, vražedné myšlenky, agresi, nepřátelství, agitovanost, úzkost a paniku, stejně jako sebevražedné myšlenky, pokusy o sebevraždu a dokonanou sebevraždu. vidět NEŽÁDOUCÍ REAKCE ]. Někteří pacienti, kteří přestali kouřit, mohli pociťovat příznaky abstinenčního syndromu od nikotinu, včetně depresivní nálady. Deprese, vzácně včetně sebevražedných myšlenek, byla hlášena u kuřáků, kteří se pokoušeli přestat kouřit bez léků. Některé z těchto nežádoucích účinků se však vyskytly u pacientů užívajících bupropion, kteří nadále kouřili.
Neuropsychiatrické nežádoucí příhody se vyskytly u pacientů bez a s již existujícím psychiatrickým onemocněním; u některých pacientů došlo ke zhoršení jejich psychiatrických onemocnění. Sledujte pacienty z hlediska výskytu neuropsychiatrických nežádoucích účinků. Informujte pacienty a pečovatele, že by pacient měl přestat užívat přípravek Elontril 300 mg a okamžitě kontaktovat poskytovatele zdravotní péče, pokud zaznamenáte neklid, depresivní náladu nebo změny v chování nebo myšlení, které nejsou pro pacienta typické, nebo pokud se u pacienta objeví sebevražedné myšlenky nebo sebevražedné chování. . V mnoha postmarketingových případech bylo hlášeno vymizení příznaků po vysazení bupropionu. Příznaky však v některých případech přetrvávaly; proto by mělo být zajištěno průběžné sledování a podpůrná péče, dokud příznaky nevymizí.
Záchvat
ELLBUTRIN 300 mg může způsobit záchvat. Riziko záchvatu závisí na dávce. Dávka by neměla překročit 450 mg/den. Postupně dávku zvyšujte. Pokud pacient dostane záchvat, ukončete léčbu přípravkem WELLBUTRIN 150 mg a nezačínejte znovu léčbu.
Riziko záchvatů také souvisí s faktory pacienta, klinickými situacemi a současně podávanými léky, které snižují práh záchvatů. Před zahájením léčby přípravkem WELLBUTRIN zvažte tato rizika. WELLBUTRIN 300 mg je kontraindikován u pacientů se záchvatovým onemocněním, současnou nebo předchozí diagnózou mentální anorexie nebo bulimie nebo u pacientů podstupujících náhlé vysazení alkoholu, benzodiazepinů, barbiturátů a antiepileptik [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ]. Následující stavy mohou také zvýšit riziko záchvatu: těžké poranění hlavy; arteriovenózní malformace; nádor CNS nebo infekce CNS; těžká mrtvice; současné užívání jiných léků, které snižují práh záchvatů (např. jiné přípravky s bupropionem, antipsychotika, tricyklická antidepresiva, teofylin a systémové kortikosteroidy); metabolické poruchy (např. hypoglykémie, hyponatrémie, těžké jaterní poškození a hypoxie); užívání nelegálních drog (např. kokainu); nebo zneužívání nebo nesprávné užívání léků na předpis, jako jsou stimulanty CNS. Další predisponující stavy zahrnují diabetes mellitus léčený perorálními hypoglykemickými léky nebo inzulínem; užívání anorektických léků; a nadměrné užívání alkoholu, benzodiazepinů, sedativ/hypnotik nebo opiátů.
Výskyt záchvatů při užívání bupropionu
Bupropion je spojen se záchvaty u přibližně 0,4 % (4/1 000) pacientů léčených v dávkách až 450 mg/den. Odhadovaná incidence záchvatů pro Wellbutrin se mezi 450 a 600 mg/den zvyšuje téměř 10krát.
Riziko záchvatu lze snížit, pokud dávka přípravku ELLBUTRIN 300 mg nepřekročí 450 mg/den, podaná jako 150 mg 3krát denně, a rychlost titrace je pozvolná.
Hypertenze
Léčba přípravkem Wellbutrin může vést ke zvýšenému krevnímu tlaku a hypertenzi. Před zahájením léčby přípravkem Wellbutrin 150 mg změřte krevní tlak a v průběhu léčby jej pravidelně sledujte. Riziko hypertenze se zvyšuje, pokud je přípravek Wellbutrin 150 mg užíván současně s IMAO nebo jinými léky, které zvyšují dopaminergní nebo noradrenergní aktivitu (viz KONTRAINDIKACE ].
Údaje ze srovnávací studie lékové formy bupropion HCl s prodlouženým uvolňováním, nikotinového transdermálního systému (NTS), kombinace bupropionu s prodlouženým uvolňováním plus NTS a placeba jako pomoc při odvykání kouření naznačují vyšší výskyt hypertenze vyvolané léčbou pacientů léčených kombinací bupropionu s prodlouženým uvolňováním a NTS. V této studii mělo 6,1 % subjektů léčených kombinací bupropionu s prodlouženým uvolňováním a NTS hypertenzi související s léčbou ve srovnání s 2,5 %, 1,6 % a 3,1 % subjektů léčených bupropionem s prodlouženým uvolňováním, NTS a placebem. . Většina těchto subjektů měla známky preexistující hypertenze. U tří subjektů (1,2 %) léčených kombinací bupropionu s prodlouženým uvolňováním a NTS a 1 subjektu (0,4 %) léčeného NTS byla studijní medikace přerušena z důvodu hypertenze ve srovnání s žádným ze subjektů léčených bupropionem s prodlouženým uvolňováním nebo placebem. Monitorování krevního tlaku se doporučuje u pacientů, kteří dostávají kombinaci bupropionu a nikotinu.
klinické studii bupropionu s okamžitým uvolňováním u subjektů s MDD se stabilním městnavým srdečním selháním (N = 36) byl bupropion spojen s exacerbací již existující hypertenze u 2 subjektů, což vedlo k přerušení léčby bupropionem. Neexistují žádné kontrolované studie hodnotící bezpečnost bupropionu u pacientů s nedávnou anamnézou infarktu myokardu nebo nestabilního srdečního onemocnění.
Aktivace mánie/hypománie
Léčba antidepresivy může vyvolat manickou, smíšenou nebo hypomanickou manickou epizodu. Riziko se zdá být zvýšené u pacientů s bipolární poruchou nebo s rizikovými faktory pro bipolární poruchu. Před zahájením léčby přípravkem WELLBUTRIN zkontrolujte u pacientů anamnézu bipolární poruchy a přítomnost rizikových faktorů pro bipolární poruchu (např. rodinná anamnéza bipolární poruchy, sebevražda nebo deprese). Wellbutrin 150 mg není schválen pro použití k léčbě bipolární deprese.
Psychóza a jiné neuropsychiatrické reakce
Depresivní pacienti léčení přípravkem WELLBUTRIN měli různé neuropsychiatrické příznaky a symptomy, včetně bludů, halucinací, psychózy, poruch koncentrace, paranoie a zmatenosti. Někteří z těchto pacientů měli diagnózu bipolární poruchy. V některých případech tyto příznaky odezněly po snížení dávky a/nebo vysazení léčby. Poučte pacienty, aby v případě výskytu takových reakcí kontaktovali zdravotnického pracovníka.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně přípravku Wellbutrin 300 mg, může vyvolat záchvat s uzavřeným úhlem u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii.
Hypersenzitivní reakce
Během klinických studií s bupropionem se objevily anafylaktoidní/anafylaktické reakce. Reakce byly charakterizovány svěděním, kopřivkou, angioedémem a dušností vyžadující lékařské ošetření. Kromě toho byly po uvedení na trh vzácně spontánně hlášeny erythema multiforme, Stevens-Johnsonův syndrom a anafylaktický šok spojený s bupropionem. Poučte pacienty, aby přerušili léčbu přípravkem WELLBUTRIN 150 mg a poradili se s poskytovatelem zdravotní péče, pokud se u nich během léčby rozvine alergická nebo anafylaktoidní/anafylaktická reakce (např. kožní vyrážka, svědění, kopřivka, bolest na hrudi, edém a dušnost).
Existují zprávy o artralgii, myalgii, horečce s vyrážkou a dalšími symptomy podobnými sérové nemoci, které naznačují opožděnou hypersenzitivitu.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Sebevražedné myšlenky a chování
Poučte pacienty, jejich rodiny a/nebo jejich pečovatele, aby byli ostražití před výskytem úzkosti, neklidu, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Poraďte rodinám a pečovatelům pacientů, aby každý den pozorovali výskyt takových příznaků, protože změny mohou být náhlé. Takové symptomy by měly být hlášeny pacientovi předepisujícímu lékaři nebo zdravotnickému pracovníkovi, zejména pokud jsou závažné, mají náhlý nástup nebo nebyly součástí příznaků pacienta. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě.
Neuropsychiatrické nežádoucí příhody a riziko sebevraždy při léčbě odvykání kouření
Přestože WELLBUTRIN 150 mg není indikován k léčbě odvykání kouření, obsahuje stejnou účinnou látku jako ZYBAN, který je pro toto použití schválen. Informujte pacienty, že u některých pacientů došlo ke změnám nálady (včetně deprese a mánie), psychóze, halucinacím, paranoiu, bludům, vražedným představám, agresi, nepřátelství, neklidu, úzkosti a panice, stejně jako sebevražedným myšlenkám a sebevraždě při pokusu přestat kouřit kouření při užívání bupropionu. Poučte pacienty, aby přerušili léčbu bupropionem a kontaktovali zdravotnického pracovníka, pokud se u nich objeví takové příznaky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
Závažné alergické reakce
Poučte pacienty o příznacích přecitlivělosti a aby v případě závažné alergické reakce přerušili léčbu přípravkem WELLBUTRIN 300 mg.
Záchvat
Poučte pacienty, aby přerušili léčbu a nerestartovali přípravek Wellbutrin, pokud během léčby zaznamenají záchvat. Informujte pacienty, že nadměrné užívání nebo náhlé vysazení alkoholu, benzodiazepinů, antiepileptik nebo sedativ/hypnotik může zvýšit riziko záchvatu. Poraďte pacientům, aby minimalizovali nebo se vyvarovali pití alkoholu.
Glaukom s uzavřeným úhlem
Pacienty je třeba upozornit, že užívání přípravku Elontril 150 mg může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a mají profylaktický postup (např. iridektomie), pokud jsou náchylní [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Produkty obsahující bupropion
Poučte pacienty, že přípravek WELLBUTRIN 150 mg obsahuje stejnou účinnou látku (bupropion hydrochlorid) jako přípravek ZYBAN, který se používá jako pomůcka při léčbě odvykání kouření, a že přípravek WELLBUTRIN 150 mg by se neměl používat v kombinaci s přípravkem ZYBAN nebo jinými léky, které obsahují bupropion (např. jako WELLBUTRIN 150 mg SR, přípravek s prodlouženým uvolňováním a WELLBUTRIN XL nebo FORFIVO XL, přípravky s prodlouženým uvolňováním, a APLENZIN, přípravek s prodlouženým uvolňováním bupropion hydrobromidu). Kromě toho existuje řada generických produktů bupropion HCl pro formulace s okamžitým, prodlouženým a prodlouženým uvolňováním.
Potenciál pro kognitivní a motorické poruchy
Informujte pacienty, že jakýkoli lék působící na CNS, jako je Wellbutrin, může zhoršit jejich schopnost vykonávat úkoly vyžadující úsudek nebo motorické a kognitivní dovednosti. Informujte pacienty, že dokud si nebudou přiměřeně jisti, že přípravek Wellbutrin 300 mg nepříznivě neovlivňuje jejich výkonnost, měli by se zdržet řízení automobilu nebo obsluhy složitých nebezpečných strojů. Wellbutrin 150 mg může vést ke snížení tolerance alkoholu.
Doprovodné léky
Poraďte pacientům, aby informovali svého poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože WELLBUTRIN 150 mg a další léky mohou vzájemně ovlivňovat metabolismus.

Těhotenství
Informujte pacientky, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem Wellbutrin otěhotní nebo plánují otěhotnět. Informujte pacienty, že existuje registr expozice v těhotenství, který monitoruje výsledky těhotenství u žen vystavených přípravku Wellbutrin 150 mg během těhotenství [viz Použití u konkrétních populací ].
Informace o úložišti
Poučte pacienty, aby uchovávali WELLBUTRIN při pokojové teplotě, mezi 68 °F a 77 °F (20 °C až 25 °C) a udržovali tablety suché a mimo světlo.
Informace o administraci
Poučte pacienty, aby užívali ELLBUTRIN ve rovnoměrně rozdělených dávkách 3 nebo 4krát denně, přičemž mezi jednotlivými dávkami musí být interval nejméně 6 hodin, aby se minimalizovalo riziko záchvatu. Poučte pacienty, pokud vynechají dávku, aby si nevzali další tabletu, aby nahradili vynechanou dávku, a aby si další tabletu vzali v pravidelnou dobu kvůli riziku záchvatu souvisejícímu s dávkou. Poučte pacienty, že tablety Wellbutrinu je třeba polykat celé a nedrtit, dělit nebo žvýkat. WELLBUTRIN lze užívat s jídlem nebo bez jídla.
WELLBUTRIN, WELLBUTRIN SR, WELLBUTRIN 150 mg XL a ZYBAN jsou ochranné známky vlastněné nebo licencované skupinou společností GSK. Ostatní uvedené značky jsou ochranné známky vlastněné nebo licencované jejich příslušnými vlastníky a nejsou vlastněny ani licencovány skupinou společností GSK. Tvůrci těchto značek nejsou přidruženi a nepodporují skupinu společností GSK ani její produkty.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Celoživotní studie karcinogenity byly provedeny na potkanech a myších v dávkách bupropionu až do 300 a 150 mg/kg/den, v daném pořadí. Tyto dávky jsou přibližně 6krát a 2krát vyšší než MRHD, na základě mg/m2. Ve studii na potkanech došlo ke zvýšení nodulárních proliferativních lézí jater při dávkách 100 až 300 mg/kg/den (přibližně 2 až 6násobek MRHD na základě mg/m2); nižší dávky nebyly testovány. Otázka, zda takové léze mohou nebo nemohou být prekurzory novotvarů jater, není v současné době vyřešena. Podobné jaterní léze nebyly pozorovány ve studii na myších a v žádné studii nebyl pozorován žádný nárůst maligních nádorů jater a dalších orgánů.
Bupropion vyvolal pozitivní odezvu (2 až 3krát vyšší rychlost kontrolní mutace) u 2 z 5 kmenů v Amesově testu bakteriální mutagenity. Bupropion vyvolal zvýšení chromozomálních aberací v 1 ze 3 in vivo cytogenetických studií kostní dřeně potkanů.
Když byly potkanům podávány perorální dávky bupropionu až 300 mg/kg/den (přibližně 6násobek MRHD na základě mg/m2) samicím před pářením a buď do 13. dne březosti, nebyly žádné účinky na fertilitu samců a samic. nebo prostřednictvím laktace a samcům po dobu 60 dnů před pářením a během páření. Avšak dávky 200 mg/kg/den (přibližně 4násobek MRHD na základě mg/m2) nebo vyšší způsobily u dospělých samic potkanů přechodnou ataxii nebo změny chování. Rovněž nebyly pozorovány žádné nežádoucí účinky na plodnost, reprodukci nebo růst a vývoj samčích nebo samičích potomků.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje nezávislý registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených jakýmkoli antidepresivům během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty zavoláním do Národního registru těhotenství pro antidepresiva na čísle 1-844-4056185 nebo online na adrese https://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/antidepressants.
Shrnutí rizik
Údaje z epidemiologických studií těhotných žen vystavených bupropionu v prvním trimestru neidentifikovaly celkově zvýšené riziko vrozených malformací (viz Data ). Existují rizika pro matku spojená s neléčenou depresí v těhotenství (viz Klinické úvahy ). Když byl bupropion podáván březím krysám během organogeneze, nebyly zjištěny žádné známky malformací plodu v dávkách až přibližně 10násobku maximální doporučené dávky pro člověka (MRHD) 450 mg/den. Při podávání březím králičkám během organogeneze bylo pozorováno zvýšení incidence fetálních malformací a skeletálních variací, které nebylo závislé na dávce, a to při dávkách přibližně rovných MRHD a vyšších. Snížená hmotnost plodu byla pozorována při dávkách dvojnásobku MRHD a vyšších (viz Údaje o zvířatech ).
Odhadované základní riziko závažných vrozených vad a potratu není pro indikovanou populaci známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s nemocí
Prospektivní longitudinální studie sledovala 201 těhotných žen s anamnézou závažné depresivní poruchy, které byly euthymické a užívaly antidepresiva během těhotenství na začátku těhotenství. Ženy, které vysadily antidepresiva během těhotenství, měly větší pravděpodobnost recidivy těžké deprese než ženy, které v antidepresivech pokračovaly. Zvažte rizika neléčené deprese pro matku a potenciální účinky na plod při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Data
Lidská data
Údaje z mezinárodního registru těhotenství bupropion (675 expozic v prvním trimestru) a retrospektivní kohortové studie využívající databázi United Healthcare (1 213 expozic v prvním trimestru) celkově neprokázaly zvýšené riziko malformací. Registr nebyl navržen ani poháněn k hodnocení konkrétních defektů, ale naznačoval možný nárůst srdečních malformací.
Po expozici bupropionu během prvního trimestru nebylo celkově pozorováno žádné zvýšené riziko kardiovaskulárních malformací. Prospektivně pozorovaná míra kardiovaskulárních malformací u těhotenství s expozicí bupropionu v prvním trimestru z mezinárodního registru těhotenství byla 1,3 % (9 kardiovaskulárních malformací/675 mateřských expozic bupropionu v prvním trimestru), což je podobné jako základní míra kardiovaskulárních malformací (přibližně 1 %). Údaje z databáze United Healthcare, která obsahovala omezený počet exponovaných případů s kardiovaskulárními malformacemi, a studie případové kontroly (6 853 kojenců s kardiovaskulárními malformacemi a 5 763 s nekardiovaskulárními malformacemi) o užívání bupropionu, který si sami oznámili z National Birth Defects Studie prevence (NBDPS) neprokázala celkové zvýšené riziko kardiovaskulárních malformací po expozici bupropionu během prvního trimestru.
Výsledky studie týkající se expozice bupropionu během prvního trimestru a rizika obstrukce výtokového traktu levé komory (LVOTO) jsou nekonzistentní a neumožňují vyvodit závěry ohledně možné souvislosti. Databáze United Healthcare postrádala dostatečnou sílu k vyhodnocení tohoto spojení; NBDPS zjistila zvýšené riziko LVOTO (n = 10; upravený OR = 2,6; 95% CI: 1,2, 5,7) a případová kontrolní studie Slone Epidemiology nezjistila zvýšené riziko LVOTO.
Výsledky studie týkající se expozice bupropionu během prvního trimestru a rizika defektu komorového septa (VSD) jsou nekonzistentní a neumožňují učinit závěry týkající se možné souvislosti. Studie Slone Epidemiology Study zjistila zvýšené riziko VSD po expozici bupropionu matce v prvním trimestru (n = 17; upravený OR = 2,5; 95% CI: 1,3, 5,0), ale nezjistila zvýšené riziko pro žádné další studované kardiovaskulární malformace (včetně LVOTO as výše). Studie databáze NBDPS a United Healthcare nenalezla souvislost mezi expozicí bupropionu matce v prvním trimestru a VSD.
Pokud jde o zjištění LVOTO a VSD, studie byly omezeny malým počtem exponovaných případů, nekonzistentními nálezy mezi studiemi a potenciálem náhodných zjištění z vícenásobných srovnání ve studiích kontroly případů.
Údaje o zvířatech
Ve studiích prováděných u březích potkanů a králíků byl bupropion podáván perorálně během období organogeneze v dávkách až 450 a 150 mg/kg/den, v daném pořadí (přibližně 10, resp. 6násobek MRHD, na bázi mg/m2 ). U potkanů nebyly žádné důkazy o malformacích plodu. Při podávání březím králíkům během organogeneze bylo při nejnižší testované dávce (25 mg/kg/den, přibližně stejné jako MRHD na bázi mg/m2) pozorováno zvýšení výskytu fetálních malformací a změn skeletu, které není závislé na dávce. a větší. Snížení hmotnosti plodu bylo pozorováno při dávkách 50 mg/kg/den (přibližně dvojnásobek MRHD na základě mg/m2) a vyšších. Při dávkách 50 mg/kg/den nebo nižších nebyla patrná žádná toxicita pro matku.
Ve studii prenatálního a postnatálního vývoje bupropion podávaný perorálně březím krysám v dávkách až 150 mg/kg/den (přibližně 3násobek MRHD na bázi mg/m2) od embryonální implantace přes laktaci neměl žádný vliv na růst mláďat nebo vývoj.
Laktace
Shrnutí rizik
Údaje z publikované literatury uvádějí přítomnost bupropionu a jeho metabolitů v lidském mléce (viz Data ). Neexistují žádné údaje o účincích bupropionu nebo jeho metabolitů na produkci mléka. Omezené údaje z postmarketingových hlášení neidentifikovaly jasnou souvislost nežádoucích účinků u kojeného dítěte. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky pro přípravek Wellbutrin a případnými nežádoucími účinky přípravku Wellbutrin na kojené dítě nebo ze základního stavu matky.
Data
laktační studii u 10 žen byly hladiny perorálně podávaného bupropionu a jeho aktivních metabolitů měřeny v odstříkaném mléce. Průměrná denní expozice kojence (za předpokladu 150 ml/kg denní spotřeby) bupropionu a jeho aktivním metabolitům byla 2 % dávky upravené podle hmotnosti matky. Postmarketingové zprávy popsaly záchvaty u kojených dětí. Vztah mezi expozicí bupropionu a těmito záchvaty je nejasný.
Pediatrické použití
Bezpečnost a účinnost u pediatrické populace nebyla stanovena [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Geriatrické použití
přibližně 6 000 subjektů, které se účastnily klinických studií s tabletami bupropionu s prodlouženým uvolňováním (studie zaměřené na depresi a odvykání kouření), bylo 275 ve věku ≥65 let a 47 bylo ve věku ≥75 let. Kromě toho se několik stovek subjektů ve věku ≥ 65 let zúčastnilo klinických studií s použitím formulace bupropionu s okamžitým uvolňováním (depresivní studie). Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti. Hlášená klinická zkušenost nezjistila rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců.
Bupropion je rozsáhle metabolizován v játrech na aktivní metabolity, které jsou dále metabolizovány a vylučovány ledvinami. Riziko nežádoucích účinků může být vyšší u pacientů s poruchou funkce ledvin. Protože u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, může být nutné tento faktor vzít v úvahu při výběru dávky; může být užitečné sledovat renální funkce [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE ].
Renální poškození
Zvažte snížení dávky a/nebo frekvence dávkování přípravku Wellbutrin u pacientů s poruchou funkce ledvin (Glomerulární filtrace: méně než 90 ml/min). Bupropion a jeho metabolity jsou vylučovány ledvinami a mohou se u těchto pacientů hromadit ve větší míře než obvykle. Pečlivě sledujte nežádoucí reakce, které by mohly naznačovat vysoké expozice bupropionu nebo metabolitu [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Poškození jater
pacientů se středně těžkou až těžkou poruchou funkce jater (Child-Pugh skóre: 7 až 15) je maximální dávka přípravku Wellbutrin 150 mg 75 mg denně. U pacientů s mírnou poruchou funkce jater (Child-Pugh skóre: 5 až 6) zvažte snížení dávky a/nebo frekvence dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Zkušenosti s předávkováním člověkem
Bylo hlášeno předávkování až 30 gramů nebo více bupropionu. Záchvaty byly hlášeny přibližně u jedné třetiny všech případů. Další závažné reakce hlášené při předávkování samotným bupropionem zahrnovaly halucinace, ztrátu vědomí, sinusovou tachykardii a změny EKG, jako jsou poruchy vedení (včetně prodloužení QRS) nebo arytmie. Horečka, svalová rigidita, rhabdomyolýza, hypotenze, stupor, kóma a respirační selhání byly hlášeny hlavně tehdy, když byl bupropion součástí vícenásobného předávkování léky.
Přestože se většina pacientů uzdravila bez následků, byla u pacientů, kteří požili velké dávky léku, hlášena úmrtí spojená s předávkováním samotným bupropionem. U těchto pacientů byly hlášeny četné nekontrolované záchvaty, bradykardie, srdeční selhání a srdeční zástava před smrtí.
Řízení předávkování
Obraťte se na certifikované centrum pro kontrolu jedů, kde získáte aktuální pokyny a rady. Telefonní čísla na certifikovaná toxikologická centra jsou uvedena v Physician's Desk Reference (PDR). Zavolejte na číslo 1-800-222-1222 nebo navštivte www.poison.org.
Pro bupropion nejsou známa žádná antidota. V případě předávkování poskytněte podpůrnou péči, včetně pečlivého lékařského dohledu a sledování. Zvažte možnost předávkování více drogami. Zajistěte dostatečné dýchací cesty, okysličení a ventilaci. Sledujte srdeční rytmus a životní funkce. Vyvolání zvracení se nedoporučuje.
KONTRAINDIKACE
- Wellbutrin 150 mg je kontraindikován u pacientů se záchvatovým onemocněním.
- WELLBUTRIN je kontraindikován u pacientů se současnou nebo předchozí diagnózou bulimie nebo mentální anorexie, protože u těchto pacientů léčených přípravkem WELLBUTRIN byl pozorován vyšší výskyt záchvatů (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- WELLBUTRIN 300 mg je kontraindikován u pacientů podstupujících náhlé vysazení alkoholu, benzodiazepinů, barbiturátů a antiepileptik (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- Užívání IMAO (určených k léčbě psychiatrických poruch) současně s přípravkem Wellbutrin 300 mg nebo do 14 dnů po ukončení léčby přípravkem Wellbutrin 150 mg je kontraindikováno. Při současném užívání přípravku Wellbutrin s IMAO existuje zvýšené riziko hypertenzních reakcí. Užívání přípravku Wellbutrin do 14 dnů po ukončení léčby IMAO je rovněž kontraindikováno. Zahájení léčby přípravkem WELLBUTRIN 150 mg u pacienta léčeného reverzibilními IMAO, jako je linezolid nebo intravenózní methylenová modř, je kontraindikováno (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- WELLBUTRIN je kontraindikován u pacientů se známou přecitlivělostí na bupropion nebo jiné složky přípravku WELLBUTRIN. Byly hlášeny anafylaktoidní/anafylaktické reakce a Stevens-Johnsonův syndrom (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Přesný mechanismus antidepresivního účinku bupropionu není znám, ale předpokládá se, že souvisí s noradrenergními a/nebo dopaminergními mechanismy. Bupropion je relativně slabým inhibitorem neuronálního zpětného vychytávání norepinefrinu a dopaminu a neinhibuje zpětné vychytávání serotoninu. Bupropion neinhibuje monoaminooxidázu.
Farmakokinetika
Bupropion je racemická směs. Farmakologická aktivita a farmakokinetika jednotlivých enantiomerů nebyly studovány. Průměrný poločas eliminace (±SD) bupropionu po chronickém podávání je 21 (±9) hodin a ustálených plazmatických koncentrací bupropionu je dosaženo do 8 dnů.
Vstřebávání
Absolutní biologická dostupnost přípravku Wellbutrin u lidí nebyla stanovena, protože není k dispozici intravenózní léková forma pro humánní použití. Zdá se však pravděpodobné, že pouze malá část jakékoli perorálně podané dávky se dostane do systémové cirkulace neporušená. Ve studiích na potkanech a psech se biologická dostupnost bupropionu pohybovala od 5 % do 20 %.
U lidí je po perorálním podání přípravku Wellbutrin 300 mg obvykle dosaženo maximální plazmatické koncentrace bupropionu během 2 hodin. Plazmatické koncentrace bupropionu jsou po jednotlivých dávkách 100 až 250 mg úměrné dávce; není však známo, zda je při chronickém užívání zachována proporcionalita mezi dávkou a plazmatickou hladinou.
Rozdělení
Testy in vitro ukazují, že bupropion se z 84 % váže na lidské plazmatické proteiny v koncentracích až 200 mcg/ml. Rozsah vazby metabolitu hydroxybupropion na proteiny je podobný jako u bupropionu, zatímco rozsah vazby metabolitu threohydrobupropion na proteiny je asi poloviční než u bupropionu.
Metabolismus
Bupropion je u lidí rozsáhle metabolizován. Aktivní jsou tři metabolity: hydroxybupropion, který vzniká hydroxylací terc-butylové skupiny bupropionu, a izomery aminoalkoholu threohydrobupropion a erythrohydrobupropion, které se tvoří redukcí karbonylové skupiny. Zjištění in vitro naznačují, že CYP2B6 je hlavním izoenzymem zapojeným do tvorby hydroxybupropionu, zatímco enzymy cytochromu P450 se na tvorbě threohydrobupropionu nepodílejí. Oxidace postranního řetězce bupropionu má za následek tvorbu glycinového konjugátu kyseliny meta-chlorbenzoové, který je pak vylučován jako hlavní metabolit močí. Síla a toxicita metabolitů ve vztahu k bupropionu nebyla plně charakterizována. V antidepresivním screeningovém testu na myších však bylo prokázáno, že hydroxybupropion je o polovinu silnější než bupropion, zatímco threohydrobupropion a erythrohydrobupropion jsou 5krát méně účinné než bupropion. To může mít klinický význam, protože plazmatické koncentrace metabolitů jsou stejně vysoké nebo vyšší než koncentrace bupropionu.
Po jedné dávce u lidí se maximální plazmatické koncentrace hydroxybupropionu objeví přibližně 3 hodiny po podání přípravku Wellbutrin a jsou přibližně 10krát vyšší než maximální hladina mateřského léčiva v ustáleném stavu. Eliminační poločas hydroxybupropionu je přibližně 20 (±5) hodin a jeho AUC v ustáleném stavu je přibližně 17krát větší než u bupropionu. Časy do dosažení maximálních koncentrací pro metabolity erythrohydrobupropion a threohydrobupropion jsou podobné jako pro metabolit hydroxybupropion. Jejich eliminační poločasy jsou však delší, 33 (±10) a 37 (±13) hodin, v daném pořadí, a AUC v ustáleném stavu jsou 1,5 a 7krát vyšší než u bupropionu.
Bupropion a jeho metabolity vykazují lineární kinetiku po chronickém podávání 300 až 450 mg/den.
Odstranění
Po perorálním podání 200 mg 14C-bupropionu lidem bylo 87 % a 10 % radioaktivní dávky nalezeno v moči a ve stolici. Pouze 0,5 % perorální dávky bylo vyloučeno jako nezměněný bupropion.
Specifické populace
Lze očekávat, že faktory nebo stavy měnící metabolickou kapacitu (např. onemocnění jater, městnavé srdeční selhání [CHF], věk, souběžná medikace atd.) nebo eliminaci ovlivní stupeň a rozsah akumulace aktivních metabolitů bupropionu. Eliminace hlavních metabolitů bupropionu může být ovlivněna sníženou funkcí ledvin nebo jater, protože se jedná o středně polární sloučeniny a pravděpodobně podstoupí další metabolismus nebo konjugaci v játrech před vylučováním močí.
Pacienti s poruchou ledvin
farmakokinetice bupropionu u pacientů s poruchou funkce ledvin jsou omezené informace. Srovnání mezi normálními subjekty a subjekty s terminálním selháním ledvin prokázalo, že hodnoty Cmax a AUC mateřského léku byly srovnatelné ve 2 skupinách, zatímco metabolity hydroxybupropionu a threohydrobupropionu měly 2,3násobné a 2,8násobné zvýšení. v AUC pro subjekty s terminálním selháním ledvin. Druhá studie, porovnávající normální subjekty a subjekty se středně těžkou až těžkou poruchou funkce ledvin (GFR 30,9 ± 10,8 ml/min) ukázala, že po jedné dávce 150 mg bupropionu s prodlouženým uvolňováním byla expozice bupropionu přibližně 2krát vyšší u subjektů s poruchou funkce ledvin, zatímco hladiny metabolitů hydroxybupropionu a threo/erythrohydrobupropionu (kombinovaných) byly v těchto 2 skupinách podobné. Bupropion je rozsáhle metabolizován v játrech na aktivní metabolity, které jsou dále metabolizovány a následně vylučovány ledvinami. Eliminace hlavních metabolitů bupropionu může být snížena poruchou funkce ledvin. Wellbutrin by měl být používán s opatrností u pacientů s poruchou funkce ledvin a měla by být zvážena snížená frekvence a/nebo dávka (viz Použití u konkrétních populací ].
Pacienti s poruchou funkce jater
Účinek poškození jater na farmakokinetiku bupropionu byl charakterizován ve 2 studiích s jednorázovou dávkou, jedné u subjektů s alkoholickým onemocněním jater a jedné u subjektů s mírnou až závažnou cirhózou. První studie prokázala, že poločas hydroxybupropionu byl významně delší u 8 subjektů s alkoholickým onemocněním jater než u 8 zdravých dobrovolníků (32 ± 14 hodin oproti 21 ± 5 hodinám). Ačkoli to není statisticky významné, AUC pro bupropion a hydroxybupropion byly variabilnější a měly tendenci být vyšší (o 53 % až 57 %) u dobrovolníků s alkoholickým onemocněním jater. Rozdíly v poločasu bupropionu a ostatních metabolitů ve 2 skupinách byly minimální.
Druhá studie neprokázala žádné statisticky významné rozdíly ve farmakokinetice bupropionu a jeho aktivních metabolitů u 9 subjektů s mírnou až středně těžkou cirhózou jater ve srovnání s 8 zdravými dobrovolníky. U některých farmakokinetických parametrů bupropionu (AUC, Cmax a Tmax) a jeho aktivních metabolitů (t½) však byla pozorována větší variabilita u subjektů s mírnou až středně těžkou cirhózou jater. U subjektů s těžkou cirhózou jater byly pozorovány významné změny farmakokinetiky bupropionu a jeho metabolitů (tabulka 3).
Pacienti s dysfunkcí levé komory
Během studie chronického dávkování bupropionu u 14 depresivních subjektů s dysfunkcí levé komory (anamnéza CHF nebo zvětšené srdce na rentgenovém snímku) nebyl ve srovnání se zdravými dobrovolníky žádný zjevný vliv na farmakokinetiku bupropionu nebo jeho metabolitů.
Stáří
Účinky věku na farmakokinetiku bupropionu a jeho metabolitů nebyly plně charakterizovány, ale průzkum koncentrací bupropionu v ustáleném stavu z několika studií účinnosti deprese zahrnující subjekty, kterým byla podávána dávka v rozmezí 300 až 750 mg/den při 3- denní rozvrh, neodhalil žádný vztah mezi věkem (18 až 83 let) a plazmatickou koncentrací bupropionu. Farmakokinetická studie s jednorázovou dávkou prokázala, že eliminace bupropionu a jeho metabolitů u starších subjektů byla podobná jako u mladších subjektů. Tyto údaje naznačují, že věk nemá žádný výrazný vliv na koncentraci bupropionu; nicméně další farmakokinetická studie s jednou a více dávkami naznačila, že starší lidé mají zvýšené riziko akumulace bupropionu a jeho metabolitů (viz Použití u konkrétních populací ].
Mužské A ženské pacienty
Souhrnná analýza farmakokinetických dat bupropionu od 90 zdravých dobrovolníků mužů a 90 zdravých žen neodhalila žádné rozdíly v maximálních plazmatických koncentracích bupropionu související s pohlavím. Průměrná systémová expozice (AUC) byla přibližně o 13 % vyšší u mužských dobrovolníků ve srovnání s dobrovolnicemi. Klinický význam tohoto nálezu není znám.
Kuřáci
Účinky kouření cigaret na farmakokinetiku bupropionu byly studovány u 34 zdravých dobrovolníků mužů a žen; 17 bylo chronických kuřáků cigaret a 17 nekuřáků. Po perorálním podání jedné dávky 150 mg bupropionu nebyly mezi kuřáky a nekuřáky statisticky významné rozdíly v Cmax, poločasu rozpadu, Tmax, AUC nebo clearance bupropionu nebo jeho aktivních metabolitů.
Studie lékových interakcí
Potenciál jiných léků ovlivnit Wellbutrin
Studie in vitro ukazují, že bupropion je primárně metabolizován na hydroxybupropion prostřednictvím CYP2B6. Proto existuje možnost lékových interakcí mezi Wellbutrinem a léky, které jsou inhibitory nebo induktory CYP2B6. Kromě toho studie in vitro naznačují, že paroxetin, sertralin, norfluoxetin, fluvoxamin a nelfinavir inhibují hydroxylaci bupropionu.
Inhibitory CYP2B6
Tiklopidin, Clopidogrel: Ve studii u zdravých dobrovolníků mužského pohlaví zvýšil klopidogrel 75 mg jednou denně nebo tiklopidin 250 mg dvakrát denně expozici (Cmax a AUC) bupropionu o 40 % a 60 % u klopidogrelu a o 38 % a 85 % u tiklopidinu , resp. Expozice (Cmax a AUC) hydroxybupropionu byly sníženy o 50 % a 52 % u klopidogrelu a o 78 % a 84 % u tiklopidinu. Předpokládá se, že tento účinek je způsoben inhibicí hydroxylace bupropionu katalyzované CYP2B6.
Prasugrel: Prasugrel je slabým inhibitorem CYP2B6. U zdravých jedinců zvýšil prasugrel hodnoty Cmax a AUC bupropionu o 14 % a 18 % a snížil hodnoty Cmax a AUC hydroxybupropionu, aktivního metabolitu bupropionu, o 32 % a 24 %.
Cimetidin: Zdá se, že threohydrobupropionový metabolit bupropionu není produkován enzymy cytochromu P450. Účinky současného podávání cimetidinu na farmakokinetiku bupropionu a jeho aktivních metabolitů byly studovány u 24 zdravých mladých dobrovolníků mužského pohlaví. Po perorálním podání bupropionu 300 mg s cimetidinem 800 mg a bez něj nebyla farmakokinetika bupropionu a hydroxybupropionu ovlivněna. U kombinovaných skupin threohydrobupropionu a erythrohydrobupropionu však došlo k 16% a 32% zvýšení AUC a Cmax.
Citalopram: Citalopram neovlivnil farmakokinetiku bupropionu a jeho tří metabolitů.
Induktory CYP2B6
Ritonavir a lopinavir: Ve studii se zdravými dobrovolníky snížil ritonavir v dávce 100 mg dvakrát denně AUC bupropionu o 22 % a Cmax o 21 %. Expozice metabolitu hydroxybupropion se snížila o 23 %, threohydrobupropion se snížil o 38 % a erythrohydrobupropion se snížil o 48 %.
Ve druhé studii se zdravými dobrovolníky ritonavir v dávce 600 mg dvakrát denně snížil AUC bupropionu o 66 % a Cmax o 62 %. Expozice metabolitu hydroxybupropion se snížila o 78 %, threohydrobupropion se snížil o 50 % a erythrohydrobupropion se snížil o 68 %.
V jiné studii se zdravými dobrovolníky snížil lopinavir 400 mg/ritonavir 100 mg dvakrát denně AUC a Cmax bupropionu o 57 %. AUC a Cmax hydroxybupropionu byly sníženy o 50 % a 31 %.
Efavirenz: Ve studii na zdravých dobrovolnících snížil efavirenz v dávce 600 mg jednou denně po dobu 2 týdnů AUC a Cmax bupropionu přibližně o 55 %, resp. 34 %. AUC hydroxybupropionu se nezměnila, zatímco Cmax hydroxybupropionu byla zvýšena o 50 %.
Karbamazepin, fenobarbital, fenytoin: I když nejsou systematicky studovány, mohou tyto léky indukovat metabolismus bupropionu.
Potenciál Wellbutrinu ovlivnit jiné léky
Údaje na zvířatech ukázaly, že bupropion může být induktorem enzymů metabolizujících léky u lidí. V jedné studii po chronickém podávání bupropionu 100 mg třikrát denně 8 zdravým mužským dobrovolníkům po dobu 14 dnů nebyly žádné důkazy o indukci jeho vlastního metabolismu. Přesto může existovat potenciál pro klinicky významné změny krevních hladin současně podávaných léků.
Léky metabolizované CYP2D6
In vitro jsou bupropion a jeho metabolity (erythrohydrobupropion, threohydrobupropion, hydroxybupropion) inhibitory CYP2D6. V klinické studii s 15 muži (ve věku 19 až 35 let), kteří byli extenzivními metabolizátory CYP2D6, bupropion 300 mg/den následovaný jednou dávkou 50 mg desipraminu zvýšil Cmax, AUC a t½ desipraminu v průměru o přibližně 2-, 5- a 2-násobně. Účinek byl přítomen po dobu nejméně 7 dnů po poslední dávce bupropionu. Současné užívání bupropionu s jinými léky metabolizovanými CYP2D6 nebylo formálně studováno.
Citalopram: Ačkoli citalopram není primárně metabolizován CYP2D6, v jedné studii bupropion zvýšil Cmax citalopramu o 30 % a AUC o 40 %.
Lamotrigin: Opakované perorální dávky bupropionu neměly žádné statisticky významné účinky na farmakokinetiku lamotriginu po jednorázové dávce u 12 zdravých dobrovolníků.
Digoxin: Literární údaje ukázaly, že expozice digoxinu byla snížena, když byla zdravým dobrovolníkům podána jednorázová perorální dávka 0,5 mg digoxinu 24 hodin po jednorázové perorální dávce 150 mg bupropionu s prodlouženým uvolňováním.
Klinické studie
Účinnost přípravku WELLBUTRIN 150 mg v léčbě velké depresivní poruchy byla stanovena ve dvou 4týdenních placebem kontrolovaných studiích u dospělých pacientů s MDD (zkoušky 1 a 2 v tabulce 4) a v jedné 6týdenní, placebem kontrolované studii dospělí ambulantní pacienti s MDD (zkouška 3 v tabulce 4). V první studii bylo rozmezí dávek 300 mg přípravku ELLBUTRIN 300 mg až 600 mg/den podávaných ve 3 dílčích dávkách; 78 % subjektů bylo léčeno dávkami 300 mg až 450 mg/den. Studie prokázala účinnost přípravku WELLBUTRIN 300 mg měřenou celkovým skóre Hamiltonovy škály hodnocení deprese (HDRS), položky depresivní nálady HDRS (položka 1) a skóre závažnosti klinických globálních dojmů (CGI-S). Druhá studie zahrnovala 2 dávky ELLBUTRINU (300 a 450 mg/den) a placebo. Tato studie prokázala účinnost přípravku Wellbutrin 150 mg pouze v dávce 450 mg/den. Výsledky účinnosti byly statisticky významné pro celkové skóre HDRS a skóre CGI-S, ale ne pro HDRS Položka 1. Ve třetí studii byli ambulantně léčeni 300 mg/den WELLBUTRINU. Tato studie prokázala účinnost přípravku WELLBUTRIN 150 mg měřenou celkovým skóre HDRS, bodem 1 HDRS, Montgomery-Asbergovou škálou pro hodnocení deprese (MADRS), skóre CGI-S a skóre CGI-Improvement Scale (CGI-I). . Účinnost přípravku Wellbutrin 300 mg při dlouhodobém užívání, tj. déle než 6 týdnů, nebyla v kontrolovaných studiích systematicky hodnocena.
INFORMACE PRO PACIENTA
Wellbutrin (WELL byu-trin) (bupropion hydrochlorid) Tablety
DŮLEŽITÉ: Ujistěte se, že jste si přečetli tři části této Příručky pro léky. První část pojednává o riziku sebevražedných myšlenek a jednání s antidepresivy; druhá část je o riziku změn myšlení a chování, depresích a sebevražedných myšlenkách nebo akcích s léky užívanými k odvykání kouření; a třetí část je nazvaná „Jaké další důležité informace bych měl vědět o ELLBUTRINU 150 mg?“
Antidepresiva, deprese a jiná vážná duševní onemocnění a sebevražedné myšlenky nebo činy
Tato část Příručky o medikaci je pouze o riziku sebevražedných myšlenek a jednání s antidepresivy.
Jaké jsou nejdůležitější informace, které bych měl vědět o antidepresivech, depresi a jiných vážných duševních chorobách a sebevražedných myšlenkách nebo činech?
1. Antidepresiva mohou zvýšit riziko sebevražedných myšlenek nebo činů u některých dětí, dospívajících nebo mladých dospělých během prvních několika měsíců léčby.
2. Deprese nebo jiná závažná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek a činů. Někteří lidé mohou mít zvláště vysoké riziko sebevražedných myšlenek nebo činů. Patří mezi ně lidé, kteří mají (nebo mají v rodinné anamnéze) bipolární nemoc (nazývanou také maniodepresivní nemoc) nebo sebevražedné myšlenky nebo činy.
3. Jak mohu sledovat a snažit se předcházet sebevražedným myšlenkám a činům u sebe nebo člena rodiny?
- Věnujte zvýšenou pozornost všem změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte svému poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče podle plánu. Zavolejte poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud vy nebo váš rodinný příslušník máte některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- myšlenky na sebevraždu nebo smrt
- pokusy o sebevraždu
- nová nebo horší deprese
- nová nebo horší úzkost
- pocit velkého rozrušení nebo neklidu
- panický záchvat
- potíže se spánkem (nespavost)
- nová nebo horší podrážděnost
- chovat se agresivně, být naštvaný nebo násilný
- působící na nebezpečné impulsy
- extrémní nárůst aktivity a mluvení (mánie)
- jiné neobvyklé změny v chování nebo náladě
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili s poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité probrat všechna rizika léčby deprese a také rizika její neléčení. Pacienti a jejich rodiny nebo jiní pečovatelé by měli s poskytovatelem zdravotní péče diskutovat o všech možnostech léčby, nejen o užívání antidepresiv.
- Antidepresiva mají další vedlejší účinky. Promluvte si s poskytovatelem zdravotní péče o vedlejších účincích léku předepsaného vám nebo vašemu rodinnému příslušníkovi.
- Antidepresiva mohou interagovat s jinými léky. Znát všechny léky, které užíváte vy nebo váš rodinný příslušník. Uchovávejte seznam všech léků, abyste je mohli ukázat poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
Není známo, zda je přípravek Wellbutrin bezpečný a účinný u dětí mladších 18 let.
Přestat kouřit, přestat kouřit léky, změny myšlení a chování, deprese a sebevražedné myšlenky nebo činy
Tato část Příručky o medikaci se týká pouze rizika změn myšlení a chování, deprese a sebevražedných myšlenek nebo činů s drogami používanými k odvykání kouření. I když WELLBUTRIN není lékem k odvykání kouření, obsahuje stejnou účinnou látku (bupropion hydrochlorid) jako ZYBAN, který se používá k pomoci pacientům přestat kouřit.
Promluvte si se svým poskytovatelem zdravotní péče nebo poskytovatelem zdravotní péče vašeho člena rodiny o:
- všechna rizika a přínosy léků na odvykání kouření.
- všechny možnosti léčby pro odvykání kouření.
Když se pokusíte přestat kouřit, s bupropionem nebo bez něj, můžete mít příznaky, které mohou být způsobeny abstinencí nikotinu, včetně:
- nutkání kouřit
- frustrace
- neklid
- depresivní nálada
- hněv
- snížená srdeční frekvence
- problémové spaní
- pocit úzkosti
- zvýšená chuť k jídlu
- podrážděnost
- potíže se soustředěním
- přibývání na váze
Někteří lidé dokonce zažili sebevražedné myšlenky, když se snažili přestat kouřit bez léků.
Někdy může přestat kouřit vést ke zhoršení problémů duševního zdraví, které již máte, jako je deprese.
Někteří lidé měli vážné vedlejší účinky při užívání bupropionu, aby jim pomohl přestat kouřit, včetně: Nové nebo horší problémy s duševním zdravím, jako jsou změny v chování nebo myšlení, agresivita, nepřátelství, neklid, deprese nebo sebevražedné myšlenky nebo činy. Někteří lidé měli tyto příznaky, když začali užívat bupropion, au jiných se rozvinuly po několika týdnech léčby nebo po vysazení bupropionu. Tyto příznaky se vyskytovaly častěji u lidí, kteří měli v anamnéze problémy s duševním zdravím před užitím bupropionu, než u lidí, kteří v minulosti problémy s duševním zdravím neměli.
Přestaňte užívat přípravek WELLBUTRIN a okamžitě zavolejte svého poskytovatele zdravotní péče, pokud vy, vaše rodina nebo pečovatel zaznamenáte některý z těchto příznaků. Spolupracujte se svým poskytovatelem zdravotní péče, abyste se rozhodli, zda máte pokračovat v užívání přípravku WELLBUTRIN. U mnoha lidí tyto příznaky vymizely po vysazení přípravku WELLBUTRIN 300 mg, ale u některých lidí příznaky přetrvávaly i po vysazení přípravku WELLBUTRIN. Je důležité, abyste sledovali svého poskytovatele zdravotní péče, dokud příznaky nezmizí. Před užitím přípravku Wellbutrin 150 mg informujte svého poskytovatele zdravotní péče, pokud jste někdy měl(a) depresi nebo jiné problémy s duševním zdravím. Měli byste také informovat svého poskytovatele zdravotní péče o všech příznacích, které jste měli během jiných období, kdy jste se pokusili přestat kouřit, s bupropionem nebo bez něj.
Jaké další důležité informace bych měl vědět o WELLBUTRINU?
- Záchvaty: Při užívání přípravku Wellbutrin 150 mg existuje možnost záchvatu (křeče, záchvat), zejména u lidí:
- s určitými zdravotními problémy.
- kteří užívají určité léky. Pravděpodobnost záchvatů se zvyšuje s vyššími dávkami Wellbutrinu. Další informace naleznete v části „Kdo by neměl užívat WELLBUTRIN?“ a „Co bych měl říct svému poskytovateli zdravotní péče, než začnu užívat přípravek Wellbutrin 300 mg?“ Informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech a všech lécích, které užíváte. Během užívání přípravku Elontril 150 mg neužívejte žádné jiné léky, pokud váš poskytovatel zdravotní péče neřekl, že je v pořádku je užívat. Pokud dostanete záchvat během užívání přípravku Wellbutrin, přestaňte tablety užívat a ihned kontaktujte svého poskytovatele zdravotní péče. Pokud máte záchvat, neužívejte přípravek Wellbutrin 150 mg znovu.
- Vysoký krevní tlak (hypertenze). Někteří lidé mají při užívání Wellbutrinu vysoký krevní tlak, který může být závažný. Pravděpodobnost vysokého krevního tlaku může být vyšší, pokud současně používáte nikotinovou substituční terapii (jako je nikotinová náplast), která vám pomůže přestat kouřit (viz část této Příručky pro léky nazvaná „Jak mám užívat přípravek WELLBUTRIN 150 mg?“).
- Manické epizody. Někteří lidé mohou mít během užívání Wellbutrinu 300 mg období mánie, včetně:
- Výrazně zvýšená energie
- Vážné potíže se spánkem
- Závodní myšlenky
- Bezohledné chování
- Nezvykle velkolepé nápady
- Nadměrné štěstí nebo podrážděnost
- Mluvte více nebo rychleji než obvykle Pokud máte některý z výše uvedených příznaků mánie, zavolejte svého poskytovatele zdravotní péče.
- Neobvyklé myšlenky nebo chování. Někteří pacienti mají při užívání přípravku Wellbutrin neobvyklé myšlenky nebo chování, včetně bludů (věříte, že jste někdo jiný), halucinací (vidíte nebo slyšíte věci, které neexistují), paranoie (pocit, že lidé jsou proti vám) nebo pocit zmatenosti. Pokud se vám to stane, zavolejte svého poskytovatele zdravotní péče.
- Vizuální problémy.
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo v jeho okolí Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
- Závažné alergické reakce. Někteří lidé mohou mít závažné alergické reakce na Wellbutrin. Přestaňte užívat přípravek WELLBUTRIN 300 mg a ihned kontaktujte svého poskytovatele zdravotní péče jestliže se u Vás objeví vyrážka, svědění, kopřivka, horečka, zduřené lymfatické uzliny, bolestivé vřídky v ústech nebo kolem očí, otoky rtů nebo jazyka, bolest na hrudi nebo potíže s dýcháním. Mohou to být příznaky závažné alergické reakce.
Co je WELLBUTRIN?
WELLBUTRIN je lék na předpis používaný k léčbě dospělých s určitým typem deprese nazývaným velká depresivní porucha.
Kdo by neměl užívat ELLBUTRIN 150 mg?
Neužívejte přípravek Wellbutrin, pokud ano
- máte nebo jste měli záchvatové onemocnění nebo epilepsii.
- máte nebo jste měli poruchu příjmu potravy, jako je anorexie nervosa nebo bulimie.
- užíváte jakékoli jiné léky, které obsahují bupropion, včetně ZYBANu (používaný k pomoci lidem přestat kouřit), Wellbutrinu 300 mg SR, Wellbutrinu 150 mg XL, APLENZIN nebo FORFIVO XL. Bupropion je stejná účinná látka, která je obsažena v Wellbutrinu.
- pijte hodně alkoholu a náhle přestaňte pít, nebo užívejte léky zvané sedativa (uspívají vám), benzodiazepiny nebo léky proti záchvatům, a najednou je přestanete užívat.
- užívat inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu.
- neužívejte IMAO do 2 týdnů po ukončení léčby přípravkem Wellbutrin, pokud vám to nenařídí váš poskytovatel zdravotní péče.
- nezačínejte přípravek Wellbutrin 150 mg, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš poskytovatel zdravotní péče.
- jste alergičtí na účinnou látku v přípravku Wellbutrin 300 mg, bupropion nebo na kteroukoli neaktivní složku. Úplný seznam složek v přípravku WELLBUTRIN naleznete na konci této Příručky k medikaci.
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku WELLBUTRIN?
Informujte svého poskytovatele zdravotní péče, pokud jste někdy měli depresi, sebevražedné myšlenky nebo činy nebo jiné problémy duševního zdraví. Viz „Antidepresiva, deprese a jiné vážné duševní choroby a sebevražedné myšlenky nebo činy“.
- Informujte svého poskytovatele zdravotní péče o svých dalších zdravotních stavech, včetně toho, zda:
- máte problémy s játry, zejména cirhózu jater.
- mít problémy s ledvinami.
- máte nebo jste měli poruchu příjmu potravy, jako je anorexie nervosa nebo bulimie.
- měli poranění hlavy.
- měl(a) záchvat (křeče, záchvat).
- máte nádor v nervovém systému (mozek nebo páteř).
- jste měli srdeční infarkt, srdeční problémy nebo vysoký krevní tlak.
- jste diabetik, který užívá inzulín nebo jiné léky ke kontrole hladiny cukru v krvi.
- pít alkohol.
- zneužívat léky na předpis nebo pouliční drogy.
- jste těhotná nebo plánujete otěhotnět. Poraďte se se svým poskytovatelem zdravotní péče o riziku pro vaše nenarozené dítě, pokud užíváte ELBUTRIN 300 mg během těhotenství.
- Informujte svého poskytovatele zdravotní péče, pokud během léčby přípravkem Wellbutrin otěhotníte nebo si myslíte, že jste těhotná.
- Pokud během léčby přípravkem WELLBUTRIN otěhotníte, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro antidepresiva. Můžete se zaregistrovat na telefonním čísle 1-844-405-6185.
- kojíte nebo plánujete kojit během léčby přípravkem Wellbutrin. Wellbutrin přechází do vašeho mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během léčby přípravkem WELLBUTRIN.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis, volně prodejných léků, vitamínů a bylinných doplňků. Mnoho léků zvyšuje vaše šance na záchvaty nebo jiné závažné nežádoucí účinky, pokud je užíváte během užívání přípravku Wellbutrin.
Jak mám užívat ELLBUTRIN 300 mg?
- Užívejte WELLBUTRIN 300 mg přesně podle pokynů svého poskytovatele zdravotní péče. Neměňte svou dávku ani nepřestávejte užívat přípravek Wellbutrin, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče.
- Tablety ELLBUTRINU spolkněte celé. Tablety Wellbutrinu 300 mg nežvýkejte, nekrájejte ani nedrťte.
- Užívejte ELLBUTRIN 300 mg každý den ve stejnou dobu.
- Dávky přípravku Wellbutrin 300 mg užívejte s odstupem alespoň 6 hodin.
- Wellbutrin můžete užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku, neužívejte další dávku, abyste nahradili vynechanou dávku. Počkejte a vezměte si další dávku v obvyklou dobu. Tohle je velmi důležité. Příliš mnoho welbutrinu může zvýšit vaši šanci na záchvat.
- Pokud užijete příliš mnoho přípravku WELLBUTRIN nebo se předávkujete, okamžitě zavolejte místní pohotovost nebo toxikologické centrum.
- Neužívejte žádné jiné léky během užívání přípravku Elontril 300 mg, pokud vám váš poskytovatel zdravotní péče neřekl, že je to v pořádku.
- Pokud užíváte přípravek Wellbutrin 150 mg k léčbě velké depresivní poruchy, může trvat několik týdnů, než ucítíte, že přípravek Wellbutrin 150 mg účinkuje. Jakmile se budete cítit lépe, je důležité pokračovat v užívání přípravku WELLBUTRIN přesně podle pokynů vašeho poskytovatele zdravotní péče. Pokud nemáte pocit, že WELLBUTRIN pro vás nefunguje, zavolejte svého poskytovatele zdravotní péče.
Čemu se mám vyvarovat při užívání přípravku Wellbutrin 300 mg?
- Během léčby přípravkem Wellbutrin omezte nebo se vyvarujte pití alkoholu. Pokud obvykle pijete hodně alkoholu, promluvte si se svým poskytovatelem zdravotní péče, než náhle přestanete. Pokud náhle přestanete pít alkohol, můžete zvýšit riziko záchvatů.
- Neřiďte auto ani neobsluhujte těžké stroje, dokud nezjistíte, jak na Vás Elontril 150 mg působí. WELLBUTRIN může ovlivnit vaši schopnost dělat tyto věci bezpečně.
Jaké jsou možné vedlejší účinky přípravku Wellbutrin 300 mg?
Wellbutrin může způsobit závažné nežádoucí účinky. Informace o závažných vedlejších účincích přípravku Wellbutrin naleznete v částech na začátku tohoto Průvodce léčivými přípravky.
Mezi nejčastější vedlejší účinky přípravku Wellbutrin patří:
- nervozita
- silné pocení
- suchá ústa
- třes (třes)
- zácpa
- problémové spaní
- bolest hlavy
- rozmazané vidění
- nevolnost nebo zvracení
- rychlý srdeční tep
- závrať
Pokud máte nevolnost, vezměte si lék s jídlem. Máte-li potíže se spánkem, neužívejte lék příliš blízko před spaním.
Okamžitě informujte svého poskytovatele zdravotní péče o jakýchkoli nežádoucích účincích, které vás obtěžují.
To nejsou všechny možné vedlejší účinky přípravku Wellbutrin. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého poskytovatele zdravotní péče a požádejte o radu ohledně vedlejších účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Nežádoucí účinky můžete také hlásit společnosti GlaxoSmithKline na čísle 1-888-825-5249.
Jak mám ELLBUTRIN 300 mg uchovávat?
- Uchovávejte WELLBUTRIN při pokojové teplotě mezi 68 °F a 77 °F (20 °C až 25 °C).
- Uchovávejte tablety Wellbutrinu suché a mimo světlo.
Uchovávejte ELLBUTRIN a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání přípravku WELLBUTRIN.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte přípravek WELLBUTRIN 300 mg při onemocnění, pro které nebyl předepsán. Nedávejte WELLBUTRIN jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Pokud podstoupíte screeningový test na drogy v moči, Wellbutrin může mít výsledek testu pozitivní na amfetaminy. Pokud osobě, která vám provádí screeningový test na drogy, řeknete, že užíváte WELLBUTRIN 300 mg, může provést konkrétnější screeningový test na drogy, u kterého by tento problém neměl být.
Tento průvodce léčivy shrnuje důležité informace o přípravku WELLBUTRIN. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku WELLBUTRIN, který je určen pro zdravotnické pracovníky.
Pro více informací o WELLBUTRINU volejte 1-888-825-5249.
Jaké jsou složky přípravku WELLBUTRIN 300 mg?
Účinná látka: bupropion hydrochlorid.
Neaktivní složky: 75mg tableta – D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcelulóza, hypromelóza, mikrokrystalická celulóza, polyethylenglykol, mastek a oxid titaničitý; 100mg tableta – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcelulóza, hypromelóza, mikrokrystalická celulóza, polyethylenglykol, mastek a oxid titaničitý.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
