Lexapro 10mg, 20mg, 5mg Escitalopram Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Lexapro a jak se používá?
Lexapro je lék na předpis používaný k léčbě příznaků velké depresivní poruchy a generalizované úzkostné poruchy. Lexapro lze užívat samostatně nebo s jinými léky.
- Lexapro patří do třídy léků nazývaných antidepresiva, SSRI.
- Není známo, zda je přípravek Lexapro 10 mg bezpečný a účinný u dětí mladších 12 let.
Jaké jsou možné vedlejší účinky přípravku Lexapro?
Lexapro může způsobit závažné nežádoucí účinky, včetně:
- Bolest břicha,
- Abnormální krvácení,
- Abnormální sny,
- Alergie,
- rozmazané vidění,
- tunelové vidění,
- bolest na hrudi,
- snížená koncentrace,
- hemostáza,
- bolest nebo otok očí,
- vidět halo kolem světel,
- závodní myšlenky,
- neobvyklé rizikové chování,
- pocity extrémního štěstí nebo smutku,
- bolest hlavy,
- pálení žáhy,
- návaly horka,
- zmatek,
- nezřetelná řeč,
- těžká slabost,
- zvracení,
- ztráta koordinace,
- pocit nejistoty,
- velmi ztuhlé (tuhé) svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- otřesy a
- točení hlavy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Lexapro patří:
- závrať,
- ospalost,
- slabost,
- pocení,
- pocit třesu nebo úzkosti,
- problémy se spánkem (nespavost),
- suchá ústa,
- ztráta chuti k jídlu,
- nevolnost,
- zácpa,
- zívání,
- změny hmotnosti,
- snížená chuť na sex,
- impotence a
- potíže s orgasmem
VAROVÁNÍ
SEBEVRAŽDA A ANTIDEPRESIVA
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití přípravku Lexapro nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. Přípravek Lexapro 5 mg není schválen pro použití u pediatrických pacientů mladších 12 let. [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ Klinické zhoršení a riziko sebevraždy, INFORMACE PRO PACIENTA , a Použití u konkrétních populací : Pediatrické použití].
POPIS
Lexapro® (escitalopram oxalát) je perorálně podávaný selektivní inhibitor zpětného vychytávání serotoninu (SSRI). Escitalopram je čistý senantiomer (jediný izomer) racemického bicyklického ftalanového derivátu citalopramu. Escitalopram oxalát je označen S-(+)-1-[3(dimethyl-amino)propyl]-1-(p-fluorfenyl)-5-ftalankarbonitril oxalát s následujícím strukturním vzorcem:
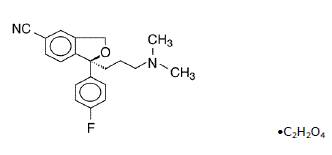
Molekulární vzorec je C20H21FN2O • C2H2O4 a molekulová hmotnost je 414,40.
Escitalopram oxalát se vyskytuje jako jemný, bílý až slabě nažloutlý prášek a je volně rozpustný v methanolu a dimethylsulfoxidu (DMSO), rozpustný v izotonickém fyziologickém roztoku, mírně rozpustný ve vodě a ethanolu, mírně rozpustný v ethylacetátu a nerozpustný v heptanu.
Lexapro (escitalopram oxalát) je dostupný ve formě tablet nebo jako perorální roztok.
Tablety Lexapro jsou potahované, kulaté tablety obsahující escitalopram-oxalát v síle ekvivalentní 5 mg, 10 mg a 20 mg báze escitalopramu. Tablety 10 a 20 mg jsou označeny rýhou. Tablety také obsahují následující neaktivní složky: mastek, sodnou sůl kroskarmelózy, mikrokrystalickou celulózu/koloidní oxid křemičitý a stearát hořečnatý. Filmový povlak obsahuje hypromelózu, oxid titaničitý a polyethylenglykol.
Lexapro 5 mg perorální roztok obsahuje escitaloprami oxalát odpovídající 1 mg/ml báze escitalopramu. Dále obsahuje následující neaktivní složky: sorbitol, čištěnou vodu, kyselinu citrónovou, citrát sodný, kyselinu jablečnou, glycerin, propylenglykol, methylparaben, propylparaben a přírodní aroma máty peprné.
INDIKACE
Velká depresivní porucha
Lexapro (escitalopram) je indikován k akutní a udržovací léčbě velké depresivní poruchy u dospělých a dospívajících ve věku 12 až 17 let (viz Klinické studie ].
Velká depresivní epizoda (DSM-IV) znamená výraznou a relativně přetrvávající (téměř každý den po dobu alespoň 2 týdnů) depresivní nebo dysforickou náladu, která obvykle narušuje každodenní fungování a zahrnuje alespoň pět z následujících devíti příznaků: depresivní náladu, ztráta zájmu o obvyklé činnosti, významná změna hmotnosti a/nebo chuti k jídlu, nespavost nebo hypersomnie, psychomotorická agitace nebo retardace, zvýšená únava, pocity viny nebo bezcennosti, zpomalené myšlení nebo porucha koncentrace, pokus o sebevraždu nebo sebevražedné myšlenky.
Generalizovaná úzkostná porucha
Lexapro 20 mg je indikován k akutní léčbě generalizované úzkostné poruchy (GAD) u dospělých (viz Klinické studie ].
Generalizovaná úzkostná porucha (DSM-IV) je charakterizována nadměrnou úzkostí a obavami (očekávaným očekáváním), které přetrvávají po dobu nejméně 6 měsíců a které člověk obtížně kontroluje. Musí být spojeno s alespoň 3 z následujících příznaků: neklid nebo pocit nervozity nebo nervozity, snadná únava, potíže se soustředěním nebo prázdnotou, podrážděnost, svalové napětí a poruchy spánku.
DÁVKOVÁNÍ A PODÁVÁNÍ
Lexapro 5 mg se má podávat jednou denně, ráno nebo večer, s jídlem nebo bez jídla.
Velká depresivní porucha
Počáteční léčba
Dospívající
Doporučená dávka přípravku Lexapro je 10 mg jednou denně. Studie s flexibilní dávkou Lexapro (10 až 20 mg/den) prokázala účinnost Lexapro [viz Klinické studie ]. Pokud se dávka zvýší na 20 mg, mělo by k tomu dojít minimálně po třech týdnech.
Dospělí
Doporučená dávka přípravku Lexapro 10 mg je 10 mg jednou denně. Studie s fixní dávkou Lexapro prokázala účinnost jak 10 mg, tak 20 mg Lexapro 5 mg, ale neprokázala větší přínos 20 mg oproti 10 mg [viz Klinické studie ]. Pokud se dávka zvýší na 20 mg, mělo by k tomu dojít minimálně po jednom týdnu.
Udržovací léčba
Všeobecně se souhlasí s tím, že akutní epizody velké depresivní poruchy vyžadují několik měsíců nebo déle trvalé farmakologické terapie nad rámec odpovědi na akutní epizodu. Systematické hodnocení pokračování Lexapro 10 nebo 20 mg/den u dospělých pacientů s velkou depresivní poruchou, kteří reagovali na užívání Lexapro během 8týdenní fáze akutní léčby, prokázalo přínos takové udržovací léčby (viz Klinické studie ]. Nicméně lékař, který se rozhodne užívat Lexapro 5 mg po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Generalizovaná úzkostná porucha
Počáteční léčba
Dospělí
Doporučená počáteční dávka přípravku Lexapro je 10 mg jednou denně. Pokud se dávka zvýší na 20 mg, mělo by k tomu dojít minimálně po jednom týdnu.
Udržovací léčba
Generalizovaná úzkostná porucha je považována za chronický stav. Účinnost přípravku Lexapro při léčbě GAD delší než 8 týdnů nebyla systematicky studována. Lékař, který se rozhodne používat Lexapro po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta.
Obrazovka pro bipolární poruchu před zahájením léčby Lexapro
Před zahájením léčby přípravkem Lexapro nebo jiným antidepresivem proveďte screening pacientů na osobní rodinnou anamnézu bipolární poruchy, mánie nebo hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zvláštní populace
10 mg/den je doporučená dávka pro většinu starších pacientů a pacientů s poruchou funkce jater.
U pacientů s mírnou nebo středně těžkou poruchou funkce ledvin není nutná žádná úprava dávkování. Lexapro by měl být používán s opatrností u pacientů s těžkou poruchou funkce ledvin.
Přerušení léčby Lexapro
Byly hlášeny příznaky spojené s vysazením Lexapro 5 mg a dalších SSRI a SNRI (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pacienti by měli být sledováni s ohledem na výskyt těchto příznaků při přerušení léčby. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, lze zvážit obnovení předchozí předepsané dávky. Následně může lékař pokračovat ve snižování dávky, ale pozvolnějším tempem.
Přechod pacienta na nebo z inhibitoru monoaminooxidázy (MAOI) určeného k léčbě psychiatrických poruch
Mezi vysazením IMAO určeného k léčbě psychiatrických poruch a zahájením léčby přípravkem Lexapro by mělo uplynout alespoň 14 dní. Naopak, po vysazení Lexapro 20 mg by mělo být umožněno alespoň 14 dní před zahájením IMAO určeného k léčbě psychiatrických poruch [viz KONTRAINDIKACE ].
Použití Lexapro s jinými MAOI, jako je linezolid nebo methylenová modř
Nezačínejte léčbu přípravkem Lexapro 5 mg u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, protože existuje zvýšené riziko serotoninového syndromu. U pacienta, který vyžaduje naléhavější léčbu psychiatrického stavu, je třeba zvážit další intervence, včetně hospitalizace [viz KONTRAINDIKACE ].
některých případech může pacient, který již dostává léčbu přípravkem Lexapro 10 mg, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou k dispozici přijatelné alternativy k léčbě linezolidem nebo intravenózní methylenovou modří a potenciální přínosy léčby linezolidem nebo intravenózní methylenovou modří u konkrétního pacienta převažují nad riziky serotoninového syndromu, měl by být Lexapro okamžitě ukončen a linezolid nebo intravenózní léčba methylenovou modří lze podávat. Pacient by měl být sledován na příznaky serotoninového syndromu po dobu 2 týdnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Léčba přípravkem Lexapro může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg u přípravku Lexapro 10 mg není jasné. Lékař by si však měl být vědom možnosti vzniku symptomů serotoninového syndromu při takovém použití [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety
Lexapro 10 mg tablety jsou potahované, kulaté tablety obsahující escitalopram-oxalát v síle ekvivalentní 5 mg, 10 mg a 20 mg báze escitalopramu. Tablety 10 a 20 mg jsou označeny rýhou. S potiskem „FL“ na jedné straně a „5“, „10“ nebo „20“ na druhé straně podle jejich příslušné síly.
Orální roztok
Lexapro perorální roztok obsahuje escitalopram oxalát odpovídající 1 mg/ml báze escitalopramu (v současnosti není na trhu).
Skladování A Manipulace
Tablety
5 mg tablety
Láhev 100 - NDC # 0456-2005-01
Bílé až téměř bílé, kulaté, bez rýhy, potažené filmem. Potisk „FL“ na jedné straně tabletu a „5“ na druhé straně.
10 mg tablety
Láhev 100 - NDC 0456-2010-01 10 x 10 jednotková dávka - NDC # 0456-2010-63
Bílé až téměř bílé, kulaté, rýhované, potažené filmem. Potisk na rýhované straně s "F" na levé straně a "L" na pravé straně. Potisk na straně bez rýhy s „10“.
20 mg tablety
Láhev 100 - NDC # 0456-2020-01 10 x 10 jednotková dávka - NDC # 0456-2020-63
Bílé až téměř bílé, kulaté, rýhované, potažené filmem. Potisk na rýhované straně s "F" na levé straně a "L" na pravé straně. Potisk na straně bez rýhy s „20“.
Orální roztok
5 mg/5 ml, příchuť máty peprné (240 ml) - NDC # 0456-2101-08. Perorální roztok není v současné době uváděn na trh.
Skladování A Manipulace
Skladujte při teplotě 20 °C až 25 °C (68 °F až 77 °F); povoleny výchylky do 15 až 30 °C (59 až 86 °F).
Distribuce: Allergan USA, Inc. Madison, NJ 07940. Revize: září 2021
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Zdroje dat klinických studií
Pediatrie (6-17 let)
Nežádoucí účinky byly shromážděny u 576 pediatrických pacientů (286 Lexapro 5 mg, 290 placebo) s velkou depresivní poruchou ve dvojitě zaslepených placebem kontrolovaných studiích. Bezpečnost a účinnost přípravku Lexapro 5 mg u pediatrických pacientů mladších 12 let nebyla stanovena.
Dospělí
Informace o nežádoucích účincích pro Lexapro 5 mg byly shromážděny od 715 pacientů s velkou depresivní poruchou, kteří byli vystaveni escitalopramu, a od 592 pacientů, kteří byli vystaveni placebu ve dvojitě zaslepených, placebem kontrolovaných studiích. Dalších 284 pacientů s velkou depresivní poruchou bylo nově vystaveno escitalopramu v otevřených studiích. Informace o nežádoucích účincích přípravku Lexapro u pacientů s GAD byly shromážděny od 429 pacientů vystavených escitalopramu a od 427 pacientů vystavených placebu ve dvojitě zaslepených, placebem kontrolovaných studiích.
Nežádoucí příhody během expozice byly primárně získány obecným dotazováním a zaznamenány klinickými zkoušejícími s použitím terminologie podle vlastního výběru. V důsledku toho není možné poskytnout smysluplný odhad podílu jedinců, u kterých se vyskytly nežádoucí příhody, aniž by se nejprve seskupily podobné typy příhod do menšího počtu standardizovaných kategorií příhod. V následujících tabulkách a tabulkách byla pro klasifikaci hlášených nežádoucích účinků použita standardní terminologie Světové zdravotnické organizace (WHO).
Uvedené frekvence nežádoucích účinků představují podíl jedinců, kteří alespoň jednou prodělali nežádoucí příhodu typu, která se objevila po léčbě. Příhoda byla považována za urgentní, pokud se objevila poprvé nebo se zhoršila během léčby po základním hodnocení.
Nežádoucí příhody spojené s přerušením léčby
Velká depresivní porucha
Pediatrie (6-17 let)
Nežádoucí účinky byly spojeny s vysazením 3,5 % z 286 pacientů užívajících Lexapro a 1 % z 290 pacientů užívajících placebo. Nejčastější nežádoucí příhodou (výskyt alespoň 1 % pro Lexapro 10 mg a vyšší než placebo) související s vysazením byla nespavost (1 % Lexapro, 0 % placebo).
Dospělí
Ze 715 pacientů s depresí, kteří dostávali Lexapro v placebem kontrolovaných studiích, 6 % přerušilo léčbu z důvodu nežádoucí příhody ve srovnání s 2 % z 592 pacientů, kteří dostávali placebo. Ve dvou studiích s fixní dávkou se míra vysazení z důvodu nežádoucích účinků u pacientů užívajících 10 mg/den Lexapro 20 mg významně nelišila od míry vysazení z důvodu nežádoucích příhod u pacientů užívajících placebo. Četnost přerušení z důvodu nežádoucích účinků u pacientů, kterým byla přidělena fixní dávka Lexapro 20 mg/den, byla 10 %, což se významně lišilo od četnosti přerušení z důvodu nežádoucích účinků u pacientů užívajících 10 mg/den Lexapro (4 %) a placebo (3 %). Nežádoucí příhody, které byly spojeny s přerušením léčby u nejméně 1 % pacientů léčených přípravkem Lexapro 5 mg a jejichž četnost byla nejméně dvojnásobná než u placeba, byly nauzea (2 %) a porucha ejakulace (2 % pacientů mužského pohlaví).
Generalizovaná úzkostná porucha
Dospělí
Mezi 429 pacienty s GAD, kteří dostávali Lexapro 10-20 mg/den v placebem kontrolovaných studiích, 8 % přerušilo léčbu z důvodu nežádoucí příhody ve srovnání se 4 % ze 427 pacientů, kteří dostávali placebo. Nežádoucí příhody, které byly spojeny s vysazením alespoň 1 % pacientů léčených přípravkem Lexapro 20 mg a jejichž četnost byla alespoň dvojnásobná než u placeba, byly nauzea (2 %), nespavost (1 %) a únava (1 %).
Výskyt nežádoucích reakcí v placebem kontrolovaných klinických studiích
Velká depresivní porucha
Pediatrie (6-17 let)
Celkový profil nežádoucích účinků u pediatrických pacientů byl obecně podobný profilu pozorovanému ve studiích u dospělých, jak je uvedeno v tabulce 2. Nicméně následující nežádoucí účinky (s výjimkou těch, které jsou uvedeny v tabulce 2 a těch, pro které byly kódované výrazy neinformativní nebo zavádějící ) byly hlášeny s výskytem nejméně 2 % pro Lexapro a vyšší než u placeba: bolesti zad, infekce močových cest, zvracení a ucpaný nos.
Dospělí
Nejčastěji pozorovanými nežádoucími účinky u pacientů s Lexaprom 10 mg (výskyt přibližně 5 % nebo vyšší a přibližně dvojnásobný výskyt u pacientů s placebem) byly nespavost, porucha ejakulace (především zpoždění ejakulace), nauzea, zvýšené pocení, únava a ospalost.
Tabulka 2 vyjmenovává výskyt, zaokrouhlený na nejbližší procenta, nežádoucích účinků souvisejících s léčbou, které se vyskytly u 715 pacientů s depresí, kteří dostávali Lexapro 20 mg v dávkách od 10 do 20 mg/den v placebem kontrolovaných studiích. Zahrnuty jsou příhody, které se vyskytly u 2 % nebo více pacientů léčených přípravkem Lexapro 20 mg a jejichž incidence u pacientů léčených přípravkem Lexapro 10 mg byla vyšší než u pacientů léčených placebem.
TABULKA 2 Nežádoucí účinky objevující se po léčbě pozorované s frekvencí ≥ 2 % a vyšší než u placeba u velké depresivní poruchy
Generalizovaná úzkostná porucha
Dospělí
Nejčastěji pozorovanými nežádoucími účinky u pacientů s Lexapro (výskyt přibližně 5 % nebo vyšší a přibližně dvojnásobný výskyt u pacientů s placebem) byly nauzea, porucha ejakulace (především zpoždění ejakulace), nespavost, únava, snížené libido a anorgasmie.
vyjmenovává incidenci zaokrouhlenou na nejbližší procento nežádoucích účinků souvisejících s léčbou, které se vyskytly u 429 pacientů s GAD, kteří dostávali Lexapro 10 až 20 mg/den v placebem kontrolovaných studiích. Zahrnuty jsou příhody, které se vyskytly u 2 % nebo více pacientů léčených přípravkem Lexapro a jejichž incidence u pacientů léčených přípravkem Lexapro byla vyšší než u pacientů léčených placebem.
TABULKA 3 Nežádoucí účinky objevující se po léčbě pozorované s frekvencí ≥ 2 % a vyšší než u placeba pro generalizovanou úzkostnou poruchu
Závislost na dávce nežádoucích účinků
Potenciální závislost běžných nežádoucích účinků na dávce (definovaná jako míra výskytu ≥5 % buď ve skupinách s 10 mg nebo 20 mg Lexapro) byla zkoumána na základě kombinované incidence nežádoucích účinků ve dvou studiích s fixní dávkou. Celková míra výskytu nežádoucích účinků u pacientů léčených Lexaprom v dávce 10 mg (66 %) byla podobná jako u pacientů léčených placebem (61 %), zatímco míra výskytu u pacientů léčených Lexaprom v dávce 20 mg/den byla vyšší (86 %). Tabulka 4 ukazuje běžné nežádoucí účinky, které se vyskytly ve skupině s 20 mg/den Lexapro s incidencí, která byla přibližně dvakrát vyšší než ve skupině s 10 mg/den Lexapro 10 mg a přibližně dvojnásobná než ve skupině s placebem.
TABULKA 4 Výskyt běžných nežádoucích reakcí u pacientů s velkou depresivní poruchou
Mužská a ženská sexuální dysfunkce s SSRI
Ačkoli změny v sexuální touze, sexuální výkonnosti a sexuální spokojenosti se často objevují jako projevy psychiatrické poruchy, mohou být také důsledkem farmakologické léčby. Zejména některé důkazy naznačují, že SSRI mohou způsobit takové nepříjemné sexuální zážitky.
Spolehlivé odhady výskytu a závažnosti nežádoucích zážitků zahrnujících sexuální touhu, výkon a uspokojení je obtížné získat, částečně proto, že pacienti a lékaři se mohou zdráhat o nich diskutovat. V souladu s tím odhady výskytu nežádoucích sexuálních zkušeností a výkonu uvedené v označení produktů pravděpodobně podhodnocují jejich skutečný výskyt.
TABULKA 5 Výskyt sexuálních vedlejších účinků v placebem kontrolovaných klinických studiích
Neexistují žádné adekvátně navržené studie zkoumající sexuální dysfunkci při léčbě escitalopramem.
Priapismus byl hlášen u všech SSRI.
když je obtížné znát přesné riziko sexuální dysfunkce spojené s užíváním SSRI, lékaři by se měli běžně dotazovat na takové možné vedlejší účinky.
Změny vitálních funkcí
Skupiny Lexapro 5 mg a placebo byly porovnávány s ohledem na (1) průměrnou změnu vitálních funkcí od výchozí hodnoty (puls, systolický krevní tlak a diastolický krevní tlak) a (2) výskyt pacientů splňujících kritéria pro potenciálně klinicky významné změny oproti výchozí hodnotě tyto proměnné. Tyto analýzy neodhalily žádné klinicky významné změny vitálních funkcí souvisejících s léčbou přípravkem Lexapro 20 mg. Kromě toho srovnání měření vitálních funkcí vleže a ve stoje u subjektů užívajících přípravek Lexapro 20 mg ukázalo, že léčba přípravkem Lexapro není spojena s ortostatickými změnami.
Změny hmotnosti
Pacienti léčení přípravkem Lexapro v kontrolovaných studiích se nelišili od pacientů léčených placebem, pokud jde o klinicky významnou změnu tělesné hmotnosti.
Laboratorní změny
Skupiny Lexapro 5 mg a placebo byly porovnány s ohledem na (1) průměrnou změnu od výchozí hodnoty v různých proměnných chemického složení séra, hematologie a analýzy moči a (2) výskyt pacientů splňujících kritéria pro potenciálně klinicky významné změny těchto proměnných oproti výchozí hodnotě. Tyto analýzy neodhalily žádné klinicky významné změny v parametrech laboratorních testů souvisejících s léčbou přípravkem Lexapro.
Změny EKG
Elektrokardiogramy ze skupin Lexapro (N=625) a placeba (N=527) byly porovnány s ohledem na odlehlé hodnoty definované jako subjekty se změnami QTc nad 60 ms od výchozích nebo absolutních hodnot nad 500 ms po dávce a subjekty se zvýšením srdeční frekvence na nad 100 tepů za minutu nebo se sníží na méně než 50 tepů za minutu s 25% změnou od výchozí hodnoty (tachykardické nebo bradykardické odlehlé hodnoty). Žádný z pacientů ve skupině Lexapro 20 mg neměl interval QTcF > 500 ms nebo prodloužení > 60 ms ve srovnání s 0,2 % pacientů ve skupině s placebem. Incidence tachykardických odlehlých hodnot byla 0,2 % ve skupině Lexapro 5 mg a placebo. Výskyt bradykardických odlehlých hodnot byl 0,5 % ve skupině Lexapro 10 mg a 0,2 % ve skupině s placebem.
Interval QTcF byl hodnocen v randomizované, placebem a aktivním (moxifloxacin 400 mg) kontrolované zkřížené studii s eskalujícími opakovanými dávkami u 113 zdravých subjektů. Maximální průměr (95% horní hranice spolehlivosti) rozdíl od ramene s placebem byl 4,5 (6,4) a 10,7 (12,7) ms pro 10 mg a supraterapeutických 30 mg escitalopramu podávaných jednou denně. Na základě zjištěného vztahu mezi expozicí a odpovědí je předpokládaná změna QTcF od ramene s placebem (95% interval spolehlivosti) pod Cmax pro dávku 20 mg 6,6 (7,9) ms. Escitalopram v dávce 30 mg podávaný jednou denně měl za následek průměrnou Cmax 1,7krát vyšší než průměrnou Cmax pro maximální doporučenou terapeutickou dávku v ustáleném stavu (20 mg). Expozice při supraterapeutické dávce 30 mg je podobná koncentracím v ustáleném stavu očekávaným u pomalých metabolizátorů CYP2C19 po terapeutické dávce 20 mg.
Další reakce pozorované během předmarketingového hodnocení Lexapro
Následuje seznam nežádoucích příhod souvisejících s léčbou, jak jsou definovány v úvodu k NEŽÁDOUCÍ REAKCE sekce, hlášené 1428 pacienty léčenými přípravkem Lexapro po dobu až jednoho roku ve dvojitě zaslepených nebo otevřených klinických studiích během jeho premarketingového hodnocení. Seznam nezahrnuje ty události, které již byly uvedeny v těch událostech, u nichž byla příčina drog vzdálená a v míře nižší než 1 % nebo nižší než u placeba, ty události, které byly tak obecné, že nebyly informativní, a ty události hlášené pouze jednou, které neměl podstatnou pravděpodobnost, že bude akutně ohrožovat život. Události jsou kategorizovány podle tělesného systému. Události zásadního klinického významu jsou popsány v VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ sekce.
Kardiovaskulární - hypertenze, bušení srdce.
Poruchy centrálního a periferního nervového systému - pocit točení hlavy, migréna.
Gastrointestinální poruchy - křeče v břiše, pálení žáhy, gastroenteritida.
Všeobecné - alergie, bolest na hrudi, horečka, návaly horka, bolest končetin.
Metabolické a nutriční poruchy - zvýšená hmotnost.
Poruchy pohybového aparátu - artralgie, myalgie ztuhlost čelisti.
Psychiatrické poruchy zvýšená chuť k jídlu, porucha koncentrace, podrážděnost.
Poruchy reprodukce/Ženy - menstruační křeče, menstruační poruchy.
Poruchy dýchacího systému - bronchitida, kašel, ucpaný nos, ucpané dutiny, bolesti hlavy v dutinách.
Poruchy kůže a příloh - vyrážka.
Speciální smysly - rozmazané vidění, tinnitus.
Poruchy močového systému - frekvence močení, infekce močových cest.
Postmarketingové zkušenosti
Nežádoucí účinky hlášené po uvedení escitalopramu na trh
Během používání přípravku Lexapro po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému: anémie, agranulocytis, aplastická anémie, hemolytická anémie, idiopatická trombocytopenie purpura, leukopenie, trombocytopenie.
Srdeční poruchy: fibrilace síní, bradykardie, srdeční selhání, infarkt myokardu, tachykardie, torsade de pointes, ventrikulární arytmie, ventrikulární tachykardie.
Poruchy ucha a labyrintu: závrať
Endokrinní poruchy: diabetes mellitus, hyperprolaktinémie, SIADH.
Oční poruchy: glaukom s uzavřeným úhlem, diplopie, mydriáza, poruchy vidění.
Gastrointestinální porucha: dysfagie, gastrointestinální krvácení, gastroezofageální reflux, pankreatitida, rektální krvácení.
Obecné poruchy a podmínky v místě podání: abnormální chůze, astenie, edém, pád, abnormální pocit, malátnost.
Poruchy jater a žlučových cest: fulminantní hepatitida, jaterní selhání, jaterní nekróza, hepatitida.
Poruchy imunitního systému: alergická reakce, anafylaxe.
Vyšetřování: zvýšení bilirubinu, snížení hmotnosti, prodloužení QT intervalu na elektrokardiogramu, zvýšení jaterních enzymů, hypercholesterolémie, zvýšení INR, snížení protrombinu.
Poruchy metabolismu a výživy: hyperglykémie, hypoglykémie, hypokalémie, hyponatremie.
Poruchy svalové a kosterní soustavy a pojivové tkáně: svalové křeče, svalová ztuhlost, svalová slabost, rhabdomyolýza.
Poruchy nervového systému: akatizie, amnézie, ataxie, choreoatetóza, cerebrovaskulární příhoda, dysartrie, dyskineze, dystonie, extrapyramidové poruchy, záchvaty grand mal (nebo křeče), hypestezie, myoklonus, nystagmus, parkinsonismus, neklidné nohy, záchvaty, treskinéza dysmorie.
Těhotenství, šestinedělí a perinatální stavy: Spontánní potrat.
Psychiatrické poruchy: akutní psychóza, agrese, agitovanost, hněv, úzkost, apatie, dokonaná sebevražda, zmatenost, depersonalizace, zhoršení deprese, delirium, bludy, dezorientace, pocit neskutečnosti, halucinace (zrakové a sluchové), změny nálad, nervozita, noční můry, panická reakce, paranoia , neklid, sebepoškozování nebo myšlenky na sebepoškozování, pokus o sebevraždu, sebevražedné myšlenky, sklony k sebevraždě.
Poruchy ledvin a močových cest: akutní selhání ledvin, dysurie, retence moči.
Poruchy reprodukčního systému a prsu: menoragie, priapismus.
Respirační, hrudní a mediastinální poruchy: dušnost, epistaxe, plicní embolie, plicní hypertenze novorozence. Poruchy kůže a podkožní tkáně: alopecie, angioedém, dermatitida, ekchymóza, multiformní erytém, fotosenzitivní reakce, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, kopřivka.
Cévní poruchy: hluboká žilní trombóza, návaly horka, hypertenzní krize, hypotenze, ortostatická hypotenze, flebitida, trombóza.
DROGOVÉ INTERAKCE
Inhibitory monoaminooxidázy (MAOI)
[Vidět DÁVKOVÁNÍ A PODÁVÁNÍ a , KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Serotonergní léky
[Vidět DÁVKOVÁNÍ A PODÁVÁNÍ a , KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
triptany
Po uvedení přípravku na trh byly vzácně hlášeny serotoninový syndrom při užívání SSRI a triptanu. Pokud je současná léčba přípravkem Lexapro 10 mg s triptanem klinicky opodstatněná, doporučuje se pečlivé sledování pacienta, zejména při zahájení léčby a při zvyšování dávky (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
CNS léky
Vzhledem k primárním účinkům escitalopramu na CNS je třeba opatrnosti při jeho užívání v kombinaci s jinými centrálně působícími léky.
Alkohol
Přestože Lexapro v klinické studii nezesilovalo kognitivní a motorické účinky alkoholu, stejně jako u jiných psychotropních léků, užívání alkoholu u pacientů užívajících Lexapro se nedoporučuje.
Léky, které interferují s hemostázou (NSAID, Aspirin, Warfarin atd.)
Uvolňování serotoninu krevními destičkami hraje důležitou roli v hemostáze. Epidemiologické studie případové kontroly a kohorty, které prokázaly souvislost mezi užíváním psychofarmak interferujících se zpětným vychytáváním serotoninu a výskytem krvácení z horní části gastrointestinálního traktu, také ukázaly, že současné užívání NSAID nebo aspirinu může potencovat riziko krvácení. Při současném podávání SSRI a SNRI s warfarinem byly hlášeny změněné antikoagulační účinky, včetně zvýšeného krvácení. Pacienti léčení warfarinem by měli být při zahájení nebo ukončení léčby přípravkem Lexapro pečlivě sledováni.
Cimetidin
subjektů, které dostávaly 21 dní racemický citalopram 40 mg/den, vedlo kombinované podávání 400 mg cimetidinu dvakrát denně po dobu 8 dní ke zvýšení AUC citalopramu o 43 % a Cmax o 39 %. Klinický význam těchto nálezů není znám.
Digoxin
U subjektů, které dostávaly 21 dní racemický citalopram 40 mg/den, kombinované podávání citalopramu a digoxinu (jednorázová dávka 1 mg) významně neovlivnilo farmakokinetiku citalopramu ani digoxinu.
Lithium
Současné podávání racemického citalopramu (40 mg/den po dobu 10 dnů) a lithia (30 mmol/den po dobu 5 dnů) nemělo žádný významný vliv na farmakokinetiku citalopramu nebo lithia. Nicméně plazmatické hladiny lithia by měly být monitorovány s vhodnou úpravou dávky lithia v souladu se standardní klinickou praxí. Protože lithium může zesilovat serotonergní účinky escitalopramu, je třeba opatrnosti při současném podávání Lexapro 5 mg a lithia.
Pimozide a Celexa
kontrolované studii byla jednorázová dávka 2 mg pimozidu společně s racemickým citalopramem 40 mg podávaná jednou denně po dobu 11 dnů spojena s průměrným zvýšením hodnot QTc přibližně o 10 ms ve srovnání s pimozidem podávaným samostatně. Racemický citalopram neměnil průměrnou AUC nebo Cmax pimozidu. Mechanismus této farmakodynamické interakce není znám.
sumatriptan
Po uvedení přípravku na trh byly vzácně hlášeny pacienty se slabostí, hyperreflexií a poruchou koordinace po použití SSRI a sumatriptanu. Pokud je současná léčba sumatriptanem a SSRI (např. fluoxetin, fluvoxamin, paroxetin, sertralin, citalopram, escitalopram) klinicky opodstatněná, doporučuje se vhodné sledování pacienta.
Theofylin
Kombinované podávání racemického citalopramu (40 mg/den po dobu 21 dnů) a theofylinu jako substrátu CYP1A2 (jednorázová dávka 300 mg) neovlivnilo farmakokinetiku theofylinu. Účinek theofylinu na farmakokinetiku citalopramu nebyl hodnocen.
Warfarin
Podávání racemického citalopramu v dávce 40 mg/den po dobu 21 dnů neovlivnilo farmakokinetiku warfarinu, substrátu CYP3A4. Protrombinový čas byl zvýšen o 5 %, jehož klinický význam není znám.
karbamazepin
Kombinované podávání racemického citalopramu (40 mg/den po dobu 14 dnů) a karbamazepinu (titrovaného na 400 mg/den po dobu 35 dnů) významně neovlivnilo farmakokinetiku karbamazepinu, substrátu CYP3A4. Přestože minimální plazmatické hladiny citalopramu nebyly ovlivněny, vzhledem k vlastnostem karbamazepinu indukujícím enzymy je třeba vzít v úvahu možnost, že karbamazepin může zvýšit clearance escitalopramu, pokud jsou tyto dva léky podávány současně.
triazolam
Kombinované podávání racemického citalopramu (titrovaného na 40 mg/den po dobu 28 dnů) a substrátu CYP3A4 triazolamu (jednorázová dávka 0,25 mg) významně neovlivnilo farmakokinetiku citalopramu ani triazolamu.
ketokonazol
Kombinované podávání racemického citalopramu (40 mg) a ketokonazolu (200 mg), silného inhibitoru CYP3A4, snížilo Cmax ketokonazolu o 21 % a AUC o 10 % a významně neovlivnilo farmakokinetiku citalopramu.
ritonavir
Kombinované podání jedné dávky ritonaviru (600 mg), substrátu CYP3A4 a silného inhibitoru CYP3A4, a escitalopramu (20 mg) neovlivnilo farmakokinetiku ritonaviru ani escitalopramu.
Inhibitory CYP3A4 a -2C19
Studie in vitro ukázaly, že CYP3A4 a -2C19 jsou primárními enzymy zapojenými do metabolismu escitalopramu. Současné podávání escitalopramu (20 mg) a ritonaviru (600 mg), silného inhibitoru CYP3A4, však významně neovlivnilo farmakokinetiku escitalopramu. Protože je escitalopram metabolizován více enzymovými systémy, inhibice jednoho enzymu nemusí významně snížit clearance escitalopramu.
Léky metabolizované cytochromem P4502D6
Studie in vitro neodhalily inhibiční účinek escitalopramu na CYP2D6. Kromě toho se hladiny racemického citalopramu v ustáleném stavu významně nelišily u pomalých metabolizátorů a extenzivních metabolizátorů CYP2D6 po podání více dávek citalopramu, což naznačuje, že současné podávání s escitalopramem léku, který inhibuje CYP2D6, pravděpodobně nebude mít klinicky významné účinky na metabolismus escitalopramu. Existují však omezené údaje in vivo naznačující mírný inhibiční účinek escitalopramu na CYP2D6, tj. současné podávání escitalopramu (20 mg/den po dobu 21 dnů) s tricyklickým antidepresivem desipraminem (jednorázová dávka 50 mg), substrátem pro CYP2D6, vedlo ve 40% zvýšení Cmax a 100% zvýšení AUC desipraminu. Klinický význam tohoto nálezu není znám. Přesto je třeba opatrnosti při současném podávání escitalopramu a léků metabolizovaných CYP2D6.
metoprolol
Podávání 20 mg/den Lexapro 20 mg po dobu 21 dnů zdravým dobrovolníkům vedlo k 50% zvýšení Cmax a 82% zvýšení AUC beta-adrenergního blokátoru metoprololu (podaného v jedné dávce 100 mg). Zvýšené plazmatické hladiny metoprololu byly spojeny se sníženou kardioselektivitou. Současné podávání Lexapro 5 mg a metoprololu nemělo žádné klinicky významné účinky na krevní tlak nebo srdeční frekvenci.
Elektrokonvulzivní terapie (ECT)
Neexistují žádné klinické studie kombinovaného použití ECT a escitalopramu.
Zneužívání drog a závislost
Zneužívání a závislost
Fyzická a psychická závislost
Studie na zvířatech naznačují, že pravděpodobnost zneužití racemického citalopramu je nízká. Lexapro 10 mg nebyl u lidí systematicky studován z hlediska jeho potenciálu pro zneužívání, toleranci nebo fyzickou závislost. Klinické zkušenosti s přípravkem Lexapro před uvedením na trh neodhalily žádné chování při hledání léku. Tato pozorování však nebyla systematická a na základě těchto omezených zkušeností není možné předpovědět, do jaké míry bude léčivo působící na CNS po uvedení na trh zneužito, odkloněno a/nebo zneužito. V důsledku toho by měli lékaři pečlivě vyhodnotit pacienty s přípravkem Lexapro z hlediska anamnézy zneužívání drog a tyto pacienty pečlivě sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání (např. vývoj tolerance, zvyšování dávek, chování při vyhledávání drog).
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Sebevražedné myšlenky a chování u dospívajících a mladých dospělých
Ve sdružených analýzách placebem kontrolovaných studií antidepresiv (SSRI a jiných tříd antidepresiv), které zahrnovaly přibližně 77 000 dospělých pacientů a 4 500 dětských pacientů, byl výskyt sebevražedných myšlenek a chování u pacientů léčených antidepresivy ve věku 24 let a mladších vyšší než u pacientů léčených placebem. Mezi drogami byly značné rozdíly v riziku sebevražedných myšlenek a chování, ale u většiny studovaných drog bylo zjištěno zvýšené riziko u mladých pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku sebevražedných myšlenek a chování, s nejvyšší incidencí u pacientů s MDD. Rozdíly mezi lékem a placebem v počtu případů sebevražedných myšlenek a chování na 1000 léčených pacientů jsou uvedeny v
Není známo, zda riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých přesahuje dlouhodobé užívání, tj. déle než čtyři měsíce. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s MDD, že antidepresiva oddalují recidivu deprese a že samotná deprese je rizikovým faktorem pro sebevražedné myšlenky a chování.
Monitorujte všechny pacienty léčené antidepresivy kvůli jakékoli indikaci klinického zhoršení a výskytu sebevražedných myšlenek a chování, zejména během několika prvních měsíců lékové terapie a v době změn dávkování. Poraďte rodinné příslušníky nebo pečovatele pacientů, aby sledovali změny v chování a varovali poskytovatele zdravotní péče. Zvažte změnu terapeutického režimu, včetně možného přerušení léčby Lexaprom, u pacientů, jejichž deprese se trvale zhoršuje nebo u kterých se objevují náhlé sebevražedné myšlenky nebo chování.
serotoninový syndrom
Rozvoj potenciálně život ohrožujícího serotoninového syndromu byl hlášen u SNRI a SSRI, včetně Lexapro, samotných, ale zejména při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů, a třezalka tečkovaná) a s léky, které zhoršují metabolismus serotoninu (zejména IMAO, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid a intravenózní methylenová modř).
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární příznaky (např. třes, ztuhlost, myoklonus, hyperreflexie, nekoordinovanost) záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu.
Současné užívání přípravku Lexapro 10 mg s IMAO určenými k léčbě psychiatrických poruch je kontraindikováno. Léčba přípravkem Lexapro 5 mg by také neměla být zahájena u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř. Všechny zprávy s methylenovou modří, které poskytly informace o cestě podání, zahrnovaly intravenózní podání v rozmezí dávek 1 mg/kg až 8 mg/kg. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Mohou nastat okolnosti, kdy je nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř u pacienta užívajícího Lexapro. Lexapro by mělo být přerušeno před zahájením léčby IMAO (viz KONTRAINDIKACE a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pokud je současné užívání Lexapro 5 mg s jinými serotonergními léky včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu, amfetaminu a třezalky tečkované, je třeba pacienty upozornit na možné zvýšené riziko serotoninového syndromu zvláště při zahájení léčby a při zvyšování dávky.
Pokud se vyskytnou výše uvedené příhody, léčba přípravkem Lexapro a jakýmikoli souběžně podávanými serotonergními látkami by měla být okamžitě přerušena a měla by být zahájena podpůrná symptomatická léčba.
Přerušení léčby Lexapro
Při uvádění přípravku Lexapro na trh a dalších SSRI a SNRI (inhibitory zpětného vychytávání serotoninu a norepinefrinu) byly spontánně hlášeny nežádoucí účinky po vysazení těchto léků, zejména pokud byly náhlé, včetně následujících: dysforická nálada, podrážděnost, agitovanost, závratě, smyslové poruchy (např. parestézie, jako jsou pocity elektrického šoku), úzkost, zmatenost, bolest hlavy, letargie, emoční labilita, nespavost a hypománie. I když tyto příhody obecně samy odezní, byly hlášeny závažné příznaky z vysazení.
Při ukončování léčby přípravkem Lexapro by měli být pacienti sledováni z hlediska těchto příznaků. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, lze zvážit obnovení předchozí předepsané dávky. Následně může lékař pokračovat ve snižování dávky, ale pozvolnějším tempem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Záchvaty
Přestože byly ve studiích na zvířatech pozorovány antikonvulzivní účinky racemického citalopramu, Lexapro nebylo systematicky hodnoceno u pacientů se záchvatovou poruchou. Tito pacienti byli vyloučeni z klinických studií během premarketingového testování produktu. V klinických studiích přípravku Lexapro 5 mg byly v souvislosti s léčbou přípravkem Lexapro hlášeny případy křečí. Stejně jako ostatní léky účinné při léčbě velké depresivní poruchy by měl být Lexapro 20 mg podáván s opatrností u pacientů s anamnézou záchvatové poruchy.
Aktivace Mánie Nebo Hypománie
pacientů s bipolární poruchou může léčba depresivní epizody přípravkem Lexapro nebo jiným antidepresivem vyvolat smíšenou/manickou epizodu. V placebem kontrolovaných studiích s přípravkem Lexapro 20 mg u velké depresivní poruchy byla aktivace mánie/hypománie hlášena u jednoho (0,1 %) ze 715 pacientů léčených přípravkem Lexapro 20 mg a u žádného z 592 pacientů léčených placebem. V souvislosti s léčbou přípravkem Lexapro 10 mg byl hlášen jeden další případ hypománie. Aktivace mánie/hypománie byla také hlášena u malé části pacientů s velkými afektivními poruchami léčených racemickým citalopramem a dalšími léčivy na trhu účinnými při léčbě velké depresivní poruchy. Před zahájením léčby přípravkem Lexapro proveďte screening pacientů na jakoukoli osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Hyponatrémie
Hyponatremie se může objevit v důsledku léčby SSRI a SNRI, včetně Lexapro. V mnoha případech se zdá, že tato hyponatremie je výsledkem syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH) a byla reverzibilní, když bylo vysazeno Lexapro 20 mg. Byly hlášeny případy se sérovým sodíkem nižším než 110 mmol/l. Starší pacienti mohou být vystaveni většímu riziku rozvoje hyponatremie u SSRI a SNRI. Také pacienti užívající diuretika nebo jinak objemově vyčerpaní mohou být vystaveni většímu riziku [viz Geriatrické použití ]. U pacientů se symptomatickou hyponatrémií je třeba zvážit vysazení přípravku Lexapro a zahájit odpovídající lékařskou intervenci.
Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, které mohou vést k pádům. Známky a symptomy spojené se závažnějšími a/nebo akutními případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt.
Abnormální krvácení
SSRI a SNRI, včetně Lexapro 20 mg, mohou zvýšit riziko krvácivých příhod. Současné užívání aspirinu, nesteroidních protizánětlivých léků, warfarinu a dalších antikoagulancií může zvýšit riziko. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Krvácení související s užíváním SSRI a SNRI se pohybovalo od ekchymóz, hematomů, epistaxe a petechií až po život ohrožující krvácení.
Pacienti by měli být upozorněni na riziko krvácení spojeného se současným užíváním přípravku Lexapro 20 mg a NSAID, aspirinu nebo jiných léků ovlivňujících koagulaci.
Zásah do kognitivního a motorického výkonu
Ve studii na normálních dobrovolnících nezpůsobilo Lexapro 10 mg/den poškození intelektuálních funkcí nebo psychomotorické výkonnosti. Vzhledem k tomu, že jakýkoli psychoaktivní lék může zhoršit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že léčba přípravkem Lexapro neovlivňuje jejich schopnost zapojit se do takových činností.
Glaukom s uzavřeným úhlem
Glaukom s uzavřeným úhlem: Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně Lexapro 20 mg, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii.
Použití u pacientů se souběžným onemocněním
Klinické zkušenosti s přípravkem Lexapro u pacientů s určitými souběžnými systémovými onemocněními jsou omezené. Opatrnost se doporučuje při používání přípravku Lexapro 5 mg u pacientů s onemocněními nebo stavy, které způsobují změněný metabolismus nebo hemodynamické odpovědi.
Lexapro nebylo systematicky hodnoceno u pacientů s nedávnou anamnézou infarktu myokardu nebo nestabilního srdečního onemocnění. Pacienti s těmito diagnózami byli obecně vyloučeni z klinických studií během premarketingového testování produktu.
U jedinců s poruchou funkce jater byla clearance racemického citalopramu snížena a plazmatické koncentrace byly zvýšeny. Doporučená dávka přípravku Lexapro u pacientů s poruchou funkce jater je 10 mg/den (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Vzhledem k tomu, že escitalopram je extenzivně metabolizován, je vylučování nezměněného léčiva močí vedlejší cestou eliminace. Dokud nebude během chronické léčby přípravkem Lexapro 20 mg zhodnocen dostatečný počet pacientů s těžkou poruchou funkce ledvin, měl by být u těchto pacientů používán s opatrností (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Sexuální dysfunkce
Užívání SSRI, včetně Lexapro, může způsobit příznaky sexuální dysfunkce (viz NEŽÁDOUCÍ REAKCE ]. U mužských pacientů může mít užívání SSRI za následek zpoždění nebo selhání ejakulace, snížení libida a erektilní dysfunkci. U pacientek může mít užívání SSRI za následek snížení libida a opožděný nebo chybějící orgasmus.
Je důležité, aby se předepisující lékaři zeptali na sexuální funkce před zahájením léčby přípravkem Lexapro a konkrétně se zeptali na změny sexuální funkce během léčby, protože sexuální funkce nemusí být spontánně hlášeny. Při hodnocení změn sexuální funkce je důležité získat podrobnou anamnézu (včetně načasování nástupu příznaků), protože sexuální příznaky mohou mít jiné příčiny, včetně základní psychiatrické poruchy. Diskutujte o možných strategiích řízení, které pomohou pacientům činit informovaná rozhodnutí o léčbě.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Sebevražedné myšlenky a chování
Poraďte pacientům, jejich rodinám a pečovatelům, aby hledali výskyt sebevražedných myšlenek a chování, zejména během léčby a při úpravě dávky nahoru nebo dolů, a poučte je, aby takové příznaky hlásili svému poskytovateli zdravotní péče [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
serotoninový syndrom
Pacienti by měli být upozorněni na riziko serotoninového syndromu při současném užívání přípravku Lexapro s jinými serotonergními léky včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů a třezalky tečkované as léky, které zhoršují metabolismus serotonin (zejména IMAO, jak ty určené k léčbě psychiatrických poruch, tak i jiné, jako je linezolid) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Aktivace Mánie Nebo Hypománie
Poraďte pacientům a jejich pečovatelům, aby sledovali známky aktivace mánie/hypománie a poučte je, aby takové příznaky hlásili poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Abnormální krvácení
Pacienti by měli být upozorněni na současné užívání Lexapro 5 mg a NSAID, aspirinu, warfarinu nebo jiných léků, které ovlivňují koagulaci, protože kombinované užívání psychofarmak, které interferují se zpětným vychytáváním serotoninu, a tyto látky byly spojeny se zvýšeným rizikem krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glaukom s uzavřeným úhlem
Pacienti by měli být upozorněni, že užívání přípravku Lexapro 5 mg může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a mají profylaktický postup (např. iridektomie), pokud jsou náchylní [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sexuální dysfunkce
Informujte pacienty, že užívání přípravku Lexapro může vyvolat příznaky sexuální dysfunkce u mužů i žen. Informujte pacienty, že by měli se svým poskytovatelem zdravotní péče prodiskutovat jakékoli změny v sexuální funkci a potenciální strategie řízení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doprovodné léky
Vzhledem k tomu, že escitalopram je aktivním izomerem racemického citalopramu (Celexa), tyto dvě látky by neměly být podávány současně. Pacienti by měli být poučeni, aby informovali svého lékaře, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože existuje možnost interakcí.
Pokračování v předepsané terapii
Zatímco pacienti mohou zaznamenat zlepšení při léčbě přípravkem Lexapro 10 mg během 1 až 4 týdnů, měli by být poučeni, aby pokračovali v léčbě podle pokynů.
Zasahování do psychomotorického výkonu
Vzhledem k tomu, že psychoaktivní léky mohou zhoršit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být upozorněni na obsluhu nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že léčba přípravkem Lexapro neovlivňuje jejich schopnost zapojit se do takových činností.
Alkohol
Pacienti by měli být informováni, že ačkoliv u Lexapro 5 mg nebylo v experimentech s normálními jedinci prokázáno zvýšení mentálních a motorických poruch způsobených alkoholem, současné užívání Lexapro 20 mg a alkoholu u pacientů s depresí se nedoporučuje.
Těhotenství
Informujte těhotné ženy, aby informovaly své poskytovatele zdravotní péče, pokud během léčby přípravkem LEXAPRO otěhotní nebo plánují otěhotnět. Informujte pacienty, že užívání přípravku LEXAPRO 10 mg později v těhotenství může vést ke zvýšenému riziku neonatálních komplikací vyžadujících prodlouženou hospitalizaci, respirační podporu, výživu sondou a/nebo přetrvávající plicní hypertenzi (PPHN) novorozence [viz Použití u konkrétních populací ].
Informujte ženy, že existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených LEXAPRO během těhotenství [viz Použití u konkrétních populací ].
Laktace
Poraďte kojícím ženám, které používají LEXAPRO, aby sledovaly kojence kvůli nadměrné sedaci, neklidu, neklidu, špatnému krmení a nízkému přírůstku hmotnosti a aby vyhledaly lékařskou péči, pokud si všimnou těchto příznaků [viz Použití u konkrétních populací ].
Potřeba komplexního léčebného programu
Lexapro 20 mg je indikován jako nedílná součást celkového léčebného programu pro MDD, který může zahrnovat další opatření (psychologická, výchovná, sociální) pro pacienty s tímto syndromem. Medikamentózní léčba nemusí být indikována u všech dospívajících s tímto syndromem. Bezpečnost a účinnost přípravku Lexapro 10 mg u MDD nebyla stanovena u pediatrických pacientů mladších 12 let. Antidepresiva nejsou určena k použití u dospívajících, kteří vykazují symptomy sekundární k faktorům prostředí a/nebo jiným primárním psychiatrickým poruchám. Vhodné umístění ve vzdělávání je zásadní a psychosociální intervence je často užitečná. Pokud samotná nápravná opatření nestačí, bude rozhodnutí předepsat antidepresivum záviset na posouzení chronicity a závažnosti symptomů pacienta lékařem.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Racemický citalopram byl podáván ve stravě myším kmene NMRI/BOM a potkanům kmene COBS WI po dobu 18 a 24 měsíců, v daném pořadí. Nebyly zjištěny žádné důkazy o karcinogenitě racemického citalopramu u myší, které dostávaly až 240 mg/kg/den. U potkanů, kteří dostávali racemický citalopram v dávce 8 nebo 24 mg/kg/den, byl zaznamenán zvýšený výskyt karcinomu tenkého střeva. Dávka bez účinku pro toto zjištění nebyla stanovena. Význam těchto zjištění pro člověka není znám.
Mutageneze
Racemický citalopram byl mutagenní v testu bakteriální reverzní mutace in vitro (Amesův test) u 2 z 5 bakteriálních kmenů (Salmonella TA98 a TA1537) bez metabolické aktivace. Byl klastogenní v in vitro testu plicních buněk čínského křečka na chromozomální aberace v přítomnosti a nepřítomnosti metabolické aktivace. Racemický citalopram nebyl mutagenní v testu in vitro savčích dopředných genových mutací (HPRT) v buňkách myšího lymfomu nebo ve spojeném testu in vitro/in vivo neplánované syntézy DNA (UDS) v játrech potkana. Nebyl klastogenní v in vitro testu chromozomálních aberací na lidských lymfocytech ani ve dvou in vivo myších mikronukleárních testech.
Zhoršení Plodnosti
Když byl racemický citalopram podáván perorálně 16 samcům a 24 samicím potkanů před pářením a během březosti v dávkách 32, 48 a 72 mg/kg/den, došlo ke snížení páření při všech dávkách a ke snížení plodnosti při dávkách ≥ 32 mg/kg/den. Délka březosti se prodloužila na 48 mg/kg/den.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených antidepresivům během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty zavoláním do Národního registru těhotenství pro antidepresiva na čísle 1-844-405-6185 nebo návštěvou online na adrese https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Shrnutí rizik
Dostupné údaje z publikovaných epidemiologických studií a postmarketingových zpráv neprokázaly zvýšené riziko závažných vrozených vad nebo potratu. Existuje riziko perzistující plicní hypertenze novorozenců (PPHN) (viz Data ) a špatná novorozenecká adaptace (viz Klinické úvahy ) s expozicí selektivním inhibitorům zpětného vychytávání serotoninu (SSRI), včetně LEXAPRO 5 mg, během těhotenství. S neléčenou depresí v těhotenství jsou spojena rizika (viz Klinické úvahy ).
reprodukčních studiích na zvířatech bylo prokázáno, že jak escitalopram, tak racemický citalopram mají nežádoucí účinky na embryo/fetální a postnatální vývoj, včetně strukturálních abnormalit plodu, pokud jsou podávány v dávkách vyšších než jsou terapeutické dávky u lidí (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Klinické úvahy
Mateřské riziko a/nebo riziko embrya/plodu spojené s onemocněním
žen, které vysadí antidepresiva, je větší pravděpodobnost návratu těžké deprese než u žen, které v antidepresivech pokračují. Toto zjištění pochází z prospektivní longitudinální studie 201 těhotných žen s anamnézou těžké deprese, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Fetální/neonatální nežádoucí účinky
novorozenců vystavených SSRI nebo SNRI, včetně Lexapro 5 mg, se koncem třetího trimestru rozvinuly komplikace vyžadující prodlouženou hospitalizaci, podporu dýchání a výživu sondou. Takové komplikace mohou nastat ihned po porodu. Hlášené klinické nálezy zahrnovaly respirační tíseň, cyanózu, apnoe, záchvaty, teplotní nestabilitu, potíže s krmením, zvracení, hypoglykémii, hypotonii, hypertonii, hyperreflexii, třes, nervozitu, podrážděnost a neustálý pláč. Tyto rysy jsou v souladu buď s přímým toxickým účinkem SSRI a SNRI, nebo případně se syndromem z vysazení léku. Je třeba poznamenat, že v některých případech je klinický obraz v souladu se serotoninovým syndromem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Data
Lidská data
Expozice SSRI, zejména později v těhotenství, může zvýšit riziko PPHN. PPHN se vyskytuje u 1–2 na 1000 živě narozených dětí v obecné populaci a je spojena se značnou novorozeneckou morbiditou a mortalitou.
Údaje o zvířatech
Ve studii vývoje embrya/plodu u potkanů vedlo perorální podávání escitalopramu (56, 112 nebo 150 mg/kg/den) březím zvířatům během období organogeneze ke snížení tělesné hmotnosti plodu a souvisejícímu zpoždění osifikace při dvou vyšších dávkách [přibližně ≥ 55násobek maximální doporučené dávky pro člověka (MRHD) 20 mg/den na základě mg/m2]. Mateřská toxicita (klinické příznaky a snížený přírůstek tělesné hmotnosti a spotřeba potravy), mírná při dávce 56 mg/kg/den, byla přítomna ve všech úrovních dávek. Dávka bez účinku na vývoj 56 mg/kg/den je přibližně 27násobkem MRHD 20 mg na základě mg/m2. V žádné z testovaných dávek nebyly pozorovány žádné malformace (až 73násobek MRHD na základě mg/m2).
Když byly samice potkanů léčeny escitalopramem (6, 12, 24 nebo 48 mg/kg/den) během březosti a po odstavení, byla zaznamenána mírně zvýšená úmrtnost potomstva a zpomalení růstu při dávce 48 mg/kg/den, což je přibližně 23násobek MRHD 20 mg na základě mg/m2. Při této dávce byla pozorována mírná toxicita pro matku (klinické příznaky a snížený přírůstek tělesné hmotnosti a spotřeba potravy). Mírně zvýšená úmrtnost potomstva byla také pozorována při dávce 24 mg/kg/den. Dávka bez účinku byla 12 mg/kg/den, což je přibližně 6násobek MRHD 20 mg na základě mg/m2.
Ve dvou studiích embryo/fetálního vývoje u potkanů vedlo perorální podávání racemického citalopramu (32, 56 nebo 112 mg/kg/den) březím zvířatům během období organogeneze ke snížení růstu a přežití embrya/plodu a zvýšenému výskytu fetálních abnormality (včetně kardiovaskulárních a kosterních defektů) při vysoké dávce, která je přibližně 18krát vyšší než MRHD 60 mg/den na základě mg/m2. Tato dávka byla také spojena s toxicitou pro matku (klinické příznaky, snížený přírůstek tělesné hmotnosti). Dávka bez účinku na vývoj byla 56 mg/kg/den, což je přibližně 9násobek MRHD na základě mg/m2. Ve studii na králících nebyly pozorovány žádné nežádoucí účinky na vývoj embrya/plodu při dávkách racemického citalopramu až do 16 mg/kg/den nebo přibližně 5násobku MRHD na základě mg/m2. Vývojové účinky racemického citalopramu byly tedy pozorovány v dávce toxické pro matku u potkanů a nebyly pozorovány u králíků.
Když byly samice potkanů léčeny racemickým citalopramem (4,8, 12,8 nebo 32 mg/kg/den) od pozdní březosti až po odstavení, byla pozorována zvýšená úmrtnost potomstva během prvních 4 dnů po narození a přetrvávající retardace růstu potomstva při nejvyšší dávce, která je přibližně 5krát vyšší než MRHD 60 mg na základě mg/m2. Dávka bez účinku byla 12,8 mg/kg/den, což je přibližně dvojnásobek MRHD na základě mg/m2. Podobné účinky na úmrtnost a růst potomstva byly pozorovány, když byly samice léčeny během březosti a časné laktace dávkami ≥ 24 mg/kg/den, což je přibližně 4násobek MRHD na základě mg/m2. V této studii nebyla stanovena dávka bez účinku.
Laktace
Shrnutí rizik
Údaje z publikované literatury uvádějí přítomnost escitalopramu a desmethylescitalopramu v mateřském mléce (viz Data ). Existují zprávy o nadměrné sedaci, neklidu, neklidu, špatném krmení a nízkém přírůstku hmotnosti u kojenců vystavených escitalopramu prostřednictvím mateřského mléka (viz Klinické úvahy ),. Neexistují žádné údaje o účincích escitalopramu nebo jeho metabolitů na produkci mléka. Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky LEXAPRO 5 mg a veškerými potenciálními nežádoucími účinky přípravku LEXAPRO na kojené dítě nebo základním onemocněním matky.
Klinické úvahy
Kojenci vystavení LEXAPRO 20 mg by měli být sledováni kvůli nadměrné sedaci, neklidu, neklidu, špatnému krmení a nízkému přírůstku hmotnosti.
Data
Studie 8 kojících matek užívajících escitalopram s denními dávkami 10-20 mg/den ukázala, že výhradně kojené děti dostávají přibližně 3,9 % dávky escitalopramu upravené podle hmotnosti matky a 1,7 % dávky desmethylcitalopramu upravené podle hmotnosti matky .
Pediatrické použití
Bezpečnost a účinnost přípravku Lexapro 10 mg byla stanovena u dospívajících (12 až 17 let) k léčbě velké depresivní poruchy (viz Klinické studie ]. Přestože udržovací účinnost u dospívajících pacientů s velkou depresivní poruchou nebyla systematicky hodnocena, lze udržovací účinnost extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů escitalopramu u dospělých a dospívajících pacientů.
Bezpečnost a účinnost přípravku Lexapro nebyla stanovena u pediatrických pacientů (mladších 12 let) s velkou depresivní poruchou. Ve 24týdenní, otevřené studii bezpečnosti u 118 dětí (ve věku 7 až 11 let), které měly velkou depresivní poruchu, byla zjištění bezpečnosti v souladu se známým profilem bezpečnosti a snášenlivosti přípravku Lexapro.
Bezpečnost a účinnost přípravku Lexapro nebyla stanovena u pediatrických pacientů mladších 18 let s generalizovanou úzkostnou poruchou.
souvislosti s užíváním SSRI byla pozorována snížená chuť k jídlu a úbytek hmotnosti. U dětí a dospívajících léčených SSRI, jako je Lexapro, by se proto mělo pravidelně sledovat hmotnost a růst.
Geriatrické použití
Přibližně 6 % z 1144 pacientů užívajících escitalopram v kontrolovaných studiích s přípravkem Lexapro 10 mg u velké depresivní poruchy a GAD bylo ve věku 60 let nebo více; starší pacienti v těchto studiích dostávali denní dávky Lexapro mezi 10 a 20 mg. Počet starších pacientů v těchto studiích nebyl dostatečný k tomu, aby bylo možné adekvátně posoudit možnou rozdílnou účinnost a bezpečnostní opatření na základě věku. Nelze však vyloučit vyšší citlivost některých starších osob na účinky Lexapro.
SSRI a SNRI, včetně Lexapro 5 mg, byly spojeny s případy klinicky významné hyponatremie u starších pacientů, u kterých může být vyšší riziko této nežádoucí příhody (viz Hyponatrémie ].
Ve dvou farmakokinetických studiích se poločas escitalopramu zvýšil přibližně o 50 % u starších subjektů ve srovnání s mladými subjekty a Cmax se nezměnila (viz KLINICKÁ FARMAKOLOGIE ]. 10 mg/den je doporučená dávka pro starší pacienty [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Ze 4422 pacientů v klinických studiích s racemickým citalopramem bylo 1357 ve věku 60 a více let, 1034 bylo ve věku 65 let a více a 457 bylo ve věku 75 a více let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, ale opět nelze vyloučit větší citlivost některých starších osob.
PŘEDÁVKOVAT
Při předávkování tabletami Lexapro byly hlášeny následující případy:
- Záchvaty, které mohou být opožděné, a změněný duševní stav včetně kómatu.
- Kardiovaskulární toxicita, která může být opožděná, včetně prodloužení QRS a QTc intervalu, rozsáhlých komplexních tachyarytmií a torsade de pointes. Nejčastěji se vyskytuje hypertenze, ale vzácně se může vyskytnout hypotenze samotná nebo se spoluužívajícími látkami včetně alkoholu.
- serotoninový syndrom (vyšší riziko mohou mít pacienti s vícenásobným předávkováním jinými proserotonergními léky).
Při předávkování přípravkem Lexapro se vzhledem k riziku arytmie doporučuje dlouhodobé monitorování srdce.
U pacientů, kteří se dostaví časně po předávkování přípravkem Lexapro, by měla být zvážena gastrointestinální dekontaminace aktivním uhlím.
Zvažte kontaktování toxikologického centra (1-800-221-2222) nebo lékařského toxikologa ohledně doporučení pro léčbu předávkování.
KONTRAINDIKACE
Inhibitory monoaminooxidázy (MAOI)
Užívání IMAO určených k léčbě psychiatrických poruch přípravkem Lexapro nebo do 14 dnů po ukončení léčby přípravkem Lexapro 5 mg je kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu. Užívání přípravku Lexapro 20 mg do 14 dnů po vysazení IMAO určeného k léčbě psychiatrických poruch je také kontraindikováno (viz DÁVKOVÁNÍ A PODÁVÁNÍ , a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zahájení podávání Lexapro 20 mg u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř, je také kontraindikováno kvůli zvýšenému riziku serotoninového syndromu (viz DÁVKOVÁNÍ A PODÁVÁNÍ , a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
pimozid
Současné užívání u pacientů užívajících pimozid je kontraindikováno [viz DROGOVÉ INTERAKCE ].
Hypersenzitivita na escitalopram nebo citalopram
Lexapro 20 mg je kontraindikováno u pacientů s přecitlivělostí na escitalopram nebo citalopram nebo na kteroukoli neaktivní složku přípravku Lexapro.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Předpokládá se, že mechanismus antidepresivního účinku escitalopramu, S-enantiomeru racemického citalopramu, je spojen s potenciací serotonergní aktivity v centrálním nervovém systému (CNS) v důsledku jeho inhibice zpětného vychytávání serotoninu (5-HT) neurony CNS.
Farmakodynamika
Studie in vitro a in vivo na zvířatech naznačují, že escitalopram je vysoce selektivní inhibitor zpětného vychytávání serotoninu (SSRI) s minimálními účinky na zpětné vychytávání norepinefrinu a dopaminu neurony. Escitalopram je alespoň 100krát účinnější než R-enantiomer, pokud jde o inhibici zpětného vychytávání 5-HT a inhibici rychlosti vzplanutí neuronů 5-HT. Tolerance k modelu antidepresivního účinku u potkanů nebyla navozena dlouhodobou (až 5 týdnů) léčbou escitalopramem. Escitalopram nemá žádnou nebo velmi nízkou afinitu k serotonergním (5-HT1-7) nebo jiným receptorům včetně alfa- a beta-adrenergních, dopaminových (D1-5), histaminových (H1-3), muskarinových (M1-5) a benzodiazepinů receptory. Escitalopram se také neváže nebo má nízkou afinitu k různým iontovým kanálům včetně Na+, K+, Cl- a Ca++ kanálů. Předpokládá se, že antagonismus muskarinových, histaminergních a adrenergních receptorů je spojen s různými anticholinergními, sedativními a kardiovaskulárními vedlejšími účinky jiných psychotropních léků.
Farmakokinetika
Farmakokinetika escitalopramu po jednorázové a opakované dávce je lineární a úměrná dávce v rozmezí dávek 10 až 30 mg/den. Biotransformace escitalopramu probíhá převážně v játrech s průměrným terminálním poločasem přibližně 27-32 hodin. Při dávkování jednou denně je ustálených plazmatických koncentrací dosaženo přibližně do jednoho týdne. V ustáleném stavu byl rozsah akumulace escitalopramu v plazmě u mladých zdravých subjektů 2,2-2,5násobek plazmatických koncentrací pozorovaných po jedné dávce. Tabletové a perorální roztokové lékové formy escitalopramu oxalátu jsou bioekvivalentní.
Absorpce a distribuce
Po jednorázové perorální dávce (20 mg tableta nebo roztok) escitalopramu se maximální hladiny v krvi objeví přibližně za 5 hodin. Absorpce escitalopramu není ovlivněna jídlem.
Absolutní biologická dostupnost citalopramu je asi 80 % ve vztahu k intravenózní dávce a distribuční objem citalopramu je asi 12 l/kg. Údaje specifické pro escitalopram nejsou k dispozici.
Vazba escitalopramu na lidské plazmatické proteiny je přibližně 56 %.
Metabolismus A Eliminace
Po perorálním podání escitalopramu je frakce léčiva zachycená v moči jako escitalopram a S-demethylcitalopram (S-DCT) asi 8 % a 10 %. Perorální clearance escitalopramu je 600 ml/min, přičemž přibližně 7 % z toho je způsobeno renální clearance.
Escitalopram je metabolizován na S-DCT a S-didemethylcitalopram (S-DDCT). U lidí je nezměněný escitalopram převládající látkou v plazmě. V ustáleném stavu je koncentrace metabolitu escitalopramu S-DCT v plazmě přibližně jedna třetina koncentrace escitalopramu. Hladina S-DDCT nebyla u většiny subjektů detekovatelná. Studie in vitro ukazují, že escitalopram je alespoň 7krát a 27krát účinnější než S-DCT a S-DDCT v inhibici zpětného vychytávání serotoninu, což naznačuje, že metabolity escitalopramu významně nepřispívají k antidepresivním účinkům escitalopramu. S-DCT a SDDCT také nemají žádnou nebo velmi nízkou afinitu k serotonergním (5-HT1-7) nebo jiným receptorům včetně alfa- a beta-adrenergních, dopaminových (D1-5), histaminových (H1-3), muskarinových (M1- 5) a benzodiazepinové receptory. S-DCT a S-DDCT se také nevážou na různé iontové kanály včetně Na+, K+, Cl- a Ca++ kanálů.
In vitro studie s použitím lidských jaterních mikrozomů ukázaly, že CYP3A4 a CYP2C19 jsou primárními izoenzymy zapojenými do N-demethylace escitalopramu.
Podskupiny populace
Stáří
Dospívající
Ve studii s jednorázovou dávkou 10 mg escitalopramu se AUC escitalopramu snížila o 19 % a Cmax se zvýšila o 26 % u zdravých dospívajících subjektů (ve věku 12 až 17 let) ve srovnání s dospělými. Po opakovaném podávání 40 mg/den citalopramu byly poločas eliminace escitalopramu, Cmax a AUC v ustáleném stavu podobné u pacientů s MDD (ve věku 12 až 17 let) ve srovnání s dospělými pacienty. U dospívajících pacientů není nutná žádná úprava dávkování.
Starší
Farmakokinetika escitalopramu u subjektů ve věku ≥ 65 let byla srovnávána s mladšími subjekty ve studii s jednorázovou dávkou a opakovanou dávkou. AUC a poločas escitalopramu byly u starších subjektů zvýšeny přibližně o 50 % a Cmax se nezměnily. 10 mg je doporučená dávka pro starší pacienty [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rod
Na základě údajů ze studií s jednorázovým a opakovaným podáváním escitalopramu u starších pacientů, mladých dospělých a dospívajících není nutná úprava dávkování na základě pohlaví.
Snížená funkce jater
Perorální clearance citalopramu se snížila o 37 % a poločas se zdvojnásobil u pacientů se sníženou funkcí jater ve srovnání s normálními jedinci. 10 mg je doporučená dávka escitalopramu pro většinu pacientů s poruchou funkce jater [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Snížená funkce ledvin
U pacientů s mírnou až středně těžkou poruchou funkce ledvin byla perorální clearance citalopramu snížena o 17 % ve srovnání s normálními jedinci. U těchto pacientů se nedoporučuje žádná úprava dávkování. Nejsou dostupné žádné informace o farmakokinetice escitalopramu u pacientů se závažně sníženou funkcí ledvin (clearance kreatininu
Lékové interakce
Údaje o inhibici enzymů in vitro neodhalily inhibiční účinek escitalopramu na CYP3A4, -1A2, -2C9, -2C19 a -2E1. Na základě údajů in vitro se očekává, že escitalopram bude mít malý inhibiční účinek na metabolismus in vivo zprostředkovaný těmito cytochromy. Zatímco údaje in vivo pro řešení této otázky jsou omezené, výsledky studií lékových interakcí naznačují, že escitalopram v dávce 20 mg nemá žádný inhibiční účinek na 3A4 a mírný inhibiční účinek na 2D6. Vidět DROGOVÉ INTERAKCE pro podrobnější informace o dostupných údajích o lékových interakcích.
Toxikologie zvířat a/nebo farmakologie
Změny sítnice u potkanů
Patologické změny (degenerace/atrofie) byly pozorovány na sítnici albínských potkanů ve 2leté studii karcinogenity s racemickým citalopramem. U samců i samic potkanů, kteří dostávali 80 mg/kg/den, došlo ke zvýšení incidence i závažnosti retinální patologie. Podobné nálezy nebyly přítomny u potkanů, kteří dostávali 24 mg/kg/den racemického citalopramu po dobu dvou let, u myší dostávajících až 240 mg/kg/den racemického citalopramu po dobu 18 měsíců nebo u psů dostávajících až 20 mg/kg/ den racemického citalopramu po dobu jednoho roku.
Další studie ke zkoumání mechanismu této patologie nebyly provedeny a potenciální význam tohoto účinku u lidí nebyl stanoven.
Kardiovaskulární změny u psů
jednoleté toxikologické studii 5 z 10 psů bíglů, kteří dostávali perorálně racemické dávky citalopramu 8 mg/kg/den, náhle zemřelo mezi 17. a 31. týdnem po zahájení léčby. Náhlá úmrtí nebyla pozorována u potkanů při dávkách racemického citalopramu až do 120 mg/kg/den, které vyvolaly plazmatické hladiny citalopramu a jeho metabolitů demethylcitalopramu a didemethylcitalopramu (DDCT) podobné těm, které byly pozorovány u psů při 8 mg/kg/den. Následná studie s intravenózním dávkováním prokázala, že u psů bíglů racemická DDCT způsobila prodloužení QT intervalu, což je známý rizikový faktor pro pozorovaný výsledek u psů.
Klinické studie
Velká depresivní porucha
Dospívající
Účinnost Lexapro jako akutní léčby velké depresivní poruchy u dospívajících pacientů byla stanovena v 8týdenní placebem kontrolované studii s flexibilním dávkováním, která porovnávala Lexapro 10-20 mg/den s placebem u ambulantních pacientů ve věku 12 až 17 let. včetně, kteří splnili kritéria DSM-IV pro velkou depresivní poruchu. Primárním výstupem byla změna z výchozí hodnoty na koncový bod v Dětské stupnici pro hodnocení deprese – revidovaná (CDRS-R). V této studii přípravek Lexapro 5 mg prokázal statisticky významně větší průměrné zlepšení ve srovnání s placebem na CDRS-R.
Účinnost přípravku Lexapro v akutní léčbě velké depresivní poruchy u dospívajících byla stanovena částečně na základě extrapolace z 8týdenní placebem kontrolované studie s flexibilním dávkováním s racemickým citalopramem 20-40 mg/den. V této ambulantní studii u dětí a dospívajících ve věku 7 až 17 let, kteří splnili kritéria DSM-IV pro velkou depresivní poruchu, vykázala léčba citalopramem statisticky významně větší průměrné zlepšení oproti výchozí hodnotě ve srovnání s placebem na CDRS-R; pozitivní výsledky této studie pocházely převážně z podskupiny adolescentů.
Dvě další studie s flexibilním dávkováním, placebem kontrolované MDD (jedna studie Lexapro u pacientů ve věku 7 až 17 let a jedna studie s citalopramem u dospívajících) neprokázaly účinnost.
Přestože udržovací účinnost u dospívajících pacientů nebyla systematicky hodnocena, lze udržovací účinnost extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů escitalopramu u dospělých a dospívajících pacientů.
Dospělí
Účinnost přípravku Lexapro 5 mg jako léčby velké depresivní poruchy byla stanovena ve třech, 8týdenních, placebem kontrolovaných studiích provedených u ambulantních pacientů ve věku od 18 do 65 let, kteří splnili kritéria DSM-IV pro velkou depresivní poruchu. Primárním výsledkem ve všech třech studiích byla změna z výchozí hodnoty na koncový bod v Montgomery Asberg Depression Rating Scale (MADRS).
Studie s fixní dávkou porovnávala 10 mg/den Lexapro a 20 mg/den Lexapro s placebem a 40 mg/den citalopramem. Léčebné skupiny 10 mg/den a 20 mg/den Lexapro 5 mg vykazovaly statisticky významně větší průměrné zlepšení ve srovnání s placebem na MADRS. Skupiny s 10 mg a 20 mg Lexapro byly v tomto výsledku podobné.
Ve druhé studii s fixní dávkou 10 mg/den Lexapro a placeba vykázala skupina léčená Lexapro 10 mg/den statisticky významně větší průměrné zlepšení ve srovnání s placebem na MADRS.
Ve studii s flexibilním dávkováním, porovnávající Lexapro 20 mg, titrovaný mezi 10 a 20 mg/den, s placebem a citalopramem, titrovaným mezi 20 a 40 mg/den, vykázala skupina léčená Lexapro 5 mg statisticky významně větší průměrné zlepšení ve srovnání s placebem na MADRS.
Analýzy vztahu mezi výsledkem léčby a věkem, pohlavím a rasou nenaznačily žádnou rozdílnou citlivost na základě těchto charakteristik pacientů.
V dlouhodobější studii bylo 274 pacientů splňujících (DSM-IV) kritéria pro velkou depresivní poruchu, kteří reagovali během úvodní 8týdenní, otevřené fáze léčby přípravkem Lexapro 10 nebo 20 mg/den, randomizováno k pokračování v léčbě přípravkem Lexapro ve stejné dávce nebo na placebo po dobu až 36 týdnů sledování relapsu. Odpověď během otevřené fáze byla definována snížením celkového skóre MADRS na ≤ 12. Relaps během dvojitě zaslepené fáze byl definován jako zvýšení celkového skóre MADRS na ≥ 22 nebo přerušení léčby z důvodu nedostatečné klinické odpovědi . Pacienti, kteří dostávali Lexapro nadále, zaznamenali statisticky významně delší dobu do relapsu ve srovnání s těmi, kteří dostávali placebo.
Generalizovaná úzkostná porucha
Účinnost Lexapro 5 mg při akutní léčbě generalizované úzkostné poruchy (GAD) byla prokázána ve třech, 8týdenních, multicentrických, placebem kontrolovaných studiích s flexibilním dávkováním, které porovnávaly Lexapro 10-20 mg/den s placebem u dospělých ambulantních pacientů mezi 18 a 80 let, kteří splnili kritéria DSM-IV pro GAD. Ve všech třech studiích přípravek Lexapro vykazoval statisticky významně větší průměrné zlepšení ve srovnání s placebem na Hamiltonově stupnici úzkosti (HAM-A).
Bylo příliš málo pacientů v různých etnických a věkových skupinách, aby bylo možné adekvátně posoudit, zda má Lexapro v těchto skupinách rozdílné účinky. Mezi muži a ženami nebyl žádný rozdíl v reakci na Lexapro.
INFORMACE PRO PACIENTA
Lexapro® (leks-a-pro) (escitalopram) Tablety/perorální roztok
Než začnete užívat Lexapro a pokaždé, když dostanete náplň, přečtěte si Příručku pro léky, která je součástí balení Lexapro. Mohou se objevit nové informace. Tento průvodce léky nenahrazuje rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě. Promluvte si se svým poskytovatelem zdravotní péče, pokud je něco, čemu nerozumíte nebo se o tom chcete dozvědět více.
Jaké jsou nejdůležitější informace, které bych měl vědět o Lexapro 20 mg?
Lexapro 10 mg a další antidepresiva mohou způsobit závažné nežádoucí účinky, včetně:
Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče a mezi návštěvami volejte, pokud máte obavy z příznaků.
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo zavolejte 911 v případě nouze, zvláště pokud jsou nové, horší nebo vás znepokojují:
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo volejte 911 v případě nouze. Lexapro může být spojeno s těmito závažnými nežádoucími účinky:
Příznaky u mužů mohou zahrnovat:
Příznaky u žen mohou zahrnovat:
Promluvte si se svým poskytovatelem zdravotní péče, pokud se u vás během léčby přípravkem Lexapro objeví nějaké změny ve vaší sexuální funkci nebo pokud máte nějaké otázky nebo obavy ohledně sexuálních problémů. Může existovat léčba, kterou může navrhnout váš poskytovatel zdravotní péče.
- Lexapro 5 mg a další antidepresiva mohou zvýšit sebevražedné myšlenky nebo činy u některých dětí, dospívajících nebo mladých dospělých v rámci prvních několik měsíců léčby nebo při změně dávky.
- Deprese nebo jiná vážná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek nebo činů.
- Sledujte tyto změny a ihned zavolejte svému poskytovateli zdravotní péče, pokud si všimnete:
- Nové nebo náhlé změny nálady, chování, jednání, myšlenek nebo pocitů, zvláště pokud jsou závažné.
- Těmto změnám věnujte zvláštní pozornost při zahájení léčby přípravkem Lexapro 5 mg nebo při změně dávky.
- pokusy o sebevraždu
- působící na nebezpečné impulsy
- chovat se agresivně nebo násilně
- myšlenky na sebevraždu nebo smrt
- nová nebo horší deprese
- nové nebo horší záchvaty úzkosti nebo paniky
- pocit rozrušení, neklidu, vzteku nebo podrážděnosti
- problémové spaní
- zvýšená aktivita nebo mluvení více, než je pro vás normální
- jiné neobvyklé změny v chování nebo náladě
- neklid, halucinace, kóma nebo jiné změny duševního stavu
- problémy s koordinací nebo svalové záškuby (nadměrně aktivní reflexy)
- rychlý srdeční tep, vysoký nebo nízký krevní tlak
- pocení nebo horečka
- nevolnost, zvracení nebo průjem
- svalová ztuhlost
- potíže s dýcháním
- otok obličeje, jazyka, očí nebo úst
- vyrážka, svědivé šrámy (kopřivka) nebo puchýře, samotné nebo s horečkou nebo bolestí kloubů
- výrazně zvýšenou energii
- vážné potíže se spánkem
- závodní myšlenky
- bezohledné chování
- neobvykle velkolepé nápady
- nadměrné štěstí nebo podrážděnost
- mluvit více nebo rychleji než obvykle
- bolest hlavy
- slabost nebo pocit nejistoty
- zmatenost, problémy se soustředěním nebo myšlením nebo problémy s pamětí
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
- Zpožděná ejakulace nebo neschopnost ejakulace
- Snížená chuť na sex
- Problémy s dosažením nebo udržením erekce
- Snížená chuť na sex
- Odložený orgasmus nebo neschopnost dosáhnout orgasmu
Nepřestávejte přípravek Lexapro, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče. Vysazení přípravku Lexapro 5 mg příliš rychle může způsobit vážné příznaky, včetně:
- úzkost, podrážděnost, povznesená nebo špatná nálada, pocit neklidu nebo změny ve spánkových návycích
- bolest hlavy, pocení, nevolnost, závratě
- pocity podobné elektrickému šoku, třes, zmatenost
Co je Lexapro?
Lexapro 20 mg je lék na předpis používaný k léčbě deprese. Je důležité mluvit se svým poskytovatelem zdravotní péče o rizicích léčby deprese a také o rizicích jejího neléčení. Všechny možnosti léčby byste měli probrat se svým poskytovatelem zdravotní péče. Lexapro se také používá k léčbě:
- Velká depresivní porucha (MDD)
- Generalizovaná úzkostná porucha (GAD)
Promluvte si se svým poskytovatelem zdravotní péče, pokud si nemyslíte, že se váš stav léčbou přípravkem Lexapro zlepšuje.
Kdo by neměl užívat Lexapro 5 mg?
Neužívejte Lexapro 10 mg, pokud:
Lidé, kteří užívají Lexapro 20 mg těsně před IMAO, mohou mít závažné nebo dokonce život ohrožující vedlejší účinky. Okamžitě vyhledejte lékařskou pomoc, pokud máte některý z těchto příznaků:
- jste alergický(á) na escitalopram nebo citalopram nebo na kteroukoli složku přípravku Lexapro. Úplný seznam složek přípravku Lexapro naleznete na konci tohoto Průvodce léčivy.
- Vezměte inhibitor monoaminooxidázy (MAOI). Pokud si nejste jisti, zda užíváte IMAO, včetně linezolidu, zeptejte se svého poskytovatele zdravotní péče nebo lékárníka.
- Neužívejte IMAO do 2 týdnů po ukončení užívání přípravku Lexapro 10 mg, pokud to nenařídí váš lékař.
- Nezačínejte s přípravkem Lexapro 20 mg, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš lékař.
- vysoká horečka
- nekontrolované svalové křeče
- ztuhlé svaly
- rychlé změny srdeční frekvence nebo krevního tlaku
- zmatek
- ztráta vědomí (omdlít)
- Neužívejte Lexapro s Orap® (pimozid), protože užívání těchto dvou léků společně může způsobit vážné srdeční problémy.
Co mám říct svému poskytovateli zdravotní péče, než začnu užívat Lexapro 20 mg? Zeptejte se, pokud si nejste jisti.
Před zahájením léčby přípravkem Lexapro 20 mg informujte svého poskytovatele zdravotní péče, pokud:
- Berete určité léky, např.
- Triptany používané k léčbě migrény
- Léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně tricyklických látek, lithia, SSRI, SNRI, amfetaminů nebo antipsychotik
- tramadol
- Volně prodejné doplňky stravy, jako je tryptofan nebo třezalka tečkovaná
- mít problémy s játry
- mít problémy s ledvinami
- mít problémy se srdcem
- máte nebo jste měli záchvaty nebo křeče
- trpíte bipolární poruchou nebo mánií
- máte nízké hladiny sodíku v krvi
- mít v anamnéze mrtvici
- mají vysoký krevní tlak
- máte nebo jste měli problémy s krvácením
- jste těhotná nebo plánujete otěhotnět. Užívání přípravku LEXAPRO v pozdním těhotenství může vést ke zvýšenému riziku určitých problémů u vašeho novorozence. Promluvte si se svým poskytovatelem zdravotní péče o výhodách a rizicích léčby deprese během těhotenství
- Pokud otěhotníte během užívání přípravku LEXAPRO, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro antidepresiva. Registrovat se můžete na telefonním čísle 1-844-405-6185 nebo přejděte na https://womensmentalhealth.org/clinicaland- researchprograms/ pregnantregistry/antidepressants/
- kojíte nebo plánujete kojit. Lexapro může přecházet do mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení vašeho dítěte, pokud užíváte Lexapro.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Lexapro 10 mg a některé léky se mohou vzájemně ovlivňovat, nemusí stejně dobře působit nebo mohou způsobit závažné nežádoucí účinky.
Váš poskytovatel zdravotní péče nebo lékárník vám může říci, zda je bezpečné užívat Lexapro 20 mg s jinými léky. Během užívání přípravku Lexapro 10 mg nezačínejte ani neukončujte žádný lék, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
Pokud užíváte Lexapro, neměli byste užívat žádné jiné léky, které obsahují escitalopram nebo citalopram, včetně: Celexa.
Jak mám užívat Lexapro?
- Užívejte Lexapro přesně podle předpisu. Váš poskytovatel zdravotní péče možná bude muset změnit dávku přípravku Lexapro, dokud pro vás nebude správná dávka.
- Lexapro 5 mg lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku přípravku Lexapro, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku Lexapro současně.
- Pokud užijete příliš mnoho přípravku Lexapro, okamžitě zavolejte svého poskytovatele zdravotní péče nebo toxikologické centrum nebo vyhledejte pohotovostní léčbu.
Čemu se mám vyhnout při užívání Lexapro?
Lexapro 5 mg může způsobit ospalost nebo může ovlivnit vaši schopnost rozhodovat se, jasně myslet nebo rychle reagovat. Neměli byste řídit, obsluhovat těžké stroje nebo dělat jiné nebezpečné činnosti, dokud nevíte, jak na vás Lexapro působí. Během používání přípravku Lexapro nepijte alkohol.
Jaké jsou možné vedlejší účinky přípravku Lexapro 20 mg?
Lexapro 10 mg může způsobit závažné nežádoucí účinky, včetně všech z těch popsaných v části nazvané „Jaké jsou nejdůležitější informace, které bych měl vědět o Lexapro?“
Časté možné nežádoucí účinky u lidí, kteří užívají Lexapro 5 mg, zahrnují:
- Nevolnost
- Ospalost
- Slabost
- Závrať
- Pocit úzkosti
- Problémové spaní
- Sexuální problémy
- Pocení
- Třes
- Necítím hlad
- Suchá ústa
- Zácpa
- Infekce
- Zívání
Další nežádoucí účinky u dětí a dospívajících zahrnují:
- zvýšená žízeň
- abnormální zvýšení svalového pohybu nebo agitovanosti
- krvácení z nosu
- obtížné močení
- silné menstruace
- možná zpomalená rychlost růstu a změna hmotnosti. Během léčby přípravkem Lexapro je třeba sledovat výšku a váhu vašeho dítěte.
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí. To nejsou všechny možné vedlejší účinky přípravku Lexapro. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
ZAVOLEJTE SVÉHO LÉKAŘE, POŽÁDÁ VÁM LÉKAŘSKOU PORADU O NEŽÁDOUCÍCH ÚČINCÍCH. NEŽÁDOUCÍ ÚČINKY MŮŽETE HLÁSIT FDA NA ČÍSLE 1-800-FDA-1088.
Jak mám uchovávat Lexapro 20 mg?
- Skladujte Lexapro při 68°F až 77°F (20°C až 25°C); povoleny výchylky do 59°F až 86°F (15°C až 30°C).
- Uchovávejte lahvičku Lexapro pevně uzavřenou.
Uchovávejte Lexapro 10 mg a všechny léky mimo dosah dětí.
Obecné informace o Lexapro
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte Lexapro pro stav, pro který nebyl předepsán. Nedávejte Lexapro 10 mg jiným lidem, i když mají stejný stav. Může jim to ublížit.
Tento průvodce léčivy shrnuje nejdůležitější informace o Lexapro. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o Lexapro, které jsou určeny pro zdravotnické pracovníky.
Pro více informací o Lexapro 20 mg volejte 1-800-678-1605 nebo přejděte na www.Lexapro.com.
Jaké jsou složky v Lexapro 20 mg?
Účinná látka: escitalopram oxalát Neaktivní látky:
- mastek, sodná sůl kroskarmelózy, mikrokrystalická celulóza/koloidní oxid křemičitý a stearát hořečnatý. Filmový povlak obsahuje hypromelózu, oxid titaničitý a polyethylenglykol.
- Orální roztok: sorbitol, čištěná voda, kyselina citrónová, citrát sodný, kyselina jablečná, glycerin, propylenglykol, methylparaben, propylparaben a přírodní aroma máty peprné (perorální roztok není v současné době na trhu).
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
