Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Zyprexa 10 mg a jak se používá?
Zyprexa je lék na předpis používaný k léčbě příznaků schizofrenie a bipolární poruchy (manické deprese). Přípravek Zyprexa lze užívat samostatně nebo s jinými léky.
- Zyprexa patří do třídy léků nazývaných antipsychotika, 2. generace, antimanické látky.
- Není známo, zda je přípravek Zyprexa bezpečný a účinný u dětí mladších 13 let.
Jaké jsou možné nežádoucí účinky přípravku Zyprexa 15 mg?
Přípravek Zyprexa může způsobit závažné nežádoucí účinky, včetně:
- nekontrolované pohyby svalů v obličeji (žvýkání, mlácení rtů, mračení, pohyby jazyka, mrkání nebo pohyby očí),
- potíže s mluvením nebo polykáním,
- otoky rukou nebo nohou,
- zmatek,
- neobvyklé myšlenky nebo chování,
- halucinace,
- myšlenky na to, jak si ublížit,
- náhlá slabost nebo nevolnost,
- horečka,
- zimnice,
- bolest krku,
- oteklé dásně,
- bolestivé vředy v ústech,
- bolest při polykání,
- kožní vředy,
- příznaky nachlazení nebo chřipky,
- kašel,
- pocit velké žízně nebo horka,
- neschopnost močit,
- silné pocení,
- horká nebo suchá kůže,
- bolest v horní části žaludku,
- svědění,
- ztráta chuti k jídlu,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- zvýšená žízeň,
- zvýšené močení,
- hlad,
- suchá ústa,
- ovocný zápach dechu,
- ospalost,
- rozmazané vidění,
- ztráta váhy,
- velmi ztuhlé svaly,
- vysoká horečka,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- otřesy a
- točení hlavy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Zyprexa patří:
- přírůstek hmotnosti (častější u dospívajících),
- zvýšená chuť k jídlu,
- bolesti hlavy,
- závrať,
- ospalost,
- pocit únavy nebo neklidu,
- problémy s řečí nebo pamětí,
- třes nebo třes,
- pocit necitlivosti nebo mravenčení,
- změny osobnosti,
- suchá ústa,
- zvýšené slinění,
- bolest břicha,
- zácpa a
- bolest v rukou nebo nohou
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Zyprexa. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
ZVÝŠENÁ ÚMRTNOST U STARŠÍCH PACIENTŮ S PSYCHÓZOU SOUVISEJÍCÍ S DEMENCÍ
starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. Analýzy sedmnácti placebem kontrolovaných studií (modální trvání 10 týdnů), převážně u pacientů užívajících atypická antipsychotika, odhalily riziko úmrtí u pacientů léčených drogami mezi 1,6 až 1,7 násobkem rizika úmrtí u pacientů léčených placebem. V průběhu typické 10týdenní kontrolované studie byla míra úmrtí u pacientů léčených léky asi 4,5 % ve srovnání s mírou asi 2,6 % ve skupině s placebem. Ačkoli byly příčiny úmrtí různé, většina úmrtí se zdála být kardiovaskulárního (např. srdeční selhání, náhlá smrt) nebo infekční (např. zápal plic). Observační studie naznačují, že podobně jako u atypických antipsychotik může léčba konvenčními antipsychotiky zvyšovat mortalitu. Není jasné, do jaké míry lze zjištění zvýšené úmrtnosti v observačních studiích přičíst antipsychotickému léku na rozdíl od některých charakteristik pacientů. ZYPREXA (olanzapin) není schválen k léčbě pacientů s psychózou související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a INFORMACE PRO PACIENTA ].
Pokud používáte přípravek ZYPREXA 15 mg a fluoxetin v kombinaci, přečtěte si také část Varování v krabici příbalové informace k přípravku Symbyax.
POPIS
ZYPREXA (olanzapin) je atypické antipsychotikum, které patří do třídy thienobenzodiazepinů. Chemické označení je 2-methyl-4-(4-methyl-l-piperazinyl)-10H-thieno[2,3-b][l,5]benzodiazepin. Molekulární vzorec je C17H20N4S, což odpovídá molekulové hmotnosti 312,44. Chemická struktura je:
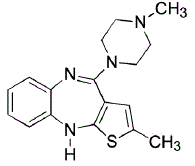
Olanzapin je žlutá krystalická pevná látka, která je prakticky nerozpustná ve vodě.
Tablety ZYPREXA 7,5 mg jsou určeny pouze k perorálnímu podání.
Jedna tableta obsahuje olanzapinum odpovídající 2,5 mg (8 μmol), 5 mg (16 μmol), 7,5 mg (24 μmol), 10 mg (32 μmol), 15 mg (48 μmol) nebo 20 mg (64 μmol). Neaktivní složky jsou karnaubský vosk, krospovidon, hydroxypropylcelulóza, hypromelóza, laktóza, magnesium-stearát, mikrokrystalická celulóza a další neaktivní složky. Barevný povlak obsahuje oxid titaničitý (všechny síly), hliníkové jezero FD&C Blue č. 2 (15 mg) nebo syntetický červený oxid železitý (20 mg). 2,5, 5, 7,5 a 10 mg tablety jsou potištěny jedlým inkoustem, který obsahuje FD&C Blue No. 2 Aluminium Lake.
ZYPREXA 2,5 mg ZYDIS (olanzapin perorálně se rozpadající tablety) je určena pouze k perorálnímu podání.
Jedna tableta rozpadající se v ústech obsahuje olanzapinum odpovídající 5 mg (16 μmol), 10 mg (32 μmol), 15 mg (48 μmol) nebo 20 mg (64 μmol). Během několika sekund se začne v ústech rozpadat, což umožňuje jeho následné spolknutí s tekutinou nebo bez tekutiny. ZYPREXA 15 mg ZYDIS (olanzapin perorálně se rozpadající tablety) také obsahuje následující neúčinné složky: želatinu, mannitol, aspartam, methylparaben sodný a propylparaben sodný.
ZYPREXA 2,5 mg intramuskulární (olanzapin pro injekci) je určen pouze k intramuskulárnímu podání.
Každá injekční lahvička umožňuje podání 10 mg (32 μmol) olanzapinu s neúčinnými složkami 50 mg monohydrátu laktosy a 3,5 mg kyseliny vinné. Během výroby může být přidána kyselina chlorovodíková a/nebo hydroxid sodný pro úpravu pH.
INDIKACE
Schizofrenie
Perorální ZYPREXA je indikována k léčbě schizofrenie. Účinnost byla stanovena ve třech klinických studiích u dospělých pacientů se schizofrenií: dvě 6týdenní studie a jedna udržovací studie. U dospívajících pacientů se schizofrenií (ve věku 13-17 let) byla účinnost stanovena v jedné 6týdenní studii (viz Klinické studie ].
Při rozhodování mezi alternativními léčebnými postupy dostupnými pro dospívající by měli lékaři zvážit zvýšený potenciál (u dospívajících ve srovnání s dospělými) pro zvýšení tělesné hmotnosti a dyslipidémii. Kliničtí lékaři by měli zvážit potenciální dlouhodobá rizika při předepisování dospívajícím a v mnoha případech je to může vést k tomu, aby zvážili předepisování jiných léků nejprve u dospívajících [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Bipolární porucha I (manické nebo smíšené epizody)
Monoterapie
Perorální ZYPREXA je indikována pro akutní léčbu manických nebo smíšených epizod spojených s bipolární poruchou I a udržovací léčbu bipolární poruchy I. Účinnost byla stanovena ve třech klinických studiích u dospělých pacientů s manickými nebo smíšenými epizodami bipolární poruchy I: dvě 3 až 4týdenní studie a jedna udržovací studie monoterapie. U dospívajících pacientů s manickými nebo smíšenými epizodami spojenými s bipolární poruchou I (ve věku 13-17 let) byla účinnost stanovena v jedné 3týdenní studii (viz Klinické studie ].
Při rozhodování mezi alternativními léčebnými postupy dostupnými pro dospívající by měli lékaři zvážit zvýšený potenciál (u dospívajících ve srovnání s dospělými) pro zvýšení tělesné hmotnosti a dyslipidémii. Kliničtí lékaři by měli zvážit potenciální dlouhodobá rizika při předepisování dospívajícím a v mnoha případech je to může vést k tomu, aby zvážili předepisování jiných léků nejprve u dospívajících [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doplňková terapie k lithiu nebo valproátu
Perorální ZYPREXA 5 mg je indikována k léčbě manických nebo smíšených epizod spojených s bipolární poruchou I jako doplněk k lithiu nebo valproátu. Účinnost byla stanovena ve dvou 6týdenních klinických studiích u dospělých. Účinnost doplňkové terapie při dlouhodobějším užívání nebyla v kontrolovaných studiích systematicky hodnocena [viz Klinické studie ].
Zvláštní úvahy při léčbě dětské schizofrenie a bipolární poruchy I
Dětská schizofrenie a bipolární porucha I jsou závažné duševní poruchy; diagnóza však může být náročná. U dětské schizofrenie mohou být profily příznaků variabilní au bipolární poruchy I mohou mít dětští pacienti různé vzorce periodicity manických nebo smíšených příznaků. Doporučuje se, aby medikamentózní terapie u dětské schizofrenie a bipolární poruchy I byla zahájena až po důkladném diagnostickém vyšetření a pečlivém zvážení rizik spojených s medikamentózní léčbou. Medikamentózní léčba jak dětské schizofrenie, tak bipolární poruchy I by měla být součástí celkového léčebného programu, který často zahrnuje psychologické, vzdělávací a sociální intervence.
ZYPREXA 15 mg intramuskulárně: Agitovanost spojená se schizofrenií a bipolární mánií I
ZYPREXA 15 mg IntraMuscular je indikována k léčbě akutního neklidu spojeného se schizofrenií a bipolární mánií typu I.
Účinnost byla prokázána ve 3 krátkodobých (24 hodin IM léčby) placebem kontrolovaných studiích u agitovaných dospělých hospitalizovaných pacientů se: schizofrenií nebo bipolární poruchou I (manické nebo smíšené epizody) [viz Klinické studie ].
„Psychomotorická agitace“ je v DSM-IV definována jako „nadměrná motorická aktivita spojená s pocitem vnitřního napětí“. Pacienti zažívající agitovanost často projevují chování, které narušuje jejich diagnózu a péči, např. ohrožující chování, eskalující nebo naléhavě stresující chování nebo sebevyčerpávající chování, což vede klinické lékaře k použití intramuskulárních antipsychotických léků k dosažení okamžité kontroly agitovanosti.
ZYPREXA a fluoxetin v kombinaci: depresivní epizody spojené s bipolární poruchou I
Perorální přípravek ZYPREXA a fluoxetin v kombinaci je na základě klinických studií indikován k léčbě depresivních epizod spojených s bipolární poruchou I. Pokud používáte přípravek ZYPREXA 10 mg a fluoxetin v kombinaci, přečtěte si část Klinické studie v příbalové informaci k přípravku Symbyax.
Monoterapie přípravkem ZYPREXA není indikována k léčbě depresivních epizod spojených s bipolární poruchou I.
ZYPREXA a fluoxetin v kombinaci: Léčba rezistentní deprese
Perorální přípravek ZYPREXA a fluoxetin v kombinaci je indikován k léčbě deprese rezistentní na léčbu (závažná depresivní porucha u pacientů, kteří nereagují na 2 samostatné studie různých antidepresiv adekvátní dávky a trvání v aktuální epizodě), na základě klinických studií u dospělých pacientů . Pokud používáte přípravek ZYPREXA a fluoxetin v kombinaci, přečtěte si část Klinické studie v příbalové informaci k přípravku Symbyax.
ZYPREXA 5 mg v monoterapii není indikována k léčbě deprese rezistentní na léčbu.
DÁVKOVÁNÍ A PODÁVÁNÍ
Schizofrenie
Dospělí
Výběr dávky
Perorální olanzapin by měl být podáván v režimu jednou denně bez ohledu na jídlo, obvykle se začíná počáteční dávkou 5 až 10 mg, cílová dávka je 10 mg/den během několika dnů. Další úpravy dávkování, pokud jsou indikovány, by se obecně měly provádět v intervalech ne kratších než 1 týden, protože ustáleného stavu olanzapinu by u typického pacienta nebylo dosaženo přibližně za 1 týden. Pokud je nutná úprava dávkování, doporučuje se zvýšení/snížení dávky o 5 mg jednou denně.
klinických studiích byla prokázána účinnost u schizofrenie v rozmezí dávek 10 až 15 mg/den. Nebylo však prokázáno, že by dávky nad 10 mg/den byly účinnější než dávka 10 mg/den. Zvýšení na dávku vyšší než je cílová dávka 10 mg/den (tj. na dávku 15 mg/den nebo vyšší) se doporučuje pouze po klinickém posouzení. Olanzapin není indikován k použití v dávkách vyšších než 20 mg/den.
Dávkování u zvláštních populací
Doporučená počáteční dávka je 5 mg u oslabených pacientů, kteří mají predispozici k hypotenzním reakcím, kteří jinak vykazují kombinaci faktorů, které mohou vést ke zpomalení metabolismu olanzapinu (např. nekuřačky ve věku ≥ 65 let), nebo kteří mohou být farmakodynamicky citlivější na olanzapin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ]. Pokud je to indikováno, je třeba u těchto pacientů zvyšovat dávku opatrně.
Udržovací léčba
Účinnost perorálního olanzapinu v dávce 10 mg/den až 20 mg/den při udržení léčebné odpovědi u schizofrenních pacientů, kteří byli stabilní na přípravku ZYPREXA po dobu přibližně 8 týdnů a poté byli sledováni pro relaps, byla prokázána v placebem kontrolované studii [viz Klinické studie ]. Poskytovatel zdravotní péče, který se rozhodne používat přípravek ZYPREXA po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta.
Dospívající
Výběr dávky
Perorální olanzapin by měl být podáván v režimu jednou denně bez ohledu na jídlo s doporučenou počáteční dávkou 2,5 nebo 5 mg, s cílovou dávkou 10 mg/den. Účinnost u dospívajících se schizofrenií byla prokázána na základě flexibilního rozmezí dávek 2,5 až 20 mg/den v klinických studiích, s průměrnou modální dávkou 12,5 mg/den (průměrná dávka 11,1 mg/den). Pokud je nutná úprava dávkování, doporučuje se zvýšení/snížení dávky o 2,5 nebo 5 mg.
Bezpečnost a účinnost dávek nad 20 mg/den nebyla v klinických studiích hodnocena [viz Klinické studie ].
Udržovací léčba
Účinnost přípravku ZYPREXA v udržovací léčbě schizofrenie u dospívající populace nebyla systematicky hodnocena; udržovací účinnost však lze extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů olanzapinu u dospělých a dospívajících pacientů. Obecně se tedy doporučuje, aby pacienti, kteří reagují, pokračovali i po akutní odpovědi, ale v nejnižší dávce potřebné k udržení remise. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Bipolární porucha I (manické nebo smíšené epizody)
Dospělí
Výběr dávky pro monoterapii
Perorální olanzapin by měl být podáván v režimu jednou denně bez ohledu na jídlo, obvykle se začíná dávkou 10 nebo 15 mg. Úpravy dávkování, je-li indikováno, by se obecně měly provádět v intervalech ne kratších než 24 hodin, v souladu s postupy v placebem kontrolovaných studiích. Pokud je nutná úprava dávkování, doporučuje se zvýšení/snížení dávky o 5 mg jednou denně.
Krátkodobá (3-4 týdny) antimanická účinnost byla v klinických studiích prokázána v rozmezí dávek 5 mg až 20 mg/den. Bezpečnost dávek nad 20 mg/den nebyla v klinických studiích hodnocena [viz Klinické studie ].
Udržovací monoterapie
Přínos udržení pacientů s bipolární poruchou I na monoterapii perorálním přípravkem ZYPREXA 10 mg v dávce 5 až 20 mg/den, po dosažení stavu respondéru po průměrnou dobu 2 týdnů, byl prokázán v kontrolované studii [viz Klinické studie ]. Poskytovatel zdravotní péče, který se rozhodne používat přípravek ZYPREXA po delší dobu, by měl pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta.
Výběr dávky pro doplňkovou léčbu
Při podávání jako přídatná léčba k lithiu nebo valproátu by perorální podávání olanzapinu mělo obecně začínat dávkou 10 mg jednou denně bez ohledu na jídlo.
Antimanická účinnost byla v klinických studiích prokázána v rozmezí dávek 5 mg až 20 mg/den (viz Klinické studie ]. Bezpečnost dávek nad 20 mg/den nebyla v klinických studiích hodnocena.
Dospívající
Výběr dávky
Perorální olanzapin by měl být podáván v režimu jednou denně bez ohledu na jídlo s doporučenou počáteční dávkou 2,5 nebo 5 mg, s cílovou dávkou 10 mg/den. Účinnost u dospívajících s bipolární poruchou I (manické nebo smíšené epizody) byla v klinických studiích prokázána na základě flexibilního rozmezí dávek 2,5 až 20 mg/den, s průměrnou modální dávkou 10,7 mg/den (průměrná dávka 8,9 mg/den ). Pokud je nutná úprava dávkování, doporučuje se zvýšení/snížení dávky o 2,5 nebo 5 mg.
Bezpečnost a účinnost dávek nad 20 mg/den nebyla v klinických studiích hodnocena [viz Klinické studie ].
Udržovací léčba
Účinnost přípravku ZYPREXA 7,5 mg pro udržovací léčbu bipolární poruchy I u dospívající populace nebyla hodnocena; udržovací účinnost však lze extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů olanzapinu u dospělých a dospívajících pacientů. Obecně se tedy doporučuje, aby pacienti, kteří reagují, pokračovali i po akutní odpovědi, ale v nejnižší dávce potřebné k udržení remise. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Podávání přípravku ZYPREXA ZYDIS (olanzapin perorálně se rozpadající tablety)
Po otevření sáčku odloupněte fólii na blistru. Tabletu neprotlačujte fólií. Ihned po otevření blistru suchýma rukama vyjměte tabletu a vložte celý přípravek ZYPREXA 15 mg ZYDIS do úst. Tableta se rychle rozpadá ve slinách, takže ji lze snadno spolknout s tekutinou nebo bez ní.
ZYPREXA Intra Muscular: Agitace spojená se schizofrenií a bipolární I mánií
Výběr dávky pro rozrušené dospělé pacienty se schizofrenií a bipolární mánií
Účinnost intramuskulárního injekčního olanzapinu při kontrole agitovanosti u těchto poruch byla prokázána v rozmezí dávek 2,5 mg až 10 mg. Doporučená dávka u těchto pacientů je 10 mg. Pokud to klinické faktory vyžadují, lze zvážit nižší dávku 5 nebo 7,5 mg [viz Klinické studie ]. Pokud po počáteční dávce přetrvává neklid vyžadující další intramuskulární dávky, lze podat následné dávky až do 10 mg. Nicméně účinnost opakovaných dávek intramuskulárního injekčního olanzapinu u agitovaných pacientů nebyla v kontrolovaných klinických studiích systematicky hodnocena. Rovněž bezpečnost celkových denních dávek vyšších než 30 mg nebo 10 mg injekcí podávaných častěji než 2 hodiny po úvodní dávce a 4 hodiny po druhé dávce nebyla v klinických studiích hodnocena. Maximální dávka intramuskulárního olanzapinu (např. 3 dávky po 10 mg podané s odstupem 2-4 hodin) může být spojena se značným výskytem významné ortostatické hypotenze (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Proto se doporučuje, aby pacienti vyžadující následné intramuskulární injekce byli vyšetřeni na ortostatickou hypotenzi před podáním jakékoli další dávky intramuskulárního olanzapinu na injekci. Podání další dávky pacientovi s klinicky významnou posturální změnou systolického krevního tlaku se nedoporučuje.
Pokud je klinicky indikována pokračující léčba olanzapinem, může být zahájena perorální léčba olanzapinem v rozmezí 5-20 mg/den, jakmile je to klinicky vhodné [viz Schizofrenie a Bipolární porucha I (manické nebo smíšené epizody) ].
Intramuskulární dávkování u zvláštních populací
U geriatrických pacientů nebo v případech, kdy to vyžadují jiné klinické faktory, je třeba zvážit dávku 5 mg/injekci. U pacientů, kteří by jinak mohli být oslabení, predisponovaní k hypotenzním reakcím nebo farmakodynamicky citlivější na olanzapin, by měla být zvážena nižší dávka 2,5 mg/injekce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
Podání přípravku ZYPREXA intramuscular
ZYPREXA Intra Muscular je určena pouze k intramuskulárnímu podání. Nepodávejte intravenózně nebo subkutánně. Aplikujte pomalu hluboko do svalové hmoty. Parenterální léčivé přípravky by měly být před podáním vizuálně zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a nádoba dovolí.
Pokyny pro přípravu přípravku ZYPREXA 2,5 mg intramuskulárně se sterilní vodou pro injekci
Rozpusťte obsah lahvičky pomocí 2,1 ml sterilní vody na injekci, abyste získali roztok obsahující přibližně 5 mg/ml olanzapinu. Výsledný roztok by měl být čirý a žlutý. ZYPREXA 7,5 mg intramuskulárně rekonstituovaný sterilní vodou na injekci se má použít okamžitě (do 1 hodiny) po rekonstituci. Veškerou nepoužitou část zlikvidujte.
Následující tabulka uvádí injekční objemy pro podání různých dávek intramuskulárního olanzapinu na injekci rekonstituovaného sterilní vodou na injekci.
Informace o fyzické nekompatibilitě
ZYPREXA 15 mg IntraMuscular by měl být rekonstituován pouze sterilní vodou na injekci. ZYPREXA 20 mg IntraMuscular se nesmí kombinovat v injekční stříkačce s injekcí diazepamu, protože při smíchání těchto přípravků dochází k vysrážení. Injekce lorazepamu by se neměla používat k rekonstituci přípravku ZYPREXA IntraMuscular, protože tato kombinace vede k prodloužení doby rekonstituce. ZYPREXA IntraMuscular by neměl být kombinován v injekční stříkačce s injekcí haloperidolu, protože bylo prokázáno, že výsledné nízké pH časem olanzapin degraduje.
ZYPREXA 20 mg a fluoxetin v kombinaci: depresivní epizody spojené s bipolární poruchou I
Pokud používáte přípravek ZYPREXA 7,5 mg a fluoxetin v kombinaci, přečtěte si také část Klinické studie v příbalové informaci k přípravku Symbyax.
Dospělí
Perorální olanzapin by měl být podáván v kombinaci s fluoxetinem jednou denně večer, bez ohledu na jídlo, obvykle se začíná 5 mg perorálního olanzapinu a 20 mg fluoxetinu. Pokud je to indikováno, lze dávku upravit podle účinnosti a snášenlivosti v rozmezí dávek perorálního olanzapinu 5 až 12,5 mg a fluoxetinu 20 až 50 mg. Antidepresivní účinnost byla prokázána u přípravku ZYPREXA 10 mg a fluoxetinu v kombinaci u dospělých pacientů v rozmezí dávek olanzapinu 6 až 12 mg a fluoxetinu 25 až 50 mg. Bezpečnost současného podávání dávek vyšších než 18 mg olanzapinu a 75 mg fluoxetinu nebyla v klinických studiích hodnocena.
Děti a dospívající (10-17 let)
Perorální olanzapin by měl být podáván v kombinaci s fluoxetinem jednou denně večer, bez ohledu na jídlo, obvykle se začíná dávkou 2,5 mg perorálního olanzapinu a 20 mg fluoxetinu. Úprava dávkování, je-li indikována, může být provedena podle účinnosti a snášenlivosti. Bezpečnost současného podávání dávek vyšších než 12 mg olanzapinu s 50 mg fluoxetinu nebyla v pediatrických klinických studiích hodnocena.
Bezpečnost a účinnost přípravku ZYPREXA a fluoxetinu v kombinaci byla stanovena v klinických studiích podporujících schválení přípravku Symbyax (kombinace fixní dávky přípravku ZYPREXA a fluoxetinu). Symbyax se dávkuje mezi 3 mg/25 mg (olanzapin/fluoxetin) denně a 12 mg/50 mg (olanzapin/fluoxetin) denně. Následující tabulka ukazuje vhodné jednotlivé dávky přípravku ZYPREXA 10 mg a fluoxetinu versus Symbyax. Úprava dávkování, je-li indikována, by měla být provedena u jednotlivých složek podle účinnosti a snášenlivosti.
když neexistuje žádný soubor důkazů, který by odpověděl na otázku, jak dlouho by měl pacient léčený přípravkem ZYPREXA a fluoxetinem v kombinaci setrvat, obecně se uznává, že bipolární porucha I, včetně depresivních epizod spojených s bipolární poruchou I, je chronická onemocnění vyžadující chronickou léčbu. Poskytovatel zdravotní péče by měl pravidelně přehodnocovat potřebu pokračování farmakoterapie.
ZYPREXA 5 mg v monoterapii není indikována k léčbě depresivních epizod spojených s bipolární poruchou I.
ZYPREXA 7,5 mg a fluoxetin v kombinaci: Léčba rezistentní deprese
Pokud používáte přípravek ZYPREXA a fluoxetin v kombinaci, přečtěte si také část Klinické studie v příbalové informaci k přípravku Symbyax.
Perorální olanzapin by měl být podáván v kombinaci s fluoxetinem jednou denně večer, bez ohledu na jídlo, obvykle se začíná 5 mg perorálního olanzapinu a 20 mg fluoxetinu. Pokud je to indikováno, lze dávku upravit podle účinnosti a snášenlivosti v rozmezí dávek perorálního olanzapinu 5 až 20 mg a fluoxetinu 20 až 50 mg. Antidepresivní účinnost byla prokázána u olanzapinu a fluoxetinu v kombinaci u dospělých pacientů v rozmezí dávek olanzapinu 6 až 18 mg a fluoxetinu 25 až 50 mg.
Bezpečnost a účinnost olanzapinu v kombinaci s fluoxetinem byla stanovena v klinických studiích podporujících schválení Symbyaxu (fixní kombinace olanzapinu a fluoxetinu). Symbyax se dávkuje mezi 3 mg/25 mg (olanzapin/fluoxetin) denně a 12 mg/50 mg (olanzapin/fluoxetin) denně. Tabulka 1 výše ukazuje vhodné jednotlivé dávky přípravku ZYPREXA a fluoxetinu oproti Symbyaxu. Úprava dávkování, je-li indikována, by měla být provedena u jednotlivých složek podle účinnosti a snášenlivosti.
když neexistují žádné důkazy, které by odpověděly na otázku, jak dlouho by pacient léčený přípravkem ZYPREXA a fluoxetinem v kombinaci měl setrvat, obecně se uznává, že deprese rezistentní na léčbu (závažná depresivní porucha u dospělých pacientů, kteří nereagují na 2 samostatné studie různých antidepresiv adekvátní dávky a trvání v současné epizodě) je chronické onemocnění vyžadující chronickou léčbu. Poskytovatel zdravotní péče by měl pravidelně přehodnocovat potřebu pokračování farmakoterapie.
Bezpečnost současného podávání dávek vyšších než 18 mg olanzapinu a 75 mg fluoxetinu nebyla v klinických studiích hodnocena.
ZYPREXA 7,5 mg v monoterapii není indikována k léčbě deprese rezistentní na léčbu (závažná depresivní porucha u pacientů, kteří v současné epizodě nereagují na 2 antidepresiva adekvátní dávky a délky trvání).
ZYPREXA 10 mg a fluoxetin v kombinaci: Dávkování u speciálních populací
Počáteční dávka perorálního olanzapinu 2,5-5 mg s fluoxetinem 20 mg by měla být použita u pacientů s predispozicí k hypotenzním reakcím, pacientů s poruchou funkce jater nebo pacientů, kteří vykazují kombinaci faktorů, které mohou zpomalit metabolismus olanzapinu nebo fluoxetinu v kombinaci (ženské pohlaví, geriatrický věk, nekuřák) nebo pacienti, kteří mohou být farmakodynamicky citliví na olanzapin. Úprava dávkování může být nezbytná u pacientů, kteří vykazují kombinaci faktorů, které mohou zpomalit metabolismus. Pokud je to indikováno, je třeba u těchto pacientů zvyšovat dávku opatrně. ZYPREXA a fluoxetin v kombinaci nebyly systematicky studovány u pacientů starších 65 let nebo u pacientů mladších 10 let (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety ZYPREXA 2,5 mg, 5 mg, 7,5 mg a 10 mg jsou bílé, kulaté, s modrým potiskem LILLY a číslem tablety. 15mg tablety jsou eliptické, modré, s vyraženým LILLY a číslem tablety. 20mg tablety jsou eliptické, růžové, s vyraženým LILLY a číslem tablety. Tablety nejsou rýhovány. Tablety jsou dostupné následovně:
ZYPREXA 10 mg ZYDIS (olanzapin perorálně se rozpadající tablety) jsou žluté, kulaté a mají vyraženou sílu tablety. Tablety nejsou rýhovány. Tablety jsou dostupné následovně:
ZYPREXA 15 mg intramuskulárně je dostupný v 10mg lahvičce (1s).
Tablety ZYPREXA 2,5 mg, 5 mg, 7,5 mg a 10 mg jsou bílé, kulaté, s modrým potiskem LILLY a číslem tablety. 15mg tablety jsou eliptické, modré, s vyraženým LILLY a číslem tablety. 20mg tablety jsou eliptické, růžové, s vyraženým LILLY a číslem tablety. Tablety jsou dostupné následovně:
ZYPREXA 2,5 mg ZYDIS (olanzapin perorálně se rozpadající tablety) jsou žluté, kulaté a mají vyraženou sílu tablety. Tablety jsou dostupné následovně:
ZYPREXA Intramuskulární je k dispozici v:
NDC 0002-7597-01 (č. VL7597) – 10 mg lahvička (1s)
Skladování A Manipulace
Uchovávejte tablety ZYPREXA, ZYPREXA ZYDIS a intramuskulární injekční lahvičky ZYPREXA (před rekonstitucí) při kontrolované pokojové teplotě, 20 ° až 25 ° C (68 ° až 77 ° F) [viz USP ]. Rekonstituovaný přípravek ZYPREXA 20 mg IntraMuscular může být uchováván při kontrolované pokojové teplotě, 20° až 25°C (68° až 77°F) [viz USP v případě potřeby po dobu až 1 hodiny. Zlikvidujte veškerou nepoužitou část rekonstituovaného přípravku ZYPREXA IntraMuscular. USP definuje řízenou pokojovou teplotu jako teplotu udržovanou termostaticky, která zahrnuje obvyklé a obvyklé pracovní prostředí 20° až 25°C (68° až 77°F); což má za následek vypočítanou střední kinetickou teplotu ne vyšší než 25 °C; a to umožňuje exkurze mezi 15° a 30°C (59° a 86°F), které jsou běžné v lékárnách, nemocnicích a skladech.
Tablety ZYPREXA a ZYPREXA ZYDIS chraňte před světlem a vlhkostí. Chraňte přípravek ZYPREXA IntraMuscular před světlem, nezmrazujte.
Prodává: Lilly USA, LLC, Indianapolis, IN 46285, USA. Upraveno: říjen 2019
VEDLEJŠÍ EFEKTY
Pokud používáte přípravek ZYPREXA 2,5 mg a fluoxetin v kombinaci, přečtěte si také část Nežádoucí účinky v příbalové informaci k přípravku Symbyax.
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet nebo předvídat míry pozorované v praxi.
Klinické zkoušky u dospělých
Níže uvedené informace pro olanzapin jsou odvozeny z databáze klinických studií olanzapinu sestávající z 10 504 dospělých pacientů s přibližně 4 765 pacientoroků expozice olanzapinu plus 722 pacientů s expozicí intramuskulárnímu injekčnímu olanzapinu. Tato databáze zahrnuje: (1) 2500 pacientů, kteří se účastnili předmarketingových studií s opakovaným perorálním olanzapinem u schizofrenie a Alzheimerovy choroby, což představuje přibližně 1122 pacientoroků expozice ke 14. únoru 1995; (2) 182 pacientů, kteří se účastnili předmarketingových studií perorálního olanzapinu s bipolární poruchou I (manické nebo smíšené epizody), což představuje přibližně 66 pacientoroků expozice; (3) 191 pacientů, kteří se účastnili studie s perorálním olanzapinem u pacientů s různými psychiatrickými symptomy v souvislosti s Alzheimerovou chorobou, což představuje přibližně 29 pacientoroků expozice; (4) 5788 dalších pacientů z 88 klinických studií s perorálním olanzapinem k 31. prosinci 2001; (5) 1843 dalších pacientů ze 41 klinických studií olanzapinu k 31. říjnu 2011; a (6) 722 pacientů, kteří se účastnili předmarketingových studií intramuskulárního injekčního olanzapinu u agitovaných pacientů se schizofrenií, bipolární poruchou I (manické nebo smíšené epizody) nebo demencí. Níže jsou také uvedeny informace z databáze předmarketingových 6týdenních klinických studií olanzapinu v kombinaci s lithiem nebo valproátem, sestávající z 224 pacientů, kteří se účastnili studií s bipolární poruchou I (manické nebo smíšené epizody) s expozicí přibližně 22 pacientoroků.
Podmínky a délka léčby olanzapinem se velmi lišily a zahrnovaly (v překrývajících se kategoriích) otevřené a dvojitě zaslepené fáze studií, hospitalizované a ambulantní pacienty, studie s fixní dávkou a titrací dávky a krátkodobou nebo dlouhodobou expozici . Nežádoucí účinky byly hodnoceny sběrem nežádoucích účinků, výsledků fyzikálních vyšetření, vitálních funkcí, hmotnosti, laboratorních analytů, EKG, rentgenových snímků hrudníku a výsledků oftalmologických vyšetření.
Některé části níže uvedené diskuse týkající se objektivních nebo číselných bezpečnostních parametrů, jmenovitě nežádoucích účinků závislých na dávce, změn vitálních funkcí, přírůstku hmotnosti, laboratorních změn a změn EKG, jsou odvozeny ze studií u pacientů se schizofrenií a nebyly duplikovány pro bipolární poruchu I. (manické nebo smíšené epizody) nebo agitovanost. Tyto informace jsou však také obecně použitelné pro bipolární poruchu I (manické nebo smíšené epizody) a agitovanost.
Nežádoucí reakce během expozice byly získány spontánním hlášením a zaznamenány klinickými zkoušejícími s použitím terminologie podle vlastního výběru. V důsledku toho není možné poskytnout smysluplný odhad podílu jedinců, u kterých se vyskytly nežádoucí reakce, aniž by se nejprve seskupily podobné typy reakcí do menšího počtu kategorií standardizovaných reakcí. V následujících tabulkách a tabulkách byla ke klasifikaci hlášených nežádoucích účinků použita terminologie MedDRA a slovníku COSTART.
Uvedené četnosti nežádoucích účinků představují podíl jedinců, kteří alespoň jednou zaznamenali nežádoucí účinek vyplývající z léčby uvedeného typu. Reakce byla považována za nastupující léčbu, pokud se objevila poprvé nebo se zhoršila během léčby po základním hodnocení. Hlášené reakce nezahrnují ty reakční termíny, které byly tak obecné, že by byly neinformativní. Reakce uvedené jinde v označení se nesmí opakovat níže. Je důležité zdůraznit, že ačkoli se reakce vyskytly během léčby olanzapinem, nemusely být nutně způsobeny. Pro úplné pochopení bezpečnostního profilu olanzapinu je třeba si přečíst celý štítek.
Předepisující lékař by si měl být vědom toho, že údaje v tabulkách a tabulkách nelze použít k předpovědi výskytu nežádoucích účinků v průběhu běžné lékařské praxe, kde se charakteristiky pacienta a další faktory liší od těch, které převládaly v klinických studiích. Podobně nelze uvedené frekvence porovnávat s údaji získanými z jiných klinických studií zahrnujících různé způsoby léčby, použití a zkoušející. Uvedené údaje však poskytují předepisujícímu poskytovateli zdravotní péče určitý základ pro odhad relativního podílu drogových a nelékových faktorů na výskytu nežádoucích účinků ve studované populaci.
Výskyt nežádoucích reakcí v krátkodobých, placebem kontrolovaných a kombinovaných studiích
Následující zjištění jsou založena na předmarketingových studiích (1) perorálního olanzapinu pro schizofrenii, bipolární poruchu I (manické nebo smíšené epizody), následné studii u pacientů s různými psychiatrickými symptomy v souvislosti s Alzheimerovou chorobou a předmarketingových kombinovaných studiích a (2 ) intramuskulární injekční olanzapin u agitovaných pacientů se schizofrenií nebo bipolární mánií I.
Nežádoucí reakce spojené s přerušením léčby v krátkodobých, placebem kontrolovaných studiích
Schizofrenie
Celkově nebyl žádný rozdíl ve výskytu přerušení léčby z důvodu nežádoucích účinků (5 % u perorálního olanzapinu oproti 6 % u placeba). Vysazení z důvodu zvýšení ALT však bylo považováno za související s lékem (2 % u perorálního olanzapinu oproti 0 % u placeba).
Monoterapie bipolární poruchy I (manické nebo smíšené epizody).
Celkově nebyl žádný rozdíl ve výskytu přerušení léčby z důvodu nežádoucích účinků (2 % u perorálního olanzapinu oproti 2 % u placeba).
Míchání
Celkově nebyl žádný rozdíl v incidenci přerušení léčby z důvodu nežádoucích účinků (0,4 % pro intramuskulární injekční olanzapin oproti 0 % pro placebo).
Nežádoucí reakce spojené s přerušením léčby v krátkodobých kombinovaných studiích
Bipolární porucha I (manické nebo smíšené epizody), olanzapin jako doplněk k lithiu nebo valproátu
Ve studii u pacientů, kteří již tolerovali lithium nebo valproát v monoterapii, byla míra přerušení léčby z důvodu nežádoucích účinků 11 % u kombinace perorálního olanzapinu s lithiem nebo valproátem ve srovnání s 2 % u pacientů, kteří zůstali na monoterapii lithiem nebo valproátem. Vysazení kombinace perorálního olanzapinu a lithia nebo valproátu, k nimž došlo u více než 1 pacienta, byla: somnolence (3 %), zvýšení tělesné hmotnosti (1 %) a periferní edém (1 %).
Běžně pozorované nežádoucí reakce v krátkodobých, placebem kontrolovaných studiích
Nejčastěji pozorované nežádoucí účinky spojené s užíváním perorálního olanzapinu (výskyt 5 % nebo vyšší) a nepozorované s ekvivalentní incidencí u pacientů léčených placebem (výskyt olanzapinu nejméně dvakrát vyšší než u placeba) byly:
Olanzapin intramuskulárně
Byl pozorován 1 nežádoucí účinek (somnolence) s incidencí 5 % nebo vyšší u pacientů léčených intramuskulárně olanzapinem injekčně a nebyl pozorován s ekvivalentní incidencí u pacientů léčených placebem (incidence olanzapinu nejméně dvakrát vyšší než u placeba) během placeba -kontrolované předmarketingové studie. Výskyt somnolence během 24hodinové IM léčby v klinických studiích u agitovaných pacientů se schizofrenií nebo bipolární I mánií byl 6 % u intramuskulárního olanzapinu na injekci a 3 % u placeba.
Nežádoucí účinky vyskytující se s výskytem 2 % nebo více u pacientů léčených perorálně olanzapinem v krátkodobých, placebem kontrolovaných studiích
Tabulka 11 vyjmenovává incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků souvisejících s léčbou, které se vyskytly u 2 % nebo více pacientů léčených perorálním olanzapinem (dávky ≥2,5 mg/den) as incidencí vyšší než u placeba, kteří se účastnili akutní fázi placebem kontrolovaných studií.
Závislost na dávce nežádoucích účinků
Rozdíl mezi dávkovou skupinou byl pozorován u únavy, závratí, přírůstku hmotnosti a zvýšení hladiny prolaktinu. V jediné 8týdenní randomizované, dvojitě zaslepené studii s fixní dávkou porovnávající 10 (N=199), 20 (N=200) a 40 (N=200) mg/den perorálního olanzapinu u dospělých pacientů se schizofrenií nebo schizoafektivní porucha, výskyt únavy (10 mg/den: 1,5 %; 20 mg/den: 2,1 %; 40 mg/den: 6,6 %) byl pozorován s významnými rozdíly mezi 10 vs 40 a 20 vs 40 mg/den. Incidence závratí (10 mg/den: 2,6 %; 20 mg/den: 1,6 %; 40 mg/den: 6,6 %) byla pozorována s významnými rozdíly mezi 20 vs 40 mg. Rozdíly mezi dávkovými skupinami byly také zaznamenány u přírůstku hmotnosti a zvýšení prolaktinu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Následující tabulka se zabývá závislostí na dávce u jiných nežádoucích účinků s použitím údajů ze studie se schizofrenií zahrnující pevná rozmezí dávek perorálního olanzapinu. Vypočítává procento pacientů s nežádoucími účinky souvisejícími s léčbou pro 3 skupiny s fixním rozmezím dávek a placebo. Data byla analyzována pomocí Cochran-Armitageova testu, s výjimkou skupiny s placebem, a tabulka zahrnuje pouze ty nežádoucí reakce, u kterých existoval trend.
Běžně pozorované nežádoucí reakce v krátkodobých studiích perorálního olanzapinu jako doplňku k lithiu nebo valproátu
V doplňkových placebem kontrolovaných studiích bipolární poruchy I (manické nebo smíšené epizody) byly nejčastěji pozorované nežádoucí účinky spojené s kombinací olanzapinu a lithia nebo valproátu (výskyt ≥5 % a nejméně dvakrát placebo):
Nežádoucí účinky vyskytující se s výskytem 2 % nebo více u pacientů léčených perorálně olanzapinem v krátkodobých studiích s olanzapinem jako doplňkem k lithiu nebo valproátu
Tabulka 14 vyjmenovává incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků souvisejících s léčbou, které se objevily u 2 % nebo více pacientů léčených kombinací olanzapinu (dávky ≥5 mg/den) a lithia nebo valproátu as incidencí vyšší než samotným lithiem nebo valproátem, kteří se účastnili akutní fáze placebem kontrolovaných kombinovaných studií.
Specifické informace o nežádoucích účincích pozorovaných u lithia nebo valproátu naleznete v části Nežádoucí účinky v příbalových informacích pro tyto další produkty.
Nežádoucí účinky vyskytující se s výskytem 1 % nebo více mezi intramuskulárním olanzapinem u pacientů léčených injekčně v krátkodobých, placebem kontrolovaných studiích
Tabulka 15 uvádí incidenci, zaokrouhlenou na nejbližší procento, nežádoucích účinků souvisejících s léčbou, které se objevily u 1 % nebo více pacientů léčených intramuskulárním injekčním olanzapinem (rozmezí dávek 2,5–10 mg/injekce) a s incidencí vyšší než u placeba kteří se účastnili krátkodobých, placebem kontrolovaných studií u agitovaných pacientů se schizofrenií nebo bipolární I mánií.
Extrapyramidové příznaky
Následující tabulka uvádí procento pacientů s extrapyramidovými symptomy, které se objevily při léčbě, jak bylo hodnoceno kategorickými analýzami formálních hodnotících škál během akutní terapie v kontrolované klinické studii srovnávající perorální olanzapin ve 3 fixních dávkách s placebem při léčbě schizofrenie během 6 týdnů soud.
Následující tabulka vyjmenovává procento pacientů s extrapyramidovými symptomy, které se objevily při léčbě, podle spontánně hlášených nežádoucích účinků během akutní terapie ve stejné kontrolované klinické studii srovnávající olanzapin ve 3 fixních dávkách s placebem při léčbě schizofrenie v 6týdenní studii.
Následující tabulka vypočítává procento dospívajících pacientů s extrapyramidovými symptomy, které se objevily při léčbě, podle spontánně hlášených nežádoucích účinků během akutní terapie (rozmezí dávek: 2,5 až 20 mg/den).
Následující tabulka uvádí procento pacientů s extrapyramidovými symptomy, které se objevily při léčbě, jak bylo hodnoceno kategorickými analýzami formálních hodnotících škál během kontrolovaných klinických studií porovnávajících fixní dávky intramuskulárního olanzapinu pro injekci s placebem při agitaci. Pacienti v každé dávkové skupině mohli během studií dostat až 3 injekce [viz Klinické studie ]. Hodnocení pacientů bylo prováděno během 24 hodin po úvodní dávce intramuskulárního olanzapinu na injekci.
Následující tabulka vypočítává procento pacientů s extrapyramidovými symptomy, které se objevily při léčbě, podle spontánně hlášených nežádoucích účinků ve stejné kontrolované klinické studii porovnávající fixní dávky intramuskulárního olanzapinu pro injekci s placebem u agitovaných pacientů se schizofrenií.
Dystonie, Class Effect
Příznaky dystonie, prodloužené abnormální kontrakce svalových skupin, se mohou objevit u vnímavých jedinců během prvních několika dnů léčby. Dystonické příznaky zahrnují: křeče šíjových svalů, někdy progredující do sevření hrdla, potíže s polykáním, potíže s dýcháním a/nebo vyčnívání jazyka. I když se tyto příznaky mohou objevit při nízkých dávkách, četnost a závažnost jsou vyšší s vysokou účinností a při vyšších dávkách antipsychotických léků první generace. Obecně lze pozorovat zvýšené riziko akutní dystonie u mužů a mladších věkových skupin užívajících antipsychotika; případy dystonie však byly při užívání olanzapinu hlášeny zřídka (
Jiné nežádoucí účinky
Jiné nežádoucí účinky pozorované během klinického hodnocení perorálního olanzapinu
Následuje seznam nežádoucích účinků souvisejících s léčbou hlášených pacienty léčenými perorálním olanzapinem (v opakovaných dávkách ≥1 mg/den) v klinických studiích. Tento seznam není zamýšlen tak, aby zahrnoval reakce (1) již uvedené v předchozích tabulkách nebo jinde v označení, (2) pro které byla drogová příčina vzdálená, (3) které byly tak obecné, že nebyly informativní, (4) které nebyly považovány za mající významné klinické důsledky, nebo (5) které se vyskytly v míře rovné nebo nižší než u placeba. Reakce jsou klasifikovány podle tělesného systému pomocí následujících definic: časté nežádoucí reakce jsou ty, které se vyskytují alespoň u 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; vzácné reakce jsou ty, které se vyskytují u méně než 1/1000 pacientů.
Tělo jako celek - Méně časté: zimnice, edém obličeje, fotosenzitivní reakce, pokus o sebevraždu1; Vzácné: zimnice a horečka, kocovina, náhlá smrt1.
Kardiovaskulární systém - Méně časté: cerebrovaskulární příhoda, vazodilatace.
Zažívací ústrojí - Méně časté: abdominální distenze, nevolnost a zvracení, edém jazyka; Vzácné: ileus, střevní obstrukce, ukládání tuku v játrech.
Hemický a lymfatický systém - Méně časté: trombocytopenie.
Poruchy metabolismu a výživy - Časté: zvýšená alkalická fosfatáza; Méně časté: bilirubinémie, hypoproteinémie.
Muskuloskeletální systém - Vzácné: osteoporóza.
Nervový systém - Méně časté: ataxie, dysartrie, snížené libido, stupor; Vzácné: kóma.
Dýchací systém - Méně časté: epistaxe; Vzácné: edém plic.
Kůže a přílohy - Méně časté: alopecie.
Speciální smysly - Méně časté: abnormalita akomodace, suché oči; Vzácné: mydriáza.
Urogenitální systém - Méně časté: amenorea2, bolest prsů, snížená menstruace, impotence2, zvýšená menstruace2, menoragie2, metroragie2, polyurie2, frekvence močení, retence moči, nutkání na močení, zhoršené močení.
1 Tyto termíny představují závažné nežádoucí účinky, ale nesplňují definici nežádoucích účinků léků. Jsou zde zahrnuty kvůli jejich závažnosti. 2 Upraveno podle pohlaví.
Jiné nežádoucí účinky pozorované během klinického hodnocení intramuskulárního olanzapinu pro injekci
Následuje seznam nežádoucích účinků souvisejících s léčbou hlášených pacienty léčenými intramuskulárním injekčním olanzapinem (v 1 nebo více dávkách ≥2,5 mg/injekce) v klinických studiích. Tento seznam není zamýšlen tak, aby zahrnoval reakce (1) již uvedené v předchozích tabulkách nebo jinde v označení, (2) pro které byla drogová příčina vzdálená, (3) které byly tak obecné, že nebyly informativní, (4) které nebyly považovány za mající významné klinické důsledky nebo (5) které se vyskytly v míře rovné nebo nižší než u placeba. Reakce jsou klasifikovány podle tělesného systému pomocí následujících definic: časté nežádoucí reakce jsou ty, které se vyskytují alespoň u 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů.
Tělo jako celek - Časté: bolest v místě vpichu.
Kardiovaskulární systém - Méně časté: synkopa.
Zažívací ústrojí - Méně časté: nevolnost.
Poruchy metabolismu a výživy - Méně časté: zvýšená hladina kreatinfosfokinázy.
Klinické studie u dospívajících pacientů (ve věku 13 až 17 let)
Běžně pozorované nežádoucí reakce v krátkodobých, placebem kontrolovaných studiích s perorálním olanzapinem
Nežádoucí účinky u dospívajících pacientů léčených perorálním olanzapinem (dávky ≥2,5 mg) hlášené s incidencí 5 % nebo více a hlášené nejméně dvakrát častěji než u pacientů léčených placebem jsou uvedeny v tabulce 21.
Nežádoucí účinky vyskytující se s výskytem 2 % nebo více u pacientů léčených perorálně olanzapinem v krátkodobém horizontu (3-6 týdnů), placebem kontrolované studie
Nežádoucí účinky u dospívajících pacientů léčených perorálním olanzapinem (dávky ≥2,5 mg) hlášené s incidencí 2 % nebo vyšší a vyšší než u placeba jsou uvedeny v tabulce 22.
Vitální Známky A Laboratorní Studie
Změny vitálních funkcí
klinických studiích byl perorální olanzapin spojován s ortostatickou hypotenzí a tachykardií. Intramuskulární injekční olanzapin byl v klinických studiích spojován s bradykardií, hypotenzí a tachykardií (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Laboratorní změny
Monoterapie olanzapinem u dospělých
Hodnocení premarketingových zkušeností s olanzapinem odhalilo souvislost s asymptomatickým zvýšením ALT, AST a GGT. V původní předmarketingové databázi asi 2 400 dospělých pacientů s výchozí hodnotou ALT ≤ 90 IU/l byla incidence zvýšení ALT na > 200 IU/l 2 % (50/2 381). U žádného z těchto pacientů se nevyskytla žloutenka nebo jiné příznaky, které lze připsat poškození jater, a většina z nich měla přechodné změny, které měly tendenci se normalizovat, zatímco léčba olanzapinem pokračovala.
placebem kontrolovaných studiích monoterapie olanzapinem u dospělých bylo pozorováno klinicky významné zvýšení ALT (změna z
Z analýzy laboratorních údajů v integrované databázi 41 dokončených klinických studií u dospělých pacientů léčených perorálním olanzapinem byly zaznamenány vysoké hladiny GMT u ≥1 % (88/5245) pacientů.
Opatrnosti je třeba u pacientů se známkami a příznaky poškození jater, u pacientů s již existujícími stavy spojenými s omezenou jaterní funkční rezervou au pacientů, kteří jsou léčeni potenciálně hepatotoxickými léky.
Podávání olanzapinu bylo také spojeno se zvýšením sérového prolaktinu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], s asymptomatickým zvýšením počtu eozinofilů u 0,3 % pacientů a se zvýšením CPK.
Z analýzy laboratorních údajů v integrované databázi 41 dokončených klinických studií u dospělých pacientů léčených perorálním olanzapinem byla zaznamenána zvýšená hladina kyseliny močové u ≥ 3 % (171/4641) pacientů.
Monoterapie olanzapinem u dospívajících
placebem kontrolovaných klinických studiích u dospívajících pacientů se schizofrenií nebo bipolární poruchou I (manické nebo smíšené epizody) byly u laboratorních analytů kdykoli pozorovány vyšší frekvence následujících nálezů souvisejících s léčbou ve srovnání s placebem: zvýšená ALT (≥3X ULN u pacientů s ALT na začátku
placebem kontrolovaných studiích monoterapie olanzapinem u dospívajících bylo klinicky významné zvýšení ALT (změna z
Změny EKG
souhrnných studiích u dospělých i ve sdružených studiích u dospívajících nebyly žádné významné rozdíly mezi olanzapinem a placebem v podílech pacientů, u kterých došlo k potenciálně významným změnám parametrů EKG, včetně QT, QTc (korekce Fridericia) a PR intervalů. Užívání olanzapinu bylo spojeno s průměrným zvýšením srdeční frekvence ve srovnání s placebem (dospělí: +2,4 tepů za minutu oproti žádné změně u placeba; dospívající: +6,3 tepu za minutu oproti -5,1 tepu za minutu u placeba). Toto zvýšení srdeční frekvence může souviset s potenciálem olanzapinu vyvolat ortostatické změny (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zkušenosti
Během používání přípravku ZYPREXA po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, je obtížné spolehlivě odhadnout jejich četnost nebo vyhodnotit kauzální vztah k expozici léku.
Nežádoucí účinky hlášené od uvedení na trh, které dočasně (ale ne nutně kauzálně) souvisely s léčbou přípravkem ZYPREXA, zahrnují následující: alergické reakce (např. anafylaktoidní reakce, angioedém, pruritus nebo kopřivka), cholestatické nebo smíšené poškození jater, diabetické kóma, diabetická ketoacidóza, reakce z vysazení (pocení, nauzea nebo zvracení), léková reakce s eozinofilií a systémovými příznaky (DRESS), hepatitida, žloutenka, neutropenie, pankreatitida, priapismus, vyrážka, syndrom neklidných nohou, rhabdomyolýza, koktání1 a žilní tromboembolické příhody (včetně plicní embolie a plicní embolie hluboká žilní trombóza). Byly hlášeny náhodné hladiny cholesterolu ≥240 mg/dl a náhodné hladiny triglyceridů ≥1000 mg/dl.
1 Koktavost byla studována pouze u orálních a dlouhodobě působících injekčních přípravků (LAI).
DROGOVÉ INTERAKCE
Rizika užívání olanzapinu v kombinaci s jinými léky nebyla v systematických studiích rozsáhle hodnocena.
Potenciál jiných léků ovlivnit olanzapin
Diazepam
Současné podávání diazepamu s olanzapinem potencovalo ortostatickou hypotenzi pozorovanou u olanzapinu.
Cimetidin a antacida
Jednotlivé dávky cimetidinu (800 mg) nebo antacid obsahujících hliník a hořčík neovlivnily perorální biologickou dostupnost olanzapinu.
Induktory CYP1A2
Léčba karbamazepinem (200 mg dvakrát denně) způsobuje přibližně 50% zvýšení clearance olanzapinu. Toto zvýšení je pravděpodobně způsobeno skutečností, že karbamazepin je silným induktorem aktivity CYP1A2. Vyšší denní dávky karbamazepinu mohou způsobit ještě větší zvýšení clearance olanzapinu.
Alkohol
Ethanol (jednorázová dávka 45 mg/70 kg) neměl vliv na farmakokinetiku olanzapinu. Současné podávání alkoholu (tj. ethanolu) s olanzapinem potencovalo ortostatickou hypotenzi pozorovanou u olanzapinu (viz DROGOVÉ INTERAKCE ].
Inhibitory CYP1A2
Fluvoxamin
Fluvoxamin, inhibitor CYP1A2, snižuje clearance olanzapinu. To má za následek průměrné zvýšení Cmax olanzapinu po fluvoxaminu o 54 % u žen nekuřaček a 77 % u mužů kuřáků. Průměrné zvýšení AUC olanzapinu je 52 % a 108 %. U pacientů, kteří jsou současně léčeni fluvoxaminem, je třeba zvážit nižší dávky olanzapinu.
Inhibitory CYP2D6
Fluoxetin
Fluoxetin (jednorázová dávka 60 mg nebo 60 mg denní dávka po dobu 8 dnů) způsobuje malé (průměrně 16 %) zvýšení maximální koncentrace olanzapinu a malé (průměrně 16 %) snížení clearance olanzapinu. Velikost dopadu tohoto faktoru je malá ve srovnání s celkovou variabilitou mezi jednotlivci, a proto se úprava dávky běžně nedoporučuje. Pokud používáte přípravek ZYPREXA a fluoxetin v kombinaci, přečtěte si také oddíl Lékové interakce v příbalovém letáku k přípravku Symbyax.
Warfarin
Warfarin (jednorázová dávka 20 mg) neovlivnil farmakokinetiku olanzapinu.
Induktory CYP1A2 nebo glukuronyl transferázy
Omeprazol a rifampin mohou způsobit zvýšení clearance olanzapinu.
Dřevěné uhlí
Podání aktivního uhlí (1 g) snížilo Cmax a AUC perorálního olanzapinu asi o 60 %. Vzhledem k tomu, že maximální hladiny olanzapinu se typicky nedosahují dříve než 6 hodin po podání dávky, může být při předávkování olanzapinem užitečné živočišné uhlí.
Potenciál pro olanzapin ovlivnit jiné léky
Léky působící na CNS
Vzhledem k primárním účinkům olanzapinu na CNS je třeba opatrnosti při užívání olanzapinu v kombinaci s jinými centrálně působícími léky a alkoholem.
Antihypertenziva
Olanzapin může vzhledem ke svému potenciálu vyvolat hypotenzi zesilovat účinky některých antihypertenziv.
Levodopa a agonisté dopaminu
Olanzapin může antagonizovat účinky levodopy a agonistů dopaminu.
lorazepam (IM)
Podání intramuskulárního lorazepamu (2 mg) 1 hodinu po intramuskulární injekci olanzapinu (5 mg) významně neovlivnilo farmakokinetiku olanzapinu, nekonjugovaného lorazepamu nebo celkového lorazepamu. Toto současné podávání intramuskulárního lorazepamu a intramuskulárního olanzapinu na injekci se však přidalo k ospalosti pozorované u každého léku samostatně [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lithium
Opakované dávky olanzapinu (10 mg po dobu 8 dnů) neovlivnily kinetiku lithia. Současné podávání olanzapinu proto nevyžaduje úpravu dávkování lithia [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Valproát
Olanzapin (10 mg denně po dobu 2 týdnů) neovlivnil plazmatické koncentrace valproátu v ustáleném stavu. Proto současné podávání olanzapinu nevyžaduje úpravu dávkování valproátu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vliv Olanzapinu Na Enzymy Metabolizující Léky
Studie in vitro využívající lidské jaterní mikrozomy naznačují, že olanzapin má malý potenciál inhibovat CYP1A2, CYP2C9, CYP2C19, CYP2D6 a CYP3A. Není tedy pravděpodobné, že by olanzapin způsoboval klinicky významné lékové interakce zprostředkované těmito enzymy.
Imipramin
Jednotlivé dávky olanzapinu neovlivnily farmakokinetiku imipraminu nebo jeho aktivního metabolitu desipraminu.
Warfarin
Jednotlivé dávky olanzapinu neovlivnily farmakokinetiku warfarinu.
Diazepam
Olanzapin neovlivnil farmakokinetiku diazepamu ani jeho aktivního metabolitu Ndesmethyldiazepamu. Diazepam podávaný současně s olanzapinem však zvyšoval ortostatickou hypotenzi pozorovanou u každého léku podávaného samostatně.
Alkohol
Vícenásobné dávky olanzapinu neovlivnily kinetiku ethanolu.
Biperiden
Opakované dávky olanzapinu neovlivnily kinetiku biperidenu.
Theofylin
Opakované dávky olanzapinu neovlivnily farmakokinetiku theofylinu ani jeho metabolitů.
Zneužívání drog a závislost
Závislost
Ve studiích prospektivně navržených k posouzení potenciálu zneužívání a závislosti bylo prokázáno, že olanzapin má akutní depresivní účinky na CNS, ale malý nebo žádný potenciál zneužívání nebo fyzické závislosti u potkanů, kterým byly podávány perorální dávky až 15násobku denních perorálních dávek MRHD (20 mg) a opic rhesus podávané perorální dávky až do 8násobku denní perorální MRHD na základě mg/m² tělesného povrchu.
olanzapinu nebyl systematicky zkoumán jeho potenciál pro zneužívání, toleranci nebo fyzickou závislost. I když klinické studie neodhalily žádnou tendenci k nějakému chování při vyhledávání drog, tato pozorování nebyla systematická a na základě těchto omezených zkušeností není možné předpovědět, do jaké míry bude léčivo působící na CNS zneužito, odkloněno. a/nebo zneužity po uvedení na trh. V důsledku toho by pacienti měli být pečlivě vyšetřeni, zda v anamnéze nebyli zneužíváni drogy, a tito pacienti by měli být pečlivě sledováni, zda se u nich nevyskytují známky nesprávného užívání nebo zneužívání olanzapinu (např. rozvoj tolerance, zvýšení dávky, vyhledávání drog).
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Pokud používáte přípravek ZYPREXA 7,5 mg a fluoxetin v kombinaci, přečtěte si také část Upozornění a bezpečnostní opatření v příbalové informaci k přípravku Symbyax.
Starší pacienti s psychózou související s demencí
Zvýšená úmrtnost
starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. ZYPREXA 20 mg není schválena pro léčbu pacientů s psychózou související s demencí (viz VAROVÁNÍ V RÁMCI, Použití u pacientů se souběžným onemocněním a INFORMACE PRO PACIENTA).
V placebem kontrolovaných klinických studiích u starších pacientů s psychózou související s demencí byla incidence úmrtí u pacientů léčených olanzapinem významně vyšší než u pacientů léčených placebem (3,5 % vs. 1,5 %).
Cerebrovaskulární nežádoucí příhody (CVAE), včetně mrtvice
Cerebrovaskulární nežádoucí příhody (např. mrtvice, tranzitorní ischemická ataka), včetně úmrtí, byly hlášeny u pacientů ve studiích s olanzapinem u starších pacientů s psychózou související s demencí. V placebem kontrolovaných studiích byl u pacientů léčených olanzapinem ve srovnání s pacienty léčenými placebem významně vyšší výskyt cerebrovaskulárních nežádoucích příhod. Olanzapin není schválen k léčbě pacientů s psychózou související s demencí [viz VAROVÁNÍ V KRABICE a INFORMACE PRO PACIENTA ].
Sebevražda
Možnost pokusu o sebevraždu je vlastní schizofrenii a bipolární poruše I a medikamentózní terapii by měl doprovázet pečlivý dohled nad vysoce rizikovými pacienty. Recepty na olanzapin by měly být napsány na nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Neuroleptický maligní syndrom (NMS)
souvislosti s podáváním antipsychotik, včetně olanzapinu, byl hlášen potenciálně fatální komplex symptomů, někdy označovaný jako neuroleptický maligní syndrom (NMS). Klinickými projevy NMS jsou hyperpyrexie, svalová rigidita, změněný duševní stav a známky autonomní nestability (nepravidelný puls nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatininfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní selhání ledvin.
Diagnostické hodnocení pacientů s tímto syndromem je složité. Při stanovení diagnózy je důležité vyloučit případy, kdy klinický obraz zahrnuje jak závažné onemocnění (např. zápal plic, systémová infekce atd.), tak neléčené nebo nedostatečně léčené extrapyramidové příznaky a symptomy (EPS). Další důležitá hlediska v diferenciální diagnóze zahrnují centrální anticholinergní toxicitu, úpal, horečku po drogách a primární patologii centrálního nervového systému.
Léčba NMS by měla zahrnovat: 1) okamžité vysazení antipsychotik a jiných léků, které nejsou nezbytné pro souběžnou léčbu; 2) intenzivní symptomatická léčba a lékařské sledování; a 3) léčba jakýchkoli doprovodných vážných zdravotních problémů, pro které je k dispozici specifická léčba. Neexistuje obecná shoda ohledně specifických farmakologických léčebných režimů pro NMS.
Vyžaduje-li pacient po zotavení z NMS léčbu antipsychotickými léky, je třeba pečlivě zvážit případné znovuzavedení lékové terapie. Pacient by měl být pečlivě sledován, protože byly hlášeny recidivy NMS [viz INFORMACE PRO PACIENTA ].
Léková reakce s eozinofilií a systémovými příznaky (DRESS)
Při expozici olanzapinu byla hlášena léková reakce s eozinofilií a systémovými příznaky (DRESS). DRESS se může projevit kožní reakcí (jako je vyrážka nebo exfoliativní dermatitida), eozinofilií, horečkou a/nebo lymfadenopatií se systémovými komplikacemi, jako je hepatitida, nefritida, pneumonitida, myokarditida a/nebo perikarditida. ŠATY jsou někdy fatální. Při podezření na DRESS přerušte podávání olanzapinu [viz INFORMACE PRO PACIENTA ].
Metabolické změny
Atypická antipsychotika jsou spojována s metabolickými změnami včetně hyperglykémie, dyslipidémie a přírůstku hmotnosti. Metabolické změny mohou být spojeny se zvýšeným kardiovaskulárním/cerebrovaskulárním rizikem. Specifický metabolický profil olanzapinu je uveden níže.
Hyperglykémie A Diabetes Mellitus
Poskytovatelé zdravotní péče by měli zvážit rizika a přínosy při předepisování olanzapinu pacientům se stanovenou diagnózou diabetes mellitus nebo s hraničně zvýšenou hladinou glukózy v krvi (100-126 mg/dl nalačno, 140-200 mg/dl bez lačnění). Pacienti užívající olanzapin by měli být pravidelně sledováni, zda se u nich nezhoršuje kontrola glukózy. Pacienti zahajující léčbu olanzapinem by měli na začátku léčby a pravidelně v jejím průběhu podstoupit vyšetření hladiny glukózy v krvi nalačno. U každého pacienta léčeného atypickými antipsychotiky je třeba sledovat příznaky hyperglykémie včetně polydipsie, polyurie, polyfagie a slabosti. Pacienti, u kterých se během léčby atypickými antipsychotiky objeví příznaky hyperglykémie, by měli podstoupit vyšetření glykémie nalačno. V některých případech hyperglykémie ustoupila po vysazení atypického antipsychotika; někteří pacienti však vyžadovali pokračování v antidiabetické léčbě i přes vysazení podezřelého léku [viz INFORMACE PRO PACIENTA ].
pacientů léčených atypickými antipsychotiky včetně olanzapinu byla hlášena hyperglykémie, v některých případech extrémní a spojená s ketoacidózou nebo hyperosmolárním kómatem nebo smrtí. Posouzení vztahu mezi atypickým užíváním antipsychotik a glukózovými abnormalitami je komplikováno možností zvýšeného základního rizika diabetes mellitus u pacientů se schizofrenií a zvyšujícím se výskytem diabetes mellitus v běžné populaci. Epidemiologické studie naznačují zvýšené riziko nežádoucích účinků souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky. Zatímco odhady relativního rizika jsou nekonzistentní, zdá se, že souvislost mezi atypickými antipsychotiky a zvýšením hladiny glukózy padá na kontinuum a olanzapin se zdá mít větší souvislost než některá jiná atypická antipsychotika.
Průměrné zvýšení hladiny glukózy v krvi bylo pozorováno u pacientů léčených (medián expozice 9,2 měsíce) olanzapinem ve fázi 1 klinických antipsychotických studií účinnosti intervence (CATIE). Průměrné zvýšení sérové glukózy (vzorky nalačno a vzorky bez hladovění) od výchozí hodnoty k průměru 2 nejvyšších sérových koncentrací bylo 15,0 mg/dl.
Ve studii se zdravými dobrovolníky bylo u jedinců, kteří dostávali olanzapin (N=22) po dobu 3 týdnů, průměrné zvýšení glykémie nalačno ve srovnání s výchozí hodnotou o 2,3 mg/dl. Subjekty léčené placebem (N=19) měly průměrné zvýšení glykémie nalačno ve srovnání s výchozí hodnotou 0,34 mg/dl.
Monoterapie olanzapinem u dospělých
analýze 5 placebem kontrolovaných studií monoterapie olanzapinem u dospělých s mediánem trvání léčby přibližně 3 týdny byl olanzapin spojen s větší průměrnou změnou hladin glukózy nalačno ve srovnání s placebem (2,76 mg/dl oproti 0,17 mg/dl). Rozdíl v průměrných změnách mezi olanzapinem a placebem byl větší u pacientů s prokázanou dysregulací glukózy na začátku (pacienti s diagnózou diabetes mellitus nebo souvisejícími nežádoucími účinky, pacienti léčení antidiabetiky, pacienti s výchozí náhodnou hladinou glukózy ≥200 mg/ dl a/nebo výchozí hladina glukózy nalačno ≥126 mg/dl). Pacienti léčení olanzapinem měli větší průměrné zvýšení HbA1c oproti výchozí hodnotě o 0,04 % (medián expozice 21 dní) ve srovnání s průměrným snížením HbA1c o 0,06 % u subjektů léčených placebem (medián expozice 17 dní).
analýze 8 placebem kontrolovaných studií (medián léčebné expozice 4-5 týdnů) mělo 6,1 % subjektů léčených olanzapinem (N=855) glykosurii související s léčbou ve srovnání s 2,8 % subjektů léčených placebem (N=599). . Tabulka 2 ukazuje krátkodobé a dlouhodobé změny hladin glukózy nalačno ze studií monoterapie olanzapinem u dospělých.
Průměrná změna glykémie nalačno u pacientů exponovaných alespoň 48 týdnů byla 4,2 mg/dl (N=487). V analýzách pacientů, kteří dokončili 9-12měsíční léčbu olanzapinem, se průměrná změna hladin glukózy nalačno a nalačno v průběhu času dále zvyšovala.
Monoterapie olanzapinem u dospívajících
Bezpečnost a účinnost olanzapinu nebyla stanovena u pacientů mladších 13 let. V analýze 3 placebem kontrolovaných studií monoterapie olanzapinem u dospívajících pacientů, včetně pacientů se schizofrenií (6 týdnů) nebo bipolární poruchou I (manické nebo smíšené epizody) (3 týdny), byl olanzapin spojen s větší průměrnou změnou oproti výchozí hodnotě nalačno hladiny glukózy ve srovnání s placebem (2,68 mg/dl versus -2,59 mg/dl). Průměrná změna glykémie nalačno u dospívajících vystavených alespoň 24 týdnů byla 3,1 mg/dl (N=121). Tabulka 3 ukazuje krátkodobé a dlouhodobé změny glykémie nalačno ze studií monoterapie olanzapinem u dospívajících.
Dyslipidémie
Při užívání olanzapinu byly pozorovány nežádoucí změny lipidů. U pacientů užívajících olanzapin se doporučuje klinické sledování, včetně výchozího a pravidelného sledování lipidů (viz INFORMACE PRO PACIENTA ].
Při užívání olanzapinu bylo pozorováno klinicky významné a někdy velmi vysoké (>500 mg/dl) zvýšení hladin triglyceridů. Při užívání olanzapinu bylo také pozorováno mírné průměrné zvýšení celkového cholesterolu.
Monoterapie olanzapinem u dospělých
analýze 5 placebem kontrolovaných studií monoterapie olanzapinem s dobou léčby až 12 týdnů došlo u pacientů léčených olanzapinem ke zvýšení průměrného celkového cholesterolu, LDL cholesterolu a triglyceridů nalačno oproti výchozí hodnotě o 5,3 mg/dl, 3,0 mg/dl a 20,8 mg/dl v tomto pořadí ve srovnání se snížením průměrné hodnoty celkového cholesterolu nalačno, LDL cholesterolu a triglyceridů o 6,1 mg/dl, 4,3 mg/dl a 10,7 mg/dl u pacientů léčených placebem od výchozí hodnoty. U HDL cholesterolu nalačno nebyly pozorovány žádné klinicky významné rozdíly mezi pacienty léčenými olanzapinem a pacienty léčenými placebem. Průměrné zvýšení hodnot lipidů nalačno (celkový cholesterol, LDL cholesterol a triglyceridy) bylo vyšší u pacientů bez známek dysregulace lipidů na začátku studie, kde dysregulace lipidů byla definována jako pacienti s diagnózou dyslipidémie nebo související nežádoucí reakce, pacienti léčení přípravky snižujícími lipidy, nebo pacientů s vysokými výchozími hladinami lipidů.
dlouhodobých studiích (nejméně 48 týdnů) se u pacientů zvýšil průměrný celkový cholesterol nalačno, LDL cholesterol a triglyceridy o 5,6 mg/dl, 2,5 mg/dl a 18,7 mg/dl, v daném pořadí, a průměrný snížení HDL cholesterolu nalačno o 0,16 mg/dl. V analýze pacientů, kteří dokončili 12měsíční léčbu, se průměrný celkový cholesterol bez lačnění dále nezvyšoval přibližně po 4-6 měsících.
Podíl pacientů, u kterých došlo (alespoň jednou) ke změnám celkového cholesterolu, LDL cholesterolu nebo triglyceridů z normálního nebo hraničního na vysoké, nebo ke změnám v HDL cholesterolu z normálního nebo hraničního na nízký, byl vyšší v dlouhodobých studiích (nejméně 48 týdnů) ve srovnání s krátkodobými studiemi. Tabulka 4 ukazuje kategorické změny hodnot lipidů nalačno.
Ve fázi 1 klinických antipsychotických studií účinnosti intervence (CATIE) bylo po střední expozici 9,2 měsíce průměrné zvýšení triglyceridů u pacientů užívajících olanzapin 40,5 mg/dl. Ve fázi 1 CATIE bylo průměrné zvýšení celkového cholesterolu 9,4 mg/dl.
Monoterapie olanzapinem u dospívajících
Bezpečnost a účinnost olanzapinu nebyla stanovena u pacientů mladších 13 let. V analýze 3 placebem kontrolovaných studií monoterapie olanzapinem u dospívajících, včetně pacientů se schizofrenií (6 týdnů) nebo bipolární poruchou I (manické nebo smíšené epizody) (3 týdny), došlo u dospívajících léčených olanzapinem ke zvýšení průměrného celkového cholesterolu nalačno, LDL cholesterolu a triglyceridů o 12,9 mg/dl, 6,5 mg/dl a 28,4 mg/dl, v tomto pořadí, ve srovnání se zvýšením průměrného celkového cholesterolu nalačno a LDL cholesterolu o 1,3 mg/dl a 1,0 mg/dl od výchozí hodnoty a snížením v triglyceridech 1,1 mg/dl u dospívajících léčených placebem. U HDL cholesterolu nalačno nebyly pozorovány žádné klinicky významné rozdíly mezi dospívajícími léčenými olanzapinem a mladistvými léčenými placebem.
dlouhodobých studiích (nejméně 24 týdnů) se u dospívajících oproti výchozí hodnotě zvýšil průměrný celkový cholesterol nalačno, LDL cholesterol a triglyceridy o 5,5 mg/dl, 5,4 mg/dl a 20,5 mg/dl, v tomto pořadí, a průměr snížení HDL cholesterolu nalačno o 4,5 mg/dl. Tabulka 5 ukazuje kategorické změny hodnot lipidů nalačno u adolescentů.
Přibývání na váze
Před zahájením léčby olanzapinem je třeba zvážit možné důsledky zvýšení tělesné hmotnosti. Pacienti užívající olanzapin by měli pravidelně sledovat tělesnou hmotnost [viz Informace pro pacienty ].
Monoterapie olanzapinem u dospělých
analýze 13 placebem kontrolovaných studií monoterapie olanzapinem přibrali pacienti léčení olanzapinem v průměru o 2,6 kg (5,7 lb) ve srovnání s průměrným úbytkem hmotnosti 0,3 kg (0,6 lb) u pacientů léčených placebem s mediánem expozice 6 týdnů ; 22,2 % pacientů léčených olanzapinem přibralo nejméně o 7 % své výchozí hmotnosti ve srovnání s 3 % pacientů léčených placebem, s mediánem expozice k události 8 týdnů; 4,2 % pacientů léčených olanzapinem přibralo alespoň 15 % své výchozí hmotnosti ve srovnání s 0,3 % pacientů léčených placebem, s mediánem expozice k události 12 týdnů. Klinicky významný nárůst hmotnosti byl pozorován ve všech kategoriích základního indexu tělesné hmotnosti (BMI). K přerušení léčby z důvodu zvýšení tělesné hmotnosti došlo u 0,2 % pacientů léčených olanzapinem au 0 % pacientů léčených placebem.
dlouhodobých studiích (alespoň 48 týdnů) byl průměrný přírůstek hmotnosti 5,6 kg (12,3 lb) (medián expozice 573 dní, N=2021). Procento pacientů, kteří při dlouhodobé expozici přibrali alespoň 7 %, 15 % nebo 25 % své výchozí tělesné hmotnosti, bylo 64 %, 32 % a 12 %. K přerušení léčby z důvodu zvýšení tělesné hmotnosti došlo u 0,4 % pacientů léčených olanzapinem po nejméně 48 týdnech expozice.
Tabulka 6 obsahuje údaje o přírůstku hmotnosti u dospělých s olanzapinem shromážděné z 86 klinických studií. Údaje v každém sloupci představují údaje pro ty pacienty, kteří dokončili léčebné období specifikované délky.
Byly pozorovány rozdíly mezi dávkovými skupinami s ohledem na přírůstek hmotnosti. V jediné 8týdenní randomizované, dvojitě zaslepené studii s fixní dávkou porovnávající 10 (N=199), 20 (N=200) a 40 (N=200) mg/den perorálního olanzapinu u dospělých pacientů se schizofrenií nebo schizoafektivní poruchou, bylo pozorováno průměrné zvýšení hmotnosti od výchozího do koncového bodu (10 mg/den: 1,9 kg; 20 mg/den: 2,3 kg; 40 mg/den: 3 kg) s významnými rozdíly mezi 10 vs 40 mg/den.
Monoterapie olanzapinem u dospívajících
Bezpečnost a účinnost olanzapinu nebyla stanovena u pacientů mladších 13 let. Průměrné zvýšení hmotnosti u dospívajících bylo větší než u dospělých. Ve 4 placebem kontrolovaných studiích došlo k přerušení léčby z důvodu zvýšení tělesné hmotnosti u 1 % pacientů léčených olanzapinem ve srovnání s 0 % pacientů léčených placebem.
dlouhodobých studiích (alespoň 24 týdnů) byl průměrný přírůstek hmotnosti 11,2 kg (24,6 lb); (medián expozice 201 dní, N=179). Procento dospívajících, kteří při dlouhodobé expozici přibrali alespoň 7 %, 15 % nebo 25 % své výchozí tělesné hmotnosti, bylo 89 %, 55 % a 29 %. Mezi dospívajícími pacienty byl průměrný přírůstek hmotnosti podle výchozí kategorie BMI 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) a 12,7 kg (27,9 lb), v daném pořadí, pro normální (N=106), nadváhu (N=26). a obézní (N=17). K přerušení léčby z důvodu zvýšení tělesné hmotnosti došlo u 2,2 % pacientů léčených olanzapinem po nejméně 24 týdnech expozice.
Tabulka 8 uvádí údaje o přírůstku hmotnosti u dospívajících při užívání olanzapinu shromážděné ze 6 klinických studií. Údaje v každém sloupci představují údaje pro ty pacienty, kteří dokončili léčebné období specifikované délky. K dispozici je jen málo údajů z klinických studií o zvýšení tělesné hmotnosti u dospívajících při léčbě olanzapinem po 6 měsících léčby.
Tardivní dyskineze
pacientů léčených antipsychotiky se může vyvinout syndrom potenciálně ireverzibilních, mimovolních, dyskinetických pohybů. Ačkoli se zdá, že prevalence syndromu je nejvyšší u starších osob, zejména u starších žen, není možné spoléhat na odhady prevalence, které by na začátku antipsychotické léčby předpověděly, u kterých pacientů se syndrom pravděpodobně rozvine. Není známo, zda se antipsychotické léčivé přípravky liší svým potenciálem způsobit tardivní dyskinezi.
Předpokládá se, že riziko rozvoje tardivní dyskineze a pravděpodobnost, že se stane ireverzibilní, se zvyšuje s délkou léčby a celkovou kumulativní dávkou antipsychotik podávaných pacientovi. Syndrom se však může vyvinout, i když mnohem méně často, po relativně krátkých obdobích léčby nízkými dávkami nebo může dokonce vzniknout po přerušení léčby.
Tardivní dyskineze může částečně nebo úplně odeznít, pokud je antipsychotická léčba vysazena. Antipsychotická léčba sama o sobě však může potlačit (nebo částečně potlačit) známky a příznaky syndromu, a tím případně maskovat základní proces. Účinek, který má symptomatická suprese na dlouhodobý průběh syndromu, není znám.
Vzhledem k těmto úvahám by měl být olanzapin předepisován způsobem, který s největší pravděpodobností minimalizuje výskyt tardivní dyskineze. Chronická antipsychotická léčba by měla být obecně vyhrazena pro pacienty (1) kteří trpí chronickým onemocněním, o kterém je známo, že reagují na antipsychotika, a (2) pro které alternativní, stejně účinné, ale potenciálně méně škodlivé způsoby léčby nejsou dostupné nebo vhodné. U pacientů, kteří vyžadují chronickou léčbu, je třeba hledat nejnižší dávku a nejkratší dobu trvání léčby, která vede k uspokojivé klinické odpovědi. Potřeba pokračování v léčbě by měla být pravidelně přehodnocována.
Pokud se u pacienta užívajícího olanzapin objeví známky a příznaky tardivní dyskineze, je třeba zvážit vysazení léku. Někteří pacienti však mohou vyžadovat léčbu olanzapinem i přes přítomnost syndromu.
Konkrétní informace o varováních týkajících se lithia nebo valproátu naleznete v části Varování v příbalových informacích pro tyto další produkty.
Ortostatická hypotenze
Olanzapin může vyvolat ortostatickou hypotenzi spojenou se závratí, tachykardií, bradykardií a u některých pacientů synkopou, zejména během počáteční titrace dávky, což pravděpodobně odráží jeho α1-adrenergní antagonistické vlastnosti (viz Informace pro pacienty ].
Z analýzy dat vitálních funkcí v integrované databázi 41 dokončených klinických studií u dospělých pacientů léčených perorálním olanzapinem byla ortostatická hypotenze zaznamenána u ≥ 20 % (1277/6030) pacientů.
Při perorální léčbě olanzapinem lze riziko ortostatické hypotenze a synkopy minimalizovat zahájením léčby 5 mg jednou denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Pokud dojde k hypotenzi, je třeba zvážit pozvolnější titraci na cílovou dávku.
Během klinických studií s intramuskulárním injekčním olanzapinem byly hlášeny také hypotenze, bradykardie s hypotenzí nebo bez ní, tachykardie a synkopa. V otevřené klinické farmakologické studii u agitovaných pacientů se schizofrenií, ve které byla bezpečnost a snášenlivost intramuskulárního olanzapinu hodnocena při maximálním dávkovacím režimu (tři dávky 10 mg podané s odstupem 4 hodin), přibližně u jedné třetiny těchto pacientů došlo k významnému ortostatický pokles systolického krevního tlaku (tj. pokles ≥30 mmHg) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Synkopa byla hlášena u 0,6 % (15/2 500) pacientů léčených olanzapinem ve studiích fáze 2-3 s perorálním olanzapinem au 0,3 % (2/722) pacientů léčených olanzapinem s neklidem ve studiích s intramuskulárním injekčním olanzapinem. U tří normálních dobrovolníků ve studiích fáze 1 s intramuskulárním olanzapinem se vyskytla hypotenze, bradykardie a sinusové pauzy v délce až 6 sekund, které spontánně odezněly (ve 2 případech se reakce objevily po intramuskulárním olanzapinu a v 1 případě po perorálním olanzapinu). Riziko této sekvence hypotenze, bradykardie a sinusové pauzy může být větší u nepsychiatrických pacientů ve srovnání s psychiatrickými pacienty, kteří jsou možná lépe adaptováni na určité účinky psychofarmak. Při intramuskulární injekční léčbě olanzapinem by pacienti měli zůstat vleže, pokud jsou po injekci ospalí nebo mají závratě, dokud vyšetření neukáže, že u nich nedochází k posturální hypotenzi, bradykardii a/nebo hypoventilaci.
Olanzapin by měl být používán se zvláštní opatrností u pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemie v anamnéze, srdeční selhání nebo poruchy převodu), cerebrovaskulárním onemocněním a stavy, které by mohly pacienty predisponovat k hypotenzi (dehydratace, hypovolémie a léčba antihypertenzivy ), kde by výskyt synkopy nebo hypotenze a/nebo bradykardie mohl pacienta vystavit zvýšenému zdravotnímu riziku.
Opatrnost je nutná u pacientů, kteří dostávají léčbu jinými léky s účinky, které mohou vyvolat hypotenzi, bradykardii, respirační nebo centrální nervový systém (viz DROGOVÉ INTERAKCE ]. Současné podávání intramuskulárního olanzapinu a parenterálního benzodiazepinu se nedoporučuje kvůli možnosti nadměrné sedace a kardiorespirační deprese.
Falls
ZYPREXA může způsobit somnolenci, posturální hypotenzi, motorickou a senzorickou nestabilitu, což může vést k pádům a následně ke zlomeninám nebo jiným zraněním. U pacientů s nemocemi, stavy nebo léky, které by mohly tyto účinky zhoršit, dokončete posouzení rizika pádu při zahájení antipsychotické léčby a opakovaně u pacientů na dlouhodobé antipsychotické léčbě.
Leukopenie, neutropenie a agranulocytóza
Třídní efekt
V klinických studiích a/nebo po uvedení přípravku na trh byly hlášeny případy leukopenie/neutropenie dočasně související s antipsychotiky, včetně přípravku ZYPREXA. Byla také hlášena agranulocytóza.
Mezi možné rizikové faktory leukopenie/neutropenie patří již existující nízký počet bílých krvinek (WBC) a leukopenie/neutropenie v anamnéze. U pacientů s anamnézou klinicky významného nízkého počtu bílých krvinek nebo leukopenie/neutropenie vyvolané léky by měl být během prvních několika měsíců léčby často monitorován kompletní krevní obraz (CBC) a při prvních známkách klinicky významného poklesu by mělo být zváženo přerušení léčby přípravkem ZYPREXA. u WBC při absenci jiných příčinných faktorů.
Pacienti s klinicky významnou neutropenií by měli být pečlivě sledováni kvůli horečce nebo jiným symptomům nebo známkám infekce a pokud se takové příznaky nebo příznaky objeví, okamžitě je léčit. Pacienti se závažnou neutropenií (absolutní počet neutrofilů
Dysfagie
Dysmotilita a aspirace jícnu jsou spojovány s užíváním antipsychotik. Aspirační pneumonie je častou příčinou morbidity a mortality u pacientů s pokročilou Alzheimerovou chorobou. Olanzapin není schválen pro léčbu pacientů s Alzheimerovou chorobou.
Záchvaty
Během premarketingového testování se záchvaty objevily u 0,9 % (22/2500) pacientů léčených olanzapinem. Existovaly matoucí faktory, které mohly přispět k výskytu záchvatů v mnoha z těchto případů. Olanzapin by měl být používán s opatrností u pacientů se záchvaty v anamnéze nebo se stavy, které potenciálně snižují práh záchvatů, např. Alzheimerova demence. Olanzapin není schválen pro léčbu pacientů s Alzheimerovou chorobou. Stavy, které snižují práh záchvatů, mohou být častější v populaci ve věku 65 let nebo starší.
Potenciál pro kognitivní a motorické poruchy
Často hlášeným nežádoucím účinkem spojeným s léčbou olanzapinem byla somnolence, která se vyskytovala s incidencí 26 % u pacientů užívajících olanzapin ve srovnání s 15 % u pacientů užívajících placebo. Tato nežádoucí reakce také souvisela s dávkou. Somnolence vedla k přerušení léčby u 0,4 % (9/2 500) pacientů v premarketingové databázi.
Vzhledem k tomu, že olanzapin může narušit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že je léčba olanzapinem neovlivňuje nepříznivě [viz Informace pro pacienty ].
Regulace tělesné teploty
Narušení schopnosti těla snižovat tělesnou teplotu se připisuje antipsychotikům. Při předepisování olanzapinu pacientům, kteří budou mít stavy, které mohou přispívat ke zvýšení tělesné teploty, např. namáhavé cvičení, vystavení extrémnímu teplu, souběžnou léčbu s anticholinergní aktivitou nebo dehydrataci [viz. INFORMACE PRO PACIENTA ].
Použití u pacientů se souběžným onemocněním
Klinické zkušenosti s olanzapinem u pacientů s určitými souběžnými systémovými onemocněními jsou omezené (viz KLINICKÁ FARMAKOLOGIE ].
Olanzapin vykazuje in vitro afinitu k muskarinovým receptorům. V premarketingových klinických studiích s olanzapinem byl olanzapin spojován se zácpou, suchem v ústech a tachykardií, přičemž všechny nežádoucí účinky mohly souviset s cholinergním antagonismem. Takové nežádoucí účinky nebyly často důvodem pro přerušení léčby olanzapinem, ale olanzapin by měl být používán s opatrností u pacientů s klinicky významnou hypertrofií prostaty, glaukomem s úzkým úhlem nebo s paralytickým ileem nebo podobnými stavy v anamnéze.
5 placebem kontrolovaných studiích olanzapinu u starších pacientů s psychózou související s demencí (n=1184) byly u pacientů léčených olanzapinem hlášeny následující nežádoucí účinky související s léčbou s incidencí nejméně 2 % a významně vyšší než u pacientů užívajících placebo léčení pacienti: pády, somnolence, periferní edém, abnormální chůze, inkontinence moči, letargie, zvýšená hmotnost, astenie, horečka, zápal plic, sucho v ústech a zrakové halucinace. Četnost přerušení léčby z důvodu nežádoucích účinků byla vyšší u olanzapinu než u placeba (13 % vs. 7 %). Starší pacienti s psychózou související s demencí léčení olanzapinem mají ve srovnání s placebem zvýšené riziko úmrtí. Olanzapin není schválen k léčbě pacientů s psychózou související s demencí [viz VAROVÁNÍ V KRABICE , Starší pacienti s psychózou související s demencí , a INFORMACE PRO PACIENTA ].
Olanzapin nebyl hodnocen ani používán v žádném znatelném rozsahu u pacientů s nedávnou anamnézou infarktu myokardu nebo nestabilního srdečního onemocnění. Pacienti s těmito diagnózami byli vyloučeni z premarketingových klinických studií. Vzhledem k riziku ortostatické hypotenze u olanzapinu je třeba opatrnosti u kardiaků (viz Ortostatická hypotenze ].
Hyperprolaktinémie
Stejně jako jiné léky, které antagonizují dopaminové D2 receptory, olanzapin zvyšuje hladiny prolaktinu a toto zvýšení přetrvává i během chronického podávání. Hyperprolaktinémie může potlačit hypotalamický GnRH, což má za následek sníženou sekreci hypofyzárního gonadotropinu. To zase může inhibovat reprodukční funkci zhoršením gonadální steroidogeneze u žen i mužů. U pacientů užívajících látky zvyšující prolaktin byly hlášeny galaktorea, amenorea, gynekomastie a impotence. Dlouhodobá hyperprolaktinémie spojená s hypogonadismem může vést ke snížení hustoty kostí u žen i mužů.
Experimenty na tkáňových kulturách ukazují, že přibližně jedna třetina lidských karcinomů prsu je in vitro závislá na prolaktinu, což je faktor potenciální důležitosti, pokud se uvažuje o předepisování těchto léků u pacientky s dříve zjištěnou rakovinou prsu. Jak je běžné u sloučenin, které zvyšují uvolňování prolaktinu, bylo ve studiích kancerogenity olanzapinu prováděných na myších a potkanech pozorováno zvýšení neoplazie mléčné žlázy (viz Neklinická toxikologie ]. Dosud provedené klinické studie ani epidemiologické studie neprokázaly souvislost mezi chronickým podáváním této třídy léků a tumorigenezí u lidí; dostupné důkazy jsou v tuto chvíli považovány za příliš omezené na to, aby byly průkazné.
placebem kontrolovaných klinických studiích olanzapinu (trvajících až 12 týdnů) byly změny z normální na vysoké koncentrace prolaktinu pozorovány u 30 % dospělých léčených olanzapinem ve srovnání s 10,5 % dospělých léčených placebem. V souhrnné analýze z klinických studií zahrnujících 8136 dospělých léčených olanzapinem potenciálně související klinické projevy zahrnovaly příhody související s menstruací1 (2 % [49/3240] žen), příhody související se sexuální funkcí2 (2 % [150/8136] žen a muži) a příhody související s prsy3 (0,7 % [23/3240] žen, 0,2 % [9/4896] mužů).
placebem kontrolovaných studiích monoterapie olanzapinem u dospívajících pacientů (až 6 týdnů) se schizofrenií nebo bipolární poruchou I (manické nebo smíšené epizody) byly změny koncentrací prolaktinu z normální na vysoké pozorovány u 47 % pacientů léčených olanzapinem ve srovnání se 7 % pacientů léčených placebem. V souhrnné analýze z klinických studií zahrnujících 454 dospívajících léčených olanzapinem potenciálně související klinické projevy zahrnovaly příhody související s menstruací1 (1 % [2/168] žen), příhody související se sexuální funkcí2 (0,7 % [3/454] žen a mužů a příhody související s prsy3 (2 % [3/168] žen, 2 % [7/286] mužů) [viz Použití u konkrétních populací ].
1 Na základě vyhledávání následujících termínů: amenorea, hypomenorea, opožděná menstruace a oligomenorea.
2 Na základě vyhledávání následujících pojmů: anorgasmie, opožděná ejakulace, erektilní dysfunkce, snížené libido, ztráta libida, abnormální orgasmus a sexuální dysfunkce.
Na základě vyhledávání následujících pojmů: výtok z prsou, zvětšení nebo otok, galaktorea, gynekomastie a porucha laktace.
Byly pozorovány rozdíly mezi dávkovými skupinami s ohledem na zvýšení prolaktinu. V jediné 8týdenní randomizované, dvojitě zaslepené studii s fixní dávkou porovnávající 10 (N=199), 20 (N=200) a 40 (N=200) mg/den perorálního olanzapinu u dospělých pacientů se schizofrenií nebo schizoafektivní porucha, výskyt zvýšení prolaktinu > 24,2 ng/ml (ženy) nebo > 18,77 ng/ml (muži) kdykoli během studie (10 mg/den: 31,2 %; 20 mg/den: 42,7 %; 40 mg/den : 61,1 %) indikovalo významné rozdíly mezi 10 vs 40 mg/den a 20 vs 40 mg/den.
Používejte v kombinaci s fluoxetinem, lithiem nebo valproátem
Při použití přípravku ZYPREXA a fluoxetinu v kombinaci by se měl předepisující lékař také podívat na část Upozornění a opatření v příbalové informaci k přípravku Symbyax. Při použití přípravku ZYPREXA v kombinaci s lithiem nebo valproátem by se měl předepisující lékař seznámit s oddíly Upozornění a opatření v příbalových informacích pro lithium nebo valproát [viz DROGOVÉ INTERAKCE ].
Laboratorní testy
Na začátku léčby a pravidelně v jejím průběhu se doporučuje testování glykémie nalačno a lipidového profilu [viz Metabolické změny a INFORMACE PRO PACIENTA ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ) pro perorální přípravky.
Pacienti by měli být upozorněni na následující problémy a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde při užívání přípravku ZYPREXA 15 mg v monoterapii nebo v kombinaci s fluoxetinem. Pokud si myslíte, že se vám nelepší nebo máte nějaké obavy ohledně svého stavu během užívání přípravku ZYPREXA 2,5 mg, zavolejte svého lékaře. Pokud používáte přípravek ZYPREXA a fluoxetin v kombinaci, přečtěte si také část Informace pro pacienty v příbalovém letáku k přípravku Symbyax.
Starší pacienti s psychózou související s demencí: zvýšená mortalita a cerebrovaskulární nežádoucí příhody (CVAE), včetně mrtvice
Pacienti a ošetřovatelé by měli být upozorněni, že starší pacienti s psychózou související s demencí léčení antipsychotiky mají zvýšené riziko úmrtí. Pacienti a ošetřovatelé by měli být upozorněni, že starší pacienti s psychózou související s demencí léčení přípravkem ZYPREXA měli významně vyšší výskyt cerebrovaskulárních nežádoucích příhod (např. mrtvice, tranzitorní ischemické ataky) ve srovnání s placebem.
ZYPREXA není schválena pro starší pacienty s psychózou související s demencí (viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Neuroleptický maligní syndrom (NMS)
Pacienti a ošetřovatelé by měli být poučeni, že v souvislosti s podáváním antipsychotik, včetně přípravku ZYPREXA, byl hlášen potenciálně fatální komplex symptomů, někdy označovaný jako NMS. Známky a příznaky NMS zahrnují hyperpyrexii, svalovou rigiditu, změněný duševní stav a známky autonomní nestability (nepravidelný puls nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léková reakce s eozinofilií a systémovými příznaky (DRESS)
Pacienti by měli být poučeni, aby co nejdříve hlásili svému poskytovateli zdravotní péče jakékoli známky a příznaky, které mohou být spojeny s lékovou reakcí s eozinofilií a systémovými příznaky (DRESS) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hyperglykémie A Diabetes Mellitus
Pacienti by měli být informováni o potenciálním riziku nežádoucích účinků souvisejících s hyperglykémií. Pacienti by měli být pravidelně sledováni, zda nedošlo ke zhoršení kontroly glukózy. Pacienti, kteří mají cukrovku, by se měli řídit pokyny svého lékaře o tom, jak často si kontrolovat hladinu cukru v krvi při užívání přípravku ZYPREXA [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Dyslipidémie
Pacienty je třeba upozornit, že během léčby přípravkem ZYPREXA došlo k dyslipidémii. U pacientů by měl být pravidelně sledován lipidový profil [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přibývání na váze
Pacienty je třeba upozornit, že během léčby přípravkem ZYPREXA došlo k nárůstu tělesné hmotnosti. U pacientů by měla být pravidelně sledována jejich hmotnost [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ortostatická hypotenze
Pacienti by měli být upozorněni na riziko ortostatické hypotenze, zejména během období úvodní titrace dávky a ve spojení s užíváním souběžně podávaných léků, které mohou potencovat ortostatický účinek přípravku ZYPREXA, např. diazepam nebo alkohol [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ]. Pacientům je třeba doporučit, aby opatrně měnili polohu, aby se předešlo ortostatické hypotenzi, a aby si lehli, pokud pocítí závratě nebo mdloby, dokud se nebudou cítit lépe. Pacientům je třeba doporučit, aby zavolali svého lékaře, pokud se u nich objeví některý z následujících příznaků a příznaků spojených s ortostatickou hypotenzí: závratě, rychlý nebo pomalý srdeční tep nebo mdloby.
Potenciál pro kognitivní a motorické poruchy
Vzhledem k tomu, že přípravek ZYPREXA má potenciál narušit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že je léčba přípravkem ZYPREXA neovlivňuje nepříznivě (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Regulace tělesné teploty
Pacienti by měli být poučeni o náležité péči, aby se vyhnuli přehřátí a dehydrataci. Pacientům by mělo být doporučeno, aby okamžitě zavolali svého lékaře, pokud těžce onemocní a mají některé nebo všechny tyto příznaky dehydratace: přílišné pocení nebo vůbec žádné, sucho v ústech, pocit velkého horka, pocit žízně, neschopnost tvořit moč [ vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Souběžná medikace
Pacienti by měli být poučeni, aby informovali své poskytovatele zdravotní péče, pokud užívají nebo plánují užívat přípravek Symbyax. Pacientům by také mělo být doporučeno, aby informovali své poskytovatele zdravotní péče, pokud užívají, plánují užívat nebo přestali užívat jakékoli léky na předpis nebo volně prodejné léky, včetně bylinných doplňků, protože existuje možnost interakcí [viz DROGOVÉ INTERAKCE ].
Alkohol
Pacienti by měli být poučeni, aby se během užívání přípravku ZYPREXA vyhýbali alkoholu [viz DROGOVÉ INTERAKCE ].
Fenylketonurika
ZYPREXA 10 mg ZYDIS (olanzapin perorálně se rozpadající tablety) obsahuje fenylalanin (0,34, 0,45, 0,67 nebo 0,90 mg na 5, 10, 15 nebo 20 mg tabletu, v tomto pořadí) (viz POPIS ].
Použití u konkrétních populací
Těhotenství
Informujte ženy, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem ZYPREXA otěhotní nebo plánují otěhotnět. Informujte pacienty, že přípravek ZYPREXA může u novorozence způsobit extrapyramidové a/nebo abstinenční příznaky (neklid, hypertonie, hypotonie, třes, ospalost, dýchací potíže a poruchy příjmu potravy). Informujte pacienty, že existuje registr expozice v těhotenství, který monitoruje výsledky těhotenství u žen vystavených přípravku ZYPREXA 7,5 mg během těhotenství [viz Použití u konkrétních populací ].
Laktace
Doporučte kojícím ženám, které užívají přípravek ZYPREXA 20 mg, aby sledovaly kojence kvůli nadměrné sedaci, podrážděnosti, špatnému krmení a extrapyramidovým symptomům (třes a abnormální pohyby svalů) a aby vyhledaly lékařskou péči, pokud si všimnou těchto příznaků. [vidět Použití u konkrétních populací ].
Neplodnost
Informujte ženy s reprodukčním potenciálem, že přípravek ZYPREXA může zhoršit plodnost v důsledku zvýšení hladiny prolaktinu v séru. Účinky na plodnost jsou reverzibilní [viz Použití u konkrétních populací ].
Pediatrické použití
ZYPREXA 15 mg je indikována k léčbě schizofrenie a manických nebo smíšených epizod spojených s bipolární poruchou I u dospívajících ve věku 13 až 17 let. Ve srovnání s pacienty z klinických studií u dospělých adolescenti pravděpodobně více přibrali na váze, pociťovali zvýšenou sedaci a měli větší zvýšení hladiny celkového cholesterolu, triglyceridů, LDL cholesterolu, prolaktinu a jaterních aminotransferáz. Pacienti by měli být poučeni o potenciálních dlouhodobých rizicích spojených s přípravkem ZYPREXA a poučeni, že tato rizika je mohou vést k tomu, aby nejprve zvážili jiné léky [viz INDIKACE A POUŽITÍ ]. Bezpečnost a účinnost přípravku ZYPREXA 5 mg u pacientů mladších 13 let nebyla stanovena. Bezpečnost a účinnost přípravku ZYPREXA 15 mg a fluoxetinu v kombinaci u pacientů ve věku 10 až 17 let byla stanovena pro akutní léčbu depresivních epizod spojených s bipolární poruchou I. Bezpečnost a účinnost přípravku ZYPREXA a fluoxetinu v kombinaci u pacientů VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Potřeba komplexního léčebného programu u dětských pacientů
ZYPREXA 20 mg je indikována jako nedílná součást celkového léčebného programu pro dětské pacienty se schizofrenií a bipolární poruchou, který může zahrnovat další opatření (psychologická, výchovná, sociální) pro pacienty s touto poruchou. Účinnost a bezpečnost přípravku ZYPREXA 7,5 mg nebyla stanovena u pediatrických pacientů mladších 13 let. Atypická antipsychotika nejsou určena pro použití u pediatrických pacientů, kteří vykazují symptomy sekundární k faktorům prostředí a/nebo jiným primárním psychiatrickým poruchám. Vhodné umístění ve vzdělávání je zásadní a psychosociální intervence je často užitečná. Rozhodnutí předepsat atypickou antipsychotiku bude záviset na posouzení chronicity a závažnosti pacientových symptomů poskytovatelem zdravotní péče [viz INDIKACE A POUŽITÍ ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Studie orální karcinogenity byly provedeny na myších a potkanech. Olanzapin byl podáván myším ve dvou 78týdenních studiích v dávkách 3, 10, 30/20 mg/kg/den (což odpovídá 0,8-5násobku denní perorální MRHD na základě mg/m² tělesného povrchu) a 0,25,2 , 8 mg/kg/den (ekvivalent 0,06-2násobku denního perorálního MRHD na základě mg/m² tělesného povrchu). Potkani dostávali po dobu 2 let dávky 0,25, 1, 2,5, 4 mg/kg/den (samci) a 0,25, 1, 4, 8 mg/kg/den (samice) (ekvivalent 0,13-2 a 0,13-4 krát denní perorální MRHD na základě mg/m² tělesného povrchu, v daném pořadí). Incidence jaterních hemangiomů a hemangiosarkomů byla významně zvýšena v 1 studii na myších u samic myší při 2násobku denní perorální MRHD na základě mg/m² plochy povrchu těla. Tyto nádory nebyly zvýšeny v jiné studii na myších u samic, které dostávaly až 2-5násobek denní perorální MRHD na základě mg/m² tělesného povrchu; v této studii byla vysoká incidence časných úmrtí u mužů ve skupině 30/20 mg/kg/den. Incidence adenomů mléčné žlázy a adenokarcinomů byla významně zvýšena u samic myší, kterým byla podávána dávka ≥2 mg/kg/den, a u samic potkanů, kterým byla podávána dávka ≥4 mg/kg/den (0,5 a 2násobek denní perorální MRHD na základě mg/m² plocha povrchu těla). Bylo prokázáno, že antipsychotika chronicky zvyšují hladiny prolaktinu u hlodavců. Během studií kancerogenity olanzapinu nebyly měřeny hladiny prolaktinu v séru; měření během studií subchronické toxicity však ukázala, že olanzapin zvýšil sérové hladiny prolaktinu až 4krát u potkanů ve stejných dávkách, jaké byly použity ve studii kancerogenity. Zvýšení novotvarů mléčné žlázy bylo zjištěno u hlodavců po chronickém podávání jiných antipsychotik a je považováno za zprostředkované prolaktinem. Význam pro lidské riziko nálezu endokrinních nádorů zprostředkovaných prolaktinem u hlodavců není znám (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Mutageneze
Nebyl nalezen žádný důkaz genotoxického potenciálu olanzapinu v Amesově testu reverzních mutací, in vivo mikronukleovém testu u myší, testu chromozomálních aberací v buňkách vaječníků čínského křečka, testu neplánované syntézy DNA v potkaních hepatocytech, testu indukce přímé mutace u myších lymfomových buněk nebo in vivo test výměny sesterských chromatid v kostní dřeni čínských křečků.
Zhoršení Plodnosti
Ve studii orální fertility a reprodukční výkonnosti u potkanů došlo při dávce 22,4 mg/kg/den ke zhoršení páření samců, ale ne k fertilitě a při dávce 3 mg/kg/den ke snížení samičí fertility (11 a 1,5 krát denní perorální MRHD na základě mg/m² tělesného povrchu, v daném pořadí). Přerušení léčby olanzapinem zvrátilo účinky na páření samců. U samic potkanů se prekoitální období prodloužilo a index páření se snížil na 5 mg/kg/den (2,5násobek denní perorální MRHD na základě mg/m² plochy povrchu těla). Diestrální stav byl prodloužen a estrální opožděn při dávce 1,1 mg/kg/den (0,6násobek denního perorálního MRHD na základě mg/m² plochy povrchu těla); proto může olanzapin způsobit zpoždění ovulace.
Použití u konkrétních populací
Pokud používáte přípravek ZYPREXA a fluoxetin v kombinaci, přečtěte si také část Použití ve specifických populacích příbalové informace k Symbyax.
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených atypickým antipsychotikům, včetně přípravku ZYPREXA, během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty kontaktováním Národního registru těhotenství pro atypická antipsychotika na čísle 1-866-961-2388 nebo navštivte http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Shrnutí rizik
Novorozenci vystavení antipsychotikům, včetně přípravku ZYPREXA, během třetího trimestru, jsou vystaveni riziku extrapyramidových a/nebo abstinenčních příznaků po porodu (viz Klinické úvahy ). Celkově dostupné údaje z publikovaných epidemiologických studií těhotných žen vystavených olanzapinu neprokázaly s lékem spojené riziko závažných vrozených vad, potratu nebo nežádoucích účinků na matku nebo plod (viz Data ). Existují rizika pro matku spojená s neléčenou schizofrenií nebo bipolární poruchou I a s expozicí antipsychotikům, včetně přípravku ZYPREXA 7,5 mg, během těhotenství (viz Klinické úvahy ).
Olanzapin nebyl teratogenní, když byl perorálně podáván březím potkanům a králíkům v dávkách, které jsou 9- a 30násobkem denní perorální maximální doporučené dávky pro člověka (MRHD), vztaženo na mg/m² tělesného povrchu; při těchto dávkách byly pozorovány některé fetální toxicity (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozených vad, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a embryo/fetální riziko spojené s nemocí
Pro matku existuje riziko neléčené schizofrenie nebo bipolární poruchy I, včetně zvýšeného rizika relapsu, hospitalizace a sebevraždy. Schizofrenie a bipolární porucha I jsou spojeny se zvýšenými nepříznivými perinatálními následky, včetně předčasného porodu. Není známo, zda je to přímý důsledek onemocnění nebo jiných komorbidních faktorů.
Fetální/neonatální nežádoucí reakce
Extrapyramidové a/nebo abstinenční příznaky, včetně agitovanosti, hypertonie, hypotonie, třesu, ospalosti, respirační tísně a poruchy příjmu potravy byly hlášeny u novorozenců, kteří byli vystaveni antipsychotikům, včetně přípravku ZYPREXA 2,5 mg, během třetího trimestru těhotenství. Tyto příznaky mají různou závažnost. Sledujte u novorozenců extrapyramidové a/nebo abstinenční příznaky a příslušně je řiďte. Někteří novorozenci se zotavili během hodin nebo dnů bez specifické léčby; ostatní vyžadovali delší hospitalizaci.
Data
Lidská data
publikovaných zprávách ze studií byl hlášen průchod placentou; poměr průchodu placentou byl však vysoce variabilní v rozmezí od 7 % do 167 % při porodu po expozici během těhotenství. Klinický význam tohoto zjištění není znám.
Publikované údaje z observačních studií, registrů narození a kazuistik, které hodnotily užívání atypických antipsychotik během těhotenství, neprokazují zvýšené riziko závažných vrozených vad. Retrospektivní kohortová studie z databáze Medicaid zahrnující 9258 žen vystavených antipsychotikům během těhotenství neprokázala celkové zvýšené riziko závažných vrozených vad.
Údaje o zvířatech
Ve studiích orální reprodukce u potkanů v dávkách až 18 mg/kg/den a u králíků v dávkách až 30 mg/kg/den (9násobek a 30násobek denní perorální MRHD na základě mg/m² tělesného povrchu, v tomto pořadí), nebyly pozorovány žádné známky teratogenity. V teratologické studii na potkanech byly pozorovány časné resorpce a zvýšený počet neživotaschopných plodů při dávce 18 mg/kg/den (9násobek denní perorální MRHD na základě mg/m² tělesného povrchu) a gestace byla prodloužena v 10. mg/kg/den (5násobek denní perorální MRHD na základě mg/m² plochy povrchu těla). V teratologické studii na králících po perorálním podání se fetální toxicita projevila jako zvýšená resorpce a snížená hmotnost plodu, a to při dávce toxické pro matku 30 mg/kg/den (30násobek denní perorální MRHD na základě mg/m² tělesného povrchu).
Laktace
Shrnutí rizik
Olanzapin je přítomen v lidském mléce. Byly hlášeny případy nadměrné sedace, podrážděnosti, špatného krmení a extrapyramidových příznaků (třes a abnormální pohyby svalů) u kojenců vystavených působení olanzapinu prostřednictvím mateřského mléka (viz Klinické úvahy ). Neexistují žádné informace o účincích olanzapinu na produkci mléka.
Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky užívat přípravek ZYPREXA a veškerými potenciálními nežádoucími účinky přípravku ZYPREXA na kojené dítě nebo základním onemocněním matky.
Klinické úvahy
Kojenci vystavení přípravku ZYPREXA 7,5 mg by měli být sledováni kvůli nadměrné sedaci, podrážděnosti, špatnému krmení a extrapyramidovým symptomům (třes a abnormální pohyby svalů).
Ženy a muži reprodukčního potenciálu
Neplodnost
Ženy
Na základě farmakologického působení olanzapinu (antagonismus D2 receptoru) může léčba přípravkem ZYPREXA vést ke zvýšení hladin prolaktinu v séru, což může vést k reverzibilnímu snížení plodnosti u žen s reprodukčním potenciálem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pediatrické použití
Bezpečnost a účinnost perorálního přípravku ZYPREXA při léčbě schizofrenie a manických nebo smíšených epizod spojených s bipolární poruchou I byla stanovena v krátkodobých studiích u dospívajících (ve věku 13 až 17 let). Použití přípravku ZYPREXA u dospívajících je podpořeno důkazy z adekvátních a dobře kontrolovaných studií přípravku ZYPREXA 5 mg, ve kterých 268 dospívajících dostávalo přípravek ZYPREXA 20 mg v rozmezí 2,5 až 20 mg/den (viz Klinické studie ]. Doporučená počáteční dávka pro dospívající je nižší než pro dospělé [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Ve srovnání s pacienty z klinických studií u dospělých dospívající pravděpodobně přibrali více na váze, pociťovali zvýšenou sedaci a měli větší zvýšení hladiny celkového cholesterolu, triglyceridů, LDL cholesterolu, prolaktinu a jaterních aminotransferáz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ]. Při rozhodování mezi alternativními léčebnými postupy dostupnými pro dospívající by měli lékaři zvážit zvýšený potenciál (u dospívajících ve srovnání s dospělými) pro zvýšení tělesné hmotnosti a dyslipidémii. Kliničtí lékaři by měli zvážit potenciální dlouhodobá rizika při předepisování dospívajícím a v mnoha případech je to může vést k tomu, aby zvážili předepisování jiných léků nejprve u dospívajících [viz INDIKACE A POUŽITÍ ].
Bezpečnost a účinnost olanzapinu u dětí mladších 13 let nebyla stanovena [viz INFORMACE PRO PACIENTA ].
Bezpečnost a účinnost přípravku ZYPREXA 7,5 mg a fluoxetinu v kombinaci u dětí a dospívajících (ve věku 10 až 17 let) byla stanovena pro akutní léčbu depresivních epizod spojených s bipolární poruchou I.
Bezpečnost a účinnost přípravku ZYPREXA a fluoxetinu v kombinaci u dětí
Geriatrické použití
2500 pacientů v premarketingových klinických studiích s perorálním olanzapinem bylo 11 % (263) ve věku 65 let nebo více. U pacientů se schizofrenií nebyly zjištěny žádné známky rozdílné snášenlivosti olanzapinu u starších pacientů ve srovnání s mladšími pacienty. Studie u starších pacientů s psychózou související s demencí naznačily, že u této populace může být odlišný profil snášenlivosti ve srovnání s mladšími pacienty se schizofrenií. Starší pacienti s psychózou související s demencí léčení olanzapinem mají ve srovnání s placebem zvýšené riziko úmrtí. V placebem kontrolovaných studiích olanzapinu u starších pacientů s psychózou související s demencí byl u pacientů léčených olanzapinem ve srovnání s pacienty léčenými placebem vyšší výskyt cerebrovaskulárních nežádoucích příhod (např. mozková mrtvice, tranzitorní ischemická ataka). Olanzapin není schválen k léčbě pacientů s psychózou související s demencí. Také přítomnost faktorů, které by mohly snížit farmakokinetickou clearance nebo zvýšit farmakodynamickou odpověď na olanzapin, by měla vést ke zvážení nižší počáteční dávky u jakéhokoli geriatrického pacienta (viz VAROVÁNÍ V KRABICE , DÁVKOVÁNÍ A PODÁVÁNÍ , a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Klinické studie přípravku ZYPREXA a fluoxetinu v kombinaci nezahrnovaly dostatečný počet pacientů ve věku ≥ 65 let, aby bylo možné určit, zda reagují odlišně od mladších pacientů.
PŘEDÁVKOVAT
Lidská zkušenost
V premarketingových studiích zahrnujících více než 3100 pacientů a/nebo normálních subjektů bylo náhodné nebo úmyslné akutní předávkování olanzapinem identifikováno u 67 pacientů. U pacienta užívajícího největší zjištěné množství, 300 mg, byly jedinými hlášenými příznaky ospalost a nezřetelná řeč. U omezeného počtu pacientů, kteří byli hodnoceni v nemocnicích, včetně pacienta užívajícího 300 mg, nebyla žádná pozorování naznačující nepříznivou změnu laboratorních analytů nebo EKG. Životní funkce byly po předávkování obvykle v normálních mezích.
postmarketingových hlášeních o předávkování samotným olanzapinem byly ve většině případů hlášeny příznaky. U symptomatických pacientů symptomy s incidencí ≥ 10 % zahrnovaly agitovanost/agresivitu, dysartrii, tachykardii, různé extrapyramidové symptomy a sníženou úroveň vědomí v rozsahu od sedace po kóma. Mezi méně často hlášené příznaky patřily následující potenciálně medicínsky závažné reakce: aspirace, kardiopulmonální zástava, srdeční arytmie (jako je supraventrikulární tachykardie a u 1 pacienta došlo k sinusové pauze se spontánním obnovením normálního rytmu), delirium, možný neuroleptický maligní syndrom, respirační deprese/zástava , křeče, hypertenze a hypotenze. Společnost Eli Lilly and Company obdržela hlášení o úmrtí v souvislosti s předávkováním samotným olanzapinem. V 1 případě úmrtí bylo hlášeno množství akutně požitého olanzapinu pravděpodobně tak nízké jako 450 mg perorálního olanzapinu; v jiném případě však bylo hlášeno, že pacient přežil akutní požití přibližně 2 g perorálního olanzapinu.
Řízení Předávkování
Pro aktuální informace o léčbě předávkování přípravkem ZYPREXA (olanzapin) kontaktujte certifikované centrum pro kontrolu jedů (1-800-222-1222 nebo www.poison.org). Je třeba vzít v úvahu možnost zapojení více léků. V případě akutního předávkování zajistěte a udržujte dýchací cesty a zajistěte dostatečnou oxygenaci a ventilaci, která může zahrnovat intubaci. Je třeba zvážit výplach žaludku (po intubaci, je-li pacient v bezvědomí) a podání aktivního uhlí spolu s projímadlem. Podání aktivního uhlí (1 g) snížilo Cmax a AUC perorálního olanzapinu asi o 60 %. Vzhledem k tomu, že maximální hladiny olanzapinu se typicky nedosahují dříve než 6 hodin po podání dávky, může být při předávkování olanzapinem užitečné živočišné uhlí.
Možnost otupění, záchvatů nebo dystonické reakce hlavy a krku po předávkování může vytvářet riziko aspirace s indukovaným zvracením. Kardiovaskulární monitorování by mělo být zahájeno okamžitě a mělo by zahrnovat nepřetržité elektrokardiografické monitorování k detekci možných arytmií.
Neexistuje žádné specifické antidotum olanzapinu. Proto by měla být zahájena vhodná podpůrná opatření. Hypotenze a oběhový kolaps by měly být léčeny vhodnými opatřeními, jako jsou intravenózní podání tekutin a/nebo sympatomimetika. (Neužívejte adrenalin, dopamin nebo jiná sympatomimetika s beta-agonistickou aktivitou, protože beta stimulace může zhoršit hypotenzi při alfa blokádě vyvolané olanzapinem.) Přísný lékařský dohled a sledování by mělo pokračovat, dokud se pacient neuzdraví.
Specifické informace o předávkování lithiem nebo valproátem naleznete v příbalových informacích těchto přípravků v části Předávkování. Specifické informace o předávkování olanzapinem a fluoxetinem v kombinaci naleznete v části Předávkování v příbalové informaci Symbyax.
KONTRAINDIKACE
- Žádné při monoterapii přípravkem ZYPREXA.
- Pokud používáte přípravek ZYPREXA a fluoxetin v kombinaci, přečtěte si také část Kontraindikace v příbalové informaci k přípravku Symbyax.
- Konkrétní informace o kontraindikacích lithia nebo valproátu naleznete v části Kontraindikace v příbalových informacích těchto dalších produktů.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku olanzapinu v uvedených indikacích není jasný. Nicméně účinnost olanzapinu u schizofrenie může být zprostředkována kombinací antagonismu dopaminu a serotoninu typu 2 (5HT2).
Farmakodynamika
Olanzapin se s vysokou afinitou váže na následující receptory: serotonin 5HT2A/2C, 5HT6 (Ki=4, 11, respektive 5nM), dopamin D1-4 (Ki=11-31 nM), histamin H1 (Ki=7 nM a adrenergní al receptory (Ki=19 nM). Olanzapin je antagonista se střední afinitou k vazbě pro serotonin 5HT3 (Ki=57 nM) a muskarinový M1-5 (Ki=73, 96, 132, 32, respektive 48 nM). Olanzapin se váže s nízkou afinitou na GABAA, BZD a β-adrenergní receptory (Ki>10 μM).
Farmakokinetika
Orální podání, monoterapie
Olanzapin se dobře vstřebává a dosahuje maximálních koncentrací přibližně za 6 hodin po perorální dávce. Je extenzivně eliminován metabolismem prvního průchodu, přičemž přibližně 40 % dávky je metabolizováno před dosažením systémové cirkulace. Jídlo neovlivňuje rychlost ani rozsah absorpce olanzapinu. Farmakokinetické studie ukázaly, že lékové formy olanzapinu ZYPREXA 5 mg tablety a ZYPREXA ZYDIS (olanzapin orálně se rozpadající tablety) jsou bioekvivalentní.
Olanzapin vykazuje lineární kinetiku v rozsahu klinického dávkování. Jeho poločas se pohybuje od 21 do 54 hodin (5. až 95. percentil; průměr 30 h) a zdánlivá plazmatická clearance se pohybuje od 12 do 47 l/h (5. až 95. percentil; průměr 25 l/h).
Podávání olanzapinu jednou denně vede k ustáleným koncentracím přibližně za 1 týden, které jsou přibližně dvojnásobkem koncentrací po jednotlivých dávkách. Plazmatické koncentrace, poločas a clearance olanzapinu se mohou mezi jednotlivci lišit v závislosti na kouření, pohlaví a věku.
Olanzapin je rozsáhle distribuován po celém těle, s distribučním objemem přibližně 1000 l. V koncentračním rozmezí 7 až 1100 ng/ml se váže z 93 % na plazmatické bílkoviny, váže se primárně na albumin a kyselý α1-glykoprotein.
Metabolismus A Eliminace
Po jednorázové perorální dávce olanzapinu značeného 14C bylo 7 % dávky olanzapinu nalezeno v moči jako nezměněné léčivo, což ukazuje, že olanzapin je vysoce metabolizován. Přibližně 57 % a 30 % dávky bylo nalezeno v moči a ve stolici. V plazmě představoval olanzapin pouze 12 % AUC celkové radioaktivity, což ukazuje na významnou expozici metabolitům. Po opakovaných dávkách byly hlavními cirkulujícími metabolity 10-N-glukuronid, přítomný v ustáleném stavu při 44 % koncentrace olanzapinu, a 4´-N-desmethyl olanzapin, přítomný v ustáleném stavu při 31 % koncentrace olanzapinu . Oba metabolity postrádají farmakologickou aktivitu v pozorovaných koncentracích.
Primárními metabolickými cestami olanzapinu jsou přímá glukuronidace a oxidace zprostředkovaná cytochromem P450 (CYP). Studie in vitro naznačují, že na oxidaci olanzapinu se podílejí CYP 1A2 a 2D6 a systém monooxygenázy obsahující flavin. Oxidace zprostředkovaná CYP2D6 se zdá být vedlejší metabolickou cestou in vivo, protože clearance olanzapinu není snížena u subjektů s nedostatkem tohoto enzymu.
Intramuskulární podání
ZYPREXA IntraMuscular má za následek rychlou absorpci s vrcholovými plazmatickými koncentracemi dosaženými během 15 až 45 minut. Na základě farmakokinetické studie u zdravých dobrovolníků vede dávka 5 mg intramuskulárního olanzapinu pro injekci v průměru k maximální plazmatické koncentraci přibližně 5krát vyšší, než je maximální plazmatická koncentrace dosažená po 5 mg perorálním podání olanzapinu. Plocha pod křivkou dosažená po intramuskulární dávce je podobná ploše dosažené po perorálním podání stejné dávky. Poločas pozorovaný po intramuskulárním podání je podobný jako po perorálním podání. Farmakokinetika je v rozsahu klinického dávkování lineární. Metabolické profily po intramuskulárním podání jsou kvalitativně podobné metabolickým profilům po perorálním podání.
Specifické populace
Renální poškození
Protože je olanzapin před vylučováním vysoce metabolizován a pouze 7 % léčiva se vylučuje v nezměněné podobě, není pravděpodobné, že by samotná renální dysfunkce měla zásadní vliv na farmakokinetiku olanzapinu. Farmakokinetické vlastnosti olanzapinu byly podobné u pacientů s těžkou poruchou funkce ledvin au zdravých jedinců, což naznačuje, že úprava dávkování na základě stupně poruchy funkce ledvin není nutná. Olanzapin navíc nelze odstranit dialýzou. Vliv poruchy funkce ledvin na eliminaci metabolitu nebyl studován.
Poškození jater
Ačkoli lze očekávat, že přítomnost poškození jater sníží clearance olanzapinu, studie vlivu zhoršené funkce jater u subjektů (n=6) s klinicky významnou (Childova Pughova klasifikace A a B) cirhózou odhalila malý vliv na farmakokinetiku olanzapinu.
Geriatrický
Ve studii zahrnující 24 zdravých subjektů byl průměrný poločas eliminace olanzapinu asi 1,5krát delší u starších osob (≥65 let) než u osob mladšího věku ( DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rod
Clearance olanzapinu je přibližně o 30 % nižší u žen než u mužů. Nebyly však žádné zjevné rozdíly mezi muži a ženami v účinnosti nebo nežádoucích účincích. Úprava dávkování na základě pohlaví by neměla být nutná.
Stav kouření
Clearance olanzapinu je asi o 40 % vyšší u kuřáků než u nekuřáků, i když úpravy dávkování se běžně nedoporučují.
Závod
Studie in vivo ukázaly, že expozice jsou podobné u Japonců, Číňanů a bělochů, zejména po normalizaci rozdílů v tělesné hmotnosti. Úprava dávkování pro rasu se proto nedoporučuje.
Kombinované efekty
Kombinované účinky věku, kouření a pohlaví by mohly vést k podstatným farmakokinetickým rozdílům v populacích. Clearance u mladých kuřáků může být například 3krát vyšší než u starších nekuřáků. Úprava dávkování může být nezbytná u pacientů, kteří vykazují kombinaci faktorů, které mohou vést ke zpomalení metabolismu olanzapinu (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Dospívající (ve věku 13 až 17 let)
V klinických studiích byla většina dospívajících nekuřáci a tato populace měla nižší průměrnou tělesnou hmotnost, což vedlo k vyšší průměrné expozici olanzapinu ve srovnání s dospělými.
Toxikologie zvířat a/nebo farmakologie
Ve studiích s olanzapinem na zvířatech byly hlavními hematologickými nálezy reverzibilní periferní cytopenie u jednotlivých psů, kterým byla podávána dávka 10 mg/kg (17násobek denní perorální MRHD na základě mg/m² plochy povrchu těla), na dávce závislý pokles lymfocytů a neutrofilů u myší a lymfopenie u potkanů. U několika psů léčených dávkou 10 mg/kg se mezi 1. a 10. měsícem léčby vyvinula reverzibilní neutropenie a/nebo reverzibilní hemolytická anémie. Snížení počtu lymfocytů a neutrofilů související s dávkou bylo pozorováno u myší, kterým byly podávány dávky 10 mg/kg (což odpovídá dvojnásobku denní perorální MRHD na základě mg/m² plochy povrchu těla) ve studiích trvajících 3 měsíce. Nespecifická lymfopenie, konzistentní se sníženým přírůstkem tělesné hmotnosti, se objevila u potkanů, kteří dostávali 22,5 mg/kg (11násobek denní perorální MRHD na základě mg/m² tělesného povrchu) po dobu 3 měsíců nebo 16 mg/kg (8násobek denní perorální MRHD na základě na mg/m² tělesného povrchu) po dobu 6 nebo 12 měsíců. U žádného ze zkoumaných druhů nebyl nalezen žádný důkaz cytotoxicity kostní dřeně. Kostní dřeň byla normocelulární nebo hypercelulární, což ukazuje, že snížení počtu cirkulujících krvinek bylo pravděpodobně způsobeno periferními (nedřeňovými) faktory.
Klinické studie
Pokud používáte přípravek ZYPREXA 7,5 mg a fluoxetin v kombinaci, přečtěte si také část Klinické studie v příbalové informaci k přípravku Symbyax.
Schizofrenie
Dospělí
Účinnost perorálního olanzapinu v léčbě schizofrenie byla stanovena ve 2 krátkodobých (6týdenních) kontrolovaných studiích u dospělých hospitalizovaných pacientů, kteří splnili kritéria DSM III-R pro schizofrenii. Jedna větev s haloperidolem byla zahrnuta jako srovnávací léčba v 1 ze 2 studií, ale tato studie neporovnávala tyto 2 léky v celém rozsahu klinicky relevantních dávek pro obě.
těchto studiích bylo použito několik nástrojů pro hodnocení psychiatrických příznaků a symptomů, mezi nimi Brief Psychiatric Rating Scale (BPRS), vícepoložkový inventář obecné psychopatologie tradičně používaný k hodnocení účinků protidrogové léčby u schizofrenie. Shluk psychóz BPRS (pojmová dezorganizace, halucinační chování, podezřívavost a neobvyklý myšlenkový obsah) je považován za zvláště užitečnou podmnožinu pro hodnocení aktivně psychotických schizofrenních pacientů. Druhé tradiční hodnocení, klinický globální dojem (CGI), odráží dojem zkušeného pozorovatele, který je plně obeznámen s projevy schizofrenie, o celkovém klinickém stavu pacienta. Kromě toho byly použity 2 nově vyvinuté váhy; mezi ně patřila 30-položková škála pozitivních a negativních příznaků (PANSS), ve které je začleněno 18 položek BPRS, a škála pro hodnocení negativních příznaků (SANS). Níže uvedené souhrny studií se zaměřují na následující výsledky: PANSS celkem a/nebo BPRS celkem; shluk psychózy BPRS; PANSS negativní subškála nebo SANS; a CGI Závažnost. Výsledky zkoušek jsou následující:
(1) V 6týdenní, placebem kontrolované studii (n=149) zahrnující 2 fixní dávky olanzapinu 1 a 10 mg/den (rozpis jednou denně), olanzapin v dávce 10 mg/den (ale ne v dávce 1 mg/den) den), byl lepší než placebo v celkovém skóre PANSS (také v celkovém extrahovaném BPRS), v klastru psychózy BPRS, v subškále PANSS Negative a v závažnosti CGI.
(2) V 6týdenní, placebem kontrolované studii (n=253) zahrnující 3 pevná rozmezí dávek olanzapinu (5 ± 2,5 mg/den, 10 ± 2,5 mg/den a 15 ± 2,5 mg/den) na schématu jednou denně, 2 skupiny s nejvyšší dávkou olanzapinu (skutečné průměrné dávky 12 a 16 mg/den, v daném pořadí) byly lepší než placebo v celkovém skóre BPRS, klastru psychózy BPRS a skóre závažnosti CGI; skupina s nejvyšší dávkou olanzapinu byla u SANS lepší než placebo. Nebyla zde žádná jasná výhoda pro skupinu s vysokou dávkou oproti skupině se střední dávkou.
(3) V dlouhodobější studii byli dospělí ambulantní pacienti (n=326), kteří převážně splňovali kritéria DSM-IV pro schizofrenii a kteří zůstali stabilní na olanzapinu během otevřené léčby po dobu alespoň 8 týdnů, randomizováni k pokračování ve stávající léčbě olanzapinem. dávky (v rozmezí od 10 do 20 mg/den) nebo na placebo. Sledovací období pro pozorování pacientů z důvodu relapsu, definovaného na základě nárůstu pozitivních příznaků BPRS nebo hospitalizace, bylo plánováno na 12 měsíců, byla však splněna kritéria pro předčasné ukončení studie z důvodu nadměrného počtu relapsů placeba ve srovnání s relapsy olanzapinu a olanzapin byl lepší než placebo v době do relapsu, což je primární výsledek této studie. Olanzapin byl tedy účinnější než placebo při zachování účinnosti u pacientů stabilizovaných po dobu přibližně 8 týdnů a sledovaných po dobu až 8 měsíců.
Zkoumání podskupin populace (rasa a pohlaví) neodhalilo žádnou rozdílnou schopnost reagovat na základě těchto podskupin.
Dospívající
Účinnost perorálního olanzapinu v akutní léčbě schizofrenie u dospívajících (ve věku 13 až 17 let) byla stanovena v 6týdenní dvojitě zaslepené, placebem kontrolované, randomizované studii s hospitalizovanými a ambulantními pacienty se schizofrenií (n=107), kteří se setkali diagnostická kritéria podle DSM-IV-TR a potvrzená Kiddie Schedule pro afektivní poruchy a schizofrenii pro děti školního věku – současná a celoživotní verze (K-SADS-PL).
Primárním hodnotícím nástrojem použitým pro hodnocení psychiatrických známek a příznaků v této studii byla ukotvená verze stručné psychiatrické hodnotící škály pro děti (BPRS-C) celkového skóre.
této studii s flexibilním dávkováním byl olanzapin 2,5 až 20 mg/den (průměrná modální dávka 12,5 mg/den, průměrná dávka 11,1 mg/den) v léčbě dospívajících s diagnostikovanou schizofrenií účinnější než placebo, jak dokládají statistická významně větší průměrné snížení celkového skóre BPRS-C u pacientů ve skupině léčené olanzapinem než ve skupině s placebem.
I když nejsou k dispozici žádné důkazy, které by odpověděly na otázku, jak dlouho by měl být dospívající pacient léčený přípravkem ZYPREXA udržován, lze účinnost udržovací léčby extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů olanzapinu u dospělých a dospívajících pacientů. Obecně se doporučuje, aby pacienti s odpovědí pokračovali i po akutní odpovědi, ale při nejnižší dávce potřebné k udržení remise. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Bipolární porucha I (manické nebo smíšené epizody)
Dospělí
Monoterapie
Účinnost perorálního olanzapinu v léčbě manických nebo smíšených epizod byla stanovena ve 2 krátkodobých (jedné 3týdenní a jedné 4týdenní) placebem kontrolovaných studiích u dospělých pacientů, kteří splnili kritéria DSM-IV pro bipolární poruchu I s manické nebo smíšené epizody. Tyto studie zahrnovaly pacienty s psychotickými rysy nebo bez nich as rychlým cyklováním nebo bez něj.
Primárním hodnotícím nástrojem použitým pro hodnocení manických příznaků v těchto studiích byla Young Mania Rating Scale (Y-MRS), 11položková škála hodnocená lékařem tradičně používaná k posouzení stupně manické symptomatologie (podrážděnost, rušivé/agresivní chování, spánek , zvýšená nálada, řeč, zvýšená aktivita, sexuální zájem, porucha jazyka/myšlenek, obsah myšlenek, vzhled a vhled) v rozsahu od 0 (žádné manické rysy) do 60 Â (maximální skóre). Primárním výsledkem v těchto studiích byla změna celkového skóre Y-MRS oproti výchozí hodnotě. Výsledky zkoušek jsou následující:
(1) V jedné 3týdenní placebem kontrolované studii (n=67), která zahrnovala rozsah dávek olanzapinu (5-20 mg/den, jednou denně, počínaje dávkou 10 mg/den), byl olanzapin lepší než placebo v snížení celkového skóre Y-MRS. V identicky navržené studii provedené současně s první studií prokázal olanzapin podobný rozdíl v léčbě, ale pravděpodobně kvůli velikosti vzorku a variabilitě místa nebyl v tomto výsledku prokázán jako lepší než placebo.
(2) Ve 4týdenní placebem kontrolované studii (n=115), která zahrnovala rozsah dávek olanzapinu (5-20 mg/den, jednou denně, počínaje dávkou 15 mg/den), byl olanzapin lepší než placebo v snížení celkového skóre Y-MRS.
(3) V jiné studii bylo 361 pacientů splňujících kritéria DSM-IV pro manickou nebo smíšenou epizodu bipolární poruchy I, kteří reagovali během počáteční otevřené fáze léčby v průměru po dobu asi 2 týdnů na olanzapin v dávce 5 až 20 mg/ dne byli randomizováni buď k pokračování v léčbě olanzapinem ve stejné dávce (n=225) nebo k placebu (n=136), za účelem pozorování relapsu. Přibližně 50 % pacientů ukončilo léčbu olanzapinem do 59. dne a 50 % pacientů ve skupině s placebem ukončilo do 23. dne dvojitě zaslepenou léčbu. Odpověď během otevřené fáze byla definována snížením celkového skóre Y-MRS na ≤ 12 a HAM-D 21 na ≤ 8. Relaps během dvojitě zaslepené fáze byl definován jako zvýšení celkového skóre Y-MRS nebo HAM-D 21 na ≥15 nebo hospitalizace pro mánii nebo depresi. V randomizované fázi došlo u pacientů užívajících pokračující olanzapin k významně delší době do relapsu.
Doplněk k lithiu nebo valproátu
Účinnost perorálního olanzapinu se současným lithiem nebo valproátem v léčbě manických nebo smíšených epizod byla stanovena ve 2 kontrolovaných studiích u pacientů, kteří splnili kritéria DSM-IV pro bipolární poruchu I s manickými nebo smíšenými epizodami. Tyto studie zahrnovaly pacienty s psychotickými rysy nebo bez nich as rychlým cyklováním nebo bez něj. Výsledky zkoušek jsou následující:
(1) V jedné 6týdenní placebem kontrolované kombinované studii bylo 175 ambulantních pacientů léčených lithiem nebo valproátem s nedostatečně kontrolovanými manickými nebo smíšenými příznaky (Y-MRS ≥16) randomizováno k léčbě buď olanzapinem, nebo placebem v kombinaci s jejich původní léčbou. . Olanzapin (v rozmezí dávek 5–20 mg/den, jednou denně, počínaje dávkou 10 mg/den) v kombinaci s lithiem nebo valproátem (v terapeutickém rozmezí 0,6 mEq/l až 1,2 mEq/l nebo 50 μg/ml až 125 μg/ml) bylo lepší než samotné lithium nebo valproát ve snížení celkového skóre Y-MRS.
(2) Ve druhé 6týdenní placebem kontrolované kombinované studii bylo 169 ambulantních pacientů léčených lithiem nebo valproátem s nedostatečně kontrolovanými manickými nebo smíšenými příznaky (Y-MRS ≥16) randomizováno k léčbě buď olanzapinem, nebo placebem v kombinaci s původním terapie. Olanzapin (v rozmezí dávek 5–20 mg/den, jednou denně, počínaje dávkou 10 mg/den) v kombinaci s lithiem nebo valproátem (v terapeutickém rozmezí 0,6 mEq/l až 1,2 mEq/l nebo 50 μg/ml až 125 μg/ml) bylo lepší než samotné lithium nebo valproát ve snížení celkového skóre Y-MRS.
Dospívající
Akutní monoterapie
Účinnost perorálního olanzapinu v léčbě akutních manických nebo smíšených epizod u dospívajících (ve věku 13 až 17 let) byla stanovena v 3týdenní, dvojitě zaslepené, placebem kontrolované, randomizované studii u dospívajících hospitalizovaných a ambulantních pacientů, kteří splnili diagnostické kritéria pro manické nebo smíšené epizody spojené s bipolární poruchou I (s psychotickými rysy nebo bez nich) podle DSM-IV-TR (n=161). Diagnóza byla potvrzena K-SADS-PL.
Primárním hodnotícím nástrojem použitým pro hodnocení manických symptomů v této studii bylo celkové skóre Adolescent Structured Young-Mania Rating Scale (Y-MRS).
této studii s flexibilním dávkováním byl olanzapin 2,5 až 20 mg/den (průměrná modální dávka 10,7 mg/den, průměrná dávka 8,9 mg/den) v léčbě dospívajících s manickými nebo smíšenými epizodami spojenými s bipolární poruchou I účinnější než placebo poruchy, což je podpořeno statisticky významně větším průměrným snížením celkového skóre Y-MRS u pacientů ve skupině léčené olanzapinem než ve skupině s placebem.
I když nejsou k dispozici žádné důkazy, které by odpověděly na otázku, jak dlouho by měl být dospívající pacient léčený přípravkem ZYPREXA udržován, lze účinnost udržovací léčby extrapolovat z údajů pro dospělé spolu se srovnáním farmakokinetických parametrů olanzapinu u dospělých a dospívajících pacientů. Obecně se doporučuje, aby pacienti s odpovědí pokračovali i po akutní odpovědi, ale při nejnižší dávce potřebné k udržení remise. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Agitovanost spojená se schizofrenií a bipolární mánií
Účinnost intramuskulárního injekčního olanzapinu k léčbě agitovanosti byla stanovena ve 3 krátkodobých (24 hodin IM léčby) placebem kontrolovaných studiích u agitovaných dospělých hospitalizovaných pacientů ze 2 diagnostických skupin: schizofrenie a bipolární porucha I (manické nebo smíšené epizody) . Každá ze studií zahrnovala jedno aktivní srovnávací léčebné rameno buď injekce haloperidolu (studie schizofrenie) nebo injekce lorazepamu (studie bipolární I mánie). Pacienti zařazení do studií potřebovali: (1) být klinickými výzkumníky posouzeni jako klinicky vzrušení a klinicky vhodní kandidáti pro léčbu intramuskulární medikací a (2) vykazovat úroveň agitovanosti, která dosáhla nebo přesáhla prahové skóre ≥14 na 5 položek zahrnujících škálu pozitivních a negativních syndromů (PANSS) Excited Component (tj. špatná kontrola impulzů, napětí, nepřátelství, nespolupráce a vzrušení) s alespoň 1 skóre jednotlivé položky ≥4 pomocí bodovacího systému 1-7 (1= chybí, 4=střední, 7=extrémní). Ve studiích bylo průměrné výchozí skóre PANSS Excited Component 18,4 se skóre v rozmezí od 13 do 32 (z maximálního skóre 35), což naznačuje převážně mírné úrovně neklidu, přičemž někteří pacienti zažívali mírné nebo těžké úrovně neklidu. Primárním měřítkem účinnosti použitým pro hodnocení známek a symptomů agitovanosti v těchto studiích byla změna v PANSS Excited Component od výchozí hodnoty 2 hodiny po injekci. Pacienti mohli obdržet až 3 injekce během 24 hodin IM léčby; pacienti však nemohli dostat druhou injekci dříve než po počátečním 2hodinovém období, kdy bylo hodnoceno primární měřítko účinnosti. Výsledky zkoušek jsou následující:
(1) V placebem kontrolované studii u agitovaných hospitalizovaných pacientů splňujících kritéria DSM-IV pro schizofrenii (n=270) byly hodnoceny 4 fixní intramuskulární injekční dávky olanzapinu 2,5 mg, 5 mg, 7,5 mg a 10 mg. Všechny dávky byly statisticky lepší než placebo na PANSS Excited Component 2 hodiny po injekci. Účinek byl však větší a konzistentnější u 3 nejvyšších dávek. Nebyly zjištěny žádné významné párové rozdíly pro dávky 7,5 a 10 mg oproti dávce 5 mg.
(2) V druhé placebem kontrolované studii u agitovaných hospitalizovaných pacientů splňujících kritéria DSM-IV pro schizofrenii (n=311) byl hodnocen 1 fixní intramuskulární olanzapin pro injekci v dávce 10 mg. Olanzapin na injekci byl statisticky lepší než placebo na PANSS Excited Component 2 hodiny po injekci.
(3) V placebem kontrolované studii u agitovaných hospitalizovaných pacientů splňujících kritéria DSM-IV pro bipolární poruchu I (a aktuálně vykazující akutní manickou nebo smíšenou epizodu s psychotickými rysy nebo bez nich) (n=201) byla 1 fixní intramuskulární injekční dávka olanzapinu 10 mg. Olanzapin na injekci byl statisticky lepší než placebo na PANSS Excited Component 2 hodiny po injekci.
Zkoumání podskupin populace (věk, rasa a pohlaví) neodhalilo žádnou rozdílnou citlivost na základě těchto podskupin.
INFORMACE PRO PACIENTA
ZYPREXA® (zy-PREX-a) (olanzapin) Tableta
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (olanzapin) Tableta, rozpadající se v ústech
Než začnete přípravek ZYPREXA užívat, přečtěte si Průvodce léčivými přípravky, který je dodáván se ZYPREXOU, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tento průvodce léky nenahrazuje rozhovor s lékařem o vašem zdravotním stavu nebo léčbě. Promluvte si se svým lékařem nebo lékárníkem, pokud něčemu nerozumíte nebo se chcete o přípravku ZYPREXA dozvědět více.
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku ZYPREXA?
ZYPREXA 20 mg může způsobit závažné nežádoucí účinky, včetně:
Tyto závažné nežádoucí účinky jsou popsány níže.
1. Zvýšené riziko úmrtí u starších lidí, kteří jsou zmatení, mají ztrátu paměti a ztratili kontakt s realitou (psychóza související s demencí). Přípravek ZYPREXA není schválen k léčbě psychózy u starších lidí s demencí.
2. Vysoká hladina cukru v krvi (hyperglykémie). Vysoká hladina cukru v krvi se může objevit, pokud již máte cukrovku nebo pokud jste cukrovku nikdy neměli. Vysoká hladina cukru v krvi může vést k:
- hromadění kyseliny v krvi v důsledku ketonů (ketoacidóza)
- kóma
- smrt
Před zahájením léčby přípravkem ZYPREXA 7,5 mg a během léčby by Vám měl lékař provést testy ke kontrole hladiny cukru v krvi. U lidí, kteří nemají cukrovku, někdy po vysazení přípravku ZYPREXA 7,5 mg vysoká hladina cukru v krvi odezní. Lidé s cukrovkou a někteří lidé, kteří cukrovku před užíváním přípravku ZYPREXA neměli, musí užívat léky na vysokou hladinu cukru v krvi i poté, co přestanou přípravek ZYPREXA užívat.
Pokud máte cukrovku, dodržujte pokyny svého lékaře o tom, jak často si kontrolovat hladinu cukru v krvi při užívání přípravku ZYPREXA.
Zavolejte svému lékaři jestliže máte některý z těchto příznaků vysoké hladiny cukru v krvi (hyperglykémie) při užívání přípravku ZYPREXA:
- cítit velkou žízeň
- potřeba močit více než obvykle
- cítit velký hlad
- cítit se slabý nebo unavený
- cítit se špatně od žaludku
- cítit se zmateně nebo váš dech voní po ovoci
3. Vysoké hladiny tuků v krvi (cholesterol a triglyceridy). Vysoké hladiny tuku se mohou vyskytnout u lidí léčených přípravkem ZYPREXA 10 mg, zejména u dospívajících (13 až 17 let), nebo při použití v kombinaci s fluoxetinem u dětí (10 až 17 let). Nemusíte mít žádné příznaky, proto by vám měl lékař před zahájením léčby přípravkem ZYPREXA a během léčby provést krevní testy, aby zkontroloval hladinu cholesterolu a triglyceridů.
4. Přibývání na váze. U lidí, kteří užívají přípravek ZYPREXA, je nárůst tělesné hmotnosti velmi častý. U dospívajících (13 až 17 let) je větší pravděpodobnost, že přiberou a přiberou více než dospělí. U dětí (ve věku 10 až 17 let) je také pravděpodobnější, že přiberou a přiberou více než dospělí, pokud se přípravek ZYPREXA 7,5 mg používá v kombinaci s fluoxetinem. Někteří lidé mohou při užívání přípravku ZYPREXA výrazně přibrat, proto byste měli vy i váš lékař pravidelně kontrolovat svou hmotnost. Poraďte se se svým lékařem o způsobech, jak kontrolovat přírůstek hmotnosti, jako je zdravá, vyvážená strava a cvičení.
Co je ZYPREXA?
ZYPREXA je lék na předpis používaný k léčbě:
- schizofrenie u lidí ve věku 13 let nebo starších.
- bipolární porucha, včetně:
- manické nebo smíšené epizody, které se vyskytují u bipolární poruchy I u lidí ve věku 13 let nebo starších.
- manické nebo smíšené epizody, ke kterým dochází při bipolární poruše I, při použití s lékem lithium nebo valproát, u dospělých.
- dlouhodobá léčba bipolární poruchy I u dospělých.
- epizody deprese, ke kterým dochází u bipolární poruchy I, při použití s léčivem fluoxetinem (Prozac®) u lidí ve věku 10 let nebo starších.
- epizody deprese, které se nezlepší po 2 dalších lécích, nazývaných také deprese rezistentní na léčbu, pokud se užívají s léčivem fluoxetinem (Prozac), u dospělých.
Přípravek ZYPREXA 7,5 mg nebyl schválen pro použití u dětí mladších 13 let. Přípravek ZYPREXA 10 mg v kombinaci s fluoxetinem nebyl schválen pro použití u dětí mladších 10 let.
Příznaky schizofrenie zahrnují slyšení hlasů, vidění věcí, které neexistují, přesvědčení, které není pravdivé, a podezřívavost nebo odtažitost.
Mezi příznaky bipolární poruchy I patří střídání období deprese a povznesené nebo podrážděné nálady, zvýšená aktivita a neklid, uspěchané myšlenky, rychlá mluva, impulzivní chování a snížená potřeba spánku.
Příznaky deprese rezistentní na léčbu zahrnují sníženou náladu, snížený zájem, zvýšené pocity viny, sníženou energii, sníženou koncentraci, změny chuti k jídlu a sebevražedné myšlenky nebo chování.
Některé z vašich příznaků se mohou léčbou zlepšit. Pokud si myslíte, že se nelepšíte, zavolejte svého lékaře.
Co mám říci svému lékaři, než začnu užívat přípravek ZYPREXA?
ZYPREXA nemusí být pro vás to pravé. Před zahájením léčby přípravkem ZYPREXA informujte svého lékaře, pokud máte nebo jste měl(a):
- srdeční problémy
- záchvaty
- cukrovka nebo vysoká hladina cukru v krvi (hyperglykémie)
- vysoké hladiny cholesterolu nebo triglyceridů v krvi
- problémy s játry
- nízký nebo vysoký krevní tlak
- mozkové příhody nebo „malé mozkové příhody“ nazývané také tranzitorní ischemické ataky (TIA)
- Alzheimerova choroba
- glaukom s úzkým úhlem
- zvětšená prostata u mužů
- střevní obstrukce
- fenylketonurii, protože ZYPREXA 5 mg ZYDIS obsahuje fenylalanin
- rakovina prsu
- myšlenky na sebevraždu nebo sebepoškození
- jakýkoli jiný zdravotní stav
- jste těhotná nebo plánujete otěhotnět. Není známo, zda přípravek ZYPREXA 2,5 mg poškodí vaše nenarozené dítě.
- Pokud otěhotníte během užívání přípravku ZYPREXA 20 mg, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro atypická antipsychotika. Můžete se zaregistrovat na telefonním čísle 1-866-961-2388 nebo na http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/.
- kojíte nebo plánujete kojit. ZYPREXA přechází do mateřského mléka. Pokud užíváte přípravek ZYPREXA, poraďte se se svým lékařem o nejlepším způsobu krmení dítěte.
Informujte svého lékaře, pokud hodně cvičíte nebo jste často na horkých místech.
Příznaky bipolární poruchy I, deprese rezistentní na léčbu nebo schizofrenie mohou zahrnovat myšlenky na sebevraždu nebo ublížit sobě nebo ostatním. Pokud máte tyto myšlenky kdykoli, sdělte to svému lékaři nebo jděte ihned na pohotovost.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. ZYPREXA 20 mg a některé léky se mohou vzájemně ovlivňovat a nemusí tak dobře fungovat nebo způsobit možné závažné nežádoucí účinky. Váš lékař vám může říci, zda je bezpečné užívat přípravek ZYPREXA s jinými léky. Během užívání přípravku ZYPREXA nezačínejte ani neukončujte žádný lék, aniž byste se nejprve poradil(a) se svým lékařem.
Jak mám užívat přípravek ZYPREXA 7,5 mg?
- Užívejte přípravek ZYPREXA přesně podle předpisu. Váš lékař možná bude muset změnit (upravit) dávku přípravku ZYPREXA 15 mg, dokud pro vás nebude vhodná.
- Pokud vynecháte dávku přípravku ZYPREXA 20 mg, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku ZYPREXA 10 mg ve stejnou dobu.
- Abyste předešli závažným nežádoucím účinkům, nepřestávejte náhle užívat přípravek ZYPREXA. Pokud potřebujete ukončit užívání přípravku ZYPREXA, váš lékař vám může říci, jak jej bezpečně ukončit.
- Pokud užijete příliš mnoho přípravku ZYPREXA, zavolejte ihned svému lékaři nebo toxikologickému centru na čísle 1-800-222-1222 nebo vyhledejte pohotovostní léčbu.
- ZYPREXA 10 mg lze užívat s jídlem nebo bez jídla.
- ZYPREXA se obvykle užívá jednou denně.
- Užívejte přípravek ZYPREXA 20 mg ZYDIS následovně:
- Ujistěte se, že máte suché ruce.
- Otevřete sáček a sloupněte fólii na blistru. Neprotlačujte tabletu přes fólii.
- Jakmile blistr otevřete, vyjměte tabletu a vložte si ji do úst.
- Tableta se rychle rozpadne ve slinách, takže ji můžete snadno spolknout s tekutinou nebo bez ní.
- Zavolejte svého lékaře, pokud si myslíte, že se vám nezlepšuje nebo máte nějaké obavy ohledně svého stavu během užívání přípravku ZYPREXA.
Čemu se mám vyvarovat při užívání přípravku ZYPREXA?
- ZYPREXA může způsobit ospalost a může ovlivnit vaši schopnost rozhodovat se, jasně myslet nebo rychle reagovat. Neměli byste řídit, obsluhovat těžké stroje nebo vykonávat jiné nebezpečné činnosti, dokud nezjistíte, jak na vás přípravek ZYPREXA 7,5 mg působí.
- Během užívání přípravku ZYPREXA se vyvarujte pití alkoholu. Pití alkoholu během užívání přípravku ZYPREXA může způsobit ospalost, než když užíváte přípravek ZYPREXA 15 mg samotnou.
Jaké jsou možné nežádoucí účinky přípravku ZYPREXA 5 mg?
Při užívání přípravku ZYPREXA 5 mg se mohou vyskytnout závažné nežádoucí účinky, včetně:
- Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku ZYPREXA?“, která popisuje zvýšené riziko úmrtí u starších lidí s psychózou související s demencí a rizika vysoké hladiny cukru v krvi, vysoké hladiny cholesterolu a triglyceridů a přibírání na váze.
- Zvýšený výskyt cévní mozkové příhody nebo „malých mozkových příhod“ nazývaných tranzitorní ischemické ataky (TIA) u starších lidí s psychózou související s demencí (starší lidé, kteří ztratili kontakt s realitou kvůli zmatenosti a ztrátě paměti). Přípravek ZYPREXA není pro tyto pacienty schválen.
- Neuroleptický maligní syndrom (NMS): NMS je vzácný, ale velmi závažný stav, který se může vyskytnout u lidí, kteří užívají antipsychotika, včetně přípravku ZYPREXA. NMS může způsobit smrt a musí být léčena v nemocnici. Okamžitě zavolejte svého lékaře, pokud vážně onemocníte a máte některý z těchto příznaků:
- vysoká horečka
- Nadměrné pocení
- tuhé svaly
- zmatek
- změny vašeho dýchání, srdečního tepu a krevního tlaku.
- Léková reakce s eozinofilií a systémovými příznaky (DRESS): S přípravkem ZYPREXA může dojít k DRESS. Charakteristiky DRESS mohou zahrnovat vyrážku, horečku, otoky uzlin a další postižení vnitřních orgánů, jako jsou játra, ledviny, plíce a srdce. ŠATY jsou někdy fatální; proto okamžitě informujte svého lékaře, pokud zaznamenáte některý z těchto příznaků.
- Tardivní dyskineze: Tento stav způsobuje pohyby těla, které se neustále dějí a které nemůžete ovládat. Tyto pohyby obvykle postihují obličej a jazyk. Tardivní dyskineze nemusí vymizet, i když přestanete užívat přípravek ZYPREXA. Může také začít poté, co přestanete užívat přípravek ZYPREXA. Informujte svého lékaře, pokud zaznamenáte jakékoli pohyby těla, které nemůžete ovládat.
- Snížený krevní tlak při změně polohy s příznaky závratě, rychlého nebo pomalého srdečního tepu nebo mdloby.
- Obtížné polykání, které může způsobit, že se jídlo nebo tekutina dostane do plic.
- Záchvaty: Pokud během léčby přípravkem ZYPREXA dostanete záchvat, informujte svého lékaře.
- Problémy s kontrolou tělesné teploty: Mohlo by vám být velmi horko, například když hodně cvičíte nebo se zdržujete v oblasti, která je velmi horká. Je důležité, abyste pili vodu, abyste se vyhnuli dehydrataci. Okamžitě zavolejte svého lékaře, pokud vážně onemocníte a máte některý z těchto příznaků dehydratace:
- příliš nebo vůbec se potit
- suchá ústa
- cítit se velmi horko
- pocit žízně
- není schopen produkovat moč.
Mezi časté nežádoucí účinky přípravku ZYPREXA patří: nedostatek energie, sucho v ústech, zvýšená chuť k jídlu, ospalost, třes (třes), tvrdá nebo řídká stolice, závratě, změny chování nebo neklid.
Mezi další časté nežádoucí účinky u dospívajících (13-17 let) patří: bolest hlavy, bolest v oblasti žaludku (břicha), bolest paží nebo nohou nebo únava. Teenageři zaznamenali větší zvýšení prolaktinu, jaterních enzymů a ospalosti ve srovnání s dospělými.
Informujte svého lékaře o jakémkoli nežádoucím účinku, který vás obtěžuje nebo který nezmizí.
To nejsou všechny možné vedlejší účinky přípravku ZYPREXA. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám přípravek ZYPREXA uchovávat?
- Uchovávejte přípravek ZYPREXA při pokojové teplotě, mezi 68 °F až 77 °F (20 °C až 25 °C).
- Chraňte přípravek ZYPREXA před světlem.
- Uchovávejte přípravek ZYPREXA 15 mg v suchu a mimo vlhkost.
Uchovávejte přípravek ZYPREXA 5 mg a všechny léky mimo dosah dětí.
Obecné informace o ZYPREXA
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte přípravek ZYPREXA na stav, pro který nebyl předepsán. Nedávejte ZYPREXU 5 mg jiným lidem, i když mají stejné onemocnění. Může jim to ublížit.
Tento průvodce léčivy shrnuje nejdůležitější informace o přípravku ZYPREXA. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku ZYPREXA 20 mg, který byl napsán pro zdravotnické pracovníky. Pro více informací o ZYPREXA volejte 1-800-Lilly-Rx (1-800-545-5979).
Jaké jsou složky přípravku ZYPREXA?
Aktivní složka: olanzapin
Neaktivní složky:
karnaubský vosk, krospovidon, hydroxypropylcelulóza, hypromelóza, laktóza, magnesium-stearát, mikrokrystalická celulóza a další neaktivní složky. Barevný povlak obsahuje: oxid titaničitý, hliníkové jezero FD&C Blue No. 2 nebo syntetický červený oxid železitý.
ZYDIS - želatina, mannitol, aspartam, methylparaben sodný a propylparaben sodný.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
