Geodon 40mg, 80mg, 20mg Ziprasidone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Geodon a jak se používá?
Geodon je lék na předpis používaný k léčbě příznaků schizofrenie, akutního neklidu se schizofrenií a bipolární poruchy I. Geodon může být použit samostatně nebo s jinými léky.
Geodon 20 mg patří do třídy léků nazývaných antipsychotika.
Není známo, zda je Geodon bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky Geodonu?
Geodon 20 mg může způsobit závažné nežádoucí účinky, včetně:
- rychlé nebo bušení srdce,
- chvění v tvé hrudi,
- dušnost,
- náhlá závrať,
- nekontrolované pohyby svalů v obličeji (žvýkání, mlácení rtů, mračení, pohyby jazyka, mrkání nebo pohyby očí),
- jakákoli kožní vyrážka,
- horečka,
- vředy v ústech,
- kožní vředy,
- bolest krku,
- kašel,
- potíže s dýcháním,
- zvýšená žízeň,
- zvýšené močení
- suchá ústa,
- ovocný zápach dechu,
- velmi ztuhlé svaly,
- vysoká horečka,
- pocení,
- agitace a
- zmatek
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Geodon 40 mg patří:
- závrať,
- ospalost,
- slabost,
- nevolnost,
- zvracení,
- potíže s polykáním,
- pocit neklidu,
- třes,
- problémy se zrakem,
- rýma a
- nový nebo zhoršující se kašel
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Prometrium. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
ZVÝŠENÁ ÚMRTNOST U STARŠÍCH PACIENTŮ S PSYCHÓZOU SOUVISEJÍCÍ S DEMENCÍ
U starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. GEODON není schválen pro léčbu psychózy související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
POPIS
GEODON 40 mg je dostupný ve formě tobolek (ziprasidon hydrochlorid) pro perorální podání a jako injekce (ziprasidon mesylát) pouze pro intramuskulární podání. Ziprasidon je psychotropní látka, která chemicky nesouvisí s fenothiazinovými nebo butyrofenonovými antipsychotiky. Má molekulovou hmotnost 412,94 (volná báze) s následujícím chemickým názvem: 5-[2-[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1 ,3-dihydro-2H-indol-2-on. Empirický vzorec C21H21ClN4OS (volná báze ziprasidonu) představuje následující strukturní vzorec:
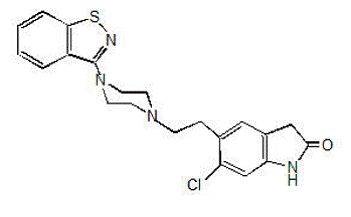
GEODON tobolky obsahují monohydrochlorid, monohydrátovou sůl ziprasidonu. Chemicky je monohydrát hydrochloridu ziprasidonu 5-[2-[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1,3-dihydro-2H-indol-2-on , monohydrochlorid, monohydrát. Empirický vzorec je C21H21ClN4OS• HCl• H2O a jeho molekulová hmotnost je 467,42. Monohydrát ziprasidonu je bílý až slabě růžový prášek.
GEODON 20mg tobolky se dodávají pro perorální podání v tobolkách 20 mg (modrá/bílá), 40 mg (modrá/modrá), 60 mg (bílá/bílá) a 80 mg (modrá/bílá). GEODON 40 mg tobolky obsahují monohydrát ziprasidon-hydrochloridu, laktózu, předbobtnalý škrob a magnesium-stearát.
GEODON pro injekci obsahuje lyofilizovanou formu trihydrátu ziprasidon mesylátu. Chemicky je trihydrát mesylátu ziprasidonu 5-[2-[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1,3-dihydro-2H-indol-2-on methansulfonát, trihydrát. Empirický vzorec je C21H21ClN4OS • CH3SO3H • 3H2O a jeho molekulová hmotnost je 563,09.
GEODON 40 mg pro injekci je dostupný v jednodávkové injekční lahvičce jako ziprasidon mesylát (20 mg ziprasidonu/ml při rekonstituci podle pokynů na štítku) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Každý ml ziprasidon mesylátu pro injekci (po rekonstituci) obsahuje 20 mg ziprasidonu a 4,7 mg methansulfonové kyseliny rozpuštěné v 294 mg sulfobutylether β-cyklodextrinu sodného (SBECD).
INDIKACE
GEODON je indikován k léčbě schizofrenie, jako monoterapie k akutní léčbě bipolárních manických nebo smíšených epizod a jako doplněk k lithiu nebo valproátu k udržovací léčbě bipolární poruchy. GEODON intramuskulárně je indikován k akutnímu neklidu u schizofrenních pacientů. Při rozhodování mezi alternativními léčebnými postupy dostupnými pro stav vyžadující léčbu by měl předepisující lékař zvážit zjištění, že ziprasidon má větší schopnost prodloužit QT/QTc interval ve srovnání s několika jinými antipsychotiky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Prodloužení QTc intervalu je u některých dalších léků spojeno se schopností způsobit arytmii typu torsade de pointes, potenciálně fatální polymorfní komorovou tachykardii a náhlou smrt. V mnoha případech by to vedlo k závěru, že je třeba nejprve vyzkoušet jiné drogy. Zda ziprasidon způsobí torsade de pointes nebo zvýší míru náhlé smrti, není dosud známo [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Schizofrenie
- GEODON je indikován k léčbě schizofrenie u dospělých (viz Klinické studie ].
Bipolární porucha I (akutní smíšené nebo manické epizody a udržovací léčba jako doplněk k lithiu nebo valproátu)
- GEODON je indikován jako monoterapie pro akutní léčbu dospělých s manickými nebo smíšenými epizodami spojenými s bipolární poruchou I (viz Klinické studie ].
- GEODON 40 mg je indikován jako doplněk k lithiu nebo valproátu k udržovací léčbě bipolární poruchy I u dospělých (viz Klinické studie ].
Akutní Léčba Agitovanosti U Schizofrenie
- GEODON 40 mg intramuskulárně je indikován k léčbě akutního neklidu u schizofrenních dospělých pacientů, pro které je vhodná léčba ziprasidonem a kteří potřebují intramuskulární antipsychotiku pro rychlou kontrolu agitovanosti (viz Klinické studie ].
Vzhledem k tomu, že nejsou žádné zkušenosti s bezpečností intramuskulárního podávání ziprasidonu pacientům se schizofrenií, kteří již užívají ziprasidon perorálně, praxe současného podávání se nedoporučuje.
DÁVKOVÁNÍ A PODÁVÁNÍ
Schizofrenie
Výběr dávky
GEODON 40 mg tobolky by měl být podáván v počáteční denní dávce 20 mg dvakrát denně s jídlem. U některých pacientů může být denní dávka následně upravena na základě individuálního klinického stavu až na 80 mg dvakrát denně. Úpravy dávkování, je-li indikováno, by se obecně měly provádět v intervalech ne kratších než 2 dny, protože ustáleného stavu je dosaženo během 1 až 3 dnů. Aby bylo zajištěno použití nejnižší účinné dávky, měli by být pacienti před úpravou dávky obvykle několik týdnů sledováni z hlediska zlepšení.
Účinnost u schizofrenie byla prokázána v rozmezí dávek 20 mg až 100 mg dvakrát denně v krátkodobých, placebem kontrolovaných klinických studiích. Byly pozorovány tendence k odpovědi na dávku v rozmezí 20 mg až 80 mg dvakrát denně, ale výsledky nebyly konzistentní. Zvýšení na dávku vyšší než 80 mg dvakrát denně se obecně nedoporučuje. Bezpečnost dávek nad 100 mg dvakrát denně nebyla v klinických studiích systematicky hodnocena [viz Klinické studie ].
Udržovací léčba
když nejsou k dispozici žádné důkazy, které by zodpověděly otázku, jak dlouho by měl pacient léčený ziprasidonem setrvat, udržovací studie u pacientů, kteří byli symptomaticky stabilní a poté randomizováni k pokračování v ziprasidonu nebo k přechodu na placebo, prokázala zpoždění v čase k relapsu u pacientů užívajících GEODON [viz Klinické studie ]. U dávek nad 20 mg dvakrát denně nebyl prokázán žádný další přínos. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby.
Bipolární porucha I (akutní smíšené nebo manické epizody a udržovací léčba jako doplněk k lithiu nebo valproátu)
Akutní léčba manických nebo smíšených epizod
Volba dávky – perorální ziprasidon by měl být podáván v počáteční denní dávce 40 mg dvakrát denně s jídlem. Dávka může být poté zvýšena na 60 mg nebo 80 mg dvakrát denně druhý den léčby a následně upravena na základě tolerance a účinnosti v rozmezí 40 mg – 80 mg dvakrát denně. V klinických studiích s flexibilní dávkou byla průměrná podaná denní dávka přibližně 120 mg [viz Klinické studie ].
Udržovací léčba (jako doplněk k lithiu nebo valproátu)
Pokračujte v léčbě stejnou dávkou, na které byl pacient zpočátku stabilizován, v rozmezí 40 mg – 80 mg dvakrát denně s jídlem. Pacienti by měli být pravidelně přehodnocováni, aby se zjistila potřeba udržovací léčby [viz Klinické studie ].
Akutní Léčba Agitovanosti U Schizofrenie
Intramuskulární dávkování
Doporučená dávka je 10 mg až 20 mg podávaná podle potřeby až do maximální dávky 40 mg denně. Dávky 10 mg mohou být podávány každé dvě hodiny; dávky 20 mg mohou být podávány každé čtyři hodiny až do maximální dávky 40 mg/den. Intramuskulární podávání ziprasidonu po dobu delší než tři po sobě jdoucí dny nebylo studováno.
Pokud je indikována dlouhodobá léčba, měly by být intramuskulární podání co nejdříve nahrazeny perorálními tobolkami ziprasidon-hydrochloridu.
Vzhledem k tomu, že nejsou žádné zkušenosti s bezpečností intramuskulárního podávání ziprasidonu pacientům se schizofrenií, kteří již užívají ziprasidon perorálně, praxe současného podávání se nedoporučuje.
Ziprasidon intramuskulárně je určen pouze k intramuskulárnímu podání a neměl by být podáván intravenózně.
Intramuskulární přípravek pro podání
GEODON pro injekci (ziprasidon mesylát) by měl být podáván pouze intramuskulární injekcí a neměl by být podáván intravenózně. Jednodávkové lahvičky vyžadují před podáním rekonstituci.
Přidejte 1,2 ml sterilní vody na injekci do lahvičky a důkladně protřepejte, dokud se veškerý lék nerozpustí. Každý ml rekonstituovaného roztoku obsahuje 20 mg ziprasidonu. Pro podání dávky 10 mg odeberte 0,5 ml rekonstituovaného roztoku. Pro podání dávky 20 mg odeberte 1,0 ml rekonstituovaného roztoku. Jakákoli nepoužitá část by měla být zlikvidována. Vzhledem k tomu, že tento produkt neobsahuje žádné konzervační nebo bakteriostatické činidlo, je nutné při přípravě konečného roztoku použít aseptickou techniku. Tento léčivý přípravek se nesmí mísit s jinými léčivými přípravky nebo rozpouštědly než se sterilní vodou na injekci. Parenterální léčivé přípravky by měly být před podáním vizuálně zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a nádoba dovolí.
JAK DODÁVÁNO
Dávkové formy A Síly
Kapsle GEODON se liší barvou/velikostí tobolky a jsou potištěny černým inkoustem s nápisem „Pfizer a ZDX [dávková síla]“ nebo „Pfizer“ a jedinečným číslem. GEODON 40 mg tobolky se dodávají pro perorální podání v tobolkách 20 mg (modrá/bílá), 40 mg (modrá/modrá), 60 mg (bílá/bílá) a 80 mg (modrobílá). Dodávají se v následujících pevnostech a konfiguracích balení:
GEODON pro injekci je dostupný v jednodávkové injekční lahvičce jako ziprasidon mesylát (20 mg ziprasidonu/ml při rekonstituci podle pokynů na štítku) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Každý ml ziprasidon mesylátu pro injekci (po rekonstituci) poskytuje bezbarvý až světle růžový roztok, který obsahuje 20 mg ziprasidonu a 4,7 mg methansulfonové kyseliny solubilizované 294 mg sulfobutylether β-cyklodextrinu sodného (SBECD).
Skladování A Manipulace
Kapsle GEODON se liší barvou/velikostí kapsle a jsou potištěny černým inkoustem s nápisem „Pfizer a ZDX [síla dávky]“ nebo „Pfizer“ a jedinečným číslem. GEODON 20mg tobolky se dodávají pro perorální podání v tobolkách 20 mg (modrá/bílá), 40 mg (modrá/modrá), 60 mg (bílá/bílá) a 80 mg (modrá/bílá). Dodávají se v následujících pevnostech a konfiguracích balení:
Nebo
Kapsle GEODON by měly být skladovány při 25°C (77°F); povoleny výchylky do 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ].
GEODON 80 mg pro injekci je dostupný v jednodávkové injekční lahvičce jako ziprasidon mesylát (20 mg ziprasidonu/ml při rekonstituci podle pokynů na štítku) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Každý ml ziprasidon mesylátu pro injekci (po rekonstituci) poskytuje bezbarvý až světle růžový roztok, který obsahuje 20 mg ziprasidonu a 4,7 mg methansulfonové kyseliny solubilizované 294 mg sulfobutylether β-cyklodextrinu sodného (SBECD).
GEODON 40 mg pro injekci by měl být skladován při teplotě 25 °C (77 °F); povoleny výchylky do 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota v suché formě. Chraňte před světlem. Po rekonstituci lze přípravek GEODON 40 mg pro injekci uchovávat, je-li chráněn před světlem, po dobu až 24 hodin při teplotě 15 °C až 30 °C (59 °F až 86 °F) nebo až 7 dní v chladničce při teplotě 2 °C až 8 °C (36 °F až 46 °F).
Distribuuje: Roerig Division of Pfizer Inc, NY, NY 10017. Revize: říjen 2020
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Klinické studie s perorálním ziprasidonem zahrnovaly přibližně 5700 pacientů a/nebo normálních subjektů vystavených jedné nebo více dávkám ziprasidonu. Z těchto 5 700 bylo více než 4 800 pacientů, kteří se účastnili studií účinnosti více dávek, a jejich zkušenosti odpovídaly přibližně 1 831 pacientorokům. Tito pacienti zahrnují: (1) 4331 pacientů, kteří se účastnili studií s více dávkami, převážně se schizofrenií, což představuje přibližně 1698 pacientoroků expozice k 5. únoru 2000; a (2) 472 pacientů, kteří se zúčastnili studií bipolární mánie, což představuje přibližně 133 pacientoroků expozice. Dalších 127 pacientů s bipolární poruchou se zúčastnilo dlouhodobé studie udržovací léčby představující přibližně 74,7 pacientoroků expozice ziprasidonu. Podmínky a délka léčby ziprasidonem zahrnovaly otevřené a dvojitě zaslepené studie, hospitalizované a ambulantní studie a krátkodobou a dlouhodobou expozici.
Klinické studie s intramuskulárním ziprasidonem zahrnovaly 570 pacientů a/nebo normálních subjektů, kteří dostali jednu nebo více injekcí ziprasidonu. Více než 325 z těchto subjektů se zúčastnilo studií zahrnujících podávání více dávek.
Nežádoucí účinky během expozice byly získány sběrem dobrovolně hlášených nežádoucích účinků, stejně jako výsledků fyzikálních vyšetření, vitálních funkcí, hmotnosti, laboratorních analýz, EKG a výsledků oftalmologických vyšetření.
Uvedené četnosti nežádoucích účinků představují podíl jedinců, kteří alespoň jednou zaznamenali nežádoucí účinek vyplývající z léčby uvedeného typu. Reakce byla považována za nastupující léčbu, pokud se objevila poprvé nebo se zhoršila během léčby po základním hodnocení.
Nežádoucí nálezy pozorované v krátkodobých, placebem kontrolovaných studiích s perorálním ziprasidonem
Následující zjištění jsou založena na krátkodobých placebem kontrolovaných předmarketingových studiích pro schizofrenii (soubor dvou 6týdenních a dvou 4týdenních studií s fixní dávkou) a bipolární mánie (soubor dvou 3týdenních flexibilních dávek studií), ve kterých byl ziprasidon podáván v dávkách v rozmezí od 10 do 200 mg/den.
Běžně pozorované nežádoucí reakce v krátkodobých studiích kontrolovaných placebem
Následující nežádoucí účinky byly nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním ziprasidonu (výskyt 5 % nebo vyšší) a nebyly pozorovány s ekvivalentní incidencí u pacientů léčených placebem (výskyt ziprasidonu nejméně dvakrát vyšší než u placeba):
Studie schizofrenie (viz tabulka 11)
- Spavost
- Infekce dýchacích cest
Bipolární studie (viz tabulka 12)
- Spavost
- Extrapyramidové příznaky, které zahrnují následující termíny nežádoucích reakcí: extrapyramidový syndrom, hypertonie, dystonie, dyskineze, hypokineze, třes, paralýza a záškuby. Žádný z těchto nežádoucích účinků se ve studiích bipolární mánie nevyskytl jednotlivě s incidencí vyšší než 10 %.
- Závratě, která zahrnuje nežádoucí reakce jako závrať a točení hlavy.
- Akathisia
- Abnormální vize
- astenie
- Zvracení
Schizofrenie
Nežádoucí účinky spojené s přerušením léčby v krátkodobých placebem kontrolovaných studiích perorálního ziprasidonu
Přibližně 4,1 % (29/702) pacientů léčených ziprasidonem v krátkodobých, placebem kontrolovaných studiích přerušilo léčbu kvůli nežádoucí reakci, ve srovnání s přibližně 2,2 % (6/273) na placebu. Nejčastější reakcí spojenou s vysazením byla vyrážka, včetně 7 vyřazení pro vyrážku mezi pacienty se ziprasidonem (1 %) ve srovnání s pacienty bez placeba [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nežádoucí účinky vyskytující se s výskytem 2 % nebo více u pacientů léčených ziprasidonem v krátkodobých, perorálních, placebem kontrolovaných studiích
Tabulka 11 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků souvisejících s léčbou, které se objevily během akutní terapie (až 6 týdnů) u převážně pacientů se schizofrenií, včetně pouze těch reakcí, které se objevily u 2 % nebo více pacientů léčených ziprasidon a jehož incidence u pacientů léčených ziprasidonem byla vyšší než u pacientů léčených placebem.
Závislost nežádoucích účinků na dávce v krátkodobých studiích kontrolovaných placebem s fixní dávkou
Analýza odezvy na dávku v souboru 4 studií schizofrenie odhalila zjevný vztah nežádoucí reakce k dávce u následujících reakcí: astenie, posturální hypotenze, anorexie, sucho v ústech, zvýšené slinění, artralgie, úzkost, závratě, dystonie, hypertonie, somnolence , třes, rýma, vyrážka a abnormální vidění.
Extrapyramidové příznaky (EPS)
Incidence hlášených EPS (která zahrnovala termíny nežádoucí reakce extrapyramidový syndrom, hypertonie, dystonie, dyskineze, hypokineze, třes, paralýza a záškuby) u pacientů léčených ziprasidonem v krátkodobých, placebem kontrolovaných studiích se schizofrenií byla 14 % vs. 8 % pro placebo. Objektivně shromážděná data z těchto studií na Simpsonově-Angusově hodnotící škále (pro EPS) a Barnesově akathisijské škále (pro akatizii) obecně neprokázala rozdíl mezi ziprasidonem a placebem.
Dystonie
Třída účinku: Příznaky dystonie, prodloužené abnormální kontrakce svalových skupin, se mohou objevit u citlivých jedinců během prvních několika dnů léčby. Dystonické příznaky zahrnují: křeče šíjových svalů, někdy progredující do sevření hrdla, potíže s polykáním, potíže s dýcháním a/nebo vyčnívání jazyka. I když se tyto příznaky mohou objevit při nízkých dávkách, vyskytují se častěji as větší závažností při vysoké účinnosti a při vyšších dávkách antipsychotik první generace. Zvýšené riziko akutní dystonie je pozorováno u mužů a mladších věkových skupin.
Změny vitálních funkcí
Ziprasidon je spojen s ortostatickou hypotenzí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Změny EKG
Ziprasidon je spojen se zvýšením QTc intervalu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Ve studiích se schizofrenií byl ziprasidon spojen s průměrným zvýšením srdeční frekvence o 1,4 tepu za minutu ve srovnání s poklesem o 0,2 tepu za minutu u pacientů s placebem.
Další nežádoucí účinky pozorované během předmarketingového hodnocení perorálního ziprasidonu
Následuje seznam pojmů COSTART, které odrážejí nežádoucí účinky související s léčbou, jak jsou definovány v úvodu části NEŽÁDOUCÍ ÚČINKY hlášené pacienty léčenými ziprasidonem ve studiích se schizofrenií v opakovaných dávkách > 4 mg/den v databázi 3 834 pacientů. Všechny hlášené reakce jsou zahrnuty kromě těch, které jsou již uvedeny v tabulce 11 nebo jinde v označení, těch reakčních termínů, které byly tak obecné, že nebyly informativní, reakcí hlášených pouze jednou a u kterých nebyla podstatná pravděpodobnost, že budou akutně ohrožovat život, reakcí, které jsou součástí léčeného onemocnění nebo jsou jinak běžné jako reakce na pozadí a reakce, které pravděpodobně nesouvisejí s lékem. Je důležité zdůraznit, že ačkoli se hlášené reakce vyskytly během léčby ziprasidonem, nemusely být nutně způsobeny právě ziprasidonem.
Nežádoucí účinky jsou dále kategorizovány podle tělesného systému a uvedeny v pořadí klesající frekvence podle následujících definic:
Časté – nežádoucí účinky vyskytující se nejméně u 1/100 pacientů (≥1,0 % pacientů) (v tomto seznamu se objevují pouze ty, které již nejsou uvedeny v tabulkových výsledcích z placebem kontrolovaných studií);
Méně časté – nežádoucí účinky vyskytující se u 1/100 až 1/1000 pacientů (u 0,1-1,0 % pacientů)
Vzácné – nežádoucí účinky vyskytující se u méně než 1/1000 pacientů (
Tělo jako celek
Časté bolesti břicha, chřipkový syndrom, horečka, náhodný pád, edém obličeje, zimnice, fotosenzitivní reakce, bolest v boku, hypotermie, nehoda motorového vozidla
Kardiovaskulární systém
Častá tachykardie, hypertenze, posturální hypotenze
Méně častá bradykardie, angina pectoris, fibrilace síní
Vzácné AV blokáda 1. stupně, blokáda raménka, flebitida, plicní embolie, kardiomegalie, mozkový infarkt, cerebrovaskulární příhoda, hluboká tromboflebitida, myokarditida, tromboflebitida
Zažívací ústrojí
Časté nechutenství, zvracení
Méně časté rektální krvácení, dysfagie, edém jazyka
Vzácné krvácení z dásní, žloutenka, fekální impakce, zvýšení gama glutamyltranspeptidázy, hemateméza, cholestatická žloutenka, hepatitida, hepatomegalie, leukoplakie v ústech, ztučnění jater, melena
Endokrinní
Vzácné hypotyreóza, hypertyreóza, tyreoiditida
Hemický a lymfatický systém
Méně častá anémie, ekchymóza, leukocytóza, leukopenie, eozinofilie, lymfadenopatie
Vzácné trombocytopenie, hypochromní anémie, lymfocytóza, monocytóza, bazofilie, lymfedém, polycytémie, trombocytémie
Metabolické a nutriční poruchy
Méně častá žízeň, zvýšená transamináza, periferní edém, hyperglykémie, zvýšená kreatinfosfokináza, zvýšená alkalická fosfatáza, hypercholesterémie, dehydratace, zvýšená laktátdehydrogenáza, albuminurie, hypokalémie
Vzácné zvýšení BUN, zvýšení kreatininu, hyperlipémie, hypocholesterémie, hyperkalémie, hypochlorémie, hypoglykémie, hyponatrémie, hypoproteinémie, snížená glukózová tolerance, dna, hyperchlorémie, hyperurikémie, hypokalcémie, hypoglykemie, hypomagnezémie, ketóza, respirační alkalóza
Muskuloskeletální systém
Častá myalgie
Méně častá tenosynovitida
Vzácná myopatie
Nervový systém
Frekvence, extrapyramidový syndrom, třes, dystonie, hypertonie, dyskineze, hostilita, záškuby, parestézie, zmatenost, vertigo, hypokineze, hyperkineze, abnormální chůze, okulogyrická krize, hypestezie, ataxie, amnézie, rigidita ozubených kol, hypotonie, delirie, akinerie abstinenční syndrom, bukoglosální syndrom, choreoatetóza, diplopie, nekoordinovanost, neuropatie
Méně časté ochrnutí
Vzácné myoklonus, nystagmus, torticollis, cirkumorální parestézie, opistotonos, zvýšené reflexy, trismus
Dýchací systém
Častá dušnost
Méně časté pneumonie, epistaxe
Vzácné hemoptýza, laryngismus
Kůže a přílohy
Méně časté makulopapulózní vyrážky, kopřivka, alopecie, ekzém, exfoliativní dermatitida, kontaktní dermatitida, vezikulobulózní vyrážka
Speciální smysly
Častá plísňová dermatitida
Méně časté záněty spojivek, suché oči, tinitus, blefaritida, katarakta, fotofobie
Vzácné oční krvácení, defekt zorného pole, keratitida, keratokonjunktivitida
Urogenitální systém
Méně častá impotence, abnormální ejakulace, amenorea, hematurie, menoragie, laktace žen, polyurie, retence moči, metroragie, mužská sexuální dysfunkce, anorgasmie, glykosurie
Vzácné gynekomastie, vaginální krvácení, nykturie, oligurie, ženská sexuální dysfunkce, děložní krvácení
Bipolární porucha
Akutní léčba manických nebo smíšených epizod
Nežádoucí reakce spojené s přerušením léčby v krátkodobém horizontu, placebem kontrolované studie
Přibližně 6,5 % (18/279) pacientů léčených ziprasidonem v krátkodobých, placebem kontrolovaných studiích přerušilo léčbu kvůli nežádoucí reakci, ve srovnání s přibližně 3,7 % (5/136) na placebu. Nejčastějšími reakcemi spojenými s předčasným ukončením léčby u pacientů léčených ziprasidonem byly akatizie, úzkost, deprese, závratě, dystonie, vyrážka a zvracení, přičemž u pacientů se ziprasidonem došlo ke 2 vysazení pro každou z těchto reakcí (1 %) ve srovnání s jedním pacientem užívajícím placebo. dystonie a vyrážka (1 %) a žádní pacienti s placebem pro zbývající nežádoucí účinky.
Nežádoucí účinky vyskytující se s výskytem 2 % nebo více u pacientů léčených ziprasidonem v krátkodobých, perorálních, placebem kontrolovaných studiích
Tabulka 12 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků souvisejících s léčbou, které se objevily během akutní terapie (až 3 týdny) u pacientů s bipolární mánií, včetně pouze reakcí, které se objevily u 2 % nebo více pacientů léčených ziprasidon a jehož incidence u pacientů léčených ziprasidonem byla vyšší než u pacientů léčených placebem.
Průzkumy interakcí na základě pohlaví neodhalily žádné klinicky významné rozdíly ve výskytu nežádoucích účinků na základě tohoto demografického faktoru.
Intramuskulární ziprasidon
Nežádoucí účinky vyskytující se s výskytem 1 % nebo více mezi pacienty léčenými ziprasidonem v krátkodobých studiích intramuskulárního ziprasidonu
Tabulka 13 uvádí incidenci, zaokrouhlenou na nejbližší procento, nežádoucích účinků souvisejících s léčbou, které se vyskytly během akutní terapie intramuskulárním ziprasidonem u 1 % nebo více pacientů.
těchto studiích byly nejčastěji pozorované nežádoucí účinky spojené s použitím intramuskulárního ziprasidonu (výskyt 5 % nebo vyšší) a pozorované v míře u intramuskulárního ziprasidonu (ve skupinách s vyšší dávkou) nejméně dvakrát vyšší než ve skupině s nejnižším intramuskulárním ziprasidonem byly bolesti hlavy (13 %), nevolnost (12 %) a somnolence (20 %).
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku GEODON po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Hlášení nežádoucích účinků, které nejsou uvedeny výše a které byly obdrženy od uvedení na trh, zahrnují vzácné výskyty následujících: Srdeční poruchy: Tachykardie, torsade de pointes (v přítomnosti více matoucích faktorů), [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]; Poruchy trávicího systému: oteklý jazyk; Poruchy reprodukčního systému a prsu: galaktorea, priapismus; Poruchy nervového systému: pokles obličeje, neuroleptický maligní syndrom, serotoninový syndrom (samotný nebo v kombinaci se serotonergními léčivými přípravky), tardivní dyskineze; Psychiatrické poruchy: Nespavost, mánie/hypománie; Poruchy kůže a podkožní tkáně: Alergická reakce (jako je alergická dermatitida, angioedém, orofaciální edém, kopřivka), vyrážka, léková reakce s eozinofilií a systémovými příznaky (DRESS); Poruchy urogenitálního systému: Enuréza, inkontinence moči; Cévní poruchy: Posturální hypotenze, synkopa.
DROGOVÉ INTERAKCE
Interakce lék-lék mohou být farmakodynamické (kombinované farmakologické účinky) nebo farmakokinetické (změna plazmatických hladin). Rizika užívání ziprasidonu v kombinaci s jinými léky byla hodnocena, jak je popsáno níže. Všechny studie interakcí byly provedeny s perorálním ziprasidonem. Na základě farmakodynamického a farmakokinetického profilu ziprasidonu lze předpokládat možné interakce:
Metabolická cesta
Přibližně dvě třetiny ziprasidonu jsou metabolizovány kombinací chemické redukce glutathionem a enzymatické redukce aldehydoxidázou. Nejsou známy žádné klinicky relevantní inhibitory nebo induktory aldehydoxidázy. Méně než jedna třetina metabolické clearance ziprasidonu je zprostředkována oxidací katalyzovanou cytochromem P450.
Studie in vitro
In vitro studie inhibice enzymů využívající mikrozomy lidských jater ukázala, že ziprasidon má malý inhibiční účinek na CYP1A2, CYP2C9, CYP2C19, CYP2D6 a CYP3A4, a proto by pravděpodobně neinterferoval s metabolismem léků primárně metabolizovaných těmito enzymy. Existuje malý potenciál pro lékové interakce se ziprasidonem v důsledku vytěsnění [viz KLINICKÁ FARMAKOLOGIE ].
Farmakodynamické interakce
Ziprasidon by neměl být užíván s žádným lékem, který prodlužuje QT interval [viz KONTRAINDIKACE ].
Vzhledem k primárním účinkům ziprasidonu na CNS je třeba opatrnosti při jeho užívání v kombinaci s jinými centrálně působícími léky.
Vzhledem ke svému potenciálu vyvolávat hypotenzi může ziprasidon zesilovat účinky některých antihypertenziv.
Ziprasidon může antagonizovat účinky levodopy a agonistů dopaminu.
Farmakokinetické interakce
karbamazepin
Karbamazepin je induktor CYP3A4; podávání 200 mg dvakrát denně po dobu 21 dnů vedlo ke snížení AUC ziprasidonu přibližně o 35 %. Tento účinek může být větší, jsou-li podávány vyšší dávky karbamazepinu.
ketokonazol
Ketokonazol, silný inhibitor CYP3A4, v dávce 400 mg QD po dobu 5 dnů zvýšil AUC a Cmax ziprasidonu asi o 35–40 %. Ostatní inhibitory CYP3A4 by měly mít podobné účinky.
Cimetidin
Cimetidin v dávce 800 mg jednou denně po dobu 2 dnů neovlivnil farmakokinetiku ziprasidonu.
Antacid
Současné podání 30 ml přípravku Maalox® se ziprasidonem neovlivnilo farmakokinetiku ziprasidonu.
Lithium
Ziprasidon v dávce 40 mg dvakrát denně podávaný současně s lithiem v dávce 450 mg dvakrát denně po dobu 7 dnů neovlivnil hladinu lithia v rovnovážném stavu ani renální clearance. Ziprasidon podávaný přídavně k lithiu v udržovací studii u bipolárních pacientů neovlivnil průměrné terapeutické hladiny lithia.
Orální antikoncepce
Studie in vivo neprokázaly žádný účinek ziprasidonu na farmakokinetiku estrogenových nebo progesteronových složek. Ziprasidon v dávce 20 mg dvakrát denně neovlivnil farmakokinetiku současně podávaných perorálních kontraceptiv, ethinylestradiolu (0,03 mg) a levonorgestrelu (0,15 mg).
Dextromethorfan
V souladu s výsledky in vitro studie na normálních zdravých dobrovolnících prokázala, že ziprasidon nemění metabolismus dextromethorfanu, modelového substrátu CYP2D6, na jeho hlavní metabolit, dextrorfan. V poměru dextrometorfan/dextrorfan v moči nedošlo k žádné statisticky významné změně.
Valproát
Farmakokinetická interakce ziprasidonu s valproátem je nepravděpodobná kvůli nedostatku společných metabolických cest pro tyto dva léky. Ziprasidon podávaný jako doplněk k valproátu v udržovací studii u pacientů s bipolární poruchou neovlivnil průměrné terapeutické hladiny valproátu.
Jiná souběžná léková terapie
Populační farmakokinetická analýza pacientů se schizofrenií zařazených do kontrolovaných klinických studií neprokázala žádné klinicky významné farmakokinetické interakce s benztropinem, propranololem nebo lorazepamem.
Interakce s jídlem
Absolutní biologická dostupnost dávky 20 mg za podmínek nasycení je přibližně 60 %. Absorpce ziprasidonu se v přítomnosti potravy zvyšuje až dvojnásobně [viz KLINICKÁ FARMAKOLOGIE ].
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí
U starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. Analýzy 17 placebem kontrolovaných studií (modální trvání 10 týdnů), převážně u pacientů užívajících atypická antipsychotika, odhalily riziko úmrtí u pacientů léčených drogami 1,6 až 1,7krát vyšší než riziko úmrtí u pacientů léčených placebem. V průběhu typické 10týdenní kontrolované studie byla míra úmrtí u pacientů léčených léky asi 4,5 % ve srovnání s mírou asi 2,6 % ve skupině s placebem.
Ačkoli byly příčiny úmrtí různé, většina úmrtí se zdála být kardiovaskulárního (např. srdeční selhání, náhlá smrt) nebo infekční (např. zápal plic). GEODON není schválen pro léčbu pacientů s psychózou související s demencí. [vidět BOX VAROVÁNÍ , Cerebrovaskulární nežádoucí reakce, včetně mrtvice, u starších pacientů s psychózou související s demencí ].
Cerebrovaskulární nežádoucí reakce, včetně mrtvice, u starších pacientů s psychózou související s demencí
V placebem kontrolovaných studiích u starších pacientů s demencí byla u pacientů randomizovaných k léčbě risperidonem, aripiprazolem a olanzapinem vyšší výskyt cévní mozkové příhody a tranzitorní ischemické ataky, včetně smrtelné cévní mozkové příhody. GEODON není schválen pro léčbu pacientů s psychózou související s demencí [viz BOX VAROVÁNÍ a Zvýšená úmrtnost u starších pacientů s psychózou související s demencí ].
Prodloužení QT a riziko náhlé smrti
Je třeba se vyhnout použití ziprasidonu v kombinaci s jinými léky, o kterých je známo, že prodlužují QTc interval (viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ]. Kromě toho by kliničtí lékaři měli věnovat pozornost identifikaci jiných léků, u kterých bylo trvale pozorováno prodloužení QTc intervalu. Takové léky by neměly být předepisovány se ziprasidonem. Ziprasidon by se také neměl používat u pacientů s vrozeným syndromem dlouhého QT intervalu a u pacientů s anamnézou srdečních arytmií (viz KONTRAINDIKACE ].
Studie přímo porovnávající QT/QTc prodlužující účinek perorálního ziprasidonu s několika dalšími léky účinnými při léčbě schizofrenie byla provedena na pacientech dobrovolnících. V první fázi pokusu byly EKG získány v době maximální plazmatické koncentrace, když bylo léčivo podáváno samostatně. Ve druhé fázi studie byly EKG získány v době maximální plazmatické koncentrace, zatímco lék byl podáván společně s inhibitorem metabolismu léku CYP4503A4.
první fázi studie byla pro každý lék vypočtena průměrná změna QTc od výchozí hodnoty pomocí korekce založené na vzorku, která odstraňuje vliv srdeční frekvence na QT interval. Průměrné zvýšení QTc od výchozí hodnoty u ziprasidonu bylo přibližně o 9 až 14 ms vyšší než u čtyř srovnávacích léků (risperidon, olanzapin, quetiapin a haloperidol), ale bylo přibližně o 14 ms menší než prodloužení pozorované u thioridazinu.
Ve druhé fázi studie nebyl účinek ziprasidonu na délku QTc zesílen přítomností metabolického inhibitoru (ketokonazol 200 mg dvakrát denně).
placebem kontrolovaných studiích prodloužil perorální ziprasidon QTc interval ve srovnání s placebem přibližně o 10 ms při nejvyšší doporučené denní dávce 160 mg. V klinických studiích s perorálním ziprasidonem elektrokardiogramy 2/2988 (0,06 %) pacientů, kteří dostávali GEODON 80 mg, a 1/440 (0,23 %) pacientů, kteří dostávali placebo, odhalily QTc intervaly přesahující potenciálně klinicky relevantní práh 500 ms. U pacientů léčených ziprasidonem žádný případ nenaznačoval roli ziprasidonu. Jeden pacient měl v anamnéze prodloužené QTc a screeningové měření 489 ms; QTc bylo 503 ms během léčby ziprasidonem. Druhý pacient měl QTc 391 ms na konci léčby ziprasidonem a po přechodu na thioridazin zaznamenal QTc měření 518 a 593 ms.
Některé léky, které prodlužují QT/QTc interval, jsou spojovány s výskytem torsade de pointes a s náhlou nevysvětlitelnou smrtí. Vztah prodloužení QT k torsade de pointes je nejzřetelnější u větších nárůstů (20 ms a více), ale je možné, že menší prodloužení QT/QTc může také zvýšit riziko nebo jej zvýšit u citlivých jedinců. Ačkoli torsade de pointes nebylo v předmarketingových studiích pozorováno v souvislosti s užíváním ziprasidonu a zkušenosti jsou příliš omezené na to, aby bylo možné vyloučit zvýšené riziko, byly po uvedení přípravku na trh vzácně hlášeny (za přítomnosti mnoha matoucích faktorů) [viz NEŽÁDOUCÍ REAKCE ].
Studie hodnotící účinek intramuskulárního ziprasidonu na prodloužení QT/QTc intervalu s intramuskulárním haloperidolem jako kontrolou byla provedena na pacientech dobrovolnících. Ve studii byly EKG získány v době maximální plazmatické koncentrace po dvou injekcích ziprasidonu (20 mg, poté 30 mg) nebo haloperidolu (7,5 mg a poté 10 mg) podaných s odstupem čtyř hodin. Všimněte si, že dávka 30 mg intramuskulárního ziprasidonu je o 50 % vyšší než doporučená terapeutická dávka. Průměrná změna QTc od výchozí hodnoty byla vypočtena pro každý lék pomocí korekce založené na vzorku, která odstraňuje vliv srdeční frekvence na QT interval. Průměrné zvýšení QTc od výchozí hodnoty pro ziprasidon bylo 4,6 ms po první injekci a 12,8 ms po druhé injekci. Průměrné zvýšení QTc od výchozí hodnoty pro haloperidol bylo 6,0 ms po první injekci a 14,7 ms po druhé injekci. V této studii žádný pacient neměl QTc interval přesahující 500 ms.
Stejně jako u jiných antipsychotik a placeba byla u pacientů užívajících ziprasidon v doporučených dávkách hlášena náhlá nevysvětlitelná úmrtí. Zkušenosti před uvedením ziprasidonu na trh neodhalily zvýšené riziko mortality u ziprasidonu ve srovnání s jinými antipsychotiky nebo placebem, ale rozsah expozice byl omezený, zejména u léků používaných jako aktivní kontroly a placeba. Nicméně větší prodloužení délky QTc ziprasidonu ve srovnání s několika jinými antipsychotiky zvyšuje možnost, že riziko náhlé smrti může být větší u ziprasidonu než u jiných dostupných léků k léčbě schizofrenie. Tuto možnost je třeba vzít v úvahu při rozhodování mezi alternativními léčivými přípravky [viz INDIKACE ].
Určité okolnosti mohou zvýšit riziko výskytu torsade de pointes a/nebo náhlé smrti v souvislosti s užíváním léků prodlužujících QTc interval, včetně (1) bradykardie; (2) hypokalémie nebo hypomagnezémie; (3) současné užívání jiných léků, které prodlužují QTc interval; a (4) přítomnost vrozeného prodloužení QT intervalu.
Doporučuje se, aby pacienti, u kterých je zvažována léčba ziprasidonem a kteří jsou ohroženi významnými poruchami elektrolytů, zejména hypokalemií, měli výchozí hodnoty draslíku a hořčíku v séru. Hypokalémie (a/nebo hypomagnezémie) může zvýšit riziko prodloužení QT intervalu a arytmie. Hypokalémie může být důsledkem diuretické terapie, průjmu a dalších příčin. Pacienti s nízkou hladinou draslíku a/nebo hořčíku v séru by měli být před zahájením léčby doplněni těmito elektrolyty. U pacientů, u kterých byla během léčby ziprasidonem zavedena diuretická léčba, je nezbytné pravidelně monitorovat sérové elektrolyty. Trvale prodloužené QTc intervaly mohou také zvýšit riziko dalšího prodloužení a arytmie, ale není jasné, zda jsou rutinní screeningová EKG opatření účinná při detekci takových pacientů. Spíše je třeba se ziprasidonu vyhnout u pacientů s anamnézou významného kardiovaskulárního onemocnění, např. prodloužení QT intervalu, nedávný akutní infarkt myokardu, nekompenzované srdeční selhání nebo srdeční arytmie. Ziprasidon by měl být přerušen u pacientů, u kterých bylo zjištěno, že mají trvalé hodnoty QTc > 500 ms.
pacientů užívajících ziprasidon, kteří mají příznaky, které by mohly naznačovat výskyt torsade de pointes, např. závratě, bušení srdce nebo synkopu, by měl předepisující lékař zahájit další vyšetření, např. může být užitečné Holterovo monitorování.
Neuroleptický maligní syndrom (NMS)
V souvislosti s podáváním antipsychotik byl hlášen potenciálně fatální komplex symptomů, někdy označovaný jako neuroleptický maligní syndrom (NMS). Klinickými projevy NMS jsou hyperpyrexie, svalová rigidita, změněný duševní stav a známky autonomní nestability (nepravidelný puls nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatininfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní selhání ledvin.
Diagnostické hodnocení pacientů s tímto syndromem je složité. Při stanovení diagnózy je důležité vyloučit případy, kdy klinický obraz zahrnuje jak závažné onemocnění (např. zápal plic, systémová infekce atd.), tak neléčené nebo nedostatečně léčené extrapyramidové příznaky a symptomy (EPS). Další důležitá hlediska v diferenciální diagnostice zahrnují centrální anticholinergní toxicitu, úpal, horečku po drogách a primární patologii centrálního nervového systému (CNS).
Léčba NMS by měla zahrnovat: (1) okamžité vysazení antipsychotických léků a jiných léků, které nejsou nezbytné pro souběžnou léčbu; (2) intenzivní symptomatická léčba a lékařské sledování; a (3) léčba jakýchkoli doprovodných závažných zdravotních problémů, pro které je k dispozici specifická léčba. Neexistuje obecná shoda ohledně specifických farmakologických léčebných režimů pro NMS.
Vyžaduje-li pacient po zotavení z NMS léčbu antipsychotickými léky, je třeba pečlivě zvážit případné znovuzavedení lékové terapie. Pacient by měl být pečlivě sledován, protože byly hlášeny recidivy NMS.
Závažné kožní nežádoucí reakce
Léková reakce s eozinofilií a systémovými příznaky (DRESS)
Při expozici ziprasidonu byla hlášena léková reakce s eosinofilií a systémovými příznaky (DRESS). DRESS se skládá z kombinace tří nebo více z následujících: kožní reakce (jako je vyrážka nebo exfoliativní dermatitida), eozinofilie, horečka, lymfadenopatie a jedna nebo více systémových komplikací, jako je hepatitida, nefritida, pneumonitida, myokarditida a perikarditida. ŠATY jsou někdy fatální. Při podezření na DRESS přerušte léčbu ziprasidonem.
Jiné závažné kožní nežádoucí reakce
Při expozici ziprasidonu byly hlášeny další závažné kožní nežádoucí reakce, jako je Stevens-Johnsonův syndrom. Závažné kožní nežádoucí reakce jsou někdy fatální. Při podezření na závažné kožní nežádoucí účinky přerušte léčbu ziprasidonem.
Tardivní dyskineze
pacientů léčených antipsychotiky se může vyvinout syndrom potenciálně ireverzibilních, mimovolních, dyskinetických pohybů. Ačkoli se zdá, že prevalence syndromu je nejvyšší u starších osob, zejména u starších žen, není možné spoléhat na odhady prevalence, které by na začátku antipsychotické léčby předpověděly, u kterých pacientů se syndrom pravděpodobně rozvine. Není známo, zda se antipsychotické léčivé přípravky liší svým potenciálem způsobit tardivní dyskinezi.
Předpokládá se, že riziko rozvoje tardivní dyskineze a pravděpodobnost, že se stane ireverzibilní, se zvyšuje s délkou léčby a celkovou kumulativní dávkou antipsychotik podávaných pacientovi. Syndrom se však může vyvinout, i když mnohem méně často, po relativně krátkých obdobích léčby nízkými dávkami.
Není známa žádná léčba prokázaných případů tardivní dyskineze, ačkoli syndrom může částečně nebo úplně odeznít, pokud je antipsychotická léčba vysazena. Samotná antipsychotická léčba však může potlačit (nebo částečně potlačit) známky a symptomy syndromu, a tím případně maskovat základní proces. Účinek, který má symptomatická suprese na dlouhodobý průběh syndromu, není znám.
Vzhledem k těmto úvahám by měl být ziprasidon předepisován způsobem, který s největší pravděpodobností minimalizuje výskyt tardivní dyskineze. Chronická antipsychotická léčba by měla být obecně vyhrazena pro pacienty, kteří trpí chronickým onemocněním, o kterém (1) je známo, že reaguje na antipsychotika, a (2) pro které alternativní, stejně účinné, ale potenciálně méně škodlivé způsoby léčby nejsou dostupné nebo vhodné. U pacientů, kteří vyžadují chronickou léčbu, je třeba hledat nejnižší dávku a nejkratší dobu trvání léčby, která vede k uspokojivé klinické odpovědi. Potřeba pokračování v léčbě by měla být pravidelně přehodnocována.
Pokud se u pacienta užívajícího ziprasidon objeví známky a příznaky tardivní dyskineze, je třeba zvážit vysazení léku. Někteří pacienti však mohou vyžadovat léčbu ziprasidonem navzdory přítomnosti syndromu.
Metabolické změny
Atypická antipsychotika byla spojována s metabolickými změnami, které mohou zvýšit kardiovaskulární/cerebrovaskulární riziko. Tyto metabolické změny zahrnují hyperglykémii, dyslipidémii a nárůst tělesné hmotnosti. I když bylo prokázáno, že všechny léky ve třídě vyvolávají určité metabolické změny, každý lék má svůj vlastní specifický rizikový profil.
Hyperglykémie A Diabetes Mellitus
Hyperglykémie a diabetes mellitus, v některých případech extrémní a spojené s ketoacidózou nebo hyperosmolárním kómatem nebo smrtí, byly hlášeny u pacientů léčených atypickými antipsychotiky. U pacientů léčených přípravkem GEODON bylo hlášeno několik případů hyperglykémie nebo diabetu. Ačkoli bylo přípravkem GEODON léčeno méně pacientů, není známo, zda tato omezenější zkušenost není jediným důvodem pro nedostatek takových hlášení. Posouzení vztahu mezi atypickým užíváním antipsychotik a glukózovými abnormalitami je komplikováno možností zvýšeného základního rizika diabetes mellitus u pacientů se schizofrenií a zvyšujícím se výskytem diabetes mellitus v běžné populaci. Vzhledem k těmto matoucím faktorům není vztah mezi atypickým užíváním antipsychotik a nežádoucími účinky souvisejícími s hyperglykémií zcela objasněn. Přesné odhady rizik nežádoucích reakcí souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky nejsou k dispozici.
Pacienti s prokázanou diagnózou diabetes mellitus, u kterých byla zahájena léčba atypickými antipsychotiky, by měli být pravidelně sledováni, zda nedochází ke zhoršení glukózové kontroly. Pacienti s rizikovými faktory pro diabetes mellitus (např. obezita, rodinná anamnéza diabetu), kteří zahajují léčbu atypickými antipsychotiky, by měli podstoupit vyšetření glykémie nalačno na začátku léčby a pravidelně během léčby. U každého pacienta léčeného atypickými antipsychotiky je třeba sledovat příznaky hyperglykémie včetně polydipsie, polyurie, polyfagie a slabosti. Pacienti, u kterých se během léčby atypickými antipsychotiky objeví příznaky hyperglykémie, by měli podstoupit vyšetření glykémie nalačno. V některých případech hyperglykémie ustoupila po vysazení atypického antipsychotika; někteří pacienti však vyžadovali pokračování v antidiabetické léčbě i přes vysazení podezřelého léku.
Souhrnné údaje z krátkodobých, placebem kontrolovaných studií u schizofrenie a bipolární poruchy jsou uvedeny v tabulkách 1-4. Všimněte si, že pro studie s flexibilní dávkou jak u schizofrenie, tak u bipolární poruchy je každý subjekt kategorizován jako subjekt, který obdržel buď nízkou (20-40 mg BID) nebo vysokou (60-80 mg BID) dávku na základě modální denní dávky subjektu. V tabulkách znázorňujících kategorické změny jsou procenta (sloupec %) vypočtena jako 100x (n/N).

V dlouhodobých (alespoň 1 rok), placebem kontrolovaných studiích s flexibilním dávkováním u schizofrenie byla průměrná změna od výchozí hodnoty v náhodné glykémii pro ziprasidon 20-40 mg dvakrát denně -3,4 mg/dl (N=122); pro ziprasidon 60-80 mg BID bylo +1,3 mg/dl (N=10); a pro placebo byla +0,3 mg/dl (N=71).
Dyslipidémie
U pacientů léčených atypickými antipsychotiky byly pozorovány nežádoucí změny lipidů. Souhrnné údaje z krátkodobých, placebem kontrolovaných studií u schizofrenie a bipolární poruchy jsou uvedeny v tabulkách 5-8.
dlouhodobých (alespoň 1 rok) placebem kontrolovaných studiích s flexibilní dávkou u schizofrenie byla průměrná změna náhodných triglyceridů od výchozí hodnoty pro ziprasidon 20-40 mg dvakrát denně +26,3 mg/dl (N=15); pro ziprasidon 60-80 mg BID bylo -39,3 mg/dl (N=10); a pro placebo byla +12,9 mg/dl (N=9). V dlouhodobých (alespoň 1 rok) placebem kontrolovaných studiích s flexibilním dávkováním u schizofrenie byla průměrná změna náhodného celkového cholesterolu od výchozí hodnoty pro ziprasidon 20-40 mg dvakrát denně +2,5 mg/dl (N=14); pro ziprasidon 60-80 mg BID bylo -19,7 mg/dl (N=10); a pro placebo byla -28,0 mg/dl (N=9).
Přibývání na váze
Při užívání atypických antipsychotik bylo pozorováno zvýšení tělesné hmotnosti. Doporučuje se sledování hmotnosti. Souhrnné údaje z krátkodobých, placebem kontrolovaných studií u schizofrenie a bipolární poruchy jsou uvedeny v tabulkách 9-10.
dlouhodobých (alespoň 1 rok) placebem kontrolovaných studiích s flexibilní dávkou u schizofrenie byla průměrná změna od výchozí hmotnosti pro ziprasidon 20-40 mg dvakrát denně -2,3 kg (N=124); pro ziprasidon 60-80 mg BID bylo +2,5 kg (N=10); a pro placebo -2,9 kg (N=72). Ve stejných dlouhodobých studiích byl podíl subjektů s ≥ 7% zvýšením hmotnosti oproti výchozí hodnotě pro ziprasidon 20-40 mg dvakrát denně 5,6 % (N=124); pro ziprasidon 60-80 mg BID bylo 20,0 % (N=10) a pro placebo 5,6 % (N=72). V dlouhodobé (alespoň 1 rok), placebem kontrolované studii s fixní dávkou u schizofrenie byla průměrná změna od výchozí hmotnosti pro ziprasidon 20 mg dvakrát denně -2,6 kg (N=72); pro ziprasidon 40 mg BID bylo -3,3 kg (N=69); pro ziprasidon 80 mg BID byla -2,8 kg (N=70) a pro placebo -3,8 kg (N=70). Ve stejné dlouhodobé studii schizofrenie s fixní dávkou byl podíl subjektů s ≥ 7% zvýšením hmotnosti oproti výchozí hodnotě pro ziprasidon 20 mg dvakrát denně 5,6 % (N=72); pro ziprasidon 40 mg BID bylo 2,9 % (N=69); pro ziprasidon 80 mg dvakrát denně bylo 5,7 % (N=70) a pro placebo 2,9 % (N=70).
Schizofrenie
Podíl pacientů splňujících kritérium váhového přírůstku ≥ 7 % tělesné hmotnosti byl porovnán v souboru čtyř 4- a 6týdenních placebem kontrolovaných klinických studií schizofrenie, které odhalily statisticky významně vyšší výskyt přírůstku hmotnosti u ziprasidonu (10 % ) ve srovnání s placebem (4 %). U pacientů se ziprasidonem byl pozorován střední přírůstek hmotnosti 0,5 kg ve srovnání s žádnou střední změnou hmotnosti u pacientů s placebem. V tomto souboru klinických studií byl přírůstek hmotnosti hlášen jako nežádoucí účinek u 0,4 % pacientů se ziprasidonem a 0,4 % pacientů s placebem. Během dlouhodobé léčby ziprasidonem kategorizace pacientů na začátku na základě indexu tělesné hmotnosti (BMI) odhalila největší průměrný přírůstek hmotnosti a nejvyšší výskyt klinicky významného přírůstku hmotnosti (> 7 % tělesné hmotnosti) u pacientů s nízkou BMI (27). U pacientů s „nízkým“ výchozím BMI došlo k průměrnému přírůstku hmotnosti 1,4 kg, u pacientů s „normálním“ BMI nedošlo k žádné průměrné změně a u pacientů, kteří vstoupili do programu s „vysokým“ BMI, došlo k průměrnému úbytku hmotnosti 1,3 kg. BMI.
Bipolární porucha
Během 6měsíční placebem kontrolované bipolární udržovací studie u dospělých se ziprasidonem jako doplňkem k lithiu nebo valproátu byla incidence klinicky významného zvýšení tělesné hmotnosti (≥ 7 % tělesné hmotnosti) během dvojitě zaslepeného období 5,6 % pro oba ziprasidon a skupiny léčené placebem, které dokončily 6 měsíců pozorování relapsu. Interpretace těchto zjištění by měla vzít v úvahu, že do dvojitě zaslepené fáze studie vstoupili pouze pacienti, kteří adekvátně tolerovali ziprasidon, a během otevřené fáze došlo k podstatnému vysazení.
Vyrážka
předmarketingových studiích se ziprasidonem se asi u 5 % pacientů rozvinula vyrážka a/nebo kopřivka, přičemž asi u jedné šestiny těchto případů byla léčba ukončena. Výskyt vyrážky souvisel s dávkou ziprasidonu, i když nález lze vysvětlit také delší dobou expozice u pacientů s vyšší dávkou. Několik pacientů s vyrážkou mělo známky a příznaky souvisejícího systémového onemocnění, např. zvýšený počet bílých krvinek. U většiny pacientů došlo k okamžitému zlepšení při doplňkové léčbě antihistaminiky nebo steroidy a/nebo po vysazení ziprasidonu a u všech pacientů, u kterých se tyto reakce objevily, bylo hlášeno úplné uzdravení. Při objevení se vyrážky, u níž nelze určit alternativní etiologii, by měla být léčba ziprasidonem přerušena.
Ortostatická hypotenze
Ziprasidon může vyvolat ortostatickou hypotenzi spojenou se závratěmi, tachykardií a u některých pacientů se synkopou, zejména během počáteční titrace dávky, což pravděpodobně odráží jeho α1-adrenergní antagonistické vlastnosti. Synkopa byla hlášena u 0,6 % pacientů léčených ziprasidonem.
Ziprasidon by měl být používán se zvláštní opatrností u pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemická choroba srdeční v anamnéze, srdeční selhání nebo poruchy převodu), cerebrovaskulárním onemocněním nebo stavy, které by mohly pacienty predisponovat k hypotenzi (dehydratace, hypovolémie a léčba antihypertenzivy léky).
Falls
Antipsychotika (mezi které patří GEODON) mohou způsobit ospalost, posturální hypotenzi a motorickou a senzorickou nestabilitu, což může vést k pádům a následně ke zlomeninám nebo jiným zraněním. U pacientů s nemocemi, stavy nebo léky, které by mohly tyto účinky zhoršit, dokončete posouzení rizika pádu při zahájení antipsychotické léčby a opakovaně u pacientů na dlouhodobé antipsychotické léčbě.
Leukopenie, neutropenie a agranulocytóza
V klinických studiích a po uvedení přípravku na trh byly hlášeny případy leukopenie/neutropenie dočasně související s antipsychotiky. Byla také hlášena agranulocytóza (včetně fatálních případů).
Mezi možné rizikové faktory leukopenie/neutropenie patří již existující nízký počet bílých krvinek (WBC) a leukopenie/neutropenie v anamnéze. U pacientů s již existující nízkou WBC nebo s leukopenií/neutropenií vyvolanou léky v anamnéze by měl být během prvních několika měsíců léčby často monitorován kompletní krevní obraz (CBC) a měli by přerušit léčbu přípravkem GEODON při prvních známkách poklesu počtu WBC v nepřítomnosti dalších příčinných faktorů.
U pacientů s neutropenií je třeba pečlivě sledovat horečku nebo jiné příznaky či známky infekce a v případě výskytu těchto příznaků nebo známek je okamžitě léčit. Pacienti s těžkou neutropenií (absolutní počet neutrofilů
Záchvaty
Během klinických studií se záchvaty objevily u 0,4 % pacientů léčených ziprasidonem. Existovaly matoucí faktory, které mohly přispět k výskytu záchvatů v mnoha z těchto případů. Stejně jako u jiných antipsychotik by měl být ziprasidon používán s opatrností u pacientů s anamnézou záchvatů nebo se stavy, které potenciálně snižují práh záchvatů, např. Alzheimerova demence. Stavy, které snižují práh záchvatů, mohou být častější v populaci ve věku 65 let nebo starší.
Dysfagie
Dysmotilita a aspirace jícnu jsou spojovány s užíváním antipsychotik. Aspirační pneumonie je častou příčinou morbidity a mortality u starších pacientů, zejména u pacientů s pokročilou Alzheimerovou demencí. Ziprasidon a další antipsychotika by měly být používány opatrně u pacientů s rizikem aspirační pneumonie (viz BOX VAROVÁNÍ ].
Hyperprolaktinémie
Stejně jako jiné léky, které antagonizují dopaminové D2 receptory, i ziprasidon u lidí zvyšuje hladiny prolaktinu. Zvýšené hladiny prolaktinu byly také pozorovány ve studiích na zvířatech s touto sloučeninou a byly spojeny se zvýšením neoplazie mléčné žlázy u myší; podobný účinek nebyl pozorován u potkanů [viz Neklinická toxikologie ]. Experimenty na tkáňových kulturách ukazují, že přibližně jedna třetina lidských rakovin prsu je in vitro závislá na prolaktinu, což je faktor potenciální důležitosti, pokud se uvažuje o předepisování těchto léků u pacientky s dříve zjištěnou rakovinou prsu. Dosud provedené klinické studie ani epidemiologické studie neprokázaly souvislost mezi chronickým podáváním této třídy léků a tumorigenezí u lidí; dostupné důkazy jsou v tuto chvíli považovány za příliš omezené na to, aby byly průkazné.
Ačkoli byly u sloučenin zvyšujících hladinu prolaktinu hlášeny poruchy jako galaktorea, amenorea, gynekomastie a impotence, klinický význam zvýšených hladin prolaktinu v séru je u většiny pacientů neznámý. Dlouhodobá hyperprolaktinémie spojená s hypogonadismem může vést ke snížení hustoty kostí.
Potenciál pro kognitivní a motorické poruchy
Často hlášeným nežádoucím účinkem u pacientů léčených ziprasidonem byla somnolence. Ve 4- a 6-týdenních placebem kontrolovaných studiích byla ospalost hlášena u 14 % pacientů užívajících ziprasidon ve srovnání se 7 % pacientů užívajících placebo. Somnolence vedla v krátkodobých klinických studiích k přerušení léčby u 0,3 % pacientů. Vzhledem k tomu, že ziprasidon může narušit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být upozorněni na provádění činností vyžadujících duševní bdělost, jako je řízení motorového vozidla (včetně automobilů) nebo obsluha nebezpečných strojů, dokud si nebudou přiměřeně jisti, že léčba ziprasidonem nezpůsobuje působit na ně nepříznivě.
Priapismus
premarketingové databázi byl hlášen jeden případ priapismu. Zatímco vztah reakce k použití ziprasidonu nebyl stanoven, bylo hlášeno, že jiné léky s alfa-adrenergními blokujícími účinky vyvolávají priapismus a je možné, že ziprasidon může sdílet tuto kapacitu. Těžký priapismus může vyžadovat chirurgický zákrok.
Regulace tělesné teploty
Ačkoli to nebylo hlášeno u ziprasidonu v předmarketingových studiích, narušení schopnosti těla snižovat tělesnou teplotu bylo připisováno antipsychotikům. Při předepisování ziprasidonu pacientům, kteří budou mít stavy, které mohou přispívat ke zvýšení tělesné teploty, např. namáhavé cvičení, vystavení extrémnímu horku, souběžnou medikaci s anticholinergním účinkem nebo dehydrataci, se doporučuje náležitá opatrnost.
Sebevražda
Možnost pokusu o sebevraždu je vlastní psychotickému onemocnění nebo bipolární poruše a lékovou terapii by měl doprovázet pečlivý dohled nad vysoce rizikovými pacienty. Předpisy pro ziprasidon by měly být napsány na nejmenší množství tobolek v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Pacienti se souběžnými onemocněními
Klinické zkušenosti se ziprasidonem u pacientů s určitými souběžnými systémovými onemocněními jsou omezené [viz Použití u konkrétních populací ].
Ziprasidon nebyl hodnocen ani používán v žádném znatelném rozsahu u pacientů s nedávnou anamnézou infarktu myokardu nebo nestabilního srdečního onemocnění. Pacienti s těmito diagnózami byli vyloučeni z premarketingových klinických studií. Vzhledem k riziku prodloužení QTc intervalu a ortostatické hypotenzi při užívání ziprasidonu je třeba u kardiaků postupovat opatrně. [vidět Prodloužení QT intervalu a riziko náhlé smrti, ortostatická hypotenze ].
Laboratorní testy
Pacienti, u kterých je zvažována léčba ziprasidonem a kteří jsou vystaveni riziku významných poruch elektrolytů, by měli mít základní hodnoty draslíku a hořčíku v séru. Před zahájením léčby je třeba nahradit nízkou hladinu draslíku a hořčíku v séru. Pacienti, u kterých byla během léčby ziprasidonem zahájena léčba diuretiky, potřebují pravidelné monitorování sérového draslíku a hořčíku. Ziprasidon by měl být přerušen u pacientů, u kterých bylo zjištěno, že mají trvalé měření QTc > 500 ms (viz Prodloužení QT a riziko náhlé smrti ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Informace o administraci pro kapsle
Doporučte pacientům, aby tobolky GEODON užívali celé. Tobolky neotevírejte, nedrťte ani nežvýkejte. Poučte pacienty, aby užívali tobolky GEODON s jídlem pro optimální absorpci. Absorpce ziprasidonu se v přítomnosti potravy zvyšuje až dvojnásobně [viz DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
Prodloužení QTc
Poraďte pacientům, aby informovali své poskytovatele zdravotní péče o následujícím: Prodloužení QT v anamnéze; nedávný akutní infarkt myokardu; nekompenzované srdeční selhání; předepisování jiných léků, které prokázaly prodloužení QT; riziko významných elektrolytových abnormalit; a anamnéza srdeční arytmie [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Poučte pacienty, aby hlásili nástup jakýchkoli stavů, které je vystavují riziku významných poruch elektrolytů, zejména hypokalémie, včetně, ale bez omezení na zahájení diuretické léčby nebo dlouhotrvajícího průjmu. Kromě toho poučte pacienty, aby předepisujícímu lékaři hlásili příznaky, jako jsou závratě, bušení srdce nebo synkopa [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Závažné kožní nežádoucí reakce
Poučte pacienty, aby co nejdříve hlásili svému poskytovateli zdravotní péče jakékoli známky nebo příznaky, které mohou být spojeny s lékovou reakcí s eozinofilií a systémovými příznaky (DRESS) nebo se závažnými kožními nežádoucími reakcemi, jako je Stevens-Johnsonův syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těhotenství
Informujte těhotné ženy, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem GEODON otěhotní nebo plánují otěhotnět. Informujte pacienty, že GEODON může u novorozence způsobit extrapyramidové a/nebo abstinenční příznaky (agitovanost, hypertonie, hypotonie, třes, ospalost, dýchací potíže a poruchy příjmu potravy). Informujte pacienty, že existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených GEODONu během těhotenství [viz Použití u konkrétních populací ].
Laktace
Poraďte kojícím ženám, které používají GEODON 20 mg, aby sledovaly kojence na nadměrnou sedaci, podrážděnost, špatné krmení a extrapyramidové příznaky (třes a abnormální pohyby svalů) a aby vyhledaly lékařskou péči, pokud si všimnou těchto příznaků [viz Použití u konkrétních populací ].
Neplodnost
Informujte ženy s reprodukčním potenciálem, že GEODON 80 mg může zhoršit plodnost v důsledku zvýšení hladiny prolaktinu v séru. Účinky na plodnost jsou reverzibilní [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Celoživotní studie karcinogenity byly provedeny se ziprasidonem u potkanů Long Evans a myší CD-1. Ziprasidon byl podáván po dobu 24 měsíců v dietě v dávkách 2, 6 nebo 12 mg/kg/den potkanům a 50, 100 nebo 200 mg/kg/den myším (0,1 až 0,6 a 1 až 5krát vyšší než maximální doporučená dávka pro člověka (MRHD) 200 mg/den na základě mg/m2 tělesného povrchu, v daném pořadí). Ve studii na potkanech nebyl ve srovnání s kontrolami prokázán zvýšený výskyt nádorů. U samců myší nedošlo k žádnému zvýšení výskytu nádorů ve srovnání s kontrolami. U samic myší došlo k na dávce závislému zvýšení výskytu adenomu a karcinomu hypofýzy a adenokarcinomu mléčné žlázy ve všech testovaných dávkách (50 až 200 mg/kg/den nebo 1 až 5násobek MRHD na základě mg/m2 těla plocha povrchu). Po chronickém podávání jiných antipsychotik byly pozorovány proliferativní změny v hypofýze a mléčných žlázách hlodavců a jsou považovány za zprostředkované prolaktinem. Zvýšení sérového prolaktinu bylo pozorováno v 1měsíční dietní studii u samic, ale ne u samců myší při dávkách 100 a 200 mg/kg/den (nebo 2,5 a 5násobku MRHD na základě tělesného povrchu v mg/m2). Ziprasidon neměl žádný účinek na sérový prolaktin u potkanů v 5týdenní dietní studii v dávkách, které byly použity ve studii karcinogenity. Význam nálezů endokrinních nádorů zprostředkovaných prolaktinem u hlodavců pro lidské riziko není znám (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Mutageneze
Ziprasidon byl testován v Amesově testu bakteriálních mutací, in vitro testu mutace genu u savčích buněk myšího lymfomu, testu in vitro na chromozomální aberaci v lidských lymfocytech a testu in vivo na chromozomální aberaci v kostní dřeni myší. V Amesově testu byla reprodukovatelná mutagenní odpověď u jednoho kmene S. typhimurium bez metabolické aktivace. Pozitivní výsledky byly získány jak v in vitro testu mutace genu savčích buněk, tak in vitro testu chromozomálních aberací na lidských lymfocytech.
Zhoršení Plodnosti
Bylo prokázáno, že ziprasidon prodlužuje dobu do kopulace u potkanů Sprague-Dawley ve dvou studiích fertility a raného embryonálního vývoje v dávkách 10 až 160 mg/kg/den (0,5 až 8násobek MRHD 200 mg/den na základě mg/m2 těla plocha povrchu). Plodnost byla snížena na 160 mg/kg/den (8násobek MRHD na základě mg/m2 plochy povrchu těla). Při dávce 40 mg/kg/den (dvojnásobek MRHD vztaženo na mg/m2 plochy povrchu těla) nebyl pozorován žádný vliv na fertilitu. Zdá se, že účinek na fertilitu byl u samic, protože fertilita nebyla narušena, když samci, kterým bylo podáváno 160 mg/kg/den (8násobek MRHD na základě mg/m2 plochy povrchu těla), byli pářeni s neléčenými samicemi.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených atypickým antipsychotikům, včetně GEODON 40 mg, během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty kontaktováním Národního registru těhotenství pro atypická antipsychotika na čísle 1-866-961-2388 nebo online na adrese http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Shrnutí rizik
Novorozenci vystavení antipsychotikům, včetně GEODONu, během třetího trimestru, jsou vystaveni riziku extrapyramidových a/nebo abstinenčních příznaků po porodu (viz Klinické úvahy ). Celkově dostupné údaje z publikovaných epidemiologických studií těhotných žen vystavených ziprasidonu neprokázaly s lékem spojené riziko závažných vrozených vad, potratu nebo nepříznivých mateřských nebo fetálních výsledků (viz Data ). Existují rizika pro matku spojená s neléčenou schizofrenií nebo bipolární poruchou I a s expozicí antipsychotikům, včetně GEODONu, během těhotenství (viz Klinické úvahy ).
Ve studiích na zvířatech způsobovalo podávání ziprasidonu březím krysám a králíkům během organogeneze vývojovou toxicitu v dávkách podobných dávkám doporučeným pro člověka a byl teratogenní u králíků při 3násobku maximální doporučené dávky pro člověka (MRHD). Potkani vystavení ziprasidonu během březosti a laktace vykazovali zvýšenou perinatální mortalitu mláďat a opožděný neurobehaviorální a funkční vývoj potomstva v dávkách nižších nebo podobných jako terapeutické dávky u lidí (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Pro matku existuje riziko neléčené schizofrenie nebo bipolární poruchy I, včetně zvýšeného rizika relapsu, hospitalizace a sebevraždy. Schizofrenie a bipolární porucha I jsou spojeny se zvýšenými nepříznivými perinatálními následky, včetně předčasného porodu. Není známo, zda je to přímý důsledek onemocnění nebo jiných komorbidních faktorů.
Fetální/neonatální nežádoucí účinky
Extrapyramidové a/nebo abstinenční příznaky, včetně agitovanosti, hypertonie, hypotonie, třesu, ospalosti, respirační tísně a poruchy příjmu potravy, byly hlášeny u novorozenců, kteří byli vystaveni antipsychotikům, včetně GEODONu, během třetího trimestru těhotenství. Tyto příznaky mají různou závažnost. Sledujte u novorozenců extrapyramidové a/nebo abstinenční příznaky a příslušně je řiďte. Někteří novorozenci se zotavili během hodin nebo dnů bez specifické léčby; ostatní vyžadovali delší hospitalizaci.
Data
Lidská data
Publikovaná data z observačních studií, registrů narození a kazuistik o užívání atypických antipsychotik v těhotenství neuvádějí jednoznačnou souvislost s antipsychotiky a velkými vrozenými vadami. Retrospektivní kohortová studie z databáze Medicaid zahrnující 9258 žen vystavených antipsychotikům během těhotenství neprokázala celkové zvýšené riziko závažných vrozených vad.
Údaje o zvířatech
Když byl ziprasidon podáván březím králíkům během období organogeneze, byl pozorován zvýšený výskyt strukturálních abnormalit plodu (defekty komorového septa a jiné kardiovaskulární malformace a změny ledvin) v dávce 30 mg/kg/den (3násobek MRHD 200 mg/den na základě mg/m2 tělesného povrchu). Neexistoval žádný důkaz, který by naznačoval, že tyto vývojové účinky byly sekundární k mateřské toxicitě. Dávka bez účinku na vývoj byla 10 mg/kg/den (ekvivalentní MRHD založené na mg/m2 plochy povrchu těla). U potkanů byla pozorována embryofetální toxicita (snížená hmotnost plodu, opožděná osifikace skeletu) po podání 10 až 160 mg/kg/den (0,5 až 8násobek MRHD na základě mg/m2 plochy povrchu těla) během organogeneze nebo během březosti, ale nebyla prokázána teratogenita. Dávky 40 a 160 mg/kg/den (2 a 8násobek MRHD na základě mg/m2 tělesného povrchu) byly spojeny s toxicitou pro matku. Dávka bez účinku na vývoj je 5 mg/kg/den (0,2násobek MRHD na základě mg/m2 plochy povrchu těla).
potomků potkaních samic, kterým byly během březosti a laktace podávány dávky 10 mg/kg/den (0,5násobek MRHD, došlo ke zvýšení počtu mrtvých narozených mláďat a snížení postnatálního přežití během prvních 4 dnů laktace na mg/m2 tělesného povrchu) nebo větší. Při dávkách 5 mg/kg/den (0,2násobek MRHD na základě mg/m2 tělesného povrchu) nebo vyšších bylo pozorováno opoždění vývoje potomstva (snížená hmotnost mláďat) a neurobehaviorální funkční porucha (vzpřímení otevření očí). Pro tyto účinky nebyla stanovena hladina bez účinku.
Laktace
Shrnutí rizik
Omezené údaje z publikované kazuistiky naznačují přítomnost ziprasidonu v mateřském mléce. Ačkoli nejsou hlášeny žádné nežádoucí účinky na kojené dítě vystavené ziprasidonu prostřednictvím mateřského mléka, existují zprávy o nadměrné sedaci, podrážděnosti, špatném krmení a extrapyramidových symptomech (třes a abnormální pohyby svalů) u kojenců vystavených jiným atypickým antipsychotikům prostřednictvím prsu mléko (viz Klinické úvahy ). Neexistují žádné informace o účincích ziprasidonu na produkci mléka. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky GEODON a veškerými potenciálními nežádoucími účinky na kojené dítě z GEODON 20 mg nebo ze základního onemocnění matky.
Klinické úvahy
Kojenci vystavení GEODONu by měli být sledováni kvůli nadměrné sedaci, podrážděnosti, špatnému krmení a extrapyramidovým symptomům (třes a abnormální pohyby svalů).
Ženy a muži reprodukčního potenciálu
Neplodnost
Ženy
Na základě farmakologického působení ziprasidonu (antagonismus D2) může léčba přípravkem GEODON 40 mg vést ke zvýšení hladin prolaktinu v séru, což může vést k reverzibilnímu snížení plodnosti u žen s reprodukčním potenciálem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Neklinická toxikologie ].
Pediatrické použití
Bezpečnost a účinnost ziprasidonu u pediatrických pacientů nebyla stanovena.
Geriatrické použití
celkového počtu subjektů v klinických studiích ziprasidonu bylo 2,4 procenta 65 a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších osob. Nicméně přítomnost více faktorů, které mohou zvýšit farmakodynamickou odpověď na ziprasidon nebo způsobit horší toleranci či ortostázu, by měla u některých starších pacientů vést ke zvážení nižší počáteční dávky, pomalejší titrace a pečlivého sledování během počátečního dávkovacího období.
Ziprasidon intramuskulárně nebyl systematicky hodnocen u starších pacientů (65 let a více).
Renální poškození
Vzhledem k tomu, že ziprasidon je vysoce metabolizován a méně než 1 % léčiva se vylučuje v nezměněné podobě, není pravděpodobné, že by samotné poškození ledvin mělo zásadní vliv na farmakokinetiku ziprasidonu. Farmakokinetika ziprasidonu po 8 dnech dávkování 20 mg dvakrát denně byla podobná u subjektů s různým stupněm poškození ledvin (n=27) au subjektů s normální funkcí ledvin, což naznačuje, že úprava dávkování na základě stupně poškození ledvin není nutná . Ziprasidon nelze odstranit hemodialýzou.
Intramuskulární ziprasidon nebyl systematicky hodnocen u starších pacientů nebo u pacientů s poruchou funkce jater nebo ledvin. Vzhledem k tomu, že pomocná látka cyklodextrinu je odstraněna renální filtrací, ziprasidon intramuskulárně by měl být podáván s opatrností pacientům s poruchou funkce ledvin (viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Vzhledem k tomu, že ziprasidon je v podstatě vylučován játry, lze očekávat, že přítomnost poruchy funkce jater zvýší AUC ziprasidonu; studie s opakovanými dávkami 20 mg dvakrát denně po dobu 5 dnů u subjektů (n=13) s klinicky významnou (Child-Pugh třída A a B) cirhózou odhalila zvýšení AUC 0-12 o 13 % a 34 % u Childs- Pughova třída A a B, v tomto pořadí, ve srovnání s odpovídající kontrolní skupinou (n=14). U subjektů s cirhózou byl pozorován poločas 7,1 hodiny ve srovnání se 4,8 hodinami v kontrolní skupině.
Vliv na věk a pohlaví
Ve studii s opakovanými dávkami (8 dní léčby) zahrnující 32 subjektů nebyl žádný rozdíl ve farmakokinetice ziprasidonu mezi muži a ženami nebo mezi staršími (>65 let) a mladými (18 až 45 let) subjekty. Populační farmakokinetické hodnocení pacientů v kontrolovaných studiích navíc neodhalilo žádné klinicky významné rozdíly ve farmakokinetice ziprasidonu související s věkem nebo pohlavím. Úprava dávkování podle věku nebo pohlaví se proto nedoporučuje.
Kouření
Na základě studií in vitro využívajících lidské jaterní enzymy ziprasidon není substrátem pro CYP1A2; kouření by proto nemělo mít vliv na farmakokinetiku ziprasidonu. V souladu s těmito výsledky in vitro neodhalilo populační farmakokinetické hodnocení žádné významné farmakokinetické rozdíly mezi kuřáky a nekuřáky.
PŘEDÁVKOVAT
Lidská zkušenost
premarketingových studiích zahrnujících více než 5 400 pacientů a/nebo normálních subjektů bylo náhodné nebo úmyslné předávkování perorálním ziprasidonem dokumentováno u 10 pacientů. Všichni tito pacienti přežili bez následků. U pacienta užívajícího největší potvrzené množství, 3 240 mg, byly jedinými hlášenými příznaky minimální sedace, nezřetelná řeč a přechodná hypertenze (200/95).
Nežádoucí účinky hlášené při předávkování ziprasidonem zahrnovaly extrapyramidové symptomy, somnolenci, třes a úzkost. [vidět NEŽÁDOUCÍ REAKCE ]
Řízení Předávkování
V případě akutního předávkování zajistěte a udržujte dýchací cesty a zajistěte dostatečnou oxygenaci a ventilaci. Je třeba zajistit intravenózní přístup a zvážit výplach žaludku (po intubaci, je-li pacient v bezvědomí) a podání aktivního uhlí spolu s laxativem. Možnost otupění, záchvatu nebo dystonické reakce hlavy a krku po předávkování může vytvářet riziko aspirace s indukovaným zvracením.
Kardiovaskulární monitorování by mělo být zahájeno okamžitě a mělo by zahrnovat nepřetržité elektrokardiografické monitorování k detekci možných arytmií. Pokud je podávána antiarytmická léčba, disopyramid, prokainamid a chinidin s sebou nesou teoretické riziko aditivního prodloužení QT intervalu, které může být aditivní k účinkům ziprasidonu.
Hypotenze a oběhový kolaps by měly být léčeny vhodnými opatřeními, jako je intravenózní podávání tekutin. Pokud se k podpoře cév používají sympatomimetika, neměly by se používat epinefrin a dopamin, protože beta stimulace v kombinaci s α1 antagonismem spojeným se ziprasidonem může zhoršit hypotenzi. Podobně je rozumné očekávat, že alfa-adrenergní blokující vlastnosti bretylia mohou být aditivní k vlastnostem ziprasidonu, což vede k problematické hypotenzi.
případech závažných extrapyramidových příznaků by měla být podána anticholinergní medikace. Pro ziprasidon neexistuje žádné specifické antidotum a není dialyzovatelný. Je třeba vzít v úvahu možnost zapojení více léků. Pečlivý lékařský dohled a sledování by mělo pokračovat, dokud se pacient neuzdraví.
KONTRAINDIKACE
Prodloužení QT
Vzhledem k prodloužení QT intervalu v závislosti na dávce ziprasidonu a známému spojení fatálních arytmií s prodloužením QT u některých jiných léků je ziprasidon kontraindikován:
- u pacientů se známou anamnézou prodloužení QT intervalu (včetně vrozeného syndromu dlouhého QT intervalu)
- u pacientů s nedávným akutním infarktem myokardu
- u pacientů s nekompenzovaným srdečním selháním
Farmakokinetické/farmakodynamické studie mezi ziprasidonem a jinými léky, které prodlužují QT interval, nebyly provedeny. Aditivní účinek ziprasidonu a dalších léků prodlužujících QT interval nelze vyloučit. Proto by ziprasidon neměl být podáván s:
- dofetilid, sotalol, chinidin, jiná antiarytmika třídy Ia a III, mesoridazin, thioridazin, chlorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, moxifloxacin, halofantrin, meflochin, pentamidin, meflochin, pentamidin, arzenicko-levometyl-proxidát, arseniron, dotamidin, arsenicyl-promazin-proxidát.
- jiné léky, které prokázaly prodloužení QT intervalu jako jeden ze svých farmakodynamických účinků a mají tento účinek popsaný v úplné preskripční informaci jako kontraindikaci nebo upozornění v rámečku nebo tučně [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přecitlivělost
Ziprasidon je kontraindikován u jedinců se známou přecitlivělostí na přípravek.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku ziprasidonu v léčbě uvedených indikací by mohl být zprostředkován kombinací antagonismu dopaminu typu 2 (D2) a serotoninu typu 2 (5HT2).
Farmakodynamika
Ziprasidon se váže s relativně vysokou afinitou k dopaminu D2 a D3, serotoninu 5HT2A, 5HT2C, 5HT1A, 5HT1D a α1-adrenergním receptorům (Kis 4,8, 7,2, 0,4, 1,3, 3,4, 2, v tomto pořadí) a se střední afinitou k histaminovému Hl receptoru (Ki=47 nM). Ziprasidon je antagonista na receptorech D2, 5HT2A a 5HT1D a agonista na receptoru 5HT1A. Ziprasidon inhiboval synaptické zpětné vychytávání serotoninu a norepinefrinu. Nebyla prokázána žádná znatelná afinita k jiným testovaným receptorům/vazebným místům, včetně cholinergního muskarinového receptoru (IC50 >1 μM).
Farmakokinetika
Orální farmakokinetika
Aktivita ziprasidonu je primárně způsobena původním léčivem. Farmakokinetika opakovaných dávek ziprasidonu je úměrná dávce v rámci navrhovaného klinického rozmezí dávek a akumulace ziprasidonu je předvídatelná při opakovaném podávání. Eliminace ziprasidonu probíhá převážně prostřednictvím jaterního metabolismu s průměrným terminálním poločasem asi 7 hodin v rámci navrhovaného klinického dávkovacího rozmezí. Koncentrace v ustáleném stavu je dosaženo během jednoho až tří dnů po podání. Průměrná zdánlivá systémová clearance je 7,5 ml/min/kg. Je nepravděpodobné, že by ziprasidon interferoval s metabolismem léků metabolizovaných enzymy cytochromu P450.
Vstřebávání
Ziprasidon se po perorálním podání dobře vstřebává a dosahuje maximální plazmatické koncentrace za 6 až 8 hodin. Absolutní biologická dostupnost dávky 20 mg za podmínek nasycení je přibližně 60 %. Absorpce ziprasidonu se v přítomnosti potravy zvyšuje až dvojnásobně.
Rozdělení
Ziprasidon má průměrný zdánlivý distribuční objem 1,5 l/kg. Váže se z více než 99 % na plazmatické proteiny, primárně se váže na albumin a α1-kyselý glykoprotein. Vazba ziprasidonu na plazmatické bílkoviny in vitro nebyla změněna warfarinem nebo propranololem, dvěma léky s vysokou vazbou na proteiny, ani ziprasidon nezměnil vazbu těchto léků v lidské plazmě. Potenciál lékových interakcí se ziprasidonem v důsledku vytěsnění je tedy minimální.
Metabolismus a eliminace
Ziprasidon je po perorálním podání rozsáhle metabolizován, pouze malé množství se vylučuje močí (
Intramuskulární farmakokinetika
Systémová biologická dostupnost
Biologická dostupnost ziprasidonu podávaného intramuskulárně je 100 %. Po intramuskulárním podání jednotlivých dávek se vrcholové sérové koncentrace typicky objevují přibližně 60 minut po dávce nebo dříve a průměrný poločas (T½) se pohybuje od dvou do pěti hodin. Expozice se zvyšuje v závislosti na dávce a po třech dnech intramuskulárního podávání je pozorována malá akumulace.
Metabolismus a eliminace
Ačkoli metabolismus a eliminace i.m. ziprasidonu nebyly systematicky hodnoceny, neočekává se, že intramuskulární způsob podání změní metabolické cesty.
Klinické studie
Schizofrenie
Účinnost perorálního ziprasidonu v léčbě schizofrenie byla hodnocena v 5 placebem kontrolovaných studiích, 4 krátkodobých (4- a 6-týdenních) studiích a jedné udržovací studii. Všechny studie byly u dospělých hospitalizovaných pacientů, z nichž většina splnila kritéria DSM III-R pro schizofrenii. Každá studie zahrnovala 2 až 3 fixní dávky ziprasidonu a také placebo. Čtyři z 5 studií byly schopny odlišit ziprasidon od placeba; jedna krátkodobá studie ne. Ačkoli bylo v jedné ze tří krátkodobých studií jako srovnávací léčba zahrnuto jedno rameno s fixní dávkou haloperidolu, tato jediná studie nebyla dostatečná k tomu, aby poskytla spolehlivé a platné srovnání ziprasidonu a haloperidolu.
těchto studiích bylo použito několik nástrojů pro hodnocení psychiatrických příznaků a symptomů. Brief Psychiatric Rating Scale (BPRS) a Positive and Negative Syndrome Scale (PANSS) jsou oba vícepoložkové soupisy obecné psychopatologie, které se obvykle používají k hodnocení účinků protidrogové léčby u schizofrenie. Shluk psychóz BPRS (pojmová dezorganizace, halucinační chování, podezřívavost a neobvyklý myšlenkový obsah) je považován za zvláště užitečnou podmnožinu pro hodnocení aktivně psychotických schizofrenních pacientů. Druhé široce používané hodnocení, klinický globální dojem (CGI), odráží dojem zkušeného pozorovatele, který je plně obeznámen s projevy schizofrenie, o celkovém klinickém stavu pacienta. Kromě toho byla pro hodnocení negativních symptomů v jedné studii použita škála pro hodnocení negativních příznaků (SANS).
Následují výsledky zkoušek perorálního ziprasidonu u schizofrenie
- Ve 4týdenní placebem kontrolované studii (n=139) porovnávající 2 fixní dávky ziprasidonu (20 a 60 mg dvakrát denně) s placebem byla pouze dávka 60 mg lepší než placebo v celkovém skóre BPRS a závažnosti CGI skóre. Tato skupina s vyšší dávkou nebyla lepší než placebo u skupiny psychózy BPRS nebo u SANS.
- V 6týdenní placebem kontrolované studii (n=302) porovnávající 2 fixní dávky ziprasidonu (40 a 80 mg dvakrát denně) s placebem byly obě dávkové skupiny lepší než placebo v celkovém skóre BPRS, klastru psychózy BPRS, skóre závažnosti CGI a skóre PANSS celkové a negativní subškály. Přestože dávka 80 mg dvakrát denně měla numericky větší účinek než dávka 40 mg dvakrát denně, rozdíl nebyl statisticky významný.
- 6týdenní placebem kontrolované studii (n=419) porovnávající 3 fixní dávky ziprasidonu (20, 60 a 100 mg dvakrát denně) s placebem byly všechny tři dávkové skupiny lepší než placebo v celkovém skóre PANSS, tj. Celkové skóre BPRS, shluk psychózy BPRS a skóre závažnosti CGI. Pouze skupina s dávkou 100 mg dvakrát denně byla lepší než placebo ve skóre PANSS negativní subškály. V rozmezí dávek 20 mg dvakrát denně až 100 mg dvakrát denně nebyl žádný jasný důkaz o vztahu mezi dávkou a odpovědí.
- Ve 4týdenní placebem kontrolované studii (n=200) porovnávající 3 fixní dávky ziprasidonu (5, 20 a 40 mg dvakrát denně) nebyla žádná z dávkových skupin statisticky lepší než placebo v žádném sledovaném výsledku.
- Studie byla provedena u stabilních chronických nebo subchronických (CGI-S ≤5 na začátku) schizofrenních hospitalizovaných pacientů (n=294), kteří byli hospitalizováni nejméně dva měsíce. Po 3denním jednoduše zaslepeném placebu byly subjekty randomizovány do jedné ze 3 fixních dávek ziprasidonu (20 mg, 40 mg nebo 80 mg dvakrát denně) nebo placeba a byl u nich pozorován relaps. U pacientů byl pozorován „hrozící psychotický relaps“, definovaný jako skóre zlepšení CGI ≤6 (mnohem horší nebo mnohem horší) a/nebo skóre ≤6 (středně závažné) v položkách nepřátelství nebo nespoluprace v PANSS ve dvou po sobě jdoucích dnech. . Ziprasidon byl významně lepší než placebo v době do relapsu, bez signifikantního rozdílu mezi skupinami s různými dávkami. Nebyly k dispozici dostatečné údaje pro zkoumání podskupin populace na základě věku a rasy. Zkoumání podskupin populace na základě pohlaví neodhalilo žádnou rozdílnou citlivost.
Bipolární porucha I (akutní smíšené nebo manické epizody a udržovací léčba jako doplněk k lithiu nebo valproátu)
Akutní manické a smíšené epizody spojené s bipolární poruchou I
Účinnost ziprasidonu byla stanovena ve 2 placebem kontrolovaných, dvojitě zaslepených, 3týdenních monoterapeutických studiích u pacientů splňujících kritéria DSM-IV pro bipolární poruchu I, manickou nebo smíšenou epizodu s psychotickými rysy nebo bez nich. Primární hodnotící nástroje používané pro hodnocení manických symptomů v těchto studiích byly: (1) Mania Rating Scale (MRS), která je odvozena z Schedule for Affective Disorders and Schizophrenia-Change Version (SADS-CB) s položkami seskupenými jako manický syndrom subškála (povznesená nálada, menší potřeba spánku, nadměrná energie, nadměrná aktivita, grandiozita), subškála Chování a představy (podrážděnost, motorická hyperaktivita, zrychlená řeč, uspěchané myšlenky, špatný úsudek) a zhoršený vhled; a (2) škála Clinical Global Impression-Severity of Illness (CGI-S), která byla použita k posouzení klinické významnosti léčebné odpovědi.
Následují výsledky studií perorálního ziprasidonu u dospělých s bipolární poruchou I, manickou/smíšenou epizodou: ve 3týdenní placebem kontrolované studii (n=210) byla dávka ziprasidonu 40 mg dvakrát denně v den 1 a 80 mg dvakrát denně v den 2. Po dobu trvání studie byla povolena titrace v rozmezí 40-80 mg dvakrát denně (v přírůstcích 20 mg dvakrát denně). Ziprasidon byl významně účinnější než placebo ve snížení celkového skóre MRS a skóre CGI-S. Průměrná denní dávka ziprasidonu v této studii byla 132 mg. Ve druhé 3týdenní placebem kontrolované studii (n=205) byla dávka ziprasidonu 40 mg dvakrát denně v den 1. Byla povolena titrace v rozmezí 40-80 mg dvakrát denně (v přírůstcích po 20 mg dvakrát denně) po dobu studia (počínaje 2. dnem). Ziprasidon byl významně účinnější než placebo ve snížení celkového skóre MRS a skóre CGI-S. Průměrná denní dávka ziprasidonu v této studii byla 112 mg.
Udržovací terapie
Účinnost ziprasidonu jako přídavné terapie k lithiu nebo valproátu v udržovací léčbě bipolární poruchy I byla prokázána v placebem kontrolované studii u pacientů, kteří splnili kritéria DSM-IV pro bipolární poruchu I. Studie zahrnovala pacienty, jejichž poslední epizoda byla manická nebo smíšená, s psychotickými rysy nebo bez nich. V otevřené fázi bylo požadováno, aby byli pacienti stabilizováni na ziprasidonu s lithiem nebo kyselinou valproovou po dobu nejméně 8 týdnů, aby mohli být randomizováni. Ve dvojitě zaslepené randomizované fázi pacienti pokračovali v léčbě lithiem nebo kyselinou valproovou a byli randomizováni do skupiny buď ziprasidon (podávaný dvakrát denně v celkové dávce 80 mg až 160 mg denně) nebo placebo. Obecně platí, že v udržovací fázi pacienti pokračovali ve stejné dávce, na které byli stabilizováni během stabilizační fáze. Primárním cílovým parametrem v této studii byla doba do recidivy epizody nálady (manické, smíšené nebo depresivní epizody) vyžadující intervenci, která byla definována jako kterákoli z následujících situací: přerušení kvůli epizodě nálady, klinická intervence pro epizodu nálady (např. zahájení léčby nebo hospitalizace), nebo skóre Mania Rating Scale ≥ 18 nebo skóre MADRS ≥ 18 (při 2 po sobě jdoucích hodnoceních s odstupem maximálně 10 dnů). V otevřeném období stabilizace bylo léčeno celkem 584 subjektů. V období dvojitě zaslepené randomizace bylo 127 subjektů léčeno ziprasidonem a 112 subjektů bylo léčeno placebem. Ziprasidon byl lepší než placebo v prodloužení doby do recidivy epizody nálady. Typy pozorovaných relapsů zahrnovaly depresivní, manické a smíšené epizody. Depresivní, manické a smíšené epizody tvořily 53 %, 34 % a 13 % z celkového počtu případů relapsu ve studii.
Akutní Léčba Agitovanosti U Schizofrenie
Účinnost intramuskulárního ziprasidonu v léčbě agitovaných schizofrenních pacientů byla prokázána ve dvou krátkodobých, dvojitě zaslepených studiích se schizofrenními subjekty, které výzkumníci považovali za „akutně agitované“ a potřebovali IM antipsychotikum. Kromě toho bylo požadováno, aby pacienti měli skóre 3 nebo více alespoň ve 3 z následujících položek PANSS: úzkost, napětí, nepřátelství a vzrušení. Účinnost byla hodnocena analýzou plochy pod křivkou (AUC) stupnice Behavioral Activity Rating Scale (BARS) a hodnocení závažnosti klinického globálního dojmu (CGI). BARS je sedmibodová stupnice se skóre v rozmezí od 1 (obtížné nebo neschopné vzbudit) do 7 (násilné, vyžaduje zdrženlivost). Pacienti' skóre na BARS na začátku bylo většinou 5 (známky zjevné aktivity [fyzické nebo verbální], uklidňuje se pokyny) a podle zjištění výzkumníků vykazovalo stupeň agitovanosti, který zaručoval intramuskulární terapii. V hodnocení BARS bylo jen málo pacientů s hodnocením vyšším než 5, protože nejvážněji rozrušení pacienti obecně nebyli schopni poskytnout informovaný souhlas s účastí v klinických studiích před uvedením na trh.
Obě studie porovnávaly vyšší dávky ziprasidonu intramuskulárně s kontrolní dávkou 2 mg. V jedné studii byla vyšší dávka 20 mg, kterou bylo možné podat až 4krát během 24 hodin studie, v intervalech mezi dávkami ne kratších než 4 hodiny. V druhé studii byla vyšší dávka 10 mg, kterou bylo možné podat až 4krát během 24 hodin studie, v intervalech mezi dávkami ne kratších než 2 hodiny.
Následují výsledky intramuskulárních zkoušek ziprasidonu
INFORMACE PRO PACIENTA
GEODON® Kapsle (ziprasidon)
Informace pro pacienty užívající GEODON nebo jejich pečovatele
Tento souhrn obsahuje důležité informace o GEODONu. Nemá to nahrazovat pokyny vašeho lékaře. Před užitím přípravku GEODON si pečlivě přečtěte tyto informace. Zeptejte se svého lékaře nebo lékárníka, pokud některým z těchto informací nerozumíte nebo pokud se chcete o GEODONu dozvědět více.
Co je GEODON 80 mg?
GEODON je typ léku na předpis nazývaný psychotropní, také známý jako atypické antipsychotikum. GEODON lze použít k léčbě příznaků schizofrenie a akutních manických nebo smíšených epizod spojených s bipolární poruchou. GEODON 80 mg lze také použít jako udržovací léčbu bipolární poruchy, pokud je přidán k lithiu nebo valproátu.
Kdo by měl užívat GEODON 20 mg?
Pouze váš lékař může vědět, zda je GEODON pro vás vhodný. GEODON 20 mg Vám může být předepsán, pokud máte schizofrenii nebo bipolární poruchu.
Příznaky schizofrenie mohou zahrnovat:
- slyšet hlasy, vidět věci nebo cítit věci, které tam nejsou (halucinace)
- přesvědčení, která nejsou pravdivá (klamy)
- neobvyklá podezřívavost (paranoia)
- odstup od rodiny a přátel
Příznaky manických nebo smíšených epizod bipolární poruchy mohou zahrnovat:
- extrémně povznesená nebo podrážděná nálada
- zvýšená energie, aktivita a neklid
- závodní myšlenky nebo mluvení velmi rychle
- snadno vyrušitelný
- malá potřeba spánku
Pokud zaznamenáte odpověď na GEODON 40 mg, vaše příznaky se mohou zlepšit. Pokud budete pokračovat v užívání přípravku GEODON 40 mg, je menší šance, že se vaše příznaky vrátí. Nepřestávejte užívat tobolky, i když se cítíte lépe, aniž byste to nejprve probrali se svým lékařem.
Je také důležité mít na paměti, že GEODON 40 mg tobolky by se měly užívat s jídlem.
Jaké jsou nejdůležitější bezpečnostní informace, které bych měl vědět o přípravku GEODON 20 mg?
GEODON není schválen pro léčbu pacientů s psychózou související s demencí. Starší pacienti s diagnózou psychózy související s demencí léčení antipsychotiky mají zvýšené riziko úmrtí ve srovnání s pacienty, kteří jsou léčeni placebem (cukrovou pilulkou).
GEODON je účinný lék k léčbě příznaků schizofrenie a manických nebo smíšených epizod bipolární poruchy. Jedním z potenciálních vedlejších účinků však je, že může změnit způsob, jakým elektrický proud ve vašem srdci funguje více než některé jiné léky. Změna je malá a není známo, zda to bude škodlivé, ale některé jiné léky, které způsobují tento druh změny, způsobily ve vzácných případech nebezpečné abnormality srdečního rytmu. Z tohoto důvodu by měl být GEODON používán pouze poté, co váš lékař zvážil toto riziko pro GEODON oproti rizikům a přínosům jiných léků dostupných pro léčbu schizofrenie nebo bipolárních manických a smíšených epizod.
Vaše riziko nebezpečných změn srdečního rytmu se může zvýšit, pokud užíváte některé další léky a pokud již máte určité abnormální srdeční stavy. Proto je důležité informovat svého lékaře o všech dalších lécích, které užíváte, včetně léků bez předpisu, doplňků stravy a rostlinných léků. Musíte také informovat svého lékaře o jakýchkoli srdečních problémech, které máte nebo jste měl(a).
Kdo by NEMĚL užívat GEODON 40 mg?
Starší pacienti s diagnózou psychózy související s demencí. GEODON není schválen pro léčbu těchto pacientů.
Je třeba se vyhnout všemu, co může zvýšit pravděpodobnost abnormality srdečního rytmu. Proto neužívejte GEODON 80 mg, pokud:
- Máte určitá srdeční onemocnění, například syndrom dlouhého QT intervalu, nedávný srdeční infarkt, závažné srdeční selhání nebo určité nepravidelnosti srdečního rytmu (prodiskutujte podrobnosti se svým lékařem)
- současné době užíváte léky, které by se neměly užívat v kombinaci se ziprasidonem, například dofetilid, sotalol, chinidin, další antiarytmika třídy Ia a III, mezoridazin, thioridazin, chlorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, halofoxifloxacin meflochin, pentamidin, oxid arsenitý, levomethadylacetát, dolasetron mesylát, probukol nebo takrolimus.
Co říci svému lékaři, než začnete GEODON
Pouze váš lékař může rozhodnout, zda je GEODON pro vás vhodný. Před zahájením léčby přípravkem GEODON nezapomeňte svému lékaři sdělit, pokud:
- jste měl(a) jakýkoli problém s tím, jak Vaše srdce bije, nebo jakékoli onemocnění nebo onemocnění související se srdcem
- jakákoliv rodinná anamnéza srdečního onemocnění, včetně nedávného srdečního infarktu
- měli jakýkoli problém s mdlobou nebo závratí
- užíváte nebo jste v nedávné době užíval(a) jakékoli léky na předpis
- užíváte jakékoli volně prodejné léky, které si můžete koupit bez lékařského předpisu, včetně přírodních/rostlinných přípravků
- máte nějaké problémy s játry
- jste těhotná, mohla byste být těhotná nebo plánujete otěhotnět
- kojíte nebo plánujete kojit
- jsou alergičtí na jakékoli léky
- jste někdy měli alergickou reakci na ziprasidon nebo na kteroukoli další složku přípravku GEODON 20 mg tobolky. Požádejte svého lékaře nebo lékárníka o seznam těchto složek
- máte nízké hladiny draslíku nebo hořčíku v krvi
Váš lékař může chtít, abyste podstoupil další laboratorní testy, aby zjistil, zda je pro vás GEODON 40 mg vhodnou léčbou.
GEODON a další léky
Existují některé léky, které mohou být nebezpečné při užívání přípravku GEODON, a existují některé léky, které mohou ovlivnit účinek přípravku GEODON 40 mg. Zatímco jste na GEODONu, poraďte se se svým lékařem dříve, než začnete užívat jakékoli nové léky na předpis nebo volně prodejné léky, včetně přírodních/rostlinných léků.
Jak se GEODON užívá
- Užívejte GEODON pouze podle pokynů svého lékaře.
- Tobolky GEODON spolkněte celé. Tobolky nežvýkejte, nedrťte ani neotevírejte.
- Užívejte GEODON 40 mg tobolky s jídlem.
- Nejlepší je užívat GEODON 80 mg každý den ve stejnou dobu.
- Účinek přípravku GEODON 80 mg může trvat několik týdnů. Je důležité být trpělivý.
- Neměňte dávku ani nepřestávejte užívat svůj lék bez souhlasu lékaře.
- Nezapomeňte užívat tobolky, i když se budete cítit lépe.
Možné vedlejší účinky
Protože tyto problémy mohou znamenat, že máte abnormalitu srdečního rytmu, kontaktujte svého lékaře IHNED jestli ty:
- Omdlet nebo ztratit vědomí
- Vnímejte změnu ve způsobu, jakým vaše srdce bije (bušení srdce)
Časté nežádoucí účinky přípravku GEODON zahrnují následující a měly by být také projednány se svým lékařem, pokud se vyskytnou:
- Pocit neobvykle unavený nebo ospalý
- Nevolnost nebo žaludeční nevolnost
- Zácpa
- Závrať
- Neklid
- Abnormální pohyby svalů, včetně třesu, šoupání a nekontrolovaných mimovolních pohybů
- Průjem
- Vyrážka
- Zvýšený kašel / rýma
Pokud se u Vás objeví jakékoli nežádoucí účinky, které se Vás týkají, poraďte se se svým lékařem. Je zvláště důležité informovat svého lékaře, pokud máte průjem, zvracení nebo jiné onemocnění, které může způsobit ztrátu tekutin. Váš lékař může chtít zkontrolovat vaši krev, aby se ujistil, že máte po takových onemocněních správné množství důležitých solí.
Pro seznam všech nežádoucích účinků, které byly hlášeny, si vyžádejte od svého lékaře nebo lékárníka příbalovou informaci GEODON Professional.
Co dělat při předávkování
V případě předávkování okamžitě zavolejte svého lékaře nebo toxikologické centrum nebo jděte na nejbližší pohotovost.
Další důležité bezpečnostní informace
Závažný stav nazývaný neuroleptický maligní syndrom (NMS) se může objevit u všech antipsychotických léků včetně GEODONu. Mezi příznaky NMS patří velmi vysoká horečka, ztuhlé svaly, třes, zmatenost, pocení nebo zvýšená srdeční frekvence a krevní tlak. NMS je vzácný, ale závažný vedlejší účinek, který může být smrtelný. Informujte proto svého lékaře, pokud zaznamenáte některý z těchto příznaků.
U ziprasidonu se může objevit léková reakce s opožděným nástupem, nazývaná léková reakce s eozinofilií a systémovými příznaky (DRESS). Příznaky DRESS mohou zahrnovat vyrážku, horečku a zduření lymfatických uzlin. U ziprasidonu se mohou vyskytnout další závažné kožní nežádoucí reakce (SCAR), jako je Stevens-Johnsonův syndrom. Příznaky Stevens-Johnsonova syndromu mohou zahrnovat vyrážku s puchýři, která může zahrnovat vředy v ústech, odlupování kůže, horečku a terčovité skvrny na kůži. ŠATY a další JIZVY jsou někdy fatální; proto okamžitě informujte svého lékaře, pokud zaznamenáte některý z těchto příznaků.
pacientů léčených atypickými antipsychotiky byly hlášeny nežádoucí účinky související s vysokou hladinou cukru v krvi (hyperglykémie), někdy závažné. U pacientů léčených přípravkem GEODON bylo hlášeno několik případů hyperglykémie nebo diabetu a není známo, zda je přípravek GEODON spojen s těmito reakcemi. U pacientů léčených atypickým antipsychotikem je třeba sledovat příznaky hyperglykémie.
U přípravku GEODON se mohou objevit závratě způsobené poklesem krevního tlaku, zvláště když poprvé začnete užívat tento lék nebo když se zvýší dávka. Pokud k tomu dojde, dávejte pozor, abyste nevstávali příliš rychle, a promluvte si o problému se svým lékařem.
Před užitím přípravku GEODON informujte svého lékaře, pokud ano
- jste těhotná nebo plánujete otěhotnět.
- Pokud otěhotníte během užívání přípravku GEODON 80 mg, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro atypická antipsychotika. Můžete se zaregistrovat na telefonním čísle 1-866-961-2388 nebo na adrese http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- kojíte nebo plánujete kojit. GEODON 40 mg může přecházet do vašeho mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení vašeho dítěte, pokud dostáváte GEODON.
Protože GEODON 80 mg může způsobit ospalost, buďte opatrní při obsluze strojů nebo řízení motorových vozidel.
Vzhledem k tomu, že léky stejné třídy jako GEODON mohou narušovat schopnost těla přizpůsobit se teplu, je nejlepší vyhýbat se situacím zahrnujícím vysokou teplotu nebo vlhkost.
Během užívání přípravku GEODON je nejlepší se vyhnout konzumaci alkoholických nápojů.
Zavolejte svému lékaři ihned jestliže užijete větší množství přípravku GEODON, než Vám předepsal lékař.
Nebylo prokázáno, že GEODON je bezpečný nebo účinný při léčbě dětí a dospívajících mladších 18 let.
Uchovávejte GEODON 80 mg a všechny léky mimo dosah dětí.
Jak uchovávat GEODON
Uchovávejte tobolky GEODON 20 mg při pokojové teplotě (59 °F až 86 °F nebo 15 °C až 30 °C).
Pro více informací o GEODON
Tento list je pouze shrnutím. GEODON 20 mg je lék na předpis a pouze váš lékař může rozhodnout, zda je pro vás vhodný. Máte-li jakékoli dotazy nebo chcete více informací o přípravku GEODON, promluvte si se svým lékařem nebo lékárníkem. Můžete také navštívit www.geodon.com.
Označení tohoto produktu mohlo být aktualizováno. Nejnovější informace o předepisování naleznete na www.pfizer.com
