Desyrel 25mg, 50mg, 100mg Trazodone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Desyrel 100 mg a jak se používá?
Desyrel 100 mg je lék na předpis používaný u dospělých k léčbě velké depresivní poruchy (MDD). Desyrel patří do třídy léků známých jako SSRI (nebo selektivní inhibitory zpětného vychytávání serotoninu).
Jaké jsou možné vedlejší účinky přípravku Desyrel?
Desyrel může způsobit závažné nežádoucí účinky nebo smrt, včetně:
- serotoninový syndrom. Příznaky serotoninového syndromu zahrnují: neklid, halucinace, problémy s koordinací, rychlý srdeční tep, napjaté svaly, potíže s chůzí, pocení, horečka, nevolnost, zvracení a průjem.
- Nepravidelný nebo rychlý srdeční tep nebo mdloby (prodloužení QT intervalu)
- Nízký krevní tlak. Pociťujete závratě nebo mdloby, když změníte polohu (přejdete ze sedu do stoje)
- Neobvyklé modřiny nebo krvácení
- Erekce trvající déle než 6 hodin (priapismus)
- Pocit povznesení nebo velmi dobrá nálada, poté podrážděnost nebo přílišná energie, pocit, že musíte dál mluvit nebo nespát (mánie).
- Abstinenční příznaky. Příznaky abstinence mohou zahrnovat úzkost, neklid a problémy se spánkem. Nepřestávejte užívat Desyrel, aniž byste si promluvili se svým poskytovatelem zdravotní péče.
- Vizuální problémy.
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
- Nízká hladina sodíku v krvi (hyponatremie). Příznaky hyponatremie zahrnují: bolest hlavy, pocit slabosti, pocit zmatenosti, potíže se soustředěním, problémy s pamětí a pocit nejistoty při chůzi.
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Desyrel patří:
- otok
- rozmazané vidění
- závrať
- ospalost
- únava
- průjem
- ucpaný nos
- ztráta váhy
Toto nejsou všechny možné vedlejší účinky přípravku Desyrel. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
SEBEvražedné myšlenky a chování
Antidepresiva v krátkodobých studiích zvyšovala riziko sebevražedných myšlenek a chování u pediatrických a mladých dospělých pacientů. Pečlivě sledujte všechny pacienty léčené antidepresivy na klinické zhoršení a na výskyt sebevražedných myšlenek a chování (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ). DESYREL není schválen pro použití u pediatrických pacientů (viz Použití u specifických populací ).
POPIS
Tablety DESYREL (trazodon hydrochlorid) pro perorální podání obsahují trazodon hydrochlorid, selektivní inhibitor zpětného vychytávání serotoninu a antagonistu receptoru 5HT2. DESYREL je derivát triazolopyridinu označený jako 2-[3-[4-(3-chlorfenyl)-1-piperazinyl]propyl]-1,2,4-triazolo[4,3-a]pyridin-3(2H)-on hydrochlorid. Je to bílý krystalický prášek bez zápachu, který je volně rozpustný ve vodě. Strukturní vzorec je reprezentován následovně:
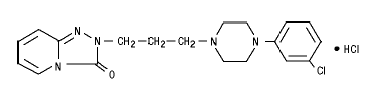
Molekulární vzorec : C19H22CIN5O • HCl Molekulární váha : 408,33
Každá tableta pro perorální podání obsahuje 50 mg, 100 mg, 150 mg nebo 300 mg trazodon hydrochloridu, USP. Kromě toho každá tableta obsahuje následující neaktivní složky:
50 mg a 100 mg: kukuřičný škrob, hydrogenfosforečnan vápenatý, hypromelóza, monohydrát laktózy, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, povidon, sodná sůl glykolátu škrobu a triacetin
150 mg: stearát hořečnatý, mikrokrystalická celulóza, předbobtnalý škrob a kyselina stearová
300 mg: stearát hořečnatý, mikrokrystalická celulóza, předbobtnalý škrob, sodná sůl glykolátu škrobu a kyselina stearová
INDIKACE
DESYREL® je indikován k léčbě velké depresivní poruchy (MDD) u dospělých.
DÁVKOVÁNÍ A PODÁVÁNÍ
Výběr dávky
Doporučuje se počáteční dávka 150 mg/den v rozdělených dávkách. Dávkování by mělo být zahájeno nízkou dávkou a mělo by se postupně zvyšovat s ohledem na klinickou odpověď a jakékoli známky intolerance. Výskyt ospalosti může vyžadovat podání větší části denní dávky před spaním nebo snížení dávky.
Dávku lze zvyšovat o 50 mg/den každé 3 až 4 dny. Maximální dávka pro ambulantní pacienty by obvykle neměla překročit 400 mg/den v rozdělených dávkách. Hospitalizovaným pacientům (tj. pacientům se závažnější depresí) může být podáváno až 600 mg/den v rozdělených dávkách, ale ne více.
Jakmile je dosaženo adekvátní odpovědi, může být dávka postupně snižována s následnou úpravou v závislosti na terapeutické odpovědi.
Důležité pokyny pro administraci
DESYREL® lze spolknout celý nebo podat jako polovinu tablety rozlomením tablety podél dělicí rýhy.
DESYREL se má užívat krátce po jídle nebo lehké svačině.
Obrazovka pro bipolární poruchu před zahájením léčby DESYREL
Před zahájením léčby přípravkem DESYREL 50 mg nebo jiným antidepresivem proveďte screening pacientů na osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přechod na nebo z antidepresiv s inhibitorem monoaminooxidázy
Mezi vysazením antidepresiva inhibitoru monoaminooxidázy (MAOI) a zahájením léčby přípravkem DESYREL musí uplynout alespoň 14 dní. Kromě toho musí po vysazení přípravku DESYREL 100 mg uplynout alespoň 14 dní před zahájením léčby antidepresivem MAOI [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doporučené dávkování pro současné užívání se silnými inhibitory nebo induktory CYP3A4
Současné podávání se silnými inhibitory CYP3A4
Zvažte snížení dávky DESYREL 25 mg na základě snášenlivosti, pokud je DESYREL 100 mg podáván společně se silným inhibitorem CYP3A4 (viz DROGOVÉ INTERAKCE ].
Současné podávání se silnými induktory CYP3A4
Zvažte zvýšení dávky DESYREL 100 mg na základě terapeutické odpovědi, když je DESYREL 100 mg podáván společně se silným induktorem CYP3A4 (viz DROGOVÉ INTERAKCE ].
Přerušení léčby přípravkem DESYREL
Nežádoucí účinky se mohou objevit po vysazení DESYRELu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Postupně snižujte dávkování, spíše než náhlé vysazení DESYRELu, kdykoli je to možné.
JAK DODÁVÁNO
Dávkové formy A Síly
- 50 mg: bílá, kulatá, potahovaná tableta s půlicí rýhou; půlené s vyraženým „50“ a „P 005“ na jedné straně a hladké na druhé straně.
- 100 mg: bílá, kulatá, potahovaná tableta s půlicí rýhou; půlené s vyraženým „100“ a „P 006“ na jedné straně a hladké na druhé straně.
- 150 mg: bílá, obdélníková tableta s půlicí rýhou; třísek na obou stranách, s vyraženým „P“ a „007“ na jedné straně a „50“, „50“, „50“ na druhé straně, s půlicí na každém okraji.
- 300 mg: bílá, obdélníková tableta s půlicí rýhou; rozpůlený na jedné straně s vyraženým „100“, „100“, „100“ a rozpůlený na druhé straně s vyraženým „P“ a „008“.
Skladování A Manipulace
50 mg Bílá, kulatá, potahovaná tableta s půlicí rýhou; půlené s vyraženým „50“ a „P 005“ na jedné straně a hladké na druhé straně. Láhve po 100 NDC 58463-005-01
100 mg : Bílá, kulatá, potahovaná tableta s půlicí rýhou; půlené s vyraženým „100“ a „P 006“ na jedné straně a hladké na druhé straně. Láhve po 100 NDC 58463-006-01
150 mg : Bílá, obdélníková tableta s půlicí rýhou; třísek na obou stranách, s vyraženým „P“ a „007“ na jedné straně a „50“, „50“, „50“ na druhé straně, s půlicí na každém okraji. Láhve po 100 NDC 58463-007-01
300 mg : Bílá, obdélníková tableta s půlicí rýhou; rozpůlený na jedné straně s vyraženým „100“, „100“, „100“ a rozpůlený na druhé straně s vyraženým „P“ a „008“. Láhve po 100 NDC 58463-008-01
Uchovávejte při teplotě 20 °C až 25 °C (68 °F až 77 °F). Povolené exkurze mezi 15°C a 30°C (59°F až 86°F) [viz USP řízená pokojová teplota ].
Dávkujte v těsné nádobě odolné vůči světlu, jak je definováno v USP.
Vyrobeno v Kanadě pro: Pragma Pharmaceuticals, LLC., Distribuce: Fera, Pharmaceuticals, LLC., Locust Valley, NY 11560. Revize Oct:2018
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány jinde v označení:
- Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých [viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Srdeční arytmie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Ortostatická hypotenze a synkopa [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšené riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Priapismus [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Aktivace mánie nebo hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Potenciál pro kognitivní a motorické poruchy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Další nežádoucí účinky vyskytující se s incidencí
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku DESYREL po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku:
Poruchy krve a lymfatického systému : hemolytická anémie, leukocytóza
Srdeční poruchy kardiospasmus, městnavé srdeční selhání, blokáda vedení, ortostatická hypotenze a synkopa, palpitace, bradykardie, fibrilace síní, infarkt myokardu, srdeční zástava, arytmie, ventrikulární ektopická aktivita, včetně komorové tachykardie a prodloužení QT intervalu. Prodloužený QT interval, torsade de pointes a ventrikulární tachykardie byly hlášeny při dávkách 100 mg denně nebo méně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Endokrinní poruchy : nepřiměřený syndrom ADH
Oční poruchy : diplopie
Gastrointestinální poruchy : zvýšené slinění, nevolnost/zvracení
Celkové poruchy a reakce v místě aplikace : zimnice, edém, nevysvětlitelná smrt, slabost
Poruchy jater a žlučových cest : cholestáza, žloutenka, hyperbilirubinémie, změny jaterních enzymů
Vyšetřování : zvýšená amyláza
Poruchy metabolismu a výživy : methemoglobinémie
Poruchy nervového systému afázie, ataxie, cerebrovaskulární příhoda, extrapyramidové příznaky, záchvaty grand mal, parestézie, tardivní dyskineze, vertigo
Psychiatrické poruchy : abnormální sny, neklid, úzkost, halucinace, nespavost, paranoidní reakce, psychóza, stupor
Poruchy ledvin a močových cest : inkontinence moči, retence moči
Poruchy reprodukčního systému a prsu : zvětšení nebo překrvení prsou, klitorismus, laktace, priapismus [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Poruchy dýchání, hrudníku a mediastina : apnoe
Poruchy kůže a podkoží : alopecie, hirsutismus, leukonychie, pruritus, psoriáza, vyrážka, kopřivka
Cévní poruchy : vazodilatace
DROGOVÉ INTERAKCE
Léky s klinicky významnými interakcemi s DESYRELem
Zneužívání drog a závislost
Kontrolovaná látka
DESYREL® není kontrolovaná látka.
Zneužívání
Ačkoli trazodon-hydrochlorid nebyl systematicky studován v preklinických ani klinických studiích z hlediska jeho potenciálu pro zneužívání, nebyly v klinických studiích s trazodon-hydrochloridem pozorovány žádné známky chování při vyhledávání léku.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Sebevražedné myšlenky a chování u pediatrických a mladých dospělých pacientů
V souhrnných analýzách placebem kontrolovaných studií antidepresiv (SSRI a dalších tříd antidepresiv), které zahrnovaly přibližně 77 000 dospělých pacientů a více než 4 400 pediatrických pacientů, byl výskyt sebevražedných myšlenek a chování u pediatrických a mladých dospělých pacientů vyšší u pacientů léčených antidepresivy než u pacientů léčených placebem. Rozdíly mezi lékem a placebem v počtu případů sebevražedných myšlenek a chování na 1000 léčených pacientů jsou uvedeny v tabulce 1.
žádné z pediatrických studií nedošlo k sebevraždě. Ve studiích u dospělých došlo k sebevraždám, ale počet nebyl dostatečný k tomu, aby bylo možné učinit závěr o účinku antidepresiv na sebevraždu.
Není známo, zda se riziko sebevražedných myšlenek a chování u pediatrických a mladých dospělých pacientů rozšiřuje na dlouhodobé užívání, tj. déle než čtyři měsíce. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s MDD, že antidepresiva oddalují recidivu deprese.
všech pacientů léčených antidepresivy sledujte klinické zhoršení a výskyt sebevražedných myšlenek a chování, zejména během několika prvních měsíců lékové terapie a v době změn dávkování. Poraďte rodinné příslušníky nebo pečovatele pacientů, aby sledovali změny v chování a varovali poskytovatele zdravotní péče. Zvažte změnu terapeutického režimu, včetně možného vysazení přípravku DESYREL 100 mg, u pacientů, jejichž deprese se trvale zhoršuje nebo u kterých se objevují náhlé sebevražedné myšlenky nebo chování.
serotoninový syndrom
Inhibitory zpětného vychytávání serotoninu-norepinefrinu (SNRI) a SSRI, včetně DESYREL 25 mg, mohou urychlit serotoninový syndrom, potenciálně život ohrožující stav. Riziko je zvýšená při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu a třezalky tečkované) a s léky, které zhoršují metabolismus serotoninu, tj. IMAO [vidět KONTRAINDIKACE , DROGOVÉ INTERAKCE ]. Serotoninový syndrom se může také objevit, když se tyto léky užívají samostatně.
Známky a symptomy serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardie, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární příznaky (např. rigidita, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a gastrointestinální symptomy (např. nauzea, zvracení, průjem).
Současné užívání přípravku DESYREL s IMAO je kontraindikováno. Navíc nezahajujte léčbu přípravkem DESYREL u pacienta léčeného IMAO, jako je linezolid nebo intravenózní methylenová modř. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo místní injekce do tkáně). Pokud je nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř u pacienta užívajícího DESYREL, přerušte DESYREL před zahájením léčby IMAO [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
všech pacientů užívajících DESYREL 50 mg sledujte výskyt serotoninového syndromu. Pokud se objeví výše uvedené příznaky, okamžitě přerušte léčbu přípravkem DESYREL a jakýmikoli souběžně podávanými serotonergními látkami a zahajte podpůrnou symptomatickou léčbu. Pokud je současné užívání přípravku DESYREL s jinými serotonergními léky klinicky oprávněné, informujte pacienty o zvýšeném riziku serotoninového syndromu a sledujte příznaky.
Srdeční arytmie
Klinické studie naznačují, že trazodon-hydrochlorid může být arytmogenní u pacientů s již existujícím srdečním onemocněním. Mezi identifikované arytmie patří izolované PVC, ventrikulární kuplety, tachykardie se synkopou a torsade de pointes. Postmarketingové příhody, včetně torsade de pointes, byly hlášeny při dávkách 100 mg nebo nižších s formou DESYREL s okamžitým uvolňováním. DESYREL by se také neměl používat u pacientů s anamnézou srdečních arytmií, stejně jako za jiných okolností, které mohou zvýšit riziko výskytu torsade de pointes a/nebo náhlé smrti, včetně symptomatické bradykardie, hypokalemie nebo hypomagnezémie a přítomnosti vrozených prodloužení QT intervalu. DESYREL se nedoporučuje používat během počáteční fáze zotavení po infarktu myokardu. Při podávání DESYREL 100 mg pacientům se srdečním onemocněním je třeba postupovat opatrně a tito pacienti by měli být pečlivě sledováni, protože antidepresiva (včetně DESYRELu) mohou způsobit srdeční arytmie (viz NEŽÁDOUCÍ REAKCE ].
DESYREL prodlužuje QT/QTc interval. Použití DESYRELu je třeba se vyhnout u pacientů se známým prodloužením QT intervalu nebo v kombinaci s jinými léky, které jsou inhibitory CYP3A4 (např. itrakonazol, klarithromycin, vorikonazol) nebo o kterých je známo, že prodlužují QT interval včetně antiarytmik třídy 1A (např. chinidin, prokainamid ) nebo antiarytmika třídy 3 (např. amiodaron, sotalol), některé antipsychotické léky (např. ziprasidon, chlorpromazin, thioridazin) a některá antibiotika (např. gatifloxacin). Současné podávání léků může zvýšit riziko srdeční arytmie [viz DROGOVÉ INTERAKCE ].
Ortostatická hypotenze a synkopa
U pacientů užívajících trazodon-hydrochlorid byla hlášena hypotenze, včetně ortostatické hypotenze a synkopy. Současné užívání s antihypertenzivem může vyžadovat snížení dávky antihypertenziva.
Zvýšené riziko krvácení
Léky, které interferují s inhibicí zpětného vychytávání serotoninu, včetně DESYREL 100 mg, zvyšují riziko krvácivých příhod. Současné užívání aspirinu, nesteroidních protizánětlivých léků (NSAIDS), jiných protidestičkových léků, warfarinu a dalších antikoagulancií může toto riziko zvýšit. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Krvácení související s léky, které interferují se zpětným vychytáváním serotoninu, se pohybovaly od ekchymózy, hematomu, epistaxe a petechií až po život ohrožující krvácení.
Informujte pacienty o riziku krvácení spojeném se současným užíváním přípravku DESYREL 25 mg a protidestičkových látek nebo antikoagulancií. U pacientů užívajících warfarin pečlivě sledujte koagulační indexy při zahájení, titraci nebo vysazení DESYRELu.
Priapismus
mužů užívajících DESYREL byly hlášeny případy priapismu (bolestivé erekce trvající déle než 6 hodin). Priapismus, pokud není včas léčen, může vést k nevratnému poškození erektilní tkáně. Muži, kteří mají erekci trvající déle než 4 hodiny, ať už bolestivou nebo ne, by měli okamžitě přerušit lék a vyhledat pohotovostní lékařskou pomoc [viz NEŽÁDOUCÍ REAKCE , PŘEDÁVKOVÁNÍ ].
DESYREL 100 mg by měl být používán s opatrností u mužů, kteří mají onemocnění, která by je mohla predisponovat k priapismu (např. srpkovitá anémie, mnohočetný myelom nebo leukémie), nebo u mužů s anatomickou deformací penisu (např. angulace, kavernózní fibróza nebo Peyronieho nemoc).

Aktivace Mánie Nebo Hypománie
pacientů s bipolární poruchou může léčba depresivní epizody přípravkem DESYREL 50 mg nebo jiným antidepresivem vyvolat smíšenou/manickou epizodu. Aktivace mánie/hypománie byla hlášena u malé části pacientů s velkou afektivní poruchou, kteří byli léčeni antidepresivy. Před zahájením léčby přípravkem DESYREL proveďte screening pacientů na jakoukoli osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Syndrom vysazení
Nežádoucí účinky po vysazení serotonergních antidepresiv, zejména po náhlém vysazení, zahrnují: nevolnost, pocení, dysforickou náladu, podrážděnost, neklid, závratě, poruchy smyslů (např. parestézie, jako jsou pocity elektrického šoku), třes, úzkost, zmatenost, bolest hlavy, letargie, emoční labilita, nespavost, hypománie, tinnitus a záchvaty. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Potenciál pro kognitivní a motorické poruchy
DESYREL® může způsobit ospalost nebo sedaci a může narušit duševní a/nebo fyzické schopnosti potřebné pro provádění potenciálně nebezpečných úkolů. Pacienti by měli být varováni před obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou přiměřeně jisti, že na ně medikamentózní léčba nemá nepříznivý vliv.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně DESYREL 25 mg, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii. Vyhněte se užívání antidepresiv, včetně DESYRELu, u pacientů s neléčenými anatomicky úzkými úhly.
Hyponatrémie
Hyponatremie se může objevit v důsledku léčby SNRI a SSRI, včetně DESYRELu. Byly hlášeny případy se sérovým sodíkem nižším než 110 mmol/l. Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, což může vést k pádům. Známky a symptomy spojené se závažnějšími a/nebo akutními případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt. V mnoha případech se zdá, že tato hyponatremie je výsledkem syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH).
U pacientů se symptomatickou hyponatrémií přerušte léčbu přípravkem DESYREL 25 mg a zahajte vhodnou lékařskou intervenci. Starší pacienti, pacienti užívající diuretika a ti, kteří mají depleci objemu, mohou mít větší riziko rozvoje hyponatremie s SSRI a SNRI [viz Použití u konkrétních populací ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Sebevražedné myšlenky a chování
Poraďte pacientům a pečovatelům, aby hledali výskyt sebevraždy, zvláště brzy během léčby a když je dávka upravena nahoru nebo dolů, a poučte je, aby hlásili takové příznaky poskytovateli zdravotní péče [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Dávkování a podávání
Informujte pacienty, že DESYREL by měl být užíván krátce po jídle nebo lehké svačině. Informujte pacienty o důležitosti dodržování pokynů pro titraci dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
serotoninový syndrom
Varujte pacienty před rizikem serotoninového syndromu, zvláště při současném užívání DESYRELu s jinými serotonergními léky včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, třezalky tečkované a s léky, které zhoršují metabolismus serotoninu ( zejména MAOI, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid). Pacienti by měli kontaktovat svého poskytovatele zdravotní péče nebo hlásit na pohotovost, pokud zaznamenají známky nebo příznaky serotoninového syndromu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Aktivace mánie/hypománie
Poraďte pacientům a jejich pečovatelům, aby sledovali známky aktivace mánie/hypománie a poučte je, aby takové příznaky hlásili poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zvýšené riziko krvácení
Informujte pacienty o současném užívání přípravku DESYREL s aspirinem, NSAID, jinými protidestičkovými léky, warfarinem nebo jinými antikoagulancii, protože kombinované užívání léků, které interferují se zpětným vychytáváním serotoninu, a těchto léků bylo spojeno se zvýšeným rizikem krvácení. Poraďte jim, aby informovali své poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, které zvyšují riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Syndrom vysazení
Poraďte pacientům, aby náhle nepřerušovali léčbu přípravkem DESYREL 100 mg a aby případný postup snižování dávky projednali se svým poskytovatelem zdravotní péče. Nežádoucí účinky se mohou objevit, když je DESYREL 50 mg vysazen (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doprovodné léky
Poraďte pacientům, aby informovali své poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože existuje možnost interakcí [viz DROGOVÉ INTERAKCE ].
Těhotenství
Informujte pacientky, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem DESYREL otěhotní nebo plánují otěhotnět. Informujte pacienty, že existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených DESYREL 25 mg během těhotenství [viz Použití ve zvláštních populacích ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
U potkanů, kteří dostávali trazodon v denních perorálních dávkách až do 7,3násobku maximální doporučené dávky pro člověka (MRHD) 400 mg/den u dospělých na základě mg/m², nebyl zřejmý žádný výskyt karcinogeneze související s lékem nebo dávkou.
Mutageneze
S trazodonem nebyly provedeny žádné studie genotoxicity.
Zhoršení Plodnosti
Trazodon nemá žádný vliv na fertilitu u potkanů v dávkách až 7,3násobku MRHD u dospělých na základě mg/m².
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených antidepresivům během těhotenství. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty zavoláním do Národního registru těhotenství pro antidepresiva na čísle 1-844-405-6185 nebo návštěvou online na adrese https://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/antidepressants/
Shrnutí rizik
Publikované prospektivní kohortové studie, kazuistiky a kazuistiky v průběhu několika desetiletí s užíváním DESYREL 50 mg u těhotných žen neidentifikovaly žádná rizika závažných vrozených vad, potratu nebo nepříznivých mateřských nebo fetálních výsledků spojená s užíváním léků (viz Data ). Bylo prokázáno, že trazodon-hydrochlorid způsobuje zvýšenou fetální resorpci a další nežádoucí účinky na plod u potkanů, pokud je podáván v dávkách přibližně 7,3 až 11násobku maximální doporučené dávky pro člověka (MRHD) 400 mg/den u dospělých na mg/m² základ. Došlo také ke zvýšení vrozených anomálií u králíka na přibližně 7,3 až 22násobek MRHD na základě mg/m² (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Klinické úvahy
Mateřské a/nebo embryofetální riziko spojené s nemocí
Prospektivní, longitudinální studie sledovala 201 těhotných žen s anamnézou velké depresivní poruchy, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Ženy, které vysadily antidepresiva během těhotenství, měly větší pravděpodobnost recidivy těžké deprese než ženy, které v antidepresivech pokračovaly. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Data
Lidská data
Zatímco dostupné studie nemohou definitivně prokázat absenci rizika, publikované údaje z prospektivních kohortových studií, kazuistik a kazuistik za několik desetiletí neidentifikovaly souvislost s užíváním trazodonu během těhotenství a závažnými vrozenými vadami, potraty nebo jinými nepříznivými účinky na matku nebo plod. výsledky. Všechny dostupné studie mají metodologická omezení, včetně malé velikosti vzorku a nekonzistentních srovnávacích skupin.
Údaje o zvířatech
Nebyly pozorovány žádné teratogenní účinky, když byl trazodon podáván březím potkanům a králíkům během období organogeneze v perorálních dávkách až 450 mg/kg/den. Tato dávka je u potkanů a králíků 11násobkem a 22násobkem maximální doporučené dávky pro člověka (MRHD) 400 mg/den u dospělých na základě mg/m². Byla pozorována zvýšená fetální resorpce a další nežádoucí účinky na plod u potkanů při 7,3 až 11násobku MRHD a zvýšení vrozených anomálií u králíků při 7,3 až 22násobku MRHD na základě mg/m². Žádné další podrobnosti o těchto studiích nejsou k dispozici.
Laktace
Shrnutí rizik
Údaje z publikované literatury uvádějí přenos trazodonu do lidského mléka. Neexistují žádné údaje o účinku trazodonu na produkci mléka. Omezené údaje z postmarketingových hlášení nezjistily ani souvislost nežádoucích účinků na kojené dítě. Je třeba zvážit vývojové a zdravotní přínosy kojení spolu s klinickou potřebou matky užívat DESYREL a veškerými potenciálními nežádoucími účinky přípravku DESYREL nebo základního stavu matky na kojené dítě.
Pediatrické použití
Bezpečnost a účinnost u pediatrické populace nebyla stanovena. Antidepresiva zvyšovala riziko sebevražedných myšlenek a chování u dětských pacientů [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Geriatrické použití
Hlášená klinická literatura a zkušenosti s trazodonem neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty. Protože jsou však zkušenosti s podáváním trazodon-hydrochloridu u starších pacientů omezené, měl by být u geriatrických pacientů používán s opatrností.
Serotonergní antidepresiva byla spojována s případy klinicky významné hyponatremie u starších pacientů, u kterých může být vyšší riziko této nežádoucí reakce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Renální poškození
Trazodon nebyl studován u pacientů s poruchou funkce ledvin. Trazodon by měl být u této populace používán s opatrností.
Poškození jater
Trazodon nebyl studován u pacientů s poruchou funkce jater. Trazodon by měl být u této populace používán s opatrností.
PŘEDÁVKOVAT
U pacientů užívajících současně DESYREL a další léky tlumící CNS (alkohol; alkohol a chloralhydrát a diazepam; amobarbital; chlordiazepoxid; nebo meprobamát) došlo k úmrtí z předávkování.
Nejzávažnější reakce, které se vyskytly při předávkování samotným DESYRELem, byly priapismus, zástava dechu, záchvaty a změny na EKG, včetně prodloužení QT intervalu. Nejčastěji hlášené reakce byly ospalost a zvracení. Předávkování může způsobit zvýšení incidence nebo závažnosti některého z hlášených nežádoucích účinků.
Neexistuje žádné specifické antidotum pro předávkování trazodon-hydrochloridem. Při zvládání předávkování zvažte možnost zapojení více léků. Pro aktuální informace o léčbě otravy nebo předávkování kontaktujte toxikologické centrum (1-800-222-1222 nebo www.poison.org).
KONTRAINDIKACE
DESYREL 25 mg je kontraindikován u:
- Pacienti užívající nebo do 14 dnů po ukončení léčby inhibitory monoaminooxidázy (IMAO), včetně IMAO, jako je linezolid nebo intravenózní methylenová modř, kvůli zvýšenému riziku serotoninového syndromu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus antidepresivního účinku trazodonu není plně objasněn, ale předpokládá se, že souvisí s jeho zvýšením serotonergní aktivity v CNS. Trazodon je jak selektivní inhibitor zpětného vychytávání serotoninu (SSRI), tak antagonista 5HT2 receptoru a čistý výsledek tohoto působení na serotonergní přenos a jeho role v antidepresivním účinku trazodonu není známa.
Farmakodynamika
Předklinické studie ukázaly, že trazodon selektivně inhibuje neuronální zpětné vychytávání serotoninu (Ki = 367 nM) a působí jako antagonista na 5-HT-2A (Ki = 35,6 nM) serotoninových receptorech. Trazodon je také antagonistou několika dalších monoaminergních receptorů včetně 5-HT2B (Ki = 78,4 nM), 5-HT2C (Ki = 224 nM), α1A (Ki = 153 nM), α2C (Ki = 155 nM) receptorů a je částečný agonista na 5-HT1A (Ki = 118 nM) receptoru.
Trazodon antagonizuje alfa 1-adrenergní receptory, což je vlastnost, která může být spojena s posturální hypotenzí.
Farmakokinetika
Vstřebávání
lidí je trazodon-hydrochlorid po perorálním podání absorbován bez selektivní lokalizace v jakékoli tkáni. Pokud se trazodon-hydrochlorid užije krátce po požití potravy, může dojít ke zvýšení množství absorbovaného léčiva, snížení maximální koncentrace a prodloužení doby do dosažení maximální koncentrace. Maximální plazmatické hladiny se objevují přibližně jednu hodinu po podání dávky, pokud se trazodon-hydrochlorid užívá nalačno, nebo 2 hodiny po podání dávky, pokud se užívá s jídlem.
Metabolismus
In vitro studie na lidských jaterních mikrozomech ukazují, že trazodon je metabolizován prostřednictvím oxidačního štěpení na aktivní metabolit, mchlorfenylpiperazin (mCPP) prostřednictvím CYP3A4. Jiné metabolické dráhy, které se mohou podílet na metabolismu trazodonu, nebyly dobře charakterizovány. Trazodon je rozsáhle metabolizován; méně než 1 % perorální dávky se vylučuje v nezměněné podobě močí.
Odstranění
U některých pacientů se trazodon může akumulovat v plazmě.
Vazba na bílkoviny
Trazodon se in vitro váže z 89 až 95 % na proteiny v koncentracích dosahovaných terapeutickými dávkami u lidí.
Klinické studie
Účinnost a bezpečnost trazodon-hydrochloridu byla stanovena z hospitalizovaných a ambulantních studií přípravku trazodonu s okamžitým uvolňováním při léčbě velké depresivní poruchy.
INFORMACE PRO PACIENTA
DESYREL® (DEZ ur el) (trazodon hydrochlorid) tablety, pro perorální podání
Jaké jsou nejdůležitější informace, které bych měl vědět o DESYREL?
Antidepresivní léky, deprese nebo jiná vážná duševní onemocnění a sebevražedné myšlenky nebo činy: Promluvte si se svým poskytovatelem zdravotní péče o:
- Všechna rizika a přínosy léčby antidepresivy
- Všechny možnosti léčby deprese nebo jiných vážných duševních chorob
- Věnujte zvýšenou pozornost jakýmkoli změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte svému poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče podle plánu. Zavolejte svého poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- Myšlenky na sebevraždu nebo umírání
- Pokusy o sebevraždu
- Nová nebo horší deprese
- Nová nebo horší úzkost
- Pocit velkého rozrušení nebo neklidu
- Panický záchvat
- Potíže se spánkem (nespavost)
- Nová nebo horší podrážděnost
- Chovat se agresivně, být naštvaný nebo násilný
- Působení na nebezpečné impulsy
- Extrémní nárůst aktivity a mluvení (mánie)
- Jiné neobvyklé změny v chování nebo náladě
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili s poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité probrat všechna rizika léčby deprese a také rizika její neléčení. Se svým poskytovatelem zdravotní péče byste měli probrat všechny možnosti léčby, nejen použití antidepresiv.
- Antidepresiva mají další vedlejší účinky. Poraďte se se svým poskytovatelem zdravotní péče o vedlejších účincích vašich léků.
- Antidepresiva mohou interagovat s jinými léky. Znát všechny léky, které užíváte. Uchovávejte si seznam všech léků, abyste je mohli ukázat svému poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
Není známo, zda je DESYREL bezpečný a účinný u dětí.
Co je DESYREL 100 mg?
DESYREL je lék na předpis používaný u dospělých k léčbě velké depresivní poruchy (MDD). DESYREL patří do třídy léků známých jako SSRI (nebo selektivní inhibitory zpětného vychytávání serotoninu).
Neužívejte DESYREL:
- Jestliže užíváte inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu, a intravenózní methylenové modři.
- Neužívejte IMAO do 2 týdnů po ukončení užívání přípravku DESYREL 100 mg, pokud vám to nenařídí váš poskytovatel zdravotní péče.
- Nezačínejte přípravek DESYREL 100 mg, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš poskytovatel zdravotní péče.
Než začnete DESYREL užívat, informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- máte problémy se srdcem, včetně prodloužení QT intervalu nebo je má v rodinné anamnéze
- někdy měl infarkt
- mají bipolární poruchu
- máte problémy s játry nebo ledvinami
- mít jiné vážné zdravotní potíže
- jste těhotná nebo plánujete otěhotnět. Není známo, zda DESYREL poškodí vaše nenarozené dítě. Poraďte se se svým poskytovatelem zdravotní péče o riziku pro vaše nenarozené dítě, pokud užíváte DESYREL.
- Pokud během léčby přípravkem DESYREL otěhotníte, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro antidepresiva. Můžete se zaregistrovat na telefonním čísle 1-844-405-6185.
- kojíte nebo plánujete kojit. DESYREL 100 mg přechází do mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte, pokud užíváte DESYREL.
- jestliže jste užil(a) inhibitor monoaminooxidázy (MAOI) nebo jste přestal(a) užívat některý IMAO v posledních 2 týdnech.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Užívání DESYRELu s některými jinými léky se může vzájemně ovlivňovat a způsobit závažné nežádoucí účinky.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- triptany používané k léčbě migrény
- léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně tricyklických látek, lithia, SSRI, SNRI, buspironu nebo antipsychotik
- tramadol
- volně prodejné doplňky stravy, jako je tryptofan nebo třezalka tečkovaná
- nesteroidní protizánětlivé léky (NSAIDS)
- aspirin
- warfarin (Coumadin, Jantoven)
- fenytoin (mesantoin)
- diuretika
Znát léky, které užíváte. Uchovávejte si jejich seznam a ukažte jej svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat DESYREL 25 mg?
- Užívejte DESYREL přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- DESYREL se má užívat krátce po jídle nebo lehké svačině.
- Pokud se po užití přípravku DESYREL 25 mg cítíte ospalý, poraďte se se svým poskytovatelem zdravotní péče. Váš poskytovatel zdravotní péče může změnit vaši dávku nebo denní dobu, kdy přípravek DESYREL užíváte.
- Nepřestávejte užívat DESYREL, aniž byste si promluvili se svým poskytovatelem zdravotní péče.
- DESYREL 100 mg by se měl spolknout celý nebo rozlomený napůl podél rýhy. DESYREL nežvýkejte ani nedrťte. Informujte svého poskytovatele zdravotní péče, pokud nemůžete spolknout trazodon celý nebo jako polovinu tablety.
- Pokud užijete příliš mnoho DESYRELu, zavolejte svého poskytovatele zdravotní péče, své Poison Control Center na číslo 1-800-222-1222 nebo jděte ihned na nejbližší pohotovost.
Čemu se mám vyvarovat při užívání DESYREL 25 mg?
- Neřiďte, neobsluhujte těžké stroje ani neprovádějte jiné nebezpečné činnosti, dokud nebudete vědět, jak na vás DESYREL 100 mg působí. DESYREL 100 mg může zpomalit vaše myšlení a motoriku.
- Během užívání DESYRELu nepijte alkohol ani neužívejte jiné léky, které způsobují ospalost nebo závratě, dokud si nepromluvíte se svým poskytovatelem zdravotní péče. DESYREL může zhoršit vaši ospalost nebo závratě, pokud jej užíváte s alkoholem nebo jinými léky, které způsobují ospalost nebo závratě.
Jaké jsou možné vedlejší účinky přípravku DESYREL?
DESYREL 100 mg může způsobit závažné nežádoucí účinky nebo smrt, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o DESYREL 25 mg?"
- serotoninový syndrom. Příznaky serotoninového syndromu zahrnují: neklid, halucinace, problémy s koordinací, rychlý srdeční tep, napjaté svaly, potíže s chůzí, pocení, horečka, nevolnost, zvracení a průjem.
- Nepravidelný nebo rychlý srdeční tep nebo mdloby (prodloužení QT intervalu)
- Nízký krevní tlak. Pociťujete závratě nebo mdloby, když změníte polohu (přejdete ze sedu do stoje)
- Neobvyklé modřiny nebo krvácení
- Erekce trvající déle než 6 hodin (priapismus)
- Pocit povznesení nebo velmi dobrá nálada, poté podrážděnost nebo přílišná energie, pocit, že musíte dál mluvit nebo nespát (mánie).
- Abstinenční příznaky. Příznaky abstinence mohou zahrnovat úzkost, neklid a problémy se spánkem. Nepřestávejte užívat DESYREL 25 mg, aniž byste se poradili se svým poskytovatelem zdravotní péče.
- Vizuální problémy.
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
- Nízká hladina sodíku v krvi (hyponatremie). Příznaky hyponatremie zahrnují: bolest hlavy, pocit slabosti, pocit zmatenosti, potíže se soustředěním, problémy s pamětí a pocit nejistoty při chůzi.
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku DESYREL patří:
- otok
- rozmazané vidění
- závrať
- ospalost
- únava
- průjem
- ucpaný nos
- ztráta váhy
Toto nejsou všechny možné vedlejší účinky přípravku DESYREL. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám DESYREL 100 mg uchovávat?
- Skladujte DESYREL při pokojové teplotě mezi 68°F až 77°F (20°C až 25°C).
- Uchovávejte v těsné nádobě
- Držte se mimo světlo
- Léky, které jsou zastaralé nebo již nepotřebné, bezpečně vyhoďte.
Uchovávejte DESYREL 100 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání přípravku DESYREL.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte DESYREL 100 mg při onemocnění, pro které nebyl předepsán. Nedávejte DESYREL 25 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o přípravku DESYREL 100 mg, který je určen pro zdravotníky.
Jaké jsou složky přípravku DESYREL 100 mg?
Aktivní složka: trazo done hydrochlorid, USP
Neaktivní složky: 50 mg a 100 mg: kukuřičný škrob, hydrogenfosforečnan vápenatý, hypromelóza, monohydrát laktózy, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, povidon, sodná sůl glykolátu škrobu a triacetin 150 mg: magnesium-stearát, mikrokrystalická škrobová celulóza, předbobtnalý 300 % škrob mg: stearát hořečnatý, mikrokrystalická celulóza, předbobtnalý škrob, sodná sůl glykolátu škrobu a kyselina stearová
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
