Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Seroquel 100 mg a jak se používá?
Seroquel 50 mg je lék na předpis používaný k léčbě příznaků schizofrenie, bipolární poruchy I, mánie; bipolární porucha, depresivní epizody; bipolární porucha I, údržba; a velká depresivní porucha. Seroquel 50 mg lze užívat samostatně nebo s jinými léky.
Seroquel patří do třídy léků nazývaných antipsychotika 2. generace; Antimanové látky.
Není známo, zda je přípravek Seroquel 200 mg bezpečný a účinný u dětí mladších 12 let.
Jaké jsou možné vedlejší účinky přípravku Seroquel 50 mg?
Seroquel může způsobit závažné nežádoucí účinky, včetně:
- nekontrolované pohyby svalů v obličeji (žvýkání, mlácení rtů, mračení, pohyby jazyka, mrkání nebo pohyby očí),
- vzhled obličeje jako maska,
- potíže s polykáním,
- problémy s řečí,
- točení hlavy,
- silná zácpa,
- bolestivé nebo obtížné močení,
- rozmazané vidění,
- tunelové vidění,
- bolest očí,
- vidět halo kolem světel,
- velmi ztuhlé (tuhé) svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- třes,
- mdloby,
- zvýšená žízeň,
- zvýšené močení,
- suchá ústa,
- ovocný zápach dechu,
- horečka,
- zimnice,
- vředy v ústech,
- kožní vředy,
- bolest krku,
- kašel a
- potíže s dýcháním
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Seroquel patří:
- problémy s řečí,
- závrať,
- ospalost,
- únava,
- nedostatek energie,
- rychlé tepy,
- ucpaný nos,
- zvýšená chuť k jídlu,
- přibývání na váze,
- žaludeční nevolnost,
- zvracení,
- zácpa,
- sucho v ústech a
- abnormální jaterní test
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Seroquel. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
ZVÝŠENÁ ÚMRTNOST U STARŠÍCH PACIENTŮ S PSYCHÓZOU SOUVISEJÍCÍ S DEMENCÍ; a SEBEvražedné myšlenky a chování
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí
Starší pacienti s psychózou související s demencí léčení antipsychotiky mají zvýšené riziko úmrtí (viz UPOZORNĚNÍ A OPATŘENÍ ). SEROQUEL není schválen pro léčbu pacientů s psychózou související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Sebevražedné myšlenky a chování
Antidepresiva v krátkodobých studiích zvyšovala riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých. Tyto studie neprokázaly zvýšení rizika sebevražedných myšlenek a chování při užívání antidepresiv u pacientů starších 24 let; došlo ke snížení rizika při užívání antidepresiv u pacientů ve věku 65 let a starších (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
pacientů všech věkových kategorií, u kterých byla zahájena léčba antidepresivy, pečlivě sledujte, zda nedochází ke zhoršení a výskytu sebevražedných myšlenek a chování. Informujte rodiny a pečovatele o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
SEROQUEL 50 mg není schválen pro použití u pediatrických pacientů mladších deseti let (viz Použití u specifických populací ).
POPIS
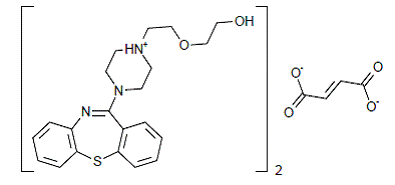
SEROQUEL® (quetiapin fumarát) je psychotropní látka patřící do chemické třídy, deriváty dibenzothiazepinu. Chemické označení je 2-[2-(4-dibenzo[b,f][l,4]thiazepin-ll-yl-l-piperazinyl)ethoxy]-ethanol fumarát (2:1) (sůl). Je přítomen v tabletách jako fumarátová sůl. Všechny dávky a síly tablet jsou vyjádřeny jako miligramy báze, nikoli jako fumarátová sůl. Jeho molekulový vzorec je C42H50N6O4S2•C4H4O4 a má molekulovou hmotnost 883,11 (fumarátová sůl). Strukturní vzorec je:
Quetiapin fumarát je bílý až téměř bílý krystalický prášek, který je středně rozpustný ve vodě.
SEROQUEL se dodává k perorálnímu podání jako 25 mg (kulatý, broskvový), 50 mg (kulatý, bílý), 100 mg (kulatý, žlutý), 200 mg (kulatý, bílý), 300 mg (ve tvaru tobolky, bílý) a 400 mg tablety (ve tvaru tobolky, žluté).
Neaktivními složkami jsou povidon, dihydrát hydrogenfosforečnanu vápenatého, mikrokrystalická celulóza, sodná sůl karboxymethylškrobu, monohydrát laktózy, magnesium-stearát, hypromelóza, polyethylenglykol a oxid titaničitý.
25 mg tablety obsahují červený oxid železitý a žlutý oxid železitý a 100 mg a 400 mg tablety obsahují pouze žlutý oxid železitý.
INDIKACE
Schizofrenie
SEROQUEL XR je indikován k léčbě schizofrenie. Účinnost přípravku SEROQUEL XR u schizofrenie byla stanovena v jedné 6týdenní a jedné udržovací studii u dospělých se schizofrenií. Účinnost byla podpořena třemi 6týdenními studiemi u dospělých se schizofrenií a jednou 6týdenní studií u dospívajících se schizofrenií (13-17 let) léčených SEROQUELem (viz Klinické studie ].
Bipolární porucha
SEROQUEL 25 mg XR je indikován k akutní léčbě manických nebo smíšených epizod spojených s bipolární poruchou I, a to jak v monoterapii, tak jako doplněk k lithiu nebo divalproexu. Účinnost přípravku SEROQUEL XR u manických nebo smíšených epizod bipolární poruchy I byla stanovena v jedné 3týdenní studii u dospělých s manickými nebo smíšenými epizodami spojenými s bipolární poruchou I. Účinnost byla podpořena dvěma 12týdenními monoterapeutickými studiemi a jednou 3týdenní doplňkovou studií u dospělých s manickými epizodami spojenými s bipolární poruchou I a také jednou 3týdenní monoterapeutickou studií u dětí a dospívajících (10–17 let) s manickými epizodami spojenými s s bipolární poruchou I léčenou SEROQUEL [viz Klinické studie ].
SEROQUEL 100 mg XR je indikován k akutní léčbě depresivních epizod spojených s bipolární poruchou. Účinnost SEROQUEL XR byla stanovena v jedné 8týdenní studii u dospělých s bipolární poruchou I nebo II a podpořena dvěma 8týdenními studiemi u dospělých s bipolární poruchou I nebo II léčených SEROQUELem (viz Klinické studie ].
SEROQUEL 100 mg XR je indikován k udržovací léčbě bipolární poruchy typu I jako doplněk k lithiu nebo divalproexu. Účinnost byla extrapolována ze dvou udržovacích studií u dospělých s bipolární poruchou I léčených SEROQUELem. Účinnost monoterapie pro udržovací léčbu bipolární poruchy I nebyla systematicky hodnocena v kontrolovaných klinických studiích [viz Klinické studie ].
Doplňková léčba velké depresivní poruchy (MDD)
SEROQUEL 100 mg XR je indikován k použití jako doplňková léčba k antidepresivům při léčbě MDD. Účinnost SEROQUEL XR jako doplňkové léčby k antidepresivům u MDD byla prokázána ve dvou 6týdenních studiích u dospělých s MDD, kteří neměli adekvátní odpověď na léčbu antidepresivy [viz Klinické studie ].
Zvláštní úvahy při léčbě dětské schizofrenie a bipolární poruchy I
Dětská schizofrenie a bipolární porucha I jsou závažné duševní poruchy, avšak diagnostika může být náročná. U dětské schizofrenie mohou být profily příznaků variabilní au bipolární poruchy I mohou mít pacienti různé vzorce periodicity manických nebo smíšených příznaků. Doporučuje se, aby medikamentózní terapie u dětské schizofrenie a bipolární poruchy I byla zahájena až po důkladném diagnostickém vyšetření a pečlivém zvážení rizik spojených s medikamentózní léčbou. Medikamentózní léčba dětské schizofrenie i bipolární poruchy I je indikována jako součást celkového léčebného programu, který často zahrnuje psychologické, výchovné a sociální intervence.
DÁVKOVÁNÍ A PODÁVÁNÍ
Důležité pokyny pro administraci
Tablety SEROQUEL XR by se měly polykat celé a neměly by se dělit, žvýkat ani drtit.
Doporučuje se užívat SEROQUEL 50 mg XR bez jídla nebo s lehkým jídlem (přibližně 300 kalorií) [viz KLINICKÁ FARMAKOLOGIE ].
SEROQUEL 25 mg XR by měl být podáván jednou denně, nejlépe večer.
Doporučené dávkování
Doporučená počáteční dávka, titrace, rozmezí dávek a maximální dávka SEROQUEL 50 mg XR pro každou schválenou indikaci jsou uvedeny v tabulce 1 níže. Po počátečním dávkování lze v případě potřeby provést úpravy směrem nahoru nebo dolů, v závislosti na klinické odpovědi a snášenlivosti pacienta [viz Klinické studie ].
Udržovací léčba schizofrenie a bipolární poruchy I
Udržovací léčba
Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby a vhodná dávka pro takovou léčbu [viz Klinické studie ].
Úpravy dávek u starších pacientů
Je třeba zvážit pomalejší titraci dávky a nižší cílovou dávku u starších pacientů a u pacientů, kteří jsou oslabení nebo mají predispozici k hypotenzním reakcím (viz Použití u konkrétních populací , a KLINICKÁ FARMAKOLOGIE ]. Pokud je to indikováno, je třeba u těchto pacientů zvyšovat dávku opatrně.
Starší pacienti by měli začít užívat SEROQUEL XR 50 mg/den a dávka může být zvyšována o 50 mg/den v závislosti na klinické odpovědi a snášenlivosti jednotlivého pacienta.
Úpravy dávek u pacientů s poškozením jater
U pacientů s poruchou funkce jater by měla být zahájena léčba přípravkem SEROQUEL XR 50 mg/den. Dávku lze denně zvyšovat o 50 mg/den na účinnou dávku v závislosti na klinické odpovědi a snášenlivosti pacienta.
Úpravy dávkování při použití s inhibitory CYP3A4
Dávka SEROQUELu XR by měla být snížena na jednu šestinu původní dávky, pokud je podáván současně se silným inhibitorem CYP3A4 (např. ketokonazolem, itrakonazolem, indinavirem, ritonavirem, nefazodonem atd.). Když se vysadí inhibitor CYP3A4, dávka přípravku SEROQUEL XR by měla být zvýšena 6krát (viz KLINICKÁ FARMAKOLOGIE a DROGOVÉ INTERAKCE ].
Úpravy dávky při použití s induktory CYP3A4
Dávka SEROQUEL XR by měla být zvýšena až na 5násobek původní dávky, pokud se používá v kombinaci s chronickou léčbou (např. delší než 7-14 dní) silným induktorem CYP3A4 (např. fenytoinem, karbamazepinem, rifampinem, avasimibem, St. třezalka atd.). Dávka by měla být titrována na základě klinické odpovědi a tolerance jednotlivého pacienta. Když se vysadí induktor CYP3A4, dávka přípravku SEROQUEL 100 mg XR by měla být snížena na původní úroveň během 7-14 dnů (viz KLINICKÁ FARMAKOLOGIE a DROGOVÉ INTERAKCE ].
Opětovné zahájení léčby u pacientů, kteří byli dříve přerušeni
Ačkoli nejsou k dispozici žádné údaje, které by konkrétně řešily opětovné zahájení léčby, doporučuje se, aby při opětovném zahájení léčby pacientů, kteří byli bez přípravku SEROQUEL 50 mg XR déle než jeden týden, bylo dodrženo schéma počátečního dávkování. Při opětovném zahájení léčby u pacientů, kteří užívali SEROQUEL 300 mg XR po dobu kratší než jeden týden, nemusí být nutné postupné zvyšování dávky a může být znovu zahájena udržovací dávka.
Přechod pacientů ze SEROQUEL 50 mg tablety na SEROQUEL 100 mg XR tablety
Pacienti, kteří jsou v současné době léčeni SEROQUELem (formulace s okamžitým uvolňováním), mohou být převedeni na SEROQUEL XR v ekvivalentní celkové denní dávce užívané jednou denně. Může být nutná individuální úprava dávkování.
Přechod z antipsychotik
Neexistují žádné systematicky shromažďované údaje, které by konkrétně řešily přechod pacientů z jiných antipsychotik na SEROQUEL 200 mg XR nebo týkající se současného podávání s jinými antipsychotiky. Zatímco pro některé pacienty může být přijatelné okamžité ukončení předchozí antipsychotické léčby, pro jiné může být nejvhodnější postupnější vysazování. Ve všech případech by měla být minimalizována doba překrývajícího se podávání antipsychotik. Při přechodu pacientů z depotních antipsychotik, je-li to z lékařského hlediska vhodné, zahajte terapii SEROQUEL XR místo další plánované injekce. Potřeba pokračování stávající léčby extrapyramidového syndromu by měla být pravidelně přehodnocována.
JAK DODÁVÁNO
Dávkové formy A Síly
- 50 mg tablety s prodlouženým uvolňováním jsou broskvové, potahované, bikonvexní, zahloubené tablety ve tvaru tobolky s „XR 50“ na jedné straně a hladké na druhé straně
- 150 mg tablety s prodlouženým uvolňováním jsou bílé, potahované, bikonvexní tablety ve tvaru tobolky s „XR 150“ na jedné straně a hladké na druhé straně.
- 200 mg tablety s prodlouženým uvolňováním jsou žluté, potahované, bikonvexní, zahloubené tablety ve tvaru tobolky s „XR 200“ na jedné straně a hladké na druhé straně
- 300 mg tablety s prodlouženým uvolňováním jsou světle žluté, potahované, bikonvexní tablety ve tvaru tobolky s „XR 300“ na jedné straně a hladké na druhé straně
- 400 mg tablety s prodlouženým uvolňováním jsou bílé, potahované, bikonvexní tablety ve tvaru tobolky s „XR 400“ na jedné straně a hladké na druhé straně.
Skladování A Manipulace
50 mg tablety ( NDC 0310-0280-60) broskvové, potahované, tobolkovité, bikonvexní, zahloubené tablety s „XR 50“ na jedné straně a hladké na druhé straně se dodávají v lahvičkách po 60 tabletách.
150 mg tablety ( NDC 0310-0281-60) bílé, potahované, bikonvexní, zahloubené tablety ve tvaru tobolky s „XR 150“ na jedné straně a hladké na druhé straně, jsou dodávány v lahvičkách po 60 tabletách.
200 mg tablety ( NDC 0310-0282-60) žlutá, potahovaná, bikonvexní, zahloubená tableta ve tvaru tobolky s „XR 200“ na jedné straně a hladká na druhé straně se dodávají v lahvičkách po 60 tabletách.
300 mg tablety ( NDC 0310-0283-60) světle žlutá, potahovaná, bikonvexní, zahloubená tableta ve tvaru tobolky s „XR 300“ na jedné straně a hladká na druhé straně, jsou dodávány v lahvičkách po 60 tabletách.
400 mg tablety ( NDC 0310-0284-60) bílé, potahované, bikonvexní, zahloubené tablety ve tvaru tobolky s „XR 400“ na jedné straně a hladké na druhé straně, jsou dodávány v lahvičkách po 60 tabletách.
SEROQUEL XR skladujte při 25°C (77°F); povoleny výchylky do 15-30°C (59-86°F) [Viz USP ].
Distribuce: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revize: březen 2020
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Zvýšená úmrtnost u starších pacientů s psychózou související s demencí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sebevražedné myšlenky a chování u dospívajících a mladých dospělých [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Cerebrovaskulární nežádoucí reakce, včetně mrtvice u starších pacientů s psychózou související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Neuroleptický maligní syndrom (NMS) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Metabolické změny (hyperglykémie, dyslipidémie, přibývání na váze) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Tardivní dyskineze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypotenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Falls [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšení krevního tlaku (u dětí a dospívajících) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Leukopenie, neutropenie a agranulocytóza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Šedý zákal [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypotyreóza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyperprolaktinémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Potenciál pro kognitivní a motorické poruchy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Regulace tělesné teploty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Dysfagie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Anticholinergní (antimuskarinové) účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinické studie
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Dospělí
Níže uvedené informace jsou odvozeny z databáze klinických studií pro SEROQUEL 200 mg sestávající z více než 4300 pacientů. Tato databáze zahrnuje 698 pacientů užívajících SEROQUEL pro léčbu bipolární deprese, 405 pacientů vystavených SEROQUELu 200 mg pro léčbu akutní bipolární mánie (monoterapie a doplňková terapie), 646 pacientů vystavených SEROQUELu pro udržovací léčbu bipolární poruchy I jako doplněk a přibližně 2 600 pacientů a/nebo normálních subjektů vystavených 1 nebo více dávkám přípravku SEROQUEL 200 mg pro léčbu schizofrenie.
těchto přibližně 4 300 subjektů bylo přibližně 4 000 (2 300 u schizofrenie, 405 u akutní bipolární mánie, 698 u bipolární deprese a 646 pro udržovací léčbu bipolární poruchy I) pacientů, kteří se účastnili studií účinnosti více dávek, a jejich zkušenosti odpovídaly přibližně 2400 pacientoroků. Podmínky a délka léčby přípravkem SEROQUEL 200 mg se velmi lišily a zahrnovaly (v překrývajících se kategoriích) otevřené a dvojitě zaslepené fáze studií, hospitalizované a ambulantní pacienty, studie s fixní dávkou a titrací dávky a krátkodobé nebo dlouhodobé studie. vystavení. Nežádoucí účinky byly hodnoceny sběrem nežádoucích účinků, výsledků fyzikálních vyšetření, vitálních funkcí, hmotnosti, laboratorních analýz, EKG a výsledků oftalmologických vyšetření.
Uvedené frekvence nežádoucích účinků představují podíl jedinců, kteří alespoň jednou zaznamenali nežádoucí účinek uvedeného typu.
Nežádoucí reakce spojené s přerušením léčby v krátkodobých, placebem kontrolovaných studiích
Schizofrenie
Celkově byl ve skupině kontrolovaných studií malý rozdíl ve výskytu přerušení léčby z důvodu nežádoucích účinků (4 % u SEROQUELu vs. 3 % u placeba). Nicméně přerušení z důvodu somnolence (0,8 % SEROQUEL 100 mg vs. 0 % placebo) a hypotenze (0,4 % SEROQUEL 200 mg vs. 0 % placebo) bylo považováno za související s lékem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Bipolární porucha
Mánie
Celkově bylo přerušení léčby z důvodu nežádoucích účinků 5,7 % u SEROQUELU 25 mg vs. 5,1 % u placeba v monoterapii a 3,6 % u SEROQUELu vs. 5,9 % u placeba v doplňkové léčbě.
Deprese
Celkově bylo přerušení z důvodu nežádoucích účinků 12,3 % u SEROQUELu 300 mg oproti 19,0 % u SEROQUELu 600 mg a 5,2 % u placeba.
Běžně pozorované nežádoucí reakce v krátkodobých, placebem kontrolovaných studiích
Ve studiích akutní léčby schizofrenie (až 6 týdnů) a bipolární mánie (až 12 týdnů) byly nejčastěji pozorované nežádoucí účinky spojené s použitím přípravku SEROQUEL v monoterapii (výskyt 5 % nebo vyšší) a pozorované s frekvencí SEROQUEL nejméně dvakrát vyšší než u placeba byly somnolence (18 %), závratě (11 %), sucho v ústech (9 %), zácpa (8 %), zvýšení ALT (5 %), přírůstek hmotnosti (5 %) a dyspepsie ( 5 %).
Nežádoucí účinky vyskytující se s incidencí 2 % nebo více mezi pacienty léčenými SEROQUEL v krátkodobých, placebem kontrolovaných studiích
Předepisující lékař by si měl být vědom toho, že údaje v tabulkách a tabulkách nelze použít k předpovědi výskytu nežádoucích účinků v průběhu běžné lékařské praxe, kde se charakteristiky pacienta a další faktory liší od těch, které převládaly v klinických studiích. Podobně nelze uvedené frekvence porovnávat s údaji získanými z jiných klinických studií zahrnujících různé způsoby léčby, použití a zkoušející. Uvedené údaje však poskytují předepisujícímu lékaři určitý základ pro odhad relativního podílu léčivých a nelékových faktorů na výskytu nežádoucích účinků ve studované populaci.
Tabulka 9 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během akutní léčby schizofrenie (až 6 týdnů) a bipolární mánie (až 12 týdnů) u 2 % nebo více pacientů léčených přípravkem SEROQUEL (dávky v rozmezí od 75 do 800 mg/den), kde byl výskyt u pacientů léčených přípravkem SEROQUEL vyšší než u pacientů léčených placebem.
Ve studiích akutní doplňkové terapie bipolární mánie (až 3 týdny) byly nejčastěji pozorované nežádoucí účinky spojené s užíváním přípravku SEROQUEL (výskyt 5 % nebo vyšší) a pozorované v míře u přípravku SEROQUEL nejméně dvakrát vyšší než u placeba somnolence (34 %), sucho v ústech (19 %), astenie (10 %), zácpa (10 %), bolest břicha (7 %), posturální hypotenze (7 %), faryngitida (6 %) a přírůstek hmotnosti (6 %).
Tabulka 10 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během léčby (až 3 týdny) akutní mánie u 2 % nebo více pacientů léčených SEROQUEL (dávky v rozmezí 100 až 800 mg/den). jako přídatná léčba k lithiu a divalproexu, kde byla incidence u pacientů léčených SEROQUELem vyšší než u pacientů léčených placebem.
Ve studiích bipolární deprese (až 8 týdnů) byly nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním přípravku SEROQUEL (výskyt 5 % nebo vyšší) a pozorovanými u SEROQUELu 200 mg alespoň dvakrát častěji než u placeba ospalost (57 % ), sucho v ústech (44 %), závratě (18 %), zácpa (10 %) a letargie (5 %).
Tabulka 11 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se objevily během léčby (až 8 týdnů) bipolární deprese u 2 % nebo více pacientů léčených SEROQUELem (dávky 300 a 600 mg/den), kde incidence u pacientů léčených SEROQUELem byla vyšší než u pacientů léčených placebem.
Průzkumy interakcí na základě pohlaví, věku a rasy neodhalily žádné klinicky významné rozdíly ve výskytu nežádoucích účinků na základě těchto demografických faktorů.
Dávková závislost nežádoucích reakcí v krátkodobých, placebem kontrolovaných studiích
Nežádoucí účinky závislé na dávce
Spontánně vyvolané údaje o nežádoucích účincích ze studie schizofrenie porovnávající pět fixních dávek přípravku SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg a 750 mg/den) s placebem byly zkoumány z hlediska závislosti nežádoucích účinků na dávce. Logistické regresní analýzy odhalily pozitivní odpověď na dávku (p
Nežádoucí účinky v klinických studiích s kvetiapinem a neuvedené jinde na štítku:
U kvetiapinu byly také hlášeny následující nežádoucí účinky: noční můry, hypersenzitivita a zvýšení sérové kreatinfosfokinázy (nesouvisející s NMS), galaktorea, bradykardie (které se mohou objevit na začátku léčby nebo těsně před zahájením léčby a mohou být spojeny s hypotenzí a/nebo synkopou ) snížení počtu krevních destiček, somnambulismus (a další související příhody), zvýšení hladin gama-GT, hypotermie, dušnost, eozinofilie, retence moči, střevní obstrukce a priapismus.
Extrapyramidové příznaky (EPS)
Dystonie
Třídní efekt
Příznaky dystonie, prodloužené abnormální kontrakce svalových skupin, se mohou objevit u vnímavých jedinců během prvních několika dnů léčby. Dystonické příznaky zahrnují: křeče šíjových svalů, někdy progredující do sevření hrdla, potíže s polykáním, potíže s dýcháním a/nebo vyčnívání jazyka. I když se tyto příznaky mohou objevit při nízkých dávkách, vyskytují se častěji as větší závažností při vysoké účinnosti a při vyšších dávkách antipsychotik první generace. Zvýšené riziko akutní dystonie je pozorováno u mužů a mladších věkových skupin.
K měření EPS byly použity čtyři metody: (1) Simpsonovo-Angusovo celkové skóre (průměrná změna od výchozí hodnoty), které hodnotí parkinsonismus a akatizii, (2) Barnesova hodnotící škála Akathisie (BARS) Global Assessment Score, (3) výskyt spontánních stížností EPS (akatizie, akineze, rigidita ozubeného kola, extrapyramidový syndrom, hypertonie, hypokineze, ztuhlost krku a třes) a (4) použití anticholinergních léků k léčbě EPS.
Dospělí
Údaje z jedné 6týdenní klinické studie schizofrenie porovnávající pět fixních dávek SEROQUELU (75, 150, 300, 600, 750 mg/den) poskytly důkazy o absenci extrapyramidových příznaků (EPS) a závislosti na dávce u EPS spojené s SEROQUELem 100mg léčba. K měření EPS byly použity tři metody: (1) Simpsonovo-Angusovo celkové skóre (průměrná změna od výchozí hodnoty), které hodnotí parkinsonismus a akatizii, (2) výskyt spontánních stížností na EPS (akatizie, akineze, rigidita ozubeného kola, extrapyramidový syndrom, hypertonie, hypokineze, ztuhlost krku a třes) a (3) užívání anticholinergních léků k EPS.
tabulce 12 dystonická příhoda zahrnovala nuchální rigiditu, hypertonii, dystonii, svalovou rigiditu, okulogyraci; parkinsonismus zahrnoval rigiditu ozubeného kola, třes, slintání, hypokinezi; akatizie zahrnovala akatizii, psychomotorickou agitaci; dyskinetická příhoda zahrnovala tardivní dyskinezi, dyskinezi, choreoatetózu; a další extrapyramidové příhody zahrnovaly neklid, extrapyramidovou poruchu, poruchu hybnosti.
Míry výskytu parkinsonismu měřené celkovým skóre Simpson-Angus pro placebo a pět fixních dávek (75, 150, 300, 600, 750 mg/den) byly: -0,6; -1,0, -1,2; -1,6; -1,8 a -1,8. Míra použití anticholinergní medikace k léčbě EPS pro placebo a pět fixních dávek byla: 14 %; 11 %; 10 %; 8 %; 12 % a 11 %.
šesti dalších placebem kontrolovaných klinických studiích (3 u akutní mánie a 3 u schizofrenie) s použitím různých dávek SEROQUELu nebyly zjištěny žádné rozdíly mezi léčebnými skupinami SEROQUEL a placebem v incidenci EPS, jak bylo hodnoceno celkovým skóre Simpson-Angus, spontánní stížnosti na EPS a použití souběžných anticholinergních léků k léčbě EPS.
Ve dvou placebem kontrolovaných klinických studiích léčby bipolární deprese s použitím 300 mg a 600 mg přípravku SEROQUEL 100 mg byla incidence nežádoucích účinků potenciálně souvisejících s EPS 12 % v obou dávkových skupinách a 6 % ve skupině s placebem. V těchto studiích byl výskyt jednotlivých nežádoucích účinků (akatizie, extrapyramidová porucha, třes, dyskineze, dystonie, neklid, mimovolní svalové kontrakce, psychomotorická hyperaktivita a svalová rigidita) obecně nízký a nepřesáhl 4 % v žádné léčebné skupině.
Tyto 3 léčebné skupiny byly podobné v průměrné změně celkového skóre SAS a skóre BARS Global Assessment na konci léčby. Použití souběžných anticholinergních léků bylo vzácné a podobné ve všech třech léčebných skupinách.
Děti A Dospívající
Níže uvedené informace jsou odvozeny z databáze klinických studií pro SEROQUEL 200 mg sestávající z více než 1000 pediatrických pacientů. Tato databáze zahrnuje 677 pacientů vystavených přípravku SEROQUEL 200 mg k léčbě schizofrenie a 393 dětí a dospívajících (10-17 let) vystavených přípravku SEROQUEL k léčbě akutní bipolární mánie.
Nežádoucí účinky spojené s přerušením léčby v krátkodobých, placebem kontrolovaných studiích
Schizofrenie
Incidence přerušení léčby z důvodu nežádoucích účinků u pacientů léčených kvetiapinem a placeba byla 8,2 % a 2,7 %. Nežádoucí příhodou vedoucí k přerušení léčby u 1 % nebo více pacientů užívajících SEROQUEL as vyšší incidencí než u placeba byla somnolence (2,7 % a 0 % u placeba).
Bipolární I Mania
Incidence přerušení léčby z důvodu nežádoucích účinků u pacientů léčených kvetiapinem a placeba byla 11,4 %, respektive 4,4 %. Nežádoucí účinky vedoucí k přerušení léčby u 2 % nebo více pacientů užívajících SEROQUEL as vyšší incidencí než u placeba byly somnolence (4,1 % vs. 1,1 %) a únava (2,1 % vs. 0).
Běžně pozorované nežádoucí reakce v krátkodobých, placebem kontrolovaných studiích
Při léčbě schizofrenie (až 6 týdnů) byly nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním kvetiapinu u dospívajících (výskyt 5 % nebo vyšší a výskyt kvetiapinu alespoň dvojnásobný než u placeba) somnolence (34 %), závratě (12 %), sucho v ústech (7 %), tachykardie (7 %).
Při léčbě bipolární mánie (až 3 týdny) byly nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním kvetiapinu u dětí a dospívajících (výskyt 5 % nebo vyšší a výskyt kvetiapinu alespoň dvakrát vyšší než u placeba) somnolence (53 %), závratě (18 %), únava (11 %), zvýšená chuť k jídlu (9 %), nevolnost (8 %), zvracení (8 %), tachykardie (7 %), sucho v ústech (7 %) a zvýšení tělesné hmotnosti (6 %) ).
V akutní (8týdenní) studii SEROQUEL 100 mg XR u dětí a dospívajících (10-17 let) s bipolární depresí, ve které nebyla stanovena účinnost, byly nejčastěji pozorované nežádoucí účinky spojené s užíváním SEROQUEL XR (incidence 5 % nebo více a alespoň dvakrát více než u placeba) byly závratě 7 %, průjem 5 %, únava 5 % a nevolnost 5 %.
Nežádoucí účinky vyskytující se s incidencí ≥ 2 % u pacientů léčených SEROQUEL 300 mg v krátkodobých, placebem kontrolovaných studiích
Schizofrenie (dospívající, 13–17 let)
Následující zjištění byla založena na 6týdenní placebem kontrolované studii, ve které byl kvetiapin podáván buď v dávkách 400 nebo 800 mg/den.
Tabulka 13 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se vyskytly během léčby (až 6 týdnů) schizofrenie u 2 % nebo více pacientů léčených SEROQUELem (dávky 400 nebo 800 mg/den), kde výskyt u pacientů léčených přípravkem SEROQUEL byla incidence nejméně dvojnásobná ve srovnání s pacienty léčenými placebem.
Nežádoucí účinky, které byly potenciálně závislé na dávce s vyšší frekvencí ve skupině 800 mg ve srovnání se skupinou 400 mg, zahrnovaly závratě (8 % vs. 15 %), sucho v ústech (4 % vs. 10 %) a tachykardii (6 % vs. 11 %).
Bipolární I Mania (děti a dospívající ve věku 10–17 let)
Následující zjištění byla založena na 3týdenní placebem kontrolované studii, ve které byl kvetiapin podáván buď v dávkách 400 nebo 600 mg/den.
Běžně pozorované nežádoucí účinky
Při léčbě bipolární mánie (až 3 týdny) byly nejčastěji pozorovanými nežádoucími účinky spojenými s užíváním kvetiapinu u dětí a dospívajících (výskyt 5 % nebo vyšší a výskyt kvetiapinu alespoň dvakrát vyšší než u placeba) somnolence (53 %), závratě (18 %), únava (11 %), zvýšená chuť k jídlu (9 %), nevolnost (8 %), zvracení (8 %), tachykardie (7 %), sucho v ústech (7 %) a zvýšení tělesné hmotnosti (6 %) ).
Tabulka 14 uvádí incidenci, zaokrouhlenou na nejbližší procenta, nežádoucích účinků, které se objevily během léčby (až 3 týdny) bipolární mánie u 2 % nebo více pacientů léčených SEROQUELem (dávky 400 nebo 600 mg/den), kde incidence u pacientů léčených SEROQUELem byla vyšší než u pacientů léčených placebem.
Nežádoucí účinky, které byly potenciálně závislé na dávce s vyšší frekvencí ve skupině 600 mg ve srovnání se skupinou 400 mg, zahrnovaly somnolenci (50 % vs. 57 %), nauzeu (6 % vs. 10 %) a tachykardii (6 % vs. 9 %).
Extrapyramidové příznaky
krátkodobé placebem kontrolované monoterapeutické studii u dospívajících pacientů se schizofrenií (trvání 6 týdnů) byla agregovaná incidence extrapyramidových příznaků 12,9 % (19/147) u přípravku SEROQUEL 100 mg a 5,3 % (4/75) u placeba, ačkoli výskyt jednotlivých nežádoucích účinků (akatizie, třes, extrapyramidová porucha, hypokineze, neklid, psychomotorická hyperaktivita, svalová rigidita, dyskineze) nepřesáhl 4,1 % v žádné léčebné skupině. V krátkodobé placebem kontrolované monoterapeutické studii u dětí a dospívajících pacientů s bipolární mánií (trvání 3 týdny) byla agregovaná incidence extrapyramidových symptomů 3,6 % (7/193) nebo SEROQUEL a 1,1 % (1/90) u placebo.
Tabulka 15 uvádí seznam pacientů s nežádoucími reakcemi potenciálně spojenými s extrapyramidovými symptomy v krátkodobé placebem kontrolované monoterapeutické studii u dospívajících pacientů se schizofrenií (trvání 6 týdnů).
tabulkách 15–16 dystonická příhoda zahrnovala nuchální rigiditu, hypertonii a svalovou rigiditu; parkinsonismus zahrnoval ztuhlost ozubených kol a třes; akatizie zahrnovala pouze akatizii; dyskinetická příhoda zahrnovala tardivní dyskinezi, dyskinezi a choreoatetózu; a další extrapyramidové příhody zahrnovaly neklid a extrapyramidové poruchy.
Tabulka 16 uvádí seznam pacientů s nežádoucími účinky spojenými s extrapyramidovými příznaky v krátkodobé placebem kontrolované monoterapeutické studii u dětí a dospívajících pacientů s bipolární mánií (trvání 3 týdny).
Laboratorní, EKG a změny vitálních funkcí pozorované v klinických studiích
Laboratorní změny
Počet neutrofilů
Dospělí
placebem kontrolovaných monoterapeutických klinických studiích zahrnujících 3368 pacientů užívajících kvetiapin-fumarát a 1515 pacientů užívajících placebo byla incidence alespoň jednoho výskytu počtu neutrofilů VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zvýšení transamináz
Dospělí
Bylo hlášeno asymptomatické, přechodné a reverzibilní zvýšení sérových transamináz (především ALT). Ve studiích schizofrenie u dospělých byl podíl pacientů se zvýšením transamináz > 3násobkem horní hranice normálního referenčního rozmezí ve skupině 3 až 6týdenních placebem kontrolovaných studií přibližně 6 % (29/483) pro SEROQUEL ve srovnání s 1 % (3/194) u placeba. Ve studiích akutní bipolární mánie u dospělých byl podíl pacientů se zvýšením transamináz > 3násobkem horní hranice normálního referenčního rozmezí v souboru 3 až 12týdenních placebem kontrolovaných studií přibližně 1 % pro oba SEROQUEL (3 /560) a placebo (3/294). Tato zvýšení jaterních enzymů se obvykle objevila během prvních 3 týdnů léčby a rychle se vrátila na úroveň před studií s pokračující léčbou SEROQUELem. Ve studiích bipolární deprese byl podíl pacientů se zvýšením transamináz > 3násobkem horní hranice normálního referenčního rozmezí ve dvou 8týdenních placebem kontrolovaných studiích 1 % (5/698) pro SEROQUEL 50 mg a 2 % (6/ 347) pro placebo.
Snížený hemoglobin
Dospělí
V krátkodobých placebem kontrolovaných studiích došlo k poklesu hemoglobinu na ≤ 13 g/dl u mužů, ≤ 12 g/dl u žen alespoň jednou u 8,3 % (594/7 155) pacientů léčených kvetiapinem ve srovnání s 6,2 % ( 219/3536) pacientů léčených placebem. V databázi kontrolovaných a nekontrolovaných klinických studií došlo k poklesu hemoglobinu na ≤ 13 g/dl u mužů, ≤ 12 g/dl u žen alespoň v jednom případě u 11 % (2277/20 729) pacientů léčených kvetiapinem.
Interference s obrazovkami proti drogám v moči
V literatuře byly hlášeny falešně pozitivní výsledky enzymatických imunoanalýz v moči na metadon a tricyklická antidepresiva u pacientů, kteří užívali kvetiapin. Při interpretaci pozitivních výsledků screeningu těchto léků v moči je třeba postupovat opatrně a je třeba zvážit potvrzení alternativní analytickou technikou (např. chromatografickými metodami).
Změny EKG
Dospělí
Srovnání mezi skupinami ve sdružených placebem kontrolovaných studiích neodhalilo žádné statisticky významné rozdíly mezi SEROQUEL/placebem v podílech pacientů, u kterých došlo k potenciálně významným změnám parametrů EKG, včetně intervalů QT, QTc a PR. Podíl pacientů splňujících kritéria pro tachykardii však byl porovnán ve čtyřech 3 až 6týdenních placebem kontrolovaných klinických studiích léčby schizofrenie, které odhalily 1% (4/399) výskyt pro SEROQUEL 100 mg ve srovnání s 0,6% (1 /156) výskyt pro placebo. Ve studiích akutní (monoterapie) bipolární mánie byl podíl pacientů splňujících kritéria pro tachykardii 0,5 % (1/192) pro SEROQUEL 200 mg ve srovnání s 0 % (0/178) výskytem u placeba. Ve studiích akutní bipolární mánie (adjuvantní) byl podíl pacientů splňujících stejná kritéria 0,6 % (1/166) pro SEROQUEL 100 mg ve srovnání s 0 % (0/171) výskytem u placeba. Ve studiích bipolární deprese nedošlo u žádného pacienta ke zvýšení srdeční frekvence na > 120 tepů za minutu. Užívání přípravku SEROQUEL 50 mg bylo spojeno s průměrným zvýšením srdeční frekvence, hodnoceným pomocí EKG, o 7 tepů za minutu ve srovnání s průměrným zvýšením o 1 tep za minutu u pacientů s placebem. Tato mírná tendence k tachykardii u dospělých může souviset s potenciálem SEROQUELu indukovat ortostatické změny (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Děti a dospívající
V akutní (6týdenní) studii schizofrenie u dospívajících došlo ke zvýšení srdeční frekvence (>110 tepů/min) u 5,2 % (3/73) pacientů užívajících SEROQUEL 400 mg a 8,5 % (5/74) pacientů užívajících SEROQUEL 800 mg ve srovnání s 0 % (0/75) pacientů užívajících placebo. Průměrné zvýšení srdeční frekvence bylo 3,8 tepů za minutu a 11,2 tepů za minutu u skupin SEROQUEL 400 mg a 800 mg, v tomto pořadí, ve srovnání s poklesem o 3,3 tepů za minutu ve skupině s placebem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ve studii akutní (3týdenní) bipolární mánie u dětí a dospívajících došlo ke zvýšení srdeční frekvence (>110 tepů/min) u 1,1 % (1/89) pacientů užívajících SEROQUEL 400 mg a 4,7 % (4/85) pacientů užívající SEROQUEL 600 mg ve srovnání s 0 % (0/98) pacientů užívajících placebo. Průměrné zvýšení srdeční frekvence bylo 12,8 tepů za minutu a 13,4 tepů za minutu u skupin SEROQUEL 400 mg a 600 mg, v tomto pořadí, ve srovnání s poklesem o 1,7 tepů za minutu ve skupině s placebem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
akutní (8týdenní) studii SEROQUEL XR u dětí a dospívajících (10-17 let) s bipolární depresí, ve které nebyla stanovena účinnost, došlo ke zvýšení srdeční frekvence (>110 tepů/min 10-12 let a 13-17 let) se vyskytla u 0 % pacientů užívajících SEROQUEL XR a 1,2 % pacientů užívajících placebo. Průměrné zvýšení srdeční frekvence bylo 3,4 tepů za minutu pro SEROQUEL XR ve srovnání s 0,3 tepy za minutu ve skupině s placebem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny po schválení přípravku SEROQUEL. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Nežádoucí účinky hlášené od uvedení na trh, které dočasně souvisely s léčbou kvetiapinem, zahrnují anafylaktickou reakci, kardiomyopatii, lékovou reakci s eozinofilií a systémovými příznaky (DRESS), hyponatrémii, myokarditidu, noční enurézu, pankreatitidu, retrográdní amnézii, rhabdomyolýzu, syndrom nepřiměřené antidiuretické sekrece (SIADH), Stevens-Johnsonův syndrom (SJS), toxická epidermální nekrolýza (TEN), snížený počet krevních destiček, závažné jaterní reakce (včetně hepatitidy, nekrózy jater a selhání jater), agranulocytóza, střevní obstrukce, ileus, ischemie tlustého střeva, retence moči spánková apnoe a akutní generalizovaná exantematózní pustulóza (AGEP).
DROGOVÉ INTERAKCE
Vliv Jiných Léků Na Kvetiapin
Rizika užívání přípravku SEROQUEL v kombinaci s jinými léky nebyla v systematických studiích rozsáhle hodnocena. Vzhledem k primárním účinkům přípravku SEROQUEL na CNS je třeba opatrnosti při jeho užívání v kombinaci s jinými centrálně působícími léky. SEROQUEL 300 mg potencoval kognitivní a motorické účinky alkoholu v klinické studii u jedinců s vybranými psychotickými poruchami a při užívání kvetiapinu je třeba omezit alkoholické nápoje.
Expozice kvetiapinu je zvýšena prototypovými inhibitory CYP3A4 (např. ketokonazol, itrakonazol, indinavir, ritonavir, nefazodon atd.) a snížena prototypovými induktory CYP3A4 (např. fenytoin, karbamazepin, rifampin, avasimib, třezalka atd.) . Úprava dávky kvetiapinu bude nezbytná, pokud je podáván současně se silnými induktory nebo inhibitory CYP3A4.
Inhibitory CYP3A4
Současné podávání ketokonazolu, silného inhibitoru cytochromu CYP3A4, vedlo k významnému zvýšení expozice kvetiapinu. Dávka přípravku SEROQUEL 200 mg by měla být snížena na jednu šestinu původní dávky, pokud je podáván současně se silným inhibitorem CYP3A4 (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Induktory CYP3A4
Současné podávání kvetiapinu a fenytoinu, induktoru CYP3A4, zvýšilo průměrnou perorální clearance kvetiapinu 5krát. K udržení kontroly příznaků schizofrenie u pacientů užívajících kvetiapin a fenytoin nebo jiné známé silné induktory CYP3A4 mohou být nutné zvýšené dávky přípravku SEROQUEL 50 mg až 5krát (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ]. Když se vysadí induktor CYP3A4, dávka přípravku SEROQUEL 25 mg by měla být snížena na původní úroveň během 7-14 dnů (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Byly studovány potenciální účinky několika současně podávaných léků na farmakokinetiku kvetiapinu [viz KLINICKÁ FARMAKOLOGIE ].
Vliv kvetiapinu na jiné léky
Vzhledem ke svému potenciálu indukovat hypotenzi může SEROQUEL 50 mg zvýšit účinky některých antihypertenziv.
SEROQUEL 25 mg může antagonizovat účinky levodopy a agonistů dopaminu.
Neexistují žádné klinicky relevantní farmakokinetické interakce přípravku Seroquel s jinými léky na základě CYP. Seroquel 50 mg a jeho metabolity jsou neinhibitory hlavních metabolizujících CYP (1A2, 2C9, 2C19, 2D6 a 3A4).
Zneužívání drog a závislost
Kontrolovaná látka
SEROQUEL není kontrolovaná látka.
Zneužívání
SEROQUEL nebyl systematicky studován na zvířatech ani na lidech pro svůj potenciál pro zneužívání, toleranci nebo fyzickou závislost. I když klinické studie neodhalily žádnou tendenci k nějakému chování při vyhledávání drog, tato pozorování nebyla systematická a na základě těchto omezených zkušeností není možné předpovědět, do jaké míry bude léčivo působící na CNS zneužito, odkloněno, a/nebo zneužity po uvedení na trh. V důsledku toho by pacienti měli být pečlivě vyšetřeni na anamnézu zneužívání drog a tito pacienti by měli být pečlivě sledováni, zda se u nich nevyskytují známky nesprávného užívání nebo zneužívání přípravku SEROQUEL, např. rozvoj tolerance, zvýšení dávky, chování při vyhledávání drog.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí
starších pacientů s psychózou související s demencí, kteří jsou léčeni antipsychotiky, je zvýšené riziko úmrtí. Analýza 17 placebem kontrolovaných studií (modální trvání 10 týdnů), převážně u pacientů užívajících atypická antipsychotika, odhalila riziko úmrtí u pacientů léčených drogami 1,6 až 1,7krát vyšší než riziko úmrtí u pacientů léčených placebem. V průběhu typické 10týdenní kontrolované studie byla míra úmrtí u pacientů léčených léky asi 4,5 % ve srovnání s mírou asi 2,6 % ve skupině s placebem. Ačkoli byly příčiny úmrtí různé, většina úmrtí se zdála být kardiovaskulárního (např. srdeční selhání, náhlá smrt) nebo infekční (např. zápal plic). Observační studie naznačují, že podobně jako u atypických antipsychotik může léčba konvenčními antipsychotiky zvyšovat mortalitu. Není jasné, do jaké míry lze zjištění zvýšené úmrtnosti v observačních studiích přičíst antipsychotickému léku na rozdíl od některých charakteristik pacientů. SEROQUEL není schválen pro léčbu pacientů s psychózou související s demencí [viz VAROVÁNÍ V KRABICE ].
Sebevražedné myšlenky a chování u dospívajících a mladých dospělých
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a dalších) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (ve věku 18–24 let) s těžkou depresivní poruchou. poruchy (MDD) a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně-kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl mezi léky a placebem v počtu případů suicidality na 1000 léčených pacientů) jsou uvedeny v tabulce 2.
žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými se vyskytly sebevraždy, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky. popsané výše, stejně jako vznik sebevražednosti, a takové příznaky okamžitě hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro SEROQUEL by měly být napsány na nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy, včetně přípravku SEROQUEL, by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda u nich existuje riziko bipolární poruchy; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese.
Cerebrovaskulární nežádoucí reakce, včetně mrtvice, u starších pacientů s psychózou související s demencí
V placebem kontrolovaných studiích s risperidonem, aripiprazolem a olanzapinem u starších pacientů s demencí byla ve srovnání se subjekty léčenými placebem vyšší incidence cerebrovaskulárních nežádoucích účinků (cerebrovaskulární příhody a přechodné ischemické ataky) včetně úmrtí. SEROQUEL není schválen pro léčbu pacientů s psychózou související s demencí (viz také VAROVÁNÍ V KRABICE a Zvýšená úmrtnost u starších pacientů s psychózou související s demencí ].
Neuroleptický maligní syndrom (NMS)
souvislosti s podáváním antipsychotik, včetně přípravku SEROQUEL, byl hlášen potenciálně fatální komplex symptomů, někdy označovaný jako neuroleptický maligní syndrom (NMS). U přípravku SEROQUEL byly hlášeny vzácné případy NMS. Klinickými projevy NMS jsou hyperpyrexie, svalová rigidita, změněný duševní stav a známky autonomní nestability (nepravidelný puls nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatininfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní selhání ledvin.
Diagnostické hodnocení pacientů s tímto syndromem je složité. Při stanovení diagnózy je důležité vyloučit případy, kdy klinický obraz zahrnuje jak závažné onemocnění (např. zápal plic, systémová infekce atd.), tak neléčené nebo nedostatečně léčené extrapyramidové příznaky a symptomy (EPS). Další důležitá hlediska v diferenciální diagnostice zahrnují centrální anticholinergní toxicitu, úpal, horečku po drogách a primární patologii centrálního nervového systému (CNS).
Léčba NMS by měla zahrnovat: 1) okamžité vysazení antipsychotik a jiných léků, které nejsou nezbytné pro souběžnou léčbu; 2) intenzivní symptomatická léčba a lékařské sledování; a 3) léčba jakýchkoli doprovodných vážných zdravotních problémů, pro které je k dispozici specifická léčba. Neexistuje obecná shoda ohledně specifických farmakologických léčebných režimů pro NMS.
Vyžaduje-li pacient po zotavení z NMS léčbu antipsychotickými léky, je třeba pečlivě zvážit případné znovuzavedení lékové terapie. Pacient by měl být pečlivě sledován, protože byly hlášeny recidivy NMS.
Metabolické změny
Atypická antipsychotika jsou spojována s metabolickými změnami, které zahrnují hyperglykémii/diabetes mellitus, dyslipidémii a nárůst tělesné hmotnosti. I když bylo prokázáno, že všechny léky ve třídě vyvolávají určité metabolické změny, každý lék má svůj vlastní specifický rizikový profil. U některých pacientů bylo v klinických studiích pozorováno zhoršení více než jednoho z metabolických parametrů hmotnosti, glukózy v krvi a lipidů. Změny v těchto metabolických profilech by měly být klinicky vhodné.
Hyperglykémie A Diabetes Mellitus
pacientů léčených atypickými antipsychotiky, včetně kvetiapinu, byla hlášena hyperglykémie, v některých případech extrémní a spojená s ketoacidózou nebo hyperosmolárním kómatem nebo smrtí. Posouzení vztahu mezi atypickým užíváním antipsychotik a glukózovými abnormalitami je komplikováno možností zvýšeného základního rizika diabetes mellitus u pacientů se schizofrenií a zvyšujícím se výskytem diabetes mellitus v běžné populaci. Vzhledem k těmto matoucím faktorům není vztah mezi atypickým užíváním antipsychotik a nežádoucími účinky souvisejícími s hyperglykémií zcela objasněn. Epidemiologické studie však naznačují zvýšené riziko nežádoucích účinků souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky. Přesné odhady rizik nežádoucích reakcí souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky nejsou k dispozici.
Pacienti s prokázanou diagnózou diabetes mellitus, u kterých byla zahájena léčba atypickými antipsychotiky, by měli být pravidelně sledováni, zda nedochází ke zhoršení glukózové kontroly. Pacienti s rizikovými faktory pro diabetes mellitus (např. obezita, rodinná anamnéza diabetu), kteří zahajují léčbu atypickými antipsychotiky, by měli podstoupit vyšetření glykémie nalačno na začátku léčby a pravidelně během léčby. U každého pacienta léčeného atypickými antipsychotiky je třeba sledovat příznaky hyperglykémie včetně polydipsie, polyurie, polyfagie a slabosti. Pacienti, u kterých se během léčby atypickými antipsychotiky objeví příznaky hyperglykémie, by měli podstoupit vyšetření glykémie nalačno. V některých případech hyperglykémie ustoupila po vysazení atypického antipsychotika; někteří pacienti však vyžadovali pokračování v antidiabetické léčbě i přes vysazení podezřelého léku.
Dospělí
Ve 24týdenní studii (aktivní kontrolovaná, 115 pacientů léčených SEROQUELem) navržené k vyhodnocení glykemického stavu pomocí orálního glukózového tolerančního testu u všech pacientů byla ve 24. týdnu incidence hladiny glukózy po stimulaci glukózou ≥200 mg/dl 1,7 % a výskyt hladiny glukózy v krvi nalačno ≥ 126 mg/dl byl 2,6 %. Průměrná změna glykémie nalačno od výchozí hodnoty byla 3,2 mg/dl a průměrná změna 2hodinové glykémie od výchozí hodnoty byla -1,8 mg/dl pro kvetiapin.
Ve 2 dlouhodobých placebem kontrolovaných randomizovaných klinických studiích s vysazením bipolární poruchy I, průměrná expozice 213 dnů u SEROQUEL (646 pacientů) a 152 dnů u placeba (680 pacientů), byla průměrná změna glukosy oproti výchozí hodnotě +5,0 mg /dl pro SEROQUEL 100 mg a –0,05 mg/dl pro placebo. Expozičně upravená rychlost jakékoli zvýšené hladiny glukózy v krvi (≥126 mg/dl) u pacientů po více než 8 hodinách od jídla (některým pacientům však nemuselo být zabráněno v příjmu kalorií z tekutin během období nalačno) byla 18,0 na 100 pacientoroků pro SEROQUEL (10,7 % pacientů; n=556) a 9,5 pro placebo na 100 pacientoroků (4,6 % pacientů; n=581).
Děti a dospívající
placebem kontrolované monoterapeutické studii SEROQUEL 25 mg u dospívajících pacientů (13-17 let) se schizofrenií (trvání 6 týdnů) byla průměrná změna hladin glukózy nalačno pro SEROQUEL (n=138) ve srovnání s placebem (n=67). byla – 0,75 mg/dl oproti –1,70 mg/dl. V placebem kontrolované monoterapeutické studii SEROQUEL 300 mg u dětí a dospívajících pacientů (10-17 let) s bipolární mánií (trvání 3 týdny) byla průměrná změna hladiny glukózy nalačno pro SEROQUEL (n=170) ve srovnání s placebem (n =81) byla 3,62 mg/dl oproti –1,17 mg/dl. Žádný pacient v žádné studii s výchozí normální hladinou glukózy nalačno (
placebem kontrolované monoterapeutické studii SEROQUEL XR (trvání 8 týdnů) u dětí a dospívajících pacientů (1017 let) s bipolární depresí, ve které nebyla stanovena účinnost, byla průměrná změna hladin glukózy nalačno pro SEROQUEL 300 mg XR (n= 60) ve srovnání s placebem (n=62) byla 1,8 mg/dl oproti 1,6 mg/dl. V této studii nebyli žádní pacienti ve skupinách léčených přípravkem SEROQUEL XR nebo placebem s výchozí normální hladinou glukózy nalačno (126 mg/dl. Ve skupině SEROQUEL 25 mg XR byl jeden pacient s výchozí hraniční hladinou glukózy nalačno (>100 mg/dl a 126 mg/dl ve srovnání s nulou pacientů v placebo skupina.
Dyslipidémie
Dospělí
Tabulka 4 ukazuje procento dospělých pacientů se změnami celkového cholesterolu, triglyceridů, LDL-cholesterolu a HDL-cholesterolu oproti výchozí hodnotě podle indikací v klinických studiích se SEROQUELem.
Děti a dospívající
Tabulka 5 ukazuje procento dětí a dospívajících se změnami celkového cholesterolu, triglyceridů, LDL-cholesterolu a HDL-cholesterolu oproti výchozí hodnotě v klinických studiích se SEROQUELem.
V placebem kontrolované monoterapeutické studii SEROQUEL XR (trvání 8 týdnů) u dětí a dospívajících pacientů (1017 let) s bipolární depresí, ve které nebyla stanovena účinnost, bylo procento dětí a dospívajících s posuny v celkovém cholesterolu (≥200 mg/dl), triglyceridy (≥ 150 mg/dl), LDL-cholesterol (≥ 130 mg/dl) a HDL-cholesterol (≤ 40 mg/dl) od výchozích po klinicky významné hladiny byly: celkový cholesterol 8 % (7 /83) pro SEROQUEL 50 mg XR vs. 6 % (5/84) pro placebo; triglyceridy 28 % (22/80) pro SEROQUEL 100 mg XR vs. 9 % (7/82) pro placebo; LDL-cholesterol 2 % (2/86) pro SEROQUEL XR vs. 4 % (3/85) pro placebo a HDL-cholesterol 20 % (13/65) pro SEROQUEL XR vs. 15 % (11/74) pro placebo.
Přibývání na váze
klinických studiích bylo pozorováno zvýšení hmotnosti. U pacientů užívajících kvetiapin by měla být pravidelně sledována hmotnost.
Dospělí
V klinických studiích se SEROQUEL 50 mg bylo hlášeno následující zvýšení tělesné hmotnosti.
Děti a dospívající
Ve dvou klinických studiích se SEROQUEL 25 mg, jedné u bipolární mánie a jedné u schizofrenie, jsou hlášená zvýšení hmotnosti zahrnuta v tabulce 7.
Průměrná změna tělesné hmotnosti ve studii schizofrenie byla 2,0 kg ve skupině SEROQUEL 25 mg a -0,4 kg ve skupině s placebem a ve studii s bipolární mánií to bylo 1,7 kg ve skupině SEROQUEL 200 mg a 0,4 kg ve skupině s placebem.
otevřené studii, do které byli zařazeni pacienti z výše uvedených dvou pediatrických studií, 63 % pacientů (241/380) dokončilo 26týdenní léčbu přípravkem SEROQUEL. Po 26 týdnech léčby bylo průměrné zvýšení tělesné hmotnosti 4,4 kg. 45 procent pacientů přibralo ≥ 7 % své tělesné hmotnosti, neupravené pro normální růst. Za účelem úpravy na normální růst po dobu 26 týdnů bylo jako měřítko klinicky významné změny použito zvýšení BMI o alespoň 0,5 standardní odchylky od výchozí hodnoty; Po 26 týdnech léčby splnilo toto kritérium 18,3 % pacientů užívajících SEROQUEL.
V klinické studii přípravku SEROQUEL XR u dětí a dospívajících (10-17 let) s bipolární depresí, ve které nebyla stanovena účinnost, bylo procento pacientů s přírůstkem hmotnosti ≥ 7 % tělesné hmotnosti kdykoli 15 % ( 14/92) pro SEROQUEL 25 mg XR vs. 10 % (10/100) pro placebo. Průměrná změna tělesné hmotnosti byla 1,4 kg ve skupině SEROQUEL 50 mg XR vs. 0,6 kg ve skupině s placebem.
Při léčbě pediatrických pacientů přípravkem SEROQUEL 50 mg pro jakoukoli indikaci by měl být přírůstek hmotnosti posouzen oproti přírůstku hmotnosti očekávanému pro normální růst.
Tardivní dyskineze
U pacientů léčených antipsychotiky, včetně kvetiapinu, se může vyvinout syndrom potenciálně ireverzibilních, mimovolních, dyskinetických pohybů. Ačkoli se zdá, že prevalence syndromu je nejvyšší u starších osob, zejména u starších žen, není možné spoléhat na odhady prevalence, které by na začátku antipsychotické léčby předpověděly, u kterých pacientů se syndrom pravděpodobně rozvine. Není známo, zda se antipsychotické léčivé přípravky liší svým potenciálem způsobit tardivní dyskinezi.
Předpokládá se, že riziko rozvoje tardivní dyskineze a pravděpodobnost, že se stane ireverzibilní, se zvyšuje s délkou léčby a celkovou kumulativní dávkou antipsychotik podávaných pacientovi. Syndrom se však může vyvinout, i když mnohem méně často, po relativně krátkých obdobích léčby nízkými dávkami nebo může dokonce vzniknout po přerušení léčby.
Tardivní dyskineze může částečně nebo úplně odeznít, pokud je antipsychotická léčba vysazena. Antipsychotická léčba sama o sobě však může potlačit (nebo částečně potlačit) známky a příznaky syndromu, a tím případně maskovat základní proces. Účinek, který má symptomatická suprese na dlouhodobý průběh syndromu, není znám.
Vzhledem k těmto úvahám by měl být SEROQUEL 50 mg předepisován způsobem, který s největší pravděpodobností minimalizuje výskyt tardivní dyskineze. Chronická antipsychotická léčba by měla být obecně vyhrazena pro pacienty, kteří zřejmě trpí chronickým onemocněním, o kterém (1) je známo, že reagují na antipsychotika, a (2) pro které není dostupná nebo vhodná alternativní, stejně účinná, ale potenciálně méně škodlivá léčba. . U pacientů, kteří vyžadují chronickou léčbu, je třeba hledat nejnižší dávku a nejkratší dobu trvání léčby, která vede k uspokojivé klinické odpovědi. Potřeba pokračování v léčbě by měla být pravidelně přehodnocována.

Pokud se u pacienta užívajícího SEROQUEL 200 mg objeví známky a příznaky tardivní dyskineze, je třeba zvážit vysazení léku. Někteří pacienti však mohou vyžadovat léčbu přípravkem SEROQUEL 200 mg i přes přítomnost syndromu.
Hypotenze
Kvetiapin může vyvolat ortostatickou hypotenzi spojenou se závratěmi, tachykardií a u některých pacientů se synkopou, zejména během počáteční titrace dávky, což pravděpodobně odráží jeho α1-adrenergní antagonistické vlastnosti. Synkopa byla hlášena u 1 % (28/3265) pacientů léčených SEROQUELem ve srovnání s 0,2 % (2/954) na placebu a asi 0,4 % (2/527) na aktivních kontrolních lécích. Ortostatická hypotenze, závratě a synkopa mohou vést k pádům.
SEROQUEL 25 mg by měl být používán se zvláštní opatrností u pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemická choroba srdeční v anamnéze, srdeční selhání nebo poruchy převodu), cerebrovaskulárním onemocněním nebo stavy, které by mohly pacienty predisponovat k hypotenzi (dehydratace, hypovolémie a léčba antihypertenziva). Riziko ortostatické hypotenze a synkopy lze minimalizovat omezením počáteční dávky na 25 mg dvakrát denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Pokud se během titrace na cílovou dávku objeví hypotenze, je vhodný návrat k předchozí dávce v titračním schématu.
Falls
Atypická antipsychotika, včetně SEROQUEL, mohou způsobit somnolenci, posturální hypotenzi, motorickou a senzorickou nestabilitu, což může vést k pádům a následně ke zlomeninám nebo jiným zraněním. U pacientů s nemocemi, stavy nebo léky, které by mohly tyto účinky zhoršit, dokončete posouzení rizika pádu při zahájení antipsychotické léčby a opakovaně u pacientů na dlouhodobé antipsychotické léčbě.
Zvýšení krevního tlaku (děti a dospívající)
placebem kontrolovaných studiích u dětí a dospívajících se schizofrenií (trvání 6 týdnů) nebo bipolární mánií (trvání 3 týdny) byla incidence zvýšení systolického krevního tlaku (≥ 20 mmHg) kdykoliv 15,2 % (51/335 ) pro SEROQUEL 50 mg a 5,5 % (9/163) pro placebo; incidence zvýšení diastolického krevního tlaku (≥10 mmHg) byla 40,6 % (136/335) pro SEROQUEL a 24,5 % (40/163) pro placebo. Ve 26týdenní otevřené klinické studii prodělalo jedno dítě s hlášenou anamnézou hypertenze hypertenzní krizi. Krevní tlak u dětí a dospívajících by měl být měřen na začátku léčby a pravidelně v jejím průběhu.
placebem kontrolované klinické studii SEROQUEL XR (trvání 8 týdnů) u dětí a dospívajících (10-17 let) s bipolární depresí, ve které nebyla stanovena účinnost, byla incidence zvýšení systolického krevního tlaku kdykoli (≥ 20 mmHg) byla 6,5 % (6/92) pro SEROQUEL XR a 6,0 % (6/100) pro placebo; incidence zvýšení diastolického krevního tlaku (≥10 mmHg) byla 46,7 % (43/92) pro SEROQUEL 25 mg XR a 36,0 % (36/100) pro placebo.
Leukopenie, neutropenie a agranulocytóza
V klinických studiích a po uvedení přípravku na trh byly hlášeny případy leukopenie/neutropenie přechodně související s atypickými antipsychotiky, včetně přípravku SEROQUEL. Byla hlášena agranulocytóza.
kvetiapinu byla hlášena agranulocytóza (definovaná jako absolutní počet neutrofilů
Mezi možné rizikové faktory leukopenie/neutropenie patří již existující nízký počet bílých krvinek (WBC) a leukopenie/neutropenie v anamnéze. U pacientů s již existující nízkou WBC nebo s leukopenií/neutropenií navozenou léky v anamnéze by měl být během prvních několika měsíců léčby často monitorován kompletní krevní obraz (CBC) a měli by vysadit SEROQUEL 50 mg při prvních známkách poklesu počtu WBC absence dalších příčinných faktorů.
pacientů s neutropenií je třeba pečlivě sledovat horečku nebo jiné příznaky či známky infekce a v případě výskytu těchto příznaků nebo známek je okamžitě léčit. Pacienti se závažnou neutropenií (absolutní počet neutrofilů
Šedý zákal
Rozvoj katarakty byl pozorován v souvislosti s léčbou kvetiapinem ve studiích s chronickými psy [viz Neklinická toxikologie ]. Změny čočky byly také pozorovány u dospělých, dětí a dospívajících během dlouhodobé léčby přípravkem SEROQUEL 100 mg, ale kauzální vztah k užívání přípravku SEROQUEL 200 mg nebyl stanoven. Přesto nelze v tuto chvíli vyloučit možnost čočkovitých změn. Proto se na začátku léčby nebo krátce po ní a v 6měsíčních intervalech během chronické léčby doporučuje vyšetření čočky metodami adekvátními k detekci tvorby katarakty, jako je vyšetření štěrbinovou lampou nebo jiné vhodně citlivé metody.
Prodloužení QT
klinických studiích nebyl kvetiapin spojen s přetrvávajícím prodloužením QT intervalů. Účinek QT však nebyl systematicky hodnocen v důkladné studii QT. Po uvedení přípravku na trh byly hlášeny případy prodloužení QT intervalu u pacientů, kteří se předávkovali kvetiapinem (viz PŘEDÁVKOVAT ], u pacientů se souběžným onemocněním a u pacientů užívajících léky, o kterých je známo, že způsobují nerovnováhu elektrolytů nebo prodlužují QT interval (viz DROGOVÉ INTERAKCE ].
Je třeba se vyhnout užívání kvetiapinu v kombinaci s jinými léky, o kterých je známo, že prodlužují QTc, včetně antiarytmik třídy 1A (např. chinidin, prokainamid) nebo antiarytmik třídy III (např. amiodaron, sotalol), antipsychotiky (např. ziprasidon, chlorpromazin, thioridazin), antibiotika (např. gatifloxacin, moxifloxacin) nebo jakákoli jiná skupina léků, o kterých je známo, že prodlužují QTc interval (např. pentamidin, levomethadylacetát, metadon).
Kvetiapinu je také třeba se vyhnout za okolností, které mohou zvýšit riziko výskytu torsade de pointes a/nebo náhlé smrti, včetně (1) anamnézy srdečních arytmií, jako je bradykardie; (2) hypokalémie nebo hypomagnezémie; (3) současné užívání jiných léků, které prodlužují QTc interval; a (4) přítomnost vrozeného prodloužení QT intervalu.
Opatrnosti je také třeba při předepisování kvetiapinu pacientům se zvýšeným rizikem prodloužení QT intervalu (např. kardiovaskulární onemocnění, rodinná anamnéza prodloužení QT intervalu, starší pacienti, městnavé srdeční selhání a srdeční hypertrofie).
Záchvaty
Během klinických studií se záchvaty objevily u 0,5 % (20/3490) pacientů léčených přípravkem SEROQUEL ve srovnání s 0,2 % (2/954) na placebu a 0,7 % (4/527) na aktivních kontrolních lécích. Stejně jako u jiných antipsychotik by měl být SEROQUEL 25 mg používán s opatrností u pacientů se záchvaty v anamnéze nebo se stavy, které potenciálně snižují práh záchvatů, např. Alzheimerova demence. Stavy, které snižují práh záchvatů, mohou být častější v populaci ve věku 65 let nebo starší.
Hypotyreóza
Dospělí
Klinické studie s kvetiapinem prokázaly na dávce závislé snížení hladin hormonů štítné žlázy. Snížení celkového a volného tyroxinu (T4) o přibližně 20 % na horním konci rozmezí terapeutických dávek bylo maximální v prvních šesti týdnech léčby a udrželo se bez adaptace nebo progrese během více chronické terapie. Téměř ve všech případech bylo ukončení léčby kvetiapinem spojeno s reverzí účinků na celkový a volný T4, bez ohledu na délku léčby. Mechanismus, kterým kvetiapin působí na osu štítné žlázy, není jasný. Pokud dojde k ovlivnění osy hypotalamus-hypofýza, samotné měření TSH nemusí přesně odrážet stav štítné žlázy pacienta. Proto by se měl TSH i volný T4 kromě klinického hodnocení měřit na začátku a při sledování.
adjuvantních studiích s mánií, kde byl SEROQUEL 50 mg přidán k lithiu nebo divalproexu, mělo 12 % (24/196) pacientů léčených přípravkem SEROQUEL 200 mg ve srovnání se 7 % (15/203) pacientů léčených placebem zvýšené hladiny TSH. Z pacientů léčených přípravkem SEROQUEL 300 mg se zvýšenými hladinami TSH měli 3 současně nízké hladiny volného T4 (volný T4
Přibližně 0,7 % (26/3489) pacientů se SEROQUELem zaznamenalo zvýšení TSH ve studiích monoterapie. Někteří pacienti se zvýšeným TSH potřebovali substituční léčbu štítné žlázy.
Ve všech studiích kvetiapinu byla incidence posunů hormonů štítné žlázy a TSH1: snížení volného T4 (5 mIU/l), 4,9 % (956/19412). U osmi pacientů, u kterých byl TBG měřen, byly hladiny TBG nezměněny.
Tabulka 8 ukazuje výskyt těchto posunů v krátkodobých placebem kontrolovaných klinických studiích.
V krátkodobých placebem kontrolovaných monoterapeutických studiích byla incidence recipročních posunů T3 a TSH 0,0 % u kvetiapinu (1/4800) i placeba (0/2190) au T4 a TSH byly posuny 0,1 % (7 /6154) pro kvetiapin oproti 0,0 % (1/3007) pro placebo.
Děti A Dospívající
V akutních placebem kontrolovaných studiích u dětí a dospívajících pacientů se schizofrenií (trvání 6 týdnů) nebo bipolární mánií (trvání 3 týdny) byla incidence posunů hodnot funkce štítné žlázy kdykoli u pacientů léčených přípravkem SEROQUEL 100 mg a pacientů léčených placebem pro zvýšený TSH byl 2,9 % (8/280) vs. 0,7 % (1/138), v tomto pořadí, a pro snížený celkový tyroxin byl 2,8 % (8/289) vs. 0 % (0/145), v tomto pořadí. Z pacientů léčených SEROQUELem se zvýšenými hladinami TSH měl 1 současně nízkou hladinu volného T4 na konci léčby.
Hyperprolaktinémie
Dospělí
Během klinických studií s kvetiapinem došlo k výskytu posunů hladin prolaktinu na klinicky významnou hodnotu u 3,6 % (158/4416) pacientů léčených kvetiapinem ve srovnání s 2,6 % (51/1968) na placebu.
Děti A Dospívající
V akutních placebem kontrolovaných studiích u dětí a dospívajících pacientů s bipolární mánií (trvání 3 týdny) nebo schizofrenií (trvání 6 týdnů) byl výskyt posunů hladin prolaktinu na hodnotu (>20 μg/l muži; >26 μg /L žen kdykoli) bylo 13,4 % (18/134) pro SEROQUEL ve srovnání se 4 % (3/75) pro placebo u mužů a 8,7 % (9/104) pro SEROQUEL 25 mg ve srovnání s 0 % (0/39) pro placebo u žen.
Stejně jako ostatní léky, které antagonizují dopaminové D2 receptory, i SEROQUEL 300 mg u některých pacientů zvyšuje hladiny prolaktinu a toto zvýšení může přetrvávat i během chronického podávání. Hyperprolaktinémie, bez ohledu na etiologii, může potlačit hypotalamický GnRH, což má za následek sníženou sekreci hypofyzárních gonadotropinů. To zase může inhibovat reprodukční funkci zhoršením gonadální steroidogeneze u žen i mužů. U pacientů užívajících látky zvyšující prolaktin byly hlášeny galaktorea, amenorea, gynekomastie a impotence. Dlouhodobá hyperprolaktinémie spojená s hypogonadismem může vést ke snížení hustoty kostí u žen i mužů.
Experimenty na tkáňových kulturách ukazují, že přibližně jedna třetina lidských karcinomů prsu je in vitro závislá na prolaktinu, což je faktor potenciální důležitosti, pokud se uvažuje o předepisování těchto léků u pacientky s dříve zjištěnou rakovinou prsu. Stejně jako u sloučenin, které zvyšují uvolňování prolaktinu, byla ve studiích karcinogenity prováděných na myších a potkanech pozorována neoplazie mléčné žlázy a buněk pankreatických ostrůvků (adenokarcinomy mléčné žlázy, adenomy hypofýzy a pankreatu). Ani klinické studie, ani epidemiologické studie dosud provedené neprokázaly souvislost mezi chronickým podáváním této třídy léků a tumorigenezí u lidí, ale dostupné důkazy jsou příliš omezené na to, aby byly přesvědčivé (viz Neklinická toxikologie ].
Potenciál pro kognitivní a motorické poruchy
Somnolence byla často hlášeným nežádoucím účinkem hlášeným u pacientů léčených přípravkem SEROQUEL, zejména během 3-5denního období počáteční titrace dávky. Ve studiích se schizofrenií byla ospalost hlášena u 18 % (89/510) pacientů užívajících SEROQUEL 200 mg ve srovnání s 11 % (22/206) pacientů užívajících placebo. Ve studiích akutní bipolární mánie s použitím přípravku SEROQUEL 200 mg jako monoterapie byla ospalost hlášena u 16 % (34/209) pacientů užívajících přípravek SEROQUEL 300 mg ve srovnání se 4 % pacientů s placebem. Ve studiích akutní bipolární mánie s použitím přípravku SEROQUEL jako doplňkové léčby byla ospalost hlášena u 34 % (66/196) pacientů užívajících přípravek SEROQUEL ve srovnání s 9 % (19/203) pacientů užívajících placebo. Ve studiích bipolární deprese byla ospalost hlášena u 57 % (398/698) pacientů užívajících SEROQUEL 50 mg ve srovnání s 15 % (51/347) pacientů užívajících placebo. Vzhledem k tomu, že SEROQUEL 25 mg může narušit úsudek, myšlení nebo motorické dovednosti, pacienti by měli být upozorněni na provádění činností vyžadujících duševní bdělost, jako je řízení motorových vozidel (včetně automobilů) nebo obsluha nebezpečných strojů, dokud si nebudou přiměřeně jisti, že léčba přípravkem SEROQUEL funguje. neovlivňovat je nepříznivě. Ospalost může vést k pádům.
Regulace tělesné teploty
Ačkoli to nebylo hlášeno u SEROQUEL 100 mg, narušení schopnosti těla snižovat tělesnou teplotu bylo připisováno antipsychotikům. Při předepisování přípravku SEROQUEL 300 mg pacientům, kteří budou mít stavy, které mohou přispívat ke zvýšení tělesné teploty, např. namáhavé cvičení, vystavení extrémnímu horku, souběžnou medikaci s anticholinergní aktivitou nebo dehydrataci, se doporučuje patřičná opatrnost.
Dysfagie
Dysmotilita a aspirace jícnu jsou spojovány s užíváním antipsychotik. Aspirační pneumonie je častou příčinou morbidity a mortality u starších pacientů, zejména u pacientů s pokročilou Alzheimerovou demencí. SEROQUEL 100 mg a další antipsychotika by měly být používány s opatrností u pacientů s rizikem aspirační pneumonie.
Syndrom vysazení
Po náhlém vysazení atypických antipsychotik, včetně SEROQUELu, byly popsány akutní abstinenční příznaky, jako je nespavost, nauzea a zvracení. V krátkodobých placebem kontrolovaných monoterapeutických klinických studiích se SEROQUELem 25 mg XR, které zahrnovaly fázi vysazení, která hodnotila symptomy z vysazení, byla agregovaná incidence pacientů s jedním nebo více symptomy z vysazení po náhlém vysazení 12,1 % (241/1993) pro SEROQUEL XR a 6,7 % (71/1065) pro placebo. Výskyt jednotlivých nežádoucích účinků (tj. nespavost, nauzea, bolest hlavy, průjem, zvracení, závratě a podrážděnost) nepřesáhl 5,3 % v žádné léčebné skupině a obvykle odezněl po 1 týdnu po vysazení. Doporučuje se postupné stažení. [vidět Použití u konkrétních populací ]
Anticholinergní (antimuskarinové) účinky
Norkvetiapin, aktivní metabolit kvetiapinu, má střední až silnou afinitu k několika podtypům muskarinových receptorů. To přispívá k anticholinergním nežádoucím reakcím, pokud je SEROQUEL 25 mg užíván v terapeutických dávkách, užíván současně s jinými anticholinergními léky nebo při předávkování. SEROQUEL by měl být používán s opatrností u pacientů užívajících léky s anticholinergními (antimuskarinovými) účinky (viz PŘEDÁVKOVAT a KLINICKÁ FARMAKOLOGIE ].
Zácpa byla často hlášeným nežádoucím účinkem u pacientů léčených kvetiapinem a představuje rizikový faktor pro střevní obstrukci. U kvetiapinu byla hlášena střevní obstrukce, včetně fatálních hlášení u pacientů, kteří současně dostávali více léků snižujících střevní motilitu.
SEROQUEL 300 mg by měl být používán s opatrností u pacientů se současnou diagnózou nebo předchozí anamnézou retence moči, klinicky významnou hypertrofií prostaty, zácpou nebo zvýšeným nitroočním tlakem.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA (Medication Guide).
Pacienti by měli být upozorněni na následující problémy a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání přípravku SEROQUEL.
Zvýšená úmrtnost u starších pacientů s psychózou související s demencí Pacienti a ošetřovatelé by měli být upozorněni, že starší pacienti s psychózou související s demencí léčení atypickými antipsychotiky mají ve srovnání s placebem zvýšené riziko úmrtí. Kvetiapin není schválen pro starší pacienty s psychózou související s demencí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sebevražedné myšlenky a chování
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Rodiny a pečovatelé pacientů by měli být poučeni, aby každý den hledali výskyt těchto příznaků, protože změny mohou být náhlé. Takové symptomy by měly být hlášeny pacientovi předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, mají náhlý nástup nebo nebyly součástí symptomů pacienta. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Neuroleptický maligní syndrom (NMS)
Pacienti by měli být poučeni, aby svému lékaři hlásili jakékoli známky nebo příznaky, které mohou souviset s NMS. Ty mohou zahrnovat svalovou ztuhlost a vysokou horečku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hyperglykémie A Diabetes Mellitus
Pacienti by si měli být vědomi příznaků hyperglykémie (vysoká hladina cukru v krvi) a diabetes mellitus. U pacientů, u kterých je diagnostikován diabetes, u pacientů s rizikovými faktory pro diabetes nebo u těch, u kterých se tyto příznaky objeví během léčby, by měla být na začátku a pravidelně během léčby monitorována hladina glukózy v krvi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hyperlipidémie
Pacienti by měli být upozorněni, že může dojít ke zvýšení celkového cholesterolu, LDL-cholesterolu a triglyceridů a snížení HDL-cholesterolu. U pacientů by měl být na začátku a pravidelně během léčby monitorován lipidový profil [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přibývání na váze
Pacienti by měli být upozorněni, že u nich může dojít ke zvýšení tělesné hmotnosti. U pacientů by měla být pravidelně sledována jejich hmotnost [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ortostatická hypotenze
Pacienti by měli být upozorněni na riziko ortostatické hypotenze (příznaky zahrnují pocit závratě nebo točení hlavy při vstávání, což může vést k pádům), zejména během období počáteční titrace dávky a také v době opětovného zahájení léčby nebo zvýšení dávky. vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zvýšený krevní tlak u dětí a dospívajících
Dětem a dospívajícím pacientům by měl být měřen krevní tlak na začátku léčby a pravidelně v jejím průběhu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Leukopenie/Neutropenie
Pacienti s již existujícím nízkým počtem bílých krvinek nebo leukopenií/neutropenií v anamnéze by měli být upozorněni, že by měli mít během užívání přípravku SEROQUEL monitorován CBC. Pacientům by mělo být doporučeno, aby co nejdříve promluvili se svým lékařem, pokud mají horečku, příznaky podobné chřipce, bolest v krku nebo jakoukoli jinou infekci, protože to může být důsledek velmi nízkého počtu bílých krvinek, což může vyžadovat, aby byl přípravek SEROQUEL 100 mg podán. zastavit a/nebo léčbu podat [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zásah do kognitivního a motorického výkonu
Pacienti by měli být upozorněni na riziko somnolence nebo sedace (které mohou vést k pádům), zvláště během období počáteční titrace dávky. Pacienti by měli být upozorněni na provádění jakékoli činnosti vyžadující duševní bdělost, jako je řízení motorového vozidla (včetně automobilů) nebo obsluha strojů, dokud si nejsou přiměřeně jisti, že je léčba kvetiapinem neovlivňuje nepříznivě (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Tepelná expozice a dehydratace
Pacienti by měli být informováni o vhodné péči, aby se zabránilo přehřátí a dehydrataci [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Souběžná medikace
Stejně jako u jiných léků by pacienti měli být poučeni, aby informovali své lékaře, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné [viz DROGOVÉ INTERAKCE ].
Těhotenství
Informujte těhotné ženy, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem SEROQUEL otěhotní nebo plánují otěhotnět. Informujte pacienty, že SEROQUEL může u novorozence způsobit extrapyramidové a/nebo abstinenční příznaky (agitovanost, hypertonie, hypotonie, třes, ospalost, respirační tíseň a poruchy příjmu potravy). Informujte pacienty, že existuje registr těhotenství, který monitoruje výsledky těhotenství u žen vystavených přípravku SEROQUEL 25 mg během těhotenství [viz Použití u konkrétních populací ].
Neplodnost
Informujte ženy s reprodukčním potenciálem, že SEROQUEL může zhoršit plodnost v důsledku zvýšení hladiny prolaktinu v séru. Účinky na plodnost jsou reverzibilní [viz Použití u konkrétních populací ].
Potřeba komplexního léčebného programu
SEROQUEL je indikován jako nedílná součást celkového léčebného programu pro dospívající se schizofrenií a dětskou bipolární poruchou, který může zahrnovat další opatření (psychologická, výchovná a sociální). Účinnost a bezpečnost přípravku SEROQUEL 100 mg nebyla stanovena u pediatrických pacientů mladších 13 let pro schizofrenii nebo mladších 10 let pro bipolární mánii. Vhodné umístění ve vzdělávání je zásadní a psychosociální intervence je často užitečná. Rozhodnutí předepsat atypické antipsychotické léky bude záviset na posouzení chronicity a závažnosti symptomů pacienta lékařem [viz INDIKACE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Studie karcinogenity byly provedeny na myších C57BL a potkanech Wistar. Kvetiapin byl podáván v dietě myším v dávkách 20, 75, 250 a 750 mg/kg a potkanům sondou v dávkách 25, 75 a 250 mg/kg po dobu dvou let. Tyto dávky jsou ekvivalentní 0,1, 0,5, 1,5 a 4,5násobku MRHD 800 mg/den na základě mg/m2 tělesného povrchu (myši) nebo 0,3, 1 a 3násobku MRHD na mg/m2 tělesného povrchu (krysy). Došlo ke statisticky významnému zvýšení folikulárních adenomů štítné žlázy u samců myší při dávkách 1,5 a 4,5 násobku MRHD na základě mg/m2 tělesného povrchu a u samců potkanů při dávce 3násobku MRHD na mg/m2 tělesného povrchu. Adenokarcinomy mléčné žlázy byly statisticky významně zvýšeny u samic potkanů ve všech testovaných dávkách (0,3, 1 a 3krát vyšší než MRHD na základě mg/m2 plochy povrchu těla).
Adenom folikulárních buněk štítné žlázy může být důsledkem chronické stimulace štítné žlázy hormonem stimulujícím štítnou žlázu (TSH) v důsledku zvýšeného metabolismu a clearance tyroxinu játry hlodavců. Změny TSH, tyroxinu a clearance tyroxinu konzistentní s tímto mechanismem byly pozorovány ve studiích subchronické toxicity u potkanů a myší a v jednoleté studii toxicity u potkanů; výsledky těchto studií však nebyly definitivní. Význam nárůstu adenomů folikulárních buněk štítné žlázy pro lidské riziko, ať už prostřednictvím jakéhokoli mechanismu, není znám.
Bylo prokázáno, že antipsychotika chronicky zvyšují hladiny prolaktinu u hlodavců. Měření séra v 1leté studii toxicity ukázala, že kvetiapin zvýšil medián sérových hladin prolaktinu maximálně 32krát a 13krát u samců a samic potkanů. Po chronickém podávání jiných antipsychotik bylo u hlodavců zjištěno zvýšení novotvarů mléčné žlázy a je považováno za zprostředkované prolaktinem. Význam tohoto zvýšeného výskytu nádorů mléčné žlázy zprostředkovaných prolaktinem u potkanů pro riziko u lidí není znám (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Mutageneze
Ve standardních testech genotoxicity nebyl kvetiapin mutagenní ani klastogenní. Mutagenní potenciál kvetiapinu byl testován v in vitro zkoušce bakteriálních genových mutací Ames a v in vitro zkoušce savčích genových mutací na buňkách vaječníků čínského křečka. Klastogenní potenciál kvetiapinu byl testován v in vitro testu chromozomálních aberací na kultivovaných lidských lymfocytech a v in vivo mikronukleárním testu kostní dřeně u potkanů až do 500 mg/kg, což je 6násobek maximální doporučené dávky pro člověka na základě mg/m2 plocha povrchu těla.
Zhoršení Plodnosti
Kvetiapin snižoval páření a plodnost u samců potkanů Sprague-Dawley při perorálních dávkách 50 a 150 mg/kg nebo přibližně 1 a 3násobku MRHD 800 mg/den na základě mg/m2 tělesného povrchu. Účinky související s drogou zahrnovaly prodloužení intervalu k páření a počtu páření potřebných pro úspěšnou impregnaci. Tyto účinky byly nadále pozorovány při 3násobku MRHD i po dvoutýdenním období bez léčby. Dávka, která neovlivňuje páření a fertilitu u samců potkanů, byla 25 mg/kg nebo 0,3násobek dávky MRHD na základě mg/m2 tělesného povrchu. Kvetiapin nepříznivě ovlivnil páření a fertilitu u samic potkanů Sprague-Dawley při perorální dávce přibližně 1krát vyšší, než je MRHD 800 mg/den, vztaženo na mg/m2 tělesného povrchu. Účinky související s drogami zahrnovaly snížení páření a páření vedoucí k březosti a prodloužení intervalu mezi pářením. Zvýšení nepravidelných cyklů říje bylo pozorováno při dávkách 10 a 50 mg/kg nebo přibližně 0,1 a 1násobku MRHD 800 mg/den na základě mg/m2 tělesného povrchu. Dávka bez účinku u potkaních samic byla 1 mg/kg nebo 0,01násobek MRHD 800 mg/den na základě mg/m2 plochy povrchu těla.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených během těhotenství atypickým antipsychotikům, včetně SEROQUEL 50 mg. Poskytovatelům zdravotní péče se doporučuje, aby registrovali pacienty kontaktováním Národního registru těhotenství pro atypická antipsychotika na čísle 1-866-961-2388 nebo online na adrese http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Shrnutí rizik
Novorozenci vystavení antipsychotikům (včetně SEROQUEL) během třetího trimestru jsou vystaveni riziku extrapyramidových a/nebo abstinenčních příznaků po porodu (viz Klinické úvahy ). Celkově dostupné údaje z publikovaných epidemiologických studií těhotných žen vystavených kvetiapinu neprokázaly s lékem spojené riziko závažných vrozených vad, potratu nebo nepříznivých mateřských nebo fetálních výsledků (viz Data ). Rizika pro matku jsou spojena s neléčenou schizofrenií, bipolární I nebo velkou depresivní poruchou a s expozicí antipsychotikům, včetně SEROQUEL 200 mg, během těhotenství (viz Klinické úvahy ).
Ve studiích na zvířatech se objevila embryo-fetální toxicita včetně zpoždění skeletální osifikace při přibližně 1 a 2násobku maximální doporučené dávky pro člověka (MRHD) 800 mg/den u potkanů a králíků a zvýšeného výskytu karpálního/tarzálního ohybu (menší anomálie měkkých tkání) u plodů králíků přibližně 2krát vyšší než MRHD. Kromě toho se u obou druhů snížila hmotnost plodů. Mateřská toxicita (pozorovaná jako snížená tělesná hmotnost a/nebo smrt) se vyskytla při 2násobku MRHD u potkanů a přibližně 1-2násobku MRHD u králíků.
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Klinické úvahy
Mateřské a/nebo fetální riziko spojené s onemocněním
Pro matku existuje riziko neléčené schizofrenie nebo bipolární poruchy I, včetně zvýšeného rizika relapsu, hospitalizace a sebevraždy. Schizofrenie a bipolární porucha I jsou spojeny se zvýšenými nepříznivými perinatálními následky, včetně předčasného porodu. Není známo, zda je to přímý důsledek onemocnění nebo jiných komorbidních faktorů.
Prospektivní, longitudinální studie sledovala 201 těhotných žen s anamnézou velké depresivní poruchy, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Ženy, které vysadily antidepresiva během těhotenství, měly větší pravděpodobnost recidivy těžké deprese než ženy, které v antidepresivech pokračovaly. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Fetální/neonatální nežádoucí účinky
Extrapyramidové a/nebo abstinenční příznaky, včetně agitovanosti, hypertonie, hypotonie, třesu, somnolence, respirační tísně a poruchy příjmu potravy byly hlášeny u novorozenců, kteří byli vystaveni antipsychotikům, včetně přípravku SEROQUEL 50 mg, během třetího trimestru těhotenství. Tyto příznaky se lišily v závažnosti. Sledujte u novorozenců extrapyramidové a/nebo abstinenční příznaky a příslušně je řiďte. Někteří novorozenci se zotavili během hodin nebo dnů bez specifické léčby; ostatní vyžadovali delší hospitalizaci.
Data
Lidská data
Publikovaná data z observačních studií, registrů narození a kazuistik o užívání atypických antipsychotik v těhotenství neuvádějí jednoznačnou souvislost s antipsychotiky a velkými vrozenými vadami. Retrospektivní kohortová studie z databáze Medicaid zahrnující 9258 žen vystavených antipsychotikům během těhotenství neprokázala celkové zvýšené riziko závažných vrozených vad.
Údaje o zvířatech
Když byly březí potkaní potkani a králíci vystaveni kvetiapinu během organogeneze, neprokázal se u plodů žádný teratogenní účinek. Dávky byly 25, 50 a 200 mg/kg u potkanů a 25, 50 a 100 mg/kg u králíků, což je přibližně 0,3, 0,6 a 2násobek (krysy) a 0,6, 1 a 2násobek (králíky) MRHD pro schizofrenie 800 mg/den na základě mg/m2 tělesného povrchu. Byly však důkazy o embryofetální toxicitě včetně zpoždění skeletální osifikace při přibližně 1 a 2násobku MRHD 800 mg/den u potkanů i králíků a zvýšeného výskytu karpálního/tarzálního ohybu (menší anomálie měkkých tkání) u králičí plody na přibližně 2násobku MRHD. Kromě toho se u obou druhů snížila hmotnost plodů. Mateřská toxicita (pozorovaná jako snížená tělesná hmotnost a/nebo smrt) se vyskytla při 2násobku MRHD u potkanů a přibližně 1-2násobku MRHD (všechny testované dávky) u králíků.
peri/postnatální reprodukční studii u potkanů nebyly pozorovány žádné účinky související s lékem, když byly březím samičkám podávány kvetiapin v dávkách 0,01, 0,1 a 0,2 násobku MRHD 800 mg/den na základě mg/m2 tělesného povrchu. V předběžné peri/postnatální studii však došlo ke zvýšení úmrtnosti plodu a mláďat a ke snížení průměrné hmotnosti vrhu na trojnásobek MRHD.
Laktace
Shrnutí rizik
Omezené údaje z publikované literatury uvádějí přítomnost kvetiapinu v lidském mateřském mléce při relativní dávce pro kojence
Ženy a muži reprodukčního potenciálu
Neplodnost
Ženy
Na základě farmakologického účinku kvetiapinu (antagonismus D2) může léčba přípravkem SEROQUEL vést ke zvýšení hladiny prolaktinu v séru, což může vést k reverzibilnímu snížení plodnosti u žen s reprodukčním potenciálem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pediatrické použití
Obecně byly nežádoucí účinky pozorované u dětí a dospívajících během klinických studií podobné jako u dospělé populace až na několik výjimek. Ke zvýšení systolického a diastolického krevního tlaku došlo u dětí a dospívajících a nevyskytlo se u dospělých. Ortostatická hypotenze se vyskytovala častěji u dospělých (4–7 %) ve srovnání s dětmi a dospívajícími ( VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Schizofrenie
Účinnost a bezpečnost přípravku SEROQUEL 50 mg při léčbě schizofrenie u dospívajících ve věku 13-17 let byla prokázána v jedné 6týdenní, dvojitě zaslepené, placebem kontrolované studii [viz INDIKACE , DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , a Klinické studie ].
Bezpečnost a účinnost přípravku SEROQUEL 300 mg u pediatrických pacientů mladších 13 let se schizofrenií nebyla stanovena.
Údržba
Bezpečnost a účinnost přípravku SEROQUEL v udržovací léčbě bipolární poruchy nebyla u pediatrických pacientů mladších 18 let stanovena. Bezpečnost a účinnost přípravku SEROQUEL v udržovací léčbě schizofrenie nebyla stanovena u žádné populace pacientů, včetně pediatrických pacientů.
Bipolární mánie
Účinnost a bezpečnost přípravku SEROQUEL při léčbě mánie u dětí a dospívajících ve věku 10-17 let s bipolární poruchou I byla prokázána ve 3týdenní, dvojitě zaslepené, placebem kontrolované, multicentrické studii [viz INDIKACE , DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , a Klinické studie ]. Bezpečnost a účinnost přípravku SEROQUEL u pediatrických pacientů mladších 10 let s bipolární mánií nebyla stanovena.
Bipolární deprese
Bezpečnost a účinnost přípravku SEROQUEL 300 mg u pediatrických pacientů mladších 18 let s bipolární depresí nebyla stanovena. Klinická studie s přípravkem SEROQUEL XR byla provedena u dětí a dospívajících (10-17 let) s bipolární depresí, účinnost nebyla stanovena.
Mezi dětmi/adolescenty (10-17 let) a dospělými byly zaznamenány určité rozdíly ve farmakokinetice kvetiapinu. Po úpravě podle hmotnosti byly AUC a Cmax kvetiapinu o 41 % a 39 % nižší u dětí a dospívajících ve srovnání s dospělými. Farmakokinetika aktivního metabolitu norkvetiapinu byla u dětí/dospívajících a dospělých po úpravě hmotnosti podobná (viz KLINICKÁ FARMAKOLOGIE ].
Geriatrické použití
přibližně 3 700 pacientů v klinických studiích s přípravkem SEROQUEL 300 mg bylo 7 % (232) ve věku 65 let nebo více. Obecně nebyly zjištěny žádné známky jiné snášenlivosti přípravku SEROQUEL u starších osob ve srovnání s mladšími dospělými. Nicméně přítomnost faktorů, které mohou snížit farmakokinetickou clearance, zvýšit farmakodynamickou odpověď na SEROQUEL 200 mg nebo způsobit horší toleranci nebo ortostázu, by měla vést ke zvážení nižší počáteční dávky, pomalejší titraci a pečlivému sledování během počátečního dávkovacího období starší. Průměrná plazmatická clearance přípravku SEROQUEL 25 mg byla u starších pacientů snížena o 30 % až 50 % ve srovnání s mladšími pacienty (viz KLINICKÁ FARMAKOLOGIE a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Renální poškození
Klinické zkušenosti s přípravkem SEROQUEL u pacientů s poruchou funkce ledvin jsou omezené (viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Vzhledem k tomu, že kvetiapin je extenzivně metabolizován v játrech, lze u pacientů s poruchou funkce jater očekávat vyšší plazmatické hladiny. U této populace se doporučuje nízká počáteční dávka 25 mg/den a dávka může být zvyšována o 25 mg/den-50 mg/den (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Lidská zkušenost
V klinických studiích bylo hlášeno přežití při akutním předávkování až 30 gramů kvetiapinu. Většina pacientů, kteří se předávkovali, nezaznamenala žádné nežádoucí účinky nebo se z hlášených příhod plně zotavila. V klinické studii bylo hlášeno úmrtí po předávkování 13,6 gramů samotného kvetiapinu. Obecně byly hlášené známky a symptomy ty, které jsou výsledkem zveličování známých farmakologických účinků léku, tj. ospalost, sedace, tachykardie, hypotenze a anticholinergní toxicita včetně kómatu a deliria. Pacienti s již existujícím závažným kardiovaskulárním onemocněním mohou mít zvýšené riziko účinků předávkování [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Jeden případ, zahrnující odhadované předávkování 9 600 mg, byl spojen s hypokalémií a srdeční blokádou prvního stupně. Po uvedení přípravku na trh byly hlášeny případy prodloužení QT intervalu při předávkování.
Řízení Předávkování
Vytvořte a udržujte dýchací cesty a zajistěte dostatečnou oxygenaci a ventilaci. Kardiovaskulární monitorování by mělo být zahájeno okamžitě a mělo by zahrnovat nepřetržité elektrokardiografické monitorování k detekci možných arytmií.
Základem řízení jsou vhodná podpůrná opatření. Chcete-li získat nejaktuálnější informace o léčbě předávkování Seroquelem XR, kontaktujte certifikované Regionální centrum pro kontrolu jedů (1-800-222-1222).
KONTRAINDIKACE
Hypersenzitivita na kvetiapin nebo na kteroukoli pomocnou látku přípravku SEROQUEL XR. U pacientů léčených přípravkem SEROQUEL XR byly hlášeny anafylaktické reakce.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku kvetiapinu v uvedených indikacích není jasný. Nicméně účinnost kvetiapinu v těchto indikacích může být zprostředkována kombinací antagonismu dopaminu typu 2 (D2) a serotoninu typu 2 (5HT2). Aktivní metabolit, N-desalkyl quetiapin (norkvetiapin), má podobnou aktivitu na D2, ale vyšší aktivitu na 5HT2A receptorech než původní léčivo (quetiapin).
Farmakodynamika
Kvetiapin a jeho metabolit norkvetiapin mají afinitu k četným neurotransmiterovým receptorům s vazbou norkvetiapinu s vyšší afinitou než kvetiapin obecně. Hodnoty Ki pro kvetiapin a norkvetiapin na dopaminu D1 jsou 428/99,8 nM, na D2 626/489 nM, na serotoninu 5HT1A 1040/191 nM na 5HT2A 38/2,9 nM, na histaminu/1.14 při mustaminu/1.14 38,3 nM a na adrenergním alb 14,6/46,4 nM a na a2 receptorech 617/1290 nM, v daném pořadí. Kvetiapin a norkvetiapin postrádají znatelnou afinitu k benzodiazepinovým receptorům.
Vliv na QT interval
klinických studiích nebyl kvetiapin spojen s přetrvávajícím prodloužením QT intervalů. Účinek QT však nebyl systematicky hodnocen v důkladné studii QT. Po uvedení přípravku na trh byly hlášeny případy prodloužení QT intervalu u pacientů, kteří se předávkovali kvetiapinem (viz PŘEDÁVKOVAT ], u pacientů se souběžným onemocněním a u pacientů užívajících léky, o kterých je známo, že způsobují nerovnováhu elektrolytů nebo prodlužují QT interval.
Farmakokinetika
Dospělí
Aktivita kvetiapin-fumarátu je primárně způsobena původním léčivem. Farmakokinetika kvetiapinu po opakovaných dávkách je v navrhovaném rozmezí klinických dávek úměrná dávce a akumulace kvetiapinu je předvídatelná při opakovaném podávání. K eliminaci kvetiapinu dochází především prostřednictvím jaterního metabolismu s průměrným terminálním poločasem asi 6 hodin v rámci navrhovaného klinického dávkovacího rozmezí. Očekává se, že ustálených koncentrací bude dosaženo do dvou dnů po podání. Je nepravděpodobné, že by kvetiapin interferoval s metabolismem léků metabolizovaných enzymy cytochromu P450.
Děti A Dospívající
ustáleném stavu byla farmakokinetika původní látky u dětí a dospívajících (10-17 let) podobná jako u dospělých. Po úpravě na dávku a hmotnost však byly AUC a Cmax původní látky o 41 % a 39 % nižší u dětí a dospívajících než u dospělých. U aktivního metabolitu norkvetiapinu byly AUC o 45 % a Cmax o 31 % vyšší u dětí a dospívajících než u dospělých. Po úpravě na dávku a hmotnost byla farmakokinetika metabolitu norkvetiapinu podobná u dětí a dospívajících a dospělých (viz Použití u konkrétních populací ].
Vstřebávání
Kvetiapin-fumarát se po perorálním podání rychle vstřebává a dosahuje maximální plazmatické koncentrace za 1,5 hodiny. Tabletová formulace je 100% biologicky dostupná vzhledem k roztoku. Biologická dostupnost kvetiapinu je okrajově ovlivněna podáváním s jídlem, přičemž hodnoty Cmax a AUC se zvýšily o 25 % a 15 %.
Rozdělení
Kvetiapin je široce distribuován po celém těle se zdánlivým distribučním objemem 10±4 l/kg. V terapeutických koncentracích se váže na plazmatické proteiny z 83 %. In vitro kvetiapin neovlivnil vazbu warfarinu nebo diazepamu na lidský sérový albumin. Na druhé straně ani warfarin, ani diazepam nezměnily vazbu kvetiapinu.
Metabolismus a eliminace
Po jednorázové perorální dávce 14C-kvetiapinu bylo méně než 1 % podané dávky vyloučeno jako nezměněné léčivo, což ukazuje, že kvetiapin je vysoce metabolizován. Přibližně 73 % a 20 % dávky bylo nalezeno v moči a ve stolici.
Kvetiapin je extenzivně metabolizován v játrech. Hlavními metabolickými cestami jsou sulfoxidace na sulfoxidový metabolit a oxidace na metabolit mateřské kyseliny; oba metabolity jsou farmakologicky neaktivní. Studie in vitro s použitím lidských jaterních mikrozomů odhalily, že izoenzym cytochromu P450 3A4 se podílí na metabolismu kvetiapinu na jeho hlavní, ale neaktivní sulfoxidový metabolit a na metabolismu jeho aktivního metabolitu N-desalkyl kvetiapinu.
Stáří
Perorální clearance kvetiapinu byla snížena o 40 % u starších pacientů (≥ 65 let, n=9) ve srovnání s mladými pacienty (n=12) a může být nutná úprava dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rod
Pohlaví nemá žádný vliv na farmakokinetiku kvetiapinu.
Závod
Farmakokinetika kvetiapinu nemá rasový vliv.
Kouření
Kouření nemá žádný vliv na perorální clearance kvetiapinu.
Renální insuficience
Pacienti s těžkou poruchou funkce ledvin (Clcr=10-30 ml/min/1,73 m2, n=8) měli o 25 % nižší průměrnou perorální clearance než normální jedinci (Clcr > 80 ml/min/1,73 m2, n=8), ale plazmatické koncentrace kvetiapinu u subjektů s renální insuficiencí byly v rozmezí koncentrací pozorovaných u normálních subjektů užívajících stejnou dávku. Úprava dávkování proto u těchto pacientů není nutná [viz Použití u konkrétních populací ].
Jaterní nedostatečnost
Pacienti s poruchou funkce jater (n=8) měli průměrnou perorální clearance kvetiapinu o 30 % nižší než normální jedinci. U dvou z 8 pacientů s poruchou funkce jater byly AUC a Cmax 3krát vyšší než hodnoty pozorované typicky u zdravých subjektů. Vzhledem k tomu, že kvetiapin je extenzivně metabolizován v játrech, očekávají se vyšší plazmatické hladiny u populace s poruchou funkce jater a může být nutná úprava dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ a POUŽITÍ U KONKRÉTNÍCH POPULACÍ ].
Studie lékových interakcí
Hodnocení in vivo účinku jiných léků na farmakokinetiku kvetiapinu je shrnuto v tabulce 17 [viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
Údaje o inhibici enzymů in vitro naznačují, že kvetiapin a 9 jeho metabolitů by měly malý inhibiční účinek na metabolismus in vivo zprostředkovaný cytochromy CYP 1A2, 2C9, 2C19, 2D6 a 3A4. Kvetiapin v dávkách 750 mg/den neovlivnil farmakokinetiku jednorázové dávky antipyrinu, lithia nebo lorazepamu (tabulka 18) [viz DROGOVÉ INTERAKCE ].
Toxikologie zvířat a/nebo farmakologie
Kvetiapin způsobil na dávce závislé zvýšení ukládání pigmentu ve štítné žláze ve studiích toxicity na potkanech, které trvaly 4 týdny nebo déle, a ve dvouleté studii karcinogenity u myší. Ve studiích na potkanech byly dávky 10, 25, 50, 75, 150 a 250 mg/kg, což je přibližně 0,1, 0,3, 0,6, 1, 2 a 3násobek MRHD 800 mg/den na základě tělesného povrchu v mg/m2 , resp. Dávky ve studii karcinogenity na myších byly 20, 75, 250 a 750 mg/kg, což je přibližně 0,1, 0,5, 1,5 a 4,5násobek MRHD 800 mg/den na základě mg/m2 tělesného povrchu. U krys se ukázalo, že ukládání pigmentů je nevratné. Identitu pigmentu nebylo možné určit, ale bylo zjištěno, že je lokalizován společně s kvetiapinem ve folikulárních epiteliálních buňkách štítné žlázy. Funkční účinky a význam tohoto zjištění pro lidské riziko nejsou známy.
psů, kteří dostávali kvetiapin po dobu 6 nebo 12 měsíců, ale ne po dobu 1 měsíce, se vyskytly fokální trojúhelníkové katarakty v místě spojení zadních stehů ve zevním kortexu čočky v dávce 100 mg/kg, neboli 4násobek MRHD 800 mg/den na základě mg/m2 tělesného povrchu. Toto zjištění může být způsobeno inhibicí biosyntézy cholesterolu kvetiapinem. Ve studiích s opakovanými dávkami u psů a opic kvetiapin způsobil na dávce závislé snížení hladiny cholesterolu v plazmě; mezi plazmatickým cholesterolem a přítomností katarakty u jednotlivých psů však nebyla žádná korelace. Výskyt delta-8cholestanolu v plazmě je konzistentní s inhibicí pozdního stadia biosyntézy cholesterolu u těchto druhů. Ve speciální studii u fen léčených kvetiapinem bylo také pozorováno 25% snížení obsahu cholesterolu ve vnější kůře čočky. Katarakta související s drogami nebyla pozorována u žádného jiného druhu; v jednoleté studii na opicích však byl pruhovaný vzhled předního povrchu čočky detekován u 2/7 samic při dávce 225 mg/kg nebo 5,5násobku MRHD 800 mg/den na základě mg/m2 těla plocha povrchu.
Klinické studie
Schizofrenie
Krátkodobé zkoušky-Dospělí
Účinnost přípravku SEROQUEL 50 mg v léčbě schizofrenie byla prokázána ve 3 krátkodobých (6týdenních) kontrolovaných studiích u hospitalizovaných pacientů se schizofrenií, kteří splnili kritéria DSM III-R pro schizofrenii. I když v jedné ze tří studií byla jako srovnávací léčba zahrnuta větev s jednou fixní dávkou haloperidolu, tato skupina s jednou dávkou haloperidolu nebyla dostatečná k tomu, aby poskytla spolehlivé a platné srovnání přípravku SEROQUEL 200 mg a haloperidolu.
těchto studiích bylo použito několik nástrojů pro hodnocení psychiatrických příznaků a symptomů, mezi nimi Brief Psychiatric Rating Scale (BPRS), vícepoložkový inventář obecné psychopatologie tradičně používaný k hodnocení účinků protidrogové léčby u schizofrenie. Shluk psychóz BPRS (pojmová dezorganizace, halucinační chování, podezřívavost a neobvyklý myšlenkový obsah) je považován za zvláště užitečnou podmnožinu pro hodnocení aktivně psychotických schizofrenních pacientů. Druhé tradiční hodnocení, klinický globální dojem (CGI), odráží dojem zkušeného pozorovatele, který je plně obeznámen s projevy schizofrenie, o celkovém klinickém stavu pacienta.
Výsledky zkoušek jsou následující:
Primární výsledky účinnosti těchto tří studií v léčbě schizofrenie u dospělých jsou uvedeny v tabulce 19.
Vyšetření podskupin populace (rasa, pohlaví a věk) neodhalilo žádnou rozdílnou citlivost na základě rasy nebo pohlaví, se zjevně větším účinkem u pacientů mladších 40 let ve srovnání s pacienty staršími 40 let. tento nález není znám.
Dospívající (13–17 let)
Účinnost přípravku SEROQUEL 300 mg v léčbě schizofrenie u dospívajících (13-17 let) byla prokázána v 6týdenní, dvojitě zaslepené, placebem kontrolované studii (studie 4). Pacienti, kteří splnili diagnostická kritéria DSM-IV pro schizofrenii, byli randomizováni do jedné ze tří léčebných skupin: SEROQUEL 400 mg/den (n=73), SEROQUEL 800 mg/den (n=74) nebo placebo (n=75). Studovaná medikace byla zahájena dávkou 50 mg/den a 2. den zvýšena na 100 mg/den (rozděleno a podáváno dvakrát nebo třikrát denně). Následně byla dávka titrována na cílovou dávku 400 mg/den nebo 800 mg/den pomocí přírůstků po 100 mg/den, rozdělena a podávána dvakrát nebo třikrát denně. Primární proměnnou účinnosti byla průměrná změna od výchozí hodnoty v celkové škále pozitivních a negativních syndromů (PANSS).
SEROQUEL v dávce 400 mg/den a 800 mg/den byl lepší než placebo ve snížení celkového skóre PANSS. Primární výsledky účinnosti této studie v léčbě schizofrenie u adolescentů jsou uvedeny v tabulce 19.
Bipolární porucha
Bipolární porucha I, manické nebo smíšené epizody
Dospělí
Účinnost přípravku SEROQUEL v akutní léčbě manických epizod byla prokázána ve 3 placebem kontrolovaných studiích u pacientů, kteří splnili kritéria DSM-IV pro bipolární poruchu I s manickými epizodami. Tyto studie zahrnovaly pacienty s psychotickými rysy nebo bez nich a vylučovaly pacienty s rychlým cyklováním a smíšenými epizodami. Z těchto studií byly 2 monoterapie (12 týdnů) a 1 doplňková léčba (3 týdny) k lithiu nebo divalproexu. Klíčovými výsledky v těchto studiích byla změna od výchozí hodnoty ve skóre Young Mania Rating Scale (YMRS) po 3 a 12 týdnech pro monoterapii a po 3 týdnech pro doplňkovou terapii. Doplňková terapie je definována jako současné zahájení nebo následné podávání přípravku SEROQUEL 100 mg s lithiem nebo divalproexem.
Primárním hodnotícím nástrojem použitým pro hodnocení manických příznaků v těchto studiích byla YMRS, 11-ti položková klinická škála tradičně používaná k hodnocení stupně manické symptomatologie (podrážděnost, rušivé/agresivní chování, spánek, povznesená nálada, řeč, zvýšená aktivita, sexuální zájem, porucha jazyka/myšlenek, obsah myšlenek, vzhled a vhled) v rozsahu od 0 (žádné manické rysy) do 60 (maximální skóre).
Výsledky zkoušek jsou následující:
Monoterapie
Účinnost přípravku SEROQUEL v akutní léčbě bipolární mánie byla prokázána ve 2 placebem kontrolovaných studiích. Ve dvou 12týdenních studiích (n=300, n=299) porovnávajících SEROQUEL s placebem byl SEROQUEL 300 mg lepší než placebo ve snížení celkového skóre YMRS ve 3. a 12. týdnu. Většina pacientů v těchto studiích užívala SEROQUEL 100 mg byly dávkovány v rozmezí mezi 400 mg/den a 800 mg za den (studie 1 a 2 v tabulce 20).
Doplňková terapie
této 3týdenní placebem kontrolované studii bylo 170 pacientů s bipolární mánií (YMRS ≥20) randomizováno k léčbě SEROQUEL 100 mg nebo placebem jako doplňková léčba k lithiu nebo divalproexu. Pacienti před randomizací mohli nebo nemuseli dostat adekvátní léčebný cyklus lithiem nebo divalproexem. SEROQUEL 50 mg byl lepší než placebo, když byl přidán k samotnému lithiu nebo divalproexu ve snížení celkového skóre YMRS (studie 3 v tabulce 20).
Většina pacientů v této studii užívala SEROQUEL 25 mg v rozmezí 400 mg/den až 800 mg denně. V podobně koncipované studii (n=200) byl SEROQUEL spojen se zlepšením skóre YMRS, ale neprokázal lepší účinek než placebo, pravděpodobně kvůli vyššímu účinku placeba.
Primární výsledky účinnosti těchto studií při léčbě mánie u dospělých jsou uvedeny v tabulce 20.
Děti a dospívající (ve věku 10–17 let)
Účinnost přípravku SEROQUEL v akutní léčbě manických epizod spojených s bipolární poruchou I u dětí a dospívajících (10-17 let) byla prokázána ve 3týdenní, dvojitě zaslepené, placebem kontrolované, multicentrické studii (studie 4 v Tabulka 20). Pacienti, kteří splnili diagnostická kritéria DSM-IV pro manickou epizodu, byli randomizováni do jedné ze tří léčebných skupin: SEROQUEL 400 mg/den (n=95), SEROQUEL 600 mg/den (n=98) nebo placebo (n=91). . Studovaná medikace byla zahájena dávkou 50 mg/den a 2. den zvýšena na 100 mg/den (rozdělené dávky podávané dvakrát nebo třikrát denně). Následně byla dávka titrována na cílovou dávku 400 mg/den nebo 600 mg/den s použitím přírůstků po 100 mg/den, podávaných v rozdělených dávkách dvakrát nebo třikrát denně. Primární proměnnou účinnosti byla průměrná změna od výchozí hodnoty v celkovém skóre YMRS.
SEROQUEL 400 mg/den a 600 mg/den byl lepší než placebo ve snížení celkového skóre YMRS (tabulka 20).
Bipolární porucha, depresivní epizody
Dospělí
Účinnost přípravku SEROQUEL 25 mg pro akutní léčbu depresivních epizod spojených s bipolární poruchou byla stanovena ve 2 identicky navržených 8týdenních, randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích (N=1045) (studie 5 a 6 v tabulce 21). . Tyto studie zahrnovaly pacienty buď s bipolární poruchou I nebo II a pacienty s rychlým cyklováním nebo bez něj. Pacientům randomizovaným na SEROQUEL 200 mg byly podávány fixní dávky buď 300 mg nebo 600 mg jednou denně.
Primárním hodnotícím nástrojem použitým k posouzení symptomů deprese v těchto studiích byla Montgomery-Asbergova škála hodnocení deprese (MADRS), 10-položková škála hodnocená klinickými lékaři se skóre v rozmezí od 0 do 60. Primárním cílovým parametrem v obou studiích byla změna od výchozí hodnota skóre MADRS v 8. týdnu. V obou studiích byl SEROQUEL 50 mg lepší než placebo ve snížení skóre MADRS. Zlepšení symptomů, měřeno změnou skóre MADRS ve srovnání s placebem, bylo pozorováno v obou studiích v den 8 (1. týden) a dále. V těchto studiích nebyl u dávky 600 mg pozorován žádný další přínos. U skupiny s dávkou 300 mg byla pozorována statisticky významná zlepšení oproti placebu v celkové kvalitě života a spokojenosti související s různými oblastmi fungování, jak bylo měřeno pomocí Q-LES-Q(SF).
Primární výsledky účinnosti těchto studií v akutní léčbě depresivních epizod spojených s bipolární poruchou u dospělých jsou uvedeny v tabulce 21.
Udržovací léčba jako doplněk k lithiu nebo divalproexu
Účinnost přípravku SEROQUEL 100 mg v udržovací léčbě bipolární poruchy I byla prokázána ve 2 placebem kontrolovaných studiích u pacientů (n=1326), kteří splnili kritéria DSM-IV pro bipolární poruchu I (studie 7 a 8 na obrázcích 1 a 2). Studie zahrnovaly pacienty, jejichž poslední epizoda byla manická, depresivní nebo smíšená, s psychotickými rysy nebo bez nich. V otevřené fázi museli být pacienti stabilní na léčbě SEROQUEL plus lithium nebo divalproex po dobu alespoň 12 týdnů, aby mohli být randomizováni. V průměru byli pacienti stabilizováni po dobu 15 týdnů. Ve fázi randomizace pacienti pokračovali v léčbě lithiem nebo divalproexem a byli randomizováni buď k léčbě SEROQUEL (podávaný dvakrát denně v celkové dávce 400 mg/den až 800 mg/den) nebo placebu. Přibližně 50 % pacientů přerušilo léčbu ve skupině SEROQUEL do 280. dne a 50 % ve skupině s placebem přerušilo do 117. dne dvojitě zaslepenou léčbu. Primárním cílovým parametrem v těchto studiích byla doba do recidivy náladové události (manická, smíšená nebo depresivní epizoda). Náladová událost byla definována jako zahájení medikace nebo hospitalizace pro epizodu nálady; skóre YMRS≥20 nebo skóre MADRS≥20 při 2 po sobě jdoucích hodnoceních; nebo přerušení studie z důvodu náladové události (obrázek 1 a obrázek 2).
obou studiích byl SEROQUEL lepší než placebo v prodloužení doby do recidivy jakékoli náladové události. Účinek léčby byl přítomen po delší dobu do recidivy manických i depresivních epizod. Účinek přípravku SEROQUEL byl nezávislý na jakékoli konkrétní podskupině (přiřazený stabilizátor nálady, pohlaví, věk, rasa, poslední bipolární epizoda nebo kurz rychlé jízdy na kole).
Obrázek 1: Kaplan-Meierovy křivky času do opakování náladové události (studie 7)
Obrázek 2: Kaplan-Meierovy křivky času do opakování náladové události (studie 8)
INFORMACE PRO PACIENTA
SEROQUEL (SER-oh-kwell) (quetiapin fumarát) Tablety
Před zahájením užívání SEROQUELu a pokaždé, když dostanete náplň, si přečtěte tento Návod k použití. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o SEROQUEL?
SEROQUEL 100 mg může způsobit závažné nežádoucí účinky, včetně:
- Promluvte si se svým poskytovatelem zdravotní péče nebo s vaším rodinným příslušníkem o:
- všechna rizika a přínosy léčby antidepresivy.
- všechny možnosti léčby deprese nebo jiné vážné duševní choroby
- Antidepresiva mohou u některých dětí, dospívajících a mladých dospělých během prvních měsíců léčby zvýšit sebevražedné myšlenky nebo činy.
- Deprese a další vážná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek a činů. Někteří lidé mohou mít zvláště vysoké riziko sebevražedných myšlenek nebo činů. Patří mezi ně lidé, kteří mají (nebo mají v rodinné anamnéze) depresi, bipolární nemoc (nazývanou také maniodepresivní nemoc) nebo sebevražedné myšlenky nebo činy.
- Jak mohu sledovat a snažit se zabránit sebevražedným myšlenkám a činům u sebe nebo člena rodiny?
- Věnujte zvýšenou pozornost všem změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Dodržujte všechny následné návštěvy u poskytovatele zdravotní péče podle plánu. Zavolejte poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte poskytovatele zdravotní péče, pokud máte vy nebo váš rodinný příslušník některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- myšlenky na sebevraždu nebo smrt
- pokusy o sebevraždu
- nová nebo horší deprese
- nová nebo horší úzkost
- pocit velkého rozrušení nebo neklidu
- panický záchvat
- potíže se spánkem (nespavost)
- nová nebo horší podrážděnost
- chovat se agresivně, být naštvaný nebo násilný
- působící na nebezpečné impulsy
- extrémní nárůst aktivity a mluvení (mánie)
- jiné neobvyklé změny v chování nebo náladě
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili se svým poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité probrat všechna rizika léčby deprese a také rizika její neléčení. Pacienti a jejich rodiny nebo jiní pečovatelé by měli s poskytovatelem zdravotní péče diskutovat o všech možnostech léčby, nejen o užívání antidepresiv.
- Antidepresiva mají další vedlejší účinky. Promluvte si s poskytovatelem zdravotní péče o vedlejších účincích léku předepsaného vám nebo vašemu rodinnému příslušníkovi.
- Antidepresiva mohou interagovat s jinými léky. Znát všechny léky, které vy nebo váš rodinný příslušník užíváte. Uchovávejte seznam všech léků, abyste je mohli ukázat poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
- Ne všechna antidepresiva předepisovaná dětem jsou schválena FDA pro použití u dětí. Pro více informací se poraďte s poskytovatelem zdravotní péče vašeho dítěte.
Co je SEROQUEL 300 mg?
SEROQUEL 100 mg je lék na předpis používaný k léčbě:
- schizofrenie u lidí ve věku 13 let nebo starších
- bipolární porucha u dospělých, včetně:
- depresivní epizody spojené s bipolární poruchou
- manické epizody spojené se samotnou bipolární poruchou I nebo s lithiem nebo divalproexem
- dlouhodobá léčba bipolární poruchy I lithiem nebo divalproexem
- manické epizody spojené s bipolární poruchou I u dětí ve věku 10-17 let
Není známo, zda je SEROQUEL 100 mg bezpečný a účinný u dětí do 10 let.
Co mám sdělit svému poskytovateli zdravotní péče, než začnu užívat SEROQUEL 100 mg?
Před užitím přípravku SEROQUEL 200 mg informujte svého poskytovatele zdravotní péče, pokud máte nebo jste měl(a):
- cukrovku nebo vysokou hladinu cukru v krvi u vás nebo ve vaší rodině. Před zahájením léčby přípravkem SEROQUEL 300 mg a také v průběhu léčby by vám měl lékař zkontrolovat hladinu cukru v krvi
- vysoké hladiny celkového cholesterolu, triglyceridů nebo LDL-cholesterolu nebo nízké hladiny HDL-cholesterolu
- nízký nebo vysoký krevní tlak
- nízký počet bílých krvinek
- šedý zákal
- záchvaty
- abnormální testy štítné žlázy
- vysoké hladiny prolaktinu
- srdeční problémy
- problémy s játry
- jakýkoli jiný zdravotní stav
- těhotenství nebo plánuje otěhotnět. Není známo, zda SEROQUEL 100 mg poškodí vaše nenarozené dítě.
- Pokud otěhotníte během užívání přípravku SEROQUEL, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro atypická antipsychotika. Můžete se zaregistrovat na telefonním čísle 1-866-961-2388 nebo na adrese http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- kojíte nebo plánujete kojit. SEROQUEL může přecházet do vašeho mateřského mléka. Poraďte se se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení vašeho dítěte, pokud dostáváte SEROQUEL.
- jestliže máte nebo jste měl(a) stav, kdy nemůžete zcela vyprázdnit močový měchýř (retence moči), máte zvětšenou prostatu nebo zácpu nebo zvýšený tlak v očích.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte nebo jste v nedávné době užíval(a). včetně léků na předpis, volně prodejných léků, bylinných doplňků a vitamínů.
SEROQUEL 300 mg a jiné léky se mohou navzájem ovlivňovat a způsobit závažné nežádoucí účinky. SEROQUEL 200 mg může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku SEROQUEL 200 mg.
Informujte svého poskytovatele zdravotní péče, pokud podstupujete screening léků v moči, protože SEROQUEL může ovlivnit výsledky vašich testů. Řekněte testujícím, že užíváte SEROQUEL.
Jak mám užívat SEROQUEL?
- Užívejte SEROQUEL přesně tak, jak vám řekl váš poskytovatel zdravotní péče. Neměňte sami dávku.
- Užívejte SEROQUEL 25 mg ústy, s jídlem nebo bez jídla.
- Pokud máte pocit, že potřebujete vysadit SEROQUEL 25 mg, poraďte se nejprve se svým poskytovatelem zdravotní péče. Pokud náhle přestanete užívat SEROQUEL, můžete mít nežádoucí účinky, jako jsou potíže se spánkem nebo potíže s usínáním (nespavost), nevolnost a zvracení.
- Pokud vynecháte dávku přípravku SEROQUEL 25 mg, užijte ji, jakmile si vzpomenete. Pokud se blížíte k další dávce, vynechejte vynechanou dávku. Užijte si další dávku v obvyklou dobu. Neužívejte 2 dávky současně, pokud vám to neřekne váš poskytovatel zdravotní péče. Pokud si nejste jisti svým dávkováním, zavolejte svého poskytovatele zdravotní péče.
Čemu se mám vyhnout při užívání SEROQUEL 100 mg?
- Neřiďte, neobsluhujte stroje ani neprovádějte jiné nebezpečné činnosti, dokud nevíte, jak na vás SEROQUEL působí. SEROQUEL může způsobit ospalost.
- Vyhněte se přehřátí nebo dehydrataci.
- Nepřetěžujte se.
- V horkém počasí zůstaňte pokud možno uvnitř na chladném místě.
- Drž se mimo slunce. Nenoste příliš mnoho nebo těžké oblečení.
- Pít hodně vody.
- Během užívání přípravku SEROQUEL nepijte alkohol. Může to zhoršit některé nežádoucí účinky přípravku SEROQUEL.
Jaké jsou možné nežádoucí účinky přípravku SEROQUEL 300 mg?
SEROQUEL 200 mg může způsobit závažné nežádoucí účinky, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o SEROQUEL 200 mg?"
- mozková mrtvice, která může vést k úmrtí, se může vyskytnout u starších lidí s demencí, kteří užívají léky jako SEROQUEL
- neuroleptický maligní syndrom (NMS). NMS je vzácný, ale velmi závažný stav, který se může vyskytnout u lidí, kteří užívají antipsychotika, včetně přípravku SEROQUEL. NMS může způsobit smrt a musí být léčena v nemocnici. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud vážně onemocníte a máte některé nebo všechny tyto příznaky:
- vysoká horečka
- Nadměrné pocení
- tuhé svaly
- zmatek
- změny vašeho dýchání, srdečního tepu a krevního tlaku
- padá se může stát u některých lidí, kteří užívají SEROQUEL. Tyto pády mohou způsobit vážná zranění.
- vysoká hladina cukru v krvi (hyperglykémie). Vysoká hladina cukru v krvi se může objevit, pokud již máte cukrovku nebo pokud jste cukrovku nikdy neměli. Vysoká hladina cukru v krvi může vést k:
- hromadění kyseliny v krvi v důsledku ketonů (ketoacidóza)
- kóma
- smrt
některých lidí, kteří užívají SEROQUEL, může dojít ke zvýšení hladiny cukru v krvi. Extrémně vysoká hladina cukru v krvi může vést ke kómatu nebo smrti. Pokud máte cukrovku nebo rizikové faktory cukrovky (jako je nadváha nebo cukrovka v rodinné anamnéze), měl by vám váš poskytovatel zdravotní péče před zahájením léčby přípravkem SEROQUEL 50 mg a během léčby kontrolovat hladinu cukru v krvi. Zavolejte svého poskytovatele zdravotní péče, pokud máte některý z těchto příznaků vysoké hladiny cukru v krvi (hyperglykémie) při užívání přípravku SEROQUEL:
- cítit velkou žízeň
- potřeba močit více než obvykle
- cítit velký hlad
- cítit se slabý nebo unavený
- cítit se špatně od žaludku
- cítíte se zmateně nebo váš dech voní ovocně
- vysoké hladiny tuků v krvi (zvýšený cholesterol a triglyceridy). U lidí léčených SEROQUELem se může vyskytnout vysoká hladina tuku. Nemusíte mít žádné příznaky, takže se váš poskytovatel zdravotní péče může rozhodnout, že během léčby přípravkem SEROQUEL bude kontrolovat váš cholesterol a triglyceridy.
- zvýšení hmotnosti (přírůstek hmotnosti). Přibývání na váze je běžné u lidí, kteří užívají SEROQUEL, takže vy a váš poskytovatel zdravotní péče byste měli pravidelně kontrolovat svou váhu. Promluvte si se svým poskytovatelem zdravotní péče o způsobech, jak kontrolovat přibírání na váze, jako je zdravá, vyvážená strava a cvičení.
- pohyby, které nemůžete ovládat ve svém obličeji, jazyku nebo jiných částech těla (tardivní dyskineze). Mohou to být příznaky vážného stavu. Tardivní dyskineze nemusí vymizet, i když přestanete užívat SEROQUEL. Tardivní dyskineze může také začít poté, co přestanete užívat SEROQUEL.
- snížený krevní tlak (ortostatická hypotenze), včetně točení hlavy nebo mdloby způsobených náhlou změnou srdeční frekvence a krevního tlaku při příliš rychlém vstávání ze sedu nebo lehu.
- zvýšení krevního tlaku u dětí a dospívajících. Váš poskytovatel zdravotní péče by měl před zahájením léčby přípravkem SEROQUEL a během léčby kontrolovat krevní tlak u dětí a dospívajících.
- nízký počet bílých krvinek. Informujte svého poskytovatele zdravotní péče co nejdříve, pokud máte horečku, příznaky podobné chřipce nebo jakoukoli jinou infekci, protože to může být důsledkem velmi nízkého počtu bílých krvinek. Váš poskytovatel zdravotní péče může zkontrolovat hladinu vašich bílých krvinek, aby zjistil, zda je zapotřebí další léčba nebo jiná opatření.
- šedý zákal
- záchvaty
- abnormální testy štítné žlázy. Váš poskytovatel zdravotní péče může provést krevní testy, aby zkontroloval hladinu hormonů štítné žlázy.
- zvýšení hladiny prolaktinu
- ospalost, ospalost, pocit únavy, potíže s myšlením a prováděním běžných činností
- zvýšená tělesná teplota
- potíže s polykáním
- potíže se spánkem nebo potíže se spánkem (nespavost), nevolnost nebo zvracení, pokud náhle přestanete užívat SEROQUEL. Tyto příznaky se obvykle zlepší 1 týden poté, co je začnete mít.
Mezi nejčastější nežádoucí účinky přípravku SEROQUEL 50 mg patří:
U dospělých:
- ospalost
- náhlý pokles krevního tlaku při postavení
- přibývání na váze
- pomalost
- abnormální jaterní testy
- žaludeční nevolnost
- suchá ústa
- závrať
- slabost
- bolest břicha
- zácpa
- bolest krku
dětí a dospívajících:
- ospalost
- závrať
- únava
- nevolnost
- suchá ústa
- přibývání na váze
- zvýšená chuť k jídlu
- zvracení
- rychlý srdeční tep
To nejsou všechny možné vedlejší účinky přípravku SEROQUEL. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám SEROQUEL 100 mg uchovávat?
- Uchovávejte SEROQUEL 100 mg při pokojové teplotě, mezi 68 °F až 77 °F (20 °C až 25 °C).
- Uchovávejte SEROQUEL a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném užívání přípravku SEROQUEL
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte SEROQUEL na stav, pro který nebyl předepsán. Nedávejte SEROQUEL jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o SEROQUEL. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o přípravku SEROQUEL 100 mg, který je určen pro zdravotníky.
Pro více informací přejděte na www.SEROQUEL.com nebo zavolejte na číslo 1-800-236-9933.
Jaké složky obsahuje SEROQUEL 200 mg?
Aktivní složka: quetiapin fumarát
Neaktivní složky: povidon, dihydrát hydrogenfosforečnanu vápenatého, mikrokrystalická celulóza, sodná sůl karboxymethylškrobu, monohydrát laktózy, magnesium-stearát, hypromelóza, polyethylenglykol a oxid titaničitý. 25 mg tablety obsahují červený a žlutý oxid železitý. Tablety 100 mg a 400 mg obsahují pouze žlutý oxid železitý.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
