Paxil 10mg, 20mg, 30mg, 40mg Paroxetine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Paxil a jak se používá?
Paxil 20 mg je lék na předpis používaný k léčbě příznaků deprese, obsedantně-kompulzivní poruchy (OCD), panické poruchy, sociální fobie, generalizované úzkostné poruchy, posttraumatické stresové poruchy (PTSD) a premenstruačních dysohorických poruch (PMDD). Paxil lze užívat samostatně nebo s jinými léky.
- Paxil 40 mg patří do třídy léků nazývaných antidepresiva, SSRI.
- Není známo, zda je přípravek Paxil bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Paxil 30 mg?
Paxil 10 mg může způsobit závažné nežádoucí účinky, včetně:
- závodní myšlenky,
- snížená potřeba spánku,
- neobvyklé rizikové chování,
- pocity extrémního štěstí nebo smutku,
- být hovornější než obvykle,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halo kolem světel,
- neobvyklá bolest nebo citlivost kostí, otok nebo modřiny,
- změny hmotnosti,
- změny chuti k jídlu,
- snadná tvorba modřin,
- neobvyklé krvácení z nosu, úst, pochvy nebo konečníku,
- vykašlávání krve,
- velmi ztuhlé nebo ztuhlé svaly,
- vysoká horečka,
- pocení,
- zmatek,
- rychlý nebo nerovnoměrný srdeční tep,
- třes,
- mdloby,
- bolest hlavy,
- zmatek,
- nezřetelná řeč,
- těžká slabost,
- ztráta koordinace a
- pocit nejistoty
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Paxil 30 mg patří:
- změny vidění,
- slabost,
- ospalost,
- závrať,
- únava,
- pocení,
- úzkost,
- třes,
- problémy se spánkem (nespavost),
- ztráta chuti k jídlu,
- nevolnost,
- zvracení,
- průjem,
- zácpa,
- suchá ústa,
- infekce,
- bolest hlavy,
- snížená chuť na sex,
- impotence,
- abnormální ejakulace a
- potíže s orgasmem
Sebevražednost a antidepresiva
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití přípravku PAXIL 40 mg nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. PAXIL 30 mg není schválen pro použití u pediatrických pacientů. (Viz VAROVÁNÍ: Klinické zhoršení a riziko sebevraždy, INFORMACE PRO PACIENTA a BEZPEČNOSTNÍ OPATŘENÍ: Pediatrické použití.)
POPIS
PAXIL (paroxetin hydrochlorid) je perorálně podávané psychotropní léčivo. Je to hydrochloridová sůl fenylpiperidinové sloučeniny chemicky identifikovaná jako (-)-trans-4R-(4'fluorfenyl)-3S-[(3',4'-methylendioxyfenoxy)methyl]piperidin hydrochlorid hemihydrát a má empirický vzorec C19H20FNO3•HCl•½H2O. Molekulová hmotnost je 374,8 (329,4 jako volná báze). Strukturní vzorec hydrochloridu paroxetinu je:
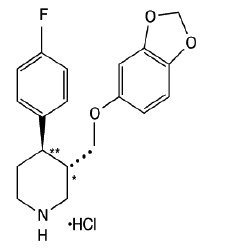
Paroxetin hydrochlorid je špinavě bílý prášek bez zápachu, který má teplotu tání v rozmezí 120 °C až 138 °C a rozpustnost ve vodě 5,4 mg/ml.
Jedna potahovaná tableta obsahuje paroxetini hydrochloridum ekvivalentní paroxetinu v následujícím pořadí: 10 mg – žlutá (s rýhou); 20 mg-růžová (bodováno); 30 mg-modrá, 40 mg-zelená. Neaktivní složky obsahují dihydrát hydrogenfosforečnanu vápenatého, hypromelózu, stearát hořečnatý, polyethylenglykoly, polysorbát 80, sodnou sůl glykolátu škrobu, oxid titaničitý a 1 nebo více z následujících látek: hliníkový lak D&C Red č. 30, hliníkový lak D&C Yellow č. 10 , FD&C Blue č. 2 hliníkový lak, FD&C Yellow č. 6 hliníkový lak.
Suspenze pro perorální podání
Každých 5 ml oranžové tekutiny s pomerančovou příchutí obsahuje paroxetin hydrochlorid ekvivalentní paroxetinu, 10 mg. Neaktivní složky se skládají z polakrilinu draselného, mikrokrystalické celulózy, propylenglykolu, glycerinu, sorbitolu, methylparabenu, propylparabenu, dihydrátu citrátu sodného, bezvodé kyseliny citrónové, sodné soli sacharinu, aromat, hliníkového laku FD&C Yellow č. 6 a emulze simethikonu, USP.
INDIKACE
PAXIL 20 mg je indikován u dospělých k léčbě:
- Velká depresivní porucha (MDD)
- Obsedantně kompulzivní porucha (OCD)
- Panická porucha (PD)
- Sociální úzkostná porucha (SAD)
- Generalizovaná úzkostná porucha (GAD)
- Posttraumatická stresová porucha (PTSD)
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o administraci
Podávejte PAXIL jako jednu denní dávku ráno, s jídlem nebo bez jídla.
Před podáním perorální suspenzi dobře protřepejte.
Doporučené dávkování pro MDD, OCD, PD a PTSD
Doporučené počáteční dávky a maximální dávky přípravku PAXIL 20 mg u pacientů s MDD, OCD, PD a PTSD jsou uvedeny v tabulce 1.
U pacientů s nedostatečnou odpovědí zvyšujte dávku o 10 mg denně v intervalech alespoň 1 týdne, v závislosti na snášenlivosti.
Doporučené dávkování pro SAD a GAD
SMUTNÝ
Počáteční a doporučená dávka u pacientů se SAD je 20 mg denně. V klinických studiích byla účinnost přípravku PAXIL 30 mg prokázána u pacientů, kteří dostávali dávky v rozmezí 20 mg až 60 mg denně. Zatímco bezpečnost přípravku PAXIL byla hodnocena u pacientů se SAD v dávkách až 60 mg denně, dostupné informace nenaznačují žádný další přínos pro dávky nad 20 mg denně (viz Klinické studie ].
GAD
Počáteční a doporučená dávka u pacientů s GAD je 20 mg denně. V klinických studiích byla účinnost přípravku PAXIL 10 mg u GAD prokázána u pacientů, kteří dostávali dávky v rozmezí 20 mg až 50 mg denně. Neexistují dostatečné důkazy, které by naznačovaly větší přínos dávek vyšších než 20 mg denně [viz Klinické studie ].
U pacientů s nedostatečnou odpovědí zvyšujte dávku o 10 mg denně v intervalech alespoň 1 týdne, v závislosti na snášenlivosti.
Obrazovka pro bipolární poruchu před zahájením PAXIL
Před zahájením léčby přípravkem PAXIL 10 mg nebo jiným antidepresivem proveďte screening pacientů na osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doporučené dávkování pro starší pacienty, pacienty s těžkou poruchou funkce ledvin a pacienty s těžkou poruchou funkce jater
Doporučená počáteční dávka je 10 mg denně pro starší pacienty, pacienty s těžkou poruchou funkce ledvin a pacienty s těžkou poruchou funkce jater. Dávkování by nemělo překročit 40 mg/den.
Přechod pacientů na nebo z inhibitoru monoaminooxidázy (MAOI)
Mezi vysazením inhibitoru monoaminooxidázy (MAOI a zahájením léčby přípravkem PAXIL musí uplynout alespoň 14 dní. Po vysazení přípravku PAXIL navíc musí uplynout alespoň 14 dní, než se zahájí podávání antidepresiv s MAOI [viz. KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přerušení léčby přípravkem PAXIL
Po přerušení léčby přípravkem PAXIL se mohou objevit nežádoucí účinky (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Postupně snižujte dávkování, spíše než náhlé vysazení přípravku PAXIL, kdykoli je to možné.
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety PAXIL jsou k dispozici jako:
- 10 mg žlutá tableta s půlicí rýhou na přední straně s vyrytým „PAXIL“ a na zadní straně s „10“.
- 20 mg růžová tableta s půlicí rýhou na přední straně s vyrytým „PAXIL“ a na zadní straně s „20“.
- 30mg modrá tableta s vyrytým nápisem „PAXIL“ na přední straně a „30“ na zadní straně.
- 40 mg zelená tableta s vyrytým nápisem „PAXIL“ na přední straně a „40“ na zadní straně.
PAXIL 20 mg perorální suspenze je k dispozici jako:
- 10 mg/5 ml oranžové suspenze s pomerančovou příchutí v lahvičkách o obsahu 250 ml.
Skladování A Manipulace
Tablety PAXIL (paroxetin). jsou oválné tablety dodávané jako:
Tablety uchovávejte při teplotě mezi 15° a 30°C (59° a 86°F).
PAXIL (paroxetin) perorální suspenze se dodává jako:
Suspenzi uchovávejte při teplotě do 25 °C (77 °F)
Výrobce: Apotex Inc., Toronto, Ontario, Kanada M9L 1T9. Upraveno: únor 2021
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji zahrnuty v jiných částech informací o předepisování:
- Hypersenzitivní reakce na paroxetin [viz KONTRAINDIKACE ]
- Sebevražedné myšlenky a chování [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Embryofetální a neonatální toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšené riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Aktivace mánie/hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Bezpečnostní údaje pro PAXIL jsou z:
- 6týdenní klinické studie u pacientů s MDD, kteří dostávali PAXIL 20 mg až 50 mg jednou denně
- 12týdenní klinické studie u pacientů s OCD, kteří dostávali PAXIL 20 mg až 60 mg jednou denně
- 10 až 12týdenní klinické studie u pacientů s PD, kteří dostávali PAXIL 10 mg až 60 mg jednou denně
- 12týdenní klinické studie u pacientů se SAD, kteří dostávali PAXIL 20 mg až 50 mg jednou denně
- 8týdenní klinické studie u pacientů s GAD, kteří dostávali PAXIL 10 mg až 50 mg jednou denně
- 12týdenní klinické studie u pacientů s PTSD, kteří dostávali PAXIL 20 mg až 50 mg jednou denně
Nežádoucí reakce vedoucí k ukončení
Dvacet procent (1 199/6 145) pacientů léčených přípravkem PAXIL v klinických studiích u MDD a 16,1 % (84/522), 11,8 % (64/542), 9,4 % (44/469), 10,7 % (79/735), a 11,7 % (79/676) pacientů léčených přípravkem PAXIL v klinických studiích u SAD, OCD, PD, GAD a PTSD, v tomto pořadí, přerušilo léčbu kvůli nežádoucí reakci. Nejčastější nežádoucí účinky (≥1 %) spojené s přerušením léčby (tj. nežádoucí účinky spojené s vysazením v míře přibližně dvojnásobné nebo vyšší pro PAXIL 10 mg ve srovnání s placebem) jsou uvedeny v tabulce 3:
Nejčastější nežádoucí reakce
Nejčastěji pozorované nežádoucí účinky spojené s užíváním přípravku PAXIL (výskyt 5 % nebo vyšší a nejméně dvakrát vyšší než u placeba) byly:
MDD
Astenie, pocení, nevolnost, snížená chuť k jídlu, somnolence, závratě, nespavost, třes, nervozita, poruchy ejakulace a další poruchy mužských pohlavních orgánů.
OCD
Nevolnost, sucho v ústech, snížená chuť k jídlu, zácpa, závratě, somnolence, třes, pocení, impotence a abnormální ejakulace.
PD
Astenie, pocení, snížená chuť k jídlu, snížené libido, třes, abnormální ejakulace, poruchy ženských pohlavních orgánů a impotence.
SMUTNÝ
Pocení, nevolnost, sucho v ústech, zácpa, snížená chuť k jídlu, somnolence, třes, snížené libido, zívání, abnormální ejakulace, poruchy ženských pohlavních orgánů a impotence.
GAD
Astenie, infekce, zácpa, snížená chuť k jídlu, sucho v ústech, nevolnost, snížené libido, somnolence, třes, pocení a abnormální ejakulace.
PTSD
Astenie, pocení, nevolnost, sucho v ústech, průjem, snížená chuť k jídlu, somnolence, snížené libido, abnormální ejakulace, poruchy ženských pohlavních orgánů a impotence.
Nežádoucí účinky u pacientů s MDD
Tabulka 4 uvádí nežádoucí účinky, které se vyskytly s incidencí 1 % nebo vyšší a vyšší než u placeba v klinických studiích u pacientů s MDD léčených PAXILem.
Nežádoucí reakce u pacientů s OCD, PD a SAD
Tabulka 5 uvádí nežádoucí účinky, které se vyskytly s frekvencí 2 % nebo více v klinických studiích u pacientů s OCD, PD a SAD.
Nežádoucí reakce u pacientů s GAD a PTSD
Tabulka 6 uvádí nežádoucí účinky, které se vyskytly s frekvencí 2 % nebo více v klinických studiích u pacientů s GAD a PTSD.
Nežádoucí účinky závislé na dávce
MDD
Srovnání četnosti nežádoucích reakcí ve studii s fixní dávkou porovnávající PAXIL10 mg, 20 mg, 30 mg a 40 mg jednou denně s placebem při léčbě MDD odhalilo na dávce závislé nežádoucí účinky, jak ukazuje tabulka 7:
OCD
Ve studii s fixní dávkou porovnávající placebo a PAXIL 20 mg, 40 mg a 60 mg při léčbě OCD nebyl jasný vztah mezi nežádoucími účinky a dávkou PAXIL 30 mg, ke které byli pacienti zařazeni.
PD
Ve studii s fixní dávkou porovnávající placebo a PAXIL 10 mg, 20 mg a 40 mg při léčbě PD se ukázalo, že následující nežádoucí účinky jsou závislé na dávce: astenie, sucho v ústech, úzkost, snížené libido, třes a abnormální ejakulace.
SMUTNÝ
Ve studii s fixní dávkou porovnávající placebo a PAXIL 20 mg, 40 mg a 60 mg při léčbě SAD u většiny nežádoucích účinků nebyl jasný vztah mezi nežádoucími účinky a dávkou přípravku PAXIL 10 mg, ke které byli pacienti zařazeni. .
GAD
Ve studii s fixní dávkou porovnávající placebo a PAXIL 20 mg a 40 mg při léčbě GAD se ukázalo, že následující nežádoucí účinky jsou závislé na dávce: astenie, zácpa a abnormální ejakulace.
PTSD
Ve studii s fixní dávkou porovnávající placebo a PAXIL 20 mg a 40 mg při léčbě PTSD se ukázalo, že následující nežádoucí účinky jsou závislé na dávce: impotence a abnormální ejakulace.
Mužské a ženské sexuální dysfunkce
Ačkoli změny v sexuální touze, sexuální výkonnosti a sexuální spokojenosti se často objevují jako projevy psychiatrické poruchy, mohou být také důsledkem léčby SSRI. Spolehlivé odhady výskytu a závažnosti nežádoucích zážitků zahrnujících sexuální touhu, výkon a uspokojení je však obtížné získat, částečně proto, že pacienti a poskytovatelé zdravotní péče se mohou zdráhat o nich diskutovat. V souladu s tím mohou odhady výskytu nežádoucích sexuálních zkušeností a výkonu uvedené v označení podceňovat jejich skutečný výskyt.
Procento pacientů uvádějících příznaky sexuální dysfunkce u mužů a žen s MDD, OCD, PD, SAD, GAD a PTSD je uvedeno v tabulce 8.
Léčba přípravkem PAXIL 20 mg byla spojena s několika případy priapismu. V případech se známým výsledkem se pacienti zotavili bez následků.
Halucinace
souhrnných klinických studiích s PAXILem byly halucinace pozorovány u 0,2 % pacientů léčených přípravkem PAXIL ve srovnání s 0,1 % pacientů užívajících placebo.
Méně časté nežádoucí reakce
Následující nežádoucí účinky se objevily během klinických studií přípravku PAXIL a nejsou zahrnuty jinde v označení.
Nežádoucí účinky jsou kategorizovány podle tělesného systému a uvedeny v pořadí klesající frekvence podle následujících definic: Časté nežádoucí účinky jsou ty, které se vyskytují 1 nebo vícekrát u nejméně 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1 000 pacientů; vzácné nežádoucí účinky jsou ty, které se vyskytují u méně než 1/1 000 pacientů.
Tělo jako celek
Méně časté: Alergická reakce, zimnice, otok obličeje, malátnost, bolest šíje; vzácné: Adrenergní syndrom, celulitida, moniliáza, ztuhlost krku, pánevní bolest, peritonitida, sepse, vřed.
Kardiovaskulární systém
Časté: Hypertenze, tachykardie; méně časté: Bradykardie, hematom, hypotenze, migréna, posturální hypotenze, synkopa; vzácné: angina pectoris, nodální arytmie, fibrilace síní, blokáda raménka, mozková ischemie, cerebrovaskulární příhoda, městnavé srdeční selhání, srdeční blok, nízký srdeční výdej, infarkt myokardu, ischemie myokardu, bledost, flebitida, plicní embolie, extratoletrisysybitis trombóza, křečové žíly, vaskulární bolesti hlavy, ventrikulární extrasystoly.
Zažívací ústrojí
Méně časté: Bruxismus, kolitida, dysfagie, říhání, gastritida, gastroenteritida, gingivitida, glositida, zvýšené slinění, abnormální jaterní testy, rektální krvácení, ulcerózní stomatitida; vzácné: Aftózní stomatitida, krvavý průjem, bulimie, kardiospasmus, cholelitiáza, duodenitida, enteritida, ezofagitida, fekální zaklínění, fekální inkontinence, krvácení z dásní, hematemeza, hepatitida, ileitida, ileus, střevní obstrukce, žloutenka, melena, ulcerace v ústech, peptický vřed zvětšení slinných žláz, sialadenitida, žaludeční vřed, stomatitida, změna barvy jazyka, edém jazyka, zubní kaz.
Endokrinní systém
Vzácné: Diabetes mellitus, struma, hypertyreóza, hypotyreóza, tyreoiditida.
Hemický a lymfatický systém
Méně časté: Anémie, leukopenie, lymfadenopatie, purpura; vzácné: Abnormální erytrocyty, bazofilie, zvýšená doba krvácení, eozinofilie, hypochromní anémie, anémie z nedostatku železa, leukocytóza, lymfedém, abnormální lymfocyty, lymfocytóza, mikrocytární anémie, monocytóza, normocytární anémie, trombocytémie, trombocytopenie.
Metabolické a nutriční
Časté: Přibývání na váze; vzácné: Edém, periferní edém, zvýšená SGOT, zvýšená SGPT, žízeň, ztráta hmotnosti; vzácné: zvýšení alkalické fosfatázy, bilirubinémie, zvýšení BUN, zvýšení kreatininfosfokinázy, dehydratace, zvýšení gama globulinů, dna, hyperkalcémie, hypercholesterémie, hyperglykémie, hyperkalémie, hyperfosfatémie, hypokalcémie, hypoglykémie, hypokalémie, hypoketagenáza, zvýšená laktická dehydrogenémie, dusíku (NPN) zvýšené.
Muskuloskeletální systém
Časté: Artralgie; vzácné: Artritida, artróza; vzácné: Bursitida, myositida, osteoporóza, generalizovaný spasmus, tenosynovitida, tetanie.
Nervový systém
Časté: emoční labilita, vertigo; méně časté: Abnormální myšlení, zneužívání alkoholu, ataxie, dystonie, dyskineze, euforie, nepřátelství, hypertonie, hypestezie, hypokineze, nekoordinovanost, nedostatek emocí, zvýšené libido, manická reakce, neuróza, paralýza, paranoidní reakce; vzácné: Abnormální chůze, akineze, antisociální reakce, afázie, choreoatetóza, cirkumorální parestézie, křeče, delirium, bludy, diplopie, drogová závislost, dysartrie, extrapyramidový syndrom, fascikulace, grand mal křeče, hyperalgezie, hysterie, maniakální zánět myelitida, neuralgie, neuropatie, nystagmus, periferní neuritida, psychotická deprese, psychóza, snížené reflexy, zvýšené reflexy, stupor, torticollis, trismus, abstinenční syndrom.
Dýchací systém
Méně časté: Astma, bronchitida, dušnost, epistaxe, hyperventilace, pneumonie, respirační chřipka; vzácné: Emfyzém, hemoptýza, škytavka, plicní fibróza, plicní edém, zvýšené sputum, stridor, změna hlasu.
Kůže a přílohy
Časté: pruritus; méně časté: Akné, alopecie, kontaktní dermatitida, suchá kůže, ekchymóza, ekzém, herpes simplex, fotosenzitivita, kopřivka; vzácné: Angioedém, erythema nodosum, erythema multiforme, exfoliativní dermatitida, plísňová dermatitida, furunkulóza; herpes zoster, hirsutismus, makulopapulózní vyrážka, seborrhea, změna barvy kůže, hypertrofie kůže, kožní vřed, snížené pocení, vezikulobulózní vyrážka.
Speciální smysly
Časté: Tinnitus; méně časté: Abnormality akomodace, konjunktivitida, bolest ucha, bolest oka, keratokonjunktivitida, mydriáza, zánět středního ucha; vzácné: Amblyopie, anizokorie, blefaritida, šedý zákal, edém spojivky, vřed rohovky, hluchota, exoftalmus, oční krvácení, glaukom, hyperakuzie, šeroslepost, zánět zevního ucha, parosmie, fotofobie, ptóza, krvácení do sítnice, ztráta chuti, defekt zorného pole.
Urogenitální systém
Méně časté: Amenorea, bolest prsů, cystitida, dysurie, hematurie, menoragie, nykturie, polyurie, pyurie, inkontinence moči, retence moči, nutkání na moč, vaginitida; vzácné: Potrat, atrofie prsů, zvětšení prsou, porucha endometria, epididymitida, laktace u žen, fibrocystická prsa, ledvinový kámen, bolest ledvin, leukorea, mastitida, metroragie, nefritida, oligurie, salpingitida, uretritida, urinární křeče, děložní křeče, uralitida, vagina krvácení, vaginální moniliáza.
Postmarketingové zkušenosti
Následující reakce byly zjištěny během používání PAXIL po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace neznámé velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Akutní pankreatitida, zvýšené hodnoty jaterních testů (nejzávažnější případy byly úmrtí v důsledku jaterní nekrózy a výrazně zvýšené transaminázy spojené s těžkou jaterní dysfunkcí), Guillain-Barrého syndrom, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, syndrom nepřiměřené sekrece ADH, prolaktinemie a galaktorea; extrapyramidové příznaky, které zahrnovaly akatizii, bradykinezi, rigiditu ozubeného kola, okulogyrickou krizi, která byla spojena se současným užíváním pimozidu; status epilepticus, akutní selhání ledvin, plicní hypertenze, alergická alveolitida, anafylaxe, eklampsie, laryngismus, optická neuritida, porfyrie, syndrom neklidných nohou (RLS), ventrikulární fibrilace, ventrikulární tachykardie (včetně torsade de pointes), hemolytická anémie, příhody související s poruchou hematopoéza (včetně aplastické anémie, pancytopenie, aplazie kostní dřeně a agranulocytózy), vaskulitické syndromy (jako je Henochova-Schönleinova purpura) a předčasné porody u těhotných žen. Byl hlášen případ těžké hypotenze, když byl PAXIL 20 mg přidán k chronické léčbě metoprololem.
DROGOVÉ INTERAKCE
Tabulka 9 uvádí klinicky významné lékové interakce s PAXILem.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Sebevražedné myšlenky a chování u dospívajících a mladých dospělých
V souhrnných analýzách placebem kontrolovaných studií antidepresiv (SSRI a jiných tříd antidepresiv), které zahrnovaly přibližně 77 000 dospělých pacientů a 4 500 dětských pacientů, byl výskyt sebevražedných myšlenek a chování u pacientů léčených antidepresivy ve věku 24 let a mladších vyšší než v pacientů léčených placebem. Mezi drogami byly značné rozdíly v riziku sebevražedných myšlenek a chování, ale u většiny studovaných drog bylo zjištěno zvýšené riziko u mladých pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku sebevražedných myšlenek a chování, s nejvyšší incidencí u pacientů s MDD. Rozdíly mezi lékem a placebem v počtu případů sebevražedných myšlenek a chování na 1000 léčených pacientů jsou uvedeny v tabulce 2.
PAXIL 30 mg není schválen pro použití u pediatrických pacientů.
Není známo, zda riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých přesahuje dlouhodobé užívání, tj. déle než čtyři měsíce. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s MDD, že antidepresiva oddalují recidivu deprese a že samotná deprese je rizikovým faktorem pro sebevražedné myšlenky a chování.
Monitorujte všechny pacienty léčené antidepresivy kvůli jakékoli indikaci klinického zhoršení a výskytu sebevražedných myšlenek a chování, zejména během několika prvních měsíců lékové terapie a v době změn dávkování. Poraďte rodinné příslušníky nebo pečovatele pacientů, aby sledovali změny v chování a varovali poskytovatele zdravotní péče. Zvažte změnu terapeutického režimu, včetně možného přerušení léčby přípravkem PAXIL, u pacientů, jejichž deprese se trvale zhoršuje nebo u kterých se objevují náhlé sebevražedné myšlenky nebo chování.
serotoninový syndrom
SSRI, včetně PAXIL, mohou urychlit serotoninový syndrom, potenciálně život ohrožující stav. Riziko se zvyšuje při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů a třezalky tečkované) a léků, které zhoršují metabolismus serotoninu, tj. IMAO [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ]. Serotoninový syndrom se může také objevit, když se tyto léky užívají samostatně.
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární příznaky (např. třes, ztuhlost, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem).
Současné užívání přípravku PAXIL s IMAO je kontraindikováno. Kromě toho nezahajujte léčbu přípravkem PAXIL 30 mg u pacienta léčeného IMAO, jako je linezolid nebo intravenózní methylenová modř. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Pokud je nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř u pacienta užívajícího PAXIL 10 mg, přerušte PAXIL 40 mg před zahájením léčby IMAO [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
U všech pacientů užívajících PAXIL 20 mg sledujte výskyt serotoninového syndromu. Pokud se objeví výše uvedené příznaky, okamžitě přerušte léčbu přípravkem PAXIL 20 mg a jakýmikoli souběžně podávanými serotonergními látkami a zahajte podpůrnou symptomatickou léčbu. Pokud je současné užívání přípravku PAXIL s jinými serotonergními léky klinicky oprávněné, informujte pacienty o zvýšeném riziku serotoninového syndromu a sledujte příznaky.
Lékové interakce vedoucí k prodloužení QT intervalu
Inhibiční vlastnosti paroxetinu na CYP2D6 mohou zvýšit plazmatické hladiny thioridazinu a pimozidu. Vzhledem k tomu, že thioridazin a pimozid podávané samostatně způsobují prodloužení QTc intervalu a zvyšují riziko závažných komorových arytmií, je použití přípravku PAXIL 40 mg kontraindikováno v kombinaci s thioridazinem a pimozidem [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
Embryofetální a neonatální toxicita
PAXIL může způsobit poškození plodu při podání těhotné ženě. Epidemiologické studie ukázaly, že kojenci vystavení paroxetinu v prvním trimestru těhotenství mají zvýšené riziko kardiovaskulárních malformací. Expozice paroxetinu v pozdním těhotenství může vést ke zvýšenému riziku perzistující plicní hypertenze novorozenců (PPNH) a/nebo neonatálních komplikací vyžadujících prodlouženou hospitalizaci, respirační podporu a sondovou výživu.
Pokud se přípravek PAXIL 20 mg používá během těhotenství nebo pokud pacientka otěhotní během užívání přípravku PAXIL 30 mg, měla by být informována o potenciálním riziku pro plod [viz Použití u konkrétních populací ].
Zvýšené riziko krvácení
Léky, které interferují s inhibicí zpětného vychytávání serotoninu, včetně přípravku PAXIL 40 mg, zvyšují riziko krvácivých příhod. Současné užívání aspirinu, nesteroidních protizánětlivých léků (NSAIDS), jiných protidestičkových léků, warfarinu a dalších antikoagulancií může toto riziko zvýšit. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Krvácení související s léky, které interferují se zpětným vychytáváním serotoninu, se pohybovaly od ekchymóz, hematomů, epistaxe a petechií až po život ohrožující krvácení.
Informujte pacienty o zvýšeném riziku krvácení spojeném se současným užíváním přípravku PAXIL 20 mg a protidestičkových látek nebo antikoagulancií. U pacientů užívajících warfarin pečlivě sledujte mezinárodní normalizovaný poměr.
Aktivace Mánie Nebo Hypománie
U pacientů s bipolární poruchou může léčba depresivní epizody přípravkem PAXIL 30 mg nebo jiným antidepresivem vyvolat smíšenou/manickou epizodu. Během kontrolovaných klinických studií přípravku PAXIL se hypománie nebo mánie vyskytly přibližně u 1 % unipolárních pacientů léčených přípravkem PAXIL ve srovnání s 1,1 % pacientů s aktivní kontrolou a 0,3 % unipolárních pacientů léčených placebem. Před zahájením léčby přípravkem PAXIL 20 mg proveďte screening pacientů na jakoukoli osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie.
Syndrom vysazení
Nežádoucí účinky po vysazení serotonergních antidepresiv, zejména po náhlém vysazení, zahrnují: nevolnost, pocení, dysforickou náladu, podrážděnost, neklid, závratě, poruchy smyslů (např. parestézie, jako jsou pocity elektrického šoku), třes, úzkost, zmatenost, bolest hlavy, letargie, emoční labilita, nespavost, hypománie, tinnitus a záchvaty. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Během klinických studií GAD a PTSD se před ukončením léčby používalo postupné snižování denní dávky o 10 mg/den v týdenních intervalech a následně 1 týden při 20 mg/den. Následující nežádoucí účinky byly hlášeny s incidencí 2 % nebo vyšší pro PAXIL 20 mg a byly nejméně dvakrát vyšší než u placeba: Abnormální sny, parestézie a závratě Nežádoucí účinky byly hlášeny po přerušení léčby přípravkem PAXIL u pediatrických pacientů. Bezpečnost a účinnost přípravku PAXIL u pediatrických pacientů nebyla stanovena (viz VAROVÁNÍ V KRABICE , Sebevražedné myšlenky a chování u dospívajících a mladých dospělých , Použití u konkrétních populací ].
Záchvaty
PAXIL 10 mg tablety a perorální suspenze nebyly systematicky hodnoceny u pacientů se záchvatovými poruchami. Pacienti s anamnézou záchvatů byli z klinických studií vyloučeni. Během klinických studií se záchvaty vyskytly u 0,1 % pacientů léčených přípravkem PAXIL. PAXIL by měl být předepisován s opatrností u pacientů se záchvatovým onemocněním. U každého pacienta, u kterého se objeví záchvaty, přerušte léčbu přípravkem PAXIL 30 mg.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně PAXIL, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii. Byly hlášeny případy glaukomu s uzavřeným úhlem spojené s užíváním přípravku PAXIL 40 mg. Vyhněte se užívání antidepresiv, včetně přípravku PAXIL u pacientů s neléčenými anatomicky úzkými úhly.
Hyponatrémie
V důsledku léčby SSRI, včetně přípravku PAXIL, se může objevit hyponatremie. Byly hlášeny případy se sérovým sodíkem nižším než 110 mmol/l. Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, které mohou vést k pádům. Známky a symptomy spojené se závažnějšími a/nebo akutními případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt. V mnoha případech se zdá, že tato hyponatremie je výsledkem syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH).
pacientů se symptomatickou hyponatrémií přerušte léčbu přípravkem PAXIL a zahajte vhodnou lékařskou intervenci. Starší pacienti, pacienti užívající diuretika a ti, kteří mají depleci objemu, mohou mít větší riziko rozvoje hyponatremie s SSRI (viz Použití u konkrétních populací ].
Snížení účinnosti Tamoxifenu
Některé studie ukázaly, že účinnost tamoxifenu, měřená rizikem relapsu/úmrtnosti rakoviny prsu, může být snížena při současném užívání přípravku PAXIL v důsledku nevratné inhibice CYP2D6 paroxetinem a nižších hladin tamoxifenu v krvi [viz DROGOVÉ INTERAKCE ]. Jedna studie naznačuje, že riziko se může zvyšovat s delší dobou současného podávání. Jiné studie však takové riziko neprokázaly. Pokud se tamoxifen používá k léčbě nebo prevenci rakoviny prsu, předepisující lékaři by měli zvážit použití alternativního antidepresiva s malou nebo žádnou inhibicí CYP2D6.
Zlomenina kosti
Epidemiologické studie o riziku zlomenin kostí při expozici některým antidepresivům, včetně SSRI, uvádějí souvislost mezi léčbou antidepresivy a zlomeninami. Existuje několik možných příčin tohoto pozorování a není známo, do jaké míry lze riziko zlomenin přímo připsat léčbě SSRI.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Sebevražedné myšlenky a chování
Poraďte pacientům a pečovatelům, aby hledali výskyt sebevraždy, zvláště brzy během léčby a když je dávka upravena nahoru nebo dolů, a poučte je, aby takové příznaky hlásili poskytovateli zdravotní péče [viz VAROVÁNÍ V KRABICE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
serotoninový syndrom
Varujte pacienty před rizikem serotoninového syndromu, zvláště při současném užívání přípravku PAXIL s jinými serotonergními léky včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů, třezalky tečkované a léků, které zhoršují metabolismus serotonin (zejména IMAO, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid). Poučte pacienty, aby kontaktovali svého poskytovatele zdravotní péče nebo hlásili na pohotovost, pokud zaznamenají známky nebo příznaky serotoninového syndromu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Doprovodné léky
Poraďte pacientům, aby informovali svého lékaře, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože existuje možnost lékových interakcí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Zvýšené riziko krvácení
Informujte pacienty o současném užívání přípravku PAXIL s aspirinem, NSAID, jinými protidestičkovými léky, warfarinem nebo jinými antikoagulancii, protože kombinované použití bylo spojeno se zvýšeným rizikem krvácení. Poraďte pacientům, aby informovali své poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, které zvyšují riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Aktivace mánie/hypománie
Poraďte pacientům a jejich pečovatelům, aby sledovali známky aktivace mánie/hypománie a poučte je, aby takové příznaky hlásili poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Syndrom vysazení
Poraďte pacientům, aby náhle neukončili léčbu přípravkem PAXIL 40 mg a aby případný postup snižování dávky projednali se svým poskytovatelem zdravotní péče. Informujte pacienty, že se mohou objevit nežádoucí účinky, když je PAXIL přerušen (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Informace o podávání pro perorální pozastavení
Poučte pacienty, aby před podáním dobře protřepali perorální suspenzi [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Alergické reakce
Informujte pacienty, aby informovali svého poskytovatele zdravotní péče, pokud se u nich objeví alergická reakce, jako je vyrážka, kopřivka, otok nebo potíže s dýcháním [viz NEŽÁDOUCÍ REAKCE ].
Embryo-fetální toxicita
Informujte ženy o potenciálním riziku pro plod [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ]. Informujte pacientky, aby informovaly svého poskytovatele zdravotní péče, pokud otěhotní nebo plánují otěhotnět během léčby kvůli riziku pro plod.
Ošetřovatelství
Poraďte ženám, aby informovaly svého poskytovatele zdravotní péče, pokud kojí kojence [viz Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Dvouleté studie karcinogenity byly provedeny na hlodavcích, kterým byl paroxetin podáván v potravě v dávkách 1, 5 a 25 mg/kg/den (myši) a 1, 5 a 20 mg/kg/den (krysy). Tyto dávky jsou až 2,0 (myš) a 3,2 (krysa) násobek MRHD 75 mg na základě mg/m2. Ve skupině s vysokou dávkou byl významně vyšší počet samců potkanů se sarkomy retikulárních buněk (1/100, 0/50, 0/50 a 4/50 pro kontrolní skupiny, skupiny s nízkou, střední a vysokou dávkou a významně zvýšený lineární trend napříč dávkovými skupinami pro výskyt lymforetikulárních nádorů u samců potkanů. Samice potkanů nebyly ovlivněny. Přestože u myší došlo ke zvýšení počtu nádorů v závislosti na dávce, nedošlo k žádnému zvýšení počtu myší s nádory souvisejícími s lékem. Význam těchto zjištění pro člověka není znám.

Mutageneze
Paroxetin nevyvolal žádné genotoxické účinky v baterii 5 in vitro a 2 in vivo testů, které zahrnovaly následující: Test bakteriální mutace, test mutace myšího lymfomu, test neplánované syntézy DNA a testy na cytogenetické aberace in vivo v kostní dřeni myší a in vitro v lidských lymfocytech a v dominantním letálním testu u potkanů.
Zhoršení Plodnosti
Některé klinické studie ukázaly, že SSRI (včetně paroxetinu) mohou ovlivnit kvalitu spermií během léčby SSRI, což může u některých mužů ovlivnit plodnost.
Snížená míra březosti byla zjištěna v reprodukčních studiích u potkanů při dávce paroxetinu 15 mg/kg/den, což je 2,4násobek MRHD 75 mg na základě mg/m2. Ireverzibilní léze se objevily v reprodukčním traktu samců potkanů po dávkování ve studiích toxicity po dobu 2 až 52 týdnů. Tyto léze sestávaly z vakuolizace epididymálního tubulárního epitelu při 50 mg/kg/den a atrofických změn v semenotvorných tubulech varlat se zástavou spermatogeneze při 25 mg/kg/den (8,2 a 4,1násobek MRHD 75 mg na mg/den). základ m2).
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství D [Viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Epidemiologické studie ukázaly, že kojenci vystavení paroxetinu v prvním trimestru těhotenství mají zvýšené riziko vrozených malformací, zejména kardiovaskulárních malformací. Pokud se paroxetin používá během těhotenství nebo pokud pacientka otěhotní během užívání paroxetinu, upozorněte pacientku na potenciální riziko pro plod.
Klinické úvahy
Pokud přínos paroxetinu pro matku neospravedlňuje pokračování léčby, je třeba zvážit buď přerušení léčby paroxetinem, nebo přechod na jiné antidepresivum (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pro
- Studie založená na údajích švédského národního registru prokázala, že kojenci vystavení paroxetinu během těhotenství (n = 815) měli zvýšené riziko kardiovaskulárních malformací (riziko 2 % u kojenců vystavených paroxetinu) ve srovnání s celou populací v registru (riziko 1 %), pro poměr šancí (OR) 1,8 (95% interval spolehlivosti 1,1 až 2,8). U kojenců exponovaných paroxetinu nebylo pozorováno žádné zvýšení rizika celkových vrozených malformací. Srdeční malformace u dětí vystavených paroxetinu byly primárně defekty komorového septa (VSD) a defekty septa síní (ASD). Závažnost defektů septa se pohybuje od těch, které vymizí spontánně, až po ty, které vyžadují chirurgický zákrok.
- Samostatná retrospektivní kohortová studie ze Spojených států (data United Healthcare) hodnotila 5 956 kojenců matek, kterým byla během prvního trimestru vydána antidepresiva (n = 815 pro paroxetin). Tato studie ukázala trend ke zvýšenému riziku kardiovaskulárních malformací u paroxetinu (riziko 1,5 %) ve srovnání s jinými antidepresivy (riziko 1 %), pro OR 1,5 (95% interval spolehlivosti 0,8 až 2,9). Z 12 dětí s kardiovaskulárními malformacemi vystavených paroxetinu mělo 9 VSD. Tato studie také naznačila zvýšené riziko celkových velkých vrozených malformací včetně kardiovaskulárních defektů u paroxetinu (4% riziko) ve srovnání s jinými (2% riziko) antidepresivy (OR 1,8; 95% interval spolehlivosti 1,2 až 2,8).
- Dvě velké studie případ-kontrola využívající samostatné databáze, každá s > 9 000 případy vrozených vad a > 4 000 kontrolami, zjistily, že užívání paroxetinu matkou během prvního trimestru těhotenství bylo spojeno s 2- až 3-násobným zvýšením rizika odtoku z pravé komory překážky traktu. V jedné studii byl OR 2,5 (95% interval spolehlivosti, 1,0 až 6,0, 7 exponovaných kojenců) a v druhé studii byl OR 3,3 (95% interval spolehlivosti, 1,3 až 8,8, 6 exponovaných kojenců).
Jiné studie zjistily různé výsledky, pokud jde o to, zda existuje zvýšené riziko celkových, kardiovaskulárních nebo specifických vrozených malformací. Metaanalýza epidemiologických údajů za 16leté období (1992 až 2008) o užívání paroxetinu v prvním trimestru v těhotenství a vrozených malformacích zahrnovala kromě jiných i výše uvedené studie (n = 17 studií, které zahrnovaly celkové malformace a n = 14 studií, které zahrnovaly kardiovaskulární malformace; n = 20 různých studií). Ačkoli tato metaanalýza podléhá omezením, naznačila zvýšený výskyt kardiovaskulárních malformací (poměr pravděpodobnosti prevalence [POR] 1,5; 95% interval spolehlivosti 1,2 až 1,9) a celkových malformací (POR 1,2; 95% interval spolehlivosti 1,1 až 1,4) u paroxetinu používat během prvního trimestru. V této metaanalýze nebylo možné určit, do jaké míry mohla pozorovaná prevalence kardiovaskulárních malformací přispět k celkovému výskytu malformací, ani nebylo možné určit, zda k pozorované prevalenci mohly přispět nějaké specifické typy kardiovaskulárních malformací. všech kardiovaskulárních malformací.
Pokud přínos paroxetinu pro matku neospravedlňuje pokračování léčby, je třeba zvážit buď přerušení léčby paroxetinem, nebo přechod na jiné antidepresivum (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. U žen, které plánují otěhotnět nebo jsou v prvním trimestru těhotenství, by měla být léčba paroxetinem zahájena pouze po zvážení dalších dostupných možností léčby (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léčba těhotných žen během jejich třetího trimestru
novorozenců vystavených SSRI nebo inhibitorům zpětného vychytávání serotoninu a norepinefrinu (SNRI), včetně PAXIL 40 mg, se koncem třetího trimestru rozvinuly komplikace vyžadující prodlouženou hospitalizaci, podporu dýchání a výživu sondou. Takové komplikace mohou nastat ihned po porodu. Hlášené klinické nálezy zahrnovaly respirační tíseň, cyanózu, apnoe, záchvaty, teplotní nestabilitu, potíže s krmením, zvracení, hypoglykémii, hypotonii, hypertonii, hyperreflexii, třes, nervozitu, podrážděnost a neustálý pláč. Tyto rysy jsou v souladu buď s přímým toxickým účinkem SSRI a SNRI, nebo případně se syndromem z vysazení léku. Je třeba poznamenat, že v některých případech je klinický obraz v souladu se serotoninovým syndromem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Expozice SSRI v pozdním těhotenství může mít zvýšené riziko perzistující plicní hypertenze novorozenců (PPHN). PPHN se vyskytuje u 1 – 2 na 1 000 živě narozených dětí v běžné populaci a je spojena s významnou neonatální morbiditou a mortalitou. V retrospektivní studii případ-kontrola 377 žen, jejichž děti se narodily s PPHN, a 836 žen, jejichž děti se narodily zdravé, bylo riziko rozvoje PPHN přibližně šestkrát vyšší u kojenců vystavených SSRI po 20. týdnu gestace ve srovnání s kojenci. kteří nebyli vystaveni antidepresivům během těhotenství.
Po uvedení přípravku na trh byly také hlášeny předčasné porody u těhotných žen vystavených paroxetinu nebo jiným SSRI.
Při léčbě těhotné ženy paroxetinem během třetího trimestru by měl lékař pečlivě zvážit potenciální rizika i přínosy léčby. Prospektivní longitudinální studie 201 žen s anamnézou těžké deprese, které byly euthymické na začátku těhotenství. Ženy, které během těhotenství vysadily antidepresiva, měly větší pravděpodobnost recidivy těžké deprese než ženy, které pokračovaly v léčbě antidepresivy.
Nálezy na zvířatech
Reprodukční studie byly provedeny v dávkách až 50 mg/kg/den u potkanů a 6 mg/kg/den u králíků podávaných během organogeneze. Tyto dávky jsou přibližně 6násobek (potkan) a méně než 2násobek (králík) maximální doporučené dávky pro člověka (MRHD – 75 mg) na základě mg/m2. Tyto studie neodhalily žádné důkazy o vývojových účincích. U potkanů však došlo ke zvýšení počtu úmrtí mláďat během prvních 4 dnů laktace, když k dávkování došlo během posledního trimestru gestace a pokračovalo během laktace. K tomuto účinku došlo při dávce 1 mg/kg/den, což je více než MRHD na základě mg/m2. Dávka bez účinku na mortalitu potkaních mláďat nebyla stanovena. Příčina těchto úmrtí není známa.
Kojící matky
Stejně jako mnoho jiných léků je paroxetin vylučován do mateřského mléka. Vzhledem k potenciálu závažných nežádoucích reakcí u kojených dětí při užívání přípravku PAXIL 20 mg by se mělo rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost přípravku PAXIL u pediatrických pacientů nebyla stanovena (viz BOX VAROVÁNÍ ]. Účinnost nebyla prokázána ve třech placebem kontrolovaných studiích u 752 pediatrických pacientů s MDD léčených PAXILem.
Antidepresiva zvyšují riziko sebevražedných myšlenek a chování u dětských pacientů [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. V souvislosti s užíváním SSRI byla pozorována snížená chuť k jídlu a úbytek hmotnosti.
placebem kontrolovaných klinických studiích prováděných s pediatrickými pacienty byly následující nežádoucí účinky hlášeny u nejméně 2 % pediatrických pacientů léčených přípravkem PAXIL a vyskytovaly se nejméně dvakrát častěji než u pediatrických pacientů užívajících placebo: emoční labilita (včetně sebepoškozování , sebevražedné myšlenky, pokus o sebevraždu, pláč a kolísání nálady), nepřátelství, snížená chuť k jídlu, třes, pocení, hyperkineze a neklid.
Nežádoucí reakce po přerušení léčby přípravkem PAXIL v pediatrických klinických studiích, které zahrnovaly režim zužující se fáze, které se vyskytly u nejméně 2 % pacientů a v míře nejméně dvakrát vyšší než u placeba, byly: emoční labilita (včetně sebevražedných myšlenek, sebevraždy pokus, změny nálady a plačtivost), nervozita, závratě, nevolnost a bolest břicha.
Geriatrické použití
premarketingových klinických studiích s přípravkem PAXIL 10 mg bylo 17 % pacientů léčených přípravkem PAXIL (přibližně 700) ve věku 65 let nebo starších. Farmakokinetické studie odhalily sníženou clearance u starších pacientů a doporučuje se nižší počáteční dávka; nebyly však pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti mezi staršími a mladšími pacienty (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
SSRI včetně PAXILu byly spojeny s případy klinicky významné hyponatremie u starších pacientů, u kterých může být vyšší riziko této nežádoucí reakce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Renální A jaterní poškození
U pacientů s poruchou funkce ledvin a jater se vyskytují zvýšené plazmatické koncentrace paroxetinu. Počáteční dávka přípravku PAXIL by měla být snížena u pacientů s těžkou poruchou funkce ledvin a u pacientů s těžkou poruchou funkce jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Lidská zkušenost
Od zavedení přípravku PAXIL 30 mg ve Spojených státech byly celosvětově hlášeny spontánní případy úmyslného nebo náhodného předávkování během léčby paroxetinem. Patří sem předávkování samotným paroxetinem a v kombinaci s jinými látkami. Existují zprávy o smrtelných případech, které se zřejmě týkaly samotného paroxetinu.
Běžně hlášené nežádoucí účinky spojené s předávkováním paroxetinem zahrnují ospalost, kóma, nauzeu, třes, tachykardii, zmatenost, zvracení a závratě. Mezi další významné známky a příznaky pozorované při předávkování paroxetinem (samotným nebo s jinými látkami) patří mydriáza, křeče (včetně status epilepticus), ventrikulární dysrytmie (včetně torsade de pointes), hypertenze, agresivní reakce, synkopa, hypotenze, stupor, bradykardie, dystonie rhabdomyolýza, příznaky jaterní dysfunkce (včetně jaterního selhání, jaterní nekrózy, žloutenky, hepatitidy a jaterní steatózy), serotoninový syndrom, manické reakce, myoklonus, akutní renální selhání a retence moči.
Řízení předávkování
Nejsou známa žádná specifická antidota pro PAXIL. Pokud dojde k předávkování, zavolejte do toxikologického centra na číslo 1-800-222-1222, kde získáte nejnovější doporučení.
KONTRAINDIKACE
PAXIL je kontraindikován u pacientů:
- Užívání nebo do 14 dnů po ukončení léčby IMAO (včetně IMAO linezolidu a intravenózní methylenové modři) kvůli zvýšenému riziku serotoninového syndromu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- Užívání thioridazinu kvůli riziku prodloužení QT intervalu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ]
- Užívání pimozidu kvůli riziku prodloužení QT intervalu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- Se známou přecitlivělostí (např. anafylaxe, angioedém, Stevens-Johnsonův syndrom) na paroxetin nebo kteroukoli z neaktivních složek přípravku PAXIL [viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku PAXILu při léčbě MDD, SAD, OCD\, PD, GAD a PTSD není znám, ale předpokládá se, že souvisí s potenciací serotonergní aktivity v centrálním nervovém systému v důsledku inhibice zpětného vychytávání serotoninu neurony. (5-hydroxy-tryptamin, 5-HT).
Farmakodynamika
Studie s klinicky relevantními dávkami u lidí prokázaly, že paroxetin blokuje vychytávání serotoninu lidskými krevními destičkami. Studie in vitro na zvířatech také naznačují, že paroxetin je účinný a vysoce selektivní inhibitor zpětného vychytávání neuronového serotoninu (SSRI) a má jen velmi slabé účinky na zpětné vychytávání norepinefrinu a dopaminu neurony.
Farmakokinetika
Nelinearita farmakokinetiky je pozorována se zvyšujícími se dávkami přípravku PAXIL.
V metaanalýze paroxetinu ze 4 studií provedených na zdravých dobrovolnících po opakovaném podávání dávek 20 mg/den až 40 mg/den muži nevykazovali významně nižší Cmax nebo AUC než ženy.
Vstřebávání
Paroxetin-hydrochlorid je po perorálním podání roztoku hydrochloridové soli zcela absorbován. Ve studii, ve které normální mužští jedinci (n = 15) dostávali 30 mg tablety denně po dobu 30 dnů, bylo ustálených koncentrací paroxetinu u většiny subjektů dosaženo přibližně po 10 dnech, i když to může u příležitostných pacientů trvat podstatně déle. V ustáleném stavu byly průměrné hodnoty Cmax, Tmax, Cmin a T½ 61,7 ng/ml (CV 45 %), 5,2 hodiny. (CV 10 %), 30,7 ng/ml (CV 67 %), respektive 21,0 hodin (CV 32 %). Hodnoty Cmax a Cmin v ustáleném stavu byly asi 6krát a 14krát větší, než by bylo možné předpovědět ze studií s jednorázovou dávkou. Expozice léku v ustáleném stavu na základě AUC0-24 byla asi 8krát vyšší, než by se dalo předpokládat z údajů o jednorázové dávce u těchto subjektů. Nadměrná akumulace je důsledkem skutečnosti, že 1 z enzymů, které metabolizují paroxetin, je snadno saturovatelný.
Paroxetin je stejně biologicky dostupný z perorální suspenze a tablety.
Účinek jídla
Účinky potravy na biologickou dostupnost paroxetinu byly studovány u subjektů, kterým byla podána jedna dávka s jídlem a bez jídla. AUC byla jen mírně zvýšena (6 %), když byl lék podáván s jídlem, ale Cmax byla o 29 % vyšší, zatímco doba k dosažení maximální plazmatické koncentrace se snížila z 6,4 hodin po podání na 4,9 hodin.
Rozdělení
Paroxetin se distribuuje do celého těla, včetně CNS, přičemž pouze 1 % zůstává v plazmě.
Přibližně 95 % a 93 % paroxetinu se váže na plazmatické bílkoviny v koncentraci 100 ng/ml a 400 ng/ml. Za klinických podmínek by koncentrace paroxetinu normálně byly nižší než 400 ng/ml. Paroxetin nemění in vitro vazbu fenytoinu nebo warfarinu na proteiny.
Odstranění
Metabolismus
Průměrný eliminační poločas je přibližně 21 hodin (CV 32 %) po perorálním podávání 30 mg tablet denně po dobu 30 dnů PAXILu.
Ve studiích proporcionality dávky v ustáleném stavu zahrnujících starší a starší pacienty, při dávkách 20 mg až 40 mg denně pro starší osoby a 20 mg až 50 mg denně pro starší osoby, byla u obou populací pozorována určitá nelinearita, která opět odráží saturovatelnou metabolickou dráhu . Ve srovnání s hodnotami Cmin po 20 mg denně byly hodnoty po 40 mg denně jen asi 2 až 3krát vyšší než dvojnásobné.
Paroxetin je po perorálním podání značně metabolizován. Hlavními metabolity jsou polární a konjugované produkty oxidace a methylace, které se snadno odstraňují. Převládají konjugáty s kyselinou glukuronovou a sulfátem a byly izolovány a identifikovány hlavní metabolity. Údaje naznačují, že metabolity nemají více než 1/50 účinnosti původní sloučeniny při inhibici vychytávání serotoninu. Metabolismus paroxetinu je částečně zajišťován CYP2D6. Zdá se, že saturace tohoto enzymu v klinických dávkách odpovídá za nelinearitu kinetiky paroxetinu se zvyšující se dávkou a prodlužující se dobou léčby. Role tohoto enzymu v metabolismu paroxetinu také naznačuje potenciální lékové interakce [viz DROGOVÉ INTERAKCE ]. Farmakokinetické chování paroxetinu nebylo hodnoceno u subjektů s nedostatkem CYP2D6 (pomalí metabolizátoři).
Vylučování
Přibližně 64 % dávky 30mg perorálního roztoku paroxetinu bylo vyloučeno močí, z toho 2 % jako mateřská látka a 62 % jako metabolity během 10 dnů po podání dávky. Asi 36 % bylo vyloučeno stolicí (pravděpodobně žlučí), většinou jako metabolity a méně než 1 % jako mateřská látka během 10 dnů po podání dávky.
Studie lékových interakcí
Existují klinicky významné, známé lékové interakce mezi paroxetinem a jinými léky [viz DROGOVÉ INTERAKCE ].
Obrázek 1. Vliv paroxetinu na farmakokinetiku současně podávaných léků (logo stupnice)
Obrázek 2. Vliv společně podávaných léčiv na farmakokinetiku paroxetinu
Theofylin
Byly hlášeny zprávy o zvýšených hladinách theofylinu spojených s léčbou přípravkem PAXIL. I když tato interakce nebyla formálně studována, doporučuje se při současném podávání těchto léků sledovat hladiny teofylinu.
Léky metabolizované cytochromem CYP3A4
Studie interakcí in vivo zahrnující společné podávání paroxetinu a terfenadinu, substrátu pro CYP3A4, za podmínek ustáleného stavu, neodhalila žádný účinek paroxetinu na farmakokinetiku terfenadinu. Kromě toho studie in vitro ukázaly, že ketokonazol, silný inhibitor aktivity CYP3A4, je nejméně 100krát účinnější než paroxetin jako inhibitor metabolismu několika substrátů pro tento enzym, včetně terfenadinu, astemizolu, cisapridu, triazolamu a cyklosporin. Neočekává se, že by míra inhibice aktivity CYP3A4 paroxetinem měla klinický význam.
Specifické populace
Vliv specifických populací na farmakokinetiku paroxetinu ukazuje obrázek 3.
Doporučená počáteční dávka a maximální dávka přípravku PAXIL je snížena u starších pacientů, pacientů s těžkou poruchou funkce ledvin a pacientů s těžkou poruchou funkce jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Obrázek 3. Vliv specifické populace na farmakokinetiku paroxetinu (logo stupnice)
Klinické studie
Velká depresivní porucha
Účinnost přípravku PAXIL jako léčby velké depresivní poruchy (MDD) byla stanovena v 6 placebem kontrolovaných studiích u pacientů s MDD (ve věku 18 až 73). V těchto studiích bylo prokázáno, že PAXIL je statisticky významně účinnější než placebo v léčbě MDD pomocí alespoň 2 z následujících měření: Hamiltonova škála pro hodnocení deprese (HDRS), položka Hamiltonova depresivní nálada a klinický globální dojem (CGI)- Závažnost onemocnění. PAXIL byl statisticky významně lepší než placebo ve zlepšení skóre subfaktoru HDRS, včetně položky depresivní nálady, faktoru poruch spánku a faktoru úzkosti.
Dlouhodobá účinnost přípravku PAXIL 10 mg pro léčbu MDD u ambulantních pacientů byla prokázána v randomizované studii s vysazením. Pacienti, kteří reagovali na PAXIL (celkové skóre HDRS
Obsedantně kompulzivní porucha
Účinnost přípravku PAXIL v léčbě obsedantně kompulzivní poruchy (OCD) byla prokázána ve dvou 12týdenních multicentrických placebem kontrolovaných studiích dospělých ambulantních pacientů (studie 1 a 2). Pacienti měli středně těžkou až těžkou OCD (DSM-IIIR) s průměrným výchozím hodnocením na celkovém skóre Yale Brown Obsessive Compulsive Scale (YBOCS) v rozmezí od 23 do 26. Ve studii 1, studii zaměřené na zjištění rozmezí dávek, pacienti dostávali fixní denní dávky PAXIL 20 mg, 40 mg nebo 60 mg. Studie 1 prokázala, že denní dávky PAXILu 40 mg a 60 mg jsou účinné při léčbě OCD. U pacientů, kteří dostávali dávky PAXILu 40 mg a 60 mg, došlo k průměrnému snížení o přibližně 6 a 7 bodů v celkovém skóre YBOCS, které bylo statisticky významně vyšší než přibližně 4bodové snížení při 20 mg a 3bodové snížení pacientů léčených placebem. Studie 2 byla studie s flexibilním dávkováním porovnávající PAXIL 20 mg až 60 mg denně s klomipraminem 25 mg až 250 mg denně nebo placebem). V této studii pacienti užívající PAXIL zaznamenali průměrné snížení o přibližně 7 bodů celkového skóre YBOCS, což bylo statisticky významně vyšší než průměrné snížení přibližně o 4 body u pacientů léčených placebem.
Následující tabulka uvádí klasifikaci výsledků podle léčebných skupin na položkách globálního zlepšení na stupnici klinického globálního dojmu (CGI) pro studii 1.
Analýzy podskupin nenaznačily, že by existovaly nějaké rozdíly ve výsledcích léčby jako funkce věku nebo pohlaví.
Dlouhodobá účinnost PAXILu pro léčbu OCD byla stanovena v dlouhodobém rozšíření studie 1. Pacienti, kteří reagovali na PAXIL během 3měsíční dvojitě zaslepené fáze a 6měsíčního prodloužení na otevřeném PAXIL 20 mg až 60 mg denně byli randomizováni buď k PAXILu 10 mg nebo placebu v 6měsíční dvojitě zaslepené fázi prevence relapsu. U pacientů randomizovaných k léčbě PAXILem byla statisticky významně nižší pravděpodobnost relapsu než u pacientů léčených placebem.
Panická porucha
Účinnost přípravku PAXIL 20 mg v léčbě panické poruchy (PD) byla prokázána ve třech 10- až 12týdenních multicentrických, placebem kontrolovaných studiích dospělých ambulantních pacientů (studie 1, 2 a 3). Pacienti měli PD (DSM-IIIR), s agorafobií nebo bez ní. V těchto studiích bylo prokázáno, že PAXIL je statisticky významně účinnější než placebo v léčbě PD alespoň ve 2 ze 3 měření frekvence záchvatů paniky a na skóre klinického globálního dojmu závažnosti onemocnění.
Studie 1 byla 10týdenní studie pro zjištění rozmezí dávek; pacienti dostávali fixní dávky PAXILu 10 mg, 20 mg nebo 40 mg denně nebo placebo. Statisticky významný rozdíl od placeba byl pozorován pouze u skupiny užívající PAXIL 40 mg denně. V koncovém bodě bylo 76 % pacientů užívajících PAXIL 40 mg denně bez záchvatů paniky, ve srovnání se 44 % pacientů léčených placebem.
Studie 2 byla 12týdenní studie s flexibilním dávkováním porovnávající PAXIL 10 mg až 60 mg denně a placebo. V koncovém bodě bylo 51 % pacientů léčených PAXILem bez záchvatů paniky ve srovnání s 32 % pacientů léčených placebem.
Studie 3 byla 12týdenní studie s flexibilním dávkováním porovnávající PAXIL 10 mg až 60 mg denně s placebem u pacientů, kteří současně dostávali standardizovanou kognitivně behaviorální terapii. Na konci vykázalo 33 % pacientů léčených PAXILem snížení na 0 nebo 1 záchvaty paniky ve srovnání se 14 % pacientů léčených placebem.
Ve studiích 2 a 3 byla průměrná dávka přípravku PAXIL pro pacienty, kteří dokončili léčbu, na konci studie přibližně 40 mg denně.
Dlouhodobá účinnost přípravku PAXIL 10 mg u PD byla prokázána v rozšíření studie 1. Pacienti, kteří reagovali na PAXIL 20 mg během 10týdenní dvojitě zaslepené fáze a během 3měsíční dvojitě zaslepené prodloužené fáze, byli randomizováni buď do skupiny PAXIL 10 mg, 20 mg nebo 40 mg denně nebo placebo ve 3měsíční dvojitě zaslepené fázi prevence relapsu. U pacientů randomizovaných na PAXIL 20 mg byla statisticky významně nižší pravděpodobnost relapsu než u pacientů léčených placebem.
Analýzy podskupin nenaznačily, že by existovaly nějaké rozdíly ve výsledcích léčby jako funkce věku nebo pohlaví.
Sociální úzkostná porucha
Účinnost přípravku PAXIL v léčbě sociální úzkostné poruchy (SAD) byla prokázána ve třech 12týdenních, multicentrických, placebem kontrolovaných studiích (Studie 1, 2 a 3) u dospělých ambulantních pacientů se SAD (DSM-IV). V těchto studiích byla účinnost přípravku PAXIL 30 mg ve srovnání s placebem hodnocena na základě (1) podílu respondentů, jak je definováno skóre zlepšení klinického globálního dojmu (CGI) 1 (velmi výrazně lepší) nebo 2 (velmi lepší ) a (2) změna od výchozí hodnoty v Liebowitzově škále sociální úzkosti (LSAS).
Studie 1 a 2 byly studie s flexibilním dávkováním porovnávající PAXIL 20 mg až 50 mg denně a placebo. PAXIL prokázal statisticky významnou převahu nad placebem jak na kritériu zlepšení CGI, tak na Liebowitzově stupnici sociální úzkosti (LSAS). Ve studii 1 u pacientů, kteří dokončili do 12. týdne, 69 % pacientů léčených PAXILem ve srovnání s 29 % pacientů léčených placebem reagovalo na zlepšení CGI. Ve studii 2 bylo u pacientů léčených PAXILem 77 % a 42 % pacientů léčených placebem zlepšení CGI.
Studie 3 byla 12týdenní studie porovnávající fixní dávky přípravku PAXIL 20 mg, 40 mg nebo 60 mg denně s placebem. PAXIL 20 mg byl statisticky významně lepší než placebo jak v LSAS Total Score, tak v kritériu CGI zlepšení; u skupin s denní dávkou 40 mg a 60 mg PAXILu byly tendence k převaze nad placebem. V této studii nebyly žádné známky dalšího přínosu pro dávky vyšší než 20 mg denně.
Analýzy podskupin obecně neukázaly rozdíly ve výsledcích léčby jako funkce věku, rasy nebo pohlaví.
Generalizovaná úzkostná porucha
Účinnost přípravku PAXIL v léčbě generalizované úzkostné poruchy (GAD) byla prokázána ve dvou 8týdenních, multicentrických, placebem kontrolovaných studiích (studie 1 a 2) u dospělých ambulantních pacientů s GAD (DSM-IV).
Studie 1 byla 8týdenní studie porovnávající fixní dávky přípravku PAXIL 20 mg nebo 40 mg denně s placebem. Dávky PAXILu 20 mg nebo 40 mg byly obě prokázány jako statisticky významně lepší než placebo na celkovém skóre Hamilton Rating Scale for Anxiety (HAM-A).
V této studii nebyly dostatečné důkazy, které by naznačovaly větší přínos pro denní dávku 40 mg přípravku PAXIL ve srovnání s denní dávkou 20 mg.
Studie 2 byla studie s flexibilním dávkováním porovnávající PAXIL 20 mg až 50 mg denně a placebo. PAXIL prokázal statisticky významnou převahu nad placebem na celkovém skóre Hamilton Rating Scale for Anxiety (HAM-A).
Třetí studie, studie s flexibilním dávkováním porovnávající PAXIL 20 mg až 50 mg denně s placebem, neprokázala statisticky významnou převahu PAXILu nad placebem na celkovém skóre Hamilton Rating Scale for Anxiety (HAM-A), což je primární výsledek.
Analýzy podskupin neukázaly rozdíly ve výsledcích léčby jako funkci rasy nebo pohlaví. Nebyl dostatek starších pacientů k provedení analýz podskupin na základě věku.
dlouhodobé studii bylo 566 pacientů splňujících kritéria DSM-IV pro GAD, kteří reagovali během jednorázově zaslepené, 8týdenní akutní fáze léčby přípravkem PAXIL 20 mg až 50 mg denně, randomizováno k pokračování v léčbě přípravkem PAXIL 30 mg při stejné dávce nebo placebu po dobu až 24 týdnů sledování relapsu. Odpověď během jednoduše zaslepené fáze byla definována snížením o ≥ 2 body ve srovnání s výchozí hodnotou na škále CGI-závažnost onemocnění na skóre ≤3. Relaps během dvojitě zaslepené fáze byl definován jako zvýšení o ≥ 2 body ve srovnání s výchozí hodnotou na stupnici CGI-závažnost onemocnění na skóre ≥4 nebo vysazení z důvodu nedostatečné účinnosti. U pacientů, kteří pokračovali v léčbě přípravkem PAXIL 40 mg, došlo během následujících 24 týdnů ke statisticky významně nižší míře relapsů ve srovnání s těmi, kteří dostávali placebo.
Posttraumatická stresová porucha
Účinnost přípravku PAXIL 20 mg v léčbě posttraumatické stresové poruchy (PTSD) byla prokázána ve dvou 12týdenních, multicentrických, placebem kontrolovaných studiích (studie 1 a 2) dospělých ambulantních pacientů, kteří splnili kritéria DSM-IV pro PTSD. Průměrná doba trvání příznaků PTSD ve 2 studiích byla dohromady 13 let (v rozmezí od 0,1 roku do 57 let). Procento pacientů se sekundární MDD nebo non-PTSD úzkostnými poruchami v kombinovaných 2 studiích bylo 41 % (356 z 858 pacientů) a 40 % (345 z 858 pacientů). Výsledek studie byl hodnocen pomocí (1) skóre CAPS-2 (CAPS-2) škály PTSD prováděné lékařem a (2) škály klinického globálního dojmu a globálního zlepšení (CGI-I). CAPS-2 je vícepoložkový přístroj, který měří 3 aspekty PTSD s následujícími symptomy: opětovné prožívání/intruze, vyhýbání se/znecitlivění a hyperarousal. 2 primární výsledky pro každou studii byly (1) změna od výchozího k cílovému bodu v celkovém skóre CAPS-2 (17 položek) a (2) podíl respondentů na CGI-I, kde respondenti byli definováni jako pacienti se skóre 1 (velmi se zlepšilo) nebo 2 (velmi zlepšilo).
Studie 1 byla 12týdenní studie porovnávající fixní dávky přípravku PAXIL 20 mg nebo 40 mg denně s placebem. Bylo prokázáno, že dávky PAXIL 20 mg a 40 mg jsou statisticky významně lepší než placebo, pokud jde o změnu od výchozí hodnoty pro celkové skóre CAPS-2 ao podíl respondentů na CGI-I. V této studii nebyly dostatečné důkazy, které by naznačovaly větší přínos pro denní dávku 40 mg ve srovnání s denní dávkou 20 mg.
Studie 2 byla 12týdenní studie s flexibilním dávkováním porovnávající PAXIL 20 mg až 50 mg denně s placebem. Bylo prokázáno, že PAXIL 40 mg je významně lepší než placebo, pokud jde o změnu od výchozí hodnoty pro celkové skóre CAPS-2 a pro podíl respondentů na CGI-I.
Třetí studie, studie s flexibilním dávkováním porovnávající PAXIL 20 mg až 50 mg denně s placebem, prokázala, že PAXIL 20 mg je statisticky významně lepší než placebo, pokud jde o změnu od výchozí hodnoty pro celkové skóre CAPS-2, ale nikoli o podíl respondentů na CGI -Já
Většina pacientů v těchto studiích byly ženy (68 % žen: 377 z 551 subjektů ve studii 1 a 66 % žen: 202 z 303 subjektů ve studii 2). Analýzy podskupin neukázaly rozdíly ve výsledcích léčby v závislosti na pohlaví. Nebyl dostatečný počet pacientů, kteří byli starší 65 let nebo nebyli bílé rasy, aby bylo možné provést analýzy podskupin na základě věku nebo rasy.
INFORMACE PRO PACIENTA
PAXIL® (PAX-il) (paroxetin) tablety a perorální suspenze
Jaké jsou nejdůležitější informace, které bych měl o PAXIL vědět?
PAXIL může způsobit závažné nežádoucí účinky, včetně:
- Zvýšené riziko sebevražedných myšlenek nebo činů. PAXIL 10 mg a další antidepresiva mohou zvýšit sebevražedné myšlenky a činy u některých lidí ve věku 24 let a mladších, zejména v prvních několik měsíců léčby nebo při změně dávky. PAXIL není určen k použití u dětí.
- Deprese nebo jiná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek a činů.
Jak mohu sledovat a pokusit se zabránit sebevražedným myšlenkám a činům?
- Věnujte zvýšenou pozornost jakýmkoli změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů, nebo pokud se u vás objeví sebevražedné myšlenky nebo činy. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávkování.
- Okamžitě zavolejte svému poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů nebo pokud se u vás objeví sebevražedné myšlenky nebo činy.
- Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče podle plánu. Zavolejte svého poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc, pokud máte některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- pokusy o sebevraždu
- chovat se agresivně nebo násilně
- nová nebo horší deprese
- pocit vzrušení, neklidu, vzteku nebo podrážděnosti
- zvýšení aktivity a mluvení více, než je pro vás normální
- působící na nebezpečné impulsy
- myšlenky na sebevraždu nebo smrt
- nové nebo horší záchvaty úzkosti nebo paniky
- problémové spaní
- jiné neobvyklé změny v chování nebo náladě
Co je PAXIL?
PAXIL 30 mg je lék na předpis používaný u dospělých k léčbě:
- Určitý typ deprese nazývaný hlavní depresivní porucha (MDD)
- Obsedantně kompulzivní porucha (OCD)
- panická porucha (PD)
- Sociální úzkostná porucha (SAD)
- Generalizovaná úzkostná porucha (GAD)
- Posttraumatická stresová porucha (PTSD)
Neužívejte PAXIL, pokud:
- užívat inhibitor monoaminooxidázy (MAOI)
- přestali užívat některý IMAO v posledních 14 dnech
- jste léčeni antibiotikem linezolidem nebo intravenózní methylenovou modří
- berou pimozid
- berou thioridazin
- jste alergický(á) na paroxetin nebo na kteroukoli složku přípravku PAXIL. Úplný seznam složek přípravku PAXIL naleznete na konci tohoto Průvodce léčivy.
Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO nebo některý z těchto léků, včetně antibiotika linezolidu nebo intravenózní methylenové modři.
Nezačínejte užívat některý IMAO alespoň 14 dní po ukončení léčby přípravkem PAXIL.
Před užitím přípravku PAXIL informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- mít problémy se srdcem
- máte nebo jste měli problémy s krvácením
- máte nebo máte v rodinné anamnéze bipolární poruchu, mánii nebo hypománii
- máte nebo jste měli záchvaty nebo křeče
- máte glaukom (vysoký tlak v oku)
- máte nízké hladiny sodíku v krvi
- mít problémy s kostmi
- máte problémy s ledvinami nebo játry
- jste těhotná nebo plánujete otěhotnět. PAXIL 40 mg může poškodit vaše nenarozené dítě. Poraďte se se svým poskytovatelem zdravotní péče o rizicích pro vaše nenarozené dítě, pokud užíváte PAXIL během těhotenství. Okamžitě informujte svého poskytovatele zdravotní péče, pokud během léčby přípravkem PAXIL otěhotníte nebo si myslíte, že jste těhotná.
- kojíte nebo plánujete kojit. PAXIL přechází do mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během léčby přípravkem PAXIL.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
PAXIL a některé další léky se mohou vzájemně ovlivňovat a způsobit tak možné závažné nežádoucí účinky. PAXIL 30 mg může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku PAXIL.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- léky používané k léčbě migrénových bolestí hlavy nazývané triptany
- tricyklická antidepresiva
- fentanyl
- lithium
- tramadol
- tryptofan
- buspiron
- amfetaminy
- Třezalka tečkovaná
- léky, které mohou ovlivnit srážlivost krve, jako je aspirin, nesteroidní protizánětlivé léky (NSAID), warfarin
- diuretika
- tamoxifen
- léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně selektivního zpětného vychytávání serontoninu (SSRI) a inhibitorů zpětného vychytávání serotoninu a norepinefrinu (SNRI)
Pokud si nejste jisti, zda některý z těchto léků užíváte, zeptejte se svého poskytovatele zdravotní péče. Váš poskytovatel zdravotní péče vám může říci, zda je bezpečné užívat PAXIL 10 mg s jinými léky.
Nezačínejte ani nevysazujte žádné jiné léky během léčby přípravkem PAXIL, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče. Náhlé ukončení užívání přípravku PAXIL může způsobit vážné nežádoucí účinky. Vidět, Jaké jsou možné vedlejší účinky přípravku PAXIL 20 mg?
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat PAXIL?
- Užívejte PAXIL přesně podle předpisu. Váš poskytovatel zdravotní péče možná bude muset změnit dávku přípravku PAXIL 30 mg, dokud pro vás nebude správná dávka.
- Užívejte PAXIL 1krát denně ráno.
- PAXIL 30 mg lze užívat s jídlem nebo bez jídla.
- Pokud užíváte perorální suspenzi PAXIL, před užitím suspenzi dobře protřepejte.
- Pokud užijete příliš mnoho přípravku PAXIL, zavolejte do toxikologického centra na číslo 1-800-222-1222 nebo jděte ihned na pohotovost v nejbližší nemocnici.
Jaké jsou možné vedlejší účinky přípravku PAXIL 10 mg?
PAXIL 40 mg může způsobit závažné nežádoucí účinky, včetně:
- Vidět, "Jaké jsou nejdůležitější informace, které bych měl vědět o PAXIL?"
- serotoninový syndrom. Potenciálně život ohrožující problém nazývaný serotoninový syndrom se může objevit, pokud užíváte PAXIL 20 mg s některými dalšími léky. Podívejte se, "Kdo by neměl užívat PAXIL?" Zavolejte svému poskytovateli zdravotní péče nebo jděte na pohotovost v nejbližší nemocnici jestliže máte některý z následujících známek a příznaků serotoninového syndromu:
- míchání
- vidět nebo slyšet věci, které nejsou skutečné (halucinace)
- zmatek
- kóma
- rychlý tep srdce
- změny krevního tlaku
- závrať
- pocení
- proplachování
- vysoká tělesná teplota (hypertermie)
- třes (třes), ztuhlé svaly nebo svalové záškuby
- ztráta koordinace
- záchvaty
- nevolnost, zvracení, průjem
- Oční problémy (glaukom s uzavřeným úhlem). PAXIL 10 mg může způsobit typ očního problému nazývaného glaukom s uzavřeným úhlem u lidí s určitými dalšími očními onemocněními. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano. Zavolejte svého poskytovatele zdravotní péče, pokud máte bolest oka, změny ve vašem vidění nebo otok nebo zarudnutí v oku nebo kolem něj.
- Lékové interakce. Užívání přípravku PAXIL 20 mg s některými dalšími léky včetně thioridazinu a pimozidu může zvýšit riziko rozvoje závažného srdečního problému zvaného prodloužení QT intervalu.
- Záchvaty (křeče).
- Manické epizody. U lidí s bipolární poruchou, kteří užívají PAXIL, se mohou objevit manické epizody. Příznaky mohou zahrnovat:
- výrazně zvýšená energie
- závodní myšlenky
- neobvykle velkolepé nápady
- mluvit více nebo rychleji než obvykle
- vážné problémy se spánkem
- bezohledné chování
- nadměrné štěstí nebo podrážděnost
- Syndrom vysazení. Náhlé vysazení přípravku PAXIL 20 mg může způsobit vážné nežádoucí účinky. Váš poskytovatel zdravotní péče může chtít snižovat dávku pomalu. Příznaky mohou zahrnovat:
- nevolnost
- pocení
- změny vaší nálady
- podrážděnost a neklid
- závrať
- pocit elektrického šoku (parestézie)
- třes
- úzkost
- zmatek
- bolest hlavy
- únava
- problémy se spánkem
- hypománie
- zvonění v uších (tinnitus)
- záchvaty
- Nízké hladiny sodíku v krvi (hyponatremie). Během léčby přípravkem PAXIL se mohou objevit nízké hladiny sodíku v krvi, které mohou být závažné a mohou způsobit smrt. Starší lidé a lidé, kteří užívají určité léky, mohou být vystaveni většímu riziku vzniku nízkých hladin sodíku v krvi. Příznaky a příznaky mohou zahrnovat:
- bolest hlavy
- potíže se soustředěním
- změny paměti
- zmatek
- slabost a neklid na nohou, což může vést k pádům
závažnějších nebo více náhlých případech příznaky a příznaky zahrnují:
- vidět nebo slyšet věci, které nejsou skutečné (halucinace)
- mdloba
- záchvaty
- kóma
- zástava dechu (zástava dechu)
- Abnormální krvácení. Užívání přípravku PAXIL s aspirinem, NSAID nebo léky na ředění krve může toto riziko zvýšit. Informujte svého poskytovatele zdravotní péče o jakémkoli neobvyklém krvácení nebo modřinách.
- Zlomeniny kostí.
Mezi nejčastější nežádoucí účinky přípravku PAXIL 10 mg patří:
- problémy mužské a ženské sexuální funkce
- zácpa
- průjem
- suchá ústa
- problémy se spánkem
- nervozita
- pocení
- zívání
- slabost (astenie)
- snížená chuť k jídlu
- závrať
- infekce
- nevolnost
- ospalost
- třes (třes)
To nejsou všechny možné vedlejší účinky přípravku PAXIL.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat PAXIL?
- Tablety PAXIL skladujte při teplotě od 59 °F do 86 °F (15 °C až 30 °C).
- Uchovávejte PAXIL 10 mg perorální suspenzi při teplotě 25 °C nebo nižší.
Uchovávejte PAXIL a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku PAXIL.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte PAXIL pro stav, pro který nebyl předepsán. Nedávejte PAXIL jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku PAXIL, který je určen pro zdravotnické pracovníky.
Jaké jsou složky přípravku PAXIL 30 mg?
Aktivní složka: paroxetin hydrochlorid
Neaktivní složky:
dihydrát hydrogenfosforečnanu vápenatého, hypromelóza, stearát hořečnatý, polyethylenglykoly, polysorbát 80, sodná sůl glykolátu škrobu, oxid titaničitý a 1 nebo více z následujících látek: hliníkový lak D&C Red No. 30, hliníkový lak D&C Yellow No. 10, FD&C Blue No 2 hliníkový lak, FD&C Yellow č. 6 hliníkový lak
Perorální suspenze: kyselina citronová (bezvodá), FD&C žlutá č. 6, příchutě, glycerin, methylparaben, mikrokrystalická celulóza a sodná sůl karboxymethylcelulózy, polakrilin draselný, propylenglykol, propylparaben, čištěná voda, sodná sůl sacharinu, emulze simethikonu a citrát sodný (dihydrát)
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
