Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Cymbalta a jak se používá?
Cymbalta je lék na předpis používaný k léčbě příznaků velké depresivní poruchy, diabetické periferní neuropatické bolesti, generalizované úzkostné poruchy, fibromyalgie a chronické bolesti svalů. Cymbalta lze užívat samostatně nebo s jinými léky.
- Cymbalta patří do třídy léků nazývaných antidepresiva, SNRI, fibromyalgie.
- Není známo, zda je přípravek Cymbalta bezpečný a účinný u dětí mladších 7 let.
Jaké jsou možné vedlejší účinky přípravku Cymbalta 20 mg?
Cymbalta může způsobit závažné nežádoucí účinky, včetně:
- bušení srdce nebo chvění v hrudi,
- točení hlavy,
- snadná tvorba modřin,
- neobvyklé krvácení,
- změny vidění,
- bolestivé nebo obtížné močení,
- impotence,
- sexuální problémy,
- pravostranná bolest v horní části žaludku,
- svědění,
- tmavá moč,
- zežloutnutí kůže nebo očí (žloutenka),
- bolest hlavy,
- zmatek,
- nezřetelná řeč,
- těžká slabost,
- zvracení,
- ztráta koordinace,
- pocit nejistoty,
- závodní myšlenky,
- zvýšená energie,
- bezohledné chování,
- cítit se extrémně šťastný nebo podrážděný,
- mluví více než obvykle a
- vážné problémy se spánkem
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Cymbalta patří:
- ospalost,
- nevolnost,
- zácpa,
- ztráta chuti k jídlu,
- sucho v ústech a
- zvýšené pocení
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Cymbalta. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
SEBEvražedné myšlenky a chování
Antidepresiva v krátkodobých studiích zvyšovala riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých. Tyto studie neprokázaly zvýšení rizika sebevražedných myšlenek a chování při užívání antidepresiv u pacientů starších 24 let; došlo ke snížení rizika při užívání antidepresiv u pacientů ve věku 65 let a starších [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
U pacientů všech věkových kategorií, u kterých byla zahájena léčba antidepresivy, pečlivě sledujte, zda nedochází ke zhoršení a k výskytu sebevražedných myšlenek a chování. Informujte rodiny a pečovatele o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
POPIS
CYMBALTA® (duloxetin tobolky s opožděným uvolňováním) je selektivní inhibitor zpětného vychytávání serotoninu a norepinefrinu (SSNRI) pro perorální podání. Jeho chemické označení je (+)-(S)-N-methyl-y-(1-naftyloxy)-2-thiofenpropylamin hydrochlorid. Empirický vzorec je C18H19NOS•HCl, což odpovídá molekulové hmotnosti 333,88. Strukturní vzorec je:
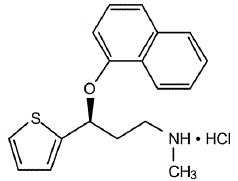
Duloxetin-hydrochlorid je bílá až slabě nahnědlá bílá pevná látka, která je mírně rozpustná ve vodě.
Každá tobolka obsahuje enterosolventní pelety 22,4, 33,7 nebo 67,3 mg duloxetin-hydrochloridu, což odpovídá 20, 30 nebo 60 mg duloxetinu. Tyto enterosolventně potažené pelety jsou navrženy tak, aby zabránily degradaci léčiva v kyselém prostředí žaludku. Mezi neaktivní složky patří FD&C Blue č. 2, želatina, hypromelóza, acetát sukcinát hydroxypropylmethylcelulózy, laurylsulfát sodný, sacharóza, kuličky cukru, mastek, oxid titaničitý a triethylcitrát. 20 a 60 mg tobolky obsahují také žlutý oxid železitý.
INDIKACE
CYMBALTA® je indikována k léčbě:
- Velká depresivní porucha u dospělých
- Generalizovaná úzkostná porucha u dospělých a dětských pacientů ve věku 7 let a starších
- Diabetická periferní neuropatická bolest u dospělých
- Fibromyalgie u dospělých a dětských pacientů ve věku 13 let a starších
- chronická muskuloskeletální bolest u dospělých
DÁVKOVÁNÍ A PODÁVÁNÍ
Důležité pokyny pro administraci
Podávejte přípravek CYMBALTA perorálně (s jídlem nebo bez jídla) a polykejte celý. Nežvýkejte ani nedrťte a neotevírejte tobolku s opožděným uvolňováním a nesypte její obsah na jídlo nebo nemíchejte s tekutinami, protože tyto akce by mohly ovlivnit enterosolventní povlak. Pokud vynecháte dávku přípravku CYMBALTA 20 mg, vezměte si vynechanou dávku, jakmile si na to vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku CYMBALTA 60 mg ve stejnou dobu.
Dávkování pro léčbu velké depresivní poruchy u dospělých
Doporučená počáteční dávka u dospělých s MDD je 40 mg/den (podávaná jako 20 mg dvakrát denně) až 60 mg/den (podávaná buď jednou denně, nebo jako 30 mg dvakrát denně). U některých pacientů může být žádoucí začít s dávkou 30 mg jednou denně po dobu 1 týdne, aby se pacientům umožnilo přizpůsobit se na CYMBALTU 30 mg před zvýšením na 60 mg jednou denně. I když se ukázalo, že dávka 120 mg/den je účinná, neexistuje žádný důkaz, že by dávky vyšší než 60 mg/den přinášely nějaké další výhody. Pravidelně přehodnocujte, abyste určili potřebu udržovací léčby a vhodné dávkování pro takovou léčbu.
Dávkování pro léčbu generalizované úzkostné poruchy
Doporučené dávkování u dospělých mladších než 65 let
většiny dospělých ve věku do 65 let s GAD zahajte podáváním CYMBALTY 60 mg jednou denně. Pro některé pacienty může být žádoucí začít s dávkou 30 mg jednou denně po dobu 1 týdne, aby se pacientům umožnilo upravit dávku CYMBALTY 40 mg před zvýšením na 60 mg jednou denně. I když se ukázalo, že dávka 120 mg jednou denně je účinná, neexistuje žádný důkaz, že dávky vyšší než 60 mg/den přinášejí další přínos. Pokud se však rozhodnete zvýšit dávku nad 60 mg jednou denně, zvyšujte dávku o 30 mg jednou denně. Pravidelně přehodnocujte, abyste určili pokračující potřebu udržovací léčby a vhodné dávkování pro takovou léčbu.
Doporučené dávkování u geriatrických pacientů
geriatrických pacientů s GAD zahajte CYMBALTU v dávce 30 mg jednou denně po dobu 2 týdnů a poté zvažte zvýšení na cílovou dávku 60 mg/den. Poté mohou pacienti mít prospěch z dávek nad 60 mg jednou denně. Pokud se rozhodnete zvýšit dávku nad 60 mg jednou denně, zvyšujte dávku o 30 mg jednou denně. Maximální studovaná dávka byla 120 mg denně.
Doporučené dávkování u pediatrických pacientů ve věku 7 až 17 let
Zahajte léčbu přípravkem CYMBALTA 30 mg u pediatrických pacientů ve věku 7 až 17 let s GAD v dávce 30 mg jednou denně po dobu 2 týdnů před zvážením zvýšení na 60 mg jednou denně. Doporučené rozmezí dávkování je 30 až 60 mg jednou denně. Někteří pacienti mohou mít prospěch z dávek nad 60 mg jednou denně. Pokud se rozhodnete zvýšit dávku nad 60 mg jednou denně, zvyšujte dávku o 30 mg jednou denně. Maximální studovaná dávka byla 120 mg denně.
Dávkování pro léčbu diabetické periferní neuropatické bolesti u dospělých
Dospělým s diabetickou periferní neuropatickou bolestí podávejte 60 mg jednou denně. Neexistují žádné důkazy o tom, že by dávky vyšší než 60 mg jednou denně přinášely další významný přínos a vyšší dávka byla zjevně hůře tolerována. U pacientů, u kterých je snášenlivost problémem, lze zvážit nižší počáteční dávku.
Vzhledem k tomu, že diabetes je často komplikován onemocněním ledvin, zvažte nižší počáteční dávku a postupné zvyšování dávky u pacientů s poruchou funkce ledvin (viz Dávkování u pacientů s poruchou funkce jater nebo těžkou poruchou funkce ledvin a Použití u konkrétních populací ].
Dávkování Pro Léčba Fibromyalgie
Doporučené dávkování u dospělých
Doporučená dávka přípravku CYMBALTA je 60 mg jednou denně u dospělých s fibromyalgií. Začněte léčbu dávkou 30 mg jednou denně po dobu 1 týdne, aby se pacienti mohli přizpůsobit na 20 mg CYMBALTY, než se zvýší na 60 mg jednou denně. Někteří pacienti mohou reagovat na počáteční dávku. Neexistují žádné důkazy o tom, že dávky vyšší než 60 mg/den přinášejí další přínos, a to i u pacientů, kteří nereagují na dávku 60 mg/den, a vyšší dávky byly spojeny s vyšším výskytem nežádoucích účinků.
Doporučené dávkování u pediatrických pacientů ve věku 13 až 17 let
Doporučená počáteční dávka přípravku CYMBALTA 60 mg u pediatrických pacientů ve věku 13-17 let s fibromyalgií je 30 mg jednou denně. Dávkování může být zvýšeno na 60 mg jednou denně na základě odpovědi a snášenlivosti.
Dávkování pro léčbu chronické muskuloskeletální bolesti u dospělých
Doporučená dávka přípravku CYMBALTA je 60 mg jednou denně u dospělých s chronickou muskuloskeletální bolestí. Začněte léčbu dávkou 30 mg jednou denně po dobu jednoho týdne, aby se pacienti mohli přizpůsobit na CYMBALTU, než se zvýší na 60 mg jednou denně. Neexistují žádné důkazy o tom, že vyšší dávky poskytují další přínos, a to i u pacientů, kteří nereagují na dávku 60 mg jednou denně, a vyšší dávky jsou spojeny s vyšší mírou nežádoucích účinků (viz Klinické studie ].
Dávkování u pacientů s poruchou funkce jater nebo těžkou poruchou funkce ledvin
Vyhněte se použití u pacientů s chronickým onemocněním jater nebo cirhózou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Vyhněte se použití u pacientů s těžkou poruchou funkce ledvin, GFR VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Ukončení provozu CYMBALTA
Nežádoucí účinky po vysazení přípravku CYMBALTA, po náhlém nebo postupném vysazení, zahrnují: závratě, bolest hlavy, nevolnost, průjem, parestézie, podrážděnost, zvracení, nespavost, úzkost, hyperhidrózu a únavu. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přechod pacienta na nebo z inhibitoru monoaminooxidázy (MAOI) určeného k léčbě psychiatrických poruch
Mezi vysazením IMAO určeného k léčbě psychiatrických poruch a zahájením léčby přípravkem CYMBALTA by mělo uplynout alespoň 14 dní. Naopak, po vysazení přípravku CYMBALTA 60 mg by mělo uplynout alespoň 5 dní před zahájením IMAO určeného k léčbě psychiatrických poruch (viz KONTRAINDIKACE ].
Použití přípravku CYMBALTA s jinými MAOI, jako je linezolid nebo methylenová modř
Nezačínejte léčbu přípravkem CYMBALTA u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, protože existuje zvýšené riziko serotoninového syndromu. U pacienta, který vyžaduje naléhavější léčbu psychiatrického stavu, je třeba zvážit další intervence, včetně hospitalizace [viz KONTRAINDIKACE ].
některých případech může pacient, který již dostává léčbu přípravkem CYMBALTA, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou dostupné přijatelné alternativy k léčbě linezolidem nebo intravenózní metylenovou modří a potenciální přínosy linezolidu nebo intravenózní léčby methylenovou modří u konkrétního pacienta převažují nad riziky serotoninového syndromu, CYMBALTA by měla být okamžitě ukončena a linezolid nebo intravenózní methylenová modř lze podávat. Pacient by měl být sledován na příznaky serotoninového syndromu po dobu 5 dnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Léčba přípravkem CYMBALTA může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg u přípravku CYMBALTA není jasné. Lékař by si však měl být vědom možnosti vzniku symptomů serotoninového syndromu při takovém použití [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
JAK DODÁVÁNO
Dávkové formy A Síly
CYMBALTA je dostupná jako tobolky s opožděným uvolňováním:
- 20 mg neprůhledné zelené tobolky s potiskem „Lilly 3235 20 mg“
- 30 mg neprůhledné bílé a modré tobolky s potiskem „Lilly 3240 30 mg“
- 60 mg neprůhledné zelené a modré tobolky s potiskem „Lilly 3270 60 mg“
CYMBALTA (duloxetin tobolky s opožděným uvolňováním) je k dispozici v následujících silách, barvách, potiskech a prezentacích:
Skladování A Manipulace
Skladujte při teplotě 25 °C (77 °F); povolené odchylky do 15-30°C (59-86°F) [viz USP Controlled Room Temperature].
Prodává: Lilly USA, LLC Indianapolis, IN 46285, USA. Upraveno: červenec 2021
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Ortostatická hypotenze, pády a synkopa [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšené riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Aktivace mánie/hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšení krevního tlaku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Klinicky důležité lékové interakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Váhání a zadržování moči [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sexuální dysfunkce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Uvedené frekvence nežádoucích účinků představují podíl pacientů, u kterých se alespoň jednou vyskytl jeden nežádoucí účinek uvedený v souvislosti s léčbou. Reakce byla považována za naléhavou, pokud se objevila poprvé nebo se zhoršila během léčby po základním hodnocení.
Nežádoucí účinky u dospělých
Databáze klinických studií pro dospělé
Údaje popsané níže odrážejí expozici přípravku CYMBALTA v placebem kontrolovaných studiích dospělých pro MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), a FM (N=1294). Věkové rozmezí v této sloučené populaci bylo 17 až 89 let. V této souhrnné populaci bylo 66 %, 61 %, 61 %, 43 % a 94 % dospělých pacientů žen; a 82 %, 73 %, 85 %, 74 % a 86 % dospělých pacientů byli běloši v populacích MDD, GAD, OA a CLBP, DPNP a FM, v daném pořadí. Většina pacientů dostávala dávky CYMBALTY celkem 60 až 120 mg denně [viz Klinické studie ]. Níže uvedená data nezahrnují výsledky studie, která hodnotila účinnost přípravku CYMBALTA 30 mg pro léčbu GAD u pacientů ve věku ≥ 65 let (studie GAD-5) [viz Klinické studie ]; nicméně nežádoucí účinky pozorované u této geriatrické populace byly obecně podobné nežádoucím účinkům u celé dospělé populace.
Nežádoucí účinky vedoucí k přerušení léčby u dospělých placebem kontrolovaných studií
Velká depresivní porucha
Přibližně 8,4 % (319/3779) pacientů léčených přípravkem CYMBALTA v placebem kontrolovaných studiích pro dospělé pro MDD přerušilo léčbu kvůli nežádoucí reakci, ve srovnání se 4,6 % (117/2536) pacientů léčených placebem. Nevolnost (CYMBALTA 1,1 %, placebo 0,4 %) byla jediným nežádoucím účinkem hlášeným jako důvod pro přerušení léčby a považována za související s lékem (tj. přerušení se vyskytlo u nejméně 1 % pacientů léčených přípravkem CYMBALTA a s četností při nejméně dvakrát vyšší než u pacientů léčených placebem).
Generalizovaná úzkostná porucha
Přibližně 13,7 % (139/1018) pacientů léčených přípravkem CYMBALTA v placebem kontrolovaných studiích pro dospělé pro GAD přerušilo léčbu kvůli nežádoucí reakci, ve srovnání s 5 % (38/767) u pacientů léčených placebem. Časté nežádoucí účinky hlášené jako důvod pro přerušení léčby a považované za související s lékem (jak je definováno výše) zahrnovaly nauzeu (CYMBALTA 3,3 %, placebo 0,4 %) a závratě (CYMBALTA 1,3 %, placebo 0,4 %).
Diabetická periferní neuropatická bolest
Přibližně 12,9 % (117/906) pacientů léčených přípravkem CYMBALTA v placebem kontrolovaných studiích pro dospělé s DPNP přerušilo léčbu kvůli nežádoucí reakci, ve srovnání s 5,1 % (23/448) u pacientů léčených placebem. Časté nežádoucí účinky hlášené jako důvod pro přerušení léčby a považované za související s lékem (jak je definováno výše) zahrnovaly nauzeu (CYMBALTA 3,5 %, placebo 0,7 %), závratě (CYMBALTA 1,2 %, placebo 0,4 %) a ospalost (CYMBALTA 1,1 % , placebo 0 %).
Fibromyalgie
Přibližně 17,5 % (227/1294) pacientů léčených přípravkem CYMBALTA v 3 až 6měsíčních placebem kontrolovaných studiích pro dospělé u dospělých přerušilo léčbu kvůli nežádoucí reakci, ve srovnání s 10,1 % (96/955) u pacientů léčených placebem . Nežádoucí účinky hlášené jako důvod pro přerušení a považované za související s lékem (jak je definováno výše) zahrnovaly nauzeu (CYMBALTA 2,0 %, placebo 0,5 %), bolest hlavy (CYMBALTA 1,2 %, placebo 0,3 %), ospalost (CYMBALTA 1,1 %, placebo 0 %) a únava (CYMBALTA 1,1 %, placebo 0,1 %).
Chronická bolest způsobená osteoartrózou
Přibližně 15,7 % (79/503) pacientů léčených přípravkem CYMBALTA ve 13týdenních placebem kontrolovaných studiích u dospělých pro chronickou bolest v důsledku OA přerušilo léčbu kvůli nežádoucí reakci, ve srovnání se 7,3 % (37/508) u pacientů užívajících placebo léčených pacientů. Nežádoucí účinky hlášené jako důvod pro přerušení léčby a považované za související s lékem (jak je definováno výše) zahrnovaly nauzeu (CYMBALTA 2,2 %, placebo 1 %).
Chronická bolest dolní části zad
Přibližně 16,5 % (99/600) pacientů léčených přípravkem CYMBALTA ve 13týdenních placebem kontrolovaných studiích pro dospělé s CLBP přerušilo léčbu kvůli nežádoucí reakci, ve srovnání s 6,3 % (28/441) u pacientů léčených placebem. Nežádoucí účinky hlášené jako důvod k přerušení léčby a považované za související s lékem (jak je definováno výše) zahrnovaly nevolnost (CYMBALTA 3 %, placebo 0,7 %) a somnolenci (CYMBALTA 1 %, placebo 0 %).
Nejčastější nežádoucí reakce ve studiích u dospělých
Nejčastěji pozorované nežádoucí účinky u pacientů léčených přípravkem CYMBALTA (jak je definováno výše) byly:
- Diabetická periferní neuropatická bolest: nevolnost, somnolence, snížená chuť k jídlu, zácpa, hyperhidróza a sucho v ústech.
- Fibromyalgie: nevolnost, sucho v ústech, zácpa, somnolence, snížená chuť k jídlu, hyperhidróza a neklid.
- Chronická bolest způsobená osteoartrózou: nevolnost, únava, zácpa, sucho v ústech, nespavost, somnolence a závratě.
- Chronická bolest dolní části zad: nevolnost, sucho v ústech, nespavost, somnolence, zácpa, závratě a únava.
Nejčastěji pozorované nežádoucí účinky u pacientů léčených přípravkem CYMBALTA ve všech sdružených dospělých populacích (tj. MDD, GAD, DPNP, FM, OA a CLBP) (výskyt alespoň 5 % a alespoň dvojnásobný výskyt u pacientů léčených placebem pacienti) byli nevolnost, sucho v ústech, somnolence, zácpa, snížená chuť k jídlu a hyperhidróza.
Tabulka 2 uvádí výskyt nežádoucích účinků v placebem kontrolovaných studiích pro schválené dospělé populace (tj. MDD, GAD, DPNP, FM, OA a CLBP), které se vyskytly u 5 % nebo více pacientů léčených přípravkem CYMBALTA as incidencí vyšší než u pacientů léčených placebem.
Nežádoucí reakce ve sdružených studiích MDD a GAD u dospělých
Tabulka 3 uvádí výskyt nežádoucích účinků v placebem kontrolovaných studiích MDD a GAD u dospělých, které se vyskytly u 2 % nebo více pacientů léčených přípravkem CYMBALTA as incidencí vyšší než u pacientů léčených placebem.
Nežádoucí reakce ve studiích DPNP, FM, OA a CLBP pro dospělé
Tabulka 4 uvádí výskyt nežádoucích účinků, které se vyskytly u 2 % nebo více pacientů léčených přípravkem CYMBALTA (určeno před zaokrouhlením) v předmarketingové akutní fázi placebem kontrolovaných studií dospělých DPNP, FM, OA a CLBP a s incidencí vyšší než u pacientů léčených placebem.
Účinky na mužské a ženské sexuální funkce u dospělých s MDD
Změny sexuální touhy, sexuální výkonnosti a sexuálního uspokojení se často objevují jako projevy psychiatrických poruch nebo diabetu, ale mohou být také důsledkem farmakologické léčby. Protože se předpokládá, že nežádoucí sexuální reakce jsou dobrovolně podhodnoceny, byla prospektivně ve 4 MDD placebem kontrolovaných studiích pro dospělé (studie MDD-1, MDD-2) prospektivně použita škála Arizona Sexual Experience Scale (ASEX), ověřené měřítko určené k identifikaci sexuálních nežádoucích reakcí. , MDD-3 a MDD-4) [viz Klinické studie ]. Škála ASEX zahrnuje pět otázek, které se týkají následujících aspektů sexuální funkce: 1) sexuální touha, 2) snadnost vzrušení, 3) schopnost dosáhnout erekce (muži) nebo lubrikace (ženy), 4) snadnost dosažení orgasmu a 5) uspokojení z orgasmu. Kladná čísla znamenají zhoršení sexuálních funkcí oproti výchozímu stavu. Záporná čísla znamenají zlepšení od výchozí úrovně dysfunkce, která je běžně pozorována u pacientů s depresí.
těchto studiích zaznamenali muži léčení přípravkem CYMBALTA významně více sexuální dysfunkce, měřeno celkovým skóre na ASEX a schopností dosáhnout orgasmu, než muži užívající placebo (viz ). Pacientky léčené přípravkem CYMBALTA nezaznamenaly více sexuální dysfunkce než pacientky léčené placebem, měřeno celkovým skóre ASEX. Poskytovatelé zdravotní péče by se měli běžně dotazovat na možné sexuální nežádoucí reakce u pacientů léčených přípravkem CYMBALTA.
Změny vitálních funkcí u dospělých
V placebem kontrolovaných klinických studiích napříč schválenou dospělou populací pro změnu z výchozí hodnoty na koncový bod měli pacienti léčení přípravkem CYMBALTA průměrné zvýšení systolického krevního tlaku (SBP) o 0,23 mm Hg a diastolického krevního tlaku (DBP) o 0,73 mm Hg ve srovnání s průměrným poklesem 1,09 mm Hg v SBP a 0,55 mm Hg v DBP u pacientů léčených placebem. Nebyl žádný významný rozdíl ve frekvenci trvalého (3 po sobě jdoucí návštěvy) zvýšeného krevního tlaku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léčba přípravkem CYMBALTA 20 mg po dobu až 26 týdnů v placebem kontrolovaných studiích napříč schválenou dospělou populací obvykle způsobila malé zvýšení srdeční frekvence pro změnu od výchozí hodnoty k koncovému bodu ve srovnání s placebem až o 1,37 úderů za minutu (nárůst o 1,20 úderů za minutu u pacientů léčených přípravkem CYMBALTA pokles o 0,17 tepů za minutu u pacientů léčených placebem).
Laboratorní změny u dospělých
Léčba přípravkem CYMBALTA v placebem kontrolovaných klinických studiích napříč schválenými dospělými populacemi byla spojena s malým průměrným zvýšením ALT, AST, CPK a alkalické fosfatázy od výchozího k cílovému bodu; vzácné, mírné, přechodné, abnormální hodnoty byly pozorovány u těchto analytů u pacientů léčených přípravkem CYMBALTA ve srovnání s pacienty léčenými placebem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Vysoká hladina bikarbonátu, cholesterolu a abnormální (vysoká nebo nízká) hladina draslíku byly pozorovány častěji u pacientů léčených přípravkem CYMBALTA ve srovnání s pacienty léčenými placebem.
Další nežádoucí účinky pozorované během klinického hodnocení přípravku CYMBALTA u dospělých
Následuje seznam nežádoucích účinků hlášených pacienty léčenými přípravkem CYMBALTA 40 mg v klinických studiích u dospělých. V klinických studiích všech schválených dospělých populací bylo přípravkem CYMBALTA léčeno 34 756 pacientů. Z nich 27 % (9337) užívalo přípravek CYMBALTA 60 mg po dobu alespoň 6 měsíců a 12 % (4317) užívalo přípravek CYMBALTA po dobu alespoň jednoho roku. Následující seznam není určen k tomu, aby zahrnoval reakce (1) již uvedené v předchozích tabulkách nebo jinde v označení, (2) pro které byla drogová příčina vzdálená, (3) které byly tak obecné, že nebyly informativní, (4) které byly nepovažují za významné klinické důsledky, nebo (5) k nimž došlo v míře rovné nebo nižší než u placeba.
Reakce jsou kategorizovány podle tělesného systému podle následujících definic: časté nežádoucí reakce jsou ty, které se vyskytují alespoň u 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; vzácné reakce jsou ty, které se vyskytují u méně než 1/1000 pacientů.
- Srdeční poruchy - Časté: bušení srdce; Méně časté: infarkt myokardu, tachykardie a Takotsubo kardiomyopatie.
- Poruchy ucha a labyrintu - Časté: vertigo; Méně časté: bolest ucha a tinnitus.
- Endokrinní poruchy - Méně časté: hypotyreóza.
- Oční poruchy - Časté: rozmazané vidění; Méně časté: diplopie, suché oko a poškození zraku.
- Gastrointestinální poruchy - Časté: plynatost; Méně časté: dysfagie, říhání, gastritida, gastrointestinální krvácení, halitóza a stomatitida; Vzácné: žaludeční vřed.
- Obecné poruchy a podmínky v místě podání - Časté: zimnice/zimnice; Méně časté: pády, abnormální pocit, pocit horka a/nebo chladu, malátnost a žízeň; Vzácné: poruchy chůze.
- Infekce a infestace - Méně časté: gastroenteritida a laryngitida.
- Vyšetřování Časté: zvýšení hmotnosti, snížení hmotnosti; Méně časté: zvýšený cholesterol v krvi.
- Poruchy metabolismu a výživy - Méně časté: dehydratace a hyperlipidémie; Vzácné: dyslipidémie.
- Poruchy svalové a kosterní soustavy a pojivové tkáně - Časté: muskuloskeletální bolest; Méně časté: svalové napětí a svalové záškuby.
- Poruchy nervového systému - Časté: dysgeuzie, letargie a parestézie/hypostezie; Méně časté: poruchy pozornosti, dyskineze, myoklonus a špatná kvalita spánku; Vzácné: dysartrie.
- Psychiatrické poruchy - Časté: abnormální sny a poruchy spánku; Méně časté: apatie, bruxismus, dezorientace/stav zmatenosti, podrážděnost, změny nálad a pokusy o sebevraždu; Vzácné: dokonaná sebevražda.
- Poruchy ledvin a močových cest - Časté: frekvence močení; Méně časté: dysurie, nutkání na močení, nykturie, polyurie a abnormální zápach moči.
- Poruchy reprodukčního systému a prsu - Časté: anorgasmie/orgasmus abnormální; Méně časté: symptomy menopauzy, sexuální dysfunkce a bolest varlat; Vzácné: porucha menstruace.
- Respirační, hrudní a mediastinální poruchy Časté: zívání, orofaryngeální bolest; Méně časté: svírání hrdla.
- Poruchy kůže a podkožní tkáně - Časté: pruritus; Méně časté: studený pot, kontaktní dermatitida, erytém, zvýšený sklon k tvorbě modřin, noční pocení a fotosenzitivní reakce; Vzácné: ekchymóza.
- Cévní poruchy - Časté: návaly horka; Méně časté: návaly horka, ortostatická hypotenze a periferní chlad.
Nežádoucí účinky pozorované v placebem kontrolovaných klinických studiích u pediatrických pacientů
Databáze pediatrických klinických studií
Údaje popsané níže odrážejí expozici přípravku CYMBALTA (N=567) u pediatrických pacientů ve věku 7 až 18 let ze dvou 10týdenních placebem kontrolovaných studií u pacientů s MDD (N=341) (studie MDD-6 a MDD- 7), jedna 10týdenní placebem kontrolovaná studie u GAD (N=135) (studie GAD-6) a 13týdenní studie u fibromyalgie (N=91). CYMBALTA 60 mg není schválena pro léčbu MDD u dětských pacientů [viz Použití u konkrétních populací ]. Z pacientů léčených přípravkem CYMBALTA v těchto studiích bylo 36 % ve věku 7 až 11 let (64 % bylo ve věku 12 až 18 let), 55 % byly ženy a 69 % byli běloši. Během placebem kontrolovaných studií akutní léčby pacienti dostávali 30 až 120 mg přípravku CYMBALTA denně. V pediatrických studiích MDD, GAD a fibromyalgie v délce až 40 týdnů bylo 988 pediatrických pacientů léčených přípravkem CYMBALTA ve věku 7 až 17 let (většina pacientů dostávala 30–120 mg denně) – 35 % bylo ve věku 7 až 11 let věku (65 % bylo ve věku 12 až 17 let) a 56 % byly ženy.
Nejčastější nežádoucí reakce v pediatrických studiích
Nejčastějšími nežádoucími účinky (≥5 % u pacientů léčených přípravkem CYMBALTA a nejméně dvojnásobný výskyt pacientů léčených placebem) ve všech sdružených pediatrických populacích (MDD, GAD a fibromyalgie) byly snížení hmotnosti, snížená chuť k jídlu, nauzea, zvracení, únava a průjem.
Nežádoucí účinky u pediatrických pacientů ve věku 7 až 17 let s MDD a GAD
Profil nežádoucích účinků pozorovaný v klinických studiích u pediatrických pacientů ve věku 7 až 18 let s MDD a GAD byl v souladu s profilem nežádoucích účinků pozorovaným v klinických studiích u dospělých. Mezi nejčastější (≥5 % a dvakrát placebo) nežádoucí účinky pozorované v těchto pediatrických klinických studiích patřily: nauzea, průjem, snížení hmotnosti a závratě.
Tabulka 6 uvádí výskyt nežádoucích účinků v pediatrických placebem kontrolovaných studiích MDD a GAD, které se vyskytly u více než 2 % pacientů léčených přípravkem CYMBALTA as incidencí vyšší než u pacientů léčených placebem. CYMBALTA není schválena k léčbě MDD u dětských pacientů (viz Použití u konkrétních populací ].
Další nežádoucí účinky, které se vyskytly s incidencí nižší než 2 % a byly hlášeny více pacienty léčenými přípravkem CYMBALTA než pacienty léčenými placebem v pediatrických klinických studiích MDD a GAD, zahrnovaly: abnormální sny (včetně nočních můr), úzkost, zrudnutí (včetně návalů horka ), hyperhidróza, palpitace, zvýšený puls a třes (CYMBALTA 20 mg není schválena k léčbě pediatrických pacientů s MDD).
Nejčastěji hlášené příznaky po vysazení přípravku CYMBALTA 30 mg v pediatrických klinických studiích MDD a GAD zahrnovaly bolest hlavy, závratě, nespavost a bolest břicha (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Růst (výška a hmotnost) u pediatrických pacientů ve věku 7 až 17 let s GAD a MDD
souvislosti s užíváním SSRI a SNRI byla pozorována snížená chuť k jídlu a úbytek hmotnosti. Pediatričtí pacienti léčení přípravkem CYMBALTA v klinických studiích zaznamenali průměrný pokles hmotnosti o 0,1 kg po 10 týdnech ve srovnání s průměrným přírůstkem hmotnosti přibližně 0,9 kg u pediatrických pacientů léčených placebem. Podíl pacientů, u kterých došlo ke klinicky významnému poklesu hmotnosti (≥3,5 %), byl větší ve skupině s přípravkem CYMBALTA než ve skupině s placebem (16 % a 6 %). Následně během 4 až 6měsíčních nekontrolovaných prodloužení měli pacienti léčení přípravkem CYMBALTA v průměru trend k zotavení na očekávaný výchozí hmotnostní percentil na základě údajů o populaci od vrstevníků stejného věku a pohlaví.
Ve studiích trvajících až 9 měsíců došlo u pediatrických pacientů léčených přípravkem CYMBALTA ke zvýšení výšky v průměru o 1,7 cm (zvýšení o 2,2 cm u pacientů ve věku 7 až 11 let a zvýšení o 1,3 cm u pacientů ve věku 12 až 17 let). Zatímco během těchto studií bylo pozorováno zvýšení výšky, bylo pozorováno průměrné snížení percentilu výšky o 1 % (pokles o 2 % u pacientů ve věku 7 až 11 let a zvýšení o 0,3 % u pacientů ve věku 12 až 17 let). U pediatrických pacientů léčených přípravkem CYMBALTA by měla být pravidelně sledována hmotnost a výška (viz Použití u konkrétních populací ].
Nežádoucí účinky u pediatrických pacientů ve věku 13 až 17 let s fibromyalgií
Tabulka 7 uvádí výskyt nežádoucích účinků v pediatrické placebem kontrolované studii s fibromyalgií (studie FM-4), které se vyskytly u více než 5 % pacientů léčených přípravkem CYMBALTA 30 mg as incidencí vyšší než u pacientů léčených placebem (viz Klinické studie ].
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku CYMBALTA po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Nežádoucí účinky hlášené od uvedení na trh, které dočasně souvisely s léčbou přípravkem CYMBALTA 40 mg a nebyly uvedeny jinde v označení, zahrnují: akutní pankreatitidu, anafylaktické reakce, agresi a hněv (zejména na začátku léčby nebo po jejím přerušení), angioneurotický edém, glaukom s uzavřeným úhlem, kolitida (mikroskopická nebo blíže neurčená), kožní vaskulitida (někdy spojená se systémovým postižením), extrapyramidová porucha, galaktorea, gynekologické krvácení, halucinace, hyperglykémie, hyperprolaktinémie, hypersenzitivita, hypertenzní krize, svalové křeče, vyrážka, syndrom neklidných nohou, záchvaty po přerušení léčby, supraventrikulární arytmie, tinnitus (po přerušení léčby), trismus a kopřivka.
DROGOVÉ INTERAKCE
Za metabolismus duloxetinu jsou odpovědné jak CYP1A2, tak CYP2D6.
Inhibitory CYP1A2
Když byla CYMBALTA 60 mg podávána současně s fluvoxaminem 100 mg, silným inhibitorem CYP1A2, mužům (n=14), AUC duloxetinu se zvýšila přibližně 6krát, Cmax se zvýšila přibližně 2,5krát a duloxetin t1/2 byl zvýšila přibližně 3krát. Mezi další léky, které inhibují metabolismus CYP1A2, patří cimetidin a chinolonová antimikrobiální látky, jako je ciprofloxacin a enoxacin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Inhibitory CYP2D6
Současné užívání přípravku CYMBALTA (40 mg jednou denně) s paroxetinem (20 mg jednou denně) zvýšilo koncentraci AUC duloxetinu asi o 60 % a vyšší stupeň inhibice se očekává při vyšších dávkách paroxetinu. Podobné účinky by se daly očekávat u jiných silných inhibitorů CYP2D6 (např. fluoxetin, chinidin) (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Duální inhibice CYP1A2 a CYP2D6
Současné podávání CYMBALTY 40 mg dvakrát denně s fluvoxaminem 100 mg, silným inhibitorem CYP1A2, subjektům s pomalým metabolizmem CYP2D6 (n=14) vedlo k 6násobnému zvýšení AUC a Cmax duloxetinu.
Léky, které interferují s hemostázou (např. NSAID, aspirin a warfarin)
Uvolňování serotoninu krevními destičkami hraje důležitou roli v hemostáze. Epidemiologické studie případové kontroly a kohorty, které prokázaly souvislost mezi užíváním psychofarmak interferujících se zpětným vychytáváním serotoninu a výskytem krvácení z horní části gastrointestinálního traktu, také ukázaly, že současné užívání NSAID nebo aspirinu může toto riziko krvácení zesílit. Při současném podávání SSRI nebo SNRI s warfarinem byly hlášeny změněné antikoagulační účinky, včetně zvýšeného krvácení. Současné podávání warfarinu (2-9 mg jednou denně) za podmínek ustáleného stavu s přípravkem CYMBALTA 60 nebo 120 mg jednou denně po dobu až 14 dnů u zdravých subjektů (n=15) významně nezměnilo INR od výchozí hodnoty (průměrné změny INR se pohybovaly od 0,05 až +0,07). Celková farmakokinetika warfarinu (navázaný na protein plus volné léčivo) (AUCτ,ss, Cmax,ss nebo tmax,ss) pro R- a S-warfarin nebyla duloxetinem změněna. Vzhledem k možnému účinku duloxetinu na krevní destičky by pacienti užívající warfarin měli být při zahájení nebo ukončení léčby přípravkem CYMBALTA pečlivě sledováni (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lorazepam
V podmínkách ustáleného stavu pro CYMBALTA (60 mg Q 12 hodin) a lorazepam (2 mg Q 12 hodin) nebyla farmakokinetika duloxetinu ovlivněna současným podáváním.
Temazepam
Za podmínek ustáleného stavu pro CYMBALTA (20 mg qhs) a temazepam (30 mg qhs) nebyla farmakokinetika duloxetinu ovlivněna současným podáváním.
Léky, které ovlivňují žaludeční kyselost
CYMBALTA má enterosolventní povlak, který odolává rozpouštění, dokud nedosáhne segmentu gastrointestinálního traktu, kde pH přesahuje 5,5. V extrémně kyselých podmínkách může CYMBALTA 20 mg, nechráněná enterosolventním povlakem, podléhat hydrolýze za vzniku naftolu. Při používání přípravku CYMBALTA 30 mg se doporučuje opatrnost u pacientů se stavy, které mohou zpomalit vyprazdňování žaludku (např. někteří diabetici). Léky, které zvyšují gastrointestinální pH, mohou vést k dřívějšímu uvolnění duloxetinu. Současné podávání CYMBALTY 60 mg s antacidy obsahujícími hliník a hořčík (51 mEq) nebo CYMBALTY s famotidinem však nemělo žádný významný vliv na rychlost nebo rozsah absorpce duloxetinu po perorálním podání 40 mg
Léky metabolizované CYP1A2
Studie lékových interakcí in vitro ukazují, že duloxetin neindukuje aktivitu CYP1A2. Proto se zvýšení metabolismu substrátů CYP1A2 (např. theofylin, kofein) v důsledku indukce nepředpokládá, ačkoli klinické studie indukce nebyly provedeny. Duloxetin je inhibitor izoformy CYP1A2 ve studiích in vitro a ve dvou klinických studiích bylo průměrné (90% interval spolehlivosti) zvýšení AUC theofylinu 7% (1%-15%) a 20% (13%-27%) při současném podávání s přípravkem CYMBALTA (60 mg dvakrát denně).
Léky metabolizované CYP2D6
Duloxetin je středně silný inhibitor CYP2D6. Když byla CYMBALTA podávána (v dávce 60 mg dvakrát denně) ve spojení s jednou dávkou 50 mg desipraminu, substrátu CYP2D6, AUC desipraminu se zvýšila 3krát (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léky metabolizované CYP2C9
Výsledky studií in vitro ukazují, že duloxetin neinhibuje aktivitu. V klinické studii nebyla farmakokinetika S-warfarinu, substrátu CYP2C9, významně ovlivněna duloxetinem (viz Léky, které interferují s hemostázou (např. NSAID, Aspirin a Warfarin) ].
Léky metabolizované CYP3A
Výsledky studií in vitro ukazují, že duloxetin neinhibuje ani neindukuje aktivitu CYP3A. Proto se zvýšení nebo snížení metabolismu substrátů CYP3A (např. perorální antikoncepce a jiných steroidních látek) v důsledku indukce nebo inhibice nepředpokládá, ačkoli klinické studie nebyly provedeny.
Léky metabolizované CYP2C19
Výsledky studií in vitro ukazují, že duloxetin v terapeutických koncentracích neinhibuje aktivitu CYP2C19. Inhibice metabolismu substrátů CYP2C19 se proto nepředpokládá, ačkoli klinické studie nebyly provedeny.
Inhibitory monoaminooxidázy (MAOI)
[Vidět DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Serotonergní léky
[Vidět DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Alkohol
Když byly CYMBALTA 40 mg a ethanol podávány s odstupem několika hodin, takže maximální koncentrace každého z nich se shodovaly, CYMBALTA nezvýšila poškození mentálních a motorických dovedností způsobené alkoholem.
V databázi klinických studií CYMBALTA měli tři pacienti léčení přípravkem CYMBALTA poškození jater, které se projevilo zvýšením ALT a celkového bilirubinu s důkazy obstrukce. V každém z těchto případů bylo přítomno značné interkurentní užívání etanolu, což mohlo přispět k pozorovaným abnormalitám [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
CNS léky
[Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léky vysoce vázané na plazmatické bílkoviny
Protože se duloxetin silně váže na plazmatické bílkoviny, může podávání přípravku CYMBALTA 30 mg pacientovi užívajícímu jiný lék, který se silně váže na bílkoviny, způsobit zvýšení volných koncentrací jiného léku, což může mít za následek nežádoucí účinky. Současné podávání přípravku CYMBALTA (60 nebo 120 mg) s warfarinem (2–9 mg), lékem vysoce vázaným na proteiny, však nevedlo k významným změnám v INR a ve farmakokinetice celkového S- nebo celkového R- warfarin (vázaný na protein plus volné léčivo) [viz Léky, které interferují s hemostázou (např. NSAID, Aspirin a Warfarin) ].
Zneužívání drog a závislost
Zneužívání
Ve studiích na zvířatech duloxetin neprokázal potenciál zneužívání podobné barbiturátům (depresivním účinkům).
Zatímco CYMBALTA nebyla systematicky studována na lidech z hlediska jejího potenciálu ke zneužívání, v klinických studiích nebyly žádné známky chování při vyhledávání drog. Na základě předmarketingových zkušeností však není možné předpovědět, do jaké míry bude léčivo působící na CNS po uvedení na trh zneužito, odkloněno a/nebo zneužito. Lékaři by proto měli pacienty pečlivě vyhodnotit, zda v anamnéze nezískávali drogy, a pozorně tyto pacienty sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání přípravku CYMBALTA (např. rozvoj tolerance, zvyšování dávky, chování vyhledávající drogu).
Závislost
Ve studiích lékové závislosti duloxetin neprokázal u potkanů potenciál produkovat závislost.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Sebevražedné myšlenky a chování u dětí, dospívajících a mladých dospělých
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby.
Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a dalších) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (1824 let) s velkou depresivní poruchou ( MDD) a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Riziko rozdílů (lék vs. placebo) však bylo relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl lék-placebo v počtu případů sebevraždy na 1000 léčených pacientů) jsou uvedeny v tabulce 1.
žádné z pediatrických studií CYMBALTA nedošlo k sebevraždě. Ve studiích dospělých CYMBALTA 20 mg došlo k sebevraždám, ale počet nebyl dostatečný k tomu, aby bylo možné učinit závěr o účinku přípravku CYMBALTA na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Pokud bylo rozhodnuto přerušit léčbu, měla by být medikace snižována tak rychle, jak je to možné, ale s vědomím, že přerušení může být spojeno s určitými příznaky [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Syndrom vysazení ] pro popis rizik vysazení přípravku CYMBALTA.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky popsané výše. , stejně jako vznik suicidality, a takové příznaky neprodleně hlásit poskytovatelům zdravotní péče. Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro přípravek CYMBALTA by měly být napsány na nejmenší množství tobolek v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese. Je třeba poznamenat, že přípravek CYMBALTA není schválen pro použití k léčbě bipolární deprese.
Hepatotoxicita
pacientů léčených přípravkem CYMBALTA byly hlášeny případy selhání jater, někdy fatální. Tyto případy se projevily jako hepatitida s bolestí břicha, hepatomegalií a zvýšením hladin transamináz na více než dvacetinásobek horní hranice normálu (ULN) se žloutenkou nebo bez ní, což odráží smíšený nebo hepatocelulární vzorec poškození jater. Léčba přípravkem CYMBALTA 30 mg by měla být přerušena u pacientů, u kterých se rozvine žloutenka nebo jiné známky klinicky významné jaterní dysfunkce, a léčba by neměla být obnovena, pokud nelze zjistit jinou příčinu.
Byly také hlášeny případy cholestatické žloutenky s minimálním zvýšením hladin transamináz. Jiné postmarketingové zprávy naznačují, že u pacientů s chronickým onemocněním jater nebo cirhózou došlo ke zvýšení transamináz, bilirubinu a alkalické fosfatázy.
CYMBALTA zvyšovala riziko zvýšení hladin sérových transamináz v klinických studiích vývojového programu. Zvýšení jaterních transamináz vedlo k přerušení léčby u 0,3 % (92/34 756) pacientů léčených přípravkem CYMBALTA. U většiny pacientů byl střední čas do detekce zvýšení transamináz asi dva měsíce. V placebem kontrolovaných studiích u dospělých pacientů s normálními a abnormálními výchozími hodnotami ALT došlo ke zvýšení ALT > 3násobku ULN u 1,25 % (144/11 496) pacientů léčených přípravkem CYMBALTA ve srovnání s 0,45 % (39/8716) u pacientů užívajících placebo -léčení pacienti. V placebem kontrolovaných studiích u dospělých s použitím designu s fixní dávkou byl prokázán vztah závislosti odpovědi na dávce přípravku CYMBALTA pro zvýšení ALT a AST na >3násobek ULN a >5násobek ULN.
Protože je možné, že CYMBALTA a alkohol mohou interagovat a způsobit poškození jater nebo že CYMBALTA 20 mg může zhoršit již existující jaterní onemocnění, CYMBALTA by neměla být předepisována pacientům, kteří ve velké míře konzumují alkohol nebo mají prokázané chronické onemocnění jater.
Ortostatická hypotenze, pády a synkopy
U pacientů léčených doporučenými dávkami přípravku CYMBALTA byly hlášeny ortostatická hypotenze, pády a synkopa. Synkopa a ortostatická hypotenze se obvykle objevují během prvního týdne léčby, ale mohou se objevit kdykoli během léčby přípravkem CYMBALTA, zejména po zvýšení dávky. Zdá se, že riziko pádu souvisí se stupněm ortostatického poklesu krevního tlaku (BP) a také s dalšími faktory, které mohou zvyšovat základní riziko pádů.
analýze pacientů ze všech placebem kontrolovaných studií pacienti léčení přípravkem CYMBALTA 20 mg hlásili vyšší míru pádů ve srovnání s pacienty léčenými placebem. Zdá se, že riziko souvisí s přítomností ortostatického poklesu TK. Riziko poklesu TK může být větší u pacientů užívajících současně léky, které vyvolávají ortostatickou hypotenzi (jako jsou antihypertenziva) nebo jsou silnými inhibitory CYP1A2 (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Klinicky důležité lékové interakce ] au pacientů užívajících přípravek CYMBALTA 20 mg v dávkách vyšších než 60 mg denně. U pacientů, u kterých se během léčby přípravkem CYMBALTA 40 mg vyskytne symptomatická ortostatická hypotenze, pády a/nebo synkopa, je třeba zvážit snížení dávky nebo vysazení přípravku CYMBALTA.
Riziko pádu se také zdálo být úměrné pacientovu základnímu riziku pádů a zdálo se, že se s věkem neustále zvyšuje. Vzhledem k tomu, že geriatričtí pacienti mají tendenci mít vyšší základní riziko pádů v důsledku vyšší prevalence rizikových faktorů, jako je užívání více léků, medikamentózní komorbidity a poruchy chůze, není dopad samotného zvyšujícího se věku jasný. Při užívání přípravku CYMBALTA 30 mg byly hlášeny pády se závažnými následky včetně zlomenin a hospitalizací (viz NEŽÁDOUCÍ REAKCE ].
serotoninový syndrom
Rozvoj potenciálně život ohrožujícího serotoninového syndromu byl hlášen u SNRI a SSRI, včetně CYMBALTY 60 mg, samotných, ale zejména při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů a třezalka tečkovaná) a s léky, které zhoršují metabolismus serotoninu (zejména IMAO, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid a intravenózní methylenová modř).
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární příznaky (např. třes, ztuhlost, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu.
Současné užívání přípravku CYMBALTA 30 mg s antidepresivy MAOI je kontraindikováno. Léčba přípravkem CYMBALTA 60 mg by rovněž neměla být zahájena u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř. Všechny zprávy s methylenovou modří, které poskytly informace o cestě podání, zahrnovaly intravenózní podání v rozmezí dávek 1 mg/kg až 8 mg/kg. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Mohou nastat okolnosti, kdy je u pacienta užívajícího přípravek CYMBALTA nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř. CYMBALTA by měla být vysazena před zahájením léčby IMAO (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KONTRAINDIKACE ].
Pokud je klinicky oprávněné současné užívání přípravku CYMBALTA 20 mg s jinými serotonergními léky včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu, amfetaminů a třezalky tečkované, pacienti by si měli být vědomi možného zvýšeného rizika serotoninového syndromu zvláště při zahájení léčby a při zvyšování dávky. Pokud se vyskytnou výše uvedené příhody, léčba přípravkem CYMBALTA 60 mg a jakýmikoli souběžně podávanými serotonergními látkami by měla být okamžitě přerušena a měla by být zahájena podpůrná symptomatická léčba.
Zvýšené riziko krvácení
Léky, které interferují s inhibicí zpětného vychytávání serotoninu, včetně přípravku CYMBALTA, mohou zvýšit riziko krvácivých příhod. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Postmarketingová studie prokázala vyšší výskyt poporodního krvácení u matek užívajících přípravek CYMBALTA. Další krvácivé příhody související s užíváním SSRI a SNRI sahaly od ekchymóz, hematomů, epistaxe a petechií až po život ohrožující krvácení. Současné užívání aspirinu, nesteroidních protizánětlivých léků (NSAID), warfarinu a dalších antikoagulancií může toto riziko zvýšit.
Informujte pacienty o riziku krvácení spojeného se současným užíváním přípravku CYMBALTA a NSAID, aspirinu nebo jiných léků ovlivňujících koagulaci (viz DROGOVÉ INTERAKCE ].
Závažné kožní reakce
přípravku CYMBALTA se mohou vyskytnout závažné kožní reakce, včetně erythema multiforme a Stevens-Johnsonova syndromu (SJS). Hlášená četnost SJS spojená s užíváním přípravku CYMBALTA překračuje základní míru incidence této závažné kožní reakce v běžné populaci (1 až 2 případy na milion osoboroků). Míra vykazování je obecně přijímána jako podhodnocená z důvodu nedostatečného vykazování.
Léčba přípravkem CYMBALTA by měla být přerušena při prvním výskytu puchýřů, olupující se vyrážky, slizničních erozí nebo jakýchkoli jiných příznaků hypersenzitivity, pokud nelze identifikovat jinou etiologii.
Syndrom vysazení
Příznaky z vysazení byly systematicky hodnoceny u pacientů užívajících přípravek CYMBALTA. Po náhlém nebo postupném vysazování v placebem kontrolovaných klinických studiích u dospělých se u pacientů léčených přípravkem CYMBALTA ve srovnání s pacienty, kteří ukončili léčbu placebem, vyskytly následující příznaky s 1 % nebo více as významně vyšší četností: závratě, bolest hlavy, nauzea, průjem, parestézie, podrážděnost, zvracení, nespavost, úzkost, hyperhidróza a únava.
Při uvádění na trh jiných SSRI a SNRI (inhibitory zpětného vychytávání serotoninu a norepinefrinu) byly spontánně hlášeny nežádoucí účinky po vysazení těchto léků, zvláště když byly náhlé, včetně následujících: dysforická nálada, podrážděnost, agitovanost, závratě, senzorické poruchy ( např. parestézie, jako jsou pocity elektrického šoku), úzkost, zmatenost, bolest hlavy, letargie, emoční labilita, nespavost, hypománie, tinitus a záchvaty. Ačkoli tyto příhody obecně spontánně odezní, některé byly hlášeny jako závažné.
Při ukončování léčby přípravkem CYMBALTA je třeba u pacientů sledovat výskyt těchto příznaků. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, lze zvážit obnovení předchozí předepsané dávky. Následně může poskytovatel zdravotní péče pokračovat ve snižování dávky, ale pozvolnějším tempem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Aktivace mánie/hypománie
placebem kontrolovaných studiích dospělých u pacientů s MDD byla aktivace mánie nebo hypománie hlášena u 0,1 % (4/3779) pacientů léčených přípravkem CYMBALTA a 0,04 % (1/2536) pacientů léčených placebem. V placebem kontrolovaných studiích DPNP, GAD, fibromyalgie nebo chronické muskuloskeletální bolesti nebyla hlášena žádná aktivace mánie nebo hypománie. Aktivace mánie nebo hypománie byla hlášena u malé části pacientů s poruchami nálady, kteří byli léčeni jinými dostupnými léky účinnými v léčbě velké depresivní poruchy. Stejně jako u těchto jiných látek by měla být CYMBALTA 60 mg používána s opatrností u pacientů s mánií v anamnéze.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně přípravku CYMBALTA, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii.
Záchvaty
CYMBALTA nebyla systematicky hodnocena u pacientů se záchvatovým onemocněním a tito pacienti byli vyloučeni z klinických studií. V placebem kontrolovaných klinických studiích u dospělých se záchvaty/křeče vyskytly u 0,02 % (3/12 722) pacientů léčených přípravkem CYMBALTA 60 mg au 0,01 % (1/9513) pacientů léčených placebem. CYMBALTA by měla být předepisována s opatrností pacientům s anamnézou záchvatové poruchy.
Zvýšení krevního tlaku
placebem kontrolovaných klinických studiích u dospělých ve schválených dospělých populacích od výchozího po koncový bod byla léčba přípravkem CYMBALTA spojena s průměrným zvýšením systolického krevního tlaku o 0,5 mm Hg a diastolického krevního tlaku o 0,8 mm Hg ve srovnání s průměrným snížením o 0,6 mm Hg systolického a 0,3 mm Hg diastolický u pacientů léčených placebem. Nebyl žádný významný rozdíl ve frekvenci trvalého (3 po sobě jdoucích návštěv) zvýšeného krevního tlaku. V klinické farmakologické studii určené k vyhodnocení účinků přípravku CYMBALTA 60 mg na různé parametry, včetně krevního tlaku v supraterapeutických dávkách se zrychlenou titrací dávky, bylo prokázáno zvýšení krevního tlaku vleže na zádech při dávkách až 200 mg dvakrát denně (přibližně 3,3krát maximální doporučené dávkování). Při nejvyšší dávce 200 mg dvakrát denně bylo zvýšení průměrné tepové frekvence o 5,0 až 6,8 tepů a zvýšení průměrného krevního tlaku o 4,7 až 6,8 mm Hg (systolický) a 4,5 až 7 mm Hg (diastolický) do 12 hodin po podání dávky .
Krevní tlak by měl být měřen před zahájením léčby a pravidelně měřen během léčby [viz NEŽÁDOUCÍ REAKCE ].
Klinicky důležité lékové interakce
Jak CYP1A2, tak CYP2D6 jsou zodpovědné za metabolismus CYMBALTY.
Potenciál jiných léků ovlivnit CYMBALTU
Inhibitory CYP1A2
Je třeba se vyvarovat současného podávání přípravku CYMBALTA 40 mg se silnými inhibitory CYP1A2 (viz DROGOVÉ INTERAKCE ].
Inhibitory CYP2D6
Protože se CYP2D6 podílí na metabolismu CYMBALTY, očekává se, že současné užívání CYMBALTY se silnými inhibitory CYP2D6 povede k vyšším koncentracím (v průměru 60 %) CYMBALTY (viz DROGOVÉ INTERAKCE ].
Potenciál CYMBALTY 30 mg ovlivnit jiné léky
Léky metabolizované CYP2D6
Současné podávání přípravku CYMBALTA 20 mg s léky, které jsou rozsáhle metabolizovány CYP2D6 a které mají úzký terapeutický index, včetně určitých antidepresiv (tricyklická antidepresiva [TCA], jako je nortriptylin, amitriptylin a imipramin), fenothiaziny a antiarytmika typu 1C (antiarytmika propafenon, flekainid), je třeba přistupovat s opatrností. Pokud je TCA podávána současně s přípravkem CYMBALTA, může být nutné monitorovat plazmatické koncentrace TCA a snížit dávku TCA. Vzhledem k riziku závažných ventrikulárních arytmií a náhlé smrti potenciálně spojené se zvýšenými hladinami thioridazinu v plazmě by neměly být CYMBALTA 30 mg a thioridazin podávány současně (viz DROGOVÉ INTERAKCE ].
Další klinicky významné lékové interakce
Alkohol
Užívání přípravku CYMBALTA 40 mg současně s těžkým pitím alkoholu může být spojeno se závažným poškozením jater. Z tohoto důvodu by CYMBALTA 60 mg neměla být předepisována pacientům s výraznou konzumací alkoholu [viz Hepatotoxicita a DROGOVÉ INTERAKCE ].
Léky působící na CNS
Vzhledem k primárním účinkům přípravku CYMBALTA na CNS by měl být přípravek CYMBALTA používán s opatrností, pokud je užíván v kombinaci s jinými centrálně působícími léky nebo jako náhrada za jiné centrálně působící léky, včetně těch s podobným mechanismem účinku (viz Klinicky důležité lékové interakce a DROGOVÉ INTERAKCE ].
Hyponatrémie
Hyponatremie se může objevit v důsledku léčby SSRI a SNRI, včetně přípravku CYMBALTA. V mnoha případech se zdá, že tato hyponatremie je výsledkem syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH). Při užívání přípravku CYMBALTA 40 mg byly hlášeny případy se sérovým sodíkem nižším než 110 mmol/l, které se zdály být reverzibilní, když bylo podávání přípravku CYMBALTA ukončeno. Geriatričtí pacienti mohou být vystaveni většímu riziku rozvoje hyponatremie u SSRI a SNRI. Také pacienti užívající diuretika nebo jinak objemově vyčerpaní mohou být vystaveni většímu riziku [viz Použití u konkrétních populací ]. U pacientů se symptomatickou hyponatrémií by mělo být zváženo vysazení přípravku CYMBALTA a měla by být zahájena vhodná lékařská intervence.
Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, které mohou vést k pádům. Závažnější a/nebo akutní případy byly spojeny s halucinacemi, synkopou, záchvaty, kómatem, zástavou dechu a smrtí.
Použití u pacientů se souběžným onemocněním
Klinické zkušenosti s přípravkem CYMBALTA u pacientů se souběžnými systémovými onemocněními jsou omezené. Neexistují žádné informace o vlivu, který mohou mít změny motility žaludku na stabilitu enterosolventního povlaku přípravku CYMBALTA. V extrémně kyselých podmínkách může CYMBALTA, nechráněná enterosolventním povlakem, podléhat hydrolýze za vzniku naftolu. Při používání přípravku CYMBALTA se doporučuje opatrnost u pacientů se stavy, které mohou zpomalit vyprazdňování žaludku (např. někteří diabetici).
CYMBALTA 30 mg nebyla systematicky hodnocena u pacientů s nedávnou anamnézou infarktu myokardu nebo nestabilním onemocněním koronárních tepen. Pacienti s těmito diagnózami byli obecně vyloučeni z klinických studií během premarketingového testování přípravku.
Poškození jater
Vyhněte se použití u pacientů s chronickým onemocněním jater nebo cirhózou [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Hepatotoxicita , a Použití u konkrétních populací ].
Těžké poškození ledvin
Vyhněte se použití u pacientů s těžkou poruchou funkce ledvin, GFR DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Kontrola glykémie u pacientů s diabetem
Jak bylo pozorováno ve studiích DPNP, léčba přípravkem CYMBALTA 30 mg zhoršila kontrolu glykémie u některých pacientů s diabetem. Ve třech klinických studiích přípravku CYMBALTA pro léčbu neuropatické bolesti spojené s diabetickou periferní neuropatií (viz Klinické studie ], průměrné trvání diabetu bylo přibližně 12 let, průměrná výchozí hodnota glykémie nalačno byla 176 mg/dl a průměrná výchozí hodnota hemoglobinu A1c (HbA1c) byla 7,8 %. Ve 12týdenní akutní fázi léčby těchto studií byl přípravek CYMBALTA spojen s malým zvýšením průměrné hladiny glukózy v krvi nalačno ve srovnání s placebem. V prodloužené fázi těchto studií, která trvala až 52 týdnů, se průměrná glykémie nalačno zvýšila o 12 mg/dl ve skupině CYMBALTA 40 mg a snížila se o 11,5 mg/dl ve skupině s běžnou péčí. HbA1c se zvýšil o 0,5 % ve skupině CYMBALTA 40 mg a o 0,2 % ve skupině s běžnou péčí.
Močové váhání a zadržování
CYMBALTA 60 mg patří do skupiny léků, o kterých je známo, že ovlivňují rezistenci močové trubice. Pokud se během léčby přípravkem CYMBALTA 20 mg rozvinou příznaky váhání moči, je třeba zvážit možnost, že mohou souviset s lékem.
Po uvedení přípravku na trh byly pozorovány případy retence moči. V některých případech retence moči spojené s užíváním přípravku CYMBALTA 60 mg byla nutná hospitalizace a/nebo katetrizace.
Sexuální dysfunkce
Užívání SNRI, včetně přípravku CYMBALTA 60 mg, může způsobit příznaky sexuální dysfunkce (viz NEŽÁDOUCÍ REAKCE ]. U mužských pacientů může mít užívání SNRI za následek zpoždění nebo selhání ejakulace, snížení libida a erektilní dysfunkci. U pacientek může mít užívání SNRI za následek snížení libida a opožděný nebo chybějící orgasmus.
Je důležité, aby se předepisující lékaři zeptali na sexuální funkce před zahájením léčby přípravkem CYMBALTA 40 mg a konkrétně se zeptali na změny sexuální funkce během léčby, protože sexuální funkce nemusí být spontánně hlášeny. Při hodnocení změn sexuální funkce je důležité získat podrobnou anamnézu (včetně načasování nástupu příznaků), protože sexuální příznaky mohou mít jiné příčiny, včetně základní psychiatrické poruchy. Diskutujte o možných strategiích řízení, které pomohou pacientům činit informovaná rozhodnutí o léčbě.
Pacientské poradenství Inofrmace
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Sebevražedné myšlenky a chování
Poraďte pacientům, jejich rodinám a jejich pečovatelům, aby hledali výskyt sebevražedných myšlenek a chování, zejména během léčby a když je dávka upravována nahoru nebo dolů, a poučte je, aby hlásili takové příznaky svému poskytovateli zdravotní péče [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Správa
Doporučte pacientům, aby polykali CYMBALTU 20 mg celou a tobolku nežvýkali, nedrtily ani neotevíraly (nestříkejte obsah na jídlo ani nemíchejte s tekutinami), protože tyto účinky mohou ovlivnit enterosolventní povlak.
Hepatotoxicita
Informujte pacienty, že u pacientů léčených přípravkem CYMBALTA byly hlášeny závažné jaterní problémy, někdy fatální. Poučte pacienty, aby si promluvili se svým poskytovatelem zdravotní péče, pokud se u nich během užívání přípravku CYMBALTA objeví svědění, bolest v pravé horní části břicha, tmavá moč nebo žlutá kůže/oči, což mohou být příznaky problémů s játry. Poučte pacienty, aby o své konzumaci alkoholu hovořili se svým poskytovatelem zdravotní péče. Užívání přípravku CYMBALTA s těžkým příjmem alkoholu může být spojeno se závažným poškozením jater (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Alkohol
Přestože přípravek CYMBALTA nezvyšuje poškození mentálních a motorických dovedností způsobené alkoholem, užívání přípravku CYMBALTA současně s těžkým příjmem alkoholu může být spojeno se závažným poškozením jater (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Ortostatická hypotenze, pády a synkopy
Informujte pacienty o riziku ortostatické hypotenze, pádů a synkopy, zejména během období počátečního užívání a následného zvyšování dávky a ve spojení s užíváním souběžných léků, které by mohly potencovat ortostatický účinek přípravku CYMBALTA (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
serotoninový syndrom
Pozor pacienty na riziko serotoninového syndromu při současném užívání přípravku CYMBALTA 30 mg a dalších serotonergních látek včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu, amfetaminů a třezalky tečkované [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a DROGOVÉ INTERAKCE ]. Poučte pacienty o známkách a symptomech spojených se serotoninovým syndromem, které mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, návaly horka, hypertermii), neuromuskulární změny (např. třes, rigidita, myoklonus, hyperreflexie, nekoordinace), záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem). Varujte pacienty, aby okamžitě vyhledali lékařskou péči, pokud se u nich objeví tyto příznaky.
Zvýšené riziko krvácení
Pozor u pacientů na současné užívání přípravku CYMBALTA 30 mg a NSAID, aspirinu, warfarinu nebo jiných léků ovlivňujících koagulaci, protože kombinované užívání psychofarmak, které interferují se zpětným vychytáváním serotoninu, a těchto látek bylo spojeno se zvýšeným rizikem krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Závažné kožní reakce
Varujte pacienty, že přípravek CYMBALTA může způsobit závažné kožní reakce. To může být nutné léčit v nemocnici a může být život ohrožující. Poraďte pacientům, aby okamžitě zavolali svého lékaře nebo získali pohotovostní pomoc, pokud mají kožní puchýře, olupující se vyrážku, vředy v ústech, kopřivku nebo jiné alergické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přerušení léčby
Poučte pacienty, že přerušení léčby přípravkem CYMBALTA 30 mg může být spojeno s příznaky, jako jsou závratě, bolest hlavy, nevolnost, průjem, parestézie, podrážděnost, zvracení, nespavost, úzkost, hyperhidróza a únava, a měli by být upozorněni, aby neměnili svůj dávkovací režim ani neukončovali léčbu užívat přípravek CYMBALTA bez konzultace s poskytovatelem zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Aktivace Mánie Nebo Hypománie
Před zahájením léčby přípravkem CYMBALTA proveďte odpovídající screening pacientů s depresivními příznaky na riziko bipolární poruchy (např. sebevražda v rodinné anamnéze, bipolární porucha a deprese). Poraďte pacientům, aby hlásili jakékoli známky nebo příznaky manické reakce, jako je výrazně zvýšená energie, vážné problémy se spánkem, uspěchané myšlenky, bezohledné chování, mluvení více nebo rychleji než obvykle, neobvykle velké nápady a nadměrné štěstí nebo podrážděnost [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glaukom s uzavřeným úhlem
Informujte pacienty, že užívání přípravku CYMBALTA 40 mg může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a mají profylaktický postup (např. iridektomie), pokud jsou náchylní [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Záchvaty
Poraďte pacientům, aby informovali svého poskytovatele zdravotní péče, pokud mají v anamnéze záchvatovou poruchu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Účinky na krevní tlak
Pozor pacienti, že CYMBALTA 60 mg může způsobit zvýšení krevního tlaku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doprovodné léky
Poraďte pacientům, aby informovali svého poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, protože existuje možnost interakcí [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a DROGOVÉ INTERAKCE ].
Hyponatrémie
Informujte pacienty, že hyponatremie byla hlášena v důsledku léčby SNRI a SSRI, včetně přípravku CYMBALTA. Informujte pacienty o známkách a příznacích hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].

Průběžná onemocnění
Doporučte pacientům, aby informovali svého poskytovatele zdravotní péče o všech svých zdravotních stavech [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Močové váhání a zadržování
CYMBALTA patří do skupiny léků, které mohou ovlivnit močení. Poučte pacienty, aby se poradili se svým poskytovatelem zdravotní péče, pokud se u nich objeví nějaké problémy s proudem moči [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sexuální dysfunkce
Informujte pacienty, že užívání přípravku CYMBALTA 40 mg může vyvolat příznaky sexuální dysfunkce u mužů i žen. Informujte pacienty, že by měli se svým poskytovatelem zdravotní péče prodiskutovat jakékoli změny v sexuální funkci a potenciální strategie řízení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těhotenství
- Informujte ženy, aby informovaly svého poskytovatele zdravotní péče, pokud během léčby přípravkem CYMBALTA otěhotní nebo plánují otěhotnět.
- Informujte těhotné ženy nebo pacientky, které plánují otěhotnět, že užívání přípravku CYMBALTA 40 mg během měsíce před porodem může vést ke zvýšenému riziku poporodního krvácení a může zvýšit riziko neonatálních komplikací vyžadujících prodlouženou hospitalizaci, podporu dýchání a výživu sondou.
- Upozorněte těhotné ženy, že při vysazení antidepresiv existuje riziko relapsu.
- Informujte pacienty, že existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených duloxetinu během těhotenství [viz Použití u konkrétních populací ].
Laktace
Poraďte kojícím ženám, které používají přípravek CYMBALTA 30 mg, aby sledovaly kojence kvůli sedaci, špatnému krmení a nízkému přírůstku hmotnosti a aby vyhledaly lékařskou péči, pokud si všimnou těchto příznaků [viz Použití u konkrétních populací ].
Zasahování do psychomotorického výkonu
CYMBALTA 30 mg může být spojena se sedací a závratí. Proto varujte pacienty před obsluhou nebezpečných strojů včetně automobilů, dokud si nebudou přiměřeně jisti, že léčba přípravkem CYMBALTA neovlivňuje jejich schopnost zapojit se do takových činností.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Duloxetin byl podáván ve stravě myším a potkanům po dobu 2 let.
U myších samic, které dostávaly duloxetin v dávce 140 mg/kg/den (trojnásobek maximální doporučené dávky pro člověka (MRHD) 120 mg/den podávané dětem na základě mg/m2), byla zvýšená incidence hepatocelulárních adenomů a karcinomů. Dávka bez účinku byla 50 mg/kg/den (jednonásobek MRHD podávaný dětem). Výskyt nádorů nebyl zvýšen u myších samců, kteří dostávali duloxetin v dávkách až 100 mg/kg/den (dvojnásobek MRHD podávaných dětem).
U potkanů dietní dávky duloxetinu až do 27 mg/kg/den u samic (jednonásobek MRHD podávaného dětem) a až 36 mg/kg/den u samců (1,4násobek MRHD podávaného dětem) nezvýšily výskyt nádorů.
Mutageneze
Duloxetin nebyl mutagenní v testu bakteriální reverzní mutace in vitro (Amesův test) a nebyl klastogenní v testu chromozomálních aberací in vivo v buňkách kostní dřeně myší. Kromě toho nebyl duloxetin genotoxický v in vitro testu mutací přímých genů savců v myších lymfomových buňkách nebo v testu in vitro neplánované syntézy DNA (UDS) v primárních hepatocytech potkana a neindukoval výměnu sesterských chromatid v kostní dřeni čínského křečka in vivo .
Zhoršení Plodnosti
Duloxetin podávaný perorálně samcům nebo samicím potkanů před a během páření v dávkách až 45 mg/kg/den (3násobek MRHD podávaných dospívajícím na základě mg/m2) nezměnil páření ani fertilitu.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který monitoruje výsledky těhotenství u žen vystavených přípravku CYMBALTA během těhotenství. Chcete-li se zaregistrovat, kontaktujte CYMBALTA Pregnancy Registry na čísle 1-866-814-6975 nebo www.cymbalta 20mgpregnancyregistry.com.
Shrnutí rizik
Údaje z postmarketingové retrospektivní kohortové studie naznačují, že užívání duloxetinu v měsíci před porodem může být spojeno se zvýšeným rizikem poporodního krvácení. Údaje z publikované literatury a z postmarketingové retrospektivní kohortové studie neidentifikovaly jasné riziko závažných vrozených vad nebo jiných nepříznivých vývojových výsledků související s užíváním léků (viz Data ). Existují rizika spojená s neléčenou depresí a fibromyalgií v těhotenství a s expozicí SNRI a SSRI, včetně přípravku CYMBALTA, během těhotenství (viz Klinické úvahy ).
potkanů a králíků léčených duloxetinem během období organogeneze došlo ke snížení hmotnosti plodů, ale nebyly prokázány účinky na vývoj při dávkách až do 3 a 6násobku maximální doporučené dávky pro člověka (MRHD) 120 mg/den podané u dospívajících na základě mg/m2. Když byl duloxetin podáván perorálně březím potkanům během březosti a laktace, hmotnost mláďat při narození a přežití mláďat do 1 dne po porodu byly sníženy v dávce 2násobku MRHD podávané dospívajícím na základě mg/m2. Při této dávce bylo pozorováno chování mláďat konzistentní se zvýšenou reaktivitou, jako je zvýšená úleková reakce na hluk a snížené přivykání na lokomotorickou aktivitu. Růst po odstavení nebyl nepříznivě ovlivněn.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
U žen, které během těhotenství vysadily antidepresiva, je větší pravděpodobnost, že dojde k relapsu těžké deprese, než u žen, které v antidepresivech pokračují. Toto zjištění pochází z prospektivní, longitudinální studie, která sledovala 201 těhotných žen s anamnézou závažné depresivní poruchy, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Těhotné ženy s fibromyalgií jsou vystaveny zvýšenému riziku nepříznivých následků pro matku a kojence, včetně předčasného předčasného prasknutí blan, předčasný porod, malé vzhledem ke gestačnímu věku, omezení intrauterinního růstu, porušení placenty a žilní trombóza. Není známo, zda jsou tyto nepříznivé důsledky pro matku a plod přímým důsledkem fibromyalgie nebo jiných komorbidních faktorů.
Mateřské nežádoucí reakce
Užívání duloxetinu v měsíci před porodem může být spojeno se zvýšeným rizikem poporodního krvácení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Fetální/neonatální nežádoucí reakce
novorozenců vystavených CYMBALTĚ a dalším SNRI nebo SSRI pozdě ve třetím trimestru se rozvinuly komplikace vyžadující prodlouženou hospitalizaci, podporu dýchání a výživu sondou. Takové komplikace mohou nastat ihned po porodu. Hlášené klinické nálezy zahrnovaly respirační tíseň, cyanózu, apnoe, záchvaty, teplotní nestabilitu, potíže s krmením, zvracení, hypoglykémii, hypotonii, hypertonii, hyperreflexii, třes, nervozitu, podrážděnost a neustálý pláč. Tyto nálezy jsou v souladu buď s přímým toxickým účinkem SNRI nebo SSRI, nebo možná se syndromem z vysazení léku. Je třeba poznamenat, že v některých případech je klinický obraz v souladu se serotoninovým syndromem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Data
Lidská data
Údaje z postmarketingové retrospektivní kohortové studie založené na tvrzeních zjistily zvýšené riziko poporodního krvácení u 955 těhotných žen vystavených duloxetinu v posledním měsíci těhotenství ve srovnání s 4 128 460 neexponovanými těhotnými ženami (upravené relativní riziko: 1,53; 95% CI: 1,08-2,18). ). Stejná studie nezjistila klinicky významné zvýšení rizika závažných vrozených vad ve srovnání 2 532 žen vystavených duloxetinu v prvním trimestru těhotenství s 1 284 827 neexponovanými ženami po úpravě na několik matoucích faktorů. Metodologická omezení zahrnují možné zbytkové zmatení, chybnou klasifikaci expozice a výsledků, nedostatek přímých měření závažnosti onemocnění a nedostatek informací o konzumaci alkoholu, výživě a expozici volně prodejným lékům.
Údaje o zvířatech
V reprodukčních studiích na zvířatech bylo prokázáno, že duloxetin má nežádoucí účinky na embryo/fetální a postnatální vývoj.
Když byl duloxetin podáván perorálně březím potkanům a králíkům během období organogeneze, nebyly prokázány malformace nebo vývojové odchylky v dávkách až 45 mg/kg/den [3 a 6násobek MRHD 120 mg/den podávané dospívajícím na bázi mg/m2]. Hmotnost plodů se však při této dávce snížila, přičemž dávka bez účinku 10 mg/kg/den (přibližně stejná jako MRHD u potkanů a dvojnásobek MRHD u králíků).
Když byl duloxetin podáván perorálně březím potkanům během březosti a laktace, přežití mláďat do 1 dne po porodu a tělesná hmotnost mláďat při narození a během období laktace byla snížena v dávce 30 mg/kg/den (dvojnásobek MRHD podané u dospívajících na základě mg/m2); dávka bez účinku byla 10 mg/kg/den. Dále bylo u mláďat po expozici matek 30 mg/kg/den pozorováno chování konzistentní se zvýšenou reaktivitou, jako je zvýšená úleková reakce na hluk a snížené přivykání na lokomotorickou aktivitu. Růst po odstavení a reprodukční výkonnost potomstva nebyly nepříznivě ovlivněny mateřskou léčbou duloxetinem.
Laktace
Shrnutí rizik
Údaje z publikované literatury uvádějí přítomnost duloxetinu v mateřském mléce (viz Data ). Existují zprávy o sedaci, špatném krmení a nízkém přírůstku hmotnosti u kojenců vystavených duloxetinu prostřednictvím mateřského mléka (viz Klinické úvahy ). Neexistují žádné údaje o účinku duloxetinu na produkci mléka.
Je třeba zvážit vývojové a zdravotní přínosy kojení spolu s klinickou potřebou matky užívat přípravek CYMBALTA a veškerými potenciálními nežádoucími účinky přípravku CYMBALTA nebo základního onemocnění matky na kojené dítě.
Klinické úvahy
Kojenci vystavení přípravku CYMBALTA by měli být sledováni kvůli sedaci, špatnému krmení a nízkému přírůstku hmotnosti.
Data
Dispozice přípravku CYMBALTA 60 mg byla studována u 6 kojících žen, které byly alespoň 12 týdnů po porodu a rozhodly se odstavit své děti. Ženám bylo podáváno 40 mg přípravku CYMBALTA 60 mg dvakrát denně po dobu 3,5 dne. Maximální koncentrace naměřená v mateřském mléce se objevila v průměru 3 hodiny po podání dávky. Množství přípravku CYMBALTA v mateřském mléce bylo při této dávce přibližně 7 mcg/den; odhadovaná denní dávka pro kojence byla přibližně 2 mcg/kg/den, což je méně než 1 % mateřské dávky. Přítomnost metabolitů přípravku CYMBALTA 40 mg v mateřském mléce nebyla zkoumána.
Pediatrické použití
Bezpečnost a účinnost přípravku CYMBALTA 60 mg byla stanovena pro léčbu generalizované úzkostné poruchy (GAD) u pacientů ve věku 7 až 17 let a pro léčbu syndromu juvenilní fibromyalgie u pacientů ve věku 13 až 17 let. Bezpečnost a účinnost přípravku CYMBALTA 20 mg nebyla stanovena u pediatrických pacientů s velkou depresivní poruchou (MDD), diabetickou periferní neuropatickou bolestí nebo chronickou muskuloskeletální bolestí.
Antidepresiva zvyšovala riziko sebevražedných myšlenek a chování u dětských pacientů. Sledujte všechny pediatrické pacienty léčené antidepresivy kvůli klinickému zhoršení a výskytu sebevražedných myšlenek a chování, zejména během prvních několika měsíců léčby nebo v době změny dávkování (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Provádějte pravidelné sledování hmotnosti a růstu u dětských pacientů léčených přípravkem CYMBALTA [viz NEŽÁDOUCÍ REAKCE ].
Generalizovaná úzkostná porucha
Použití přípravku CYMBALTA k léčbě GAD u pacientů ve věku 7 až 17 let je podpořeno jednou 10týdenní placebem kontrolovanou studií (GAD-6). Studie zahrnovala 272 dětských pacientů s GAD, z nichž 47 % bylo ve věku 7 až 11 let (53 % bylo ve věku 12 až 17 let). CYMBALTA prokázala převahu nad placebem, jak bylo měřeno větším zlepšením v Pediatric Anxiety Rating Scale (PARS) pro skóre závažnosti GAD [viz Klinické studie ].
Bezpečnost a účinnost přípravku CYMBALTA 20 mg pro léčbu GAD u pediatrických pacientů mladších 7 let nebyla stanovena.
Fibromyalgie
Použití přípravku CYMBALTA k léčbě fibromyalgie u pacientů ve věku 13 až 17 let je podpořeno 13týdenní placebem kontrolovanou studií u 184 pacientů se syndromem juvenilní fibromyalgie (studie FM-4). CYMBALTA prokázala zlepšení ve srovnání s placebem v primárním koncovém bodě, změna od výchozího stavu k ukončení léčby na Brief Pain Inventory (BPI) – Modified Short Form: Verze pro dospívající 24hodinové průměrné hodnocení závažnosti bolesti [viz Klinické studie ].
Bezpečnost a účinnost přípravku CYMBALTA při léčbě fibromyalgie u pacientů mladších 13 let nebyla stanovena.
Velká depresivní porucha
Bezpečnost a účinnost přípravku CYMBALTA nebyla u pediatrických pacientů pro léčbu MDD stanovena.
Účinnost přípravku CYMBALTA nebyla prokázána ve dvou 10týdenních, placebem kontrolovaných studiích s 800 pediatrickými pacienty ve věku 7 až 17 let s MDD (MDD-6 a MDD-7). Ani CYMBALTA, ani aktivní kontrola (schválená pro léčbu dětské MDD) nebyly lepší než placebo.
Nejčastěji pozorované nežádoucí účinky v pediatrických klinických studiích MDD zahrnovaly nevolnost, bolest hlavy, snížení hmotnosti a bolest břicha. V souvislosti s užíváním SSRI a SNRI byla pozorována snížená chuť k jídlu a úbytek hmotnosti.
Toxikologická data mladých zvířat
Podávání duloxetinu mladým potkanům od postnatálního dne 21 (odstavení) do postnatálního dne 90 (dospělí) mělo za následek snížení tělesné hmotnosti, které přetrvávalo do dospělosti, ale obnovilo se po přerušení léčby; mírně opožděné (~1,5 dne) pohlavní dospívání u samic, bez jakéhokoli vlivu na plodnost; a zpoždění v učení složitého úkolu v dospělosti, které nebylo pozorováno po přerušení léčby drogami. Tyto účinky byly pozorovány při vysoké dávce 45 mg/kg/den (dvojnásobek MRHD, pro dítě); hladina bez účinku byla 20 mg/kg/den (≈1násobek MRHD, pro dítě).
Geriatrické použití
Geriatrická expozice v premarketingových klinických studiích přípravku CYMBALTA
- Z 2 418 pacientů ve studiích MDD bylo 6 % (143) ve věku 65 let nebo více.
- Z 1041 pacientů ve studiích CLBP bylo 21 % (221) ve věku 65 let nebo více.
- Ze 487 pacientů ve studiích OA bylo 41 % (197) ve věku 65 let nebo více.
- Z 1 074 pacientů ve studiích DPNP bylo 33 % (357) ve věku 65 let nebo více.
- 1 761 pacientů ve studiích FM bylo 8 % (140) ve věku 65 let nebo více.
Ve studiích MDD, GAD, DPNP, FM, OA a CLBP nebyly mezi těmito pacienty a mladšími dospělými pacienty obecně pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi těmito geriatrickými a mladšími pacienty. dospělých pacientů, ale nelze vyloučit větší citlivost některých starších pacientů.
SSRI a SNRI, včetně CYMBALTY, byly spojeny s klinicky významnou hyponatrémií u geriatrických pacientů, u kterých může být vyšší riziko této nežádoucí reakce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
analýze údajů ze všech placebem kontrolovaných studií pacienti léčení přípravkem CYMBALTA hlásili vyšší míru pádů ve srovnání s pacienty léčenými placebem. Zdá se, že zvýšené riziko je úměrné pacientovu základnímu riziku pádů. Zdá se, že základní riziko se s věkem neustále zvyšuje. Vzhledem k tomu, že geriatričtí pacienti mají tendenci mít vyšší prevalenci rizikových faktorů pádů, jako jsou léky, zdravotní komorbidity a poruchy chůze, není dopad samotného zvyšujícího se věku na pády během léčby přípravkem CYMBALTA 30 mg jasný. Při užívání přípravku CYMBALTA byly hlášeny pády se závažnými následky včetně zlomenin kostí a hospitalizací (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Farmakokinetika duloxetinu po jednorázové dávce 40 mg byla srovnávána u zdravých starších žen (65 až 77 let) a zdravých žen středního věku (32 až 50 let). V Cmax nebyl žádný rozdíl, ale AUC duloxetinu byla poněkud (asi o 25 %) vyšší a poločas asi o 4 hodiny delší u starších žen. Populační farmakokinetické analýzy naznačují, že typické hodnoty clearance klesají přibližně o 1 % pro každý rok věku mezi 25. a 75. rokem věku; ale věk jako prediktivní faktor představuje pouze malé procento variability mezi pacienty. Úprava dávkování na základě věku dospělého pacienta není nutná.
Rod
Poločas duloxetinu je u mužů a žen podobný. Úprava dávkování na základě pohlaví není nutná.
Stav kouření
Zdá se, že biologická dostupnost duloxetinu (AUC) je u kuřáků snížena asi o jednu třetinu. Úpravy dávkování se nedoporučují kuřákům.
Závod
Nebyla provedena žádná specifická farmakokinetická studie, která by zkoumala účinky rasy.
Poškození jater
Pacienti s klinicky evidentním poškozením jater mají snížený metabolismus a eliminaci duloxetinu. Po jednorázové dávce 20 mg přípravku CYMBALTA 20 mg mělo 6 pacientů s cirhózou se středně těžkou poruchou funkce jater (Child-Pugh třída B) průměrnou plazmatickou clearance duloxetinu přibližně 15 % clearance zdravých jedinců stejného věku a pohlaví, s 5násobným zvýšením střední expozice (AUC). Ačkoli Cmax byla podobná normálním hodnotám u pacientů s cirhózou, poločas byl asi 3krát delší [viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těžké poškození ledvin
dispozici jsou omezené údaje o účincích přípravku CYMBALTA 40 mg u pacientů s terminálním onemocněním ledvin (ESRD). Po jednorázové dávce 60 mg CYMBALTY 20 mg byly hodnoty Cmax a AUC přibližně o 100 % vyšší u pacientů s ESRD podstupujících chronickou intermitentní hemodialýzu než u subjektů s normální funkcí ledvin. Eliminační poločas však byl v obou skupinách podobný. Hodnoty AUC hlavních cirkulujících metabolitů, 4-hydroxyduloxetinglukuronidu a 5-hydroxy, 6methoxyduloxetinsulfátu, vylučovaných převážně močí, byly přibližně 7 až 9krát vyšší a lze očekávat, že se budou dále zvyšovat při opakovaném podávání. Populační PK analýzy naznačují, že mírné až střední stupně poškození ledvin (odhad CrCl 30-80 ml/min) nemají žádný významný vliv na zdánlivou clearance duloxetinu (viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
PŘEDÁVKOVAT
Příznaky a symptomy
postmarketingových zkušenostech byly hlášeny fatální následky při akutním předávkování CYMBALTA 60 mg, především u smíšených předávkování, ale také pouze u CYMBALTY 20 mg, včetně 1000 mg CYMBALTY (přibližně 8,3násobek maximální doporučené dávky). Známky a příznaky předávkování (CYMBALTA samostatně nebo se smíšenými léky) zahrnovaly somnolenci, kóma, serotoninový syndrom, záchvaty, synkopu, tachykardii, hypotenzi, hypertenzi a zvracení.
Řízení Předávkování
Neexistuje žádné specifické antidotum na předávkování přípravkem CYMBALTA 60 mg, ale pokud se objeví serotoninový syndrom, lze zvážit specifickou léčbu (jako je cyproheptadin a/nebo kontrola teploty).
případě akutního předávkování přípravkem CYMBALTA 30 mg by léčba měla sestávat z obecných opatření používaných při zvládání předávkování jakýmkoli lékem, jako je zajištění dostatečných dýchacích cest, okysličení a ventilace a sledování srdečního rytmu a vitálních funkcí. V případě potřeby může být indikován výplach žaludku velkoprůměrnou orogastrickou sondou s vhodnou ochranou dýchacích cest, pokud se provede brzy po požití nebo u symptomatických pacientů. Vyvolání zvracení se nedoporučuje.
Aktivní uhlí může být užitečné při omezení absorpce duloxetinu z gastrointestinálního traktu. Bylo prokázáno, že podávání aktivního uhlí snižuje AUC a Cmax duloxetinu v průměru o jednu třetinu, ačkoli někteří pacienti měli omezený účinek aktivního uhlí. Vzhledem k velkému distribučnímu objemu duloxetinu je nepravděpodobné, že by forsírovaná diuréza, dialýza, hemoperfuze a výměnná transfuze byly přínosné.
Při zvládání předávkování je třeba vzít v úvahu možnost zapojení více léků. Zvláštní opatrnost se týká pacientů, kteří se předávkují přípravkem CYMBALTA 60 mg a tricyklickými antidepresivy. V takovém případě může snížená clearance mateřského tricyklu a/nebo jeho aktivního metabolitu zvýšit možnost klinicky významných následků a prodloužit dobu potřebnou pro pečlivé lékařské pozorování [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Zvažte kontaktování toxikologického centra (1-800-222-1222 nebo www.poison.org), kde získáte další informace o léčbě předávkování.
KONTRAINDIKACE
Užívání IMAO určených k léčbě psychiatrických poruch přípravkem CYMBALTA 40 mg nebo do 5 dnů po ukončení léčby přípravkem CYMBALTA je kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu. Užívání přípravku CYMBALTA do 14 dnů po ukončení užívání IMAO určeného k léčbě psychiatrických poruch je kontraindikováno (viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zahájení léčby přípravkem CYMBALTA 30 mg u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř, je také kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu (viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Přestože přesné mechanismy antidepresivního, centrálního inhibičního účinku na bolest a anxiolytického účinku duloxetinu u lidí nejsou známy, předpokládá se, že tyto účinky souvisí s jeho potenciaci serotonergní a noradrenergní aktivity v CNS.
Farmakodynamika
Předklinické studie prokázaly, že duloxetin je silný inhibitor zpětného vychytávání serotoninu a norepinefrinu neurony a méně účinný inhibitor zpětného vychytávání dopaminu. Duloxetin nemá in vitro žádnou významnou afinitu k dopaminergním, adrenergním, cholinergním, histaminergním, opioidním, glutamátovým a GABA receptorům. Duloxetin neinhibuje monoaminooxidázu (MAO).
CYMBALTA je ve třídě léků, o kterých je známo, že ovlivňují uretrální rezistenci (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Elektrofyziologie srdce
Účinek přípravku CYMBALTA 160 mg a 200 mg podávaných dvakrát denně (2,7násobek, respektive 3,3násobek maximální doporučené dávky) na ustálený stav byl hodnocen v randomizované, dvojitě zaslepené, dvoucestné zkřížené studii u 117 zdravých dospělých žen. Nebylo zjištěno žádné prodloužení QT intervalu. Zdá se, že CYMBALTA 40 mg je spojena s koncentrací závislým, ale ne klinicky významným zkrácením QT.
Farmakokinetika
Duloxetin má poločas eliminace přibližně 12 hodin (rozmezí 8 až 17 hodin) a jeho farmakokinetika je úměrná dávce v terapeutickém rozmezí. Ustáleného stavu plazmatických koncentrací je typicky dosaženo po 3 dnech podávání. Eliminace duloxetinu probíhá především prostřednictvím jaterního metabolismu zahrnujícího dva izoenzymy P450, CYP1A2 a CYP2D6.
Vstřebávání
Po perorálním podání přípravku CYMBALTA 30 mg se duloxetin-hydrochlorid dobře vstřebává. Do zahájení absorpce (Tlag) je střední 2hodinové zpoždění, přičemž maximální plazmatické koncentrace (Cmax) duloxetinu se objevují 6 hodin po podání dávky. Po večerní dávce dochází k 3hodinovému zpoždění absorpce a ke zvýšení zdánlivé clearance duloxetinu o jednu třetinu ve srovnání s ranní dávkou.
Účinek jídla
Jídlo neovlivňuje Cmax duloxetinu, ale prodlužuje dobu dosažení maximální koncentrace z 6 na 10 hodin a okrajově snižuje rozsah absorpce (AUC) asi o 10 %.
Rozdělení
Zdánlivý distribuční objem je v průměru asi 1640 l. Duloxetin se silně váže (>90 %) na proteiny v lidské plazmě, primárně se váže na albumin a kyselý α1-glykoprotein. Interakce mezi duloxetinem a jinými léky vysoce vázanými na proteiny nebyla plně vyhodnocena. Vazba duloxetinu na plazmatické proteiny není ovlivněna poruchou funkce ledvin nebo jater.
Odstranění
Metabolismus
Biotransformace a vylučování duloxetinu u lidí byly stanoveny po perorálním podání 14C-značeného duloxetinu. Duloxetin tvoří asi 3 % celkového radioaktivně značeného materiálu v plazmě, což naznačuje, že podléhá rozsáhlému metabolismu na četné metabolity. Hlavní biotransformační cesty duloxetinu zahrnují oxidaci naftylového kruhu následovanou konjugací a další oxidací. Jak CYP1A2, tak CYP2D6 katalyzují oxidaci naftylového kruhu in vitro. Metabolity nalezené v plazmě zahrnují 4-hydroxy duloxetin glukuronid a 5-hydroxy, 6-methoxy duloxetin sulfát.
Vylučování
moči bylo identifikováno mnoho dalších metabolitů, z nichž některé představují pouze malé cesty eliminace. V moči jsou přítomna pouze stopová množství (
Specifické populace
Pediatričtí pacienti
Plazmatická koncentrace duloxetinu v ustáleném stavu byla srovnatelná u pediatrických pacientů ve věku 7 až 17 let au dospělých pacientů. Průměrná koncentrace duloxetinu v ustáleném stavu byla u této pediatrické populace přibližně o 30 % nižší než u dospělých pacientů. Modelem předpokládané plazmatické koncentrace duloxetinu v ustáleném stavu u pediatrických pacientů ve věku 7 až 17 let byly většinou v rozmezí koncentrací pozorovaném u dospělých pacientů a nepřesáhly rozmezí koncentrací u dospělých.
Klinické studie
Přehled klinických zkoušek
Účinnost přípravku CYMBALTA 60 mg byla stanovena u následujících populací v adekvátních a dobře kontrolovaných studiích:
Velká depresivní porucha (MDD)
4 krátkodobé (studie MDD-1, MDD-2, MDD-3 a MDD-4) a 1 udržovací studie (studie MDD-5) u dospělých [viz Závažná depresivní porucha u dospělých ].
Generalizovaná úzkostná porucha (GAD)
3 krátkodobé studie u dospělých (studie GAD-1, GAD-2 a GAD-3), 1 udržovací studie u dospělých (studie GAD-4), 1 krátkodobá studie u geriatrických pacientů (studie GAD-5), a 1 krátkodobá studie u pediatrických pacientů ve věku 7 až 17 let (studie GAD-6) [viz Generalizovaná úzkostná porucha ].
Diabetická periferní neuropatická bolest (DPNP)
Dvě 12týdenní studie u dospělých (studie DPNP-1 a DPNP-2) [viz Diabetická periferní neuropatická bolest u dospělých ].
fibromyalgie (FM)
Dvě studie u dospělých (jedna v délce 3 měsíců a jedna v délce trvání 6 měsíců) (studie FM-1 a FM-2) a jedna 13týdenní studie u pediatrických pacientů ve věku 13 až 17 let (studie FM-4) [viz Fibromyalgie ].
Chronická muskuloskeletální bolest
Dvě 12 až 13týdenní studie u dospělých pacientů s chronickou bolestí dolní části zad (CLBP) (studie CLBP-1 a CLBP-3) a jedna 13týdenní studie u dospělých pacientů s chronickou bolestí způsobenou osteoartrózou (OA) (studie OA -1) [viz Chronická muskuloskeletální bolest u dospělých ].
Dále je níže uveden souhrn následujících studií, které neprokázaly účinnost: Studie FM-3 (16týdenní studie u dospělých pacientů s fibromyalgií), Studie CLBP-2 (13týdenní studie u dospělých pacientů s CLBP) a Studie OA-2 (13týdenní studie u dospělých pacientů s chronickou bolestí způsobenou OA).
Závažná depresivní porucha u dospělých
Účinnost přípravku CYMBALTA jako léčby MDD u dospělých byla stanovena ve 4 randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích s fixní dávkou u dospělých ambulantních pacientů (18 až 83 let), kteří splňují kritéria DSM-IV pro MDD:
- Ve studiích MDD-1 a MDD-2 byli pacienti randomizováni k užívání přípravku CYMBALTA 60 mg jednou denně (N=123, resp. N=128) nebo placeba (N=122 a N=139, v tomto pořadí) po dobu 9 týdnů
- Ve studii MDD-3 byli pacienti randomizováni k užívání přípravku CYMBALTA 20 nebo 40 mg dvakrát denně (N=86 a N=91) nebo placeba (N=89) po dobu 8 týdnů
- Ve studii MDD-4 byli pacienti randomizováni k léčbě přípravkem CYMBALTA 40 nebo 60 mg dvakrát denně (N=95 a N=93) nebo placebem (N=93) po dobu 8 týdnů.
Ve všech čtyřech studiích prokázala CYMBALTA 40 mg převahu nad placebem, jak bylo měřeno zlepšením celkového skóre 17-položkové Hamiltonovy stupnice pro hodnocení deprese (HAMD-17) (viz ). Neexistují žádné důkazy o tom, že by dávky vyšší než 60 mg/den přinášely další výhody.
Ve všech těchto klinických studiích analýzy vztahu mezi výsledkem léčby a věkem, pohlavím a rasou nenaznačovaly žádnou rozdílnou citlivost na základě těchto charakteristik pacientů.
Studie MDD-1 CYMBALTA (60 mg/den)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
Ve studii MDD-5 dostávalo 533 dospělých pacientů splňujících kritéria DSM-IV pro MDD přípravek CYMBALTA 60 mg jednou denně během úvodní 12týdenní otevřené léčebné fáze. Dvě stě sedmdesát osm pacientů, kteří reagovali na otevřenou léčbu [definováno jako splňující následující kritéria v týdnech 10 a 12: celkové skóre HAMD-17 ≤9, klinické globální dojmy závažnosti (CGI-S) ≤2 a nikoli splňující kritéria DSM-IV pro MDD] byli náhodně přiřazeni k pokračování v léčbě přípravkem CYMBALTA ve stejné dávce (N=136) nebo k placebu (N=142) po dobu 6 měsíců.
Ve studii MDD-5 prodělali pacienti užívající přípravek CYMBALTA statisticky významně delší dobu do relapsu deprese než pacienti užívající placebo (viz Obrázek 1 ). Relaps byl definován jako zvýšení skóre CGI-S o ≥ 2 body ve srovnání se skórem získaným v týdnu 12, stejně jako splnění kritérií DSM-IV pro MDD při 2 po sobě jdoucích návštěvách s odstupem alespoň 2 týdnů, kdy 2 týdny časové kritérium muselo být splněno až při druhé návštěvě.
Obrázek 1: Kumulativní podíl dospělých pacientů s relapsem MDD (studie MDD-5)
Generalizovaná úzkostná porucha
Zkoušky GAD u dospělých (včetně geriatrických pacientů)
Účinnost přípravku CYMBALTA 20 mg v léčbě generalizované úzkostné poruchy (GAD) byla stanovena v 1 randomizované, dvojitě zaslepené, placebem kontrolované studii s fixní dávkou a 2 randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích s flexibilním dávkováním u dospělých ambulantních pacientů ve věku od 18 do 83 let splňující kritéria DSM-IV pro GAD (studie GAD-1, GAD-2, respektive GAD-3).
Ve studiích GAD-1 a GAD-2 byla počáteční dávka 60 mg jednou denně (z důvodů snášenlivosti byla povolena titrace směrem dolů na 30 mg jednou denně; dávka mohla být zvýšena na 60 mg jednou denně). Patnáct procent pacientů bylo titrováno dolů. Studie GAD-3 měla počáteční dávku 30 mg jednou denně po dobu 1 týdne, než byla zvýšena na 60 mg jednou denně.
Studie GAD-2 a GAD-3 zahrnovaly titraci dávky s dávkami přípravku CYMBALTA v rozmezí od 60 mg jednou denně do 120 mg jednou denně (N=168 a N=162) ve srovnání s placebem (N=159 a N=161) po dobu 10 týdenní léčebné období. Průměrná dávka pro pacienty, kteří dokončili léčbu, byla na konci těchto studií 104,8 mg/den. Studie GAD-1 hodnotila dávky CYMBALTY 60 mg 60 mg jednou denně (N=168) a 120 mg jednou denně (N=170) ve srovnání s placebem (N=175) po dobu 9 týdnů léčby. I když se ukázalo, že dávka 120 mg/den je účinná, neexistuje žádný důkaz, že dávky vyšší než 60 mg/den přinášejí další přínos.
Ve všech 3 studiích prokázala CYMBALTA převahu nad placebem, jak bylo měřeno větším zlepšením celkového skóre Hamiltonovy škály úzkosti (HAM-A) (viz ) a celkového skóre funkčního poškození podle Sheehanovy škály disability (SDS). SDS je složené měření míry, do jaké emoční symptomy narušují fungování pacienta ve 3 životních oblastech: práce/škola, společenský život/volnočasové aktivity a rodinný život/domácí povinnosti.
Ve studii GAD-4 dostávalo 887 pacientů splňujících kritéria DSM-IV-TR pro GAD přípravek CYMBALTA 60 mg až 120 mg jednou denně během úvodní 26týdenní otevřené léčebné fáze. Čtyři sta dvacet devět pacientů, kteří reagovali na otevřenou léčbu [definováno jako splňující následující kritéria ve 24. a 26. týdnu: snížení celkového skóre HAM-A od výchozího stavu alespoň o 50 % na skóre ne vyšší než 11 a skóre klinického globálního dojmu zlepšení (CGI-Improvement) 1 nebo 2] byli náhodně přiřazeni k pokračování v léčbě přípravkem CYMBALTA 30 mg ve stejné dávce (N=216) nebo k placebu (N=213) a byli pozorováni kvůli relapsu. Z randomizovaných pacientů bylo 73 % ve stavu respondéru po dobu alespoň 10 týdnů. Relaps byl definován jako zvýšení skóre CGI-Severity alespoň o 2 body na skóre ≥4 a MINI (Mini-International Neuropsychiatric Interview) diagnóza GAD (kromě trvání) nebo přerušení léčby z důvodu nedostatečné účinnosti. U pacientů užívajících přípravek CYMBALTA byla statisticky významně delší doba do relapsu GAD než u pacientů užívajících placebo (viz Obrázek 2 ).
Analýzy podskupin nenaznačily, že by existovaly nějaké rozdíly ve výsledcích léčby jako funkce věku nebo pohlaví.
GAD Trial u geriatrických pacientů
Účinnost přípravku CYMBALTA v léčbě pacientů ve věku ≥65 let s GAD byla stanovena v jedné 10týdenní randomizované, dvojitě zaslepené, placebem kontrolované studii s flexibilním dávkováním u dospělých ve věku ≥65 let splňujících kritéria DSM-IV pro GAD (studie GAD-5). Ve studii GAD-5 byla počáteční dávka 30 mg jednou denně po dobu 2 týdnů, než bylo povoleno další zvyšování dávky o 30 mg ve 2., 4. a 7. týdnu léčby až na 120 mg jednou denně na základě posouzení klinické odpovědi a snášenlivost. Průměrná dávka pro pacienty, kteří dokončili 10týdenní akutní fázi léčby, byla 51 mg. Pacienti léčení přípravkem CYMBALTA (N=151) prokázali signifikantně větší zlepšení ve srovnání s placebem (N=140) v průměrné změně od výchozí hodnoty k cílovému bodu, měřeno celkovým skóre HAM-A (viz ).
GAD Trial u pediatrických pacientů ve věku 7 až 17 let
Účinnost přípravku CYMBALTA v léčbě dětských pacientů ve věku 7 až 17 let s GAD byla stanovena v 1 randomizované, dvojitě zaslepené, placebem kontrolované studii s flexibilním dávkováním u pediatrických ambulantních pacientů s GAD (na základě kritérií DSM-IV) (studie GAD-6).
Ve studii GAD-6 byla počáteční dávka 30 mg jednou denně po dobu 2 týdnů. Další zvýšení dávky o 30 mg až na 120 mg jednou denně bylo povoleno na základě posouzení klinické odpovědi a snášenlivosti zkoušejícího. Průměrná dávka pro pacienty, kteří dokončili 10týdenní léčebnou fázi, byla 57,6 mg/den. V této studii CYMBALTA (N=135) prokázala převahu nad placebem (N=137) od výchozího k cílovému bodu, jak bylo měřeno větším zlepšením v Pediatric Anxiety Rating Scale (PARS) pro skóre závažnosti GAD (viz ).
Obrázek 2: Kumulativní podíl dospělých pacientů s relapsem GAD (studie GAD-4)
Diabetická periferní neuropatická bolest u dospělých
Účinnost přípravku CYMBALTA 30 mg při léčbě neuropatické bolesti spojené s diabetickou periferní neuropatií u dospělých byla stanovena ve 2 randomizovaných, 12týdenních, dvojitě zaslepených, placebem kontrolovaných studiích s fixní dávkou u dospělých pacientů s diabetickou periferní neuropatickou bolestí (DPNP ) po dobu alespoň 6 měsíců (studie DPNP-1 a studie DPNP-2). Do těchto studií bylo zařazeno celkem 791 pacientů, z nichž 592 (75 %) studie dokončilo. Zařazení pacienti měli diabetes mellitus I. nebo II. typu s diagnózou bolestivé distální symetrické senzomotorické polyneuropatie po dobu nejméně 6 měsíců. Pacienti měli výchozí skóre bolesti ≥4 na 11bodové škále v rozmezí od 0 (žádná bolest) do 10 (nejhorší možná bolest). Kromě CYMBALTY bylo pacientům povoleno až 4 gramy acetaminofenu denně podle potřeby proti bolesti. Pacienti zaznamenávali svou bolest denně do deníku.
Obě studie porovnávaly přípravek CYMBALTA 60 mg jednou denně nebo 60 mg dvakrát denně s placebem. Studie DPNP-1 navíc porovnávala přípravek CYMBALTA 20 mg s placebem. Celkem 457 pacientů (342 CYMBALTA, 115 placebo) bylo zařazeno do studie DPNP-1 a celkem 334 pacientů (226 CYMBALTA, 108 placebo) bylo zařazeno do studie DPNP-2.
Léčba přípravkem CYMBALTA 60 mg jednou nebo dvakrát denně statisticky významně zlepšila koncové průměrné skóre bolesti oproti výchozí hodnotě a zvýšila podíl pacientů s alespoň 50% snížením skóre bolesti oproti výchozí hodnotě. Pro různé stupně zlepšení bolesti od výchozího stavu k cíli studie ukazují obrázky 3 a 4 podíl pacientů, kteří dosáhli tohoto stupně zlepšení ve studiích DPNP-1 a DPNP-2, v daném pořadí. Údaje jsou kumulativní, takže pacienti, jejichž změna oproti výchozí hodnotě je například 50 %, jsou také zahrnuti na každé úrovni zlepšení pod 50 %. Pacientům, kteří studii nedokončili, bylo přiřazeno 0% zlepšení. Někteří pacienti zaznamenali snížení bolesti již v 1. týdnu, které přetrvávalo po celou dobu studie.
Obrázek 3: Procento dospělých pacientů s DPNP, kteří dosáhli různých úrovní úlevy od bolesti, měřeno průměrnou 24hodinovou intenzitou bolesti (studie DPNP-1)
Obrázek 4: Procento dospělých pacientů s DPNP, kteří dosáhli různých úrovní úlevy od bolesti, měřeno průměrnou 24hodinovou intenzitou bolesti (studie DPNP-2)
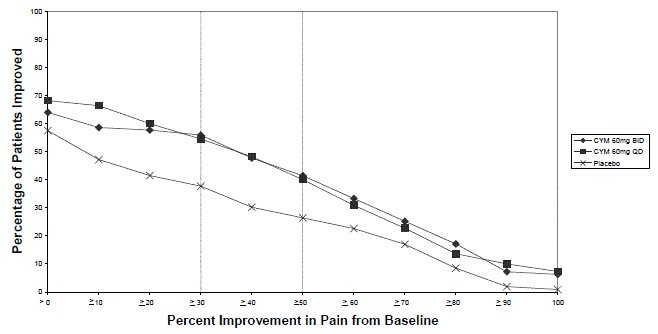
Fibromyalgie
Dospělé studie fibromyalgie
Účinnost přípravku CYMBALTA pro léčbu fibromyalgie u dospělých byla stanovena ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích s fixní dávkou u dospělých pacientů splňujících kritéria American College of Rheumatology pro fibromyalgii (anamnéza rozšířené bolesti po dobu 3 měsíců a bolest přítomná na 11 nebo více z 18 specifických citlivých míst). Studie FM-1 trvala tři měsíce a zahrnovala pouze pacientky. Studie FM-2 trvala šest měsíců a zahrnovala pacienty mužského i ženského pohlaví. Přibližně 25 % účastníků mělo komorbidní diagnózu MDD. Do studií FM1 a FM-2 bylo zařazeno celkem 874 pacientů, z nichž 541 (62 %) studie dokončilo. Celkem 354 pacientů (234 CYMBALTA 40 mg, 120 placebo) bylo zařazeno do studie FM-1 a celkem 520 pacientů (376 CYMBALTA, 144 placebo) bylo zařazeno do studie FM-2 (5 % mužů, 95 % žen). Pacienti měli výchozí skóre bolesti 6,5 na 11bodové škále v rozmezí od 0 (žádná bolest) do 10 (horší možná bolest).
Studie FM-1 a FM-2 porovnávaly přípravek CYMBALTA 60 mg jednou denně nebo 120 mg denně (podávané v rozdělených dávkách ve studii FM-1 a jako jedna denní dávka ve studii FM-2) s placebem. Studie FM-2 navíc porovnávala přípravek CYMBALTA 20 mg s placebem během prvních tří měsíců šestiměsíční studie.
Léčba přípravkem CYMBALTA 60 mg nebo 120 mg denně statisticky významně zlepšila koncové průměrné skóre bolesti oproti výchozí hodnotě a zvýšila podíl pacientů s alespoň 50% snížením skóre bolesti oproti výchozí hodnotě. Snížení bolesti bylo pozorováno u pacientů s komorbidní MDD i bez ní. Stupeň zmírnění bolesti však může být větší u pacientů s komorbidní MDD. Pro různé stupně zlepšení bolesti od výchozího stavu do koncového bodu studie ukazují obrázky 5 a 6 podíl pacientů, kteří dosáhli tohoto stupně zlepšení ve studiích FM-1 a FM-2, v daném pořadí. Údaje jsou kumulativní, takže pacienti, jejichž změna oproti výchozí hodnotě je například 50 %, jsou také zahrnuti na každé úrovni zlepšení pod 50 %. Pacientům, kteří studii nedokončili, bylo přiřazeno 0% zlepšení. Někteří pacienti zaznamenali snížení bolesti již v 1. týdnu, které přetrvávalo po celou dobu studie. Zlepšení bylo také prokázáno na měření funkce (Fibromyalgia Impact Questionnaires) a celkového dojmu změny pacienta (PGI). Žádná ze studií neprokázala přínos 120 mg ve srovnání s 60 mg a vyšší dávka byla spojena s větším počtem nežádoucích účinků a předčasným přerušením léčby.
Obrázek 5: Procento dospělých pacientů s fibromyalgií, kteří dosáhli různých úrovní úlevy od bolesti na konci studie, měřeno 24hodinovou průměrnou závažností bolesti (studie FM-1)

Obrázek 6: Procento dospělých pacientů s fibromyalgií, kteří dosáhli různých úrovní úlevy od bolesti na konci studie, měřeno průměrnou 24hodinovou závažností bolesti (studie FM-2)
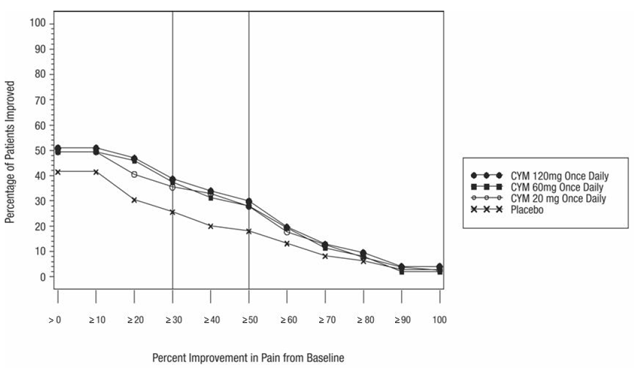
Kromě toho byl v samostatné studii (studie FM-3) hodnocen přínos titrace směrem nahoru u pacientů, kteří nereagovali na léčbu přípravkem CYMBALTA v dávce 60 mg/den. Dospělí pacienti byli zpočátku léčeni přípravkem CYMBALTA 60 mg jednou denně po dobu osmi týdnů otevřeným způsobem. Následně byli pacienti, kteří dokončili tuto fázi, randomizováni k dvojitě zaslepené léčbě přípravkem CYMBALTA v dávce 60 mg jednou denně nebo 120 mg jednou denně. Respondenti byli definováni jako pacienti, kteří měli alespoň 30% snížení skóre bolesti oproti výchozí hodnotě na konci 8týdenní léčby. U pacientů, kteří po 8 týdnech nereagovali, nebyla pravděpodobnější, že splní kritéria odpovědi na konci 60. týdne léčby, pokud byli titrováni naslepo na CYMBALTA 120 mg, ve srovnání s těmi, kteří slepě pokračovali v CYMBALTĚ 60 mg.
Pediatrický pokus s fibromyalgií
Přípravek CYMBALTA byl zkoumán u 184 dětských pacientů ve věku 13 až 17 let se syndromem juvenilní fibromyalgie ve 13týdenní placebem kontrolované studii (studie FM-4). Ve studii FM-4 dokončilo studii 149 (81 %) pacientů. Léčba přípravkem CYMBALTA (N=91) byla zahájena dávkou 30 mg jednou denně po dobu jednoho týdne a titrována na 60 mg jednou denně po dobu 12 týdnů podle tolerance. Průměrná dávka pro pacienty, kteří dokončili 12týdenní léčebnou fázi, byla 49 mg/den. CYMBALTA prokázala zlepšení oproti placebu v primárním koncovém bodě [změna od výchozího stavu k ukončení léčby v přehledu Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24hodinové průměrné hodnocení závažnosti bolesti] s hodnotou p 0,052 od předem specifikovanou primární analýzu a p-hodnoty v rozmezí 0,011-0,020 z analýz citlivosti, které přiřazovaly výchozí hodnoty chybějícím hodnocením některých pacientů, kteří z různých důvodů studii nedokončili. Pacienti měli výchozí hodnotu BPI 5,7. Pro různé stupně zlepšení bolesti od výchozího stavu do koncového bodu studie ukazuje obrázek 7 podíl pacientů, kteří dosáhli tohoto stupně zlepšení ve studii FM-4.
Obrázek 7: Procento dětských pacientů ve věku 13 až 17 let se syndromem juvenilní fibromyalgie, kteří dosáhli různých úrovní úlevy od bolesti v týdnu 12 (studie FM-4)a
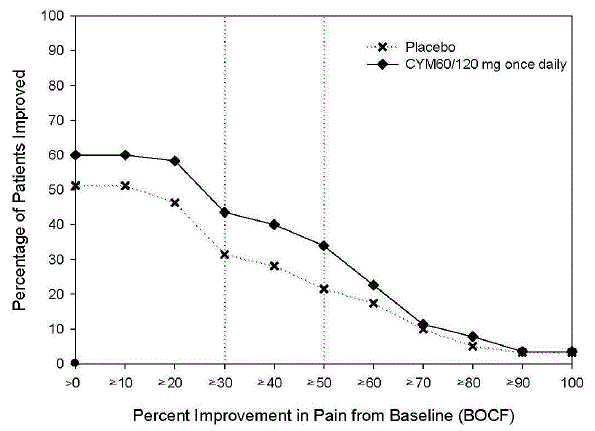
Chronická muskuloskeletální bolest u dospělých
CYMBALTA je indikována k léčbě chronické muskuloskeletální bolesti u dospělých. To bylo prokázáno ve studiích u dospělých pacientů s chronickou bolestí dolní části zad a chronickou bolestí způsobenou osteoartrózou.
Pokusy o chronické bolesti dolní části zad u dospělých
Účinnost přípravku CYMBALTA 60 mg u chronické bolesti dolní části zad (CLBP) u dospělých byla hodnocena ve dvou dvojitě zaslepených, placebem kontrolovaných, randomizovaných klinických studiích trvajících 13 týdnů (studie CLBP-1 a CLBP-2) a jedné z 12 -týdenní trvání (CLBP-3). Studie CLBP-1 a CLBP-3 prokázaly účinnost přípravku CYMBALTA v léčbě CLBP. Pacienti ve všech studiích neměli žádné známky radikulopatie nebo spinální stenózy.
Studie CLBP-1
Bylo zařazeno 236 dospělých pacientů (N=115 na CYMBALTĚ 40 mg, N=121 na placebu) a 182 (77%) dokončilo 13týdenní léčebnou fázi. Po 7 týdnech léčby byla u pacientů léčených přípravkem CYMBALTA s méně než 30% snížením průměrné denní bolesti a kteří byli schopni tolerovat dávku 60 mg jednou denně, dvojitě zaslepeným způsobem zvýšena dávka přípravku CYMBALTA na 120 mg jednou denně. zbytek soudu. Pacienti měli průměrné základní hodnocení bolesti 6 na numerické hodnotící stupnici v rozmezí od 0 (žádná bolest) do 10 (nejhorší možná bolest). Po 13 týdnech léčby měli pacienti užívající přípravek CYMBALTA 60-120 mg denně významně větší zmírnění bolesti ve srovnání s pacienty užívajícími placebo. Randomizace byla stratifikována podle výchozího stavu užívání NSAID pacientů. Analýzy podskupin nenaznačily, že by existovaly rozdíly ve výsledcích léčby jako funkce užívání NSAID.
Studie CLBP-2
Čtyři sta čtyři pacientů bylo randomizováno tak, aby dostávali fixní dávky CYMBALTY 60 mg denně nebo odpovídající placebo (N=59 u CYMBALTY 20 mg, N=116 u CYMBALTY 60 mg, N=112 u CYMBALTY 120 mg, N=117 u placeba) a 267 (66 %) dokončilo celou 13týdenní studii. Po 13 týdnech léčby žádná ze tří dávek CYMBALTY 30 mg nevykázala statisticky významný rozdíl ve snížení bolesti ve srovnání s placebem.
Studie CLBP-3
Čtyři sta jedna pacientů bylo randomizováno k podávání fixních dávek přípravku CYMBALTA 60 mg denně nebo placeba (N=198 na přípravku CYMBALTA 20 mg, N=203 na placebu) a 303 (76 %) dokončilo studii. Pacienti měli průměrné základní hodnocení bolesti 6 na numerické hodnotící stupnici v rozmezí od 0 (žádná bolest) do 10 (nejhorší možná bolest). Po 12 týdnech léčby měli pacienti užívající CYMBALTA 60 mg denně významně větší zmírnění bolesti ve srovnání s pacienty užívajícími placebo.
Pro různé stupně zlepšení bolesti od výchozího stavu do koncového bodu studie ukazují obrázky 8 a 9 podíl pacientů ve studiích CLBP-1 a CLBP-3, kteří dosáhli tohoto stupně zlepšení. Údaje jsou kumulativní, takže pacienti, jejichž změna oproti výchozí hodnotě je například 50 %, jsou také zahrnuti na každé úrovni zlepšení pod 50 %. Pacientům, kteří studii nedokončili, byla přiřazena hodnota 0% zlepšení.
Obrázek 8: Procento dospělých pacientů s CLBP, kteří dosáhli různých úrovní úlevy od bolesti, měřeno průměrnou závažností bolesti za 24 hodin (studie CLBP-1)
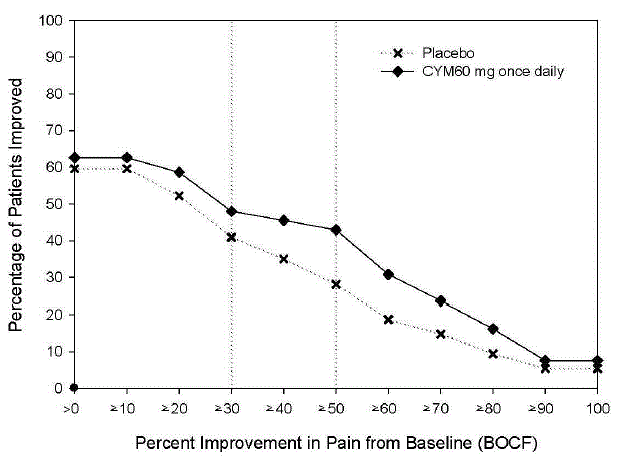
Obrázek 9: Procento dospělých pacientů s CLBP, kteří dosáhli různých úrovní úlevy od bolesti, měřeno průměrnou závažností bolesti za 24 hodin (studie CLBP-3)
Pokusy o chronické bolesti způsobené osteoartrózou u dospělých
Účinnost přípravku CYMBALTA u chronické bolesti způsobené osteoartrózou (OA) u dospělých byla hodnocena ve 2 dvojitě zaslepených, placebem kontrolovaných, randomizovaných klinických studiích trvajících 13 týdnů (studie OA-1 a studie OA-2). Všichni pacienti v obou studiích splnili ACR klinická a rentgenová kritéria pro klasifikaci idiopatické OA kolena. Randomizace byla stratifikována podle výchozího stavu užívání NSAID pacientů.
Pacienti zařazení do CYMBALTY zahájili léčbu v obou studiích dávkou 30 mg jednou denně po dobu jednoho týdne. Po prvním týdnu byla dávka přípravku CYMBALTA zvýšena na 60 mg jednou denně. Po 7 týdnech léčby přípravkem CYMBALTA 60 mg jednou denně byla ve studii OA-1 pacientům se suboptimální odpovědí na léčbu (
Studie OA-1
Bylo zařazeno 256 pacientů (N=128 na CYMBALTA 30 mg, N=128 na placebu) a 204 (80%) dokončilo studii. Pacienti měli průměrné základní hodnocení bolesti 6 na numerické hodnotící stupnici v rozmezí od 0 (žádná bolest) do 10 (nejhorší možná bolest). Po 13 týdnech léčby měli pacienti užívající přípravek CYMBALTA 20 mg významně větší zmírnění bolesti než pacienti užívající placebo. Analýzy podskupin nenaznačily, že by existovaly rozdíly ve výsledcích léčby jako funkce užívání NSAID.
Studie OA-2
Bylo zařazeno 231 pacientů (N=111 na CYMBALTA 30 mg, N=120 na placebu) a 173 (75%) dokončilo studii. Pacienti měli průměrnou výchozí bolest 6 na numerické hodnotící stupnici v rozmezí od 0 (žádná bolest) do 10 (nejhorší možná bolest). Po 13 týdnech léčby nevykázali pacienti užívající přípravek CYMBALTA 20 mg významně větší zmírnění bolesti než pacienti užívající placebo.
Ve studii OA-1 ukazuje obrázek 10 pro různé stupně zlepšení bolesti od výchozího stavu do cíle studie podíl pacientů, kteří dosáhli tohoto stupně zlepšení. Číslo je kumulativní, takže pacienti, jejichž změna oproti výchozí hodnotě je například 50 %, jsou rovněž zahrnuti při každé úrovni zlepšení pod 50 %. Pacientům, kteří studii nedokončili, byla přiřazena hodnota 0% zlepšení.
Obrázek 10: Procento dospělých pacientů s OA, kteří dosáhli různých úrovní úlevy od bolesti, měřeno průměrnou 24hodinovou závažností bolesti (studie OA-1)
INFORMACE PRO PACIENTA
Cymbalta® [sim-BALL-tah] (duloxetin tobolky s opožděným uvolňováním)
Než začnete užívat Cymbalta® a pokaždé, když dostanete náhradní náplň, přečtěte si tuto příručku k lékům. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě.
Promluvte si se svým poskytovatelem zdravotní péče o:
- všechna rizika a přínosy léčby antidepresivy
- všechny možnosti léčby deprese nebo jiné vážné duševní choroby
Jaké jsou nejdůležitější informace, které bych měl vědět o antidepresivech, depresi, jiných vážných duševních chorobách a sebevražedných myšlenkách nebo činech?
- Věnujte zvýšenou pozornost všem změnám nálady, chování, jednání, myšlenek nebo pocitů, zejména náhlým změnám. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte svému poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče podle plánu. Zavolejte svého poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků nebo pocitů, zvláště pokud jsou nové, horší nebo vás znepokojují. V případě nouze volejte 911.
- pokusy o sebevraždu
- působící na nebezpečné impulsy
- chovat se agresivně, být naštvaný nebo násilný
- myšlenky na sebevraždu nebo smrt
- nová nebo horší deprese
- nová nebo horší úzkost
- panický záchvat
- pocit velkého rozrušení nebo neklidu
- nová nebo horší podrážděnost
- problémové spaní
- extrémní zvýšení aktivity nebo mluvení (mánie)
- jiné neobvyklé změny v chování nebo náladě
Co dalšího potřebuji vědět o antidepresivech?
- Nikdy nevysazujte antidepresivum, aniž byste si nejprve promluvili s poskytovatelem zdravotní péče. Náhlé zastavení antidepresiv může způsobit další příznaky.
- Antidepresiva jsou léky používané k léčbě deprese a jiných onemocnění. Je důležité prodiskutovat všechna rizika léčby deprese a také rizika její neléčení. Pacienti by měli se svým poskytovatelem zdravotní péče prodiskutovat všechny možnosti léčby, nejen použití antidepresiv.
- Antidepresiva mají další vedlejší účinky. Poraďte se se svým poskytovatelem zdravotní péče o vedlejších účincích léku předepsaného vám nebo vašemu rodinnému příslušníkovi.
- Antidepresiva mohou interagovat s jinými léky. Znát všechny léky, které užíváte vy nebo váš rodinný příslušník. Uchovávejte si seznam všech léků, abyste je mohli ukázat svému poskytovateli zdravotní péče. Nezačínejte s novými léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
Co je Cymbalta 60 mg?
Cymbalta je lék na předpis, který se používá k léčbě určitého typu deprese nazývané MajorDepressive Disorder (MDD). Cymbalta 20 mg patří do třídy léků známých jako SNRI (inhibitory zpětného vychytávání orerotoninu-norepinefrinu).
Cymbalta 60 mg se také používá k léčbě nebo léčbě:
- Generalizovaná úzkostná porucha (GAD)
- Diabetická periferní neuropatická bolest (DPNP)
- fibromyalgie (FM)
- Chronická muskuloskeletální bolest
Kdo by neměl užívat přípravek Cymbalta?
Neužívejte přípravek Cymbalta 20 mg, jestliže:
- užívat inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu nebo nitrožilní methylenové modři.
- Neužívejte IMAO do 5 dnů od ukončení užívání Cymbalty, pokud vám to nenařídí váš poskytovatel zdravotní péče.
- Nezačínejte léčbu přípravkem Cymbalta, pokud jste přestali užívat některý IMAO v posledních 14 dnech, pokud vám to nenařídí váš poskytovatel zdravotní péče.
Lidé, kteří užívají přípravek Cymbalta 60 mg těsně před IMAO, mohou mít vážný problém nazývaný serotoninový syndrom (viz „Jaké jsou možné vedlejší účinky přípravku Cymbalta 60 mg?“).
Co bych měl říci svému poskytovateli zdravotní péče, než začnu užívat přípravek Cymbalta?
Před zahájením léčby přípravkem Cymbalta informujte svého poskytovatele zdravotní péče, pokud:
- máte problémy se srdcem nebo vysoký krevní tlak
- máte cukrovku (léčba přípravkem Cymbalta 40 mg ztěžuje některým lidem s cukrovkou kontrolu hladiny cukru v krvi)
- mít problémy s játry
- mít problémy s ledvinami
- mít glaukom
- máte nebo jste měli záchvaty nebo křeče
- trpíte bipolární poruchou nebo mánií
- máte nízké hladiny sodíku v krvi
- mají opožděné vyprazdňování žaludku
- máte nebo jste měli problémy s krvácením
- jste těhotná nebo plánujete otěhotnět. Cymbalta může poškodit vaše nenarozené dítě. Poraďte se se svým poskytovatelem zdravotní péče o riziku pro vaše nenarozené dítě, pokud užíváte přípravek Cymbalta během těhotenství.
- Okamžitě informujte svého poskytovatele zdravotní péče, pokud během léčby přípravkem Cymbalta otěhotníte nebo si myslíte, že jste těhotná.
- Pokud otěhotníte během užívání přípravku Cymbalta 30 mg, poraďte se se svým poskytovatelem zdravotní péče o registraci v registru těhotenství Cymbalta. Můžete se zaregistrovat na telefonním čísle 1-866-8146975 nebo na adrese www.cymbalta 40mgpregnancyregistry.com. Účelem tohoto registru je sledovat výsledky těhotenství u žen, které byly léčeny přípravkem Cymbalta kdykoli během těhotenství.
- kojíte nebo plánujete kojit. Cymbalta přechází do vašeho mateřského mléka a může poškodit vaše dítě. Poraďte se se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během užívání přípravku Cymbalta.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Cymbalta a některé léky se mohou vzájemně ovlivňovat, nemusí stejně dobře působit nebo mohou způsobit závažné nežádoucí účinky.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- triptany používané k léčbě migrény
- léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně tricyklických látek, lithia, buspironu, SSRI, SNRI nebo IMAO
- tramadol a fentanyl
- amfetaminy
- cimetidin
- antibiotika ciprofloxacin, enoxacin
- léky k léčbě nepravidelné srdeční frekvence (jako je propafenon, flekainid, chinidin)
- theofylin
- lék na ředění krve warfarin (Coumadin, Jantoven)
- nesteroidní protizánětlivé léky (NSAID) (jako ibuprofen, naproxen nebo aspirin).
- volně prodejné doplňky stravy, jako je tryptofan nebo třezalka tečkovaná
- thioridazin (Mellaril). Mellaril spolu s přípravkem Cymbalta může způsobit vážné problémy se srdečním rytmem nebo náhlou smrt.
Pokud si nejste jisti, požádejte svého poskytovatele zdravotní péče o seznam těchto léků.
Neužívejte přípravek Cymbalta s žádným jiným lékem, který obsahuje duloxetin.
Jak mám užívat přípravek Cymbalta 60 mg?
- Užívejte přípravek Cymbalta přesně podle pokynů svého poskytovatele zdravotní péče. Váš poskytovatel zdravotní péče možná bude muset změnit dávku přípravku Cymbalta 20 mg, dokud pro vás nebude správná dávka.
- Cymbaltu spolkněte celou. Cymbaltu nežvýkejte ani nedrťte.
- Neotvírejte kapsli a nesypte na jídlo nebo nemíchejte s tekutinami. Otevření tobolky může ovlivnit, jak dobře Cymbalta účinkuje.
- Cymbalta lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku přípravku Cymbalta 30 mg, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku Cymbalta 30 mg ve stejnou dobu.
- Pokud užijete příliš mnoho přípravku Cymbalta, okamžitě zavolejte svého poskytovatele zdravotní péče nebo centrum kontroly jedů na číslo 1800-222-1222 nebo vyhledejte pohotovostní léčbu.
- Při přechodu z jiného antidepresiva na přípravek Cymbalta může váš poskytovatel zdravotní péče nejprve snížit dávku původního antidepresiva, aby se potenciálně vyhnul nežádoucím účinkům.
Čemu se mám vyhnout při užívání Cymbalty?
- Cymbalta může způsobit ospalost nebo může ovlivnit vaši schopnost rozhodovat se, jasně myslet nebo rychle reagovat. Neměli byste řídit, obsluhovat těžké stroje nebo provádět jiné nebezpečné činnosti, dokud nezjistíte, jak na vás Cymbalta působí.
- Užívání přípravku Cymbalta současně s těžkým pitím alkoholu může být spojeno se závažným poškozením jater. Během užívání přípravku Cymbalta se vyvarujte nadměrné konzumaci alkoholu.
Jaké jsou možné vedlejší účinky přípravku Cymbalta?
Cymbalta 30 mg může způsobit závažné nežádoucí účinky, včetně: Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku Cymbalta?“
Časté možné nežádoucí účinky u lidí, kteří užívají přípravek Cymbalta 20 mg, zahrnují:
Příznaky u mužů mohou zahrnovat:
Příznaky u žen mohou zahrnovat:
Promluvte si se svým poskytovatelem zdravotní péče, pokud se u vás během léčby přípravkem CYMBALTA objeví nějaké změny ve vaší sexuální funkci nebo pokud máte nějaké otázky nebo obavy ohledně sexuálních problémů. Mohou existovat způsoby léčby, které vám může navrhnout váš poskytovatel zdravotní péče.
- svědění
- bolest v pravé horní části břicha
- tmavá moč
- žlutá kůže nebo oči
- zvětšená játra
- zvýšené jaterní enzymy
- zvýšit svůj krevní tlak.
- snížit krevní tlak ve stoje a způsobit závratě nebo mdloby, většinou při prvním zahájení léčby přípravkem Cymbalta nebo při zvýšení dávky.
- zvyšují riziko pádů, zejména u starších osob.
- neklid, halucinace, kóma nebo jiné změny duševního stavu
- problémy s koordinací nebo svalové záškuby (nadměrně aktivní reflexy)
- rychlý srdeční tep, vysoký nebo nízký krevní tlak
- pocení nebo horečka
- nevolnost, zvracení nebo průjem
- svalová ztuhlost
- závrať
- proplachování
- třes
- záchvaty
- úzkost
- podrážděnost
- pocit únavy nebo problémy se spánkem
- bolest hlavy
- pocení
- závrať
- pocity podobné elektrickému šoku
- zvracení nebo nevolnost
- průjem
- výrazně zvýšená energie
- vážné potíže se spánkem
- závodní myšlenky
- bezohledné chování
- neobvykle velkolepé nápady
- nadměrné štěstí nebo podrážděnost
- mluvit více nebo rychleji než obvykle
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
- bolest hlavy
- slabost nebo pocit nejistoty
- zmatenost, problémy se soustředěním nebo myšlením nebo problémy s pamětí
- zvýšený průtok moči
- není schopen vylučovat žádnou moč
- opožděná ejakulace nebo neschopnost ejakulace
- snížená chuť na sex
- problémy s dosažením nebo udržením erekce
- snížená chuť na sex
- opožděný orgasmus nebo neschopnost dosáhnout orgasmu
Mezi nejčastější nežádoucí účinky přípravku Cymbalta 20 mg patří:
- nevolnost
- suchá ústa
- ospalost
- únava
- zácpa
- ztráta chuti k jídlu
- zvýšené pocení
- závrať
Časté možné nežádoucí účinky u dětí a dospívajících užívajících přípravek Cymbalta 20 mg zahrnují:
- nevolnost
- snížená hmotnost
- závrať
Nežádoucí účinky u dospělých se mohou objevit také u dětí a dospívajících, kteří užívají přípravek Cymbalta. U dětí a dospívajících by měla být během léčby sledována výška a hmotnost.
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku Cymbalta. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit na 1800-FDA-1088.
Jak mám přípravek Cymbalta 40 mg uchovávat?
Skladujte Cymbalta při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte přípravek Cymbalta a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném užívání přípravku Cymbalta.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léčivy. Nepoužívejte přípravek Cymbalta pro stav, pro který nebyl předepsán. Nedávejte Cymbalta 20 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o Cymbaltě. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku Cymbalta, které jsou určeny pro zdravotnické pracovníky.
Pro více informací volejte 1-800-545-5979.
Jaké jsou složky přípravku Cymbalta 30 mg?
Účinná látka: duloxetin-hydrochlorid
Neaktivní složky:
FD&C Blue č. 2, želatina, hypromelóza, acetátsukcinát hydroxypropylmethylcelulózy, laurylsulfát sodný, sacharóza, kuličky cukru, mastek, oxid titaničitý a triethylcitrát. 20 a 60 mg tobolky také obsahují žlutý oxid železitý.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
