Remeron 15mg, 30mg Mirtazapine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co jsou Remeron a jak se používá?
Remeron je lék na předpis používaný k léčbě příznaků deprese. Remeron 30 mg lze užívat samostatně nebo s jinými léky.
Remeron patří do třídy léků nazývaných antidepresiva, alfa-2 antagonisté; Antidepresiva, jiné.
Není známo, zda je přípravek Remeron 30 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Remeron 30 mg?
Remeron může způsobit závažné nežádoucí účinky, včetně:
- pocit neklidu,
- závodní myšlenky,
- snížená potřeba spánku,
- neobvyklé rizikové chování,
- pocity extrémního štěstí nebo smutku,
- být hovornější než obvykle,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halo kolem světel,
- točení hlavy,
- horečka,
- zimnice,
- bolest krku,
- vředy v ústech,
- změny hmotnosti nebo chuti k jídlu,
- závažná vyrážka, puchýře nebo otoky na dlaních nebo ploskách nohou,
- křeče (záchvaty),
- bolest hlavy,
- zmatek,
- nezřetelná řeč,
- těžká slabost,
- zvracení,
- ztráta koordinace a
- pocit nejistoty
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Remeron patří:
- ospalost,
- závrať,
- podivné sny,
- suchá ústa,
- zácpa,
- zvýšená chuť k jídlu a
- přibývání na váze
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Remeron. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Sebevražednost a antidepresiva
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití tablet REMERON® (mirtazapin) nebo jakéhokoli jiného antidepresiva u dítěte, dospívajícího nebo mladého dospělého, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o nutnosti pečlivého pozorování a komunikace s předepisujícím lékařem. REMERON není pro nás schválen u dětských pacientů. (Viz VAROVÁNÍ: Klinické zhoršení a riziko sebevraždy, INFORMACE PRO PACIENTA a BEZPEČNOSTNÍ OPATŘENÍ: Pediatrické použití)
POPIS
Tablety REMERON® (mirtazapin) jsou perorálně podávané léčivo. Mirtazapin má tetracyklickou chemickou strukturu a patří do skupiny piperazinoazepinových sloučenin. Označuje se jako 1,2,3,4,10,14b-hexahydro-2-methylpyrazino[2,1-a]pyrido[2,3-c]benzazepin a má empirický vzorec C17H19N3. Jeho molekulová hmotnost je 265,36. Strukturní vzorec je následující a jedná se o racemickou směs:
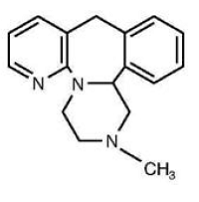
Mirtazapin je bílý až krémově bílý krystalický prášek, který je mírně rozpustný ve vodě.
REMERON se dodává k perorálnímu podání jako potahované tablety s rýhou obsahující 15 nebo 30 mg mirtazapinu a potahované tablety bez rýhy obsahující 45 mg mirtazapinu. Každá tableta také obsahuje kukuřičný škrob, hydroxypropylcelulózu, stearát hořečnatý, koloidní oxid křemičitý, laktózu a další neaktivní složky.
INDIKACE
REMERON (mirtazapin) Tablety jsou indikovány k léčbě velké depresivní poruchy.
Účinnost REMERONu v léčbě velké depresivní poruchy byla prokázána v 6týdenních kontrolovaných studiích u ambulantních pacientů, jejichž diagnózy nejvíce odpovídaly Diagnostickému a statistickému manuálu duševních poruch – 3. vydání (DSM-III) kategorie velké depresivní poruchy (viz KLINICKÁ FARMAKOLOGIE ).
Velká depresivní epizoda (DSM-IV) znamená výraznou a relativně přetrvávající (téměř každý den po dobu alespoň 2 týdnů) depresivní nebo dysforickou náladu, která obvykle narušuje každodenní fungování a zahrnuje alespoň 5 z následujících 9 příznaků: depresivní náladu, ztráta zájmu o obvyklé činnosti, významná změna hmotnosti a/nebo chuti k jídlu, nespavost nebo hypersomnie, psychomotorická agitace nebo retardace, zvýšená únava, pocity viny nebo bezcennosti, zpomalené myšlení nebo porucha koncentrace, pokus o sebevraždu nebo sebevražedné myšlenky.
Účinnost přípravku REMERON 15 mg u hospitalizovaných pacientů s depresí nebyla dostatečně studována.
placebem kontrolované studii byla prokázána účinnost přípravku REMERON 15 mg při udržení odpovědi u pacientů s velkou depresivní poruchou po dobu až 40 týdnů po 8 až 12 týdnech počáteční otevřené léčby. Přesto by měl lékař, který se rozhodne užívat REMERON 15 mg po delší dobu, pravidelně přehodnocovat dlouhodobou užitečnost léku pro jednotlivého pacienta (viz KLINICKÁ FARMAKOLOGIE ).
DÁVKOVÁNÍ A PODÁVÁNÍ
Počáteční léčba
Doporučená počáteční dávka pro tablety REMERON (mirtazapin) je 15 mg / den, podávaná v jedné dávce, nejlépe večer před spaním. V kontrolovaných klinických studiích stanovujících účinnost REMERONu v léčbě velké depresivní poruchy bylo rozmezí účinné dávky obecně 15 až 45 mg/den. Zatímco vztah mezi dávkou a uspokojivou odpovědí při léčbě velké depresivní poruchy pro REMERON 15 mg nebyl dostatečně prozkoumán, pacienti nereagující na počáteční 15 mg dávku mohou mít prospěch ze zvýšení dávky až na maximum 45 mg/den. REMERON má poločas eliminace přibližně 20 až 40 hodin; změny dávky by proto neměly být prováděny v intervalech kratších než 1 až 2 týdny, aby byl poskytnut dostatek času na vyhodnocení terapeutické odpovědi na danou dávku.
Starší pacienti a pacienti s poruchou ledvin nebo jater
Clearance mirtazapinu je snížena u starších pacientů a u pacientů se středně těžkou až těžkou poruchou funkce ledvin nebo jater. V důsledku toho by si předepisující lékař měl být vědom toho, že plazmatické hladiny mirtazapinu mohou být u těchto skupin pacientů zvýšeny ve srovnání s hladinami pozorovanými u mladších dospělých bez poškození ledvin nebo jater (viz OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ).
Údržba/rozšířená léčba
Je obecně dohodnuto, že akutní epizody deprese vyžadují několik měsíců nebo déle trvalé farmakologické terapie po reakci na akutní epizodu. Systematické hodnocení tablet REMERON (mirtazapin) prokázalo, že jeho účinnost u velké depresivní poruchy je udržována po dobu až 40 týdnů po 8 až 12 týdnech počáteční léčby v dávce 15 až 45 mg/den (viz KLINICKÁ FARMAKOLOGIE ). Na základě těchto omezených údajů není známo, zda dávka REMERON 30 mg potřebná pro udržovací léčbu je totožná s dávkou potřebnou k dosažení počáteční odpovědi. Pacienti by měli být pravidelně přehodnocováni, aby se určila potřeba udržovací léčby a vhodná dávka pro takovou léčbu.
Přechod pacienta na nebo z inhibitoru monoaminooxidázy (MAOI) určeného k léčbě psychiatrických poruch
Mezi vysazením IMAO určeného k léčbě psychiatrických poruch a zahájením léčby tabletami REMERON (mirtazapin) by mělo uplynout alespoň 14 dní. Naopak, po vysazení přípravku REMERON 30 mg by mělo uplynout alespoň 14 dní před zahájením IMAO určeného k léčbě psychiatrických poruch (viz KONTRAINDIKACE ).
Použití přípravku REMERON 15 mg s jinými IMAO, jako je linezolid nebo methylenová modř
Nezačínejte léčbu přípravkem REMERON 15 mg u pacienta, který je léčen linezolidem nebo intravenózní methylenovou modří, protože existuje zvýšené riziko serotoninového syndromu. U pacienta, který vyžaduje naléhavější léčbu psychiatrického stavu, je třeba zvážit další intervence, včetně hospitalizace (viz KONTRAINDIKACE ).
některých případech může pacient, který již dostává léčbu přípravkem REMERON 30 mg, vyžadovat urgentní léčbu linezolidem nebo intravenózní methylenovou modří. Pokud nejsou dostupné přijatelné alternativy k léčbě linezolidem nebo intravenózní metylenovou modří a potenciální přínosy linezolidu nebo intravenózní léčby methylenovou modří u konkrétního pacienta převažují nad riziky serotoninového syndromu, je třeba okamžitě ukončit podávání přípravku REMERON 30 mg a podávání linezolidu nebo intravenózního methylenu modrá může být podávána. Pacient by měl být sledován na příznaky serotoninového syndromu po dobu 2 týdnů nebo do 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři, podle toho, co nastane dříve. Léčba přípravkem REMERON 30 mg může být obnovena 24 hodin po poslední dávce linezolidu nebo intravenózní methylenové modři (viz VAROVÁNÍ ).
Riziko podávání methylenové modři neintravenózními cestami (jako jsou perorální tablety nebo lokální injekce) nebo v intravenózních dávkách mnohem nižších než 1 mg/kg u přípravku REMERON není jasné. Lékař by si však měl být vědom možnosti vzniku symptomů serotoninového syndromu při takovém použití (viz VAROVÁNÍ ).
Ukončení léčby REMERON
Byly hlášeny příznaky spojené s vysazením nebo snížením dávky přípravku REMERON 15 mg tablety. Pacienti by měli být sledováni, zda se u nich nevyskytují tyto a další příznaky při přerušení léčby nebo během snižování dávky. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky během několika týdnů než náhlé vysazení. Pokud se po snížení dávky nebo po přerušení léčby objeví netolerovatelné příznaky, je třeba titraci dávky řídit na základě klinické odpovědi pacienta (viz OPATŘENÍ a NEŽÁDOUCÍ REAKCE ).
Informace pro pacienty
Pacienti by měli být poučeni, že užívání REMERONu může způsobit mírnou dilataci zornic, která u citlivých jedinců může vést k epizodě glaukomu s uzavřeným úhlem. Preexistující glaukom je téměř vždy glaukom s otevřeným úhlem, protože glaukom s uzavřeným úhlem, pokud je diagnostikován, může být definitivně léčen iridektomií. Glaukom s otevřeným úhlem není rizikovým faktorem pro glaukom s uzavřeným úhlem. Pacienti si mohou přát, aby byli vyšetřeni, aby se zjistilo, zda jsou náchylní k uzavření úhlu, a pokud jsou citliví, mohou podstoupit profylaktický postup (např. iridektomie).
JAK DODÁVÁNO
REMERON (mirtazapin) tablety jsou dodávány jako:
15 mg tablety — oválné, rýhované, žluté, potažené, s vyraženým „Organon“ na jedné straně a „T3Z “ na druhé straně.
Láhve po 30 NDC 0052-0105-30
30 mg tablety — oválný, rýhovaný, červenohnědý, potažený, s vyraženým „Organon“ na jedné straně a „T5Z“ na druhé straně.
Láhve po 30 NDC 0052-0107-30
45 mg tablety — oválný, bílý, potažený, s vyraženým „Organon“ na jedné straně a „T7Z“ na druhé straně.
Láhve po 30 NDC 0052-0109-30
Úložný prostor
Skladujte při teplotě 20 °C až 25 °C (68 °F až 77 °F); povoleny výchylky do 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ]. Chraňte před světlem a vlhkostí.
Vyrobeno pro: Merck Sharp & Dohme Corp., dceřiná společnost Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Výrobce: NV Organon, Oss, Nizozemsko, dceřiná společnost Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Revize: červenec 2016
VEDLEJŠÍ EFEKTY
Souvisí s přerušením léčby
Přibližně 16 % ze 453 pacientů, kteří dostávali tablety REMERON (mirtazapin) v 6týdenních kontrolovaných klinických studiích v USA, přerušilo léčbu kvůli nežádoucí zkušenosti, ve srovnání se 7 % z 361 pacientů léčených placebem v těchto studiích. Nejčastější příhody (≥ 1 %) spojené s přerušením léčby a považované za související s lékem (tj. příhody spojené s předčasným ukončením léčby v míře alespoň dvojnásobné oproti placebu) jsou uvedeny v tabulce 2.
Běžně pozorované nežádoucí účinky v klinických studiích kontrolovaných v USA
Nejčastěji pozorované nežádoucí příhody spojené s užíváním tablet REMERON (mirtazapin) (výskyt 5 % nebo vyšší) a nepozorované s ekvivalentní incidencí u pacientů léčených placebem (výskyt REMERONu alespoň dvakrát vyšší než u placeba) jsou uvedeny v tabulce 3.
Nežádoucí účinky vyskytující se s výskytem 1 % nebo více mezi pacienty léčenými REMERONem
Tabulka 4 uvádí nežádoucí příhody, které se vyskytly s incidencí 1 % nebo více a byly častější než ve skupině s placebem, mezi pacienty léčenými tabletami REMERON (mirtazapin), kteří se účastnili krátkodobých placebem kontrolovaných studií v USA, ve kterých byli pacienti dávka v rozmezí 5 až 60 mg/den. Tato tabulka ukazuje procento pacientů v každé skupině, kteří měli alespoň 1 epizodu příhody v určitou dobu během léčby. Hlášené nežádoucí účinky byly klasifikovány pomocí standardní terminologie slovníku založeného na COSTART.
Předepisující lékař by si měl být vědom toho, že tyto údaje nelze použít k předpovědi výskytu nežádoucích účinků v průběhu obvyklé lékařské praxe, kde se charakteristiky pacienta a další faktory liší od těch, které převládaly v klinických studiích. Podobně nelze uvedené frekvence porovnávat s údaji získanými z jiných šetření zahrnujících různé způsoby léčby, použití a vyšetřovatele. Uvedené údaje však poskytují předepisujícímu lékaři určitý základ pro odhad relativního podílu léčivých a nelékových faktorů na míře výskytu vedlejších účinků ve studované populaci.
Změny EKG
Byly analyzovány elektrokardiogramy 338 pacientů, kteří dostávali tablety REMERON (mirtazapin) a 261 pacientů, kteří dostávali placebo v 6týdenních, placebem kontrolovaných studiích. Prodloužení QTc ≥ 500 ms nebylo u pacientů léčených mirtazapinem pozorováno; průměrná změna QTc byla +1,6 ms pro mirtazapin a - 3,1 ms pro placebo. Mirtazapin byl spojen s průměrným zvýšením srdeční frekvence o 3,4 tepů za minutu ve srovnání s 0,8 tepy za minutu u placeba. Klinický význam těchto změn není znám.
Účinek REMERONu (mirtazapin) na QTc interval byl hodnocen v klinické randomizované studii s placebem a pozitivní (moxifloxacin) kontrolami zahrnujícími 54 zdravých dobrovolníků pomocí analýzy odezvy na expozici. Tato studie prokázala pozitivní vztah mezi koncentracemi mirtazapinu a prodloužením QTc intervalu. Stupeň prodloužení QT pozorovaný u obou dávek 45 mg (terapeutické) a 75 mg (supraterapeutické) mirtazapinu však nebyl na úrovni obecně považované za klinicky významnou.
Další nežádoucí účinky pozorované během předmarketingového hodnocení přípravku REMERON
Během hodnocení před uvedením na trh byly v klinických studiích podávány opakované dávky tablet REMERON (mirtazapin) 2796 pacientům. Podmínky a trvání expozice mirtazapinu se velmi lišily a zahrnovaly (v překrývajících se kategoriích) otevřené a dvojitě zaslepené studie, nekontrolované a kontrolované studie, hospitalizované a ambulantní studie, studie s fixní dávkou a titrační studie. Nežádoucí události spojené s touto expozicí byly zaznamenány klinickými výzkumníky s použitím terminologie podle vlastního výběru. V důsledku toho není možné poskytnout smysluplný odhad podílu jedinců, u kterých se vyskytly nežádoucí příhody, aniž by se nejprve seskupily podobné typy nežádoucích příhod do menšího počtu standardizovaných kategorií příhod.
tabulkách, které následují, byly hlášené nežádoucí účinky klasifikovány pomocí standardní slovníkové terminologie založené na COSTART. Uvedené frekvence proto představují podíl z 2796 pacientů vystavených opakovaným dávkám přípravku REMERON, u kterých se příhoda uvedeného typu vyskytla alespoň jednou při užívání přípravku REMERON. Zahrnuty jsou všechny hlášené příhody kromě těch, které jsou již uvedeny v tabulce 4, těch nežádoucích příhod zahrnutých pod termíny COSTART, které jsou buď příliš obecné, nebo přehnaně specifické, aby byly neinformativní, a těch příhod, u nichž byla příčina drog velmi vzdálená.
Je důležité zdůraznit, že ačkoli se hlášené příhody vyskytly během léčby přípravkem REMERON 30 mg, nebyly nezbytně způsobeny.
Příhody jsou dále kategorizovány podle tělesného systému a uvedeny v pořadí klesající frekvence podle následujících definic: časté nežádoucí příhody jsou ty, které se vyskytují 1 nebo vícekrát u alespoň 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; vzácné příhody jsou ty, které se vyskytují u méně než 1/1000 pacientů. V tomto seznamu se objevují pouze ty události, které ještě nejsou uvedeny v tabulce 4. Události zásadního klinického významu jsou také popsány v částech VAROVÁNÍ a BEZPEČNOSTNÍ OPATŘENÍ.
Tělo jako celek: časté: malátnost, bolest břicha, akutní břišní syndrom; vzácné: zimnice, horečka, edém obličeje, vřed, fotosenzitivní reakce, ztuhlost krku, bolest šíje, zvětšené břicho; vzácné: celulitida, substernální bolest na hrudi.
Kardiovaskulární systém: časté: hypertenze, vazodilatace; méně časté: angina pectoris, infarkt myokardu, bradykardie, ventrikulární extrasystoly, synkopa, migréna, hypotenze; vzácné: síňová arytmie, bigeminie, vaskulární bolesti hlavy, plicní embolie, cerebrální ischemie, kardiomegalie, flebitida, levostranné srdeční selhání.
Zažívací ústrojí: časté: zvracení, anorexie; méně časté: říhání, glositida, cholecystitida, nauzea a zvracení, krvácení z dásní, stomatitida, kolitida, abnormální jaterní testy; vzácné: změna barvy jazyka, ulcerózní stomatitida, zvětšení slinných žláz, zvýšené slinění, střevní obstrukce, pankreatitida, aftózní stomatitida, cirhóza jater, gastritida, gastroenteritida, orální moniliáza, edém jazyka.
Endokrinní systém: vzácné: struma, hypotyreóza.
Hemický a lymfatický systém: vzácné: lymfadenopatie, leukopenie, petechie, anémie, trombocytopenie, lymfocytóza, pancytopenie.
Poruchy metabolismu a výživy: časté: žízeň; vzácné: dehydratace, ztráta hmotnosti; vzácné: dna, zvýšená SGOT, abnormální hojení, zvýšená kyselá fosfatáza, zvýšená SGPT, diabetes mellitus, hyponatremie.
Muskuloskeletální systém: časté: myastenie, artralgie; vzácné: artritida, tenosynovitida; vzácné: patologická zlomenina, zlomenina při osteoporóze, bolest kostí, myositida, ruptura šlachy, artróza, burzitida.
Nervový systém: časté: hypestezie, apatie, deprese, hypokineze, vertigo, záškuby, agitovanost, úzkost, amnézie, hyperkineze, parestézie; méně časté: ataxie, delirium, bludy, depersonalizace, dyskineze, extrapyramidový syndrom, zvýšené libido, abnormální koordinace, dysartrie, halucinace, manická reakce, neuróza, dystonie, hostilita, zvýšené reflexy, emoční labilita, euforie, paranoidní reakce; vzácné: afázie, nystagmus, akatizie (psychomotorický neklid), stupor, demence, diplopie, drogová závislost, paralýza, grand mal křeče, hypotonie, myoklonus, psychotická deprese, abstinenční syndrom, serotoninový syndrom.
Dýchací systém: časté: zvýšený kašel, sinusitida; méně časté: epistaxe, bronchitida, astma, pneumonie; vzácné: asfyxie, laryngitida, pneumotorax, škytavka.
Kůže a přílohy: časté: svědění, vyrážka; méně časté: akné, exfoliativní dermatitida, suchá kůže, herpes simplex, alopecie; vzácné: kopřivka, pásový opar, kožní hypertrofie, seborea, kožní vředy.
Speciální smysly: méně časté: bolest oka, abnormalita akomodace, konjunktivitida, hluchota, keratokonjunktivitida, porucha slzení, glaukom s uzavřeným úhlem, hyperakuzie, bolest ucha; vzácné: blefaritida, částečná přechodná hluchota, zánět středního ucha, ztráta chuti, parosmie.
Urogenitální systém: časté: infekce močových cest; méně časté: ledvinový kámen, cystitida, dysurie, inkontinence moči, retence moči, vaginitida, hematurie, bolest prsů, amenorea, dysmenorea, leukorea, impotence; vzácné: polyurie, uretritida, metroragie, menoragie, abnormální ejakulace, překrvení prsou, zvětšení prsou, nutkání na močení.
Další nežádoucí účinky pozorované během postmarketingového hodnocení přípravku REMERON
Nežádoucí příhody hlášené od uvedení na trh, které dočasně (ale ne nutně kauzálně) souvisely s léčbou mirtazapinem, zahrnují případy ventrikulární arytmie Torsades de Pointes. Ve většině těchto případů však byly implikovány souběžné léky. Byly také hlášeny případy závažných kožních reakcí, včetně Stevens-Johnsonova syndromu, bulózní dermatitidy, erythema multiforme a toxické epidermální nekrolýzy. Byly také hlášeny zvýšené hladiny kreatinkinázy v krvi a rhabdomyolýza.
Zneužívání drog a závislost
Třída kontrolovaných látek
REMERON (mirtazapin) Tablety nejsou kontrolovanou látkou.
Fyzická a psychická závislost
Tablety REMERON (mirtazapin) nebyly systematicky studovány u zvířat nebo lidí z hlediska jejich potenciálu pro zneužívání, toleranci nebo fyzickou závislost. I když klinické studie neodhalily žádnou tendenci k nějakému chování při vyhledávání drog, tato pozorování nebyla systematická a na základě těchto omezených zkušeností není možné předpovědět, do jaké míry bude léčivo působící na CNS zneužito, odkloněno a /nebo zneužity po uvedení na trh. V důsledku toho by pacienti měli být pečlivě vyšetřeni na anamnézu zneužívání drog a tito pacienti by měli být pečlivě sledováni, zda se u nich nevyskytují známky nesprávného užívání nebo zneužívání přípravku REMERON (např. rozvoj tolerance, zvyšování dávky, chování při vyhledávání drog).
DROGOVÉ INTERAKCE
Stejně jako u jiných léků existuje možnost interakce různými mechanismy (např. farmakodynamická, farmakokinetická inhibice nebo zesílení atd.) (viz. KLINICKÁ FARMAKOLOGIE ).
Inhibitory monoaminoxidázy
(Vidět KONTRAINDIKACE , VAROVÁNÍ , a DÁVKOVÁNÍ A PODÁVÁNÍ .)
Serotonergní léky
(Vidět KONTRAINDIKACE a VAROVÁNÍ .)
Léky ovlivňující jaterní metabolismus
Metabolismus a farmakokinetika tablet REMERON (mirtazapin) může být ovlivněna indukcí nebo inhibicí enzymů metabolizujících léky.
Léky, které jsou metabolizovány a/nebo inhibují enzymy cytochromu P450
Induktory CYP enzymů
(tyto studie používaly oba léky v ustáleném stavu)
fenytoin
U zdravých mužských pacientů (n=18) zvýšil fenytoin (200 mg denně) clearance mirtazapinu (30 mg denně) asi dvojnásobně, což vedlo ke snížení průměrných plazmatických koncentrací mirtazapinu o 45 %. Mirtazapin významně neovlivnil farmakokinetiku fenytoinu.
karbamazepin
U zdravých mužských pacientů (n=24) zvýšil karbamazepin (400 mg dvakrát denně) clearance mirtazapinu (15 mg dvakrát denně), což vedlo ke snížení průměrné plazmatické koncentrace mirtazapinu o 60 %.
Pokud je k léčbě mirtazapinem přidán fenytoin, karbamazepin nebo jiný induktor jaterního metabolismu (jako je rifampicin), může být nutné zvýšit dávku mirtazapinu. Pokud je léčba takovým léčivým přípravkem přerušena, může být nutné snížit dávku mirtazapinu.
Inhibitory enzymů CYP
Cimetidin
U zdravých mužských pacientů (n=12), kdy byl cimetidin, slabý inhibitor CYP1A2, CYP2D6 a CYP3A4, podávaný v dávce 800 mg dvakrát denně v rovnovážném stavu, podáván současně s mirtazapinem (30 mg denně) v rovnovážném stavu, byla oblast pod křivkou (AUC) mirtazapinu se zvýšil o více než 50 %. Mirtazapin nezpůsobil významné změny ve farmakokinetice cimetidinu. Dávku mirtazapinu může být nutné snížit, když je zahájena souběžná léčba cimetidinem, nebo zvýšit, když je léčba cimetidinem ukončena.
ketokonazol
zdravých, mužských, bělošských pacientů (n=24) zvýšilo současné podávání silného inhibitoru CYP3A4 ketokonazolu (200 mg dvakrát denně po dobu 6,5 dne) maximální plazmatické hladiny a AUC jednorázové dávky 30 mg mirtazapinu přibližně o 40 % a 50 %, resp.
Při současném podávání mirtazapinu se silnými inhibitory CYP3A4, inhibitory HIV proteázy, azolovými antimykotiky, erytromycinem nebo nefazodonem je třeba opatrnosti.
paroxetin
V interakční studii in vivo u zdravých pacientů s rychlým metabolizmem CYP2D6 (n=24) nezpůsobil mirtazapin (30 mg/den) v ustáleném stavu významné změny ve farmakokinetice paroxetinu v ustáleném stavu (40 mg/den), inhibitorem CYP2D6.
Jiné lékové interakce
amitriptylin
zdravých pacientů s rychlým metabolizmem CYP2D6 (n=32) amitriptylin (75 mg denně) v rovnovážném stavu nezpůsobil významné změny ve farmakokinetice mirtazapinu v rovnovážném stavu (30 mg denně); mirtazapin také nezpůsobil významné změny farmakokinetiky amitriptylinu.
Warfarin
U zdravých mužů (n=16) způsobil mirtazapin (30 mg denně) v rovnovážném stavu malé (0,2), ale statisticky významné zvýšení mezinárodního normalizovaného poměru (INR) u subjektů léčených warfarinem. Protože při vyšší dávce mirtazapinu nelze vyloučit výraznější účinek, je vhodné sledovat INR v případě současné léčby warfarinem s mirtazapinem.
Lithium
Při současné léčbě subterapeutickými hladinami lithia (600 mg/den po dobu 10 dnů) v rovnovážném stavu a jednorázovou dávkou 30 mg mirtazapinu nebyly u zdravých mužů pozorovány žádné relevantní klinické účinky nebo významné změny farmakokinetiky. Účinky vyšších dávek lithia na farmakokinetiku mirtazapinu nejsou známy.
Risperidon
V nerandomizované interakční studii in vivo u jedinců (n=6), kteří potřebovali léčbu antipsychotiky a antidepresivy, bylo prokázáno, že mirtazapin (30 mg denně) v rovnovážném stavu neovlivňuje farmakokinetiku risperidonu (až do 3 mg nabídka).
Alkohol
Současné podávání alkoholu (ekvivalent 60 g) mělo minimální vliv na plazmatické hladiny mirtazapinu (15 mg) u 6 zdravých mužů. Ukázalo se však, že poškození kognitivních a motorických dovedností způsobené přípravkem REMERON je aditivní s těmi, které způsobuje alkohol. V souladu s tím je třeba pacientům doporučit, aby se během užívání REMERONu vyhýbali alkoholu.
Diazepam
Současné podávání diazepamu (15 mg) mělo minimální vliv na plazmatické hladiny mirtazapinu (15 mg) u 12 zdravých subjektů. Bylo však prokázáno, že zhoršení motorických schopností způsobené přípravkem REMERON 30 mg je aditivní s poruchami způsobenými diazepamem. V souladu s tím je třeba pacientům doporučit, aby se během užívání přípravku REMERON vyhýbali diazepamu a jiným podobným lékům.
Léky prodlužující QTc
Riziko prodloužení QT intervalu a/nebo ventrikulárních arytmií (např. Torsades de Pointes) se může zvýšit při současném užívání léků prodlužujících QTc interval (např. některá antipsychotika a antibiotika) a v případě předávkování mirtazapinem (viz NEŽÁDOUCÍ REAKCE a PŘEDÁVKOVAT sekce).
VAROVÁNÍ
Klinické zhoršení a riziko sebevraždy
pacientů s velkou depresivní poruchou (MDD), dospělých i dětí, může dojít ke zhoršení jejich deprese a/nebo objevení se sebevražedných myšlenek a chování (suicidality) nebo neobvyklých změn v chování, ať už užívají antidepresiva či nikoli, a to riziko může přetrvávat, dokud nedojde k významné remisi. Sebevražda je známým rizikem deprese a některých dalších psychiatrických poruch a tyto poruchy samy o sobě jsou nejsilnějšími prediktory sebevraždy. Existuje však dlouhotrvající obava, že antidepresiva mohou hrát roli při navození zhoršení deprese a vzniku suicidality u některých pacientů během raných fází léčby. Souhrnné analýzy krátkodobých placebem kontrolovaných studií antidepresiv (SSRI a dalších) ukázaly, že tyto léky zvyšují riziko sebevražedného myšlení a chování (sebevražednost) u dětí, dospívajících a mladých dospělých (ve věku 18–24 let) s těžkou depresivní poruchou. poruchy (MDD) a další psychiatrické poruchy. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších.
Souhrnné analýzy placebem kontrolovaných studií u dětí a dospívajících s MDD, obsedantně kompulzivní poruchou (OCD) nebo jinými psychiatrickými poruchami zahrnovaly celkem 24 krátkodobých studií s 9 antidepresivy u více než 4400 pacientů. Souhrnné analýzy placebem kontrolovaných studií u dospělých s MDD nebo jinými psychiatrickými poruchami zahrnovaly celkem 295 krátkodobých studií (medián trvání 2 měsíce) s 11 antidepresivy u více než 77 000 pacientů. Mezi drogami existovaly značné rozdíly v riziku sebevraždy, ale téměř u všech zkoumaných drog byla tendence ke zvýšení počtu mladších pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku suicidality, s nejvyšší incidencí u MDD. Rozdíly v riziku (lék vs. placebo) však byly relativně stabilní v rámci věkových skupin a napříč indikacemi. Tyto rizikové rozdíly (rozdíl lék-placebo v počtu případů sebevraždy na 1000 léčených pacientů) jsou uvedeny v tabulce 1.
žádné z pediatrických studií nedošlo k žádné sebevraždě. Ve studiích s dospělými se vyskytly sebevraždy, ale počet nebyl dostatečný k tomu, aby se dospělo k nějakému závěru o účinku drogy na sebevraždu.
Není známo, zda se riziko sebevraždy rozšiřuje i na dlouhodobé užívání, tj. déle než několik měsíců. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s depresí, že užívání antidepresiv může oddálit recidivu deprese.
Všichni pacienti léčení antidepresivy pro jakoukoli indikaci by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality a neobvyklých změn v chování, zejména během prvních několika měsíců lékové terapie nebo v době změny dávky, buď zvýšení nebo klesá.
Následující příznaky, úzkost, agitovanost, záchvaty paniky, nespavost, podrážděnost, nepřátelství, agresivita, impulzivita, akatizie (psychomotorický neklid), hypománie a mánie, byly hlášeny také u dospělých a dětských pacientů léčených antidepresivy pro těžkou depresivní poruchu co se týče dalších indikací, psychiatrických i nepsychiatrických. Ačkoli příčinná souvislost mezi vznikem takových symptomů a buď zhoršením deprese a/nebo vznikem sebevražedných impulzů nebyla prokázána, existuje obava, že takové symptomy mohou představovat prekurzory objevující se sebevraždy.
Je třeba zvážit změnu terapeutického režimu, včetně možného přerušení léčby, u pacientů, jejichž deprese se trvale zhoršuje, nebo u kterých se objevuje náhlá sebevražda nebo symptomy, které mohou být předzvěstí zhoršení deprese nebo sebevražednosti, zvláště pokud jsou tyto příznaky závažné, náhlé na začátku nebo nebyly součástí symptomů pacienta.
Rodiny a ošetřovatelé pacientů léčených antidepresivy pro těžkou depresivní poruchu nebo jiné indikace, psychiatrické i nepsychiatrické, by měli být upozorněni na nutnost sledovat pacienty, zda se u nich neobjeví agitovanost, podrážděnost, neobvyklé změny v chování a další příznaky popsané výše. , stejně jako vznik sebevraždy, a takové příznaky okamžitě hlásit poskytovatelům zdravotní péče . Takové sledování by mělo zahrnovat každodenní pozorování ze strany rodin a pečovatelů. Předpisy pro REMERON (mirtazapin) Tablety by měly být napsány pro nejmenší množství tablet v souladu s dobrou léčbou pacienta, aby se snížilo riziko předávkování.
Screening pacientů na bipolární poruchu
Velká depresivní epizoda může být počátečním projevem bipolární poruchy. Obecně se má za to (ačkoli to nebylo prokázáno v kontrolovaných studiích), že léčba takové epizody samotným antidepresivem může zvýšit pravděpodobnost precipitace smíšené/manické epizody u pacientů s rizikem bipolární poruchy. Není známo, zda některý z výše popsaných příznaků představuje takovou konverzi. Před zahájením léčby antidepresivy by však pacienti s depresivními symptomy měli být adekvátně vyšetřeni, aby se zjistilo, zda jsou ohroženi bipolární poruchou; takový screening by měl zahrnovat podrobnou psychiatrickou anamnézu, včetně rodinné anamnézy sebevraždy, bipolární poruchy a deprese. Je třeba poznamenat, že tablety REMERON (mirtazapin) nejsou schváleny pro použití při léčbě bipolární deprese.
Agranulocytóza
klinických studiích před uvedením na trh se u 2 (1 se Sjögrenovým syndromem) z 2 796 pacientů léčených tabletami REMERON (mirtazapin) vyvinula agranulocytóza [absolutní počet neutrofilů (ANC)
serotoninový syndrom
Vývoj potenciálně život ohrožujícího serotoninového syndromu byl hlášen u SNRI a SSRI, včetně REMERON 30 mg, samotných, ale zejména při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu a třezalka tečkovaná) a s léky, které zhoršují metabolismus serotoninu (zejména IMAO, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid a intravenózní methylenová modř).
Příznaky serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardii, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární příznaky (např. třes, ztuhlost, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu.
Současné užívání přípravku REMERON 15 mg s IMAO určenými k léčbě psychiatrických poruch je kontraindikováno. Léčba přípravkem REMERON by rovněž neměla být zahájena u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř. Všechny zprávy s methylenovou modří, které poskytly informace o cestě podání, zahrnovaly intravenózní podání v rozmezí dávek 1 mg/kg až 8 mg/kg. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo lokální injekce do tkáně) nebo v nižších dávkách. Mohou nastat okolnosti, kdy je u pacienta užívajícího REMERON nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř. REMERON 15 mg by měl být vysazen před zahájením léčby IMAO (viz KONTRAINDIKACE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pokud je současné užívání REMERON 30 mg s jinými serotonergními léky, včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu a třezalky tečkované, klinicky oprávněné, mějte na paměti možné zvýšené riziko serotoninového syndromu, zejména během zahájení léčby a zvýšení dávky.
Pokud se vyskytnou výše uvedené příhody, léčba přípravkem REMERON 30 mg a jakýmikoli souběžně podávanými serotonergními látkami by měla být okamžitě přerušena a měla by být zahájena podpůrná symptomatická léčba.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv včetně REMERON 15 mg, může vyvolat záchvat s uzavřeným úhlem u pacienta s anatomicky úzkými úhly, který nemá viditelnou iridektomii.
Prodloužení QT a Torsades de Pointes
Účinek REMERONu (mirtazapin) na QTc interval byl hodnocen v klinické randomizované studii s placebem a pozitivní (moxifloxacin) kontrolami zahrnujícími 54 zdravých dobrovolníků pomocí analýzy odezvy na expozici. Tato studie prokázala pozitivní vztah mezi koncentracemi mirtazapinu a prodloužením QTc intervalu. Stupeň prodloužení QT pozorovaný u obou dávek 45 mg (terapeutické) a 75 mg (supraterapeutické) mirtazapinu však nebyl na úrovni obecně považované za klinicky významnou. Během postmarketingového používání mirtazapinu byly hlášeny případy prodloužení QT intervalu, Torsades de Pointes, ventrikulární tachykardie a náhlé smrti (viz NEŽÁDOUCÍ REAKCE ). Většina hlášení se objevila v souvislosti s předávkováním nebo u pacientů s jinými rizikovými faktory pro prodloužení QT intervalu, včetně současného užívání léků prodlužujících QTc (viz DROGOVÉ INTERAKCE a PŘEDÁVKOVAT sekce). Opatrnosti je třeba při předepisování REMERON pacientům se známým kardiovaskulárním onemocněním nebo s rodinnou anamnézou prodloužení QT intervalu a při současném užívání s jinými léčivými přípravky, o kterých se předpokládá, že prodlužují QTc interval.
OPATŘENÍ
Všeobecné
Příznaky přerušení
Byly hlášeny nežádoucí reakce po vysazení tablet REMERON (mirtazapin) (zejména pokud jsou náhlé), včetně, ale bez omezení na následující: závratě, abnormální sny, senzorické poruchy (včetně parestézie a pocitů elektrického šoku), agitovanost, úzkost, únava, zmatenost, bolest hlavy, třes, nevolnost, zvracení a pocení nebo jiné příznaky, které mohou mít klinický význam. Většina hlášených případů je mírná a sama odezní. I když byly hlášeny jako nežádoucí účinky, je třeba si uvědomit, že tyto příznaky mohou souviset se základním onemocněním.
Pacienti, kteří v současné době užívají REMERON, NESMÍ léčbu náhle přerušit kvůli riziku příznaků z vysazení. V době, kdy je učiněno lékařské rozhodnutí přerušit léčbu přípravkem REMERON, se doporučuje spíše postupné snižování dávky než náhlé vysazení.
Akatizie/psychomotorický neklid
Užívání antidepresiv je spojováno s rozvojem akatizie, charakterizované subjektivně nepříjemným nebo úzkostným neklidem a potřebou pohybu, často doprovázenou neschopností klidně sedět nebo stát. K tomu s největší pravděpodobností dojde během prvních několika týdnů léčby. U pacientů, u kterých se rozvinou tyto příznaky, může být zvyšování dávky škodlivé.
Hyponatrémie
Při užívání mirtazapinu byla hyponatremie hlášena velmi vzácně. Opatrnosti je třeba u rizikových pacientů, jako jsou starší pacienti nebo pacienti, kteří jsou současně léčeni léky, o kterých je známo, že způsobují hyponatrémii.

Spavost
kontrolovaných studiích v USA byla ospalost hlášena u 54 % pacientů léčených tabletami REMERON (mirtazapin) ve srovnání s 18 % u placeba a 60 % u amitriptylinu. V těchto studiích vedla ospalost k přerušení léčby u 10,4 % pacientů léčených REMERONem ve srovnání s 2,2 % u placeba. Není jasné, zda se vyvine tolerance k ospalým účinkům REMERONu či nikoli. Vzhledem k potenciálně významným účinkům přípravku REMERON 30 mg na zhoršení výkonnosti by pacienti měli být opatrní, aby se zapojovali do činností vyžadujících bdělost, dokud nebudou schopni posoudit účinek léku na jejich vlastní psychomotorickou výkonnost (viz INFORMACE PRO PACIENTA ).
Závrať
V kontrolovaných studiích v USA byly závratě hlášeny u 7 % pacientů léčených přípravkem REMERON ve srovnání se 3 % u placeba a 14 % u amitriptylinu. Není jasné, zda se vyvine tolerance k závratím pozorovaným v souvislosti s užíváním REMERONu.
Zvýšená chuť k jídlu / přírůstek hmotnosti
kontrolovaných studiích v USA bylo zvýšení chuti k jídlu hlášeno u 17 % pacientů léčených přípravkem REMERON 30 mg ve srovnání s 2 % u placeba a 6 % u amitriptylinu. Ve stejných studiích bylo hlášeno zvýšení tělesné hmotnosti o ≥ 7 % tělesné hmotnosti u 7,5 % pacientů léčených mirtazapinem ve srovnání s 0 % u placeba a 5,9 % u amitriptylinu. V souboru předmarketingových studií v USA, zahrnujících mnoho pacientů pro dlouhodobou, otevřenou léčbu, 8 % pacientů užívajících REMERON 30 mg přerušilo léčbu kvůli zvýšení tělesné hmotnosti. V 8týdenní pediatrické klinické studii s dávkami mezi 15 až 45 mg/den mělo 49 % pacientů léčených REMERONEM přírůstek hmotnosti nejméně o 7 % ve srovnání s 5,7 % pacientů léčených placebem (viz OPATŘENÍ : Pediatrické použití ).
Cholesterol/triglyceridy
kontrolovaných studiích v USA bylo zvýšení cholesterolu na lačno o ≥ 20 % nad horní hranici normálu pozorováno u 15 % pacientů léčených přípravkem REMERON 30 mg ve srovnání se 7 % u placeba a 8 % u amitriptylinu. Ve stejných studiích bylo pozorováno zvýšení triglyceridů na lačno na ≥ 500 mg/dl u 6 % pacientů léčených mirtazapinem ve srovnání se 3 % u placeba a 3 % u amitriptylinu.
Zvýšení transamináz
Klinicky významné zvýšení ALT (SGPT) (≥ 3násobek horní hranice normálního rozmezí) bylo pozorováno u 2,0 % (8/424) pacientů vystavených REMERONu 30 mg v souboru krátkodobých kontrolovaných studií v USA, ve srovnání s 0,3 % (1/328) pacientů s placebem a 2,0 % (3/181) pacientů s amitriptylinem. U většiny těchto pacientů se zvýšením ALT se nevyvinuly známky nebo příznaky spojené s narušenou funkcí jater. Zatímco u některých pacientů byla léčba přerušena pro zvýšení ALT, v jiných případech se hladiny enzymů vrátily k normálu i přes pokračující léčbu REMERONem. REMERON by měl být používán s opatrností u pacientů s poruchou funkce jater (viz KLINICKÁ FARMAKOLOGIE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Aktivace mánie/hypománie
Mánie/hypománie se ve studiích v USA vyskytla přibližně u 0,2 % (3/1299 pacientů) pacientů léčených REMERONEM. Přestože výskyt mánie/hypománie byl během léčby mirtazapinem velmi nízký, měl by být používán opatrně u pacientů s mánií/hypománií v anamnéze.
Záchvat
klinických studiích před uvedením na trh byl hlášen pouze 1 záchvat mezi 2 796 pacienty z USA a mimo USA léčenými přípravkem REMERON. U pacientů s anamnézou záchvatů však nebyly provedeny žádné kontrolované studie. Při podávání mirtazapinu těmto pacientům je proto třeba postupovat opatrně.
Použití u pacientů se souběžným onemocněním
Klinické zkušenosti s přípravkem REMERON u pacientů se souběžným systémovým onemocněním jsou omezené. V souladu s tím je při předepisování mirtazapinu u pacientů s onemocněními nebo stavy, které ovlivňují metabolismus nebo hemodynamické odpovědi, doporučena opatrnost.
REMERON nebyl systematicky hodnocen ani používán v žádném znatelném rozsahu u pacientů s nedávnou anamnézou infarktu myokardu nebo jiného významného srdečního onemocnění. REMERON byl spojen s významnou ortostatickou hypotenzí v časných klinických farmakologických studiích s normálními dobrovolníky. Ortostatická hypotenze byla v klinických studiích u pacientů s depresí zřídka pozorována. REMERON 15 mg by se měl používat s opatrností u pacientů se známým kardiovaskulárním nebo cerebrovaskulárním onemocněním, které by mohlo být zhoršeno hypotenzí (infarkt myokardu, angina pectoris nebo ischemická cévní mozková příhoda v anamnéze) a stavy, které by pacienty predisponovaly k hypotenzi (dehydratace, hypovolémie a léčba antihypertenzivy léky).
Clearance mirtazapinu je snížena u pacientů se středně těžkou [glomerulární filtrace (GFR)=11 - 39 ml/min/1,73 m2] a těžkou [GFR KLINICKÁ FARMAKOLOGIE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Informace pro pacienty
Předepisující lékaři nebo jiní zdravotničtí pracovníci by měli informovat pacienty, jejich rodiny a jejich pečovatele o výhodách a rizicích spojených s léčbou tabletami REMERON (mirtazapin) a měli by jim poradit v jejich vhodném použití. Pacient Průvodce léky o „Antidepresivních lécích, depresi a jiných vážných duševních chorobách a sebevražedných myšlenkách nebo akcích“ je k dispozici pro REMERON. Předepisující lékař nebo zdravotnický pracovník by měl poučit pacienty, jejich rodiny a pečovatele, aby si přečetli Průvodce léky a měl by jim pomoci pochopit jeho obsah. Pacienti by měli dostat příležitost prodiskutovat obsah tohoto dokumentu Průvodce léky získat odpovědi na případné otázky. Kompletní text Průvodce léky je přetištěno na konci tohoto dokumentu.
Pacienti by měli být informováni o následujících problémech a měli by být požádáni, aby upozornili svého předepisujícího lékaře, pokud k nim dojde během užívání REMERONu.
Klinické zhoršení a riziko sebevraždy
Pacienti, jejich rodiny a jejich pečovatelé by měli být upozorněni na výskyt úzkosti, agitovanosti, záchvatů paniky, nespavosti, podrážděnosti, nepřátelství, agresivity, impulzivity, akatizie (psychomotorický neklid), hypománie, mánie a dalších neobvyklých změn v chování. zhoršení deprese a sebevražedných myšlenek, zejména na začátku léčby antidepresivy a při zvyšování nebo snižování dávky. Rodiny a pečovatelé pacientů by měli být poučeni, aby každý den hledali výskyt těchto příznaků, protože změny mohou být náhlé. Takové příznaky by měly být hlášeny pacientovu předepisujícímu lékaři nebo zdravotníkovi, zejména pokud jsou závažné, začínají náhle nebo nejsou součástí pacientových příznaků. Příznaky, jako jsou tyto, mohou být spojeny se zvýšeným rizikem sebevražedného myšlení a chování a naznačují potřebu velmi pečlivého sledování a možné změny v léčbě.
Agranulocytóza
Pacienti, kteří mají dostávat REMERON, by měli být upozorněni na riziko rozvoje agranulocytózy. Pacientům je třeba doporučit, aby kontaktovali svého lékaře, pokud se u nich objeví jakékoli známky infekce, jako je horečka, zimnice, bolest v krku, ulcerace na sliznici nebo jiné možné příznaky infekce. Zvláštní pozornost by měla být věnována jakýmkoliv potížím podobným chřipce nebo jiným příznakům, které by mohly naznačovat infekci.
Zásah do kognitivního a motorického výkonu
REMERON 15 mg může zhoršit úsudek, myšlení a zejména motorické dovednosti, protože má výrazný sedativní účinek. Ospalost spojená s užíváním mirtazapinu může zhoršit schopnost pacienta řídit, obsluhovat stroje nebo vykonávat činnosti, které vyžadují pozornost. Pacienti by proto měli být varováni před zapojováním se do nebezpečných činností, dokud si nejsou přiměřeně jisti, že léčba REMERONem nepříznivě neovlivňuje jejich schopnost zapojit se do takových činností.
Dokončení kurzu terapie
Zatímco pacienti mohou zaznamenat zlepšení při léčbě REMERONEM 15 mg během 1 až 4 týdnů, měli by být poučeni, aby pokračovali v léčbě podle pokynů.
Souběžná medikace
Pacienti by měli být poučeni, aby informovali svého lékaře, pokud užívají nebo hodlají užívat jakékoli léky na předpis nebo volně prodejné léky, protože u REMERONu existuje možnost interakce s jinými léky.
Pacienti by si měli být vědomi možného zvýšeného rizika serotoninového syndromu, pokud je klinicky oprávněné současné užívání REMERON 15 mg s jinými serotonergními léky, včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, buspironu, tryptofanu a třezalky tečkované, zejména při zahájení léčby a při zvyšování dávky.
Alkohol
Bylo prokázáno, že poškození kognitivních a motorických dovedností způsobené přípravkem REMERON je aditivní s těmi, které způsobuje alkohol. Pacienti by proto měli být poučeni, aby se během užívání mirtazapinu vyhýbali alkoholu.
Těhotenství
Pacientky by měly být poučeny, aby informovaly svého lékaře, pokud během léčby REMERONem otěhotní nebo plánují otěhotnět.
Ošetřovatelství
Pacientky by měly být poučeny, aby informovaly svého lékaře, pokud kojí kojence.
Laboratorní testy
Nedoporučují se žádné rutinní laboratorní testy.
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Studie karcinogenity byly provedeny s mirtazapinem podávaným v potravě v dávkách 2, 20 a 200 mg/kg/den myším a 2, 20 a 60 mg/kg/den potkanům. Nejvyšší použité dávky jsou přibližně 20násobek a 12násobek maximální doporučené dávky pro člověka (MRHD) 45 mg/den na základě mg/m² u myší a potkanů. U myších samců při vysokých dávkách byl zvýšený výskyt hepatocelulárního adenomu a karcinomu. U potkanů došlo při středních a vysokých dávkách ke zvýšení hepatocelulárního adenomu u samic a při vysoké dávce hepatocelulárních nádorů a folikulárního adenomu/cystadenomu štítné žlázy a karcinomu u samců. Údaje naznačují, že výše uvedené účinky by mohly být zprostředkovány negenotoxickými mechanismy, jejichž význam pro člověka není znám.
Dávky použité ve studii na myších nemusely být dostatečně vysoké, aby plně charakterizovaly karcinogenní potenciál tablet REMERON (mirtazapin).
Mutageneze
Mirtazapin nebyl mutagenní ani klastogenní a neindukoval obecné poškození DNA, jak bylo zjištěno v několika testech genotoxicity: Amesův test, in vitro test genové mutace v buňkách čínského křečka V 79, in vitro test výměny sesterských chromatid v kultivovaných králičích lymfocytech, in vivo kostní dřeň mikronukleový test u potkanů a neplánovaný test syntézy DNA v buňkách HeLa.
Zhoršení Plodnosti
Ve studii fertility u potkanů byl mirtazapin podáván v dávkách až 100 mg/kg [20násobek maximální doporučené dávky u člověka (MRHD) na základě mg/m]. Páření a početí nebyly ovlivněny lékem, ale estrální cyklus byl narušen při dávkách, které byly 3 nebo vícekrát vyšší než MRHD, a preimplantační ztráty se objevily při 20násobku MRHD.
Těhotenství
Teratogenní účinky
Kategorie těhotenství C
Reprodukční studie u březích potkanů a králíků v dávkách až 100 mg/kg a 40 mg/kg, v tomto pořadí [20 a 17násobek maximální doporučené dávky pro člověka (MRHD) na bázi mg/m²], neodhalily žádné důkazy teratogenní účinky. U potkanů však došlo ke zvýšení postimplantačních ztrát u samic léčených mirtazapinem. Došlo k nárůstu úmrtí mláďat během prvních 3 dnů laktace a ke snížení porodní hmotnosti mláďat. Příčina těchto úmrtí není známa. Účinky se objevily při dávkách, které byly 20krát vyšší než MRHD, ale ne při dávkách 3krát vyšší než MRHD, na základě mg/m². Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Kojící matky
Vzhledem k tomu, že část REMERONu může být vylučována do mateřského mléka, je třeba postupovat opatrně, když jsou tablety REMERON (mirtazapin) podávány kojícím ženám.
Pediatrické použití
Bezpečnost a účinnost u pediatrické populace nebyla stanovena (viz VAROVÁNÍ V KRABICE a VAROVÁNÍ : Klinické zhoršení a riziko sebevraždy ). Dvě placebem kontrolované studie u 258 pediatrických pacientů s MDD byly provedeny s tabletami REMERON (mirtazapin) a údaje nebyly dostatečné pro podporu tvrzení o použití u pediatrických pacientů. Každý, kdo zvažuje použití přípravku REMERON 30 mg u dětí nebo dospívajících, musí zvážit možná rizika s klinickou potřebou.
V 8týdenní pediatrické klinické studii s dávkami mezi 15 až 45 mg/den mělo 49 % pacientů léčených REMERONem nárůst hmotnosti o nejméně 7 % ve srovnání s 5,7 % pacientů léčených placebem. Průměrné zvýšení hmotnosti bylo 4 kg (2 kg SD) u pacientů léčených REMERONem oproti 1 kg (2 kg SD) u pacientů užívajících placebo (viz OPATŘENÍ : Zvýšená chuť k jídlu / přírůstek hmotnosti ).
Geriatrické použití
Přibližně 190 starších jedinců (ve věku ≥ 65 let) se zúčastnilo klinických studií s tabletami REMERON (mirtazapin). Je známo, že tento lék je v podstatě vylučován ledvinami (75 %) a riziko snížené clearance tohoto léku je větší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, je třeba věnovat pozornost výběru dávky. Sedativní léky mohou u starších lidí způsobit zmatenost a nadměrnou sedaci. V této skupině nebyly zjištěny žádné neobvyklé nežádoucí jevy související s věkem. Farmakokinetické studie odhalily sníženou clearance u starších osob. Při podávání přípravku REMERON starším pacientům je nutná opatrnost (viz KLINICKÁ FARMAKOLOGIE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
PŘEDÁVKOVAT
Lidská zkušenost
předávkováním tabletami REMERON (mirtazapin) jsou velmi omezené zkušenosti. V klinických studiích před uvedením na trh bylo hlášeno 8 případů předávkování přípravkem REMERON samotným nebo v kombinaci s jinými farmakologickými látkami. Jediné úmrtí z předávkování lékem hlášené při užívání REMERONu bylo v kombinaci s amitriptylinem a chlorprotixenem v klinické studii mimo USA. Na základě plazmatických hladin byla přijatá dávka REMERON 15 mg 30 až 45 mg, zatímco plazmatické hladiny amitriptylinu a chlorprotixenu byly shledány toxickými. Všechny ostatní případy předávkování před uvedením na trh vedly k úplnému uzdravení. Známky a příznaky hlášené v souvislosti s předávkováním zahrnovaly dezorientaci, ospalost, zhoršenou paměť a tachykardii. Nebyly hlášeny žádné abnormality EKG, kóma nebo křeče po předávkování samotným REMERONEM.
Na základě postmarketingových zpráv však existuje možnost závažnějších následků (včetně úmrtí) při dávkách mnohem vyšších, než je terapeutická dávka, zejména u smíšených předávkování. V těchto případech bylo také hlášeno prodloužení QT intervalu a Torsades de Pointes (viz DROGOVÉ INTERAKCE a NEŽÁDOUCÍ REAKCE sekce).
Řízení předávkování
Léčba by se měla skládat z obecných opatření používaných při zvládání předávkování jakýmkoli lékem účinným při léčbě velké depresivní poruchy. Zajistěte dostatečné dýchací cesty, okysličení a ventilaci. Sledujte parametry EKG (včetně srdečního rytmu) a vitální funkce. Doporučují se také obecná podpůrná a symptomatická opatření. Vyvolání zvracení se nedoporučuje. V případě potřeby může být indikován výplach žaludku velkoprůměrnou orogastrickou sondou s vhodnou ochranou dýchacích cest, pokud se provede brzy po požití nebo u symptomatických pacientů. Je třeba podat aktivní uhlí. Nejsou žádné zkušenosti s použitím forsírované diurézy, dialýzy, hemoperfuze nebo výměnné transfuze v léčbě předávkování mirtazapinem. Nejsou známa žádná specifická antidota pro mirtazapin.
Při zvládání předávkování zvažte možnost zapojení více léků. Lékař by měl zvážit kontaktování toxikologického centra pro další informace o léčbě jakéhokoli předávkování. Telefonní čísla na certifikovaná toxikologická centra jsou uvedena v Physicians' Desk Reference (PDR).
KONTRAINDIKACE
Přecitlivělost
Tablety REMERON (mirtazapin) jsou kontraindikovány u pacientů se známou přecitlivělostí na mirtazapin nebo na kteroukoli pomocnou látku.
Inhibitory monoaminoxidázy
Užívání inhibitorů monoaminooxidázy (IMAO) určených k léčbě psychiatrických poruch přípravkem REMERON 15 mg tablety nebo do 14 dnů po ukončení léčby přípravkem REMERON 15 mg je kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu. Užívání přípravku REMERON 15 mg během 14 dnů po ukončení užívání IMAO určeného k léčbě psychiatrických poruch je také kontraindikováno (viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Zahájení léčby přípravkem REMERON u pacienta, který je léčen IMAO, jako je linezolid nebo intravenózní methylenová modř, je také kontraindikováno z důvodu zvýšeného rizika serotoninového syndromu (viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
KLINICKÁ FARMAKOLOGIE
Farmakodynamika
Mechanismus účinku tablet REMERON (mirtazapin), stejně jako u jiných léků účinných při léčbě velké depresivní poruchy, není znám.
Důkazy shromážděné v předklinických studiích naznačují, že mirtazapin zvyšuje centrální noradrenergní a serotonergní aktivitu. Tyto studie ukázaly, že mirtazapin působí jako antagonista na centrálních presynaptických α2 - adrenergních inhibičních autoreceptorech a heteroreceptorech, což je účinek, o kterém se předpokládá, že vede ke zvýšení centrální noradrenergní a serotonergní aktivity.
Mirtazapin je silný antagonista 5-HT2 a 5-HT3 receptorů. Mirtazapin nemá žádnou významnou afinitu k receptorům 5-HT1A a 5-HT1B.
Mirtazapin je silný antagonista histaminových (H1) receptorů, což je vlastnost, která může vysvětlit jeho výrazné sedativní účinky.
Mirtazapin je středně silný periferní α-adrenergní antagonista, což je vlastnost, která může vysvětlit občasnou ortostatickou hypotenzi hlášenou v souvislosti s jeho užíváním.
Mirtazapin je středně silný antagonista muskarinových receptorů, což je vlastnost, která může vysvětlit relativně nízký výskyt anticholinergních vedlejších účinků spojených s jeho použitím.
Farmakokinetika
Tablety REMERON (mirtazapin) se po perorálním podání rychle a úplně absorbují a mají poločas asi 20 až 40 hodin. Maximální plazmatické koncentrace je dosaženo přibližně za 2 hodiny po perorálním podání. Přítomnost potravy v žaludku má minimální vliv na rychlost i rozsah absorpce a nevyžaduje úpravu dávkování.
Mirtazapin je po perorálním podání značně metabolizován. Hlavními cestami biotransformace jsou demethylace a hydroxylace následovaná glukuronidovou konjugací. Údaje in vitro z lidských jaterních mikrozomů ukazují, že cytochrom 2D6 a 1A2 se účastní tvorby 8-hydroxymetabolitu mirtazapinu, zatímco cytochrom 3A je považován za odpovědný za tvorbu N-desmethylového a N-oxidového metabolitu. Mirtazapin má absolutní biologickou dostupnost přibližně 50 %. Vylučuje se převážně močí (75 %) a 15 % stolicí. Několik nekonjugovaných metabolitů má farmakologickou aktivitu, ale jsou přítomny v plazmě ve velmi nízkých hladinách. (-) enantiomer má poločas eliminace, který je přibližně dvakrát delší než (+) enantiomer, a proto dosahuje plazmatických hladin, které jsou přibližně 3krát vyšší než u (+) enantiomeru.
Plazmatické hladiny jsou lineárně závislé na dávce v rozmezí dávek 15 až 80 mg. Průměrný eliminační poločas mirtazapinu po perorálním podání se pohybuje od přibližně 20 do 40 hodin napříč věkovými a genderovými podskupinami, přičemž ženy všech věkových kategorií vykazují významně delší eliminační poločasy než muži (průměrný poločas 37 hodin u žen vs. 26 hodin pro muže). Ustáleného stavu plazmatických hladin mirtazapinu je dosaženo během 5 dnů, s asi 50% akumulací (akumulační poměr = 1,5).
Mirtazapin se přibližně z 85 % váže na plazmatické proteiny v rozmezí koncentrací 0,01 až 10 mcg/ml.
Zvláštní populace
Geriatrický
Po perorálním podávání tablet REMERON (mirtazapin) 20 mg/den po dobu 7 dnů subjektům různého věku (rozmezí 25 - 74 let) byla perorální clearance mirtazapinu snížena u starších osob ve srovnání s mladšími subjekty. Rozdíly byly nejmarkantnější u mužů, s o 40 % nižší clearance u starších mužů ve srovnání s mladšími muži, zatímco clearance u starších žen byla pouze o 10 % nižší ve srovnání s mladšími ženami. Při podávání přípravku REMERON 30 mg starším pacientům je nutná opatrnost (viz OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pediatrie
Bezpečnost a účinnost mirtazapinu u pediatrické populace nebyla stanovena (viz OPATŘENÍ ).
Rod
Průměrný eliminační poločas mirtazapinu po perorálním podání se pohybuje od přibližně 20 do 40 hodin napříč věkovými a genderovými podskupinami, přičemž ženy všech věkových kategorií vykazují významně delší eliminační poločasy než muži (průměrný poločas 37 hodin u žen vs. 26 hodin pro muže) (viz Farmakokinetika ).
Závod
Nebyly provedeny žádné klinické studie hodnotící vliv rasy na farmakokinetiku přípravku REMERON.
Renální insuficience
Dispozice mirtazapinu byla studována u pacientů s různým stupněm renálních funkcí. Eliminace mirtazapinu koreluje s clearance kreatininu. Celková tělesná clearance mirtazapinu byla snížena přibližně o 30 % u pacientů se středně těžkou (Clcr=11 - 39 ml/min/1,73 m²) a přibližně o 50 % u pacientů s těžkou (Clcr= OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Jaterní nedostatečnost
Po jednorázové 15mg perorální dávce REMERONu byla perorální clearance mirtazapinu snížena přibližně o 30 % u pacientů s poruchou funkce jater ve srovnání s jedinci s normální funkcí jater. Při podávání přípravku REMERON pacientům se sníženou funkcí jater je nutná opatrnost (viz OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Klinické studie prokazující účinnost
Účinnost tablet REMERON (mirtazapin) jako léčba velké depresivní poruchy byla stanovena ve 4 placebem kontrolovaných 6týdenních studiích u dospělých ambulantních pacientů splňujících kritéria DSM-III pro velkou depresivní poruchu. Pacientům byl titrován mirtazapin v rozmezí dávek 5 mg až 35 mg/den. Celkově tyto studie prokázaly, že mirtazapin je lepší než placebo alespoň ve 3 z následujících 4 měření: 21-položková Hamiltonova stupnice pro hodnocení deprese (HDRS) celkové skóre; Položka HDRS Depressed Mood; Skóre závažnosti CGI; a Montgomery a Asberg Depression Rating Scale (MADRS). Převaha mirtazapinu nad placebem byla také zjištěna u určitých faktorů HDRS, včetně faktoru úzkosti/somatizace a faktoru poruch spánku. Průměrná dávka mirtazapinu u pacientů, kteří dokončili tyto 4 studie, byla v rozmezí od 21 do 32 mg/den. Pátá studie podobného designu používala vyšší dávku (až 50 mg) denně a také prokázala účinnost.
Zkoumání věkových a genderových podskupin populace neodhalilo žádnou rozdílnou citlivost na základě těchto podskupin.
V dlouhodobější studii byli pacienti splňující (DSM-IV) kritéria pro velkou depresivní poruchu, kteří reagovali během úvodních 8 až 12 týdnů akutní léčby přípravkem REMERON 30 mg, randomizováni k pokračování v léčbě přípravkem REMERON 15 mg nebo placebem po dobu až 40 týdnů pozorování relapsu. Odpověď během otevřené fáze byla definována jako dosažení celkového skóre HAM-D 17 ≤ 8 a skóre zlepšení CGI 1 nebo 2 při 2 po sobě jdoucích návštěvách počínaje týdnem 6 z 8 až 12 týdnů v otevřené fázi studie. Relaps během dvojitě zaslepené fáze určovali jednotliví vyšetřovatelé. U pacientů, kteří dostávali pokračující léčbu REMERONem 30 mg, došlo během následujících 40 týdnů k významně nižší míře relapsu ve srovnání s pacienty, kteří dostávali placebo. Tento vzorec byl prokázán u mužských i ženských pacientů.
INFORMACE PRO PACIENTA
REMERON® (rem' - e - ron) (mirtazapin) Tablety
Jaké jsou nejdůležitější informace, které bych měl vědět o REMERON®?
REMERON 15 mg a další antidepresiva mohou způsobit závažné nežádoucí účinky, včetně:
1. Sebevražedné myšlenky nebo činy:
- REMERON 30 mg a další antidepresiva mohou zvýšit sebevražedné myšlenky nebo činy u některých dětí, dospívajících nebo mladých dospělých během prvních několika měsíců léčby nebo při změně dávky.
- Deprese nebo jiná vážná duševní onemocnění jsou nejdůležitějšími příčinami sebevražedných myšlenek nebo činů.
- Sledujte tyto změny a ihned zavolejte svému poskytovateli zdravotní péče, pokud si všimnete:
- Nové nebo náhlé změny nálady, chování, jednání, myšlenek nebo pocitů, zvláště pokud jsou závažné.
- Těmto změnám věnujte zvláštní pozornost při zahájení léčby přípravkem REMERON nebo při změně dávky.
Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče a mezi návštěvami volejte, pokud máte obavy z příznaků.
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo zavolejte 911 v případě nouze, zvláště pokud jsou nové, horší nebo vás znepokojují:
- pokusy o sebevraždu
- působící na nebezpečné impulsy
- chovat se agresivně nebo násilně
- myšlenky na sebevraždu nebo smrt
- nová nebo horší deprese
- nové nebo horší záchvaty úzkosti nebo paniky
- pocit rozrušení, neklidu, vzteku nebo podrážděnosti
- problémové spaní
- zvýšená aktivita nebo mluvení více, než je pro vás normální
- jiné neobvyklé změny v chování nebo náladě
Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte některý z následujících příznaků, nebo volejte 911 v případě nouze. REMERON může být spojen s těmito závažnými nežádoucími účinky:
2. Manické epizody:
- výrazně zvýšená energie
- bezohledné chování
- mluvit více nebo rychleji než obvykle
- vážné potíže se spánkem
- neobvykle velkolepé nápady
- závodní myšlenky
- nadměrné štěstí nebo podrážděnost
3. Snížení počtu bílých krvinek tzv. neutrofily, které jsou potřebné k boji proti infekcím. Informujte svého lékaře, pokud máte jakékoli známky infekce, jako je horečka, zimnice, bolest v krku nebo vředy v ústech nebo nosu, zejména příznaky podobné chřipce.
4. Serotoninový syndrom. Tento stav může být život ohrožující a může zahrnovat:
- neklid, halucinace, kóma nebo jiné změny duševního stavu
- rychlý srdeční tep, vysoký nebo nízký krevní tlak
- nevolnost, zvracení nebo průjem
- problémy s koordinací nebo svalové záškuby (nadměrně aktivní reflexy)
- pocení nebo horečka
- svalová ztuhlost
5. Problémy se zrakem
- bolest očí
- změny vidění
- otok nebo zarudnutí v oku nebo kolem oka
Pouze někteří lidé jsou ohroženi těmito problémy. Možná budete chtít podstoupit oční vyšetření, abyste zjistili, zda jste ohroženi, a podstoupit preventivní léčbu, pokud ano.
6. Záchvaty
7. Nízká hladina soli (sodíku) v krvi.
Starší lidé mohou být tímto více ohroženi. Příznaky mohou zahrnovat:
- bolest hlavy
- zmatenost, problémy se soustředěním nebo myšlením nebo problémy s pamětí
- slabost nebo pocit nejistoty
8. Ospalost. Nejlepší je vzít REMERON těsně před spaním.
9. Závažné kožní reakce: Okamžitě zavolejte svého lékaře, pokud máte některý nebo všechny z následujících příznaků:
- závažná vyrážka s otokem kůže (včetně dlaní a plosek nohou)
- bolestivé zarudnutí kůže, puchýře nebo vředy na těle nebo v ústech
10. Závažné alergické reakce: potíže s dýcháním, otok obličeje, jazyka, očí nebo úst
- vyrážka, svědivé šrámy (kopřivka) nebo puchýře, samotné nebo s horečkou nebo bolestí kloubů
11. Zvýšení chuti k jídlu nebo zvýšení hmotnosti. U dětí a dospívajících by měla být během léčby sledována výška a hmotnost.
12. Zvýšené hladiny cholesterolu a triglyceridů v krvi
Neužívejte REMERON 15 mg, aniž byste si promluvili se svým poskytovatelem zdravotní péče. Vysazení přípravku REMERON 15 mg příliš rychle může způsobit potenciálně závažné příznaky včetně:
- závrať
- únava
- pocit mravenčení
- abnormální sny
- zmatek
- nevolnost, zvracení
- míchání
- bolest hlavy
- pocení
- úzkost
- třepání
Co je REMERON 15 mg?
REMERON 15 mg je lék na předpis používaný k léčbě deprese. Je důležité mluvit se svým poskytovatelem zdravotní péče o rizicích léčby deprese a také o rizicích jejího neléčení. Všechny možnosti léčby byste měli probrat se svým poskytovatelem zdravotní péče.
Promluvte si se svým poskytovatelem zdravotní péče, pokud si nemyslíte, že se váš stav léčbou REMERONem zlepšuje.
Kdo by neměl užívat REMERON 15 mg?
Neužívejte REMERON:
- jestliže jste alergický(á) na mirtazapin nebo na kteroukoli další složku přípravku REMERON. Úplný seznam složek přípravku REMERON naleznete na konci tohoto Průvodce léčivy.
- jestliže užíváte inhibitor monoaminooxidázy (MAOI). Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně antibiotika linezolidu.
- Neužívejte IMAO do 2 týdnů po ukončení užívání REMERONu, pokud vám to nenařídí váš poskytovatel zdravotní péče.
- Nezačínejte léčbu přípravkem REMERON, pokud jste přestali užívat některý IMAO v posledních 2 týdnech, pokud to nenařídí váš poskytovatel zdravotní péče.
Lidé, kteří užívají REMERON 15 mg těsně před IMAO, mohou mít závažné nebo dokonce život ohrožující nežádoucí účinky. Okamžitě vyhledejte lékařskou pomoc, pokud máte některý z těchto příznaků:
- vysoká horečka
- rychlé změny srdeční frekvence nebo krevního tlaku
- nekontrolované svalové křeče
- zmatek
- ztuhlé svaly
- ztráta vědomí (omdlít)
Co mám sdělit svému poskytovateli zdravotní péče, než začnu užívat REMERON?
Než začnete REMERON užívat, informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- užíváte určité léky, např.
- Triptany používané k léčbě migrény
- Léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně tricyklických látek, lithia, SSRI, SNRI nebo antipsychotik
- Tramadol používaný k léčbě bolesti
- Volně prodejné doplňky stravy, jako je tryptofan nebo třezalka tečkovaná
- Fenytoin, karbamazepin nebo rifampicin (tyto léky mohou snížit hladinu REMERONu v krvi)
- Cimetidin nebo ketokonazol (tyto léky mohou zvýšit hladinu REMERONu v krvi)
- Léky, které mohou ovlivnit váš srdeční rytmus (jako jsou některá antibiotika a některá antipsychotika)
- mít nebo měl:
- problémy s játry
- problémy s ledvinami
- srdeční problémy nebo určité stavy, které mohou změnit váš srdeční rytmus
- záchvaty nebo křeče
- bipolární porucha nebo mánie
- sklon k točení hlavy nebo mdlobám
- jste těhotná nebo plánujete otěhotnět. Není známo, zda REMERON poškodí vaše nenarozené dítě. Promluvte si se svým poskytovatelem zdravotní péče o výhodách a rizicích léčby deprese během těhotenství
- kojíte nebo plánujete kojit. Část REMERONu může přecházet do mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během užívání REMERONu
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. REMERON a některé léky se mohou vzájemně ovlivňovat, nemusí stejně dobře působit nebo mohou způsobit závažné nežádoucí účinky.
Váš poskytovatel zdravotní péče nebo lékárník vám může říci, zda je bezpečné užívat REMERON 15 mg s jinými léky. Nezačínejte ani nevysazujte žádné léky během užívání REMERONu, aniž byste se nejprve poradil(a) se svým poskytovatelem zdravotní péče. Pokud užíváte REMERON 30 mg, neměli byste užívat žádné jiné léky, které obsahují mirtazapin, včetně REMERON 30 mgSolTab®.
Jak mám užívat REMERON?
- Užívejte REMERON přesně podle předpisu. Váš poskytovatel zdravotní péče možná bude muset změnit dávku přípravku REMERON 15 mg, dokud pro vás nebude správná dávka.
- Užívejte REMERON každý den ve stejnou dobu, nejlépe večer před spaním.
- Polykejte REMERON 15 mg podle pokynů.
- Je běžné, že antidepresivní léky, jako je REMERON, zaberou až několik týdnů, než se začnete cítit lépe. Nepřestávejte užívat REMERON 15 mg, pokud necítíte výsledky ihned.
- Nepřestávejte užívat ani neměňte dávku přípravku REMERON 15 mg bez předchozí konzultace se svým lékařem, i když se cítíte lépe.
- REMERON lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku REMERON 30 mg, vezměte si vynechanou dávku, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky přípravku REMERON 15 mg ve stejnou dobu.
- Jestliže jste užil(a) příliš mnoho přípravku REMERON 15 mg, okamžitě zavolejte svému poskytovateli zdravotní péče nebo toxikologickému centru nebo vyhledejte pohotovostní léčbu. Příznaky předávkování přípravkem REMERON (bez jiných léků nebo alkoholu) zahrnují:
- zmatek,
- problémy s pamětí
- ospalost
- zvýšená srdeční frekvence.
Příznaky možného předávkování mohou zahrnovat změny srdečního rytmu (rychlý, nepravidelný srdeční tep) nebo mdloby, což mohou být příznaky život ohrožujícího stavu známého jako Torsades de Pointes.
Čemu se mám vyhnout při užívání REMERON 15 mg?
- REMERON může způsobit ospalost nebo může ovlivnit vaši schopnost rozhodovat se, jasně myslet nebo rychle reagovat. Neměli byste řídit, obsluhovat těžké stroje nebo vykonávat jiné nebezpečné činnosti, dokud nezjistíte, jak na vás REMERON působí.
- Během užívání přípravku REMERON se vyvarujte pití alkoholu nebo užívání diazepamu (lék užívaný například proti úzkosti, nespavosti a záchvatům) nebo podobných léků. Pokud si nejste jistý(á), zda lze určité léky užívat s přípravkem REMERON 30 mg, poraďte se prosím se svým lékařem.
Jaké jsou možné vedlejší účinky přípravku REMERON?
REMERON může způsobit závažné nežádoucí účinky:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o REMERON?"
Mezi nejčastější vedlejší účinky přípravku REMERON patří:
- ospalost
- zácpa
- zvýšená chuť k jídlu
- závrať
- přibývání na váze
- sucho v ústech abnormální sny
Toto nejsou všechny možné vedlejší účinky přípravku REMERON.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám roztrhnout REMERON?
- Uchovávejte REMERON 15 mg při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
- Uchovávejte REMERON 15 mg mimo světlo.
- Uchovávejte lahvičku REMERON 30 mg dobře uzavřenou.
Uchovávejte REMERON 30 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání REMERONu.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte REMERON 15 mg při onemocnění, pro které nebyl předepsán. Nedávejte REMERON jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Informace o přípravku REMERON 30 mg, který je určen pro zdravotnické pracovníky, můžete požádat svého lékárníka nebo poskytovatele zdravotní péče.
Jaké složky obsahuje REMERON 15 mg?
Aktivní složka: mirtazapin
Neaktivní složky:
- 15 mg tablety: Škrob (kukuřičný), hydroxypropylcelulóza, magnesium-stearát, koloidní oxid křemičitý, laktóza, hypromelóza, polyethylenglykol 8000, oxid titaničitý, oxid železitý (žlutý).
- 30 mg tablety: Škrob (kukuřičný), hydroxypropylcelulóza, stearát hořečnatý, koloidní oxid křemičitý, laktóza, hypromelóza, polyethylenglykol 8000, oxid titaničitý, oxid železitý (žlutý), oxid železitý (červený).
- 45 mg tablety: Škrob (kukuřičný), hydroxypropylcelulóza, stearát hořečnatý, koloidní oxid křemičitý, laktóza, hypromelóza, polyethylenglykol 8000, oxid titaničitý.
