Léčba deprese: Celexa 10mg, 20mg Citalopram Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Celexa a jak se používá?
Celexa je lék na předpis používaný k léčbě příznaků deprese. Celexa může být užívána samostatně nebo s jinými léky.
Celexa 20 mg patří do třídy léků nazývaných antidepresiva, SSRI.
Jaké jsou možné vedlejší účinky přípravku Celexa?
Celexa může způsobit závažné nežádoucí účinky včetně:
- točení hlavy,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo otok očí,
- vidět halo kolem světel,
- bolest hlavy s bolestí na hrudi a těžkými závratěmi,
- mdloby,
- rychlý nebo bušení srdce,
- velmi ztuhlé (tuhé) svaly,
- horečka nebo vysoká horečka,
- pocení,
- zmatek,
- třes,
- míchání,
- halucinace,
- přehnaně aktivní reflexy,
- nevolnost,
- zvracení,
- průjem,
- ztráta koordinace,
- bolest hlavy,
- nezřetelná řeč,
- těžká slabost a
- pocit nejistoty
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Celexa 20 mg patří:
- problémy s pamětí,
- potíže se soustředěním,
- bolest hlavy,
- ospalost,
- suchá ústa,
- zvýšit pocení,
- necitlivost nebo mravenčení,
- zvýšená chuť k jídlu,
- nevolnost,
- průjem,
- plyn,
- rychlé tepy,
- cítit se roztřeseně,
- problémy se spánkem (nespavost),
- cítit se unaveně,
- příznaky nachlazení (ucpaný nos, kýchání, bolest v krku),
- změny hmotnosti a
- potíže s orgasmem
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Celexa. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Sebevražednost a antidepresiva
Antidepresiva ve srovnání s placebem zvýšila riziko sebevražedného myšlení a chování (suicidality) u dětí, dospívajících a mladých dospělých v krátkodobých studiích velké depresivní poruchy (MDD) a dalších psychiatrických poruch. Každý, kdo zvažuje použití přípravku Celexa nebo jakéhokoli jiného antidepresiva u dětí, dospívajících nebo mladých dospělých, musí toto riziko vyvážit klinickou potřebou. Krátkodobé studie neprokázaly u dospělých starších 24 let zvýšení rizika sebevraždy u antidepresiv ve srovnání s placebem; došlo ke snížení rizika u antidepresiv ve srovnání s placebem u dospělých ve věku 65 let a starších. Deprese a některé další psychiatrické poruchy jsou samy o sobě spojeny se zvýšeným rizikem sebevraždy. Pacienti všech věkových kategorií, u kterých je zahájena léčba antidepresivy, by měli být náležitě sledováni a pečlivě sledováni z hlediska klinického zhoršení, suicidality nebo neobvyklých změn v chování. Rodiny a pečovatelé by měli být informováni o potřebě pozorného sledování a komunikace s lékařem. Celexa 10 mg není schválena pro použití u pediatrických pacientů. (Viz VAROVÁNÍ: Klinické zhoršení a riziko sebevraždy, INFORMACE PRO PACIENTA a BEZPEČNOSTNÍ OPATŘENÍ: Pediatrické použití.)
POPIS
Celexa® (citalopram HBr) je perorálně podávaný selektivní inhibitor zpětného vychytávání serotoninu (SSRI) s chemickou strukturou nepříbuznou struktuře jiných SSRI nebo tricyklických, tetracyklických nebo jiných dostupných antidepresiv. Citalopram HBr je racemický bicyklický ftalanový derivát označený jako (±)-1-(3-dimethylaminopropyl)-1-(4-fluorfenyl)-1,3-dihydroisobenzofuran-5-karbonitril, HBr s následujícím strukturním vzorcem:
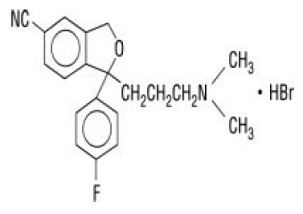
Molekulární vzorec je C20H22BrFN2O a jeho molekulová hmotnost je 405,35.
Citalopram HBr se vyskytuje jako jemný bílý až téměř bílý prášek. Citalopram HBr je těžko rozpustný ve vodě a rozpustný v ethanolu.
Celexa (citalopram hydrobromid) je k dispozici pouze ve formě tablet.
Celexa 10 mg jsou potahované, oválné tablety obsahující citalopram HBr v síle ekvivalentní 10 mg báze citalopramu. Celexa 20 mg a 40 mg jsou potahované, oválné tablety s půlicí rýhou obsahující citalopram HBr v síle odpovídající 20 mg nebo 40 mg báze citalopramu. Tablety také obsahují následující neaktivní složky: kopolyvidon, kukuřičný škrob, sodná sůl kroskarmelózy, glycerin, monohydrát laktózy, magnesium-stearát, hypromelóza, mikrokrystalická celulóza, polyethylenglykol a oxid titaničitý. Oxidy železa se používají jako barviva v béžových (10 mg) a růžových (20 mg) tabletách.
INDIKACE
CELEXA 20 mg je indikována k léčbě velké depresivní poruchy (MDD) u dospělých (viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučené dávkování
Podávejte CELEXA jednou denně, s jídlem nebo bez jídla, v počáteční dávce 20 mg jednou denně, s maximální dávkou 40 mg jednou denně v intervalu ne kratším než jeden týden.
Dávky nad 40 mg jednou denně se nedoporučují kvůli riziku prodloužení QT intervalu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Obrazovka pro bipolární poruchu před zahájením léčby CELEXA
Před zahájením léčby přípravkem CELEXA 20 mg nebo jiným antidepresivem proveďte screening pacientů na osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doporučené dávkování pro specifické populace
Maximální doporučená dávka přípravku CELEXA 10 mg pro pacienty starší 60 let, pacienty s poruchou funkce jater a pro pomalé metabolizátory CYP2C19 je 20 mg jednou denně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , KLINICKÁ FARMAKOLOGIE ].
Úpravy dávkování při současném užívání inhibitorů CYP2C19
Maximální doporučená dávka přípravku CELEXA 20 mg při současném užívání s inhibitorem CYP2C19 je 20 mg jednou denně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Přechod pacientů na antidepresivum inhibitoru monoaminooxidázy nebo z něj
Mezi vysazením antidepresiva inhibitoru monoaminooxidázy (IMAO) a zahájením léčby přípravkem CELEXA musí uplynout alespoň 14 dní. Naopak, po vysazení přípravku CELEXA musí uplynout alespoň 14 dní, než se zahájí podávání antidepresiv s MAOI [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Přerušení léčby přípravkem CELEXA
Nežádoucí účinky se mohou objevit po vysazení CELEXY (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Kdykoli je to možné, snižujte dávku postupně, než abyste náhle vysadili přípravek CELEXA.
JAK DODÁVÁNO
Dávkové formy A Síly
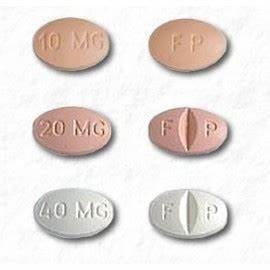
CELEXA 10 mg tablety jsou dostupné jako:
- 10 mg: béžový, oválný s vytištěným „FP“ na jedné straně, „10 mg“ vytištěný na druhé straně
- 20 mg: růžový, oválný, s půlicí rýhou s „F“ vytištěným na levé straně půlicí rýhy a „P“ vytištěným na pravé straně půlicí rýhy, „20 mg“ vytištěným na bezrýhované straně
- 40 mg: bílý, oválný, s půlicí rýhou s „F“ vytištěným na levé straně půlicí rýhy a „P“ vytištěným na pravé straně půlicí rýhy, „40 mg“ vytištěným na bezrýhované straně
CELEXA (citalopram) tablety se dodávají takto:
Skladování A Manipulace
Tablety CELEXA 10 mg by měly být uchovávány při teplotě 20-25 °C (68 až 77 °F); povolené výchylky mezi 15 a 30 °C (59-86 °F) [viz USP řízená pokojová teplota ].
Distribuuje: Allergan USA, Inc. Revize: únor 2022
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech označení:
- Hypersenzitivní reakce [viz KONTRAINDIKACE ]
- Sebevražedné myšlenky a chování u dospívajících a mladých dospělých [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT intervalu a torsade de pointes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zvýšené riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Aktivace mánie nebo hypománie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom z vysazení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sexuální dysfunkce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi rozdílných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Bezpečnost přípravku CELEXA 20 mg zahrnovala expozice citalopramu u pacientů a/nebo zdravých subjektů ze 3 různých skupin studií: 429 zdravých subjektů v klinických farmakologických/farmakokinetických studiích; 4 422 expozic od pacientů v kontrolovaných a nekontrolovaných klinických studiích, což odpovídá přibližně 1 370 letům expozice pacientům. Kromě toho došlo k více než 19 000 expozicím z většinou otevřených evropských postmarketingových studií. Podmínky a délka léčby přípravkem CELEXA 10 mg se velmi lišily a zahrnovaly (v překrývajících se kategoriích) otevřené a dvojitě zaslepené studie, hospitalizované a ambulantní studie, studie s fixní dávkou a titrací dávky a krátkodobou a dlouhodobou expozici .
Nežádoucí účinky spojené s přerušením léčby
Mezi 1 063 pacienty s MDD, kteří dostávali přípravek CELEXA 10 mg v dávkách od 10 mg do 80 mg jednou denně v placebem kontrolovaných studiích trvajících až 6 týdnů, 16 % přerušilo léčbu kvůli nežádoucí reakci ve srovnání s 8 % ze 446 pacientů dostávající placebo. Nežádoucí účinky spojené s přerušením léčby (tj. spojené s přerušením léčby u alespoň 1 % pacientů léčených přípravkem CELEXA v míře alespoň dvojnásobné oproti placebu) jsou uvedeny v tabulce 2.
Tabulka 3 uvádí incidenci nežádoucích účinků, které se vyskytly u 1 063 pacientů s MDD, kteří dostávali přípravek CELEXA 20 mg v dávkách od 10 mg do 80 mg jednou denně v placebem kontrolovaných studiích trvajících až 6 týdnů.
Nejčastější nežádoucí reakcí, která se vyskytla u pacientů léčených přípravkem CELEXA s incidencí 5 % nebo vyšší a nejméně dvojnásobnou u pacientů s placebem, byla porucha ejakulace (především zpoždění ejakulace) u mužů (viz tabulka 3).
Nežádoucí účinky závislé na dávce
Potenciální vztah mezi dávkou přípravku CELEXA 10 mg a výskytem nežádoucích účinků byl zkoumán ve studii s fixní dávkou u pacientů s MDD, kteří dostávali placebo nebo přípravek CELEXA 10 mg, 20 mg 40 mg nebo 60 mg (1,5násobek maximální doporučené dávky). . Pozitivní odpověď na dávku (p
Mužská a ženská sexuální dysfunkce s SSRI
Ačkoli změny v sexuální touze, sexuální výkonnosti a sexuální spokojenosti se často objevují jako projevy psychiatrické poruchy, mohou být také důsledkem léčby SSRI. Spolehlivé odhady výskytu a závažnosti nežádoucích zážitků zahrnujících sexuální touhu, výkon a uspokojení je však obtížné získat, částečně proto, že pacienti a poskytovatelé zdravotní péče se mohou zdráhat o nich diskutovat. V souladu s tím mohou odhady výskytu nežádoucích sexuálních zkušeností a výkonu uvedené v označení podceňovat jejich skutečný výskyt.
Tabulka 4 uvádí incidenci sexuálních nežádoucích reakcí hlášených nejméně u 2 % pacientů mužského pohlaví užívajících přípravek CELEXA 20 mg v souboru placebem kontrolovaných klinických studií u pacientů s depresí.
U pacientek s depresí užívajících přípravek CELEXA 20 mg byla hlášená incidence sníženého libida a anorgasmie 1,3 % (n=638 žen) a 1,1 % (n=252 žen).
Změny hmotnosti
pacientů léčených přípravkem CELEXA v kontrolovaných studiích došlo ke snížení hmotnosti o přibližně 0,5 kg ve srovnání s žádnou změnou u pacientů s placebem.
Změny EKG
V důkladné QT studii bylo zjištěno, že CELEXA je spojena se zvýšením QTc intervalu v závislosti na dávce.
Elektrokardiogramy ze skupin CELEXA (N=802) a placeba (N=241) byly porovnány s ohledem na odlehlé hodnoty definované jako subjekty se změnami QTc během 60 ms od výchozích nebo absolutních hodnot nad 500 ms po dávce a subjekty se zvýšením srdeční frekvence na nad 100 tepů za minutu nebo se sníží na méně než 50 tepů za minutu s 25% změnou od výchozí hodnoty (tachykardické nebo bradykardické odlehlé hodnoty). Ve skupině CELEXA mělo 1,9 % pacientů změnu QTcF od výchozí hodnoty > 60 ms ve srovnání s 1,2 % pacientů ve skupině s placebem. Žádný z pacientů ve skupině s placebem neměl po dávce QTcF > 500 ms ve srovnání s 0,5 % pacientů ve skupině CELEXA 10 mg. Incidence tachykardických odlehlých hodnot byla 0,5 % ve skupině CELEXA a 0,4 % ve skupině s placebem. Incidence bradykardických odlehlých hodnot byla 0,9 % ve skupině CELEXA 10 mg a 0,4 % ve skupině s placebem.
Další nežádoucí účinky pozorované během předmarketingového hodnocení přípravku CELEXA
Následující seznam nežádoucích účinků nezahrnuje reakce, které jsou: 1) zahrnuty v tabulce 3 nebo jinde v označení, 2) u nichž byla příčina léku vzdálená, 3) které byly tak obecné, že nebyly informativní, a ty, které se vyskytly pouze v jeden pacient.
Nežádoucí účinky jsou kategorizovány podle tělesného systému a uvedeny v pořadí klesající frekvence podle následujících definic: časté nežádoucí účinky jsou ty, které se vyskytují jednou nebo vícekrát u nejméně 1/100 pacientů; méně časté nežádoucí účinky jsou ty, které se vyskytují u méně než 1/100 pacientů až 1/1000 pacientů; vzácné nežádoucí účinky jsou ty, které se vyskytují u méně než 1/1000 pacientů.
Kardiovaskulární - Časté: tachykardie, posturální hypotenze, hypotenze. Méně časté: hypertenze, bradykardie, otoky (končetin), angina pectoris, extrasystoly, srdeční selhání, návaly horka, infarkt myokardu, cerebrovaskulární příhoda, ischemie myokardu. Vzácné: tranzitorní ischemická ataka, flebitida, fibrilace síní, srdeční zástava, blokáda raménka.
Poruchy centrálního a periferního nervového systému – časté: parestézie, migréna. Méně časté: hyperkineze, vertigo, hypertonie, extrapyramidová porucha, křeče v nohou, mimovolní svalové kontrakce, hypokineze, neuralgie, dystonie, abnormální chůze, hypoestézie, ataxie. Vzácné: abnormální koordinace, hyperestézie, ptóza, stupor.
Endokrinní poruchy -Vzácné: hypotyreóza, struma, gynekomastie.
Gastrointestinální poruchy -Časté: zvýšená tvorba slin, plynatost. Méně časté: gastritida, gastroenteritida, stomatitida, říhání, hemoroidy, dysfagie, skřípání zubů, gingivitida, ezofagitida. Vzácné: kolitida, žaludeční vřed, cholecystitida, cholelitiáza, duodenální vřed, gastroezofageální reflux, glositida, žloutenka, divertikulitida, rektální krvácení, škytavka.
Obecné – Zřídka : návaly horka, ztuhlost, intolerance alkoholu, synkopa, příznaky podobné chřipce. Vzácné: senná rýma.
Hemické a lymfatické poruchy - Méně časté: purpura, anémie, epistaxe, leukocytóza, leukopenie, lymfadenopatie. Vzácné: plicní embolie, granulocytopenie, lymfocytóza, lymfopenie, hypochromní anémie, porucha koagulace, krvácení z dásní.
Metabolické a nutriční poruchy -Časté: snížená hmotnost, zvýšená hmotnost. Méně časté: zvýšené jaterní enzymy, žízeň, suché oči, zvýšená alkalická fosfatáza, abnormální glukózová tolerance. Vzácné: bilirubinémie, hypokalémie, obezita, hypoglykémie, hepatitida, dehydratace.
Poruchy pohybového aparátu - Méně časté: artritida, svalová slabost, bolesti skeletu. Vzácné: burzitida, osteoporóza.
Psychiatrické poruchy -Časté: porucha koncentrace, amnézie, apatie, deprese, zvýšená chuť k jídlu, zhoršená deprese, pokus o sebevraždu, zmatenost. Méně časté: zvýšené libido, agresivní reakce, paronirie, drogová závislost, depersonalizace, halucinace, euforie, psychotická deprese, bludy, paranoidní reakce, emoční labilita, panická reakce, psychóza. Vzácné: katatonická reakce, melancholie.
Poruchy reprodukce/Ženy* -Časté: amenorea. Méně časté: galaktorea, bolest prsou, zvětšení prsou, vaginální krvácení. (*% pouze na základě žen: 2955)
Poruchy dýchacího systému -Časté: kašel. Méně časté: bronchitida, dušnost, pneumonie. Vzácné: astma, laryngitida, bronchospasmus, pneumonitida, zvýšené sputum.
Poruchy kůže a příloh - Časté: vyrážka, svědění. Méně časté: fotosenzitivní reakce, kopřivka, akné, změna barvy kůže, ekzém, alopecie, dermatitida, suchá kůže, psoriáza. Vzácné: hypertrichóza, snížené pocení, melanóza, keratitida, celulitida, pruritus ani.
Speciální smysly - Časté: abnormální akomodace, perverze chuti. Méně časté: tinitus, konjunktivitida, bolest očí. Vzácné: mydriáza, fotofobie, diplopie, abnormální slzení, katarakta, ztráta chuti.
Poruchy močového systému - Časté: polyurie. Méně časté: frekvence močení, inkontinence moči, retence moči, dysurie. Vzácné: otok obličeje, hematurie, oligurie, pyelonefritida, ledvinový kámen, bolest ledvin.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly identifikovány během postregistračního užívání citalopramu, racemátu nebo escitalopramu, S-enantiomeru citalopramu. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému: hemolytická anémie, trombocytopenie, snížený protrombin
Srdeční poruchy: torsade de pointes, ventrikulární arytmie, prodloužený QT interval
Endokrinní poruchy: hyperprolaktinémie
Oční poruchy: glaukom s uzavřeným úhlem
Gastrointestinální poruchy: gastrointestinální krvácení, pankreatitida
Obecné poruchy a podmínky administrativního místa: abstinenční syndrom
Poruchy jater a žlučových cest: jaterní nekróza
Poruchy imunitního systému: anafylaxe, alergická reakce
Poruchy svalové a kosterní soustavy a pojivové tkáně: rabdomyolýza
Poruchy nervového systému: grand mal křeče, myoklonus, choreoatetóza, dyskineze, akatizie, nystagmus
Těhotenství, šestinedělí a perinatální stavy: Spontánní potrat
Psychiatrické poruchy: delirium
Poruchy ledvin a močových cest: akutní renální selhání
Poruchy reprodukčního systému a prsu: priapismus
Poruchy kůže a podkožní tkáně: Stevens Johnsonův syndrom, epidermální nekrolýza, angioedém, erythema multiforme, ekchymóza
Cévní poruchy: trombóza
DROGOVÉ INTERAKCE
Tabulka 5 uvádí klinicky důležité lékové interakce s přípravkem CELEXA.
Zneužívání drog a závislost
Kontrolovaná látka
CELEXA (citalopram HBr) není kontrolovaná látka.
Zneužívání
Studie na zvířatech naznačují, že riziko zneužití přípravku CELEXA 20 mg je nízké. CELEXA nebyla systematicky studována u lidí z hlediska jejího potenciálu pro zneužívání, toleranci nebo fyzickou závislost. Klinické zkušenosti před uvedením přípravku CELEXA na trh neodhalily žádné chování při hledání léku. Tato pozorování však nebyla systematická a na základě těchto omezených zkušeností není možné předpovědět, do jaké míry bude léčivo působící na CNS po uvedení na trh zneužito, odkloněno a/nebo zneužito. Poskytovatelé zdravotní péče by proto měli u pacientů s přípravkem CELEXA 20 mg pečlivě vyhodnotit anamnézu zneužívání drog a tyto pacienty pečlivě sledovat a sledovat u nich známky nesprávného užívání nebo zneužívání (např. rozvoj tolerance, zvyšování dávky, chování při vyhledávání drog).
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Sebevražedné myšlenky a chování u dospívajících a mladých dospělých
souhrnných analýzách placebem kontrolovaných studií antidepresiv (SSRI a jiných tříd antidepresiv), které zahrnovaly přibližně 77 000 dospělých pacientů a 4 500 dětských pacientů, byl výskyt sebevražedných myšlenek a chování u pacientů léčených antidepresivy ve věku 24 let a mladších vyšší než u pacientů léčených placebem. Mezi drogami byly značné rozdíly v riziku sebevražedných myšlenek a chování, ale u většiny studovaných drog bylo zjištěno zvýšené riziko u mladých pacientů. Mezi různými indikacemi byly rozdíly v absolutním riziku sebevražedných myšlenek a chování, s nejvyšší incidencí u pacientů s MDD. Rozdíly mezi lékem a placebem v počtu případů sebevražedných myšlenek a chování na 1000 léčených pacientů jsou uvedeny v tabulce 1.
Není známo, zda riziko sebevražedných myšlenek a chování u dětí, dospívajících a mladých dospělých přesahuje dlouhodobé užívání, tj. déle než čtyři měsíce. Existují však podstatné důkazy z placebem kontrolovaných udržovacích studií u dospělých s MDD, že antidepresiva oddalují recidivu deprese a že samotná deprese je rizikovým faktorem pro sebevražedné myšlenky a chování.
U všech pacientů léčených antidepresivy sledujte klinické zhoršení a výskyt sebevražedných myšlenek a chování, zejména během několika prvních měsíců lékové terapie a v době změn dávkování. Poraďte rodinné příslušníky nebo pečovatele pacientů, aby sledovali změny v chování a varovali poskytovatele zdravotní péče. Zvažte změnu terapeutického režimu, včetně možného přerušení léčby přípravkem CELEXA, u pacientů, jejichž deprese se trvale zhoršuje nebo u kterých se objevují nové sebevražedné myšlenky nebo chování.
QT-prodloužení a torsade de pointes
CELEXA způsobuje prodloužení QTc závislé na dávce, abnormalitu EKG, která byla spojena s Torsade de Pointes (TdP), ventrikulární tachykardií a náhlou smrtí, z nichž všechny byly pozorovány v postmarketingových hlášeních pro citalopram (viz NEŽÁDOUCÍ REAKCE ].
Vzhledem k riziku prodloužení QTc intervalu při vyšších dávkách CELEXA 20 mg se doporučuje, aby CELEXA nebyla podávána v dávkách vyšších než 40 mg jednou denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Přípravek CELEXA by se neměl používat u pacientů s vrozeným syndromem dlouhého QT intervalu, bradykardií, hypokalémií nebo hypomagnezémií, nedávným akutním infarktem myokardu nebo nekompenzovaným srdečním selháním, pokud přínosy pro konkrétního pacienta nepřeváží rizika. CELEXA by se měla také vyhnout pacientům, kteří užívají jiné léky prodlužující QTc interval (viz DROGOVÉ INTERAKCE ]. Mezi takové léky patří antiarytmika třídy 1A (např. chinidin, prokainamid) nebo třídy III (např. amiodaron, sotalol), antipsychotické léky (např. chlorpromazin, thioridazin), antibiotika (např. gatifloxacin, moxifloxacin) nebo jakákoli jiná třída léků známé tím, že prodlužují QTc interval (např. pentamidin, levomethadylacetát, metadon).
Dávka citalopramu by měla být u určitých populací omezena. Maximální dávka by měla být omezena na 20 mg jednou denně u pacientů, kteří jsou pomalými metabolizátory CYP2C19 nebo u pacientů užívajících současně cimetidin nebo jiný inhibitor CYP2C19, protože lze očekávat vyšší expozice citalopramu. Maximální dávka by měla být také omezena na 20 mg jednou denně u pacientů s poruchou funkce jater a u pacientů starších 60 let z důvodu očekávaných vyšších expozic (viz DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE , Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE ].
Za určitých okolností se doporučuje monitorování elektrolytů a/nebo EKG. Pacienti, u kterých se uvažuje o léčbě přípravkem CELEXA 20 mg, u kterých existuje riziko významných poruch elektrolytů, by měli mít výchozí hodnoty draslíku a hořčíku v séru s pravidelným sledováním. Hypokalémie (a/nebo hypomagnezémie) může zvýšit riziko prodloužení QTc intervalu a arytmie a měla by být upravena před zahájením léčby a pravidelně sledována. Monitorování EKG se doporučuje u pacientů, u kterých se užívání přípravku CELEXA 10 mg nedoporučuje, pokud přínosy pro konkrétního pacienta jasně nepřeváží rizika (viz výše ). Patří mezi ně pacienti s výše uvedenými srdečními stavy a pacienti užívající jiné léky, které mohou prodloužit QTc interval.
pacientů, u kterých bylo zjištěno přetrvávající měření QTc > 500 ms, přerušte léčbu přípravkem CELEXA 10 mg. Pokud se u pacientů užívajících přípravek CELEXA objeví příznaky, které by mohly naznačovat výskyt srdečních arytmií, např. závratě, bušení srdce nebo synkopa, předepisující lékař by měl zahájit další vyšetření, včetně monitorování srdce.
serotoninový syndrom
SSRI, včetně přípravku CELEXA 20 mg, mohou urychlit serotoninový syndrom, potenciálně život ohrožující stav. Riziko se zvyšuje při současném užívání jiných serotonergních léků (včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů a třezalky tečkované) a léků, které zhoršují metabolismus serotoninu, tj. MAOI [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ]. Serotoninový syndrom se může také objevit, když se tyto léky užívají samostatně. Příznaky serotoninového syndromu byly zaznamenány u 0,1 % pacientů s MDD léčených přípravkem CELEXA 20 mg v klinických studiích před uvedením na trh.
Známky a symptomy serotoninového syndromu mohou zahrnovat změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilitu (např. tachykardie, labilní krevní tlak, závratě, pocení, zrudnutí, hypertermii), neuromuskulární příznaky (např. rigidita, myoklonus, hyperreflexie, nekoordinovanost), záchvaty a gastrointestinální symptomy (např. nauzea, zvracení, průjem).
Současné užívání přípravku CELEXA s IMAO je kontraindikováno. Kromě toho nezahajujte léčbu přípravkem CELEXA 20 mg u pacienta léčeného IMAO, jako je linezolid nebo intravenózní methylenová modř. Žádné zprávy nezahrnovaly podávání methylenové modři jinými cestami (jako jsou perorální tablety nebo místní injekce do tkáně). Pokud je nutné zahájit léčbu IMAO, jako je linezolid nebo intravenózní methylenová modř u pacienta užívajícího CELEXA 10 mg, přerušte léčbu přípravkem CELEXA 20 mg před zahájením léčby IMAO [viz KONTRAINDIKACE , DROGOVÉ INTERAKCE ].
všech pacientů užívajících přípravek CELEXA 20 mg sledujte výskyt serotoninového syndromu. Pokud se objeví výše uvedené příznaky, okamžitě přerušte léčbu přípravkem CELEXA a jakýmikoli souběžně podávanými serotonergními látkami a zahajte podpůrnou symptomatickou léčbu. Pokud je současné užívání přípravku CELEXA s jinými serotonergními léky klinicky oprávněné, informujte pacienty o zvýšeném riziku serotoninového syndromu a sledujte příznaky.
Zvýšené riziko krvácení
Léky, které interferují s inhibicí zpětného vychytávání serotoninu, včetně přípravku CELEXA 20 mg, zvyšují riziko krvácivých příhod. Současné užívání aspirinu, nesteroidních protizánětlivých léků (NSAIDS), jiných protidestičkových léků, warfarinu a dalších antikoagulancií může toto riziko zvýšit. Kazuistiky a epidemiologické studie (kontrola případů a kohortní uspořádání) prokázaly souvislost mezi užíváním léků, které interferují se zpětným vychytáváním serotoninu, a výskytem gastrointestinálního krvácení. Krvácení související s léky, které interferují se zpětným vychytáváním serotoninu, se pohybovaly od ekchymózy, hematomu, epistaxe a petechií až po život ohrožující krvácení.
Informujte pacienty o zvýšeném riziku krvácení souvisejícím se současným užíváním přípravku CELEXA 20 mg a protidestičkových látek nebo antikoagulancií. U pacientů užívajících warfarin pečlivě sledujte mezinárodní normalizovaný poměr [viz DROGOVÉ INTERAKCE ].
Aktivace Mánie Nebo Hypománie
pacientů s bipolární poruchou může léčba depresivní epizody přípravkem CELEXA nebo jiným antidepresivem vyvolat smíšenou/manickou epizodu. V kontrolovaných klinických studiích byli vyloučeni pacienti s bipolární poruchou; příznaky mánie nebo hypománie však byly hlášeny u 0,1 % nediagnostikovaných pacientů léčených přípravkem CELEXA. Před zahájením léčby přípravkem CELEXA 10 mg proveďte screening pacientů na jakoukoli osobní nebo rodinnou anamnézu bipolární poruchy, mánie nebo hypománie [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Syndrom vysazení
Nežádoucí účinky po vysazení serotonergních antidepresiv, zejména po náhlém vysazení, zahrnují: nevolnost, pocení, dysforickou náladu, podrážděnost, neklid, závratě, poruchy smyslů (např. parestézie, jako jsou pocity elektrického šoku), třes, úzkost, zmatenost, bolest hlavy, letargie, emoční labilita, nespavost, hypománie, tinnitus a záchvaty. Kdykoli je to možné, doporučuje se spíše postupné snižování dávky než náhlé vysazení [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Záchvaty
CELEXA 20 mg nebyla systematicky hodnocena u pacientů se záchvatovými poruchami. Pacienti s anamnézou záchvatů byli z klinických studií vyloučeni. V klinických studiích s přípravkem CELEXA 20 mg se záchvaty objevily u 0,3 % pacientů léčených přípravkem CELEXA (četnost jeden pacient za 98 let expozice) a 0,5 % pacientů léčených placebem (četnost jeden pacient za 50 let expozice). CELEXA 10 mg by měla být předepisována s opatrností pacientům se záchvatovým onemocněním.
Glaukom s uzavřeným úhlem
Rozšíření zornice, ke kterému dochází po použití mnoha antidepresiv, včetně přípravku CELEXA, může vyvolat záchvat uzavření úhlu u pacienta s anatomicky úzkými úhly, který nemá patentovanou iridektomii. Vyhněte se užívání antidepresiv, včetně přípravku CELEXA, u pacientů s neléčenými anatomicky úzkými úhly.
Hyponatrémie
důsledku léčby SSRI, včetně přípravku CELEXA, se může objevit hyponatremie. Byly hlášeny případy sérového sodíku nižšího než 110 mmol/l. Mezi příznaky a příznaky hyponatremie patří bolest hlavy, potíže se soustředěním, zhoršení paměti, zmatenost, slabost a nestabilita, které mohou vést k pádům. Známky a symptomy spojené se závažnějšími a/nebo akutními případy zahrnovaly halucinace, synkopu, záchvaty, kóma, zástavu dechu a smrt. V mnoha případech se zdá, že tato hyponatremie je výsledkem syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH).
U pacientů se symptomatickou hyponatrémií přerušte podávání přípravku CELEXA a zahajte vhodnou lékařskou intervenci. Starší pacienti, pacienti užívající diuretika a ti, kteří mají depleci objemu, mohou mít větší riziko rozvoje hyponatremie s SSRI (viz Použití u konkrétních populací ].
Sexuální dysfunkce
Užívání SSRI, včetně CELEXA, může způsobit příznaky sexuální dysfunkce (viz NEŽÁDOUCÍ REAKCE ]. U mužských pacientů může mít užívání SSRI za následek zpoždění nebo selhání ejakulace, snížení libida a erektilní dysfunkci. U pacientek může mít užívání SSRI za následek snížení libida a opožděný nebo chybějící orgasmus.
Je důležité, aby se předepisující lékaři zeptali na sexuální funkce před zahájením léčby přípravkem CELEXA a konkrétně se zeptali na změny sexuální funkce během léčby, protože sexuální funkce nemusí být spontánně hlášeny. Při hodnocení změn sexuální funkce je důležité získat podrobnou anamnézu (včetně načasování nástupu příznaků), protože sexuální příznaky mohou mít jiné příčiny, včetně základní psychiatrické poruchy. Diskutujte o možných strategiích řízení, které pomohou pacientům činit informovaná rozhodnutí o léčbě.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Sebevražedné myšlenky a chování
Poraďte pacientům a pečovatelům, aby hledali výskyt sebevraždy, zvláště brzy během léčby a když je dávka upravena nahoru nebo dolů, a poučte je, aby takové příznaky hlásili poskytovateli zdravotní péče [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Prodloužení QT a Torsade De Pointes
Poraďte pacientům, aby se okamžitě obrátili na svého poskytovatele zdravotní péče, pokud mají pocit na omdlení, ztrátu vědomí nebo bušení srdce. Poučte pacienty, aby informovali svého poskytovatele zdravotní péče, že užívají přípravek CELEXA dříve, než začnou užívat jakékoli nové léky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
serotoninový syndrom
Varujte pacienty před rizikem serotoninového syndromu, zejména při současném užívání přípravku CELEXA 20 mg s jinými serotonergními léky včetně triptanů, tricyklických antidepresiv, fentanylu, lithia, tramadolu, tryptofanu, buspironu, amfetaminů, třezalky tečkované a s léky, které narušují metabolismus serotoninu (zejména IMAO, jak ty, které jsou určeny k léčbě psychiatrických poruch, tak i jiné, jako je linezolid). Poučte pacienty, aby kontaktovali svého poskytovatele zdravotní péče nebo hlásili na pohotovost, pokud zaznamenají známky nebo příznaky serotoninového syndromu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Zvýšené riziko krvácení
Informujte pacienty o současném užívání přípravku CELEXA 10 mg s aspirinem, NSAID, jinými protidestičkovými léky, warfarinem nebo jinými antikoagulancii, protože kombinované užívání je spojeno se zvýšeným rizikem krvácení. Poraďte pacientům, aby informovali své poskytovatele zdravotní péče, pokud užívají nebo plánují užívat jakékoli léky na předpis nebo volně prodejné léky, které zvyšují riziko krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Aktivace Mánie Nebo Hypománie
Poraďte pacientům a jejich pečovatelům, aby sledovali známky aktivace mánie/hypománie a poučte je, aby takové příznaky hlásili poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Syndrom vysazení
Poraďte pacientům, aby náhle nepřerušovali léčbu přípravkem CELEXA a aby případný postup snižování dávky projednali se svým poskytovatelem zdravotní péče. Informujte pacienty o tom, že se mohou vyskytnout nežádoucí účinky, když je CELEXA 20 mg vysazena [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sexuální dysfunkce
Informujte pacienty, že užívání přípravku CELEXA může vyvolat příznaky sexuální dysfunkce u mužů i žen. Informujte pacienty, že by měli se svým poskytovatelem zdravotní péče prodiskutovat jakékoli změny v sexuální funkci a potenciální strategie řízení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těhotenství
- Informujte pacienty, aby informovali svého poskytovatele zdravotní péče, pokud otěhotní nebo zamýšlejí otěhotnět během léčby přípravkem CELEXA [viz Použití u konkrétních populací ].
- Informujte pacienty, že užívání CELEXA v pozdním těhotenství může vést ke zvýšenému riziku neonatálních komplikací vyžadujících prodlouženou hospitalizaci, respirační podporu, výživu sondou a/nebo přetrvávající plicní hypertenzi novorozenců (PPHN) [viz Použití u konkrétních populací ].
- Informujte ženy, že existuje registr expozice v těhotenství, který monitoruje výsledky těhotenství u žen vystavených citalopramu během těhotenství [viz Použití u konkrétních populací ].
Laktace
Doporučte kojícím ženám, aby sledovaly kojence kvůli nadměrné sedaci, neklidu, neklidu, špatnému krmení a nízkému přírůstku hmotnosti a aby vyhledaly lékařskou péči, pokud zaznamenají tyto příznaky [viz Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Citalopram zvýšil výskyt karcinomu tenkého střeva u potkanů léčených po dobu 24 měsíců v dávkách 8 a 24 mg/kg/den v dietě, což je přibližně 2 a 6násobek maximální doporučené dávky pro člověka (MRHD) 40 mg, v tomto pořadí, na základě mg/m² tělesného povrchu. Hladina bez účinku (NOEL) pro toto zjištění nebyla stanovena.
Citalopram nezvýšil výskyt nádorů u myší léčených po dobu 18 měsíců v dávkách vyšších než 240 mg/kg/den v potravě, což je přibližně 30násobek MRDH 40 mg na základě mg/m² tělesného povrchu.
Mutageneze
Citalopram byl mutagenní v testu bakteriálních reverzních mutací in vitro (Amesův test) u 2 z 5 bakteriálních kmenů (Salmonella TA98 a TA1537) bez metabolické aktivace. Byl klastogenní v in vitro testu plicních buněk čínského křečka na chromozomální aberace v přítomnosti a nepřítomnosti metabolické aktivace. Citalopram nebyl mutagenní v testu in vitro savčích přímých genových mutací (HPRT) v buňkách myšího lymfomu ani v testu in vitro/in vivo neplánované syntézy DNA (UDS) v játrech potkana. Nebyl klastogenní v in vitro testu chromozomálních aberací na lidských lymfocytech ani ve dvou in vivo myších mikronukleárních testech.
Zhoršení Plodnosti
Citalopram byl podáván perorálně samicím a samcům potkanů v dávkách 32, 48 a 72 mg/kg/den před pářením a během páření a během březosti. Tyto dávky jsou přibližně 8, 12 a 17krát vyšší než MRHD 40 mg na základě mg/m² tělesného povrchu. Páření a plodnost byly sníženy při dávkách ≥ 32 mg/kg/den, což je přibližně 8násobek MRHD.
Délka těhotenství se prodloužila na 48 mg/kg/den, což je přibližně 12násobek MRHD.
Použití u konkrétních populací
Těhotenství
Registr expozice v těhotenství
Existuje registr těhotenských expozic, který sleduje výsledky těhotenství u žen vystavených antidepresivům během těhotenství. Poskytovatelé zdravotní péče se vyzývají, aby registrovali pacienty zavoláním do Národního registru těhotenství pro antidepresiva na čísle 1-844-405-6185 nebo online na https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Shrnutí rizik
Dostupné údaje z publikovaných epidemiologických studií a postmarketingových zpráv o užívání citalopramu v těhotenství neprokázaly zvýšené riziko závažných vrozených vad nebo potratu. Publikované studie prokázaly, že hladiny citalopramu v pupečníkové krvi i plodové vodě jsou podobné hladinám pozorovaným v mateřském séru. Existuje riziko perzistující plicní hypertenze novorozenců (PPHN) (viz Data ) a/nebo špatná adaptace novorozence při expozici selektivním inhibitorům zpětného vychytávání serotoninu (SSRI), včetně CELEXA, během těhotenství. Existují také rizika spojená s neléčenou depresí v těhotenství (viz Klinické úvahy ).
V reprodukčních studiích na zvířatech způsobil citalopram nežádoucí účinky na embryo/plod v dávkách, které způsobily toxicitu pro matku (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s nemocí
U žen, které během těhotenství vysadily antidepresiva, je větší pravděpodobnost, že dojde k relapsu těžké deprese, než u žen, které v antidepresivech pokračují. Toto zjištění pochází z prospektivní longitudinální studie 201 těhotných žen s anamnézou velké depresivní poruchy, které byly euthymické a užívaly antidepresiva na začátku těhotenství. Zvažte riziko neléčené deprese při přerušení nebo změně léčby antidepresivy během těhotenství a po porodu.
Fetální/neonatální nežádoucí reakce
novorozenců vystavených přípravku CELEXA a dalším SSRI koncem třetího trimestru se vyvinuly komplikace vyžadující prodlouženou hospitalizaci, podporu dýchání a výživu sondou. Takové komplikace mohou nastat ihned po porodu. Hlášené klinické nálezy zahrnovaly respirační tíseň, cyanózu, apnoe, záchvaty, teplotní nestabilitu, potíže s krmením, zvracení, hypoglykémii, hypotonii, hypertonii, hyperreflexii, třes, nervozitu, podrážděnost a neustálý pláč. Tyto nálezy jsou v souladu buď s přímým toxickým účinkem SSRI, nebo možná se syndromem z vysazení léku. Je třeba poznamenat, že v některých případech je klinický obraz v souladu se serotoninovým syndromem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Data
Lidská data
Expozice SSRI během pozdního těhotenství může mít zvýšené riziko perzistující plicní hypertenze novorozenců (PPHN). PPHN se vyskytuje u 1–2 na 1 000 živě narozených dětí v běžné populaci a je spojena s významnou neonatální morbiditou a mortalitou.
Údaje o zvířatech
Citalopram byl podáván perorálně březím krysám během období organogeneze v dávkách 32, 56 a 112 mg/kg/den, což je přibližně 8, 14 a 27násobek maximální doporučené dávky pro člověka (MRHD) 40 mg, na základě na mg/m² tělesného povrchu. Citalopram způsobil mateřskou toxicitu klinických příznaků CNS a snížil přírůstek hmotnosti při dávce 112 mg/kg/den, což je 27násobek MRHD. Při této dávce toxické pro matku citalopram snižoval růst a přežití embrya/plodu a zvýšil abnormality plodu (včetně kardiovaskulárních a kosterních defektů). Hladina bez pozorovaných nežádoucích účinků (NOAEL) pro mateřskou a embryofetální toxicitu je 56 mg/kg/den, což je přibližně 14násobek MRHD.
Citalopram byl podáván perorálně březím králičkám během období organogeneze v dávkách až 16 mg/kg/den, což je přibližně 8násobek MRHD 40 mg, vztaženo na mg/m² tělesného povrchu. Nebyla pozorována žádná mateřská ani embryofetální toxicita. NOAEL pro mateřskou a embryofetální toxicitu je 16 mg/kg/den, což je přibližně 8násobek MRHD.
Citalopram byl podáván perorálně březím krysám během pozdní březosti a období laktace v dávkách 4,8, 12,8 a 32 mg/kg/den, což je přibližně 1, 3 a 8násobek MRHD 40 mg, vztaženo na mg/m² těla. plocha povrchu. Citalopram zvýšil mortalitu potomstva během prvních 4 dnů narození a snížil růst potomstva při dávce 32 mg/kg/den, což je přibližně 8násobek MRHD. NOAEL pro vývojovou toxicitu je 12,8 mg/kg/den, což je přibližně trojnásobek MRHD. V samostatné studii byly pozorovány podobné účinky na úmrtnost a růst potomstva, když byly matky léčeny během březosti a časné laktace dávkami ≥ 24 mg/kg/den, což je přibližně 6násobek MRHD. NOAEL nebyla v této studii stanovena.
Laktace
Shrnutí rizik
Údaje z publikované literatury uvádějí přítomnost citalopramu v mateřském mléce při relativních dávkách kojenců v rozmezí 0,7 až 9,4 % dávky upravené podle hmotnosti matky a poměru mléko/plazma v rozmezí 0,78 až 4,3. Existují zprávy o tom, že kojené děti vystavené citalopramu pociťovaly podrážděnost, neklid, nadměrnou ospalost, snížené krmení a ztrátu hmotnosti (viz Klinické úvahy ). Neexistují žádné informace o účincích citalopramu na produkci mléka.
Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky CELEXA 20 mg a veškerými potenciálními nežádoucími účinky CELEXA 20 mg na kojené dítě nebo základním onemocněním matky.
Klinické úvahy
Sledujte u kojících dětí nežádoucí reakce, jako je podrážděnost, neklid, nadměrná ospalost, snížené krmení a ztráta hmotnosti.
Pediatrické použití
Bezpečnost a účinnost přípravku CELEXA nebyla u pediatrických pacientů stanovena. S přípravkem CELEXA 20 mg byly provedeny dvě placebem kontrolované studie u 407 pediatrických pacientů s MDD a údaje nebyly dostatečné pro podporu použití u pediatrických pacientů.
Antidepresiva zvyšují riziko sebevražedných myšlenek a chování u dětských pacientů [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. V souvislosti s užíváním SSRI u pediatrických pacientů byla pozorována snížená chuť k jídlu a úbytek hmotnosti.
Geriatrické použití
Ze 4 422 pacientů v klinických studiích s přípravkem CELEXA 20 mg bylo 1 357 ve věku 60 a více let, 1 034 bylo ve věku 65 a více let a 457 bylo ve věku 75 a více let. Ve dvou farmakokinetických studiích byla AUC citalopramu zvýšena o 23 % a 30 % u subjektů ve věku ≥ 60 let ve srovnání s mladšími subjekty a jeho poločas byl prodloužen o 30 % a 50 % [viz KLINICKÁ FARMAKOLOGIE ]. Proto je maximální doporučená dávka u pacientů ve věku 60 let a starších nižší než u mladších pacientů [viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
SSRI, včetně CELEXA, byly spojovány s případy klinicky významné hyponatremie u starších pacientů, u kterých může být vyšší riziko této nežádoucí reakce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Poškození jater
U pacientů s poruchou funkce jater dochází ke zvýšené expozici citalopramu. Maximální doporučená dávka přípravku CELEXA 10 mg je nižší u pacientů s poruchou funkce jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Při předávkování tabletami Celexa byly hlášeny následující případy:
- Záchvaty, které mohou být opožděné, a změněný duševní stav včetně kómatu.
- Kardiovaskulární toxicita, která může být opožděná, včetně prodloužení QRS a QTc intervalu, rozsáhlých komplexních tachyarytmií a torsade de pointes. Nejčastěji se vyskytuje hypertenze, ale vzácně se může vyskytnout hypotenze samotná nebo se spoluužívajícími látkami včetně alkoholu.
- serotoninový syndrom (vyšší riziko mohou mít pacienti s vícenásobným předávkováním jinými proserotonergními léky).
Při předávkování přípravkem Celexa se doporučuje dlouhodobé monitorování srdce kvůli riziku arytmie. U pacientů, kteří se dostaví časně po předávkování přípravkem Celexa 10 mg, je třeba zvážit dekontaminaci gastrointestinálního traktu aktivním uhlím. Zvažte kontaktování Toxikologického centra (1-800-221-2222) nebo lékařského toxikologa pro další doporučení pro léčbu předávkování.
KONTRAINDIKACE
CELEXA je kontraindikována u pacientů:
- užívání nebo do 14 dnů po ukončení užívání IMAO (včetně IMAO, jako je linezolid nebo intravenózní methylenová modř) kvůli zvýšenému riziku serotoninového syndromu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
- užívání pimozidu kvůli riziku prodloužení QT intervalu [viz DROGOVÉ INTERAKCE ].
- se známou přecitlivělostí na citalopram nebo na kteroukoli neaktivní složku přípravku CELEXA. Reakce zahrnovaly angioedém a anafylaxi [viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku citalopramu je nejasný, ale předpokládá se, že souvisí se zesílením serotonergní aktivity v centrálním nervovém systému (CNS) v důsledku jeho inhibice zpětného vychytávání serotoninu (5-HT) neurony CNS.
Farmakodynamika
Studie in vitro a in vivo na zvířatech naznačují, že citalopram je selektivní inhibitor zpětného vychytávání serotoninu (SSRI) s minimálními účinky na zpětné vychytávání norepinefrinu (NE) a dopaminu (DA) neurony.
Citalopram nemá žádnou nebo má velmi nízkou afinitu k 5-HT1A, 5-HT2A, dopaminovým D1 a D2, α1-, α2- a β-adrenergním, histaminovým H1, gama-aminomáselné kyselině (GABA), muskarinovým cholinergním a benzodiazepinovým receptorům.
Elektrofyziologie srdce
Individuálně korigovaný QTc (QTcNi) interval byl hodnocen v randomizované, placebem a aktivním (moxifloxacin 400 mg) kontrolované zkřížené, eskalující studii s opakovanými dávkami u 119 zdravých subjektů. Maximální průměr (horní hranice 95% jednostranného intervalu spolehlivosti) rozdíl od placeba byl 8,5 (10,8) a 18,5 (21,0) ms pro 20 mg a 60 mg (1,5násobek maximální doporučené dávky) citalopramu, v daném pořadí. Na základě zjištěného vztahu expozice-odpověď je předpokládaná změna QTcNi oproti placebu (horní hranice 95% jednostranného intervalu spolehlivosti) pod Cmax pro dávku 40 mg 12,6 (14,3) ms [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Farmakokinetika
Farmakokinetika citalopramu po jednorázové a opakované dávce je lineární a úměrná dávce v rozmezí dávek 10 až 40 mg/den. Biotransformace citalopramu probíhá převážně v játrech s průměrným terminálním poločasem asi 35 hodin. Při dávkování jednou denně je ustálených plazmatických koncentrací dosaženo přibližně do jednoho týdne. V ustáleném stavu se očekává, že rozsah akumulace citalopramu v plazmě, na základě poločasu, bude 2,5krát vyšší než plazmatické koncentrace pozorované po jedné dávce.
Vstřebávání
Po jednorázové perorální dávce (40 mg tableta) citalopramu se maximální hladiny v krvi objeví přibližně za 4 hodiny. Absolutní biologická dostupnost citalopramu byla asi 80 % ve srovnání s intravenózní dávkou a absorpce není ovlivněna potravou.
Rozdělení
Distribuční objem citalopramu je asi 12 l/kg a vazba citalopramu (CT), demethylcitalopramu (DCT) a didemethylcitalopramu (DDCT) na lidské plazmatické proteiny je asi 80 %.
Odstranění
Metabolismus
Citalopram je metabolizován na demethylcitalopram (DCT), didemethylcitalopram (DDCT), citalopram-N-oxid a deaminovaný derivát kyseliny propionové. U lidí je nezměněný citalopram převládající látkou v plazmě. V rovnovážném stavu jsou koncentrace metabolitů citalopramu, DCT a DDCT, v plazmě přibližně poloviční a desetinové než původní léčivo. Studie in vitro ukazují, že citalopram je nejméně 8krát účinnější než jeho metabolity v inhibici zpětného vychytávání serotoninu, což naznačuje, že hodnocené metabolity pravděpodobně významně nepřispívají k antidepresivním účinkům citalopramu.
In vitro studie s použitím lidských jaterních mikrozomů ukázaly, že CYP3A4 a CYP2C19 jsou primárními izoenzymy zapojenými do N-demethylace citalopramu.
Vylučování
Po intravenózním podání citalopramu byla frakce léčiva zachycená v moči jako citalopram asi 10 % a DCT asi 5 %, v tomto pořadí. Systémová clearance citalopramu byla 330 ml/min, přičemž přibližně 20 % z toho bylo způsobeno renální clearance.
Specifické populace
Geriatričtí pacienti
Farmakokinetika citalopramu u subjektů ve věku ≥ 60 let byla srovnávána s mladšími subjekty ve dvou studiích s normálními dobrovolníky. Ve studii s jednorázovou dávkou byly AUC a poločas citalopramu zvýšeny u subjektů ve věku ≥ 60 let o 30 % a 50 %, zatímco ve studii s opakovanými dávkami byly zvýšeny o 23 % a 30 % [ vidět DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ].
Mužské A ženské pacienty
Ve třech farmakokinetických studiích (celkem N=32) byla AUC citalopramu u žen jedenapůlkrát až dvakrát vyšší než u mužů. Tento rozdíl nebyl pozorován v pěti dalších farmakokinetických studiích (celkem N=114). V klinických studiích nebyly pozorovány žádné rozdíly v rovnovážných sérových hladinách citalopramu mezi muži (N=237) a ženami (N=388). Ve farmakokinetice DCT a DDCT nebyly žádné rozdíly mezi pohlavími.
Pacienti s poruchou funkce jater
Perorální clearance citalopramu byla snížena o 37 % a poločas se zdvojnásobil u pacientů se sníženou funkcí jater ve srovnání s normálními jedinci (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ].
Pacienti s poruchou ledvin
U pacientů s mírnou až středně těžkou poruchou funkce ledvin byla perorální clearance citalopramu snížena o 17 % ve srovnání s normálními jedinci. U těchto pacientů se nedoporučuje žádná úprava dávkování. Nejsou dostupné žádné informace o farmakokinetice citalopramu u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu
CYP2C19 Špatní metabolizátoři
U pomalých metabolizátorů CYP2C19 byla Cmax citalopramu v ustáleném stavu zvýšena o 68 % a AUC o 107 % [viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
CYP2D6 Špatní metabolizátoři
Hladiny citalopramu v ustáleném stavu se významně nelišily u pomalých a rychlých metabolizátorů CYP2D6.
Studie lékových interakcí
Údaje o inhibici enzymů in vitro neodhalily inhibiční účinek citalopramu na CYP3A4, -2C9 nebo -2E1, ale naznačovaly, že jde o slabý inhibitor CYP1A2, -2D6 a -2C19. Očekává se, že citalopram bude mít malý inhibiční účinek na metabolismus in vivo zprostředkovaný těmito enzymy. Údaje in vivo k řešení této otázky jsou však omezené.
Inhibitory CYP3A4 a CYP2C19
Protože CYP3A4 a CYP2C19 jsou primárními enzymy zapojenými do metabolismu citalopramu, očekává se, že silné inhibitory CYP3A4 (např. ketokonazol, itrakonazol a makrolidová antibiotika) a inhibitory CYP2C19 (např. omeprazol, cimetidin) mohou snižovat clearance citalopram. Současné podávání citalopramu a silného inhibitoru CYP3A4 ketokonazolu však významně neovlivnilo farmakokinetiku citalopramu. 20 mg/den je maximální doporučená dávka citalopramu u pacientů užívajících současně cimetidin nebo jiný inhibitor CYP2C19 kvůli riziku prodloužení QT intervalu (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Cimetidin
subjektů, které dostávaly 21 dní 40 mg/den CELEXA 10 mg, vedlo kombinované podávání 400 mg cimetidinu dvakrát denně po dobu 8 dní ke zvýšení AUC citalopramu o 43 % a Cmax o 39 % [viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Inhibitory CYP2D6
Na základě výsledků studie u pomalých metabolizátorů CYP2D6 je nepravděpodobné, že by současné podávání léku, který inhibuje CYP2D6, s citalopramem klinicky významné účinky na metabolismus citalopramu.
Digoxin
U subjektů, které dostávaly 21 dní 40 mg/den CELEXA 20 mg, kombinované podávání CELEXY a digoxinu (jednorázová dávka 1 mg) významně neovlivnilo farmakokinetiku citalopramu ani digoxinu.
Lithium
Současné podávání přípravku CELEXA (40 mg/den po dobu 10 dnů) a lithia (30 mmol/den po dobu 5 dnů) nemělo žádný významný vliv na farmakokinetiku citalopramu nebo lithia.
pimozid
kontrolované studii byla jednorázová dávka 2 mg pimozidu společně s citalopramem 40 mg podávaná jednou denně po dobu 11 dnů spojena s průměrným zvýšením hodnot QTc přibližně o 10 ms ve srovnání s pimozidem podávaným samostatně. Citalopram neměnil průměrnou AUC nebo Cmax pimozidu. Mechanismus této farmakodynamické interakce není znám [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Theofylin
Kombinované podávání přípravku CELEXA (40 mg/den po dobu 21 dnů) a substrátu CYP1A2 theofylinu (jednorázová dávka 300 mg) neovlivnilo farmakokinetiku theofylinu. Účinek theofylinu na farmakokinetiku citalopramu nebyl hodnocen.
Warfarin
Podání 40 mg/den CELEXY po dobu 21 dnů neovlivnilo farmakokinetiku warfarinu, substrátu CYP3A4. Protrombinový čas byl zvýšen o 5 %, jehož klinický význam není znám.
karbamazepin
Kombinované podávání přípravku CELEXA (40 mg/den po dobu 14 dnů) a karbamazepinu (titrovaného na 400 mg/den po dobu 35 dnů) významně neovlivnilo farmakokinetiku karbamazepinu, substrátu CYP3A4. Přestože minimální plazmatické hladiny citalopramu nebyly ovlivněny, vzhledem k vlastnostem karbamazepinu indukujícím enzymy je třeba vzít v úvahu možnost, že karbamazepin může zvýšit clearance citalopramu, pokud jsou tyto dva léky podávány současně.
triazolam
Kombinované podávání přípravku CELEXA (titrované na 40 mg/den po dobu 28 dní) a substrátu CYP3A4 triazolamu (jednorázová dávka 0,25 mg) významně neovlivnilo farmakokinetiku citalopramu ani triazolamu.
ketokonazol
Kombinované podávání přípravku CELEXA (40 mg) a ketokonazolu (200 mg) snížilo Cmax ketokonazolu o 21 % a AUC o 10 % a významně neovlivnilo farmakokinetiku citalopramu.
metoprolol
Podávání 40 mg/den CELEXA 20 mg po dobu 22 dnů vedlo ke dvojnásobnému zvýšení plazmatických hladin betaadrenergního blokátoru metoprololu. Zvýšené plazmatické hladiny metoprololu byly spojeny se sníženou kardioselektivitou. Současné podávání přípravku CELEXA 10 mg a metoprololu nemělo žádné klinicky významné účinky na krevní tlak nebo srdeční frekvenci.
Imipramin a další tricyklická antidepresiva (TCA)
Studie in vitro naznačují, že citalopram je relativně slabým inhibitorem CYP2D6. Současné podávání přípravku CELEXA (40 mg/den po dobu 10 dnů) s TCA imipraminem (jednorázová dávka 100 mg), substrátem pro CYP2D6, významně neovlivnilo plazmatické koncentrace imipraminu nebo citalopramu. Koncentrace imipraminového metabolitu desipraminu však byla zvýšena přibližně o 50 %. Klinický význam změny desipraminu není znám.
Toxikologie zvířat a/nebo farmakologie
Změny sítnice u potkanů
Patologické změny (degenerace/atrofie) byly pozorovány na sítnici albínských potkanů ve 2leté studii karcinogenity s citalopramem. Došlo ke zvýšení incidence a závažnosti retinální patologie u samců i samic potkanů, kteří dostávali 80 mg/kg/den, což je přibližně 19násobek MRHD 40 mg na základě mg/m² plochy povrchu těla. Podobné nálezy nebyly přítomny u potkanů léčených po dobu dvou let dávkou 24 mg/kg/den, u myší léčených po dobu 18 měsíců v dávkách do 240 mg/kg/den nebo u psů léčených po dobu jednoho roku v dávkách do 20 mg/kg/den, což je přibližně 6, 29 a 17násobek MRHD, v daném pořadí, na základě mg/m² plochy povrchu těla.
Další studie ke zkoumání mechanismu této patologie nebyly provedeny a potenciální význam tohoto účinku u lidí nebyl stanoven.
Klinické studie
Účinnost přípravku CELEXA jako léčby velké depresivní poruchy byla stanovena ve dvou placebem kontrolovaných studiích (trvajících 4 až 6 týdnů) u dospělých ambulantních pacientů (ve věku 18–66 let), kteří splňují kritéria DSM-III nebo DSM-III-R pro velkou depresi porucha (MDD) (studie 1 a 2).
Studie 1, 6týdenní studie, ve které pacienti dostávali fixní dávky 10 mg CELEXY 10 mg, 20 mg, 40 mg a 60 mg denně, ukázala, že CELEXA 40 denně a 60 mg denně (1,5násobek maximální doporučené denní dávky) byla efektivní, jak je měřeno celkovým skóre Hamiltonovy škály hodnocení deprese (HAMD), primárním koncovým bodem účinnosti. HAMD-17 je 17-položková, klinicky hodnocená škála, která se používá k posouzení závažnosti symptomů deprese. Skóre na HAMD-17 se pohybuje od 0 do 52, přičemž vyšší skóre ukazuje na závažnější depresi. Tato studie neprokázala žádný jasný účinek denních dávek 10 mg a 20 mg a denní dávka 60 mg nebyla účinnější než denní dávka 40 mg. Vzhledem k riziku prodloužení QTc intervalu a ventrikulárních arytmií je maximální doporučená dávka přípravku CELEXA 10 mg 40 mg jednou denně.
Ve studii 2, 4týdenní, placebem kontrolované studii u pacientů s MDD, byla počáteční dávka 20 mg denně, po které následovala titrace na maximální tolerovanou dávku nebo maximální dávku 80 mg denně (dvojnásobek maximální doporučené denní dávky ). Pacienti léčení přípravkem CELEXA 20 mg vykázali statisticky významně větší zlepšení než pacienti s placebem v celkovém skóre HAMD, což je primární cílový ukazatel účinnosti. Ve třech dalších placebem kontrolovaných studiích u pacientů s MDD nebyl rozdíl v odpovědi na léčbu mezi pacienty užívajícími přípravek CELEXA a pacienty užívajícími placebo statisticky významný.
Ve dvou dlouhodobých studiích byli pacienti s MDD, kteří reagovali na léčbu přípravkem CELEXA 10 mg během úvodních 6 nebo 8 týdnů akutní léčby, randomizováni k pokračování v léčbě přípravkem CELEXA 10 mg nebo placebem. V jedné studii pacienti dostávali fixní dávky přípravku CELEXA 20 mg nebo 40 mg denně a ve druhé studii pacienti dostávali flexibilní dávky přípravku CELEXA 20 mg denně až 60 mg denně (1,5násobek maximální doporučené denní dávky). V obou studiích se u pacientů, kteří dostávali pokračující léčbu přípravkem CELEXA, vyskytl statisticky významně nižší počet relapsů během následujících 6 měsíců ve srovnání s těmi, kteří dostávali placebo. Ve studii s fixní dávkou bylo snížení míry relapsu deprese podobné u pacientů, kteří dostávali 20 mg nebo 40 mg přípravku CELEXA denně. Vzhledem k riziku prodloužení QTc intervalu a ventrikulárních arytmií je maximální doporučená dávka přípravku CELEXA 20 mg 40 mg jednou denně.
Analýzy vztahu mezi výsledkem léčby a věkem, pohlavím a rasou nenaznačily žádnou rozdílnou citlivost na základě těchto charakteristik pacientů.
INFORMACE PRO PACIENTA
CELEXA® (Suh-leks-uh) (citalopram) Tablety pro perorální podání
Jaké jsou nejdůležitější informace, které bych měl vědět o CELEXA?
CELEXA 20 mg může způsobit závažné nežádoucí účinky, včetně:
- Zvýšené riziko sebevražedných myšlenek a činů. CELEXA 10 mg a další antidepresiva mohou zvýšit sebevražedné myšlenky a činy u některých dětí, dospívajících a mladých dospělých zejména během prvních několika měsíců léčby nebo při změně dávky. CELEXA není určena k použití u dětí.
- Deprese a další duševní choroby jsou nejdůležitějšími příčinami sebevražedných myšlenek a činů.
Jak mohu sledovat a snažit se zabránit sebevražedným myšlenkám a činům u sebe nebo člena rodiny?
- Věnujte zvýšenou pozornost jakýmkoli změnám, zejména náhlým změnám nálady, chování, myšlenek nebo pocitů, nebo pokud se u vás objeví sebevražedné myšlenky nebo činy. To je velmi důležité při zahájení léčby antidepresivem nebo při změně dávky.
- Okamžitě zavolejte svému poskytovateli zdravotní péče a nahlaste nové nebo náhlé změny nálady, chování, myšlenek nebo pocitů.
- Udržujte všechny následné návštěvy u svého poskytovatele zdravotní péče podle plánu. Zavolejte svého poskytovatele zdravotní péče mezi návštěvami podle potřeby, zvláště pokud máte obavy z příznaků.
Zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc, pokud vy nebo váš rodinný příslušník máte některý z následujících příznaků, zejména pokud jsou nové, horší nebo vás znepokojují:
- myšlenky na sebevraždu nebo smrt
- nová nebo horší deprese
- pocit velkého rozrušení nebo neklidu
- potíže se spánkem (nespavost)
- chovat se agresivně, být naštvaný nebo násilný
- extrémní zvýšení aktivity nebo mluvení (mánie)
- pokusy o sebevraždu
- nová nebo horší úzkost
- působící na nebezpečné impulsy
- panický záchvat
- nová nebo horší podrážděnost
- jiné neobvyklé změny v chování nebo náladě
Co je CELEXA?
CELEXA 10 mg je léčivý přípravek na předpis používaný k léčbě určitého typu deprese zvaného velká depresivní porucha (MDD) u dospělých.
Není známo, zda je použití přípravku CELEXA 10 mg u dětí bezpečné a účinné.
Kdo by neměl užívat přípravek CELEXA?
Neužívejte přípravek CELEXA, jestliže:
- užívat inhibitor monoaminooxidázy (MAOI)
- přestali užívat některý IMAO v posledních 14 dnech
- jste léčeni antibiotikem linezolidem nebo intravenózní methylenovou modří
- vezměte pimozid
- jste alergický(á) na citalopram nebo na kteroukoli složku přípravku CELEXA. Úplný seznam složek přípravku CELEXA naleznete na konci tohoto Průvodce léčivy.
Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, pokud si nejste jisti, zda užíváte IMAO, včetně IMAO, jako je linezolid nebo intravenózní methylenová modř.
Nezačínejte užívat některý IMAO alespoň 14 dní po ukončení léčby přípravkem CELEXA.
Před užitím přípravku CELEXA informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- máte nebo máte v rodinné anamnéze sebevraždu, depresi, bipolární poruchu, mánii nebo hypománii
- máte abnormální srdeční rytmus nazývaný prodloužení QT intervalu
- máte nebo jste měl(a) problémy se srdcem, včetně srdečního záchvatu, srdečního selhání, abnormálního srdečního rytmu nebo syndromu dlouhého QT intervalu
- máte nízké hladiny draslíku, hořčíku nebo sodíku v krvi
- máte nebo jste měli problémy s krvácením
- máte nebo jste měl(a) záchvaty (křeče)
- máte vysoký tlak v oku (glaukom)
- máte nebo jste měli problémy s ledvinami nebo játry
- jste těhotná nebo plánujete otěhotnět. CELEXA 20 mg může poškodit vaše nenarozené dítě. Užívání CELEXY v pozdním těhotenství může vést ke zvýšenému riziku určitých problémů u vašeho novorozence. Promluvte si se svým poskytovatelem zdravotní péče o rizicích a přínosech léčby deprese během těhotenství.
- Okamžitě informujte svého poskytovatele zdravotní péče, pokud během léčby přípravkem CELEXA otěhotníte nebo si myslíte, že byste mohla být těhotná.
- Existuje registr těhotenství pro ženy, které jsou vystaveny přípravku CELEXA během těhotenství. Účelem registru je shromažďovat informace o zdraví žen vystavených CELEXA a jejich dítěte. Pokud během léčby přípravkem CELEXA 10 mg otěhotníte, poraďte se se svým poskytovatelem zdravotní péče o registraci v Národním registru těhotenství pro antidepresiva. Můžete se zaregistrovat na telefonním čísle 1-844-405-6185 nebo online na adrese https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- kojíte nebo plánujete kojit. Není známo, zda CELEXA přechází do vašeho mateřského mléka. Poraďte se se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během léčby přípravkem CELEXA.
- Pokud během léčby přípravkem CELEXA 20 mg kojíte, okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u vašeho dítěte objeví ospalost nebo nervozita, špatně se krmí nebo přibírá na váze.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
CELEXA 10 mg a jiné léky se mohou vzájemně ovlivňovat a způsobit tak možné závažné nežádoucí účinky. CELEXA může ovlivnit způsob účinku jiných léků a jiné léky mohou ovlivnit způsob, jakým CELEXA účinkuje.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- léky používané k léčbě migrénových bolestí hlavy známé jako triptany
- tricyklická antidepresiva
- fentanyl
- lithium
- tramadol
- tryptofan
- buspiron
- amfetaminy
- Třezalka tečkovaná
- léky, které mohou ovlivnit srážlivost krve, jako je aspirin, nesteroidní protizánětlivé léky (NSAID) a warfarin
- diuretika
- metadon
- gatifloxacin nebo moxifloxacin
- léky používané ke kontrole srdeční frekvence nebo rytmu (antiarytmika)
- léky používané k léčbě nálady, úzkosti, psychotických poruch nebo poruch myšlení, včetně selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) a inhibitorů zpětného vychytávání serotoninu a norepinefrinu (SNRI)
Pokud si nejste jisti, zda některý z těchto léků užíváte, zeptejte se svého poskytovatele zdravotní péče. Váš poskytovatel zdravotní péče vám může říci, zda je bezpečné užívat přípravek CELEXA 10 mg s jinými léky.
Nezačínejte ani neukončujte během léčby přípravkem CELEXA žádné jiné léky, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče. Náhlé ukončení užívání přípravku CELEXA může způsobit závažné nežádoucí účinky. Vidět, "Jaké jsou možné vedlejší účinky CELEXY?"
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat CELEXA 10 mg?
- Užívejte přípravek CELEXA 20 mg přesně podle pokynů svého poskytovatele zdravotní péče. Neměňte dávku ani nepřestávejte užívat přípravek CELEXA, aniž byste se nejprve poradili se svým poskytovatelem zdravotní péče.
- Váš poskytovatel zdravotní péče možná bude muset změnit dávku přípravku CELEXA, dokud pro vás nebude správná dávka.
- Užívejte přípravek CELEXA 1krát denně s jídlem nebo bez jídla.
- Pokud užijete příliš mnoho přípravku CELEXA 20 mg, zavolejte svého poskytovatele zdravotní péče nebo toxikologické centrum na číslo 1-800-222-1222 nebo jděte ihned na pohotovost v nejbližší nemocnici.
Jaké jsou možné nežádoucí účinky přípravku CELEXA 20 mg?
CELEXA může způsobit závažné nežádoucí účinky, včetně:
- Vidět, "Jaké jsou nejdůležitější informace, které bych měl vědět o CELEXA?"
- Problémy se srdečním rytmem. CELEXA může způsobit závažnou změnu vašeho srdečního tepu (rychlý nebo nepravidelný srdeční tep), která může způsobit smrt. Okamžitě informujte svého poskytovatele zdravotní péče, pokud se cítíte na omdlení, omdlíte nebo pokud máte změnu srdečního rytmu.
- serotoninový syndrom. Užívání přípravku CELEXA může způsobit potenciálně život ohrožující problém nazývaný serotoninový syndrom. Riziko rozvoje serotoninového syndromu se zvyšuje, pokud se CELEXA 20 mg užívá s některými jinými léky. Vidět, "Kdo by neměl užívat CELEXU?" Zavolejte svému poskytovateli zdravotní péče nebo jděte na nejbližší pohotovost v nemocnici jestliže máte některý z následujících známek a příznaků serotoninového syndromu:
- míchání
- vidět nebo slyšet věci, které nejsou skutečné (halucinace)
- zmatek
- kóma
- rychlý tep srdce
- změny krevního tlaku
- závrať
- pocení
- proplachování
- vysoká tělesná teplota (hypertermie)
- třes, ztuhlé svaly nebo svalové záškuby
- ztráta koordinace
- záchvaty
- nevolnost, zvracení, průjem
- Zvýšené riziko krvácení. Užívání přípravku CELEXA 20 mg s aspirinem, nesteroidními protizánětlivými léky (NSAID), warfarinem nebo léky na ředění krve může toto riziko zvýšit. Okamžitě informujte svého poskytovatele zdravotní péče o jakémkoli neobvyklém krvácení nebo modřinách.
- Manické epizody. U lidí s bipolární poruchou, kteří užívají přípravek CELEXA, se mohou objevit manické epizody. Příznaky mohou zahrnovat:
- výrazně zvýšená energie
- vážné potíže se spánkem
- závodní myšlenky
- bezohledné chování
- neobvykle velkolepé nápady
- nadměrné štěstí nebo podrážděnost
- mluvit více nebo rychleji než obvykle
- Syndrom vysazení. Náhlé vysazení přípravku CELEXA 20 mg u Vás může způsobit závažné nežádoucí účinky. Váš poskytovatel zdravotní péče může chtít snižovat dávku pomalu. Příznaky mohou zahrnovat:
- nevolnost
- pocení
- změny vaší nálady
- bolest hlavy
- podrážděnost a neklid
- únava
- závrať
- problémy se spánkem
- pocit elektrického šoku (parestézie)
- hypománie
- úzkost
- zvonění v uších (tinnitus)
- zmatek
- záchvaty
- Záchvaty (křeče).
- Oční problémy (glaukom s uzavřeným úhlem). Mnoho antidepresiv, včetně přípravku CELEXA, může způsobit určitý typ očního problému nazývaného glaukom s uzavřeným úhlem. Zavolejte svého poskytovatele zdravotní péče, pokud máte změny ve vidění nebo bolesti očí.
- Nízké hladiny sodíku v krvi (hyponatremie). Nízké hladiny sodíku ve vaší krvi mohou být vážné a mohou způsobit smrt. Starší lidé mohou být tímto více ohroženi. Okamžitě informujte svého poskytovatele zdravotní péče, pokud se u vás během léčby přípravkem CELEXA objeví známky nebo příznaky nízké hladiny sodíku v krvi. Příznaky a příznaky nízké hladiny sodíku ve vaší krvi mohou zahrnovat:
- bolest hlavy
- potíže se soustředěním
- změny paměti
- zmatek
- slabost a neklid na nohou, což může vést k pádům
V závažných nebo náhlých případech příznaky a příznaky zahrnují:
-
- halucinace (vidět nebo slyšet věci, které nejsou skutečné)
- mdloba
- záchvaty
- kóma
- zastavení dýchání
- smrt
- Sexuální problémy (dysfunkce). Užívání selektivních inhibitorů zpětného vychytávání serotoninu (SSRI), včetně přípravku CELEXA, může způsobit sexuální problémy.
Příznaky u mužů mohou zahrnovat:
- Zpožděná ejakulace nebo neschopnost ejakulace
- Snížená chuť na sex
- Problémy s dosažením nebo udržením erekce
Příznaky u žen mohou zahrnovat:
- Snížená chuť na sex
- Odložený orgasmus nebo neschopnost dosáhnout orgasmu
Promluvte si se svým poskytovatelem zdravotní péče, pokud se u vás během léčby přípravkem DRIZALMA SPRINKLE objeví jakékoli změny ve vaší sexuální funkci nebo pokud máte nějaké otázky nebo obavy ohledně sexuálních problémů. Může existovat léčba, kterou může navrhnout váš poskytovatel zdravotní péče.
Nejčastějším vedlejším účinkem přípravku CELEXA je opožděná ejakulace.
Toto nejsou všechny možné vedlejší účinky přípravku CELEXA.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám přípravek CELEXA uchovávat?
- Uchovávejte CELEXA při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
- Uchovávejte CELEXA 20 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném užívání přípravku CELEXA
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Neužívejte CELEXA 20 mg při onemocnění, pro které nebyla předepsána. Nedávejte CELEXU jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku CELEXA, které jsou určeny pro zdravotnické pracovníky.
Jaké složky obsahuje CELEXA?
Aktivní složka: citalopram hydrobromid
Neaktivní složky: kopolyvidon, kukuřičný škrob, sodná sůl kroskarmelózy, glycerin, monohydrát laktózy, magnesium-stearát, hypromelóza, mikrokrystalická celulóza, polyethylenglykol, oxid titaničitý a oxid železitý pro barvení.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
