Amoxil 250mg, 500mg, 625mg, 1000mg Amoxicillin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Amoxicilin a jak se používá?
Co je Amoxil 1000 mg?
Amoxil je lék na předpis používaný k léčbě příznaků mnoha různých typů bakteriálních infekcí, jako je tonsilitida, bronchitida, pneumonie a infekce ucha, nosu, krku, kůže nebo močových cest. Amoxil 1000 mg lze užívat samostatně nebo s jinými léky.
Amoxil patří do třídy léků nazývaných peniciliny, Amino.
Jaké jsou možné vedlejší účinky přípravku Amoxil?
Amoxil může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- horečka,
- bolest krku,
- pálení očí,
- bolest kůže,
- červená nebo fialová kožní vyrážka s puchýři a olupováním,
- silná bolest žaludku a
- průjem, který je vodnatý nebo krvavý (i když se objeví měsíce po vaší poslední dávce)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Amoxil patří:
- nevolnost,
- zvracení,
- průjem a
- vyrážka
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Amoxil. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Formulace AMOXILu obsahují amoxicilin, semisyntetické antibiotikum, analog ampicilinu, se širokým spektrem baktericidní aktivity proti mnoha grampozitivním a gramnegativním mikroorganismům. Chemicky se jedná o (2S,5,R,6,R)-6-[(,R)-(-)-2-amino-2-(p-hydroxyfenyl)acetamido]-3,3-dimethyl-7- trihydrát oxo-4-thia-l-azabicyklo[3.2.0]heptan-2-karboxylové kyseliny. Strukturálně může být reprezentován jako:
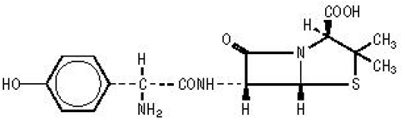
Molekulární vzorec amoxicilinu je C16H19N3O5S•3H2O a molekulová hmotnost je 419,45.
Kapsle : Každá tobolka AMOXILu s královsky modrým neprůhledným uzávěrem a růžovým neprůhledným tělem obsahuje 250 mg nebo 500 mg amoxicilinu jako trihydrát. Na víčku a těle 250mg tobolky je potištěno označení AMOXIL 1000 mg a 250; uzávěr a tělo 500mg tobolky jsou potištěny AMOXILem 1000 mg a 500. Neaktivní složky: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, želatina, stearát hořečnatý a oxid titaničitý.
Jedna tableta obsahuje 500 mg nebo 875 mg amoxicilinu ve formě trihydrátu. Každá potahovaná růžová tableta ve tvaru tobolky má vyraženo AMOXIL 500 mg se středem nad 500, respektive 875. 875mg tableta s půlicí rýhou na druhé straně. Neaktivní složky: koloidní oxid křemičitý, krospovidon, hliníkový lak FD&C Red č. 30, hypromelóza, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, sodná sůl glykolátu škrobu a oxid titaničitý.
Prášek pro perorální suspenzi Každých 5 ml rekonstituované suspenze obsahuje 125 mg, 200 mg, 250 mg nebo 400 mg amoxicilinu ve formě trihydrátu. Každých 5 ml 125mg rekonstituované suspenze obsahuje 0,11 mEq (2,51 mg) sodíku. Každých 5 ml 200mg rekonstituované suspenze obsahuje 0,15 mEq (3,39 mg) sodíku. Každých 5 ml 250 mg rekonstituované suspenze obsahuje 0,15 mEq (3,36 mg) sodíku; každých 5 ml 400 mg rekonstituované suspenze obsahuje 0,19 mEq (4,33 mg) sodíku. Neaktivní složky: FD&C Red No. 3, příchutě, silikagel, benzoát sodný, citrát sodný, sacharóza a xantanová guma.
INDIKACE
Infekce Uší, Nosu A Krku
AMOXIL® je indikován k léčbě infekcí způsobených citlivými (POUZE negativními na β-laktamázu) izoláty druhů Streptococcus. (pouze α- a β-hemolytické izoláty), Streptococcus pneumoniae, Staphylococcus spp. nebo Haemophilus influenzae.
Infekce urogenitálního traktu
AMOXIL® je indikován k léčbě infekcí způsobených citlivými (POUZE negativními na β-laktamázu) izoláty Escherichia coli, Proteus mirabilis nebo Enterococcus faecalis.
Infekce Kůže A Struktury Kůže
AMOXIL® je indikován k léčbě infekcí způsobených citlivými (POUZE negativními na β-laktamázu) izoláty Streptococcus spp. (pouze α- a β-hemolytické izoláty), Staphylococcus spp. nebo E. coli.
Infekce Dolních Dýchacích Cest
AMOXIL® je indikován k léčbě infekcí způsobených citlivými (POUZE negativními na β-laktamázu) izoláty Streptococcus spp. (pouze α-a β-hemolytické izoláty), S. pneumoniae, Staphylococcus spp. nebo H. influenzae.
Infekce Helicobacter Pylori
Trojitá terapie pro Helicobacter pylori s klarithromycinem a lansoprazolem
AMOXIL v kombinaci s klarithromycinem a lansoprazolem jako trojkombinace je indikován k léčbě pacientů s infekcí H. pylori a vředovou chorobou dvanáctníku (aktivní nebo 1 rok v anamnéze duodenálního vředu) k eradikaci H. pylori. Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu.
Duální terapie pro H. pylori s lansoprazolem
AMOXIL v kombinaci s tobolkami s lansoprazolem s opožděným uvolňováním jako duální terapie je indikován k léčbě pacientů s infekcí H. pylori a duodenální vředovou chorobou (aktivní nebo 1 rok v anamnéze duodenálního vředu) kteří jsou buď alergičtí nebo netolerují klarithromycin nebo u nichž je známa nebo existuje podezření na rezistenci na klarithromycin. (Vidět příbalový leták klarithromycinu , Mikrobiologie .) Eradikace H. pylori prokazatelně snižuje riziko recidivy duodenálního vředu.
Používání
Pro omezení rozvoje bakterií rezistentních vůči lékům a zachování účinnosti AMOXILu (amoxicilinu) a dalších antibakteriálních léků by měl být AMOXIL 250 mg používán pouze k léčbě infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování pro dospělé a dětské pacienty > 3 měsíce věku
Léčba by měla pokračovat minimálně 48 až 72 hodin po uplynutí doby, kdy se pacient stane asymptomatickým nebo kdy byly získány důkazy o eradikaci bakterií. Doporučuje se alespoň 10denní léčba jakékoli infekce způsobené Streptococcus pyogenes, aby se zabránilo výskytu akutní revmatické horečky. U některých infekcí může být nutná terapie po dobu několika týdnů. Může být nutné pokračovat v klinickém a/nebo bakteriologickém sledování několik měsíců po ukončení léčby.
Dávkování u novorozenců a kojenců ve věku ≤ 12 týdnů (≤ 3 měsíce)
Léčba by měla pokračovat minimálně 48 až 72 hodin po uplynutí doby, kdy se pacient stane asymptomatickým nebo kdy byly získány důkazy o eradikaci bakterií. Doporučuje se alespoň 10denní léčba jakékoli infekce způsobené Streptococcus pyogenes, aby se zabránilo výskytu akutní revmatické horečky. Vzhledem k neúplně vyvinuté renální funkci ovlivňující eliminaci amoxicilinu v této věkové skupině je doporučená horní dávka AMOXILu 30 mg/kg/den rozdělená každých 12 hodin. V současné době neexistují žádná doporučení pro dávkování pro pediatrické pacienty s poruchou funkce ledvin.
Dávkování pro infekci H. pylori
Trojitá terapie
Doporučená perorální dávka pro dospělé je 1 gram AMOXILu 1000 mg, 500 mg klarithromycinu a 30 mg lansoprazolu, všechny se podávají dvakrát denně (každých 12 hodin) po dobu 14 dnů.
Duální terapie
Doporučená perorální dávka pro dospělé je 1 gram AMOXILu 625 mg a 30 mg lansoprazolu, každý podávaný třikrát denně (každých 8 hodin) po dobu 14 dnů. Přečtěte si prosím úplné informace o předepisování klarithromycinu a lansoprazolu.
Dávkování při poškození ledvin
- Pacienti s poruchou funkce ledvin obecně nevyžadují snížení dávky, pokud není porucha závažná.
- Pacienti se závažnou poruchou s rychlostí glomerulární filtrace
- Pacienti s rychlostí glomerulární filtrace 10 až 30 ml/min by měli dostávat 500 mg nebo 250 mg každých 12 hodin, v závislosti na závažnosti infekce.
- Pacienti s rychlostí glomerulární filtrace nižší než 10 ml/min by měli dostávat 500 mg nebo 250 mg každých 24 hodin, v závislosti na závažnosti infekce.
- Hemodialyzovaní pacienti by měli dostávat 500 mg nebo 250 mg každých 24 hodin v závislosti na závažnosti infekce. Měli by dostat další dávku během dialýzy i na jejím konci.
Pokyny pro míchání perorální suspenze
Poklepejte na láhev, dokud všechen prášek volně nevyteče. Přidejte přibližně 1/3 celkového množství vody pro rekonstituci (viz tabulka 2) a důkladně protřepejte na vlhký prášek. Přidejte zbytek vody a znovu důkladně protřepejte.
Po rekonstituci by mělo být požadované množství suspenze umístěno přímo na jazyk dítěte, aby jej mohlo spolknout. Alternativním způsobem podávání je přidání požadovaného množství suspenze do umělé výživy, mléka, ovocné šťávy, vody, zázvorového piva nebo studených nápojů. Tyto přípravky by se pak měly okamžitě užít.
POZNÁMKA: PŘED POUŽITÍM ÚSTNÍ SUSPENZI DOBŘE PROTŘEPEJTE. Uchovávejte lahvičku těsně uzavřenou. Jakákoli nepoužitá část rekonstituované suspenze musí být po 14 dnech zlikvidována. Upřednostňuje se chlazení, ale není nutné.
JAK DODÁVÁNO
Dávkové formy A Síly
Kapsle
250 mg, 500 mg. Každá tobolka AMOXIL 625 mg s královsky modrým neprůhledným uzávěrem a růžovým neprůhledným tělem obsahuje 250 mg nebo 500 mg amoxicilinu jako trihydrát. Na víčku a těle 250mg tobolky je potištěno označení AMOXIL a 250; na uzávěru a těle tobolky 500 mg je potisk AMOXIL a 500.
Tablety
500 mg, 875 mg. Jedna tableta obsahuje 500 mg nebo 875 mg amoxicilinu ve formě trihydrátu. Každá potahovaná růžová tableta ve tvaru tobolky má vyražený AMOXIL se středem nad 500 nebo 875, v tomto pořadí. 875mg tableta s půlicí rýhou na druhé straně.
Prášek pro perorální suspenzi
125 mg/5 ml, 200 mg/5 ml, 250 mg/5 ml, 400 mg/5 ml. Každých 5 ml rekonstituované suspenze s jahodovou příchutí obsahuje 125 mg amoxicilinu ve formě trihydrátu. Každých 5 ml rekonstituované suspenze s příchutí žvýkačky obsahuje 200 mg, 250 mg nebo 400 mg amoxicilinu ve formě trihydrátu.
Skladování A Manipulace
Kapsle: Každá tobolka AMOXIL s neprůhledným víčkem královské modři a růžovým neprůhledným tělem obsahuje 250 mg nebo 500 mg amoxicilinu jako trihydrát. Na víčku a těle 250mg tobolky je potištěno označení AMOXIL a 250; na uzávěru a těle tobolky 500 mg je potisk AMOXIL a 500.
250 mg kapsle
NDC 43598-025-01 Láhve po 100 ks NDC 43598-025-05 Láhve po 500
500 mg kapsle
NDC 43598-005-01 Láhve po 100 ks NDC 43598-005-05 Láhve po 500
Jedna tableta obsahuje 500 mg nebo 875 mg amoxicilinu ve formě trihydrátu. Každá potahovaná růžová tableta ve tvaru tobolky má vyražený AMOXIL se středem nad 500 nebo 875, v tomto pořadí. 875mg tableta s půlicí rýhou na druhé straně.
500 mg tablety
NDC 43598-024-01 Láhve po 100 ks NDC 43598-024-05 Láhve po 500
875 mg tablety
NDC 43598-019-01 Láhve po 100 ks NDC 43598-019-14 Láhve po 20
Prášek pro perorální suspenzi: Každých 5 ml rekonstituované suspenze s jahodovou příchutí obsahuje 125 mg amoxicilinu ve formě trihydrátu. Každých 5 ml rekonstituované suspenze s příchutí žvýkačky obsahuje 200 mg, 250 mg nebo 400 mg amoxicilinu ve formě trihydrátu.
125 mg/5 ml
NDC 43598-022-80 80ml lahvička NDC 43598-022-52 100ml lahvička NDC 43598-022-53 Láhev 150 ml
200 mg/5 ml
NDC 43598-023-50 50ml lahvička NDC 43598-023-51 75ml lahvička NDC 43598-023-52 100ml lahvička
250 mg/5 ml
NDC 43598-009-80 Láhev 80 ml NDC 43598-009-52 Láhev 100 ml NDC 43598-009-53 Láhev 150 ml
400 mg/5 ml
NDC 43598-007-50 50ml lahvička NDC 43598-007-51 Láhev 75 ml NDC 43598-007-52 Láhev 100 ml
Uchovávejte při teplotě do 20 °C (68 °F) – 250 mg a 500 mg tobolky a 125 mg a 250 mg nerozpuštěného prášku.
Uchovávejte při teplotě do 25 °C (77 °F) – 500 mg a 875 mg tablety a 200 mg a 400 mg nerozpuštěného prášku.
Dávkujte v těsné nádobě.
Vyrobeny. Autor: Dr. Reddy's Laboratories Tennessee, LLC. Bristol, TN 37620. Revize: září 2015
VEDLEJŠÍ EFEKTY
Následující jsou podrobněji diskutovány v jiných částech označování:
- Anafylaktické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- CDAD [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Nejčastější nežádoucí účinky (> 1 %) pozorované v klinických studiích tobolek, tablet nebo perorální suspenze AMOXIL byly průjem, vyrážka, zvracení a nauzea.
Trojitá terapie : Nejčastěji hlášenými nežádoucími účinky u pacientů, kteří dostávali trojkombinaci (amoxicilin/klaritromycin/lansoprazol), byly průjem (7 %), bolest hlavy (6 %) a poruchy chuti (5 %).
Duální terapie : Nejčastěji hlášenými nežádoucími účinky u pacientů, kteří dostávali dvojitou léčbu amoxicilinem/lansoprazolem, byly průjem (8 %) a bolest hlavy (7 %). Další informace o nežádoucích účincích klarithromycinu nebo lansoprazolu naleznete v části Nežádoucí účinky v jejich příbalových informacích.
Postmarketingové nebo jiné zkušenosti
Kromě nežádoucích příhod hlášených z klinických studií byly během postmarketingového užívání penicilinů identifikovány následující příhody. Protože jsou hlášeny dobrovolně z populace neznámé velikosti, nelze provést odhad frekvence. Tyto příhody byly vybrány pro zahrnutí kvůli kombinaci jejich závažnosti, četnosti hlášení nebo potenciální kauzální souvislosti s AMOXILem.
- Infekce a infestace : Mukokutánní kandidóza.
- Gastrointestinální : Černý chlupatý jazyk a hemoragická/pseudomembranózní kolitida. Nástup symptomů pseudomembranózní kolitidy se může objevit během nebo po antibakteriální léčbě [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Hypersenzitivní reakce : Anafylaxe [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Byly hlášeny reakce podobné sérové nemoci, erytematózní makulopapulární vyrážky, erythema multiforme, Stevens-Johnsonův syndrom, exfoliativní dermatitida, toxická epidermální nekrolýza, akutní generalizovaná exantematózní pustulóza, hypersenzitivní vaskulitida a kopřivka.
- Játra Bylo zaznamenáno mírné zvýšení AST a/nebo ALT, ale význam tohoto zjištění není znám. Byly hlášeny jaterní dysfunkce včetně cholestatické žloutenky, jaterní cholestázy a akutní cytolytické hepatitidy.
- Renální : Byla hlášena krystalurie [viz PŘEDÁVKOVÁNÍ ].
- Hemický a lymfatický systém : Byla hlášena anémie, včetně hemolytické anémie, trombocytopenie, trombocytopenická purpura, eozinofilie, leukopenie a agranulocytóza. Tyto reakce jsou obvykle po přerušení léčby reverzibilní a má se za to, že se jedná o jevy přecitlivělosti.
- Centrální nervový systém : Byla hlášena reverzibilní hyperaktivita, agitovanost, úzkost, nespavost, zmatenost, křeče, změny chování a/nebo závratě
- Smíšený : Bylo hlášeno zbarvení zubů (hnědé, žluté nebo šedé zabarvení). Většina hlášení se objevila u dětských pacientů. Zbarvení bylo ve většině případů sníženo nebo odstraněno kartáčováním nebo čištěním zubů.
DROGOVÉ INTERAKCE
Probenecid
Probenecid snižuje renální tubulární sekreci amoxicilinu. Současné užívání amoxicilinu a probenecidu může vést ke zvýšeným a prodlouženým hladinám amoxicilinu v krvi.
Perorální antikoagulancia
U pacientů užívajících amoxicilin a perorální antikoagulancia bylo hlášeno abnormální prodloužení protrombinového času (zvýšený mezinárodní normalizovaný poměr [INR]). Při současném předepisování antikoagulancií by mělo být provedeno odpovídající monitorování. K udržení požadované úrovně antikoagulace může být nutné upravit dávku perorálních antikoagulancií.
allopurinol
Současné podávání alopurinolu a amoxicilinu zvyšuje výskyt vyrážek u pacientů užívajících oba léky ve srovnání s pacienty užívajícími samotný amoxicilin. Není známo, zda je tato potenciace amoxicilinových vyrážek způsobena alopurinolem nebo hyperurikémií přítomnou u těchto pacientů.
Orální antikoncepce
AMOXIL může ovlivnit střevní flóru, což vede k nižší reabsorpci estrogenu a snížené účinnosti kombinovaných perorálních estrogen/progesteronových kontraceptiv.

Další antibakteriální látky
Chloramfenikol, makrolidy, sulfonamidy a tetracykliny mohou interferovat s baktericidními účinky penicilinu. To bylo prokázáno in vitro; klinický význam této interakce však není dobře zdokumentován.
Účinky na laboratorní testy
Vysoké koncentrace ampicilinu v moči mohou vést k falešně pozitivním reakcím při testování přítomnosti glukózy v moči pomocí CLINITEST®, Benedict's Solution nebo Fehling's Solution. Vzhledem k tomu, že k tomuto účinku může dojít také u amoxicilinu, doporučuje se použít glukózové testy založené na enzymatických glukózooxidázových reakcích (jako je CLINISTIX®).
Po podání ampicilinu nebo amoxicilinu těhotným ženám byl zaznamenán přechodný pokles plazmatické koncentrace celkového konjugovaného estriolu, estriol-glukuronidu, konjugovaného estronu a estradiolu.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Anafylaktické reakce
U pacientů léčených penicilinem včetně amoxicilinu byly hlášeny závažné a příležitostně fatální hypersenzitivní (anafylaktické) reakce. Ačkoli je anafylaxe častější po parenterální léčbě, objevila se u pacientů užívajících perorální peniciliny. Tyto reakce se pravděpodobněji vyskytují u jedinců s anamnézou přecitlivělosti na penicilin a/nebo anamnézou citlivosti na více alergenů. Existují zprávy o jedincích s anamnézou přecitlivělosti na penicilin, u kterých se vyskytly závažné reakce při léčbě cefalosporiny. Před zahájením léčby přípravkem AMOXIL je třeba pečlivě zjistit předchozí hypersenzitivní reakce na peniciliny, cefalosporiny nebo jiné alergeny.
Průjem spojený s Clostridium Difficile
Průjem spojený s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně AMOXILu, a jeho závažnost se může pohybovat od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po použití antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než 2 měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibiotická léčba C. difficile a chirurgické vyšetření.
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku AMOXIL v nepřítomnosti prokázané nebo silně podezřelé bakteriální infekce přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Použití u pacientů s mononukleózou
U vysokého procenta pacientů s mononukleózou, kteří dostávají amoxicilin, se rozvine erytematózní kožní vyrážka. Amoxicilin by proto neměl být podáván pacientům s mononukleózou.
Fenylketonurika
Amoxil 250 mg žvýkací tablety obsahují aspartam, který obsahuje fenylalanin. Jedna 200mg žvýkací tableta obsahuje 1,82 mg fenylalaninu; jedna 400mg žvýkací tableta obsahuje 3,64 mg fenylalaninu. Perorální suspenze Amoxil neobsahují fenylalanin a mohou být používány fenylketonuriky.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyly provedeny dlouhodobé studie na zvířatech pro hodnocení karcinogenního potenciálu. Studie k detekci mutagenního potenciálu samotného amoxicilinu nebyly provedeny; nicméně následující informace jsou dostupné z testů na směsi amoxicilinu a klavulanátu draselného v poměru 4:1 (AUGMENTIN). AUGMENTIN nebyl mutagenní v testu Amesovy bakteriální mutace a testu konverze genu kvasinek. AUGMENTIN byl slabě pozitivní v testu myšího lymfomu, ale trend ke zvýšení četnosti mutací v tomto testu se objevil při dávkách, které byly také spojeny se sníženým přežitím buněk. AUGMENTIN byl negativní v myším mikronukleovém testu a v dominantním letálním testu u myší. Samotný klavulanát draselný byl testován v Amesově bakteriálním mutačním testu a v myším mikronukleovém testu a byl negativní v každém z těchto testů. Ve vícegenerační reprodukční studii na potkanech nebylo pozorováno žádné poškození fertility nebo jiné nepříznivé reprodukční účinky při dávkách až 500 mg/kg (přibližně dvojnásobek 3 g dávky pro člověka na základě tělesného povrchu).
Použití u konkrétních populací
Těhotenství
Teratogenní účinky
Těhotenství Kategorie B. Reprodukční studie byly provedeny na myších a potkanech v dávkách až 2000 mg/kg (3 a 6násobek dávky 3 g pro člověka, na základě plochy povrchu těla). Nebylo prokázáno poškození plodu amoxicilinem. Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, měl by být amoxicilin během těhotenství používán pouze tehdy, je-li to nezbytně nutné.
Práce a dodání
Perorální ampicilin se během porodu špatně vstřebává. Není známo, zda použití amoxicilinu u lidí během porodu nebo porodu má okamžité nebo opožděné nežádoucí účinky na plod, prodlužuje trvání porodu nebo zvyšuje pravděpodobnost nutnosti porodnického zákroku.
Kojící matky
Bylo prokázáno, že peniciliny se vylučují do lidského mléka. Užívání amoxicilinu kojícími matkami může vést k senzibilizaci kojenců. Při podávání amoxicilinu kojící ženě je třeba postupovat opatrně.
Pediatrické použití
Vzhledem k neúplně vyvinuté renální funkci u novorozenců a malých kojenců může být eliminace amoxicilinu zpožděna. Dávkování přípravku AMOXIL 625 mg by mělo být upraveno u pediatrických pacientů ve věku 12 týdnů nebo mladších (≤ 3 měsíce). [Vidět DÁVKOVÁNÍ A PODÁVÁNÍ ]
Geriatrické použití
Byla provedena analýza klinických studií AMOXIL 250 mg, aby se zjistilo, zda subjekty ve věku 65 let a více reagují odlišně od mladších subjektů. Tyto analýzy nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců.
Je známo, že tento lék je v podstatě vylučován ledvinami a riziko toxických reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin.
Dávkování při poškození ledvin
Amoxicilin je primárně eliminován ledvinami a u pacientů s těžkou poruchou funkce ledvin (GFR Dávkování při poškození ledvin pro konkrétní doporučení u pacientů s poruchou funkce ledvin.
PŘEDÁVKOVAT
V případě předávkování přerušte léčbu, ošetřete symptomaticky a podle potřeby zaveďte podpůrná opatření. Prospektivní studie 51 pediatrických pacientů v toxikologickém centru naznačila, že předávkování amoxicilinu nižší než 250 mg/kg není spojeno s významnými klinickými příznaky.
Intersticiální nefritida vedoucí k oligurickému selhání ledvin byla hlášena u malého počtu pacientů po předávkování amoxicilinem1.
Po předávkování amoxicilinem u dospělých a dětských pacientů byla také hlášena krystalurie, v některých případech vedoucí k selhání ledvin. V případě předávkování by měl být zachován dostatečný příjem tekutin a diuréza, aby se snížilo riziko krystalurie amoxicilinu.
Zdá se, že poškození ledvin je po ukončení podávání léku reverzibilní. Vysoké hladiny v krvi se mohou vyskytnout snadněji u pacientů s poruchou funkce ledvin v důsledku snížené renální clearance amoxicilinu. Amoxicilin lze odstranit z oběhu hemodialýzou.
KONTRAINDIKACE
AMOXIL 625 mg je kontraindikován u pacientů, kteří prodělali závažnou hypersenzitivní reakci (např. anafylaxe nebo Stevens-Johnsonův syndrom) na AMOXIL nebo na jiná β-laktamová antibiotika (např. peniciliny a cefalosporiny).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Amoxicilin je antibakteriální léčivo. [vidět Mikrobiologie ].
Farmakokinetika
Vstřebávání
Amoxicilin je stabilní v přítomnosti žaludeční kyseliny a po perorálním podání se rychle vstřebává. Částečně byl zkoumán vliv potravy na absorpci amoxicilinu z tablet a suspenze AMOXILU; Formulace 400 mg a 875 mg byly studovány pouze při podávání na začátku lehkého jídla.
Perorálně podávané dávky 250 mg a 500 mg amoxicilinových tobolek vedou k průměrným maximálním hladinám v krvi 1 až 2 hodiny po podání v rozmezí 3,5 mcg/ml až 5,0 mcg/ml a 5,5 mcg/ml až 7,5 mcg/ml, v daném pořadí .
Průměrné farmakokinetické parametry amoxicilinu z otevřené, dvoudílné, jednodávkové zkřížené bioekvivalenční studie u 27 dospělých, porovnávající 875 mg AMOXILU s 875 mg AUGMENTINU® (amoxicilin/klavulanát draselný) ukázaly, že 875mg tableta AMOXILU 500 mg AUC0-∞ 35,4 ± 8,1 mcg•hod/ml a Cmax 13,8 ± 4,1 mcg/ml. Dávkování bylo na začátku lehkého jídla po celonočním hladovění.
Orálně podávané dávky amoxicilinové suspenze, 125 mg/5 ml a 250 mg/5 ml, vedou k průměrným maximálním hladinám v krvi 1 až 2 hodiny po podání v rozmezí 1,5 mcg/ml až 3,0 mcg/ml a 3,5 mcg/ml až 5,0 mcg/ml, resp.
Perorální podání jednotlivých dávek 400 mg žvýkacích tablet a 400 mg/5 ml suspenze AMOXIL 625 mg 24 dospělým dobrovolníkům poskytlo srovnatelné farmakokinetické údaje:
Rozdělení
Amoxicilin snadno difunduje do většiny tělesných tkání a tekutin, s výjimkou mozkové a míšní tekutiny, kromě případů, kdy jsou zanícené mozkové blanky. V krevním séru je amoxicilin přibližně z 20 % vázán na proteiny. Po 1 gramové dávce a použití speciální techniky kožního okna ke stanovení hladin antibiotika bylo zjištěno, že terapeutické hladiny byly nalezeny v intersticiální tekutině.
Metabolismus a vylučování
Poločas amoxicilinu je 61,3 minut. Přibližně 60 % perorálně podané dávky amoxicilinu se vyloučí močí během 6 až 8 hodin. Detekovatelné hladiny v séru jsou pozorovány až 8 hodin po perorálně podané dávce amoxicilinu. Vzhledem k tomu, že většina amoxicilinu se vylučuje v nezměněné podobě močí, jeho vylučování může být zpožděno současným podáváním probenecidu (viz DROGOVÉ INTERAKCE ].
Mikrobiologie
Mechanismus působení
Amoxicilin je podobný penicilinu ve svém baktericidním účinku proti citlivým bakteriím ve fázi aktivního množení. Působí prostřednictvím inhibice biosyntézy buněčné stěny, která vede ke smrti bakterií.
Mechanismus odporu
Rezistence na amoxicilin je zprostředkována primárně prostřednictvím enzymů nazývaných beta-laktamázy, které štěpí beta-laktamový kruh amoxicilinu a činí jej neaktivním.
Bylo prokázáno, že amoxicilin je účinný proti většině izolátů bakterií uvedených níže, a to jak in vitro, tak při klinických infekcích, jak je popsáno v INDIKACE A POUŽITÍ sekce.
Gram-pozitivní bakterie
Enterococcus faecalis Staphylococcus spp. Streptococcus pneumoniae Streptococcus spp. (alfa a beta-hemolytická)
Gram-negativní bakterie
Escherichia coli Haemophilus influenzae Helicobacter pylori Proteus mirabilis
Metody testování citlivosti
Je-li to možné, měla by klinická mikrobiologická laboratoř poskytovat lékaři kumulativní výsledky testů citlivosti in vitro na antimikrobiální léky používané v místních nemocnicích a ordinacích jako pravidelné zprávy, které popisují profil citlivosti nozokomiálních a komunitně získaných patogenů. Tyto zprávy by měly pomoci lékaři při výběru nejúčinnějšího antimikrobiálního prostředku.
Techniky ředění: Kvantitativní metody se používají ke stanovení antimikrobiálních minimálních inhibičních koncentrací (MIC). Tyto MIC poskytují odhady citlivosti bakterií na antimikrobiální sloučeniny. MIC by měly být stanoveny pomocí standardizované testovací metody (bujón nebo agar)2,4. Hodnoty MIC by měly být interpretovány podle kritérií v tabulce 4.
Difúzní techniky: Kvantitativní metody, které vyžadují měření průměrů zón, mohou také poskytnout reprodukovatelné odhady citlivosti bakterií na antimikrobiální sloučeniny3,4. Velikost zóny by měla být určena pomocí standardizované zkušební metody3.
Citlivost Enterococcus spp., Enterobacteriaceae a H. influenzae na amoxicilin lze odvodit testováním ampicilinu4. Citlivost Staphylococcus spp. a beta-hemolytický Streptococcus spp. na amoxicilin lze odvodit testováním penicilinu4. Většina izolátů Enterococcus spp. které jsou rezistentní na ampicilin nebo amoxicilin, produkují beta-laktamázu typu TEM. Test na beta-laktamázu může poskytnout rychlý způsob stanovení rezistence na ampicilin a amoxicilin4.
Citlivost Streptococcus pneumoniae (nemeningitidové izoláty) na amoxicilin lze odvodit testováním penicilinu nebo oxacilinu4. Interpretační kritéria pro S. pneumoniae pro amoxicilin jsou uvedena v tabulce 44.
Hlášení „citlivé“ naznačuje, že antimikrobiální látka pravděpodobně inhibuje růst patogenu, pokud antimikrobiální sloučenina dosáhne koncentrace v místě infekce nezbytné k inhibici růstu patogenu. Zpráva „Střední“ znamená, že výsledek by měl být považován za nejednoznačný, a pokud mikroorganismus není plně citlivý na alternativní, klinicky proveditelné léky, test by se měl opakovat. Tato kategorie implikuje možnou klinickou použitelnost v místech těla, kde je léčivo fyziologicky koncentrované. Tato kategorie také poskytuje nárazníkovou zónu, která zabraňuje malým nekontrolovaným technickým faktorům způsobit velké nesrovnalosti ve výkladu. Zpráva „Rezistentní“ naznačuje, že antimikrobiální látka pravděpodobně nebude inhibovat růst patogenu, pokud antimikrobiální sloučenina dosáhne koncentrace obvykle dosažitelné v místě infekce; měla by být zvolena jiná terapie.
Testování citlivosti na Helicobacter pylori
Metody testování citlivosti na amoxicilin in vitro pro stanovení minimálních inhibičních koncentrací (MIC) a velikosti zón nebyly standardizovány, validovány ani schváleny pro testování H. pylori. Vzorky na H. pylori a výsledky testu citlivosti klarithromycinu by měly být získány na izolátech od pacientů, u kterých selhala trojitá terapie. Pokud je zjištěna rezistence na klarithromycin, je třeba použít režim bez klarithromycinu.
Kontrola kvality
Standardizované postupy testování citlivosti2,3,4 vyžadují použití laboratorních kontrol k monitorování a zajištění přesnosti a přesnosti zásob a činidel používaných v testu a technik jednotlivců provádějících kontrolu testu. Standardní prášek amoxicilinu by měl poskytovat následující rozsah hodnot MIC uvedený v tabulce 54. Pro techniku difúze by mělo být dosaženo kritérií uvedených v tabulce 5.
Klinické studie
Eradikace H. pylori ke snížení rizika recidivy duodenálního vředu
Randomizované, dvojitě zaslepené klinické studie provedené ve Spojených státech u pacientů s H. pylori a duodenální vředovou chorobou (definovanou jako aktivní vřed nebo vřed v anamnéze do 1 roku) hodnotily účinnost lansoprazolu v kombinaci s tobolkami amoxicilinu a tabletami klarithromycinu jako trojitá 14denní terapie nebo v kombinaci s tobolkami amoxicilinu jako duální 14denní terapie k eradikaci H. pylori. Na základě výsledků těchto studií byla stanovena bezpečnost a účinnost 2 různých eradikačních režimů: Trojitá terapie: Amoxicilin 1 gram dvakrát denně/klaritromycin 500 mg dvakrát denně/lansoprazol 30 mg dvakrát denně (viz tabulka 6). Duální terapie: Amoxicilin 1 gram třikrát denně/lansoprazol 30 mg třikrát denně (viz tabulka 7. Všechny léčby trvaly 14 dní. Eradikace H. pylori byla definována jako 2 negativní testy (kultivace a histologie) 4 až 6 týdnů po ukončení léčby Bylo prokázáno, že trojitá terapie je účinnější než všechny možné kombinace duoterapie Duoterapie se ukázala jako účinnější než obě monoterapie Eradikace H. pylori prokazatelně snižuje riziko recidivy duodenálního vředu.
REFERENCE
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Účinky požití penicilinu a cefalosporinu u dětí mladších šesti let. Vet Hum Toxicol. 1988; 30: 66-67.
2. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti pro bakterie, které rostou aerobně; Schválený standard – desáté vydání. Dokument CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro antimikrobiální diskové difúzní testy citlivosti; Schválený standard – dvanácté vydání. CLSI dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
4. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro testování antimikrobiální citlivosti; Dvacátý pátý informační doplněk, dokument CLSI M100-S25. CLSI dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
INFORMACE PRO PACIENTA
- Pacienti by měli být upozorněni, že AMOXIL lze užívat každých 8 hodin nebo každých 12 hodin v závislosti na předepsané dávce.
- Pacienti by měli být poučeni, že antibakteriální léky, včetně AMOXILu, by měly být používány pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je přípravek AMOXIL 250 mg předepsán k léčbě bakteriální infekce, je třeba pacientům říci, že ačkoli je běžné, že se na začátku léčby cítí lépe, lék by měl být užíván přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může: (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem AMOXIL 625 mg nebo jinými antibakteriálními léky. .
- Pacienti by měli být poučeni, že průjem je častým problémem způsobeným antibiotiky a obvykle končí, když je antibiotikum vysazeno. Někdy po zahájení léčby antibiotiky se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich), a to dokonce až 2 nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, pacienti by měli co nejdříve kontaktovat svého lékaře.
- Pacienti by si měli být vědomi toho, že AMOXIL obsahuje léčivý přípravek třídy penicilinu, který může u některých jedinců způsobit alergické reakce.
