Vantin 200mg, 100mg Cefpodoxime Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Vantin 100 mg a jak se používá?
Vantin 100 mg je lék na předpis používaný k léčbě příznaků různých bakteriálních infekcí, jako je bronchitida, zápal plic, sinusitida, faryngitida, tonzilitida, infekce močových cest, kožní infekce a kapavka. Vantin 200 mg lze užívat samostatně nebo s jinými léky.
Vantin patří do třídy léků nazývaných kaphalosporiny, 3. generace.
Není známo, zda je přípravek Vantin bezpečný a účinný u dětí mladších 2 měsíců.
Jaké jsou možné vedlejší účinky přípravku Vantin 200 mg?
Vantin může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- horečka,
- bolest krku,
- pálení ve tvých očích,
- bolest kůže,
- červená nebo fialová kožní vyrážka, která se šíří a způsobuje puchýře a olupování,
- silná bolest žaludku,
- průjem, který je vodnatý nebo krvavý,
- oteklé žlázy,
- bolest kloubů,
- celkový pocit nemoci,
- bušení srdce,
- chvění v tvé hrudi,
- dušnost a
- záchvat
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Vantin patří:
- vaginální svědění nebo výtok,
- plenková vyrážka u kojence užívajícího tento lék,
- nevolnost,
- zvracení,
- průjem,
- bolest žaludku a
- bolest hlavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Vantin. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Pro omezení rozvoje bakterií rezistentních vůči lékům a zachování účinnosti přípravku VANTIN 100 mg a dalších antibakteriálních léků by měl být přípravek VANTIN 100 mg používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny bakteriemi.
POPIS
Cefpodoxim proxetil je perorálně podávané, rozšířené, polosyntetické antibiotikum ze třídy cefalosporinů. Chemický název je (RS)-1(isopropoxykarbonyloxy)ethyl (+)-(6R,7R)-7-[2-(2-amino-4-thiazolyl)-2-{(Z)methoxyimino}acetamido]-3 -methoxymethyl-8-oxo-5-thia-l-azabicyklo[4.2.0]okt-2-en-2-karboxylát. Jeho empirický vzorec je C21H27N5O9S2 a jeho strukturní vzorec je uveden níže:
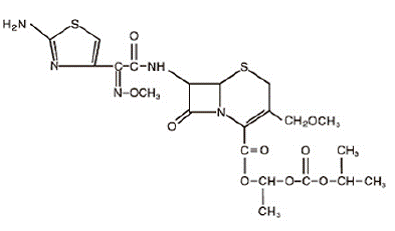
Molekulová hmotnost cefpodoxim proxetilu je 557,6.
Cefpodoxim proxetil je proléčivo; jeho aktivním metabolitem je cefpodoxim. Všechny dávky cefpodoxim proxetilu v tomto inzertu jsou vyjádřeny jako aktivní cefpodoximová skupina. Lék se dodává jak ve formě potahovaných tablet, tak i jako ochucený granulát pro perorální suspenzi.
Tablety VANTIN obsahují cefpodoxim proxetil ekvivalentní 100 mg nebo 200 mg aktivity cefpodoximu a následující neaktivní složky: vápenatá sůl karboxymethylcelulózy, karnaubský vosk, FD&C Yellow č. 6, hydroxypropylcelulóza, hypromelóza, hydratovaná laktóza, stearát hořečnatý, propylenglykolsulfát sodný a propylenglykol. oxid titaničitý. Kromě toho 100 mg potahované tablety obsahují D&C Yellow č. 10 a 200 mg potahované tablety obsahují FD&C Red č. 40.
Každých 5 ml perorální suspenze VANTIN obsahuje cefpodoxim proxetil ekvivalentní 50 mg nebo 100 mg aktivity cefpodoximu po rekonstituci a následující neaktivní složky: umělá aromata, butylhydroxyanisol (BHA), sodná sůl karboxymethylcelulózy, mikrokrystalická celulóza, karagenan, kyselina citrónová, kololoid oxid křemičitý, sodná sůl kroskarmelózy, hydroxypropylcelulóza, laktóza, maltodextrin, přírodní příchutě, propylenglykol alginát, citrát sodný, benzoát sodný, škrob, sacharóza a rostlinný olej.
INDIKACE
Cefpodoxim proxetil je indikován k léčbě pacientů s mírnými až středně těžkými infekcemi způsobenými citlivými kmeny určených mikroorganismů za níže uvedených stavů.
Doporučené dávkování, trvání léčby a příslušné populace pacientů se u těchto infekcí liší. Konkrétní doporučení naleznete v části DÁVKOVÁNÍ A PODÁVÁNÍ. Akutní zánět středního ucha způsobené Streptococcus pneumoniae (s výjimkou kmenů rezistentních na penicilin), Streptococcus pyogenes, Haemophilus influenzae (včetně kmenů produkujících beta-laktamázu) nebo Moraxella (Branhamella) catarrhalis (včetně kmenů produkujících beta-laktamázu).
Faryngitida a/nebo tonzilitida způsobená Streptococcus pyogenes.
POZNÁMKA: V profylaxi revmatické horečky se ukázal jako účinný pouze penicilin intramuskulárním způsobem podání. Cefpodoxim proxetil je obecně účinný při eradikaci streptokoků z orofaryngu. Údaje prokazující účinnost cefpodoxim proxetilu v profylaxi následné revmatické horečky však nejsou k dispozici.
Komunitní pneumonie způsobené S. pneumoniae nebo H. Influenzae (včetně kmenů produkujících beta-laktamázu).
Akutní bakteriální exacerbace chronické bronchitidy způsobené S. pneumoniae, H. influenzae (pouze kmeny neprodukující betalaktamázu) nebo M. catarrhalis. Údaje jsou v současnosti nedostatečné pro stanovení účinnosti u pacientů s akutní bakteriální exacerbací chronické bronchitidy způsobené kmeny H. influenzae produkujícími beta-laktamázu.
Akutní, nekomplikovaná uretrální a cervikální kapavka způsobené Neisseria gonorrhoeae (včetně kmenů produkujících penicilinázu).
Akutní, nekomplikované anorektální infekce u žen kvůli Neisseria gonorrhoeae (včetně kmenů produkujících penicilinázu).
POZNÁMKA: Účinnost cefpodoximu při léčbě pacientů mužského pohlaví s rektálními infekcemi způsobenými N. gonorrhoeae nebyla stanovena. Údaje nepodporují použití cefpodoxim proxetilu v léčbě faryngálních infekcí způsobených N. gonorrhoeae u mužů nebo žen.
Nekomplikované infekce kůže a kožní struktury způsobené Staphylococcus aureus (včetně kmenů produkujících penicilinázu) nebo Streptococcus pyogenes. Abscesy by měly být chirurgicky drénovány, jak je klinicky indikováno.
POZNÁMKA: V klinických studiích byla úspěšná léčba nekomplikovaných infekcí kůže a kožních struktur závislá na dávce. Účinná terapeutická dávka u kožních infekcí byla vyšší než u jiných doporučených indikací. (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ .)
Akutní maxilární sinusitida způsobené Haemophilus influenzae (včetně kmenů produkujících beta-laktamázu), Streptococcus pneumoniae a Moraxella catarrhalis.
Nekomplikované infekce močových cest (cystitida) způsobené Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis nebo Staphylococcus saprophyticus.
POZNÁMKA: Při zvažování použití cefpodoxim proxetilu v léčbě cystitidy je třeba zvážit nižší míru eradikace bakterií cefpodoxim proxetilu oproti zvýšené míře eradikace a různým bezpečnostním profilům některých jiných tříd schválených látek. (Vidět Klinické studie sekce.)
Měly by být získány vhodné vzorky pro bakteriologické vyšetření za účelem izolace a identifikace původců a stanovení jejich citlivosti na cefpodoxim. Během čekání na výsledky těchto studií může být zahájena terapie. Jakmile budou tyto výsledky k dispozici, měla by být antimikrobiální léčba odpovídajícím způsobem upravena.
Pro omezení rozvoje bakterií rezistentních vůči lékům a zachování účinnosti přípravku VANTIN 100 mg a dalších antibakteriálních léků by měl být přípravek VANTIN 200 mg používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
(Vidět INDIKACE A POUŽITÍ pro uvedené patogeny.)
Tablety potahované filmem
Tablety VANTIN by měly být podávány perorálně s jídlem, aby se zvýšila absorpce. (Vidět KLINICKÁ FARMAKOLOGIE .)
Doporučené dávkování, trvání léčby a příslušná populace pacientů jsou popsány v následující tabulce:
Dospělí a dospívající (ve věku 12 let a starší)
Granule pro perorální suspenzi
VANTIN perorální suspenze může být podávána bez ohledu na jídlo. Doporučené dávkování, trvání léčby a příslušné populace pacientů jsou popsány v následující tabulce:
Dospělí a dospívající (ve věku 12 let a starší)
Kojenci a dětští pacienti (ve věku od 2 měsíců do 12 let)
Pacienti s renální dysfunkcí
U pacientů s těžkou poruchou funkce ledvin (clearance kreatininu
Pokud je k dispozici pouze hladina kreatininu v séru, lze k odhadu clearance kreatininu (ml/min) použít následující vzorec (na základě pohlaví, hmotnosti a věku pacienta). Aby byl tento odhad platný, hladina kreatininu v séru by měla představovat ustálený stav funkce ledvin.
Muži (ml/min): Hmotnost (kg) x (140 – věk)/ 72 x sérový kreatinin (mg/100 ml)
Ženy (ml/min) : 0,85 x nad hodnotou
Pacienti s cirhózou
Farmakokinetika cefpodoximu u pacientů s cirhózou (s ascitem nebo bez něj) je podobná jako u zdravých subjektů. Úprava dávky není u této populace nutná.
Příprava Suspenze
Konstituční pokyny pro orální pozastavení
Po smíchání by měla být suspenze uchovávána v chladničce, 2° až 8°C (36° až 46°F). Před použitím dobře protřepejte. Nádobu uchovávejte těsně uzavřenou. Směs lze používat 14 dní. Nepoužitou část po 14 dnech zlikvidujte.
JAK DODÁVÁNO
Tablety VANTIN jsou k dispozici v následujících silách (ekvivalent cefpodoximu), barvách a velikostech:
100 mg (světle oranžová, elipsovitá, s vyraženým U3617)
Láhve po 20 NDC 0009-3617-01 Láhve po 100 ks NDC 0009-3617-02 Jednodávkové balení po 100 kusech NDC 0009-3617-03
200 mg (korálově červená, elipsovitá, s vyraženým U3618)
Láhve po 20 NDC 0009-3618-01 Láhve po 100 ks NDC 0009-3618-02
200 mg (korálově červená, elipsovitá, s vyraženým U3618)
Jednodávkové balení po 100 ks NDC 0009-3618-03
Uchovávejte tablety při kontrolované pokojové teplotě 20 ° až 25 ° C (68 ° až 77 ° F) [viz USP ].
Po každém otevření uzávěr bezpečně nasaďte zpět. Chraňte jednotková balení před nadměrnou vlhkostí.
VANTIN 200 mg perorální suspenze poskytuje ekvivalent 50 mg nebo 100 mg cefpodoximu na 5 ml suspenze (je-li připraven podle návodu) a je k dispozici s příchutí citronového krému v následujících velikostech:
50 mg/5 ml
100 ml suspenze NDC 0009-3531-01 75 ml suspenze NDC 0009-3531-02 50 ml suspenze NDC 0009-3531-03
100 mg/5 ml
100 ml suspenze NDC 0009-3615-01 75 ml suspenze NDC 0009-3615-02 50 ml suspenze NDC 0009-3615-03
Nesuspendované granule skladujte při kontrolované pokojové teplotě 20° až 25°C (68° až 77°F) [viz USP ].
Pokyny pro míchání jsou uvedeny na štítku. Po smíchání by měla být suspenze uchovávána v chladničce, 2° až 8°C (36° až 46°F). Před použitím dobře protřepejte. Nádobu uchovávejte těsně uzavřenou. Směs lze používat 14 dní. Nepoužitou část po 14 dnech zlikvidujte.
Distribuuje: Pharmacia & Upjohn Company, divize společnosti Pfizer Inc., NY, NY 10017. Revize: srpen 2016
VEDLEJŠÍ EFEKTY
Klinické testy
Potahované tablety (více dávek)
V klinických studiích s použitím více dávek cefpodoxim proxetil potahovaných tablet bylo 4 696 pacientů léčeno doporučenými dávkami cefpodoximu (100 až 400 mg Q 12 hodin). Nedošlo k žádnému úmrtí nebo trvalému postižení, které by souviselo s toxicitou drog. Sto dvacet devět (2,7 %) pacientů přerušilo medikaci kvůli nežádoucím příhodám, o kterých se předpokládá, že mohou nebo pravděpodobně souvisí s toxicitou léku. Devadesát tři (52 %) ze 178 pacientů, kteří přerušili léčbu (ať už se domnívali, že souvisejí s farmakoterapií či nikoli), tak učinilo kvůli gastrointestinálním poruchám, nevolnosti, zvracení nebo průjmu. Procento pacientů léčených cefpodoxim proxetilem, kteří vysadili studovaný lék z důvodu nežádoucích účinků, bylo významně vyšší při dávce 800 mg denně než při dávce 400 mg denně nebo při dávce 200 mg denně. Nežádoucí účinky, o kterých se v klinických studiích s opakovanými dávkami (N=4696 pacientů léčených cefpodoximem) domnívalo, že mohou nebo pravděpodobně souvisejí s cefpodoximem, byly:
Incidence větší než 1 %
Průjem 7,0 %
Průjem nebo řídká stolice byly závislé na dávce: pokles z 10,4 % pacientů užívajících 800 mg denně na 5,7 % u pacientů užívajících 200 mg denně. Z pacientů s průjmem mělo 10 % organismus nebo toxin C. difficile ve stolici. (Vidět VAROVÁNÍ .)
Nevolnost 3,3 % vaginální mykotické infekce 1,0 % vulvovaginální infekce 1,3 % bolest břicha 1,2 % bolest hlavy 1,0 %
Výskyt menší než 1 %
Podle tělesného systému v sestupném pořadí
Klinické studie
Nežádoucí příhody pravděpodobně nebo pravděpodobně související s cefpodoxim-proxetilem, které se vyskytly u méně než 1 % pacientů (N=4696)
Tělo - plísňové infekce, abdominální distenze, malátnost, únava, astenie, horečka, bolest na hrudi, bolest zad, zimnice, generalizovaná bolest, abnormální mikrobiologické testy, moniliáza, absces, alergická reakce, edém obličeje, bakteriální infekce, parazitární infekce, lokalizovaný edém, lokalizovaná bolest .
Kardiovaskulární - městnavé srdeční selhání, migréna, palpitace, vazodilatace, hematom, hypertenze, hypotenze.
Zažívací - zvracení, dyspepsie, sucho v ústech, plynatost, snížená chuť k jídlu, zácpa, orální moniliáza, anorexie, říhání, gastritida, vředy v ústech, gastrointestinální poruchy, poruchy rekta, poruchy jazyka, poruchy zubů, zvýšená žízeň, orální léze, tenesmus, sucho v krku, bolest zubů .
Hemické a lymfatické - anémie.
Metabolické a nutriční - dehydratace, dna, periferní edém, zvýšení tělesné hmotnosti.
Muskuloskeletální - myalgie.
nervózní - závratě, nespavost, ospalost, úzkost, třes, nervozita, mozkový infarkt, změna snů, poruchy koncentrace, zmatenost, noční můry, parestézie, vertigo.
Respirační - astma, kašel, epistaxe, rýma, sípání, bronchitida, dušnost, pleurální výpotek, pneumonie, sinusitida.
Kůže - kopřivka, vyrážka, svědění v místě bez aplikace, pocení, makulopapulózní vyrážka, plísňová dermatitida, deskvamace, suchá kůže v místě bez aplikace, vypadávání vlasů, vezikulobulózní vyrážka, spálení sluncem.
Speciální smysly - změny chuti, podráždění očí, ztráta chuti, tinitus.
Urogenitální - hematurie, infekce močových cest, metroragie, dysurie, frekvence močení, nykturie, infekce penisu, proteinurie, vaginální bolest.
Granule pro perorální suspenzi (více dávek)
klinických studiích s opakovanými dávkami cefpodoxim proxetil granulí pro přípravu perorální suspenze bylo 2 128 pediatrických pacientů (93 % z nich bylo mladších 12 let) léčeno doporučenými dávkami cefpodoximu (10 mg/kg/den Q 24 hodin nebo rozděleně Q 12 hodin do maximální ekvivalentní dávky pro dospělé). U žádného z pacientů v těchto studiích nedošlo k úmrtí nebo trvalému postižení. 24 pacientů (1,1 %) přerušilo medikaci kvůli nežádoucím účinkům, o kterých se předpokládá, že mohou nebo pravděpodobně souvisí se studovaným lékem. Tato přerušení se týkala především gastrointestinálních poruch, obvykle průjmu, zvracení nebo vyrážky.
Nežádoucí příhody, o kterých se v klinických studiích s opakovanými dávkami (N=2128 pacientů léčených cefpodoximem) považovalo za možná nebo pravděpodobně související nebo neznámou souvislost s cefpodoxim proxetilem pro perorální suspenzi, byly:
Incidence větší než 1 %
Průjem 6,0 % Výskyt průjmu u kojenců a batolat (ve věku 1 měsíc až 2 roky) byl 12,8 %. Plenková vyrážka/plísňová kožní vyrážka 2,0 % (zahrnuje moniliázu) Výskyt plenkové vyrážky u kojenců a batolat byl 8,5 %. Jiné kožní vyrážky 1,8 % Zvracení 2,3 %
Výskyt menší než 1 %
Tělo: Lokalizovaná bolest břicha, křeče v břiše, bolest hlavy, monilie, generalizovaná bolest břicha, astenie, horečka, plísňová infekce.
Zažívací: Nevolnost, monilie, anorexie, sucho v ústech, stomatitida, pseudomembranózní kolitida.
Hemické a lymfatické: Trombocytémie, pozitivní přímý Coombsův test, eozinofilie, leukocytóza, leukopenie, prodloužený parciální tromboplastinový čas, trombocytopenická purpura.
Metabolické a nutriční: Zvýšený SGPT.
Muskulo-kosterní: Myalgie.
Nervový: Halucinace, hyperkineze, nervozita, somnolence.
Respirační: Epistaxe, rýma.

Kůže: Kožní moniliáza, kopřivka, plísňová dermatitida, akné, exfoliativní dermatitida, makulopapulózní vyrážka.
Speciální smysly: Chuťová perverze.
Potahované tablety (jedna dávka)
V klinických studiích s použitím a jednorázová dávka cefpodoxim proxetil potahovaných tablet bylo 509 pacientů léčeno doporučenou dávkou cefpodoximu (200 mg). V těchto studiích nedošlo k žádnému úmrtí nebo trvalému postižení, které by souviselo s toxicitou léků.
Nežádoucí účinky, o kterých se v klinických studiích s jednorázovou dávkou prováděných ve Spojených státech amerických považovalo za možná nebo pravděpodobně související s cefpodoximem, byly:
Incidence větší než 1 %
Nevolnost 1,4 % Průjem 1,2 %
Výskyt menší než 1 %
Centrální nervový systém: Závrať, bolest hlavy, synkopa. Dermatologické: vyrážka. Genitální: Vaginitida. Gastrointestinální: Bolest břicha. Psychiatrické: Úzkost.
Laboratorní změny
Významné laboratorní změny, které byly hlášeny u dospělých a dětských pacientů v klinických studiích s cefpodoxim proxetilem, bez ohledu na lékový vztah, byly:
Jaterní: Přechodné zvýšení AST (SGOT), ALT (SGPT), GGT, alkalické fosfatázy, bilirubinu a LDH.
Hematologické: Eozinofilie, leukocytóza, lymfocytóza, granulocytóza, bazofilie, monocytóza, trombocytóza, snížený hemoglobin, snížený hematokrit, leukopenie, neutropenie, lymfocytopenie, trombocytopenie, trombocytémie, pozitivní Coombsův test a prodloužená PT a PTT.
Chemie séra: Hyperglykémie, hypoglykémie, hypoalbuminémie, hypoproteinémie, hyperkalémie a hyponatremie.
Renální: Zvýšení BUN a kreatininu.
Většina těchto abnormalit byla přechodná a nebyla klinicky významná.
Postmarketingové zkušenosti
Byly hlášeny následující závažné nežádoucí účinky: alergické reakce včetně Stevens-Johnsonova syndromu, toxická epidermální nekrolýza, erythema multiforme a reakce podobné sérové nemoci, pseudomembranózní kolitida, krvavý průjem s bolestí břicha, ulcerózní kolitida, rektoragie s hypotenzí, anafylaktický šok, akutní poškození jater, expozice in utero s potratem, purpurová nefritida, plicní infiltrát s eozinofilií a dermatitida očních víček.
Jedno úmrtí bylo připsáno pseudomembranózní kolitidě a diseminované intravaskulární koagulaci.
Označení třídy cefalosporinů
Kromě výše uvedených nežádoucích účinků, které byly pozorovány u pacientů léčených cefpodoxim proxetilem, byly u antibiotik třídy cefalosporinů hlášeny následující nežádoucí účinky a změněné laboratorní testy:
Nežádoucí účinky a abnormální laboratorní testy: Renální dysfunkce, toxická nefropatie, jaterní dysfunkce včetně cholestázy, aplastická anémie, hemolytická anémie, reakce podobná sérové nemoci, krvácení, agranulocytóza a pancytopenie.
Některé cefalosporiny se podílejí na spouštění záchvatů, zejména u pacientů s poruchou funkce ledvin, kdy dávka nebyla snížena. (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ a PŘEDÁVKOVÁNÍ .) Pokud se vyskytnou záchvaty spojené s farmakoterapií, je třeba lék vysadit. Pokud je to klinicky indikováno, lze podat antikonvulzivní léčbu.
DROGOVÉ INTERAKCE
Antacida
Současné podávání vysokých dávek antacidů (hydrogenuhličitanu sodného a hydroxidu hlinitého) nebo H2 blokátorů snižuje maximální plazmatické hladiny o 24 % až 42 % a rozsah absorpce o 27 % až 32 %, v tomto pořadí. Rychlost absorpce se těmito souběžně podávanými léky nemění. Perorální anticholinergika (např. propanthelin) zpomalují maximální plazmatické hladiny (47% zvýšení Tmax), ale neovlivňují rozsah absorpce (AUC).
Probenecid
Stejně jako u jiných beta-laktamových antibiotik bylo renální vylučování cefpodoximu inhibováno probenecidem a mělo za následek přibližně 31% zvýšení AUC a 20% zvýšení maximálních plazmatických hladin cefpodoximu.
Nefrotoxické léky
Ačkoli nefrotoxicita nebyla zaznamenána při podávání cefpodoxim-proxetil samostatně, doporučuje se pečlivé sledování funkce ledvin, pokud je cefpodoxim-proxetil podáván současně se sloučeninami se známým nefrotoxickým potenciálem.
Interakce drog/laboratorních testů
Je známo, že cefalosporiny, včetně cefpodoxim proxetilu, příležitostně vyvolávají pozitivní přímý Coombsův test.
VAROVÁNÍ
PŘED ZAHÁJENÍM TERAPIE CEFPODOXIMEM PROXETIL BY MĚLO BÝT PROVEDENO PEČLIVÉHO ŠETŘENÍ A ZJIŠTĚNO, ZDA PACIENT MĚL PŘEDCHOZÍ REAKCE PŘECITLIVOSTI NA CEFPODOXIM, JINÉ CEPHALOSPORINY, GSOR. POKUD MÁ BÝT CEFPODOXIM PODÁN PACIENTŮM CITLIVÝM NA PENICILIN, MĚLA BY BÝT OPATRNOST, PROTOŽE ZŘÍŽENÁ HYPERCITLIVITA MEZI BETA-LAKTAMOVÝMI ANTIBIOTIKY H BYLA JASNĚ DOKUMENTOVÁNA A MŮŽE SE VYSKYTOVAT AŽ 10 % PENICILISG U VŠECH. V PŘÍPADĚ ALERGICKÉ REAKCE NA CEFPODOXIME PROXETIL, LÉK VYRUŠTE. VÁŽNÉ AKUTNÍ REAKCE PŘECITLIVOSTI MŮŽE VYŽADOVAT LÉČBA EPINEFRINEM A JINÁ NOUZOVÁ OPATŘENÍ, VČETNĚ KYSLÍKU, INTRAVENÓZNÍCH TEKULIN, INTRAVENOZNÍCH ANTIHISTAMINEK A LÉČBY DÝCHACÍCH CEST, JAK JE KLINICKY INDIKOVÁNO.
Průjem spojený s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně VANTINU, a může mít rozsah závažnosti od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po užívání antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibiotická léčba C. difficile a chirurgické vyšetření.
Bylo vyvinuto společné úsilí o monitorování C. difficile u pacientů s průjmem léčených cefpodoximem kvůli zvýšenému výskytu průjmu spojeného s C. difficile v časných studiích u normálních subjektů. Organismy nebo toxin C. difficile byly hlášeny u 10 % dospělých pacientů léčených cefpodoximem s průjmem; u těchto pacientů však nebyla stanovena žádná specifická diagnóza pseudomembranózní kolitidy.
Po uvedení přípravku na trh mimo Spojené státy byly obdrženy zprávy o pseudomembranózní kolitidě spojené s užíváním cefpodoxim proxetilu.
OPATŘENÍ
Všeobecné
U pacientů s přechodným nebo přetrvávajícím snížením výdeje moči v důsledku renální insuficience by měla být celková denní dávka cefpodoxim proxetilu snížena, protože u těchto jedinců se po obvyklých dávkách mohou vyskytnout vysoké a dlouhodobé koncentrace antibiotik v séru. Cefpodoxim, stejně jako jiné cefalosporiny, by měl být podáván s opatrností pacientům, kteří jsou současně léčeni silnými diuretiky. (Vidět DÁVKOVÁNÍ A PODÁVÁNÍ .)
Stejně jako u jiných antibiotik může dlouhodobé užívání cefpodoxim proxetilu vést k přemnožení necitlivých organismů. Opakované hodnocení stavu pacienta je nezbytné. Pokud se během léčby objeví superinfekce, je třeba přijmout vhodná opatření.
Je nepravděpodobné, že by předepsání přípravku VANTIN v nepřítomnosti prokázané nebo silně suspektní bakteriální infekce nebo profylaktické indikace přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Karcinogeneze, mutageneze, zhoršení plodnosti
Dlouhodobé studie karcinogeneze cefpodoxim proxetilu na zvířatech nebyly provedeny. Studie mutageneze cefpodoximu, včetně Amesova testu s metabolickou aktivací i bez ní, testu chromozomových aberací, testu neplánované syntézy DNA, mitotické rekombinace a genové konverze, testu dopředných genových mutací a mikronukleárního testu in vivo, byly všechny negativní. Při perorálním podávání 100 mg/kg/den nebo méně (dvojnásobek dávky pro člověka vztaženo na mg/m2) potkanům nebyly zaznamenány žádné nežádoucí účinky na fertilitu nebo reprodukci.
Těhotenství
Teratogenní účinky
Cefpodoxim proxetil nebyl ani teratogenní, ani embryocidní, když byl podáván potkanům během organogeneze v dávkách až 100 mg/kg/den (dvojnásobek dávky pro člověka na mg/m²) nebo králíkům v dávkách až 30 mg/kg/den (1 -2násobek lidské dávky na základě mg/m²).
Neexistují však žádné adekvátní a dobře kontrolované studie použití cefpodoxim proxetilu u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Práce a dodání
Cefpodoxim proxetil nebyl studován pro použití během porodu a porodu. Léčba by měla být podána pouze tehdy, je-li to nezbytně nutné.
Kojící matky
Cefpodoxim se vylučuje do lidského mléka. Ve studii u 3 kojících žen byly hladiny cefpodoximu v mateřském mléce 0 %, 2 % a 6 % souběžných sérových hladin za 4 hodiny po perorální dávce 200 mg cefpodoxim proxetilu. 6 hodin po podání byly hladiny 0 %, 9 % a 16 % souběžných sérových hladin. Vzhledem k možnosti závažných reakcí u kojených dětí je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u kojenců mladších 2 měsíců nebyla stanovena.
Geriatrické použití
3338 pacientů v klinických studiích s opakovanými dávkami potahovaných tablet cefpodoxim proxetil bylo 521 (16 %) ve věku 65 let a více, zatímco 214 (6 %) bylo ve věku 75 let a více. Mezi staršími a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti. U zdravých geriatrických subjektů s normální funkcí ledvin byl poločas cefpodoximu v plazmě v průměru 4,2 hodiny a obnovení moči v průměru 21 % po dávce 400 mg podávané každých 12 hodin po dobu 15 dnů. Ostatní farmakokinetické parametry se nezměnily ve srovnání s těmi, které byly pozorovány u zdravých mladších subjektů.
Úprava dávky u starších pacientů s normální funkcí ledvin není nutná.
PŘEDÁVKOVAT
Ve studiích akutní toxicity na hlodavcích nevyvolala jediná perorální dávka 5 g/kg žádné nežádoucí účinky.
V případě závažné toxické reakce z předávkování může hemodialýza nebo peritoneální dialýza pomoci odstranit cefpodoxim z těla, zejména pokud je narušena funkce ledvin.
Toxické příznaky po předávkování beta-laktamovými antibiotiky mohou zahrnovat nevolnost, zvracení, epigastrické potíže a průjem.
KONTRAINDIKACE
Cefpodoxim proxetil je kontraindikován u pacientů se známou alergií na cefpodoxim nebo na cefalosporinovou skupinu antibiotik.
KLINICKÁ FARMAKOLOGIE
Absorpce A Vylučování
Cefpodoxim proxetil je proléčivo, které se absorbuje z gastrointestinálního traktu a deesterifikuje na svůj aktivní metabolit, cefpodoxim. Po perorálním podání 100 mg cefpodoxim proxetilu subjektům nalačno bylo přibližně 50 % podané dávky cefpodoximu systémově absorbováno. V doporučeném dávkovacím rozmezí (100 až 400 mg) bylo přibližně 29 až 33 % podané dávky cefpodoximu vyloučeno v nezměněné podobě močí za 12 hodin. Metabolismus cefpodoximu in vivo je minimální.
Účinky Jídlo
Rozsah absorpce (průměrná AUC) a průměrná maximální plazmatická koncentrace se zvýšily, když byly potahované tablety podávány s jídlem. Po dávce 200 mg tablety užité s jídlem byla AUC o 21 až 33 % vyšší než za podmínek nalačno a vrcholová plazmatická koncentrace byla v průměru 3,1 mcg/ml u jedinců s jídlem oproti 2,6 μg/ml u jedinců nalačno. Čas do dosažení maximální koncentrace se významně nelišil mezi nakrmenými a na lačno.
Když byla dávka 200 mg suspenze užita s jídlem, rozsah absorpce (průměrná AUC) a průměrná maximální plazmatická koncentrace se u nasycených jedinců významně nelišily od jedinců nalačno, ale rychlost absorpce byla pomalejší s jídlem (48% nárůst v Tmax).
Farmakokinetika Cefpodoxim Proxetil potahovaných tablet
doporučeném dávkovacím rozmezí (100 až 400 mg) vykazovala rychlost a rozsah absorpce cefpodoximu závislost na dávce; Cmax a AUC normalizované na dávku se s rostoucí dávkou snížily až o 32 %. V doporučeném rozmezí dávkování byl Tmax přibližně 2 až 3 hodiny a T½ se pohyboval od 2,09 do 2,84 hodin. Průměrná Cmax byla 1,4 mcg/ml pro dávku 100 mg, 2,3 mcg/ml pro dávku 200 mg a 3,9 mcg/ml pro dávku 400 mg. U pacientů s normální funkcí ledvin nebyla po opakovaných perorálních dávkách až do 400 mg Q 12 hodin zaznamenána akumulace ani významné změny jiných farmakokinetických parametrů.
PLAZMOVÉ HLADINY CEFPODOXIMU (mcg/ml) U DOSPĚLÝCH NA LAČO PO PODÁNÍ POTAHOVANÝCH TABLETY (jednorázová dávka)
Farmakokinetika Cefpodoxim Proxetil Suspenze
dospělých jedinců vyvolala dávka 100 mg perorální suspenze průměrnou maximální koncentraci cefpodoximu přibližně 1,5 μg/ml (rozmezí: 1,1 až 2,1 μg/ml), což je ekvivalentní koncentraci hlášené po podání 100 mg tablety. Doba do dosažení maximální plazmatické koncentrace a plocha pod křivkou plazmatické koncentrace-čas (AUC) pro perorální suspenzi byly také ekvivalentní těm, které byly vyrobeny s potahovanými tabletami u dospělých po perorální dávce 100 mg.
Farmakokinetika cefpodoximu byla zkoumána u 29 pacientů ve věku 1 až 17 let. Každý pacient dostal jednu perorální dávku 5 mg/kg perorální suspenze cefpodoximu. Vzorky plazmy a moči byly odebírány po dobu 12 hodin po podání dávky. Plazmatické hladiny hlášené z této studie jsou následující:
PLAZMOVÉ HLADINY CEFPODOXIMU (mcg/ml) U PACIENTŮ NA LAČO (1 až 17 LET VĚKU) PO PODÁNÍ SUSPENZE
Rozdělení
Vazba cefpodoximu na proteiny se pohybuje od 22 do 33 % v séru a od 21 do 29 % v plazmě.
Kožní puchýř
Po opakovaném podávání každých 12 hodin po dobu 5 dnů 200 mg nebo 400 mg cefpodoxim proxetilu byla průměrná maximální koncentrace cefpodoximu v tekutině z kožních puchýřů průměrně 1,6 a 2,8 mcg/ml, v daném pořadí. Hladiny cefpodoximu z kožních puchýřů za 12 hodin po podání byly v průměru 0,2 a 0,4 mcg/ml pro režimy 200 mg a 400 mg s opakovanými dávkami.
Tkáň mandlí
Po jedné perorální 100 mg potahované tabletě cefpodoxim proxetilu byla průměrná maximální koncentrace cefpodoximu ve tkáni mandlí v průměru 0,24 mcg/g za 4 hodiny po podání a 0,09 mcg/g za 7 hodin po podání. Rovnováhy mezi plazmou a tkání mandlí bylo dosaženo během 4 hodin po podání. 12 hodin po podání dávky nebyla hlášena žádná detekce cefpodoximu v tonzilární tkáni. Tyto výsledky ukázaly, že koncentrace cefpodoximu překračovaly MIC90 S. pyogenes po dobu alespoň 7 hodin po podání 100 mg cefpodoxim proxetilu.
Plicní tkáň
Po jedné perorální 200 mg potahované tabletě cefpodoximu proxetilu byla průměrná maximální koncentrace cefpodoximu v plicní tkáni v průměru 0,63 mcg/g za 3 hodiny po podání, 0,52 mcg/g za 6 hodin po podání a 0,19 mcg/g 12 hodin po podání. Výsledky této studie ukázaly, že cefpodoxim pronikl do plicní tkáně a produkoval trvalé koncentrace léčiva po dobu alespoň 12 hodin po podání na hladinách, které překračovaly MIC90 pro S. pneumoniae a H. influenzae.
CSF
Adekvátní údaje o hladinách cefpodoximu v CSF nejsou k dispozici.
Účinky snížené funkce ledvin
Eliminace cefpodoximu je snížena u pacientů se středně těžkou až těžkou poruchou funkce ledvin (clearance kreatininu OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ .) U subjektů s mírnou poruchou funkce ledvin (clearance kreatininu 50 až 80 ml/min) byl průměrný plazmatický poločas cefpodoximu 3,5 hodiny. U subjektů se středně těžkou (clearance kreatininu 30 až 49 ml/min) nebo těžkou poruchou funkce ledvin (clearance kreatininu 5 až 29 ml/min) se poločas zvýšil na 5,9 a 9,8 hodin, v daném pořadí. Přibližně 23 % podané dávky bylo z těla odstraněno během standardní 3hodinové hemodialýzy.
Vliv poškození jater (cirhóza)
U pacientů s cirhózou byla absorpce poněkud snížena a eliminace nezměněna. Průměrný T½ cefpodoximu a renální clearance u pacientů s cirhózou byly podobné těm, které byly získány ve studiích se zdravými subjekty. Nezdálo se, že by ascites ovlivňoval hodnoty u pacientů s cirhózou. U této populace pacientů se nedoporučuje žádná úprava dávkování.
Farmakokinetika u starších pacientů
Starší pacienti nevyžadují úpravu dávkování, pokud nemají sníženou funkci ledvin. (Vidět OPATŘENÍ .) U zdravých geriatrických subjektů byl poločas cefpodoximu v plazmě v průměru 4,2 hodiny (oproti 3,3 u mladších subjektů) a obnovení moči v průměru 21 % po podání dávky 400 mg každých 12 hodin. Ostatní farmakokinetické parametry (Cmax, AUC a Tmax) se nezměnily ve srovnání s těmi, které byly pozorovány u zdravých mladých subjektů.
Mikrobiologie
Mechanismus působení
Cefpodoxim je baktericidní činidlo, které působí inhibicí syntézy bakteriální buněčné stěny. Cefpodoxim má aktivitu v přítomnosti některých beta-laktamáz, jak penicilináz, tak cefalosporináz, z gramnegativních a grampozitivních bakterií.
Mechanismus Odporu
Rezistence na cefpodoxim je primárně způsobena hydrolýzou beta-laktamázou, změnou proteinů vázajících penicilin (PBP) a sníženou permeabilitou.
Bylo prokázáno, že cefpodoxim je účinný proti většině izolátů následujících bakterií, a to jak in vitro, tak při klinických infekcích, jak je popsáno v části Indikace a použití (1):
Gram-pozitivní bakterie
Staphylococcus aureus (kmeny citlivé na meticilin, včetně kmenů produkujících penicilinázy) Staphylococcus saprophyticus Streptococcus pneumoniae (kromě izolátů rezistentních na penicilin) Streptococcus pyogenes
Gram-negativní bakterie
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (včetně izolátů produkujících beta-laktamázu) Moraxella catarrhalis Neisseria gonorrhoeae (včetně izolátů produkujících penicilinázu)
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám. Nejméně 90 procent následujících mikroorganismů vykazuje in vitro minimální inhibiční koncentraci (MIC) nižší nebo rovnou prahu citlivosti pro cefpodoxim. Účinnost cefpodoximu při léčbě klinických infekcí způsobených těmito mikroorganismy však nebyla stanovena v adekvátních a dobře kontrolovaných klinických studiích.
Gram-pozitivní bakterie
Streptococcus agalactiae Streptococcus spp. (skupiny C, F, G)
Gram-negativní bakterie
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Anaerobní grampozitivní bakterie
Peptostreptococcus magnus
Metody testování citlivosti
Je-li to možné, měla by klinická mikrobiologická laboratoř poskytovat výsledky in vitro testů citlivosti pro antimikrobiální léčivé přípravky používané v rezidentních nemocnicích lékaři jako pravidelné zprávy, které popisují profil citlivosti nozokomiálních a komunitně získaných patogenů. Tyto zprávy by měly pomoci lékaři při výběru antibakteriálního léku pro léčbu.
Techniky ředění
Kvantitativní metody se používají ke stanovení antimikrobiálních minimálních inhibičních koncentrací (MIC). Tyto MIC poskytují odhady citlivosti bakterií na antimikrobiální sloučeniny. MIC by měly být stanoveny pomocí standardizované zkušební metody. Hodnoty MIC by měly být interpretovány podle kritérií uvedených v tabulce 1.
Difúzní techniky
Kvantitativní metody, které vyžadují měření průměrů zón, také poskytují reprodukovatelné odhady citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny poskytuje odhad citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny by měla být určena pomocí standardizované zkušební metody. Tento postup používá papírové disky impregnované 10 mcg cefpodoximu k testování citlivosti mikroorganismů na cefpodoxim. Kritéria interpretace diskové difúze jsou uvedena v tabulce 1.
Zpráva o citlivosti naznačuje, že antimikrobiální látka pravděpodobně inhibuje růst patogenu, pokud antimikrobiální sloučenina dosáhne koncentrace v místě infekce nezbytné k inhibici růstu patogenu. Zpráva o meziproduktu naznačuje, že výsledek by měl být považován za nejednoznačný, a pokud mikroorganismus není plně vnímavý k alternativním, klinicky proveditelným lékům, test by se měl opakovat. Tato kategorie implikuje možnou klinickou použitelnost v místech těla, kde je léčivo fyziologicky koncentrované, nebo v situacích, kdy lze použít vysokou dávku léčiva. Tato kategorie také poskytuje nárazníkovou zónu, která zabraňuje malým nekontrolovaným technickým faktorům způsobit velké nesrovnalosti ve výkladu. Zpráva o Resistant ukazuje, že antimikrobiální látka pravděpodobně nebude inhibovat růst patogenu, pokud antimikrobiální sloučenina dosáhne koncentrací obvykle dosažitelných v místě infekce; měla by být zvolena jiná terapie.
Kontrola kvality
Standardizované postupy testování citlivosti vyžadují použití laboratorních kontrol k monitorování a zajištění přesnosti a přesnosti zásob a činidel používaných v testu a technik jednotlivce provádějícího test1,2,3. Standardní prášek cefpodoximu by měl poskytovat následující rozsah hodnot MIC uvedených v tabulce 2. Pro difuzní techniku používající 10 mcg disk by mělo být dosaženo kritérií v tabulce 2.
Klinické testy
Cystitida
Ve dvou dvojitě zaslepených, 2:1 randomizovaných, srovnávacích studiích provedených u dospělých ve Spojených státech amerických byl cefpodoxim proxetil srovnáván s jinými beta-laktamovými antibiotiky. V těchto studiích byly 5 až 9 dnů po léčbě získány následující míry eradikace bakterií:
těchto studiích byly míry klinického vyléčení a míry eradikace bakterií pro cefpodoxim proxetil srovnatelné se srovnávacími látkami; míra klinického vyléčení a míra bakteriologické eradikace však byla nižší než míra pozorovaná u některých jiných tříd schválených látek pro cystitidu.
Studie akutního zánětu středního ucha
V kontrolovaných studiích akutního zánětu středního ucha provedených ve Spojených státech amerických, kde byly nalezeny významné podíly organismů produkujících betalaktamázu, byl cefpodoxim proxetil srovnáván s cefiximem. V těchto studiích, za použití velmi přísných kritérií hodnotitelnosti a kritérií mikrobiologické a klinické odpovědi při sledování 4 až 21 dnů po léčbě, byly získány následující výsledky předpokládané eradikace/klinického úspěchu (vyléčené a zlepšené).
REFERENCE
1. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti pro bakterie, které rostou aerobně; Schválený standard – deváté vydání. Dokument CLSI M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
2. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro testování antimikrobiální citlivosti; Dvacátý třetí informační doplněk, dokument CLSI M100-S23. CLSI dokument M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2013.
3. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro antimikrobiální diskové difúzní testy citlivosti; Schválený standard – jedenácté vydání dokumentu CLSI M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
INFORMACE PRO PACIENTA
Pacienti by měli být poučeni, že antibakteriální léky včetně přípravku VANTIN by se měly používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je přípravek VANTIN předepsán k léčbě bakteriální infekce, pacienti by měli být informováni, že ačkoli je běžné, že se na začátku léčby cítí lépe, lék by měl být užíván přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné VANTINem nebo jinými antibakteriálními léky.
Průjem je častým problémem způsobeným antibiotiky, který obvykle končí, když je antibiotikum vysazeno. Někdy po zahájení léčby antibiotiky se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, pacienti by měli co nejdříve kontaktovat svého lékaře.
