Keflex 250mg, 500mg Cephalexin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Keflex 250 mg a jak se používá?
Keflex je lék na předpis používaný k léčbě příznaků různých bakteriálních infekcí zastavením růstu bakterií. Keflex 500 mg lze užívat samostatně nebo s jinými léky.
Keflex je známý jako cefalosporinové antibiotikum.
Jaké jsou vedlejší účinky Keflexu?
Keflex může způsobit závažné nežádoucí účinky včetně:
- silná bolest žaludku,
- průjem, který je vodnatý nebo krvavý,
- neobvyklá únava,
- pocit točení hlavy nebo dušnosti,
- snadná tvorba modřin,
- neobvyklé krvácení,
- fialové nebo červené skvrny pod kůží,
- záchvat,
- bledá kůže,
- studené ruce a nohy,
- zažloutlá kůže, tmavě zbarvená moč,
- horečka,
- slabost,
- bolest v boku nebo dolní části zad,
- bolestivé močení,
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Keflex 500 mg patří:
- průjem,
- nevolnost,
- zvracení,
- špatné trávení,
- bolest břicha,
- vaginální svědění nebo výtok,
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Keflexu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
KEFLEX® (cephalexin) Capsules, USP je semisyntetický cefalosporinový antibakteriální lék určený k perorálnímu podání. Je to monohydrát 7-(D-a-amino-a-fenylacetamido)-3-methyl-3-cefem-4-karboxylové kyseliny. Cephalexin má molekulový vzorec C16H17N3O4S•H2O a molekulová hmotnost je 365,41.
Cephalexin má následující strukturní vzorec:
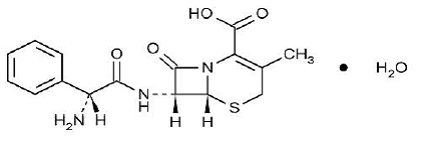
Jedna tobolka obsahuje cefalexin monohydrát odpovídající 250 mg, 500 mg nebo 750 mg cefalexinu. Kapsle také obsahují sodnou sůl karboxymethylcelulózy, D&C Yellow č. 10, dimethikon, FD&C Blue č. 1, FD&C Yellow č. 6, želatinu, stearát hořečnatý, mikrokrystalickou celulózu a oxid titaničitý.
INDIKACE
Infekce dýchacích cest
KEFLEX je indikován k léčbě infekcí dýchacích cest způsobených citlivými izoláty Streptococcus pneumoniae a Streptococcus pyogenes.
Zánět středního ucha
KEFLEX je indikován k léčbě zánětu středního ucha způsobeného citlivými izoláty Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes a Moraxella catarrhalis.
Infekce kůže a kožní struktury
KEFLEX 250 mg je indikován k léčbě infekcí kůže a kožních struktur způsobených citlivými izoláty následujících grampozitivních bakterií: Staphylococcus aureus a Streptococcus pyogenes.
Kostní infekce
KEFLEX 250 mg je indikován k léčbě kostních infekcí způsobených citlivými izoláty Staphylococcus aureus a Proteus mirabilis.
Infekce urogenitálního traktu
KEFLEX je indikován k léčbě infekcí urogenitálního traktu, včetně akutní prostatitidy, způsobené citlivými izoláty Escherichia coli, Proteus mirabilis a Klebsiella pneumoniae.
Používání
omezení rozvoje bakterií rezistentních vůči lékům a zachování účinnosti přípravku KEFLEX 250 mg a dalších antibakteriálních léků by se přípravek KEFLEX 500 mg měl používat pouze k léčbě infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, měly by být tyto informace zohledněny při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dospělí a dětští pacienti ve věku nejméně 15 let
Obvyklá dávka perorálního přípravku KEFLEX 250 mg je 250 mg každých 6 hodin, ale lze podat dávku 500 mg každých 12 hodin. Léčba se podává po dobu 7 až 14 dnů.
U závažnějších infekcí mohou být zapotřebí větší dávky perorálního přípravku KEFLEX, až 4 gramy denně ve dvou až čtyřech rovnoměrně rozdělených dávkách.
Pediatričtí pacienti (starší 1 rok)
Doporučená celková denní dávka perorálního přípravku KEFLEX 500 mg pro pediatrické pacienty je 25 až 50 mg/kg podávaná ve rovnoměrně rozdělených dávkách po dobu 7 až 14 dnů. Při léčbě β-hemolytických streptokokových infekcí se doporučuje trvání minimálně 10 dnů. U těžkých infekcí může být podána celková denní dávka 50 až 100 mg/kg ve stejně rozdělených dávkách.
Pro léčbu zánětu středního ucha je doporučená denní dávka 75 až 100 mg/kg podávaná ve stejně rozdělených dávkách.
Úprava dávkování u dospělých a dětských pacientů ve věku alespoň 15 let s poruchou funkce ledvin
Pacientům s poruchou funkce ledvin podávejte následující dávkovací režimy KEFLEXU [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití ve specifických populacích ].
JAK DODÁVÁNO
Dávkové formy A Síly
250 mg kapsle: bílý až světle žlutý prášek plněný do neprůhledné bílé a neprůhledné tmavě zelené tobolky s potiskem KEFLEX 250 mg jedlým černým inkoustem na bílém těle.
500 mg kapsle: bílý až světle žlutý prášek naplněný do neprůhledné světle zelené a neprůhledné tmavě zelené tobolky s potiskem KEFLEX 500 mg jedlým černým inkoustem na světle zeleném těle.
750 mg kapsle: bílý až světle žlutý prášek plněný do podlouhlé neprůhledné tmavě zelené a neprůhledné tmavě zelené tobolky s potiskem KEFLEX 750 mg jedlým bílým inkoustem na tmavě zeleném těle.
Skladování A Manipulace
Kapsle KEFLEX (cefalexin). , USP, se dodává následovně:
250 mg tobolky, lahvičky po 100 – NDC 59630-112-10 500 mg tobolky, lahvičky po 100 – NDC 59630-113-10 750 mg tobolky, lahvičky po 50 – NDC 59630-115-05
KEFLEX by měl být skladován při 25°C (77°F); povoleny výchylky do 15° až 30°C (59° až 86°F) [viz USP řízená pokojová teplota ].
Dávkujte v těsné nádobě odolné vůči světlu.
Vyrobeno pro: Shionogi Inc. Florham Park, NJ 07932. Výrobce: Sandoz GmbH Kundl, Rakousko. Revize: říjen 2015.
VEDLEJŠÍ EFEKTY
Následující závažné události jsou podrobněji popsány v části Varování a bezpečnostní opatření:
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem související s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Přímá sérokonverze Coombsova testu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Záchvatový potenciál [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vliv na aktivitu protrombinu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vývoj bakterií rezistentních vůči léčivům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie probíhají za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
V klinických studiích byl nejčastějším nežádoucím účinkem průjem. Objevily se také nevolnost a zvracení, dyspepsie, gastritida a bolesti břicha. Stejně jako u penicilinů a jiných cefalosporinů byla hlášena přechodná hepatitida a cholestatická žloutenka.
Mezi další reakce patřily reakce z přecitlivělosti, genitální a anální pruritus, genitální kandidóza, vaginitida a vaginální výtok, závratě, únava, bolest hlavy, neklid, zmatenost, halucinace, artralgie, artritida a kloubní poruchy. Byla hlášena reverzibilní intersticiální nefritida. Byla hlášena eozinofilie, neutropenie, trombocytopenie, hemolytická anémie a mírné zvýšení aspartáttransamináz (AST) a alanintransamináz (ALT).
Kromě výše uvedených nežádoucích účinků, které byly pozorovány u pacientů léčených přípravkem KEFLEX 500 mg, byly u antibakteriálních léků třídy cefalosporinů hlášeny následující nežádoucí účinky a další změněné laboratorní testy:
Jiné nežádoucí účinky
Horečka, kolitida, aplastická anémie, krvácení, renální dysfunkce a toxická nefropatie.
Změněné laboratorní testy
Prodloužený protrombinový čas, zvýšený dusík močoviny v krvi (BUN), zvýšený kreatinin, zvýšená alkalická fosfatáza, zvýšený bilirubin, zvýšená laktátdehydrogenáza (LDH), pancytopenie, leukopenie a agranulocytóza.
DROGOVÉ INTERAKCE
metformin
Podávání přípravku KEFLEX 250 mg s metforminem má za následek zvýšení plazmatických koncentrací metforminu a snížení renální clearance metforminu.
U pacientů, kteří současně užívají KEFLEX a metformin, se doporučuje pečlivé sledování pacienta a úprava dávky metforminu (viz KLINICKÁ FARMAKOLOGIE ].
Probenecid
Renální vylučování KEFLEXu je inhibováno probenecidem. Současné podávání probenecidu s přípravkem KEFLEX 500 mg se nedoporučuje.
Interakce s laboratorním nebo diagnostickým testováním
Při testování přítomnosti glukózy v moči pomocí Benediktova roztoku nebo Fehlingova roztoku se může objevit falešně pozitivní reakce.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Hypersenzitivní reakce
Při použití přípravku KEFLEX byly hlášeny alergické reakce ve formě vyrážky, kopřivky, angioedému, anafylaxe, erythema multiforme, Stevens-Johnsonova syndromu nebo toxické epidermální nekrolýzy. Před zahájením léčby přípravkem KEFLEX 500 mg se informujte, zda pacient nemá v anamnéze hypersenzitivní reakce na cefalexin, cefalosporiny, peniciliny nebo jiné léky. Zkřížená hypersenzitivita mezi beta-laktamovými antibakteriálními léky se může objevit až u 10 % pacientů s alergií na penicilin v anamnéze.
Pokud se objeví alergická reakce na KEFLEX 500 mg, vysaďte lék a nasaďte vhodnou léčbu.
Průjem spojený s Clostridium Difficile
Průjem související s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně KEFLEX 500 mg, a může se pohybovat v rozsahu od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po užívání antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibiotická léčba C. difficile a chirurgické vyšetření.
Přímá sérokonverze Coombsova testu
Během léčby cefalosporinovými antibakteriálními léky včetně cefalexinu byly hlášeny pozitivní přímé Coombsovy testy. Byla hlášena akutní intravaskulární hemolýza vyvolaná terapií cefalexiny. Pokud se anémie rozvine během nebo po léčbě cefalexiny, proveďte diagnostické vyšetření hemolytické anémie vyvolané léky, přerušte léčbu cefalexinem a zahajte vhodnou léčbu.
Potenciál záchvatů
Některé cefalosporiny se podílejí na spouštění záchvatů, zejména u pacientů s poruchou funkce ledvin, kdy dávka nebyla snížena. Pokud se objeví záchvaty, přerušte léčbu přípravkem KEFLEX. Pokud je to klinicky indikováno, lze podat antikonvulzivní léčbu.
Prodloužený protrombinový čas
Cefalosporiny mohou být spojeny s prodlouženým protrombinovým časem. Mezi ohrožené patří pacienti s renálním nebo jaterním poškozením nebo špatným nutričním stavem, stejně jako pacienti užívající protrahovanou antibakteriální léčbu a pacienti užívající antikoagulační léčbu. Monitorujte protrombinový čas u rizikových pacientů a řiďte se podle indikace.
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku KEFLEX při absenci prokázané nebo silně suspektní bakteriální infekce přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Dlouhodobé používání přípravku KEFLEX může vést k přemnožení necitlivých organismů. Pečlivé sledování pacienta je nezbytné. Pokud se během léčby objeví superinfekce, je třeba přijmout vhodná opatření.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Celoživotní studie na zvířatech k hodnocení karcinogenního potenciálu cefalexinu nebyly provedeny. Testy na stanovení mutagenního potenciálu cefalexinu nebyly provedeny. U samců a samic potkanů nebyla fertilita a reprodukční schopnost ovlivněna perorálními dávkami cefalexinu až do 1,5násobku nejvyšší doporučené dávky pro člověka na základě tělesného povrchu.
Použití u konkrétních populací
Těhotenství
Těhotenství kategorie B
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Reprodukční studie byly provedeny na myších a potkanech s použitím perorálních dávek monohydrátu cefalexinu 0,6 a 1,5 násobku maximální denní dávky pro člověka (66 mg/kg/den) na základě tělesného povrchu a neodhalily žádné známky poškození plodnosti nebo poškození plod.
Kojící matky
Cefalexin se vylučuje do lidského mléka. Při podávání přípravku KEFLEX kojící ženě je třeba postupovat opatrně.
Pediatrické použití
Bezpečnost a účinnost přípravku KEFLEX 500 mg u pediatrických pacientů byla stanovena v klinických studiích pro dávky popsané v části dávkování a podávání [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Geriatrické použití
Ze 701 subjektů ve 3 publikovaných klinických studiích cefalexinu bylo 433 (62 %) ve věku 65 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty.
Tento lék je v podstatě vylučován ledvinami a riziko toxických reakcí na tento lék může být vyšší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, je třeba věnovat pozornost výběru dávky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Renální poškození
KEFLEX by měl být podáván s opatrností v případě poruchy funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ ].
REFERENCE
1. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti pro bakterie, které rostou aerobně; Schválený standard – desáté vydání. Dokument CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
2. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro testy citlivosti na antimikrobiální látky; Dvacátý pátý informační doplněk. CLSI dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro testy citlivosti antimikrobiálních disků; Schválený standard – dvanácté vydání. CLSI dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
PŘEDÁVKOVAT
Příznaky perorálního předávkování mohou zahrnovat nevolnost, zvracení, epigastrické potíže, průjem a hematurii. V případě předávkování zahajte obecná podpůrná opatření.
Forsírovaná diuréza, peritoneální dialýza, hemodialýza nebo hemoperfuze aktivním uhlím nebyly prokázány jako přínosné při předávkování cefalexinem.
KONTRAINDIKACE
KEFLEX je kontraindikován u pacientů se známou přecitlivělostí na cefalexin nebo jiné antibiotika ze skupiny cefalosporinů.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Cefalexin je cefalosporinové antibakteriální léčivo [viz Mikrobiologie ].
Farmakokinetika
Vstřebávání
Cephalexin je stabilní vůči kyselinám a může být podáván bez ohledu na jídlo. Po dávkách 250 mg, 500 mg a 1 g byly průměrné maximální sérové hladiny přibližně 9, 18 a 32 mcg/ml, v daném pořadí, za 1 hodinu. Sérové hladiny byly detekovatelné 6 hodin po podání (při hladině detekce 0,2 mcg/ml).
Rozdělení
Cefalexin se přibližně z 10 % až 15 % váže na plazmatické proteiny.
Vylučování
Cefalexin se vylučuje močí glomerulární filtrací a tubulární sekrecí. Studie ukázaly, že více než 90 % léku bylo vyloučeno v nezměněné podobě močí během 8 hodin. Během tohoto období byly maximální koncentrace v moči po dávkách 250 mg, 500 mg a 1 g přibližně 1000, 2200 a 5000 mcg/ml.
Lékové interakce
zdravých subjektů, kterým byly podávány jednotlivé 500 mg dávky cefalexinu a metforminu, se průměrná Cmax metforminu v plazmě zvýšila v průměru o 34 % a AUC o 24 % a průměrná renální clearance metforminu se snížila o 14 %. Nejsou dostupné žádné informace o interakci cefalexinu a metforminu po opakovaných dávkách obou léků.
Mikrobiologie
Mechanismus působení
Cefalexin je baktericidní činidlo, které působí inhibicí syntézy bakteriální buněčné stěny.
Odpor
Stafylokoky rezistentní na meticilin a většina izolátů enterokoků jsou rezistentní vůči cefalexinu. Cephalexin není účinný proti většině izolátů Enterobacter spp., Morganella morganii a Proteus vulgaris. Cephalexin nemá žádnou aktivitu proti Pseudomonas spp. nebo Acinetobacter calcoaceticus. Streptococcus pneumoniae rezistentní na penicilin je obvykle zkříženě rezistentní na beta-laktamová antibakteriální léčiva.
Antimikrobiální aktivita
Bylo prokázáno, že cefalexin je účinný proti většině izolátů následujících bakterií in vitro i při klinických infekcích (viz INDIKACE A POUŽITÍ ].
Gram-pozitivní bakterie
Staphylococcus aureus (pouze izoláty citlivé na meticilin) Streptococcus pneumoniae (izoláty citlivé na penicilin) Streptococcus pyogenes
Gram-negativní bakterie
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Metody testů citlivosti
Je-li to možné, měla by klinická mikrobiologická laboratoř poskytovat výsledky in vitro testů citlivosti pro antimikrobiální léčivé přípravky používané v rezidentních nemocnicích lékaři jako pravidelné zprávy, které popisují profil citlivosti nozokomiálních a komunitně získaných patogenů. Tyto zprávy by měly pomoci lékaři při výběru antibakteriálního léku pro léčbu.
Pouze v případech nekomplikované infekce močových cest může být citlivost E. coli, K. pneumoniae a P. mirabilis na cefalexin odvozena z testování cefazolinu2.
Techniky ředění
Kvantitativní metody se používají ke stanovení antimikrobiálních minimálních inhibičních koncentrací (MIC). Tyto MIC poskytují odhady citlivosti bakterií na antimikrobiální sloučeniny. MIC by měly být stanoveny pomocí standardizovaných testovacích metod (bujón nebo agar)1,2.
Difúzní techniky
Kvantitativní metody, které vyžadují měření průměrů zón, také poskytují reprodukovatelné odhady citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny poskytuje odhad citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny by měla být určena pomocí standardizované zkušební metody2,3.
Zpráva o citlivosti (S) naznačuje, že antimikrobiální léčivo pravděpodobně inhibuje růst patogenu, pokud antimikrobiální léčivo dosáhne koncentrace obvykle dosažitelné v místě infekce. Zpráva o meziproduktu (I) naznačuje, že výsledek by měl být považován za nejednoznačný, a pokud mikroorganismus není plně citlivý na alternativní klinicky proveditelné léky, test by se měl opakovat. Tato kategorie implikuje možnou klinickou použitelnost v místech těla, kde je léčivo fyziologicky koncentrované, nebo v situacích, kdy lze použít vysokou dávku léčiva. Tato kategorie také poskytuje nárazníkovou zónu, která zabraňuje malým nekontrolovaným technickým faktorům způsobit velké nesrovnalosti ve výkladu. Zpráva o Resistant (R) ukazuje, že antimikrobiální léčivo pravděpodobně nebude inhibovat růst patogenu, pokud antimikrobiální léčivo dosáhne koncentrací obvykle dosažitelných v místě infekce; měla by být zvolena jiná terapie.
Kontrola kvality
Standardizované postupy testování citlivosti vyžadují použití laboratorních kontrol k monitorování a zajištění přesnosti a přesnosti zásob a činidel používaných v testu a technik jednotlivce provádějícího test1,2,3.
INFORMACE PRO PACIENTA
- Informujte pacienty, že se mohou objevit alergické reakce, včetně závažných alergických reakcí, a že závažné reakce vyžadují okamžitou léčbu. Zeptejte se pacienta na jakékoli předchozí reakce přecitlivělosti na KEFLEX, jiné beta-laktamy (včetně cefalosporinů) nebo jiné alergeny
- Informujte pacienty, že průjem je častým problémem způsobeným antibakteriálními léky a obvykle odezní, když se lék vysadí. Někdy se mohou objevit časté vodnaté nebo krvavé průjmy a mohou být příznakem závažnější střevní infekce. Pokud se objeví silný vodnatý nebo krvavý průjem, doporučte pacientům, aby kontaktovali svého poskytovatele zdravotní péče.
- Informujte pacienty, že antibakteriální léky včetně přípravku KEFLEX by se měly používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Když je přípravek KEFLEX 500 mg předepisován k léčbě bakteriální infekce, řekněte pacientům, že ačkoli je běžné, že se na začátku léčby cítí lépe, lék by měl být užíván přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem KEFLEX nebo jinými antibakteriálními léky.
