Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Augmentin 875 mg a jak se používá?
Augmentin 250 mg je lék na předpis používaný k léčbě příznaků mnoha různých infekcí způsobených bakteriemi, jako jsou infekce dolních cest dýchacích, chronická obstrukční plicní nemoc, bakteriální sinusitida, kousnutí zvířete/lidmi a kožní infekce. Augmentin 125 mg lze užívat samostatně nebo s jinými léky.
- Augmentin je penicilin, Amino.
Jaké jsou možné vedlejší účinky přípravku Augmentin?
Augmentin 750 mg může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- průjem, který je vodnatý nebo krvavý,
- bledá nebo zažloutlá kůže,
- tmavě zbarvená moč,
- horečka,
- zmatek,
- slabost,
- ztráta chuti k jídlu,
- bolest v horní části žaludku,
- zežloutnutí kůže nebo očí (žloutenka),
- snadná tvorba modřin nebo krvácení,
- malé nebo žádné močení,
- bolest krku,
- otok v obličeji nebo na jazyku,
- pálení ve tvých očích,
- bolest kůže následovaná červenou nebo fialovou vyrážkou, která se šíří (na obličeji nebo horní části těla) s puchýři a olupováním
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Augmentin patří:
- nevolnost,
- průjem,
- vaginální svědění nebo výtok,
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Augmentin. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
AUGMENTIN 500 mg je perorální antibakteriální kombinace skládající se z amoxicilinu a inhibitoru beta-laktamázy, klavulanátu draselného (draselná sůl kyseliny klavulanové).
Amoxicilin je analog ampicilinu, odvozený od základního penicilinového jádra, kyseliny 6-aminopenicilanové. Molekulární vzorec amoxicilinu je C16H19N3O5S•3H2O a molekulová hmotnost je 419,46. Chemicky je amoxicilin (2S,5R,6R)-6-[(R)-(-)-2-amino-2-(p-hydroxyfenyl)acetamido]-3,3-dimethyl-7-oxo-4-thia trihydrát -1-azabicyklo[3.2.0]heptan-2-karboxylové kyseliny a může být strukturně reprezentován jako:
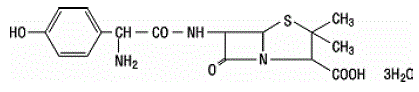
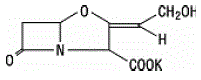
Kyselina klavulanová se vyrábí fermentací Streptomyces clavuligerus. Je to beta-laktam strukturálně příbuzný penicilinům a má schopnost inaktivovat některé beta-laktamázy blokováním aktivních míst těchto enzymů. Molekulární vzorec klavulanátu draselného je C8H8KNO5 a molekulová hmotnost je 237,25. Chemicky je klavulanát draselný (Z)(2R,5R)-3-(2-hydroxyethyliden)-7-oxo-4-oxa-1-azabicyklo[3.2.0]-heptan-2-karboxylát draselný a může být zastoupen strukturně tak jako:
Neaktivní ingredience
- Tablety - koloidní oxid křemičitý, hypromelóza, stearát hořečnatý, mikrokrystalická celulóza, polyethylenglykol, sodná sůl glykolátu škrobu a oxid titaničitý. Každá tableta přípravku AUGMENTIN obsahuje 0,63 mEq draslíku.
- Prášek pro perorální suspenzi - Koloidní oxid křemičitý, příchutě, xanthanová guma a jeden nebo více z následujících: hypromelóza, mannitol, silikagel, oxid křemičitý, kyselina jantarová, sodná sůl sacharinu a aspartam. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Žvýkací tablety – koloidní oxid křemičitý, příchutě, stearát hořečnatý, mannitol a jedna nebo více z následujících látek: D&C Yellow č. 10, FD&C Red č. 40, glycin, sodná sůl sacharinu a aspartam. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
- Každá 125mg žvýkací tableta a každých 5 ml rekonstituované 125/5 ml perorální suspenze přípravku AUGMENTIN 750 mg obsahuje 0,16 mEq draslíku
- Každá 250mg žvýkací tableta a každých 5 ml rekonstituované 250/5 ml perorální suspenze přípravku AUGMENTIN obsahuje 0,32 mEq draslíku
- Každá 200mg žvýkací tableta a každých 5 ml rekonstituované 200/5 ml perorální suspenze přípravku AUGMENTIN obsahuje 0,14 mEq draslíku
- Každá 400mg žvýkací tableta a každých 5 ml rekonstituované 400/5 ml perorální suspenze přípravku AUGMENTIN 500 mg obsahuje 0,29 mEq draslíku
INDIKACE
Ke snížení rozvoje bakterií rezistentních vůči lékům a zachování účinnosti přípravku AUGMENTIN (amoxicilin/klavulanát draselný) a dalších antibakteriálních léků by měl být přípravek AUGMENTIN 500 mg používán pouze k léčbě infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
AUGMENTIN® je kombinace antibiotika třídy penicilinu a inhibitoru beta-laktamázy indikovaná k léčbě infekcí způsobených citlivými izoláty uvedených bakterií za níže uvedených stavů*:
Infekce dolních cest dýchacích
Způsobeno izoláty Haemophilus influenzae a Moraxella catarrhalis produkujícími beta-laktamázu.
Akutní bakteriální zánět středního ucha
Způsobeno izoláty H. influenzae a M. catarrhalis produkujícími beta-laktamázu.
Sinusitida
Způsobeno izoláty H. influenzae a M. catarrhalis produkujícími beta-laktamázu.
Infekce kůže a kožní struktury
Způsobeno izoláty Staphylococcus aureus, Escherichia coli a Klebsiella produkujícími beta-laktamázu.
Infekce močového ústrojí
Způsobeno izoláty E. coli, Klebsiella a Enterobacter produkujícími beta-laktamázu.
Omezení použití
Pokud výsledky testu citlivosti prokážou citlivost na amoxicilin, což nenaznačuje žádnou produkci beta-laktamázy, AUGMENTIN by se neměl používat.
DÁVKOVÁNÍ A PODÁVÁNÍ
AUGMENTIN 875 mg lze užívat bez ohledu na jídlo; avšak absorpce klavulanátu draselného je zvýšena, když se AUGMENTIN 250 mg podává na začátku jídla. Aby se minimalizovala možnost gastrointestinální intolerance, měl by se přípravek AUGMENTIN 125 mg užívat na začátku jídla.
Dospělí
Obvyklá dávka pro dospělé je jedna 500mg tableta přípravku AUGMENTIN každých 12 hodin nebo jedna 250mg tableta přípravku AUGMENTIN 125 mg každých 8 hodin. U závažnějších infekcí a infekcí dýchacích cest by dávka měla být jedna 875mg tableta přípravku AUGMENTIN 875 mg každých 12 hodin nebo jedna 500mg tableta přípravku AUGMENTIN každých 8 hodin. Dospělým, kteří mají potíže s polykáním, může být místo 500mg tablety podána suspenze 125 mg/5 ml nebo 250 mg/5 ml. Místo 875mg tablety lze použít suspenzi 200 mg/5 ml nebo suspenzi 400 mg/5 ml.
Dvě 250mg tablety přípravku AUGMENTIN by neměly být nahrazeny jednou 500mg tabletou přípravku AUGMENTIN. Protože jak 250mg, tak 500mg tablety přípravku AUGMENTIN obsahují stejné množství kyseliny klavulanové (125 mg, jako draselná sůl), dvě 250mg tablety nejsou ekvivalentní jedné 500mg tabletě AUGMENTINU.
250mg tableta přípravku AUGMENTIN a 250mg žvýkací tableta by se neměly vzájemně nahrazovat, protože nejsou zaměnitelné. 250mg tableta přípravku AUGMENTIN 250mg a 250mg žvýkací tableta neobsahují stejné množství kyseliny klavulanové (jako draselná sůl). 250mg tableta přípravku AUGMENTIN obsahuje 125 mg kyseliny klavulanové, zatímco 250mg žvýkací tableta obsahuje 62,5 mg kyseliny klavulanové.
Pediatričtí pacienti
Na základě složky amoxicilinu by měl být AUGMENTIN dávkován následovně:
Novorozenci a kojenci ve věku
Doporučená dávka přípravku AUGMENTIN je 30 mg/kg/den rozdělená každých 12 hodin na základě amoxicilinové složky. Zkušenosti s přípravkem 200 mg/5 ml v této věkové skupině jsou omezené, a proto se doporučuje použití perorální suspenze 125 mg/5 ml.
Pacienti ve věku 12 týdnů (3 měsíců) a starší
Viz dávkovací režimy uvedené v tabulce 1. Doporučuje se režim každých 12 hodin, protože je spojen s výrazně menším průjmem [viz Klinické studie ]. Nicméně suspenze každých 12 hodin (200 mg/5 ml a 400 mg/5 ml) a žvýkací tablety (200 mg a 400 mg) obsahují aspartam a neměly by být používány fenylketonuriky. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Pacienti s hmotností 40 kg nebo více
Pediatričtí pacienti s hmotností 40 kg nebo více by měli dostávat dávku podle doporučení dospělých.
250mg tableta AUGMENTINU by se neměla užívat, dokud dítě neváží alespoň 40 kg, kvůli různým poměrům amoxicilinu a kyseliny klavulanové v 250mg tabletě AUGMENTINU (250/125) oproti 250mg žvýkací tabletě AUGMENTIN (250/62,5).
Pacienti s poruchou ledvin
Pacienti s poruchou funkce ledvin obecně nevyžadují snížení dávky, pokud není porucha závažná. Pacienti s poruchou funkce ledvin s rychlostí glomerulární filtrace
Hemodialyzovaní pacienti by měli dostávat 500 mg nebo 250 mg každých 24 hodin, v závislosti na závažnosti infekce. Měli by dostat další dávku během dialýzy i na jejím konci.
Pokyny pro míchání perorální suspenze
Připravte suspenzi při dávkování následovně: Poklepávejte lahvičkou, dokud všechen prášek volně nevytéká. Přidejte přibližně 2/3 celkového množství vody pro rekonstituci (viz tabulka 2 níže) a důkladně protřepejte, aby se prášek suspendoval. Přidejte zbytek vody a znovu důkladně protřepejte.
Poznámka: Před použitím perorální suspenzi dobře protřepejte. Rekonstituovaná suspenze musí být uchovávána v chladničce a po 10 dnech zlikvidována.
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety
- 250 mg/125 mg tablety: Jedna bílá oválná potahovaná tableta s vyraženým AUGMENTIN 750 mg na jedné straně a 250/125 na druhé straně obsahuje 250 mg amoxicilinu a 125 mg kyseliny klavulanové ve formě draselné soli.
- 500 mg/125 mg tablety: Jedna bílá oválná potahovaná tableta s vyraženým AUGMENTIN 125 mg na jedné straně a 500/125 na druhé straně obsahuje 500 mg amoxicilinu a 125 mg kyseliny klavulanové ve formě draselné soli.
- 875 mg/125 mg tablety: Každá bílá tableta ve tvaru tobolky s půlicí rýhou, s vyraženým AUGMENTIN 875 na jedné straně a půlicí rýhou na druhé straně, obsahuje 875 mg amoxicilinu a 125 mg kyseliny klavulanové ve formě draselné soli.
Prášek pro perorální suspenzi
- 125 mg/31,25 mg na 5 ml: Prášek pro přípravu perorální suspenze s banánovou příchutí (každých 5 ml rekonstituované suspenze obsahuje 125 mg amoxicilinu a 31,25 mg kyseliny klavulanové ve formě draselné soli).
- 200 mg/28,5 mg na 5 ml: Oranžový prášek pro přípravu perorální suspenze (každých 5 ml rekonstituované suspenze obsahuje 200 mg amoxicilinu a 28,5 mg kyseliny klavulanové ve formě draselné soli).
- 250 mg/62,5 mg na 5 ml: Prášek pro přípravu perorální suspenze s pomerančovou příchutí (každých 5 ml rekonstituované suspenze obsahuje 250 mg amoxicilinu a 62,5 mg kyseliny klavulanové ve formě draselné soli).
- 400 mg/57 mg na 5 ml Prášek pro přípravu perorální suspenze s pomerančovou příchutí (každých 5 ml rekonstituované suspenze obsahuje 400 mg amoxicilinu a 57,0 mg kyseliny klavulanové ve formě draselné soli).
Žvýkací tablety
- 125 mg/31,25 mg žvýkací tablety: Jedna skvrnitá žlutá kulatá tableta s příchutí citronu a limetky s vyraženým BMP 189 obsahuje 125 mg amoxicilinu a 31,25 mg kyseliny klavulanové ve formě draselné soli.
- 200 mg/28,5 mg žvýkací tablety: Každá skvrnitá růžová, kulatá, bikonvexní tableta s příchutí třešně a banánu s vyraženým AUGMENTIN 200 obsahuje 200 mg amoxicilinu a 28,5 mg kyseliny klavulanové ve formě draselné soli.
- 250 mg/62,5 mg žvýkací tablety: Jedna skvrnitá žlutá kulatá tableta s příchutí citronu a limetky s vyraženým BMP 190 obsahuje 250 mg amoxicilinu a 62,5 mg kyseliny klavulanové ve formě draselné soli.
- 400 mg/57 mg žvýkací tablety: Každá skvrnitá růžová, kulatá, bikonvexní tableta s příchutí třešně a banánu s vyraženým nápisem AUGMENTIN 400 obsahuje 400 mg amoxicilinu a 57,0 mg kyseliny klavulanové ve formě draselné soli.
250mg tableta přípravku AUGMENTIN 750mg a 250mg žvýkací tableta se NESMÍ vzájemně nahrazovat, protože nejsou zaměnitelné a 250mg tableta by se neměla používat u dětí vážících méně než 40 kg. 250mg tableta přípravku AUGMENTIN a 250mg žvýkací tableta neobsahují stejné množství kyseliny klavulanové. 250mg tableta přípravku AUGMENTIN obsahuje 125 mg kyseliny klavulanové, zatímco 250mg žvýkací tableta obsahuje 62,5 mg kyseliny klavulanové.
Dvě 250 mg tablety přípravku AUGMENTIN 750 mg NESMÍ být nahrazeny jednou 500 mg tabletou přípravku AUGMENTIN. Vzhledem k tomu, že 250 mg i 500 mg tablety přípravku AUGMENTIN obsahují stejné množství kyseliny klavulanové (125 mg jako draselná sůl), dvě 250 mg tablety přípravku AUGMENTIN 750 mg nejsou ekvivalentní jedné 500 mg tabletě přípravku AUGMENTIN.
Skladování A Manipulace
Tablety
250 mg/125 mg tablety: Jedna bílá oválná potahovaná tableta s vyraženým AUGMENTIN 750 mg na jedné straně a 250/125 na druhé straně obsahuje 250 mg amoxicilinu ve formě trihydrátu a 125 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-018-30 lahví po 30 NDC 43598-018-78 Jednotková dávka (10x10) 100 tablet
500 mg/125 mg tablety: Jedna bílá oválná potahovaná tableta s vyraženým AUGMENTINEM na jedné straně a 500/125 na druhé straně obsahuje 500 mg amoxicilinu ve formě trihydrátu a 125 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-006-14 lahví po 20 NDC 43598-006-78 Jednotková dávka (10x10) 100 tablet
875 mg/125 mg tablety: Každá bílá tableta ve tvaru tobolky s půlicí rýhou, s vyraženým AUGMENTIN 875 na jedné straně a půlicí rýhou na druhé straně, obsahuje 875 mg amoxicilinu ve formě trihydrátu a 125 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-021-14 lahví po 20 NDC 43598-021-78 Jednotková dávka (10x10) 100 tablet
Prášek pro perorální suspenzní pera: 125 mg/31,25 mg na 5 ml: Prášek pro přípravu perorální suspenze s banánovou příchutí (každých 5 ml rekonstituované suspenze obsahuje 125 mg amoxicilinu a 31,25 mg kyseliny klavulanové ve formě draselné soli).
NDC 43598-012-51 Láhev 75 ml NDC 43598-012-52 Láhev 100 ml NDC 43598-012-53 Láhev 150 ml
200 mg/28,5 mg na 5 ml: Oranžový prášek pro přípravu perorální suspenze (každých 5 ml rekonstituované suspenze obsahuje 200 mg amoxicilinu a 28,5 mg kyseliny klavulanové ve formě draselné soli).
NDC 43598-013-50 Láhev 50 ml NDC 43598-013-51 Láhev 75 ml NDC 43598-013-52 Láhev 100 ml
250 mg/62,5 mg na 5 ml: Prášek pro přípravu perorální suspenze s pomerančovou příchutí (každých 5 ml rekonstituované suspenze obsahuje 250 mg amoxicilinu a 62,5 mg kyseliny klavulanové ve formě draselné soli).
NDC 43598-004-51 Láhev 75 ml NDC 43598-004-52 Láhev 100 ml NDC 43598-004-53 Láhev 150 ml
400 mg/57 mg na 5 ml Prášek pro přípravu perorální suspenze s pomerančovou příchutí (každých 5 ml rekonstituované suspenze obsahuje 400 mg amoxicilinu a 57,0 mg kyseliny klavulanové ve formě draselné soli).
NDC 43598-008-50 Láhev 50 ml NDC 43598-008-51 Láhev 75 ml NDC 43598-008-52 Láhev 100 ml
Žvýkací tablety: 125 mg/31,25 mg žvýkací tablety: Jedna skvrnitá žlutá, kulatá tableta s citronovou příchutí, s vyraženým BMP 189, obsahuje 125 mg amoxicilinu a 31,25 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-014-31 krabička s 30 (5x6) tabletami
200 mg/28,5 mg žvýkací tablety: Každá skvrnitá růžová, kulatá, bikonvexní tableta s příchutí třešně a banánu, s vyraženým nápisem AUGMENTIN 200, obsahuje 200 mg amoxicilinu a 28,5 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-015-14 karton po 20 tabletách
250 mg/62,5 mg žvýkací tablety: Jedna skvrnitá žlutá, kulatá tableta s příchutí citronu a limetky, s vyraženým BMP 190, obsahuje 250 mg amoxicilinu a 62,5 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-016-31 karton po 30 (5x6) tabletách
400 mg/57 mg žvýkací tablety: Každá skvrnitá růžová, kulatá, bikonvexní tableta s příchutí třešně a banánu, s vyraženým nápisem AUGMENTIN 400, obsahuje 400 mg amoxicilinu a 57,0 mg kyseliny klavulanové ve formě draselné soli.
NDC 43598-017-14 karton po 20 tabletách
Dávkujte v originální nádobě.
Tablety a suchý prášek uchovávejte při teplotě do 25 °C (77 °F).
Rekonstituovanou suspenzi uchovávejte v chladničce. Nepoužitou suspenzi po 10 dnech zlikvidujte. Udržujte mimo dosah dětí.
REFERENCE
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Účinky požití penicilinu a cefalosporinu u dětí mladších šesti let. Vet Hum Toxicol. 1988; 30: 66 67.
2. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti pro bakterie, které rostou aerobně; Schválený standard – 8. Dokument CLSI M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Institut klinických a laboratorních standardů (CLSI). Výkonový standard pro testy citlivosti antimikrobiálních disků; Schválený standard – 11. Dokument CLSI M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Výkonové standardy pro testování antimikrobiální citlivosti: 22. informační příloha. CLSI dokument M100-S22. CLSI, Wayne, PA, 2012.
Distribuuje: Dr. Reddy's Laboratories Inc.Bridgewater, NJ 08807. Revize: březen 2013
VEDLEJŠÍ EFEKTY
Následující jsou podrobněji diskutovány v jiných částech označování:
- Anafylaktické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Jaterní dysfunkce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- CDAD [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Nejčastěji hlášenými nežádoucími účinky byly průjem/řídká stolice (9 %), nauzea (3 %), kožní vyrážky a kopřivka (3 %), zvracení (1 %) a vaginitida (1 %). Méně než 3 % pacientů přerušilo léčbu kvůli nežádoucím účinkům souvisejícím s lékem. Celkový výskyt nežádoucích účinků, a zejména průjmu, se zvýšil s vyšší doporučenou dávkou. Další méně často hlášené nežádoucí účinky (
pediatrických pacientů (ve věku od 2 měsíců do 12 let) byla provedena 1 klinická studie v USA/Kanadě, která porovnávala 45/6,4 mg/kg/den (rozděleno každých 12 hodin) přípravku AUGMENTIN po dobu 10 dnů oproti 40/10 mg/kg/den (rozděleno každých 8 hodin) AUGMENTINU 125 mg po dobu 10 dnů při léčbě akutního zánětu středního ucha. Celkem bylo zařazeno 575 pacientů a v této studii byly použity pouze suspenzní přípravky. Celkově byly pozorované nežádoucí účinky srovnatelné s nežádoucími účinky uvedenými výše; nicméně byly rozdíly v četnosti průjmu, kožních vyrážek/kopřivka a vyrážek v oblasti plen. [Vidět Klinické studie ]
Postmarketingové zkušenosti
Kromě nežádoucích účinků hlášených z klinických studií byly během postmarketingového používání přípravku AUGMENTIN zjištěny následující. Protože jsou hlášeny dobrovolně z populace neznámé velikosti, nelze provést odhad frekvence. Tyto události byly vybrány pro zahrnutí kvůli kombinaci jejich závažnosti, četnosti hlášení nebo potenciální kauzální souvislosti s AUGMENTIN.
Gastrointestinální
Poruchy trávení, gastritida, stomatitida, glositida, černý „chlupatý“ jazyk, mukokutánní kandidóza, enterokolitida a hemoragická/pseudomembranózní kolitida. Během nebo po léčbě antibiotiky se mohou objevit příznaky pseudomembranózní kolitidy. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Hypersenzitivní reakce
Pruritus, angioedém, reakce podobné sérové nemoci (kopřivka nebo kožní vyrážka doprovázená artritidou, artralgií, myalgií a často horečkou), multiformní erytém, Stevens-Johnsonův syndrom, akutní generalizovaná exantematózní pustulóza, hypersenzitivní vaskulitida a případy exfoliativní dermatitidy (včetně toxické epidermální dermatitidy nekrolýza) byly hlášeny. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Játra
přípravku AUGMENTIN byla hlášena jaterní dysfunkce, včetně hepatitidy a cholestatické žloutenky, zvýšení sérových transamináz (AST a/nebo ALT), sérového bilirubinu a/nebo alkalické fosfatázy. Častěji byl hlášen u starších pacientů, u mužů nebo u pacientů dlouhodobě léčených. Histologické nálezy jaterní biopsie se skládaly převážně z cholestatické léčby. Histologické nálezy jaterní biopsie se skládaly převážně z cholestatických, hepatocelulárních nebo smíšených cholestatických hepatocelulárních změn. Nástup známek/symptomů jaterní dysfunkce se může objevit během nebo několik týdnů po ukončení léčby. Jaterní dysfunkce, která může být závažná, je obvykle reverzibilní. Byla hlášena úmrtí. [vidět KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Renální
Byla hlášena intersticiální nefritida, hematurie a krystalurie. [vidět PŘEDÁVKOVAT ]

Hemický A Lymfatický Systém
Byla hlášena anémie, včetně hemolytické anémie, trombocytopenie, trombocytopenická purpura, eozinofilie, leukopenie a agranulocytóza. Tyto reakce jsou obvykle po přerušení léčby reverzibilní a má se za to, že se jedná o jevy přecitlivělosti. Trombocytóza byla zaznamenána u méně než 1 % pacientů léčených přípravkem AUGMENTIN. U pacientů užívajících AUGMENTIN 125 mg a antikoagulační léčbu byly hlášeny případy prodloužení protrombinového času. [vidět DROGOVÉ INTERAKCE ]
Centrální nervový systém
Byly hlášeny agitovanost, úzkost, změny chování, zmatenost, křeče, závratě, nespavost a reverzibilní hyperaktivita.
Smíšený
Bylo hlášeno zbarvení zubů (hnědé, žluté nebo šedé zabarvení). Většina hlášení se objevila u dětských pacientů. Zbarvení bylo ve většině případů sníženo nebo odstraněno kartáčováním nebo čištěním zubů.
DROGOVÉ INTERAKCE
Probenecid
Probenecid snižuje renální tubulární sekreci amoxicilinu, ale nezpomaluje renální vylučování kyseliny klavulanové. Současné užívání s přípravkem AUGMENTIN 875 mg může vést ke zvýšeným a prodlouženým koncentracím amoxicilinu v krvi. Současné podávání probenecidu se nedoporučuje.
Perorální antikoagulancia
U pacientů užívajících amoxicilin a perorální antikoagulancia bylo hlášeno abnormální prodloužení protrombinového času (zvýšený mezinárodní normalizovaný poměr [INR]). Jsou-li antikoagulancia předepisována současně s přípravkem AUGMENTIN, je třeba provádět odpovídající monitorování. K udržení požadované úrovně antikoagulace může být nutné upravit dávku perorálních antikoagulancií.
allopurinol
Současné podávání alopurinolu a amoxicilinu zvyšuje výskyt vyrážek u pacientů užívajících oba léky ve srovnání s pacienty užívajícími samotný amoxicilin. Není známo, zda je tato potenciace amoxicilinových vyrážek způsobena alopurinolem nebo hyperurikémií přítomnou u těchto pacientů.
Orální antikoncepce
AUGMENTIN 750 mg může ovlivnit střevní flóru, což vede k nižší reabsorpci estrogenu a snížené účinnosti kombinovaných perorálních estrogen/progesteronových kontraceptiv.
Účinky na laboratorní testy
Vysoké koncentrace amoxicilinu v moči mohou vést k falešně pozitivním reakcím při testování přítomnosti glukózy v moči pomocí CLINITEST®, Benedict's Solution nebo Fehling's Solution. Vzhledem k tomu, že se tento účinek může objevit i u přípravku AUGMENTIN, doporučuje se použít glukózové testy založené na enzymatických reakcích glukózooxidázy.
Po podání amoxicilinu těhotným ženám bylo zaznamenáno přechodné snížení plazmatické koncentrace celkového konjugovaného estriolu, estriol-glukuronidu, konjugovaného estronu a estradiolu.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Hypersenzitivní reakce
pacientů užívajících beta-laktamová antibiotika, včetně přípravku AUGMENTIN, byly hlášeny závažné a příležitostně fatální hypersenzitivní (anafylaktické) reakce. Tyto reakce se pravděpodobněji vyskytují u jedinců s anamnézou přecitlivělosti na penicilin a/nebo anamnézou citlivosti na více alergenů. Před zahájením léčby přípravkem AUGMENTIN 250 mg je třeba pečlivě zjistit předchozí hypersenzitivní reakce na peniciliny, cefalosporiny nebo jiné alergeny. Pokud se objeví alergická reakce, je třeba AUGMENTIN vysadit a zahájit vhodnou léčbu.
Jaterní dysfunkce
Jaterní dysfunkce, včetně hepatitidy a cholestatické žloutenky, byla spojena s užíváním přípravku AUGMENTIN. Jaterní toxicita je obvykle reverzibilní; byla však hlášena úmrtí. U pacientů s poruchou funkce jater je třeba v pravidelných intervalech sledovat jaterní funkce.
Průjem spojený s Clostridium Difficile (CDAD)
Průjem spojený s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně přípravku AUGMENTIN 250 mg, a může se pohybovat v rozsahu závažnosti od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po použití antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než 2 měsíce po podání antibakteriálních látek.
Je-li podezření na CDAD nebo je-li potvrzeno, může být nutné přerušit pokračující používání antibakteriálních látek, které nejsou zaměřeny proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibakteriální léčba C. difficile a chirurgické vyšetření.
Kožní vyrážka U pacientů s mononukleózou
U vysokého procenta pacientů s mononukleózou, kteří dostávají amoxicilin, se rozvine erytematózní kožní vyrážka. Proto by AUGMENTIN neměl být podáván pacientům s mononukleózou.
Potenciál pro přemnožení mikrobů
Během léčby je třeba vzít v úvahu možnost superinfekcí houbovými nebo bakteriálními patogeny. Pokud dojde k superinfekci, je třeba vysadit amoxicilin/klavulanát draselný a zahájit vhodnou léčbu.
Fenylketonurika
AUGMENTIN 500 mg žvýkací tablety a AUGMENTIN prášek pro perorální roztok obsahují aspartam, který obsahuje fenylalanin. Jedna 200mg žvýkací tableta přípravku AUGMENTIN 750 mg obsahuje 2,1 mg fenylalaninu; jedna 400mg žvýkací tableta obsahuje 4,2 mg fenylalaninu; každých 5 ml buď 200 mg/5 ml nebo 400 mg/5 ml perorální suspenze obsahuje 7 mg fenylalaninu. Ostatní formulace přípravku AUGMENTIN 875 mg fenylalanin neobsahují.
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku AUGMENTIN 250 mg v nepřítomnosti prokázané nebo silně suspektní bakteriální infekce přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyly provedeny dlouhodobé studie na zvířatech pro hodnocení karcinogenního potenciálu.
AUGMENTIN (formulace amoxicilin:klavulanát v poměru 4:1) nebyl mutagenní v testu Amesovy bakteriální mutace a testu konverze genu kvasinek. AUGMENTIN byl slabě pozitivní v testu myšího lymfomu, ale trend ke zvýšení četnosti mutací v tomto testu se objevil při dávkách, které byly také spojeny se sníženým přežitím buněk. AUGMENTIN byl negativní v myším mikronukleovém testu a v dominantním letálním testu u myší. Samotný klavulanát draselný byl testován v Amesově bakteriálním mutačním testu a v myším mikronukleovém testu a byl negativní v každém z těchto testů.
Bylo zjištěno, že AUGMENTIN (formulace amoxicilin:klavulanát v poměru 2:1) v perorálních dávkách až 1 200 mg/kg/den nemá žádný vliv na fertilitu a reprodukční schopnost u potkanů. Na základě plochy povrchu těla je tato dávka amoxicilinu přibližně 4násobkem maximální doporučené perorální dávky pro dospělého člověka (875 mg každých 12 hodin). U klavulanátu je násobek dávky přibližně 9krát vyšší než maximální doporučená perorální dávka pro dospělého člověka (125 mg každých 8 hodin), rovněž na základě plochy povrchu těla.
Použití u konkrétních populací
Těhotenství
Teratogenní účinky
Kategorie březosti B. Reprodukční studie provedené na březích potkaních potkanech a myších, kterým byl podáván AUGMENTIN (formulace amoxicilin:klavulanát v poměru 2:1) v perorálních dávkách až 1200 mg/kg/den neodhalily žádné známky poškození plodu způsobeného přípravkem AUGMENTIN. Dávky amoxicilinu u potkanů a myší (na základě plochy povrchu těla) byly přibližně 4 a 2krát vyšší než maximální doporučená perorální dávka pro dospělého člověka (875 mg každých 12 hodin). U klavulanátu byly tyto násobky dávek přibližně 9- a 4násobkem maximální doporučené perorální dávky pro dospělého člověka (125 mg každých 8 hodin). Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Práce a dodání
Perorální antibiotika třídy ampicilinu se během porodu špatně vstřebávají. Není známo, zda použití amoxicilinu/klavulanátu draselného u lidí během porodu nebo porodu má okamžité nebo opožděné nežádoucí účinky na plod, prodlužuje trvání porodu nebo zvyšuje pravděpodobnost nutnosti porodnického zákroku.
Kojící matky
Bylo prokázáno, že amoxicilin se vylučuje do lidského mléka. Užívání amoxicilinu/klavulanátu draselného kojícími matkami může vést k senzibilizaci kojenců. Při podávání amoxicilinu/klavulanátu draselného kojící ženě je třeba postupovat opatrně.
Pediatrické použití
Bezpečnost a účinnost přípravku AUGMENTIN prášek pro perorální suspenzi a žvýkací tablety byla stanovena u pediatrických pacientů. Použití přípravku AUGMENTIN 125 mg u pediatrických pacientů je podpořeno důkazy ze studií přípravku AUGMENTIN Tablets u dospělých s dalšími údaji ze studie přípravku AUGMENTIN Powder for Oral Suspension u pediatrických pacientů ve věku od 2 měsíců do 12 let s akutním zánětem středního ucha. [vidět Klinické studie ]
Vzhledem k neúplně vyvinuté renální funkci u novorozenců a malých kojenců může být eliminace amoxicilinu zpožděna; eliminace klavulanátu je v této věkové skupině nezměněna. Dávkování přípravku AUGMENTIN 500 mg by mělo být upraveno u pediatrických pacientů ve věku DÁVKOVÁNÍ A PODÁVÁNÍ ]
Geriatrické použití
Z 3 119 pacientů v analýze klinických studií přípravku AUGMENTIN bylo 32 % ve věku ≥ 65 let a 14 % ve věku ≥ 75 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších osob.
Je známo, že tento lék je v podstatě vylučován ledvinami a riziko nežádoucích reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin.
Dávkování při poškození ledvin
Amoxicilin je primárně eliminován ledvinami a u pacientů s těžkou poruchou funkce ledvin (GFR Pacienti s poruchou funkce ledvin pro konkrétní doporučení u pacientů s poruchou funkce ledvin.
PŘEDÁVKOVAT
V případě předávkování přerušte léčbu, ošetřete symptomaticky a podle potřeby zaveďte podpůrná opatření. Prospektivní studie s 51 pediatrickými pacienty v toxikologickém centru naznačila, že předávkování amoxicilinem v dávce nižší než 250 mg/kg není spojeno s významnými klinickými příznaky1.
U pacientů po předávkování amoxicilinem/klavulanátem draselným byla hlášena intersticiální nefritida vedoucí k oligurickému selhání ledvin.
Po předávkování amoxicilinem/klavulanátem draselným u dospělých a dětských pacientů byla také hlášena krystalurie, v některých případech vedoucí k selhání ledvin. V případě předávkování by měl být zachován dostatečný příjem tekutin a diuréza, aby se snížilo riziko krystalurie amoxicilinu/klavulanátu draselného. Zdá se, že poškození ledvin je po ukončení podávání léku reverzibilní. Vysoké hladiny v krvi se mohou vyskytnout snadněji u pacientů s poruchou funkce ledvin v důsledku snížené renální clearance amoxicilinu/klavulanátu draselného. Amoxicilin/klavulanát draselný lze odstranit z oběhu hemodialýzou. [vidět DÁVKOVÁNÍ A PODÁVÁNÍ ]
KONTRAINDIKACE
Závažné hypersenzitivní reakce
AUGMENTIN je kontraindikován u pacientů s anamnézou závažných hypersenzitivních reakcí (např. anafylaxe nebo Stevens-Johnsonův syndrom) na amoxicilin, klavulanát nebo na jiná beta-laktamová antibakteriální léčiva (např. peniciliny a cefalosporiny).
Cholestatická žloutenka/jaterní dysfunkce
AUGMENTIN 250 mg je kontraindikován u pacientů s předchozí anamnézou cholestatické žloutenky/jaterní dysfunkce související s přípravkem AUGMENTIN.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
AUGMENTIN je antibakteriální léčivo. [vidět Mikrobiologie ]
Farmakokinetika
Průměrné farmakokinetické parametry amoxicilinu a klavulanátu draselného u normálních dospělých po podání přípravku AUGMENTIN 250 mg tablety jsou uvedeny v tabulce 3 a po podání přípravku AUGMENTIN 250 mg prášek pro perorální suspenzi a žvýkací tablety jsou uvedeny v tabulce 4.
Perorální podání 5 ml 250 mg/5 ml suspenze AUGMENTINU nebo ekvivalentní dávka 10 ml 125 mg/5 ml suspenze AUGMENTINU poskytuje průměrné maximální sérové koncentrace přibližně 1 hodinu po dávce 6,9 mcg/ml pro amoxicilin a 1,6 mcg /ml pro kyselinu klavulanovou. Plochy pod křivkami sérové koncentrace získané během prvních 4 hodin po podání byly 12,6 mcg*h/ml pro amoxicilin a 2,9 mcg*h/ml pro kyselinu klavulanovou, když 5 ml suspenze 250 mg/5 ml AUGMENTINU nebo ekvivalentní dávka Normálním dospělým bylo podáno 10 ml 125 mg/5 ml suspenze AUGMENTINU. Jedna 250mg žvýkací tableta AUGMENTINU nebo dvě 125mg žvýkací tablety AUGMENTINU jsou ekvivalentní 5 ml suspenze AUGMENTINU 250 mg/5 ml a poskytují podobné sérové koncentrace amoxicilinu a kyseliny klavulanové.
Sérové koncentrace amoxicilinu dosažené s přípravkem AUGMENTIN 250 mg jsou podobné jako při perorálním podání ekvivalentních dávek samotného amoxicilinu. Čas nad minimální inhibiční koncentrací 1 mcg/ml pro amoxicilin se ukázal být podobný po odpovídajících dávkovacích režimech každých 12 hodin a každých 8 hodin AUGMENTINU 250 mg u dospělých a dětí.
Vstřebávání
Dávkování nalačno nebo po jídle má minimální vliv na farmakokinetiku amoxicilinu. Zatímco AUGMENTIN lze podávat bez ohledu na jídlo, absorpce klavulanátu draselného, když se užívá s jídlem, je vyšší než nalačno. V jedné studii byla relativní biologická dostupnost klavulanátu snížena, když byl AUGMENTIN podáván 30 a 150 minut po začátku snídaně s vysokým obsahem tuku.
Rozdělení
Žádná ze složek přípravku AUGMENTIN není silně vázána na proteiny; kyselina klavulanová se váže na lidské sérum přibližně z 25 % a amoxicilin přibližně z 18 %. Amoxicilin snadno difunduje do většiny tělesných tkání a tekutin s výjimkou mozkové a míšní tekutiny.
Dvě hodiny po perorálním podání jednorázové dávky 35 mg/kg suspenze přípravku AUGMENTIN 500 mg dětem nalačno byly ve výpotcích středního ucha detekovány průměrné koncentrace amoxicilinu 3 mcg/ml a kyseliny klavulanové 0,5 mcg/ml.
Metabolismus A Vylučování
Poločas amoxicilinu po perorálním podání přípravku AUGMENTIN 125 mg je 1,3 hodiny a poločas kyseliny klavulanové je 1 hodina.
Přibližně 50 % až 70 % amoxicilinu a přibližně 25 % až 40 % kyseliny klavulanové se vylučuje v nezměněné podobě močí během prvních 6 hodin po podání jedné 250 mg nebo 500 mg tablety přípravku AUGMENTIN.
Mikrobiologie
Amoxicilin je semisyntetické antibiotikum s in vitro baktericidní aktivitou proti grampozitivním a gramnegativním bakteriím. Amoxicilin je však náchylný k degradaci beta-laktamázami, a proto spektrum aktivity nezahrnuje organismy, které tyto enzymy produkují. Kyselina klavulanová je beta-laktam, strukturálně příbuzný penicilinům, který má schopnost inaktivovat některé enzymy beta-laktamázy běžně se vyskytující v mikroorganismech odolných vůči penicilinům a cefalosporinům. Zejména má dobrou aktivitu proti klinicky důležitým plasmidem zprostředkovaným betalaktamázám, které jsou často odpovědné za přenesenou rezistenci vůči léčivům.
Formulace amoxicilinu a kyseliny klavulanové v AUGMENTINU chrání amoxicilin před degradací některými beta-laktamázovými enzymy a rozšiřuje antibiotické spektrum amoxicilinu o mnoho bakterií normálně rezistentních na amoxicilin.
Bylo prokázáno, že amoxicilin/kyselina klavulanová je účinný proti většině izolátů následujících bakterií, a to jak in vitro, tak při klinických infekcích, jak je popsáno v části INDIKACE A POUŽITÍ.
Gram-pozitivní bakterie
Staphylococcus aureus
Gram-negativní bakterie
Enterobacter druh Escherichia coli Haemophilus influenzae Klebsiella druh Moraxella catarrhalis Obrázky Zařazení v systému
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám . Nejméně 90 procent následujících bakterií vykazuje in vitro minimální inhibiční koncentraci (MIC) nižší nebo rovnou prahu citlivosti pro amoxicilin/kyselinu klavulanovou. Nicméně účinnost amoxicilinu/kyseliny klavulanové při léčbě klinických infekcí způsobených těmito bakteriemi nebyl prokázáno v adekvátních a dobře kontrolovaných klinických studiích.
Gram-pozitivní bakterie
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Viridans skupina Streptococcus
Gram-negativní bakterie
Eikenellacorrodens Proteus mirabilis
Anaerobní bakterie
Bacteroidesspecies včetně Bacteroides fragilis Fusobacterium druh Peptostreptococcus druh
Metody testování citlivosti
Je-li to možné, měla by klinická mikrobiologická laboratoř poskytovat výsledky in vitro testů citlivosti pro antimikrobiální léčivé přípravky používané v rezidentních nemocnicích lékaři jako pravidelné zprávy, které popisují profil citlivosti nozokomiálních a komunitně získaných patogenů. Tyto zprávy by měly pomoci lékaři při výběru antibakteriálního léku pro léčbu.
Techniky ředění
Kvantitativní metody se používají ke stanovení antimikrobiálních minimálních inhibičních koncentrací (MIC). Tyto MIC poskytují odhady citlivosti bakterií na antimikrobiální sloučeniny. MIC by měly být stanoveny pomocí standardizované testovací metody2,3 (bujón a/nebo agar). Hodnoty MIC by měly být interpretovány podle kritérií uvedených v tabulce 5.
Difúzní techniky
Kvantitativní metody, které vyžadují měření průměrů zón, mohou také poskytnout reprodukovatelné odhady citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny poskytuje odhad citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny by měla být určena pomocí standardizované zkušební metody3,4. Tento postup používá papírové disky impregnované 30 mcg amoxicilinu/kyseliny klavulanové (20 mcg amoxicilinu plus 10 mcg kyseliny klavulanové) k testování citlivosti bakterií na amoxicilin/kyselinu klavulanovou. Kritéria interpretace diskové difuze jsou uvedena v tabulce 5.
Kontrola kvality
Standardizované postupy testu citlivosti vyžadují použití laboratorních kontrol pro sledování a zajištění přesnosti a přesnosti zásob a činidel používaných v testu a technik jednotlivců provádějících test2,3,4. Standardní prášek amoxicilinu/kyseliny klavulanové by měl poskytovat následující rozsah hodnot MIC uvedených v tabulce 6 pro difúzní techniku s použitím disku 30 mcg amoxicilinu/kyseliny klavulanové (20 mcg amoxicilinu plus 10 mcg kyseliny klavulanové), měla by být splněna kritéria v tabulce 6 .
Klinické studie
Infekce dolních cest dýchacích a komplikovaných močových cest
Údaje ze 2 klíčových studií u 1 191 pacientů léčených buď pro infekce dolních cest dýchacích nebo pro komplikované infekce močových cest porovnávaly režim 875 mg tablet AUGMENTINU každých 12 hodin s 500 mg tabletami AUGMENTINU 125 mg podávaných každých 8 hodin (584 a 607 pacientů, v tomto pořadí ). Srovnatelná účinnost byla prokázána mezi režimy dávkování každých 12 hodin a každých 8 hodin. V procentech nežádoucích účinků v každé skupině nebyl žádný významný rozdíl. Nejčastěji hlášeným nežádoucím účinkem byl průjem; četnost výskytu byla podobná pro dávkovací režim 875 mg každých 12 hodin a 500 mg každých 8 hodin (15 %, resp. 14 %); mezi jednotlivými režimy však byl statisticky významný rozdíl (p
jedné z těchto klíčových studií byli randomizováni pacienti buď s pyelonefritidou (n = 361) nebo s komplikovanou infekcí močových cest (tj. pacienti s abnormalitami močového traktu, které predisponují k relapsu bakteriurie po eradikaci, n = 268) (1: 1) dostávat buď 875 mg tablety přípravku AUGMENTIN 125 mg každých 12 hodin (n=308) nebo 500 mg tablety přípravku AUGMENTIN každých 8 hodin (n=321).
Počet bakteriologicky hodnotitelných pacientů byl mezi oběma dávkovacími režimy srovnatelný. AUGMENTIN 250 mg vyvolal srovnatelnou míru bakteriologické úspěšnosti u pacientů hodnocených 2 až 4 dny bezprostředně po ukončení léčby. Míry bakteriologické účinnosti byly srovnatelné při jedné z následných návštěv (5 až 9 dnů po léčbě) a při pozdní návštěvě po léčbě (ve většině případů to byly 2 až 4 týdny po léčbě), jak je vidět v tabulce 7.
Jak bylo uvedeno dříve, ačkoliv v každé skupině nebyl žádný významný rozdíl v procentech nežádoucích účinků, mezi režimy byl statisticky významný rozdíl v četnosti těžkého průjmu nebo abstinenčních příznaků s průjmem.
Akutní bakteriální zánět středního ucha a průjem u dětských pacientů
Byla provedena jedna klinická studie v USA/Kanadě, která porovnávala 45/6,4 mg/kg/den (děleno každých 12 hodin) AUGMENTINU po dobu 10 dnů oproti 40/10 mg/kg/den (děleno každých 8 hodin) AUGMENTINU po 10 dnů v roce léčba akutního zánětu středního ucha. V tomto testu byly použity pouze suspenzní formulace. Celkem bylo zařazeno 575 pediatrických pacientů (ve věku od 2 měsíců do 12 let), s rovnoměrným rozdělením mezi 2 léčebné skupiny a srovnatelný počet pacientů (tj. ³ 84 %) na léčebnou skupinu. Pro způsobilost byla vyžadována specifická kritéria pro zánět středního ucha a mezi těmito kritérii a hodnocením klinické odpovědi lékařem byla nalezena silná korelace na konci terapie a sledování. Míry klinické účinnosti na konci terapeutické návštěvy (definované jako 2 4 dny po dokončení terapie) a při následné návštěvě (definované jako 22 28 dní po dokončení terapie) byly srovnatelné pro 2 léčebné skupiny, s následujícími míra vyléčení získaná u hodnotitelných pacientů: Na konci léčby 87 % (n = 265) a 82 % (n = 260) pro 45 mg/kg/den každých 12 hodin a 40 mg/kg/den každých 8 hodin, v daném pořadí . Při sledování 67 % (n = 249) a 69 % (n = 243) pro 45 mg/kg/den každých 12 hodin a 40 mg/kg/den každých 8 hodin, v daném pořadí.
Průjem byl definován buď jako: (a) 3 nebo více vodnatých nebo 4 nebo více řídkých/vodnatých stolic za 1 den; NEBO (b) 2 vodnaté stolice denně nebo 3 řídké/vodnaté stolice denně po 2 po sobě jdoucí dny. Výskyt průjmu byl významně nižší u pacientů, kteří dostávali režim každých 12 hodin, ve srovnání s pacienty, kteří dostávali režim každých 8 hodin (14 %, resp. 34 %). Kromě toho byl počet pacientů buď s těžkým průjmem, nebo kteří byli vysazeni s průjmem, významně nižší ve skupině léčené každých 12 hodin (3 % a 8 % každých 12 hodin/10 dní a každých 8 hodin/10 dní, v tomto pořadí ). Ve skupině s léčbou každých 12 hodin byli vyřazeni 3 pacienti (1 %) s alergickou reakcí, zatímco 1 pacient ve skupině každých 8 hodin byl vyřazen z tohoto důvodu. Počet pacientů s kandidální infekcí plenkové oblasti byl 4 % a 6 % ve skupinách každých 12 hodin a každých 8 hodin.
Není známo, zda lze zjištění statisticky významného snížení průjmu u perorálních suspenzí podávaných každých 12 hodin oproti suspenzím podávaným každých 8 hodin extrapolovat na žvýkací tablety. Přítomnost mannitolu ve žvýkacích tabletách může přispívat k odlišnému profilu průjmu. Perorální suspenze každých 12 hodin (200 mg/5 ml a 400 mg/5 ml) se oslazují aspartamem.
INFORMACE PRO PACIENTA
Pacienti by měli být informováni, že AUGMENTIN lze užívat každých 8 hodin nebo každých 12 hodin v závislosti na předepsané dávce. Každá dávka by se měla užívat s jídlem nebo svačinou, aby se snížila možnost gastrointestinálních potíží.
Pacienti by měli být poučeni, že antibakteriální léky, včetně přípravku AUGMENTIN 125 mg, by měly být používány pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je AUGMENTIN předepsán k léčbě bakteriální infekce, je třeba pacientům říci, že ačkoli je běžné, že se na začátku léčby cítí lépe, léky by měly být užívány přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může: (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem AUGMENTIN 250 mg nebo jinými antibakteriálními léky. .
Poraďte pacientům, že průjem je častým problémem způsobeným antibakteriálními látkami a obvykle končí, když je antibiotikum vysazeno. Někdy po zahájení léčby antibakteriálními látkami se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až 2 nebo více měsíců po užití poslední dávky antibakteriálního přípravku. Pokud je průjem těžký nebo trvá déle než 2 nebo 3 dny, pacienti by měli kontaktovat svého lékaře.
Pacienti by měli být poučeni, aby uchovávali suspenzi v chladničce. Před použitím dobře protřepejte. Při dávkování suspenze (tekutiny) přípravku AUGMENTIN 125 mg dítěti použijte dávkovací lžičku nebo kapátko na léky. Po každém použití nezapomeňte lžičku nebo kapátko opláchnout. Lahvičky suspenze přípravku AUGMENTIN mohou obsahovat více tekutiny, než je požadováno. Dodržujte pokyny svého lékaře o množství, které se má použít, a dnech léčby, které vaše dítě potřebuje. Zlikvidujte veškerý nepoužitý lék.
Pacienti by si měli být vědomi toho, že AUGMENTIN 125 mg obsahuje léčivý přípravek třídy penicilinů, který může u některých jedinců způsobit alergické reakce.
