Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Myambutol a jak se používá?
Myambutol je lék na předpis používaný k léčbě příznaků tuberkulózy. Myambutol 400 mg lze užívat samostatně nebo s jinými léky.
Myambutol patří do třídy léků nazývaných antituberkulární látky.
Není známo, zda je přípravek Myambutol 800 mg bezpečný a účinný u dětí mladších 13 let.
Jaké jsou možné vedlejší účinky přípravku Myambutol 800 mg?
Myambutol může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- problémy se zrakem,
- ztráta zraku, která může být trvalá,
- rozmazané vidění,
- potíže se zaměřením,
- ztráta zraku v jednom oku, která trvá hodinu nebo déle,
- zvýšená citlivost vašich očí na světlo,
- ztráta barevného vidění,
- bolest s pohybem očí,
- bolest za očima,
- nový nebo zhoršující se kašel s horečkou,
- necitlivost, brnění v rukou nebo nohou,
- zmatek,
- halucinace,
- horečka,
- oteklé žlázy,
- bolestivé vředy v ústech,
- kožní vředy,
- příznaky nachlazení nebo chřipky,
- celkový pocit nemoci,
- snadná tvorba modřin nebo krvácení,
- krvácení z nosu,
- krvácení z dásní,
- malé nebo žádné močení,
- bolest v horní části žaludku,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- bolest krku,
- pálení ve tvých očích,
- bolest kůže,
- červená nebo fialová kožní vyrážka, která se šíří (zejména v obličeji nebo horní části těla) a způsobuje puchýře a olupování,
- bolest na hrudi a
- dušnost
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky Myambutolu patří:
- svědění,
- vyrážka,
- bolest kloubů,
- bolest hlavy,
- závrať,
- nevolnost,
- zvracení,
- bolest břicha,
- poruchy trávení a
- ztráta chuti k jídlu
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Myambutolu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
MYAMBUTOL (ethambutol hydrochlorid) je perorální chemoterapeutické činidlo, které je specificky účinné proti aktivně rostoucím mikroorganismům rodu Mycobacterium, včetně M. tuberculosis. Strukturní vzorec je:
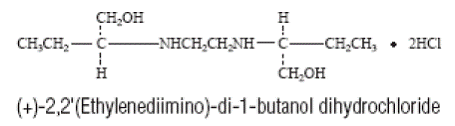
Tablety MYAMBUTOL (ethambutol hydrochlorid) 100 a 400 mg obsahují následující neaktivní složky: želatinu, hydroxypropylmethylcelulózu, stearát hořečnatý, laurylsulfát sodný, sorbitol, kyselinu stearovou, sacharózu, oxid titaničitý a další složky.
INDIKACE
MYAMBUTOL je indikován k léčbě plicní tuberkulózy. Neměl by se používat jako jediné antituberkulotikum, ale měl by se používat ve spojení s alespoň jedním dalším antituberkulotikum. Výběr doprovodného léčiva by měl být založen na klinických zkušenostech, zvážení komparativní bezpečnosti a vhodných studiích citlivosti in vitro. U pacientů, kteří nedostávali předchozí antituberkulotikum, tj. počáteční léčbu, byly nejčastěji používané následující režimy:
MYAMBUTOL plus isoniazid
MYAMBUTOL 800 mg plus isoniazid plus streptomycin.
pacientů, kteří již podstoupili antituberkulotikum, je často mykobakteriální rezistence na jiná léčiva používaná v počáteční terapii. V důsledku toho by u takových pacientů po přeléčení měl být MYAMBUTOL kombinován s alespoň jedním z léků druhé linie, které nebyly pacientovi dříve podávány au kterých byla bakteriální citlivost indikována vhodnými studiemi in vitro. Antituberkulózní léky používané s MYAMBUTOLem zahrnovaly cykloserin, ethionamid, pyrazinamid, viomycin a další léky. Isoniazid, kyselina aminosalicylová a streptomycin byly také použity v režimech s více léky. Byly také použity střídavé lékové režimy.
DÁVKOVÁNÍ A PODÁVÁNÍ
MYAMBUTOL 200 mg by se neměl používat samostatně, při počáteční léčbě nebo při přeléčení. MYAMBUTOL 400 mg by měl být podáván pouze jednou za 24 hodin. Absorpce se podáváním s jídlem významně nemění. Léčba by obecně měla pokračovat, dokud se bakteriologická konverze nestane trvalou a dokud nedojde k maximálnímu klinickému zlepšení.
MYAMBUTOL se nedoporučuje používat u pediatrických pacientů mladších třinácti let, protože nebyly stanoveny bezpečné podmínky pro použití.
Počáteční léčba: U pacientů, kteří nedostávali předchozí antituberkulotikum, podávejte MYAMBUTOL 15 mg/kg (7 mg/lb) tělesné hmotnosti v jedné perorální dávce jednou za 24 hodin. V novějších studiích byl isoniazid podáván současně v jedné denní perorální dávce.
Přeléčení: pacientů, kteří podstoupili předchozí antituberkulotikum, podávejte MYAMBUTOL 25 mg/kg (11 mg/lb) tělesné hmotnosti v jedné perorální dávce jednou za 24 hodin. Souběžně podávejte alespoň jedno další antituberkulotikum, na které bylo prokázáno, že jsou organismy citlivými vhodnými testy in vitro. Vhodné léky se obvykle skládají z těch, které se dříve při léčbě pacienta nepoužívaly. Po 60 dnech podávání MYAMBUTOL 600 mg snižte dávku na 15 mg/kg (7 mg/lb) tělesné hmotnosti a podávejte jako jednu perorální dávku jednou za 24 hodin.
Během období, kdy je pacient na denní dávce 25 mg/kg, se doporučuje měsíční oční vyšetření.
Viz tabulka pro snadný výběr tablety (tablet) se správnou hmotnostní dávkou.
Tabulka hmotnostních dávek
JAK DODÁVÁNO
Tablety hydrochloridu etambutolu USP
100 mg – kulaté, konvexní, bílé, potahované tablety s vyraženým E6 na jedné straně se dodávají následovně:
NDC 54879-001-01 – Láhev po 100 NDC 54879-001-00 - 10 blistrových balení x 10 tablet
400 mg – kulaté, konvexní, bílé, potahované tablety s půlicí rýhou, s vyrytým E nalevo a 7 napravo od půlicí rýhy na jedné straně se dodávají následovně:
NDC 54879-002-01 – Láhev po 100 NDC 54879-002-00 - 10 blistrových balení x 10 tablet
Skladujte při kontrolované pokojové teplotě 20° až 25°C (68° až 77°F).
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088
Vyrábí a distribuuje: STI Pharma, LLC Langhorne, PA 19047. Revidováno březen 2013
VEDLEJŠÍ EFEKTY
MYAMBUTOL může způsobit snížení zrakové ostrosti, včetně nevratné slepoty, která se zdá být způsobena zánětem zrakového nervu. Optická neuropatie včetně optické neuritidy nebo retrobulbární neuritidy vyskytující se v souvislosti s terapií ethambutolem může být charakterizována jednou nebo více z následujících příhod: snížená zraková ostrost, skotom, barvoslepost a/nebo zraková vada. Tyto příhody byly také hlášeny při absenci diagnózy optické nebo retrobulbární neuritidy.
Pacienti by měli být poučeni, aby neprodleně hlásili svému lékaři jakoukoli změnu zrakové ostrosti.
Změna zrakové ostrosti může být jednostranná nebo oboustranná, a proto musí být každé oko testováno samostatně a obě oči testovány společně. Testování zrakové ostrosti by mělo být prováděno před zahájením léčby přípravkem MYAMBUTOL a pravidelně během podávání léku, kromě toho, že by mělo být prováděno jednou měsíčně, pokud je pacient na dávce vyšší než 15 mg na kilogram denně. Snellenovy oční tabulky se doporučují pro testování zrakové ostrosti. Studie ukázaly, že u mnoha pacientů s tuberkulózou, kteří nedostávají MYAMBUTOL, existují určité výkyvy jednoho nebo dvou řádků Snellenova diagramu ve zrakové ostrosti.

Následující tabulka může být užitečná při interpretaci možných změn zrakové ostrosti, které lze přičíst MYAMBUTOL.
Obecně platí, že změny zrakové ostrosti menší než ty, které jsou uvedeny v části „Významný počet čar“ a „Snížení počtu bodů“ mohou být způsobeny náhodnými odchylkami, omezeními testovací metody nebo fyziologickou variabilitou. Naopak změny ve zrakové ostrosti, které se rovnají nebo překračují hodnoty pod „Významný počet čar“ a „Snížení počtu bodů“ indikují potřebu opětovného testování a pečlivého vyhodnocení zrakového stavu pacienta. Pokud pečlivé hodnocení potvrdí velikost zrakové změny a neodhalí jinou příčinu, je třeba léčbu přípravkem MYAMBUTOL 400 mg přerušit a pacienta v častých intervalech znovu hodnotit. Progresivní snížení zrakové ostrosti během terapie musí být považováno za důsledek MYAMBUTOLU.
Pokud se před léčbou používají korekční brýle, je nutné je nosit při testování zrakové ostrosti. Během 1 až 2 let terapie se může vyvinout refrakční vada, kterou je nutné korigovat, aby byly získány přesné výsledky testu. Testování zrakové ostrosti dírkou eliminuje refrakční vadu. Pacienti, u kterých se během léčby přípravkem MYAMBUTOL 800 mg rozvinou zrakové abnormality, mohou vykazovat subjektivní zrakové příznaky před nebo současně s projevem snížení zrakové ostrosti a všichni pacienti užívající přípravek MYAMBUTOL by měli být pravidelně dotazováni na rozmazané vidění a další subjektivní oční příznaky.
K obnovení zrakové ostrosti obvykle dochází v průběhu týdnů až měsíců po vysazení léku. Někteří pacienti dostali MYAMBUTOL (ethambutol hydrochlorid) znovu po takovém zotavení, aniž by se znovu objevila ztráta zrakové ostrosti.
Mezi další hlášené nežádoucí účinky patří: hypersenzitivita, anafylaktická/anafylaktoidní reakce, dermatitida, erythema multiforme, pruritus a bolest kloubů; anorexie, nauzea, zvracení, gastrointestinální potíže a bolesti břicha; horečka, malátnost, bolest hlavy a závratě; duševní zmatek, dezorientace a možné halucinace; trombocytopenie, leukopenie a neutropenie. Byla hlášena necitlivost a brnění končetin v důsledku periferní neuritidy.
Objevují se zvýšené hladiny kyseliny močové v séru a bylo hlášeno vysrážení akutní dny. Během léčby přípravkem MYAMBUTOL byly také hlášeny plicní infiltráty s eozinofilií nebo bez eozinofilie. Byly hlášeny jaterní toxicity, včetně úmrtí (viz VAROVÁNÍ .) Vzhledem k tomu, že se MYAMBUTOL 400 mg doporučuje k léčbě ve spojení s jedním nebo více jinými antituberkulotiky, mohou tyto změny souviset se souběžnou léčbou. Syndrom hypersenzitivity sestávající z kožní reakce (jako je vyrážka nebo exfoliativní dermatitida), eozinofilie a jednoho nebo více z následujících: hepatitida, pneumonitida, nefritida, myokarditida, perikarditida. Může být přítomna horečka a lymfadenopatie.
DROGOVÉ INTERAKCE
Výsledky studie současného podávání MYAMBUTOLU (50 mg/kg) s antacidem obsahujícím hydroxid hlinitý 13 pacientům s tuberkulózou prokázaly snížení průměrných sérových koncentrací a vylučování etambutolu močí přibližně o 20 % a 13 %, v tomto pořadí, což naznačuje, že orální absorpce etambutolu může být těmito antacidními přípravky snížena. Doporučuje se vyhnout se současnému podávání etambutolu s antacidy obsahujícími hydroxid hlinitý po dobu nejméně 4 hodin po podání etambutolu.
VAROVÁNÍ
MYAMBUTOL 600 mg může způsobit snížení zrakové ostrosti, které se zdá být způsobeno oční neuritidou. Tento účinek může souviset s dávkou a délkou léčby. Tento účinek je obecně reverzibilní, když je podávání léku okamžitě přerušeno. Byla však hlášena nevratná slepota. (Vidět OPATŘENÍ a NEŽÁDOUCÍ REAKCE ).
Byly hlášeny jaterní toxicity včetně úmrtí (viz NEŽÁDOUCÍ REAKCE ). Mělo by být provedeno základní a pravidelné hodnocení jaterních funkcí.
OPATŘENÍ
MYAMBUTOL 800 mg ethambutol hydrochlorid se nedoporučuje používat u pediatrických pacientů mladších třinácti let, protože nebyly stanoveny bezpečné podmínky pro použití.
Pacienti se sníženou funkcí ledvin potřebují snížit dávku podle sérových hladin MYAMBUTOLU, protože hlavní cestou vylučování tohoto léku jsou ledviny.
Protože tento lék může mít nepříznivé účinky na zrak, fyzikální vyšetření by mělo zahrnovat oftalmoskopii, perimetrii prstů a testování barevného rozlišení. U pacientů se zrakovými vadami, jako je šedý zákal, recidivující zánětlivé stavy oka, optická neuritida a diabetická retinopatie, je hodnocení změn zrakové ostrosti obtížnější a je třeba dbát na to, aby změny vidění nebyly způsobeny základní chorobné stavy. U takových pacientů je třeba zvážit vztah mezi očekávaným přínosem a možným zhoršením zraku, protože hodnocení zrakových změn je obtížné. (Doporučené postupy viz další odstavce pod NEŽÁDOUCÍ REAKCE ).
Jako u každého silného léku by mělo být provedeno základní a pravidelné hodnocení funkcí orgánových systémů, včetně ledvin, jater a krvetvorby.
Těhotenství
Teratogenní účinky
Kategorie těhotenství C.
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Existují zprávy o očních abnormalitách vyskytujících se u kojenců narozených ženám na antituberkulózní léčbě, která zahrnovala MYAMBUTOL. MYAMBUTOL by měl být používán během těhotenství pouze v případě, že přínos ospravedlňuje potenciální riziko pro plod.
Bylo prokázáno, že MYAMBUTOL 200 mg je teratogenní u březích myší a králíků, pokud je podáván ve vysokých dávkách. Když byly březím myším nebo králíkům podávány vysoké dávky hydrochloridu ethambutolu, fetální mortalita se mírně, ale ne významně (P>0,05) zvýšila. Samice potkanů léčených ethambutol hydrochloridem vykazovaly mírné, ale nevýznamné (P>0,05) snížení plodnosti a velikosti vrhu.
plodů narozených myším léčeným vysokými dávkami MYAMBUTOLU 400 mg během březosti byl pozorován nízký výskyt rozštěpů patra, exencefalie a abnormalit páteře. U novorozenců potkanů, kterým byly během březosti podávány vysoké dávky etambutol-hydrochloridu, byly pozorovány drobné abnormality krčního obratle. Králičkám, které dostávaly během březosti vysoké dávky MYAMBUTOLU, se narodily dva plody s monoftalmií, jeden se zkráceným pravým předloktím doprovázeným oboustrannou kontrakturou zápěstního kloubu a jeden se zaječím rtem a rozštěpem patra.
Kojící matky
MYAMBUTOL se vylučuje do mateřského mléka. Použití přípravku MYAMBUTOL by mělo být zváženo pouze tehdy, pokud očekávaný přínos pro matku převáží potenciální riziko pro kojence.
Pediatrické použití
MYAMBUTOL (ethambutol hydrochlorid) se nedoporučuje používat u pediatrických pacientů mladších třinácti let, protože nebyly stanoveny bezpečné podmínky pro použití.
Geriatrické použití
použití etambutolu u starších osob jsou omezené údaje. Jedna studie se 101 pacienty ve věku 65 let a staršími na vícelékových antituberkulotických režimech zahrnovala 94 pacientů na ethambutolu. U těchto pacientů nebyly pozorovány žádné rozdíly v bezpečnosti nebo snášenlivosti ve srovnání s obecně hlášenými u dospělých. Jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců.
PŘEDÁVKOVAT
Nebyly poskytnuty žádné informace
KONTRAINDIKACE
MYAMBUTOL je kontraindikován u pacientů, o kterých je známo, že jsou na tento lék přecitlivělí. Je také kontraindikován u pacientů se známou optickou neuritidou, pokud klinický úsudek neurčí, že může být použit. MYAMBUTOL je kontraindikován u pacientů, kteří nejsou schopni ocenit a hlásit zrakové vedlejší účinky nebo změny vidění (např. malé děti, pacienti v bezvědomí).
KLINICKÁ FARMAKOLOGIE
MYAMBUTOL 600 mg po jednorázové perorální dávce 25 mg/kg tělesné hmotnosti dosahuje vrcholu 2 až 5 mg/ml v séru 2 až 4 hodiny po podání. Když je lék podáván denně po delší dobu v této dávce, jsou sérové hladiny podobné. Sérová hladina MYAMBUTOLU klesne na nedetekovatelné hladiny do 24 hodin po poslední dávce s výjimkou některých pacientů s abnormální funkcí ledvin. Intracelulární koncentrace erytrocytů dosahují maximálních hodnot přibližně dvojnásobku plazmy a tento poměr si udržují po dobu 24 hodin.
Během 24 hodin po perorálním podání přípravku MYAMBUTOL se přibližně 50 procent počáteční dávky vyloučí v nezměněné podobě močí, zatímco dalších 8 až 15 procent se objeví ve formě metabolitů. Zdá se, že hlavní cestou metabolismu je počáteční oxidace alkoholu na aldehydický meziprodukt s následnou konverzí na dikarboxylovou kyselinu. 20 až 22 procent počáteční dávky se vyloučí stolicí jako nezměněné léčivo. U pacientů s normální funkcí ledvin nebyla při po sobě jdoucích jednorázových denních dávkách 25 mg/kg pozorována žádná akumulace léku, ačkoli u pacientů s renální insuficiencí byla prokázána výrazná akumulace.
MYAMBUTOL difunduje do aktivně rostoucích buněk mykobakterií, jako jsou tuberkulózní bacily. Zdá se, že MYAMBUTOL 800 mg inhibuje syntézu jednoho nebo více metabolitů, a tak způsobuje narušení buněčného metabolismu, zastavení množení a buněčnou smrt. Nebyla prokázána žádná zkřížená rezistence s jinými dostupnými antimykobakteriálními látkami.
Bylo prokázáno, že MYAMBUTOL 200 mg je účinný proti kmenům Mycobacterium tuberculosis, ale nezdá se, že by byl účinný proti houbám, virům nebo jiným bakteriím. Kmeny Mycobacterium tuberculosis dříve nevystavené MYAMBUTOL byly jednotně citlivé na koncentrace 8 nebo méně mcg/ml, v závislosti na povaze kultivačního média. Když byl MYAMBUTOL použit samostatně k léčbě tuberkulózy, tuberkulózní bacily od těchto pacientů si vyvinuly rezistenci na MYAMBUTOL (ethambutol hydrochlorid) pomocí testů citlivosti in vitro; vývoj rezistence byl nepředvídatelný a zdá se, že probíhá stupňovitě. Nebyla hlášena žádná zkřížená rezistence mezi MYAMBUTOLem a jinými antituberkulotiky. MYAMBUTOL snížil incidenci vzniku mykobakteriální rezistence na isoniazid, když byly oba léky užívány současně.
Ke stanovení koncentrací MYAMBUTOLU v séru a moči lze použít agarový difúzní mikrobiologický test, založený na inhibici Mycobacterium smegmatis (ATCC 607).
Farmakologie zvířat
Toxikologické studie u psů s vysokými prodlouženými dávkami prokázaly poškození a selhání myokardu a depigmentaci tapetum lucidum očí, jejichž význam není znám. Degenerativní změny v centrálním nervovém systému, zjevně nesouvisející s dávkou, byly také zaznamenány u psů, kteří dostávali etambutol-hydrochlorid po delší dobu.
U opic rhesus se neurologické příznaky objevily po léčbě vysokými dávkami podávanými denně po dobu několika měsíců. Ty byly korelovány se specifickými hladinami etambutolu v séru a s určitými neuroanatomickými změnami v centrálním nervovém systému. Fokální intersticiální karditida byla také zaznamenána u opic, které dostávaly etambutol-hydrochlorid ve vysokých dávkách po delší dobu.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ a OPATŘENÍ sekce.
