Flagyl 200mg, 400mg Metronidazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Flagyl a jak se používá?
Flagyl je lék na předpis používaný k léčbě příznaků bakteriálních infekcí vagíny, žaludku, jater, kůže, kloubů, mozku a dýchacích cest. Flagyl lze užívat samostatně nebo s jinými léky.
Flagyl je nitroimidazol, inhibitor CYP3A4, středně silný.
Jaké jsou možné vedlejší účinky přípravku Flagyl 200 mg?
Flagyl 400 mg může způsobit závažné nežádoucí účinky včetně:
- průjem,
- bolestivé nebo obtížné močení,
- problémové spaní,
- Deprese,
- podrážděnost,
- bolest hlavy,
- závrať
- slabost,
- točení hlavy,
- puchýře nebo vředy v ústech,
- červené nebo oteklé dásně a
- potíže s polykáním
Informujte svého lékaře, pokud zaznamenáte závažné nežádoucí účinky přípravku Flagyl, včetně:
- necitlivost,
- mravenčení,
- palčivá bolest v rukou nebo nohou,
- problémy se zrakem,
- bolest za očima,
- vidět záblesky nebo světlo,
- svalová slabost,
- potíže s koordinací,
- potíže s mluvením nebo porozuměním toho, co se vám říká,
- záchvat,
- horečka,
- ztuhlost krku a
- zvýšená citlivost na světlo
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
To nejsou všechny možné vedlejší účinky přípravku Flagyl. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Aby se snížil vývoj bakterií rezistentních vůči lékům a zachovala se účinnost přípravku FLAGYL® a dalších antibakteriálních léků, měl by být přípravek FLAGYL® používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny bakteriemi.
VAROVÁNÍ
Bylo prokázáno, že metronidazol je karcinogenní u myší a potkanů (viz OPATŘENÍ ). Je třeba se vyvarovat zbytečného užívání léku. Jeho použití by mělo být vyhrazeno pro podmínky popsané v INDIKACE A POUŽITÍ sekce níže.
POPIS
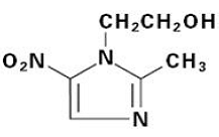
FLAGYL (metronidazol) tablety, 250 mg nebo 500 mg je perorální přípravek syntetického nitroimidazolového antimikrobiálního činidla, 2-methyl-5-nitro-1H-imidazol-1-ethanolu, který má následující strukturní vzorec:
Tablety FLAGYL (metronidazol) obsahují 250 mg nebo 500 mg metronidazolu. Mezi neaktivní složky patří celulóza, FD&C Blue No. 2 Lake, hydroxypropylcelulóza, hypromelóza, polyethylenglykol, kyselina stearová a oxid titaničitý.
INDIKACE
Symptomatická trichomoniáza. FLAGYL je indikován k léčbě infekce T. vaginalis u žen a mužů, pokud byla přítomnost trichomonády potvrzena vhodnými laboratorními postupy (vlhké nátěry a/nebo kultivace).
Asymptomatická trichomoniáza. FLAGYL 400 mg je indikován k léčbě asymptomatické infekce T. vaginalis u žen, kdy je organismus spojen s endocervicitidou, cervicitidou nebo erozí děložního hrdla. Protože existují důkazy, že přítomnost trichomonády může interferovat s přesným hodnocením abnormálních cytologických stěrů, měly by být po eradikaci parazita provedeny další stěry.
Léčba asymptomatických sexuálních partnerů. Infekce T. vaginalis je pohlavní onemocnění. Proto by asymptomatičtí sexuální partneři léčených pacientů měli být léčeni současně, pokud byla zjištěna přítomnost organismu, aby se zabránilo reinfekci partnera. Rozhodnutí, zda léčit asymptomatického mužského partnera, který má negativní kulturu, nebo toho, u kterého se o žádnou kulturu nepokusili, je individuální. Při tomto rozhodování je třeba poznamenat, že existují důkazy o tom, že se žena může znovu nakazit, pokud její sexuální partner není léčen. Vzhledem k tomu, že izolace organismu od asymptomatického mužského přenašeče může být značně obtížná, nelze v tomto ohledu spoléhat na negativní nátěry a kultury. V každém případě by měl být sexuální partner v případě reinfekce léčen přípravkem FLAGYL.
Amébiasis. FLAGYL je indikován k léčbě akutní střevní amebiázy (amébická úplavice) a amébového jaterního abscesu.
amébického jaterního abscesu terapie FLAGYL neodstraňuje potřebu aspirace nebo drenáže hnisu.
Anaerobní bakteriální infekce. FLAGYL 200 mg je indikován k léčbě závažných infekcí způsobených citlivými anaerobními bakteriemi. Indikované chirurgické zákroky by měly být prováděny ve spojení s terapií FLAGYL. U smíšené aerobní a anaerobní infekce by měla být kromě přípravku FLAGYL použita antimikrobiální činidla vhodná pro léčbu aerobní infekce.
VNITŘNÍ BŘIŠNÍ INFEKCE, včetně peritonitidy, intraabdominálního abscesu a jaterního abscesu, způsobené druhy Bacteroides včetně skupiny B. fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium druhy, druhy Eubacterium, druhy Peptococcus a druhy Peptostreptococcus.
INFEKCE KŮŽE A STRUKTURY KŮŽE způsobené druhy Bacteroides včetně skupiny B. fragilis, druhy Clostridium, druhy Peptococcus, druhy Peptostreptococcus a druhy Fusobacterium.
GYNEKOLOGICKÉ INFEKCE, včetně endometritidy, endomyometritidy, tuboovariálního abscesu a pooperační infekce vaginální manžety, způsobené druhy Bacteroides včetně skupiny B. fragilis, druhy Clostridium, druhy Peptococcus, druhy Peptostreptococcus a druhy Fusobacterium.
BAKTERIÁLNÍ SEPTICEMIE způsobená druhy Bacteroides včetně skupiny B. fragilis a druhů Clostridium.
INFEKCE KOSTÍ A KLOUBŮ (jako doplňková terapie) způsobené druhy Bacteroides včetně skupiny B. fragilis.
INFEKCE CENTRÁLNÍHO NERVOVÉHO SYSTÉMU (CNS), včetně meningitidy a mozkového abscesu, způsobené druhy Bacteroides včetně skupiny B. fragilis.
INFEKCE DOLNÍCH DÝCHACÍCH CEST, včetně pneumonie, empyému a plicního abscesu, způsobené druhy Bacteroides včetně skupiny B. fragilis.
ENDOKARDITIDA způsobená druhy Bacteroides včetně skupiny B. fragilis.
Aby se omezil vývoj bakterií rezistentních vůči lékům a zachovala se účinnost přípravku FLAGYL 400 mg a dalších antibakteriálních léků, měl by být přípravek FLAGYL používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
Trichomoniáza
In The Female
Jednodenní kúra - dva gramy FLAGYL, podané buď jako jedna dávka, nebo ve dvou rozdělených dávkách po jednom gramu, podané ve stejný den.
Sedmidenní průběh léčby - 250 mg třikrát denně po dobu sedmi po sobě jdoucích dnů. Z kontrolovaných srovnávacích studií vyplývá, že míra vyléčení stanovená na základě vaginálních výtěrů a známek a symptomů může být vyšší po sedmidenní léčbě než po jednodenním léčebném režimu.
Dávkovací režim by měl být individuální. Léčba jednou dávkou může zajistit compliance, zejména pokud je podávána pod dohledem, u těch pacientů, u kterých se nelze spolehnout, že budou pokračovat v sedmidenním režimu. Sedmidenní léčebný cyklus může minimalizovat reinfekci tím, že chrání pacienta dostatečně dlouho, aby sexuální kontakty získaly vhodnou léčbu. Dále mohou někteří pacienti snášet jeden léčebný režim lépe než druhý.
Těhotné pacientky by neměly být léčeny během prvního trimestru (viz KONTRAINDIKACE ). U těhotných pacientek, u kterých alternativní léčba nebyla dostatečná, by se neměla používat jednodenní terapie, protože vede k vyšším hladinám v séru, které se mohou dostat do fetálního oběhu (viz OPATŘENÍ , Těhotenství ).
Pokud jsou nutné opakované cykly léku, doporučuje se, aby mezi cykly uplynul čtyř až šestitýdenní interval a přítomnost trichomonády byla znovu potvrzena vhodnými laboratorními měřeními. Celkový a diferenciální počet leukocytů by měl být proveden před a po opětovné léčbě.
U mužů: Léčba by měla být individuální, stejně jako u žen.
Amébiasis
Dospělí
Pro akutní střevní amebiázu (akutní amébická úplavice): 750 mg perorálně třikrát denně po dobu 5 až 10 dnů.
Pro amébový jaterní absces: 500 mg nebo 750 mg perorálně třikrát denně po dobu 5 až 10 dnů.
Pediatričtí pacienti: 35 až 50 mg/kg/24 hodin, rozdělených do tří dávek, perorálně po dobu 10 dnů.
Anaerobní bakteriální infekce
Při léčbě nejzávažnějších anaerobních infekcí se obvykle zpočátku podává intravenózní metronidazol.
Obvyklá perorální dávka pro dospělého je 7,5 mg/kg každých šest hodin (přibližně 500 mg pro dospělého o hmotnosti 70 kg). Během 24 hodin by nemělo být překročeno maximum 4 g.
Obvyklá délka terapie je 7 až 10 dní; avšak infekce kostí a kloubů, dolních cest dýchacích a endokardu mohou vyžadovat delší léčbu.
Úpravy dávkování
Pacienti s těžkou poruchou funkce jater
U pacientů s těžkou poruchou funkce jater (Child-Pugh C) by měla být dávka přípravku FLAGYL snížena o 50 % (viz KLINICKÁ FARMAKOLOGIE a OPATŘENÍ ).
Pacienti podstupující hemodialýzu
Hemodialýza odstraňuje významná množství metronidazolu a jeho metabolitů ze systémové cirkulace. Clearance metronidazolu bude záviset na typu použité dialyzační membrány, délce trvání dialýzy a dalších faktorech. Pokud nelze podání metronidazolu oddělit od hemodialýzy, je třeba zvážit doplnění dávky metronidazolu po hemodialýze v závislosti na klinické situaci pacienta (viz KLINICKÁ FARMAKOLOGIE ).
JAK DODÁVÁNO
FLAGYL 250 mg tablety jsou kulaté, modré, potahované, s vyraženým SEARLE a 1831 na jedné straně a FLAGYL a 250 na druhé straně; dodáváno jako lahve po 50 a 100.
FLAGYL 500 mg tablety jsou podlouhlé, modré, potahované, s vyraženým FLAGYL na jedné straně a 500 na druhé straně; lahve 50 a 100.
Skladování A Stabilita
Uchovávejte při teplotě do 25°C (77°F) a chraňte před světlem.
Distribuce: Pfizer Labs, divize Pfizre Inc., NY, NY 10017. Revize: prosinec 2021
VEDLEJŠÍ EFEKTY
Během léčby metronidazolem byly hlášeny následující reakce:
Centrální nervový systém
Nejzávažnější nežádoucí účinky hlášené u pacientů léčených metronidazolem byly konvulzivní záchvaty, encefalopatie, aseptická meningitida, optická a periferní neuropatie, která se vyznačovala především necitlivostí nebo parestezií končetiny. Vzhledem k tomu, že u některých pacientů užívajících metronidazol byla hlášena přetrvávající periferní neuropatie, pacienti by měli být na tyto reakce výslovně upozorněni a měli by být upozorněni, aby přestali užívat lék a okamžitě informovali svého lékaře, pokud se objeví jakékoli neurologické příznaky. Kromě toho pacienti hlásili bolest hlavy, synkopu, závratě, vertigo, nekoordinovanost, ataxii, zmatenost, dysartrii, podrážděnost, depresi, slabost a nespavost (viz VAROVÁNÍ ).
Gastrointestinální
Nejčastěji hlášené nežádoucí účinky se týkaly gastrointestinálního traktu, zejména nauzea, někdy doprovázená bolestí hlavy, anorexií a příležitostně zvracením; průjem; epigastrické potíže; a břišní křeče a zácpa.
Ústa
Ostrá, nepříjemná kovová chuť není neobvyklá. Vyskytl se chlupatý jazyk, glositida a stomatitida; tyto mohou být spojeny s náhlým přemnožením Candidy, ke kterému může dojít během léčby.
Dermatologické
Erytematózní vyrážka a pruritus.
Hematopoetický
Reverzibilní neutropenie (leukopenie); vzácně reverzibilní trombocytopenie.
Kardiovaskulární
Bylo hlášeno prodloužení QT intervalu, zvláště když byl metronidazol podáván s léky s potenciálem prodlužovat QT interval. Zploštění T-vlny lze pozorovat v elektrokardiografických záznamech.
Přecitlivělost
Kopřivka, erytematózní vyrážka, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, zrudnutí, ucpaný nos, sucho v ústech (nebo vagíny nebo vulvy) a horečka.
Renální
Dysurie, cystitida, polyurie, inkontinence a pocit tlaku v pánvi. Případy tmavé moči byly hlášeny přibližně u jednoho pacienta ze 100 000. Ačkoli pigment, který je pravděpodobně odpovědný za tento jev, nebyl pozitivně identifikován, je téměř jistě metabolitem metronidazolu a zdá se, že nemá žádný klinický význam.
Jaterní
Případy těžké ireverzibilní hepatotoxicity/akutní jaterní selhání, včetně případů s fatálními následky s velmi rychlým nástupem po zahájení systémového užívání metronidazolu, byly hlášeny u pacientů s Cockayne syndromem (latence od začátku užívání léku do známek jaterního selhání již za 2 dny ) (viz KONTRAINDIKACE ).
jiný
Proliferace Candidy ve vagíně, dyspareunie, snížení libida, proktitida a prchavé bolesti kloubů někdy připomínající „sérovou nemoc“. Byly hlášeny vzácné případy pankreatitidy, které se po vysazení léku obecně zmírnily.
Je známo, že pacienti s Crohnovou chorobou mají zvýšený výskyt gastrointestinálních a některých extraintestinálních rakovin. V lékařské literatuře se objevilo několik zpráv o rakovině prsu a tlustého střeva u pacientů s Crohnovou chorobou, kteří byli dlouhodobě léčeni vysokými dávkami metronidazolu. Vztah příčiny a následku nebyl stanoven. Crohnova choroba není schválenou indikací pro FLAGYL 200 mg tablety.
DROGOVÉ INTERAKCE
disulfiram
Psychotické reakce byly hlášeny u alkoholických pacientů, kteří užívali metronidazol a disulfiram současně. Metronidazol by neměl být podáván pacientům, kteří užívali disulfiram během posledních dvou týdnů (viz KONTRAINDIKACE ).
Alkoholické nápoje
Břišní křeče, nevolnost, zvracení, bolesti hlavy a návaly horka se mohou objevit, pokud jsou během nebo po léčbě metronidazolem konzumovány alkoholické nápoje nebo produkty obsahující propylenglykol (viz KONTRAINDIKACE ).
Warfarin a další perorální antikoagulancia
Bylo hlášeno, že metronidazol zesiluje antikoagulační účinek warfarinu a jiných perorálních kumarinových antikoagulancií, což vede k prodloužení protrombinového času. Pokud je FLAGYL předepisován pacientům s tímto typem antikoagulační léčby, je třeba pečlivě sledovat protrombinový čas a INR.

Lithium
U pacientů stabilizovaných na relativně vysokých dávkách lithia byla krátkodobá léčba metronidazolem spojena se zvýšením sérového lithia a v několika případech se známkami toxicity lithia. Hladiny lithia v séru a sérového kreatininu by měly být získány několik dní po zahájení podávání metronidazolu, aby se zjistilo jakékoli zvýšení, které může předcházet klinickým příznakům intoxikace lithiem.
busulfan
Bylo hlášeno, že metronidazol zvyšuje plazmatické koncentrace busulfanu, což může vést ke zvýšenému riziku závažné toxicity busulfanu. Metronidazol by neměl být podáván současně s busulfanem, pokud přínos nepřeváží riziko. Pokud nejsou k dispozici žádné terapeutické alternativy k metronidazolu a současné podávání busulfanu je z lékařského hlediska nutné, je třeba provádět časté monitorování plazmatické koncentrace busulfanu a podle toho upravit dávku busulfanu.
Léky, které inhibují enzymy CYP450
Současné podávání léků, které snižují aktivitu mikrozomálních jaterních enzymů, jako je cimetidin, může prodloužit poločas a snížit plazmatickou clearance metronidazolu.
Léky, které indukují enzymy CYP450
Současné podávání léků, které indukují mikrozomální jaterní enzymy, jako je fenytoin nebo fenobarbital, může urychlit eliminaci metronidazolu, což vede ke snížení plazmatických hladin; byla také hlášena porucha clearance fenytoinu.
Léky, které prodlužují QT interval
Bylo hlášeno prodloužení QT intervalu, zvláště když byl metronidazol podáván s léky s potenciálem prodlužovat QT interval.
VAROVÁNÍ
Účinky na centrální a periferní nervový systém
Encefalopatie a periferní neuropatie: U metronidazolu byly hlášeny případy encefalopatie a periferní neuropatie (včetně neuropatie zrakového nervu).
Encefalopatie byla hlášena v souvislosti s cerebelární toxicitou charakterizovanou ataxií, závratí a dysartrií. Léze CNS pozorované na MRI byly popsány ve zprávách o encefalopatii. Příznaky CNS jsou obecně reverzibilní během dnů až týdnů po vysazení metronidazolu. Léze CNS pozorované na MRI byly také popsány jako reverzibilní.
Byla hlášena periferní neuropatie, především senzorického typu, která je charakterizována necitlivostí nebo parestezií končetiny.
U pacientů léčených metronidazolem byly hlášeny konvulzivní záchvaty.
Aseptická meningitida: Při podávání metronidazolu byly hlášeny případy aseptické meningitidy. Příznaky se mohou objevit během několika hodin po podání dávky a obecně vymizí po přerušení léčby metronidazolem.
Výskyt abnormálních neurologických známek a příznaků vyžaduje rychlé vyhodnocení poměru přínos/riziko pokračování léčby (viz NEŽÁDOUCÍ REAKCE ).
OPATŘENÍ
Všeobecné
Poškození jater
Pacienti s poruchou funkce jater metabolizují metronidazol pomalu, s výslednou akumulací metronidazolu v plazmě. U pacientů s těžkou poruchou funkce jater (Child-Pugh C) se doporučuje snížená dávka přípravku FLAGYL 400 mg. U pacientů s mírnou až středně těžkou poruchou funkce jater není nutná úprava dávkování, ale tyto pacienty je třeba sledovat kvůli nežádoucím účinkům souvisejícím s metronidazolem (viz KLINICKÁ FARMAKOLOGIE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Renální poškození
Pacienti s terminálním onemocněním ledvin mohou vylučovat metronidazol a metabolity pomalu močí, což vede k významné akumulaci metabolitů metronidazolu. Doporučuje se sledování nežádoucích účinků spojených s metronidazolem (viz KLINICKÁ FARMAKOLOGIE ).
Plísňové superinfekce
Známá nebo dříve nerozpoznaná kandidóza může během léčby přípravkem FLAGYL vykazovat výraznější příznaky a vyžaduje léčbu kandidacidním činidlem.
Použití u pacientů s krevní dyskrazií
Metronidazol je nitroimidazol a měl by být používán s opatrností u pacientů s prokázanou nebo anamnézou krevní dyskrazie. Během jeho podávání byla pozorována mírná leukopenie; v klinických studiích však nebyly pozorovány žádné perzistentní hematologické abnormality přisuzované metronidazolu. Před a po léčbě se doporučuje stanovit celkový a diferenciální počet leukocytů.
Bakterie a parazity odolné vůči lékům
Je nepravděpodobné, že by předepsání přípravku FLAGYL při absenci prokázané nebo silně suspektní bakteriální nebo parazitární infekce nebo profylaktické indikace přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií a parazitů rezistentních na léky.
Interakce drog/laboratorních testů
Metronidazol může interferovat s určitými typy stanovení chemických hodnot séra, jako je aspartátaminotransferáza (AST, SGOT), alaninaminotransferáza (ALT, SGPT), laktátdehydrogenáza (LDH), triglyceridy a glukózahexokináza. Lze pozorovat nulové hodnoty. Všechny testy, ve kterých byla hlášena interference, zahrnují enzymatické spojení testu s oxidačně-redukcí nikotinamidadenindinukleotidu (NAD+ NADH). Interference je způsobena podobností vrcholů absorbance NADH (340 nm) a metronidazolu (322 nm) při pH 7.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nádory postihující játra, plíce, prsní žlázy a lymfatické tkáně byly detekovány v několika studiích metronidazolu u potkanů a myší, ale ne u křečků.
Plicní nádory byly pozorovány ve všech šesti hlášených studiích u myší, včetně jedné studie, ve které byla zvířatům podávána dávka v přerušovaném režimu (pouze během každého čtvrtého týdne). U samců myší léčených dávkou přibližně 1500 mg/m² (podobně jako maximální doporučená denní dávka na základě srovnání plochy povrchu těla) došlo ke zvýšení zhoubných nádorů jater. Maligní lymfomy a plicní novotvary byly také zvýšeny s celoživotním podáváním léku myším. Nádory mléčné žlázy a jater byly zvýšeny u samic potkanů, kterým byl perorálně podáván metronidazol ve srovnání se souběžnými kontrolami. Byly provedeny dvě celoživotní studie tumorigenicity u křečků, které byly hlášeny jako negativní.
Metronidazol prokázal mutagenní aktivitu v in vitro testovacích systémech včetně Amesova testu. Studie na savcích in vivo neprokázaly potenciál pro genetické poškození.
Metronidazol nevyvolal žádné nežádoucí účinky na fertilitu nebo funkci varlat u samců potkanů v dávkách až 400 mg/kg/den (podobné maximální doporučené klinické dávce na základě srovnání plochy povrchu těla) po dobu 28 dnů. Avšak krysy léčené stejnou dávkou po dobu 6 týdnů nebo déle byly neplodné a vykazovaly závažnou degeneraci semenotvorného epitelu ve varlatech a rovněž výrazné snížení počtu spermatid ve varlatech a počtu spermií nadvarlat. U většiny potkanů byla plodnost obnovena po osmitýdenním období zotavení bez léků.
Těhotenství
Teratogenní účinky
Neexistují žádné adekvátní a dobře kontrolované studie přípravku FLAGYL u těhotných žen. Jsou publikovány údaje z případových kontrolních studií, kohortových studií a 2 metaanalýz, které zahrnují více než 5000 těhotných žen, které užívaly metronidazol během těhotenství. Mnoho studií zahrnovalo expozice v prvním trimestru. Jedna studie ukázala zvýšené riziko rozštěpu rtu, s rozštěpem patra nebo bez něj, u kojenců vystavených metronidazolu in utero; tato zjištění se však nepotvrdila. Kromě toho více než deset randomizovaných placebem kontrolovaných klinických studií zahrnovalo více než 5 000 těhotných žen, aby zhodnotily použití antibiotické léčby (včetně metronidazolu) u bakteriální vaginózy na výskyt předčasného porodu. Většina studií neprokázala zvýšené riziko vrozených anomálií nebo jiných nežádoucích účinků na plod po expozici metronidazolu během těhotenství. Tři studie provedené za účelem posouzení rizika rakoviny u kojenců po expozici metronidazolu během těhotenství neprokázaly zvýšené riziko; schopnost těchto studií detekovat takový signál však byla omezená.
Metronidazol prochází placentární bariérou a jeho účinky na organogenezi lidského plodu nejsou známy. Reprodukční studie byly provedeny na potkanech, králících a myších v dávkách podobných maximální doporučené dávce pro člověka na základě srovnání plochy povrchu těla. Nebylo prokázáno poškození plodu metronidazolem.
Kojící matky
Metronidazol je přítomen v lidském mléce v koncentracích podobných hladinám v séru matky a hladiny v séru kojenců mohou být blízké nebo srovnatelné s terapeutickými hladinami kojenců. Vzhledem k potenciálu tumorigenicity ukázanému u metronidazolu u myší a potkanů
studiích by mělo být učiněno rozhodnutí, zda přerušit kojení nebo přerušit podávání léku, s přihlédnutím k důležitosti léku pro matku. Alternativně se kojící matka může rozhodnout odsát a zlikvidovat mateřské mléko po dobu trvání léčby metronidazolem a 24 hodin po ukončení léčby a krmit své kojence skladovaným lidským mlékem nebo umělou výživou.
Geriatrické použití
starších geriatrických pacientů se doporučuje sledování nežádoucích účinků spojených s metronidazolem (viz KLINICKÁ FARMAKOLOGIE , OPATŘENÍ ). Snížená funkce jater u geriatrických pacientů může vést ke zvýšeným koncentracím metronidazolu, což může vyžadovat úpravu dávkování metronidazolu (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena, s výjimkou léčby amebiázy.
PŘEDÁVKOVAT
Jednorázové perorální dávky metronidazolu až do 15 g byly hlášeny při pokusech o sebevraždu a náhodném předávkování. Mezi hlášené příznaky patří nevolnost, zvracení a ataxie.
Perorální metronidazol byl studován jako radiační senzibilizátor při léčbě maligních nádorů. Neurotoxické účinky, včetně záchvatů a periferní neuropatie, byly hlášeny po 5 až 7 dnech podávání dávek 6 až 10,4 g každý druhý den.
Léčba Předávkování
Neexistuje žádné specifické antidotum pro předávkování metronidazolem; léčba pacienta by proto měla sestávat ze symptomatické a podpůrné terapie.
KONTRAINDIKACE
Přecitlivělost
Přípravek FLAGYL Tablets je kontraindikován u pacientů s předchozí anamnézou přecitlivělosti na metronidazol nebo jiné deriváty nitroimidazolu.
U pacientek s trichomoniázou je přípravek FLAGYL 200 mg tablety kontraindikován během prvního trimestru těhotenství (viz OPATŘENÍ ).
Psychotická reakce s disulfiramem
Užívání perorálního metronidazolu je spojeno s psychotickými reakcemi u alkoholických pacientů, kteří současně užívali disulfiram. Nepodávejte metronidazol pacientům, kteří užívali disulfiram během posledních dvou týdnů (viz OPATŘENÍ , DROGOVÉ INTERAKCE ).
Interakce s alkoholem
Užívání perorálního metronidazolu je spojeno s reakcí podobnou disulfiramu na alkohol, včetně břišních křečí, nevolnosti, zvracení, bolestí hlavy a zrudnutí. Během léčby metronidazolem a alespoň tři dny po ní přestaňte konzumovat alkohol nebo produkty obsahující propylenglykol (viz OPATŘENÍ , DROGOVÉ INTERAKCE ).
Cockayneův syndrom
FLAGYL 400 mg tablety je kontraindikován u pacientů s Cockayne syndromem. Po zahájení léčby metronidazolem u pacientů s Cockayne syndromem byla hlášena těžká ireverzibilní hepatotoxicita/akutní selhání jater s fatálními následky (viz NEŽÁDOUCÍ REAKCE ).
KLINICKÁ FARMAKOLOGIE
Vstřebávání
Dispozice metronidazolu v těle je podobná pro perorální i intravenózní lékové formy. Po perorálním podání se metronidazol dobře vstřebává, přičemž maximální plazmatické koncentrace se objevují mezi jednou a dvěma hodinami po podání.
Plazmatické koncentrace metronidazolu jsou úměrné podané dávce. Orální podání 250 mg, 500 mg nebo 2 000 mg vedlo k maximálním plazmatickým koncentracím 6 mcg/ml, 12 mcg/ml a 40 mcg/ml. Studie neodhalily žádné významné rozdíly v biologické dostupnosti mezi muži a ženami; avšak kvůli rozdílům v hmotnosti jsou výsledné plazmatické hladiny u mužů obecně nižší.
Rozdělení
Metronidazol je hlavní složkou vyskytující se v plazmě s menším množstvím metabolitů. Méně než 20 % cirkulujícího metronidazolu se váže na plazmatické proteiny. Metronidazol se objevuje v mozkomíšním moku, slinách a mateřském mléce v koncentracích podobných koncentracím v plazmě. Baktericidní koncentrace metronidazolu byly také zjištěny v hnisu z jaterních abscesů.
Metabolismus/vylučování
Hlavní cestou eliminace metronidazolu a jeho metabolitů je moč (60 % až 80 % dávky), přičemž fekální exkrece představuje 6 % až 15 % dávky. Metabolity, které se objevují v moči, jsou primárně důsledkem oxidace postranního řetězce [1-(6-hydroxyethyl)-2-hydroxymethyl-5-nitroimidazol a 2-methyl-5-nitroimidazol-1-yloctová kyselina] a glukuronidové konjugace s nezměněným metronidazolem asi 20 % z celkového počtu. Jak mateřská sloučenina, tak hydroxylový metabolit mají in vitro antimikrobiální aktivitu.
Renální clearance metronidazolu je přibližně 10 ml/min/1,73 m². Průměrný poločas eliminace metronidazolu u zdravých jedinců je osm hodin.
Renální poškození
Snížená funkce ledvin nemění farmakokinetiku jednorázové dávky metronidazolu.
Jedinci s terminálním onemocněním ledvin (ESRD; CLCR= 8,1±9,1 ml/min) a kteří dostali jednorázovou intravenózní infuzi metronidazolu 500 mg neměli žádnou významnou změnu ve farmakokinetice metronidazolu, ale měli 2krát vyšší Cmax hydroxymetronidazolu a 5 -krát vyšší Cmax metronidazolacetátu ve srovnání se zdravými jedinci s normální funkcí ledvin (CLCR= 126±16 ml/min). Vzhledem k potenciální akumulaci metabolitů metronidazolu u pacientů s ESRD se proto doporučuje sledování nežádoucích účinků spojených s metronidazolem (viz OPATŘENÍ ).
Vliv dialýzy
Po jednorázové intravenózní infuzi nebo perorální dávce metronidazolu 500 mg byla clearance metronidazolu zkoumána u jedinců s ESRD podstupujících hemodialýzu nebo kontinuální ambulantní peritoneální dialýzu (CAPD). Hemodialýza trvající 4 až 8 hodin odstranila 40 % až 65 % podané dávky metronidazolu v závislosti na typu použité membrány dialyzátoru a délce trvání dialýzy. Pokud nelze podání metronidazolu oddělit od dialýzy, je třeba zvážit doplnění dávky metronidazolu po hemodialýze (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Peritoneální dialýza trvající 7,5 hodiny odstranila přibližně 10 % podané dávky metronidazolu. U pacientů s ESRD podstupujících CAPD není nutná žádná úprava dávky metronidazolu.
Poškození jater
Po jednorázové intravenózní infuzi 500 mg metronidazolu byla průměrná AUC24 metronidazolu vyšší o 114 % u pacientů s těžkou (Child-Pugh C) poruchou funkce jater a o 54 % a 53 % u pacientů s mírnou (Child-Pugh A) a středně těžké (Child-Pugh B) poškození jater, v tomto pořadí, ve srovnání se zdravými kontrolními subjekty. U těchto pacientů s poruchou funkce jater nedošlo k žádným významným změnám v AUC24 hydroxyl-metronidazolu. U pacientů s těžkou (Child-Pugh C) poruchou jater se doporučuje snížení dávky metronidazolu o 50 % (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). U pacientů s mírnou až středně těžkou poruchou funkce jater není nutná žádná úprava dávkování. Pacienti s mírnou až středně těžkou poruchou funkce jater by měli být sledováni kvůli nežádoucím účinkům souvisejícím s metronidazolem (viz OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Geriatričtí pacienti
Po jednorázové 500 mg perorální nebo IV dávce metronidazolu měli jedinci starší 70 let bez zjevné renální nebo jaterní dysfunkce o 40 % až 80 % vyšší průměrnou AUC hydroxymetronidazolu (aktivního metabolitu), bez zjevného zvýšení průměrné AUC metronidazolu (mateřská sloučenina) ve srovnání s mladými zdravými kontrolami OPATŘENÍ ).
Pediatričtí pacienti
V jedné studii se zdálo, že novorozenci vykazovali sníženou schopnost eliminovat metronidazol. Eliminační poločas, měřený během prvních 3 dnů života, byl nepřímo úměrný gestačnímu věku. U kojenců, jejichž gestační věk byl mezi 28. a 40. týdnem, se odpovídající eliminační poločasy pohybovaly od 109 do 22,5 hodin.
Mikrobiologie
Mechanismus působení
Metronidazol, nitroimidazol, má antibakteriální účinky v anaerobním prostředí proti většině obligátních anaerobů. Jakmile metronidazol vstoupí do organismu pasivní difúzí a aktivuje se v cytoplazmě citlivých anaerobních bakterií, dojde k jeho redukci; tento proces zahrnuje intracelulární proteiny transportující elektrony, jako je ferredoxin, přenos elektronu na nitroskupinu metronidazolu a tvorbu volného nitroso radikálu s krátkou životností. Kvůli této změně molekuly metronidazolu se vytváří a udržuje koncentrační gradient, který podporuje intracelulární transport léčiva. Redukovaná forma metronidazolu a volných radikálů může interagovat s DNA, což vede k inhibici syntézy DNA a degradaci DNA vedoucí ke smrti bakterií. Přesný mechanismus účinku metronidazolu není jasný.
Odpor
Existuje potenciál pro rozvoj rezistence vůči metronidazolu.
Rezistence může být způsobena více mechanismy, které zahrnují sníženou absorpci léčiva, změněnou účinnost redukce, nadměrnou expresi efluxních pump, inaktivaci léčiva a/nebo zvýšenou opravu poškození DNA.
Metronidazol nevykazuje žádnou klinicky významnou aktivitu proti fakultativním anaerobům nebo obligátním aerobům.
Antimikrobiální aktivita
Bylo prokázáno, že metronidazol je účinný proti většině izolátů následujících bakterií in vitro i při klinických infekcích, jak je popsáno v části INDIKACE A POUŽITÍ.
Gram-pozitivní anaeroby
Clostridium druh Eubacterium druh Peptococcus druh Peptostreptococcus species
Gram-negativní Aaeroby
Skupina Bacteroides fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B.vulgatus) Druh Fusobacterium
Protozoální parazité
Entamoeba histolytica Trichomonas vaginalis
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám:
Metronidazol vykazuje in vitro minimální inhibiční koncentrace (MIC) 8 mcg/ml nebo méně proti většině (≥ 90 %) izolátů následujících bakterií; bezpečnost a účinnost metronidazolu při léčbě klinických infekcí způsobených těmito bakteriemi však nebyla stanovena v adekvátních a dobře kontrolovaných klinických studiích.
Gram-negativní anaeroby
Skupina Bacteroides fragilis (B. caccae, B. uniformis) Druh Prevotella (P. bivia, P. buccae, P. disiens)
Testování citlivosti
Konkrétní informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: https://www.fda.gov/STIC.
INFORMACE PRO PACIENTA
Interakce s alkoholem
Během užívání přípravku FLAGYL 400 mg a alespoň tři dny poté přestaňte konzumovat alkoholické nápoje nebo produkty obsahující propylenglykol, protože se mohou objevit křeče v břiše, nevolnost, zvracení, bolesti hlavy a návaly horka (viz KONTRAINDIKACE a OPATŘENÍ , DROGOVÉ INTERAKCE ).
Léčba bakteriálních a parazitárních infekcí
Pacienti by měli být poučeni, že FLAGYL 400 mg by měl být používán pouze k léčbě bakteriálních a parazitárních infekcí. FLAGYL 400 mg neléčí virové infekce (např. běžné nachlazení). Když je FLAGYL předepsán k léčbě bakteriální infekce, pacienti by měli být informováni, že ačkoli je běžné, že se na začátku léčby cítí lépe, lék by měl být užíván přesně podle pokynů. Vynechání dávek nebo nedokončení celého léčebného cyklu může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem FLAGYL 400 mg.
