Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Cipro 750 mg a jak se používá?
Cipro 500 mg je lék na předpis používaný k léčbě příznaků bakteriálních infekcí. Cipro lze užívat samostatně nebo s jinými léky.
Cipro patří do třídy léků nazývaných fluorochinolony.
Není známo, zda je Cipro 750 mg bezpečný a účinný u dětí mladších 1 roku.
Jaké jsou možné vedlejší účinky přípravku Cipro?
Cipro může způsobit závažné nežádoucí účinky včetně:
- nízká hladina cukru v krvi,
- bolest hlavy,
- hlad,
- pocení,
- podrážděnost,
- závrať,
- nevolnost,
- rychlý srdeční tep,
- pocit úzkosti nebo rozechvění,
- necitlivost rukou, paží, nohou nebo chodidel,
- slabost,
- brnění nebo pálivá bolest,
- nervozita,
- zmatek,
- míchání,
- paranoia,
- halucinace,
- problémy s pamětí,
- potíže se soustředěním,
- myšlenky na sebevraždu,
- náhlá bolest,
- otok,
- modřiny,
- něha,
- ztuhlost,
- pohybové problémy,
- cvaknutí nebo prasknutí v jakémkoli spoji,
- silná nebo trvalá bolest na hrudi, žaludku nebo zádech,
- průjem, který je vodnatý nebo krvavý,
- chvění v tvé hrudi,
- dušnost,
- točení hlavy,
- vyrážka,
- dýchací problémy,
- malé nebo žádné močení,
- zežloutnutí kůže nebo očí,
- těžká bolest hlavy,
- zvoní ti v uších,
- problémy se zrakem a
- bolest za očima
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Cipro 1000 mg patří:
- nevolnost,
- zvracení,
- průjem,
- bolest břicha,
- vaginální svědění nebo výtok,
- bolest hlavy a
- abnormální jaterní testy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Cipro. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
ZÁVAŽNÉ NEŽÁDOUCÍ ÚČINKY VČETNĚ TENDINITIDY, RUPCE ŠLACH, PERIFERNÍ NEUROPATIE, ÚČINKY NA CENTRÁLNÍ NERVOVÝ SYSTÉM A EXACERBACE MYASTHENIA GRAVIS
- Fluorochinolony, včetně Cipro 250 mg, byly spojeny s invalidizujícími a potenciálně ireverzibilními závažnými nežádoucími reakcemi, které se vyskytly společně (viz UPOZORNĚNÍ A OPATŘENÍ ), včetně:
- Tendinitida a ruptura šlachy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ)
- Periferní neuropatie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
- Účinky na centrální nervový systém (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ)
Okamžitě přerušte podávání přípravku Cipro 750 mg a vyvarujte se užívání fluorochinolonů, včetně přípravku Cipro, u pacientů, u kterých se vyskytne některý z těchto závažných nežádoucích účinků (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Fluorochinolony, včetně přípravku Cipro 750 mg, mohou u pacientů s myasthenia gravis zhoršit svalovou slabost. Vyhněte se přípravku Cipro u pacientů se známou anamnézou myasthenia gravis. [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
- Vzhledem k tomu, že fluorochinolony, včetně CIPRO 500 mg, byly spojeny se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A OPATŘENÍ), vyhraďte CIPRO pro použití u pacientů, kteří nemají žádné alternativní možnosti léčby nekomplikovaných infekcí močových cest (viz INDIKACE)
POPIS
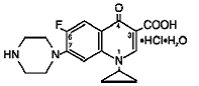
Cipro (cipro 750mgfloxacin*) tablety s prodlouženým uvolňováním obsahují cipro 500mgfloxacin, syntetické antimikrobiální činidlo pro perorální podání. Cipro 1000 mg tablety jsou potahované dvouvrstvé tablety skládající se z vrstvy s okamžitým uvolňováním a vrstvy s řízeným uvolňováním typu erozní matrice. Tablety obsahují kombinaci dvou typů léčivé látky ciprofloxacin, ciprofloxacin hydrochlorid a ciprofloxacin betain (báze). Cipro 750mgfloxacin hydrochlorid je hydrochlorid 1-cyklopropyl-6-fluor-1,4dihydro-4-oxo-7-(1-piperazinyl)-3-chinolinkarboxylové kyseliny. Poskytuje se jako směs monohydrátu a seskvihydrátu. Empirický vzorec monohydrátu je C17H18FN3O3. HCl. H2O a její molekulová hmotnost je 385,8. Empirický vzorec seskvihydrátu je C17H18FN3O3. HCl. 1,5 H2O a jeho molekulová hmotnost je 394,8. Léčivá látka je slabě nažloutlá až světle žlutá krystalická látka. Chemická struktura monohydrátu je následující:
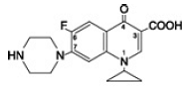
Cipro 1000 mgfloxacinbetain je 1-cyklopropyl-6-fluor-1,4-dihydro-4-oxo-7-(1-piperazinyl)-3-chinolinkarboxylová kyselina. Jako hydrát má empirický vzorec C17H18FN3O3. 3,5 H2O a jeho molekulová hmotnost je 394,3. Je to světle nažloutlá až světle žlutá krystalická látka a její chemická struktura je následující:
Cipro je dostupný v tabletách o síle 500 mg a 1000 mg (ekvivalent cipro 500 mgfloxacinu). Tablety Cipro jsou téměř bílé až slabě nažloutlé potahované tablety podlouhlého tvaru. Každá tableta Cipro 500 mg obsahuje 500 mg ciprofloxacinu ve formě ciprofloxacinu HCl (287,5 mg, vypočteno jako ciprofloxacin na sušinu) a cipro 1000 mgfloxacinu† (212,6 mg, vypočteno na sušinu). Každá tableta Cipro 1000 mg obsahuje 1000 mg ciprofloxacinu ve formě ciprofloxacinu HCl (574,9 mg, vypočteno jako ciprofloxacin na sušinu) a cipro 750 mgfloxacinu† (425,2 mg, vypočteno na sušinu). Neaktivními složkami jsou krospovidon, hypromelóza, magnesium-stearát, polyethylenglykol, koloidní bezvodý oxid křemičitý, kyselina jantarová a oxid titaničitý.
* protože cipro 500 mgfloxacin† a cipro 250 mgfloxacin hydrochlorid † nevyhovuje testu ztráty sušením a zbytku při žíhání podle monografie USP.
INDIKACE
Infekce kůže a kožní struktury
CIPRO 1000 mg je indikován u dospělých pacientů k léčbě infekcí kůže a kožních struktur způsobených Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundii, Pseudomginosa-methocilusceptibleus, Pseudomginosa, methioccus Staphylococcus epidermidis citlivý na meticilin nebo Streptococcus pyogenes.
Kostní a kloubní infekce
CIPRO 750 mg je indikován u dospělých pacientů k léčbě infekcí kostí a kloubů způsobených Enterobacter cloacae, Serratia marcescens nebo Pseudomonas aeruginosa.
Komplikované intraabdominální infekce
CIPRO 250 mg je indikován u dospělých pacientů k léčbě komplikovaných nitrobřišních infekcí (používaných v kombinaci s metronidazolem) způsobených Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae nebo Bacteroides fragilis.
Infekční průjem
CIPRO 500 mg je indikován u dospělých pacientů k léčbě infekčního průjmu způsobeného Escherichia coli (enterotoxigenní izoláty), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri nebo Shigella sonnei†, pokud je indikována antibakteriální léčba.
†Přestože léčba infekcí způsobených tímto organismem v tomto orgánovém systému prokázala klinicky významný výsledek, účinnost byla studována u méně než 10 pacientů.
Břišní tyfus (enterická horečka)
CIPRO 1000 mg je indikován u dospělých pacientů k léčbě břišního tyfu (enterické horečky) způsobené Salmonella typhi. Účinnost ciprofloxacinu při eradikaci chronického břišního tyfu nebyla prokázána.
Nekomplikovaná cervikální a uretrální kapavka
CIPRO je indikován u dospělých pacientů k léčbě nekomplikované cervikální a uretrální kapavky způsobené Neisseria gonorrhoeae (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Inhalační antrax (po expozici)
CIPRO 250 mg je indikován u dospělých a dětských pacientů od narození do 17 let pro inhalační antrax (po expozici) ke snížení výskytu nebo progrese onemocnění po expozici aerosolizovanému Bacillus anthracis.
Sérové koncentrace Cipro 500 mgfloxacinu dosažené u lidí sloužily jako náhradní koncový bod s rozumnou pravděpodobností předpovídající klinický přínos a poskytly počáteční základ pro schválení této indikace.1 Podpůrné klinické informace o ciprofloxacinu pro postexpoziční profylaxi antraxu byly získány během bioteroristických útoků antraxu v říjnu 2001 [viz Klinické studie ].
Mor
CIPRO 1000 mg je indikován k léčbě moru, včetně plicního a septikemického moru, způsobeného Yersinia pestis (Y. pestis) ak profylaxi moru u dospělých a dětských pacientů od narození do 17 let věku. Studie účinnosti cipro 250 mgfloxacinu nemohly být provedeny u lidí s morem z důvodů proveditelnosti. Proto je tato indikace založena na studii účinnosti provedené pouze na zvířatech [viz Klinické studie ].
Chronická bakteriální prostatitida
CIPRO je indikován u dospělých pacientů k léčbě chronické bakteriální prostatitidy způsobené Escherichia coli nebo Proteus mirabilis.
Infekce dolních cest dýchacích
CIPRO 750 mg je indikován u dospělých pacientů k léčbě infekcí dolních cest dýchacích způsobených Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus parainfluenzae pneumoniae nebo Streptococcus pneumoniae.
CIPRO není lékem první volby v léčbě předpokládané nebo potvrzené pneumonie sekundární k Streptococcus pneumoniae.
CIPRO je indikován k léčbě akutních exacerbací chronické bronchitidy (AECB) způsobené Moraxella catarrhalis.
Protože fluorochinolony, včetně CIPRO, byly spojeny se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] a pro některé pacienty je AECB samoomezující, rezervujte CIPRO 750 mg pro léčbu AECB u pacientů, kteří nemají žádné alternativní možnosti léčby.
Infekce močového ústrojí
Infekce močových cest u dospělých
CIPRO 500mg je indikován u dospělých pacientů k léčbě infekcí močových cest způsobených Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter koseri, Citrobacter freshidomocunsocosa,ceptrecepter freucillincus a. , Staphylococcus saprophyticus nebo Enterococcus faecalis.
Akutní nekomplikovaná cystitida
CIPRO 750 mg je indikován u dospělých pacientek k léčbě akutní nekomplikované cystitidy způsobené Escherichia coli nebo Staphylococcus saprophyticus.
Protože fluorochinolony, včetně CIPRO, byly spojeny se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] a pro některé pacienty akutní nekomplikovaná cystitida sama odezní, rezervujte CIPRO pro léčbu akutní nekomplikované cystitidy u pacientů, kteří nemají žádné alternativní možnosti léčby.
Komplikovaná infekce močových cest a pyelonefritida u dětských pacientů
CIPRO je indikován u pediatrických pacientů ve věku od 1 do 17 let k léčbě komplikovaných infekcí močových cest (cUTI) a pyelonefritidy způsobené Escherichia coli [viz Použití u konkrétních populací ].
Přestože je CIPRO účinný v klinických studiích, není lékem první volby u pediatrické populace kvůli zvýšenému výskytu nežádoucích účinků ve srovnání s kontrolami, včetně reakcí souvisejících s klouby a/nebo okolními tkáněmi. CIPRO 250 mg, stejně jako ostatní fluorochinolony, je spojován s artropatií a histopatologickými změnami v nosných kloubech juvenilních zvířat [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE , Použití u konkrétních populací a Neklinická toxikologie ].
Akutní sinusitida
CIPRO je indikován u dospělých pacientů k léčbě akutní sinusitidy způsobené Haemophilus influenzae, Streptococcus pneumoniae nebo Moraxella catarrhalis.
Protože fluorochinolony, včetně CIPRO, byly spojeny se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] a pro některé pacienty akutní sinusitida sama odezní, rezervujte CIPRO pro léčbu akutní sinusitidy u pacientů, kteří nemají žádné alternativní možnosti léčby.
Používání
Aby se snížil vývoj bakterií rezistentních vůči lékům a zachovala se účinnost přípravku CIPRO 1000 mg a dalších antibakteriálních léků, měl by být přípravek CIPRO 500 mg používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
Pokud existuje podezření, že k infekci přispívají anaerobní organismy, je třeba zahájit vhodnou léčbu. Před léčbou by měly být provedeny příslušné kultivační testy a testy citlivosti, aby se izolovaly a identifikovaly organismy způsobující infekci a aby se určila jejich citlivost na ciprofloxacin. Léčba přípravkem CIPRO může být zahájena dříve, než budou známy výsledky těchto testů; jakmile budou k dispozici výsledky, měla by vhodná léčba pokračovat.
Stejně jako u jiných léků se u některých izolátů Pseudomonas aeruginosa může během léčby cipro 1000 mgfloxacinem poměrně rychle vyvinout rezistence. Testování kultivace a citlivosti prováděné periodicky během terapie poskytne informace nejen o terapeutickém účinku antimikrobiální látky, ale také o možném vzniku bakteriální rezistence.
DÁVKOVÁNÍ A PODÁVÁNÍ
CIPRO 1000 mg tablety a perorální suspenze by měly být podávány perorálně, jak je popsáno v příslušných tabulkách s pokyny pro dávkování.
Dávkování u dospělých
Určení dávkování a trvání pro každého konkrétního pacienta musí vzít v úvahu závažnost a povahu infekce, vnímavost původce mikroorganismu, integritu obranných mechanismů hostitele a pacienta a stav funkce ledvin a jater. . Tablety CIPRO nebo CIPRO pro perorální suspenzi mohou být podávány dospělým pacientům, pokud je to klinicky indikováno podle uvážení lékaře. Podávejte CIPRO pro perorální suspenzi pomocí společně přibalené odměrné lžičky [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Přeměna IV na perorální dávkování u dospělých
Pacienti, jejichž léčba je zahájena přípravkem CIPRO IV, mohou být převedeni na CIPRO 750 mg tablety nebo perorální suspenzi, pokud je to klinicky indikováno podle uvážení lékaře (tabulka 2) [viz KLINICKÁ FARMAKOLOGIE ].
Dávkování u pediatrických pacientů
Dávkování a počáteční způsob léčby (tj. IV nebo perorální) u cUTI nebo pyelonefritidy by měly být určeny podle závažnosti infekce. CIPRO by měl být podáván tak, jak je popsáno v tabulce 3. Podávejte CIPRO pro perorální suspenzi pomocí společně přibalené odměrné lžičky [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Úprava dávkování u pacientů s poruchou funkce ledvin
Cipro 250 mgfloxacin je eliminován primárně renální exkrecí; léčivo je však také metabolizováno a částečně vylučováno žlučovým systémem jater a střevem. Zdá se, že tyto alternativní cesty eliminace léčiva kompenzují sníženou renální exkreci u pacientů s poruchou funkce ledvin. Přesto se doporučuje určitá úprava dávkování, zejména u pacientů s těžkou renální dysfunkcí. Pokyny pro dávkování pro použití u pacientů s poruchou funkce ledvin jsou uvedeny v tabulce 4.
Pokud je známa pouze koncentrace kreatininu v séru, lze pro odhad clearance kreatininu použít následující vzorce:
Sérový kreatinin by měl představovat ustálený stav funkce ledvin.
U pacientů se závažnými infekcemi a závažným poškozením ledvin může být ve výše uvedených intervalech podána jednotková dávka 750 mg. Pacienti by měli být pečlivě sledováni.
Pediatričtí pacienti se středně těžkou až těžkou renální insuficiencí byli vyloučeni z klinické studie cUTI a pyelonefritidy. Nejsou dostupné žádné informace o úpravách dávkování nezbytných u pediatrických pacientů se středně těžkou až těžkou renální insuficiencí (tj. clearance kreatininu
Důležité pokyny pro administraci
S multivalentními kationty
Podávejte CIPRO alespoň 2 hodiny před nebo 6 hodin po antacidách obsahujících hořčík/hliník; polymerní fosfátová pojiva (například sevelamer, uhličitan lanthanitý) nebo sukralfát; Videx® (didanosin) žvýkací/pufrované tablety nebo pediatrický prášek pro perorální roztok; další vysoce pufrovaná léčiva; nebo jiné produkty obsahující vápník, železo nebo zinek.
S mléčnými výrobky
Je třeba se vyhnout současnému podávání přípravku CIPRO 500 mg s mléčnými výrobky (jako je mléko nebo jogurt) nebo samotnými šťávami obohacenými vápníkem, protože je možné snížené vstřebávání; CIPRO však lze užívat s jídlem, které tyto produkty obsahuje.
Hydratace pacientů, kteří dostávají CIPRO
Zajistěte dostatečnou hydrataci pacientů užívajících CIPRO 1000 mg, aby se zabránilo tvorbě vysoce koncentrované moči. U chinolonů byla hlášena krystalurie.
Poučte pacienta o vhodném podávání CIPRO 1000 mg [viz Informace pro pacienty ].
Vynechané dávky
Pokud dojde k vynechání dávky, měla by se užít kdykoli, ale ne později než 6 hodin před další plánovanou dávkou. Pokud do další dávky zbývá méně než 6 hodin, vynechaná dávka by se neměla užít a léčba by měla pokračovat podle předpisu další plánovanou dávkou. Dvojité dávky by se neměly užívat jako kompenzace vynechané dávky.
Dělení CIPRO 1000 mg tablety
CIPRO 750 mg tablety, 250 mg a 500 mg jsou funkčně rýhované tablety, které lze rozdělit na polovinu v rýhované rýze a získat tak sílu 125 mg a 250 mg.
Pokyny pro rekonstituci mikrokapslí CIPRO 500 mg pro perorální suspenzi
CIPRO 750 mg perorální suspenze se dodává v 5% (5 g ciprofloxacinu ve 100 ml) a 10% (10 g cipro 750 mgfloxacinu ve 100 ml) síle. CIPRO 250 mg perorální suspenze se skládá ze dvou složek (mikrokapslí a ředidla), které je nutné před výdejem spojit.
Příprava Suspenze
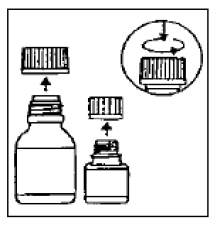
Krok 1
Malá lahvička obsahuje mikrokapsle, velká lahvička obsahuje ředidlo.

Krok 2
Otevřete obě lahve. Dětská pojistka: Zatlačte dolů podle pokynů na uzávěru a otočte doleva.

Krok 3
Nalijte mikrokapsle úplně do větší lahvičky s ředidlem. Do suspenze nepřidávejte vodu .
Krok 4
Odstraňte vrchní vrstvu štítku lahvičky s rozpouštědlem (a odhalte štítek CIPRO 1000 mg perorální suspenze). Velkou lahvičku zcela uzavřete podle pokynů na víčku a intenzivně protřepávejte asi 15 sekund. Suspenze je připravena k použití.
Krok 5
Napište datum exspirace rekonstituované perorální suspenze na štítek lahvičky.
Rekonstituovaný přípravek může být uchováván při teplotě do 30°C (86°F) po dobu 14 dnů. Chraňte před mrazem.
Do namíchané konečné suspenze ciprofloxacinu by se neměly přidávat žádné přísady. CIPRO 1000 mg perorální suspenze by neměla být podávána prostřednictvím krmení nebo NG (nazogastrické) sondy kvůli svým fyzikálním vlastnostem.
Pokyny pro podávání přípravku CIPRO pro perorální suspenzi po rekonstituci
- Před každým použitím CIPRO 750 mg perorální suspenzi silně protřepejte po dobu přibližně 15 sekund.
- Podávejte CIPRO perorální suspenzi pomocí společně přibalené odměrné čajové lžičky dodané pro pacienta (viz obrázek 1)
Obrázek 1: Společně zabalené 5 ml odměrné lžičky
Dodává se společně balená odměrná lžička (5 ml) s označením ½ (2,5 ml) a 1/1 (5 ml)
- Po použití očistěte odměrnou lžičku pod tekoucí vodou s mycím prostředkem na nádobí a důkladně osušte.
- Mikrokapsle v perorální suspenzi CIPRO 250 mg nežvýkejte, ale polykejte je celé.
- Voda může být odebrána poté.
- Po každém použití lahvičku řádně uzavřete podle pokynů na víčku.
- Po ukončení léčby se CIPRO 1000 mg perorální suspenze nesmí znovu použít.
Dávkování přípravku CIPRO pro perorální suspenzi pomocí společně balené lžičky u dospělých a dětských pacientů
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety
- 250 mg, slabě nažloutlé, potažené, kulaté, funkčně rýhované, s potiskem „BAYER“ na jedné straně a „CIP 250“ na druhé straně.
- 500 mg, slabě nažloutlá, potahovaná, ve tvaru tobolky, funkčně dělená, s potiskem „BAYER“ na jedné straně a „CIP 500“ na druhé straně.
Orální suspenze
- 5% perorální suspenze: 250 mg cipro 750 mgfloxacinu na 5 ml po rekonstituci
- 10% perorální suspenze: 500 mg cipro 250 mgfloxacinu na 5 ml po rekonstituci
Skladování A Manipulace
CIPRO (cipro 750 mgfloxacin hydrochlorid) Tablety jsou dostupné jako kulaté, mírně nažloutlé potahované tablety obsahující 250 mg cipro 500 mgfloxacinu. 250mg tableta je na jedné straně kódována slovem „BAYER“ a na druhé straně je funkčně rýha a vyryto „CIP 250“. CIPRO je k dispozici také jako mírně nažloutlé potahované tablety ve tvaru tobolky obsahující 500 mg ciprofloxacinu. 500mg tableta je na jedné straně kódována slovem „BAYER“ a na druhé straně je funkčně rýha a vyryto „CIP 500“. CIPRO 250 mg a 500 mg jsou dostupné v lahvičkách po 100.
Skladujte při teplotě 20° až 25°C (68° až 77°F); povoleny výchylky do 15° až 30°C (59° až 86°F) [viz USP řízená pokojová teplota ].
CIPRO perorální suspenze se dodává v 5% a 10% síle. Léčivý přípravek se skládá ze dvou složek (mikrokapsle obsahující účinnou látku a ředidlo), které musí smíchat lékárník [viz. DÁVKOVÁNÍ A PODÁVÁNÍ ].
Mikrokapsle a ředidlo skladujte při teplotě do 25 °C (77 °F); výlety jsou povoleny od 15 °C do 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ]. Chraňte před mrazem.
Rekonstituovaný přípravek může být uchováván při 25°C (77°F) po dobu 14 dnů; výlety jsou povoleny od 15 °C do 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ]. Chraňte před mrazem.
Pro pacienta je poskytnuta odměrná čajová lžička (5 ml) s označením ½ (2,5 ml) a 1/1 (5 ml).
REFERENCE
1. 21 CFR 314.510 (Podčást H – Zrychlené schvalování nových léků pro život ohrožující nemoci).
2. Friedman J, Polifka J. Teratogenní účinky léků: zdroj pro klinické lékaře (TERIS). Baltimore, Maryland: Johns Hopkins University Press, 2000:149-195.
3. Loebstein R, Addis A, Ho E, a kol. Výsledek těhotenství po gestační expozici fluorochinolonům: multicentrická prospektivní kontrolovaná studie. Antimikrobiální látky Chemother. 1998;42(6):1336-1339.
Vyrobeno pro: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Revize: listopad 2021
VEDLEJŠÍ EFEKTY
Následující závažné a jinak důležité nežádoucí účinky léku jsou podrobněji popsány v jiných částech označení:
- Deaktivace a potenciálně nevratné závažné nežádoucí reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Tendinitida a ruptura šlach [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Periferní neuropatie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Účinky na centrální nervový systém [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] Exacerbace Myasthenia Gravis [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Jiné závažné a někdy fatální nežádoucí reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Riziko aneuryzmatu a disekce aorty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné nežádoucí účinky při současném podávání teofylinu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridioides difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT intervalu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Muskuloskeletální poruchy u dětských pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Fotosenzitivita/fototoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vývoj bakterií rezistentních vůči léčivům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Dospělí pacienti
Během klinických studií s perorálním a parenterálním CIPRO 750 mg dostalo 49 038 pacientů cykly tohoto léku.
Nejčastěji hlášenými nežádoucími účinky z klinických studií všech přípravků, všech dávek, všech trvání lékové terapie a všech indikací léčby ciprofloxacinem byly nauzea (2,5 %), průjem (1,6 %), abnormální jaterní testy (1,3 % ), zvracení (1 %) a vyrážka (1 %).
V randomizovaných, dvojitě zaslepených kontrolovaných klinických studiích porovnávajících tablety CIPRO [500 mg dvakrát denně (BID)] s cefuroxim axetilem (250 mg–500 mg BID) a klarithromycinem (500 mg BID) u pacientů s infekcemi dýchacích cest prokázal CIPRO profil nežádoucích reakcí CNS srovnatelný s kontrolními léky.
Pediatričtí pacienti
Krátkodobá (6 týdnů) a dlouhodobá (1 rok) muskuloskeletální a neurologická bezpečnost perorálního/intravenózního ciprofloxacinu byla srovnávána s cefalosporinem pro léčbu cUTI nebo pyelonefritidy u pediatrických pacientů ve věku 1 až 17 let (průměrný věk 6 ± 4 roky ) v mezinárodním multicentrickém procesu. Délka léčby byla 10 až 21 dnů (průměrná délka léčby byla 11 dnů s rozmezím 1 až 88 dnů). Celkem bylo zařazeno 335 pacientů léčených přípravkem cipro 250 mgfloxacinu a 349 pacientů léčených komparátorem.
Nezávislá pediatrická bezpečnostní komise (IPSC) přezkoumala všechny případy muskuloskeletálních nežádoucích reakcí včetně abnormální chůze nebo abnormálního vyšetření kloubů (základní stav nebo léčba související). Během 6 týdnů od zahájení léčby byl výskyt muskuloskeletálních nežádoucích účinků 9,3 % (31/335) ve skupině léčené cipro 750 mgfloxacinem oproti 6 % (21/349) u pacientů léčených komparátorem. Všechny muskuloskeletální nežádoucí účinky, které se objevily do 6 týdnů, odezněly (klinické vymizení známek a symptomů), obvykle do 30 dnů po ukončení léčby. Radiologická vyšetření nebyla běžně používána k potvrzení vymizení nežádoucích účinků. U pacientů léčených přípravkem Cipro 500 mgfloxacinem byla ve srovnání s kontrolními pacienty pravděpodobnější, že hlásili více než jednu nežádoucí reakci a více než jednu příležitost. Četnost muskuloskeletálních nežádoucích účinků byla konzistentně vyšší ve skupině s ciprofloxacinem ve srovnání s kontrolní skupinou ve všech věkových podskupinách. Na konci 1 roku byl výskyt těchto nežádoucích účinků hlášených kdykoli během tohoto období 13,7 % (46/335) ve skupině léčené cipro 250 mgfloxacinem oproti 9,5 % (33/349) u pacientů léčených komparátorem ( Tabulka 9).
Incidence neurologických nežádoucích účinků během 6 týdnů od zahájení léčby byla 3 % (9/335) ve skupině CIPRO oproti 2 % (7/349) ve srovnávací skupině a zahrnovala závratě, nervozitu, nespavost a somnolenci.
této studii byla celková incidence nežádoucích účinků během 6 týdnů od zahájení léčby 41 % (138/335) ve skupině cipro 250 mgfloxacinu oproti 31 % (109/349) ve srovnávací skupině. Nejčastějšími nežádoucími účinky byly gastrointestinální: 15 % (50/335) pacientů s ciprofloxacinem ve srovnání s 9 % (31/349) pacientů s komparátorem. Závažné nežádoucí účinky byly pozorovány u 7,5 % (25/335) pacientů léčených ciprofloxacinem ve srovnání s 5,7 % (20/349) kontrolních pacientů. Vysazení léku z důvodu nežádoucího účinku bylo pozorováno u 3 % (10/335) pacientů léčených ciprofloxacinem oproti 1,4 % (5/349) pacientů s komparátorem. Další nežádoucí účinky, které se vyskytly u nejméně 1 % pacientů s ciprofloxacinem, byly průjem 4,8 %, zvracení 4,8 %, bolest břicha 3,3 %, dyspepsie 2,7 %, nauzea 2,7 %, horečka 2,1 %, astma 1,8 % a vyrážka 1,8 %.
Krátkodobé údaje o bezpečnosti cipro 1000 mgfloxacinu byly také shromážděny v randomizované, dvojitě zaslepené klinické studii pro léčbu akutních plicních exacerbací u pacientů s cystickou fibrózou (ve věku 5–17 let). Šedesát sedm pacientů dostávalo CIPRO IV 10 mg/kg/dávku každých 8 hodin po dobu jednoho týdne a následně CIPRO 250 mg tablety 20 mg/kg/dávku každých 12 hodin k dokončení 10–21denní léčby a 62 pacientů dostávalo kombinaci ceftazidimu intravenózně 50 mg/kg/dávka každých 8 hodin a tobramycin intravenózně 3 mg/kg/dávka každých 8 hodin po celkem 10–21 dní. Periodická hodnocení muskuloskeletálního systému byla prováděna zaslepenými vyšetřovateli. Pacienti byli sledováni v průměru 23 dnů po ukončení léčby (rozmezí 0–93 dnů). Muskuloskeletální nežádoucí účinky byly hlášeny u 22 % pacientů ve skupině s ciprofloxacinem a u 21 % ve srovnávací skupině. Snížený rozsah pohybu byl hlášen u 12 % subjektů ve skupině s ciprofloxacinem a u 16 % ve srovnávací skupině. Artralgie byla hlášena u 10 % pacientů ve skupině cipro 500 mgfloxacinu a 11 % ve srovnávací skupině. Další nežádoucí účinky byly podobné povahy a frekvence mezi léčebnými rameny. Účinnost přípravku CIPRO při léčbě akutních plicních exacerbací u pediatrických pacientů s cystickou fibrózou nebyla stanovena.
Kromě nežádoucích účinků hlášených u pediatrických pacientů v klinických studiích je třeba očekávat, že nežádoucí účinky hlášené u dospělých během klinických studií nebo po uvedení přípravku na trh se mohou objevit také u pediatrických pacientů.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly hlášeny z celosvětové marketingové zkušenosti s fluorochinolony, včetně CIPRO. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku (tabulka 10).
Nežádoucí laboratorní změny
Změny laboratorních parametrů během léčby CIPRO 250 mg jsou uvedeny níže:
Jaterní – Zvýšení ALT (SGPT), AST (SGOT), alkalické fosfatázy, LDH, sérového bilirubinu.
Hematologické – Eozinofilie, leukopenie, snížený počet krevních destiček, zvýšený počet krevních destiček, pancytopenie.
Renální – Bylo hlášeno zvýšení sérového kreatininu, BUN, krystalurie, cylindrurie a hematurie.
Další změny byly: zvýšení sérové gamaglutamyltransferázy, zvýšení sérové amylázy, snížení hladiny glukózy v krvi, zvýšení kyseliny močové, snížení hemoglobinu, anémie, krvácivá diatéza, zvýšení krevních monocytů a leukocytóza.
DROGOVÉ INTERAKCE
Ciprofloxacin je inhibitor metabolismu zprostředkovaného lidským cytochromem P450 1A2 (CYP1A2). Současné podávání CIPRO s jinými léky primárně metabolizovanými CYP1A2 má za následek zvýšené plazmatické koncentrace těchto léků a mohlo by vést ke klinicky významným nežádoucím účinkům současně podávaného léku.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Deaktivace a potenciálně nevratné závažné nežádoucí reakce včetně tendinitidy a ruptury šlach, periferní neuropatie a účinků na centrální nervový systém
Fluorochinolony, včetně CIPRO, byly spojovány s invalidizujícími a potenciálně ireverzibilními závažnými nežádoucími reakcemi z různých tělesných systémů, které se mohou vyskytnout společně u stejného pacienta. Mezi běžně pozorované nežádoucí účinky patří tendinitida, ruptura šlach, artralgie, myalgie, periferní neuropatie a účinky na centrální nervový systém (halucinace, úzkost, deprese, nespavost, silné bolesti hlavy a zmatenost). Tyto reakce se mohou objevit během hodin až týdnů po zahájení CIPRO. Pacienti jakéhokoli věku nebo bez již existujících rizikových faktorů zaznamenali tyto nežádoucí reakce (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Při prvních známkách nebo příznacích jakékoli závažné nežádoucí reakce okamžitě ukončete léčbu přípravkem CIPRO 250 mg. Kromě toho se vyvarujte užívání fluorochinolonů, včetně CIPRO 500 mg, u pacientů, u kterých se vyskytl některý z těchto závažných nežádoucích účinků spojených s fluorochinolony.
Tendinitida A Ruptura šlachy
Fluorochinolony, včetně CIPRO, byly spojovány se zvýšeným rizikem tendinitidy a ruptury šlach ve všech věkových kategoriích (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ]. Tato nežádoucí reakce se nejčastěji týká Achillovy šlachy a byla hlášena také u rotátorové manžety (rameno), ruky, bicepsu, palce a dalších šlach. Tendinitida nebo ruptura šlachy se může objevit během hodin nebo dnů po zahájení léčby přípravkem CIPRO 500 mg nebo až několik měsíců po dokončení léčby fluorochinolony. Tendinitida a ruptura šlachy se mohou objevit bilaterálně.
Riziko vzniku tendinitidy a ruptury šlachy související s fluorochinolony je zvýšené u pacientů starších 60 let, u pacientů užívajících kortikosteroidy a u pacientů po transplantaci ledvin, srdce nebo plic. Další faktory, které mohou nezávisle zvýšit riziko ruptury šlachy, zahrnují namáhavou fyzickou aktivitu, selhání ledvin a předchozí poruchy šlach, jako je revmatoidní artritida. Tendinitida a ruptura šlach se vyskytly také u pacientů užívajících fluorochinolony, kteří nemají výše uvedené rizikové faktory. Pokud pacient pociťuje bolest, otok, zánět nebo rupturu šlachy, okamžitě vysaďte CIPRO 250 mg. Vyhněte se fluorochinolonům, včetně CIPRO 250 mg, u pacientů, kteří mají v anamnéze poruchy šlach nebo prodělali tendinitidu nebo rupturu šlachy (viz NEŽÁDOUCÍ REAKCE ].
Periferní neuropatie
Fluorochinolony, včetně přípravku CIPRO, byly spojovány se zvýšeným rizikem periferní neuropatie. U pacientů užívajících fluorochinolony, včetně přípravku CIPRO, byly hlášeny případy senzorické nebo senzomotorické axonální polyneuropatie postihující malé a/nebo velké axony, které měly za následek parestezie, hypoestézie, dysestézie a slabost. Příznaky se mohou objevit brzy po zahájení léčby CIPRO a u některých pacientů mohou být nevratné [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Okamžitě přerušte podávání CIPRO, pokud se u pacienta objeví příznaky periferní neuropatie včetně bolesti, pálení, mravenčení, necitlivosti a/nebo slabosti, nebo jiné změny pocitů včetně lehkého dotyku, bolesti, teploty, vnímání polohy a vibrací a/nebo motorické síly aby se minimalizoval vznik nevratného stavu. Vyhněte se fluorochinolonům, včetně CIPRO 500 mg, u pacientů, kteří dříve prodělali periferní neuropatii (viz NEŽÁDOUCÍ REAKCE ].
Účinky na centrální nervový systém
Psychiatrické nežádoucí účinky
Fluorochinolony, včetně CIPRO, byly spojovány se zvýšeným rizikem psychiatrických nežádoucích reakcí, včetně: toxické psychózy, psychotických reakcí progredujících do sebevražedných myšlenek/myšlenek, halucinací nebo paranoie; deprese nebo sebepoškozující chování, jako je pokus o sebevraždu nebo dokonaná sebevražda; úzkost, neklid nebo nervozita; zmatenost, delirium, dezorientace nebo poruchy pozornosti; nespavost nebo noční můry; zhoršení paměti. Tyto reakce se mohou objevit po první dávce. Poraďte pacientům užívajícím CIPRO, aby v případě výskytu těchto reakcí okamžitě informovali svého poskytovatele zdravotní péče, přerušili podávání léku a zahájili vhodnou péči.
Nežádoucí účinky centrálního nervového systému
Fluorochinolony, včetně přípravku CIPRO 750 mg, byly spojovány se zvýšeným rizikem záchvatů (křečí), zvýšeným intrakraniálním tlakem (pscudotumor cerebri), závratěmi a třesem. CIPRO, stejně jako ostatní fluorochinolony, je známo, že spouští záchvaty nebo snižuje práh záchvatů. Byly hlášeny případy status epilepticus. Stejně jako u všech fluorochinolonů používejte přípravek CIPRO opatrně u epileptických pacientů a pacientů se známými nebo suspektními poruchami CNS, které mohou predisponovat k záchvatům nebo mohou snížit práh záchvatů (například těžká cerebrální arterioskleróza, předchozí anamnéza křečí, snížený průtok krve mozkem, změněný mozek struktura nebo mrtvice), nebo v přítomnosti jiných rizikových faktorů, které mohou predisponovat k záchvatům nebo snižovat práh záchvatů (například určitá medikamentózní terapie, renální dysfunkce). Pokud se objeví záchvaty, přerušte léčbu přípravkem CIPRO 500 mg a zajistěte vhodnou péči [viz NEŽÁDOUCÍ REAKCE a DROGOVÉ INTERAKCE ].
Exacerbace Myasthenia Gravis
Fluorochinolony, včetně CIPRO, mají neuromuskulární blokádu a mohou zhoršit svalovou slabost u pacientů s myasthenia gravis. Závažné nežádoucí účinky po uvedení na trh, včetně úmrtí a potřeby ventilační podpory, byly spojeny s užíváním fluorochinolonu u pacientů s myasthenia gravis. Vyhněte se CIPRO u pacientů se známou anamnézou myasthenia gravis (viz NEŽÁDOUCÍ REAKCE ].
Jiné vážné a někdy fatální nežádoucí reakce
Další závažné a někdy fatální nežádoucí účinky, některé z důvodu přecitlivělosti a některé z důvodu nejasné etiologie, byly hlášeny u pacientů léčených chinolony, včetně přípravku CIPRO. Tyto příhody mohou být závažné a obvykle se vyskytují po podání více dávek. Klinické projevy mohou zahrnovat jeden nebo více z následujících:
- Horečka, vyrážka nebo závažné dermatologické reakce (například toxická epidermální nekrolýza, Stevens-Johnsonův syndrom);
- vaskulitida; artralgie; myalgie; sérová nemoc;
- Alergická pneumonitida;
- intersticiální nefritida; akutní renální insuficience nebo selhání;
- hepatitida; žloutenka; akutní jaterní nekróza nebo selhání;
- Anémie, včetně hemolytické a aplastické; trombocytopenie, včetně trombotické trombocytopenické purpury; leukopenie; agranulocytóza; pancytopenie; a/nebo jiné hematologické abnormality.
Okamžitě přerušte užívání přípravku CIPRO 500 mg při prvním výskytu kožní vyrážky, žloutenky nebo jakýchkoli jiných příznaků přecitlivělosti a zavedených podpůrných opatření [viz NEŽÁDOUCÍ REAKCE ].
Hypersenzitivní reakce
pacientů léčených fluorochinolony, včetně přípravku CIPRO, byly hlášeny závažné a příležitostně fatální hypersenzitivní (anafylaktické) reakce, některé po první dávce. Některé reakce byly doprovázeny kardiovaskulárním kolapsem, ztrátou vědomí, brněním, otokem hltanu nebo obličeje, dušností, kopřivkou a svěděním. Pouze několik pacientů mělo v anamnéze hypersenzitivní reakce. Závažné anafylaktické reakce vyžadují okamžitou pohotovostní léčbu epinefrinem a další resuscitační opatření, včetně kyslíku, intravenózních tekutin, intravenózních antihistaminik, kortikosteroidů, presorických aminů a zajištění dýchacích cest, včetně intubace, jak je uvedeno [viz NEŽÁDOUCÍ REAKCE ].
Hepatotoxicita
přípravku CIPRO byly hlášeny případy závažné hepatotoxicity, včetně nekrózy jater, život ohrožujícího selhání jater a fatálních příhod. Akutní poškození jater má rychlý nástup (rozsah 1 – 39 dní) a je často spojeno s přecitlivělostí. Vzor poranění může být hepatocelulární, cholestatický nebo smíšený. Většina pacientů s fatálními následky byla starší 55 let. V případě jakýchkoli známek a příznaků hepatitidy (jako je anorexie, žloutenka, tmavá moč, svědění nebo citlivé břicho) okamžitě přerušte léčbu.
Může dojít k přechodnému zvýšení transamináz, alkalické fosfatázy nebo cholestatické žloutenky, zejména u pacientů s předchozím poškozením jater, kteří jsou léčeni přípravkem CIPRO [viz NEŽÁDOUCÍ REAKCE ].
Riziko Aneuryzmatu Aorty A Disekce
Epidemiologické studie uvádějí zvýšený výskyt aneuryzmat a disekce aorty během dvou měsíců po použití fluorochinolonů, zejména u starších pacientů. Příčina zvýšeného rizika nebyla zjištěna. U pacientů se známým aneuryzmatem aorty nebo u pacientů, kteří jsou vystaveni většímu riziku aneuryzmatu aorty, vyhraďte CIPRO 750 mg pro použití pouze v případě, že není k dispozici žádná alternativní antibakteriální léčba.
Závažné nežádoucí účinky při současném užívání teofylinu
Závažné a fatální reakce byly hlášeny u pacientů, kteří dostávali souběžné podávání přípravku CIPRO 250 mg a theofylinu. Tyto reakce zahrnovaly zástavu srdce, záchvaty, status epilepticus a respirační selhání. Vyskytly se také případy nevolnosti, zvracení, třesu, podrážděnosti nebo palpitace.
Přestože byly podobné závažné nežádoucí účinky hlášeny u pacientů užívajících samotný theofylin, nelze vyloučit možnost, že tyto reakce mohou být potencovány přípravkem CIPRO. Pokud se nelze vyhnout současnému použití, sledujte sérové hladiny theofylinu a upravte dávkování podle potřeby [viz DROGOVÉ INTERAKCE ].
Průjem spojený s Clostridioides Difficile
Průjem spojený s Clostridioides difficile (C. difficile) (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně CIPRO, a jeho závažnost se může pohybovat od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Izoláty C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po použití antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Je-li podezření na CDAD nebo je-li potvrzeno, může být nutné přerušit pokračující používání antibakteriálních látek, které nejsou zaměřeny proti C. difficile. Vhodné hospodaření s tekutinami a elektrolyty, suplementace proteinů, antibakteriální léčba C. difficile a chirurgické vyhodnocení podle klinické indikace [viz NEŽÁDOUCÍ REAKCE ].
Prodloužení QT intervalu
Některé fluorochinolony, včetně CIPRO 750 mg, byly spojovány s prodloužením QT intervalu na elektrokardiogramu a případy arytmie. Během postmarketingového sledování byly u pacientů užívajících fluorochinolony, včetně přípravku CIPRO, hlášeny případy torsade de pointes.
Vyhněte se CIPRO 1000 mg u pacientů se známým prodloužením QT intervalu, rizikovými faktory pro prodloužení QT intervalu nebo torsade de pointes (například vrozený syndrom dlouhého QT intervalu, nekorigovaná nerovnováha elektrolytů, jako je hypokalémie nebo hypomagnezémie, a srdeční onemocnění, jako je srdeční selhání, myokard infarkt nebo bradykardie) a pacienti užívající antiarytmika třídy IA (chinidin, prokainamid) nebo antiarytmika třídy III (amiodaron, sotalol), tricyklická antidepresiva, makrolidy a antipsychotika. Starší pacienti mohou být také náchylnější k účinkům souvisejícím s léky na QT interval [viz NEŽÁDOUCÍ REAKCE , Použití u konkrétních populací ].
Muskuloskeletální poruchy u dětských pacientů a artropatické účinky u zvířat
CIPRO 250 mg je indikován u pediatrických pacientů (mladších než 18 let) pouze pro cUTI, prevenci inhalačního antraxu (po expozici) a moru [viz INDIKACE A POUŽITÍ ]. Byl pozorován zvýšený výskyt nežádoucích reakcí ve srovnání s kontrolami, včetně reakcí souvisejících s klouby a/nebo okolními tkáněmi (viz NEŽÁDOUCÍ REAKCE ].
V předklinických studiích způsobilo perorální podání přípravku CIPRO kulhání u nedospělých psů. Histopatologické vyšetření váhonosných kloubů těchto psů odhalilo trvalé léze chrupavky. Příbuzné léky třídy chinolonů také způsobují eroze chrupavky nosných kloubů a další známky artropatie u nedospělých zvířat různých druhů [viz Použití u konkrétních populací a Neklinická toxikologie ].
Fotosenzitivita/fototoxicita
Středně těžké až závažné fotosenzitivní/fototoxické reakce, z nichž poslední se mohou projevit jako přehnané reakce spálení sluncem (například pálení, erytém, exsudace, puchýřky, puchýře, edém) zahrnující oblasti vystavené světlu (typicky obličej, oblast „V“ krku, extenzorových ploch předloktí, hřbetu rukou), může být spojeno s použitím chinolonů včetně CIPRO po vystavení slunci nebo UV záření. Vyvarujte se proto nadměrnému vystavení těmto zdrojům světla. Pokud dojde k fototoxicitě, přerušte podávání CIPRO 250 mg [viz NEŽÁDOUCÍ REAKCE ].
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepisování přípravku CIPRO 250 mg tablety a perorální suspenze CIPRO při absenci prokázané nebo silně suspektní bakteriální infekce nebo profylaktické indikace přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Potenciální rizika při současném užívání léků metabolizovaných enzymy cytochromu P450 1A2
CIPRO 750 mg je inhibitorem jaterní enzymové dráhy CYP1A2. Současné podávání CIPRO a dalších léků primárně metabolizovaných CYP1A2 (například teofylin, methylxantiny, kofein, tizanidin, ropinirol, klozapin, olanzapin a zolpidem) má za následek zvýšení plazmatických koncentrací současně podávaného léku a může vést ke klinicky významným farmakodynamické nežádoucí účinky současně podávaného léku [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Rušení s včasnou diagnózou syfilis
CIPRO 1000 mg se neprokázal jako účinný při léčbě syfilis. Antimikrobiální látky používané ve vysokých dávkách po krátkou dobu k léčbě kapavky mohou maskovat nebo oddálit příznaky inkubující syfilis. Proveďte sérologické vyšetření na syfilis u všech pacientů s kapavkou v době diagnózy. Proveďte kontrolní sérologický test na syfilis tři měsíce po léčbě CIPRO.
krystalurie
Krystaly ciprofloxacinu byly pozorovány vzácně v moči lidí, ale častěji v moči laboratorních zvířat, která je obvykle alkalická (viz Neklinická toxikologie ]. Krystalurie související s CIPRO byla u lidí hlášena jen vzácně, protože lidská moč je obvykle kyselá. Vyhněte se alkalitě moči u pacientů užívajících CIPRO. Pacienty dobře hydratujte, abyste zabránili tvorbě vysoce koncentrované moči [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Poruchy krevní glukózy
Fluorochinolony, včetně CIPRO, byly spojovány s poruchami hladiny glukózy v krvi, včetně symptomatické hyperglykémie a hypoglykémie, obvykle u diabetických pacientů, kteří dostávali souběžnou léčbu perorálními hypoglykemickými látkami (například glyburidem) nebo inzulínem. U těchto pacientů se doporučuje pečlivé sledování hladiny glukózy v krvi. Byly hlášeny závažné případy hypoglykémie vedoucí ke kómatu nebo smrti. Pokud se u pacienta léčeného přípravkem CIPRO objeví hypoglykemická reakce, přerušte podávání přípravku CIPRO 750 mg a okamžitě zahajte vhodnou léčbu (viz NEŽÁDOUCÍ REAKCE , DROGOVÉ INTERAKCE ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky )
Závažné nežádoucí reakce
Poraďte pacientům, aby přestali užívat přípravek CIPRO 250 mg, pokud se u nich objeví nežádoucí reakce, a aby zavolali svého poskytovatele zdravotní péče o radu ohledně dokončení celého cyklu léčby jiným antibakteriálním lékem.
Informujte pacienty o následujících závažných nežádoucích účincích, které byly spojeny s užíváním CIPRO nebo jiných fluorochinolonů:

- Deaktivující a potenciálně nevratné závažné nežádoucí reakce, které se mohou vyskytnout společně: Informujte pacienty, že invalidizující a potenciálně ireverzibilní závažné nežádoucí reakce, včetně tendinitidy a ruptury šlach, periferních neuropatií a účinků na centrální nervový systém, byly spojeny s užíváním přípravku CIPRO 1000 mg a mohou se vyskytnout společně u stejného pacienta. Informujte pacienty, aby okamžitě přestali užívat přípravek CIPRO, pokud se u nich objeví nežádoucí reakce, a aby zavolali svého poskytovatele zdravotní péče.
- Tendinitida a ruptura šlachy: Poučte pacienty, aby kontaktovali svého poskytovatele zdravotní péče, pokud pociťují bolest, otok nebo zánět šlachy nebo slabost nebo neschopnost používat některý ze svých kloubů; odpočívat a zdržet se cvičení; a přerušte léčbu přípravkem CIPRO 750 mg. Příznaky mohou být nevratné. Riziko těžkého postižení šlach u fluorochinolonů je vyšší u starších pacientů obvykle nad 60 let, u pacientů užívajících kortikosteroidy a u pacientů po transplantaci ledvin, srdce nebo plic.
- Periferní neuropatie: Informujte pacienty, že periferní neuropatie byly spojeny s užíváním ciprofloxacinu, příznaky se mohou objevit brzy po zahájení léčby a mohou být nevratné. Pokud se objeví příznaky periferní neuropatie včetně bolesti, pálení, brnění, necitlivosti a/nebo slabosti, okamžitě přerušte léčbu přípravkem CIPRO a řekněte jim, aby kontaktovali svého lékaře.
- Účinky na centrální nervový systém (například křeče, závratě, točení hlavy, zvýšený intrakraniální tlak): Informujte pacienty, že u pacientů užívajících fluorochinolony, včetně Ciprofloxacinu, byly hlášeny křeče. Informujte pacienty, aby informovali svého lékaře před užitím tohoto léku, pokud mají v anamnéze křeče. Informujte pacienty, že by měli vědět, jak reagují na CIPRO předtím, než budou ovládat automobil nebo stroje nebo se zapojit do jiných činností vyžadujících duševní bdělost a koordinaci. Poučte pacienty, aby informovali svého lékaře, pokud se objeví přetrvávající bolest hlavy s rozmazaným viděním nebo bez něj.
- Exacerbace myasthenia gravis: Poučte pacienty, aby informovali svého lékaře o jakékoli anamnéze myasthenia gravis. Poučte pacienty, aby informovali svého lékaře, pokud zaznamenají jakékoli příznaky svalové slabosti, včetně dýchacích obtíží.
- Hypersenzitivní reakce: Informujte pacienty, že ciprofloxacin může způsobit hypersenzitivní reakce, dokonce i po jednorázové dávce, a přerušit léčbu při prvních známkách kožní vyrážky, kopřivky nebo jiných kožních reakcí, zrychleného srdečního tepu, potíží s polykáním nebo dýcháním, jakéhokoli otoku svědčícího pro angioedém ( například otok rtů, jazyka, obličeje, sevření hrdla, chrapot) nebo jiné příznaky alergické reakce.
- Hepatotoxicita: Informujte pacienty, že u pacientů užívajících přípravek CIPRO byla hlášena závažná hepatotoxicita (včetně akutní hepatitidy a fatálních příhod). Poučte pacienty, aby informovali svého lékaře, pokud zaznamenají jakékoli známky nebo příznaky poškození jater, včetně: ztráty chuti k jídlu, nevolnosti, zvracení, horečky, slabosti, únavy, citlivosti pravého horního kvadrantu, svědění, zežloutnutí kůže a očí, světlých stolic nebo tmavě zbarvená moč.
- Aneuryzma aorty a disekce: Informujte pacienty, aby vyhledali pohotovostní lékařskou péči, pokud zaznamenají náhlou bolest na hrudi, žaludku nebo zádech.
- Průjem: Průjem je častým problémem způsobeným antibiotiky, který obvykle končí, když je antibiotikum vysazeno. Někdy po zahájení léčby antibiotiky se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, poučte pacienty, aby co nejdříve kontaktovali svého lékaře.
- Prodloužení QT intervalu: Poučte pacienty, aby informovali svého lékaře o jakékoli osobní nebo rodinné anamnéze prodloužení QT intervalu nebo proarytmických stavech, jako je hypokalémie, bradykardie nebo nedávná ischemie myokardu; jestliže užívají jakákoli antiarytmika třídy IA (chinidin, prokainamid) nebo třídy III (amiodaron, sotalol). Poučte pacienty, aby informovali svého lékaře, pokud mají jakékoli příznaky prodloužení QT intervalu, včetně prodlouženého bušení srdce nebo ztráty vědomí.
- Muskuloskeletální poruchy u dětských pacientů: Poučte rodiče, aby před užitím tohoto léku informovali lékaře svého dítěte, pokud má dítě v anamnéze problémy s klouby. Informujte rodiče dětských pacientů, aby informovali lékaře svého dítěte o jakýchkoli problémech souvisejících s klouby, které se vyskytnou během nebo po léčbě přípravkem Cipro 1000 mgfloxacin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
- tizanidin: Poučte pacienty, aby nepoužívali cipro 250 mgfloxacin, pokud již užívají tizanidin. CIPRO zvyšuje účinky tizanidinu (Zanaflex®).
- teofylin: Informujte pacienty, že cipro 250 mgfloxacin CIPRO 1000 mg může zvýšit účinky theofylinu. Mohou se objevit život ohrožující účinky na CNS a arytmie. Poraďte pacientům, aby okamžitě vyhledali lékařskou pomoc, pokud zaznamenají záchvaty, bušení srdce nebo potíže s dýcháním.
- Kofein: Informujte pacienty, že CIPRO 500 mg může zvýšit účinky kofeinu. Při konzumaci produktů obsahujících kofein během užívání chinolonů existuje možnost akumulace kofeinu.
- Fotosenzitivita/fototoxicita: Informujte pacienty, že u pacientů užívajících fluorochinolony byla hlášena fotosenzitivita/fototoxicita. Informujte pacienty, aby během užívání chinolonů minimalizovali nebo se vyvarovali vystavení přirozenému nebo umělému slunečnímu záření (solária nebo UVA/B léčba). Pokud pacienti potřebují být při používání chinolonů venku, poučte je, aby nosili volné oblečení, které chrání pokožku před slunečním zářením, a prodiskutujte další opatření na ochranu před sluncem se svým lékařem. Pokud dojde k reakci podobné spálení sluncem nebo kožní erupci, poučte pacienty, aby kontaktovali svého lékaře.
- Poruchy glukózy v krvi: Informujte pacienty, že pokud jsou diabetici a jsou léčeni inzulinem nebo perorálním hypoglykemickým přípravkem a dojde k hypoglykemické reakci, měli by vysadit CIPRO 250 mg a poradit se s lékařem.
- Laktace: jiných indikací než je inhalační antrax (po expozici) upozorněte ženu, že kojení se během léčby přípravkem Cipro a další 2 dny po poslední dávce nedoporučuje. Alternativně může žena pumpovat a zlikvidovat během léčby a další 2 dny po poslední dávce [viz Použití u konkrétních populací ].
Antibakteriální odolnost
Informujte pacienty, že antibakteriální léky včetně CIPRO 250 mg tablety a CIPRO 1000 mg perorální suspenze by se měly používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (například nachlazení). Když jsou CIPRO 500 mg tablety a CIPRO 500 mg perorální suspenze předepisovány k léčbě bakteriální infekce, pacienti by měli být informováni, že ačkoli je běžné, že se na začátku léčby cítí lépe, léky by měly být užívány přesně podle pokynů. Vynechání dávek nebo nedokončení celého léčebného cyklu může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou léčitelné CIPRO 500 mg tabletami a CIPRO 250 mg perorální suspenzí nebo jinými antibakteriálními látkami. drogy v budoucnu.
Pokyny pro administraci
Poučte pacienta
- Před každým použitím CIPRO perorální suspenzi silně protřepejte po dobu přibližně 15 sekund.
- získání přesné dávky vždy používejte společně přibalenou odměrnou lžičku s označením pro ½ (2,5 ml) a 1/1 (5 ml).
- Po použití je třeba odměrnou lžičku očistit pod tekoucí vodou s mycím prostředkem na nádobí a důkladně osušit.
- Mikrokapsle ne žvýkat, ale polykat celé.
- Tato voda může být odebrána později.
- Po každém použití lahvičku řádně uzavřete podle pokynů na víčku.
- Po ukončení léčby se CIPRO 1000 mg perorální suspenze nesmí znovu použít.
Informujte pacienty, že CIPRO 250 mg lze užívat s jídlem nebo bez jídla.
Informujte pacienty, aby během užívání přípravku CIPRO dostatečně pili tekutiny, aby se zabránilo tvorbě vysoce koncentrované moči a tvorbě krystalů v moči.
Informujte pacienty, že antacida obsahující hořčík nebo hliník a také sukralfát, kationty kovů, jako je železo, a multivitaminové přípravky se zinkem nebo didanosinem by měly být užívány nejméně dvě hodiny před nebo šest hodin po podání přípravku CIPRO 1000 mg. CIPRO by se neměl užívat s mléčnými výrobky (jako je mléko nebo jogurt) nebo samotnými šťávami obohacenými vápníkem, protože vstřebávání ciprofloxacinu může být významně sníženo; CIPRO 500 mg však lze užívat s jídlem, které tyto produkty obsahuje.
Upozorněte pacienty, že pokud dojde k vynechání dávky, měla by se užít kdykoli, ale ne později než 6 hodin před další plánovanou dávkou. Pokud do další dávky zbývá méně než 6 hodin, vynechaná dávka by se neměla užít a léčba by měla pokračovat podle předpisu další plánovanou dávkou. Dvojité dávky by se neměly užívat jako kompenzace vynechané dávky.
Informujte pacienty, že tablety CIPRO 500 mg (250 mg a 500 mg) jsou rýhovány a mohou být rozděleny na polovinu v rýhované čáře, aby se dosáhlo síly 125 mg nebo 250 mg.
Lékové interakce Perorální antidiabetika
Informujte pacienty, že při současném podávání cipro 250 mgfloxacinu a perorálních antidiabetik byla hlášena hypoglykémie; pokud se u přípravku CIPRO 750 mg objeví nízká hladina cukru v krvi, poučte je, aby se poradili se svým lékařem a že možná bude nutné změnit jejich antibakteriální lék.
Studie antraxu a moru
Informujte pacienty, kterým byl podáván přípravek CIPRO pro tyto stavy, že studie účinnosti nemohou být provedeny u lidí z důvodů proveditelnosti. Proto bylo schválení pro tyto stavy založeno na studiích účinnosti provedených na zvířatech.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
S cipro 500 mgfloxacinem bylo provedeno osm in vitro testů mutagenity a výsledky testů jsou uvedeny níže:
- Test na salmonelu/mikrozomy (negativní)
- Test na opravu DNA E. coli (negativní)
- Test přímé mutace buněk myšího lymfomu (pozitivní)
- Test HGPRT u čínského křečka V79 (negativní)
- Test transformace buněk embryí syrského křečka (negativní)
- Test bodové mutace Saccharomyces cerevisiae (negativní)
- Test mitotického křížení a genové konverze Saccharomyces cerevisiae (negativní)
- Test na opravu DNA potkaních hepatocytů (pozitivní)
Takže 2 z 8 testů byly pozitivní, ale výsledky následujících 3 testovacích systémů in vivo poskytly negativní výsledky:
- Test na opravu DNA potkaních hepatocytů
- Mikronukleový test (myši)
- Dominantní letální test (myši)
Dlouhodobé studie karcinogenity u potkanů a myší nevedly k žádným karcinogenním nebo tumorigenním účinkům v důsledku cipro 500 mgfloxacinu v denních perorálních dávkách až 250 mg/kg a 750 mg/kg u potkanů a myší (přibližně 1,7krát a 2,5krát nejvyšší doporučená terapeutická dávka na základě tělesného povrchu).
Výsledky testování fotoko-karcinogenity ukazují, že cipro 1000 mgfloxacin nezkracuje dobu do výskytu kožních nádorů vyvolaných UV zářením ve srovnání s kontrolou s vehikulem. Bezsrsté (Skh-1) myši byly vystaveny UVA světlu na 3,5 hodiny pětkrát každé dva týdny po dobu až 78 týdnů, přičemž jim byl současně podáván ciprofloxacin. Doba do rozvoje prvních kožních nádorů byla 50 týdnů u myší léčených současně UVA a cipro 1000 mgfloxacinem (dávka myší přibližně rovna maximální doporučené dávce pro člověka na základě plochy povrchu těla), na rozdíl od 34 týdnů, kdy byla zvířata léčena oběma UVA a vozidlo. Doba do rozvoje kožních nádorů se pohybovala od 16 týdnů do 32 týdnů u myší léčených současně UVA a jinými chinolony.5
V tomto modelu se u myší léčených samotným ciprofloxacinem nevyvinuly kožní nebo systémové nádory. Neexistují žádná data z podobných modelů používajících pigmentované myši a/nebo plně chlupaté myši. Klinický význam těchto zjištění pro člověka není znám.
Studie fertility provedené u samců a samic potkanů při perorálních dávkách cipro 250 mgfloxacinu až do 100 mg/kg (přibližně 0,6násobek nejvyšší doporučené terapeutické perorální dávky na základě tělesného povrchu) neodhalily žádné známky poškození. Samci potkanů dostávali perorálně ciprofloxacin po dobu 10 týdnů před pářením a samice dostávaly dávky po dobu 3 týdnů před pářením až do 7. dne březosti.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dlouhodobé zkušenosti s přípravkem cipro 1000 mgfloxacin u těhotných žen v průběhu několika desetiletí, na základě dostupných publikovaných informací z kazuistik, případových kontrolních studií a observačních studií s přípravkem cipro 1000 mgfloxacin podávaným během těhotenství, nezjistily žádné riziko závažných vrozených vad, potratu nebo nežádoucích účinků souvisejících s léky. výsledky u matky nebo plodu (viz Data ). Perorální podávání cipro 500 mgfloxacinu během organogeneze v dávkách až 100 mg/kg březím myším a potkanům a až 30 mg/kg březím králíkům nezpůsobilo malformace plodu (viz Data ). Tyto dávky byly až 0,3, 0,6 a 0,4násobek maximální doporučené klinické perorální dávky u myší, potkanů a králíků, v daném pořadí, na základě plochy povrchu těla. Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Data
Lidská data
Zatímco dostupné studie nemohou definitivně prokázat absenci rizika, publikované údaje z prospektivních observačních studií v průběhu několika desetiletí neprokázaly souvislost s užíváním cipro 250 mgfloxacinu během těhotenství a závažných vrozených vad, potratu nebo nepříznivých mateřských nebo fetálních výsledků. Dostupné studie mají metodologická omezení včetně malé velikosti vzorku a některé z nich nejsou specifické pro ciprofloxacin. Kontrolovaná prospektivní observační studie sledovala 200 žen vystavených fluorochinolonům (52,5 % vystaveno cipro 250 mgfloxacinu a 68 % expozici v prvním trimestru) během těhotenství. Expozice fluorochinolonům in utero během embryogeneze nebyla spojena se zvýšeným rizikem závažných malformací. Hlášená četnost velkých vrozených malformací byla 2,2 % u skupiny s fluorochinolony a 2,6 % u kontrolní skupiny (základní výskyt velkých malformací je 1 – 5 %). Míra samovolných potratů, nedonošenosti a nízké porodní hmotnosti se mezi skupinami nelišila a u dětí vystavených cipro 500 mgfloxacinu nebyly do jednoho roku věku žádné klinicky významné muskuloskeletální dysfunkce.
Další prospektivní následná studie referovala o 549 těhotenstvích s expozicí fluorochinolonu (93 % expozice v prvním trimestru). Došlo k 70 expozicím cipro 500 mgfloxacinu, všechny během prvního trimestru. Míra malformací mezi živě narozenými dětmi vystavenými cipro 750 mgfloxacinu a celkově fluorochinolonům byla v obou rozmezích výskytu. Nebyly nalezeny žádné specifické vzorce vrozených abnormalit. Studie neodhalila žádné jasné nežádoucí účinky v důsledku expozice ciprofloxacinu in utero.
U žen vystavených ciprofloxacinu během těhotenství nebyly pozorovány žádné rozdíly v míře nedonošenosti, spontánních potratů nebo porodní hmotnosti. Tyto malé postmarketingové epidemiologické studie, z nichž většina zkušeností pochází z krátkodobé expozice v prvním trimestru, však nepostačují k vyhodnocení rizika méně častých defektů nebo k tomu, aby umožnily spolehlivé a definitivní závěry týkající se bezpečnosti ciprofloxacinu u těhotných žen a jejich vyvíjejících se plodů .
Údaje o zvířatech
Vývojové toxikologické studie byly provedeny s cipro 500 mgfloxacinem u potkanů, myší a králíků. U potkanů a myší nebyly perorální dávky až do 100 mg/kg podané během organogeneze (Gestation Days, GD, 6-17) spojeny s nepříznivými vývojovými výsledky, včetně embryofetální toxicity nebo malformací. U potkanů a myší je dávka 100 mg/kg přibližně 0,6násobkem a 0,3násobkem maximální denní perorální dávky pro člověka (1500 mg/den) na základě plochy tělesného povrchu. V sérii vývojových toxikologických studií králíků dostávaly laně orálně nebo intravenózně cipro 250 mgfloxacinu po jedno z následujících pětidenních období: GD 6 až 10, GD 10 až 14 nebo GD 14 až 18, určené k pokrytí období organogeneze. Jednalo se o pokus zmírnit gastrointestinální intoleranci pozorovanou u králíků, kteří dostávají antibakteriální látky, projevující se sníženou spotřebou mateřské potravy a úbytkem hmotnosti, což může vést k embryofetální resorpci nebo spontánnímu potratu. Perorální dávka cipro 750 mgfloxacinu 100 mg/kg (přibližně 1,3násobek nejvyšší doporučené klinické perorální dávky na základě tělesného povrchu) způsobila nadměrnou mateřskou toxicitu zkreslující hodnocení plodů. Perorální dávka 30 mg/kg (přibližně 0,4násobek nejvyšší doporučené klinické perorální dávky) byla spojena se supresí přírůstku tělesné hmotnosti matky a plodu, ale fetální malformace nebyly pozorovány. Intravenózní podání dávek až do 20 mg/kg (přibližně 0,3násobek nejvyšší doporučené klinické perorální dávky na základě tělesného povrchu) březím králíkům nebylo toxické pro matku a nebyla pozorována embryofetální toxicita ani fetální malformace.
peri- a postnatálních studiích dostávaly potkani cipro 1000 mgfloxacinu v dávkách až 200 mg/kg/den (perorálně) nebo až 30 mg/kg/den (subkutánně) od GD 16 až 22 dní po porodu. Dávka 200 mg/kg je přibližně 1,3násobkem maximální doporučené klinické perorální dávky na základě plochy povrchu těla. Nebyla pozorována ani mateřská toxicita, ani nepříznivé účinky na růst a vývoj mláďat, včetně žádné známky artropatie na kloubech zadních nohou mláďat. Bylo prokázáno, že ciprofloxacin a další chinolony způsobují artropatii u nezralých zvířat většiny testovaných druhů, když jsou podávány přímo [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Neklinická toxikologie ].
Laktace
Shrnutí rizik
Publikovaná literatura uvádí, že cipro 1000 mgfloxacin je přítomen v mateřském mléce po intravenózním a perorálním podání. Neexistují žádné informace o účincích přípravku CIPRO na produkci mléka nebo kojené dítě. Vzhledem k potenciálnímu riziku závažných nežádoucích účinků u kojených dětí, včetně artropatie prokázané ve studiích s juvenilními zvířaty (viz Použití u konkrétních populací (Klinické úvahy)], u většiny indikací může kojící žena zvážit odsávání a vyřazení mateřského mléka během léčby přípravkem CIPRO 500 mg a další dva dny (pět poločasů) po poslední dávce. Případně informujte ženu, že kojení se během léčby přípravkem CIPRO a další dva dny (pět poločasů) po poslední dávce nedoporučuje.
V případě inhalačního antraxu (po expozici), během incidentu vedoucího k expozici antraxu, však může být přijatelné posouzení rizika a přínosu pokračování kojení, zatímco matka (a potenciálně dítě) je (jsou) na CIPRO [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Pediatrické použití , a Klinické studie ]. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky CIPRO a veškerými potenciálními nežádoucími účinky na kojené dítě z CIPRO 1000 mg nebo ze základního stavu matky.
Klinické úvahy
Cipro 1000 mgfloxacin může způsobit změnu střevní flóry u kojeného dítěte. Poraďte ženě, aby sledovala kojené dítě kvůli řídké nebo krvavé stolici a kandidóze (soor, plenková vyrážka).
Pediatrické použití
Přestože byl CIPRO 750 mg účinný v klinických studiích, není lékem první volby u pediatrické populace kvůli zvýšenému výskytu nežádoucích účinků ve srovnání s kontrolami. Chinolony, včetně CIPRO, způsobují artropatii (artralgie, artritida) u mladých zvířat [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Neklinická toxikologie ].
Komplikovaná infekce močových cest a pyelonefritida
CIPRO 250 mg je indikován k léčbě cUTI a pyelonefritidy způsobené Escherichia coli u dětských pacientů ve věku 1 až 17 let. Přestože je v klinických studiích účinný, CIPRO 500 mg není lékem první volby u pediatrické populace kvůli zvýšenému výskytu nežádoucích účinků ve srovnání s kontrolami, včetně příhod souvisejících s klouby a/nebo okolními tkáněmi [viz NEŽÁDOUCÍ REAKCE a Klinické studie ].
Inhalační antrax (po expozici)
CIPRO 750 mg je indikován u dětských pacientů od narození do 17 let pro inhalační antrax (po expozici). Hodnocení rizika a přínosu ukazuje, že podávání ciprofloxacinu dětským pacientům je vhodné [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
Mor
CIPRO 500 mg je indikován u dětských pacientů od narození do 17 let k léčbě moru, včetně plicního a septikemického moru způsobeného Yersinia pestis (Y. pestis) ak profylaxi moru. Studie účinnosti přípravku CIPRO nemohly být provedeny u lidí s plicním morem z důvodů proveditelnosti. Proto bylo schválení této indikace založeno na studii účinnosti provedené na zvířatech. Hodnocení rizika a přínosu ukazuje, že podávání CIPRO pediatrickým pacientům je vhodné [viz INDIKACE A POUŽITÍ , DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
Geriatrické použití
Geriatričtí pacienti jsou vystaveni zvýšenému riziku rozvoje závažných poruch šlach včetně ruptury šlachy, když jsou léčeni fluorochinolony, jako je CIPRO. Toto riziko se dále zvyšuje u pacientů, kteří dostávají souběžnou léčbu kortikosteroidy. Tendinitida nebo ruptura šlachy může postihnout Achillovu šlachu, ruku, rameno nebo jiná místa šlach a může se objevit během nebo po dokončení terapie; byly hlášeny případy vyskytující se až několik měsíců po léčbě fluorochinolony. Při předepisování přípravku CIPRO 500 mg starším pacientům, zejména těm, kteří užívají kortikosteroidy, je třeba postupovat opatrně. Pacienti by měli být informováni o této potenciální nežádoucí reakci a měli by být poučeni, aby přerušili léčbu přípravkem CIPRO 500 mg a kontaktovali svého poskytovatele zdravotní péče, pokud se objeví jakékoli příznaky tendinitidy nebo ruptury šlachy [viz VAROVÁNÍ V KRABICE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a NEŽÁDOUCÍ REAKCE ].
Epidemiologické studie uvádějí zvýšenou míru aneuryzmatu aorty a disekce během dvou měsíců po použití fluorochinolonů, zejména u starších pacientů (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
retrospektivní analýze 23 kontrolovaných klinických studií s opakovanými dávkami CIPRO, které zahrnovaly více než 3500 pacientů léčených ciprofloxacinem, bylo 25 % pacientů starších nebo rovných 65 let a 10 % bylo starších nebo rovných 75 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších jedinců na jakoukoli lékovou terapii. Je známo, že ciprofloxacin je v podstatě vylučován ledvinami a riziko nežádoucích účinků může být vyšší u pacientů s poruchou funkce ledvin. U pacientů starších 65 let s normální funkcí ledvin není nutná žádná úprava dávkování. Protože však někteří starší jedinci mají sníženou funkci ledvin v důsledku svého pokročilého věku, je třeba věnovat pozornost výběru dávky u starších pacientů a u těchto pacientů může být užitečné monitorování funkce ledvin [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Obecně mohou být starší pacienti náchylnější k účinkům na QT interval souvisejícím s léky. Proto je třeba opatrnosti při užívání přípravku CIPRO 500 mg současně s léky, které mohou vést k prodloužení QT intervalu (například antiarytmika třídy IA nebo třídy III) nebo u pacientů s rizikovými faktory pro torsade de pointes (například známé prodloužení QT intervalu , nekorigovaná hypokalémie) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Renální poškození
Cipro 500 mgfloxacin je eliminován primárně renální exkrecí; léčivo je však také metabolizováno a částečně vylučováno žlučovým systémem jater a střevem. Zdá se, že tyto alternativní cesty eliminace léčiva kompenzují sníženou renální exkreci u pacientů s poruchou funkce ledvin. Přesto se doporučuje určitá úprava dávkování, zejména u pacientů s těžkou renální dysfunkcí [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
předběžných studiích u pacientů se stabilní chronickou jaterní cirhózou nebyly pozorovány žádné významné změny ve farmakokinetice ciprofloxacinu. Farmakokinetika cipro 500 mgfloxacinu u pacientů s akutní jaterní insuficiencí nebyla studována.
PŘEDÁVKOVAT
V případě akutního předávkování byla v některých případech hlášena reverzibilní renální toxicita. Vyprázdněte žaludek vyvoláním zvracení nebo výplachem žaludku. Pečlivě pacienta sledujte a poskytněte podpůrnou léčbu, včetně monitorování funkce ledvin, pH moči a v případě potřeby okyselte, abyste zabránili krystalurii a podávání antacid obsahujících hořčík, hliník nebo vápník, které mohou snížit absorpci cipro 750 mgfloxacinu. Je třeba udržovat dostatečnou hydrataci. Po hemodialýze nebo peritoneální dialýze se z těla odstraní pouze malé množství cipro 250 mgfloxacinu (méně než 10 %).
KONTRAINDIKACE
Přecitlivělost
CIPRO 1000mg je kontraindikován u osob s anamnézou přecitlivělosti na cipro 750mgfloxacin, jakýkoli člen chinolonové třídy antibakteriálních látek nebo kteroukoli složku přípravku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
tizanidin
Současné podávání s tizanidinem je kontraindikováno [viz DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Ciprofloxacin je členem fluorochinolonové třídy antibakteriálních látek [viz Mikrobiologie ].
Farmakokinetika
Vstřebávání
Absolutní biologická dostupnost cipro 500 mgfloxacinu při podání jako perorální tableta je přibližně 70 % bez podstatné ztráty metabolismem prvního průchodu játry. Maximální sérové koncentrace ciprofloxacinu (Cmax) a plocha pod křivkou (AUC) jsou uvedeny v tabulce pro rozmezí dávek 250 mg až 1000 mg (Tabulka 12).
Maximálních sérových koncentrací je dosaženo 1 až 2 hodiny po perorálním podání. Průměrné koncentrace 12 hodin po podání 250, 500 nebo 750 mg jsou 0,1, 0,2 a 0,4 mcg/ml. Sérový eliminační poločas u jedinců s normální funkcí ledvin je přibližně 4 hodiny. Sérové koncentrace se zvyšují úměrně s dávkami do 1000 mg.
Bylo prokázáno, že perorální dávka 500 mg podávaná každých 12 hodin vytváří AUC ekvivalentní té, kterou vytváří intravenózní infuze 400 mg CIPRO 1000 mg podávaná po dobu 60 minut každých 12 hodin. Bylo prokázáno, že perorální dávka 750 mg podávaná každých 12 hodin vytváří AUC v ustáleném stavu ekvivalentní té, kterou vytváří intravenózní infuze 400 mg podávaná po dobu 60 minut každých 8 hodin. Perorální dávka 750 mg vede k Cmax podobné té, která byla pozorována při intravenózní dávce 400 mg (tabulka 13). Perorální dávka 250 mg podávaná každých 12 hodin vytváří AUC ekvivalentní té, kterou vytváří infuze 200 mg CIPRO 1000 mg podávaná každých 12 hodin.
Jídlo
Když se CIPRO Tablet podává současně s jídlem, dochází ke zpoždění v absorpci léku, což vede k vrcholovým koncentracím, které se objevují blíže 2 hodinám po podání, spíše než 1 hodině, zatímco při podávání CIPRO 750 mg suspenze s jídlem není pozorováno žádné zpoždění. . Celková absorpce CIPRO 1000 mg tablety nebo CIPRO 500 mg suspenze však není podstatně ovlivněna. Farmakokinetika cipro 750 mgfloxacinu podávaného ve formě suspenze také není ovlivněna jídlem. Vyhněte se současnému podávání CIPRO s mléčnými výrobky (jako je mléko nebo jogurt) nebo samotnými šťávami obohacenými vápníkem, protože je možné snížené vstřebávání; CIPRO 1000 mg však lze užívat s jídlem, které obsahuje tyto produkty
Při perorálním podání je dávka 500 mg podaná jako 10 ml 5% suspenze CIPRO (obsahující 250 mg ciprofloxacinu/5 ml) bioekvivalentní 500 mg tabletě. 10 ml objem 5% CIPRO 1000 mg suspenze (obsahující 250 mg ciprofloxacinu/5 ml) je bioekvivalentní 5 ml objemu 10% CIPRO 750 mg suspenze (obsahující 500 mg cipro 1000 mgloxacin/5 ml).
Rozdělení
Vazba ciprofloxacinu na sérové proteiny je 20 % až 40 %, což pravděpodobně nebude dostatečně vysoké, aby způsobilo významné vazebné interakce na proteiny s jinými léky.
Po perorálním podání je cipro 250 mgfloxacin široce distribuován po celém těle. Koncentrace v tkáních často překračují sérové koncentrace u mužů i žen, zejména v genitální tkáni včetně prostaty. Ciprofloxacin je přítomen v aktivní formě ve slinách, nosních a bronchiálních sekretech, sliznici dutin, sputu, tekutině z kožních puchýřů, lymfě, peritoneální tekutině, žluči a sekretu prostaty. Cipro 500 mgfloxacin byl také zjištěn v plicích, kůži, tuku, svalech, chrupavkách a kostech. Lék difunduje do mozkomíšního moku (CSF); avšak koncentrace CSF jsou obecně nižší než 10 % maximálních sérových koncentrací. Nízké hladiny léčiva byly zjištěny v oční tekutině a sklivci.
Metabolismus
lidské moči byly identifikovány čtyři metabolity, které dohromady tvoří přibližně 15 % perorální dávky. Metabolity mají antimikrobiální aktivitu, ale jsou méně aktivní než nezměněný cipro 500 mgfloxacin. Cipro 500 mgfloxacin je inhibitor metabolismu zprostředkovaného lidským cytochromem P450 1A2 (CYP1A2). Současné podávání ciprofloxacinu s jinými léky primárně metabolizovanými CYP1A2 má za následek zvýšení plazmatických koncentrací těchto léků a mohlo by vést ke klinicky významným nežádoucím účinkům současně podávaného léku [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a DROGOVÉ INTERAKCE ].
Vylučování
Sérový eliminační poločas u jedinců s normální funkcí ledvin je přibližně 4 hodiny. Přibližně 40 až 50 % perorálně podané dávky se vylučuje močí jako nezměněné léčivo. Po perorální dávce 250 mg koncentrace cipro 500 mgfloxacinu v moči obvykle překračují 200 mcg/ml během prvních dvou hodin a jsou přibližně 30 mcg/ml za 8 až 12 hodin po podání. Vylučování ciprofloxacinu močí je prakticky úplné do 24 hodin po podání. Renální clearance cipro 250 mgfloxacinu, která je přibližně 300 ml/min, překračuje normální rychlost glomerulární filtrace 120 ml/min. Zdá se tedy, že aktivní tubulární sekrece hraje významnou roli v její eliminaci. Současné podávání probenecidu s ciprofloxacinem má za následek asi 50% snížení renální clearance ciprofloxacinu a 50% zvýšení jeho koncentrace v systémovém oběhu.
Přestože koncentrace cipro 250 mgfloxacinu ve žluči jsou několikanásobně vyšší než koncentrace v séru po perorálním podání, pouze malé množství podané dávky se získá ze žluči jako nezměněné léčivo. Další 1 % až 2 % dávky se získá ze žluči ve formě metabolitů. Přibližně 20 % až 35 % perorálně podané dávky se získá ze stolice do 5 dnů po podání. To může vzniknout buď biliární clearance nebo transintestinální eliminací.
Specifické populace
Starší
Farmakokinetické studie perorální (jednorázová dávka) a intravenózní (jednorázové a vícedávkové) formy cipro 250 mgfloxacinu ukazují, že plazmatické koncentrace ciprofloxacinu jsou vyšší u starších subjektů (starších 65 let) ve srovnání s mladými dospělými. Ačkoli je Cmax zvýšena o 16 % až 40 %, zvýšení průměrné AUC je přibližně 30 % a lze jej alespoň částečně připsat snížené renální clearance u starších osob. Eliminační poločas je u starších pacientů prodloužen pouze mírně (~20 %). Tyto rozdíly nejsou považovány za klinicky významné [viz Použití u konkrétních populací ].
Renální poškození
U pacientů se sníženou funkcí ledvin je poločas ciprofloxacinu mírně prodloužen. Může být nutné upravit dávkování [viz Použití u konkrétních populací a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Poškození jater
V předběžných studiích u pacientů se stabilní chronickou jaterní cirhózou nebyly pozorovány žádné významné změny ve farmakokinetice ciprofloxacinu. Kinetika cipro 750 mgfloxacinu u pacientů s akutní jaterní insuficiencí nebyla plně studována.
Pediatrie
Tabulka 14 shrnuje farmakokinetické parametry u pediatrických pacientů ve věku od 1 do méně než 12 let, kteří dostávali intravenózní léčbu.
Tyto hodnoty jsou v rozmezí uváděném pro dospělé při terapeutických dávkách. Na základě populační farmakokinetické analýzy pediatrických pacientů s různými infekcemi je předpokládaný průměrný poločas u dětí přibližně 4 hodiny – 5 hodin a biologická dostupnost perorální suspenze je přibližně 60 %.
Lékové interakce
Antacida
Současné podávání antacidů obsahujících hydroxid hořečnatý nebo hydroxid hlinitý může snížit biologickou dostupnost cipro 500 mgfloxacinu až o 90 % [viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
Antagonisté histaminových H2-receptorů
Zdá se, že antagonisté histaminového H2-receptoru nemají žádný významný vliv na biologickou dostupnost cipro 250 mgfloxacinu.
metronidazol
Sérové koncentrace ciprofloxacinu a metronidazolu se při současném podávání těchto dvou léků nezměnily.
tizanidin
Ve farmakokinetické studii byla systémová expozice tizanidinu (jednorázová dávka 4 mg) významně zvýšena (Cmax 7krát, AUC 10krát), když byl lék podáván současně s CIPRO (500 mg dvakrát denně po dobu 3 dnů). Současné podávání tizanidinu a CIPRO je kontraindikováno z důvodu potenciace hypotenzních a sedativních účinků tizanidinu [viz KONTRAINDIKACE ].
ropinirol
Ve studii provedené u 12 pacientů s Parkinsonovou nemocí, kterým bylo podáváno 6 mg ropinirolu jednou denně s 500 mg CIPRO 250 mg dvakrát denně, byla průměrná Cmax a průměrná AUC ropinirolu zvýšena o 60 % a 84 %. Během a krátce po současném podávání s CIPRO se doporučuje sledování nežádoucích účinků souvisejících s ropinirolem a vhodná úprava dávky ropinirolu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
klozapin
Po současném podávání 250 mg CIPRO 500 mg s 304 mg klozapinu po dobu 7 dnů byly sérové koncentrace klozapinu zvýšeny o 29 % a N-desmethylklozapinu o 31 %. Doporučuje se pečlivé sledování nežádoucích účinků spojených s klozapinem a vhodná úprava dávkování klozapinu během a krátce po současném podávání s CIPRO.
Sildenafil
Po současném podání jednorázové perorální dávky 50 mg sildenafilu s 500 mg CIPRO 1000 mg zdravým subjektům se průměrná Cmax i průměrná AUC sildenafilu zvýšily přibližně dvojnásobně. Při současném podávání s CIPRO 500 mg používejte sildenafil opatrně kvůli očekávanému dvojnásobnému zvýšení expozice sildenafilu při současném podávání CIPRO.
duloxetin
klinických studiích bylo prokázáno, že současné užívání duloxetinu se silnými inhibitory izozymu CYP450 1A2, jako je fluvoxamin, může vést k 5násobnému zvýšení průměrné AUC a 2,5násobnému zvýšení průměrné Cmax duloxetinu.
lidokain
Ve studii provedené na 9 zdravých dobrovolnících vedlo současné užívání 1,5 mg/kg lidokainu IV s CIPRO 500 mg dvakrát denně ke zvýšení Cmax lidokainu o 12 % a AUC o 26 %. I když byla léčba lidokainem při této zvýšené expozici dobře tolerována, při současném podávání se může objevit možná interakce s CIPRO a zvýšení nežádoucích účinků souvisejících s lidokainem.
metoklopramid
Metoklopramid významně urychluje absorpci perorálního cipro 750 mgfloxacinu, což má za následek kratší dobu k dosažení maximálních plazmatických koncentrací. Nebyl pozorován žádný významný vliv na biologickou dostupnost ciprofloxacinu.
omeprazol
Když byl CIPRO podáván jako jednorázová dávka 1000 mg současně s omeprazolem (40 mg jednou denně po dobu tří dnů) 18 zdravým dobrovolníkům, průměrná AUC a Cmax ciprofloxacinu byly sníženy o 20 % a 23 %. Klinický význam této interakce nebyl stanoven.
Mikrobiologie
Mechanismus působení
Baktericidní účinek cipro 750 mgfloxacinu je výsledkem inhibice enzymů topoizomerázy II (DNA gyráza) a topoizomerázy IV (oba topoizomerázy typu II), které jsou nezbytné pro replikaci, transkripci, opravu a rekombinaci bakteriální DNA.
Mechanismus Odporu
Mechanismus účinku fluorochinolonů, včetně ciprofloxacinu, je odlišný od mechanismu účinku penicilinů, cefalosporinů, aminoglykosidů, makrolidů a tetracyklinů; proto mikroorganismy rezistentní na tyto skupiny léků mohou být citlivé na ciprofloxacin. Rezistence k fluorochinolonům nastává primárně buď mutacemi v DNA gyrázách, sníženou permeabilitou vnější membrány nebo efluxem léčiva. In vitro rezistence k ciprofloxacinu se vyvíjí pomalu vícestupňovými mutacemi. Rezistence na ciprofloxacin v důsledku spontánních mutací se vyskytuje s obecnou frekvencí mezi
Křížový odpor
Není známá zkřížená rezistence mezi cipro 1000 mgfloxacinem a jinými třídami antimikrobiálních látek.
Bylo prokázáno, že ciprofloxacin je účinný proti většině izolátů následujících bakterií, a to jak in vitro, tak při klinických infekcích (viz INDIKACE A POUŽITÍ ].
Gram-pozitivní bakterie
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (pouze izoláty citlivé na meticilin) Staphylococcus epidermidis (pouze izoláty citlivé na meticilin) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Gram-negativní bakterie
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám. Nejméně 90 procent následujících bakterií vykazuje in vitro minimální inhibiční koncentraci (MIC) menší nebo rovnou prahu citlivosti pro cipro 750 mgfloxacin proti izolátům podobného rodu nebo skupiny organismů. Účinnost cipro 500 mgfloxacinu při léčbě klinických infekcí způsobených těmito bakteriemi však nebyla prokázána v adekvátních a dobře kontrolovaných klinických studiích.
Gram-pozitivní bakterie
Staphylococcus haemolyticus (pouze izoláty citlivé na meticilin) Staphylococcus hominis (pouze izoláty citlivé na meticilin)
Gram-negativní bakterie
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Testování citlivosti
Konkrétní informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: https://www.fda.gov/STIC.
Klinické studie
Komplikovaná infekce močových cest a pyelonefritida – účinnost u dětských pacientů
CIPRO podávaný intravenózně a/nebo perorálně byl srovnáván s cefalosporinem pro léčbu cUTI a pyelonefritidy u pediatrických pacientů ve věku 1 až 17 let (průměrný věk 6 ± 4 roky). Zkouška byla provedena v USA, Kanadě, Argentině, Peru, Kostarice, Mexiku, Jižní Africe a Německu. Délka léčby byla 10 až 21 dnů (průměrná délka léčby byla 11 dnů s rozmezím 1 až 88 dnů). Primárním cílem studie bylo posoudit muskuloskeletální a neurologickou bezpečnost.
pacientů byl hodnocen klinický úspěch a bakteriologická eradikace základního organismu (organismů) bez nové infekce nebo superinfekce 5 až 9 dnů po terapii (Test of Cure nebo TOC). Populace podle protokolu měla původce organismu (organismy) s protokolem specifikovaným počtem kolonií na začátku, bez porušení protokolu a bez předčasného přerušení nebo ztráty sledování (mimo jiných kritérií).
Klinický úspěch a míra bakteriologické eradikace v populaci podle protokolu byly podobné mezi CIPRO 250 mg a srovnávací skupinou, jak je uvedeno níže.
Inhalační Antrax U Dospělých A Pediatrie
Průměrné sérové koncentrace ciprofloxacinu spojené se statisticky významným zlepšením přežití v modelu inhalačního antraxu u opice rhesus jsou dosaženy nebo překročeny u dospělých a pediatrických pacientů užívajících perorální a intravenózní režimy. Farmakokinetika Cipro 500 mgfloxacinu byla hodnocena u různých lidských populací. Průměrná maximální koncentrace v séru dosažená v ustáleném stavu u dospělých lidí, kteří dostávali 500 mg perorálně každých 12 hodin, je 2,97 mcg/ml a 4,56 mcg/ml po 400 mg intravenózně každých 12 hodin. Průměrná minimální koncentrace v séru v ustáleném stavu pro oba tyto režimy je 0,2 mcg/ml. Ve studii s 10 pediatrickými pacienty ve věku od 6 do 16 let byla průměrná dosažená maximální plazmatická koncentrace 8,3 mcg/ml a minimální koncentrace se pohybovaly od 0,09 mcg/ml do 0,26 mcg/ml po dvou 30minutových intravenózních infuzích 10 mg/kg podávaných s odstupem 12 hodin. Po druhé intravenózní infuzi pacienti převedení na 15 mg/kg perorálně každých 12 hodin dosáhli průměrné maximální koncentrace 3,6 mcg/ml po úvodní perorální dávce. Údaje o dlouhodobé bezpečnosti, včetně účinků na chrupavku, po podání přípravku CIPRO dětským pacientům jsou omezené. Sérové koncentrace Cipro 1000 mgfloxacinu dosažené u lidí slouží jako náhradní koncový bod, který pravděpodobně předpovídá klinický přínos a poskytuje základ pro tuto indikaci.1
Byla provedena placebem kontrolovaná studie na zvířatech na opicích rhesus vystavených inhalační průměrné dávce 11 LD50 (~5,5 x 105 spor (rozmezí 5 – 30 LD50) B. anthracis. Minimální inhibiční koncentrace (MIC) cipro 250 mgfloxacinu pro kmen antraxu použitý v této studii byl 0,08 mcg/ml. U studovaných zvířat byly průměrné sérové koncentrace cipro 1000 mgfloxacinu dosažené při očekávaném Tmax (1 hodina po dávce) po perorálním podání do ustáleného stavu v rozmezí od 0,98 mcg/ml do 1,69 Průměrné minimální koncentrace v ustáleném stavu 12 hodin po dávce se pohybovaly od 0,12 mcg/ml do 0,19 mcg/ml.6 Úmrtnost způsobená antraxem u zvířat, která dostávala 30denní režim perorálního cipro 750 mg 4 hodiny po začátku 2. - expozice byla významně nižší (1/9) ve srovnání se skupinou s placebem (9/10) [p= 0,001] Jedno zvíře léčené CIPRO, které zemřelo na antrax, tak učinilo po 30denním období podávání léku.7
Více než 9300 osobám bylo doporučeno absolvovat minimálně 60denní antibakteriální profylaxi proti možné inhalační expozici B. anthracis během roku 2001. Většině těchto jedinců bylo doporučeno CIPRO 250 mg pro celý režim profylaxe nebo jeho část. Některým osobám byla také podána vakcína proti antraxu nebo byly převedeny na alternativní antibakteriální léky. U nikoho, kdo dostával CIPRO 1000 mg nebo jiné terapie jako profylaktickou léčbu, se následně nevyvinul inhalační antrax. Počet osob, které dostaly CIPRO jako celek nebo část svého režimu postexpoziční profylaxe, není znám.
Mor
Byla provedena placebem kontrolovaná studie na zvířatech na afrických zelených opicích vystavených inhalační průměrné dávce 110 LD50 (rozmezí 92 až 127 LD50) Yersinia pestis (kmen CO92). Minimální inhibiční koncentrace (MIC) ciprofloxacinu pro kmen Y. pestis použitý v této studii byla 0,015 mcg/ml. Průměrné maximální sérové koncentrace ciprofloxacinu dosažené na konci jedné 60minutové infuze byly 3,49 ± mcg/ml 0,55 mcg/ml, 3,91 mcg/ml ± 0,58 mcg/ml a 4,03 mcg/ml v den 1,2 ml ± 2 mL ± Den 6 a den 10 léčby u afrických zelených opic, v tomto pořadí Všechny minimální koncentrace (den 2, den 6 a den 10) byly
Toxikologie zvířat a/nebo farmakologie
Bylo prokázáno, že Cipro 250 mgfloxacin a další chinolony způsobují artropatii u nezralých zvířat většiny testovaných druhů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Poškození nosných kloubů bylo pozorováno u mladých psů a potkanů. U mladých bíglů způsobilo 100 mg/kg ciprofloxacinu podávané denně po dobu 4 týdnů degenerativní kloubní změny kolenního kloubu. Při dávce 30 mg/kg byl účinek na kloub minimální. V následné studii na mladých psech bígla způsobily perorální dávky cipro 750 mgfloxacinu 30 mg/kg a 90 mg/kg cipro 750 mgfloxacin (přibližně 1,3násobek a 3,5násobek pediatrické dávky na základě srovnávacích plazmatických AUC) podávané denně po dobu 2 týdnů změny, které byly histopatologicky pozorovány i po období 5 měsíců bez léčby. Při dávce 10 mg/kg (přibližně 0,6násobek pediatrické dávky na základě srovnávacích plazmatických AUC) nebyly pozorovány žádné účinky na klouby. Tato dávka také nebyla spojena s artrotoxicitou po dalších 5 měsících bez léčby. V jiné studii odstranění zátěže z kloubu snížilo léze, ale zcela jim nezabránilo.
laboratorních zvířat, kterým byl podáván ciprofloxacin, se vyskytuje krystalurie, někdy spojená se sekundární nefropatií. Souvisí to především se sníženou rozpustností ciprofloxacinu za alkalických podmínek, které převažují v moči pokusných zvířat; u člověka je krystalurie vzácná, protože lidská moč je typicky kyselá. U opic rhesus byla krystalurie bez nefropatie zaznamenána po jednotlivých perorálních dávkách tak nízkých, jako je 5 mg/kg. (přibližně 0,07násobek nejvyšší doporučené terapeutické dávky na základě tělesného povrchu). Po 6 měsících intravenózního podávání 10 mg/kg/den nebyly zaznamenány žádné nefropatologické změny; nefropatie však byla pozorována po dávkování 20 mg/kg/den po stejnou dobu (přibližně 0,2násobek nejvyšší doporučené terapeutické dávky na základě tělesného povrchu).
psů vyvolává ciprofloxacin v dávce 3 mg/kg a 10 mg/kg rychlou intravenózní injekcí (15 sekund) výrazné hypotenzní účinky. Tyto účinky se považují za související s uvolňováním histaminu, protože jsou částečně antagonizovány pyrilaminem, antihistaminikem. U opic rhesus vyvolává rychlá intravenózní injekce také hypotenzi, ale účinek u tohoto druhu je nekonzistentní a méně výrazný.
U myší bylo hlášeno, že současné podávání nesteroidních protizánětlivých léků, jako je fenylbutazon a indomethacin s chinolony, zvyšuje stimulační účinek chinolonů na CNS.
Oční toxicita pozorovaná u některých příbuzných léků nebyla u zvířat léčených ciprofloxacinem pozorována
REFERENCE
1. 21 CFR 314.510 (Podčást H – Zrychlené schvalování nových léků pro život ohrožující nemoci).
5. Zpráva předložená na zasedání poradního výboru FDA pro antiinfekční léčiva a dermatologické léčivé přípravky, 31. března 1993, Silver Spring, MD. Zpráva je k dispozici od FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, USA.
6. Kelly DJ a kol. Sérové koncentrace penicilinu, doxycyklinu a ciprofloxacinu během dlouhodobé terapie u opic rhesus. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, a kol. Postexpoziční profylaxe proti experimentálnímu inhalačnímu antraxu. J Infect Dis 1993; 167:1239-42.
8. Zasedání poradního výboru pro antiinfekční léky, 3. dubna 2012 - Účinnost ciprofloxacinu při léčbě pneumonického moru.
INFORMACE PRO PACIENTA
CIPRO® (Sip-row) (ciprofloxacin hydrochlorid) tablety, pro perorální podání
CIPRO® (Sip-row) (cipro 1000 mgfloxacin) pro perorální suspenzi
Než začnete užívat přípravek CIPRO 500 mg a pokaždé, když dostanete náhradní náplň, přečtěte si tento Průvodce léčivými přípravky. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o CIPRO 500 mg?
CIPRO, fluorochinolonový antibakteriální lék, může způsobit závažné nežádoucí účinky. Některé z těchto závažných vedlejších účinků se mohou vyskytnout současně a mohou mít za následek smrt.
Pokud se u Vás během užívání přípravku CIPRO vyskytne některý z následujících závažných nežádoucích účinků, měli byste okamžitě přestat užívat přípravek CIPRO 750 mg a okamžitě vyhledat lékařskou pomoc.
1. Ruptura šlachy nebo otok šlachy (tendinitida).
- Problémy se šlachami se mohou vyskytnout u lidí všech věkových kategorií, kteří užívají CIPRO. Šlachy jsou pevné provazce tkáně, které spojují svaly s kostmi. Příznaky problémů se šlachami mohou zahrnovat:
- bolest
- otok
- slzy a otoky šlach včetně zadní části kotníku (Achilles), ramene, ruky, palce nebo jiných šlach.
- Riziko vzniku problémů se šlachami během užívání přípravku CIPRO je vyšší, pokud:
- jsou starší 60 let
- užíváte steroidy (kortikosteroidy)
- podstoupili transplantaci ledvin, srdce nebo plic.
- Problémy se šlachami se mohou objevit u lidí, kteří nemají výše uvedené rizikové faktory, když užívají CIPRO.
- Další důvody, které mohou zvýšit vaše riziko problémů se šlachami, mohou zahrnovat:
- fyzická aktivita nebo cvičení
- selhání ledvin
- problémy se šlachami v minulosti, například u lidí s revmatoidní artritidou (RA).
- Okamžitě přestaňte užívat přípravek CIPRO a okamžitě vyhledejte lékařskou pomoc při prvních známkách bolesti, otoku nebo zánětu šlach. Nejčastější oblastí bolesti a otoku je Achillova šlacha na zadní straně kotníku. To se může stát i u jiných šlach.
- K ruptuře šlachy může dojít během užívání přípravku CIPRO nebo po jeho ukončení. K ruptuře šlach může dojít během hodin nebo dnů po užití přípravku CIPRO a došlo k nim až několik měsíců poté, co lidé ukončili užívání fluorochinolonu.
- Okamžitě přestaňte užívat přípravek CIPRO 500 mg a okamžitě vyhledejte lékařskou pomoc, pokud se u Vás objeví některý z následujících příznaků nebo příznaků ruptury šlachy:
- slyšet nebo cítit prasknutí nebo prasknutí v oblasti šlach
- modřiny hned po zranění v oblasti šlach
- neschopný pohybovat postiženou oblastí nebo nést váhu
Problémy se šlachami mohou být trvalé.
2. Změny čití a možné poškození nervů (periferní neuropatie). U lidí, kteří užívají fluorochinolony, včetně CIPRO, může dojít k poškození nervů v pažích, rukou, nohou nebo chodidlech. Okamžitě přestaňte užívat přípravek CIPRO 750 mg a okamžitě se poraďte se svým poskytovatelem zdravotní péče, pokud se u Vás objeví některý z následujících příznaků periferní neuropatie na pažích, rukou, nohou nebo chodidlech:
- bolest
- necitlivost
- hořící
- slabost
- mravenčení
CIPRO 500 mg může být nutné přerušit, aby se zabránilo trvalému poškození nervů.
3. Účinky na centrální nervový systém (CNS). Problémy s duševním zdravím a záchvaty byly hlášeny u lidí, kteří užívali fluorochinolonové antibakteriální léky, včetně CIPRO. Než začnete užívat přípravek CIPRO, informujte svého poskytovatele zdravotní péče, pokud máte v anamnéze záchvaty. Nežádoucí účinky na CNS se mohou objevit ihned po užití první dávky přípravku CIPRO. Okamžitě přestaňte užívat přípravek CIPRO a okamžitě se poraďte se svým poskytovatelem zdravotní péče, pokud zaznamenáte některý z těchto nežádoucích účinků nebo jiné změny nálady nebo chování:
- záchvaty
- problémové spaní
- slyšet hlasy, vidět věci nebo cítit věci, které tam nejsou (halucinace)
- noční můry
- pociťovat točení hlavy nebo závratě
- cítit se rozrušený
- cítit se podezřívavější (paranoia)
- otřesy
- sebevražedné myšlenky nebo činy
- cítit úzkost nebo nervozitu
- bolesti hlavy, které nezmizí, s nebo bez
- zmatenost rozmazané vidění
- Deprese
- problémy s pamětí
- snížené povědomí o okolí
- falešné nebo podivné myšlenky nebo přesvědčení (klamy)
Tyto změny mohou být trvalé.
4. Zhoršení myasthenia gravis (problém, který způsobuje svalovou slabost). Fluorochinolony jako CIPRO 500 mg mohou způsobit zhoršení příznaků myasthenia gravis, včetně svalové slabosti a problémů s dýcháním. Informujte svého poskytovatele zdravotní péče, pokud máte v anamnéze myasthenia gravis, než začnete užívat přípravek CIPRO. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u vás zhorší svalová slabost nebo problémy s dýcháním.
Co je CIPRO 750 mg?
CIPRO je fluorochinolonový antibakteriální lék používaný u dospělých ve věku 18 let a starších k léčbě určitých infekcí způsobených určitými zárodky nazývanými bakterie. Mezi tyto bakteriální infekce patří:
-
- Infekce močových cest
- infekce kostí a kloubů
- cervikální a uretrální kapavka, nekomplikovaná
- chronická infekce prostaty
- nozokomiální pneumonie
- lidé s nízkým počtem bílých krvinek a horečkou
- infekce dolních cest dýchacích
- intraabdominální infekce, komplikovaná
- inhalační antrax
- sinusová infekce
- infekční průjem
- mor
- kožní infekce
- tyfus (enterická) horečka
- Studie CIPRO 1000 mg pro použití při léčbě moru a antraxu byly provedeny pouze na zvířatech, protože mor a antrax nebylo možné studovat u lidí.
- CIPRO 250 mg by neměly užívat osoby s akutní exacerbací chronické bronchitidy, akutní nekomplikovanou cystitidou a infekcemi dutin, pokud jsou k dispozici jiné možnosti léčby.
- CIPRO 750 mg by se neměl používat jako antibakteriální lék první volby k léčbě infekcí dolních cest dýchacích způsobených určitým typem bakterií zvaným Streptococcus pneumoniae.
- CIPRO 1000 mg se také používá u dětí mladších 18 let k léčbě komplikovaných infekcí močových cest a ledvin nebo kteří mohli vdechnout zárodky antraxu, mít mor nebo byli vystaveni zárodkům moru.
- Děti mladší 18 let mají větší šanci, že při užívání přípravku CIPRO dostanou problémy s kostmi, klouby nebo šlachami (muskuloskeletální) jako je bolest nebo otoky. CIPRO 500 mg by neměl být používán jako antibakteriální lék první volby u dětí do 18 let.
Kdo by neměl užívat CIPRO 1000 mg?
Neužívejte přípravek CIPRO 500 mg, pokud:
- jste někdy měli závažnou alergickou reakci na antibakteriální lék známý jako fluorochinolon nebo jste alergický(á) na cipro 500 mgfloxacin hydrochlorid nebo na kteroukoli složku přípravku CIPRO. Úplný seznam složek v CIPRO naleznete na konci této Příručky pro léky.
- užívejte také lék nazývaný tizanidin (Zanaflex®). Pokud si nejste jisti, zeptejte se svého poskytovatele zdravotní péče.
Co bych měl říci svému poskytovateli zdravotní péče, než začnu užívat přípravek CIPRO?
Než začnete užívat přípravek CIPRO, informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- mít problémy se šlachami. Přípravek CIPRO by neměli užívat lidé, kteří mají v minulosti problémy se šlachami.
- máte onemocnění, které způsobuje svalovou slabost (myasthenia gravis). Přípravek CIPRO by neměli užívat lidé, kteří mají v anamnéze myasthenia gravis.
- mít problémy s játry.
- máte problémy s centrálním nervovým systémem (jako je epilepsie).
- mít nervové problémy. CIPRO 500 mg by neměli užívat lidé, kteří mají v anamnéze nervový problém nazývaný periferní neuropatie nebo kdokoli z vaší rodiny má nepravidelný srdeční tep nebo srdeční záchvat, zvláště stav nazývaný „prodloužení QT intervalu“.
- máte nízkou hladinu draslíku v krvi (hypokalémie) nebo nízkou hladinu hořčíku (hypomagnezémii).
- máte nebo jste měli záchvaty.
- mít problémy s ledvinami. Pokud vaše ledviny nepracují dobře, možná budete potřebovat nižší dávku přípravku CIPRO 500 mg.
- máte cukrovku nebo problémy s nízkou hladinou cukru v krvi (hypoglykémie).
- máte problémy s klouby včetně revmatoidní artritidy (RA).
- mít potíže s polykáním pilulek.
- jste těhotná nebo plánujete otěhotnět. Není známo, zda CIPRO 250 mg poškodí vaše nenarozené dítě.
- kojíte nebo plánujete kojit. CIPRO 250 mg přechází do mateřského mléka.
- Během léčby přípravkem CIPRO 500 mg a 2 dny po užití poslední dávky přípravku CIPRO byste neměla kojit. Během léčby přípravkem CIPRO a 2 dny po užití poslední dávky přípravku CIPRO můžete své mateřské mléko odsát a vyhodit.
- Pokud užíváte přípravek CIPRO k inhalačnímu antraxu, měli byste se vy a váš poskytovatel zdravotní péče rozhodnout, zda můžete během užívání přípravku CIPRO pokračovat v kojení.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
- CIPRO 1000 mg a další léky se mohou vzájemně ovlivňovat a způsobit nežádoucí účinky.
- Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- steroidní lék.
- antipsychotický lék.
- tricyklické antidepresivum.
- pilulka na vodu (diuretikum).
- theofylin (jako Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- lék na kontrolu srdeční frekvence nebo rytmu (antiarytmika).
- perorální lék proti cukrovce.
- fenytoin (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Phenytoin Sodium®, Prompt Phenytoin Sodium®, Phenytek®).
- cyklosporin (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- ředidlo krve (jako je warfarin, Coumadin®, Jantoven®).
- methotrexát (Trexall®).
- ropinirol (Requip®).
- klozapin (Clozaril®, Fazaclo® ODT®).
- nesteroidní protizánětlivý lék (NSAID). Mnoho běžných léků na úlevu od bolesti jsou NSAID. Užívání NSAID během užívání přípravku CIPRO 500 mg nebo jiných fluorochinolonů může zvýšit riziko účinků na centrální nervový systém a záchvatů.
- sildenafil (Viagra®, Revatio®).
- duloxetin.
- produkty, které obsahují kofein.
- probenecid (Probalan®, Col-probenecid®).
- Některé léky mohou bránit správnému účinku tablet CIPRO a perorální suspenze CIPRO. Užívejte CIPRO tablety a perorální suspenzi buď 2 hodiny před nebo 6 hodin po užití těchto léků, vitamínů nebo doplňků:
- antacidum, multivitamin nebo jiný lék nebo doplňky, které obsahují hořčík, vápník, hliník, železo nebo zinek.
- sukralfát (Carafate®).
- didanosin (Videx®, Videx EC®).
Pokud si nejste jisti, požádejte svého poskytovatele zdravotní péče o seznam těchto léků.
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat CIPRO 500 mg?
- Užívejte CIPRO přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- Váš poskytovatel zdravotní péče vám řekne, jaké množství přípravku CIPRO máte užívat a kdy ho užívat.
- CIPRO lze užívat s jídlem nebo bez jídla.
- CIPRO se nesmí užívat s mléčnými výrobky (jako je mléko nebo jogurt) nebo samotnými šťávami obohacenými vápníkem, ale lze je užívat s jídlem, které tyto produkty obsahuje.
- Při užívání přípravku CIPRO pijte hodně tekutin.
- Nevynechávejte žádné dávky přípravku CIPRO ani jej nepřestávejte užívat, i když se začnete cítit lépe, dokud nedokončíte předepsanou léčbu, pokud:
- máte problémy se šlachami. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o CIPRO?"
- máte nervové problémy. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o CIPRO?"
- máte problémy s centrálním nervovým systémem. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o CIPRO 1000 mg?"
- máte závažnou alergickou reakci. Vidět Jaké jsou možné vedlejší účinky přípravku CIPRO 750 mg?
- váš poskytovatel zdravotní péče vám řekl, abyste přestali užívat přípravek CIPRO.
Užívání všech vašich dávek CIPRO pomůže zajistit, že všechny bakterie budou zabity. Užívání všech vašich dávek CIPRO pomůže snížit pravděpodobnost, že se bakterie stanou odolnými vůči CIPRO. Pokud se stanete rezistentní vůči CIPRO, CIPRO 1000 mg a další antibakteriální léky u vás v budoucnu nemusí fungovat.
-
Pokud užijete příliš mnoho CIPRO 750 mg, zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc.
-
CIPRO se dodává jako tableta s rýhou (CIPRO 1000 mg tablety), perorální suspenze (CIPRO 750 mg perorální suspenze), tableta s prodlouženým uvolňováním (CIPRO XR) a injekce pro intravenózní infuzi (CIPRO IV). Přečtěte si a dodržujte níže uvedené pokyny pro typ CIPRO 500 mg, který vám lékař předepsal.
Tablety CIPRO:
- Tablety CIPRO se dodávají jako 250mg a 500mg tablety s půlicí rýhou, které lze užívat celé nebo je lze rozlomit na poloviny v místě půlicí rýhy. Váš poskytovatel zdravotní péče vám sdělí, jaké množství CIPRO 500 mg tablety máte užívat a zda budete muset CIPRO 1000 mg tablety rozdělit na polovinu, abyste dostali předepsanou dávku.
- Tablety CIPRO užívejte ráno a večer každý den přibližně ve stejnou dobu. Tabletu nedrťte ani nežvýkejte. Pokud nemůžete tabletu spolknout, informujte svého poskytovatele zdravotní péče.
- Jestliže vynecháte dávku přípravku CIPRO 500 mg tablety a je to:
- 6 hodin nebo více až do vaší další plánované dávky, vezměte si vynechanou dávku ihned. Poté si vezměte další dávku v obvyklou dobu.
- méně než 6 hodin do vaší další plánované dávky neužívejte vynechanou dávku. Užijte další dávku v obvyklou dobu.
- Neužívejte 2 dávky přípravku CIPRO 750 mg tablety najednou, abyste nahradili vynechanou dávku. Pokud si nejste jistý/á, kdy máte užít přípravek CIPRO 500 mg tablety po vynechané dávce, zeptejte se svého poskytovatele zdravotní péče nebo lékárníka.
CIPRO perorální suspenze:
- Užívejte CIPRO 1000 mg perorální suspenze ráno a večer každý den přibližně ve stejnou dobu. Před každým použitím lahvičku CIPRO 750 mg perorální suspenze dobře protřepejte po dobu asi 15 sekund, abyste se ujistili, že je suspenze dobře promíchána. Po použití lahvičku úplně uzavřete.
- Jestliže vynecháte dávku přípravku CIPRO perorální suspenze a je to:
- 6 hodin nebo více až do vaší další plánované dávky, vezměte si vynechanou dávku ihned. Poté si vezměte další dávku v obvyklou dobu.
- méně než 6 hodin do vaší další plánované dávky neužívejte vynechanou dávku. Užijte další dávku v obvyklou dobu.
- Neužívejte 2 dávky přípravku CIPRO 750 mg perorální suspenze najednou, abyste nahradili vynechanou dávku. Pokud si nejste jisti, kdy máte užít perorální suspenzi CIPRO po vynechané dávce, zeptejte se svého poskytovatele zdravotní péče nebo lékárníka.
Čemu se mám vyhnout při užívání přípravku CIPRO?
- CIPRO 250 mg vám může způsobit závrať a točení hlavy. Neřiďte, neobsluhujte stroje ani neprovádějte jiné činnosti, které vyžadují duševní bdělost nebo koordinaci, dokud nezjistíte, jak na vás CIPRO 250 mg působí.
- Vyhněte se slunečním paprskům, soláriím a snažte se omezit čas na slunci. CIPRO 500 mg může způsobit, že vaše pokožka bude citlivá na slunce (fotosenzitivita) a na světlo ze slunečních lamp a solárií. Mohli byste se vážně spálit, způsobit puchýře nebo otok kůže. Pokud se u Vás během užívání přípravku CIPRO 250 mg objeví některý z těchto příznaků, ihned kontaktujte svého poskytovatele zdravotní péče. Pokud musíte být na slunci, měli byste používat opalovací krém a nosit klobouk a oblečení, které vám zakryje pokožku.
Jaké jsou možné vedlejší účinky přípravku CIPRO?
CIPRO může způsobit závažné nežádoucí účinky, včetně:
- Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o CIPRO?"
- Závažné alergické reakce. U lidí užívajících fluorochinolony, včetně přípravku CIPRO, se mohou vyskytnout závažné alergické reakce, včetně úmrtí, i po pouhé 1 dávce. Přestaňte užívat přípravek CIPRO a okamžitě vyhledejte lékařskou pomoc, pokud se u Vás objeví některý z následujících příznaků závažné alergické reakce:
- kopřivka
- rychlý srdeční tep
- potíže s dýcháním nebo polykáním
- chabý
- otok rtů, jazyka, obličeje
- vyrážka
- svírání hrdla, chrapot
Kožní vyrážka se může objevit u lidí užívajících CIPRO 1000 mg již po 1 dávce. Přestaňte užívat přípravek CIPRO 500 mg při prvních známkách kožní vyrážky a zavolejte svého poskytovatele zdravotní péče. Kožní vyrážka může být známkou závažnější reakce na CIPRO.
- Poškození jater (hepatotoxicita). U lidí, kteří užívají CIPRO, se může vyskytnout hepatotoxicita. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte nevysvětlitelné příznaky, jako jsou:
- nevolnost nebo zvracení
- neobvyklá únava
- bolest břicha
- ztráta chuti k jídlu
- horečka
- světlé pohyby střev
- slabost
- tmavě zbarvená moč
- bolest nebo citlivost břicha
- zežloutnutí kůže a očního bělma
- svědění
Přestaňte užívat přípravek CIPRO 750 mg a okamžitě informujte svého poskytovatele zdravotní péče, pokud máte zežloutnou kůži nebo bílou část očí nebo pokud máte tmavou moč. Mohou to být příznaky závažné reakce na CIPRO (problém s játry).
- Aneuryzma aorty a disekce. Informujte svého poskytovatele zdravotní péče, pokud vám bylo někdy řečeno, že máte aneuryzma aorty, otok velké tepny, která vede krev ze srdce do těla. Okamžitě vyhledejte lékařskou pomoc, pokud máte náhlou bolest na hrudi, žaludku nebo zádech.
- Střevní infekce (Clostridioides difficile – přidružený průjem). Průjem související s Clostridioides difficile (CDAD) se může objevit u mnoha antibakteriálních léků, včetně přípravku CIPRO. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud dostanete vodnatý průjem, průjem, který nezmizí, nebo krvavou stolici. Můžete mít žaludeční křeče a horečku. CDAD se může objevit 2 nebo více měsíců poté, co jste dokončili svůj antibakteriální lék.
- Závažné změny srdečního rytmu (prodloužení QT intervalu a torsade de pointes). Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte změnu srdečního tepu (rychlý nebo nepravidelný srdeční tep) nebo pokud omdlíte. CIPRO může způsobit vzácný srdeční problém známý jako prodloužení QT intervalu. Tento stav může způsobit abnormální srdeční tep a může být velmi nebezpečný. Šance na tuto událost je vyšší u lidí:
- kteří jsou starší.
- s rodinnou anamnézou prodlouženého QT intervalu.
- s nízkou hladinou draslíku v krvi (hypokalémie) nebo nízkou hladinou hořčíku (hypomagnezémie).
- kteří užívají určité léky na kontrolu srdečního rytmu (antiarytmika).
- Problémy s klouby. U dětí mladších 18 let může nastat zvýšená pravděpodobnost problémů s klouby a tkáněmi kolem kloubů. Informujte poskytovatele zdravotní péče svého dítěte, pokud má vaše dítě během léčby nebo po léčbě přípravkem CIPRO nějaké problémy s klouby.
- Citlivost na sluneční světlo (fotosenzitivita). Viz "Čemu se mám vyvarovat při užívání přípravku CIPRO 250 mg?"
- Změny hladiny cukru v krvi. Lidé, kteří užívají CIPRO a další fluorochinolonové léky s perorálními léky proti cukrovce nebo s inzulínem, mohou mít nízkou hladinu cukru v krvi (hypoglykémii) a vysokou hladinu cukru v krvi (hyperglykémii). Postupujte podle pokynů svého poskytovatele zdravotní péče, jak často kontrolovat hladinu cukru v krvi. Pokud máte cukrovku a máte nízkou hladinu cukru v krvi během užívání přípravku CIPRO, přestaňte přípravek CIPRO užívat a ihned kontaktujte svého poskytovatele zdravotní péče. Váš antibiotický lék může být nutné změnit.
Mezi nejčastější vedlejší účinky přípravku CIPRO 750 mg patří:
- nevolnost
- průjem
- změny jaterních funkčních testů
- zvracení
- vyrážka
Informujte svého poskytovatele zdravotní péče o jakémkoli nežádoucím účinku, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku CIPRO. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat CIPRO?
CIPRO 500 mg tablety
- Skladujte při pokojové teplotě mezi 68°F až 77°F (20°C až 25°C).
CIPRO 750 mg perorální suspenze
- Mikrokapsle a ředidlo skladujte při pokojové teplotě do 77 °F (25 °C).
- Chraňte před mrazem.
- Po ukončení léčby přípravkem CIPRO bezpečně zlikvidujte veškerou nepoužitou perorální suspenzi.
Uchovávejte CIPRO 250 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání CIPRO.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte CIPRO pro stav, pro který není předepsán. Nedávejte CIPRO jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léčivy shrnuje nejdůležitější informace o přípravku CIPRO. Pokud byste chtěli více informací o CIPRO, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku CIPRO 250 mg, který je určen pro zdravotníky.
Jaké jsou složky v CIPRO 500 mg?
CIPRO 1000 mg tablety:
- Aktivní složka: cipro 250 mg floxacinu hydrochloridu
- Neaktivní složky: kukuřičný škrob, krospovidon, hypromelóza, stearát hořečnatý, mikrokrystalická celulóza, polyethylenglykol, oxid křemičitý a oxid titaničitý.
CIPRO perorální suspenze:
- Aktivní složka: ciprofloxacin
- Neaktivní složky:
- Mikrokapsle obsahují: hypromelóza, stearát hořečnatý, kopolymer kyseliny methakrylové a polysorbát 20 a povidon.
- Ředidlo obsahuje: triglyceridy se středně dlouhým řetězcem, sacharóza, sójový lecitin, voda a jahodová příchuť.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
