Levaquin 250mg, 500mg, 750mg Levofloxacin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Levaquin 750 mg a jak se používá?
Levaquin je lék na předpis používaný k léčbě příznaků různých bakteriálních infekcí. Levaquin lze užívat samostatně nebo s jinými léky.
Levaquin 500 mg patří do třídy léků nazývaných fluorochinolony.
Není známo, zda je přípravek Levaquin bezpečný a účinný u dětí při léčbě trvající déle než 14 dní.
Jaké jsou možné vedlejší účinky přípravku Levaquin 500 mg?
Levaquin 750 mg může způsobit závažné nežádoucí účinky, včetně:
- bolest hlavy,
- hlad,
- pocení,
- podrážděnost,
- závrať,
- nevolnost,
- rychlý srdeční tep,
- pocit úzkosti nebo rozechvění,
- necitlivost nebo mravenčení v rukou, pažích, nohou nebo chodidlech,
- slabost v pažích, rukou, nohou nebo chodidlech,
- palčivá bolest paží, rukou, nohou nebo chodidel,
- vážné změny nálady nebo chování,
- nervozita,
- zmatek,
- míchání,
- paranoia,
- halucinace,
- problémy s pamětí,
- potíže se soustředěním,
- myšlenky na sebevraždu,
- ruptura šlachy,
- náhlá bolest,
- otok,
- modřiny,
- něha,
- ztuhlost,
- pohybové problémy,
- praskání nebo praskání v kterémkoli z vašich kloubů,
- silná bolest žaludku,
- průjem, který je vodnatý nebo krvavý,
- chvění v tvé hrudi,
- dušnost,
- vyrážka,
- dýchací problémy,
- záchvaty (křeče),
- silné bolesti hlavy,
- problémy se zrakem,
- bolest za očima,
- bolest v horní části žaludku,
- ztráta chuti k jídlu,
- tmavá moč,
- stolice hliněné barvy, a
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Levaquin 250 mg patří:
- nevolnost,
- zácpa,
- průjem,
- bolest hlavy,
- závratě a
- problémové spaní
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Levaquin. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
ZÁVAŽNÉ NEŽÁDOUCÍ ÚČINKY VČETNĚ TENDINITIDY, RUPCE ŠLACH, PERIFERNÍ NEUROPATIE, ÚČINKY NA CENTRÁLNÍ NERVOVÝ SYSTÉM A EXACERBACE MYASTHENIA GRAVIS
- Fluorochinolony, včetně LEVAQUIN®, byly spojovány s invalidizujícími a potenciálně ireverzibilními závažnými nežádoucími reakcemi, které se vyskytly společně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ), včetně:
- Tendinitida a ruptura šlachy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ)
- Periferní neuropatie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ]
- Účinky na centrální nervový systém (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ)
Okamžitě přerušte podávání přípravku LEVAQUIN® a vyvarujte se užívání fluorochinolonů, včetně přípravku LEVAQUIN®, u pacientů, u kterých se vyskytne některý z těchto závažných nežádoucích účinků (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
- Fluorochinolony, včetně přípravku LEVAQUIN®, mohou u pacientů s myasthenia gravis zhoršit svalovou slabost. Vyhněte se LEVAQUINU® u pacientů se známou anamnézou myasthenia gravis [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Protože fluorochinolony, včetně LEVAQUIN®, byly spojeny se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], vyhraďte LEVAQUIN® pro použití u pacientů, kteří nemají žádné alternativní možnosti léčby pro následující indikace:
- Nekomplikovaná infekce močových cest [viz INDIKACE ]
- Akutní bakteriální exacerbace chronické bronchitidy [viz INDIKACE ]
- Akutní bakteriální sinusitida [viz INDIKACE ].
POPIS
Tablety LEVAQUIN® jsou syntetické antibakteriální látky pro perorální podání. Chemicky je levofloxacin, chirální fluorovaný karboxychinolon, čistý (-)-(S)-enantiomer racemické léčivé látky ofloxacinu. Chemický název je (-)-(S)-9-fluor-2,3-dihydro-3-methyl-10-(4-methyl-1-piperazinyl)-7-oxo-7H-pyrido[1,2, hemihydrát 3-de]-l,4-benzoxazin-6-karboxylové kyseliny.
Obrázek 1: Chemická struktura levofloxacinu
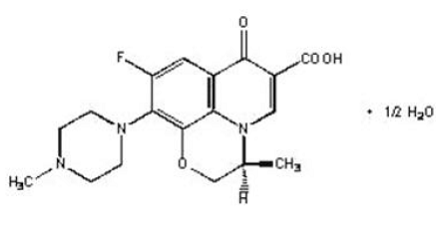
Empirický vzorec je C18H20FN3O4 · 1/2 H2O a molekulová hmotnost je 370,38. Levofloxacin je světle žlutobílý až žlutobílý krystal nebo krystalický prášek. Molekula existuje jako zwitterion za podmínek pH v tenkém střevě.
Data ukazují, že od pH 0,6 do 5,8 je rozpustnost levofloxacinu v podstatě konstantní (přibližně 100 mg/ml). Levofloxacin je považován za rozpustný až volně rozpustný v tomto rozmezí pH, jak je definováno nomenklaturou USP. Nad pH 5,8 se rozpustnost rychle zvyšuje na maximum při pH 6,7 (272 mg/ml) a v tomto rozmezí se považuje za volně rozpustný. Nad pH 6,7 rozpustnost klesá a dosahuje minimální hodnoty (asi 50 mg/ml) při pH přibližně 6,9.
Levofloxacin má potenciál tvořit stabilní koordinační sloučeniny s mnoha kovovými ionty. Tento chelatační potenciál in vitro má následující pořadí tvorby: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
Tablety LEVAQUIN® jsou dostupné jako potahované tablety a obsahují následující neaktivní složky:
- 250 mg (vyjádřeno v bezvodé formě): krospovidon, hypromelóza, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, polysorbát 80, syntetický červený oxid železitý a oxid titaničitý.
- 500 mg (vyjádřeno v bezvodé formě): krospovidon, hypromelóza, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, polysorbát 80, syntetické červené a žluté oxidy železa a oxid titaničitý.
- 750 mg (vyjádřeno v bezvodé formě): krospovidon, hypromelóza, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, polysorbát 80, oxid titaničitý.
INDIKACE
Nozokomiální pneumonie
LEVAQUIN® je indikován u dospělých pacientů k léčbě nozokomiální pneumonie způsobené Staphylococcus aureus citlivým na meticilin, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae nebo Streptococcus pneumoniae. Doplňková léčba by měla být použita podle klinické indikace. Tam, kde je Pseudomonas aeruginosa dokumentovaný nebo předpokládaný patogen, doporučuje se kombinovaná léčba s antipseudomonálním β-laktamem [viz Klinické studie ].
Pneumonie získaná v komunitě
7 až 14denní léčebný režim
LEVAQUIN® je indikován u dospělých pacientů k léčbě komunitní pneumonie způsobené Staphylococcus aureus citlivým na meticilin, Streptococcus pneumoniae (včetně multirezistentního Streptococcus pneumoniae [MDRSP]), Haemophilus influenzae, Haemophilus parainrrhefalisa pneumoniae, Morssiellaxa pneumoniae , Chlamydophila pneumoniae, Legionella pneumophila nebo Mycoplasma pneumoniae [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
MDRSP izoláty jsou izoláty rezistentní vůči dvěma nebo více z následujících antibakteriálních látek: penicilin (MIC ≥2 mcg/ml), cefalosporiny 2. generace, např. cefuroxim, makrolidy, tetracykliny a trimethoprim/sulfamethoxazol.
Pneumonie získaná v komunitě
5denní léčebný režim
LEVAQUIN® je indikován u dospělých pacientů k léčbě komunitní pneumonie způsobené Streptococcus pneumoniae (s výjimkou multirezistentních izolátů [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae nebo Chlamydophila pneumoniae [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
Komplikované infekce kůže a kožní struktury
LEVAQUIN® je indikován u dospělých pacientů k léčbě komplikovaných infekcí kůže a kožních struktur způsobených Staphylococcus aureus citlivými na meticilin, Enterococcus faecalis, Streptococcus pyogenes nebo Proteus mirabilis [viz Klinické studie ].
Nekomplikované infekce kůže a kožní struktury
LEVAQUIN® je indikován u dospělých pacientů k léčbě nekomplikovaných infekcí kůže a kožních struktur (mírných až středně závažných) včetně abscesů, celulitidy, furunkulů, impetiga, pyodermie, infekcí ran, způsobených Staphylococcus aureus nebo Streptococcus pyogenes citlivými na meticilin.
Chronická bakteriální prostatitida
LEVAQUIN® je indikován u dospělých pacientů k léčbě chronické bakteriální prostatitidy způsobené Escherichia coli, Enterococcus faecalis nebo Staphylococcus epidermidis citlivým na meticilin [viz Klinické studie ].
Inhalační antrax (po expozici)
LEVAQUIN® je indikován pro inhalační antrax (po expozici), aby se snížil výskyt nebo progrese onemocnění po expozici aerosolizovanému Bacillus anthracis u dospělých a pediatrických pacientů ve věku 6 měsíců a starších [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Účinnost přípravku LEVAQUIN® je založena na plazmatických koncentracích dosažených u lidí, což je zástupný cíl, který pravděpodobně předpovídá klinický přínos.
LEVAQUIN® nebyl testován na lidech pro postexpoziční prevenci inhalačního antraxu. Bezpečnost přípravku LEVAQUIN® u dospělých po dobu léčby delší než 28 dnů nebo u pediatrických pacientů po dobu léčby delší než 14 dnů nebyla studována. Prodloužená léčba LEVAQUIN® by měla být použita pouze tehdy, když přínos převáží riziko (viz Klinické studie ].
Mor
LEVAQUIN® je indikován k léčbě moru, včetně plicního a septikemického moru, způsobeného Yersinia pestis (Y. pestis) a k profylaxi moru u dospělých a pediatrických pacientů ve věku 6 měsíců a starších [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Studie účinnosti přípravku LEVAQUIN® nemohly být provedeny u lidí s morem z etických důvodů az důvodů proveditelnosti. Proto bylo schválení této indikace založeno na studii účinnosti provedené na zvířatech [viz Klinické studie ].
Komplikované infekce močových cest
5denní léčebný režim
LEVAQUIN® je indikován u dospělých pacientů k léčbě komplikovaných infekcí močových cest způsobených Escherichia coli, Klebsiella pneumoniae nebo Proteus mirabilis [viz Klinické studie ].
Komplikované infekce močových cest
10denní léčebný režim
LEVAQUIN® je indikován u dospělých pacientů k léčbě komplikovaných infekcí močových cest (mírných až středně závažných) způsobených Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis nebo Pseudomonas aeruginosa [viz Klinické studie ].
Akutní pyelonefritida
5 nebo 10denní léčebný režim
LEVAQUIN® je indikován u dospělých pacientů k léčbě akutní pyelonefritidy způsobené Escherichia coli, včetně případů se souběžnou bakteriémií (viz Klinické studie ].
Nekomplikované infekce močových cest
LEVAQUIN® je indikován u dospělých pacientů k léčbě nekomplikovaných infekcí močových cest (mírných až středně závažných) způsobených Escherichia coli, Klebsiella pneumoniae nebo Staphylococcus saprophyticus.
Protože fluorochinolony, včetně LEVAQUIN®, byly spojovány se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a pro některé pacienty je nekomplikovaná infekce močových cest sama o sobě omezená, rezervujte si LEVAQUIN® pro léčbu nekomplikovaných infekcí močových cest u pacientů, kteří nemají žádné alternativní možnosti léčby.
Akutní bakteriální exacerbace chronické bronchitidy
LEVAQUIN® je indikován u dospělých pacientů k léčbě akutní bakteriální exacerbace chronické bronchitidy (ABECB) způsobené Staphylococcus aureus citlivým na meticilin, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae nebo Moraxella catarrhalis.
Protože fluorochinolony, včetně LEVAQUIN®, byly spojovány se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] a pro některé pacienty je ABECB samoomezující, rezervujte si LEVAQUIN® pro léčbu ABECB u pacientů, kteří nemají žádné alternativní možnosti léčby.
Akutní bakteriální sinusitida
5denní a 10–14denní léčebné režimy
LEVAQUIN® je indikován u dospělých pacientů k léčbě akutní bakteriální sinusitidy (ABS) způsobené Streptococcus pneumoniae, Haemophilus influenzae nebo Moraxella catarrhalis [viz Klinické studie ].
Protože fluorochinolony, včetně LEVAQUIN®, byly spojovány se závažnými nežádoucími reakcemi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a pro některé pacienty je ABS samoomezující, rezervujte si LEVAQUIN® pro léčbu ABS u pacientů, kteří nemají žádné alternativní možnosti léčby.
Používání
Aby se snížil vývoj bakterií rezistentních vůči lékům a zachovala se účinnost přípravku LEVAQUIN® a dalších antibakteriálních léků, měl by být přípravek LEVAQUIN® používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
Testování kultury a citlivosti
Před léčbou by měly být provedeny příslušné kultivační testy a testy citlivosti, aby se izolovaly a identifikovaly organismy způsobující infekci a aby se určila jejich citlivost na levofloxacin [viz Mikrobiologie ]. Léčba přípravkem LEVAQUIN® může být zahájena dříve, než budou známy výsledky těchto testů; jakmile budou k dispozici výsledky, měla by být zvolena vhodná terapie.
Stejně jako u jiných léků v této třídě se u některých izolátů Pseudomonas aeruginosa může během léčby přípravkem LEVAQUIN® poměrně rychle vyvinout rezistence. Testování kultivace a citlivosti prováděné pravidelně během terapie poskytne informace o přetrvávající citlivosti patogenů na antimikrobiální látku a také o možném vzniku bakteriální rezistence.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování tablet LEVAQUIN® u dospělých pacientů s clearance kreatininu ≥ 50 ml/min
Obvyklá dávka přípravku LEVAQUIN® Tablets je 250 mg, 500 mg nebo 750 mg podávaná perorálně každých 24 hodin, jak je indikováno infekcí a popsáno v tabulce 1.
Tato doporučení platí pro pacienty s clearance kreatininu ≥ 50 ml/min. U pacientů s clearance kreatininu nižší než 50 ml/min je nutná úprava dávkovacího režimu (viz Úprava dávkování u dospělých s poruchou ledvin ].
Dávkování tablet LEVAQUIN® u pediatrických pacientů s inhalačním antraxem nebo morem
Dávkování tablet LEVAQUIN® pro inhalační antrax (po expozici) a mor u pediatrických pacientů, kteří váží 30 kg nebo více, je popsáno níže v tabulce 2. Tablety LEVAQUIN® nelze podávat pacientům, kteří váží méně než 30 kg z důvodu omezení dostupné síly. U pediatrických pacientů, kteří váží méně než 30 kg, lze zvážit alternativní lékové formy levofloxacinu.
Úprava dávkování u dospělých s poruchou ledvin
Pacientům s poruchou funkce ledvin podávejte LEVAQUIN® opatrně. Před léčbou a během ní by mělo být provedeno pečlivé klinické pozorování a vhodné laboratorní studie, protože u těchto pacientů může být snížena eliminace levofloxacinu.
U pacientů s poruchou funkce ledvin (clearance kreatininu nižší než 50 ml/min) je nutná úprava dávkovacího režimu, aby se zabránilo akumulaci levofloxacinu v důsledku snížené clearance (viz Použití u konkrétních populací ]. U pacientů s clearance kreatininu vyšší nebo rovnou 50 ml/min není nutná žádná úprava.
Tabulka 3 ukazuje, jak upravit dávku na základě clearance kreatininu.
Léková interakce s chelatačními činidly
Antacida, sukralfát, kationty kovů, multivitaminy
Tablety LEVAQUIN® by se měly podávat alespoň dvě hodiny před nebo dvě hodiny po antacidech obsahujících hořčík, hliník, stejně jako sukralfát, kationty kovů, jako je železo, a multivitaminové přípravky se zinkem nebo didanosinovými žvýkacími/pufrovanými tabletami nebo pediatrickým práškem pro perorální roztok. [vidět DROGOVÉ INTERAKCE a INFORMACE PRO PACIENTA ].
Pokyny pro administraci
Tablety LEVAQUIN® lze podávat bez ohledu na jídlo.
Hydratace pro pacienty, kteří dostávají tablety LEVAQUIN®
U pacientů užívajících LEVAQUIN® je třeba udržovat dostatečnou hydrataci, aby se zabránilo tvorbě vysoce koncentrované moči. U chinolonů byla hlášena krystalurie a cylindrurie [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
JAK DODÁVÁNO
Dávkové formy A Síly
TABLETY, potažené filmem, tvaru tobolky
- 250 mg terakotové růžové tablety s potiskem „250“ na jedné straně a „LEVAQUIN“ na druhé straně
- 500 mg broskvové tablety s potiskem „500“ na jedné straně a „LEVAQUIN“ na druhé straně
- 750 mg bílé tablety s potiskem „750“ na jedné straně a „LEVAQUIN“ na druhé straně
Skladování A Manipulace
Tablety LEVAQUIN® se dodávají jako 250, 500 a 750 mg potahované tablety ve tvaru tobolky.
LEVAQUIN® tablety jsou baleny v lahvích v následujících konfiguracích:
- 250 mg tablety jsou terakotově růžové a mají potisk: „LEVAQUIN®“ na jedné straně a „250“ na druhé straně
- lahve po 50 ( NDC 50458-920-50)
- 500 mg tablety jsou broskvové a mají potisk: „LEVAQUIN®“ na jedné straně a „500“ na druhé straně
- lahve po 50 ( NDC 50458-925-50)
- 750 mg tablety jsou bílé s potiskem „LEVAQUIN®“ na jedné straně a „750“ na druhé straně
- láhve po 20 ( NDC 50458-930-20)
Tablety LEVAQUIN® by měly být skladovány při teplotě 15° až 30°C (59° až 86°F) v dobře uzavřených nádobách.
Výrobce: Aktivní složka Made in Japan. Revize: červenec 2018
VEDLEJŠÍ EFEKTY
Závažné a jinak důležité nežádoucí reakce
Následující závažné a jinak důležité nežádoucí účinky léku jsou podrobněji popsány v jiných částech označení:
- Deaktivace a potenciálně nevratné závažné nežádoucí reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Tendinitida a ruptura šlach [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Periferní neuropatie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Účinky na centrální nervový systém [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Exacerbace Myasthenia Gravis [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Jiné vážné a někdy fatální reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT intervalu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Muskuloskeletální poruchy u dětských pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Poruchy krevní glukózy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Fotosenzitivita/fototoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vývoj bakterií rezistentních vůči léčivům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Krystalurie a cylindrurie byly hlášeny u chinolonů, včetně přípravku LEVAQUIN®. Proto je třeba udržovat adekvátní hydrataci pacientů užívajících LEVAQUIN®, aby se zabránilo tvorbě vysoce koncentrované moči [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Údaje popsané níže odrážejí expozici LEVAQUINU® u 7537 pacientů ve 29 sdružených klinických studiích fáze 3. Studovaná populace měla průměrný věk 50 let (přibližně 74 % populace bylo ve věku INDIKACE ]. Pacienti dostávali LEVAQUIN® v dávce 750 mg jednou denně, 250 mg jednou denně nebo 500 mg jednou nebo dvakrát denně.
Délka léčby byla obvykle 3–14 dnů a průměrný počet dnů léčby byl 10 dnů.
Celková incidence, typ a distribuce nežádoucích účinků byla podobná u pacientů, kteří dostávali LEVAQUIN® v dávkách 750 mg jednou denně, 250 mg jednou denně a 500 mg jednou nebo dvakrát denně.
přerušení léčby přípravkem LEVAQUIN® kvůli nežádoucím reakcím na léky došlo celkově u 4,3 % pacientů, u 3,8 % pacientů léčených dávkami 250 mg a 500 mg au 5,4 % pacientů léčených dávkou 750 mg. Nejčastějšími nežádoucími účinky vedoucími k přerušení léčby dávkami 250 a 500 mg byly gastrointestinální (1,4 %), primárně nauzea (0,6 %); zvracení (0,4 %); závratě (0,3 %); a bolest hlavy (0,2 %). Nejčastějšími nežádoucími účinky vedoucími k přerušení léčby dávkou 750 mg byly gastrointestinální (1,2 %), primárně nauzea (0,6 %), zvracení (0,5 %); závratě (0,3 %); a bolesti hlavy (0,3 %).
Nežádoucí reakce vyskytující se u ≥1 % pacientů léčených přípravkem LEVAQUIN® a méně časté nežádoucí reakce vyskytující se u 0,1 až
klinických studiích s použitím vícedávkové terapie byly u pacientů léčených chinolony, včetně přípravku LEVAQUIN®, zaznamenány oftalmologické abnormality, včetně katarakty a mnohočetných tečkovitých čočkovitých zákalů. Vztah drog k těmto událostem není v současné době stanoven.
Postmarketingové zkušenosti
Tabulka 6 uvádí nežádoucí reakce, které byly identifikovány během používání přípravku LEVAQUIN® po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
DROGOVÉ INTERAKCE
Chelatační činidla
Antacida, sukralfát, kationty kovů, multivitaminy
Zatímco chelace dvojmocnými kationty je méně výrazná než u jiných fluorochinolonů, současné podávání tablet LEVAQUIN® s antacidy obsahujícími hořčík nebo hliník, stejně jako sukralfát, kationty kovů, jako je železo, a multivitaminové přípravky se zinkem mohou interferovat s gastrointestinální absorpcí. levofloxacinu, což vede k systémovým hladinám značně nižším, než je žádoucí. Tablety s antacidy obsahujícími hořčík, hliník a také sukralfát, kationty kovů, jako je železo, a multivitaminové přípravky se zinkem nebo didanosinem mohou podstatně interferovat s gastrointestinální absorpcí levofloxacinu, což má za následek výrazně nižší systémové hladiny, než je žádoucí. Tyto látky by se měly užívat alespoň dvě hodiny před nebo dvě hodiny po perorálním podání LEVAQUINU®.
Warfarin
klinické studii zahrnující zdravé dobrovolníky nebyl zjištěn žádný významný účinek přípravku LEVAQUIN® na maximální plazmatické koncentrace, AUC a další dispoziční parametry pro R- a S-warfarin. Podobně nebyl pozorován žádný zjevný účinek warfarinu na absorpci a likvidaci levofloxacinu. Během postmarketingové zkušenosti u pacientů však byly hlášeny, že LEVAQUIN® zvyšuje účinky warfarinu. Zvýšení protrombinového času při současném užívání warfarinu a přípravku LEVAQUIN® bylo spojeno s epizodami krvácení. Je-li LEVAQUIN® podáván současně s warfarinem, je třeba pečlivě sledovat protrombinový čas, mezinárodní normalizovaný poměr (INR) nebo jiné vhodné antikoagulační testy. Pacienti by měli být také sledováni na známky krvácení [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Antidiabetické látky
pacientů léčených současně fluorochinolony a antidiabetiky byly hlášeny poruchy hladiny glukózy v krvi, včetně hyperglykémie a hypoglykémie. Proto se při současném podávání těchto látek doporučuje pečlivé sledování hladiny glukózy v krvi [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE , a INFORMACE PRO PACIENTA ].
Nesteroidní protizánětlivé léky
Současné podávání nesteroidního protizánětlivého léčiva s fluorochinolonem, včetně LEVAQUIN®, může zvýšit riziko stimulace CNS a konvulzivních záchvatů (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Theofylin
klinické studii zahrnující zdravé dobrovolníky nebyl zjištěn žádný významný účinek přípravku LEVAQUIN® na plazmatické koncentrace, AUC a další dispoziční parametry theofylinu. Podobně nebyl pozorován žádný zjevný účinek theofylinu na absorpci a dispozice levofloxacinu. Současné podávání jiných fluorochinolonů s theofylinem však vedlo k prodlouženému poločasu eliminace, zvýšeným hladinám theofylinu v séru a následnému zvýšení rizika nežádoucích účinků souvisejících s theofylinem v populaci pacientů. Při současném podávání přípravku LEVAQUIN® by proto měly být pečlivě sledovány hladiny theofylinu a vhodné úpravy dávkování. Nežádoucí účinky, včetně záchvatů, se mohou objevit se zvýšením hladiny teofylinu v séru nebo bez něj (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Cyklosporin
klinické studii zahrnující zdravé dobrovolníky nebyl zjištěn žádný významný účinek přípravku LEVAQUIN® na maximální plazmatické koncentrace, AUC a další parametry dispozice cyklosporinu. V populaci pacientů však byly hlášeny zvýšené sérové hladiny cyklosporinu při současném podávání s některými jinými fluorochinolony. Cmax a ke levofloxacinu byly o něco nižší, zatímco Tmax a t1/2 byly o něco delší v přítomnosti cyklosporinu než hodnoty pozorované v jiných studiích bez současné medikace. Rozdíly se však nepovažují za klinicky významné. Proto není nutná žádná úprava dávkování pro LEVAQUIN® nebo cyklosporin, pokud jsou podávány současně.
Digoxin
klinické studii zahrnující zdravé dobrovolníky nebyl zjištěn žádný významný účinek přípravku LEVAQUIN® na maximální plazmatické koncentrace, AUC a další parametry dispozice digoxinu. Absorpční a dispoziční kinetika levofloxacinu byla podobná v přítomnosti nebo nepřítomnosti digoxinu. Proto není při současném podávání přípravku LEVAQUIN® nebo digoxinu nutná žádná úprava dávkování.
Probenecid a Cimetidin
V klinické studii zahrnující zdravé dobrovolníky nebyl pozorován žádný významný účinek probenecidu nebo cimetidinu na Cmax levofloxacinu. AUC a t1/2 levofloxacinu byly vyšší, zatímco CL/F a CLR byly nižší během souběžné léčby přípravkem LEVAQUIN® s probenecidem nebo cimetidinem ve srovnání se samotným přípravkem LEVAQUIN®. Tyto změny však nezaručují úpravu dávkování přípravku LEVAQUIN®, pokud je současně podáván probenecid nebo cimetidin.
Interakce s laboratorním nebo diagnostickým testováním
Některé fluorochinolony, včetně LEVAQUIN®, mohou při použití komerčně dostupných imunoanalytických souprav produkovat falešně pozitivní výsledky screeningu moči na opiáty. Potvrzení pozitivních opiátových screeningů specifičtějšími metodami může být nezbytné.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Deaktivace a potenciálně nevratné závažné nežádoucí reakce včetně tendinitidy a ruptury šlach, periferní neuropatie a účinků na centrální nervový systém
Fluorochinolony, včetně LEVAQUIN®, byly spojovány s invalidizujícími a potenciálně ireverzibilními závažnými nežádoucími reakcemi z různých tělesných systémů, které se mohou vyskytnout společně u stejného pacienta. Mezi běžně pozorované nežádoucí účinky patří tendinitida, ruptura šlach, artralgie, myalgie, periferní neuropatie a účinky na centrální nervový systém (halucinace, úzkost, deprese, nespavost, silné bolesti hlavy a zmatenost). Tyto reakce se mohou objevit během hodin až týdnů po zahájení léčby přípravkem LEVAQUIN®. Pacienti jakéhokoli věku nebo bez již existujících rizikových faktorů zaznamenali tyto nežádoucí reakce (viz Tendinitida a ruptura šlach, periferní neuropatie, účinky na centrální nervový systém ].
Okamžitě přerušte užívání přípravku LEVAQUIN® při prvních známkách nebo příznacích jakékoli závažné nežádoucí reakce. Kromě toho se vyhněte použití fluorochinolonů, včetně LEVAQUIN®, u pacientů, u kterých se vyskytl některý z těchto závažných nežádoucích účinků spojených s fluorochinolony.
Tendinitida A Ruptura šlachy
Fluorochinolony, včetně LEVAQUIN®, byly spojovány se zvýšeným rizikem tendinitidy a ruptury šlach ve všech věkových kategoriích (viz Deaktivace a potenciálně nevratné závažné nežádoucí reakce včetně tendinitidy a ruptury šlach, periferní neuropatie a účinků na centrální nervový systém a NEŽÁDOUCÍ REAKCE ]. Tato nežádoucí reakce se nejčastěji týká Achillovy šlachy a byla také hlášena u rotátorové manžety (rameno), ruky, bicepsu, palce a dalších míst šlachy. Tendinitida nebo ruptura šlachy se může objevit během hodin nebo dnů po zahájení léčby přípravkem LEVAQUIN® nebo až několik měsíců po dokončení léčby fluorochinolony. Tendinitida a ruptura šlachy se mohou objevit bilaterálně.
Riziko vzniku tendinitidy a ruptury šlachy související s fluorochinolony je zvýšené u pacientů starších 60 let, u pacientů užívajících kortikosteroidy a u pacientů po transplantaci ledvin, srdce nebo plic. Další faktory, které mohou nezávisle zvýšit riziko ruptury šlachy, zahrnují namáhavou fyzickou aktivitu, selhání ledvin a předchozí poruchy šlach, jako je revmatoidní artritida. Tendinitida a ruptura šlachy byly hlášeny u pacientů užívajících fluorochinolony, kteří nemají výše uvedené rizikové faktory. Okamžitě přerušte léčbu přípravkem LEVAQUIN®, pokud pacient pociťuje bolest, otok, zánět nebo rupturu šlachy. Pacientům je třeba doporučit, aby si odpočinuli při prvních známkách tendinitidy nebo ruptury šlachy a aby kontaktovali svého poskytovatele zdravotní péče ohledně přechodu na nechinolonové antimikrobiální léčivo. Vyhněte se LEVAQUINU® u pacientů, kteří mají v anamnéze poruchy šlach nebo rupturu šlach [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Periferní neuropatie
Fluorochinolony, včetně LEVAQUIN®, byly spojovány se zvýšeným rizikem periferní neuropatie. U pacientů užívajících fluorochinolony, včetně přípravku LEVAQUIN®, byly hlášeny případy senzorické nebo senzomotorické axonální polyneuropatie postihující malé a/nebo velké axony s následkem parestezie, hypoestézie, dysestézie a slabosti. Příznaky se mohou objevit brzy po zahájení léčby přípravkem LEVAQUIN® a u některých pacientů mohou být nevratné (viz Deaktivace a potenciálně nevratné závažné nežádoucí reakce včetně tendinitidy a ruptury šlach, periferní neuropatie a účinků na centrální nervový systém a NEŽÁDOUCÍ REAKCE ].
Okamžitě přerušte léčbu přípravkem LEVAQUIN®, pokud pacient pociťuje příznaky neuropatie včetně bolesti, pálení, mravenčení, necitlivosti a/nebo slabosti nebo jiné změny čití včetně lehkého dotyku, bolesti, teploty, vnímání polohy a vibrací. Vyhněte se fluorochinolonům, včetně LEVAQUIN®, u pacientů, kteří dříve prodělali periferní neuropatii (viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Účinky na centrální nervový systém
Fluorochinolony, včetně LEVAQUIN®, byly spojovány se zvýšeným rizikem účinků na centrální nervový systém (CNS), včetně křečí, toxických psychóz, zvýšeného intrakraniálního tlaku (včetně pseudotumor cerebri). Fluorochinolony mohou také způsobit stimulaci centrálního nervového systému, která může vést k třesu, neklidu, úzkosti, závratě, zmatenosti, halucinacím, paranoii, depresi, nočním můrám a nespavosti. Mohou se také objevit sebevražedné myšlenky a pokusy nebo dokonané sebevraždy, zejména u pacientů s anamnézou deprese nebo základním rizikovým faktorem deprese. Tyto reakce se mohou objevit po první dávce. Pokud se tyto reakce objeví u pacientů užívajících LEVAQUIN®, přerušte podávání LEVAQUIN® a zaveďte vhodná opatření. Stejně jako ostatní fluorochinolony by měl být LEVAQUIN® používán s opatrností u pacientů se známou nebo suspektní poruchou centrálního nervového systému (CNS), která je může predisponovat k záchvatům nebo může snížit práh záchvatů (např. těžká cerebrální arterioskleróza, epilepsie) nebo v přítomnosti jiných rizikových faktorů, které je mohou predisponovat ke záchvatům nebo snížit práh záchvatů (např. určitá medikamentózní terapie, renální dysfunkce). [vidět NEŽÁDOUCÍ REAKCE , DROGOVÉ INTERAKCE , a INFORMACE PRO PACIENTA ].
Exacerbace Myasthenia Gravis
Fluorochinolony, včetně LEVAQUIN®, mají neuromuskulární blokující aktivitu a mohou zhoršit svalovou slabost u pacientů s myasthenia gravis. Postmarketingové závažné nežádoucí reakce včetně úmrtí a potřeby ventilační podpory byly spojeny s užíváním fluorochinolonu u pacientů s myasthenia gravis. Vyhněte se LEVAQUINU® u pacientů se známou anamnézou myasthenia gravis [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Jiné vážné a někdy fatální nežádoucí reakce
Další závažné a někdy fatální nežádoucí účinky, některé z důvodu přecitlivělosti a některé z důvodu nejasné etiologie, byly vzácně hlášeny u pacientů léčených fluorochinolony, včetně přípravku LEVAQUIN®. Tyto příhody mohou být závažné a obvykle se vyskytují po podání více dávek. Klinické projevy mohou zahrnovat jeden nebo více z následujících:
- horečka, vyrážka nebo závažné dermatologické reakce (např. toxická epidermální nekrolýza, Stevens-Johnsonův syndrom);
- vaskulitida; artralgie; myalgie; sérová nemoc;
- alergická pneumonitida;
- intersticiální nefritida; akutní renální insuficience nebo selhání;
- hepatitida; žloutenka; akutní jaterní nekróza nebo selhání;
- anémie, včetně hemolytické a aplastické; trombocytopenie, včetně trombotické trombocytopenické purpury; leukopenie; agranulocytóza; pancytopenie; a/nebo jiné hematologické abnormality.
Okamžitě přerušte užívání přípravku LEVAQUIN® při prvním výskytu kožní vyrážky, žloutenky nebo jakéhokoli jiného příznaku přecitlivělosti a zaveďte podpůrná opatření [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Hypersenzitivní reakce
pacientů léčených fluorochinolony, včetně přípravku LEVAQUIN®, byly hlášeny závažné a příležitostně fatální hypersenzitivní a/nebo anafylaktické reakce. Tyto reakce se často objevují po první dávce. Některé reakce byly doprovázeny kardiovaskulárním kolapsem, hypotenzí/šokem, záchvaty, ztrátou vědomí, brněním, angioedémem (včetně edému/otoku jazyka, hrtanu, hrdla nebo obličeje), obstrukcí dýchacích cest (včetně bronchospasmu, dušnosti a akutního dýchání úzkost), dušnost, kopřivka, svědění a další závažné kožní reakce. LEVAQUIN® by měl být okamžitě vysazen při prvním výskytu kožní vyrážky nebo jakéhokoli jiného příznaku přecitlivělosti. Závažné akutní hypersenzitivní reakce mohou vyžadovat léčbu epinefrinem a další resuscitační opatření, včetně kyslíku, intravenózních tekutin, antihistaminik, kortikosteroidů, presorických aminů a zajištění dýchacích cest, jak je klinicky indikováno [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Hepatotoxicita
Postmarketingové zprávy o závažné hepatotoxicitě (včetně akutní hepatitidy a fatálních příhod) byly obdrženy u pacientů léčených přípravkem LEVAQUIN®. V klinických studiích s více než 7 000 pacienty nebyly zjištěny žádné známky závažné hepatotoxicity související s léčivem. Závažná hepatotoxicita se obvykle objevila do 14 dnů od zahájení léčby a většina případů se objevila během 6 dnů. Většina případů těžké hepatotoxicity nebyla spojena s hypersenzitivitou [viz Jiné vážné a někdy fatální nežádoucí reakce ].
Většina hlášení fatální hepatotoxicity se objevila u pacientů ve věku 65 let nebo starších a většina z nich nebyla spojena s přecitlivělostí. LEVAQUIN® by měl být okamžitě přerušen, pokud se u pacienta objeví známky a příznaky hepatitidy (viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Průjem spojený s Clostridium Difficile
Průjem související s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně LEVAQUIN®, a může se pohybovat v rozsahu závažnosti od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po užívání antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibiotická léčba C. difficile a chirurgické vyšetření [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Prodloužení QT intervalu
Některé fluorochinolony, včetně přípravku LEVAQUIN®, byly spojovány s prodloužením QT intervalu na elektrokardiogramu a vzácnými případy arytmie. Během postmarketingového sledování byly u pacientů užívajících fluorochinolony, včetně přípravku LEVAQUIN®, spontánně hlášeny vzácné případy torsade de pointes. LEVAQUIN® by se neměl používat u pacientů se známým prodloužením QT intervalu, pacientů s nekorigovanou hypokalémií a pacientů užívajících antiarytmika třídy IA (chinidin, prokainamid) nebo třídy III (amiodaron, sotalol). Starší pacienti mohou být náchylnější k účinkům souvisejícím s lékem na QT interval [viz NEŽÁDOUCÍ REAKCE , Použití u konkrétních populací , a INFORMACE PRO PACIENTA ].
Muskuloskeletální poruchy u dětských pacientů a artropatické účinky u zvířat
LEVAQUIN® je indikován u dětských pacientů (ve věku 6 měsíců a starších) pouze k prevenci inhalačního antraxu (po expozici) a moru [viz INDIKACE ]. U pediatrických pacientů užívajících LEVAQUIN® byl pozorován zvýšený výskyt muskuloskeletálních poruch (artralgie, artritida, tendinopatie a abnormality chůze) ve srovnání s kontrolami (viz Použití u konkrétních populací ].
U nedospělých potkanů a psů vedlo perorální a intravenózní podání levofloxacinu ke zvýšené osteochondróze. Histopatologické vyšetření váhonosných kloubů u nezralých psů, kterým byl podáván levofloxacin, odhalilo přetrvávající léze chrupavky. Jiné fluorochinolony také způsobují podobné eroze v nosných kloubech a další známky artropatie u nedospělých zvířat různých druhů [viz Farmakologie zvířat ].
Poruchy krevní glukózy
Stejně jako u jiných fluorochinolonů byly u přípravku LEVAQUIN® hlášeny poruchy hladiny glukózy v krvi, včetně symptomatické hyper- a hypoglykémie, obvykle u diabetických pacientů, kteří byli současně léčeni perorálními hypoglykemiky (např. glyburidem) nebo inzulínem. U těchto pacientů se doporučuje pečlivé sledování hladiny glukózy v krvi. Pokud se u pacienta léčeného přípravkem LEVAQUIN® objeví hypoglykemická reakce, musí být podávání přípravku LEVAQUIN® přerušeno a musí být okamžitě zahájena vhodná léčba (viz NEŽÁDOUCÍ REAKCE , DROGOVÉ INTERAKCE a INFORMACE PRO PACIENTA ].
Fotosenzitivita/fototoxicita
Středně těžké až závažné fotosenzitivní/fototoxické reakce, z nichž poslední se mohou projevit jako přehnané reakce spálení sluncem (např. pálení, erytém, exsudace, puchýřky, puchýře, edém) zahrnující oblasti vystavené světlu (typicky obličej, oblast „V“ na krku , extenzorové plochy předloktí, dorsa rukou), může být spojeno s použitím fluorochinolonů po vystavení slunci nebo UV záření. Proto je třeba se vyhnout nadměrnému vystavení těmto zdrojům světla. Léková terapie by měla být přerušena, pokud se objeví fotosenzitivita/fototoxicita [viz NEŽÁDOUCÍ REAKCE a INFORMACE PRO PACIENTA ].
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku LEVAQUIN® v nepřítomnosti prokázané nebo silně podezřelé bakteriální infekce nebo profylaktické indikace přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky [viz INFORMACE PRO PACIENTA ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Závažné nežádoucí reakce
Poraďte pacientům, aby přestali užívat LEVAQUIN®, pokud se u nich objeví nežádoucí reakce, a aby zavolali svého poskytovatele zdravotní péče o radu, jak dokončit celý cyklus léčby jiným antibakteriálním lékem.
Informujte pacienty o následujících závažných nežádoucích účincích, které byly spojeny s užíváním přípravku LEVAQUIN® nebo jiných fluorochinolonů:
- Deaktivace a potenciálně nevratné závažné nežádoucí reakce, které se mohou vyskytnout společně: Informujte pacienty, že invalidizující a potenciálně ireverzibilní závažné nežádoucí reakce, včetně tendinitidy a ruptury šlach, periferních neuropatií a účinků na centrální nervový systém, byly spojeny s užíváním přípravku LEVAQUIN® a mohou se vyskytnout společně u stejného pacienta. Informujte pacienty, aby okamžitě přestali užívat LEVAQUIN®, pokud se u nich objeví nežádoucí reakce, a aby zavolali svého poskytovatele zdravotní péče.
- Tendinitida a ruptura šlach: Poučte pacienty, aby kontaktovali svého poskytovatele zdravotní péče, pokud pociťují bolest, otok nebo zánět šlachy nebo slabost nebo neschopnost používat některý ze svých kloubů; odpočívat a zdržet se cvičení; a přerušte léčbu přípravkem LEVAQUIN®. Příznaky mohou být nevratné. Riziko těžkého postižení šlach u fluorochinolonů je vyšší u starších pacientů obvykle nad 60 let, u pacientů užívajících kortikosteroidy a u pacientů po transplantaci ledvin, srdce nebo plic.
- Periferní neuropatie: Informujte pacienty, že periferní neuropatie byly spojeny s užíváním levofloxacinu, příznaky se mohou objevit brzy po zahájení léčby a mohou být nevratné. Pokud se objeví příznaky periferní neuropatie včetně bolesti, pálení, brnění, necitlivosti a/nebo slabosti, okamžitě přerušte léčbu přípravkem LEVAQUIN® a řekněte jim, aby kontaktovali svého lékaře.
- Účinky na centrální nervový systém (například křeče, závratě, točení hlavy, zvýšený intrakraniální tlak): Informujte pacienty, že u pacientů užívajících fluorochinolony, včetně levofloxacinu, byly hlášeny křeče. Informujte pacienty, aby informovali svého lékaře před užitím tohoto léku, pokud mají v anamnéze křeče. Informujte pacienty, že by měli vědět, jak reagují na LEVAQUIN® dříve, než budou řídit automobil nebo stroje nebo se zapojit do jiných činností vyžadujících duševní bdělost a koordinaci. Poučte pacienty, aby informovali svého lékaře, pokud se objeví přetrvávající bolest hlavy s rozmazaným viděním nebo bez něj.
- Exacerbace myasthenia gravis: Poučte pacienty, aby informovali svého lékaře o jakékoli anamnéze myasthenia gravis. Poučte pacienty, aby informovali svého lékaře, pokud zaznamenají jakékoli příznaky svalové slabosti, včetně dýchacích obtíží.
- Hypersenzitivní reakce: Informujte pacienty, že levofloxacin může vyvolat reakce přecitlivělosti, dokonce i po jednorázové dávce, a přerušit léčbu při prvních známkách kožní vyrážky, kopřivky nebo jiných kožních reakcí, zrychleného srdečního tepu, potíží s polykáním nebo dýcháním, jakéhokoli otoku naznačujícího angioedém ( například otok rtů, jazyka, obličeje, sevření hrdla, chrapot) nebo jiné příznaky alergické reakce.
- Hepatotoxicita: Informujte pacienty, že u pacientů užívajících LEVAQUIN® byla hlášena závažná hepatotoxicita (včetně akutní hepatitidy a fatálních příhod). Poučte pacienty, aby informovali svého lékaře, pokud zaznamenají jakékoli známky nebo příznaky poškození jater, včetně: ztráty chuti k jídlu, nevolnosti, zvracení, horečky, slabosti, únavy, citlivosti pravého horního kvadrantu, svědění, zežloutnutí kůže a očí, světlých stolic nebo tmavě zbarvená moč.
- Průjem: Průjem je častým problémem způsobeným antibiotiky, který obvykle končí, když je antibiotikum vysazeno. Někdy po zahájení léčby antibiotiky se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, poučte pacienty, aby co nejdříve kontaktovali svého lékaře.
- Prodloužení QT intervalu: Poučte pacienty, aby informovali svého lékaře o jakékoli osobní nebo rodinné anamnéze prodloužení QT intervalu nebo proarytmických stavech, jako je hypokalémie, bradykardie nebo nedávná ischemie myokardu; jestliže užívají jakákoli antiarytmika třídy IA (chinidin, prokainamid) nebo třídy III (amiodaron, sotalol). Poučte pacienty, aby informovali svého lékaře, pokud mají jakékoli příznaky prodloužení QT intervalu, včetně prodlouženého bušení srdce nebo ztráty vědomí.
- Muskuloskeletální poruchy u dětských pacientů: Poučte rodiče, aby před užitím tohoto léku informovali lékaře svého dítěte, pokud má dítě v minulosti problémy s klouby. Informujte rodiče dětských pacientů, aby informovali lékaře svého dítěte o jakýchkoli problémech souvisejících s klouby, které se vyskytnou během nebo po léčbě levofloxacinem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
- Fotosenzitivita/fototoxicita: Informujte pacienty, že u pacientů užívajících fluorochinolony byla hlášena fotosenzitivita/fototoxicita. Informujte pacienty, aby během užívání fluorochinolonů minimalizovali nebo se vyvarovali vystavení přirozenému nebo umělému slunečnímu záření (solária nebo UVA/B léčba). Pokud pacienti potřebují být při používání fluorochinolonů venku, poučte je, aby nosili volné oblečení, které chrání pokožku před slunečním zářením, a proberte se svým lékařem další opatření na ochranu před sluncem. Pokud dojde k reakci podobné spálení sluncem nebo kožní erupci, poučte pacienty, aby kontaktovali svého lékaře.
Antibakteriální odolnost
Antibakteriální léky včetně přípravku LEVAQUIN® by se měly používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Je-li LEVAQUIN® předepsán k léčbě bakteriální infekce, pacienti by měli být informováni, že ačkoli je běžné, že se na začátku léčby cítí lépe, léky by měly být užívány přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem LEVAQUIN® nebo jinými antibakteriálními léky.
Podávání s jídlem, tekutinami a souběžnými léky
Pacienti by měli být informováni, že tablety LEVAQUIN® lze užívat s jídlem nebo bez jídla. Tablety by se měly užívat každý den ve stejnou dobu.
Pacienti by měli během užívání přípravku LEVAQUIN® dostatečně pít tekutiny, aby se zabránilo tvorbě vysoce koncentrované moči a tvorbě krystalů v moči.
Antacida obsahující hořčík nebo hliník, stejně jako sukralfát, kationty kovů, jako je železo, a multivitaminové přípravky se zinkem nebo didanosinem by se měly užívat alespoň dvě hodiny před nebo dvě hodiny po perorálním podání LEVAQUINU®.
Lékové interakce s inzulínem, perorálními hypoglykemickými látkami a warfarinem
Pacienti by měli být informováni, že pokud jsou diabetici a jsou léčeni inzulinem nebo perorálním hypoglykemickým přípravkem a dojde k hypoglykemické reakci, měli by přerušit léčbu přípravkem LEVAQUIN® a poradit se s lékařem.
Pacienti by měli být informováni, že současné podávání warfarinu a přípravku LEVAQUIN® bylo spojeno se zvýšením INR (International Normalized Ratio) nebo protrombinového času a klinickými epizodami krvácení. Pacienti by měli informovat svého lékaře, pokud užívají warfarin, měli by být sledováni na známky krvácení a také by měli mít pečlivě sledovány antikoagulační testy při současném užívání warfarinu.
Studie moru a antraxu
Pacienti, kterým je při těchto stavech podáván LEVAQUIN®, by měli být informováni, že studie účinnosti nemohou být provedeny u lidí z etických důvodů az důvodů proveditelnosti. Proto bylo schválení pro tyto stavy založeno na studiích účinnosti provedených na zvířatech.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
celoživotním biologickém testu na potkanech levofloxacin nevykazoval žádný karcinogenní potenciál po každodenním dietním podávání po dobu 2 let; nejvyšší dávka (100 mg/kg/den) byla 1,4násobkem nejvyšší doporučené dávky pro člověka (750 mg) na základě relativní plochy povrchu těla. Levofloxacin nezkrátil dobu do vzniku nádoru kožních nádorů indukovaných UV zářením u bezsrstých albínů (Skh-1) myší při žádné hladině dávky levofloxacinu, a proto nebyl za podmínek této studie fotokarcinogenní. Dermální koncentrace levofloxacinu u bezsrstých myší se pohybovaly od 25 do 42 mcg/g při nejvyšší hladině dávky levofloxacinu (300 mg/kg/den) použité ve studii fotokarcinogenity. Pro srovnání, dermální koncentrace levofloxacinu u lidských subjektů dostávajících 750 mg LEVAQUIN® byly v průměru přibližně 11,8 mcg/g při Cmax.
Levofloxacin nebyl mutagenní v následujících testech: test Amesovy bakteriální mutace (S. typhimurium a E. coli), test přímé mutace CHO/HGPRT, mikronukleový test na myších, test dominantní letální smrti u myší, test neplánované syntézy DNA u potkanů a myší sesterská chromatid výměnný test. Byl pozitivní v testech in vitro chromozomální aberace (CHL buněčná linie) a výměny sesterských chromatid (CHL/IU buněčná linie).
Levofloxacin nezpůsobil žádné poškození fertility nebo reprodukční schopnosti u potkanů při perorálních dávkách až 360 mg/kg/den, což odpovídá 4,2násobku nejvyšší doporučené dávky u člověka na základě relativní plochy povrchu těla a intravenózních dávkách až 100 mg/kg/den den, což odpovídá 1,2násobku nejvyšší doporučené dávky u člověka na základě relativní plochy povrchu těla.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství C
Levofloxacin nebyl teratogenní u potkanů v dávkách až 810 mg/kg/den, což odpovídá 9,4násobku nejvyšší doporučené perorální dávky u člověka na základě relativní plochy povrchu těla. Perorální dávka 810 mg/kg/den potkanům způsobila snížení tělesné hmotnosti plodu a zvýšenou mortalitu plodu. Nebyla pozorována žádná teratogenita, když byla králíkům perorálně podávána dávka až 50 mg/kg/den, což odpovídá 1,1násobku nejvyšší doporučené perorální dávky pro člověka na základě relativní plochy povrchu těla.
Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. LEVAQUIN® by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Na základě údajů o jiných fluorochinolonech a velmi omezených údajů o přípravku LEVAQUIN® lze předpokládat, že levofloxacin bude vylučován do lidského mléka. Vzhledem k potenciálu závažných nežádoucích účinků přípravku LEVAQUIN® u kojených dětí je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Chinolony, včetně levofloxacinu, způsobují artropatii a osteochondrózu u mladých zvířat několika druhů. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Farmakologie zvířat ].
Inhalační antrax (po expozici)
Levofloxacin je indikován u pediatrických pacientů ve věku 6 měsíců a starších pro inhalační antrax (postexpozice). Hodnocení rizika a přínosu ukazuje, že podávání levofloxacinu pediatrickým pacientům je vhodné. Bezpečnost levofloxacinu u pediatrických pacientů léčených déle než 14 dnů nebyla studována [viz INDIKACE , DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
Mor
Levofloxacin je indikován u pediatrických pacientů ve věku 6 měsíců a starších k léčbě moru, včetně plicního a septikemického moru způsobeného Yersinia pestis (Y. pestis) ak profylaxi moru. Studie účinnosti přípravku LEVAQUIN® nemohly být provedeny u lidí s plicním morem z etických důvodů az důvodů proveditelnosti. Proto bylo schválení této indikace založeno na studii účinnosti provedené na zvířatech. Hodnocení rizika a přínosu ukazuje, že podávání levofloxacinu dětským pacientům je vhodné [viz INDIKACE , DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
Bezpečnost a účinnost přípravku LEVAQUIN® u pediatrických pacientů mladších šesti měsíců nebyla stanovena.
Farmakokinetika po intravenózním podání
Farmakokinetika levofloxacinu po jednorázové intravenózní dávce byla zkoumána u pediatrických pacientů ve věku od 6 měsíců do 16 let. Pediatričtí pacienti vylučovali levofloxacin rychleji než dospělí pacienti, což vedlo k nižším plazmatickým expozicím než u dospělých při dané dávce mg/kg (viz KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Dávkování u pediatrických pacientů s inhalačním antraxem nebo morem
Doporučené dávkování tablet LEVAQUIN® u pediatrických pacientů s inhalačním antraxem nebo morem, viz. DÁVKOVÁNÍ A PODÁVÁNÍ . Tablety LEVAQUIN® nelze podávat dětským pacientům, kteří váží méně než 30 kg z důvodu omezení dostupných sil. U pediatrických pacientů, kteří váží méně než 30 kg, lze zvážit alternativní lékové formy levofloxacinu.
Nežádoucí účinky
klinických studiích bylo 1534 pediatrických pacientů (ve věku 6 měsíců až 16 let) léčeno perorálním a intravenózním přípravkem LEVAQUIN®. Pediatričtí pacienti ve věku 6 měsíců až 5 let dostávali LEVAQUIN® 10 mg/kg dvakrát denně a pediatričtí pacienti starší 5 let dostávali 10 mg/kg jednou denně (maximálně 500 mg denně) po dobu přibližně 10 dnů. Tablety LEVAQUIN® lze podávat pouze pediatrickým pacientům s inhalačním antraxem (po expozici) nebo morem, kteří váží 30 kg nebo více kvůli omezením dostupných sil [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Podskupina pediatrických pacientů v klinických studiích (1 340 léčených přípravkem LEVAQUIN® a 893 léčených nefluorochinolony) zařazených do prospektivní dlouhodobé sledovací studie k posouzení výskytu protokolem definovaných muskuloskeletálních poruch (artralgie, artritida, tendinopatie, abnormality chůze ) během 60 dnů a 1 roku po první dávce studovaného léku. Pediatričtí pacienti léčení přípravkem LEVAQUIN® měli významně vyšší výskyt muskuloskeletálních poruch ve srovnání s dětmi neléčenými fluorochinolony, jak ukazuje tabulka 7. Tablety LEVAQUIN® lze podávat pouze pediatrickým pacientům s inhalačním antraxem (po expozici) nebo morem kteří mají 30 kg nebo více kvůli omezením dostupných sil [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Artralgie byla nejčastěji se vyskytující muskuloskeletální poruchou v obou léčebných skupinách. Většina muskuloskeletálních poruch v obou skupinách zahrnovala více váhonosných kloubů. Poruchy byly středně závažné u 8/46 (17 %) dětí a mírné u 35/46 (76 %) pediatrických pacientů léčených přípravkem LEVAQUIN® a většina z nich byla léčena analgetiky. Medián doby do vyléčení byl 7 dní u pediatrických pacientů léčených přípravkem LEVAQUIN® a 9 dní u dětí neléčených fluorochinolony (přibližně 80 % vymizelo během 2 měsíců v obou skupinách). Žádný dětský pacient neměl závažnou nebo závažnou poruchu a všechny muskuloskeletální poruchy se vyřešily bez následků.
Zvracení a průjem byly nejčastěji hlášenými nežádoucími účinky, které se vyskytovaly s podobnou frekvencí u pediatrických pacientů léčených přípravkem LEVAQUIN® a neléčených fluorochinolony.
Kromě nežádoucích účinků hlášených u pediatrických pacientů v klinických studiích, nežádoucích účinků hlášených u dospělých během klinických studií nebo po uvedení přípravku na trh [viz NEŽÁDOUCÍ REAKCE ] lze také očekávat u dětských pacientů.
Geriatrické použití
Geriatričtí pacienti jsou vystaveni zvýšenému riziku rozvoje závažných poruch šlach včetně ruptury šlach, když jsou léčeni fluorochinolony, jako je LEVAQUIN®. Toto riziko se dále zvyšuje u pacientů, kteří dostávají souběžnou léčbu kortikosteroidy. Tendinitida nebo ruptura šlachy může postihnout Achillovu šlachu, ruku, rameno nebo jiná místa šlach a může se objevit během nebo po dokončení terapie; byly hlášeny případy vyskytující se až několik měsíců po léčbě fluorochinolony. Při předepisování přípravku LEVAQUIN® starším pacientům, zejména těm, kteří užívají kortikosteroidy, je třeba postupovat opatrně. Pacienti by měli být informováni o tomto potenciálním nežádoucím účinku a měli by být poučeni, aby přerušili léčbu přípravkem LEVAQUIN® a kontaktovali svého poskytovatele zdravotní péče, pokud se objeví jakékoli příznaky tendinitidy nebo ruptury šlachy [viz BOX VAROVÁNÍ ; VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ; a NEŽÁDOUCÍ REAKCE ].

klinických studiích fáze 3 bylo 1 945 pacientů léčených přípravkem LEVAQUIN® (26 %) ve věku ≥ 65 let. Z toho 1 081 pacientů (14 %) bylo ve věku 65 až 74 let a 864 pacientů (12 %) bylo starších 75 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti, nelze však vyloučit větší citlivost některých starších jedinců.
Po uvedení přípravku LEVAQUIN® na trh byly hlášeny závažné a někdy fatální případy hepatotoxicity. Většina hlášení fatální hepatotoxicity se objevila u pacientů ve věku 65 let nebo starších a většina z nich nebyla spojena s přecitlivělostí. LEVAQUIN® by měl být okamžitě přerušen, pokud se u pacienta objeví známky a příznaky hepatitidy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Starší pacienti mohou být náchylnější k účinkům na QT interval souvisejícím s léky. Proto je třeba dbát opatrnosti při užívání přípravku LEVAQUIN® současně s léky, které mohou vést k prodloužení QT intervalu (např. antiarytmika třídy IA nebo třídy III) nebo u pacientů s rizikovými faktory pro torsade de pointes (např. známé prodloužení QT intervalu, nekorigované hypokalémie) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Farmakokinetické vlastnosti levofloxacinu u mladších dospělých a starších dospělých se významně neliší, vezmeme-li v úvahu clearance kreatininu. Protože je však známo, že lék je v podstatě vylučován ledvinami, riziko toxických reakcí na tento lék může být vyšší u pacientů s poruchou funkce ledvin. Protože u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin [viz KLINICKÁ FARMAKOLOGIE ].
Renální poškození
Clearance levofloxacinu je podstatně snížena a poločas eliminace z plazmy je podstatně prodloužen u pacientů s poruchou funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ ].
Poškození jater
Farmakokinetické studie u pacientů s poruchou funkce jater nebyly provedeny. Vzhledem k omezenému rozsahu metabolismu levofloxacinu se neočekává, že by farmakokinetika levofloxacinu byla ovlivněna poruchou funkce jater.
PŘEDÁVKOVAT
V případě akutního předávkování je třeba vyprázdnit žaludek. Pacient by měl být sledován a udržována přiměřená hydratace. Levofloxacin není účinně odstraněn hemodialýzou nebo peritoneální dialýzou.
LEVAQUIN® vykazuje nízký potenciál pro akutní toxicitu. Myši, krysy, psi a opice vykazovaly následující klinické příznaky po podání jedné vysoké dávky LEVAQUINU®: ataxie, ptóza, snížená lokomotorická aktivita, dušnost, vyčerpanost, třes a křeče. Dávky přesahující 1500 mg/kg perorálně a 250 mg/kg IV způsobily významnou mortalitu hlodavců.
KONTRAINDIKACE
LEVAQUIN® je kontraindikován u osob se známou přecitlivělostí na levofloxacin nebo jiná chinolonová antibakteriální léčiva (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Levofloxacin je členem fluorochinolonové třídy antibakteriálních látek [ viz Mikrobiologie ].
Farmakokinetika
Průměrné ± SD farmakokinetické parametry levofloxacinu stanovené za podmínek jednoduchého a ustáleného stavu po podání perorálních tablet jsou shrnuty v tabulce 8.
Farmakokinetika levofloxacinu je lineární a předvídatelná po jednorázovém a opakovaném perorálním nebo IV dávkovacím režimu. Rovnovážného stavu je dosaženo během 48 hodin po režimu dávkování 500 mg nebo 750 mg jednou denně. Průměrné ± SD maximální a minimální plazmatické koncentrace dosažené po opakovaných perorálních dávkovacích režimech jednou denně byly přibližně 5,7 ± 1,4 a 0,5 ± 0,2 mcg/ml po dávkách 500 mg a 8,6 ± 1,9 a 1,1 ± 0,4 mcg/ml po dávkách 500 mg mg dávky, resp. Průměrné ± SD vrcholové a minimální plazmatické koncentrace dosažené po opakovaných IV režimech jednou denně byly přibližně 6,4 ± 0,8 a 0,6 ± 0,2 mcg/ml po dávkách 500 mg a 12,1 ± 4,1 a 1,3 ± 0,71 mcg/ml po dávkách 500 mg dávkách, resp.
Vstřebávání
Levofloxacin se po perorálním podání rychle a v podstatě úplně absorbuje. Maximálních plazmatických koncentrací je obvykle dosaženo jednu až dvě hodiny po perorálním podání. Absolutní biologická dostupnost levofloxacinu z 500mg tablety a 750mg tablety LEVAQUIN® jsou obě přibližně 99 %, což prokazuje úplnou perorální absorpci levofloxacinu. Po jednorázové intravenózní dávce přípravku LEVAQUIN® zdravým dobrovolníkům byla dosažená průměrná ± SD maximální plazmatická koncentrace 6,2 ± 1,0 mcg/ml po dávce 500 mg podané v infuzi po dobu 60 minut a 11,5 ± 4,0 mcg/ml po dávce 750 mg podané v infuzi 90 minut. Perorální podání 500 mg dávky přípravku LEVAQUIN® s jídlem prodlužuje dobu dosažení maximální koncentrace přibližně o 1 hodinu a snižuje maximální koncentraci přibližně o 14 % po tabletě a přibližně o 25 % po podání perorálního roztoku. Proto mohou být tablety LEVAQUIN® podávány bez ohledu na jídlo.
Profil plazmatické koncentrace levofloxacinu po IV podání je podobný a srovnatelný v rozsahu expozice (AUC) jako u tablet LEVAQUIN® při podávání stejných dávek (mg/mg). Proto lze orální a IV způsob podání považovat za zaměnitelné.
Rozdělení
Průměrný distribuční objem levofloxacinu se obecně pohybuje od 74 do 112 l po jednorázové a vícenásobné dávce 500 mg nebo 750 mg, což ukazuje na širokou distribuci do tělesných tkání. Levofloxacin dosahuje maximálních hladin v kožních tkáních a v tekutině z puchýřů u zdravých jedinců přibližně 3 hodiny po podání. Poměr AUC biopsie kožní tkáně k plazmě je přibližně 2 a poměr AUC tekutiny v blistru k plazmě je přibližně 1 po opakovaném perorálním podání 750 mg a 500 mg dávek LEVAQUIN®, v daném pořadí, zdravým subjektům jednou denně. Levofloxacin také dobře proniká do plicních tkání. Koncentrace v plicní tkáni byly obecně 2- až 5krát vyšší než plazmatické koncentrace a pohybovaly se přibližně od 2,4 do 11,3 mcg/g během 24 hodin po jednorázové perorální dávce 500 mg.
In vitro v klinicky relevantním rozmezí (1 až 10 mcg/ml) koncentrací levofloxacinu v séru/plazmě se levofloxacin přibližně z 24 až 38 % váže na sérové proteiny u všech studovaných druhů, jak bylo stanoveno metodou rovnovážné dialýzy. Levofloxacin se u lidí váže hlavně na sérový albumin. Vazba levofloxacinu na sérové proteiny je nezávislá na koncentraci léčiva.
Odstranění
Metabolismus
Levofloxacin je stereochemicky stabilní v plazmě a moči a metabolicky se nekonvertuje na svůj enantiomer, D-ofloxacin. Levofloxacin podléhá omezenému metabolismu u lidí a je primárně vylučován v nezměněné formě močí. Po perorálním podání bylo přibližně 87 % podané dávky nalezeno jako nezměněné léčivo v moči během 48 hodin, zatímco méně než 4 % dávky se objevilo ve stolici za 72 hodin. Méně než 5 % podané dávky bylo nalezeno v moči jako desmethyl a N-oxid metabolity, jediné metabolity identifikované u lidí. Tyto metabolity mají malou relevantní farmakologickou aktivitu.
Vylučování
Levofloxacin je z velké části vylučován v nezměněné formě močí. Průměrný terminální poločas eliminace levofloxacinu z plazmy se pohybuje přibližně od 6 do 8 hodin po jednorázové nebo opakované dávce levofloxacinu podané perorálně nebo intravenózně. Průměrná zdánlivá celková tělesná clearance a renální clearance se pohybují přibližně od 144 do 226 ml/min a 96 až 142 ml/min. Renální clearance převyšující rychlost glomerulární filtrace naznačuje, že kromě jeho glomerulární filtrace dochází k tubulární sekreci levofloxacinu. Současné podávání cimetidinu nebo probenecidu vede k přibližně 24% a 35% snížení renální clearance levofloxacinu, v daném pořadí, což ukazuje, že k sekreci levofloxacinu dochází v proximálním tubulu ledvin. V žádném z čerstvě odebraných vzorků moči od subjektů užívajících LEVAQUIN® nebyly nalezeny žádné krystaly levofloxacinu.
Specifické populace
Geriatričtí pacienti
Neexistují žádné významné rozdíly ve farmakokinetice levofloxacinu mezi mladými a staršími subjekty, když subjekty ' rozdíly v clearance kreatininu jsou brány v úvahu. Po perorální dávce 500 mg přípravku LEVAQUIN® zdravým starším subjektům (66–80 let) byl průměrný terminální poločas eliminace levofloxacinu z plazmy přibližně 7,6 hodin ve srovnání s přibližně 6 hodinami u mladších dospělých. Rozdíl byl přisuzován změnám ve stavu renálních funkcí subjektů a nebyl považován za klinicky významný. Zdá se, že absorpce léku není ovlivněna věkem. Úprava dávky LEVAQUIN® pouze na základě věku není nutná [viz Použití u konkrétních populací ].
Pediatričtí pacienti
Farmakokinetika levofloxacinu po jednorázové intravenózní dávce 7 mg/kg byla zkoumána u pediatrických pacientů ve věku od 6 měsíců do 16 let. Pediatričtí pacienti vylučovali levofloxacin rychleji než dospělí pacienti, což vedlo k nižším plazmatickým expozicím než u dospělých při dané dávce mg/kg. Následné farmakokinetické analýzy předpověděly, že dávkovací režim 8 mg/kg každých 12 hodin (nepřekročit 250 mg na dávku) u pediatrických pacientů ve věku 6 měsíců až 17 let by dosáhl srovnatelných plazmatických expozic v ustáleném stavu (AUC0-24 a Cmax ). ty pozorované u dospělých pacientů, kterým bylo podáváno 500 mg levofloxacinu jednou za 24 hodin. Tablety LEVAQUIN® lze podávat pouze pediatrickým pacientům s inhalačním antraxem (po expozici) nebo morem, kteří váží 30 kg nebo více kvůli omezením dostupných sil [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Mužské A ženské Subjekty
Neexistují žádné významné rozdíly ve farmakokinetice levofloxacinu mezi muži a ženami, když pacienti rozdíly v clearance kreatininu jsou brány v úvahu. Po perorální dávce 500 mg přípravku LEVAQUIN® zdravým mužským subjektům byl průměrný terminální poločas eliminace levofloxacinu z plazmy přibližně 7,5 hodiny ve srovnání s přibližně 6,1 hodinami u žen. Tento rozdíl byl přisouzen změnám ve stavu renálních funkcí u mužů a žen a nebyl považován za klinicky významný. Zdá se, že absorpce léku není ovlivněna pohlavím subjektů. Úprava dávky pouze na základě pohlaví není nutná.
Rasové nebo etnické skupiny
Vliv rasy na farmakokinetiku levofloxacinu byl zkoumán pomocí kovariátní analýzy provedené na datech od 72 subjektů: 48 bílých a 24 nebílých. Zjevná celková tělesná clearance a zdánlivý distribuční objem nebyly ovlivněny rasou subjektů.
Pacienti s poruchou ledvin
Clearance levofloxacinu je podstatně snížena a poločas eliminace z plazmy je podstatně prodloužen u dospělých pacientů s poruchou funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Pacienti s poruchou funkce jater
Farmakokinetické studie u pacientů s poruchou funkce jater nebyly provedeny. Vzhledem k omezenému rozsahu metabolismu levofloxacinu se neočekává, že by farmakokinetika levofloxacinu byla ovlivněna poruchou funkce jater (viz Použití u konkrétních populací ].
Pacienti s bakteriální infekcí
Farmakokinetika levofloxacinu u pacientů se závažnými bakteriálními infekcemi získanými v komunitě je srovnatelná s farmakokinetikou pozorovanou u zdravých subjektů.
Studie lékových interakcí
Byl hodnocen potenciál farmakokinetických lékových interakcí mezi přípravkem LEVAQUIN® a antacidy, warfarinem, teofylinem, cyklosporinem, digoxinem, probenecidem a cimetidinem [viz DROGOVÉ INTERAKCE ].
Mikrobiologie
Mechanismus působení
Levofloxacin je L-izomer racemátu, ofloxacinu, chinolonového antimikrobiálního činidla. Antibakteriální aktivita ofloxacinu spočívá především v L-izomeru. Mechanismus účinku levofloxacinu a dalších fluorochinolonových antimikrobiálních látek zahrnuje inhibici bakteriální topoizomerázy IV a DNA gyrázy (obě jsou topoizomerázy typu II), enzymů nezbytných pro replikaci, transkripci, opravu a rekombinaci DNA.
Odpor
Fluorochinolonová rezistence může vzniknout prostřednictvím mutací v definovaných oblastech DNA gyrázy nebo topoizomerázy IV, označovaných jako oblasti určující rezistenci na chinolony (QRDR), nebo prostřednictvím změněného efluxu.
Fluorochinolony, včetně levofloxacinu, se liší chemickou strukturou a způsobem účinku od aminoglykosidů, makrolidů a β-laktamových antibiotik, včetně penicilinů. Fluorochinolony proto mohou být aktivní proti bakteriím odolným vůči těmto antimikrobiálním látkám.
Rezistence vůči levofloxacinu v důsledku spontánní mutace in vitro je vzácný výskyt (rozmezí: 10-9 až 10-10). Mezi levofloxacinem a některými dalšími fluorochinolony byla pozorována zkřížená rezistence, některé mikroorganismy rezistentní na jiné fluorochinolony mohou být citlivé na levofloxacin.
Antimikrobiální aktivita
Levofloxacin má in vitro aktivitu proti gramnegativním a grampozitivním bakteriím.
Bylo prokázáno, že levofloxacin je účinný proti většině izolátů následujících bakterií in vitro i při klinických infekcích, jak je popsáno v INDIKACE :
Aerobní bakterie
Gram-pozitivní bakterie
Enterococcus faecalisStaphylococcus aureus (izoláty citlivé na meticilin)Staphylococcus epidermidis (izoláty citlivé na meticilin)Staphylococcus saprophyticusStreptococcus pneumoniae (včetně izolátů rezistentních vůči více lékům [MDRSP]1)Streptokoky
Gram-negativní bakterie
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Jiné mikroorganismy
Chlamydophila pneumoniae Mycoplasma pneumoniae
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám: Levofloxacin vykazuje in vitro minimální inhibiční koncentrace (hodnoty MIC) 2 mcg/ml nebo méně proti většině (≥90 %) izolátů následujících mikroorganismů; bezpečnost a účinnost přípravku LEVAQUIN® při léčbě klinických infekcí způsobených těmito bakteriemi však nebyla stanovena v adekvátních a dobře kontrolovaných klinických studiích.
MDRSP (Multi-drug resistant Streptococcus pneumoniae) izoláty jsou izoláty rezistentní vůči dvěma nebo více z následujících antibiotik: penicilin (MIC ≥2 mcg/ml), cefalosporiny 2. generace, např. cefuroxim; makrolidy, tetracykliny a trimethoprim/sulfamethoxazol.
Aerobní bakterie
Gram-pozitivní bakterie
Staphylococcus haemolyticusβ-hemolytický streptokok (skupina C/F)β-hemolytický streptokok (skupina G)Streptococcus agalactiaeStreptococcus milleriViridans skupina streptokokůBacillus anthracis
Gram-negativní bakterie
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea aglomeransProteus vulgarisi ProvidenciasettomeriProvidenciasettromisu Providenciasettersi
Anaerobní bakterie
Gram-pozitivní bakterie
Clostridium perfringens
Testy citlivosti
Konkrétní informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: https://www.fda.gov/STIC.
Toxikologie zvířat a/nebo farmakologie
Bylo prokázáno, že levofloxacin a další chinolony způsobují artropatii u nezralých zvířat většiny testovaných druhů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. U nezralých psů (4–5 měsíců starých) vedly perorální dávky levofloxacinu 10 mg/kg/den po dobu 7 dnů a intravenózní dávky 4 mg/kg/den po dobu 14 dnů k artropatickým lézím. Podání perorálních dávek 300 mg/kg/den po dobu 7 dnů a intravenózních dávek 60 mg/kg/den po dobu 4 týdnů vyvolalo u juvenilních potkanů artropatii. Tříměsíční psi bígl, kterým byl perorálně podáván levofloxacin v dávce 40 mg/kg/den, vykazovali klinicky závažnou artrotoxicitu, která vedla k ukončení podávání v den 8 14denního dávkovacího programu. Mírné muskuloskeletální klinické účinky, při absenci makroskopických patologických nebo histopatologických účinků, byly výsledkem nejnižší dávky 2,5 mg/kg/den (přibližně 0,2násobek pediatrické dávky na základě srovnání AUC). Synovitida a léze kloubní chrupavky byly pozorovány při dávkách 10 a 40 mg/kg (přibližně 0,7násobek a 2,4násobek pediatrické dávky, v daném pořadí, na základě srovnání AUC). Hrubá patologie a histopatologie kloubní chrupavky přetrvávaly až do konce 18týdenního období zotavení u těchto psů z úrovní dávek 10 a 40 mg/kg/den.
Při testování v biologickém testu otoku ucha myší levofloxacin vykazoval fototoxicitu podobnou velikosti jako ofloxacin, ale menší fototoxicitu než jiné chinolony.
Zatímco krystalurie byla pozorována v některých studiích s intravenózními potkany, močové krystaly se v močovém měchýři netvoří, jsou přítomny pouze po močení a nejsou spojeny s nefrotoxicitou.
U myší je stimulační účinek chinolonů na CNS zesílen současným podáváním nesteroidních protizánětlivých léků.
U psů vyvolal levofloxacin podávaný v dávce 6 mg/kg nebo vyšší rychlou intravenózní injekcí hypotenzní účinky. Tyto účinky byly považovány za související s uvolňováním histaminu.
Studie in vitro a in vivo na zvířatech ukazují, že levofloxacin není ani induktorem enzymu, ani inhibitorem v rozmezí terapeutických koncentrací v lidské plazmě; proto se nepředpokládají žádné interakce s enzymy metabolizujícími léčivo s jinými léčivy nebo látkami.
Klinické studie
Nozokomiální pneumonie
Dospělí pacienti s klinicky a radiologicky dokumentovanou nozokomiální pneumonií byli zařazeni do multicentrické, randomizované, otevřené studie srovnávající intravenózní LEVAQUIN® (750 mg jednou denně) následovaný perorálním LEVAQUINEM® (750 mg jednou denně) po dobu celkem 7–15 dnů k intravenóznímu imipenemu/cilastatinu (500–1000 mg každých 6–8 hodin denně) a následně perorálnímu ciprofloxacinu (750 mg každých 12 hodin denně) po dobu celkem 7–15 dnů. Pacienti léčení přípravkem LEVAQUIN® dostávali v průměru 7 dní intravenózní terapie (rozmezí: 1–16 dní); pacienti léčení komparátorem dostávali v průměru 8 dní intravenózní terapie (rozmezí: 1–19 dní).
Celkově byla v klinicky a mikrobiologicky hodnotitelné populaci přídavná terapie empiricky zahájena při vstupu do studie u 56 z 93 (60,2 %) pacientů ve větvi LEVAQUIN® au 53 z 94 (56,4 %) pacientů ve srovnávací větvi. Průměrná doba trvání přídatné terapie byla 7 dní v rameni LEVAQUIN® a 7 dní ve srovnávacím léku. U klinicky a mikrobiologicky hodnotitelných pacientů s dokumentovanou infekcí Pseudomonas aeruginosa dostalo 15 ze 17 (88,2 %) ceftazidim (N = 11) nebo piperacilin/tazobaktam (N = 4) v rameni LEVAQUIN® a 16 ze 17 (94,1 %) aminoglykosid ve srovnávacím rameni. Celkově u klinicky a mikrobiologicky hodnotitelných pacientů byl vankomycin přidán do léčebného režimu 37 z 93 (39,8 %) pacientů ve větvi LEVAQUIN® a 28 z 94 (29,8 %) pacientů ve srovnávací větvi pro podezření na methicilin-rezistentní S. infekce aureus.
Míra klinické úspěšnosti u klinicky a mikrobiologicky hodnotitelných pacientů při návštěvě po terapii (primární cíl studie hodnocený 3.–15. den po dokončení terapie) byla 58,1 % pro LEVAQUIN® a 60,6 % pro komparátor. 95% CI pro rozdíl v četnosti odpovědí (LEVAQUIN® minus komparátor) byl [-17,2, 12,0]. Míra mikrobiologické eradikace při návštěvě po terapii byla 66,7 % pro LEVAQUIN® a 60,6 % pro komparátor. 95% CI pro rozdíl v míře eradikace (LEVAQUIN® minus komparátor) byl [-8,3, 20,3]. Klinický úspěch a míra mikrobiologické eradikace podle patogenu jsou podrobně uvedeny v tabulce 9.
Pneumonie získaná v komunitě
7–14denní léčebný režim
Dospělí hospitalizovaní a ambulantní pacienti s diagnózou komunitně získané bakteriální pneumonie byli hodnoceni ve 2 klíčových klinických studiích. V první studii bylo 590 pacientů zařazeno do prospektivní, multicentrické, nezaslepené randomizované studie porovnávající LEVAQUIN® 500 mg jednou denně perorálně nebo intravenózně po dobu 7 až 14 dnů s ceftriaxonem 1 až 2 gramy intravenózně jednou nebo ve stejně rozdělených dávkách dvakrát denně následně cefuroxim axetil 500 mg perorálně dvakrát denně po dobu celkem 7 až 14 dnů. Pacientům zařazeným do léčby kontrolním režimem bylo umožněno dostávat erytromycin (nebo doxycyklin, pokud erythromycin nesnášel), pokud bylo podezření na infekci způsobenou atypickými patogeny nebo byla prokázána. Klinická a mikrobiologická hodnocení byla prováděna během léčby, 5 až 7 dní po terapii a 3 až 4 týdny po terapii. Klinický úspěch (vyléčení plus zlepšení) s přípravkem LEVAQUIN® 5 až 7 dní po terapii, primární proměnnou účinnosti v této studii, byl lepší (95 %) než u kontrolní skupiny (83 %). 95% CI pro rozdíl v četnosti odpovědí (LEVAQUIN® minus komparátor) byl [-6, 19]. Ve druhé studii bylo 264 pacientů zařazeno do prospektivní, multicentrické, nekomparativní studie s 500 mg LEVAQUIN® podávaného perorálně nebo intravenózně jednou denně po dobu 7 až 14 dnů. Klinická úspěšnost u klinicky hodnotitelných pacientů byla 93 %. V obou studiích byla klinická úspěšnost u pacientů s atypickou pneumonií způsobenou Chlamydophila pneumoniae, Mycoplasma pneumoniae a Legionella pneumophila 96 %, 96 % a 70 %. Míry mikrobiologické eradikace v obou studiích jsou uvedeny v tabulce 10.
Pneumonie získaná v komunitě v důsledku multirezistentního Streptococcus Pneumoniae
LEVAQUIN® byl účinný při léčbě komunitní pneumonie způsobené multirezistentním Streptococcus pneumoniae (MDRSP). Izoláty MDRSP jsou izoláty rezistentní vůči dvěma nebo více z následujících antibakteriálních látek: penicilin (MIC ≥2 mcg/ml), cefalosporiny 2. generace (např. cefuroxim, makrolidy, tetracykliny a trimethoprim/sulfamethoxazol). Ze 40 mikrobiologicky hodnotitelných pacientů s izoláty MDRSP dosáhlo 38 pacientů (95,0 %) klinického a bakteriologického úspěchu po terapii. Míra klinické a bakteriální úspěšnosti je uvedena v tabulce 11.
Ne všechny izoláty byly odolné vůči všem testovaným antimikrobiálním třídám. Míra úspěšnosti a eradikace je shrnuta v tabulce 12.
Pneumonie získaná v komunitě
5denní léčebný režim
vyhodnocení bezpečnosti a účinnosti vyšší dávky a kratší kúry přípravku LEVAQUIN® bylo hodnoceno 528 ambulantních a hospitalizovaných dospělých s klinicky a radiologicky určenou mírnou až těžkou komunitní pneumonií ve dvojitě zaslepené, randomizované, prospektivní, multicentrické studii srovnávající přípravek LEVAQUIN ® 750 mg, IV nebo orálně, každý den po dobu pěti dnů nebo LEVAQUIN® 500 mg IV nebo orálně, každý den po dobu 10 dnů.
Míra klinické úspěšnosti (vyléčení plus zlepšení) v klinicky hodnotitelné populaci byla 90,9 % ve skupině LEVAQUIN® 750 mg a 91,1 % ve skupině LEVAQUIN® 500 mg. 95% CI pro rozdíl v četnosti odpovědí (LEVAQUIN® 750 minus LEVAQUIN® 500) byl [-5,9, 5,4]. V klinicky hodnotitelné populaci (31–38 dní po zařazení) byla pneumonie pozorována u 7 ze 151 pacientů ve skupině s přípravkem LEVAQUIN® 750 mg a u 2 ze 147 pacientů ve skupině s přípravkem LEVAQUIN® 500 mg. Vzhledem k malým pozorovaným počtům nelze významnost tohoto zjištění statisticky určit. Mikrobiologická účinnost 5denního režimu byla dokumentována u infekcí uvedených v tabulce 13.
Akutní bakteriální sinusitida
5denní a 10–14denní léčebné režimy
LEVAQUIN® je schválen pro léčbu akutní bakteriální sinusitidy (ABS) s použitím buď 750 mg ústy × 5 dní, nebo 500 mg ústy jednou denně × 10–14 dní. K vyhodnocení bezpečnosti a účinnosti vysokodávkové krátké léčby přípravkem LEVAQUIN® bylo hodnoceno 780 ambulantních dospělých s klinicky a radiologicky stanovenou akutní bakteriální sinusitidou ve dvojitě zaslepené, randomizované, prospektivní, multicentrické studii porovnávající přípravek LEVAQUIN® 750 mg perorálně jednou denně po dobu pěti dnů na LEVAQUIN® 500 mg perorálně jednou denně po dobu 10 dnů.
Míra klinické úspěšnosti (definovaná jako úplné nebo částečné vymizení známek a symptomů ABS před léčbou do takové míry, že nebyla považována za nezbytnou další antibiotickou léčbu) v mikrobiologicky hodnotitelné populaci byla 91,4 % (139/152) u LEVAQUIN® skupina 750 mg a 88,6 % (132/149) ve skupině 500 mg LEVAQUIN® při návštěvě testu vyléčení (TOC) (95% CI [-4,2, 10,0] pro LEVAQUIN® 750 mg mínus LEVAQUIN® 500 mg) .
Míra klinického úspěchu patogenem v mikrobiologicky hodnotitelné populaci, která měla vzorky odebrané antrálním tap při vstupu do studie, vykazovala srovnatelné výsledky pro pětidenní a desetidenní režimy při návštěvě testu vyléčení 22 dní po léčbě (viz tabulka 14) .
Komplikované infekce kůže a kožní struktury
Tři sta devadesát devět pacientů bylo zařazeno do otevřené, randomizované, srovnávací studie pro komplikované infekce kůže a kožní struktury. Pacienti byli randomizováni tak, aby dostávali buď LEVAQUIN® 750 mg jednou denně (IV a následně perorálně), nebo schválený komparátor po dobu mediánu 10 ± 4,7 dne. Jak se očekává u komplikovaných infekcí kůže a kožních struktur, byly chirurgické zákroky prováděny ve skupinách LEVAQUIN® a komparátorů. Chirurgický zákrok (řez a drenáž nebo debridement) byl proveden u 45 % pacientů léčených přípravkem LEVAQUIN® a 44 % pacientů léčených komparátorem, a to buď krátce před nebo v průběhu léčby antibiotiky a tvořily nedílnou součást terapie této indikace.
Mezi těmi, kteří mohli být klinicky vyhodnoceni 2–5 dní po dokončení studovaného léku, byla celková míra úspěšnosti (zlepšení nebo vyléčení) 116/138 (84,1 %) u pacientů léčených přípravkem LEVAQUIN® a 106/132 (80,3 %) u pacientů léčených se srovnávačem.
Úspěšnost se lišila podle typu diagnózy v rozmezí od 68 % u pacientů s infikovanými vředy do 90 % u pacientů s infikovanými ranami a abscesy. Tyto míry byly stejné jako u srovnávacích léků.
Chronická bakteriální prostatitida
Dospělí pacienti s klinickou diagnózou prostatitidy a výsledky mikrobiologické kultivace ze vzorku moči odebraného po masáži prostaty (VB3) nebo vzorků exprimované prostatické sekrece (EPS) získaných postupem Meares-Stamey byli zařazeni do multicentrické, randomizované, dvojitě zaslepené studie porovnávající perorálně LEVAQUIN® 500 mg, jednou denně po dobu celkem 28 dnů k perorálnímu ciprofloxacinu 500 mg, dvakrát denně po dobu celkem 28 dnů. Primárním cílovým parametrem účinnosti byla mikrobiologická účinnost u mikrobiologicky hodnotitelných pacientů. Do skupiny LEVAQUIN® a ciprofloxacinu bylo zařazeno celkem 136 a 125 mikrobiologicky hodnotitelných pacientů. Míra mikrobiologické eradikace infekcí pacienta za 5–18 dní po dokončení terapie byla 75,0 % ve skupině s LEVAQUINEM® a 76,8 % ve skupině s ciprofloxacinem (95% CI [-12,58, 8,98] pro LEVAQUIN® minus ciprofloxacin). Celková míra eradikace sledovaných patogenů je uvedena v tabulce 15.
Míra eradikace S. epidermidis, pokud byla nalezena s jinými kopatogeny, je v souladu s mírami pozorovanými u čistých izolátů.
Míra klinické úspěšnosti (vyléčení + zlepšení bez nutnosti další antibiotické terapie) v mikrobiologicky hodnotitelné populaci 5–18 dní po dokončení terapie byla 75,0 % u pacientů léčených přípravkem LEVAQUIN® a 72,8 % u pacientů léčených ciprofloxacinem (95 % CI [- 8,87, 13,27] pro LEVAQUIN® minus ciprofloxacin). Míra klinické dlouhodobé úspěšnosti (24–45 dní po dokončení terapie) byla 66,7 % u pacientů léčených přípravkem LEVAQUIN® a 76,9 % u pacientů léčených ciprofloxacinem (95% CI [-23,40, 2,89] pro přípravek LEVAQUIN® mínus ciprofloxacin).
Komplikované infekce močových cest a akutní pyelonefritida
5denní léčebný režim
vyhodnocení bezpečnosti a účinnosti vyšší dávky a kratšího cyklu LEVAQUIN® bylo 1109 pacientů s cUTI a AP zařazeno do randomizované, dvojitě zaslepené, multicentrické klinické studie provedené v USA od listopadu 2004 do dubna 2006 srovnávající LEVAQUIN® 750 mg IV nebo perorálně jednou denně po dobu 5 dnů (546 pacientů) s ciprofloxacinem 400 mg IV nebo 500 mg perorálně dvakrát denně po dobu 10 dnů (563 pacientů). Pacienti s AP komplikovanou základním onemocněním ledvin nebo stavy, jako je úplná obstrukce, operace, transplantace, souběžná infekce nebo vrozená malformace, byli vyloučeni. Účinnost byla měřena bakteriologickou eradikací základního organismu (organismů) při návštěvě po léčbě u pacientů s patogenem identifikovaným na začátku. Návštěva po terapii (test-of-cure) nastala 10 až 14 dní po poslední aktivní dávce přípravku LEVAQUIN® a 5 až 9 dní po poslední dávce aktivního ciprofloxacinu.
Celková míra bakteriologického vyléčení pro LEVAQUIN® a kontrolu při návštěvě testu vyléčení (TOC) pro skupinu všech pacientů s dokumentovaným patogenem na začátku (modifikovaný záměr léčit nebo mITT) a skupinu pacientů v populaci mITT kteří pečlivě dodržovali protokol (mikrobiologicky hodnotitelný), jsou shrnuty v tabulce 16.
Míry mikrobiologické eradikace v mikrobiologicky hodnotitelné populaci při TOC pro jednotlivé patogeny získané od pacientů randomizovaných k léčbě přípravkem LEVAQUIN® jsou uvedeny v tabulce 17.
Komplikované infekce močových cest a akutní pyelonefritida
10denní léčebný režim
vyhodnocení bezpečnosti a účinnosti dávky 250 mg, 10denního režimu LEVAQUIN®, bylo 567 pacientů s nekomplikovanou UTI, mírnou až středně závažnou cUTI a mírnou až středně závažnou AP zařazeno do randomizované, dvojitě zaslepené, multicentrické klinická studie prováděná v USA od června 1993 do ledna 1995 srovnávající LEVAQUIN® 250 mg perorálně jednou denně po dobu 10 dnů (285 pacientů) s ciprofloxacinem 500 mg perorálně dvakrát denně po dobu 10 dnů (282 pacientů). Pacienti s rezistentním patogenem, recidivující UTI, ženy starší 55 let a se zavedeným katetrem byli původně vyloučeni, před změnou protokolu, ke které došlo po 30 % zařazení. Mikrobiologická účinnost byla měřena bakteriologickou eradikací základního organismu (organismů) 1–12 dní po léčbě u pacientů s patogenem identifikovaným na počátku.
Celková míra bakteriologického vyléčení pro LEVAQUIN® a kontrolu při návštěvě testu vyléčení (TOC) pro skupinu všech pacientů s dokumentovaným patogenem na začátku (modifikovaný záměr léčit nebo mITT) a skupinu pacientů v populaci mITT kteří pečlivě dodržovali protokol (mikrobiologicky hodnotitelný), jsou shrnuty v tabulce 18.
Inhalační antrax (po expozici)
Účinnost přípravku LEVAQUIN® pro tuto indikaci je založena na plazmatických koncentracích dosažených u lidí, což je zástupný cíl, který pravděpodobně předpovídá klinický přínos. LEVAQUIN® nebyl testován na lidech pro postexpoziční prevenci inhalačního antraxu. Průměrné plazmatické koncentrace LEVAQUIN® spojené se statisticky významným zlepšením přežití oproti placebu v modelu inhalačního antraxu u opice rhesus jsou dosaženy nebo překročeny u dospělých a pediatrických pacientů, kteří dostávají doporučené perorální a intravenózní dávkovací režimy [viz INDIKACE a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Farmakokinetika levofloxacinu byla hodnocena u dospělých a pediatrických pacientů. Průměrná (± SD) maximální plazmatická koncentrace v ustáleném stavu u dospělých lidí užívajících 500 mg perorálně nebo intravenózně jednou denně je 5,7 ± 1,4 a 6,4 ± 0,8 mcg/ml, v daném pořadí; a odpovídající celková plazmatická expozice (AUC ) je 47,5 ± 6,7 a 54,6 ± 11,1 mcg.h/ml, v daném pořadí. Předpokládané farmakokinetické parametry v ustáleném stavu u pediatrických pacientů ve věku od 6 měsíců do 17 let užívajících 8 mg/kg perorálně každých 12 hodin (nesmí překročit 250 mg na dávku) byly vypočteny jako srovnatelné s parametry pozorovanými u dospělých užívajících 500 mg perorálně jednou denně [viz KLINICKÁ FARMAKOLOGIE ].
Tablety LEVAQUIN® lze podávat pouze pediatrickým pacientům s inhalačním antraxem (postexpozice) nebo morem, kteří váží 30 kg nebo více kvůli omezením dostupných sil [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
dospělých je bezpečnost přípravku LEVAQUIN® pro léčbu trvající až 28 dní dobře charakterizována. Informace týkající se prodlouženého užívání 500 mg denně po dobu až 60 dnů jsou však omezené. Prodloužená léčba přípravkem LEVAQUIN® u dospělých by se měla používat pouze tehdy, pokud přínos převáží riziko.
U pediatrických pacientů nebyla bezpečnost levofloxacinu při léčbě trvající déle než 14 dnů studována. V klinických studiích s délkou léčby až 14 dnů byl pozorován zvýšený výskyt muskuloskeletálních nežádoucích účinků (artralgie, artritida, tendinopatie, abnormality chůze) ve srovnání s kontrolami. Údaje o dlouhodobé bezpečnosti, včetně účinků na chrupavku, po podání levofloxacinu dětským pacientům jsou omezené (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Byla provedena placebem kontrolovaná studie na zvířatech na opicích rhesus vystavených inhalované průměrné dávce 49 LD50 (~2,7 × 106) spor (rozmezí 17 – 118 LD50) B. anthracis (kmen Ames). Minimální inhibiční koncentrace (MIC) levofloxacinu pro kmen antraxu použitý v této studii byla 0,125 mcg/ml. U studovaných zvířat byly průměrné plazmatické koncentrace levofloxacinu dosažené při očekávaném Tmax (1 hodina po dávce) po perorálním podání do ustáleného stavu v rozmezí od 2,79 do 4,87 mcg/ml. Minimální koncentrace v ustáleném stavu 24 hodin po dávce se pohybovaly od 0,107 do 0,164 mcg/ml. Průměrná (SD) AUC0-24 ustáleného stavu byla 33,4 ± 3,2 mcg.h/ml (rozsah 30,4 až 36,0 mcg.h/ml). Úmrtnost způsobená antraxem u zvířat, která dostávala 30denní režim perorálního podávání LEVAQUINU® počínaje 24 hodinami po expozici, byla významně nižší (1/10) ve srovnání se skupinou s placebem (9/10) [P = 0,0011, 2stranný Fisher 39;s Přesný test]. Jedno zvíře léčené levofloxacinem, které zemřelo na antrax, tak učinilo po 30denním období podávání léku.
Mor
Studie účinnosti přípravku LEVAQUIN® nemohly být provedeny u lidí s plicním morem z etických důvodů az důvodů proveditelnosti. Proto bylo schválení této indikace založeno na studii účinnosti provedené na zvířatech.
Průměrné plazmatické koncentrace LEVAQUIN® spojené se statisticky významným zlepšením přežití oproti placebu u modelu africké zelené opice plicního moru jsou dosaženy nebo překročeny u dospělých a pediatrických pacientů, kteří dostávají doporučené perorální a intravenózní dávkovací režimy [viz INDIKACE a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Farmakokinetika levofloxacinu byla hodnocena u dospělých a pediatrických pacientů. Průměrná (± SD) maximální plazmatická koncentrace v ustáleném stavu u dospělých lidí užívajících 500 mg perorálně nebo intravenózně jednou denně je 5,7 ± 1,4 a 6,4 ± 0,8 mcg/ml, v daném pořadí; a odpovídající celková plazmatická expozice (AUC0-24) je 47,5 ± 6,7 a 54,6 ± 11,1 mcg.h/ml, v daném pořadí. Předpokládané farmakokinetické parametry v ustáleném stavu u pediatrických pacientů ve věku od 6 měsíců do 17 let užívajících 8 mg/kg perorálně každých 12 hodin (nesmí překročit 250 mg na dávku) byly vypočteny jako srovnatelné s parametry pozorovanými u dospělých užívajících 500 mg perorálně jednou denně [viz KLINICKÁ FARMAKOLOGIE ]. Tablety LEVAQUIN® lze podávat pouze pediatrickým pacientům s inhalačním antraxem (postexpozice) nebo morem, kteří váží 30 kg nebo více kvůli omezením dostupných sil [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Byla provedena placebem kontrolovaná studie na zvířatech na afrických zelených opicích vystavených inhalační průměrné dávce 65 LD (rozmezí 3 až 145 LD50) Yersinia pestis (kmen CO92). Minimální inhibiční koncentrace (MIC) levofloxacinu pro kmen Y. pestis použitý v této studii byla 0,03 mcg/ml. Průměrné plazmatické koncentrace levofloxacinu dosažené na konci jedné 30minutové infuze se u afrických zelených opic pohybovaly v rozmezí od 2,84 do 3,50 mcg/ml. Minimální koncentrace 24 hodin po dávce se pohybovaly od 39 °C po dobu delší než 1 hodinu). Mortalita ve skupině LEVAQUIN® byla významně nižší (1/17) ve srovnání se skupinou s placebem (7/7) [p
INFORMACE PRO PACIENTA
LEVAQUIN® (Leave ah kwin) (levofloxacin) tablety
Jaké jsou nejdůležitější informace, které bych měl vědět o LEVAQUIN 500 mg?
LEVAQUIN 500 mg, fluorochinolonové antibiotikum, může způsobit závažné nežádoucí účinky. Některé z těchto závažných nežádoucích účinků se mohou objevit současně a mohou vést ke smrti.
Jestliže se u Vás během užívání přípravku LEVAQUIN 500 mg objeví některý z následujících závažných nežádoucích účinků, měli byste okamžitě přestat užívat LEVAQUIN a okamžitě vyhledat lékařskou pomoc.
- Problémy se šlachami se mohou vyskytnout u lidí všech věkových kategorií, kteří užívají LEVAQUIN. Šlachy jsou pevné provazce tkáně, které spojují svaly s kostmi. Některé problémy se šlachami zahrnují:
- bolest
- otok
- slzy a otoky šlach včetně zadní části kotníku (Achilles), ramene, ruky nebo jiných míst šlach.
- Riziko vzniku problémů se šlachami během užívání přípravku LEVAQUIN je vyšší, pokud:
- jsou starší 60 let
- podstoupili transplantaci ledvin, srdce nebo plic.
- Problémy se šlachami se mohou objevit u lidí, kteří nemají výše uvedené rizikové faktory, když užívají LEVAQUIN.
- Další důvody, které mohou zvýšit vaše riziko problémů se šlachami, mohou zahrnovat:
- fyzická aktivita nebo cvičení
- selhání ledvin
- problémy se šlachami v minulosti, například u lidí s revmatoidní artritidou (RA)
- Okamžitě přestaňte užívat LEVAQUIN a při prvních známkách bolesti, otoku nebo zánětu šlach okamžitě vyhledejte lékařskou pomoc. Vyhněte se cvičení a používání postižené oblasti.
- Nejčastější oblastí bolesti a otoku je Achillova šlacha na zadní straně kotníku. To se může stát i u jiných šlach. K léčbě infekce možná budete potřebovat jiné antibiotikum, které není fluorochinolon.
- K ruptuře šlachy může dojít během užívání nebo po ukončení užívání přípravku LEVAQUIN. K ruptuře šlach může dojít během hodin nebo dnů po užití přípravku LEVAQUIN a došlo k nim až několik měsíců poté, co lidé ukončili užívání fluorochinolonu.
- Okamžitě přestaňte užívat LEVAQUIN 750 mg a okamžitě vyhledejte lékařskou pomoc, pokud se u Vás objeví některý z následujících příznaků nebo příznaků ruptury šlachy:
- slyšet nebo cítit prasknutí nebo prasknutí v oblasti šlach
- modřiny hned po zranění v oblasti šlach
- neschopný pohybovat postiženou oblastí nebo nést váhu
- bolest
- hořící
- mravenčení
- necitlivost
- slabost
Poškození nervů může být trvalé.
- záchvaty
- slyšet hlasy, vidět věci nebo cítit věci, které tam nejsou (halucinace)
- cítit neklid
- otřesy
- cítit úzkost nebo nervozitu
- zmatek
- Deprese
- problémové spaní
- noční můry
- pociťovat točení hlavy nebo závratě
- cítit se podezřívavější (paranoia)
- sebevražedné myšlenky nebo činy
- bolesti hlavy, které nezmizí, s rozmazaným viděním nebo bez něj
Co je LEVAQUIN?
LEVAQUIN 500 mg je fluorochinolonové antibiotikum používané u dospělých ve věku 18 let nebo starších k léčbě některých infekcí způsobených určitými zárodky nazývanými bakterie. Mezi tyto bakteriální infekce patří:
- nozokomiální pneumonie
- komunitně získaná pneumonie
- kožní infekce, komplikované i nekomplikované
- chronická infekce prostaty
- vdechování zárodků antraxu
- mor
- infekce močových cest, komplikované i nekomplikované
- akutní infekce ledvin (pyelonefritida)
- akutní sinusová infekce
- akutní zhoršení nebo chronická bronchitida
Studie přípravku LEVAQUIN pro použití při léčbě moru a antraxu byly provedeny pouze na zvířatech, protože mor a antrax nebylo možné studovat u lidí.
LEVAQUIN by se neměl používat u pacientů s nekomplikovanými infekcemi močových cest, akutní bakteriální exacerbací chronické bronchitidy nebo akutní bakteriální sinusitidy, pokud jsou dostupné jiné možnosti léčby.
LEVAQUIN 750 mg tablety se také používá k léčbě dětí, které váží alespoň 66 liber (nebo alespoň 30 kilogramů) a které mohly vdechnout zárodky antraxu, mít mor nebo byly vystaveny bakteriím moru. Není známo, zda je přípravek LEVAQUIN bezpečný a účinný u dětí mladších 6 měsíců.
Bezpečnost a účinnost u dětí léčených přípravkem LEVAQUIN® déle než 14 dní není známa.
Kdo by neměl užívat LEVAQUIN 750 mg?
Neužívejte LEVAQUIN: jestliže jste někdy měl(a) závažnou alergickou reakci na antibiotikum známé jako fluorochinolon, nebo jestliže jste alergický(á) na levofloxacin nebo na kteroukoli složku přípravku LEVAQUIN. Úplný seznam složek přípravku LEVAQUIN naleznete na konci této příbalové informace.
Než začnete užívat LEVAQUIN, informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- mít problémy se šlachami; LEVAQUIN 250 mg by neměly užívat osoby, které mají v minulosti problémy se šlachami.
- máte problém, který způsobuje svalovou slabost (myasthenia gravis); LEVAQUIN by neměli užívat lidé, kteří mají v anamnéze myasthenia gravis.
- máte problémy s centrálním nervovým systémem, jako jsou záchvaty (epilepsie).
- mít nervové problémy; LEVAQUIN 250 mg by neměli užívat pacienti, kteří mají v anamnéze nervový problém nazývaný periferní neuropatie.
- máte nebo kdokoli z vaší rodiny má nepravidelný srdeční tep, zejména stav nazývaný „prodloužení QT intervalu“.
- máte nízkou hladinu draslíku v krvi (hypokalémii).
- mít problémy s kostmi.
- máte problémy s klouby včetně revmatoidní artritidy (RA).
- mít problémy s ledvinami. Pokud vaše ledviny nepracují dobře, možná budete potřebovat nižší dávku přípravku LEVAQUIN.
- mít problémy s játry.
- máte cukrovku nebo problémy s nízkou hladinou cukru v krvi (hypoglykémie).
- jste těhotná nebo plánujete otěhotnět. Není známo, zda LEVAQUIN 750 mg poškodí vaše nenarozené dítě.
- kojíte nebo plánujete kojit. Není známo, zda LEVAQUIN přechází do vašeho mateřského mléka. Vy a váš poskytovatel zdravotní péče byste se měli rozhodnout, zda budete užívat LEVAQUIN 250 mg nebo kojit. Neměli byste dělat obojí.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
LEVAQUIN a jiné léky se mohou vzájemně ovlivňovat a způsobit nežádoucí účinky.
Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte:
- steroidní lék.
- antipsychotický lék.
- tricyklické antidepresivum.
- pilulka na vodu (diuretikum).
- některé léky mohou bránit správnému účinku přípravku LEVAQUIN 750 mg. Užívejte LEVAQUIN® buď 2 hodiny před nebo 2 hodiny po užití těchto léků nebo doplňků:
- antacidum, multivitamin nebo jiné léky nebo doplňky, které obsahují hořčík, hliník, železo nebo zinek
- sukralfát (Carafate®)
- didanosin (Videx®, Videx® EC)
- lék na ředění krve (warfarin, Coumadin, Jantoven).
- perorální lék proti cukrovce nebo inzulín.
- NSAID (nesteroidní protizánětlivý lék). Mnoho běžných léků na úlevu od bolesti jsou NSAID. Užívání NSAID během užívání přípravku LEVAQUIN 250 mg nebo jiných fluorochinolonů může zvýšit riziko účinků na centrální nervový systém a záchvatů.
- theofylin (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- lék na kontrolu srdeční frekvence nebo rytmu (antiarytmika).
Pokud si nejste jisti, zda jsou některé z vašich léků uvedeny výše, zeptejte se svého poskytovatele zdravotní péče. Znát léky, které užíváte. Uchovávejte si seznam svých léků a ukažte jej svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat LEVAQUIN 500 mg?
- Užívejte LEVAQUIN přesně podle pokynů svého poskytovatele zdravotní péče.
- Užívejte LEVAQUIN 750 mg každý den přibližně ve stejnou dobu.
- Během užívání přípravku LEVAQUIN pijte dostatek tekutin.
- LEVAQUIN lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku přípravku LEVAQUIN 500 mg, užijte ji, jakmile si vzpomenete. Neužívejte více než 1 dávku za 1 den.
- Nevynechávejte žádné dávky přípravku LEVAQUIN 750 mg ani nepřestávejte užívat, i když se začnete cítit lépe, dokud nedokončíte předepsanou léčbu, pokud:
- máte problémy se šlachami. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o LEVAQUIN 500 mg?".
- máte problém s nervy. Vidět "Jaké jsou možné vedlejší účinky přípravku LEVAQUIN?".
- máte problém s centrální nervovou soustavou. Vidět "Jaké jsou možné vedlejší účinky přípravku LEVAQUIN 750 mg?".
- máte závažnou alergickou reakci. Vidět "Jaké jsou možné vedlejší účinky přípravku LEVAQUIN 250 mg?".
- váš poskytovatel zdravotní péče vám řekl, abyste přestal užívat LEVAQUIN.
Užívání všech vašich dávek LEVAQUIN 500 mg pomůže zajistit, že všechny bakterie budou zabity. Užívání všech vašich dávek LEVAQUINU 250 mg vám pomůže snížit pravděpodobnost, že se bakterie stanou rezistentními vůči LEVAQUINU. Pokud se vaše infekce během užívání přípravku LEVAQUIN 750 mg nezlepší, může to znamenat, že bakterie způsobující vaši infekci mohou být na přípravek LEVAQUIN rezistentní. Pokud se vaše infekce nezlepší, zavolejte svého poskytovatele zdravotní péče. Pokud se vaše infekce nezlepší, LEVAQUIN a další podobné antibiotické léky u vás v budoucnu nemusí účinkovat.
- Pokud užijete příliš mnoho přípravku LEVAQUIN, zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc.
Čemu se mám vyvarovat při užívání přípravku LEVAQUIN 500 mg?
- LEVAQUIN vám může způsobit závrať a točení hlavy. Ne řídit, obsluhovat stroje nebo dělat jiné činnosti, které vyžadují duševní bdělost nebo koordinaci, dokud nezjistíte, jak na vás přípravek LEVAQUIN působí.
- Vyhněte se slunečním paprskům, soláriím a snažte se omezit čas na slunci. LEVAQUIN 750 mg může způsobit, že vaše pokožka bude citlivá na slunce (fotosenzitivita) a na světlo ze slunečních lamp a solárií. Mohli byste se vážně spálit od slunce, způsobit puchýře nebo otok kůže. Pokud se u Vás během užívání přípravku LEVAQUIN objeví některý z těchto příznaků, ihned zavolejte svého poskytovatele zdravotní péče. Pokud musíte být na slunci, měli byste používat opalovací krém a nosit klobouk a oblečení, které vám zakryje pokožku.
Jaké jsou možné vedlejší účinky přípravku LEVAQUIN 750 mg?
LEVAQUIN 750 mg může způsobit závažné nežádoucí účinky, včetně:
- Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o LEVAQUIN 250 mg?"
- Závažné alergické reakce.
Alergické reakce se mohou vyskytnout u lidí užívajících fluorochinolony, včetně LEVAQUIN 500 mg, i po pouhé 1 dávce. Přestaňte užívat LEVAQUIN 500 mg a okamžitě vyhledejte lékařskou pomoc, pokud máte některý z následujících příznaků závažné alergické reakce:
- kopřivka
- potíže s dýcháním nebo polykáním
- otok rtů, jazyka, obličeje
- svírání hrdla, chrapot
- rychlý srdeční tep
- chabý
- vyrážka
lidí užívajících LEVAQUIN 500 mg se může objevit kožní vyrážka i po pouhé 1 dávce. Přestaňte užívat LEVAQUIN 250 mg při prvních známkách kožní vyrážky a okamžitě kontaktujte svého poskytovatele zdravotní péče. Kožní vyrážka může být známkou závažnější reakce na LEVAQUIN.
- Poškození jater (hepatotoxicita): U lidí, kteří užívají LEVAQUIN®, může dojít k hepatotoxicitě. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte nevysvětlitelné příznaky, jako jsou:
- nevolnost nebo zvracení
- bolest břicha
- horečka
- slabost
- bolest nebo citlivost břicha
- svědění
- neobvyklá únava
- ztráta chuti k jídlu
- světlé pohyby střev
- tmavě zbarvená moč
- zežloutnutí kůže nebo očního bělma
Přestaňte užívat LEVAQUIN 750 mg a ihned informujte svého poskytovatele zdravotní péče, pokud máte zežloutnou kůži nebo bílou část očí nebo pokud máte tmavou moč. Mohou to být příznaky závažné reakce na LEVAQUIN (problém s játry).
- Střevní infekce (pseudomembranózní kolitida) Pseudomembranózní kolitida se může objevit u mnoha antibiotik, včetně LEVAQUINU. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud dostanete vodnatý průjem, průjem, který nezmizí, nebo krvavou stolici. Můžete mít žaludeční křeče a horečku. Pseudomembranózní kolitida se může objevit 2 nebo více měsíců po ukončení léčby antibiotiky.
- Závažné změny srdečního rytmu (prodloužení QT intervalu a torsades depointes) Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte změnu srdečního rytmu (rychlý nebo nepravidelný srdeční tep) nebo pokud omdlíte. LEVAQUIN 250 mg může způsobit vzácný srdeční problém známý jako prodloužení QT intervalu. Tento stav může způsobit abnormální srdeční tep a může být velmi nebezpečný. Šance, že se to stane, jsou vyšší u lidí:
- kteří jsou starší
- s rodinnou anamnézou prodlouženého QT intervalu
- s nízkou hladinou draslíku v krvi (hypokalémie)
- kteří užívají určité léky na kontrolu srdečního rytmu (antiarytmika)
- Problémy s klouby U dětí může nastat zvýšená pravděpodobnost problémů s klouby a tkáněmi kolem kloubů. Informujte poskytovatele zdravotní péče svého dítěte, pokud má vaše dítě během léčby nebo po léčbě přípravkem LEVAQUIN nějaké problémy s klouby.
- Změny hladiny cukru v krvi Lidé, kteří užívají LEVAQUIN a další fluorochinolonové léky s perorálními léky proti cukrovce nebo s inzulínem, mohou mít nízkou hladinu cukru v krvi (hypoglykémii) a vysokou hladinu cukru v krvi (hyperglykémii). Postupujte podle pokynů svého poskytovatele zdravotní péče, jak často kontrolovat hladinu cukru v krvi. Pokud máte cukrovku a máte nízkou hladinu cukru v krvi během užívání přípravku LEVAQUIN, přestaňte přípravek LEVAQUIN 500 mg užívat a ihned kontaktujte svého poskytovatele zdravotní péče. Váš antibiotický lék může být nutné změnit.
- Citlivost na sluneční světlo (fotosenzitivita) Vidět "Čemu se mám vyvarovat při užívání LEVAQUINU?" Mezi nejčastější nežádoucí účinky přípravku LEVAQUIN 250 mg patří:
- nevolnost
- bolest hlavy
- průjem
- nespavost
- zácpa
- závrať
U dětí ve věku 6 měsíců a starších, které užívají LEVAQUIN k léčbě antraxového onemocnění nebo moru, je také časté zvracení.
LEVAQUIN může způsobit falešně pozitivní výsledky screeningu moči na opiáty, pokud je testování prováděno s některými komerčně dostupnými soupravami. Pozitivní výsledek by měl být potvrzen pomocí specifičtějšího testu. Toto nejsou všechny možné vedlejší účinky přípravku LEVAQUIN.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800- FDA-1088.
Jak mám LEVAQUIN 250 mg uchovávat?
- Uchovávejte LEVAQUIN 500 mg při pokojové teplotě mezi 59 °F až 86 °F (15 °C až 30 °C).
- Uchovávejte LEVAQUIN 500 mg v těsně uzavřené nádobě.
Obecné informace o bezpečném a účinném užívání přípravku LEVAQUIN.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte LEVAQUIN na stav, pro který není předepsán. Nedávejte LEVAQUIN 500 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Tento průvodce léky shrnuje nejdůležitější informace o LEVAQUIN. Pokud byste chtěli více informací o LEVAQUIN 750 mg, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku LEVAQUIN 500 mg, který je určen pro zdravotnické pracovníky.
Jaké jsou složky přípravku LEVAQUIN 500 mg?
Aktivní složka: levofloxacin
Neaktivní složky: krospovidon, hypromelóza, magnesium-stearát, mikrokrystalická celulóza, polyethylenglykol, polysorbát 80, oxid titaničitý.
LEVAQUIN 250 mg tablety také obsahují syntetický červený oxid železitý.
LEVAQUIN 500 mg tablety také obsahují syntetický červený oxid železitý a syntetický žlutý oxid železitý.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv
