Biaxin 250mg, 500mg Clarithromycin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Biaxin 500 mg a jak se používá?
Biaxin je lék na předpis používaný k léčbě příznaků mnoha různých bakteriálních infekcí, včetně žaludečních vředů a Helicobacter pylori. Biaxin lze užívat samostatně nebo s jinými léky.
Biaxin 500 mg je antibiotikum.
Není známo, zda je přípravek Biaxin bezpečný a účinný u dětí mladších 6 měsíců.
Jaké jsou možné vedlejší účinky přípravku Biaxin 250 mg?
Biaxin 500 mg může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- průjem obsahující krev,
- rychlé nebo bušení srdce,
- chvění v tvé hrudi,
- dušnost,
- náhlá závrať,
- zmatek,
- pocit točení,
- ztráta chuti k jídlu,
- bolest v horní části žaludku,
- únava,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí očí a kůže (žloutenka),
- málo nebo žádná moč,
- otoky nohou nebo kotníků,
- cítit se unaveně,
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Biaxin patří:
- bolest břicha,
- nevolnost,
- zvracení,
- průjem,
- neobvyklá nebo nepříjemná chuť v ústech,
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Biaxin. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Klaritromycin je semisyntetické makrolidové antimikrobiální činidlo pro perorální použití. Chemicky se jedná o 6-0-methylerythromycin. Molekulární vzorec je C38H69NO13 a molekulová hmotnost je 747,96. Strukturní vzorec je:
Obrázek 1: Struktura klarithromycinu
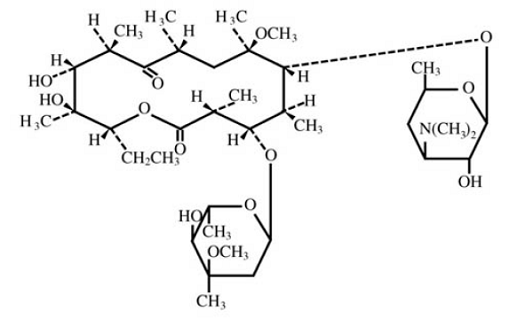
Klarithromycin je bílý až téměř bílý krystalický prášek. Je rozpustný v acetonu, těžce rozpustný v methanolu, ethanolu a acetonitrilu a prakticky nerozpustný ve vodě.
BIAXIN je dostupný jako tablety s okamžitým uvolňováním, tablety s prodlouženým uvolňováním a granule pro perorální suspenzi.
Každá žlutá oválná potahovaná tableta BIAXIN Filmtab s okamžitým uvolňováním (tablety clarithromycinu, USP) obsahuje 250 mg nebo 500 mg klarithromycinu a následující neúčinné složky:
- 250 mg tablety: hypromelóza, hydroxypropylcelulóza, sodná sůl kroskarmelózy, D&C žlutá č. 10, FD&C modrá č. 1, magnesium-stearát, mikrokrystalická celulóza, povidon, předbobtnalý škrob, propylenglykol, oxid křemičitý, kyselina sorbová, kyselina stesorbitanmonooleát, mastek, oxid titaničitý a vanilin.
- 500 mg tablety: hypromelóza, hydroxypropylcelulóza, koloidní oxid křemičitý, sodná sůl kroskarmelózy, D&C Yellow č. 10, magnesium-stearát, mikrokrystalická celulóza, povidon, propylenglykol, kyselina sorbová, sorbitanmonooleát, oxid titaničitý a vanilin.
Každá žlutá oválná potahovaná tableta BIAXIN XL Filmtab (klaritromycin tablety s prodlouženým uvolňováním) obsahuje 500 mg klarithromycinu a následující neaktivní složky: celulózové polymery, D&C Yellow č. 10, monohydrát laktózy, magnesium-stearát, propylenglykol, kyselina sorbová, sorbitan monooleát, mastek, oxid titaničitý a vanilin.
Každých 5 ml BIAXIN 500 mg rekonstituované suspenze (klarithromycin pro perorální suspenzi, USP) obsahuje 125 mg nebo 250 mg klarithromycinu. Každá lahvička granulí BIAXIN obsahuje 1250 mg (velikost 50 ml), 2500 mg (velikost 50 a 100 ml) nebo 5000 mg (velikost 100 ml) klarithromycinu a následující neaktivní složky: karbomer, ricinový olej, kyselina citrónová, ftalát hypromelózy, maltodextrin, sorban draselný, povidon, oxid křemičitý, sacharóza, xanthanová guma, oxid titaničitý a aroma ovocného punče.
INDIKACE
Akutní bakteriální exacerbace chronické bronchitidy
BIAXIN (Filmtab, Granule) a BIAXIN XL Filmtab jsou indikovány u dospělých k léčbě mírných až středně těžkých infekcí způsobených citlivými izoláty způsobenými Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis nebo Streptococcus pneumoniae [viz INDIKACE A POUŽITÍ ].
Akutní maxilární sinusitida
BIAXIN (Filmtab, Granule) a BIAXIN 500 mg XL Filmtab (u dospělých) jsou indikovány k léčbě mírných až středně závažných infekcí způsobených citlivými izoláty v důsledku Haemophilus influenzae, Moraxella catarrhalis nebo Streptococcus pneumoniae [viz INDIKACE A POUŽITÍ ].
Pneumonie získaná v komunitě
Jsou indikovány BIAXIN (Filmtab, Granules) a BIAXIN XL Filmtab [viz INDIKACE A POUŽITÍ ] k léčbě mírných až středně těžkých infekcí způsobených citlivými izoláty v důsledku:
- Haemophilus influenzae (u dospělých)
- Haemophilus parainfluenzae (BIAXIN 500 mg XL Filmtab u dospělých)
- Moraxella catarrhalis (BIAXIN 250 mg XL Filmtab u dospělých)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500 mg XL Filmtab [u dospělých]; BIAXIN Filmtab a BIAXIN Granule [u dospělých a dětských pacientů])
Faryngitida/tonzilitida
BIAXIN 500 mg Filmtab a BIAXIN 500 mg granule jsou indikovány k léčbě mírných až středně závažných infekcí způsobených citlivými izoláty způsobenými Streptococcus pyogenes jako alternativa u jedinců, kteří nemohou používat terapii první volby.
Nekomplikované infekce kůže a kožní struktury
BIAXIN Filmtab a BIAXIN Granule jsou indikovány k léčbě mírných až středně závažných infekcí způsobených citlivými izoláty způsobenými Staphylococcus aureus nebo Streptococcus pyogenes.
Akutní zánět středního ucha
BIAXIN Filmtab a BIAXIN 250 mg granule jsou indikovány u dětských pacientů k léčbě mírných až středně závažných infekcí způsobených citlivými izoláty způsobenými Haemophilus influenzae, Moraxella catarrhalis nebo Streptococcus pneumoniae [viz Klinické studie ].
Léčba a profylaxe diseminovaných mykobakteriálních infekcí
BIAXIN 500 mg Filmtab a BIAXIN 250 mg granule jsou indikovány k léčbě mírných až středně závažných infekcí způsobených citlivými izoláty způsobenými Mycobacterium avium nebo Mycobacterium intracellulare u pacientů s pokročilou infekcí HIV [viz Klinické studie ].
Helicobacter pylori infekce a duodenální vředová choroba
BIAXIN 250 mg Filmtab se podává v kombinaci s jinými léky u dospělých, jak je popsáno níže, k eradikaci H. pylori. Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu [viz Klinické studie ].
- BIAXIN Filmtab v kombinaci s amoxicilinem a PREVACID (lansoprazol) nebo PRILOSEC (omeprazol) tobolky s opožděným uvolňováním jako trojkombinace jsou indikovány k léčbě pacientů s infekcí H. pylori a vředovou chorobou dvanáctníku (aktivní nebo pětiletá anamnéza duodenálního vřed) k vymýcení H. pylori.
- BIAXIN 250 mg Filmtab v kombinaci s PRILOSEC (omeprazol) tobolkami je indikován k léčbě pacientů s aktivním duodenálním vředem spojeným s infekcí H. pylori. Režimy, které obsahují BIAXIN 250 mg Filmtab jako jediné antibakteriální činidlo, jsou pravděpodobněji spojeny s rozvojem rezistence na klarithromycin u pacientů, u kterých selhala léčba. Režimy obsahující klarithromycin by neměly být používány u pacientů se známými nebo suspektními izoláty rezistentními na klarithromycin, protože účinnost léčby je v tomto stavu snížena.
Omezení použití
BIAXIN 500 mg XL Filmtab je indikován pouze k léčbě akutní maxilární sinusitidy, akutní bakteriální exacerbace chronické bronchitidy a komunitní pneumonie u dospělých. Účinnost a bezpečnost přípravku BIAXIN 500 mg XL Filmtab při léčbě jiných infekcí, pro které jsou schváleny BIAXIN Filmtab a BIAXIN Granule, nebyly stanoveny.
některých bakteriálních infekcí způsobených Streptococcus pneumoniae a Staphylococcus aureus existuje rezistence na makrolidy. Testování citlivosti by mělo být provedeno, pokud je to klinicky indikováno.
Používání
Aby se snížil vývoj bakterií rezistentních vůči lékům a zachovala se účinnost přípravku BIAXIN a dalších antibakteriálních léků, měl by být přípravek BIAXIN používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
Důležité pokyny pro administraci
BIAXIN Filmtab a BIAXIN 250 mg granule mohou být podávány s jídlem nebo bez jídla.
BIAXIN XL Filmtab se má užívat s jídlem. Vlaštovka BIAXIN 500mg XL Filmtab celá; BIAXIN 500 mg XL Filmtab nežvýkejte, nelámejte ani nedrťte.
Dávkování pro dospělé
Doporučené dávkování přípravku BIAXIN 250 mg Filmtab a BIAXIN 250 mg XL Filmtab pro léčbu mírných až středně těžkých infekcí u dospělých jsou uvedeny v tabulce 1.
Kombinované dávkovací režimy pro infekci H. pylori
- Trojitá terapie: BIAXIN 500 mg Filmtab/lansoprazol/amoxicilin Doporučená dávka pro dospělé je 500 mg BIAXIN 500 mg Filmtab, 30 mg lansoprazolu a 1 gram amoxicilinu, vše se podává každých 12 hodin po dobu 10 nebo 14 dnů [viz INDIKACE A POUŽITÍ a Klinické studie ].
- Trojitá terapie: BIAXIN Filmtab/omeprazol/amoxicilin Doporučená dávka pro dospělé je 500 mg BIAXIN 250 mg Filmtab, 20 mg omeprazolu a 1 gram amoxicilinu; vše se podává každých 12 hodin po dobu 10 dnů. U pacientů s vředem přítomným v době zahájení léčby se doporučuje dalších 18 dní omeprazolu 20 mg jednou denně pro hojení vředů a zmírnění příznaků (viz INDIKACE A POUŽITÍ a Klinické studie ].
- Duální terapie: BIAXIN 500 mg Filmtab/omeprazol Doporučená dávka pro dospělé je 500 mg BIAXIN 250 mg Filmtab podávaných každých 8 hodin a 40 mg omeprazolu podávaných jednou každé ráno po dobu 14 dnů. Dalších 14 dní omeprazolu 20 mg jednou denně se doporučuje pro hojení vředů a zmírnění příznaků (viz INDIKACE A POUŽITÍ a Klinické studie ].
Pediatrické dávkování
Doporučená denní dávka je 15 mg/kg/den rozdělená každých 12 hodin po dobu 10 dnů (až do dávky pro dospělé). Další informace o dávkování naleznete v dávkovacích režimech pro mykobakteriální infekce u pediatrických pacientů [viz Dávkovací režimy pro mykobakteriální infekce ].
Dávkovací režimy pro mykobakteriální infekce
Pro léčbu diseminované infekce způsobené komplexem Mycobacterium avium (MAC) se jako primární látky doporučují BIAXIN Filmtab a BIAXIN 500 mg granule. BIAXIN Filmtab a BIAXIN Granule by měly být používány v kombinaci s jinými antimykobakteriálními léky (např. ethambutol), které prokázaly in vitro aktivitu proti MAC nebo klinický přínos při léčbě MAC [viz Klinické studie ].
Dospělí pacienti
Pro léčbu a profylaxi mykobakteriálních infekcí u dospělých je doporučená dávka přípravku BIAXIN 500 mg každých 12 hodin.
Pediatričtí pacienti
Pro léčbu a profylaxi mykobakteriálních infekcí u pediatrických pacientů je doporučená dávka 7,5 mg/kg každých 12 hodin až do 500 mg každých 12 hodin. [Vidět Použití u konkrétních populací a Klinické studie ].
Pokud je pozorována klinická odpověď, léčba přípravkem BIAXIN 250 mg by měla pokračovat. Léčba přípravkem BIAXIN může být přerušena, pokud je u pacienta považováno za nízké riziko diseminované infekce.
Úprava dávkování u pacientů s poruchou funkce ledvin
Viz tabulka 2 pro úpravu dávkování u pacientů se středně těžkou nebo těžkou poruchou funkce ledvin s nebo bez současného atazanaviru nebo režimů obsahujících ritonavir (viz DROGOVÉ INTERAKCE ].
Úprava dávkování v důsledku lékových interakcí
Při současném podávání s atazanavirem snižte dávku přípravku BIAXIN 500 mg o 50 % (viz DROGOVÉ INTERAKCE ]. Vzhledem k lékovým interakcím může být doporučena úprava dávkování u jiných léků při současném podávání s BIAXINEM 250 mg [viz DROGOVÉ INTERAKCE ].
Rekonstituce granulí BIAXIN
Dodávané granule BIAXIN 250 mg je nutné před podáním přípravku BIAXIN pro přípravu perorální suspenze rekonstituovat vodou. Tabulka 3 níže uvádí objem vody, který se má přidat při rekonstituci. K rekonstituci:
Před každým použitím dobře protřepejte. Po smíchání skladujte při teplotě 15° až 30°C (59° až 86°F) a spotřebujte do 14 dnů. Neuchovávejte v chladničce.
JAK DODÁVÁNO
Dávkové formy A Síly
BIAXIN 500 mg je dostupný jako:
- BIAXIN 250 mg Filmtab (žlutá oválná potahovaná tableta):
- 250 mg: potištěno modře s logem „a“ a KT
- 500 mg: s vyraženým logem „a“ na jedné straně a KL na druhé straně
- BIAXIN XL Filmtab (žlutá oválná potahovaná tableta s prodlouženým uvolňováním):
- 500 mg: s vyraženým logem „a“ a KJ
- BIAXIN Granule (bílé až téměř bílé granule před rekonstitucí; bílá až téměř bílá neprůhledná suspenze po rekonstituci):
- Koncentrace 125 mg/5 ml dostupná v 50 ml a 100 ml lahvičkách
- Koncentrace 250 mg/5 ml dostupná v 50 ml a 100 ml lahvičkách
Skladování A Manipulace
BIAXIN 250 mg Filmtab (tablety klarithromycinu, USP) je dodáván jako žluté oválné potahované tablety v následujících velikostech balení: 250 mg tablety: (potištěné modře s logem „a“ a KT)
Láhve po 60 ( NDC 0074-3368-60) a jednotková balení proužků po 100 ( NDC 0074-3368-11).
Uchovávejte BIAXIN Filmtab 250 mg při kontrolované pokojové teplotě 15° až 30°C (59° až 86°F) v dobře uzavřené nádobě. Chraňte před světlem.
500 mg tablety : (vyraženo s logem „a“ na jedné straně a KL na druhé straně)
Lahvičky po 60 (NDC 0074-2586-60) a balení jednotkových dávek po 100 ( NDC 0074-2586-11).
Uchovávejte BIAXIN Filmtab 500 mg při kontrolované pokojové teplotě 20° až 25°C (68° až 77°F) v dobře uzavřené nádobě.
BIAXIN XL Filmtab (klarithromycin tablety s prodlouženým uvolňováním) je dodáván jako žluté oválné potahované tablety v následujících velikostech balení:
500 mg tablety : (vyraženo logo „a“ a KJ)
Lahve po 60 (NDC 0074-3165-60), balení jednotkových dávek po 100 ( NDC 0074-3165-11) a BIAXIN XL PAC karton se 4 blistry po 14 tabletách ( NDC 0074-3165-41).
Uchovávejte BIAXIN 500 mg XL Filmtab při teplotě 20° až 25°C (68° až 77°F). Exkurze povoleny do 15° až 30°C (59° až 86°F). [Vidět USP řízená pokojová teplota .]
BIAXIN 500 mg granule (klaritromycin pro perorální suspenzi, USP) se dodává jako bílé až téměř bílé granule v následujících silách a velikostech:
Uchovávejte BIAXIN 500 mg granule při teplotě do 25 °C (77 °F) v dobře uzavřené nádobě. Rekonstituované granule BIAXIN 500 mg neuchovávejte v chladničce.
BIAXIN Filmtab 250 mg a 500 mg a BIAXIN 250 mg XL Filmtab 500 mg Mfd. od AbbVie LTD, Barceloneta, PR 00617. Granule BIAXIN, 125 mg/5 ml a 250 mg/5 ml Mfd. od AbbVie Inc., North Chicago, IL 60064 Pro AbbVie Inc., North Chicago, IL 60064, USA Revize: listopad 2018.
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Akutní hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatotoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné nežádoucí účinky v důsledku současného užívání s jinými léky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Exacerbace Myasthenia Gravis [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Na základě shromážděných údajů pro všechny indikace jsou nejčastějšími nežádoucími účinky u dospělé i pediatrické populace pozorované v klinických studiích bolest břicha, průjem, nauzea, zvracení a dysgeuzie. Rovněž byly hlášeny dyspepsie, abnormální jaterní testy, anafylaktická reakce, kandidóza, bolest hlavy, nespavost a vyrážka.
V následujících podkapitolách jsou uvedeny nejčastější nežádoucí účinky pro profylaxi a léčbu mykobakteriálních infekcí a duodenálních vředů spojených s infekcí H. pylori. Obecně jsou tyto profily v souladu s výše popsanými souhrnnými údaji.
Profylaxe Mykobakteriálních Infekcí
U pacientů s AIDS, kteří byli dlouhodobě léčeni přípravkem BIAXIN za účelem profylaxe proti M. avium, bylo často obtížné odlišit nežádoucí reakce, které mohou být spojeny s podáváním přípravku BIAXIN, od základního onemocnění HIV nebo interkurentního onemocnění. Medián trvání léčby byl 10,6 měsíce pro skupinu BIAXIN a 8,2 měsíce pro skupinu s placebem.
Změny laboratorních hodnot
Vybrané laboratorní nežádoucí účinky, které byly hlášeny během léčby u více než 2 % dospělých pacientů léčených přípravkem BIAXIN v randomizované dvojitě zaslepené klinické studii zahrnující 682 pacientů, jsou uvedeny v tabulce 5.
U imunokompromitovaných pacientů, kteří dostávali profylaxi proti M. avium, bylo provedeno vyhodnocení laboratorních hodnot analýzou hodnot mimo vážně abnormální hodnoty (tj. extrémně vysoké nebo nízké limity) pro specifikovaný test.
Léčba mykobakteriálních infekcí
Profily nežádoucích účinků pro dávkovací režim 500 mg i 1000 mg dvakrát denně byly podobné.
U pacientů s AIDS a dalších imunokompromitovaných pacientů léčených vyššími dávkami přípravku BIAXIN po dlouhou dobu kvůli mykobakteriálním infekcím bylo často obtížné odlišit nežádoucí reakce, které mohou být spojeny s podáváním přípravku BIAXIN 250 mg, od základních známek onemocnění HIV nebo interkurentního onemocnění.
Následující analýza shrnuje zkušenosti během prvních 12 týdnů léčby přípravkem BIAXIN. Údaje jsou uváděny odděleně pro studii 1 (randomizovaná, dvojitě zaslepená) a studie 2 (otevřená, použití ze soucitu) a také kombinované. Nežádoucí účinky byly ve studii 2 hlášeny méně často, což může být částečně způsobeno rozdíly v monitorování mezi těmito dvěma studiemi.
U dospělých pacientů užívajících BIAXIN 500 mg dvakrát denně jsou níže uvedeny nejčastěji hlášené nežádoucí účinky, považované za možná nebo možná související se studovaným lékem, s incidencí 5 % nebo vyšší (Tabulka 6). Přibližně 8 % pacientů, kteří dostávali 500 mg dvakrát denně, a 12 % pacientů, kteří dostávali 1000 mg dvakrát denně, přerušilo léčbu kvůli nežádoucím účinkům souvisejícím s lékem během prvních 12 týdnů léčby; nežádoucí reakce vedoucí k přerušení léčby u nejméně 2 pacientů zahrnovaly nauzeu, zvracení, bolest břicha, průjem, vyrážku a astenii.
Omezený počet dětských pacientů s AIDS byl léčen suspenzí BIAXIN pro mykobakteriální infekce. Nejčastěji hlášené nežádoucí účinky s výjimkou těch, které byly způsobeny souběžnými stavy pacienta, byly v souladu s těmi, které byly pozorovány u dospělých pacientů.
Změny laboratorních hodnot
V prvních 12 týdnech zahájení léčby přípravkem BIAXIN 500 mg dvakrát denně mělo 3 % pacientů zvýšení SGOT a 2 % pacientů mělo zvýšení SGPT > 5násobek horní hranice normálu ve studii 2 (469 zařazených dospělých pacientů), zatímco ve studii 1 (154 zařazených pacientů) nemělo žádné zvýšení transamináz. To zahrnuje pouze pacienty s výchozími hodnotami v normálním rozmezí nebo hraničně nízkými.
Duodenální vřed spojený s infekcí H. pylori
klinických studiích používajících kombinovanou léčbu s přípravkem BIAXIN 500 mg plus omeprazol a amoxicilin nebyly pozorovány žádné nežádoucí účinky specifické pro kombinaci těchto léků. Nežádoucí účinky, které se vyskytly, byly omezeny na ty, které byly dříve hlášeny u přípravku BIAXIN 250 mg, omeprazolu nebo amoxicilinu.
Profily nežádoucích účinků jsou uvedeny níže (Tabulka 7) pro čtyři randomizované dvojitě zaslepené klinické studie, ve kterých pacienti dostávali kombinaci přípravku BIAXIN 500 mg třikrát denně a omeprazolu 40 mg denně po dobu 14 dnů, poté omeprazol 20 mg jednou denně den (tři studie) nebo 40 mg jednou denně (jedna studie) po dobu dalších 14 dnů. Z 346 pacientů, kteří dostávali kombinaci, 3,5 % pacientů vysadilo lék kvůli nežádoucím účinkům.
Změny laboratorních hodnot
Změny laboratorních hodnot s možným klinickým významem u pacientů užívajících BIAXIN a omeprazol ve čtyřech randomizovaných dvojitě zaslepených studiích u 945 pacientů jsou následující:
Jaterní zvýšený přímý bilirubin
Méně časté nežádoucí účinky pozorované během klinických zkoušek klarithromycinu
Na základě shromážděných údajů pro všechny indikace byly v klinických studiích s klarithromycinem pozorovány následující nežádoucí účinky v míře nižší než 1 %:
Poruchy krve a lymfatického systému: Leukopenie, neutropenie, trombocytémie, eozinofilie
Srdeční poruchy: Prodloužení QT na elektrokardiogramu, zástava srdce, fibrilace síní, extrasystoly, palpitace
Poruchy ucha a labyrintu: Vertigo, tinitus, poruchy sluchu
Gastrointestinální poruchy: Stomatitida, glositida, ezofagitida, gastroezofageální reflux, gastritida, proktalgie, abdominální distenze, zácpa, sucho v ústech, říhání, plynatost
Obecné poruchy a podmínky v místě podání: Malátnost, pyrexie, astenie, bolest na hrudi, zimnice, únava
Poruchy jater a žlučových cest: Cholestáza, hepatitida
Poruchy imunitního systému: Přecitlivělost
Infekce a nákazy: Celulitida, gastroenteritida, infekce, vaginální infekce
Vyšetřování: Zvýšený bilirubin v krvi, zvýšená alkalická fosfatáza v krvi, zvýšená laktátdehydrogenáza v krvi, abnormální poměr albumin globulinu
Poruchy metabolismu a výživy: Anorexie, snížená chuť k jídlu
Poruchy svalové a kosterní soustavy a pojivové tkáně: Myalgie, svalové křeče, šíjová rigidita
Poruchy nervového systému: Závratě, třes, ztráta vědomí, dyskineze, somnolence
Psychiatrické poruchy: Úzkost, nervozita
Poruchy ledvin a močových cest: Zvýšený kreatinin v krvi, zvýšená močovina v krvi
Respirační, hrudní a mediastinální poruchy: Astma, epistaxe, plicní embolie
Poruchy kůže a podkožní tkáně: Urtikarie, bulózní dermatitida, pruritus, hyperhidróza, makulopapulózní vyrážka
Gastrointestinální nežádoucí účinky
Ve studiích akutní exacerbace chronické bronchitidy a akutní maxilární sinusitidy byly u podobného podílu pacientů užívajících buď BIAXIN 250 mg Filmtab nebo BIAXIN 500 mg XL Filmtab hlášeny celkové gastrointestinální nežádoucí účinky; nicméně pacienti užívající BIAXIN 500 mg XL Filmtab hlásili významně méně závažných gastrointestinálních příznaků ve srovnání s pacienty užívajícími BIAXIN 250 mg Filmtab. Kromě toho měli pacienti užívající BIAXIN 500 mg XL Filmtab významně méně předčasných přerušení léčby z důvodu gastrointestinálních nežádoucích účinků souvisejících s lékem nebo abnormálních chuťových nežádoucích účinků ve srovnání s přípravkem BIAXIN Filmtab.
Úmrtnost ze všech příčin u pacientů s onemocněním koronárních tepen 1 až 10 let po expozici BIAXINU
jedné klinické studii hodnotící výsledky léčby klarithromycinem u pacientů s onemocněním koronárních tepen bylo u pacientů randomizovaných na klarithromycin pozorováno zvýšení rizika mortality ze všech příčin. Klarithromycin k léčbě onemocnění koronárních tepen není schválenou indikací. Pacienti byli léčeni klarithromycinem nebo placebem po dobu 14 dnů a několik let u nich byly sledovány primární výsledné příhody (např. celková mortalita nebo nefatální srdeční příhody).1 Numericky vyšší počet primárních výsledných příhod u pacientů randomizovaných k léčbě klarithromycinem byl pozorováno s poměrem rizik 1,06 (95% interval spolehlivosti 0,98 až 1,14). Při sledování 10 let po léčbě však bylo 866 (40 %) úmrtí ve skupině s klarithromycinem a 815 (37 %) úmrtí ve skupině s placebem, což představovalo poměr rizika pro mortalitu ze všech příčin 1,10 (95 %). interval spolehlivosti 1,00 až 1,21). Rozdíl v počtu úmrtí se objevil po jednom roce nebo déle po ukončení léčby.
Příčina rozdílu v úmrtnosti ze všech příčin nebyla stanovena. Jiné epidemiologické studie hodnotící toto riziko prokázaly proměnlivé výsledky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zkušenosti
Během používání přípravku BIAXIN po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Krevní a lymfatický systém: Trombocytopenie, agranulocytóza
Srdeční: Ventrikulární arytmie, komorová tachykardie, torsades de pointes
Ucho a labyrint: Hluchota byla hlášena hlavně u starších žen a byla obvykle reverzibilní.
Gastrointestinální: Byla hlášena akutní pankreatitida, změna barvy jazyka, změna barvy zubů a byla obvykle reverzibilní profesionálním čištěním po vysazení léku.
Byly hlášeny případy BIAXIN 250 mg XL Filmtab ve stolici, z nichž mnohé se vyskytly u pacientů s anatomickými (včetně ileostomie nebo kolostomie) nebo funkčními gastrointestinálními poruchami se zkrácenou dobou průchodu GI. V několika zprávách se zbytky tablet vyskytly v souvislosti s průjmem. Doporučuje se, aby pacienti, u kterých se objeví zbytky tablet ve stolici a jejich stav se nezlepší, byli převedeni na jinou formu klarithromycinu (např. suspenzi) nebo jiný antibakteriální lék.
Hepatobiliární: Jaterní selhání, hepatocelulární žloutenka. U klarithromycinu byly hlášeny nežádoucí účinky související s jaterní dysfunkcí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Infekce a nákazy: Pseudomembranózní kolitida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Imunitní systém: Anafylaktické reakce, angioedém
Vyšetřování: Protrombinový čas se prodloužil, počet bílých krvinek se snížil, mezinárodní normalizovaný poměr se zvýšil. Byla hlášena abnormální barva moči spojená s jaterním selháním.
Metabolismus a výživa: Hypoglykémie byla hlášena u pacientů užívajících perorální hypoglykemika nebo inzulín.
Muskuloskeletální a pojivová tkáň: Byla hlášena myopatie rhabdomyolýza a v některých hlášeních byl klarithromycin podáván současně se statiny, fibráty, kolchicinem nebo alopurinolem (viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nervový systém: Parosmie, anosmie, ageuzie, parestézie a křeče
psychiatrické: Abnormální chování, stav zmatenosti, depersonalizace, dezorientace, halucinace, deprese, manické chování, abnormální sny, psychotická porucha. Tyto poruchy obvykle vymizí po vysazení léku.
Renální a močové: Intersticiální nefritida, selhání ledvin
Kůže a podkožní tkáň: Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, léková vyrážka s eozinofilií a systémovými příznaky (DRESS), Henochova-Schonleinova purpura, akné, akutní generalizovaná exantematózní pustulóza
Cévní: Krvácení
DROGOVÉ INTERAKCE
Je známo, že současné podávání přípravku BIAXIN 250 mg inhibuje CYP3A a léčivo primárně metabolizované CYP3A může být spojeno se zvýšením koncentrací léčiva, které by mohlo zvýšit nebo prodloužit terapeutické i nežádoucí účinky současně podávaného léčiva.
BIAXIN by měl být používán s opatrností u pacientů léčených jinými léky, o kterých je známo, že jsou substráty enzymu CYP3A, zvláště pokud má substrát CYP3A úzkou bezpečnostní hranici (např. karbamazepin) a/nebo je substrát tímto enzymem extenzivně metabolizován. Pokud je to vhodné, upravte dávkování a pečlivě sledujte sérové koncentrace léků primárně metabolizovaných CYP3A u pacientů současně užívajících klarithromycin.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Akutní hypersenzitivní reakce
případě závažných akutních hypersenzitivních reakcí, jako je anafylaxe, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, léková vyrážka s eozinofilií a systémovými příznaky (DRESS), Henochova-Schonleinova purpura a akutní generalizovaná exantematózní pustulóza, okamžitě přerušte léčbu přípravkem BIAXIN 250 mg nasadit vhodnou léčbu.
Prodloužení QT
BIAXIN 500 mg je spojován s prodloužením QT intervalu a vzácnými případy arytmie. Během postmarketingového sledování byly u pacientů užívajících BIAXIN spontánně hlášeny případy torsades de pointes. Byly hlášeny oběti na životech.
Vyhněte se BIAXINU u následujících pacientů:
- pacienti se známým prodloužením QT intervalu, ventrikulární srdeční arytmií, včetně torsades de pointes
- pacienti užívající léky, o kterých je známo, že prodlužují QT interval [viz také KONTRAINDIKACE ]
- pacientů s probíhajícími proarytmickými stavy, jako je nekorigovaná hypokalémie nebo hypomagnezémie, klinicky významnou bradykardií a u pacientů užívajících antiarytmika třídy IA (např. chinidin, prokainamid, disopyramid) nebo třídy III (např. dofetilid, amiodaron, sotalol).
Starší pacienti mohou být náchylnější k účinkům souvisejícím s lékem na QT interval [viz Použití u konkrétních populací ].
Hepatotoxicita
klarithromycinu byla hlášena jaterní dysfunkce, včetně zvýšených jaterních enzymů a hepatocelulární a/nebo cholestatická hepatitida, se žloutenkou nebo bez ní. Tato jaterní dysfunkce může být závažná a je obvykle reverzibilní. V některých případech bylo hlášeno selhání jater s fatálním koncem, které bylo obecně spojeno se závažnými základními onemocněními a/nebo souběžnou medikací. Příznaky hepatitidy mohou zahrnovat anorexii, žloutenku, tmavou moč, svědění nebo citlivé břicho. Pokud se objeví známky a příznaky hepatitidy, okamžitě ukončete léčbu přípravkem BIAXIN 500 mg.
Závažné nežádoucí účinky v důsledku současného užívání s jinými léky
Léky metabolizované CYP3A4
pacientů užívajících BIAXIN současně se substráty CYP3A4 byly hlášeny závažné nežádoucí účinky. Patří mezi ně toxicita kolchicinu s kolchicinem; rhabdomyolýza simvastatinem, lovastatinem a atorvastatinem; hypoglykémie a srdeční arytmie (např. torsades de pointes) s disopyramidem; hypotenze a akutního poškození ledvin blokátory kalciového kanálu metabolizovanými CYP3A4 (např. verapamil, amlodipin, diltiazem, nifedipin). Většina hlášení akutního poškození ledvin blokátory kalciových kanálů metabolizovaných CYP3A4 zahrnovala starší pacienty ve věku 65 let nebo starší. Používejte BIAXIN 500 mg opatrně při současném podávání s léky, které indukují enzym cytochrom CYP3A4. Užívání přípravku BIAXIN 250 mg se simvastatinem, lovastatinem, ergotaminem nebo dihydroergotaminem je kontraindikováno [viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
kolchicin
pacientů léčených přípravkem BIAXIN a kolchicin byly hlášeny život ohrožující a fatální lékové interakce. Klaritromycin je silný inhibitor CYP3A4 a tato interakce se může objevit při užívání obou léků v jejich doporučených dávkách. Pokud je u pacientů s normální funkcí ledvin a jater nutné současné podávání BIAXINU a kolchicinu, snižte dávku kolchicinu. Monitorujte u pacientů klinické příznaky toxicity kolchicinu. Současné podávání přípravku BIAXIN 500 mg a kolchicinu je kontraindikováno u pacientů s poruchou funkce ledvin nebo jater (viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
Inhibitory HMG-CoA reduktázy (statiny)
Současné užívání přípravku BIAXIN s lovastatinem nebo simvastatinem je kontraindikováno (viz KONTRAINDIKACE ], protože tyto statiny jsou extenzivně metabolizovány CYP3A4 a současná léčba přípravkem BIAXIN zvyšuje jejich plazmatickou koncentraci, což zvyšuje riziko myopatie, včetně rhabdomyolýzy. U pacientů užívajících BIAXIN současně s těmito statiny byly hlášeny případy rhabdomyolýzy. Pokud se nelze vyhnout léčbě přípravkem BIAXIN, musí být léčba lovastatinem nebo simvastatinem během léčby přerušena.
Při předepisování přípravku BIAXIN 250 mg s atorvastatinem nebo pravastatinem buďte opatrní. V situacích, kdy se nelze vyhnout současnému užívání přípravku BIAXIN s atorvastatinem nebo pravastatinem, by dávka atorvastatinu neměla překročit 20 mg denně a dávka pravastatinu by neměla překročit 40 mg denně. Lze zvážit použití statinu, který není závislý na metabolismu CYP3A (např. fluvastatin). Pokud se nelze vyhnout současnému užívání, doporučuje se předepsat nejnižší registrovanou dávku.
Perorální hypoglykemické látky/inzulin
Současné užívání přípravku BIAXIN 500 mg a perorálních hypoglykemik a/nebo inzulínu může vést k významné hypoglykémii. U některých hypoglykemických léků, jako je nateglinid, pioglitazon, repaglinid a rosiglitazon, může být zahrnuta inhibice enzymu CYP3A klarithromycinem, která by při současném užívání mohla způsobit hypoglykémii. Doporučuje se pečlivé sledování glukózy [viz DROGOVÉ INTERAKCE ].
kvetiapin
Používejte kvetiapin a klarithromycin současně s opatrností. Současné podávání může vést ke zvýšené expozici kvetiapinu a toxicitě související s kvetiapinem, jako je somnolence, ortostatická hypotenze, změněný stav vědomí, neuroleptický maligní syndrom a prodloužení QT intervalu. Doporučení ke snížení dávky při současném podávání s inhibitory CYP3A4, jako je klarithromycin, naleznete v informacích o předepisování kvetiapinu (viz DROGOVÉ INTERAKCE ].
Perorální antikoagulancia
Při současném podávání přípravku BIAXIN s warfarinem existuje riziko závažného krvácení a významného zvýšení INR a protrombinového času. Monitorujte INR a protrombinové časy často, když pacienti dostávají BIAXIN a perorální antikoagulancia současně (viz DROGOVÉ INTERAKCE ].
Benzodiazepiny
Při současném podávání přípravku BIAXIN 250 mg a triazolobenzodiazepinů, jako je triazolam a midazolam, byla hlášena zvýšená sedace a prodloužení sedace (viz DROGOVÉ INTERAKCE ].
Úmrtnost ze všech příčin u pacientů s onemocněním koronárních tepen 1 až 10 let po expozici BIAXINU
jedné klinické studii hodnotící výsledky léčby klarithromycinem u pacientů s onemocněním koronárních tepen bylo pozorováno zvýšení rizika mortality ze všech příčin jeden rok nebo déle po ukončení léčby u pacientů randomizovaných k léčbě klarithromycinem.1 Klaritromycin k léčbě koronárních onemocnění onemocnění tepen není schválenou indikací. Příčina zvýšeného rizika nebyla stanovena. Jiné epidemiologické studie hodnotící toto riziko prokázaly proměnlivé výsledky [viz NEŽÁDOUCÍ REAKCE ]. Zvažte vyvážení tohoto potenciálního rizika s přínosy léčby při předepisování přípravku BIAXIN pacientům, kteří mají podezření nebo potvrzené onemocnění koronárních tepen.
Průjem spojený s Clostridium Difficile
Průjem spojený s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně přípravku BIAXIN, a jeho závažnost se může pohybovat od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po použití antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Je-li podezření na CDAD nebo je-li potvrzeno, může být nutné přerušit pokračující používání antibakteriálních látek, které nejsou zaměřeny proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibakteriální léčba C. difficile a chirurgické vyšetření.
Embryofetální toxicita
Klarithromycin by neměl být podáván těhotným ženám s výjimkou klinických okolností, kdy není vhodná žádná alternativní léčba. Pokud je přípravek BIAXIN 500 mg užíván během těhotenství nebo pokud dojde k otěhotnění během užívání tohoto léku, pacientka by měla být informována o potenciálním riziku pro plod. Klarithromycin prokázal nežádoucí účinky na výsledek těhotenství a/nebo embryofetální vývoj u opic, potkanů, myší a králíků v dávkách, které produkovaly plazmatické hladiny 2krát až 17krát vyšší než sérové hladiny dosahované u lidí léčených maximálními doporučenými dávkami pro člověka [viz Použití u konkrétních populací ].
Exacerbace Myasthenia Gravis
U pacientů léčených přípravkem BIAXIN 250 mg byla hlášena exacerbace příznaků myasthenia gravis a nový nástup příznaků myastenického syndromu.
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku BIAXIN v nepřítomnosti prokázané nebo silně suspektní bakteriální infekce nebo profylaktické indikace přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
S klarithromycinem byly provedeny následující testy mutagenity in vitro:
- Test na salmonelu/savčí mikrozomy
- Test frekvence bakteriální indukované mutace
- Test chromozomové aberace in vitro
- Test syntézy DNA potkaních hepatocytů
- Myší lymfomový test
- Myší dominantní smrtící studie
- Mikronukleový test na myši
Všechny testy měly negativní výsledky kromě in vitro testu chromozomové aberace, který byl pozitivní v jednom testu a negativní v jiném. Kromě toho byl proveden bakteriální test reverzní mutace (Amesův test) na metabolitech klarithromycinu s negativními výsledky.
Zhoršení Plodnosti
Studie plodnosti a reprodukce ukázaly, že denní dávky až 160 mg/kg/ samcům a samicím potkanů nezpůsobily žádné nežádoucí účinky na estrální cyklus, plodnost, porod nebo počet a životaschopnost potomků. Plazmatické hladiny u potkanů po 150 mg/kg/den byly dvakrát vyšší než hladiny v lidském séru.
Testikulární atrofie se objevila u potkanů při dávkách 7krát, u psů při dávkách 3krát a u opic při dávkách 8krát vyšších, než je maximální denní dávka pro člověka (na základě plochy povrchu těla).
Použití u konkrétních populací
Těhotenství
Teratogenní účinky
Kategorie těhotenství C
Klarithromycin by neměl být podáván těhotným ženám s výjimkou klinických okolností, kdy není vhodná žádná alternativní léčba. Pokud během užívání tohoto léku dojde k těhotenství, pacient by měl být informován o potenciálním riziku pro plod [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Čtyři studie teratogenity u potkanů (tři s perorálními dávkami a jedna s intravenózními dávkami až 160 mg/kg/den podávanými během období hlavní organogeneze) a dvě u králíků při perorálních dávkách až 125 mg/kg/den (přibližně dvojnásobek doporučená maximální dávka pro člověka založená na mg/m²) nebo intravenózní dávky 30 mg/kg/den podané během 6. až 18. dne gestace neprokázaly žádnou teratogenitu klarithromycinu. Dvě další perorální studie na jiném kmeni potkanů při podobných dávkách a za podobných podmínek prokázaly nízký výskyt kardiovaskulárních anomálií při dávkách 150 mg/kg/den podávaných během 6. až 15. gestace.
Plazmatické hladiny po 150 mg/kg/den byly dvakrát vyšší než hladiny v lidském séru. Čtyři studie na myších odhalily různou incidenci rozštěpu patra po perorálních dávkách 1000 mg/kg/den (2 a 4násobek doporučené maximální dávky pro člověka založené na mg/m²) během 6. až 15. gestace. Rozštěp patra byl také pozorováno při 500 mg/kg/den. Expozice 1000 mg/kg/den vedla k plazmatickým hladinám 17krát vyšším než hladiny v lidském séru. U opic způsobila perorální dávka 70 mg/kg/den zpomalení růstu plodu při plazmatických hladinách, které byly dvakrát vyšší než hladiny v lidském séru.
Kojící matky
Při podávání přípravku BIAXIN kojícím ženám je třeba postupovat opatrně. Vývoj a zdravotní přínosy krmení mateřským mlékem by měly být zváženy společně s klinickou potřebou matky BIAXIN a veškerými potenciálními nežádoucími účinky léku nebo základního stavu matky na dítě krmené mateřským mlékem.
Klaritromycin a jeho aktivní metabolit 14-hydroxyklaritromycin se vylučují do lidského mléka. Vzorky séra a mléka byly získány po 3 dnech léčby v ustáleném stavu z jedné publikované studie 12 kojících žen, které užívaly BIAXIN 250 mg perorálně dvakrát denně. Na základě omezených údajů z této studie a za předpokladu spotřeby mléka 150 ml/kg/den by dítě krmené výhradně lidským mlékem dostávalo odhadovaný průměr 136 mcg/kg/den klarithromycinu a jeho aktivního metabolitu s touto dávkou pro matku. režim. To je méně než 2 % dávky upravené podle hmotnosti matky (7,8 mg/kg/den, na základě průměrné hmotnosti matky 64 kg) a méně než 1 % pediatrické dávky (15 mg/kg/den) pro děti starší 6 měsíců.
Prospektivní observační studie 55 kojených dětí matek užívajících makrolidové antibiotikum (6 bylo vystaveno klarithromycinu) byla porovnána s 36 kojenými dětmi matek užívajících amoxicilin. Nežádoucí účinky byly v obou skupinách srovnatelné. Nežádoucí účinky se objevily u 12,7 % kojenců vystavených makrolidům a zahrnovaly vyrážku, průjem, ztrátu chuti k jídlu a somnolenci.
Pediatrické použití
Bezpečnost a účinnost přípravku BIAXIN Filmtab a BIAXIN 500 mg granulí byla stanovena pro léčbu následujících stavů nebo onemocnění u dětských pacientů ve věku 6 měsíců a starších. Použití v těchto indikacích je založeno na klinických studiích u pediatrických pacientů nebo na adekvátních a dobře kontrolovaných studiích u dospělých s dalšími farmakokinetickými a bezpečnostními údaji u pediatrických pacientů:
- Faryngitida/tonzilitida
- Pneumonie získaná v komunitě
- Akutní maxilární sinusitida
- Akutní zánět středního ucha [viz Klinické studie ]
- Nekomplikované infekce kůže a kožní struktury
Bezpečnost a účinnost přípravku BIAXIN 500 mg Filmtab a BIAXIN 500 mg granule byla stanovena pro prevenci diseminovaného onemocnění Mycobacterium avium complex (MAC) u pediatrických pacientů ve věku 20 měsíců a starších s pokročilou infekcí HIV. U pediatrické populace nebyly provedeny žádné studie s přípravkem BIAXIN pro profylaxi MAC a dávky doporučené pro profylaxi jsou odvozeny ze studií pediatrické léčby MAC.
Bezpečnost a účinnost přípravku BIAXIN 500 mg XL Filmtab při léčbě dětských pacientů nebyla stanovena.
Bezpečnost a účinnost přípravku BIAXIN 250 mg u pediatrických pacientů mladších 6 měsíců nebyla stanovena. Bezpečnost přípravku BIAXIN 500 mg nebyla studována u pacientů s MAC mladších 20 měsíců.
Geriatrické použití
Ve studii v ustáleném stavu, ve které bylo zdravým starším subjektům (ve věku 65 až 81 let) podáváno 500 mg BIAXINU každých 12 hodin, byly maximální sérové koncentrace a plocha pod křivkami klarithromycinu a 14-OH klarithromycinu zvýšeny ve srovnání s těch, kterých bylo dosaženo u zdravých mladých dospělých. Tyto změny farmakokinetiky jsou paralelní se známým poklesem renálních funkcí souvisejícím s věkem. V klinických studiích nebyl u starších pacientů zaznamenán zvýšený výskyt nežádoucích účinků ve srovnání s mladšími pacienty. U starších pacientů s těžkou poruchou funkce ledvin zvažte úpravu dávkování. Starší pacienti mohou být náchylnější k rozvoji arytmií torsades de pointes než mladší pacienti (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Většina zpráv o akutním poškození ledvin blokátory kalciových kanálů metabolizovaných CYP3A4 (např. verapamil, amlodipin, diltiazem, nifedipin) zahrnovala starší pacienty ve věku 65 let nebo starší (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zejména u starších pacientů byly hlášeny případy toxicity kolchicinu při současném užívání klarithromycinu a kolchicinu, z nichž některé se vyskytly u pacientů s renální insuficiencí. U některých pacientů byla hlášena úmrtí [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Renální A jaterní poškození
BIAXIN 500 mg se vylučuje hlavně játry a ledvinami. BIAXIN lze podávat bez úpravy dávkování pacientům s poruchou funkce jater a normální funkcí ledvin. Nicméně v případě závažného poškození ledvin s nebo bez současného poškození jater může být vhodné snížit dávkování nebo prodloužené intervaly mezi dávkami (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
REFERENCE
1. Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. V randomizované, zaslepené klinické studii CLARICOR zvyšuje v průběhu 10 let klarithromycin pro stabilní ischemickou chorobu srdeční ze všech příčin a kardiovaskulární mortalitu a cerebrovaskulární morbiditu. Int J Cardiol 2015;182:459-65.
PŘEDÁVKOVAT
Předávkování přípravkem BIAXIN může způsobit gastrointestinální příznaky, jako je bolest břicha, zvracení, nevolnost a průjem.
Nežádoucí účinky doprovázející předávkování řešte okamžitou eliminací nevstřebaného léku a podpůrnými opatřeními. Stejně jako u jiných makrolidů se neočekává, že by sérové koncentrace BIAXIN byly významně ovlivněny hemodialýzou nebo peritoneální dialýzou.
KONTRAINDIKACE
Přecitlivělost
BIAXIN je kontraindikován u pacientů se známou přecitlivělostí na klarithromycin, erythromycin nebo na jakékoli makrolidové antibakteriální léky (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Srdeční arytmie
Současné podávání přípravku BIAXIN s cisapridem a pimozidem je kontraindikováno (viz DROGOVÉ INTERAKCE ].
Objevily se postmarketingové zprávy o lékových interakcích při současném podávání klarithromycinu s cisapridem nebo pimozidem, které vedly k srdečním arytmiím (prodloužení QT intervalu, ventrikulární tachykardii, ventrikulární fibrilaci a torsades de pointes), s největší pravděpodobností v důsledku inhibice metabolismu těchto léků přípravkem BIAXIN . Byly hlášeny oběti na životech.
Cholestatická žloutenka/jaterní dysfunkce
BIAXIN je kontraindikován u pacientů s anamnézou cholestatické žloutenky nebo jaterní dysfunkce související s předchozím užíváním klarithromycinu.
kolchicin
Současné podávání přípravku BIAXIN a kolchicinu je kontraindikováno u pacientů s poruchou funkce ledvin nebo jater.
Inhibitory HMG-CoA reduktázy
Neužívejte BIAXIN současně s inhibitory HMG-CoA reduktázy (statiny), které jsou extenzivně metabolizovány CYP3A4 (lovastatin nebo simvastatin), kvůli zvýšenému riziku myopatie, včetně rhabdomyolýzy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Námelové alkaloidy
Současné podávání klarithromycinu a ergotaminu nebo dihydroergotaminu je kontraindikováno (viz DROGOVÉ INTERAKCE ].
Kontraindikace pro souběžně podávané léky
Informace o kontraindikacích jiných léků indikovaných v kombinaci s přípravkem BIAXIN naleznete v jejich úplné preskripční informaci (část kontraindikace).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Klaritromycin je makrolidové antimikrobiální léčivo [viz Mikrobiologie ].
Farmakokinetika
Vstřebávání
BIAXIN 250 mg Filmtab tablety s okamžitým uvolňováním
Absolutní biologická dostupnost 250 mg tablet klarithromycinu byla přibližně 50 %. V případě jedné 500mg dávky klarithromycinu jídlo mírně zpomalí nástup absorpce klarithromycinu, čímž se prodlouží doba vrcholu z přibližně 2 na 2,5 hodiny. Jídlo také zvyšuje maximální plazmatickou koncentraci klarithromycinu asi o 24 %, ale neovlivňuje rozsah biologické dostupnosti klarithromycinu. Jídlo neovlivňuje nástup tvorby aktivního metabolitu 14-OH klarithromycinu ani jeho maximální plazmatickou koncentraci, ale mírně snižuje rozsah tvorby metabolitu, což je indikováno 11% snížením plochy pod křivkou plazmatické koncentrace-čas (AUC) . Proto může být BIAXIN Filmtab podáván bez ohledu na jídlo. U zdravých lidí (muži a ženy), kteří nehladovali, bylo maximálních plazmatických koncentrací dosaženo během 2 až 3 hodin po perorálním podání.
BIAXIN 500 mg XL Filmtab tablety s prodlouženým uvolňováním
Tablety klarithromycinu s prodlouženým uvolňováním poskytují prodlouženou absorpci klarithromycinu z gastrointestinálního traktu po perorálním podání. Ve srovnání se stejnou celkovou denní dávkou tablet klarithromycinu s okamžitým uvolňováním poskytují tablety klarithromycinu s prodlouženým uvolňováním nižší a pozdější vrcholové plazmatické koncentrace v ustáleném stavu, ale ekvivalentní 24hodinové AUC pro klarithromycin i jeho mikrobiologicky aktivní metabolit, 14-OH klarithromycin. Zatímco rozsah tvorby 14-OH klarithromycinu po podání BIAXIN 500 mg XL Filmtab (2 x 500 mg tablety jednou denně) není ovlivněn jídlem, podávání nalačno je spojeno s přibližně o 30 % nižší AUC klarithromycinu ve srovnání s podáním s jídlem. . Proto by měl být BIAXIN 250 mg XL Filmtab užíván s jídlem.
Obrázek 2: Časové profily koncentrace klarithromycinu v plazmě v ustáleném stavu 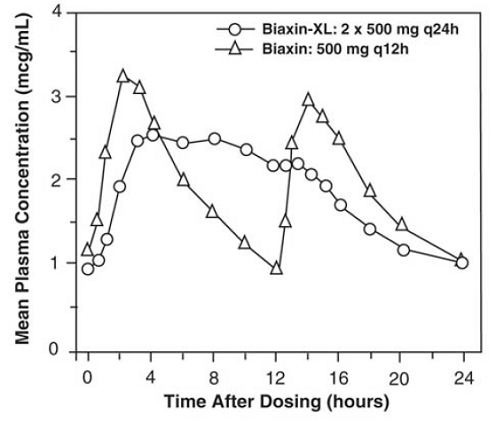
BIAXIN Granule pro perorální suspenzi
Když byly 250 mg dávky klarithromycinu jako BIAXIN ve formě perorální suspenze podávány zdravým dospělým subjektům nalačno, bylo maximálních plazmatických koncentrací dosaženo přibližně 3 hodiny po podání.
U dospělých pacientů je biologická dostupnost 10 ml suspenze 125 mg/5 ml nebo 10 ml suspenze 250 mg/5 ml podobná 250 mg nebo 500 mg tabletě, v daném pořadí.
U dospělých, kterým bylo podáváno 250 mg klarithromycinu ve formě suspenze (n = 22), se zdálo, že jídlo snižuje průměrné maximální plazmatické koncentrace klarithromycinu z 1,2 (± 0,4) mcg/ml na 1,0 (± 0,4) mcg/ml a rozsah absorpce ze 7,2 (± 0,4) 2,5) h•mcg/ml až 6,5 (± 3,7) h•mcg/ml.
Rozdělení
Klaritromycin a 14-OH metabolit klarithromycinu se snadno distribuují do tělesných tkání a tekutin. Nejsou k dispozici žádné údaje o průniku mozkomíšního moku. Kvůli vysokým intracelulárním koncentracím jsou tkáňové koncentrace vyšší než koncentrace v séru. Příklady tkáňových a sérových koncentrací jsou uvedeny níže.
Metabolismus A Eliminace
BIAXIN 500 mg Filmtab tablety s okamžitým uvolňováním
Maximální plazmatické koncentrace klarithromycinu v ustáleném stavu byly dosaženy během 3 dnů a byly přibližně 1 mcg/ml až 2 mcg/ml při dávce 250 mg podávané každých 12 hodin a 3 mcg/ml až 4 mcg/ml při dávce 500 mg podávané každých 8 hodin až 12 hodin. Eliminační poločas klarithromycinu byl asi 3 hodiny až 4 hodiny při podávání 250 mg každých 12 hodin, ale zvýšil se na 5 hodin až 7 hodin při podávání 500 mg každých 8 hodin až 12 hodin. Nelinearita farmakokinetiky klarithromycinu je mírná při doporučených dávkách 250 mg a 500 mg podávaných každých 8 hodin až 12 hodin. Při dávkování 250 mg každých 12 hodin dosahuje hlavní metabolit, 14-OH klarithromycin, maximální koncentrace v ustáleném stavu přibližně 0,6 mcg/ml a má poločas eliminace 5 hodin až 6 hodin. Při dávkování 500 mg každých 8 hodin až 12 hodin je vrcholová koncentrace 14-OH klarithromycinu v ustáleném stavu mírně vyšší (až 1 mcg/ml) a jeho eliminační poločas je přibližně 7 hodin až 9 hodin. Při kterémkoli z těchto dávkovacích režimů je koncentrace tohoto metabolitu v ustáleném stavu obecně dosažena během 3 dnů až 4 dnů.
Po 250mg tabletě každých 12 hodin je přibližně 20 % dávky vyloučeno močí jako klarithromycin, zatímco po 500mg tabletě každých 12 hodin je vylučování klarithromycinu močí o něco vyšší, přibližně 30 %. Pro srovnání, po perorální dávce 250 mg (125 mg/5 ml) suspenze každých 12 hodin se přibližně 40 % vylučuje močí ve formě klarithromycinu. Renální clearance klarithromycinu je však relativně nezávislá na velikosti dávky a blíží se normální rychlosti glomerulární filtrace. Hlavním metabolitem nalezeným v moči je 14-OH klarithromycin, který představuje dalších 10 % až 15 % dávky při podávání 250 mg nebo 500 mg tablety každých 12 hodin.
BIAXIN 250 mg XL Filmtab tablety s prodlouženým uvolňováním
zdravých lidí bylo dosaženo vrcholových plazmatických koncentrací klarithromycinu v ustáleném stavu přibližně 2 mcg/ml až 3 mcg/ml přibližně 5 hodin až 8 hodin po perorálním podání 1000 mg BIAXIN 250 mg XL Filmtab jednou denně; pro 14-OH klarithromycin bylo dosaženo vrcholových plazmatických koncentrací v ustáleném stavu přibližně 0,8 mcg/ml asi 6 hodin až 9 hodin po podání dávky. Maximální plazmatické koncentrace klarithromycinu v ustáleném stavu přibližně 1 mcg/ml až 2 mcg/ml byly dosaženy přibližně 5 hodin až 6 hodin po perorálním podání jedné 500 mg BIAXIN XL Filmtab jednou denně; pro 14-OH klarithromycin bylo dosaženo vrcholových plazmatických koncentrací v ustáleném stavu přibližně 0,6 mcg/ml asi 6 hodin po podání.
Maximální plazmatické koncentrace v ustáleném stavu byly dosaženy za 2 dny až 3 dny a byly přibližně 2 mcg/ml pro klarithromycin a 0,7 mcg/ml pro 14-OH klarithromycin, když byly každých 12 hodin podávány dávky 250 mg suspenze klarithromycinu. Poločas eliminace klarithromycinu (3 hodiny až 4 hodiny) a 14-OH klarithromycinu (5 hodin až 7 hodin) byl podobný jako poločas pozorovaný v ustáleném stavu po podání ekvivalentních dávek přípravku BIAXIN Filmtab.
Specifické populace pro formulace BIAXIN Filmtab, BIAXIN 500 mg XL Filmtab a BIAXIN 250 mg granule
BIAXIN Granule pro perorální suspenzi u dětských pacientů
Klaritromycin proniká do středoušní tekutiny u dětských pacientů se sekrečním zánětem středního ucha.
Když byla pediatrickým pacientům (n = 10) podána jedna perorální dávka 7,5 mg/kg BIAXIN 500 mg jako perorální suspenze, jídlo zvýšilo průměrné maximální plazmatické koncentrace klarithromycinu z 3,6 (± 1,5) mcg/ml na 4,6 (± 2,8) mcg/ ml a rozsah absorpce od 10,0 (± 5,5) h•mcg/ml do 14,2 (± 9,4) h•mcg/ml.
U pediatrických pacientů vyžadujících antibakteriální léčbu vedlo podávání 7,5 mg/kg každých 12 hodin BIAXINu ve formě perorální suspenze obecně k vrcholovým plazmatickým koncentracím v ustáleném stavu 3 mcg/ml až 7 mcg/ml pro klarithromycin a 1 mcg/ml až 2 mcg/ml pro 14-OH klarithromycin.
U pediatrických pacientů infikovaných HIV, kteří užívali 15 mg/kg BIAXINu jako perorální suspenzi každých 12 hodin, se maximální koncentrace klarithromycinu v ustáleném stavu obecně pohybovaly od 6 mcg/ml do 15 mcg/ml.
HIV infekce
Koncentrace klarithromycinu a 14-OH klarithromycinu v ustáleném stavu pozorované po podání dávek 500 mg klarithromycinu každých 12 hodin dospělým pacientům s infekcí HIV byly podobné jako u zdravých dobrovolníků. U dospělých pacientů infikovaných HIV, kteří užívali 500 mg nebo 1000 mg klarithromycinu každých 12 hodin, se hodnoty Cmax klarithromycinu v ustáleném stavu pohybovaly od 2 mcg/ml do 4 mcg/ml a 5 mcg/ml až 10 mcg/ml, v uvedeném pořadí. .
Poškození jater
Koncentrace klarithromycinu v ustáleném stavu se u subjektů s poruchou funkce jater nelišily od koncentrací u normálních subjektů; avšak koncentrace 14-OH klarithromycinu byly nižší u subjektů s poruchou funkce jater. Snížená tvorba 14-OH klarithromycinu byla alespoň částečně kompenzována zvýšením renální clearance klarithromycinu u subjektů s poruchou funkce jater ve srovnání se zdravými subjekty.
Renální poškození
Farmakokinetika klarithromycinu byla také změněna u subjektů s poruchou funkce ledvin (viz Použití u konkrétních populací a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Lékové interakce
flukonazol
Po podání flukonazolu 200 mg denně a klarithromycinu 500 mg dvakrát denně 21 zdravým dobrovolníkům se Cmin klarithromycinu v ustáleném stavu zvýšily o 33 % a AUC o 18 %. Expozice klarithromycinu byly zvýšeny a rovnovážné koncentrace 14-OH klarithromycinu nebyly významně ovlivněny současným podáváním flukonazolu.
kolchicin
Když byla podávána jednorázová dávka kolchicinu 0,6 mg s klarithromycinem 250 mg dvakrát denně po dobu 7 dnů, Cmax kolchicinu se zvýšila o 197 % a AUC0-∞ se zvýšila o 239 % ve srovnání s podáváním samotného kolchicinu.
atazanavir
Po podání klarithromycinu (500 mg dvakrát denně) s atazanavirem (400 mg jednou denně) se AUC klarithromycinu zvýšila o 94 %, AUC 14-OH klarithromycinu se snížila o 70 % a AUC atazanaviru se zvýšila o 28 %.
ritonavir
Současné podávání klarithromycinu a ritonaviru (n = 22) vedlo k 77% zvýšení AUC klarithromycinu a 100% snížení AUC 14-OH klarithromycinu.
saquinavir
Po podání klarithromycinu (500 mg dvakrát denně) a saquinaviru (měkké želatinové tobolky, 1200 mg třikrát denně) 12 zdravým dobrovolníkům se AUC a Cmax saquinaviru v ustáleném stavu zvýšily o 177 % a Cmax o 187 % v porovnání s podáním samotného saquinaviru. AUC a Cmax klarithromycinu se zvýšily o 45 % a 39 %, zatímco AUC a Cmax 14–OH klarithromycinu se snížily o 24 % a 34 %, v porovnání s podáváním samotného klarithromycinu.
didanosin
Současné podávání tablet klarithromycinu a didanosinu 12 dospělým pacientům infikovaným HIV nevedlo k žádné statisticky významné změně farmakokinetiky didanosinu.
zidovudin
Po podávání tablet klarithromycinu 500 mg dvakrát denně se 100 mg zidovudinu každé 4 hodiny se AUC zidovudinu v ustáleném stavu snížila o 12 % ve srovnání s podáváním samotného zidovudinu (n=4). Jednotlivé hodnoty se pohybovaly od poklesu o 34 % po nárůst o 14 %. Když byly tablety klarithromycinu podány dvě až čtyři hodiny před zidovudinem, Cmax zidovudinu v ustáleném stavu se zvýšila o 100 %, zatímco AUC nebyla ovlivněna (n=24).
omeprazol
Klaritromycin 500 mg každých 8 hodin byl podáván v kombinaci s omeprazolem 40 mg denně zdravým dospělým subjektům. Plazmatické koncentrace omeprazolu v ustáleném stavu byly zvýšeny (Cmax, AUC0-24 a t½ zvýšení o 30 %, 89 % a 34 %) při současném podávání klarithromycinu.
Plazmatické hladiny klarithromycinu a 14–OH klarithromycinu byly zvýšeny při současném podávání omeprazolu. U klarithromycinu byla průměrná Cmax o 10 % vyšší, průměrná Cmin o 27 % vyšší a průměrná AUC0-8 byla o 15 % vyšší, když byl klarithromycin podáván s omeprazolem, než když byl klarithromycin podáván samotný. Podobné výsledky byly pozorovány u 14–OH klarithromycinu, průměrná Cmax byla o 45 % vyšší, průměrná Cmin byla o 57 % vyšší a průměrná AUC0-8 byla o 45 % vyšší. Koncentrace klarithromycinu v žaludeční tkáni a hlenu byly také zvýšeny při současném podávání omeprazolu.
Koncentrace klarithromycinu v tkáních 2 hodiny po dávce (mcg/ml)/(mcg/g)
Theofylin
Ve dvou studiích, ve kterých byl theofylin podáván s klarithromycinem (formulace s prodlouženým uvolňováním theofylinu byla dávkována buď v dávce 6,5 mg/kg nebo 12 mg/kg spolu s 250 nebo 500 mg každých 12 hodin klarithromycinu), byly hladiny Cmax, Cmin, a plocha pod časovou křivkou sérové koncentrace (AUC) theofylinu se zvýšila asi o 20 %.
midazolam
Když byla jednorázová dávka midazolamu podávána současně s tabletami klarithromycinu (500 mg dvakrát denně po dobu 7 dnů), AUC midazolamu se zvýšila o 174 % po intravenózním podání midazolamu a o 600 % po perorálním podání.
Informace o dalších lécích indikovaných v kombinaci s přípravkem BIAXIN naleznete v jejich úplné preskripční informaci, KLINICKÁ FARMAKOLOGIE sekce.
Mikrobiologie
Mechanismus působení
Klaritromycin uplatňuje svůj antibakteriální účinek vazbou na 50S ribozomální podjednotku citlivých bakterií, což vede k inhibici syntézy proteinů.
Odpor
Hlavní cesty rezistence jsou modifikace 23S rRNA v ribozomální podjednotce 50S na necitlivost nebo efluxní pumpy. Produkce beta-laktamázy by neměla mít žádný vliv na aktivitu klarithromycinu.
Většina izolátů methicilin-rezistentních a oxacilin-rezistentních stafylokoků je vůči klarithromycinu rezistentní.
Pokud H. pylori není eradikován po léčbě kombinovanými režimy obsahujícími klarithromycin, může se u pacientů vyvinout rezistence na klarithromycin u izolátů H. pylori. Proto by u pacientů, u kterých selhala léčba, mělo být, pokud je to možné, provedeno testování citlivosti na klarithromycin. Pacienti s H. pylori rezistentní na klarithromycin by neměli být léčeni žádným z následujících léků: duální léčba omeprazol/klaritromycin; trojitá terapie omeprazol/klaritromycin/amoxicilin; trojitá terapie lansoprazol/klaritromycin/amoxicilin; nebo jiné režimy, které zahrnují klarithromycin jako jediné antibakteriální činidlo.
Antimikrobiální aktivita
Bylo prokázáno, že klarithromycin je účinný proti většině izolátů následujících mikroorganismů jak in vitro, tak při klinických infekcích [viz INDIKACE A POUŽITÍ ].
Gram-pozitivní bakterie
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogenes
Gram-negativní bakterie
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Jiné mikroorganismy
- Chlamydophila pneumoniae
- Helicobacter pylori
- Komplex Mycobacterium avium (MAC) sestávající z M. avium a M. intracellulare
- Mycoplasma pneumoniae
Nejméně 90 procent níže uvedených mikroorganismů vykazuje in vitro minimální inhibiční koncentrace (MIC) nižší nebo rovné hraničnímu bodu MIC citlivého na klarithromycin pro organismy podobného typu, jaké jsou uvedeny v tabulce 11. Nicméně účinnost klarithromycinu při léčbě klinických infekcí kvůli těmto mikroorganismům nebyla prokázána v adekvátních a dobře kontrolovaných klinických studiích.
Gram-pozitivní bakterie
- Streptococcus agalactiae
- streptokoky (skupiny C, F, G)
- Streptokoky skupiny Viridans
Gram-negativní bakterie
- Legionella pneumophila
- Pasteurella multocida
Anaerobní bakterie
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Testování citlivosti
Specifické informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: http://www.fda.gov/STIC.
Toxikologie zvířat a/nebo farmakologie
Zákal rohovky se objevil u psů při dávkách 12krát a u opic při dávkách 8krát vyšších, než je maximální denní dávka pro člověka (na základě plochy povrchu těla). Lymfoidní deplece se objevila u psů při dávkách 3krát vyšších než a u opic při dávkách 2krát vyšších, než je maximální denní dávka pro člověka (na základě plochy povrchu těla).
Klinické studie
Mykobakteriální infekce
Profylaxe Mykobakteriálních Infekcí
Randomizovaná, dvojitě zaslepená klinická studie (studie 3) porovnávala klarithromycin 500 mg dvakrát denně s placebem u pacientů s AIDS definovaným CDC a počtem CD4 nižším než 100 buněk/μl. Tato studie zahrnovala 682 pacientů od listopadu 1992 do ledna 1994 se středním počtem buněk CD4 na vstupu 30 buněk/mcL. Medián trvání BIAXIN 500 mg byl 10,6 měsíce oproti 8,2 měsíce u placeba. Více pacientů ve skupině s placebem než ve skupině BIAXIN předčasně ukončilo studii (75,6 %, resp. 67,4 %). Pokud se však vyloučí předčasné vysazení z důvodu komplexu Mycobacterium avium (MAC) nebo úmrtí, přibližně stejné procento pacientů v každém rameni (54,8 %) na BIAXINu a 52,5 % na placebu vysadilo studovaný lék předčasně z jiných důvodů. Studie byla navržena tak, aby vyhodnotila následující koncové body:
MAC Bakterémie
pacientů randomizovaných na BIAXIN bylo riziko MAC bakteriémie sníženo o 69 % ve srovnání s placebem. Rozdíl mezi skupinami byl statisticky významný (p
Přežití
Byl pozorován statisticky významný přínos BIAXIN v přežití ve srovnání s placebem (viz obrázek 3 a tabulka 13). Vzhledem k tomu, že analýza po 18 měsících zahrnuje pacienty, kteří již nedostávají profylaxi, může být přínos BIAXIN 250 mg přežití podhodnocen.
Obrázek 3: Přežití všech randomizovaných pacientů s AIDS v průběhu času ve studii 3 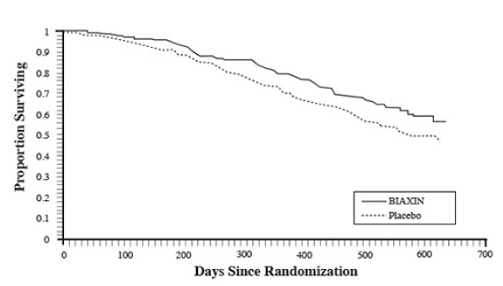
Klinicky významné diseminované onemocnění MAC
V souvislosti se sníženou incidencí MAC bakteriémie vykazovali pacienti ve skupině randomizovaní na BIAXIN snížení známek a symptomů diseminovaného MAC onemocnění, včetně horečky, nočního pocení, úbytku hmotnosti a anémie.
Léčba mykobakteriálních infekcí
Testy monoterapie s rozsahem dávek u dospělých pacientů s AIDS s MAC
Dvě randomizované klinické studie (zkoušky 1 a 2) porovnávaly různé dávky BIAXINU u pacientů s CDC-definovaným AIDS a počtem CD4 nižším než 100 buněk/mcL. Tyto studie zahrnovaly pacienty od května 1991 do března 1992. Studie 500 byla randomizovaná, dvojitě zaslepená studie; studie 577 byla otevřená studie o použití ze soucitu. Obě studie používaly 500 mg a 1000 mg dvakrát denně dávkování BIAXINU; studie 1 měla také skupinu 2000 mg dvakrát denně BIAXIN 500 mg. Do studie 1 bylo zařazeno 154 dospělých pacientů a do studie 2 bylo zařazeno 469 dospělých pacientů. Většina pacientů měla při vstupu do studie počet CD4 buněk nižší než 50 buněk/mcL. Pokusy byly navrženy tak, aby vyhodnotily následující koncové body:
Výsledky pro pokus 1 jsou popsány níže. Výsledky studie 2 byly podobné výsledkům studie 1.
MAC Bakterémie
Snížení bakteriémie MAC nebo negativní hemokultury byly pozorovány u většiny pacientů ve všech dávkovacích skupinách přípravku BIAXIN 500 mg. Průměrné snížení jednotek tvořících kolonie MAC (CFU) od výchozí hodnoty po 4 týdnech léčby v režimu 1000 mg (n=32) dvakrát denně a 2000 mg (n=26) dvakrát denně bylo 2,3 log CFU ve srovnání s 1,5 log CFU v roce režim BIAXIN 500 mg dvakrát denně (n=35). Samostatná studie s režimem čtyř léků2 (ciprofloxacin, ethambutol, rifampicin a klofazimin) měla průměrné snížení o 1,4 log CFU.
Klinické výsledky hodnocené s různými dávkovacími režimy monoterapie klarithromycinem jsou uvedeny v tabulce 14. Dávky 1000 mg a 2000 mg dvakrát denně prokázaly významně lepší kontrolu bakteriémie během prvních čtyř týdnů léčby. Za tímto bodem nebyly pozorovány žádné významné rozdíly. Všechny izoláty měly MIC nižší než 8 mcg/ml při předléčení. Relaps byl téměř vždy doprovázen zvýšením MIC.
Klinicky významné diseminované onemocnění MAC
Mezi pacienty, u kterých se před terapií objevilo noční pocení, 84 % vykázalo ústup nebo zlepšení v určitém okamžiku během 12 týdnů léčby přípravkem BIAXIN v dávkách 500 mg až 2 000 mg dvakrát denně. Podobně 77 % pacientů hlásilo ústup nebo zlepšení horečky v určitém okamžiku. Míry odpovědi na klinické příznaky MAC jsou uvedeny v tabulce 15 níže.
Medián trvání odpovědi, definované jako zlepšení nebo ústup klinických známek a symptomů, byl 2 týdny až 6 týdnů.
Vzhledem k tomu, že studie nebyla navržena tak, aby stanovila přínos monoterapie po 12 týdnech, může být doba trvání odpovědi podhodnocena u 25 % až 33 % pacientů, kteří nadále vykazovali klinickou odpověď po 12 týdnech.
Přežití
Střední doba přežití od vstupu do studie (1. studie) byla 249 dní při dávce 500 mg dvakrát denně ve srovnání s 215 dny při dávce 1000 mg dvakrát denně. Během prvních 12 týdnů terapie však došlo ke 2 úmrtím u 53 pacientů ve skupině s dávkou 500 mg dvakrát denně oproti 13 úmrtím u 51 pacientů ve skupině s dávkou 1000 mg dvakrát denně. Důvod tohoto zjevného rozdílu v úmrtnosti není znám. Přežití ve dvou skupinách bylo po 12 týdnech podobné. Střední doby přežití pro tyto dávky byly podobné jako u nedávných historických kontrol s MAC při léčbě kombinovanými terapiemi.2
Střední doba přežití od vstupu do studie 2 byla 199 dní pro dávku 500 mg dvakrát denně a 179 dní pro dávku 1000 mg dvakrát denně. Během prvních čtyř týdnů terapie, kdy byli pacienti udržováni na své původně přidělené dávce, došlo k 11 úmrtím u 255 pacientů užívajících 500 mg dvakrát denně a 18 úmrtím u 214 pacientů užívajících 1000 mg dvakrát denně.
Testy monoterapie s rozsahem dávek u pediatrických pacientů s AIDS s MAC
Studie 4 byla pediatrická studie s 3,75 mg/kg, 7,5 mg/kg a 15 mg/kg BIAXINu dvakrát denně u pacientů s AIDS definovaným CDC a počtem CD4 nižším než 100 buněk/mcL. Do studie bylo zařazeno 25 pacientů ve věku od 1 do 20 let. Studie hodnotila stejné koncové body jako ve studiích pro dospělé 1 a 2. Výsledky s dávkou 7,5 mg/kg dvakrát denně v pediatrické studii byly srovnatelné s výsledky pro 500 mg režim dvakrát denně ve studiích s dospělými.
Kombinovaná terapie u pacientů s AIDS s diseminovanou MAC
Studie 5 porovnávala bezpečnost a účinnost přípravku BIAXIN 250 mg v kombinaci s ethambutolem oproti přípravku BIAXIN 250 mg v kombinaci s ethambutolem a klofaziminem pro léčbu diseminované infekce MAC (dMAC). Do této 24týdenní studie bylo zařazeno 106 pacientů s AIDS a dMAC, přičemž 55 pacientů bylo randomizováno k léčbě přípravkem BIAXIN 500 mg a ethambutol a 51 pacientům bylo randomizováno k léčbě klarithromycinem, ethambutolem a klofazimem. Základní charakteristiky mezi léčebnými rameny byly podobné s výjimkou středních počtů CFU, které byly alespoň o 1 log vyšší ve skupině BIAXIN 500 mg, ethambutol a clofazime.
Ve srovnání s předchozími zkušenostmi s monoterapií klarithromycinem prodloužil dvoulékový režim klarithromycinu a ethambutolu dobu do mikrobiologického relapsu, a to především díky potlačení vzniku kmenů rezistentních na klarithromycin. Přidání klofaziminu do režimu však nepřidalo žádný další mikrobiologický nebo klinický přínos. Snášenlivost obou vícelékových režimů byla srovnatelná s nejčastějšími nežádoucími účinky gastrointestinálního charakteru. Pacienti, kteří dostávali režim obsahující klofazimin, měli sníženou míru přežití; jejich výchozí počty mykobakteriálních kolonií však byly vyšší. Výsledky této studie podporují přidání etambutolu ke klarithromycinu pro léčbu počátečních infekcí dMAC, ale nepodporují přidání klofaziminu jako třetího činidla.
Zánět středního ucha
Studie zánětu středního ucha BIAXIN vs. perorální cefalosporin
kontrolované klinické studii u dětských pacientů s akutním zánětem středního ucha provedené ve Spojených státech amerických, kde byly nalezeny významné podíly organismů produkujících beta-laktamázu, byl přípravek BIAXIN 500 mg srovnáván s perorálním cefalosporinem. V této studii byla ke stanovení klinické odpovědi použita přísná hodnotící kritéria. U 223 pacientů, u kterých byla hodnocena klinická účinnost, byla míra klinické úspěšnosti (tj. vyléčení plus zlepšení) při návštěvě po léčbě 88 % pro BIAXIN 500 mg a 91 % pro cefalosporin.
U menšího počtu pacientů byla mikrobiologická stanovení provedena při návštěvě před léčbou. Předpokládané výsledky eradikace/klinického vyléčení (tj. klinický úspěch) jsou uvedeny v tabulce 16.
Testy otitis media BIAXIN vs. antimikrobiální/beta-laktamázový inhibitor
Ve dvou dalších kontrolovaných klinických studiích akutního zánětu středního ucha provedených ve Spojených státech amerických, kde byly nalezeny významné podíly organismů produkujících beta-laktamázu, byl BIAXIN srovnáván s perorálním antimikrobiálním činidlem, které obsahovalo specifický inhibitor beta-laktamázy. V těchto studiích byla ke stanovení klinických odpovědí použita přísná hodnotící kritéria. U 233 pacientů, u kterých byla hodnocena klinická účinnost, byla kombinovaná klinická úspěšnost (tj. vyléčení a zlepšení) při návštěvě po léčbě 91 % jak pro BIAXIN 500 mg, tak pro kontrolu.
U pacientů, kteří měli mikrobiologická vyšetření při návštěvě před léčbou, jsou předpokládané výsledky eradikace/klinického vyléčení (tj. klinický úspěch) uvedeny v tabulce 17.
Eradikace H. pylori ke snížení rizika recidivy duodenálního vředu
BIAXIN + Lansoprazol a amoxicilin
Dvě randomizované, dvojitě zaslepené klinické studie v USA (studie 6 a studie 7) u pacientů s H. pylori a duodenální vředovou chorobou (definovanou jako aktivní vřed nebo aktivní vřed v anamnéze během jednoho roku) hodnotily účinnost přípravku BIAXIN 500 mg dvakrát denně v kombinaci s lansoprazolem 30 mg dvakrát denně a amoxicilinem 1 g dvakrát denně jako 14denní trojitá terapie k eradikaci H. pylori.
Eradikace H. pylori byla definována jako dva negativní testy (kultivace a histologie) za 4 týdny až 6 týdnů po ukončení léčby.
Kombinace BIAXIN plus lansoprazol a amoxicilin jako trojkombinace byla účinná při eradikaci H. pylori (viz výsledky v tabulce 18). Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu.
Randomizovaná, dvojitě zaslepená klinická studie (studie 8) provedená v USA u pacientů s H. pylori a duodenální vředovou chorobou (definovanou jako aktivní vřed nebo anamnéza vředu během jednoho roku) porovnávala účinnost přípravku BIAXIN 250 mg v kombinaci s lansoprazol a amoxicilin jako trojkombinace po dobu 10 dnů a 14 dnů. Tato studie prokázala, že 10denní trojitá terapie byla ekvivalentní 14denní trojité terapii při eradikaci H. pylori (viz výsledky v tabulce 18).
BIAXIN + Omeprazol a amoxicilinová terapie
Tři randomizované, dvojitě zaslepené klinické studie v USA u pacientů s infekcí H. pylori a duodenální vředovou chorobou (n = 558) porovnávaly BIAXIN plus omeprazol a amoxicilin s přípravkem BIAXIN 250 mg plus amoxicilin. Dvě studie (studie 9 a 10) byly provedeny u pacientů s aktivním duodenálním vředem a třetí studie (studie 11) byla provedena u pacientů s duodenálním vředem v posledních 5 letech, ale bez vředu přítomného v době zařazení do studie . Dávkovací režim ve studiích byl BIAXIN 500 mg dvakrát denně plus omeprazol 20 mg dvakrát denně plus amoxicilin 1 gram dvakrát denně po dobu 10 dnů. Ve studiích 9 a 10 dostávali pacienti, kteří užívali režim s omeprazolem, také dalších 18 dní omeprazolu 20 mg jednou denně. Studovanými cílovými body byla eradikace H. pylori a hojení duodenálních vředů (pouze studie 9 a 10). Stav H. pylori byl stanoven pomocí CLOtest®, histologie a kultivace ve všech třech studiích. U daného pacienta byl H. pylori považován za eradikovaný, pokud byly alespoň dva z těchto testů negativní a žádný nebyl pozitivní. Kombinace BIAXIN plus omeprazol a amoxicilin byla účinná při eradikaci H. pylori (viz výsledky v tabulce 19).
BIAXIN + Omeprazolová terapie
Čtyři randomizované, dvojitě zaslepené, multicentrické studie (studie 12, 13, 14 a 15) hodnotily BIAXIN 500 mg třikrát denně plus omeprazol 40 mg jednou denně po dobu 14 dnů, poté omeprazol 20 mg jednou denně ( studie 12, 13 a 15) nebo omeprazolem 40 mg jednou denně (studie 14) po dobu dalších 14 dnů u pacientů s aktivním duodenálním vředem spojeným s H. pylori. Studie 12 a 13 byly provedeny v USA a Kanadě a zahrnovaly 242 a 256 pacientů. Infekce H. pylori a duodenální vřed byly potvrzeny u 219 pacientů ve studii 12 a 228 pacientů ve studii 13. Tyto studie porovnávaly kombinovaný režim s omeprazolem a monoterapií BIAXIN. Studie 14 a 15 byly provedeny v Evropě a zahrnovaly 154 a 215 pacientů. Infekce H. pylori a duodenální vřed byly potvrzeny u 148 pacientů ve studii 14 a 208 pacientů ve studii 15. Tyto studie porovnávaly kombinovaný režim s monoterapií omeprazolem. Výsledky analýz účinnosti pro tyto studie jsou popsány v tabulkách 20, 21 a 22.
Hojení duodenálního vředu
Kombinace přípravku BIAXIN 250 mg a omeprazolu byla při hojení duodenálního vředu stejně účinná jako samotný omeprazol (viz tabulka 20).
Eradikace H. pylori spojeného s duodenálním vředem
Kombinace přípravku BIAXIN 500 mg a omeprazolu byla účinná při eradikaci H. pylori (viz tabulka 21). Eradikace H. pylori byla definována jako žádný pozitivní test (kultura nebo histologie) 4 týdny po ukončení léčby a dva negativní testy byly požadovány, aby bylo možné považovat za eradikované. V analýze podle protokolu byli vyloučeni následující pacienti: pacienti, kteří nedokončili léčbu, pacienti s velkým porušením protokolu, pacienti s chybějícími testy na H. pylori po léčbě a pacienti, u kterých nebyla hodnocena eradikace H. pylori 4 týdny po ukončení léčby. léčbě, protože se u nich na konci léčby zjistil nezhojený vřed.
Recidiva duodenálního vředu
Recidiva vředu za 6 měsíců a za 12 měsíců po ukončení léčby byla hodnocena u pacientů, u kterých byly vředy po léčbě zhojeny (viz výsledky v tabulce 22). U pacientů s duodenálním vředem spojeným s infekcí H. pylori tedy eradikace H. pylori redukovala recidivu vředu.
REFERENCE
2. Kemper CA, et al. Léčba komplexní bakteriémie Mycobacterium avium u AIDS pomocí čtyřlékového perorálního režimu. Ann Intern Med. 1992;116:466-472.
INFORMACE PRO PACIENTA
Poskytněte pacientům následující pokyny nebo informace o přípravku BIAXIN 250 mg:
- Poraďte pacientům, že antibakteriální léky včetně BIAXIN (klaritromycin) by měly být používány pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je přípravek BIAXIN 250 mg předepsán k léčbě bakteriální infekce, je třeba pacientům říci, že ačkoli je běžné, že se na začátku léčby cítí lépe, lék by měl být užíván přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem BIAXIN 250 mg nebo jinými antibakteriálními léky.
- Informujte pacienty, že průjem je častým problémem způsobeným antibakteriálními látkami včetně BIAXIN (klaritromycin), který obvykle končí, když je antibakteriální léčivo vysazeno. Někdy po zahájení léčby antibakteriálními látkami se u pacientů může objevit vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibakteriálního přípravku. Pokud k tomu dojde, poučte pacienty, aby co nejdříve kontaktovali svého poskytovatele zdravotní péče.
- Informujte pacienty, že BIAXIN (klaritromycin) může interagovat s některými léky; proto doporučte pacientům, aby svému poskytovateli zdravotní péče hlásili užívání jakýchkoli jiných léků.
- Informujte pacienty, že BIAXIN (klaritromycin) Filmtab a perorální suspenze lze užívat s jídlem nebo bez jídla a lze je užívat s mlékem; nicméně BIAXIN 250 mg XL Filmtab (tablety klarithromycinu s prodlouženým uvolňováním) je třeba užívat s jídlem. Suspenzi neuchovávejte v chladničce.
- Neexistují žádné údaje o účinku přípravku BIAXIN (klaritromycin) na schopnost řídit nebo obsluhovat stroje. Poraďte však pacientům ohledně možného závratě, vertiga, zmatenosti a dezorientace, které se mohou vyskytnout při užívání léků. Než budou pacienti řídit nebo obsluhovat stroje, je třeba vzít v úvahu možnost těchto nežádoucích účinků.
- Informujte pacienty, že pokud během užívání tohoto léku dojde k těhotenství, existuje potenciální riziko pro plod [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
- Doporučte pacientům, kteří mají onemocnění koronárních tepen, aby pokračovali v léčbě a úpravě životního stylu pro jejich onemocnění koronárních tepen, protože BIAXIN 500 mg může být spojen se zvýšeným rizikem úmrtnosti roky po ukončení léčby přípravkem BIAXIN.
