Aceon 2mg, 4mg, 8mg Perindopril Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Aceon 4 mg a jak se používá?
Aceon 8 mg je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze) a stabilního onemocnění koronárních tepen (CAD). Aceon lze užívat samostatně nebo s jinými léky.
Aceon patří do třídy léků nazývaných ACE inhibitory.
Není známo, zda je Aceon bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Aceon 4 mg?
Aceon může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- slabost,
- pomalý nebo nepravidelný srdeční tep,
- mdloby,
- nevolnost,
- zvracení,
- ztráta chuti k jídlu,
- bolest břicha,
- zežloutnutí očí nebo kůže (žloutenka),
- tmavá moč a
- těžké závratě
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Aceon 2 mg patří:
- závrať,
- točení hlavy,
- únava a
- suchý kašel
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Aceon. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Při zjištění těhotenství přerušte co nejdříve ACEON 4 mg. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ
- Léky, které působí přímo na renin-angiotensinový systém, mohou způsobit poranění a smrt vyvíjejícího se plodu. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ
POPIS
Tablety ACEON® (perindopril erbumin) obsahují terc-butylaminovou sůl perindoprilu, ethylester inhibitoru nesulfhydrylového angiotensin-konvertujícího enzymu (ACE). Perindopril erbumin je chemicky popsán jako 1-ethylester (2S,3DS,7DS)-1-[(S)-N-[(S)-1-karboxy-butyl]alanyl]hexahydro-2-indolinkarboxylové kyseliny, sloučenina s terc-butylamin (1:1). Jeho molekulový vzorec je C19H32N2O5C4H11N. Jeho strukturní vzorec je:
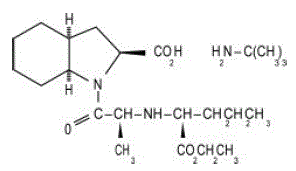
Perindopril erbumin je bílý krystalický prášek s molekulovou hmotností 368,47 (volná kyselina) nebo 441,61 (forma soli). Je volně rozpustný ve vodě (60 % w/w), alkoholu a chloroformu.
Perindopril je forma volné kyseliny perindoprilu erbuminu, je proléčivo a metabolizuje se in vivo hydrolýzou esterové skupiny za vzniku perindoprilátu, biologicky aktivního metabolitu.
ACEON je dostupný v síle 2 mg, 4 mg a 8 mg pro perorální podání. Kromě perindopril erbuminu obsahuje každá tableta následující neaktivní složky: koloidní oxid křemičitý (hydrofobní), laktózu, magnesium-stearát a mikrokrystalickou celulózu. Tablety 4 mg a 8 mg také obsahují oxid železitý.
INDIKACE
Hypertenze
ACEON je indikován k léčbě pacientů s esenciální hypertenzí. ACEON lze používat samostatně nebo s jinými třídami antihypertenziv, zejména s thiazidovými diuretiky.
Stabilní ischemická choroba srdeční
ACEON 8 mg je indikován k léčbě pacientů se stabilním onemocněním koronárních tepen ke snížení rizika kardiovaskulární mortality nebo nefatálního infarktu myokardu. ACEON lze použít s konvenční léčbou k léčbě onemocnění koronárních tepen, jako je protidestičková, antihypertenzní nebo hypolipidemická léčba.
DÁVKOVÁNÍ A PODÁVÁNÍ
Hypertenze
Použití u nekomplikovaných pacientů s hypertenzí
U pacientů s esenciální hypertenzí je doporučená počáteční dávka 4 mg jednou denně. Dávka může být titrována podle potřeby na maximálně 16 mg denně. Obvyklé rozmezí udržovací dávky je 4 mg až 8 mg podávaných v jedné denní dávce nebo ve dvou rozdělených dávkách.
Použití u starších pacientů
Doporučená počáteční denní dávka přípravku ACEON 4 mg pro starší osoby je 4 mg denně, podávaná v jedné nebo dvou dílčích dávkách. Zkušenosti s ACEONem u starších pacientů v dávkách přesahujících 8 mg jsou omezené. Dávky nad 8 mg by měly být podávány s pečlivým monitorováním krevního tlaku a titrací dávky (viz Použití u konkrétních populací ].
Používejte s diuretiky
pacientů, kteří jsou v současné době léčeni diuretiky, se může po úvodní dávce přípravku ACEON objevit symptomatická hypotenze. Zvažte snížení dávky diuretika před zahájením léčby ACEONem [viz DROGOVÉ INTERAKCE ].
Stabilní ischemická choroba srdeční
U pacientů se stabilním onemocněním koronárních tepen by měl být ACEON 4 mg podáván v počáteční dávce 4 mg jednou denně po dobu 2 týdnů a poté by měl být podle tolerance zvýšen na udržovací dávku 8 mg jednou denně. U starších pacientů (nad 70 let) by měl být ACEON podáván jako dávka 2 mg jednou denně v prvním týdnu, následovaná 4 mg jednou denně ve druhém týdnu a 8 mg jednou denně jako udržovací dávka, pokud je tolerována.
Úprava dávky při poškození ledvin a dialýze
Eliminace perindoprilátu je snížena u pacientů s poruchou funkce ledvin. ACEON se nedoporučuje u pacientů s clearance kreatininu
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety jsou podlouhlé s půlicí rýhou na jedné straně.
2 mg tableta je bílá a na straně bez rýhy je vyraženo „ACN 2“.
4 mg tableta je růžová a na straně bez rýhy je vyraženo „ACN 4“.
8mg tableta je lososová a na straně bez rýhy je vyraženo „ACN 8“.
Skladování A Manipulace
Tablety jsou podlouhlé s půlicí rýhou na jedné straně.
Udržujte mimo dosah dětí.
Skladujte při kontrolované pokojové teplotě 20° až 25°C (68° až 77°F) [viz USP]. Chraňte před vlhkostí.
Chcete-li získat další informace, zavolejte na bezplatné telefonní oddělení našeho lékařského komunikačního oddělení na čísle 888-985-7657.
Výrobce: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA. Revize: září 2017
VEDLEJŠÍ EFEKTY
Vzhledem k tomu, že klinické studie probíhají za velmi odlišných podmínek, nelze četnost nežádoucích příhod pozorovaná v klinických studiích léku přímo srovnávat s mírou v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Zkušenosti z klinických studií
Následující nežádoucí účinky jsou diskutovány jinde v označení:
- Anafylaktoidní reakce, včetně angioedému [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypotenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Neutropenie a agranulocytóza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Porucha funkce ledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyperkalémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kašel [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Hypertenze
ACEON 4 mg byl hodnocen z hlediska bezpečnosti u přibližně 3 400 pacientů s hypertenzí v amerických a zahraničních klinických studiích. Údaje zde uvedené jsou založeny na výsledcích od 1 417 pacientů léčených ACEON, kteří se účastnili klinických studií v USA. Více než 220 z těchto pacientů bylo léčeno ACEON® (perindopril erbumin) po dobu alespoň jednoho roku.
placebem kontrolovaných klinických studiích v USA byla incidence předčasného ukončení léčby z důvodu nežádoucích účinků 6,5 % u pacientů léčených ACEONem 2 mg a 6,7 % u pacientů léčených placebem. Nejčastějšími příčinami byly kašel, bolest hlavy, astenie a závratě.
Mezi 1 012 pacienty v placebem kontrolovaných studiích v USA byla celková frekvence hlášených nežádoucích účinků podobná u pacientů léčených ACEONem au pacientů léčených placebem (přibližně 75 % v každé skupině). Jedinými nežádoucími účinky, jejichž výskyt u ACEONu 4 mg byl alespoň o 2 % vyšší než u placeba, byl kašel (12 % vs. 4,5 %) a bolest zad (5,8 % vs. 3,1 %).
Závratě nebyly hlášeny častěji ve skupině s perindoprilem (8,2 %) než ve skupině s placebem (8,5 %), ale jejich pravděpodobnost se zvyšovala s dávkou, což naznačuje kauzální vztah s perindoprilem.
Stabilní ischemická choroba srdeční
Bezpečnost perindoprilu byla hodnocena v EUROPA, dvojitě zaslepené, placebem kontrolované studii u 12 218 pacientů se stabilním onemocněním koronárních tepen. Celková míra přerušení léčby byla asi 22 % u léku a placeba. Nejčastějšími zdravotními důvody pro vysazení, které byly častější na perindoprilu než na placebu, byly kašel, léková intolerance a hypotenze.
Postmarketingové zkušenosti
Dobrovolná hlášení nežádoucích účinků u pacientů užívajících ACEON, která byla přijata od uvedení na trh a jejichž příčinná souvislost s ACEON 8 mg je neznámá, zahrnují: srdeční zástavu, eozinofilní pneumonitidu, neutropenii/agranulocytózu, pancytopenii, anémii (včetně hemolytické a aplastické), trombocytopenii, akutní selhání ledvin, nefritida, selhání jater, žloutenka (hepatocelulární nebo cholestatická), symptomatická hyponatremie, bulózní pemfigoid, pemfigus, akutní pankreatitida, pády, psoriáza, exfoliativní dermatitida a syndrom, který může zahrnovat: artralgii/artritidu, vaskulitidu, serozitidu, myalgii, , vyrážka nebo jiné dermatologické projevy, pozitivní antinukleární protilátka (ANA), leukocytóza, eozinofilie nebo zvýšená sedimentace erytrocytů (ESR).
Výsledky klinických laboratorních testů
Hematologie
pacientů s hypertenzí léčených přípravkem ACEON 8 mg se často vyskytují malé poklesy hemoglobinu a hematokritu, které však mají klinický význam jen zřídka. V kontrolovaných klinických studiích nebyla u žádného pacienta přerušena léčba z důvodu rozvoje anémie. Leukopenie (včetně neutropenie) byla pozorována u 0,1 % pacientů v klinických studiích v USA [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Testy jaterních funkcí
V placebem kontrolovaných klinických studiích bylo pozorováno zvýšení ALT (1,6 % ACEON versus 0,9 % placebo) a AST (0,5 % ACEON 2 mg versus 0,4 % placebo). Zvýšení byla obecně mírná a přechodná a odezněla po přerušení léčby.
DROGOVÉ INTERAKCE
Diuretika
pacientů užívajících diuretika, a zvláště u těch, kteří začali nedávno, může po zahájení léčby přípravkem ACEON příležitostně dojít k nadměrnému snížení krevního tlaku. Možnost hypotenzních účinků lze minimalizovat buď snížením dávky nebo vysazením diuretika nebo zvýšením příjmu soli před zahájením léčby perindoprilem. Pokud nelze diuretickou léčbu změnit, zajistěte pečlivý lékařský dohled při první dávce přípravku ACEON po dobu nejméně dvou hodin a dokud se krevní tlak nestabilizuje na další hodinu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Rychlost a rozsah absorpce a eliminace perindoprilu nejsou ovlivněny souběžně podávanými diuretiky. Biologická dostupnost perindoprilátu byla však snížena diuretiky, což bylo spojeno se snížením plazmatické inhibice ACE.
Draslíkové doplňky a draslík šetřící diuretika
ACEON 8 mg může zvýšit hladinu draslíku v séru, protože má potenciál snižovat produkci aldosteronu. Riziko hyperkalemie může zvýšit užívání kalium šetřících diuretik (spironolakton, amilorid, triamteren a další), doplňků draslíku nebo jiných léků schopných zvýšit hladinu draslíku v séru (indometacin, heparin, cyklosporin a další). Proto, pokud je indikováno současné užívání takových přípravků, často monitorujte hladinu draslíku v séru pacienta.
Lithium
U pacientů léčených současně lithiem a ACE inhibitory bylo hlášeno zvýšení sérového lithia a příznaky toxicity lithia. Doporučuje se časté monitorování sérové koncentrace lithia. Použití diuretik může dále zvýšit riziko toxicity lithia.
Zlato
Nitritoidní reakce (příznaky zahrnují zčervenání obličeje, nauzeu, zvracení a hypotenzi) byly vzácně hlášeny u pacientů léčených injekčním zlatem (aurothiomalát sodný) a souběžnou terapií ACE inhibitory včetně ACEONu.
Digoxin
Kontrolovaná farmakokinetická studie neprokázala žádný účinek na plazmatické koncentrace digoxinu při současném podávání s ACEONem, ale vliv digoxinu na plazmatickou koncentraci perindoprilu/perindoprilátu nebyl vyloučen.
Gentamicin
Údaje na zvířatech naznačují možnost interakce mezi perindoprilem a gentamicinem. To však nebylo zkoumáno ve studiích na lidech.
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
U pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s ACE inhibitory, včetně perindoprilu, vést ke zhoršení funkce ledvin včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených perindoprilem a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek inhibitorů ACE, včetně perindoprilu, může být zeslaben NSAID včetně selektivních inhibitorů COX-2.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií. Většina pacientů užívajících kombinaci dvou inhibitorů RAS nezíská žádný další přínos ve srovnání s monoterapií. Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Pečlivě sledujte krevní tlak, renální funkce a elektrolyty u pacientů užívajících ACEON 2 mg a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s ACEON 8 mg pacientům s diabetem. Vyhněte se užívání aliskirenu s ACEONem 2 mg u pacientů s poruchou funkce ledvin (GFR
Inhibitory mTOR
Pacienti, kteří současně užívají inhibitory mTOR (savčí cíl rapamycinu), mohou mít zvýšené riziko angioedému (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Neprilysinový inhibitor
Pacienti užívající současně inhibitory neprilysinu mohou mít zvýšené riziko angioedému. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Anafylaktoidní a možná související reakce
Pravděpodobně proto, že inhibitory angiotenzin konvertujícího enzymu ovlivňují metabolismus eikosanoidů a polypeptidů, včetně endogenního bradykininu, mohou být pacienti užívající ACE inhibitory (včetně ACEONu) vystaveni řadě nežádoucích účinků, z nichž některé jsou závažné. Černošští pacienti užívající ACE inhibitory mají vyšší výskyt angioedému ve srovnání s nečernošskými pacienty.
Angioedém hlavy a krku
Angioedém obličeje, končetin, rtů, jazyka, glottis nebo hrtanu byl hlášen u pacientů léčených ACE inhibitory, včetně ACEONu (0,1 % pacientů léčených ACEONem v klinických studiích v USA). Angioedém spojený s postižením jazyka, glottis nebo hrtanu může být fatální. V takových případech okamžitě přerušte léčbu přípravkem ACEON a pozorujte, dokud otok nezmizí. Pokud se zdá, že postižení jazyka, hlasivkové štěrbiny nebo hrtanu pravděpodobně způsobí obstrukci dýchacích cest, okamžitě podejte vhodnou terapii, jako je subkutánní roztok epinefrinu 1:1000 (0,3 až 0,5 ml).
Pacienti, kteří současně užívají inhibitory mTOR (např. temsirolimus) nebo inhibitor neprilysinu, mohou mít zvýšené riziko angioedému (viz DROGOVÉ INTERAKCE ].
Střevní angioedém
pacientů léčených ACE inhibitory byl hlášen střevní angioedém. U těchto pacientů se objevily bolesti břicha (s nevolností nebo zvracením nebo bez nich); v některých případech nebyl v anamnéze obličejový angioedém a hladiny C-1 esterázy byly normální. Angioedém byl diagnostikován procedurami včetně CT břicha nebo ultrazvuku nebo při operaci a symptomy vymizely po vysazení ACE inhibitoru. Střevní angioedém by měl být zahrnut do diferenciální diagnózy pacientů užívajících ACE inhibitory s bolestí břicha.
Hypotenze
ACEON 4 mg může způsobit symptomatickou hypotenzi. ACEON byl spojen s hypotenzí u 0,3 % pacientů s nekomplikovanou hypertenzí v placebem kontrolovaných studiích v USA. Symptomy související s ortostatickou hypotenzí byly hlášeny u dalších 0,8 % pacientů.
Symptomatická hypotenze se s největší pravděpodobností objeví u pacientů, u kterých došlo k depleci objemu nebo solí v důsledku dlouhodobé diuretické léčby, dietního omezení soli, dialýzy, průjmu nebo zvracení [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
ACE inhibitory mohou způsobit nadměrnou hypotenzi a mohou být spojeny s oligurií nebo azotemií a vzácně s akutním selháním ledvin a smrtí. U pacientů s ischemickou chorobou srdeční nebo cerebrovaskulárním onemocněním může nadměrný pokles krevního tlaku vést k infarktu myokardu nebo cerebrovaskulární příhodě.
U pacientů s rizikem nadměrné hypotenze by měla být léčba přípravkem ACEON zahájena pod velmi pečlivým lékařským dohledem. Pacienti by měli být pečlivě sledováni po dobu prvních dvou týdnů léčby a vždy, když se dávka přípravku ACEON 2 mg a/nebo diuretika zvýší.
Pokud dojde k nadměrné hypotenzi, pacient by měl být okamžitě uložen do polohy na zádech a v případě potřeby by měl být léčen intravenózní infuzí fyziologického roztoku. Léčba přípravkem ACEON 4 mg může obvykle pokračovat po obnovení objemu a krevního tlaku.

Neutropenie/agranulocytóza
ACE inhibitory byly spojovány s agranulocytózou a útlumem kostní dřeně, nejčastěji u pacientů s poruchou funkce ledvin, zejména u pacientů s kolagenovým vaskulárním onemocněním, jako je systémový lupus erythematodes nebo sklerodermie.
Fetální toxicita
Kategorie těhotenství D
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, přerušte ACEON 4 mg co nejdříve [viz Použití u konkrétních populací ].
Porucha funkce ledvin
V důsledku inhibice systému renin-angiotenzin-aldosteron lze u citlivých jedinců předpokládat změny funkce ledvin. U pacientů užívajících ACEON by měla být pravidelně monitorována funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ ], [viz DROGOVÉ INTERAKCE ].
pacientů s těžkým městnavým srdečním selháním, kde funkce ledvin může záviset na aktivitě renin-angiotenzinaldosteronového systému, může být léčba ACE inhibitory včetně ACEONu spojena s oligurií, progresivní azotemií a vzácně s akutním selháním ledvin a smrtí.
U hypertoniků s jednostrannou nebo bilaterální stenózou renální arterie může dojít ke zvýšení dusíku močoviny v krvi a sérového kreatininu; obvykle reverzibilní po vysazení ACE inhibitoru. U těchto pacientů by měla být během prvních několika týdnů léčby sledována funkce ledvin.
U některých pacientů léčených přípravkem ACEON došlo k mírnému a přechodnému zvýšení dusíku močoviny v krvi a sérového kreatininu, zejména u pacientů, kteří jsou současně léčeni diuretiky.
Hyperkalémie
některých pacientů léčených ACE inhibitory, včetně ACEONu, bylo pozorováno zvýšení sérového draslíku. Většina případů byly izolované jednotlivé hodnoty, které se nejevily klinicky relevantní a byly jen zřídka důvodem k vysazení. Rizikové faktory pro rozvoj hyperkalémie zahrnují renální insuficienci, diabetes mellitus a současné užívání látek, jako jsou draslík šetřící diuretika, doplňky draslíku a/nebo náhražky soli obsahující draslík [viz DROGOVÉ INTERAKCE ].
U pacientů užívajících ACEON je třeba pravidelně monitorovat hladinu draslíku v séru.
Kašel
Pravděpodobně kvůli inhibici degradace endogenního bradykininu byl u všech ACE inhibitorů hlášen přetrvávající neproduktivní kašel, který obvykle ustoupil po přerušení léčby. V diferenciální diagnostice kašle zvažte kašel vyvolaný inhibitorem ACE.
Jaterní selhání
Vzácně byly ACE inhibitory spojovány se syndromem, který začíná cholestatickou žloutenkou a progreduje do fulminantní jaterní nekrózy a někdy smrti. Mechanismus tohoto syndromu není znám. Pacienti užívající ACE inhibitory, u kterých se rozvine žloutenka nebo výrazné zvýšení jaterních enzymů, by měli vysadit ACE inhibitor a podstoupit vhodné lékařské sledování.
Chirurgie/Anestezie
U pacientů podstupujících chirurgický zákrok nebo během anestezie látkami, které vyvolávají hypotenzi, může ACEON blokovat tvorbu angiotenzinu II, která by jinak nastala sekundárně po kompenzačním uvolňování reninu. Hypotenzi, kterou lze připsat tomuto mechanismu, lze korigovat objemovou expanzí.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogenita
Nebyly pozorovány žádné důkazy karcinogenního účinku ve studiích na potkanech a myších, když byl perindopril podáván v dávkách až 20násobku (mg/kg) nebo 2 až 4násobku (mg/m2) maximálních navrhovaných klinických dávek (16 mg/den) pro 104 týdnů.
Mutageneze
Nebyl zjištěn žádný genotoxický potenciál pro ACEON, perindoprilát a další metabolity v různých in vitro a in vivo výzkumech, včetně Amesova testu, testu Saccharomyces cerevisiae D4, kultivovaných lidských lymfocytů, testu TK ± myšího lymfomu, mikronukleárních testů na myších a potkanech a na čínském křečku test kostní dřeně.
Zhoršení Plodnosti
Nebyl zjištěn žádný významný účinek na reprodukční schopnost nebo plodnost u potkanů, kterým bylo podáváno až 30násobek (mg/kg) nebo 6násobek (mg/m2) navrhované maximální klinické dávky ACEON 2 mg během období spermatogeneze u samců nebo oogeneze a gestace u samic.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství D [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Po zjištění těhotenství přerušte co nejdříve ACEON. Tyto nežádoucí účinky jsou obvykle spojeny s užíváním těchto léků ve druhém a třetím trimestru těhotenství. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv.
Vhodná léčba hypertenze matky během těhotenství je důležitá pro optimalizaci výsledků pro matku i plod.
neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími renin-angiotensinový systém, informujte matku o potenciálním riziku pro plod. Proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. Pokud je pozorován oligohydramnion, vysaďte ACEON 2 mg, pokud to není považováno za záchranu života matky. V závislosti na týdnu těhotenství může být vhodné provést fetální testování. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění. Pečlivě sledujte kojence s anamnézou in utero expozice ACEONu na hypotenzi, oligurii a hyperkalémii [viz Pediatrické použití ].
Radioaktivita byla detekovatelná u plodů po podání 14C-perindoprilu březím potkanům.
Kojící matky
Mléko kojících potkanů obsahovalo po podání 14C-perindoprilu radioaktivitu. Není známo, zda se perindopril vylučuje do lidského mateřského mléka. Vzhledem k tomu, že do mateřského mléka se vylučuje mnoho léků, je třeba při podávání ACEONu kojícím matkám postupovat opatrně.
Pediatrické použití
Novorozenci s anamnézou in utero expozice ACEON
Pokud se objeví oligurie nebo hypotenze, zaměřte pozornost na podporu krevního tlaku a renální perfuze. Výměnné transfuze nebo dialýza mohou být nutné jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin. Perindopril, který prochází placentou, může být teoreticky odstraněn z novorozeneckého oběhu těmito prostředky, ale omezené zkušenosti neukázaly, že by takové odstranění mělo zásadní význam pro léčbu těchto kojenců.
Bezpečnost a účinnost přípravku ACEON 8 mg u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Průměrný účinek perindoprilu na krevní tlak byl o něco menší u pacientů starších 60 let než u mladších pacientů, i když rozdíl nebyl významný. Plazmatické koncentrace perindoprilu i perindoprilátu byly u starších pacientů zvýšeny ve srovnání s koncentracemi u mladších pacientů. U starších pacientů nebyly jasně zvýšené žádné nežádoucí účinky s výjimkou závratí a možné vyrážky.
Začněte s nízkou dávkou a podle potřeby pomalu titrujte. Sledujte, zda nemáte závratě kvůli možnému pádu.
Zkušenosti s přípravkem ACEON 8 mg u starších pacientů v denních dávkách přesahujících 8 mg jsou omezené.
Renální poškození
U pacientů s poruchou funkce ledvin může být nutná úprava dávkování (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Biologická dostupnost perindoprilátu je zvýšena u pacientů s poruchou funkce jater [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
zvířat nebyly dávky perindoprilu až do 2 500 mg/kg u myší, 3 000 mg/kg u potkanů a 1 600 mg/kg u psů letální. Minulé zkušenosti byly skromné, ale naznačovaly, že předávkování jinými ACE inhibitory bylo lidmi také docela dobře tolerováno. Nejpravděpodobnějším projevem je hypotenze a léčba by měla být symptomatická a podpůrná. Léčba ACE inhibitorem by měla být přerušena a pacient by měl být sledován. Dehydratace, nerovnováha elektrolytů a hypotenze by měly být léčeny zavedenými postupy.
Mezi hlášenými případy předávkování perindoprilem potřebovali pacienti, o kterých bylo známo, že požili dávku 80 mg až 120 mg, asistovanou ventilaci a podporu oběhu. U jednoho dalšího pacienta došlo k hypotermii, zástavě oběhu a zemřel po požití až 180 mg perindoprilu. Intervence při předávkování perindoprilem může vyžadovat intenzivní podporu.
Laboratorní stanovení sérových hladin perindoprilu a jeho metabolitů nejsou široce dostupná a taková stanovení v žádném případě nemají žádnou stanovenou roli v léčbě předávkování perindoprilem.
Nejsou k dispozici žádné údaje, které by naznačovaly fyziologické manévry (např. manévry ke změně pH moči), které by mohly urychlit eliminaci perindoprilu a jeho metabolitů. Perindopril lze odstranit hemodialýzou s clearance 52 ml/min pro perindopril a 67 ml/min pro perindoprilát.
Angiotensin II by pravděpodobně mohl sloužit jako specifický antagonista-antidotum při urovnání předávkování perindoprilem, ale angiotenzin II je v podstatě nedostupný mimo rozptýlená výzkumná zařízení. Protože hypotenzního účinku perindoprilu je dosaženo vazodilatací a účinnou hypovolémií, je rozumné léčit předávkování perindoprilem infuzí normálního fyziologického roztoku.
KONTRAINDIKACE
ACEON® (perindopril erbumin) je kontraindikován u pacientů, o kterých je známo, že jsou přecitlivělí (včetně angioedému) na tento přípravek nebo na jakýkoli jiný ACE inhibitor. ACEON 4 mg je také kontraindikován u pacientů s hereditárním nebo idiopatickým angioedémem.
Nepodávejte aliskiren současně s ACEONem pacientům s diabetem. [vidět DROGOVÉ INTERAKCE ]
ACEON je kontraindikován v kombinaci s inhibitorem neprilysinu (např. sakubitril). Nepodávejte ACEON 8 mg do 36 hodin po přechodu na sakubitril/valsartan, inhibitor neprilysinu nebo ze sakubitrilu/valsartanu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
ACEON® (perindopril erbumin) je proléčivo pro perindoprilát, který inhibuje ACE u lidí a zvířat. Předpokládá se, že mechanismus, kterým perindoprilát snižuje krevní tlak, je primárně inhibice aktivity ACE. ACE je peptidyldipeptidáza, která katalyzuje přeměnu neaktivního dekapeptidu, angiotensinu I, na vazokonstriktor, angiotenzin II. Angiotensin II je silný periferní vazokonstriktor, který stimuluje sekreci aldosteronu kůrou nadledvin a poskytuje negativní zpětnou vazbu na sekreci reninu. Inhibice ACE vede ke snížení plazmatického angiotensinu II, což vede ke snížení vazokonstrikce, zvýšení aktivity plazmatického reninu a snížení sekrece aldosteronu. To má za následek diurézu a natriurézu a může být spojeno s malým zvýšením sérového draslíku.
ACE je identický s kininázou II, enzymem, který degraduje bradykinin. Zda zvýšené hladiny bradykininu, silného vazodepresorového peptidu, hrají roli v terapeutických účincích ACEON 4 mg, je třeba ještě objasnit.
Zatímco se předpokládá, že hlavním mechanismem perindoprilu při snižování krevního tlaku je systém renin-angiotensinaldosteron, ACE inhibitory mají určitý účinek i při zjevné hypertenzi s nízkým obsahem reninu. Perindopril byl studován na relativně malém počtu černošských pacientů, obvykle na populaci s nízkým obsahem reninu, a průměrná odpověď diastolického krevního tlaku na perindopril byla přibližně poloviční než odpověď pozorovaná u pacientů jiné rasy, což je nález v souladu s předchozí zkušeností s jinými ACE inhibitory.
Farmakodynamika
Po podání perindoprilu je ACE inhibován v závislosti na dávce a koncentraci v krvi, přičemž maximální inhibice 80 až 90 % dosažená dávkou 8 mg přetrvává po dobu 10 až 12 hodin. Po těchto dávkách je 24 hodinová inhibice ACE asi 60 %. Zdá se, že stupeň ACE inhibice dosažený danou dávkou se časem snižuje (ID50 se zvyšuje). Presorická odpověď na infuzi angiotensinu I je perindoprilem snížena, ale tento účinek není tak trvalý jako účinek na ACE; existuje asi 35% inhibice za 24 hodin po dávce 12 mg.
Farmakokinetika
Vstřebávání
Perorální podání ACEONu vede k vrcholovým plazmatickým koncentracím, ke kterým dochází přibližně za 1 hodinu. Absolutní biologická dostupnost perindoprilu po perorálním podání je asi 75 %. Po absorpci je přibližně 30 až 50 % systémově dostupného perindoprilu hydrolyzováno na jeho aktivní metabolit perindoprilát, který má průměrnou biologickou dostupnost přibližně 25 %. Maximálních plazmatických koncentrací perindoprilátu je dosaženo za 3 až 7 hodin po podání perindoprilu. Perorální podání přípravku ACEON 8 mg s jídlem významně nesnižuje rychlost nebo rozsah absorpce perindoprilu ve srovnání se stavem nalačno. Rozsah biotransformace perindoprilu na aktivní metabolit perindoprilát je však snížen přibližně o 43 %, což vede ke snížení křivky inhibice ACE v plazmě přibližně o 20 %, což je pravděpodobně klinicky nevýznamné. V klinických studiích byl perindopril obecně podáván ve stavu bez hladovění.
dávkami ACEONu 4 mg, 8 mg a 16 mg se Cmax a AUC perindoprilu a perindoprilátu zvyšují úměrně dávce jak po jednorázovém perorálním podání, tak v ustáleném stavu během vícedávkového režimu jednou denně.
Rozdělení
Přibližně 60 % cirkulujícího perindoprilu se váže na plazmatické proteiny a pouze 10 až 20 % perindoprilátu se váže. Lékové interakce zprostředkované účinky na vazbu proteinů se proto nepředpokládají.
Metabolismus A Eliminace
Po perorálním podání perindopril vykazuje multikompartmentovou farmakokinetiku včetně hlubokého tkáňového kompartmentu (ACE vazebná místa). Průměrný poločas perindoprilu spojený s většinou jeho eliminace je přibližně 0,8 až 1 hodina.
Perindopril je po perorálním podání rozsáhle metabolizován, pouze 4 až 12 % dávky se objeví v nezměněné podobě v moči. Bylo identifikováno šest metabolitů vznikajících hydrolýzou, glukuronidací a cyklizací prostřednictvím dehydratace. Patří mezi ně aktivní inhibitor ACE, perindoprilát (hydrolyzovaný perindopril), perindopril a perindoprilát glukuronidy, dehydratovaný perindopril a diastereoizomery dehydratovaného perindoprilátu. U lidí se zdá, že za hydrolýzu perindoprilu je zodpovědná jaterní esteráza.
Aktivní metabolit perindoprilát také vykazuje multikompartmentovou farmakokinetiku po perorálním podání ACEONu. Tvorba perindoprilátu je pozvolná s maximální plazmatickou koncentrací mezi 3 a 7 hodinami. Následný pokles plazmatické koncentrace ukazuje zdánlivý průměrný poločas 3 až 10 hodin pro většinu eliminace, s prodlouženým terminálním eliminačním poločasem 30 až 120 hodin v důsledku pomalé disociace perindoprilátu z vazby ACE v plazmě/tkáni stránky. Během opakovaného perorálního podávání perindoprilu jednou denně se perindoprilát kumuluje asi 1,5 až 2krát a rovnovážného stavu plazmatických hladin dosahuje za 3 až 6 dnů. Clearance perindoprilátu a jeho metabolitů je téměř výhradně renální.
Starší
Plazmatické koncentrace perindoprilu i perindoprilátu u starších pacientů (starších než 70 let) jsou přibližně dvojnásobné než u mladších pacientů, což odráží jak zvýšenou konverzi perindoprilu na perindoprilát, tak snížené vylučování perindoprilátu ledvinami [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Srdeční selhání
Clearance perindoprilátu je snížena u pacientů s městnavým srdečním selháním, což má za následek o 40 % delší interval mezi dávkami AUC.
Renální poškození
Při dávkách perindoprilu 2 mg až 4 mg se AUC perindoprilátu zvyšuje s klesající funkcí ledvin. Při clearance kreatininu 30 až 80 ml/min je AUC přibližně dvojnásobná než při 100 ml/min. Když clearance kreatininu klesne pod 30 ml/min, AUC se zvyšuje výrazněji.
U omezeného počtu studovaných pacientů se clearance perindoprilu dialýzou pohybovala od přibližně 40 do 80 ml/min. Clearance perindoprilátu dialýzou se pohybovala od asi 40 do 90 ml/min [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Poškození jater
Biologická dostupnost perindoprilátu je zvýšena u pacientů s poruchou funkce jater. Plazmatické koncentrace perindoprilátu u pacientů s poruchou funkce jater byly asi o 50 % vyšší než koncentrace pozorované u zdravých subjektů nebo hypertoniků s normální funkcí jater.
Klinické studie
Hypertenze
placebem kontrolovaných studiích monoterapie perindoprilem (2 mg až 16 mg jednou denně) u pacientů s průměrným krevním tlakem přibližně 150/100 mm Hg měly 2 mg malý účinek, ale dávky 4 mg až 16 mg krevní tlak snižovaly. Dávky 8 mg a 16 mg byly nerozeznatelné a obě měly větší účinek než dávka 4 mg. V těchto studiích dávky 8 mg a 16 mg denně způsobily snížení krevního tlaku vleže na nejnižší úrovni o 9 až 15/5 až 6 mm Hg. Při srovnání dávkování jednou denně a dvakrát denně byl režim dávkování dvakrát denně obecně mírně lepší, ale ne o více než asi 0,5 mm Hg až 1 mm Hg. Po dávkách 2 mg až 16 mg perindoprilu byly účinky na minimální systolický a diastolický krevní tlak asi 75 až 100 % maximálních účinků.
Účinky perindoprilu na krevní tlak byly podobné, když byl podáván samostatně nebo v kombinaci s 25 mg hydrochlorothiazidu. Obecně se účinek perindoprilu dostavil okamžitě, s mírným zvýšením účinků během několika týdnů.
Formální studie interakcí přípravku ACEON® (perindopril erbumin) nebyly provedeny s jinými antihypertenzivy než thiazidy. Omezené zkušenosti v kontrolovaných a nekontrolovaných studiích při současném podávání přípravku ACEON 2 mg s blokátorem kalciových kanálů, kličkovým diuretikem nebo trojkombinací (betablokátor, vazodilatátor a diuretikum) nenaznačují žádné neočekávané interakce. Obecně mají ACE inhibitory méně než aditivní účinky, pokud jsou podávány s beta-adrenergními blokátory, pravděpodobně proto, že oba působí částečně prostřednictvím renin-angiotenzinového systému.
V nekontrolovaných studiích u pacientů s inzulín-dependentním diabetem se nezdálo, že by perindopril ovlivňoval glykemickou kontrolu. Při dlouhodobém užívání nebyl u těchto pacientů pozorován žádný vliv na vylučování bílkovin močí.
Účinnost přípravku ACEON 4 mg nebyla ovlivněna pohlavím a byla méně účinná u pacientů černé pleti než u pacientů jiné rasy. U starších pacientů (starších nebo rovných 60 let) byl průměrný účinek na krevní tlak poněkud menší než u mladších pacientů, i když rozdíl nebyl významný.
Stabilní ischemická choroba srdeční
Evropská studie O redukci srdečních příhod s perindoprilem při stabilním onemocnění koronárních tepen (EUROPA) byla multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie provedená u 12 218 pacientů, kteří měli prokázané stabilní onemocnění koronárních tepen bez klinického srdečního selhání. Pacienti měli známky onemocnění koronárních tepen dokumentované předchozím infarktem myokardu více než 3 měsíce před screeningem, koronární revaskularizaci více než 6 měsíců před screeningem, angiografický průkaz stenózy (alespoň 70% zúžení jedné nebo více hlavních koronárních tepen) nebo pozitivní stres test u mužů s anamnézou bolesti na hrudi. Po zaváděcím období 4 týdnů, během kterého všichni pacienti dostávali perindopril 2 mg až 8 mg, byli pacienti náhodně rozděleni do skupiny s perindoprilem 8 mg jednou denně (n=6 110) nebo odpovídajícím placebem (n=6 108). Průměrná doba sledování byla 4,2 roku. Studie zkoumala dlouhodobé účinky perindoprilu na čas do první příhody kardiovaskulární mortality, nefatálního infarktu myokardu nebo srdeční zástavy u pacientů se stabilním onemocněním koronárních tepen.
Průměrný věk pacientů byl 60 let; 85 % byli muži, 92 % užívalo inhibitory krevních destiček, 63 % užívalo β-blokátory a 56 % užívalo hypolipidemickou terapii. Studie EUROPA ukázala, že perindopril významně snížil relativní riziko příhod primárního cílového ukazatele (tabulka 1). Tento příznivý účinek lze z velké části připsat snížení rizika nefatálního infarktu myokardu. Tento příznivý účinek perindoprilu na primární výsledek byl patrný přibližně po jednom roce léčby (obrázek 1). Výsledek byl podobný ve všech předem definovaných podskupinách podle věku, základního onemocnění nebo souběžné medikace (obrázek 2).
Obrázek 1. Čas do prvního výskytu primárního koncového bodu 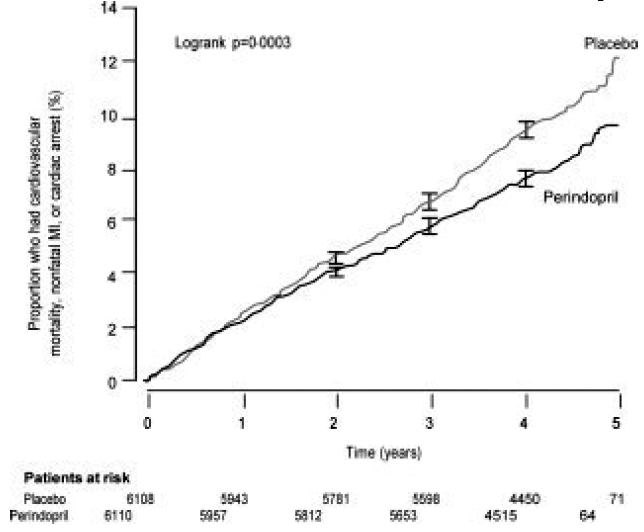
Obrázek 2. Příznivý účinek léčby perindoprilem na primární cílový bod v předem definovaných podskupinách 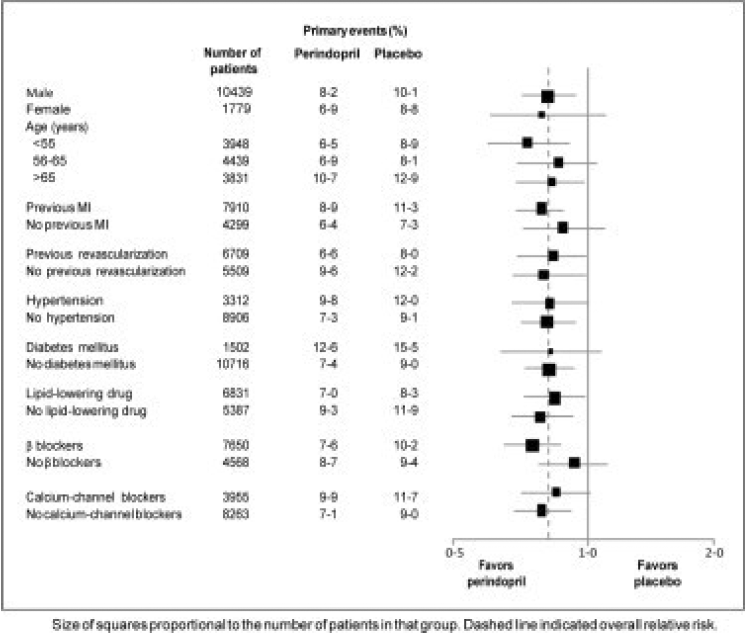
INFORMACE PRO PACIENTA
Pacientky ve fertilním věku by měly být informovány o důsledcích expozice ACEON 2 mg během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Pacientky by měly být požádány, aby co nejdříve hlásily těhotenství svým lékařům.
Řekněte pacientům, aby neprodleně hlásili jakékoli známky infekce (např. bolest v krku, horečka), které by mohly být známkou neutropenie.
