Procardia 30mg Nifedipine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Procardia 30 mg a jak se používá?
Procardia je lék na předpis používaný k léčbě příznaků bolesti na hrudi (angina pectoris), vysokého krevního tlaku (hypertenze) a plicní hypertenze. Procardia 30 mg lze užívat samostatně nebo s jinými léky.
Procardia patří do třídy léků nazývaných blokátory kalciových kanálů; Blokátory vápníkových kanálů, dihydrofyridin.
Není známo, zda je přípravek Procardia bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Procardia?
Procardia může způsobit závažné nežádoucí účinky, včetně:
- horečka,
- bolest krku,
- pálení očí,
- bolest kůže,
- červená nebo fialová kožní vyrážka s puchýři a olupováním,
- zhoršující se bolest na hrudi,
- bušení srdce,
- chvění v tvé hrudi,
- točení hlavy,
- otoky rukou nebo nohou,
- bolest v horní části žaludku a
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Procardia 30 mg patří:
- otok,
- návaly horka (teplo, zarudnutí nebo pocit brnění),
- bolest hlavy,
- závrať,
- nevolnost,
- pálení žáhy a
- pocit slabosti nebo únavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Procardia. Pro více informací se zeptejte svého lékaře nebo lékárníka.
POPIS
PROCARDIA® (nifedipin) je antianginózní lék patřící do třídy farmakologických látek, blokátorů kalciových kanálů. Nifedipin je dimethylester 3,5-pyridindikarboxylové kyseliny, 1,4-dihydro-2,6-dimethyl-4-(2-nitrofenyl)-, C17H18N2O6 a má strukturní vzorec:
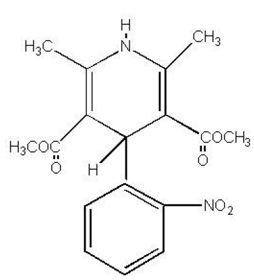
Nifedipin je žlutá krystalická látka, prakticky nerozpustná ve vodě, ale rozpustná v ethanolu. Má molekulovou hmotnost 346,3. Tobolky PROCARDIA jsou formulovány jako měkké želatinové tobolky pro orální podávání, každá obsahuje 10 mg nifedipinu.
Inertní složky ve formulaci jsou: glycerin; mátový olej; polyethylenglykol; měkké želatinové tobolky (které obsahují Yellow 6 a mohou obsahovat červený oxid železitý a další inertní složky); a voda. 10mg tobolky obsahují také sodnou sůl sacharinu.
INDIKACE
Vasospastická angina
PROCARDIA (nifedipin) je indikován k léčbě vazospastické anginy pectoris potvrzené kterýmkoli z následujících kritérií: 1) klasický typ anginy v klidu doprovázený elevací ST segmentu, 2) angina pectoris nebo spazmus koronárních tepen vyvolaný ergonovinem nebo 3) angiograficky prokázaný spazmus koronární tepny. U těch pacientů, kteří podstoupili angiografii, není přítomnost významné fixní obstrukční choroby neslučitelná s diagnózou vazospastické anginy, za předpokladu, že jsou splněna výše uvedená kritéria. PROCARDIA 30 mg lze také použít tam, kde klinický obraz naznačuje možnou vazospastickou složku, ale kde vazospasmus nebyl potvrzen, např. když bolest má proměnlivý práh při námaze nebo když je angina refrakterní na nitráty a/nebo adekvátní dávky betablokátorů.
Chronická stabilní angina pectoris (klasická angina s námahou)
PROCARDIA 30 mg je indikována k léčbě chronické stabilní anginy pectoris (angina spojená s úsilím) bez známek vazospazmu u pacientů, kteří zůstávají symptomatičtí navzdory adekvátním dávkám betablokátorů a/nebo organických nitrátů nebo kteří tato léčiva netolerují.
U chronické stabilní anginy pectoris (angina spojená s úsilím) byl přípravek PROCARDIA účinný v kontrolovaných studiích trvajících až osm týdnů při snižování frekvence anginy pectoris a zvyšování tolerance zátěže, ale potvrzení trvalé účinnosti a hodnocení dlouhodobé bezpečnosti u těchto pacientů není úplné. .
Kontrolované studie na malém počtu pacientů naznačují, že současné užívání přípravku PROCARDIA 30 mg a betablokátorů může být prospěšné u pacientů s chronickou stabilní anginou pectoris, ale dostupné informace nejsou dostatečné k tomu, aby s jistotou předpověděly účinky souběžné léčby, zejména u pacientů s oslabenou funkcí levé komory nebo abnormality srdečního vedení. Při zavádění takové souběžné léčby je třeba pečlivě sledovat krevní tlak, protože kombinovaným účinkem léků může dojít k těžké hypotenzi. (Vidět VAROVÁNÍ .)
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávka přípravku PROCARDIA 30 mg potřebná k potlačení anginy pectoris, kterou pacient toleruje, musí být stanovena titrací. Nadměrné dávky mohou vést k hypotenzi.
Léčba by měla být zahájena 10 mg tobolkou. Počáteční dávka je jedna 10mg tobolka, polyká se celá, 3krát denně. Obvyklé rozmezí účinné dávky je 10–20 mg třikrát denně. Někteří pacienti, zejména ti s prokázaným spasmem koronárních tepen, reagují pouze na vyšší dávky, častější podávání nebo obojí. U těchto pacientů mohou být účinné dávky 20–30 mg třikrát nebo čtyřikrát denně. Dávky nad 120 mg denně jsou nutné jen zřídka. Více než 180 mg denně se nedoporučuje.
Ve většině případů by titrace PROCARDIA měla probíhat po dobu 7–14 dnů, aby lékař mohl posoudit reakci na každou dávkovou hladinu a sledovat krevní tlak, než přistoupí k vyšším dávkám.
Pokud to symptomy vyžadují, může titrace probíhat rychleji za předpokladu, že je pacient často vyšetřován. Na základě úrovně fyzické aktivity pacienta, frekvence záchvatů a sublingvální spotřeby nitroglycerinu může být dávka přípravku PROCARDIA 30 mg zvýšena z 10 mg třikrát denně na 20 mg třikrát denně a poté na 30 mg třikrát denně během třídenního období.
U hospitalizovaných pacientů pod pečlivým sledováním může být dávka zvyšována po 10 mg během čtyř až šestihodinových období podle potřeby ke kontrole bolesti a arytmií způsobených ischemií. Jedna dávka by měla zřídka překročit 30 mg.
Vyhněte se současnému podávání nifedipinu s grapefruitovou šťávou (viz KLINICKÁ FARMAKOLOGIE a DROGOVÉ INTERAKCE ).
Po vysazení přípravku PROCARDIA nebyl pozorován žádný „rebound effect“. Pokud je však přerušení léčby přípravkem PROCARDIA nezbytné, správná klinická praxe naznačuje, že dávkování by mělo být snižováno postupně za přísného dohledu lékaře.
Současné podávání s jinými antianginózními léky
Sublingvální nitroglycerin lze užívat podle potřeby ke kontrole akutních projevů anginy pectoris, zejména během titrace přípravku PROCARDIA. Vidět DROGOVÉ INTERAKCE pro informaci o současném podávání přípravku PROCARDIA 30 mg s betablokátory nebo dlouhodobě působícími nitráty.
JAK DODÁVÁNO
PROCARDIA měkké želatinové kapsle se dodávají v:
Lahvičky po 100: 10 mg ( NDC 0069-2600-66)
Tobolky by měly být chráněny před světlem a vlhkostí a skladovány při kontrolované pokojové teplotě, 59 ° až 77 ° F (15 ° až 25 ° C) v originálním obalu od výrobce.
Distribuuje: Pfizer Labs, divize Pfizer Inc, NY, NY 10017. Revize: červenec 2016
VEDLEJŠÍ EFEKTY
Ve studiích s opakovanými dávkami ve Spojených státech a zahraničních kontrolovaných studiích, ve kterých byly nežádoucí účinky hlášeny spontánně, byly nežádoucí účinky časté, ale obecně nebyly závažné a zřídka vyžadovaly přerušení léčby nebo úpravu dávkování. Většina z nich byly očekávané důsledky vazodilatačních účinků přípravku PROCARDIA.
Existuje také velká nekontrolovaná zkušenost u více než 2 100 pacientů ve Spojených státech. Většina pacientů měla vazospastickou nebo rezistentní anginu pectoris a asi polovina měla souběžnou léčbu betaadrenergními blokátory. Nejčastější nežádoucí účinky byly:
Výskyt cca 10 %
Kardiovaskulární: periferní edém
Centrální nervový systém: závratě nebo točení hlavy
Gastrointestinální: nevolnost
Systémové: bolest hlavy a návaly horka, slabost
Výskyt přibližně 5 %
Kardiovaskulární: přechodná hypotenze
Incidence 2 % nebo méně
Kardiovaskulární: palpitace
Respirační: ucpaný nos a hrudník, dušnost
Gastrointestinální: průjem, zácpa, křeče, plynatost
Muskuloskeletální: zánět, ztuhlost kloubů, svalové křeče
Centrální nervový systém: třes, nervozita, nervozita, poruchy spánku, rozmazané vidění, potíže s rovnováhou
Jiný: dermatitida, pruritus, kopřivka, horečka, pocení, zimnice, sexuální potíže
Výskyt přibližně 0,5 %
Kardiovaskulární: synkopa (většinou s počáteční dávkou a/nebo zvýšením dávky), erytromelalgie
Výskyt menší než 0,5 %
Hematologické: trombocytopenie, anémie, leukopenie, purpura
Gastrointestinální: alergická hepatitida
Obličej a krk: angioedém (většinou orofaryngeální edém s dýchacími potížemi u několika pacientů), gingivální hyperplazie
CNS: deprese, paranoidní syndrom
Speciální smysly: přechodná slepota na vrcholu plazmatické hladiny, tinnitus
Urogenitální: nykturie, polyurie
Jiný: artritida s ANA (+), exfoliativní dermatitida, gynekomastie

Muskuloskeletální: myalgie
Zdá se, že několik z těchto vedlejších účinků souvisí s dávkou. Periferní edém se vyskytl přibližně u jednoho z 25 pacientů při dávkách nižších než 60 mg denně a přibližně u jednoho pacienta z osmi při 120 mg denně nebo více. Přechodná hypotenze, obvykle mírné až střední závažnosti a zřídka vyžadující přerušení léčby, se objevila u jednoho z 50 pacientů při dávce nižší než 60 mg denně a u jednoho z 20 pacientů při dávce 120 mg denně nebo více.
Velmi vzácně bylo zahájení léčby přípravkem PROCARDIA 30 mg spojeno se zvýšením anginózní bolesti, pravděpodobně v důsledku související hypotenze. Došlo také k přechodné jednostranné ztrátě zraku.
Kromě toho byly u těchto pacientů pozorovány závažnější nežádoucí účinky, které nebylo možné snadno odlišit od přirozené historie onemocnění. Je však možné, že některé nebo mnohé z těchto událostí souvisely s drogami. Infarkt myokardu se vyskytl asi u 4 % pacientů a městnavé srdeční selhání nebo plicní edém asi u 2 %. Ventrikulární arytmie nebo poruchy vedení se vyskytly u méně než 0,5 % pacientů.
V podskupině více než 1000 pacientů užívajících přípravek PROCARDIA 30 mg se současnou terapií betablokátory se vzor a incidence nežádoucích účinků nelišila od celé skupiny pacientů léčených přípravkem PROCARDIA (nifedipin). (Vidět OPATŘENÍ .)
podskupině přibližně 250 pacientů s diagnózou městnavého srdečního selhání a také anginy pectoris (asi 10 % z celkové populace pacientů) se závratě nebo točení hlavy, periferní edém, bolest hlavy nebo návaly objevily u každého osmého pacienta. Hypotenze se vyskytla asi u jednoho z 20 pacientů. Synkopa se vyskytla přibližně u jednoho pacienta z 250. Infarkt myokardu nebo příznaky městnavého srdečního selhání se vyskytly asi u jednoho pacienta z 15. Síňové nebo ventrikulární dysrytmie se vyskytly asi u jednoho pacienta ze 150.
Po uvedení přípravku na trh byly vzácně hlášeny případy exfoliativní dermatitidy způsobené nifedipinem. Vzácně byly hlášeny exfoliativní nebo bulózní kožní nežádoucí účinky (jako je erythema multiforme, Stevens-Johnsonův syndrom a toxická epidermální nekrolýza) a fotosenzitivní reakce. Rovněž byla hlášena akutní generalizovaná exantematózní pustulóza.
DROGOVÉ INTERAKCE
Beta-adrenergní blokátory
(Vidět INDIKACE A POUŽITÍ a VAROVÁNÍ Zkušenosti u více než 1400 pacientů v nekomparativní klinické studii ukázaly, že současné podávání přípravku PROCARDIA 30 mg a betablokátorů je obvykle dobře tolerováno, ale v literatuře se občas objevily zprávy naznačující, že tato kombinace může zvýšit pravděpodobnost městnavého srdečního selhání, těžká hypotenze nebo exacerbace anginy pectoris.
Dlouhodobě působící nitráty
PROCARDIA 30 mg může být bezpečně podávána současně s nitráty, ale nebyly provedeny žádné kontrolované studie hodnotící antianginózní účinnost této kombinace.
Digitální
Vzhledem k tomu, že byly ojedinělé zprávy o pacientech se zvýšenými hladinami digoxinu a protože existuje možná interakce mezi digoxinem a nifedipinem, doporučuje se monitorovat hladiny digoxinu při zahájení, úpravě a vysazení nifedipinu, aby se předešlo možné nadměrné nebo nedostatečné digitalizaci .
Chinidin
Vzácně byly hlášeny interakce mezi chinidinem a nifedipinem (se sníženou plazmatickou hladinou chinidinu).
Kumarinové antikoagulanty
Vzácně byly hlášeny případy zvýšeného protrombinového času u pacientů užívajících kumarinová antikoagulancia, kterým byla podávána PROCARDIA. Vztah k terapii PROCARDIA je však nejistý.
Cimetidin
Studie na šesti zdravých dobrovolnících prokázala významné zvýšení maximálních plazmatických hladin nifedipinu (80 %) a plochy pod křivkou (74 %) po týdenní kúře cimetidinu v dávce 1000 mg denně a nifedipinu v dávce 40 mg na den. den. Ranitidin vyvolal menší, nevýznamné zvýšení. Účinek může být zprostředkován známou inhibicí cimetidinu na jaterní cytochrom P-450, enzymový systém pravděpodobně odpovědný za metabolismus prvního průchodu nifedipinu. Pokud je léčba nifedipinem zahájena u pacienta, který v současné době dostává cimetidin, doporučuje se opatrná titrace.
Nifedipin je metabolizován CYP3A4. Současné podávání nifedipinu s fenytoinem, induktorem CYP3A4, snižuje systémovou expozici nifedipinu přibližně o 70 %. Vyhněte se současnému podávání nifedipinu s fenytoinem nebo jakýmkoli známým induktorem CYP3A4 nebo zvažte alternativní antihypertenzní léčbu.
Inhibitory CYP3A, jako je flukonazol, itrakonazol, klarithromycin, erythromycin, nefazodon, fluoxetin, saquinavir, indinavir a nelfinavir, mohou při současném podávání vést ke zvýšené expozici nifedipinu. Může být nezbytné pečlivé sledování a úprava dávky; zvážit zahájení léčby nifedipinem v nejnižší dostupné dávce, pokud je podáván současně s těmito léky.
Jiné interakce
Grepový džus
Současné podávání nifedipinu s grapefruitovou šťávou vedlo přibližně ke zdvojnásobení AUC a Cmax nifedipinu beze změny poločasu. Zvýšené plazmatické koncentrace s největší pravděpodobností vyplývají z inhibice metabolismu prvního průchodu v souvislosti s CYP 3A4. Během užívání nifedipinu se vyvarujte požití grapefruitu a grapefruitové šťávy.
VAROVÁNÍ
Nadměrná hypotenze
Ačkoli u většiny pacientů je hypotenzní účinek přípravku PROCARDIA 30 mg mírný a dobře tolerovaný, příležitostní pacienti měli nadměrnou a špatně tolerovanou hypotenzi. Tyto odpovědi se obvykle objevily během počáteční titrace nebo v době následné úpravy dávky směrem nahoru. Přestože se u pacientů vzácně vyskytla nadměrná hypotenze při léčbě samotným přípravkem PROCARDIA 30 mg, může být častější u pacientů se souběžnou léčbou betablokátory. Ačkoli to není schváleno pro tento účel, PROCARDIA a další tobolky nifedipinu s okamžitým uvolňováním byly použity (orálně a sublingválně) pro akutní snížení krevního tlaku. Několik dobře zdokumentovaných zpráv popisuje případy hluboké hypotenze, infarktu myokardu a úmrtí, když byl tímto způsobem použit nifedipin s okamžitým uvolňováním. Tobolky PROCARDIA by se neměly používat k akutnímu snížení krevního tlaku.
Těžká hypotenze a/nebo zvýšené požadavky na objem tekutin byly hlášeny u pacientů užívajících přípravek PROCARDIA 30 mg spolu s beta-blokátorem, kteří podstoupili bypass koronární artérie za použití vysoké dávky anestezie fentanylem. Zdá se, že interakce s vysokou dávkou fentanylu je způsobena kombinací přípravku PROCARDIA a betablokátoru, ale nelze vyloučit možnost, že k ní může dojít u samotného přípravku PROCARDIA 30 mg, s nízkými dávkami fentanylu, při jiných chirurgických zákrocích nebo s jinými narkotickými analgetiky. vyloučeno. U pacientů léčených přípravkem PROCARDIA, kde se uvažuje o chirurgickém zákroku s použitím vysoké dávky anestezie fentanylem, by si lékař měl být vědom těchto potenciálních problémů, a pokud to stav pacienta dovoluje, měla by být poskytnuta dostatečná doba (nejméně 36 hodin), aby se přípravek PROCARDIA 30 mg vymyl tělo před operací.
Zvýšená angina pectoris a/nebo infarkt myokardu
Vzácně se u pacientů, zvláště u těch, kteří mají těžkou obstrukční koronární chorobu, vyvinula dobře zdokumentovaná zvýšená frekvence, trvání a/nebo závažnost anginy pectoris nebo akutního infarktu myokardu při zahájení léčby přípravkem PROCARDIA 30 mg nebo v době zvýšení dávky. Mechanismus tohoto účinku není stanoven.
Několik dobře kontrolovaných, randomizovaných studií studovalo použití nifedipinu s okamžitým uvolňováním u pacientů, kteří právě prodělali infarkt myokardu. V žádné z těchto studií se nezdálo, že by nifedipin s okamžitým uvolňováním poskytoval nějaký přínos. V některých studiích měli pacienti, kteří dostávali nifedipin s okamžitým uvolňováním, významně horší výsledky než pacienti, kteří dostávali placebo. PROCARDIA 30mg tobolky by neměly být podávány během prvního týdne nebo dvou po infarktu myokardu a je třeba se jim také vyhnout v případě akutního koronárního syndromu (když může infarkt bezprostředně hrozit).
Použití při esenciální hypertenzi
PROCARDIA 30 mg a další tobolky nifedipinu s okamžitým uvolňováním byly také použity pro dlouhodobou kontrolu esenciální hypertenze, ačkoli tobolky PROCARDIA 30 mg nebyly pro tento účel schváleny a nebyly provedeny žádné řádně kontrolované studie, které by definovaly vhodnou dávku nebo interval mezi dávkami pro takovou léčbu. PROCARDIA 30 mg tobolky by se neměly používat ke kontrole esenciální hypertenze.
Stažení betablokátoru
pacientů nedávno vysazených z betablokátorů se může rozvinout abstinenční syndrom se zvýšenou anginou pectoris, pravděpodobně související se zvýšenou citlivostí na katecholaminy. Zahájení léčby přípravkem PROCARDIA 30 mg tomuto výskytu nezabrání a lze očekávat, že jej zhorší vyvoláním reflexního uvolňování katecholaminů. Občas byly hlášeny případy zvýšené anginy pectoris při vysazení betablokátoru a zahájení léčby přípravkem PROCARDIA. Je důležité omezit betablokátory, pokud je to možné, spíše než je náhle vysadit před zahájením léčby přípravkem PROCARDIA.
Městnavé srdeční selhání
Vzácně se u pacientů, obvykle u pacientů užívajících betablokátory, po zahájení léčby přípravkem PROCARDIA vyvinulo srdeční selhání. Pacienti s těsnou aortální stenózou mohou být vystaveni většímu riziku takové příhody, protože se očekává, že efekt uvolňování přípravku PROCARDIA 30 mg bude pro tyto pacienty méně přínosný vzhledem k jejich pevné impedanci průtoku přes aortální chlopeň.
OPATŘENÍ
Všeobecné
Hypotenze
Protože PROCARDIA snižuje periferní vaskulární rezistenci, doporučuje se pečlivé sledování krevního tlaku během úvodního podávání a titrace přípravku PROCARDIA 30 mg. Pečlivé sledování se doporučuje zejména u pacientů, kteří již užívají léky, o kterých je známo, že snižují krevní tlak. (Vidět VAROVÁNÍ .)
Periferní edém
Mírný až středně závažný periferní edém, typicky spojený s arteriální vazodilatací a nikoli v důsledku dysfunkce levé komory, se vyskytuje asi u jednoho z deseti pacientů léčených přípravkem PROCARDIA (nifedipin). Tento edém se vyskytuje primárně na dolních končetinách a obvykle reaguje na léčbu diuretiky. U pacientů, jejichž angina je komplikována městnavým srdečním selháním, je třeba dbát na to, aby se tento periferní edém odlišil od účinků zvyšující se dysfunkce levé komory.
Laboratorní testy
Bylo zaznamenáno vzácné, obvykle přechodné, ale příležitostně významné zvýšení enzymů, jako je alkalická fosfatáza, CPK, LDH, SGOT a SGPT. Vztah k terapii PROCARDIA je ve většině případů nejistý, ale v některých pravděpodobný. Tyto laboratorní abnormality byly zřídka spojeny s klinickými příznaky; byla však hlášena cholestáza se žloutenkou nebo bez ní. Byly hlášeny vzácné případy alergické hepatitidy.
PROCARDIA 30 mg, stejně jako jiné blokátory kalciových kanálů, snižuje agregaci krevních destiček in vitro. Omezené klinické studie prokázaly mírné, ale statisticky významné snížení agregace krevních destiček a prodloužení doby krvácení u některých pacientů s přípravkem PROCARDIA. Předpokládá se, že je to funkce inhibice transportu vápníku přes membránu krevních destiček. Pro tyto nálezy nebyl prokázán žádný klinický význam.
Byl hlášen pozitivní přímý Coombsův test s/bez hemolytické anémie, ale kauzální vztah mezi podáním přípravku PROCARDIA a pozitivitou tohoto laboratorního testu, včetně hemolýzy, nelze určit.
Přestože byl přípravek PROCARDIA 30 mg bezpečně používán u pacientů s renální dysfunkcí a bylo hlášeno, že má příznivý účinek, v určitých případech bylo u pacientů s již existující chronickou renální insuficiencí hlášeno vzácné, reverzibilní zvýšení BUN a sérového kreatininu. Vztah k terapii PROCARDIA je ve většině případů nejistý, ale v některých pravděpodobný.
Karcinogeneze, mutageneze, zhoršení plodnosti
Nifedipin byl podáván perorálně potkanům po dobu dvou let a neprokázalo se, že je karcinogenní. Při podání potkanům před pářením způsobil nifedipin sníženou plodnost v dávce přibližně 5násobku maximální doporučené dávky pro člověka. V literatuře existuje zpráva o reverzibilním snížení schopnosti lidských spermií získaných od omezeného počtu neplodných mužů užívajících doporučené dávky nifedipinu vázat se na vajíčko a oplodnit ho in vitro. Studie mutagenity in vivo byly negativní.
Těhotenství
Bylo prokázáno, že nifedipin vyvolává teratogenní nálezy u potkanů a králíků, včetně digitálních anomálií podobných těm, které byly hlášeny u fenytoinu. Digitální anomálie byly hlášeny u jiných členů třídy dihydropyridinů a jsou pravděpodobně důsledkem zhoršeného průtoku krve dělohou. Podávání nifedipinu bylo spojeno s řadou embryotoxických, placentotoxických a fetotoxických účinků, včetně zakrnělých plodů (krysy, myši, králíci), deformací žeber (myši), rozštěpu patra (myši), malých placent a nedostatečně vyvinutých choriových klků (opice), embryonálních a úmrtí plodu (krysy, myši, králíci) a prodloužená březost/snížené přežití novorozenců (krysy; nehodnoceno u jiných druhů). Na základě mg/kg byly všechny dávky spojené s teratogenními embryotoxickými nebo fetotoxickými účinky u zvířat vyšší (5 až 50krát) než maximální doporučená dávka pro člověka 120 mg/den. Na základě mg/m² byly některé dávky vyšší a některé nižší než maximální doporučená dávka pro člověka, ale všechny byly v řádové velikosti. Dávky spojené s placentotoxickými účinky u opic byly ekvivalentní nebo nižší než maximální doporučená dávka pro člověka na základě mg/m².
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Přípravek PROCARDIA by měl být užíván během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko.
Laktace
Nifedipin se přenáší mateřským mlékem. PROCARDIA by se měla během kojení užívat pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena. Použití u pediatrické populace se nedoporučuje.
Geriatrické použití
Zdá se, že věk má významný vliv na farmakokinetiku nifedipinu. Clearance je snížena, což má za následek vyšší AUC u starších osob. Tyto změny nejsou způsobeny změnami renálních funkcí (viz KLINICKÁ FARMAKOLOGIE , Farmakokinetika ).
PŘEDÁVKOVAT
Zkušenosti s předávkováním nifedipinem jsou omezené. Obecně platí, že předávkování nifedipinem vedoucí k výrazné hypotenzi vyžaduje aktivní kardiovaskulární podporu včetně monitorování kardiovaskulárních a respiračních funkcí, elevace končetin a uvážlivého použití infuze vápníku, presorických látek a tekutin. U pacientů s poruchou funkce jater lze očekávat prodloužení clearance nifedipinu. Protože se nifedipin silně váže na proteiny, dialýza pravděpodobně nebude mít žádný přínos; plazmaferéza však může být prospěšná.
KONTRAINDIKACE
Známá hypersenzitivní reakce na PROCARDIA.
KLINICKÁ FARMAKOLOGIE
PROCARDIA je inhibitor influxu vápníkových iontů (blokátor pomalého kanálu nebo antagonista vápníkových iontů) a inhibuje transmembránový tok vápníkových iontů do srdečního svalu a hladkého svalstva. Kontraktilní procesy srdečního svalu a hladkého svalstva cév jsou závislé na pohybu extracelulárních iontů vápníku do těchto buněk přes specifické iontové kanály. PROCARDIA 30 mg selektivně inhibuje influx iontů vápníku přes buněčnou membránu srdečního svalu a hladkého svalstva cév, aniž by se změnily koncentrace vápníku v séru.
Mechanismus působení
Přesné prostředky, kterými tato inhibice zmírňuje anginu pectoris, nebyly plně stanoveny, ale zahrnují alespoň následující dva mechanismy:
Relaxace a prevence spazmu koronárních tepen
PROCARDIA rozšiřuje hlavní koronární artérie a koronární arterioly, jak v normálních, tak ischemických oblastech, a je silným inhibitorem spazmu koronárních arterií, ať už spontánního nebo vyvolaného ergonovinou. Tato vlastnost zvyšuje dodávku kyslíku do myokardu u pacientů se spasmem koronárních tepen a je odpovědná za účinnost přípravku PROCARDIA 30 mg u vazospastické (Prinzmetalovy nebo variantní) anginy pectoris. Není jasné, zda tento účinek hraje nějakou roli u klasické anginy pectoris, ale studie tolerance zátěže neprokázaly zvýšení součinu maximální zátěžové frekvence a tlaku, což je široce přijímaná míra využití kyslíku. To naznačuje, že obecně není úleva od spasmu nebo dilatace koronárních tepen důležitým faktorem u klasické anginy pectoris.
Snížení spotřeby kyslíku
PROCARDIA pravidelně snižuje arteriální tlak v klidu a při dané úrovni zátěže dilatací periferních arteriol a snížením celkového periferního odporu (afterload), proti kterému srdce pracuje. Toto odlehčení srdce snižuje spotřebu energie myokardu a požadavky na kyslík a pravděpodobně odpovídá za účinnost přípravku PROCARDIA u chronické stabilní anginy pectoris.
Farmakokinetika a metabolismus
PROCARDIA se po perorálním podání rychle a plně vstřebává. Lék je detekovatelný v séru 10 minut po perorálním podání a maximální hladiny v krvi se objevují přibližně za 30 minut. Biologická dostupnost je úměrná dávce od 10 do 30 mg; poločas se významně nemění s dávkou. Existuje malý rozdíl v relativní biologické dostupnosti, když jsou tobolky PROCARDIA podávány perorálně a buď spolknuty celé, kousány a spolknuty, nebo kousány a drženy sublingválně. Nicméně prokousnutí tobolky před spolknutím vede k mírně dřívějším plazmatickým koncentracím (27 ng/ml 10 minut po 10 mg), než když jsou tobolky spolknuty neporušené. PROCARDIA 30 mg je vysoce vázána na sérové proteiny. PROCARDIA se ve velké míře přeměňuje na neaktivní metabolity a přibližně 80 procent přípravku PROCARDIA 30 mg a metabolitů je eliminováno ledvinami. Eliminační poločas nifedipinu je přibližně dvě hodiny. Vzhledem k tomu, že jaterní biotransformace je převládající cestou pro eliminaci nifedipinu, farmakokinetika může být u pacientů s chronickým onemocněním jater změněna. Pacienti s poruchou funkce jater (cirhóza jater) mají delší poločas a vyšší biologickou dostupnost nifedipinu než zdraví dobrovolníci. Stupeň vazby nifedipinu na sérové proteiny je vysoký (92-98 %). Vazba na bílkoviny může být výrazně snížena u pacientů s poruchou funkce ledvin nebo jater.
Po intravenózním podání se clearance nifedipinu u starších zdravých subjektů snížila o 33 % ve srovnání s mladými zdravými subjekty.
Hemodynamika
Stejně jako ostatní blokátory pomalých kanálů má PROCARDIA negativní inotropní účinek na izolovanou tkáň myokardu. To je zřídka, pokud vůbec, pozorováno u intaktních zvířat nebo lidí, pravděpodobně kvůli reflexním reakcím na jeho vazodilatační účinky. U člověka způsobuje PROCARDIA 30 mg sníženou periferní vaskulární rezistenci a pokles systolického a diastolického tlaku, obvykle mírný (systolický 5-10 mm Hg), ale někdy větší. Obvykle dochází k malému zvýšení srdeční frekvence, reflexní reakci na vazodilataci. Měření srdeční funkce u pacientů s normální komorovou funkcí obecně zjistilo malé zvýšení srdečního indexu bez větších účinků na ejekční frakci, end diastolický tlak levé komory (LVEDP) nebo objem (LVEDV). U pacientů s poruchou funkce komory většina akutních studií prokázala určité zvýšení ejekční frakce a snížení plnícího tlaku levé komory.
Elektrofyziologické účinky
Ačkoli, stejně jako ostatní členové své třídy, přípravek PROCARDIA snižuje funkci sinoatriálního uzlu a atrioventrikulární vedení v izolovaných preparátech myokardu, takové účinky nebyly pozorovány ve studiích u intaktních zvířat nebo u lidí. Ve formálních elektrofyziologických studiích, převážně u pacientů s normálním převodním systémem, neměla PROCARDIA 30 mg tendenci prodlužovat atrioventrikulární vedení, prodlužovat dobu zotavení sinusového uzlu nebo zpomalovat sinusovou frekvenci.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ a OPATŘENÍ sekce.
