Benicar 10mg, 20mg, 40mg Olmesartan Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Benicar 40 mg a jak se používá?
Benicar je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze). Benicar 10 mg lze užívat samostatně nebo s jinými léky.
Benicar je blokátor receptoru angiotenzinu II neboli ARB.
Není známo, zda je přípravek Benicar bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Benicar 40 mg?
Benicar může způsobit závažné nežádoucí účinky včetně:
- točení hlavy
- malé nebo žádné močení
- otoky rukou nebo nohou
- nevolnost
- slabost
- mravenčí pocit
- bolest na hrudi
- rychlý nebo nepravidelný srdeční tep
- ztráta pohybu
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Benicar patří:
- závrať
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Benicar. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Když je zjištěno těhotenství, přerušte užívání přípravku Benicar 40 mg co nejdříve (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ)
- Léky, které působí přímo na renin-angiotens v systému, mohou způsobit zranění a smrt vyvíjejícího se plodu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ )
POPIS
Olmesartan medoxomil, proléčivo, se během absorpce z gastrointestinálního traktu hydrolyzuje na olmesartan. Olmesartan je selektivní antagonista receptoru angiotenzinu II podtypu AT1.
Olmesartan medoxomil je chemicky popsán jako 2,3-dihydroxy-2-butenyl 4-(1 hydroxy-1-methylethyl)-2-propyl-1-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]imidazol- 5 karboxylát, cyklický 2,3-karbonát.
Jeho empirický vzorec je C29H30N6O6 a jeho strukturní vzorec je:
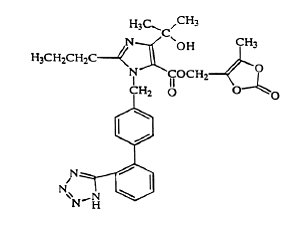
Olmesartan medoxomil je bílý až světle žlutobílý prášek nebo krystalický prášek s molekulovou hmotností 558,59. Je prakticky nerozpustný ve vodě a těžce rozpustný v methanolu. Benicar 20 mg je k dispozici pro perorální podání jako potahované tablety obsahující 5 mg, 20 mg nebo 40 mg olmesartan medoxomilu a následující neaktivní složky: hydroxypropylcelulóza, hypromelóza, monohydrát laktózy, nízko substituovaná hydroxypropylcelulóza, magnesium-stearát, mikrokrystalická celulóza mastek, oxid titaničitý a (pouze 5 mg) žlutý oxid železitý.
INDIKACE
Benicar 40 mg je indikován k léčbě hypertenze u dospělých a dětí ve věku od šesti let, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních i nefatálních kardiovaskulárních příhod, především mozkových mrtvic a infarktů myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd včetně třídy, do které tento lék v zásadě patří. Neexistují žádné kontrolované studie prokazující snížení rizika s přípravkem Benicar.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než jeden lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak.
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
Může být použit samostatně nebo v kombinaci s jinými antihypertenzivy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Hypertenze u dospělých
Dávkování musí být individuální. Obvyklá doporučená počáteční dávka přípravku Benicar 20 mg je 20 mg jednou denně, pokud se používá jako monoterapie u pacientů, kteří nemají objemovou kontrakci. U pacientů vyžadujících další snížení krevního tlaku po 2 týdnech léčby může být dávka přípravku Benicar zvýšena na 40 mg. Nezdá se, že by dávky nad 40 mg měly větší účinek. Dávkování dvakrát denně nenabízí žádnou výhodu oproti stejné celkové dávce podávané jednou denně.
U pacientů s možnou deplecí intravaskulárního objemu (např. u pacientů léčených diuretiky, zejména u pacientů s poruchou funkce ledvin), zahajte přípravek Benicar pod pečlivým lékařským dohledem a zvažte použití nižší počáteční dávky (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Dětská hypertenze (6 let a starší)
Dávkování musí být individuální. Pro děti, které mohou polykat tablety, je obvyklá doporučená počáteční dávka přípravku Benicar 10 mg jednou denně pro pacienty s hmotností 20 až
Použití přípravku Benicar 10 mg u dětí mladších 1 roku se nedoporučuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
U dětí, které nemohou polykat tablety, může být podána stejná dávka pomocí improvizované suspenze, jak je popsáno níže [viz KLINICKÁ FARMAKOLOGIE ]. Při podávání přípravku Benicar ve formě suspenze postupujte podle níže uvedených pokynů pro přípravu suspenze.
Příprava suspenze (pro 200 ml 2 mg/ml suspenze)
Přidejte 50 ml čištěné vody do jantarové polyethylentereftalátové (PET) lahvičky obsahující dvacet tablet Benicar 20 mg a nechte stát minimálně 5 minut. Nádobu protřepávejte alespoň 1 minutu a nechte suspenzi stát alespoň 1 minutu. Opakujte 1 minutu třepání a 1 minutu stání ještě čtyřikrát. Přidejte 100 ml ORA-Sweet® a 50 ml ORA-Plus®* k suspenzi a dobře protřepávejte po dobu alespoň 1 minuty. Suspenze by měla být chlazena při 2-8°C (36-46°F) a může být skladována po dobu až 4 týdnů. Před každým použitím suspenzi dobře protřepejte a ihned vraťte do chladničky.
JAK DODÁVÁNO
Dávkové formy A Síly
- 5 mg žluté, kulaté, potahované tablety bez rýhy s vyraženým Sankyo na jedné straně a C12 na druhé straně
- 20 mg bílé, kulaté, potahované tablety bez rýhy s vyraženým Sankyo na jedné straně a C14 na druhé straně
- 40 mg bílé, oválné, potahované tablety bez rýhy s vyraženým Sankyo na jedné straně a C15 na druhé straně
Skladování A Manipulace
Benicar se dodává jako žluté, kulaté, potahované tablety bez rýhy obsahující 5 mg olmesartan medoxomilu, jako bílé, kulaté, potahované tablety bez rýhy obsahující 20 mg olmesartan medoxomilu a jako bílé, oválné , potahované tablety bez rýhy obsahující 40 mg olmesartan medoxomilu. Na tabletách je vyraženo Sankyo na jedné straně a C12, C14 nebo C15 na druhé straně 5, 20 a 40 mg tablet, v tomto pořadí.
Tablety se dodávají následovně:
Úložný prostor
Skladujte při 20-25 °C (68-77 °F) [viz USP Regulovaná pokojová teplota].
Vyrobeno pro Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Revize: říjen 2019
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Hypertenze u dospělých
Benicar byl hodnocen z hlediska bezpečnosti u více než 3825 pacientů/subjektů, včetně více než 3275 pacientů léčených pro hypertenzi v kontrolovaných studiích. Tato zkušenost zahrnovala přibližně 900 pacientů léčených po dobu nejméně 6 měsíců a více než 525 pacientů po dobu nejméně 1 roku. Příhody byly obecně mírné, přechodné a neměly žádný vztah k dávce Benicaru.
Analýza skupin pohlaví, věku a rasy neprokázala žádné rozdíly mezi pacienty užívajícími přípravek Benicar 40 mg a pacienty léčenými placebem. Míra vysazení kvůli nežádoucím účinkům ve všech studiích u pacientů s hypertenzí byla 2,4 % (tj. 79/3278) pacientů léčených přípravkem Benicar 40 mg a 2,7 % (tj. 32/1179) kontrolních pacientů. V placebem kontrolovaných studiích byla jedinou nežádoucí reakcí, která se vyskytla u více než 1 % pacientů léčených přípravkem Benicar 20 mg as vyšší incidencí oproti placebu, závratě (3 % vs. 1 %).
U pěti pacientů užívajících přípravek Benicar byl hlášen otok obličeje. U antagonistů angiotenzinu II byl hlášen angioedém.
Dětská hypertenze
Nebyly zjištěny žádné relevantní rozdíly mezi profilem nežádoucích účinků u pediatrických pacientů ve věku 1 až 16 let a dříve hlášeným u dospělých pacientů.
Postmarketingové zkušenosti
Po uvedení přípravku na trh byly hlášeny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo jako celek: Astenie, angioedém, anafylaktické reakce
Gastrointestinální: Zvracení, sprue-like enteropatie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Poruchy metabolismu a výživy: Hyperkalémie
Muskuloskeletální: Rabdomyolýza
Urogenitální systém: Akutní selhání ledvin, zvýšená hladina kreatininu v krvi
Kůže a přílohy: Alopecie, pruritus, kopřivka
Údaje z jedné kontrolované studie a epidemiologické studie naznačují, že vysoké dávky olmesartanu mohou zvýšit kardiovaskulární (KV) riziko u diabetických pacientů, ale celková data nejsou přesvědčivá. Randomizovaná, placebem kontrolovaná, dvojitě zaslepená studie ROADMAP (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) zkoumala použití olmesartanu v dávce 40 mg denně oproti placebu u pacientů s diabetes mellitus 2. typu, normoalbuminurií a při alespoň jeden další rizikový faktor pro KV onemocnění. Studie splnila svůj primární cíl, opožděný nástup mikroalbuminurie, ale olmesartan neměl žádný příznivý účinek na pokles glomerulární filtrace (GFR). Ve skupině s olmesartanem byla zjištěna zvýšená KV mortalita (předpokládaná náhlá srdeční smrt, fatální infarkt myokardu, fatální cévní mozková příhoda, revaskularizační úmrtí) ve srovnání se skupinou s placebem (15 olmesartan vs. 3 placebo, HR 4,9, 95% interval spolehlivosti [CI ], 1,4, 17), ale riziko nefatálního infarktu myokardu bylo u olmesartanu nižší (HR 0,64, 95% CI 0,35, 1,18).
Epidemiologická studie zahrnovala pacienty ve věku 65 let a starší s celkovou expozicí > 300 000 pacientoroků. V podskupině diabetických pacientů užívajících vysoké dávky olmesartanu (40 mg/den) po dobu > 6 měsíců se zdálo zvýšené riziko úmrtí (HR 2,0, 95% CI 1,1, 3,8) ve srovnání s podobnými pacienty užívajícími jiné blokátory angiotenzinových receptorů. Naproti tomu užívání vysokých dávek olmesartanu u nediabetických pacientů se zdálo být spojeno se sníženým rizikem úmrtí (HR 0,46, 95% CI 0,24, 0,86) ve srovnání s podobnými pacienty užívajícími jiné blokátory receptorů pro angiotenzin. Nebyly pozorovány žádné rozdíly mezi skupinami, které dostávaly nižší dávky olmesartanu ve srovnání s jinými blokátory angiotenzinu, nebo skupinami, které dostávaly léčbu po dobu
Celkově tyto údaje vyvolávají obavy z možného zvýšeného KV rizika spojeného s užíváním vysokých dávek olmesartanu u diabetických pacientů. Existují však obavy ohledně důvěryhodnosti nálezu zvýšeného KV rizika, zejména pozorování ve velké epidemiologické studii přínosu pro přežití u nediabetiků v rozsahu podobném nepříznivému nálezu u diabetiků.
DROGOVÉ INTERAKCE
Činidla zvyšující sérový draslík
Současné užívání olmesartanu s jinými látkami, které blokují renin-angiotensinový systém, draslík šetřícími diuretiky (např. spironolakton, triamteren, amilorid), doplňky draslíku, náhražky soli obsahující draslík nebo jiné léky, které mohou zvyšovat hladiny draslíku (např. heparin), může vést ke zvýšení sérového draslíku. Pokud je souběžná medikace považována za nezbytnou, doporučuje se monitorování sérového draslíku.
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
pacientů, kteří jsou starší, s deplecí objemu (včetně pacientů na diuretické léčbě) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s antagonisty receptoru angiotenzinu II, včetně olmesartan medoxomilu, vést ke zhoršení stavu funkce ledvin, včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů užívajících olmesartan medoxomil a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek antagonistů receptoru angiotenzinu II, včetně olmesartan medoxomilu, může být zeslaben NSAID včetně selektivních inhibitorů COX-2.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií. Většina pacientů užívajících kombinaci dvou inhibitorů RAS nezíská žádný další přínos ve srovnání s monoterapií. Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Pečlivě sledujte krevní tlak, renální funkce a elektrolyty u pacientů užívajících Benicar a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s Benicarem pacientům s diabetem [viz KONTRAINDIKACE ]. Vyhněte se užívání aliskirenu s přípravkem Benicar 40 mg u pacientů s poruchou funkce ledvin (GFR
Lithium
Při současném podávání lithia s antagonisty receptoru angiotenzinu II, včetně přípravku BENICAR, bylo hlášeno zvýšení sérových koncentrací lithia a toxicita lithia. Během současného užívání sledujte hladiny lithia v séru.
Colesevelam hydrochlorid
Současné podávání sekvestračního činidla žlučových kyselin kolesevelam hydrochlorid snižuje systémovou expozici a maximální plazmatickou koncentraci olmesartanu. Podávání olmesartanu alespoň 4 hodiny před kolesevelam hydrochloridem snížilo účinek lékové interakce. Zvažte podání olmesartanu alespoň 4 hodiny před dávkou kolesevelam hydrochloridu [viz KLINICKÁ FARMAKOLOGIE ].
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Fetální toxicita
Benicar 10 mg může způsobit poškození plodu, když je podáván těhotné ženě. Užívání léků, které působí na renin-angiotensinový systém (RAS) během druhého a třetího trimestru těhotenství snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, přerušte léčbu přípravkem Benicar co nejdříve [viz Použití u konkrétních populací ].
Nemocnost u kojenců
Použití přípravku Benicar u dětí mladších 1 roku se nedoporučuje. Léky, které působí přímo na systém renin-angiotenzin-aldosteron (RAAS), mohou mít vliv na vývoj nezralých ledvin [viz Použití u konkrétních populací ].
Hypotenze u pacientů s deplecí objemu nebo soli
U pacientů s aktivovaným systémem renin-angiotenzin-aldosteron, jako jsou pacienti s deplecí objemu a/nebo solí (např. pacienti léčení vysokými dávkami diuretik), lze po zahájení léčby přípravkem Benicar očekávat symptomatickou hypotenzi. Zahajte léčbu pod pečlivým lékařským dohledem a zvažte zahájení nižší dávkou. Pokud dojde k hypotenzi, uložte pacienta do polohy na zádech a v případě potřeby podejte intravenózní infuzi fyziologického roztoku [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Přechodná hypotenzní odpověď není kontraindikací další léčby, v níž lze obvykle bez potíží pokračovat, jakmile se krevní tlak stabilizuje.
Porucha funkce ledvin
důsledku inhibice systému renin-angiotenzin-aldosteron lze u citlivých jedinců léčených přípravkem Benicar očekávat změny funkce ledvin. U pacientů, jejichž funkce ledvin může záviset na aktivitě systému renin-angiotensinaldosteron (např. pacienti s těžkým městnavým srdečním selháním), byla léčba inhibitory angiotenzin konvertujícího enzymu (ACE) a antagonisty receptoru angiotenzinu spojena s oligurií a/nebo progresivní azotemií a vzácně s akutním selháním ledvin a/nebo smrtí. Podobné výsledky lze očekávat u pacientů léčených přípravkem Benicar [viz DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE , Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Ve studiích ACE inhibitorů u pacientů s jednostrannou nebo bilaterální stenózou renální arterie bylo hlášeno zvýšení sérového kreatininu nebo dusíku močoviny v krvi (BUN). U pacientů s jednostrannou nebo oboustrannou stenózou renální arterie se přípravek Benicar dlouhodobě nepoužíval, lze však očekávat podobné výsledky.
Enteropatie podobná sprue
pacientů užívajících olmesartan měsíce až roky po zahájení léčby byl hlášen těžký chronický průjem s podstatným úbytkem hmotnosti. Střevní biopsie pacientů často prokázaly atrofii klků. Pokud se u pacienta během léčby olmesartanem objeví tyto příznaky, je třeba vyloučit jinou etiologii. Zvažte alternativní antihypertenzní léčbu v případech, kdy není identifikována žádná jiná etiologie.

Hyperkalémie
U pacientů užívajících přípravek Benicar by měla být monitorována hladina draslíku v séru. Léky, které inhibují renin angiotensinový systém, mohou způsobit hyperkalémii. Rizikové faktory pro rozvoj hyperkalemie zahrnují renální insuficienci, diabetes mellitus a současné užívání draslík šetřících diuretik, doplňků draslíku a/nebo náhražek soli obsahujících draslík [viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Olmesartan medoxomil nebyl karcinogenní, pokud byl podáván potkanům dietou po dobu až 2 let. Nejvyšší testovaná dávka (2000 mg/kg/den) byla na základě mg/m2 asi 480násobkem maximální doporučené dávky pro člověka (MRHD) 40 mg/den. Dvě studie karcinogenity provedené na myších, 6měsíční studie žaludeční sondy u p53 knockout myši a 6měsíční studie podávání stravy u transgenní myši Hras2 v dávkách až 1000 mg/kg/den (asi 120krát vyšší než MRHD) , neodhalil žádný důkaz karcinogenního účinku olmesartan medoxomilu.
Jak olmesartan medoxomil, tak olmesartan byly v testu transformace buněk embrya syrského křečka in vitro negativní a v Amesově testu (bakteriální mutagenita) neprokázaly žádnou genetickou toxicitu. Ukázalo se však, že oba indukují chromozomální aberace v kultivovaných buňkách in vitro (plíce čínského křečka) a byly pozitivně testovány na mutace thymidinkinázy v testu in vitro myšího lymfomu. Olmesartan medoxomil byl testován in vivo na mutace ve střevě a ledvinách MutaMouse a na klastogenitu v kostní dřeni myší (mikronukleární test) při perorálních dávkách až 2000 mg/kg (olmesartan netestován).
Fertilita potkanů nebyla ovlivněna podáváním olmesartan medoxomilu v dávkách až 1000 mg/kg/den (240násobek MRHD) ve studii, ve které bylo podávání zahájeno 2 (samice) nebo 9 (samci) týdnů před pářením.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Benicar 10 mg může způsobit poškození plodu, když je podáván těhotné ženě. Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. V reprodukčních studiích na zvířatech vedla léčba přípravkem Benicar během organogeneze ke zvýšené embryofetální toxicitě u potkanů při dávkách nižších, než jsou dávky toxické pro matku.
Po zjištění těhotenství přerušte léčbu přípravkem Benicar co nejdříve. Zvažte alternativní antihypertenzní léčbu během těhotenství.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Hypertenze v těhotenství zvyšuje u matky riziko preeklampsie, gestačního diabetu, předčasného porodu a porodních komplikací (např. nutnost císařského řezu a poporodní krvácení). Hypertenze zvyšuje riziko fetálního omezení intrauterinního růstu a intrauterinní smrti. Těhotné ženy s hypertenzí by měly být pečlivě sledovány a odpovídajícím způsobem léčeny.
Fetální/neonatální nežádoucí reakce
Oligohydramnion u těhotných žen, které užívají léky ovlivňující renin-angiotensinový systém ve druhém a třetím trimestru těhotenství, může mít za následek: sníženou funkci ledvin plodu vedoucí k anurii a selhání ledvin, hypoplazii plic plodu, deformace skeletu, včetně hypoplazie lebky, hypotenzi a smrt. U pacientek užívajících Benicar 20 mg během těhotenství proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. V závislosti na týdnu těhotenství může být vhodné fetální testování. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění.
Pečlivě sledujte kojence s anamnézou in utero expozice přípravku Benicar 40 mg kvůli hypotenzi, oligurii a hyperkalemii. U novorozenců s anamnézou expozice přípravku Benicar in utero, pokud se objeví oligurie nebo hypotenze, použijte opatření k udržení adekvátního krevního tlaku a renální perfuze. Jako prostředek ke zvrácení hypotenze a podpoře funkce ledvin mohou být nutné výměnné transfuze nebo dialýza.
Data
Údaje o zvířatech
Nebyly pozorovány žádné teratogenní účinky, když byl olmesartan medoxomil podáván březím potkanům v perorálních dávkách až 1000 mg/kg/den (240násobek maximální doporučené dávky pro člověka (MRHD) na bázi mg/m2) nebo březím králíkům v perorálních dávkách až do výše 1 mg/kg/den (polovina MRHD na základě mg/m2; u vyšších dávek nebylo možné vyhodnotit účinky na vývoj plodu, protože byly pro srny smrtelné). U potkanů byl pozorován významný pokles porodní hmotnosti mláďat a přírůstek hmotnosti při dávkách ≥ 1,6 mg/kg/den a opoždění vývojových mezníků (opožděné oddělení ušních boltců, prořezávání dolních řezáků, výskyt ochlupení na břiše, sestup varlat, a oddělení očních víček) a na dávce závislé zvýšení výskytu dilatace ledvinné pánvičky bylo pozorováno při dávkách ≥ 8 mg/kg/den. Dávka bez pozorovaného účinku na vývojovou toxicitu u potkanů je 0,3 mg/kg/den, což je asi jedna desetina MRHD 40 mg/den.
Laktace
Shrnutí rizik
Neexistují žádné informace týkající se přítomnosti olmesartanu v mateřském mléce, účinků na kojené dítě nebo účinků na produkci mléka. Olmesartan je vylučován v nízké koncentraci do mléka kojících potkanů (viz Data ). Vzhledem k potenciálu nežádoucích účinků na kojené dítě je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Data
Přítomnost olmesartanu v mléce byla pozorována po jednorázovém perorálním podání 5 mg/kg [14C] olmesartan medoxomilu kojícím potkanům.
Pediatrické použití
Antihypertenzní účinky Benicaru byly hodnoceny v jedné randomizované, dvojitě zaslepené klinické studii u pediatrických pacientů ve věku 1 až 16 let (viz Klinické studie ]. Farmakokinetika Benicaru byla hodnocena u pediatrických pacientů ve věku 1 až 16 let [viz KLINICKÁ FARMAKOLOGIE ]. Benicar 10 mg byl u pediatrických pacientů obecně dobře snášen a profil nežádoucích účinků byl podobný jako u dospělých.
Benicar 20 mg se neprokázal jako účinný u hypertenze u dětí mladších 6 let.
Použití přípravku Benicar u dětí mladších 1 roku se nedoporučuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Systém renin-angiotenzin-aldosteron (RAAS) hraje klíčovou roli ve vývoji ledvin. Ukázalo se, že blokáda RAAS vede k abnormálnímu vývoji ledvin u velmi mladých myší. Podávání léků, které působí přímo na reninangiotensin aldosteronový systém (RAAS), může změnit normální vývoj ledvin.
Geriatrické použití
Z celkového počtu pacientů s hypertenzí, kteří dostávali Benicar v klinických studiích, bylo více než 20 % ve věku 65 let a více, zatímco více než 5 % bylo ve věku 75 let a více. Mezi staršími a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců [viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Zvýšení AUC0-∞ a Cmax bylo pozorováno u pacientů se středně těžkou poruchou funkce jater ve srovnání s pacienty v odpovídajících kontrolách, se zvýšením AUC asi o 60 %. U pacientů se středně těžkou až výraznou jaterní dysfunkcí se nedoporučuje žádná úprava počáteční dávky (viz KLINICKÁ FARMAKOLOGIE ].
Renální poškození
Pacienti s renální insuficiencí mají zvýšené sérové koncentrace olmesartanu ve srovnání s jedinci s normální funkcí ledvin. Po opakovaném podávání byla AUC přibližně ztrojnásobena u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Černí pacienti
Antihypertenzní účinek přípravku Benicar 10 mg byl menší u pacientů černé pleti (obvykle populace s nízkým obsahem reninu), jak bylo pozorováno u ACE inhibitorů, betablokátorů a dalších blokátorů receptorů pro angiotenzin.
PŘEDÁVKOVAT
dispozici jsou omezené údaje týkající se předávkování u lidí. Nejpravděpodobnějšími projevy předávkování by byla hypotenze a tachykardie; bradykardie se může vyskytnout, pokud dojde k parasympatické (vagální) stimulaci. Pokud se objeví symptomatická hypotenze, zahajte podpůrnou léčbu. Dialyzovatelnost olmesartanu není známa.
KONTRAINDIKACE
Nepodávejte aliskiren současně s přípravkem Benicar 20 mg pacientům s diabetem [viz DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Angiotenzin II vzniká z angiotenzinu I reakcí katalyzovanou angiotenzin konvertujícím enzymem (ACE, kinináza II). Angiotensin II je hlavním presorickým činidlem renin-angiotenzinového systému s účinky, které zahrnují vazokonstrikci, stimulaci syntézy a uvolňování aldosteronu, srdeční stimulaci a renální reabsorpci sodíku. Olmesartan blokuje vazokonstrikční účinky angiotenzinu II selektivním blokováním vazby angiotenzinu II na receptor AT1 v hladkém svalstvu cév. Jeho účinek je tedy nezávislý na drahách syntézy angiotenzinu II.
AT2 receptor se nachází také v mnoha tkáních, ale není známo, že by tento receptor byl spojen s kardiovaskulární homeostázou. Olmesartan má více než 12 500krát vyšší afinitu k receptoru AT1 než k receptoru AT2.
Blokáda renin-angiotenzinového systému ACE inhibitory, které inhibují biosyntézu angiotenzinu II z angiotenzinu I, je mechanismem mnoha léků používaných k léčbě hypertenze. ACE inhibitory také inhibují degradaci bradykininu, což je reakce rovněž katalyzovaná ACE. Protože olmesartan medoxomil neinhibuje ACE (kininázu II), neovlivňuje odpověď na bradykinin. Zda má tento rozdíl klinický význam, není dosud známo.
Blokáda receptoru angiotenzinu II inhibuje negativní regulační zpětnou vazbu angiotenzinu II na sekreci reninu, ale výsledná zvýšená aktivita plazmatického reninu a hladiny cirkulujícího angiotenzinu II nepřekonají účinek olmesartanu na krevní tlak.
Farmakodynamika
Dávky přípravku Benicar 2,5 mg až 40 mg inhibují presorické účinky infuze angiotensinu I. Trvání inhibičního účinku souviselo s dávkou, přičemž dávky Benicaru >40 mg poskytovaly >90% inhibici za 24 hodin.
Plazmatické koncentrace angiotenzinu I a angiotenzinu II a plazmatická aktivita reninu (PRA) se zvyšují po jednorázovém a opakovaném podání přípravku Benicar 10 mg zdravým subjektům a pacientům s hypertenzí. Opakované podání až 80 mg Benicaru mělo minimální vliv na hladiny aldosteronu a žádný vliv na sérový draslík.
Farmakokinetika
Vstřebávání
Olmesartan medoxomil je rychle a úplně bioaktivován hydrolýzou esteru na olmesartan během absorpce z gastrointestinálního traktu.
Tablety Benicar a suspenzní přípravek připravený z tablet Benicar jsou bioekvivalentní [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Absolutní biologická dostupnost olmesartanu je přibližně 26 %. Po perorálním podání je maximální plazmatické koncentrace (Cmax) olmesartanu dosaženo za 1 až 2 hodiny. Jídlo neovlivňuje biologickou dostupnost olmesartanu. Benicar může být podáván s jídlem nebo bez jídla.
Rozdělení
Distribuční objem olmesartanu je přibližně 17 l. Olmesartan se silně váže na plazmatické proteiny (99 %) a neproniká do červených krvinek. Vazba na proteiny je konstantní při plazmatických koncentracích olmesartanu výrazně nad rozsahem dosaženým při doporučených dávkách.
U potkanů olmesartan procházel hematoencefalickou bariérou špatně, pokud vůbec. Olmesartan u potkanů prošel placentární bariérou a byl distribuován do plodu. Olmesartan byl u potkanů distribuován do mléka v nízkých hladinách.
Metabolismus A Vylučování
Po rychlé a úplné konverzi olmesartan medoxomilu na olmesartan během absorpce již prakticky nedochází k žádnému dalšímu metabolismu olmesartanu. Celková plazmatická clearance olmesartanu je 1,3 l/h, s renální clearance 0,6 l/h. Přibližně 35 % až 50 % absorbované dávky se objeví v moči, zatímco zbytek se vyloučí stolicí žlučí.
Zdá se, že olmesartan je eliminován dvoufázovým způsobem s terminálním poločasem eliminace přibližně 13 hodin. Olmesartan vykazuje lineární farmakokinetiku po jednotlivých perorálních dávkách až 320 mg a opakovaných perorálních dávkách až 80 mg. Rovnovážných hladin olmesartanu je dosaženo během 3 až 5 dnů a při podávání jednou denně nedochází k žádné akumulaci v plazmě.
Specifické populace
Geriatričtí pacienti
Farmakokinetika olmesartanu byla studována u starších osob (≥65 let). Celkově byly maximální plazmatické koncentrace olmesartanu podobné u mladých dospělých a starších osob. Mírná akumulace olmesartanu byla pozorována u starších pacientů při opakovaném podávání; AUCss, τ bylo o 33 % vyšší u starších pacientů, což odpovídá přibližně 30% snížení CLR (viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Pediatričtí pacienti
Farmakokinetika olmesartanu byla studována u pediatrických pacientů s hypertenzí ve věku 1 až 16 let. Clearance olmesartanu u pediatrických pacientů byla podobná jako u dospělých pacientů, když byla upravena podle tělesné hmotnosti (viz Použití u konkrétních populací ].
Farmakokinetika olmesartanu nebyla zkoumána u pediatrických pacientů mladších 1 roku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Mužské A ženské pacienty
Menší rozdíly byly pozorovány ve farmakokinetice olmesartanu u žen ve srovnání s muži. AUC a Cmax byly o 10-15 % vyšší u žen než u mužů.
Pacienti s poruchou funkce jater
Zvýšení AUC0-∞ a Cmax bylo pozorováno u pacientů se středně těžkou poruchou funkce jater ve srovnání s těmi u odpovídajících kontrol, se zvýšením AUC asi o 60 % [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Pacienti s poruchou ledvin
U pacientů s renální insuficiencí byly sérové koncentrace olmesartanu zvýšené ve srovnání s jedinci s normální funkcí ledvin. Po opakovaném podávání byla AUC přibližně ztrojnásobena u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Studie lékových interakcí
Sekvestrační činidlo žlučových kyselin Colesevelam
Současné podávání 40 mg olmesartan medoxomilu a 3750 mg kolesevelam hydrochloridu zdravým subjektům vedlo k 28% snížení Cmax a 39% snížení AUC olmesartanu. Menší účinky, 4% a 15% snížení Cmax a 15% v tomto pořadí, byly pozorovány, když byl olmesartan medoxomil podáván 4 hodiny před kolesevelam hydrochloridem (viz DROGOVÉ INTERAKCE ].
Jiné studie
Ve studiích, ve kterých byl olmesartan medoxomil podáván zdravým dobrovolníkům současně s digoxinem nebo warfarinem, nebyly hlášeny žádné významné lékové interakce.
Biologická dostupnost olmesartanu nebyla významně změněna současným podáváním antacid [Al(OH)3/Mg(OH)2].
Olmesartan medoxomil není metabolizován systémem cytochromu P450 a nemá žádné účinky na enzymy P450; neočekávají se tedy interakce s léky, které tyto enzymy inhibují, indukují nebo jsou těmito enzymy metabolizovány.
Klinické studie
Hypertenze u dospělých
Antihypertenzní účinky přípravku Benicar 10 mg byly prokázány v sedmi placebem kontrolovaných studiích v dávkách od 2,5 mg do 80 mg po dobu 6 až 12 týdnů, z nichž každá vykazovala statisticky významné snížení maximálního a nejnižšího krevního tlaku. Celkem bylo studováno 2693 pacientů (2145 Benicar; 548 placebo) s esenciální hypertenzí. Benicar 40 mg jednou denně snižoval diastolický a systolický krevní tlak. Odpověď byla závislá na dávce, jak ukazuje následující graf. Dávka Benicaru 20 mg denně vede ke snížení minimálního krevního tlaku vsedě (BP) oproti placebu o přibližně 10/6 mmHg a dávka 40 mg denně vede ke snížení minimálního krevního tlaku vsedě oproti placebu přibližně o 12/7 mmHg. Benicar 10 mg dávky vyšší než 40 mg měly malý dodatečný účinek. Nástup antihypertenzního účinku se objevil během 1 týdne a do značné míry se projevil po 2 týdnech.
Benicar 40 mg Dávková odpověď Placebem upravené snížení krevního tlaku (mmHg) 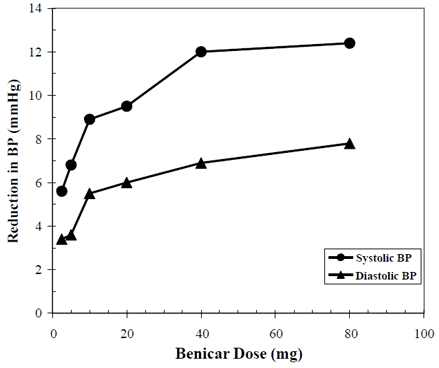
Výše uvedené údaje pocházejí ze sedmi placebem kontrolovaných studií (2145 pacientů v Benicaru, 548 pacientů s placebem). Účinek na snížení krevního tlaku byl zachován po celou dobu 24 hodin při podávání přípravku Benicar jednou denně, přičemž poměry mezi nejnižší a nejvyšší hodnotou pro systolickou a diastolickou odpověď byly mezi 60 a 80 %.
Účinek přípravku Benicar 40 mg na snížení krevního tlaku s hydrochlorothiazidem i bez něj přetrvával u pacientů léčených po dobu až 1 roku. Nebyla prokázána tachyfylaxe během dlouhodobé léčby přípravkem Benicar nebo rebound efekt po náhlém vysazení olmesartan medoxomilu po 1 roce léčby.
Antihypertenzní účinek přípravku Benicar byl podobný u mužů a žen au pacientů starších a mladších než 65 let. Účinek byl menší u pacientů černé pleti (obvykle populace s nízkým obsahem reninu), jak bylo pozorováno u ACE inhibitorů, betablokátorů a dalších blokátorů receptorů pro angiotenzin. Benicar měl další účinek na snížení krevního tlaku, když byl přidán k hydrochlorothiazidu.
Neexistují žádné studie s přípravkem Benicar, které by prokázaly snížení kardiovaskulárního rizika u pacientů s hypertenzí, ale alespoň jeden farmakologicky podobný lék takový přínos prokázal.
Dětská hypertenze
Antihypertenzní účinky přípravku Benicar 40 mg u pediatrické populace byly hodnoceny v randomizované, dvojitě zaslepené studii zahrnující 302 pacientů s hypertenzí ve věku 6 až 16 let. Studovaná populace se skládala z čistě černošské kohorty 112 pacientů a smíšené rasové kohorty 190 pacientů, včetně 38 černošských pacientů. Etiologie hypertenze byla převážně esenciální hypertenze (87 % černé kohorty a 67 % smíšené kohorty). Pacienti s hmotností 20 až
Ve stejné studii dostávalo 59 pacientů ve věku 1 až 5 let s hmotností ≥5 kg 0,3 mg/kg přípravku Benicar 10 mg jednou denně po dobu tří týdnů v otevřené fázi a poté byli randomizováni k užívání přípravku Benicar nebo placeba ve dvojitě zaslepené fáze. Na konci druhého týdne vysazení byl průměrný systolický/diastolický krevní tlak v době minima o 3/3 mmHg nižší ve skupině randomizované do Benicaru; tento rozdíl v krevním tlaku nebyl statisticky významný (95% CI -2 až 7/-1 až 7).
INFORMACE PRO PACIENTA
Těhotenství
Informujte pacientky ve fertilním věku o důsledcích expozice přípravku Benicar 20 mg během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Řekněte pacientkám, aby co nejdříve hlásili těhotenství svým lékařům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Laktace
Doporučte kojícím ženám, aby během léčby přípravkem BENICAR nekojily (viz Použití u konkrétních populací ].
Hyperkalémie
Informujte pacienty, aby nepoužívali doplňky draslíku nebo náhražky soli, které obsahují draslík, aniž by se poradili se svým poskytovatelem zdravotní péče [viz DROGOVÉ INTERAKCE ].
